Xanthocerassorbifolia抽出物を含む組成物、該抽出物から単離された化合物、それらを調製する方法、およびそれらの使用
【解決課題】本発明は、Xanthoceras sorbifoliaの抽出物を含む組成物、該抽出物を生産する方法および過程を提供する。
【解決手段】この抽出物は、アルカロイド、クマリン、サッカリド、タンパク、ポリサッカリド、グリコシド、サポニン、タンニン、酸、フラボノイド、その他を含む。本組成物は、抗ガン、脳の加齢の防止、記憶力改善、脳機能の改善および、遺尿症、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病、および、その他の脳の機能不全によってもたらされる疾患の治療、および、関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療、および、インポテンツおよび早漏の治療の治療に使用が可能である。本発明は、糖、テレペン例えばサポゲニン、および、炭素21と22に側鎖、例えばアンゲロイル基を含む化合物を提供する。本発明の化合物は、各種製薬学的、および治療的用途を有する。
【解決手段】この抽出物は、アルカロイド、クマリン、サッカリド、タンパク、ポリサッカリド、グリコシド、サポニン、タンニン、酸、フラボノイド、その他を含む。本組成物は、抗ガン、脳の加齢の防止、記憶力改善、脳機能の改善および、遺尿症、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病、および、その他の脳の機能不全によってもたらされる疾患の治療、および、関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療、および、インポテンツおよび早漏の治療の治療に使用が可能である。本発明は、糖、テレペン例えばサポゲニン、および、炭素21と22に側鎖、例えばアンゲロイル基を含む化合物を提供する。本発明の化合物は、各種製薬学的、および治療的用途を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、文冠果(Xanthoceras Sorbifolia)と呼ばれる植物から得られた抽出物、それらの使用と機能、および、その調製法に関する。
関連出願に対する相互参照
【0002】
本出願は、2003年10月9日出願の米国特許出願第60/509,851号、および、2003年12月23日出願の米国特許出願第60/532,101号の利益を主張する。これらの先行出願を、ここに参照することにより本出願に含める。
【0003】
本出願を通じて様々な文献が参照される。本発明の関連する従来技術の状態をより完全に記載するために、これら刊行物の開示全体を参照することにより本出願に含める。
【背景技術】
【0004】
文冠果は、むくろじ科の植物種である。その学名はXanthoceras sorbifolia Bungeである。文冠果(Wenguanguo)が一般的中国名であるが、その他Wenguannguo、Wenguanmu、文冠花(Wenguanhua)、Xilacedeng、Golden horn、およびYellow hornとも呼ばれる。文冠果は、中国の、遼寧、吉林、河北、山東、江蘇、河南、山西、陜西、甘粛、寧夏の各省、および内モンゴルで成育する。その種子、葉、および花は食用が可能であり、数世紀に渡って遺尿症を治療するための民間医療として使用されてきた。その枝や木部も民間医療として使用される。
【0005】
ガン細胞は二種類の遺伝可能な性質によって定義される。すなわち、(1)ガン細胞は、細胞分裂に対する正常な抑制に従わずに増殖する、および、(2)ガン細胞は、通常他の細胞のために保留されている領域に侵入し、そこで増殖する。
【0006】
ガンは、発症するためには多くの遺伝子の変異を必要とするが、その発生する組織および細胞タイプに基づいて分類される。上皮細胞から発生するガンは上皮ガンと命名され、結合組織または筋細胞から発生するものは肉腫と命名される。さらに、造血細胞に由来する白血病と呼ばれるガン、および神経系細胞に由来するガンもある。
【0007】
異なるタイプの細胞から発生するガンは、一般に、様々な違いを持つ疾患である。各ガンは、その起源を反映する特質を持つ。ガンが、転移したり、調節の手を離れて増殖したりする場合であっても、その起源は、遡って単一の、一次腫瘍に帰着させることが可能である。従って、ある特定の性質を持つ標的細胞に向けた薬剤を開発することは重要である。
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、卵巣ガンに対して実質的な効力を持つ、Xanthoceras Sorbifoliaから抽出、または合成された化合物または組成物を提供する。
本発明の上記およびその他の目的に従って、本発明の簡単な概要が提示される。下記の概要では、簡単化および省略がいくつか行われるかも知れないが、それらは、本発明のある局面を強調し、紹介することを意図してなされるものであって、その範囲を限定することを意図してなされるものではない。後続のセクションにおいて、好ましい例示の実施態様が、当業者に対し、本発明の概念を具体化し、使用することを可能とするほど十分詳細に記載される。
【0009】
本発明は、文冠果抽出物の使用に関連する。この文冠果抽出物は、患者の遺尿および頻尿を防止することが可能である。この文冠果抽出物は、患者の脳機能を改善するために、遺尿を阻止する。
【0010】
本発明は、中枢神経系の機能を改善することによって、膀胱から送られる信号に対して患者をより鋭敏にするのに役立ち、かつ、深い眠りからも目覚めるようにさせる組成物を提供する。
【0011】
本発明は、膀胱をリラックスさせ、より多量の尿を貯留することを可能とする組成物を提供する。
【0012】
文冠果の抽出物は、加齢、ストレス、神経質、活動過多、不安定、反射亢進、および膀胱抑制不全によって引き起こされる排尿筋緊張を緩和するのに用いてもよい。別の実施態様では、文冠果抽出物は、アセチルコリンAchによって引き起こされる膀胱組織収縮を緩和させるために用いてもよい。
【0013】
文冠果抽出物は、尿容量を低下させる抗利尿ホルモン(ADH)を調整するためのアセチルコリンエステラーゼAChEの阻害剤として、また、抗炎症剤として用いてもよい。
【0014】
文冠果の種皮、葉、枝または幹、および、果柄、根および樹皮からの抽出物は組み合わせてもよく、本発明は、その調製法を開示する。
【0015】
本発明は、文冠果の種皮、葉または枝、幹および/または果柄、根、種殻および樹皮からの抽出物の組み合わせを含む組成物を提供する。この有機抽出物は、サポニン、サッカライド、タンパク、グリコシド、フラボノイドその他を含む。
【0016】
本発明は、文冠果の種皮、葉または枝、幹および/または果柄、根、種殻および樹皮から得られる未精製サポニン、およびその調製法を提供する。本発明は、文冠果の種皮、葉または枝、幹、果柄の双方またはその一方、根、種殻および樹皮から得られる未精製サポニンを含む組成物を提供する。この未精製サポニンは、サポニン、サッカライド、タンパクその他を含む。
【0017】
文冠果抽出物は、膀胱の成長の加速、深い睡眠の抑制、睡眠患者の感受性の増大、抗利尿ホルモン(ADH)およびその受容体の放出、分解、および摂取の修飾、副腎皮質刺激ホルモン(ACTH)およびその受容体の放出、分解、および摂取の修飾、5-ヒドロキシトリプタミンおよびその受容体の分泌、分解、および摂取の修飾、アセチルコリン(Ach)およびその受容体の放出、分解、および摂取の修飾、アドレナリン(AD)およびその受容体の放出、分解、および摂取の修飾、ドーパミン(DA)およびその受容体の放出、分解、および摂取の修飾、ノルエピネフィリン(NE)およびその受容体の放出、分解、および摂取の修飾、睡眠麻痺の防止、神経ペプチドおよびその受容体の放出、分解、および活性の修飾、ガン、例えば、乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンを含む−ただしこれらに限定されないが−ガンの治療、および、肺および膀胱機能の改善のために用いてもよい。
【0018】
本発明は、糖、テレペンまたはサポゲニン、および、炭素21および22の側鎖またはアンゲロイル基とを含み、それらが動作的に結合して形成する、生物学的活性を持つ化合物を提供する。ある実施態様では、化合物は、二つ以上の糖を含む。
【0019】
本発明は、下記の構造を含む化合物を提供する。すなわち、
【0020】
【化1】

【0021】
本発明は、前述の化合物の塩を提供する。
【0022】
本発明は、前述の化合物および適当な担体を含む組成物を提供する。
【0023】
本発明は、前述の化合物の有効量、および製薬学的に受容可能な担体とを含む製薬組成物を提供する。
【0024】
本発明は、Xanthoceras Sorbifoliaから化合物を単離する方法であって、Xanthoceras Sorbifolia粉末を、適当量の1種以上の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;有機抽出物を収集すること;有機抽出物を有機溶媒と適当時間環流して第二抽出物を形成すること;第二抽出物から有機溶媒を除去すること;および、第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物粉末を形成すること、の諸工程を含む方法を提供する。
【0025】
本発明は、バックボーンに3個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0026】
本発明は、バックボーンに2個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0027】
本発明は、バックボーンに4個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0028】
本発明は、バックボーンに3個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0029】
本発明は、Xanthoceras Sorbifoliaから化合物を単離する方法であって、Xanthoceras Sorbifolia粉末を、適当量の1種以上の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;有機抽出物を収集すること;有機抽出物を環流して第二抽出物を形成すること;第二抽出物から有機溶媒を除去すること;第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物粉末を形成すること;抽出物粉末を画分して、抽出物粉末の1種以上の成分を獲得すること;抽出物粉末について1種以上の生物活性成分を特定すること;FPLCによって、抽出物粉末について1種以上の生物活性成分を精製し、生物活性成分について1種以上の分画を獲得すること;および、予備的HPLCによって化合物を単離すること、の諸工程を含む方法を提供する。
【0030】
本発明は、表2に示すようにHeteronuclear Multiple Quantum Correlation (HMQC)実験によるNMRデータを持つ化合物を提供する。
【0031】
本発明は、表3に示すようにHeteronuclear Multiple Quantum Correlation (HMQC)実験によるNMRデータを持つ化合物を提供する。
【課題を解決するための手段】
【0032】
本発明の上記およびその他の目的に従って、本発明の簡単な概要が提示される。下記の概要では、簡単化および省略がいくつか行われるかも知れないが、それらは、本発明のある局面を強調し、紹介することを意図してなされるものであって、その範囲を限定することを意図してなされるものではない。後続のセクションにおいて、好ましい例示の実施態様が、当業者に対し、本発明の概念を具体化し、使用することを可能とするほど十分詳細に記載される。
【0033】
本発明は、ガンに対して効果的な化合物であって、式C57H88O23を持ち、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンなる化学名を持つ化合物、および誘導体化合物の経路を提供する。本発明の化合物または組成物は、細胞の受容体または細胞成分、例えば、Gタンパク受容体、Fasタンパク、受容体チロシンキナーゼ、マイトゲン、マイトゲン受容体を調節する。この化合物は、Xanthoceras Sorbifliaと呼ばれる植物から単離することが可能であり、化学的に合成することも可能であり、あるいは、他の生物学的供給源から抽出することも可能である。
【0034】
経路における成分の活性に生じた異常な変化によって、細胞は、ガンを形成するための増殖を停止させられる。経路としては、TGFベータ-smad、FGF、TGFベータおよびTGFアルファa、ras-GTPアーゼ-MAPキナーゼ、jun-fos、Src-fyn、Jak-Jnk-STAT、BMP、Wnt、myc-細胞増殖等が挙げられる。ガン細胞の突然変異は、細胞死プログラムの不活性化を招き、細胞の無制限な分裂を可能とする。Xanthoceras Sorbifolia由来の化合物、組成物の双方またはその一方は、化合物および受容体を調整し、細胞死プログラムを再び活性化する。
(表24)



(表25)


(表26)



(表27)


(表28)



(表29)


(表30)



【発明を実施するための最良の形態】
【0035】
ヒトが辿る睡眠には、異なる多くの期間がある。そのような期間としては、徐波睡眠1(SWS1)、徐波睡眠2(SWS2)、徐波睡眠3(SWS3)、徐波睡眠4(SWS4)、および、急速眼球運動(REM)が挙げられる。SWS1およびSWS2は共に軽度の睡眠で、その場合目覚めさせることは比較的簡単である。軽度の睡眠は、通常、睡眠の後半部においてより高頻度である。SWS3およびSWS4は共に深い眠りで、その場合目覚めさせるのは難しい。深い睡眠は、睡眠の前半部においてより高頻度で、各期間は、後になるにつれて短くなる。REMは、ヒトがもっとも明瞭な夢を見る睡眠期間である。その波形パターンは、ヒトが目覚めている時のパターンと近似する。しかしながら、この睡眠状態のヒトを目覚めさせるのは難しい。通常人の睡眠サイクルは下記のように表示できる。すなわち、
SWS1, SWS2, SWS3, SWS4, SWS3, SWS2, REM, SWS1, SWS2, SWS3, SWS4, SWS3, SWS2, REM。(図4参照)。
【0036】
しかしながら、上記の配列は固定した順序ではない。睡眠状態は、SWS4からSWS1に移行することもあるし、あるいは、体が寝返りを打つために目覚めることもある。動きの後にSWS2状態へ移行することもある。二つのREMの間の間隔は約90分である。健常人では、SWS1は睡眠の約5%を占め、SWS2は睡眠の約50%を占め、SWS3は睡眠の約10%を占め、SWS4は睡眠の約10%を占め、REMは睡眠の約25%を占める。SWS1およびSWS2にあるヒトは簡単に目覚めさせることが可能なので、健常なヒトであれば、排尿のために目覚める機会は十分である。一方、ヒトの睡眠状態が大部分SWS4である場合、膀胱が一杯になった場合でも目覚める機会はより少ない。深い睡眠の障壁を突き破ることは困難である。このようにして遺尿症が起こる。本発明は、遺尿症を防止するための、文冠果を含む植物の抽出物に関する。
【0037】
文冠果は、むくろじ科の植物種である。その学名はXanthoceras sorbifolia Bungeである。文冠果(Wenguanguo)が一般的中国名であるが、その他Wenguannguo、Wenguanmu、文冠花(Wenguanhua)、およびXilacedengとも呼ばれる。この植物は最大高さ8メートルに成長することが可能である。その特徴は、奇数出羽状複葉、白色花による総状花序、厚い木質の種皮を備えた種殻である。文冠果は、中国の、遼寧、吉林、河北、山東、江蘇、河南、山西、陜西、甘粛、寧夏の各省、および内モンゴルで成育する。その種子は食用が可能であり、数世紀に渡って遺尿症を治療するための民間医療として使用されてきた。その枝や木部も民間医療として使用される。
【0038】
本発明は、文冠果から得られた抽出物、その使用、および調製法に関する追加の記載である。本発明は、患者の脳機能を改善することによって膀胱から送られる信号に対して患者をより鋭敏にし、深い眠りから目覚めさせることによって遺尿症を防止することを可能とする抽出物を提供する。膀胱が尿で満たされると、膀胱の平滑筋が引き延ばされ、これが信号を生み出し、信号は、骨盤神経、および脊髄の仙椎を経由して大脳皮質および小脳にまで達する。信号に対する大脳皮質および小脳の反応は、膀胱を持続的に収縮させるが、括約筋は弛緩させることである。かくして尿は排出される。睡眠時、膀胱が尿管を介して尿によって満たされると、排尿筋が伸長して膀胱を拡大させる。膀胱が尿を蓄え出すと、膀胱は、膀胱の伸長受容器を刺激し、受容器は、膀胱に溜められた尿の量に応じて連続的に信号を生成する。膀胱が尿で十分に満たされると、膀胱内は十分な圧を蓄積し、それによって脳は気付き、ヒトに排尿させるように目覚ませる。信号が、眠っているヒトを目覚めさせるほど十分に強くない場合、あるいは、大脳機能の障害によって閉鎖されている場合、遺尿症が起こる。この特定の植物抽出物は、大脳機能を改善することによって遺尿症を治療することが可能である。
【0039】
感覚性伸長受容器は、膀胱壁に配され、膀胱の充実度の評価を支援する。この情報は脊髄に、さらに脊髄視床経路を経由して中枢神経系に伝えられる。文冠果の抽出物は、中枢神経系をこの信号に対して鋭敏にする。
【0040】
膀胱がストレスおよび神経質のために収縮させられると、膀胱の容量は低下するので、頻尿が起こる。文冠果の抽出物は、さらに多量の尿を保存できるように膀胱を弛緩させることが可能である。
【0041】
膀胱の容量は加齢のために低下するが、この現象は、中年の人々にも起こることがある。このような人々は、低い尿量レベルで膀胱を空虚にしなければならないという焦燥感から早期に排尿筋を収縮させるという経験で悩んでいる。文冠果は、排尿筋をリラックスさせるのに役立つから、膀胱容量は増し、排尿頻度は減少する。
【0042】
排尿筋活動過多、排尿筋活動不安定、排尿筋反射亢進、または膀胱抑制不全を抱える患者では、膀胱が充満する前に、排尿筋が早期に強制的に収縮する。これによって、切迫的で、高頻度の排尿が起こる。文冠果抽出物は、患者の排尿筋をリラックスさせる。膀胱は安定し、十分な量の尿を溜めることが可能になる。
【0043】
膀胱の平滑筋には二つの機能がある。膀胱が弛緩した場合、尿が貯えられる。膀胱が収縮した場合、尿が排出される。感覚性伸長受容器は、膀胱壁中に配され膀胱の充実度を評価する。この情報は、脊髄に、さらに脊髄視床経路を経由して中枢神経系に伝えられる。脳は、排尿筋の弛緩が望まれる場合、抑制信号を生成する。しかしながら脳は、排尿筋収縮が望ましい場合には興奮信号を生成する。文冠果の抽出物は、アセチルコリンエステラーゼAchEを抑制することによって膀胱組織をリラックスさせることが可能である。この抑制作用は長期に渡って持続させることが可能である。文冠果抽出物は、アセチルコリンAchの欠乏によってもたらされる疾病を治療することが可能な、優れたAChE阻害剤である。
【0044】
抗利尿ホルモン(ADH)は、脳の下垂体後葉に貯えられている。このものは、体液の一次的調整因子である。ADHは、腎臓に作用して、体液全体を増したり、減らしたりする。これは、腎臓によって生成される尿量に作用する。ADHの放出は、浸透圧受容器と圧受容器の細胞によって調節される。浸透圧受容器は、視床下部の特殊細胞である。この細胞は、血中の粒子の濃度を感受する。粒子の濃度がより高くなると、より多くのADHが、脳下垂体によって放出される。これは、水の保持を刺激して体液を希釈する。濃度がより低くなると、より少量のADHが下垂体によって放出される。血液量および血圧を感受する圧受容器は、右心房、大静脈、および頚動脈という、心臓における特別領域に配される。心臓は、血液量または血圧が低い場合には、より多くのADHを放出するように、逆の場合はその逆を行うように、視床下部および下垂体に向けて信号を生成する。文冠果抽出物は、ADHの放出を調整し、これは、生体によって生産される尿量を下げることを可能とする。
【0045】
本発明は、文冠果の種皮または果柄から得られる混合抽出物、およびその調製法に関連する。種皮または果柄から抽出物を調製する方法は下記の工程を含む、すなわち、種皮または果柄から得られた文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;有機抽出物から有機溶媒を除去して水性抽出物を形成すること;および、該水性抽出物を乾燥し滅菌して、混合抽出物粉末を形成すること、の諸工程である。
【0046】
本発明は、文冠果の種皮または果柄から得られた混合抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0047】
本発明は、文冠果の葉から得られる混合抽出物、およびその調製法に関連する。葉から抽出物を調製する方法は下記の工程を含む。すなわち、葉から得られた文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;第二抽出物から有機溶媒を除去して水性抽出物とすること;水性抽出物をエーテルと水で抽出して第二水性抽出物を形成すること;第二水性抽出物をn-ブタノールで抽出して、n-ブタノール抽出物を形成すること;n-ブタノール抽出物からn-ブタノールを除去して第三水性抽出物を形成すること;第三水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0048】
本発明は、文冠果の葉から得られた有機抽出物を含む組成物を提供する。この有機抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0049】
本発明は、文冠果の枝または幹から得られる混合抽出物、およびその調製法に関連する。枝または幹から抽出物を調製する方法は下記の工程を含む。すなわち、枝または幹から得られた文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;第二抽出物から有機溶媒を除去して水性抽出物とすること;および、水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0050】
本発明は、文冠果の枝および幹から得られた有機抽出物を含む組成物を提供する。この有機抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0051】
本発明は、文冠果の核から得られる混合抽出物、およびその調製法に関連する。核から抽出物を調製する方法は下記の工程を含む。すなわち、核を押し潰すことによって油を除去して、核ケーキを形成すること;核ケーキを粉砕し、n-ヘキサンで抽出してn-ヘキサン抽出物を形成すること;n-ヘキサン抽出物からn-ヘキサンを除去し乾燥して核粉末を形成すること;核粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;第二抽出物から有機溶媒を除去して水性抽出物とすること;水性抽出物を乾燥し滅菌して、混合抽出物を形成すること、の諸工程である。
【0052】
本発明は、文冠果の核から得られた有機抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0053】
本発明は、文冠果の根から得られる混合抽出物、およびその調製法に関連する。根から抽出物を調製する方法は下記の工程を含む。すなわち、根から作製された文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;有機抽出物から有機溶媒を除去して水性抽出物を形成すること;および、水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0054】
本発明は、文冠果の根から得られた混合抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0055】
本発明は、文冠果の樹皮から得られる混合抽出物、およびその調製法に関連する。文冠果の樹皮から抽出物を調製する方法は下記の工程を含む。すなわち、樹皮から作製された文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;有機抽出物から有機溶媒を除去して水性抽出物を形成すること;および、水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0056】
本発明は、文冠果の樹皮から得られた混合抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0057】
本発明は、文冠果の種皮または果柄から得られる未精製サポニンを提供する。種皮または葉柄から未精製サポニンを調製する方法は下記の工程を含む、すなわち、種皮または果柄の文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0058】
混合抽出物はサポニンを含む。
本発明は、文冠果の葉から得られる未精製サポニンを提供する。葉から未精製サポニンを調製する方法は下記の工程を含む、すなわち、葉の文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノールをクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0059】
粗抽出物はサポニンを含む。
本発明は、文冠果の枝および幹から得られる未精製サポニンを提供する。枝または幹から未精製サポニンを調製する方法は下記の工程を含む、すなわち、枝または幹の文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0060】
粗抽出物はサポニンを含む。
本発明は、文冠果の核から得られる未精製サポニンを提供する。核から未精製サポニンを調製する方法は下記の工程を含む、すなわち、核を押し潰すことによって油を除去して、核ケーキを形成すること;核ケーキを粉砕し、n-ヘキサンで抽出してn-ヘキサン抽出物を形成すること;n-ヘキサン抽出物からn-ヘキサンを除去し乾燥して核粉末を形成すること;核粉末を、有機溶媒(エタノール、メタノールその他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0061】
粗抽出物はサポニンを含む。
本発明は、文冠果の根から得られる未精製サポニンを提供する。根から未精製サポニンを調製する方法は下記の工程を含む、すなわち、根の文冠果粉末を、有機溶媒(エタノール、メタノールその他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0062】
粗抽出物はサポニンを含む。
本発明は、文冠果の樹皮から得られる未精製サポニンを提供する。樹皮から未精製サポニンを調製する方法は下記の工程を含む、すなわち、樹皮の文冠果粉末を、有機溶媒(エタノール、メタノールその他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0063】
粗抽出物はサポニンを含む。
本発明は、脳の加齢の防止、記憶力の改善、大脳機能の改善、および、遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病および、脳の機能不全によるその他の疾患の治療、および、関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療、およびインポテンツおよび早漏の治療のための方法を提供する。
【0064】
本発明は、被験体における5-ヒドロキシトリプタミン(5HT)の摂取を抑制する、文冠果抽出物を提供する。
【0065】
5-HTは、深い睡眠を持続し、増進する睡眠因子を調節および変調する。5HTの摂取を抑制すると、深い睡眠が減少する。SWS3およびSWS4において過大な時間を費やす人々は、眠りが深すぎるために膀胱が充満しても眠りから覚めることができない。これが、遺尿症が多くの場合SWS3およびSWS4期において起こる理由である。
【0066】
本発明は、被験体においてドーパミン活性を増大させ、それによって前記被験体の中枢神経系を鋭敏にする文冠果抽出物を提供する。
【0067】
本発明は、被験体において抗利尿ホルモン(ADH)の分泌を増進し、前記被験体において尿を低下させる文冠果抽出物を提供する。
【0068】
本発明は、被験体においてアセチルコリン(Ach)およびその受容体の放出、分解、および摂取を変調する文冠果抽出物を提供する。本発明の前記抽出物は、5HTによって惹起される深度睡眠を抑制し、REM睡眠を増す。
【0069】
本発明は、被験体において睡眠麻痺を防止する文冠果抽出物を提供する。
【0070】
本発明は、眠っている被験体に鋭敏性を与える文冠果抽出物を提供する。
【0071】
本発明は、膀胱および括約筋の成長を助ける抽出物を提供する。
【0072】
未熟な膀胱および括約筋は、排尿過程および活動を調節することができない。膀胱および括約筋の成長を加速することによって、この問題は克服されるので、遺尿は起こらない。
【0073】
本発明は、ガンの増殖を抑える文冠果抽出物を提供する。ガンとしては、膀胱ガン、子宮頸ガン、前立腺ガン、肺ガン、乳ガン、白血球ガン、結腸ガン、肝臓ガン、骨ガン、脳のガン、および卵巣ガンが挙げられるが、ただしこれらに限定されない。
【0074】
本発明は、糖、テレペンまたはサポゲニン、および、炭素21または22における側鎖またはアンゲロイル基を含む化合物を提供する。ある実施態様では、化合物は、2種以上の糖を含む。
【0075】
本発明は、下記の構造を持つ化合物を提供する。すなわち、
【0076】
【化2】

【0077】
これは、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エン、別名キサントb1という化合物である。
【0078】
別の実施態様では、化合物の構造は下記の通りである。
【0079】
【化3】

【0080】
【化4】

【0081】
【化5】

【0082】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0083】
【化6】

【0084】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0085】
本発明は、前述の化合物の塩を提供する。
【0086】
本発明は、前述の化合物、および適切な担体を含む組成物を提供する。
【0087】
本発明は、前述の化合物の有効量、および製薬学的に受容可能な担体とを含む製薬組成物を提供する。
【0088】
本発明は、前述の組成物を含む、抗卵巣ガン組成物を提供する。
【0089】
後述の実施例/実験には、下記の方法および材料が用いられた。
【0090】
細胞。 ヒトガン細胞系統を、米国基準菌株保存機関から入手した。HTB-9(膀胱)、HeLa-S3(子宮頸部)、DU145(前立腺)、H460(肺)、MCF-7(乳房)、K562(白血球)、HCT116(結腸)、HepG2(肝臓)、U2OS(骨)、T98G(脳)、およびOVCAR-3(卵巣)である。細胞は、10%仔牛血清、グルタミン、および抗生物質を添加した培養液(HeLa-S3、DU145、MCF-7、Hep-G2、およびT98Gは、MEN(Earlの塩)において;HTB-9、H460、K562、OVCAR-3は、RPMI-1640において;HCT-116、U2O2は、McCoy-5Aにおいて)で、5%CO2含有加湿インキュベータにて37℃で育成した。
【0091】
MTTアッセイ。 MTTアッセイの手順は、些少の修正を加えたのみで(Carmichael等1987)の記載する方法に従った。薬剤投与前、細胞を、96ウェルプレートに、10,000個/ウェル(HTB-9, HeLa, H460, HCT116, T98G, OVCAR-3)、15,000個/ウェル(DU145, MCF-7, HepG2, U2OS)、または、40,000個/ウェル(K562)の濃度で撒き24時間インキュベートした。次に、細胞を、薬剤に48時間(HepG2、U2OSには72時間、MCF-7には96時間)暴露した。薬剤処置後、MTT(0.5mg/ml)を培養体に加え1時間インキュベートした。フォルマザン(生細胞によるテトラゾリウムの還元によって生ずる産物)の形成は、DMSOに溶解し、490nmにおけるO.D.を、ELISAリーダーによって測定した。薬剤処置前の細胞のMTTレベルも測定した(T0)。%細胞増殖(%G)を、下記のように計算した。すなわち、
【0092】
(数1)
%G = (TD-T0/TC-T0)x100
式中、TCまたはTDは、コントロール細胞または薬剤処置細胞のO.D.読み取り値を表す。
【0093】
T0>TDの場合、コントロールの%で表される細胞傷害性(LC)を、下記のように計算した。すなわち、
【0094】
(数2)
%LC = (TD-T0/T0)x100
【0095】
画分および分析。 0.5 gの抽出物粉末を、H2O(200 ml)とN-ブタノール(200 ml)の間で分配溶解した。ブタノール分画を凍結乾燥し、この残渣の3分の2を、あらかじめ、MeCN、次にMeCN:H2O、次にH2O(それぞれ5 ml)で湿らせた、前もって充填させた5 g RPC18ISTカラムに投入した。カラムを、H2OからMeCNに渡って段階的に展開した。分画をシリカゲルTLCで調べた。H2O:MeCN(80:20および50:50)で溶出し、Rf0.11付近にTLCスポットを示した第4、第5、および第6分画はサポニンを含んでいた。
【0096】
これらの分画のH NMRスペクトラム(CD3OD溶液、300MHz)は、グリコシドの典型的領域である3-4 ppm領域、および、サポニンのアグリコン部分に典型的な0.82-2 ppm領域に信号を示した。
【0097】
分画4のH NMRスペクトラムは、領域5.8-7.8 ppmにも信号を含んでいた。これは、クマリンおよびフラボノイドによるものと考えられた。分画5と6のスペクトラムは、ほとんど近似していた。分画4、5、6はサポニンを含んでいた。外見およびNMRスペクトラムは、サポニンであることを示していた。
【0098】
TLC過程。 RP C18 ISTカラムから得られる分画を標準濃度(10 mg/ml)で調製し、各分画を、シリカゲルTLCプレート(Merck Keiselgel 60 F254)にスポットした。下記の混合物(CHCl3:MeOH:H2O-35:65:40)の基底層を移動相として展開した。分離されたスポットは、UV光、および酸化バニリン浸潤(2 gバニリンの、100 ml EtOHプラスH2SO4溶液、1 ml)を用いて可視化した。
【0099】
本発明は、Xanthoceras Sorbifoliaから単離された化合物同士が相互作用を持つ経路を提供する。ある実施態様では、化合物は、ガンに対して効果的な化合物であって、式C57H88O23を持ち、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンなる化学名を持つ化合物、および誘導体化合物を持つ。これらの化合物は、細胞の受容体、または成分を調節する。この化合物は、Xanthoceras Sorbifliaと呼ばれる植物から単離することが可能であり、化学的に合成することも可能である。
【0100】
その化合物は、
【0101】
【化7】

3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンである。
【0102】
【化8】

【0103】
【化9】

【0104】
【化10】

【0105】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0106】
【化11】

【0107】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0108】
細胞増殖を監視する、多くの成分および経路がある。
【0109】
Xanthoceras Sorbifolia化合物、またはその誘導体は、Wnt(ウィングレス型MMTV統合部位ファミリーメンバー)シグナル伝達経路において活動する。Wntシグナル伝達経路は、進化的に保存されており、胚発生において多くの事象を調節する。この経路は、細胞形態、増殖、運動性を始め、細胞のアポトーシスも調節する。この経路はまた、腫瘍発生においても重要な役割を果たす。Wnt経路はまた、ヒトの、いくつかの異なるタイプのガンにおいて不適切に活性化されることが観察されている。
【0110】
核では、Wntシグナル用の標的遺伝子は、通常は、遺伝子調整タンパクの抑制性複合体、例えば、遺伝子調整タンパクLEF-I/TCFに結合するGrouchoコリプレッサータンパクによって休止状態に置かれる。Wntシグナルが無いと、若干のβ-カルテニンが、カドヘリンタンパクの細胞質尾部に結合し、APC-axin-GSK-3βによって結合された細胞質性β-カルテニンが少しでもあればそれは、その普遍化、およびプロテアソームにおけるその分解を誘発する。その結果は、β-カルテニンの細胞内量の減少となる。一方、Wntの、Frizzled(7個の膜貫通受容体)、およびLRP(低密度脂質タンパク受容体)に対する結合が、ある機構によってDishevelled(細胞質シグナル伝達タンパク)を活性化すると、これは、カゼインキナーゼIとカゼインキナーゼIIを必要とする、ある機構によって、分解複合体におけるGSK-β3の不活性化をもたらす。β-カテニン-axin-腺腫瘍結腸ポリープ症(APC)-グリコーゲンシンターゼキナーゼ(GSK)-3βから成る複数タンパク複合体は、プロテアソームによる分解のためにリン酸化によってβ-カテニンを標的するが、このタンパク複合体の活性は、次に、Dsh/Dvl(Dishevelled, dsh相同体1)によって抑制される。次に、これは、β-カテニンのプライマー活性を抑制し、間接的にβ-カテニンのGSK-3βのリン酸化を阻止する。Wntによって刺激されると、Dvlは、GSK-3結合タンパクGBPを招集して、β-カテニン-axin-腺腫瘍結腸ポリープ症(APC)-グリコーゲンシンターゼキナーゼ(GSK)-3βから成る複数タンパク複合体に含める。次に、GBPは、axinからGSK-βを定量し、このようにして、β-カテニンのリン酸化が抑制される。次に、axinが、LRPによって細胞膜において壊死形成される。上記全ての結果は、細胞質β-カテニンの蓄積である。核においては、β-カテニンは、LEF-I/TCFに結合し、Grouchoを押し退け、Wnt標的遺伝子の転写を刺激する共同活性因子として活動する。
【0111】
Xanthoceras Sorbifolia組成物は、Wnt経路、またはその受容体に関連する成分を調節し、そうすることによってガン細胞の増殖を停止させる。
【0112】
本化合物またはその誘導体は、マイトゲン、Ras、およびMAP(微小管結合タンパク)キナーゼ経路において活動する。マイトゲンが細胞表面の受容体に結合すると、RasおよびMAPキナーゼカスケード反応が導かれる。この経路の一つの作用は、遺伝子調節タンパクMycの産生増加である。Mycは、いくつかの遺伝子、例えば、サイクリンD、およびSCFユビキチンリガーゼのサブユニットを含む遺伝子の転写を増大させる。その結果得られる、G1-CdkおよびG1/S-Cdk活性の増加は、Rbリン酸化、および、遺伝子調節タンパクE2Fの活性化を増進し、S期への進入をもたらす。S期において、G1-Cdk活性は、Rbリン酸化を誘発し、これは次にRbを不活性化し、E2Fを遊離し、S-期遺伝子、例えば、G1/S-サイクリン(サイクリンE)およびS-サイクリン(サイクリンA)の遺伝子の転写を活性化する。その結果、G1/S-CdkおよびS-Cdkが出現するが、これは、Rbリン酸化を増し、正のフィードバックループを形成し、かつ、E2Fが後戻りに作用して、自身の遺伝子の転写を刺激し、さらに別の正フィードバックループを形成する。Mycはまた、E2F遺伝子の転写を刺激することによってE2F活性を直接増大させる。その結果、S期へ進入する遺伝子の転写が増大する。しかしながら、この経路の活性が過度に高まると、ガン細胞増殖の原因となる。
【0113】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、Ras-MAPカスケード反応を、その経路の活性が過度にならないように調節する。
【0114】
本化合物またはその誘導体は、Ras-依存性またはMyc経路において活動する。時として、Rasのアミノ酸の変異によってタンパクが恒久的に活動過多となり、マイトゲンの刺激無しに、Ras依存性信号経路を過度に刺激する。同様に、Mycの活動過多を引き起こす変異は、過剰な細胞増殖を促進し、これが、ガンの発達を増進する。
【0115】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、Ras依存性またはMyc経路の成分を、その経路の活性が過度にならないように調節する。
【0116】
本化合物またはその誘導体は、異常な細胞チェックポイント機構を再び活性化する。細胞内部には、異常な分裂促進刺激を検出し、異常に活性の高い細胞をアポトーシスに向かわせるチェックポイント機構が存在する。しかしながら、この機構は、ガン細胞では、チェックポイント反応の本質部分をコードする遺伝子に変異を生じているために活動していない。チェックポイント機構に突然変異が起こると、ガン細胞は無制限に成長し、分裂する。
【0117】
植物Xanthoceras Sorbifoliaから得られる化合物または誘導体は、チェックポイント機構を再び活性化してガン細胞の成長を止める。
【0118】
本化合物またはその誘導体は、細胞外増殖シグナル伝達経路に作用する。細胞成長を刺激する細胞外増殖因子は、細胞表面の受容体に結合し、細胞内シグナル伝達経路を活性化する。これは、酵素PI-3キナーゼを活性化し、このキナーゼは、少なくとも一部はeif4eの活性化、およびs6キナーゼのリン酸化を通じてタンパク合成を促進し、mRNA転写の増加、次に細胞成長の刺激をもたらす。
【0119】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、細胞外成長に関連する成分または受容体を調節する。本化合物または組成物は、卵巣ガン細胞の受容体に結合しガン細胞の成長を止める。
【0120】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、RasおよびMAPキナーゼに関連する成分または受容体を調節し、これは、卵巣ガン細胞の成長を止める。
【0121】
本化合物またはその誘導体は、細胞内機構に作用する。細胞分裂も、細胞増殖を制限する細胞内機構によって調節される。正常な細胞では、Mycタンパクは、核において、細胞増殖のシグナルとして活動する。大量のMycは、細胞を過度に増殖させ、腫瘍を形成させる。
【0122】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、Myc細胞増殖の成分または受容体を、腫瘍細胞の分裂を止めるように調節する。
【0123】
本化合物またはその誘導体は、TGF-アルファ・シグナル伝達経路に作用する。TGF-アルファは、ケラチノサイト、マクロファージ、肝細胞、および血小板によって生産される。その合成は、ウィルスの感染によって刺激される。TGF-アルファは、げっ歯類およびニワトリの、未成熟造血前駆細胞、例えば、BFU-Eについて、分化を招くことなくそれらの長期の増殖を誘発する。TGF-アルファはまた、BFU-E細胞の、最終的な赤血球への分化を誘発する。TGF-アルファは、培養内皮細胞の増殖を刺激する。TGF-アルファは、腫瘍組織における血管分布において重要な役割を演じる。
【0124】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、TGF-アルファの成分または受容体を、卵巣ガンおよび膀胱ガン細胞の成長を抑えるように調節する。
【0125】
本化合物またはその誘導体は、TGF-ベータ・シグナル伝達経路に作用する。TGF-ベータは、細胞の成長および増殖を調節し、多くの細胞タイプの成長を阻止する。二種類のTGF-ベータ受容体、タイプ1とタイプ2がある。これらは、転写調節因子のSMAD(二つの最初に特定されたタンパク、線虫ではSma、ショウジョウバエではMadにちなんでつけられたタンパク名)ファミリーを通じてシグナル伝達するセリン-トレオニンキナーゼである。TGF-ベータ経路およびSMADの変異はヒトのガンに関連する。
【0126】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、TGF-ベータの成分または受容体を、卵巣ガンおよび膀胱ガン細胞の成長を抑えるように調節する。
【0127】
本化合物またはその誘導体は、DNAウィルスによって損傷された細胞機能を再び活性化する。DNA腫瘍ウィルスは、細胞サイクル調節Rbタンパクおよびp53タンパクを阻害することによってガンを引き起こす。p53遺伝子の突然変異によって、ガン細胞は、DNAが損傷されているにも拘わらず、生き延び増殖することが可能になる。パピローマウィルスは、E6およびE7タンパクを用いて、それぞれ、p53およびRbの配列を並べる。この活動は、突然変異細胞を活性化し、これらの変異細胞が生存し、次に分裂し、集積することを可能にする。損傷細胞の集積はガンに至ることが可能である。
【0128】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、E6およびE7タンパクを調節し、異常な細胞の分裂を阻止するRbおよびp53タンパクを放出する。化合物または組成物は、該タンパクを調節または該タンパクと反応して、ガン細胞を死滅させる。
【0129】
本化合物またはその誘導体は、p53シグナル伝達経路に作用する。p53は、多細胞生物が、DNA損傷や、その他ストレス性の細胞事象を無事に修復することを助け、危険となる可能性のある状況下では細胞増殖を止める。ガン細胞は、大量の変異p53タンパクを含む傾向がある。これは、これらの細胞の経験した遺伝的偶発事件、または、不適切な環境における成長ストレスが、正常にp53タンパクを活性化するシグナルを生成したことを示唆する。従って、p53活性化の消失は、ガンと関連して極めて危険である可能性がある。なぜなら、その場合、突然変異細胞は、細胞周期を連続的に続けることが可能となるからである。さらに、それによって、細胞はアポトーシスを免れることが可能となる。従って、DNAが損傷された場合、ある細胞は死ぬが、生き残る細胞は、その損傷を修復するために留まることなく、分裂を続ける。これは、細胞の死を招くこともあるが、あるいは、細胞は生き延びて、ゲノムを崩壊させたままで増殖することがあり得、これは、例えば、遺伝子増幅によって、腫瘍抑制遺伝子の欠損、およびガン遺伝子の活性化の両方をもたらす可能性がある。遺伝子増幅によって、細胞は、治療薬剤に対する耐性を養う可能性がある。
【0130】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、p53経路の成分および受容体を、ガン細胞の分裂を止めるように調節する。
【0131】
本化合物またはその誘導体は、細胞の自殺シグナル伝達経路に作用する。核を含む全ての細胞は、細胞を破壊する前にシグナルを待っている、各種不活性プロカスパーゼを含んでいる。各自殺プロテアーゼは、プロカスパーゼと呼ばれる不活性な酵素前駆体として作製される。この前駆体は、通常、カスパーゼファミリーの別のメンバーによるタンパク分解性分断によって活性化される。分断された断片の二つが合わさって、カスパーゼの活性部分を形成すると、この活性酵素が、上記二つの部分2個から成るテトラマーとなると考えられる。各活性化カスパーゼ分子は、多くのプロカスパーゼ分子を分断することができるので、これが順々により多くの分子を活性化する。一連の反応すなわちカスケードを通じて、この活動は、多数のプロカスケード分子の爆発的活動をもたらす。次に、この活性化プロカスパーゼの内のあるものは、細胞における決定的に重要なタンパク、例えば、特定の細胞質タンパクおよび核ラミンを含む重要タンパクの内のいくつかを分断し、細胞の調節的死をもたらす。
【0132】
細胞外部において斃死受容体を活性化することも、不活性プロカスパーゼを起動することができる。例えば、キラーリンパ球は、標的細胞の表面にFasタンパクを生産することによってアポトーシスを起こすことが可能である。次に、これらのFasタンパククラスターは、細胞内のアダプタータンパクを招集し、これが、プロカスパーゼ-8分子を結合し、凝集する。次に、これらの分子は互いに分断して、活性化を促す。次に、活性化されたカスパーゼ-8分子は、下流のプロカスパーゼを活性化してアポトーシスを誘発する。
【0133】
しかしながら、ガン細胞では、細胞を破壊するためのシグナルが、遺伝子突然変異のために阻止される。このことは、ガン細胞が分裂を続け、そのために腫瘍の原因となることを意味する。
【0134】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、自殺シグナルの阻止を解き、ガン細胞の自己破滅を可能とする。
【0135】
本発明は、腫瘍細胞の増殖を抑制する方法であって、R1、R2、R3、R4が短い脂肪族鎖であり、R5がオキシル基を含む化合物であって、その化合物の、前記腫瘍細胞の増殖を抑制するのに有効な量、および、製薬学的に受容可能な担体に対して接触させることを含む方法を提供する。
【0136】
本発明は、R1=R2=R3=R4=CH3、およびR5=OHである、前記方法を提供する。
【0137】
【化12】

【0138】
【化13】

【0139】
【化14】

【0140】
【化15】

【0141】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0142】
【化16】

【0143】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0144】
本発明は、腫瘍細胞の増殖を抑制する方法であって、糖;テレペンまたはサポゲニン;および、炭素21および22の側鎖またはアンゲロイル基とを含み、それらが動作的に結合して形成する化合物のある量、および製薬学的に受容可能な担体に対して接触させることを含む方法を提供する。
【0145】
本発明は、被験体において腫瘍細胞増殖を抑制する方法であって、R1、R2、R3、R4が短い脂肪族鎖であり、R5がオキシル基を含む化合物であって、その化合物の、前記腫瘍細胞の増殖を抑制するのに有効な量、および製薬学的に受容可能な担体を、該被験体に投与することを含む方法を提供する。
【0146】
本発明は、R1=R2=R3=R4=CH3、およびR5はオキシル結合を含むことを特徴とする請求項27方法を提供する。
【0147】
【化17】

【0148】
【化18】

【0149】
【化19】

【0150】
【化20】

【0151】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0152】
【化21】

【0153】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0154】
本発明は、被験体において腫瘍細胞の増殖を抑制する方法であって、糖;テレペンまたはサポゲニン;炭素21および22の側鎖またはアンゲロイル基とを含み、それらが動作的に結合して形成する化合物、および製薬学的に受容可能な担体を、該被験体に投与することを含む方法を提供する。
【0155】
本発明は、下記の実施例を参照することによってさらによく理解されよう。しかしながら、当業者であれば、そこで論じられる特定の方法および結果は、単に本発明を説明するものでしかなく、本発明は、頭書の特許請求項にさらに十分に記載されることが簡単に了解されるであろう。
【実施例1】
【0156】
正常高齢マウスにおける学習能力の改善に及ぼすXおよびYの作用。XおよびYは、文冠果の異なる抽出物である。
16月齢、体重35-55gの高齢雄性マウスを、11cm水深の水(25-26℃)で満たしたSMG-2で訓練した。SMG-2には、スタートポイント、4個のブラインド終端、脱出プラットフォーム、およびそれぞれのルートがある。マウスは、脱出プラットフォームを見つけ出すように訓練され、水からの脱出潜時、および過誤頻度を記録した。3回の訓練後、2分で水から脱出したマウスを試験に選んだ。この選択された高齢マウスを、11匹から成る9グループに分割した。すなわち、1)コントロール(対照):正常生食液(NS)を服用;2)陽性コントロール(陽性対照):Xi-en-kaiを0.9 g/kg服用;3)X-Iグループ:100 mg/kgを服用;4)X-IIグループ:200 mg/kgを服用;5)X-IIIグループ:400 mg/kgを服用;6)Y-Iグループ:125 mg/kgを服用;7)Y-IIグループ:250 mg/kgを服用;8)Y-IIIグループ:500 mg/kgを服用;および9)モデルグループである。
【0157】
薬剤は全て、水迷路試験の3、6、および9日前に、経口投与20 ml/kgによって与えた。水から脱出するまでの潜時(EL)および過誤頻度を記録した。データは全てt-検定によって分析した。
【0158】
1.1. XおよびYの投与3日後、500 mg/kgのYを服用したグループ9マウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.05)。他の用量による処置も改善を示したが、有意なものではなかった。
【0159】
(表1.1.)高齢マウスに3日間投与した場合の植物抽出物の学習に及ぼす作
用

【0160】
1.2. XおよびYの投与6日後、全ての用量投与を受けたマウスについて水迷路における過誤頻度が有意に減少した(P<0.05、P<0.01)。500 mg/kgのYを服用したグループ9マウスによる、水迷路からの脱出潜時は、コントロールに比べて有意に減少した(P<0.05)。
【0161】
(表1.2.)高齢マウスに6日間投与した場合の植物抽出物の学習に及ぼす作
用

【0162】
1.3. XおよびYの投与9日後、全ての用量投与を受けたマウスについて水迷路における過誤頻度が有意に減少した(P<0.05、P<0.01)。500 mg/kgのYを服用したグループ9マウスによる、水迷路からの脱出潜時は、コントロールに比べて有意に減少した(P<0.05)。
【0163】
(表1.3.)高齢マウスに9日間投与した場合の植物抽出物の学習に及ぼす作用

【0164】
この結果は、抽出物XおよびYは、試験高齢マウスの学習および記憶において陽性作用を持つことを示す。さらに、効果は、XおよびY抽出物を服用する期間が長引くと増大する。
【実施例2】
【0165】
水迷路においてペントバルビタールナトリウムによって誘発された障害に対するXおよびYの作用
2.1. 抽出物XおよびYの投与の10日後、投与マウスに、ペントバルビタールナトリウムを注入して記憶喪失を誘発した。
ペントバルビタールナトリウム投与1日後、水迷路学習の結果は、100 mg/kgのX、125 mg, 250 mg/kg、および500 mg/kgのYを服用したマウスによって、終端プラットフォーム探索のために費やされる時間は有意に減少することを示した(P<0.05)。
500 mg/kgのYを服用したマウスが水迷路で冒した過誤頻度は有意に減少した(P<0.05)。
【0166】
(表2.1.)ペントバルビタール注入1日目の水迷路学習結果

【0167】
2.2. ペントバルビタールナトリウムの注入2日後、XおよびYを服用した全てのグループのマウスによって、水迷路における終端プラットフォームの探索に費される時間は有意に減少した(P<0.05)。
【0168】
(表2.2.)ペントバルビツール注入第2日目における水迷路学習結果

【0169】
2.3. ペントバルビツールナトリウムの注入3日後、XおよびYを服用した全てのグループのマウスによって、水迷路における終端プラットフォームの探索に費される時間、および、過誤頻度は有意に減少した(P<0.05)。水迷路において、250 mg/kgおよび500 mg/kgのYを服用したマウスによって冒される過誤頻度は有意に減少した(P<0.05)。
【0170】
(表2.3.)ペントバルビツール注入第3日目における水迷路学習結果

【0171】
この結果は、抽出物XおよびYは、ペントバルビツールナトリウムによって誘発された空間学習および記憶障害を改善することにおいて明瞭な、陽性作用を持つことを示す。
【実施例3】
【0172】
受動回避においてスコポラミン臭化水素によって誘発される障害に対するXおよびYの改善作用
体重16-20グラムのICRマウスをSTT-2で訓練した。マウスをプラットフォームの上に置き、SDLを記録した。マウスが足を下ろし、四足全てが金網に置かれた場合、直後に電気ショック(36 V)が与えられ、ELが記録された。SDLおよびELが2-60秒以内のマウスを試験に選んだ。選ばれた高齢マウスを9グループに分けた。各グループには5匹の雄性および5匹の雌性マウスが居た。薬剤は全て、プラットフォーム訓練前3、6、9日前に経口投与20 ml/kgによって投与した。5分間におけるSDL、EL、および過誤頻度(与えられた電気ショックの回数)を記録した。投与10日後、全てのマウスグループに対してスコポラミン臭化水素3 mg/kgを注入した。スコポラミン臭化水素の投与30分後、マウスをプラットフォームで訓練し、翌日も訓練を繰り返した。訓練時のマウスの成績を記録した。SDL、EL、および過誤頻度を記録した。データは全てt-検定によって分析した。
【0173】
3.1 XおよびY投与の9日後におけるマウスの受動回避の成績は、XおよびYを服用したマウスは、その全用量において、EL、および過誤頻度が低下することを示した。
【0174】
(表3.1.)投与9日後における高齢マウスの受動回避

【0175】
3.2. XおよびYの投与10日後、試験マウスにスコポラミンを投与した。高齢マウスの受動回避の成績は、Xの400 mg/kg、および、Yの250 mg/kgおよび500 mg/kgを服用したマウスが受動回避において冒した過誤頻度は有意に低下したことを示した(P<0.05、P<0.01)。
【0176】
(表3.2.)スコポラミンによって誘発された障害に対する植物抽出物XおよびYの
改善作用

【0177】
スコポラミンで障害を受けたマウスにおける受動回避試験の結果は、XおよびYを服用したマウスの冒した過誤頻度は、全ての用量において有意に低下した(P<0.05)ことを示した。Yの250 mg/kgを服用したマウスではSDLが有意に延長した。
【0178】
この結果は、抽出物XおよびYは、スコポラミンによって誘発された学習および記憶障害を改善することにおいて明瞭な、陽性作用を持つことを示す。
【0179】
(表3.3.)スコポラミンによって誘発された障害に対する植物抽出物XおよびYの
改善作用

【0180】
この結果は、抽出物XおよびYは、スコポラミン臭化水素によって誘発された学習および記憶障害を改善することにおいて明瞭な、陽性作用を持つことを示す。
【実施例4】
【0181】
水迷路においてHaCO2によって誘発された障害に対するXおよびYの改善作用。
体重16-19gのICR雄性マウスを、11cm水深の水(25-26℃)で満たしたSMG-2で訓練した。SMG-2には、スタートポイント、4個のブラインド終端、脱出プラットフォーム、およびそれぞれのルートがある。マウスは、脱出プラットフォームを見つけ出すように訓練され、水からの脱出潜時、および過誤頻度を記録した。訓練後、1分以内で水から脱出したマウスを試験に選んだ。この選択された高齢マウスを、11匹から成る9グループに分割した。薬剤は全て、水迷路試験の3、6、9日前に経口投与20 ml/kgによって投与した。投与10日後、全てのマウスグループに対してHaCO2、120 mg/kgを注入した。HaCO2の投与24時間後、マウスを、脱出プラットフォームを見つけるように訓練し、水からの脱出潜時、2分内に冒した過誤頻度を記録した。ペントバルビツールナトリウムの投与を3日間続け、水迷路試験におけるマウスの成績を記録した。水からの脱出潜時(EL)、および過誤頻度を記録した。データは全てt-検定によって分析した。
【0182】
4.1. XおよびYの投与3日後、XおよびYを服用したマウスによる、水迷路からの脱出潜時および誤差頻度は減少したが、有意ではなかった。
【0183】
(表4.1.)XおよびY投与3日後、水迷路におけるマウスの学習に対する作用。

【0184】
4.2. XおよびYの投与6日後、400 mg/kgのXおよび500 mg/kgのYを服用したマウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.01)。
【0185】
(表4.2.)XおよびY投与6日後、水迷路におけるマウスの学習に対する作用。

【0186】
4.3. XおよびYの投与9日後、250 mg/kgのX、および250 mg/kgおよび500 mg/kgのYを服用したマウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.05)。
【0187】
(表4.3.)XおよびY投与9日後、水迷路におけるマウスの学習に対する作用。

【0188】
4.4. XおよびYの投与10日後、250 mg/kgおよび500 mg/kgのYを服用したマウスによる、水迷路の過誤頻度が、また、500 mg/kgのYを服用したマウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.05、P<0.01)。
【0189】
(表4.4.)XおよびY投与10日後、水迷路におけるマウスの学習に対する作用。

【0190】
この結果は、抽出物XおよびYは、水迷路試験においてマウスの学習および記憶の改善において明瞭な、陽性作用を持つことを示す。さらに、効果は、XおよびY抽出物を服用する期間が長引くと増大した。
【0191】
4.5. XおよびYを10日間服用した後に、マウスに、試験後NaNO2を投与した。高齢マウスの水迷路学習において、NaNO2によって誘発された障害に対する、XおよびYによる処置の結果を見てみると、100 mg/kgおよび200 mg/kgのX、Yの場合は全用量を服用したマウスにおける過誤頻度は、コントロールに比べて有意に減少した(P<0.05)(表4.5)。これは、抽出物XおよびYは、NaNO2による障害の防止において明瞭な、陽性作用を持つことを示す。
【0192】
(表4.5.)NaNO2によって誘発された障害に対する抽出物XおよびYの防止作用

【実施例5】
【0193】
マウスの排尿に対する文冠果(Xanthoceras sorbifolia)抽出物の作用。
XおよびYは、文冠果の異なる抽出物である。Xは、ある一種の文冠果(Xanthoceras sorbifolia)の抽出物であり、Yは、ある一種の文冠果(Xanthoceras sorbifolia)の抽出物である。
【0194】
実験法
体重18-22グラムの、112匹の雄性ICRマウスを、14匹から成る8グループに分割した。1はコントロールで、正常な生食液(NS)を服用;2はDCTグループでDCT 33.4 mg/kgを服用;3はX-Iグループで100 mg/kgを服用;4はX-IIグループで200 mg/kgを服用;5はX-IIIグループで400 mg/kgを服用;6はY-Iグループで125 mg/kgを服用;7はY-IIグループで250 mg/kgを服用;および、8はY-IIIグループで500 mg/kgを服用した。
【0195】
薬剤は全て経口投与20 mg/kg、1日1回3日間とした。最終投与後、マウスをろ紙の上に載せた。このろ紙は、500 mlビーカーの底に敷いた。尿量を、30、60、120、180、240、300、および360分時において、電子分析秤によってろ紙の重量を測ることによって計測した。データは全てt-検定によって分析した。
【0196】
結果
XおよびYの投与3日後、400 mg/kgのXを服用したマウスによって30分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.01)減少した。600 mg/kgのYを服用したマウスによって60分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.01)減少した。
【0197】
200 mg/kgのX、125 mg/kgおよび500 mg/kgのYを服用したマウスによって180分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.01)減少した。(表5.1)。
【0198】
(表5.1.)XおよびY投与の3日後における抽出物XおよびYのマウスの尿量に対す
る作用

【0199】
(表5.1.)XおよびY投与の3日後における抽出物XおよびYのマウスの尿量に対す
る作用(続き)

【0200】
この結果は、抽出物XおよびYは、XとYの投与3日後でも尿量を調節することが可能であることを示した。
【0201】
XおよびYの投与5日後、400 mg/kgのX、および500 mg/kgのYを服用したマウスによって30分時に排出された尿量は、正常生食液を服用したマウスと比べて減少したが、有意ではなかった。400 mg/kgのX、および全用量のYを服用したマウスによって4時間時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.05、P<0.01)減少した(表5.2)。
【0202】
(表5.2.)XおよびY投与の5日後における抽出物XおよびYのマウスの尿量に対す
る作用

【0203】
(表5.2.) XおよびY投与の5日後における抽出物XおよびYのマウスの尿量に対
する作用(続き)

【0204】
この結果は、抽出物XおよびYは、XとYの投与5日後でも尿量を調節することが可能であることを示した。
【0205】
XおよびYの投与7日後、尿量を、30、60、120、180、240、300、および360分時に測定した。200、400 mg/kgのX、および、250、500 mg/kgのYを服用したマウスによって30分時に排出された尿量は、正常生食液を服用したマウスと比べると、有意に減少したが(P<0.05)が、240分では増加した(表5.3)。
【0206】
(表5.3.)XおよびY投与の7日後における抽出物XおよびYのマウスの尿量に対
する作用

【0207】
(表5.3.)XおよびY投与の7日後における抽出物XおよびYのマウスの尿量に対す
る作用(続き)

【0208】
この結果は、抽出物XおよびYは、XとYの投与7日後でも尿量を調節することが可能であることを示した。
【0209】
XおよびYの投与10日後、200、400 mg/kgのX、および250、500 mg/kgのYを服用したマウスによって120分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.05)減少した(図3)。
【0210】
(表5.4.)XおよびY投与の10日後における抽出物XおよびYのマウスの尿量に対す
る作用

【0211】
(表5.4.)XおよびY投与の10日後における抽出物XおよびYのマウスの尿量に対す
る作用(続き)

【0212】
この結果は、抽出物XおよびYは、XとYの投与3-10日後でも尿量を調節することが可能であることを示した。
【0213】
これまで、本発明を、特に好ましい実施態様を参照しながら詳細に説明してきたわけであるが、本発明は、他の異なる実施態様も可能であること、その細部は、様々な明白な局面において修正が可能であることを理解しなければならない。当業者には直ちに明白なように、本発明の精神や範囲を逸脱することなく、変更および修正を実行することが可能である。従って、前述の開示、説明、および図面は、例示目的のために為されるものであって、いかなる点でも本発明を限定するものではない。本発明はただ特許請求項によってのみ定義される。
【実施例6】
【0214】
ハーブ抽出
(a)Xanthoceras Sorbifoliaの種皮、枝、幹、葉、核、根、または樹皮の粉末を、有機溶媒によって、1:2の比率で、4-5回、各回20-35時間抽出して、有機抽出物を形成すること;(b)有機抽出物を収集すること;(c)有機抽出物を80℃において2-3回環流して第2抽出物を形成すること;(d)第2抽出物から有機溶媒を除去すること;および(e)抽出物を乾燥し、滅菌してXanthoceras Sorbifolia抽出物粉末を形成すること。
【実施例7】
【0215】
HPLCクロマトグラフィーによるXanthoceras Sorbifolia抽出成分の分析
方法および材料
HPLC
C-18逆相μボンダパックカラム(Water P/N 27324)を、10%アセトニトリル、0.005%トリフルオロ酢酸(平衡液)で平衡させた。Xanthoceras Sorbifolia抽出物を、カラムに与える前に、平衡液(1 mg/ml)に溶解した。20 μgのサンプルをカラムに注入した。溶出条件:分画は、アセトニトリル(濃度勾配は、70分で10%から80%)で溶出し(流速0.5 ml/分)、その後10分(70-80分)は80%に維持した。次に、アセトニトリルをを10%に落とし(80-85分)、10%に25分(85-110分)維持した。分画は、207 nmにおいて、チャートスピード0.25 cm/分、ODフルスケール0.128で監視した。
装置:Watersモデル510溶媒搬送システム;Waters484可変吸収検出器;Waters745/745Bデータモジュール
【0216】
吸収度分析
各種波長におけるXanthoceras Sorbifolia抽出物の吸収プロフィールを求めた。Xanthoceras Sorbifolia抽出物を、10%アセトニトリル/TFAに溶解し、分光光度計(Spectronic Inc., Model Gene Sys2)によって200-700 nmにおいて走査した。
【0217】
結果
HPLC
プロフィールにおいて、約60-70個のピークが関連ありとされた。その内、大ピークは4個、中ピークは10個、残りは小型分画であった。大ピークを、アセトニトリル溶出の濃度増加に従ってaからzで表示した。図1を参照されたい。
【0218】
吸収最大
Xanthoceras Sorbifolia植物抽出物において、三つの吸収最大が特定された。すなわち、207 nm, 278 nm、および500 nmである。図2を参照されたい。
【実施例8】
【0219】
各種ヒト器官由来のガン細胞に対するXanthoceras Sorbifolia抽出物の細胞傷害をMTTアッセイによってスクリーニングする。
方法および材料
細胞
ヒトのガン細胞系統を、米国基準菌株保存機関から入手した。HTB-9(膀胱)、HeLa-S3(子宮頸部)、DU145(前立腺)、H460(肺)、MCF-7(乳房)、K562(白血球)、HCT116(結腸)、HepG2(肝臓)、U2OS(骨)、T98G(脳)、およびOVCAR-3(卵巣)である。細胞は、10%仔牛血清、グルタミン、および抗生物質を添加した培養液(HeLa-S3、DU145、MCF-7、Hep-G2、およびT98Gは、MEN(Earlの塩)において;HTB-9、H460、K562、OVCAR-3は、RPMI-1640において;HCT-116、U2O2は、McCoy-5Aにおいて)で、5%CO2含有加湿インキュベータにて37℃で育成した。
【0220】
MTTアッセイ。
MTTアッセイの手順は、些少の修正を加えたのみで(Carmichael等1987)の記載する方法に従った。薬剤投与前、細胞を、96ウェルプレートに、10,000個/ウェル(HTB-9, HeLa, H460, HCT116, T98G, OVCAR-3)、15,000個/ウェル(DU145, MCF-7, HepG2, U2OS)、または、40,000個/ウェル(K562)の濃度で撒き24時間インキュベートした。次に、細胞を、薬剤に48時間(HepG2、U2OSには72時間、MCF-7には96時間)暴露した。薬剤処置後、MTT(0.5mg/ml)を培養体に加え1時間インキュベートした。フォルマザン(生細胞によるテトラゾリウムの還元によって生ずる産物)の形成は、DMSOに溶解し、490nmにおけるO.D.を、ELISAリーダー(Dynatech、モデルMR700)によって測定した。薬剤処置前の細胞のMTTレベルも測定した(T0)。%細胞増殖(%G)を、下記のように計算した。すなわち、
【0221】
(数3)
%G = (TD-T0/TC-T0)x100
式中、TCまたはTDは、コントロール細胞または薬剤処置細胞のO.D.読み取り値を表す。
【0222】
T0>TDの場合、コントロールの%で表される細胞傷害性(LC)を、下記のように計算した。すなわち、
【0223】
(数4)
%LC = (TD-T0/T0)x100
【0224】
結果
実験した10種の細胞において、Xanthoceras Sorbifolia抽出物に対する感受性を、四つのグループに分類することが可能である(感受性がもっとも高い:卵巣;高い:膀胱、骨、前立腺、および白血球;僅か:肝臓、乳房、および脳;および、もっとも低い:結腸、子宮頸部、および肺)(図23)(パワーポイントファイル1-22、スライドA、B、C、およびD)。そのIC50値を挙げる(表8.1)
【0225】
(表8.1.) 各種ガン細胞で定量した、Xanthoceras Sorbifolia抽出物のIC50値

【0226】
実験したこれらの細胞系統において、低濃度のXanthoceras Sorbifolia植物抽出物が、膀胱、骨、および肺の細胞の増殖を刺激することが判明した(図3Aおよび3D)(PPファイル1-22、スライド1および4)。
【0227】
純粋分画Yは、増殖刺激活性を失ったが、抑制活性は維持した(図23Aを、図25および27と比較せよ)(PPファイル4-26、スライド2および4)。予備結果(図25)(PPファイル4-26、スライド2)は、増殖成分は、FPLC分画610と1116に存在することを示す。
【実施例9】
【0228】
活性Xanthoceras Sorbifolia抽出物の精製
FPLCによるXanthoceras Sorbifolia抽出物成分の画分
方法
カラム:オクタデシル機能化シリカゲル;カラムサイズ:2cmx28cm;10%アセトニトリル-0.005%TFAで平衡。
サンプル負荷:1-2 ml;濃度:10%アセトニトリル/TFAにおいて100 mg/ml。
勾配溶出:合計500 ml容量において10-80%アセトニトリル。
モニター吸収波長:254 nm
分画収集器:5 ml/分画(10%から72%アセトニトリルで収集、合計90分画)。
装置:AKTA-FPLC, P920ポンプ;モニターUPC-900;Frac-900
【0229】
結果
溶出プロフィールは、4-5個の広範な分画を示す(図4)(PP-FPLC-15)。これらの分画をHPLCで分析した。次に、特異的成分(a-z)を、FPLCプロフィールと分画に戻って特定した。
【0230】
FPLC分画を、7個のプールに分け、膀胱細胞において、MTTアッセイにより細胞増殖活性について分析した。一つのプール(#5962)のみが抑制活性を含むことが判明した(図5)(PPファイル4-26、スライド2)。
【0231】
FPLC−C18オープンカラム、64%アセトニトリルイソクラチック溶出による#5962の画分
方法
カラム:オクタデシル機能化シリカゲル;50 ml; 2cmx28cm;64%アセトニトリル-0.005%TFAで平衡。
サンプル負荷:0.2 ml;濃度:65%アセトニトリル/TFAにおいて1-2 mg/ml。
溶出:64%アセトニトリルイソクラチック。
モニター吸収波長:254 nm
分画収集器:1 ml分画(最初の90分画を収集)。
装置:AKTA-FPLC, P920ポンプ;モニターUPC-900;Frac-900。
【0232】
結果
分画5962の、64%アセトニトリル・イソクラチック溶出によるオープンODS-C18カラムによってさらに精製した。二つの大きな分画(XおよびY)が収集された(図26)(PP-iso80-5)。MTTアッセイによって、Y分画のみが抑制活性を有することが判明した(図27)(PPフィアル4-26、スライド4)。
【0233】
HPLCによる分画Yの分析
方法
カラム:Waters μボンダパックC18 (3.9 x 300 nm)。
溶出:35%または45%イソクラチック溶出。
流速:0.5 ml/分;207 nm;減衰0.128;チャートスピード:0.25 cm/分
【0234】
結果
35%イソクラチック分析において、Y分画は、4-5個の成分(Y0、Y1、Y2、Y3、およびY4)を含む。Y3およびY4は大きな成分である。Y1とY2は一緒にまとまり、Y3とY4は一緒にまとまる(図28)。(PP-HPLC-Y-iso35)。
【0235】
45%イソクラチック分析において、Y1、Y2ピーク同士は合体して一つのピークとなり、Y3とY4ピーク同士も合体して一つのピークになる(図29)。(PPファイル6-8、スライド1)。Y3/4の後にY5成分があるようである。
【0236】
予備的HPLCによる活性Y成分の最終的単離
方法
カラム:予備的HPLCカラム(WaltersデルタパックC18-300A)。
溶出: 45%アセトニトリルイソクラチックで、流速1 ml/分。
モニター207 nm
ピーク分画を収集し、凍結乾燥した。
【0237】
この条件下における結果
Y1とY2とは互いによく分離されるので、個別に収集される。Y3/4およびY5は分離されない(図30)(PP-HPLC-Y-iso45)。Y3/4ピーク物質の上行部分および下行部分を、さらにNMRによって分析すると、同様のプロフィールが得られ、Y3/4は均一成分であることが示された(図31)(PP-3-4プロトンNMR)。従って、この分画はY分画と命名された。収集されたY分画の復帰分析は、C18逆相カラムを備えたHPLCにおいて単一ピークを示した。(図32)(PP-HPLC-純粋-Y)。
【0238】
外観および可溶性
純粋なYは、非晶質白色粉末で、水溶性アルコール(メタノール、エタノール)、50%アセトニトリル、および100%ピリジンに可溶である。
【0239】
Y分画のMTT分析によって下記が判明した。すなわち、
(a)Y分画は、卵巣ガン細胞(OCAR-3)に対して活性を持ち、IC50は1 μg/mlであり、これは、未精製物質よりも10-15倍効力が高かった(図33aおよび33b)(PPファイル7-26)、および、
(b)Y分画は、子宮頸ガン細胞(HeLa)と比較した場合、卵巣ガン細胞に対してその選択性を維持する(図34)(PP5-11、HeLa細胞における比較例ではあまり活性がない)。
【実施例10】
【0240】
Xanthoceras Sorbifolia活性抽出物の化学的構造の決定
方法
NMR分析
Xanthoceras Sorbifolia抽出物と純粋Y分画、およびその他のサンプルについてNMR分析を行った。サンプルを、0.05% v/v TMSを含むピリジン-5に溶解した。NMRスペクトラムは全て、298KにおいてQXIプローブ(1H/13C/15N/31P)を備えたBruker Avance 600 MHz NMRスペクトロメーターを用いて得た。1D 1Hスペクトラムのための走査数は、サンプル濃度に応じて16から128であった。2D HMQCスペクトラムは、6000 x 24,000 Hzのスペクトラム幅で、t2およびt1ディメンジョンに対して、それぞれ、2024x256のデータポイントを配して記録した。走査数は4から128であった。2D HMBCスペクトラムは、6000 x 30,000 Hzのスペクトラム幅で、t2およびt1ディメンジョンに対して、それぞれ、2024x512のデータポイントを配して記録した。走査数は64であった。2Dデータは、t1ディメンジョンにおいてゼロ充填してデータポイントを2倍にし、t1とt2の両ディメンジョンにおいてコサイン平方ベル・ウィンドウ関数を掛け、XWIN-NMRソフトウェアを用いてフーリエ変換した。これら2Dスペクトラムの最終的な、実際のマトリックスサイズは、HMQCおよびHMBCに対し、それぞれ、2048 x 256 および2048 x 512データポイント(F2xF1)である。
【0241】
質量分析
サンプルの質量は、(A)MALDI-TOF質量分析、および、(B)ESI-MS質量分析にて分析した。
(A)MALDI-TOF用サンプルは先ずアセトニトリに溶解し、次に、マトリックスCHCA(アルファ-シアノ-4-ヒドロキシシンナミン酸、50:50水/アセトニトリルおよび最終濃度で0.1%TFAに溶解した10 mg CHCA/mL)と混合した。このサンプルを完全にアセトニトリルに溶解し、マトリックスと混合した後溶解したままに保持する。分子量は、標準を用いた、高解像度質量分析によって定量した。
(B)ESIでは、サンプルを、Thermo Finniganの作製したLCQ DECA XP Plus機によって分析した。サンプルをESIソースによってイオン化し、化合物に対する溶媒はアセトニトリルである。
【0242】
結果
プロトンNMRのプロフィールを図35に示す。(プロトン-NMR-7-20)。YのプロトンNMRの化学シフトを下記の表10.1に挙げる。
【0243】
(表10.1.) Xanthoceras Sorbifolia抽出物のY分画のプロトンNMRの化学シフト



【0244】
2D NMRデータは、下記の図に示される。すなわち、図36(PP-2D-NMR-Y-HMQC)、図37(PP-2D-NMR-HMBC)であり、化学シフトデータは表10.2(HMQC-ピーク-シフト)および表10.3(HMBC-ピーク-シフト)に示される。
【0245】
(表10.2.)YのHMQC分析2D化学シフトの化学シフトデータ
実験NO=5、過程NO=1、F1PLO=144.360ppm, F1PHI=10.797ppm, F2PLO=7.966ppm, F2PHI=0.417ppm,MI=1.00cm, MAXI=10000.00cm, PC=1.400



【0246】
(表10.3.)YのHMMC分析2D化学シフトの化学シフトデータ
実験NO=6、過程NO=1
F1PLO=178.339ppm, F1PHI=10.721ppm, F2PLO=6.881ppm, F2PHI=0.573ppm
MI=1.00cm, MAXI=10000.00cm, PC=1.400










【0247】
表10.4(Y-構造および、2D NMR化学シフトデータ)は、化合物Yのプロトンおよび炭素-13の化学シフトから得られる官能基の割り当てを示す。これらのデータおよび分析に基づいて、化合物Yの構造は下記のように割り当てられ、図示される。すなわち、
【0248】
【化22】

C57H88O23
厳密質量:1140.5716
分子量:1141.2948
C, 59.99; H, 7.77; O, 32.24
【0249】
【化23】

【0250】
【化24】

【0251】
【化25】

【0252】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0253】
【化26】

【0254】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0255】
化合物Yの構造
化合物Yの化学名は、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンである。
【0256】
(表10.4.) 化合物Yの13Cおよび1H NMRデータ(ピリジン-d5における)a


【0257】
図38は、MALDI-TOFおよびESI-MS技術によって求めたYのマススペクトラムを示す。
【0258】
結論
化学シフト分析に基づいて、Xanthoceras Sorbifolia抽出物から単離された活性化合物Yは、バックボーンに3個の糖とビアンゲロイル基が付着したトリテルペノイドサポニンである。Yの化学式はC57H88O23であり、Yの化学名は、
3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンである。
【0259】
参考文献
1.「中国医学の薬理学の研究法」
2.「学習および記憶力改善に及ぼすYangshou Danの作用の研究」
3.「認知力改善に及ぼすAnjifuの作用の研究」
4.「マウスの学習および記憶力改善に及ぼすNokkangtaiカプセルの作用の研究」
5.「マウスの学習および記憶力改善に及ぼすpeoniesの未精製サポニンの作用の研究」
6.「血管老化による老人性痴呆のDidang tangによる治療の研究」
7.「マウスの学習および記憶力改善に及ぼすTongmai Yizhiカプセルの作用の研究」
8.「老人性痴呆研究用動物モデルの研究」
9. 公衆衛生部、医事警察局「神経系疾患治療における医薬品作用研究のためのガイドライン」、最新医学研究ガイドブック。
10.「B-ペプチドによる障害に対する、Ginseng未精製サポニンの改善作用」
【図面の簡単な説明】
【0260】
【図1】図1(a)および(b)。植物抽出物投与の、高齢マウスの9日間に渡る水迷路学習に及ぼす作用。
【図2】図2(a)および(b)。3日ペントバルビタール注入の水迷路学習結果。
【図3】XおよびY投与10日後における、抽出物XおよびYのマウスの尿量に対する作用。
【図4】図4は、典型的なヒトの睡眠サイクルを示す。
【図5】図5は、文冠果種皮抽出物のHPLCプロフィールを示す。
【図6】図6は、乳ガン細胞の抑制における文冠果抽出物の効力を示す。効力は、IC50が65 μg/ml、IC0が105 μg/mlである。図6の実験結果はさらに、該抽出物は白血球ガン細胞も抑制することを示す。その場合、IC50は35 μg/mlで、IC0は50 μg/mlである。
【図7】図7は、膀胱細胞の活性増大における文冠果抽出物の効力を示す。膀胱細胞は、10 μg/mlの抽出物濃度において最大125%まで増殖する。図7の実験結果はさらに、文冠果抽出物は、高濃度において膀胱細胞を抑制すること、その場合、IC50は45 μg/mlで、IC0は60 μg/mlであることを示す。図7の実験結果は、文冠果抽出物は、卵巣ガン細胞を抑制すること、その場合、IC50は15 μg/mlで、IC0は20 μg/mlであることを示す。
【図8】図8は、脳細胞の活性増大における文冠果抽出物の効力を示す。脳細胞は、10 μg/mlの抽出物濃度において最大108%まで増殖する。図8の実験結果はさらに、文冠果抽出物は、前立腺ガン細胞を抑制すること、その場合、IC50は40 μg/mlで、IC0は70 μg/mlであることを示す。図8の実験結果は、文冠果抽出物は、脳ガン細胞を抑制すること、その場合、IC50は70 μg/mlで、IC0は100 μg/mlであることを示す。
【図9】図9は、肺細胞の活性増大における文冠果抽出物の効力を示す。図9の実験結果は、肺細胞は、10 μg/mlの抽出物濃度を含む培養液RPMI-1640において増殖し始めることを示した。図9の実験結果はさらに、肺細胞は、50 μg/mlの抽出物濃度において最大120%まで増殖することを示した。図9はまた、膀胱細胞の活性増大における文冠果抽出物の効力を示した。膀胱細胞は、10 μg/mlの抽出物濃度を含む培養液RPMI-1640において最大125%まで増殖することを示した。図9の実験結果はさらに、文冠果抽出物は、高濃度において膀胱細胞を抑制すること、その場合、IC50は45 μg/mlで、IC0は60 μg/mlであることを示した。図9の実験結果はさらに、文冠果抽出物は、肝臓ガン細胞を抑制すること、その場合、IC50は68 μg/mlで、IC0は95 μg/mlであることを示した。
【図10】図10は、文冠果抽出物は、子宮頸細胞に対して僅かな作用しか示さないことを示す。
【図11】図11は、骨細胞の活性増大における文冠果抽出物の効力を示す。骨細胞は、10 μg/mlの抽出物濃度を含む培養液RPMI-1640において最大120%まで増殖することを示した。 図11の実験結果はさらに、抽出物は、高濃度において骨ガン細胞を抑制すること、その場合、IC50は40 μg/mlで、IC0は50 μg/mlであることを示した。
【図21】図21は、μボンダパックC18カラムを備えたHPLCによる、Xanthoceras Sorbifolia抽出物成分の分離を示す。 図21A-Mは、FPLCによる、Xanthoceras Sorbifolia抽出物の内分画Yの単離を示す。AおよびBは、FPLCクロマトグラムの代表的溶出プロフィールである。C-Kは、FPLCクロマトグラムで得られた分画のHPLCプロフィールである。L:元の材料。M:TLCクロマトグラフィー。FPLCの選択分画は、TLCで分析し、炭水化物染色した。
【図22】図22は、Xanthoceras Sorbifolia抽出物の吸収スペクトラムを示す。 横軸:nmで表した波長。 縦軸:光学的密度。植物抽出物において、三つの吸収最大が特定された。すなわち、207 nm, 278 nm、および500 nmである。
【図23】図23A-23Eは、Xanthoceras Sorbifolia抽出物で処理後、MTTアッセイで求めた細胞の増殖曲線を示す。これらの実験から、Xanthoceras Sorbifolia抽出物に対する各種細胞系統の感度が記録された。 (23A)感度がもっとも高い:卵巣 (23B)高い:膀胱および骨 (23C)中等度:白血球および肝臓 (23D)僅か:前立腺、乳房、および脳 (23E)もっとも低い:結腸、子宮頸部、および肺
【図24】図24は、Xanthoceras Sorbifolia抽出物の、10-80%勾配を持つFPLCによる溶出プロフィールを示す。 縦軸:光学的密度。 横軸:分画容量(5ml/分画)
【図25】図25は、FPLC分画の細胞(膀胱細胞で実行)増殖活性のスクリーニングを示す。25Aは、FPLCで得られた溶出分画を示す。次に、これらの分画について、どの分画が活性が高いかをMTTアッセイにて求めた。25Bは、Xanthoceras Sorbifolia抽出物の各種成分(FPLCにて画分した)が、細胞に対して増殖作用か、抑制作用かどちらかを及ぼすことを示す。分画5962(Y成分)のみが細胞抑制を引き起こす。分画610および1116は、僅かに細胞増殖を刺激する。 横軸:濃度(μl/ml)。 縦軸:%細胞増殖(MTTアッセイによって定量)。
【図26】図26は、分画5962の、64%イソクラチック溶出による溶出プロフィールを示す。(二つの大きなFPLC分画XおよびYが分離される。) 縦軸:光学的密度。 横軸:分画番号(1ml/分画)
【図27】図27は、分画X(2021)およびY(2728)による、膀胱細胞の抑制活性の比較を示す。Yのみが抑制活性を持つ。
【図28】図28は、35%イソクラチック溶出による分画YのHPLCプロフィールを示す。図28はまた、35%イソクラチック分析において、Y(2728)分画は、4-5個の成分(Y0、Y1、Y2、Y3、およびY4)を含むことを示す。
【図29】図29は、45%アセトニトリルイソクラチック溶出による分画YのHPLCプロフィールを示す。図29はまた、45%イソクラチック分析において、Y3とY4ピーク同士が合体して一つのピークになることを示す。この条件では、分画Y1およびY2は、見事に分画Y3およびY4から分離される。
【図30】図30は、予備的C18カラム(Delta Pak C18)における45%アセトニトリルイソクラチック溶出による分画YのHPLCプロフィールを示す。この条件では、分画Y1およびY2は互いに十分分離しているので、それぞれ別々に収集される。
【図31】Y(3/4)ピークの上行部分および下行部分のプロトンNMRプロフィールの比較。二つは同一であることが示された。
【図32】図32は、予備的C18カラムにおいて45%イソクラチック溶出によって収集したHPLCプロフィールを示す。
【図33】図33は、精製Y分画の、卵巣ガン細胞(OCAR-3)に対する効力を示す。 横軸:濃度(μg/ml)。A:ポイントスケール、B:直線スケール 縦軸:%細胞増殖(MTTによって定量)。IC50はほぼ1μg/ml。
【図34】図34は、卵巣ガン細胞および子宮頸ガン細胞に対するY分画の効力の比較を示す。卵巣ガン細胞は、分画Yに対して感受性を持つが、子宮頸ガン細胞はそうではない。卵巣細胞に対する分画YのIC50は約1である。この結果は、卵巣ガンは、精製Y分画に対して感受性を持つことを裏付ける。
【図35】図35は、分画YのプロトンNMRの化学シフトを示す。
【図36】図36は、サンプルYのHMQC結果を示す。化学シフトデータについてはさらに表22も参照されたい。
【図37】図37は、サンプルYのHMBC結果を示す。A:レベル1、B:レベル2。化学シフトデータについてはさらに表23も参照されたい。
【図38】図38は、化合物Yの質量分析結果を示す。(A)MALDI-TOF(高質量)、A1:Y+マトリックス(CHCA)+アンギオテンシン1「2点較正」。A2:Y+マトリックス(CHCA)+アンギオテンシン「1点較正」。A3:Y+マトリックス(CHCA)。A4:マトリックス(CHCA)のみ。A5:アンギオテンシン1+マトリックス(CHCA)。(B)ESI-MS
【図39】図39は、Yの構造と化学名を示す、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エン。
【図40】図40は、Y1のプロトンNMRを示す。化学シフトデータは、表24に示す。
【図41】図41は、Y1の2D NMR(HMQC)を示す。化学シフトデータは表25に示す。
【図42】図42は、Y2のプロトンNMRを示す。化学シフトデータは、表26に示す。
【図43】図43は、Y2の2D NMR(HMQC)を示す。化学シフトデータは表27に示す。
【図44】図44は、Y4のプロトンNMRを示す。化学シフトデータは、表28に示す。
【図45】図45は、Y4の2D NMR(HMQC)を示す。化学シフトデータは表29に示す。
【図46】図46は、Y1のCOSY-NMRプロフィールを示す。化学シフトデータは表30に示す。
【図47】図47は、Y1の3種の考えられる構造を示す。A:構造Y1-1、B:構造Y1-2、および、C:構造Y1-3。
【図1a】

【図1b】

【図2a】

【図2b】

【技術分野】
【0001】
本発明は、文冠果(Xanthoceras Sorbifolia)と呼ばれる植物から得られた抽出物、それらの使用と機能、および、その調製法に関する。
関連出願に対する相互参照
【0002】
本出願は、2003年10月9日出願の米国特許出願第60/509,851号、および、2003年12月23日出願の米国特許出願第60/532,101号の利益を主張する。これらの先行出願を、ここに参照することにより本出願に含める。
【0003】
本出願を通じて様々な文献が参照される。本発明の関連する従来技術の状態をより完全に記載するために、これら刊行物の開示全体を参照することにより本出願に含める。
【背景技術】
【0004】
文冠果は、むくろじ科の植物種である。その学名はXanthoceras sorbifolia Bungeである。文冠果(Wenguanguo)が一般的中国名であるが、その他Wenguannguo、Wenguanmu、文冠花(Wenguanhua)、Xilacedeng、Golden horn、およびYellow hornとも呼ばれる。文冠果は、中国の、遼寧、吉林、河北、山東、江蘇、河南、山西、陜西、甘粛、寧夏の各省、および内モンゴルで成育する。その種子、葉、および花は食用が可能であり、数世紀に渡って遺尿症を治療するための民間医療として使用されてきた。その枝や木部も民間医療として使用される。
【0005】
ガン細胞は二種類の遺伝可能な性質によって定義される。すなわち、(1)ガン細胞は、細胞分裂に対する正常な抑制に従わずに増殖する、および、(2)ガン細胞は、通常他の細胞のために保留されている領域に侵入し、そこで増殖する。
【0006】
ガンは、発症するためには多くの遺伝子の変異を必要とするが、その発生する組織および細胞タイプに基づいて分類される。上皮細胞から発生するガンは上皮ガンと命名され、結合組織または筋細胞から発生するものは肉腫と命名される。さらに、造血細胞に由来する白血病と呼ばれるガン、および神経系細胞に由来するガンもある。
【0007】
異なるタイプの細胞から発生するガンは、一般に、様々な違いを持つ疾患である。各ガンは、その起源を反映する特質を持つ。ガンが、転移したり、調節の手を離れて増殖したりする場合であっても、その起源は、遡って単一の、一次腫瘍に帰着させることが可能である。従って、ある特定の性質を持つ標的細胞に向けた薬剤を開発することは重要である。
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、卵巣ガンに対して実質的な効力を持つ、Xanthoceras Sorbifoliaから抽出、または合成された化合物または組成物を提供する。
本発明の上記およびその他の目的に従って、本発明の簡単な概要が提示される。下記の概要では、簡単化および省略がいくつか行われるかも知れないが、それらは、本発明のある局面を強調し、紹介することを意図してなされるものであって、その範囲を限定することを意図してなされるものではない。後続のセクションにおいて、好ましい例示の実施態様が、当業者に対し、本発明の概念を具体化し、使用することを可能とするほど十分詳細に記載される。
【0009】
本発明は、文冠果抽出物の使用に関連する。この文冠果抽出物は、患者の遺尿および頻尿を防止することが可能である。この文冠果抽出物は、患者の脳機能を改善するために、遺尿を阻止する。
【0010】
本発明は、中枢神経系の機能を改善することによって、膀胱から送られる信号に対して患者をより鋭敏にするのに役立ち、かつ、深い眠りからも目覚めるようにさせる組成物を提供する。
【0011】
本発明は、膀胱をリラックスさせ、より多量の尿を貯留することを可能とする組成物を提供する。
【0012】
文冠果の抽出物は、加齢、ストレス、神経質、活動過多、不安定、反射亢進、および膀胱抑制不全によって引き起こされる排尿筋緊張を緩和するのに用いてもよい。別の実施態様では、文冠果抽出物は、アセチルコリンAchによって引き起こされる膀胱組織収縮を緩和させるために用いてもよい。
【0013】
文冠果抽出物は、尿容量を低下させる抗利尿ホルモン(ADH)を調整するためのアセチルコリンエステラーゼAChEの阻害剤として、また、抗炎症剤として用いてもよい。
【0014】
文冠果の種皮、葉、枝または幹、および、果柄、根および樹皮からの抽出物は組み合わせてもよく、本発明は、その調製法を開示する。
【0015】
本発明は、文冠果の種皮、葉または枝、幹および/または果柄、根、種殻および樹皮からの抽出物の組み合わせを含む組成物を提供する。この有機抽出物は、サポニン、サッカライド、タンパク、グリコシド、フラボノイドその他を含む。
【0016】
本発明は、文冠果の種皮、葉または枝、幹および/または果柄、根、種殻および樹皮から得られる未精製サポニン、およびその調製法を提供する。本発明は、文冠果の種皮、葉または枝、幹、果柄の双方またはその一方、根、種殻および樹皮から得られる未精製サポニンを含む組成物を提供する。この未精製サポニンは、サポニン、サッカライド、タンパクその他を含む。
【0017】
文冠果抽出物は、膀胱の成長の加速、深い睡眠の抑制、睡眠患者の感受性の増大、抗利尿ホルモン(ADH)およびその受容体の放出、分解、および摂取の修飾、副腎皮質刺激ホルモン(ACTH)およびその受容体の放出、分解、および摂取の修飾、5-ヒドロキシトリプタミンおよびその受容体の分泌、分解、および摂取の修飾、アセチルコリン(Ach)およびその受容体の放出、分解、および摂取の修飾、アドレナリン(AD)およびその受容体の放出、分解、および摂取の修飾、ドーパミン(DA)およびその受容体の放出、分解、および摂取の修飾、ノルエピネフィリン(NE)およびその受容体の放出、分解、および摂取の修飾、睡眠麻痺の防止、神経ペプチドおよびその受容体の放出、分解、および活性の修飾、ガン、例えば、乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンを含む−ただしこれらに限定されないが−ガンの治療、および、肺および膀胱機能の改善のために用いてもよい。
【0018】
本発明は、糖、テレペンまたはサポゲニン、および、炭素21および22の側鎖またはアンゲロイル基とを含み、それらが動作的に結合して形成する、生物学的活性を持つ化合物を提供する。ある実施態様では、化合物は、二つ以上の糖を含む。
【0019】
本発明は、下記の構造を含む化合物を提供する。すなわち、
【0020】
【化1】

【0021】
本発明は、前述の化合物の塩を提供する。
【0022】
本発明は、前述の化合物および適当な担体を含む組成物を提供する。
【0023】
本発明は、前述の化合物の有効量、および製薬学的に受容可能な担体とを含む製薬組成物を提供する。
【0024】
本発明は、Xanthoceras Sorbifoliaから化合物を単離する方法であって、Xanthoceras Sorbifolia粉末を、適当量の1種以上の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;有機抽出物を収集すること;有機抽出物を有機溶媒と適当時間環流して第二抽出物を形成すること;第二抽出物から有機溶媒を除去すること;および、第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物粉末を形成すること、の諸工程を含む方法を提供する。
【0025】
本発明は、バックボーンに3個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0026】
本発明は、バックボーンに2個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0027】
本発明は、バックボーンに4個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0028】
本発明は、バックボーンに3個の糖と、1個以上のバイアンゲロイル基を付着させたトリテルペノイドサポニンを提供する。
【0029】
本発明は、Xanthoceras Sorbifoliaから化合物を単離する方法であって、Xanthoceras Sorbifolia粉末を、適当量の1種以上の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;有機抽出物を収集すること;有機抽出物を環流して第二抽出物を形成すること;第二抽出物から有機溶媒を除去すること;第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物粉末を形成すること;抽出物粉末を画分して、抽出物粉末の1種以上の成分を獲得すること;抽出物粉末について1種以上の生物活性成分を特定すること;FPLCによって、抽出物粉末について1種以上の生物活性成分を精製し、生物活性成分について1種以上の分画を獲得すること;および、予備的HPLCによって化合物を単離すること、の諸工程を含む方法を提供する。
【0030】
本発明は、表2に示すようにHeteronuclear Multiple Quantum Correlation (HMQC)実験によるNMRデータを持つ化合物を提供する。
【0031】
本発明は、表3に示すようにHeteronuclear Multiple Quantum Correlation (HMQC)実験によるNMRデータを持つ化合物を提供する。
【課題を解決するための手段】
【0032】
本発明の上記およびその他の目的に従って、本発明の簡単な概要が提示される。下記の概要では、簡単化および省略がいくつか行われるかも知れないが、それらは、本発明のある局面を強調し、紹介することを意図してなされるものであって、その範囲を限定することを意図してなされるものではない。後続のセクションにおいて、好ましい例示の実施態様が、当業者に対し、本発明の概念を具体化し、使用することを可能とするほど十分詳細に記載される。
【0033】
本発明は、ガンに対して効果的な化合物であって、式C57H88O23を持ち、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンなる化学名を持つ化合物、および誘導体化合物の経路を提供する。本発明の化合物または組成物は、細胞の受容体または細胞成分、例えば、Gタンパク受容体、Fasタンパク、受容体チロシンキナーゼ、マイトゲン、マイトゲン受容体を調節する。この化合物は、Xanthoceras Sorbifliaと呼ばれる植物から単離することが可能であり、化学的に合成することも可能であり、あるいは、他の生物学的供給源から抽出することも可能である。
【0034】
経路における成分の活性に生じた異常な変化によって、細胞は、ガンを形成するための増殖を停止させられる。経路としては、TGFベータ-smad、FGF、TGFベータおよびTGFアルファa、ras-GTPアーゼ-MAPキナーゼ、jun-fos、Src-fyn、Jak-Jnk-STAT、BMP、Wnt、myc-細胞増殖等が挙げられる。ガン細胞の突然変異は、細胞死プログラムの不活性化を招き、細胞の無制限な分裂を可能とする。Xanthoceras Sorbifolia由来の化合物、組成物の双方またはその一方は、化合物および受容体を調整し、細胞死プログラムを再び活性化する。
(表24)



(表25)


(表26)



(表27)


(表28)



(表29)


(表30)



【発明を実施するための最良の形態】
【0035】
ヒトが辿る睡眠には、異なる多くの期間がある。そのような期間としては、徐波睡眠1(SWS1)、徐波睡眠2(SWS2)、徐波睡眠3(SWS3)、徐波睡眠4(SWS4)、および、急速眼球運動(REM)が挙げられる。SWS1およびSWS2は共に軽度の睡眠で、その場合目覚めさせることは比較的簡単である。軽度の睡眠は、通常、睡眠の後半部においてより高頻度である。SWS3およびSWS4は共に深い眠りで、その場合目覚めさせるのは難しい。深い睡眠は、睡眠の前半部においてより高頻度で、各期間は、後になるにつれて短くなる。REMは、ヒトがもっとも明瞭な夢を見る睡眠期間である。その波形パターンは、ヒトが目覚めている時のパターンと近似する。しかしながら、この睡眠状態のヒトを目覚めさせるのは難しい。通常人の睡眠サイクルは下記のように表示できる。すなわち、
SWS1, SWS2, SWS3, SWS4, SWS3, SWS2, REM, SWS1, SWS2, SWS3, SWS4, SWS3, SWS2, REM。(図4参照)。
【0036】
しかしながら、上記の配列は固定した順序ではない。睡眠状態は、SWS4からSWS1に移行することもあるし、あるいは、体が寝返りを打つために目覚めることもある。動きの後にSWS2状態へ移行することもある。二つのREMの間の間隔は約90分である。健常人では、SWS1は睡眠の約5%を占め、SWS2は睡眠の約50%を占め、SWS3は睡眠の約10%を占め、SWS4は睡眠の約10%を占め、REMは睡眠の約25%を占める。SWS1およびSWS2にあるヒトは簡単に目覚めさせることが可能なので、健常なヒトであれば、排尿のために目覚める機会は十分である。一方、ヒトの睡眠状態が大部分SWS4である場合、膀胱が一杯になった場合でも目覚める機会はより少ない。深い睡眠の障壁を突き破ることは困難である。このようにして遺尿症が起こる。本発明は、遺尿症を防止するための、文冠果を含む植物の抽出物に関する。
【0037】
文冠果は、むくろじ科の植物種である。その学名はXanthoceras sorbifolia Bungeである。文冠果(Wenguanguo)が一般的中国名であるが、その他Wenguannguo、Wenguanmu、文冠花(Wenguanhua)、およびXilacedengとも呼ばれる。この植物は最大高さ8メートルに成長することが可能である。その特徴は、奇数出羽状複葉、白色花による総状花序、厚い木質の種皮を備えた種殻である。文冠果は、中国の、遼寧、吉林、河北、山東、江蘇、河南、山西、陜西、甘粛、寧夏の各省、および内モンゴルで成育する。その種子は食用が可能であり、数世紀に渡って遺尿症を治療するための民間医療として使用されてきた。その枝や木部も民間医療として使用される。
【0038】
本発明は、文冠果から得られた抽出物、その使用、および調製法に関する追加の記載である。本発明は、患者の脳機能を改善することによって膀胱から送られる信号に対して患者をより鋭敏にし、深い眠りから目覚めさせることによって遺尿症を防止することを可能とする抽出物を提供する。膀胱が尿で満たされると、膀胱の平滑筋が引き延ばされ、これが信号を生み出し、信号は、骨盤神経、および脊髄の仙椎を経由して大脳皮質および小脳にまで達する。信号に対する大脳皮質および小脳の反応は、膀胱を持続的に収縮させるが、括約筋は弛緩させることである。かくして尿は排出される。睡眠時、膀胱が尿管を介して尿によって満たされると、排尿筋が伸長して膀胱を拡大させる。膀胱が尿を蓄え出すと、膀胱は、膀胱の伸長受容器を刺激し、受容器は、膀胱に溜められた尿の量に応じて連続的に信号を生成する。膀胱が尿で十分に満たされると、膀胱内は十分な圧を蓄積し、それによって脳は気付き、ヒトに排尿させるように目覚ませる。信号が、眠っているヒトを目覚めさせるほど十分に強くない場合、あるいは、大脳機能の障害によって閉鎖されている場合、遺尿症が起こる。この特定の植物抽出物は、大脳機能を改善することによって遺尿症を治療することが可能である。
【0039】
感覚性伸長受容器は、膀胱壁に配され、膀胱の充実度の評価を支援する。この情報は脊髄に、さらに脊髄視床経路を経由して中枢神経系に伝えられる。文冠果の抽出物は、中枢神経系をこの信号に対して鋭敏にする。
【0040】
膀胱がストレスおよび神経質のために収縮させられると、膀胱の容量は低下するので、頻尿が起こる。文冠果の抽出物は、さらに多量の尿を保存できるように膀胱を弛緩させることが可能である。
【0041】
膀胱の容量は加齢のために低下するが、この現象は、中年の人々にも起こることがある。このような人々は、低い尿量レベルで膀胱を空虚にしなければならないという焦燥感から早期に排尿筋を収縮させるという経験で悩んでいる。文冠果は、排尿筋をリラックスさせるのに役立つから、膀胱容量は増し、排尿頻度は減少する。
【0042】
排尿筋活動過多、排尿筋活動不安定、排尿筋反射亢進、または膀胱抑制不全を抱える患者では、膀胱が充満する前に、排尿筋が早期に強制的に収縮する。これによって、切迫的で、高頻度の排尿が起こる。文冠果抽出物は、患者の排尿筋をリラックスさせる。膀胱は安定し、十分な量の尿を溜めることが可能になる。
【0043】
膀胱の平滑筋には二つの機能がある。膀胱が弛緩した場合、尿が貯えられる。膀胱が収縮した場合、尿が排出される。感覚性伸長受容器は、膀胱壁中に配され膀胱の充実度を評価する。この情報は、脊髄に、さらに脊髄視床経路を経由して中枢神経系に伝えられる。脳は、排尿筋の弛緩が望まれる場合、抑制信号を生成する。しかしながら脳は、排尿筋収縮が望ましい場合には興奮信号を生成する。文冠果の抽出物は、アセチルコリンエステラーゼAchEを抑制することによって膀胱組織をリラックスさせることが可能である。この抑制作用は長期に渡って持続させることが可能である。文冠果抽出物は、アセチルコリンAchの欠乏によってもたらされる疾病を治療することが可能な、優れたAChE阻害剤である。
【0044】
抗利尿ホルモン(ADH)は、脳の下垂体後葉に貯えられている。このものは、体液の一次的調整因子である。ADHは、腎臓に作用して、体液全体を増したり、減らしたりする。これは、腎臓によって生成される尿量に作用する。ADHの放出は、浸透圧受容器と圧受容器の細胞によって調節される。浸透圧受容器は、視床下部の特殊細胞である。この細胞は、血中の粒子の濃度を感受する。粒子の濃度がより高くなると、より多くのADHが、脳下垂体によって放出される。これは、水の保持を刺激して体液を希釈する。濃度がより低くなると、より少量のADHが下垂体によって放出される。血液量および血圧を感受する圧受容器は、右心房、大静脈、および頚動脈という、心臓における特別領域に配される。心臓は、血液量または血圧が低い場合には、より多くのADHを放出するように、逆の場合はその逆を行うように、視床下部および下垂体に向けて信号を生成する。文冠果抽出物は、ADHの放出を調整し、これは、生体によって生産される尿量を下げることを可能とする。
【0045】
本発明は、文冠果の種皮または果柄から得られる混合抽出物、およびその調製法に関連する。種皮または果柄から抽出物を調製する方法は下記の工程を含む、すなわち、種皮または果柄から得られた文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;有機抽出物から有機溶媒を除去して水性抽出物を形成すること;および、該水性抽出物を乾燥し滅菌して、混合抽出物粉末を形成すること、の諸工程である。
【0046】
本発明は、文冠果の種皮または果柄から得られた混合抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0047】
本発明は、文冠果の葉から得られる混合抽出物、およびその調製法に関連する。葉から抽出物を調製する方法は下記の工程を含む。すなわち、葉から得られた文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;第二抽出物から有機溶媒を除去して水性抽出物とすること;水性抽出物をエーテルと水で抽出して第二水性抽出物を形成すること;第二水性抽出物をn-ブタノールで抽出して、n-ブタノール抽出物を形成すること;n-ブタノール抽出物からn-ブタノールを除去して第三水性抽出物を形成すること;第三水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0048】
本発明は、文冠果の葉から得られた有機抽出物を含む組成物を提供する。この有機抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0049】
本発明は、文冠果の枝または幹から得られる混合抽出物、およびその調製法に関連する。枝または幹から抽出物を調製する方法は下記の工程を含む。すなわち、枝または幹から得られた文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;第二抽出物から有機溶媒を除去して水性抽出物とすること;および、水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0050】
本発明は、文冠果の枝および幹から得られた有機抽出物を含む組成物を提供する。この有機抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0051】
本発明は、文冠果の核から得られる混合抽出物、およびその調製法に関連する。核から抽出物を調製する方法は下記の工程を含む。すなわち、核を押し潰すことによって油を除去して、核ケーキを形成すること;核ケーキを粉砕し、n-ヘキサンで抽出してn-ヘキサン抽出物を形成すること;n-ヘキサン抽出物からn-ヘキサンを除去し乾燥して核粉末を形成すること;核粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;第二抽出物から有機溶媒を除去して水性抽出物とすること;水性抽出物を乾燥し滅菌して、混合抽出物を形成すること、の諸工程である。
【0052】
本発明は、文冠果の核から得られた有機抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0053】
本発明は、文冠果の根から得られる混合抽出物、およびその調製法に関連する。根から抽出物を調製する方法は下記の工程を含む。すなわち、根から作製された文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;有機抽出物から有機溶媒を除去して水性抽出物を形成すること;および、水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0054】
本発明は、文冠果の根から得られた混合抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0055】
本発明は、文冠果の樹皮から得られる混合抽出物、およびその調製法に関連する。文冠果の樹皮から抽出物を調製する方法は下記の工程を含む。すなわち、樹皮から作製された文冠果粉末を有機溶媒(エタノール、メタノール、その他)によって抽出して、有機抽出物を形成すること;有機抽出物から有機溶媒を除去して水性抽出物を形成すること;および、水性抽出物を乾燥し滅菌して、混合抽出物粉を形成すること、の諸工程である。
【0056】
本発明は、文冠果の樹皮から得られた混合抽出物を含む組成物を提供する。この混合抽出物は、サポニン、サッカライド、タンパクその他を含む。
【0057】
本発明は、文冠果の種皮または果柄から得られる未精製サポニンを提供する。種皮または葉柄から未精製サポニンを調製する方法は下記の工程を含む、すなわち、種皮または果柄の文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0058】
混合抽出物はサポニンを含む。
本発明は、文冠果の葉から得られる未精製サポニンを提供する。葉から未精製サポニンを調製する方法は下記の工程を含む、すなわち、葉の文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノールをクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0059】
粗抽出物はサポニンを含む。
本発明は、文冠果の枝および幹から得られる未精製サポニンを提供する。枝または幹から未精製サポニンを調製する方法は下記の工程を含む、すなわち、枝または幹の文冠果粉末を、有機溶媒(エタノール、メタノール、その他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0060】
粗抽出物はサポニンを含む。
本発明は、文冠果の核から得られる未精製サポニンを提供する。核から未精製サポニンを調製する方法は下記の工程を含む、すなわち、核を押し潰すことによって油を除去して、核ケーキを形成すること;核ケーキを粉砕し、n-ヘキサンで抽出してn-ヘキサン抽出物を形成すること;n-ヘキサン抽出物からn-ヘキサンを除去し乾燥して核粉末を形成すること;核粉末を、有機溶媒(エタノール、メタノールその他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0061】
粗抽出物はサポニンを含む。
本発明は、文冠果の根から得られる未精製サポニンを提供する。根から未精製サポニンを調製する方法は下記の工程を含む、すなわち、根の文冠果粉末を、有機溶媒(エタノール、メタノールその他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0062】
粗抽出物はサポニンを含む。
本発明は、文冠果の樹皮から得られる未精製サポニンを提供する。樹皮から未精製サポニンを調製する方法は下記の工程を含む、すなわち、樹皮の文冠果粉末を、有機溶媒(エタノール、メタノールその他)によって、1:2の比率で4-5回、各回20-35時間抽出して、有機抽出物を形成すること;有機抽出物を収集し、80℃で2-3回環流して第二抽出物を形成すること;第二抽出物を水に溶解して水溶液を形成すること;水溶液をn-ブタノールによって抽出してn-ブタノール抽出物を形成すること;および、n-ブタノール抽出物をクロマトグラフィー画分し、未精製サポニンを形成すること、の諸工程である。
【0063】
粗抽出物はサポニンを含む。
本発明は、脳の加齢の防止、記憶力の改善、大脳機能の改善、および、遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病および、脳の機能不全によるその他の疾患の治療、および、関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療、およびインポテンツおよび早漏の治療のための方法を提供する。
【0064】
本発明は、被験体における5-ヒドロキシトリプタミン(5HT)の摂取を抑制する、文冠果抽出物を提供する。
【0065】
5-HTは、深い睡眠を持続し、増進する睡眠因子を調節および変調する。5HTの摂取を抑制すると、深い睡眠が減少する。SWS3およびSWS4において過大な時間を費やす人々は、眠りが深すぎるために膀胱が充満しても眠りから覚めることができない。これが、遺尿症が多くの場合SWS3およびSWS4期において起こる理由である。
【0066】
本発明は、被験体においてドーパミン活性を増大させ、それによって前記被験体の中枢神経系を鋭敏にする文冠果抽出物を提供する。
【0067】
本発明は、被験体において抗利尿ホルモン(ADH)の分泌を増進し、前記被験体において尿を低下させる文冠果抽出物を提供する。
【0068】
本発明は、被験体においてアセチルコリン(Ach)およびその受容体の放出、分解、および摂取を変調する文冠果抽出物を提供する。本発明の前記抽出物は、5HTによって惹起される深度睡眠を抑制し、REM睡眠を増す。
【0069】
本発明は、被験体において睡眠麻痺を防止する文冠果抽出物を提供する。
【0070】
本発明は、眠っている被験体に鋭敏性を与える文冠果抽出物を提供する。
【0071】
本発明は、膀胱および括約筋の成長を助ける抽出物を提供する。
【0072】
未熟な膀胱および括約筋は、排尿過程および活動を調節することができない。膀胱および括約筋の成長を加速することによって、この問題は克服されるので、遺尿は起こらない。
【0073】
本発明は、ガンの増殖を抑える文冠果抽出物を提供する。ガンとしては、膀胱ガン、子宮頸ガン、前立腺ガン、肺ガン、乳ガン、白血球ガン、結腸ガン、肝臓ガン、骨ガン、脳のガン、および卵巣ガンが挙げられるが、ただしこれらに限定されない。
【0074】
本発明は、糖、テレペンまたはサポゲニン、および、炭素21または22における側鎖またはアンゲロイル基を含む化合物を提供する。ある実施態様では、化合物は、2種以上の糖を含む。
【0075】
本発明は、下記の構造を持つ化合物を提供する。すなわち、
【0076】
【化2】

【0077】
これは、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エン、別名キサントb1という化合物である。
【0078】
別の実施態様では、化合物の構造は下記の通りである。
【0079】
【化3】

【0080】
【化4】

【0081】
【化5】

【0082】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0083】
【化6】

【0084】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0085】
本発明は、前述の化合物の塩を提供する。
【0086】
本発明は、前述の化合物、および適切な担体を含む組成物を提供する。
【0087】
本発明は、前述の化合物の有効量、および製薬学的に受容可能な担体とを含む製薬組成物を提供する。
【0088】
本発明は、前述の組成物を含む、抗卵巣ガン組成物を提供する。
【0089】
後述の実施例/実験には、下記の方法および材料が用いられた。
【0090】
細胞。 ヒトガン細胞系統を、米国基準菌株保存機関から入手した。HTB-9(膀胱)、HeLa-S3(子宮頸部)、DU145(前立腺)、H460(肺)、MCF-7(乳房)、K562(白血球)、HCT116(結腸)、HepG2(肝臓)、U2OS(骨)、T98G(脳)、およびOVCAR-3(卵巣)である。細胞は、10%仔牛血清、グルタミン、および抗生物質を添加した培養液(HeLa-S3、DU145、MCF-7、Hep-G2、およびT98Gは、MEN(Earlの塩)において;HTB-9、H460、K562、OVCAR-3は、RPMI-1640において;HCT-116、U2O2は、McCoy-5Aにおいて)で、5%CO2含有加湿インキュベータにて37℃で育成した。
【0091】
MTTアッセイ。 MTTアッセイの手順は、些少の修正を加えたのみで(Carmichael等1987)の記載する方法に従った。薬剤投与前、細胞を、96ウェルプレートに、10,000個/ウェル(HTB-9, HeLa, H460, HCT116, T98G, OVCAR-3)、15,000個/ウェル(DU145, MCF-7, HepG2, U2OS)、または、40,000個/ウェル(K562)の濃度で撒き24時間インキュベートした。次に、細胞を、薬剤に48時間(HepG2、U2OSには72時間、MCF-7には96時間)暴露した。薬剤処置後、MTT(0.5mg/ml)を培養体に加え1時間インキュベートした。フォルマザン(生細胞によるテトラゾリウムの還元によって生ずる産物)の形成は、DMSOに溶解し、490nmにおけるO.D.を、ELISAリーダーによって測定した。薬剤処置前の細胞のMTTレベルも測定した(T0)。%細胞増殖(%G)を、下記のように計算した。すなわち、
【0092】
(数1)
%G = (TD-T0/TC-T0)x100
式中、TCまたはTDは、コントロール細胞または薬剤処置細胞のO.D.読み取り値を表す。
【0093】
T0>TDの場合、コントロールの%で表される細胞傷害性(LC)を、下記のように計算した。すなわち、
【0094】
(数2)
%LC = (TD-T0/T0)x100
【0095】
画分および分析。 0.5 gの抽出物粉末を、H2O(200 ml)とN-ブタノール(200 ml)の間で分配溶解した。ブタノール分画を凍結乾燥し、この残渣の3分の2を、あらかじめ、MeCN、次にMeCN:H2O、次にH2O(それぞれ5 ml)で湿らせた、前もって充填させた5 g RPC18ISTカラムに投入した。カラムを、H2OからMeCNに渡って段階的に展開した。分画をシリカゲルTLCで調べた。H2O:MeCN(80:20および50:50)で溶出し、Rf0.11付近にTLCスポットを示した第4、第5、および第6分画はサポニンを含んでいた。
【0096】
これらの分画のH NMRスペクトラム(CD3OD溶液、300MHz)は、グリコシドの典型的領域である3-4 ppm領域、および、サポニンのアグリコン部分に典型的な0.82-2 ppm領域に信号を示した。
【0097】
分画4のH NMRスペクトラムは、領域5.8-7.8 ppmにも信号を含んでいた。これは、クマリンおよびフラボノイドによるものと考えられた。分画5と6のスペクトラムは、ほとんど近似していた。分画4、5、6はサポニンを含んでいた。外見およびNMRスペクトラムは、サポニンであることを示していた。
【0098】
TLC過程。 RP C18 ISTカラムから得られる分画を標準濃度(10 mg/ml)で調製し、各分画を、シリカゲルTLCプレート(Merck Keiselgel 60 F254)にスポットした。下記の混合物(CHCl3:MeOH:H2O-35:65:40)の基底層を移動相として展開した。分離されたスポットは、UV光、および酸化バニリン浸潤(2 gバニリンの、100 ml EtOHプラスH2SO4溶液、1 ml)を用いて可視化した。
【0099】
本発明は、Xanthoceras Sorbifoliaから単離された化合物同士が相互作用を持つ経路を提供する。ある実施態様では、化合物は、ガンに対して効果的な化合物であって、式C57H88O23を持ち、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンなる化学名を持つ化合物、および誘導体化合物を持つ。これらの化合物は、細胞の受容体、または成分を調節する。この化合物は、Xanthoceras Sorbifliaと呼ばれる植物から単離することが可能であり、化学的に合成することも可能である。
【0100】
その化合物は、
【0101】
【化7】

3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンである。
【0102】
【化8】

【0103】
【化9】

【0104】
【化10】

【0105】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0106】
【化11】

【0107】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0108】
細胞増殖を監視する、多くの成分および経路がある。
【0109】
Xanthoceras Sorbifolia化合物、またはその誘導体は、Wnt(ウィングレス型MMTV統合部位ファミリーメンバー)シグナル伝達経路において活動する。Wntシグナル伝達経路は、進化的に保存されており、胚発生において多くの事象を調節する。この経路は、細胞形態、増殖、運動性を始め、細胞のアポトーシスも調節する。この経路はまた、腫瘍発生においても重要な役割を果たす。Wnt経路はまた、ヒトの、いくつかの異なるタイプのガンにおいて不適切に活性化されることが観察されている。
【0110】
核では、Wntシグナル用の標的遺伝子は、通常は、遺伝子調整タンパクの抑制性複合体、例えば、遺伝子調整タンパクLEF-I/TCFに結合するGrouchoコリプレッサータンパクによって休止状態に置かれる。Wntシグナルが無いと、若干のβ-カルテニンが、カドヘリンタンパクの細胞質尾部に結合し、APC-axin-GSK-3βによって結合された細胞質性β-カルテニンが少しでもあればそれは、その普遍化、およびプロテアソームにおけるその分解を誘発する。その結果は、β-カルテニンの細胞内量の減少となる。一方、Wntの、Frizzled(7個の膜貫通受容体)、およびLRP(低密度脂質タンパク受容体)に対する結合が、ある機構によってDishevelled(細胞質シグナル伝達タンパク)を活性化すると、これは、カゼインキナーゼIとカゼインキナーゼIIを必要とする、ある機構によって、分解複合体におけるGSK-β3の不活性化をもたらす。β-カテニン-axin-腺腫瘍結腸ポリープ症(APC)-グリコーゲンシンターゼキナーゼ(GSK)-3βから成る複数タンパク複合体は、プロテアソームによる分解のためにリン酸化によってβ-カテニンを標的するが、このタンパク複合体の活性は、次に、Dsh/Dvl(Dishevelled, dsh相同体1)によって抑制される。次に、これは、β-カテニンのプライマー活性を抑制し、間接的にβ-カテニンのGSK-3βのリン酸化を阻止する。Wntによって刺激されると、Dvlは、GSK-3結合タンパクGBPを招集して、β-カテニン-axin-腺腫瘍結腸ポリープ症(APC)-グリコーゲンシンターゼキナーゼ(GSK)-3βから成る複数タンパク複合体に含める。次に、GBPは、axinからGSK-βを定量し、このようにして、β-カテニンのリン酸化が抑制される。次に、axinが、LRPによって細胞膜において壊死形成される。上記全ての結果は、細胞質β-カテニンの蓄積である。核においては、β-カテニンは、LEF-I/TCFに結合し、Grouchoを押し退け、Wnt標的遺伝子の転写を刺激する共同活性因子として活動する。
【0111】
Xanthoceras Sorbifolia組成物は、Wnt経路、またはその受容体に関連する成分を調節し、そうすることによってガン細胞の増殖を停止させる。
【0112】
本化合物またはその誘導体は、マイトゲン、Ras、およびMAP(微小管結合タンパク)キナーゼ経路において活動する。マイトゲンが細胞表面の受容体に結合すると、RasおよびMAPキナーゼカスケード反応が導かれる。この経路の一つの作用は、遺伝子調節タンパクMycの産生増加である。Mycは、いくつかの遺伝子、例えば、サイクリンD、およびSCFユビキチンリガーゼのサブユニットを含む遺伝子の転写を増大させる。その結果得られる、G1-CdkおよびG1/S-Cdk活性の増加は、Rbリン酸化、および、遺伝子調節タンパクE2Fの活性化を増進し、S期への進入をもたらす。S期において、G1-Cdk活性は、Rbリン酸化を誘発し、これは次にRbを不活性化し、E2Fを遊離し、S-期遺伝子、例えば、G1/S-サイクリン(サイクリンE)およびS-サイクリン(サイクリンA)の遺伝子の転写を活性化する。その結果、G1/S-CdkおよびS-Cdkが出現するが、これは、Rbリン酸化を増し、正のフィードバックループを形成し、かつ、E2Fが後戻りに作用して、自身の遺伝子の転写を刺激し、さらに別の正フィードバックループを形成する。Mycはまた、E2F遺伝子の転写を刺激することによってE2F活性を直接増大させる。その結果、S期へ進入する遺伝子の転写が増大する。しかしながら、この経路の活性が過度に高まると、ガン細胞増殖の原因となる。
【0113】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、Ras-MAPカスケード反応を、その経路の活性が過度にならないように調節する。
【0114】
本化合物またはその誘導体は、Ras-依存性またはMyc経路において活動する。時として、Rasのアミノ酸の変異によってタンパクが恒久的に活動過多となり、マイトゲンの刺激無しに、Ras依存性信号経路を過度に刺激する。同様に、Mycの活動過多を引き起こす変異は、過剰な細胞増殖を促進し、これが、ガンの発達を増進する。
【0115】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、Ras依存性またはMyc経路の成分を、その経路の活性が過度にならないように調節する。
【0116】
本化合物またはその誘導体は、異常な細胞チェックポイント機構を再び活性化する。細胞内部には、異常な分裂促進刺激を検出し、異常に活性の高い細胞をアポトーシスに向かわせるチェックポイント機構が存在する。しかしながら、この機構は、ガン細胞では、チェックポイント反応の本質部分をコードする遺伝子に変異を生じているために活動していない。チェックポイント機構に突然変異が起こると、ガン細胞は無制限に成長し、分裂する。
【0117】
植物Xanthoceras Sorbifoliaから得られる化合物または誘導体は、チェックポイント機構を再び活性化してガン細胞の成長を止める。
【0118】
本化合物またはその誘導体は、細胞外増殖シグナル伝達経路に作用する。細胞成長を刺激する細胞外増殖因子は、細胞表面の受容体に結合し、細胞内シグナル伝達経路を活性化する。これは、酵素PI-3キナーゼを活性化し、このキナーゼは、少なくとも一部はeif4eの活性化、およびs6キナーゼのリン酸化を通じてタンパク合成を促進し、mRNA転写の増加、次に細胞成長の刺激をもたらす。
【0119】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、細胞外成長に関連する成分または受容体を調節する。本化合物または組成物は、卵巣ガン細胞の受容体に結合しガン細胞の成長を止める。
【0120】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、RasおよびMAPキナーゼに関連する成分または受容体を調節し、これは、卵巣ガン細胞の成長を止める。
【0121】
本化合物またはその誘導体は、細胞内機構に作用する。細胞分裂も、細胞増殖を制限する細胞内機構によって調節される。正常な細胞では、Mycタンパクは、核において、細胞増殖のシグナルとして活動する。大量のMycは、細胞を過度に増殖させ、腫瘍を形成させる。
【0122】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、Myc細胞増殖の成分または受容体を、腫瘍細胞の分裂を止めるように調節する。
【0123】
本化合物またはその誘導体は、TGF-アルファ・シグナル伝達経路に作用する。TGF-アルファは、ケラチノサイト、マクロファージ、肝細胞、および血小板によって生産される。その合成は、ウィルスの感染によって刺激される。TGF-アルファは、げっ歯類およびニワトリの、未成熟造血前駆細胞、例えば、BFU-Eについて、分化を招くことなくそれらの長期の増殖を誘発する。TGF-アルファはまた、BFU-E細胞の、最終的な赤血球への分化を誘発する。TGF-アルファは、培養内皮細胞の増殖を刺激する。TGF-アルファは、腫瘍組織における血管分布において重要な役割を演じる。
【0124】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、TGF-アルファの成分または受容体を、卵巣ガンおよび膀胱ガン細胞の成長を抑えるように調節する。
【0125】
本化合物またはその誘導体は、TGF-ベータ・シグナル伝達経路に作用する。TGF-ベータは、細胞の成長および増殖を調節し、多くの細胞タイプの成長を阻止する。二種類のTGF-ベータ受容体、タイプ1とタイプ2がある。これらは、転写調節因子のSMAD(二つの最初に特定されたタンパク、線虫ではSma、ショウジョウバエではMadにちなんでつけられたタンパク名)ファミリーを通じてシグナル伝達するセリン-トレオニンキナーゼである。TGF-ベータ経路およびSMADの変異はヒトのガンに関連する。
【0126】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、TGF-ベータの成分または受容体を、卵巣ガンおよび膀胱ガン細胞の成長を抑えるように調節する。
【0127】
本化合物またはその誘導体は、DNAウィルスによって損傷された細胞機能を再び活性化する。DNA腫瘍ウィルスは、細胞サイクル調節Rbタンパクおよびp53タンパクを阻害することによってガンを引き起こす。p53遺伝子の突然変異によって、ガン細胞は、DNAが損傷されているにも拘わらず、生き延び増殖することが可能になる。パピローマウィルスは、E6およびE7タンパクを用いて、それぞれ、p53およびRbの配列を並べる。この活動は、突然変異細胞を活性化し、これらの変異細胞が生存し、次に分裂し、集積することを可能にする。損傷細胞の集積はガンに至ることが可能である。
【0128】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、E6およびE7タンパクを調節し、異常な細胞の分裂を阻止するRbおよびp53タンパクを放出する。化合物または組成物は、該タンパクを調節または該タンパクと反応して、ガン細胞を死滅させる。
【0129】
本化合物またはその誘導体は、p53シグナル伝達経路に作用する。p53は、多細胞生物が、DNA損傷や、その他ストレス性の細胞事象を無事に修復することを助け、危険となる可能性のある状況下では細胞増殖を止める。ガン細胞は、大量の変異p53タンパクを含む傾向がある。これは、これらの細胞の経験した遺伝的偶発事件、または、不適切な環境における成長ストレスが、正常にp53タンパクを活性化するシグナルを生成したことを示唆する。従って、p53活性化の消失は、ガンと関連して極めて危険である可能性がある。なぜなら、その場合、突然変異細胞は、細胞周期を連続的に続けることが可能となるからである。さらに、それによって、細胞はアポトーシスを免れることが可能となる。従って、DNAが損傷された場合、ある細胞は死ぬが、生き残る細胞は、その損傷を修復するために留まることなく、分裂を続ける。これは、細胞の死を招くこともあるが、あるいは、細胞は生き延びて、ゲノムを崩壊させたままで増殖することがあり得、これは、例えば、遺伝子増幅によって、腫瘍抑制遺伝子の欠損、およびガン遺伝子の活性化の両方をもたらす可能性がある。遺伝子増幅によって、細胞は、治療薬剤に対する耐性を養う可能性がある。
【0130】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、p53経路の成分および受容体を、ガン細胞の分裂を止めるように調節する。
【0131】
本化合物またはその誘導体は、細胞の自殺シグナル伝達経路に作用する。核を含む全ての細胞は、細胞を破壊する前にシグナルを待っている、各種不活性プロカスパーゼを含んでいる。各自殺プロテアーゼは、プロカスパーゼと呼ばれる不活性な酵素前駆体として作製される。この前駆体は、通常、カスパーゼファミリーの別のメンバーによるタンパク分解性分断によって活性化される。分断された断片の二つが合わさって、カスパーゼの活性部分を形成すると、この活性酵素が、上記二つの部分2個から成るテトラマーとなると考えられる。各活性化カスパーゼ分子は、多くのプロカスパーゼ分子を分断することができるので、これが順々により多くの分子を活性化する。一連の反応すなわちカスケードを通じて、この活動は、多数のプロカスケード分子の爆発的活動をもたらす。次に、この活性化プロカスパーゼの内のあるものは、細胞における決定的に重要なタンパク、例えば、特定の細胞質タンパクおよび核ラミンを含む重要タンパクの内のいくつかを分断し、細胞の調節的死をもたらす。
【0132】
細胞外部において斃死受容体を活性化することも、不活性プロカスパーゼを起動することができる。例えば、キラーリンパ球は、標的細胞の表面にFasタンパクを生産することによってアポトーシスを起こすことが可能である。次に、これらのFasタンパククラスターは、細胞内のアダプタータンパクを招集し、これが、プロカスパーゼ-8分子を結合し、凝集する。次に、これらの分子は互いに分断して、活性化を促す。次に、活性化されたカスパーゼ-8分子は、下流のプロカスパーゼを活性化してアポトーシスを誘発する。
【0133】
しかしながら、ガン細胞では、細胞を破壊するためのシグナルが、遺伝子突然変異のために阻止される。このことは、ガン細胞が分裂を続け、そのために腫瘍の原因となることを意味する。
【0134】
植物Xanthoceras Sorbifoliaから得られる化合物または組成物は、自殺シグナルの阻止を解き、ガン細胞の自己破滅を可能とする。
【0135】
本発明は、腫瘍細胞の増殖を抑制する方法であって、R1、R2、R3、R4が短い脂肪族鎖であり、R5がオキシル基を含む化合物であって、その化合物の、前記腫瘍細胞の増殖を抑制するのに有効な量、および、製薬学的に受容可能な担体に対して接触させることを含む方法を提供する。
【0136】
本発明は、R1=R2=R3=R4=CH3、およびR5=OHである、前記方法を提供する。
【0137】
【化12】

【0138】
【化13】

【0139】
【化14】

【0140】
【化15】

【0141】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0142】
【化16】

【0143】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0144】
本発明は、腫瘍細胞の増殖を抑制する方法であって、糖;テレペンまたはサポゲニン;および、炭素21および22の側鎖またはアンゲロイル基とを含み、それらが動作的に結合して形成する化合物のある量、および製薬学的に受容可能な担体に対して接触させることを含む方法を提供する。
【0145】
本発明は、被験体において腫瘍細胞増殖を抑制する方法であって、R1、R2、R3、R4が短い脂肪族鎖であり、R5がオキシル基を含む化合物であって、その化合物の、前記腫瘍細胞の増殖を抑制するのに有効な量、および製薬学的に受容可能な担体を、該被験体に投与することを含む方法を提供する。
【0146】
本発明は、R1=R2=R3=R4=CH3、およびR5はオキシル結合を含むことを特徴とする請求項27方法を提供する。
【0147】
【化17】

【0148】
【化18】

【0149】
【化19】

【0150】
【化20】

【0151】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0152】
【化21】

【0153】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0154】
本発明は、被験体において腫瘍細胞の増殖を抑制する方法であって、糖;テレペンまたはサポゲニン;炭素21および22の側鎖またはアンゲロイル基とを含み、それらが動作的に結合して形成する化合物、および製薬学的に受容可能な担体を、該被験体に投与することを含む方法を提供する。
【0155】
本発明は、下記の実施例を参照することによってさらによく理解されよう。しかしながら、当業者であれば、そこで論じられる特定の方法および結果は、単に本発明を説明するものでしかなく、本発明は、頭書の特許請求項にさらに十分に記載されることが簡単に了解されるであろう。
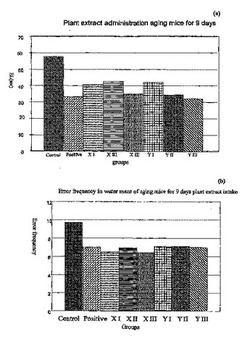
【実施例1】
【0156】
正常高齢マウスにおける学習能力の改善に及ぼすXおよびYの作用。XおよびYは、文冠果の異なる抽出物である。
16月齢、体重35-55gの高齢雄性マウスを、11cm水深の水(25-26℃)で満たしたSMG-2で訓練した。SMG-2には、スタートポイント、4個のブラインド終端、脱出プラットフォーム、およびそれぞれのルートがある。マウスは、脱出プラットフォームを見つけ出すように訓練され、水からの脱出潜時、および過誤頻度を記録した。3回の訓練後、2分で水から脱出したマウスを試験に選んだ。この選択された高齢マウスを、11匹から成る9グループに分割した。すなわち、1)コントロール(対照):正常生食液(NS)を服用;2)陽性コントロール(陽性対照):Xi-en-kaiを0.9 g/kg服用;3)X-Iグループ:100 mg/kgを服用;4)X-IIグループ:200 mg/kgを服用;5)X-IIIグループ:400 mg/kgを服用;6)Y-Iグループ:125 mg/kgを服用;7)Y-IIグループ:250 mg/kgを服用;8)Y-IIIグループ:500 mg/kgを服用;および9)モデルグループである。
【0157】
薬剤は全て、水迷路試験の3、6、および9日前に、経口投与20 ml/kgによって与えた。水から脱出するまでの潜時(EL)および過誤頻度を記録した。データは全てt-検定によって分析した。
【0158】
1.1. XおよびYの投与3日後、500 mg/kgのYを服用したグループ9マウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.05)。他の用量による処置も改善を示したが、有意なものではなかった。
【0159】
(表1.1.)高齢マウスに3日間投与した場合の植物抽出物の学習に及ぼす作
用

【0160】
1.2. XおよびYの投与6日後、全ての用量投与を受けたマウスについて水迷路における過誤頻度が有意に減少した(P<0.05、P<0.01)。500 mg/kgのYを服用したグループ9マウスによる、水迷路からの脱出潜時は、コントロールに比べて有意に減少した(P<0.05)。
【0161】
(表1.2.)高齢マウスに6日間投与した場合の植物抽出物の学習に及ぼす作
用

【0162】
1.3. XおよびYの投与9日後、全ての用量投与を受けたマウスについて水迷路における過誤頻度が有意に減少した(P<0.05、P<0.01)。500 mg/kgのYを服用したグループ9マウスによる、水迷路からの脱出潜時は、コントロールに比べて有意に減少した(P<0.05)。
【0163】
(表1.3.)高齢マウスに9日間投与した場合の植物抽出物の学習に及ぼす作用

【0164】
この結果は、抽出物XおよびYは、試験高齢マウスの学習および記憶において陽性作用を持つことを示す。さらに、効果は、XおよびY抽出物を服用する期間が長引くと増大する。
【実施例2】
【0165】
水迷路においてペントバルビタールナトリウムによって誘発された障害に対するXおよびYの作用
2.1. 抽出物XおよびYの投与の10日後、投与マウスに、ペントバルビタールナトリウムを注入して記憶喪失を誘発した。
ペントバルビタールナトリウム投与1日後、水迷路学習の結果は、100 mg/kgのX、125 mg, 250 mg/kg、および500 mg/kgのYを服用したマウスによって、終端プラットフォーム探索のために費やされる時間は有意に減少することを示した(P<0.05)。
500 mg/kgのYを服用したマウスが水迷路で冒した過誤頻度は有意に減少した(P<0.05)。
【0166】
(表2.1.)ペントバルビタール注入1日目の水迷路学習結果

【0167】
2.2. ペントバルビタールナトリウムの注入2日後、XおよびYを服用した全てのグループのマウスによって、水迷路における終端プラットフォームの探索に費される時間は有意に減少した(P<0.05)。
【0168】
(表2.2.)ペントバルビツール注入第2日目における水迷路学習結果

【0169】
2.3. ペントバルビツールナトリウムの注入3日後、XおよびYを服用した全てのグループのマウスによって、水迷路における終端プラットフォームの探索に費される時間、および、過誤頻度は有意に減少した(P<0.05)。水迷路において、250 mg/kgおよび500 mg/kgのYを服用したマウスによって冒される過誤頻度は有意に減少した(P<0.05)。
【0170】
(表2.3.)ペントバルビツール注入第3日目における水迷路学習結果

【0171】
この結果は、抽出物XおよびYは、ペントバルビツールナトリウムによって誘発された空間学習および記憶障害を改善することにおいて明瞭な、陽性作用を持つことを示す。
【実施例3】
【0172】
受動回避においてスコポラミン臭化水素によって誘発される障害に対するXおよびYの改善作用
体重16-20グラムのICRマウスをSTT-2で訓練した。マウスをプラットフォームの上に置き、SDLを記録した。マウスが足を下ろし、四足全てが金網に置かれた場合、直後に電気ショック(36 V)が与えられ、ELが記録された。SDLおよびELが2-60秒以内のマウスを試験に選んだ。選ばれた高齢マウスを9グループに分けた。各グループには5匹の雄性および5匹の雌性マウスが居た。薬剤は全て、プラットフォーム訓練前3、6、9日前に経口投与20 ml/kgによって投与した。5分間におけるSDL、EL、および過誤頻度(与えられた電気ショックの回数)を記録した。投与10日後、全てのマウスグループに対してスコポラミン臭化水素3 mg/kgを注入した。スコポラミン臭化水素の投与30分後、マウスをプラットフォームで訓練し、翌日も訓練を繰り返した。訓練時のマウスの成績を記録した。SDL、EL、および過誤頻度を記録した。データは全てt-検定によって分析した。
【0173】
3.1 XおよびY投与の9日後におけるマウスの受動回避の成績は、XおよびYを服用したマウスは、その全用量において、EL、および過誤頻度が低下することを示した。
【0174】
(表3.1.)投与9日後における高齢マウスの受動回避

【0175】
3.2. XおよびYの投与10日後、試験マウスにスコポラミンを投与した。高齢マウスの受動回避の成績は、Xの400 mg/kg、および、Yの250 mg/kgおよび500 mg/kgを服用したマウスが受動回避において冒した過誤頻度は有意に低下したことを示した(P<0.05、P<0.01)。
【0176】
(表3.2.)スコポラミンによって誘発された障害に対する植物抽出物XおよびYの
改善作用

【0177】
スコポラミンで障害を受けたマウスにおける受動回避試験の結果は、XおよびYを服用したマウスの冒した過誤頻度は、全ての用量において有意に低下した(P<0.05)ことを示した。Yの250 mg/kgを服用したマウスではSDLが有意に延長した。
【0178】
この結果は、抽出物XおよびYは、スコポラミンによって誘発された学習および記憶障害を改善することにおいて明瞭な、陽性作用を持つことを示す。
【0179】
(表3.3.)スコポラミンによって誘発された障害に対する植物抽出物XおよびYの
改善作用

【0180】
この結果は、抽出物XおよびYは、スコポラミン臭化水素によって誘発された学習および記憶障害を改善することにおいて明瞭な、陽性作用を持つことを示す。
【実施例4】
【0181】
水迷路においてHaCO2によって誘発された障害に対するXおよびYの改善作用。
体重16-19gのICR雄性マウスを、11cm水深の水(25-26℃)で満たしたSMG-2で訓練した。SMG-2には、スタートポイント、4個のブラインド終端、脱出プラットフォーム、およびそれぞれのルートがある。マウスは、脱出プラットフォームを見つけ出すように訓練され、水からの脱出潜時、および過誤頻度を記録した。訓練後、1分以内で水から脱出したマウスを試験に選んだ。この選択された高齢マウスを、11匹から成る9グループに分割した。薬剤は全て、水迷路試験の3、6、9日前に経口投与20 ml/kgによって投与した。投与10日後、全てのマウスグループに対してHaCO2、120 mg/kgを注入した。HaCO2の投与24時間後、マウスを、脱出プラットフォームを見つけるように訓練し、水からの脱出潜時、2分内に冒した過誤頻度を記録した。ペントバルビツールナトリウムの投与を3日間続け、水迷路試験におけるマウスの成績を記録した。水からの脱出潜時(EL)、および過誤頻度を記録した。データは全てt-検定によって分析した。
【0182】
4.1. XおよびYの投与3日後、XおよびYを服用したマウスによる、水迷路からの脱出潜時および誤差頻度は減少したが、有意ではなかった。
【0183】
(表4.1.)XおよびY投与3日後、水迷路におけるマウスの学習に対する作用。

【0184】
4.2. XおよびYの投与6日後、400 mg/kgのXおよび500 mg/kgのYを服用したマウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.01)。
【0185】
(表4.2.)XおよびY投与6日後、水迷路におけるマウスの学習に対する作用。

【0186】
4.3. XおよびYの投与9日後、250 mg/kgのX、および250 mg/kgおよび500 mg/kgのYを服用したマウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.05)。
【0187】
(表4.3.)XおよびY投与9日後、水迷路におけるマウスの学習に対する作用。

【0188】
4.4. XおよびYの投与10日後、250 mg/kgおよび500 mg/kgのYを服用したマウスによる、水迷路の過誤頻度が、また、500 mg/kgのYを服用したマウスによる、水迷路からの脱出潜時が、コントロールに比べて有意に減少した(P<0.05、P<0.01)。
【0189】
(表4.4.)XおよびY投与10日後、水迷路におけるマウスの学習に対する作用。

【0190】
この結果は、抽出物XおよびYは、水迷路試験においてマウスの学習および記憶の改善において明瞭な、陽性作用を持つことを示す。さらに、効果は、XおよびY抽出物を服用する期間が長引くと増大した。
【0191】
4.5. XおよびYを10日間服用した後に、マウスに、試験後NaNO2を投与した。高齢マウスの水迷路学習において、NaNO2によって誘発された障害に対する、XおよびYによる処置の結果を見てみると、100 mg/kgおよび200 mg/kgのX、Yの場合は全用量を服用したマウスにおける過誤頻度は、コントロールに比べて有意に減少した(P<0.05)(表4.5)。これは、抽出物XおよびYは、NaNO2による障害の防止において明瞭な、陽性作用を持つことを示す。
【0192】
(表4.5.)NaNO2によって誘発された障害に対する抽出物XおよびYの防止作用

【実施例5】
【0193】
マウスの排尿に対する文冠果(Xanthoceras sorbifolia)抽出物の作用。
XおよびYは、文冠果の異なる抽出物である。Xは、ある一種の文冠果(Xanthoceras sorbifolia)の抽出物であり、Yは、ある一種の文冠果(Xanthoceras sorbifolia)の抽出物である。
【0194】
実験法
体重18-22グラムの、112匹の雄性ICRマウスを、14匹から成る8グループに分割した。1はコントロールで、正常な生食液(NS)を服用;2はDCTグループでDCT 33.4 mg/kgを服用;3はX-Iグループで100 mg/kgを服用;4はX-IIグループで200 mg/kgを服用;5はX-IIIグループで400 mg/kgを服用;6はY-Iグループで125 mg/kgを服用;7はY-IIグループで250 mg/kgを服用;および、8はY-IIIグループで500 mg/kgを服用した。
【0195】
薬剤は全て経口投与20 mg/kg、1日1回3日間とした。最終投与後、マウスをろ紙の上に載せた。このろ紙は、500 mlビーカーの底に敷いた。尿量を、30、60、120、180、240、300、および360分時において、電子分析秤によってろ紙の重量を測ることによって計測した。データは全てt-検定によって分析した。
【0196】
結果
XおよびYの投与3日後、400 mg/kgのXを服用したマウスによって30分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.01)減少した。600 mg/kgのYを服用したマウスによって60分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.01)減少した。
【0197】
200 mg/kgのX、125 mg/kgおよび500 mg/kgのYを服用したマウスによって180分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.01)減少した。(表5.1)。
【0198】
(表5.1.)XおよびY投与の3日後における抽出物XおよびYのマウスの尿量に対す
る作用

【0199】
(表5.1.)XおよびY投与の3日後における抽出物XおよびYのマウスの尿量に対す
る作用(続き)

【0200】
この結果は、抽出物XおよびYは、XとYの投与3日後でも尿量を調節することが可能であることを示した。
【0201】
XおよびYの投与5日後、400 mg/kgのX、および500 mg/kgのYを服用したマウスによって30分時に排出された尿量は、正常生食液を服用したマウスと比べて減少したが、有意ではなかった。400 mg/kgのX、および全用量のYを服用したマウスによって4時間時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.05、P<0.01)減少した(表5.2)。
【0202】
(表5.2.)XおよびY投与の5日後における抽出物XおよびYのマウスの尿量に対す
る作用

【0203】
(表5.2.) XおよびY投与の5日後における抽出物XおよびYのマウスの尿量に対
する作用(続き)

【0204】
この結果は、抽出物XおよびYは、XとYの投与5日後でも尿量を調節することが可能であることを示した。
【0205】
XおよびYの投与7日後、尿量を、30、60、120、180、240、300、および360分時に測定した。200、400 mg/kgのX、および、250、500 mg/kgのYを服用したマウスによって30分時に排出された尿量は、正常生食液を服用したマウスと比べると、有意に減少したが(P<0.05)が、240分では増加した(表5.3)。
【0206】
(表5.3.)XおよびY投与の7日後における抽出物XおよびYのマウスの尿量に対
する作用

【0207】
(表5.3.)XおよびY投与の7日後における抽出物XおよびYのマウスの尿量に対す
る作用(続き)

【0208】
この結果は、抽出物XおよびYは、XとYの投与7日後でも尿量を調節することが可能であることを示した。
【0209】
XおよびYの投与10日後、200、400 mg/kgのX、および250、500 mg/kgのYを服用したマウスによって120分時に排出された尿量は、正常生食液を服用したマウスと比べて有意に(P<0.05)減少した(図3)。
【0210】
(表5.4.)XおよびY投与の10日後における抽出物XおよびYのマウスの尿量に対す
る作用

【0211】
(表5.4.)XおよびY投与の10日後における抽出物XおよびYのマウスの尿量に対す
る作用(続き)

【0212】
この結果は、抽出物XおよびYは、XとYの投与3-10日後でも尿量を調節することが可能であることを示した。
【0213】
これまで、本発明を、特に好ましい実施態様を参照しながら詳細に説明してきたわけであるが、本発明は、他の異なる実施態様も可能であること、その細部は、様々な明白な局面において修正が可能であることを理解しなければならない。当業者には直ちに明白なように、本発明の精神や範囲を逸脱することなく、変更および修正を実行することが可能である。従って、前述の開示、説明、および図面は、例示目的のために為されるものであって、いかなる点でも本発明を限定するものではない。本発明はただ特許請求項によってのみ定義される。
【実施例6】
【0214】
ハーブ抽出
(a)Xanthoceras Sorbifoliaの種皮、枝、幹、葉、核、根、または樹皮の粉末を、有機溶媒によって、1:2の比率で、4-5回、各回20-35時間抽出して、有機抽出物を形成すること;(b)有機抽出物を収集すること;(c)有機抽出物を80℃において2-3回環流して第2抽出物を形成すること;(d)第2抽出物から有機溶媒を除去すること;および(e)抽出物を乾燥し、滅菌してXanthoceras Sorbifolia抽出物粉末を形成すること。
【実施例7】
【0215】
HPLCクロマトグラフィーによるXanthoceras Sorbifolia抽出成分の分析
方法および材料
HPLC
C-18逆相μボンダパックカラム(Water P/N 27324)を、10%アセトニトリル、0.005%トリフルオロ酢酸(平衡液)で平衡させた。Xanthoceras Sorbifolia抽出物を、カラムに与える前に、平衡液(1 mg/ml)に溶解した。20 μgのサンプルをカラムに注入した。溶出条件:分画は、アセトニトリル(濃度勾配は、70分で10%から80%)で溶出し(流速0.5 ml/分)、その後10分(70-80分)は80%に維持した。次に、アセトニトリルをを10%に落とし(80-85分)、10%に25分(85-110分)維持した。分画は、207 nmにおいて、チャートスピード0.25 cm/分、ODフルスケール0.128で監視した。
装置:Watersモデル510溶媒搬送システム;Waters484可変吸収検出器;Waters745/745Bデータモジュール
【0216】
吸収度分析
各種波長におけるXanthoceras Sorbifolia抽出物の吸収プロフィールを求めた。Xanthoceras Sorbifolia抽出物を、10%アセトニトリル/TFAに溶解し、分光光度計(Spectronic Inc., Model Gene Sys2)によって200-700 nmにおいて走査した。
【0217】
結果
HPLC
プロフィールにおいて、約60-70個のピークが関連ありとされた。その内、大ピークは4個、中ピークは10個、残りは小型分画であった。大ピークを、アセトニトリル溶出の濃度増加に従ってaからzで表示した。図1を参照されたい。
【0218】
吸収最大
Xanthoceras Sorbifolia植物抽出物において、三つの吸収最大が特定された。すなわち、207 nm, 278 nm、および500 nmである。図2を参照されたい。
【実施例8】
【0219】
各種ヒト器官由来のガン細胞に対するXanthoceras Sorbifolia抽出物の細胞傷害をMTTアッセイによってスクリーニングする。
方法および材料
細胞
ヒトのガン細胞系統を、米国基準菌株保存機関から入手した。HTB-9(膀胱)、HeLa-S3(子宮頸部)、DU145(前立腺)、H460(肺)、MCF-7(乳房)、K562(白血球)、HCT116(結腸)、HepG2(肝臓)、U2OS(骨)、T98G(脳)、およびOVCAR-3(卵巣)である。細胞は、10%仔牛血清、グルタミン、および抗生物質を添加した培養液(HeLa-S3、DU145、MCF-7、Hep-G2、およびT98Gは、MEN(Earlの塩)において;HTB-9、H460、K562、OVCAR-3は、RPMI-1640において;HCT-116、U2O2は、McCoy-5Aにおいて)で、5%CO2含有加湿インキュベータにて37℃で育成した。
【0220】
MTTアッセイ。
MTTアッセイの手順は、些少の修正を加えたのみで(Carmichael等1987)の記載する方法に従った。薬剤投与前、細胞を、96ウェルプレートに、10,000個/ウェル(HTB-9, HeLa, H460, HCT116, T98G, OVCAR-3)、15,000個/ウェル(DU145, MCF-7, HepG2, U2OS)、または、40,000個/ウェル(K562)の濃度で撒き24時間インキュベートした。次に、細胞を、薬剤に48時間(HepG2、U2OSには72時間、MCF-7には96時間)暴露した。薬剤処置後、MTT(0.5mg/ml)を培養体に加え1時間インキュベートした。フォルマザン(生細胞によるテトラゾリウムの還元によって生ずる産物)の形成は、DMSOに溶解し、490nmにおけるO.D.を、ELISAリーダー(Dynatech、モデルMR700)によって測定した。薬剤処置前の細胞のMTTレベルも測定した(T0)。%細胞増殖(%G)を、下記のように計算した。すなわち、
【0221】
(数3)
%G = (TD-T0/TC-T0)x100
式中、TCまたはTDは、コントロール細胞または薬剤処置細胞のO.D.読み取り値を表す。
【0222】
T0>TDの場合、コントロールの%で表される細胞傷害性(LC)を、下記のように計算した。すなわち、
【0223】
(数4)
%LC = (TD-T0/T0)x100
【0224】
結果
実験した10種の細胞において、Xanthoceras Sorbifolia抽出物に対する感受性を、四つのグループに分類することが可能である(感受性がもっとも高い:卵巣;高い:膀胱、骨、前立腺、および白血球;僅か:肝臓、乳房、および脳;および、もっとも低い:結腸、子宮頸部、および肺)(図23)(パワーポイントファイル1-22、スライドA、B、C、およびD)。そのIC50値を挙げる(表8.1)
【0225】
(表8.1.) 各種ガン細胞で定量した、Xanthoceras Sorbifolia抽出物のIC50値

【0226】
実験したこれらの細胞系統において、低濃度のXanthoceras Sorbifolia植物抽出物が、膀胱、骨、および肺の細胞の増殖を刺激することが判明した(図3Aおよび3D)(PPファイル1-22、スライド1および4)。
【0227】
純粋分画Yは、増殖刺激活性を失ったが、抑制活性は維持した(図23Aを、図25および27と比較せよ)(PPファイル4-26、スライド2および4)。予備結果(図25)(PPファイル4-26、スライド2)は、増殖成分は、FPLC分画610と1116に存在することを示す。
【実施例9】
【0228】
活性Xanthoceras Sorbifolia抽出物の精製
FPLCによるXanthoceras Sorbifolia抽出物成分の画分
方法
カラム:オクタデシル機能化シリカゲル;カラムサイズ:2cmx28cm;10%アセトニトリル-0.005%TFAで平衡。
サンプル負荷:1-2 ml;濃度:10%アセトニトリル/TFAにおいて100 mg/ml。
勾配溶出:合計500 ml容量において10-80%アセトニトリル。
モニター吸収波長:254 nm
分画収集器:5 ml/分画(10%から72%アセトニトリルで収集、合計90分画)。
装置:AKTA-FPLC, P920ポンプ;モニターUPC-900;Frac-900
【0229】
結果
溶出プロフィールは、4-5個の広範な分画を示す(図4)(PP-FPLC-15)。これらの分画をHPLCで分析した。次に、特異的成分(a-z)を、FPLCプロフィールと分画に戻って特定した。
【0230】
FPLC分画を、7個のプールに分け、膀胱細胞において、MTTアッセイにより細胞増殖活性について分析した。一つのプール(#5962)のみが抑制活性を含むことが判明した(図5)(PPファイル4-26、スライド2)。
【0231】
FPLC−C18オープンカラム、64%アセトニトリルイソクラチック溶出による#5962の画分
方法
カラム:オクタデシル機能化シリカゲル;50 ml; 2cmx28cm;64%アセトニトリル-0.005%TFAで平衡。
サンプル負荷:0.2 ml;濃度:65%アセトニトリル/TFAにおいて1-2 mg/ml。
溶出:64%アセトニトリルイソクラチック。
モニター吸収波長:254 nm
分画収集器:1 ml分画(最初の90分画を収集)。
装置:AKTA-FPLC, P920ポンプ;モニターUPC-900;Frac-900。
【0232】
結果
分画5962の、64%アセトニトリル・イソクラチック溶出によるオープンODS-C18カラムによってさらに精製した。二つの大きな分画(XおよびY)が収集された(図26)(PP-iso80-5)。MTTアッセイによって、Y分画のみが抑制活性を有することが判明した(図27)(PPフィアル4-26、スライド4)。
【0233】
HPLCによる分画Yの分析
方法
カラム:Waters μボンダパックC18 (3.9 x 300 nm)。
溶出:35%または45%イソクラチック溶出。
流速:0.5 ml/分;207 nm;減衰0.128;チャートスピード:0.25 cm/分
【0234】
結果
35%イソクラチック分析において、Y分画は、4-5個の成分(Y0、Y1、Y2、Y3、およびY4)を含む。Y3およびY4は大きな成分である。Y1とY2は一緒にまとまり、Y3とY4は一緒にまとまる(図28)。(PP-HPLC-Y-iso35)。
【0235】
45%イソクラチック分析において、Y1、Y2ピーク同士は合体して一つのピークとなり、Y3とY4ピーク同士も合体して一つのピークになる(図29)。(PPファイル6-8、スライド1)。Y3/4の後にY5成分があるようである。
【0236】
予備的HPLCによる活性Y成分の最終的単離
方法
カラム:予備的HPLCカラム(WaltersデルタパックC18-300A)。
溶出: 45%アセトニトリルイソクラチックで、流速1 ml/分。
モニター207 nm
ピーク分画を収集し、凍結乾燥した。
【0237】
この条件下における結果
Y1とY2とは互いによく分離されるので、個別に収集される。Y3/4およびY5は分離されない(図30)(PP-HPLC-Y-iso45)。Y3/4ピーク物質の上行部分および下行部分を、さらにNMRによって分析すると、同様のプロフィールが得られ、Y3/4は均一成分であることが示された(図31)(PP-3-4プロトンNMR)。従って、この分画はY分画と命名された。収集されたY分画の復帰分析は、C18逆相カラムを備えたHPLCにおいて単一ピークを示した。(図32)(PP-HPLC-純粋-Y)。
【0238】
外観および可溶性
純粋なYは、非晶質白色粉末で、水溶性アルコール(メタノール、エタノール)、50%アセトニトリル、および100%ピリジンに可溶である。
【0239】
Y分画のMTT分析によって下記が判明した。すなわち、
(a)Y分画は、卵巣ガン細胞(OCAR-3)に対して活性を持ち、IC50は1 μg/mlであり、これは、未精製物質よりも10-15倍効力が高かった(図33aおよび33b)(PPファイル7-26)、および、
(b)Y分画は、子宮頸ガン細胞(HeLa)と比較した場合、卵巣ガン細胞に対してその選択性を維持する(図34)(PP5-11、HeLa細胞における比較例ではあまり活性がない)。
【実施例10】
【0240】
Xanthoceras Sorbifolia活性抽出物の化学的構造の決定
方法
NMR分析
Xanthoceras Sorbifolia抽出物と純粋Y分画、およびその他のサンプルについてNMR分析を行った。サンプルを、0.05% v/v TMSを含むピリジン-5に溶解した。NMRスペクトラムは全て、298KにおいてQXIプローブ(1H/13C/15N/31P)を備えたBruker Avance 600 MHz NMRスペクトロメーターを用いて得た。1D 1Hスペクトラムのための走査数は、サンプル濃度に応じて16から128であった。2D HMQCスペクトラムは、6000 x 24,000 Hzのスペクトラム幅で、t2およびt1ディメンジョンに対して、それぞれ、2024x256のデータポイントを配して記録した。走査数は4から128であった。2D HMBCスペクトラムは、6000 x 30,000 Hzのスペクトラム幅で、t2およびt1ディメンジョンに対して、それぞれ、2024x512のデータポイントを配して記録した。走査数は64であった。2Dデータは、t1ディメンジョンにおいてゼロ充填してデータポイントを2倍にし、t1とt2の両ディメンジョンにおいてコサイン平方ベル・ウィンドウ関数を掛け、XWIN-NMRソフトウェアを用いてフーリエ変換した。これら2Dスペクトラムの最終的な、実際のマトリックスサイズは、HMQCおよびHMBCに対し、それぞれ、2048 x 256 および2048 x 512データポイント(F2xF1)である。
【0241】
質量分析
サンプルの質量は、(A)MALDI-TOF質量分析、および、(B)ESI-MS質量分析にて分析した。
(A)MALDI-TOF用サンプルは先ずアセトニトリに溶解し、次に、マトリックスCHCA(アルファ-シアノ-4-ヒドロキシシンナミン酸、50:50水/アセトニトリルおよび最終濃度で0.1%TFAに溶解した10 mg CHCA/mL)と混合した。このサンプルを完全にアセトニトリルに溶解し、マトリックスと混合した後溶解したままに保持する。分子量は、標準を用いた、高解像度質量分析によって定量した。
(B)ESIでは、サンプルを、Thermo Finniganの作製したLCQ DECA XP Plus機によって分析した。サンプルをESIソースによってイオン化し、化合物に対する溶媒はアセトニトリルである。
【0242】
結果
プロトンNMRのプロフィールを図35に示す。(プロトン-NMR-7-20)。YのプロトンNMRの化学シフトを下記の表10.1に挙げる。
【0243】
(表10.1.) Xanthoceras Sorbifolia抽出物のY分画のプロトンNMRの化学シフト



【0244】
2D NMRデータは、下記の図に示される。すなわち、図36(PP-2D-NMR-Y-HMQC)、図37(PP-2D-NMR-HMBC)であり、化学シフトデータは表10.2(HMQC-ピーク-シフト)および表10.3(HMBC-ピーク-シフト)に示される。
【0245】
(表10.2.)YのHMQC分析2D化学シフトの化学シフトデータ
実験NO=5、過程NO=1、F1PLO=144.360ppm, F1PHI=10.797ppm, F2PLO=7.966ppm, F2PHI=0.417ppm,MI=1.00cm, MAXI=10000.00cm, PC=1.400



【0246】
(表10.3.)YのHMMC分析2D化学シフトの化学シフトデータ
実験NO=6、過程NO=1
F1PLO=178.339ppm, F1PHI=10.721ppm, F2PLO=6.881ppm, F2PHI=0.573ppm
MI=1.00cm, MAXI=10000.00cm, PC=1.400










【0247】
表10.4(Y-構造および、2D NMR化学シフトデータ)は、化合物Yのプロトンおよび炭素-13の化学シフトから得られる官能基の割り当てを示す。これらのデータおよび分析に基づいて、化合物Yの構造は下記のように割り当てられ、図示される。すなわち、
【0248】
【化22】

C57H88O23
厳密質量:1140.5716
分子量:1141.2948
C, 59.99; H, 7.77; O, 32.24
【0249】
【化23】

【0250】
【化24】

【0251】
【化25】

【0252】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0253】
【化26】

【0254】
上式において、R1=AまたはBまたはCであり、R2=AまたはBまたはCであり、R3=AまたはBまたはCである。
【0255】
化合物Yの構造
化合物Yの化学名は、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンである。
【0256】
(表10.4.) 化合物Yの13Cおよび1H NMRデータ(ピリジン-d5における)a


【0257】
図38は、MALDI-TOFおよびESI-MS技術によって求めたYのマススペクトラムを示す。
【0258】
結論
化学シフト分析に基づいて、Xanthoceras Sorbifolia抽出物から単離された活性化合物Yは、バックボーンに3個の糖とビアンゲロイル基が付着したトリテルペノイドサポニンである。Yの化学式はC57H88O23であり、Yの化学名は、
3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンである。
【0259】
参考文献
1.「中国医学の薬理学の研究法」
2.「学習および記憶力改善に及ぼすYangshou Danの作用の研究」
3.「認知力改善に及ぼすAnjifuの作用の研究」
4.「マウスの学習および記憶力改善に及ぼすNokkangtaiカプセルの作用の研究」
5.「マウスの学習および記憶力改善に及ぼすpeoniesの未精製サポニンの作用の研究」
6.「血管老化による老人性痴呆のDidang tangによる治療の研究」
7.「マウスの学習および記憶力改善に及ぼすTongmai Yizhiカプセルの作用の研究」
8.「老人性痴呆研究用動物モデルの研究」
9. 公衆衛生部、医事警察局「神経系疾患治療における医薬品作用研究のためのガイドライン」、最新医学研究ガイドブック。
10.「B-ペプチドによる障害に対する、Ginseng未精製サポニンの改善作用」
【図面の簡単な説明】
【0260】
【図1】図1(a)および(b)。植物抽出物投与の、高齢マウスの9日間に渡る水迷路学習に及ぼす作用。
【図2】図2(a)および(b)。3日ペントバルビタール注入の水迷路学習結果。
【図3】XおよびY投与10日後における、抽出物XおよびYのマウスの尿量に対する作用。
【図4】図4は、典型的なヒトの睡眠サイクルを示す。
【図5】図5は、文冠果種皮抽出物のHPLCプロフィールを示す。
【図6】図6は、乳ガン細胞の抑制における文冠果抽出物の効力を示す。効力は、IC50が65 μg/ml、IC0が105 μg/mlである。図6の実験結果はさらに、該抽出物は白血球ガン細胞も抑制することを示す。その場合、IC50は35 μg/mlで、IC0は50 μg/mlである。
【図7】図7は、膀胱細胞の活性増大における文冠果抽出物の効力を示す。膀胱細胞は、10 μg/mlの抽出物濃度において最大125%まで増殖する。図7の実験結果はさらに、文冠果抽出物は、高濃度において膀胱細胞を抑制すること、その場合、IC50は45 μg/mlで、IC0は60 μg/mlであることを示す。図7の実験結果は、文冠果抽出物は、卵巣ガン細胞を抑制すること、その場合、IC50は15 μg/mlで、IC0は20 μg/mlであることを示す。
【図8】図8は、脳細胞の活性増大における文冠果抽出物の効力を示す。脳細胞は、10 μg/mlの抽出物濃度において最大108%まで増殖する。図8の実験結果はさらに、文冠果抽出物は、前立腺ガン細胞を抑制すること、その場合、IC50は40 μg/mlで、IC0は70 μg/mlであることを示す。図8の実験結果は、文冠果抽出物は、脳ガン細胞を抑制すること、その場合、IC50は70 μg/mlで、IC0は100 μg/mlであることを示す。
【図9】図9は、肺細胞の活性増大における文冠果抽出物の効力を示す。図9の実験結果は、肺細胞は、10 μg/mlの抽出物濃度を含む培養液RPMI-1640において増殖し始めることを示した。図9の実験結果はさらに、肺細胞は、50 μg/mlの抽出物濃度において最大120%まで増殖することを示した。図9はまた、膀胱細胞の活性増大における文冠果抽出物の効力を示した。膀胱細胞は、10 μg/mlの抽出物濃度を含む培養液RPMI-1640において最大125%まで増殖することを示した。図9の実験結果はさらに、文冠果抽出物は、高濃度において膀胱細胞を抑制すること、その場合、IC50は45 μg/mlで、IC0は60 μg/mlであることを示した。図9の実験結果はさらに、文冠果抽出物は、肝臓ガン細胞を抑制すること、その場合、IC50は68 μg/mlで、IC0は95 μg/mlであることを示した。
【図10】図10は、文冠果抽出物は、子宮頸細胞に対して僅かな作用しか示さないことを示す。
【図11】図11は、骨細胞の活性増大における文冠果抽出物の効力を示す。骨細胞は、10 μg/mlの抽出物濃度を含む培養液RPMI-1640において最大120%まで増殖することを示した。 図11の実験結果はさらに、抽出物は、高濃度において骨ガン細胞を抑制すること、その場合、IC50は40 μg/mlで、IC0は50 μg/mlであることを示した。
【図21】図21は、μボンダパックC18カラムを備えたHPLCによる、Xanthoceras Sorbifolia抽出物成分の分離を示す。 図21A-Mは、FPLCによる、Xanthoceras Sorbifolia抽出物の内分画Yの単離を示す。AおよびBは、FPLCクロマトグラムの代表的溶出プロフィールである。C-Kは、FPLCクロマトグラムで得られた分画のHPLCプロフィールである。L:元の材料。M:TLCクロマトグラフィー。FPLCの選択分画は、TLCで分析し、炭水化物染色した。
【図22】図22は、Xanthoceras Sorbifolia抽出物の吸収スペクトラムを示す。 横軸:nmで表した波長。 縦軸:光学的密度。植物抽出物において、三つの吸収最大が特定された。すなわち、207 nm, 278 nm、および500 nmである。
【図23】図23A-23Eは、Xanthoceras Sorbifolia抽出物で処理後、MTTアッセイで求めた細胞の増殖曲線を示す。これらの実験から、Xanthoceras Sorbifolia抽出物に対する各種細胞系統の感度が記録された。 (23A)感度がもっとも高い:卵巣 (23B)高い:膀胱および骨 (23C)中等度:白血球および肝臓 (23D)僅か:前立腺、乳房、および脳 (23E)もっとも低い:結腸、子宮頸部、および肺
【図24】図24は、Xanthoceras Sorbifolia抽出物の、10-80%勾配を持つFPLCによる溶出プロフィールを示す。 縦軸:光学的密度。 横軸:分画容量(5ml/分画)
【図25】図25は、FPLC分画の細胞(膀胱細胞で実行)増殖活性のスクリーニングを示す。25Aは、FPLCで得られた溶出分画を示す。次に、これらの分画について、どの分画が活性が高いかをMTTアッセイにて求めた。25Bは、Xanthoceras Sorbifolia抽出物の各種成分(FPLCにて画分した)が、細胞に対して増殖作用か、抑制作用かどちらかを及ぼすことを示す。分画5962(Y成分)のみが細胞抑制を引き起こす。分画610および1116は、僅かに細胞増殖を刺激する。 横軸:濃度(μl/ml)。 縦軸:%細胞増殖(MTTアッセイによって定量)。
【図26】図26は、分画5962の、64%イソクラチック溶出による溶出プロフィールを示す。(二つの大きなFPLC分画XおよびYが分離される。) 縦軸:光学的密度。 横軸:分画番号(1ml/分画)
【図27】図27は、分画X(2021)およびY(2728)による、膀胱細胞の抑制活性の比較を示す。Yのみが抑制活性を持つ。
【図28】図28は、35%イソクラチック溶出による分画YのHPLCプロフィールを示す。図28はまた、35%イソクラチック分析において、Y(2728)分画は、4-5個の成分(Y0、Y1、Y2、Y3、およびY4)を含むことを示す。
【図29】図29は、45%アセトニトリルイソクラチック溶出による分画YのHPLCプロフィールを示す。図29はまた、45%イソクラチック分析において、Y3とY4ピーク同士が合体して一つのピークになることを示す。この条件では、分画Y1およびY2は、見事に分画Y3およびY4から分離される。
【図30】図30は、予備的C18カラム(Delta Pak C18)における45%アセトニトリルイソクラチック溶出による分画YのHPLCプロフィールを示す。この条件では、分画Y1およびY2は互いに十分分離しているので、それぞれ別々に収集される。
【図31】Y(3/4)ピークの上行部分および下行部分のプロトンNMRプロフィールの比較。二つは同一であることが示された。
【図32】図32は、予備的C18カラムにおいて45%イソクラチック溶出によって収集したHPLCプロフィールを示す。
【図33】図33は、精製Y分画の、卵巣ガン細胞(OCAR-3)に対する効力を示す。 横軸:濃度(μg/ml)。A:ポイントスケール、B:直線スケール 縦軸:%細胞増殖(MTTによって定量)。IC50はほぼ1μg/ml。
【図34】図34は、卵巣ガン細胞および子宮頸ガン細胞に対するY分画の効力の比較を示す。卵巣ガン細胞は、分画Yに対して感受性を持つが、子宮頸ガン細胞はそうではない。卵巣細胞に対する分画YのIC50は約1である。この結果は、卵巣ガンは、精製Y分画に対して感受性を持つことを裏付ける。
【図35】図35は、分画YのプロトンNMRの化学シフトを示す。
【図36】図36は、サンプルYのHMQC結果を示す。化学シフトデータについてはさらに表22も参照されたい。
【図37】図37は、サンプルYのHMBC結果を示す。A:レベル1、B:レベル2。化学シフトデータについてはさらに表23も参照されたい。
【図38】図38は、化合物Yの質量分析結果を示す。(A)MALDI-TOF(高質量)、A1:Y+マトリックス(CHCA)+アンギオテンシン1「2点較正」。A2:Y+マトリックス(CHCA)+アンギオテンシン「1点較正」。A3:Y+マトリックス(CHCA)。A4:マトリックス(CHCA)のみ。A5:アンギオテンシン1+マトリックス(CHCA)。(B)ESI-MS
【図39】図39は、Yの構造と化学名を示す、3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エン。
【図40】図40は、Y1のプロトンNMRを示す。化学シフトデータは、表24に示す。
【図41】図41は、Y1の2D NMR(HMQC)を示す。化学シフトデータは表25に示す。
【図42】図42は、Y2のプロトンNMRを示す。化学シフトデータは、表26に示す。
【図43】図43は、Y2の2D NMR(HMQC)を示す。化学シフトデータは表27に示す。
【図44】図44は、Y4のプロトンNMRを示す。化学シフトデータは、表28に示す。
【図45】図45は、Y4の2D NMR(HMQC)を示す。化学シフトデータは表29に示す。
【図46】図46は、Y1のCOSY-NMRプロフィールを示す。化学シフトデータは表30に示す。
【図47】図47は、Y1の3種の考えられる構造を示す。A:構造Y1-1、B:構造Y1-2、および、C:構造Y1-3。
【図1a】

【図1b】

【図2a】

【図2b】

【特許請求の範囲】
【請求項1】
【化1】

C65H100O27
厳密質量:1312.6452
分子量:1313.4733
C, 59.44; H, 7.67; O, 32.89、
【化2】

またはその塩、エステル、誘導体、または代謝産物から成るグループから選ばれる化合物
【請求項2】
【化3】

上式において、R1、R2、R3、およびR4は、短い脂肪族鎖であり、R5およびR6はオキシル基を含む式の化合物、またはその塩、エステル、誘導体、または代謝産物。
【請求項3】
R1、R2、R3、およびR4はCH3を含み、R5はOHを含み、R6はHまたはOHを含み、位置23-27、29および30は、CH3またはCH2OHまたはCOOHを含むことを特徴とする、請求項2の化合物。
【請求項4】
【化4】

【表1】

上式において、R1=AまたはBまたはCであり;R2=AまたはBまたはCであり;R3=AまたはBまたはCであり;R4=HまたはOHであり;A=アンゲロイル基;B=アセチル基;C=水素;位置23-27、29、30=CH3またはCH2OHまたはCOOHである化合物、および、
【化5】

【表2】

上式において、R1=AまたはBまたはCであり;R2=AまたはBまたはCであり;R3=AまたはBまたはCであり;R4=HまたはOHであり;A=アンゲロイル基;B=アセチル基;C=水素;位置23-27、29、30=CH3またはCH2OHまたはCOOHである化合物から成るグループから選ばれる化合物、またはその塩、エステル、誘導体、または代謝産物。
【請求項5】
表10.1、表10.2、表10.3、表10.4、表24、表25、表26、表27、表28、表29、または表30に示されるNMRデータを含む化合物。
【請求項6】
化学式:3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンを含む化合物。
【請求項7】
化学式:3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21-O-(3,4-ジアンゲロイル)-α-L-ラムノピラノシル-22-O-アセチル-3β, 16α, 21β, 22α, 28-ペンタヒドロキシオレアン-12-エンを含む化合物。
【請求項8】
化合物であって、動作的に結合される
(a)糖;
(b)トリテルペンまたはサポゲニン;
(c)炭素21および22における側鎖、またはアンゲロイル基、
を含むことによって形成される前記化合物。
【請求項9】
化合物であって、
(a)トリテルペンまたはサポゲニン;
(b)トリテルペンまたはサポゲニンに付着する糖基;
(c)トリテルペンまたはサポゲニンの炭素21および22に付着する側鎖、
を含む前記化合物。
【請求項10】
前記側鎖はアンゲロイル基であることを特徴とする、請求項9の化合物。
【請求項11】
二つ以上の糖および一つ以上のアンゲロイル基を含むことを特徴とする、請求項8または9のいずれか1項による化合物。
【請求項12】
トリテルペノイドサポニンのバックボーンに付着した三つの糖と二つのアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項13】
トリテルペノイドサポニンのバックボーンに付着した二つの糖と一つ以上のアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項14】
トリテルペノイドサポニンのバックボーンに付着した四つの糖と一つ以上のアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項15】
トリテルペノイドサポニンのバックボーンに付着した、全く無いか、一つ以上の糖と、一つ以上のアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項16】
請求項1から15のいずれか1項による化合物の塩。
【請求項17】
構造が合成されるか、または天然供給源から単離されることを特徴とする、請求項1-15の化合物。
【請求項18】
腫瘍またはガン細胞増殖を抑制することが可能な組成物であって、請求項1から15のいずれか1項による化合物の有効量を含む前記組成物。
【請求項19】
前記ガンは卵巣ガンであることを特徴とする、請求項18の組成物。
【請求項20】
前記ガンは、乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、皮膚ガン、骨ガン、または脳のガンであることを特徴とする、請求項18の組成物。
【請求項21】
請求項1から15のいずれか1項による化合物の、ガン治療のための使用。
【請求項22】
腫瘍またはガン細胞増殖を抑制する方法であって、請求項1から15のいずれか1項による化合物の有効量を前記細胞に投与することを含む前記方法。
【請求項23】
請求項1から15のいずれか1項による化合物、および適切な担体を含む組成物。
【請求項24】
請求項1から15のいずれか1項による化合物の有効量、および、製薬学的に受容可能な担体を含む製薬組成物。
【請求項25】
腫瘍またはガン細胞増殖を抑制するのに効果的な、請求項1から15のいずれか1項による化合物を含む組成物。
【請求項26】
前記ガンは卵巣ガンであることを特徴とする、請求項25の組成物。
【請求項27】
請求項1から15のいずれか1項による化合物を含む組成物であって、
遺尿症の治療;膀胱の弛緩;大脳皮質および小脳反応の改善;余分な深度睡眠進入の防止;膀胱壁の感覚性伸長受容器を改善し中枢神経系に正確な信号を送るようにする;排尿切迫または頻尿を引き起こすストレスまたは神経緊張、加齢、反射亢進、からの膀胱の解放;Achによって収縮する膀胱組織の緩和;AChEの抑制;抗炎症作用の実現;ウィルスの抑制;ヒト免疫不全ウィルスプロテアーゼの抑制;コレステロールおよびトリグリセリドの血中濃度の低下;脳の加齢を防止し、記憶力を改善、大脳機能を改善する;遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病の治療;関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療;インポテンツおよび早漏の治療;膀胱機能の改善;膀胱ガン細胞増殖の抑制;深度睡眠の抑制;目覚め意識の向上;抗利尿ホルモン(ADH)の放出、分解、および摂取、およびその受容体の修飾;副腎皮質ホルモン(ACTH)の放出、分解、および摂取、およびその受容体の修飾;5-ヒドロキシトリプタミンの放出、分解、および摂取、およびその受容体の修飾; アセチルコリン(Ach)の放出、分解、および摂取、およびその受容体の修飾;アドレナリン(AD)の放出、分解、および摂取、およびその受容体の修飾;ドーパミン(DA)の放出、分解、および摂取、およびその受容体の修飾;ノルエピネフィリン(NE)の放出、分解、および摂取、およびその受容体の修飾;睡眠麻痺の防止;神経ペプチドの形成、放出、分解、および活性、およびその受容体の修飾;乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンのようなガンの治療;肺および膀胱機能の改善;および、骨ガンの治療
が可能な前記組成物。
【請求項28】
Xanthoceras sorbifoliaから得られる治療的化合物の特定法であって、
(a)Xanthoceras Sorbifolia粉末を、適当量の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;
(b)有機抽出物を収集すること;
(c)有機抽出物を有機溶媒と共に適当時間環流して第二抽出物を形成すること;
(c)第二抽出物から有機溶媒を除去すること;
(d)第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物を形成すること;
(e)Xanthoceras Sorbifolia抽出物をHPLCクロマトグラフィーを用いて特性解明すること;
(f)Xanthoceras Sorbifolia抽出物を、HPLCクロマトグラフィーの結果に基づいて成分に分離すること;
(g)細胞傷害性に関して各成分をスクリーニングすること;
(h)細胞活性アッセイを用いて各成分を分析し、活性成分を確定すること;
(i)活性成分を精製すること;および、
(j)活性成分における化合物の化学的構造をNMR分析によって確定すること
の諸工程を含む前記方法。
【請求項29】
Xanthoceras sorbifoliaから得られる治療的化合物の特定法であって、
(a)Xanthoceras Sorbifolia抽出物を獲得すること;
(b)Xanthoceras Sorbifolia抽出物をHPLCクロマトグラフィーを用いて特性解明すること;
(c)Xanthoceras Sorbifolia抽出物を、HPLCクロマトグラフィーの結果に基づいて成分に分離すること;
(d)各成分を細胞傷害性に関してスクリーニーングすること;
(e)細胞活性アッセイを用いて各成分を分析し、活性成分を確定すること;
(f)活性成分を精製すること;および、
(g)活性成分における化合物の化学的構造をNMR分析によって確定すること
の諸工程を含む前記方法。
【請求項30】
前記Xanthoceras Sorbifolia粉末は、Xanthoceras Sorbifolia天然木の種皮、枝、幹、葉、核、根、樹皮、または種殻から得られることを特徴とする、請求項28の方法。
【請求項31】
前記有機溶媒は、エタノール、メタノール、エーテル、クロロフォルム、アルコール、またはアセトンであることを特徴とする、請求項28または29のいずれかの方法。
【請求項32】
前記Xanthoceras Sorbifolia粉末の、前記有機溶媒に対する比率は、1:2の比であることを特徴とする、請求項28または29のいずれかの方法。
【請求項33】
(a)の、前記抽出工程は、4-5回で、各回20-35時間であることを特徴とする、請求項28の方法。
【請求項34】
前記環流工程(c)は、2-3回実行されることを特徴とする、請求項28の方法。
【請求項35】
前記環流工程(c)は、80℃で実行されることを特徴とする、請求項28の方法。
【請求項36】
前記細胞活性アッセイはMTTアッセイであることを特徴とする、請求項28または29のいずれかの方法。
【請求項37】
サポニンを含む、Xanthoceras Sorbifolia抽出物を含む組成物。
【請求項38】
Xanthoceras Sorbifoliaから抽出物を調製する方法であって、
i. Xanthoceras Sorbifolia粉末を、適当量の1種以上の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;
ii. 有機抽出物を収集すること;
iii. 有機抽出物を有機溶媒と適当な時間環流して第二抽出物を形成すること;
iv. 第二抽出物から有機溶媒を除去すること;および、
v. 第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物粉末を形成すること、
の諸工程を含む前記方法。
【請求項39】
前記Xanthoceras Sorbifolia粉末は、Xanthoceras Sorbifolia天然木の種皮、枝、幹、葉、核、根、樹皮、または種殻から調製されることを特徴とする、請求項38の方法。
【請求項40】
前記有機溶媒は、エタノール、メタノール、エーテル、クロロフォルム、アルコール、またはアセトンであることを特徴とする、請求項38の方法。
【請求項41】
前記Xanthoceras Sorbifolia粉末の、前記有機溶媒に対する比率は、1:2の比であることを特徴とする、請求項38の方法。
【請求項42】
(i)の、前記抽出工程は、4-5回で、各回20-35時間であることを特徴とする、請求項38の方法。
【請求項43】
前記環流工程(iii)は、2-3回実行されることを特徴とする、請求項38の方法。
【請求項44】
前記環流工程(iii)は、80℃で実行されることを特徴とする、請求項38の方法。
【請求項45】
請求項38の抽出物の有効量を含む、腫瘍またはガン細胞増殖を抑制することが可能な組成物。
【請求項46】
前記ガンは卵巣ガンであることを特徴とする、請求項45の組成物。
【請求項47】
前記ガンは骨ガンであることを特徴とする、請求項45の組成物。
【請求項48】
前記ガンは膀胱ガンであることを特徴とする、請求項45の組成物。
【請求項49】
前記ガンは前立腺ガンであることを特徴とする、請求項45の組成物。
【請求項50】
前記ガンは、乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、皮膚ガン、骨ガン、または脳のガンであることを特徴とする、請求項45の組成物。
【請求項51】
請求項37の抽出物を含む組成物であって、
遺尿症の治療;膀胱の弛緩;大脳皮質および小脳反応の改善;余分な深度睡眠進入の防止;膀胱壁の感覚性伸長受容器を改善し中枢神経系に正確な信号を送るようにする;排尿切迫または頻尿を引き起こすストレスまたは神経緊張、加齢、反射亢進、からの膀胱の解放;Achによって収縮する膀胱組織の緩和;AChEの抑制;抗炎症作用の実現;ウィルスの抑制;ヒト免疫不全ウィルスプロテアーゼの抑制;コレステロールおよびトリグリセリドの血中濃度の低下;脳の加齢を防止し、記憶力を改善、大脳機能を改善する;遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病の治療;関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療;インポテンツおよび早漏の治療;膀胱機能の改善;膀胱ガン細胞増殖の抑制;深度睡眠の抑制;目覚め意識の向上;抗利尿ホルモン(ADH)の放出、分解、および摂取、およびその受容体の修飾;副腎皮質ホルモン(ACTH)の分泌、分解、および摂取、およびその受容体の修飾;5-ヒドロキシトリプタミンの放出、分解、および摂取、およびその受容体の修飾; アセチルコリン(Ach)の放出、分解、および摂取、およびその受容体の修飾;アドレナリン(AD)の放出、分解、および摂取、およびその受容体の修飾;ドーパミン(DA)の放出、分解、および摂取、およびその受容体の修飾;ノルエピネフィリン(NE)の放出、分解、および摂取、およびその受容体の修飾;睡眠麻痺の防止;神経ペプチドの形成、放出、分解、および活性、およびその受容体の修飾;乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンのようなガンの治療;肺および膀胱機能の改善;および、骨ガンの治療
が可能な前記組成物。
【請求項52】
Xanthoceras Sorbifoliaの抽出物を含む組成物であって、該抽出物は、サポニンまたはアルカロイドまたはフラボノールまたはフラボノールまたはジヒドロフラボノールまたはフェノロイドまたは有機酸またはサッカリドまたはタンパクまたはグリコシドまたはクマリンまたはタンニンまたは芳香族酸または脂肪性有機酸またはテルペノイド有機酸、または上記の任意の組み合わせを含み、該抽出物は、Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られることを特徴とする、前記組成物。
【請求項53】
請求項52の抽出物を含む組成物であって、
遺尿症の治療;膀胱の弛緩;大脳皮質および小脳反応の改善;余分な深度睡眠進入の防止;膀胱壁の感覚性伸長受容器を改善し中枢神経系に正確な信号を送るようにする;排尿切迫または頻尿を引き起こすストレスまたは神経緊張、加齢、反射亢進、からの膀胱の解放;Achによって収縮する膀胱組織の緩和;AChEの抑制;抗炎症作用の実現;ウィルスの抑制;ヒト免疫不全ウィルスプロテアーゼの抑制;コレステロールおよびトリグリセリドの血中濃度の低下;脳の加齢を防止し、記憶力を改善、大脳機能を改善する;遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病の治療;関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療;インポテンツおよび早漏の治療;膀胱機能の改善;膀胱ガン細胞増殖の抑制;深度睡眠の抑制;目覚め意識の向上;抗利尿ホルモン(ADH)の放出、分解、および摂取、およびその受容体の修飾;副腎皮質ホルモン(ACTH)の分泌、分解、および摂取、およびその受容体の修飾;5-ヒドロキシトリプタミンの放出、分解、および摂取、およびその受容体の修飾; アセチルコリン(Ach)の放出、分解、および摂取、およびその受容体の修飾;アドレナリン(AD)の放出、分解、および摂取、およびその受容体の修飾;ドーパミン(DA)の放出、分解、および摂取、およびその受容体の修飾;ノルエピネフィリン(NE)の放出、分解、および摂取、およびその受容体の修飾;睡眠麻痺の防止;神経ペプチドの形成、放出、分解、および活性、およびその受容体の修飾;乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンのようなガンの治療;肺および膀胱機能の改善;および、骨ガンの治療
が可能な前記組成物。
【請求項54】
請求項52の組成物を調製する方法であって、
(A)Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、エタノールで3回抽出して、エタノール抽出物を形成し;エタノール抽出物を濃縮して濃縮抽出物を形成し;濃縮抽出物を熱水で抽出して水性抽出物と水溶性抽出物を形成し;水性抽出物と水溶性抽出物を乾燥し、水溶性フラボン抽出物および水不溶性フラボン抽出物を形成する工程であって、フラボン抽出物は、フラボノール、フラボノール、ジヒドロフラボノール、フェノロイド、有機酸、その他を含む工程、または、
(B)Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、エタノール、メタノール、その他である有機溶媒で抽出して、有機抽出物を形成し;有機抽出物から有機溶媒を除去して、水性抽出物を形成し;水性抽出物を乾燥し、滅菌して抽出物を形成する工程であって、抽出物は、サポニン、サッカリド、タンパク、その他を含む工程、または、
(C) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、エタノール、メタノール、その他である有機溶媒で抽出し、抽出は、1:2の比で4-5回、各回20-35時間として有機抽出物を形成し;有機抽出物を収集し、80℃で2-3回環流して第2抽出物を形成し;第2抽出物を水に溶解して水溶液を形成し;水溶液をn-ブタノールで抽出して、n-ブタノール抽出物を形成し;n-ブタノール抽出物クロマトグラフィーを用いて処理して、未精製サポニン抽出物を形成する工程であって、未精製サポニン抽出物は、サポニンその他を含む工程、または、
(D)Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、0.5%NaOH溶液で抽出して、水性抽出物を形成し;水性抽出物を収集し、エーテルで抽出してエーテル抽出物を形成し;エーテル抽出物をHCLで中和して、中和化エーテル抽出物を形成し;中和化エーテル抽出物を濃縮し、酸性化し、クマリン抽出物を形成する工程であって、クマリン抽出物は、クマリン、クマリングリコシド、サッカリド、タンパク、その他を含む工程、または、
(E) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、水で、室温で24時間抽出して、水性抽出物を形成し;水性抽出物を60-70℃で1-2時間煮込んで第2水抽出物を形成し;第2抽出物をろ過してろ過抽出物を形成し;ろ過抽出物を濃縮して水性抽出物を形成する工程であって、水性抽出物は、糖、ポリサッカリド、グリコシド、サポニン、タンニン、その他を含む工程、または、
(F) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、水で抽出し、抽出は1:6の比で3-4回、各回10-15時間として水性抽出物を形成し;水性抽出物を収集し、NaOHでアルカリ化し、pH10-12のアルカリ化水性抽出物を形成し;アルカリ化水性抽出物をトルオールで抽出して、トルオール抽出物を形成し;トルオール抽出物を、pH5-7の、2%ジカルボキシル溶液中に通過させてジカルボキシル溶液を形成し;ジカルボキシル溶液を減圧下に濃縮して未精製アルカロイド抽出物を形成する工程であって、アルカロイド抽出物は、アルカロイド、クマリン、サッカリド、タンパク、その他を含む工程、または、
(G) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、10%HCLで抽出して酸性溶液を形成し;酸性溶液を、エーテルまたはベンゾールである有機溶媒で抽出して、有機抽出物を形成し;有機抽出物を5-10%のNaHCO3で抽出してNaHCO3抽出物を形成し;NaHCO3抽出物を酸化し、ろ過して堆積物を形成し;堆積物を有機溶媒で抽出して第2有機抽出物を形成し;第2抽出物から有機溶媒を除去して未精製有機酸抽出物を形成する工程であって、有機酸抽出物は、芳香族有機酸、脂肪族有機酸、テルペノイド有機酸、サッカリド、タンパク、その他を含む工程、または、
(H) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、95%エタノールで抽出してエタノール抽出物を形成し;エタノール抽出物を減圧下に濃縮してタンニン抽出物を形成する工程、または、
(I) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、1:1比のアセトン-水溶媒によって2-7日抽出してアセトン-水抽出物を形成し;50℃でアセトン-水抽出物からアセトンを除去して濃縮抽出物を形成し;濃縮抽出物をろ過してろ過抽出物を形成し;ろ過抽出物をエーテルで抽出して水性抽出物を形成し;水性抽出物を酢酸エチルおよびn-ブタノールで抽出して、タンニン抽出物を含む、酢酸エチルおよびn-ブタノール抽出物を形成する工程であって、タンニン抽出物は、タンニン、有機酸、サッカリド、タンパク、その他を含む工程、
を含む前記方法。
【請求項55】
Wnt経路に関連する成分、またはその受容体を調節して、ガンの増殖を阻止すること;または、Ras-MAPキナーゼカスケードの成分または受容体を調節すること;または、Ras-依存性経路、またはMyc経路を調節すること;または、チェックポイント機構を再び活性化して、被験体におけるガン細胞増殖を阻止すること;または、細胞外成長に関連する成分、または受容体を調節すること;または、RasおよびMAPキナーゼに関連する成分を調節してガンの増殖を阻止すること;Myc細胞増殖成分または受容体を調節して、腫瘍細胞の分裂を阻止すること;TGF-アルファの成分または受容体を調節すること;または、TGF-ベータの成分または受容体を調節すること;または、E6およびE7タンパクを調節し、タンパクRbおよびp53を放出して異常な細胞の分裂を阻止すること;または、前記タンパクを調節し、またはそれらの反応して、ガン細胞の死をもたらすこと;p53経路の成分、または受容体を調節して、ガン細胞の分裂を阻止すること;細胞における自殺シグナルを解き放つこと;または、BMP、FGF、Jak-Jnk-STATおよびJun-fosの成分および受容体を調節すること;または、グルココルチコイド受容体またはエストロゲン受容体またはEGF受容体を調節すること、
が可能な組成物であって、請求項1-15のいずれか1項の化合物、または、請求項37の化合物の有効量を含む、前記組成物。
【請求項56】
尿量を低減する、または排尿頻度を下げる組成物であって、請求項1-15のいずれか1項の化合物、または、請求項37の化合物の有効量を含む、前記組成物。
【請求項1】
【化1】

C65H100O27
厳密質量:1312.6452
分子量:1313.4733
C, 59.44; H, 7.67; O, 32.89、
【化2】

またはその塩、エステル、誘導体、または代謝産物から成るグループから選ばれる化合物
【請求項2】
【化3】

上式において、R1、R2、R3、およびR4は、短い脂肪族鎖であり、R5およびR6はオキシル基を含む式の化合物、またはその塩、エステル、誘導体、または代謝産物。
【請求項3】
R1、R2、R3、およびR4はCH3を含み、R5はOHを含み、R6はHまたはOHを含み、位置23-27、29および30は、CH3またはCH2OHまたはCOOHを含むことを特徴とする、請求項2の化合物。
【請求項4】
【化4】

【表1】

上式において、R1=AまたはBまたはCであり;R2=AまたはBまたはCであり;R3=AまたはBまたはCであり;R4=HまたはOHであり;A=アンゲロイル基;B=アセチル基;C=水素;位置23-27、29、30=CH3またはCH2OHまたはCOOHである化合物、および、
【化5】

【表2】

上式において、R1=AまたはBまたはCであり;R2=AまたはBまたはCであり;R3=AまたはBまたはCであり;R4=HまたはOHであり;A=アンゲロイル基;B=アセチル基;C=水素;位置23-27、29、30=CH3またはCH2OHまたはCOOHである化合物から成るグループから選ばれる化合物、またはその塩、エステル、誘導体、または代謝産物。
【請求項5】
表10.1、表10.2、表10.3、表10.4、表24、表25、表26、表27、表28、表29、または表30に示されるNMRデータを含む化合物。
【請求項6】
化学式:3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21,22-O-ジアンゲロイル-3β, 15α, 16α, 21β, 22α, 28-ヘキサヒドロキシオレアン-12-エンを含む化合物。
【請求項7】
化学式:3-O-[β-D-ガラクトピラノシル(1->2)]-α-L-アラビノフラノシル(1->3)-β-D-グルクロノピラノシル-21-O-(3,4-ジアンゲロイル)-α-L-ラムノピラノシル-22-O-アセチル-3β, 16α, 21β, 22α, 28-ペンタヒドロキシオレアン-12-エンを含む化合物。
【請求項8】
化合物であって、動作的に結合される
(a)糖;
(b)トリテルペンまたはサポゲニン;
(c)炭素21および22における側鎖、またはアンゲロイル基、
を含むことによって形成される前記化合物。
【請求項9】
化合物であって、
(a)トリテルペンまたはサポゲニン;
(b)トリテルペンまたはサポゲニンに付着する糖基;
(c)トリテルペンまたはサポゲニンの炭素21および22に付着する側鎖、
を含む前記化合物。
【請求項10】
前記側鎖はアンゲロイル基であることを特徴とする、請求項9の化合物。
【請求項11】
二つ以上の糖および一つ以上のアンゲロイル基を含むことを特徴とする、請求項8または9のいずれか1項による化合物。
【請求項12】
トリテルペノイドサポニンのバックボーンに付着した三つの糖と二つのアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項13】
トリテルペノイドサポニンのバックボーンに付着した二つの糖と一つ以上のアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項14】
トリテルペノイドサポニンのバックボーンに付着した四つの糖と一つ以上のアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項15】
トリテルペノイドサポニンのバックボーンに付着した、全く無いか、一つ以上の糖と、一つ以上のアンゲロイル基とを含むトリテルペノイドサポニン。
【請求項16】
請求項1から15のいずれか1項による化合物の塩。
【請求項17】
構造が合成されるか、または天然供給源から単離されることを特徴とする、請求項1-15の化合物。
【請求項18】
腫瘍またはガン細胞増殖を抑制することが可能な組成物であって、請求項1から15のいずれか1項による化合物の有効量を含む前記組成物。
【請求項19】
前記ガンは卵巣ガンであることを特徴とする、請求項18の組成物。
【請求項20】
前記ガンは、乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、皮膚ガン、骨ガン、または脳のガンであることを特徴とする、請求項18の組成物。
【請求項21】
請求項1から15のいずれか1項による化合物の、ガン治療のための使用。
【請求項22】
腫瘍またはガン細胞増殖を抑制する方法であって、請求項1から15のいずれか1項による化合物の有効量を前記細胞に投与することを含む前記方法。
【請求項23】
請求項1から15のいずれか1項による化合物、および適切な担体を含む組成物。
【請求項24】
請求項1から15のいずれか1項による化合物の有効量、および、製薬学的に受容可能な担体を含む製薬組成物。
【請求項25】
腫瘍またはガン細胞増殖を抑制するのに効果的な、請求項1から15のいずれか1項による化合物を含む組成物。
【請求項26】
前記ガンは卵巣ガンであることを特徴とする、請求項25の組成物。
【請求項27】
請求項1から15のいずれか1項による化合物を含む組成物であって、
遺尿症の治療;膀胱の弛緩;大脳皮質および小脳反応の改善;余分な深度睡眠進入の防止;膀胱壁の感覚性伸長受容器を改善し中枢神経系に正確な信号を送るようにする;排尿切迫または頻尿を引き起こすストレスまたは神経緊張、加齢、反射亢進、からの膀胱の解放;Achによって収縮する膀胱組織の緩和;AChEの抑制;抗炎症作用の実現;ウィルスの抑制;ヒト免疫不全ウィルスプロテアーゼの抑制;コレステロールおよびトリグリセリドの血中濃度の低下;脳の加齢を防止し、記憶力を改善、大脳機能を改善する;遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病の治療;関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療;インポテンツおよび早漏の治療;膀胱機能の改善;膀胱ガン細胞増殖の抑制;深度睡眠の抑制;目覚め意識の向上;抗利尿ホルモン(ADH)の放出、分解、および摂取、およびその受容体の修飾;副腎皮質ホルモン(ACTH)の放出、分解、および摂取、およびその受容体の修飾;5-ヒドロキシトリプタミンの放出、分解、および摂取、およびその受容体の修飾; アセチルコリン(Ach)の放出、分解、および摂取、およびその受容体の修飾;アドレナリン(AD)の放出、分解、および摂取、およびその受容体の修飾;ドーパミン(DA)の放出、分解、および摂取、およびその受容体の修飾;ノルエピネフィリン(NE)の放出、分解、および摂取、およびその受容体の修飾;睡眠麻痺の防止;神経ペプチドの形成、放出、分解、および活性、およびその受容体の修飾;乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンのようなガンの治療;肺および膀胱機能の改善;および、骨ガンの治療
が可能な前記組成物。
【請求項28】
Xanthoceras sorbifoliaから得られる治療的化合物の特定法であって、
(a)Xanthoceras Sorbifolia粉末を、適当量の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;
(b)有機抽出物を収集すること;
(c)有機抽出物を有機溶媒と共に適当時間環流して第二抽出物を形成すること;
(c)第二抽出物から有機溶媒を除去すること;
(d)第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物を形成すること;
(e)Xanthoceras Sorbifolia抽出物をHPLCクロマトグラフィーを用いて特性解明すること;
(f)Xanthoceras Sorbifolia抽出物を、HPLCクロマトグラフィーの結果に基づいて成分に分離すること;
(g)細胞傷害性に関して各成分をスクリーニングすること;
(h)細胞活性アッセイを用いて各成分を分析し、活性成分を確定すること;
(i)活性成分を精製すること;および、
(j)活性成分における化合物の化学的構造をNMR分析によって確定すること
の諸工程を含む前記方法。
【請求項29】
Xanthoceras sorbifoliaから得られる治療的化合物の特定法であって、
(a)Xanthoceras Sorbifolia抽出物を獲得すること;
(b)Xanthoceras Sorbifolia抽出物をHPLCクロマトグラフィーを用いて特性解明すること;
(c)Xanthoceras Sorbifolia抽出物を、HPLCクロマトグラフィーの結果に基づいて成分に分離すること;
(d)各成分を細胞傷害性に関してスクリーニーングすること;
(e)細胞活性アッセイを用いて各成分を分析し、活性成分を確定すること;
(f)活性成分を精製すること;および、
(g)活性成分における化合物の化学的構造をNMR分析によって確定すること
の諸工程を含む前記方法。
【請求項30】
前記Xanthoceras Sorbifolia粉末は、Xanthoceras Sorbifolia天然木の種皮、枝、幹、葉、核、根、樹皮、または種殻から得られることを特徴とする、請求項28の方法。
【請求項31】
前記有機溶媒は、エタノール、メタノール、エーテル、クロロフォルム、アルコール、またはアセトンであることを特徴とする、請求項28または29のいずれかの方法。
【請求項32】
前記Xanthoceras Sorbifolia粉末の、前記有機溶媒に対する比率は、1:2の比であることを特徴とする、請求項28または29のいずれかの方法。
【請求項33】
(a)の、前記抽出工程は、4-5回で、各回20-35時間であることを特徴とする、請求項28の方法。
【請求項34】
前記環流工程(c)は、2-3回実行されることを特徴とする、請求項28の方法。
【請求項35】
前記環流工程(c)は、80℃で実行されることを特徴とする、請求項28の方法。
【請求項36】
前記細胞活性アッセイはMTTアッセイであることを特徴とする、請求項28または29のいずれかの方法。
【請求項37】
サポニンを含む、Xanthoceras Sorbifolia抽出物を含む組成物。
【請求項38】
Xanthoceras Sorbifoliaから抽出物を調製する方法であって、
i. Xanthoceras Sorbifolia粉末を、適当量の1種以上の有機溶媒によって適当時間抽出して、有機抽出物を形成すること;
ii. 有機抽出物を収集すること;
iii. 有機抽出物を有機溶媒と適当な時間環流して第二抽出物を形成すること;
iv. 第二抽出物から有機溶媒を除去すること;および、
v. 第二抽出物を乾燥し滅菌して、Xanthoceras Sorbifolia抽出物粉末を形成すること、
の諸工程を含む前記方法。
【請求項39】
前記Xanthoceras Sorbifolia粉末は、Xanthoceras Sorbifolia天然木の種皮、枝、幹、葉、核、根、樹皮、または種殻から調製されることを特徴とする、請求項38の方法。
【請求項40】
前記有機溶媒は、エタノール、メタノール、エーテル、クロロフォルム、アルコール、またはアセトンであることを特徴とする、請求項38の方法。
【請求項41】
前記Xanthoceras Sorbifolia粉末の、前記有機溶媒に対する比率は、1:2の比であることを特徴とする、請求項38の方法。
【請求項42】
(i)の、前記抽出工程は、4-5回で、各回20-35時間であることを特徴とする、請求項38の方法。
【請求項43】
前記環流工程(iii)は、2-3回実行されることを特徴とする、請求項38の方法。
【請求項44】
前記環流工程(iii)は、80℃で実行されることを特徴とする、請求項38の方法。
【請求項45】
請求項38の抽出物の有効量を含む、腫瘍またはガン細胞増殖を抑制することが可能な組成物。
【請求項46】
前記ガンは卵巣ガンであることを特徴とする、請求項45の組成物。
【請求項47】
前記ガンは骨ガンであることを特徴とする、請求項45の組成物。
【請求項48】
前記ガンは膀胱ガンであることを特徴とする、請求項45の組成物。
【請求項49】
前記ガンは前立腺ガンであることを特徴とする、請求項45の組成物。
【請求項50】
前記ガンは、乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、皮膚ガン、骨ガン、または脳のガンであることを特徴とする、請求項45の組成物。
【請求項51】
請求項37の抽出物を含む組成物であって、
遺尿症の治療;膀胱の弛緩;大脳皮質および小脳反応の改善;余分な深度睡眠進入の防止;膀胱壁の感覚性伸長受容器を改善し中枢神経系に正確な信号を送るようにする;排尿切迫または頻尿を引き起こすストレスまたは神経緊張、加齢、反射亢進、からの膀胱の解放;Achによって収縮する膀胱組織の緩和;AChEの抑制;抗炎症作用の実現;ウィルスの抑制;ヒト免疫不全ウィルスプロテアーゼの抑制;コレステロールおよびトリグリセリドの血中濃度の低下;脳の加齢を防止し、記憶力を改善、大脳機能を改善する;遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病の治療;関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療;インポテンツおよび早漏の治療;膀胱機能の改善;膀胱ガン細胞増殖の抑制;深度睡眠の抑制;目覚め意識の向上;抗利尿ホルモン(ADH)の放出、分解、および摂取、およびその受容体の修飾;副腎皮質ホルモン(ACTH)の分泌、分解、および摂取、およびその受容体の修飾;5-ヒドロキシトリプタミンの放出、分解、および摂取、およびその受容体の修飾; アセチルコリン(Ach)の放出、分解、および摂取、およびその受容体の修飾;アドレナリン(AD)の放出、分解、および摂取、およびその受容体の修飾;ドーパミン(DA)の放出、分解、および摂取、およびその受容体の修飾;ノルエピネフィリン(NE)の放出、分解、および摂取、およびその受容体の修飾;睡眠麻痺の防止;神経ペプチドの形成、放出、分解、および活性、およびその受容体の修飾;乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンのようなガンの治療;肺および膀胱機能の改善;および、骨ガンの治療
が可能な前記組成物。
【請求項52】
Xanthoceras Sorbifoliaの抽出物を含む組成物であって、該抽出物は、サポニンまたはアルカロイドまたはフラボノールまたはフラボノールまたはジヒドロフラボノールまたはフェノロイドまたは有機酸またはサッカリドまたはタンパクまたはグリコシドまたはクマリンまたはタンニンまたは芳香族酸または脂肪性有機酸またはテルペノイド有機酸、または上記の任意の組み合わせを含み、該抽出物は、Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られることを特徴とする、前記組成物。
【請求項53】
請求項52の抽出物を含む組成物であって、
遺尿症の治療;膀胱の弛緩;大脳皮質および小脳反応の改善;余分な深度睡眠進入の防止;膀胱壁の感覚性伸長受容器を改善し中枢神経系に正確な信号を送るようにする;排尿切迫または頻尿を引き起こすストレスまたは神経緊張、加齢、反射亢進、からの膀胱の解放;Achによって収縮する膀胱組織の緩和;AChEの抑制;抗炎症作用の実現;ウィルスの抑制;ヒト免疫不全ウィルスプロテアーゼの抑制;コレステロールおよびトリグリセリドの血中濃度の低下;脳の加齢を防止し、記憶力を改善、大脳機能を改善する;遺尿、頻尿、尿失禁、痴呆、知能衰弱およびアルツハイマー病、自閉症、脳外傷、パーキンソン病の治療;関節炎、リューマチ、循環不全、アテローム硬化症、レイノー症候群、狭心症、心臓障害、冠状動脈性心疾患、頭痛、眩暈、腎臓障害の治療;インポテンツおよび早漏の治療;膀胱機能の改善;膀胱ガン細胞増殖の抑制;深度睡眠の抑制;目覚め意識の向上;抗利尿ホルモン(ADH)の放出、分解、および摂取、およびその受容体の修飾;副腎皮質ホルモン(ACTH)の分泌、分解、および摂取、およびその受容体の修飾;5-ヒドロキシトリプタミンの放出、分解、および摂取、およびその受容体の修飾; アセチルコリン(Ach)の放出、分解、および摂取、およびその受容体の修飾;アドレナリン(AD)の放出、分解、および摂取、およびその受容体の修飾;ドーパミン(DA)の放出、分解、および摂取、およびその受容体の修飾;ノルエピネフィリン(NE)の放出、分解、および摂取、およびその受容体の修飾;睡眠麻痺の防止;神経ペプチドの形成、放出、分解、および活性、およびその受容体の修飾;乳ガン、白血球ガン、肝臓ガン、卵巣ガン、膀胱ガン、前立腺ガン、および脳のガンのようなガンの治療;肺および膀胱機能の改善;および、骨ガンの治療
が可能な前記組成物。
【請求項54】
請求項52の組成物を調製する方法であって、
(A)Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、エタノールで3回抽出して、エタノール抽出物を形成し;エタノール抽出物を濃縮して濃縮抽出物を形成し;濃縮抽出物を熱水で抽出して水性抽出物と水溶性抽出物を形成し;水性抽出物と水溶性抽出物を乾燥し、水溶性フラボン抽出物および水不溶性フラボン抽出物を形成する工程であって、フラボン抽出物は、フラボノール、フラボノール、ジヒドロフラボノール、フェノロイド、有機酸、その他を含む工程、または、
(B)Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、エタノール、メタノール、その他である有機溶媒で抽出して、有機抽出物を形成し;有機抽出物から有機溶媒を除去して、水性抽出物を形成し;水性抽出物を乾燥し、滅菌して抽出物を形成する工程であって、抽出物は、サポニン、サッカリド、タンパク、その他を含む工程、または、
(C) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、エタノール、メタノール、その他である有機溶媒で抽出し、抽出は、1:2の比で4-5回、各回20-35時間として有機抽出物を形成し;有機抽出物を収集し、80℃で2-3回環流して第2抽出物を形成し;第2抽出物を水に溶解して水溶液を形成し;水溶液をn-ブタノールで抽出して、n-ブタノール抽出物を形成し;n-ブタノール抽出物クロマトグラフィーを用いて処理して、未精製サポニン抽出物を形成する工程であって、未精製サポニン抽出物は、サポニンその他を含む工程、または、
(D)Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、0.5%NaOH溶液で抽出して、水性抽出物を形成し;水性抽出物を収集し、エーテルで抽出してエーテル抽出物を形成し;エーテル抽出物をHCLで中和して、中和化エーテル抽出物を形成し;中和化エーテル抽出物を濃縮し、酸性化し、クマリン抽出物を形成する工程であって、クマリン抽出物は、クマリン、クマリングリコシド、サッカリド、タンパク、その他を含む工程、または、
(E) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、水で、室温で24時間抽出して、水性抽出物を形成し;水性抽出物を60-70℃で1-2時間煮込んで第2水抽出物を形成し;第2抽出物をろ過してろ過抽出物を形成し;ろ過抽出物を濃縮して水性抽出物を形成する工程であって、水性抽出物は、糖、ポリサッカリド、グリコシド、サポニン、タンニン、その他を含む工程、または、
(F) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から得られた文冠果の粉末を、水で抽出し、抽出は1:6の比で3-4回、各回10-15時間として水性抽出物を形成し;水性抽出物を収集し、NaOHでアルカリ化し、pH10-12のアルカリ化水性抽出物を形成し;アルカリ化水性抽出物をトルオールで抽出して、トルオール抽出物を形成し;トルオール抽出物を、pH5-7の、2%ジカルボキシル溶液中に通過させてジカルボキシル溶液を形成し;ジカルボキシル溶液を減圧下に濃縮して未精製アルカロイド抽出物を形成する工程であって、アルカロイド抽出物は、アルカロイド、クマリン、サッカリド、タンパク、その他を含む工程、または、
(G) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、10%HCLで抽出して酸性溶液を形成し;酸性溶液を、エーテルまたはベンゾールである有機溶媒で抽出して、有機抽出物を形成し;有機抽出物を5-10%のNaHCO3で抽出してNaHCO3抽出物を形成し;NaHCO3抽出物を酸化し、ろ過して堆積物を形成し;堆積物を有機溶媒で抽出して第2有機抽出物を形成し;第2抽出物から有機溶媒を除去して未精製有機酸抽出物を形成する工程であって、有機酸抽出物は、芳香族有機酸、脂肪族有機酸、テルペノイド有機酸、サッカリド、タンパク、その他を含む工程、または、
(H) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、95%エタノールで抽出してエタノール抽出物を形成し;エタノール抽出物を減圧下に濃縮してタンニン抽出物を形成する工程、または、
(I) Xanthoceras Sorbifoliaの葉または種子または種殻または根または樹皮または木質または枝または幹から作製された文冠果の粉末を、1:1比のアセトン-水溶媒によって2-7日抽出してアセトン-水抽出物を形成し;50℃でアセトン-水抽出物からアセトンを除去して濃縮抽出物を形成し;濃縮抽出物をろ過してろ過抽出物を形成し;ろ過抽出物をエーテルで抽出して水性抽出物を形成し;水性抽出物を酢酸エチルおよびn-ブタノールで抽出して、タンニン抽出物を含む、酢酸エチルおよびn-ブタノール抽出物を形成する工程であって、タンニン抽出物は、タンニン、有機酸、サッカリド、タンパク、その他を含む工程、
を含む前記方法。
【請求項55】
Wnt経路に関連する成分、またはその受容体を調節して、ガンの増殖を阻止すること;または、Ras-MAPキナーゼカスケードの成分または受容体を調節すること;または、Ras-依存性経路、またはMyc経路を調節すること;または、チェックポイント機構を再び活性化して、被験体におけるガン細胞増殖を阻止すること;または、細胞外成長に関連する成分、または受容体を調節すること;または、RasおよびMAPキナーゼに関連する成分を調節してガンの増殖を阻止すること;Myc細胞増殖成分または受容体を調節して、腫瘍細胞の分裂を阻止すること;TGF-アルファの成分または受容体を調節すること;または、TGF-ベータの成分または受容体を調節すること;または、E6およびE7タンパクを調節し、タンパクRbおよびp53を放出して異常な細胞の分裂を阻止すること;または、前記タンパクを調節し、またはそれらの反応して、ガン細胞の死をもたらすこと;p53経路の成分、または受容体を調節して、ガン細胞の分裂を阻止すること;細胞における自殺シグナルを解き放つこと;または、BMP、FGF、Jak-Jnk-STATおよびJun-fosの成分および受容体を調節すること;または、グルココルチコイド受容体またはエストロゲン受容体またはEGF受容体を調節すること、
が可能な組成物であって、請求項1-15のいずれか1項の化合物、または、請求項37の化合物の有効量を含む、前記組成物。
【請求項56】
尿量を低減する、または排尿頻度を下げる組成物であって、請求項1-15のいずれか1項の化合物、または、請求項37の化合物の有効量を含む、前記組成物。
【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図21】


【図21A−B】


【図21C−D】


【図21E−F】


【図21G−H】


【図21I−J】


【図21K−L】


【図21M】


【図22】


【図23A】


【図23B】


【図23C】


【図23D】


【図23E】


【図24】


【図25A】


【図25B】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33A】


【図33B】


【図34】


【図35】


【図36】


【図37A】


【図37B】


【図38A−1】


【図38A−2】


【図38A−3】


【図38A−4】


【図38A−5】


【図38B】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47A】


【図47B】


【図47C】




【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図21】


【図21A−B】


【図21C−D】


【図21E−F】


【図21G−H】


【図21I−J】


【図21K−L】


【図21M】


【図22】


【図23A】


【図23B】


【図23C】


【図23D】


【図23E】


【図24】


【図25A】


【図25B】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33A】


【図33B】


【図34】


【図35】


【図36】


【図37A】


【図37B】


【図38A−1】


【図38A−2】


【図38A−3】


【図38A−4】


【図38A−5】


【図38B】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47A】


【図47B】


【図47C】


【公表番号】特表2007−508317(P2007−508317A)
【公表日】平成19年4月5日(2007.4.5)
【国際特許分類】
【出願番号】特願2006−534419(P2006−534419)
【出願日】平成16年10月8日(2004.10.8)
【国際出願番号】PCT/US2004/033359
【国際公開番号】WO2005/037200
【国際公開日】平成17年4月28日(2005.4.28)
【出願人】(506096888)パシフィック アロー リミテッド (4)
【Fターム(参考)】
【公表日】平成19年4月5日(2007.4.5)
【国際特許分類】
【出願日】平成16年10月8日(2004.10.8)
【国際出願番号】PCT/US2004/033359
【国際公開番号】WO2005/037200
【国際公開日】平成17年4月28日(2005.4.28)
【出願人】(506096888)パシフィック アロー リミテッド (4)
【Fターム(参考)】
[ Back to top ]

