iPS細胞用培養容器
【課題】iPS細胞の培養、分化誘導において、効率のより質の高いiPS細胞凝集体を形成する。
【解決手段】本発明は、2個以上のウェルを有するiPS細胞用培養容器であって、前記ウェルが、垂直方向における断面が略U字形状の底部及び、略円形の開口部を有し、かつ、前記底部内面の少なくとも曲面部分が細胞低接着性であると共に、前記底部内面の曲率半径(R')が、1.0mm以上、2.6mm以下であり、前記細胞低接着性の表面は、
水溶性樹脂を用いた細胞低接着化処理または細胞非接着化処理にて形成されることを特徴とするiPS細胞用培養容器であり、本発明のiPS用培養容器を用いることで、簡便に均一なiPS細胞の胚様体の形成を可能とし、さらに胚様体を用いたアッセイにも使用可能である。
【解決手段】本発明は、2個以上のウェルを有するiPS細胞用培養容器であって、前記ウェルが、垂直方向における断面が略U字形状の底部及び、略円形の開口部を有し、かつ、前記底部内面の少なくとも曲面部分が細胞低接着性であると共に、前記底部内面の曲率半径(R')が、1.0mm以上、2.6mm以下であり、前記細胞低接着性の表面は、
水溶性樹脂を用いた細胞低接着化処理または細胞非接着化処理にて形成されることを特徴とするiPS細胞用培養容器であり、本発明のiPS用培養容器を用いることで、簡便に均一なiPS細胞の胚様体の形成を可能とし、さらに胚様体を用いたアッセイにも使用可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、iPS細胞用培養容器に関する。
【背景技術】
【0002】
iPS細胞は、体細胞へ数種類の遺伝子を導入することにより、ES細胞(胚性幹細胞)のように非常に多くの細胞に分化できる分化万能性と、分裂増殖を経てもそれを維持できる自己複製能機能を持たせた細胞である。
未分化状態を維持したまま無限増殖するiPS細胞は、様々な組織細胞に分化する多分化能を有することから、分化により得られた組織を用いた移植治療、いわゆる再生医療の分野で様々な研究の対象となっている。また、患者本人の体細胞から樹立されることから、免疫拒絶や、さらには倫理面でのハードルが低く、再生医療の主力となりうる細胞である。
【0003】
iPS細胞を様々な組織に分化誘導するためには、ES細胞における胚様体(embryoid body:EB体)に相当するiPS細胞凝集体を形成させる方法が最も広く用いられておる。EB体の形成はin vitroでのES細胞の分化誘導におけるファーストステップとなる。また、細胞凝集体の形成はiPS細胞を培養容器に接着させない浮遊状態で培養することが必要であり、通常の培養容器を使用した接着培養では細胞凝集体は形成されず、接着・伸展し、非特異的な分化を開始する。
【0004】
iPS細胞を浮遊状態で培養するために最も広く用いられているのが懸垂培養(ハンギングドロップ培養)と呼ばれる方法である。ハンギングドロップ培養はその名のとおり、水滴状に垂れ下げた培養液の中で細胞を培養する方法である。すなわち、マルチウェルプレートの穴(ウェル)に、ミネラルオイルと緩衝液を添加し、マルチウェルプレートの蓋の各ウェル上に重なる位置にiPS細胞を含む培養懸濁液を液滴となるようにスポッティングし、マルチウェルプレートにかぶせて培養する。しかし、ハンギングドロップ法においては、細胞凝集体形成の成功率が低い、顕微鏡観察ができない、一度に形成できる細胞凝集体の量が少ない、操作が煩雑である、等の問題がある。
【0005】
特許文献1では、これら問題を解決するために、凹部を有する培養容器が記載されている。当該凹部に細胞を入れ、凝集体が形成されるが、開口幅が100μm〜300μmと狭く、また、容器形状も特殊であるので汎用性に高いとは言えない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−200748号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
特許文献1に記載の技術を以てしてもなお、iPS細胞から、効率よく、質の高いiPS細胞凝集体を形成するという観点から、改善の余地があった。
【0008】
そこで、本発明は、より高いレベルにて、効率よく、質の高いiPS細胞凝集体を形成することを可能にするiPS細胞用培養容器を提供することを目的としている。
【課題を解決するための手段】
【0009】
そこで、本発明者等が鋭意検討した結果、2個以上のウェルを有する培養容器において
、各ウェルの内面を、水溶性樹脂を用いて細胞低接着化処理または細胞非接着化処理し、かつ、所定の形状とすることにより、細胞凝集塊溶媒が可能となり、その結果上記目的を達成することができることを見出して、本発明を完成させた。
【0010】
すなわち、このような目的は、下記(1)〜(4)に記載の本発明により達成される。(1)2個以上のウェルを有するiPS細胞用培養容器であって、
前記ウェルが、垂直方向における断面が略U字形状の底部及び、略円形の開口部を有し、かつ、前記底部内面の少なくとも曲面部分が細胞低接着性であると共に、前記底部内面の曲率半径(R')が、1.0mm以上、2.6mm以下であり、
前記細胞低接着性の表面は、水溶性樹脂を用いた細胞低接着化処理または細胞非接着化処理にて形成されることを特徴とするiPS細胞用培養容器。
(2)前記水溶性樹脂が、下記式(Ia)または(Ib)で表される化合物である(1)項記載のiPS細胞用培養容器。
【化1】

【化2】

(3)前記ウェルの最下部面に細胞低接着性の表面を有するくぼみが少なくとも一つ内設されていることを特徴とする(1)項または(2)項記載のiPS細胞用培養容器。
(4)前記各ウェルの内面全体が、細胞低接着性であることを特徴とする(1)項から(3)項のいずれか一項に記載のiPS細胞用培養容器。
【0011】
本発明によれば、より高いレベルにて、効率よく、質の高いiPS細胞凝集塊を形成することが可能になる。
【図面の簡単な説明】
【0012】
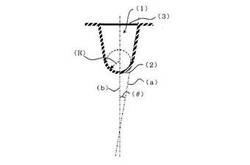
【図1】図1は、本発明によるiPS細胞培養容器の培養ウェルの断面を示す。
【図2】図2は、本発明によるウェルの最下部面に細胞低接着性の表面を有するくぼみの断面を示す。
【図3】図3は、本発明実施例1によるiPS細胞の凝集塊形成を示す。
【図4】図4は、本発明実施例2によるiPS細胞の凝集塊形成を示す。
【図5】図5は、本発明比較例1によるiPS細胞の培養状態を示す。
【図6】図6は、本発明比較例2によるiPS細胞の培養状態を示す。
【発明を実施するための形態】
【0013】
本発明の培養容器において重要な点は、図1にて示したように、ラウンドボトムやVボトムと呼ばれる側面が底面に向かって縮径し、縮径部分が半球若しくは円錐状のマルチウェルプレートを使用すると1ウェルに1個の細胞凝集塊が均一な大きさで形成されることであり、より質の高い細胞凝集塊を形成し、さらに胚様体を形成することを可能にする点にある。図1では、後述するように、垂直方向における断面が略U字形状の底部、及び、略円形の開口部を有するウェルを2個以上有し、かつ、前記底部内面の少なくとも曲面部分、好ましくはウェル内面全体が細胞低接着性であり、当該各ウェルの底部内面が所定の形状を有する態様を示す。このように縮径部分を円錐状、半球状になるようにウェルを形成することにより、細胞をウェルに播種した際に、細胞自身の自重により容器底面に集合し細胞凝集塊を形成しやすくなる。
【0014】
本発明の培養容器は、樹脂製の材料で成形することができる。この樹脂材料は、上記培養容器をディスポーザルタイプにすることができるのに加え、種々の形状を容易に成形することができる。上記樹脂材料としては、例えば、ポリプロピレン樹脂、ポリエチレン樹脂、エチレン-プロピレン共重合体等のポリオレフィン系樹脂または環状ポリオレフィン
系樹脂、ポリスチレン、アクリロニトリル−ブタジエン−スチレン系樹脂等のポリスチレン系樹脂、ポリカーボネート樹脂、ポリエチレンテレフタレート樹脂、ポリメチルメタクリレート樹脂等のメタクリル系樹脂、塩化ビニル樹脂、ポリブチレンテレフタレート樹脂、ポリアリレート樹脂、ポリサルホン樹脂、ポリエーテルサルホン樹脂、ポリエーテルエーテルケトン樹脂、ポリエーテルイミド樹脂、ポリテトラフルオロエチレン等のフッ素系樹脂、ポリメチルペンテン樹脂、ポリアクリロニトリル等のアクリル系樹脂、プロピオネート樹脂等の繊維素系樹脂等が挙げられる。これらの中でも培養容器に求められる成形性、滅菌性の点においてポリスチレン樹脂が特に好ましい。
【0015】
上記樹脂材料から本発明の培養容器を製造する場合、例えば射出成形、ブロー成形、インジェクションブロー成形により、製造することができる。
【0016】
また、本発明においては、各ウェルの底部内面の曲率半径(R')を2.6mm以下、好
ましくは2.0mm以下とする。これによりiPS細胞同士が充分な密度で集まり、より質の高い細胞凝集塊を形成することを可能にする。
また、底部内面の曲率半径(R')が2.6mmを越える従来の培養容器に比べて、ウェ
ル形状が底部(2)に向けて細くなるため、底部(2)から同じ高さで培地を吸引した場合の培地交換効率(培地全体量に対する吸引除去する培地量の割合)に優れる点も本発明の大きな特徴の一つである。
ES細胞培養であれば、底部内面の曲率半径(R')が3.5mm以下で有れば細胞凝集
塊であるEB体を作製するのに十分であるが、iPS細胞では3.5mmでは細胞が集まりが不十分であり、きれいな細胞凝集塊を作製できない。底部内面の曲率半径(R')が
2.6mm以下であれば、質の高い細胞凝集塊を形成することが可能である。
【0017】
更に、曲率半径(R')を1.0mm以上とすることにより、培養時に発生する死細胞
の底面への凝集が高密度になりすぎることなく倒立顕微鏡による顕鏡性に優れる為、ウェル内の細胞または胚様体の観察を正確に行うことができる。
【0018】
また、前述の略円形の開口部(3)の直径を4.0mm以上とすることでマルチディスペンサーを使用する場合の操作性に優れ、11.0mm以下とすることで培養容器1枚あたり48個以上の複数のウェルを設けることができる。
【0019】
ウェル(1)の容量は80μL以上、500μL以下であることが好ましい。こうすることで、1ウェルあたり1個の細胞、例えばマウスES細胞やヒトES細胞の胚様(EB)体を形成するに必要充分な量の培地を添加することができる。
より好ましくは80μL以上、200μL以下である。こうすることで、培地や試薬の使用量を減らすことができる。
【0020】
各培養ウェルは、以下の構造とすることがさらに好ましい。すなわち、図1に示すように、培養ウェル(1)の側面の稜線を上記培養ウェルの底部(2)を越えて延長した直線(a)と、上記開口部(3)の中心から垂直に前記培養ウェルの底部(2)を越えて延長した直線(b)と、が交差する角度(θ)が3°以上、30°以下であることが好ましい。こうすることで、培地中の細胞がより底部(2)に集まりやすくなり、更に培地交換の際のディスペンサーチップ操作も容易となる。5°以上、15°以下である。こうすることで略U字形状の底部(2)と側面がよりなだらかにつながる形状となり培地中の細胞が更に集まりやすくなり、より良好な形状のEB体を形成させることができる。
【0021】
また、図2に示したように、各ウェルの最下部面に細胞低接着性の表面を有するくぼみ(4)が少なくとも1つ内設されているのが好ましく、この構成により、播種した細胞が効率よくウェル最下部のくぼみに集まるため、細胞凝集塊の形成性に優れる。
【0022】
このくぼみ(4)の容量は限定されないが、1.0×10−8mL以上、5.0×10−2mL以下であれば、くぼみの中に細胞凝集塊が形成され、培地交換の際にくぼみの中の細胞凝集塊を吸い取らずに古い培地をディスペンサーで吸引する作業を容易におこなう事が出来る。くぼみの容量が、2.0×10−7mL以上、2.0×10−2mL以下であれば、くぼみの中の細胞凝集塊が成長しても、くぼみからはみ出すことなく、培地交換の際には古い培地の残量を少なくする事が出来るため好ましい。更に好ましくは、1.0×10−6mL以上、2.0×10−3mL以下であれば分化誘導研究に適したサイズの胚性幹細胞胚様体や刺激応答研究に適したサイズの上皮細胞凝集塊に対して効率よく培地交換をおこなう事が出来る。
【0023】
くぼみ(4)の形状は特に限定するものではないが、断面形状が略U字、略V字、略台形等の様に細胞が底部に集まりやすい形状であることが好ましく、略U字形状であれば細胞の凝集性に優れ、凝集塊形成後の位置的な安定性に優れるため特に好ましい。
【0024】
ひとつのウェルに内接されるくぼみの数は特に限定されず、必要に応じて1〜複数個形
成してもよい。但し、ウェルに播種した細胞がくぼみに集まるように、くぼみはウェルの最下部に形成されている必要がある。
【0025】
また、本発明においては、上述した各態様において、ウェルの細胞低接着性の表面は、以下の細胞低接着化処理または細胞非接着化処理を行うことで形成することができる。この細胞非接着化処理としては、基材表面の親水化処理であることが好ましい。ここで言うところの表面親水化処理には以下の処理方法がある。
(1)水溶性樹脂の培養容器内面での架橋固定
(2)親水性樹脂による表面塗布
【0026】
まず、(1)の方法について詳しく述べる。
この方法は、水溶性樹脂を培養容器内面に被覆させて架橋し水溶性被覆層を形成する水溶性樹脂被覆層を形成させることを特徴とする。
ここで言う水溶性樹脂とは、水分子とのイオンもしくは水素結合により水和し、その結果として水に溶解するものであり、言い換えれば、水溶性樹脂とは水に溶解するために分子内の主鎖に対して必要充分な量のイオン性もしくは極性の側鎖を持つ樹脂である。なお、ここで水溶性樹脂とは、25℃の水100gに対して1.0g以上溶解可能なものをいう。
【0027】
上記水溶性樹脂としては、例えば、ポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコール、ポリアクリルアミド、ポリメタアクリルアミド、ポリヒドロキシエチルメタアクリレート、ポリペンタエリスリトールトリアクリレート、ポリペンタエリスリトールテトラアクリレート、ポリジエチレングリコールジアクリレート、およびそれらを構成するモノマー同士の共重合体、また2−メタクリロイルオキシエチルホスホリルコリンと他のモノマー(例えばブチルメタクリレート等)との共重合体等が挙げられる。これらの中でもポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコールの中から選ばれる1種以上と上記反応基からなる構造が好ましい。これにより、種々の細胞に対する刺激を抑制し、細胞凝集塊の形成速度、形成率、および形成した細胞凝集塊の質を向上することができる。
【0028】
ここで、ポリ酢酸ビニルのケン化物とは、例えば、ポリビニルアルコールまたはビニルアルコールと他の化合物との共重合体をいう。さらには、例えば、ビニルアルコールと、親水基変性、疎水基変性、アニオン変性、カチオン変性、アミド基変性またはアセトアセチル基のような反応基変性させた変性酢酸ビニルのケン化物等も含まれる。
【0029】
また、前記水溶性樹脂として重合体を用いる場合、その平均重合度は、特に限定されないが、100〜10,000が好ましく、特に200〜5,000が好ましい。平均重合度が前記下限値未満であると細胞培養容器の表面に均一に皮膜を成形するのが困難となる場合があり、前記上限値を超えると前記水溶性樹脂の粘度が高くなり作業性が低下する場合がある。
【0030】
また、上記ポリ酢酸ビニルのケン化物を用いる場合、上記ポリ酢酸ビニルのケン化物のケン化度は特に限定されないが、該ポリ酢酸ビニル全体の20mol%以上、100mol%以下が好ましく、特に50mol%以上、95mol%以下が好ましい。
【0031】
このような水溶性樹脂としては、例えば下記式(Ia)または(Ib)で表される構成単位を含むものが好ましい。これにより、実用的な300〜500nmの波長で均一な皮膜を形成する事ができ、細胞の接着量を低減し、細胞凝集塊形成効果を低減する効果を特に向上することができる。
【0032】
【化3】

【0033】
【化4】

【0034】
前記水溶性樹脂の式(Ia)または(Ib)で表されるRはカルボニルとアミンを有するアルキル基であれば特に限定するものではないが、例えば下記式(II)で表されるものが好ましい。これにより前記極性の側鎖の合成が容易におこなえる。
細胞培養容器を、水溶性樹脂に浸漬する際、水溶性樹脂を溶媒に溶解した状態で浸漬することが好ましく、その際に使用する溶媒は水もしくは溶解度を高めるために水と有機溶媒の混合物を使用することができる。
【0035】
【化5】

【0036】
例えば、前記式(Ia)または(Ib)で示される水溶性樹脂を使用する場合には、5ないし40容量%のアルコール水溶液を前記溶媒に使用することで、水溶性樹脂の溶解性が高くなり、均一な被覆層を形成することができる。
溶解する水溶性樹脂の濃度は0.01ないし30重量%が好ましく、特に0.1ないし10重量%が好ましい。
ここで水溶性樹脂の濃度が低すぎても、高すぎても、均一な被覆層が得られず、充分な細胞の接着低減効果が得られず良好な細胞凝集塊が形成されない。
【0037】
上記水溶性樹脂を用いた被覆層の厚みとしては、100nm以上5,000nm以下が好ましく、150nm以上1,000nm以下がより好ましい。被覆層の厚みを上記下限値以上にすることにより細胞が基材から受ける物理的な刺激をより抑えることができ、厚みを上記上限値以下とすることにより被覆層に取り込まれるたんぱく質の量を少なくし、たんぱく質を介した細胞の接着を抑えることが出来るため、細胞凝集塊形成率を更に向上させることができる。
【0038】
上記水溶性樹脂を培養容器内面に被覆させる方法としては、例えば、スピンコート、ディッピング、または上記水溶性樹脂溶液を培養容器内面に分注した後、容器を傾けて溶液を排出する方法を用いることができる。この様な方法で培養容器内面に水溶性樹脂を接触させた後、培養容器内面に残留した水溶性樹脂溶液を乾燥させることで水溶性樹脂被覆層を形成することができる。
【0039】
本発明の製造方法においては、上記工程後に、上記水溶性樹脂被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程を有することを特徴とする。
上記水溶性樹脂被覆層を非水溶性硬化皮膜層とすることで、密度の高いイオン性もしくは極性の側鎖を持つ表面を構築することができる。この表面に構築されたイオン性もしくは極性の側鎖は、培養液と接触した際に、静電相互作用もしくは水素結合により水分子と水和し、培養容器表面は実質的に水分子の密な水和層となり、この水和層は細胞に対する基材表面からの刺激を抑制し、質的に良好な細胞凝集塊が迅速に形成されることとなる。こうすることで、培養液を接触させた際に、水溶性樹脂の被覆層が溶解、遊離することを防ぎ、培養容器として必要な耐水性を獲得することができる。
【0040】
上記水溶性樹脂被覆層を硬化させる方法は、特に限定するものではなく、水溶性樹脂の側鎖に、硬化させるための官能基、例えば放射線反応性、感光性、熱反応性の官能基を有する水溶性樹脂を導入し、この部分を硬化させることで可能となる。例えば、感光性の官能基であれば、ジアゾ基、アジド基、シンモナイル基等が挙げられ、また、熱反応性および放射線反応性の官能基であれば、ビニル基、エポキシ基等を挙げることができる。これ
らの中でも硬化処理を迅速におこなうことができ、簡易な設備で硬化させることができる感光性の官能基を有する水溶性樹脂が特に好ましい。
【0041】
上記感光性の官能基としては、式(Ia)、(Ib)に示したように、アジド基を含む官能基が特に好ましい。これを用いることにより、実用的な230〜500nmの波長で反応させることができ、更に優れた解像性により皮膜の形成性を向上することができる。このように、表面に予め水溶性樹脂被覆層を形成し、該被覆層を硬化させて非水溶性硬化皮膜層に変性する工程によって上記の厚みの被覆層と同等の厚みの皮膜層を得ることができる。
【0042】
水溶性樹脂を使用するもう一つの利点としては、硬化後に表面を水で洗浄することで、未反応の樹脂を容易に洗い流すことができるという点である。もし、硬化反応性が悪い等の原因で溶出物が確認された場合は、硬化後に洗浄工程を入れることにより、溶出物を低減し、更に良好な細胞凝集塊生成率を得ることができる。
【0043】
次に、(2)の方法について述べる。
塗布する親水性樹脂としては、ポリ−2−ヒドロキシエチルメタクリレート(ポリ−HEMA)、ホスホリルコリン基含有高分子化合物、ポリエチレングリコール鎖含有高分子化合物等があるが、特にこれらに限定する物ではない。
【0044】
例えば、ポリ−HEMAの2%エタノール溶液を、容器内に100μL分注しエタノールを蒸発させ容器表面にポリ−HEMAの層を形成させることができる。蒸発後、超純水や緩衝液で洗浄することで、容器表面に吸着していない余分なポリ−HEMA分子を除去することができる。
(1)の方法に比べ、(2)の方法は表面の親水化が高分子化合物の容器表面への吸着現象だけであるので効果は弱いが、方法が簡便であることが利点である。
【0045】
培養容器の必須条件である滅菌に関しては、例えば、エチレンオキサイドガス滅菌、乾熱滅菌、蒸気滅菌、放射線滅菌等が挙げられるが、γ線あるいは電子線を用いた放射線滅菌が好ましく、大量生産を行う場合は放射線透過性の点でγ線滅菌が特に好ましい。
放射線の吸収線量については特に限定するものではないが、吸収線量が低すぎると滅菌性は確保されず、高すぎると細胞培養容器および被覆層が劣化してしまう場合がある。
【0046】
前記のようにして作製された培養容器は、以下の特徴を有する。
基材表面が細胞非接着処理された円錐状、または半球状であるので細胞が底部に集まり易く、細胞凝集塊を形成しやすい。
また、形成した細胞凝集塊をそのままのプレートで蛍光、発光測定に用いることが可能である。
【実施例】
【0047】
以下、本発明を実施例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0048】
(実施例1)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)樹脂を用いて、射出成形により96ウェルマルチウェルプレートを成形した。各ウェルの形状は、図1に示したとおりであり、ウェル底面の曲率半径を2.0mmとした。
【0049】
得られたプレートにプラズマ処理装置(BRANSON/IPC社製 SERIES7000)を用いてプラズマ処理(酸素プラズマ10分)を行い、前処理としてプレート表
面に濡れ性を付与した。
【0050】
次に、水溶性樹脂として側鎖にアジド基を有するポリビニルアルコール(東洋合成工業社製 AWP:式(Ia)の化合物(水溶性樹脂の平均重合度1600、感光基の導入率0.65mol%)を着色樹脂にて遮光したポリプロプレン容器中で、25容量%エタノール水溶液に溶解し、0.3重量%の溶液を調整した。
【0051】
上述のプレートに、自動分注機(BioTec社製、オートセラウォッシャーAMW−96SX)を使用し、1ウェルにつき100μLの前述の水溶性樹脂溶液を加え、1分間浸漬した後、プレートを裏返して溶液を充分廃棄し、25℃で17時間一次乾燥した後、UVランプで250nmのUV光を2.0mW/cm2×30秒間照射して水溶性樹脂を硬化した後、超純水で3回繰り返し洗浄し、乾燥後、γ線を吸収線量5.8kGyで照射(ラジエ工業株式会社)して、本発明の培養容器(プレート)を得た。
【0052】
(実施例2)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)樹脂を用いて、射出成形により96ウェルマルチウェルプレートを成形し、ウェル底面の曲率半径を2.6mmとした以外は実施例1と同様にして培養容器(プレート)を得た。
【0053】
(比較例1)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)樹脂を用いて、射出成形により96ウェルマルチウェルプレートを成形し、ウェル底面の曲率半径3.2mmとした以外は実施例1と同様にして培養容器(プレート)を得た。
【0054】
(比較例2)
ウェルの底面が平面である35φシャーレ(住友ベークライト社製、MS−1035R)を使用した。
【0055】
実施例1、2および比較例1、2にて得られた培養容器のそれぞれについて、以下の評価を行った。
(1)ヒトiPS細胞を用いた胚様体の形成
ヒトiPS細胞201B7(iPSアカデミアジャパンより入手)をY−27632(CALBIOCHEM社製、688000)を10μM含む培養液(ダルベッコ改変MEM/F12培地+20%Knockout serum repracement+2mM グルタミン+1%非必須アミノ酸+0.1mMメルカプトエタノール)中で1時間培養した後、TrypLE Select(GIBCO社製)を使用し、ヒトiPS細胞を
単細胞に分散させ、Y−27632を10μM含む培養液を用いて、(1)90,000cells/mL、(2)60,000cells/mL、(3)30,000cells/mLで分散させた細胞懸濁液を調製し、前述のプレートに100μL/ウェルずつ分注し、37℃、5%CO2雰囲気下にて培養し、分注後、30分、2時間、4時間、96時間の時点で各ウェルについて胚様体の形成を顕微鏡下で確認した。
【0056】
図3,4に示すように本発明によるiPS細胞培養容器のウェル中では、正確に1個の凝集塊が形成されていることが分かる。一方、図5の比較例1では、主となる凝集塊の他に
小さい複数の凝集塊が形成されており、ウェル底面の曲率半径3.2mmでは、iPS細胞の単一の凝集塊が形成しにくいことがわかった。また、比較例2のウェル平面の培養器では、図6の様に凝集塊が複数個形成されており、本発明の目的には合わないことが明確となった。
【産業上の利用可能性】
【0057】
本発明のiPS用培養容器を用いることで、細胞機能を維持した培養が可能であり、さらに機能細胞を用いたアッセイにも使用可能である。
【技術分野】
【0001】
本発明は、iPS細胞用培養容器に関する。
【背景技術】
【0002】
iPS細胞は、体細胞へ数種類の遺伝子を導入することにより、ES細胞(胚性幹細胞)のように非常に多くの細胞に分化できる分化万能性と、分裂増殖を経てもそれを維持できる自己複製能機能を持たせた細胞である。
未分化状態を維持したまま無限増殖するiPS細胞は、様々な組織細胞に分化する多分化能を有することから、分化により得られた組織を用いた移植治療、いわゆる再生医療の分野で様々な研究の対象となっている。また、患者本人の体細胞から樹立されることから、免疫拒絶や、さらには倫理面でのハードルが低く、再生医療の主力となりうる細胞である。
【0003】
iPS細胞を様々な組織に分化誘導するためには、ES細胞における胚様体(embryoid body:EB体)に相当するiPS細胞凝集体を形成させる方法が最も広く用いられておる。EB体の形成はin vitroでのES細胞の分化誘導におけるファーストステップとなる。また、細胞凝集体の形成はiPS細胞を培養容器に接着させない浮遊状態で培養することが必要であり、通常の培養容器を使用した接着培養では細胞凝集体は形成されず、接着・伸展し、非特異的な分化を開始する。
【0004】
iPS細胞を浮遊状態で培養するために最も広く用いられているのが懸垂培養(ハンギングドロップ培養)と呼ばれる方法である。ハンギングドロップ培養はその名のとおり、水滴状に垂れ下げた培養液の中で細胞を培養する方法である。すなわち、マルチウェルプレートの穴(ウェル)に、ミネラルオイルと緩衝液を添加し、マルチウェルプレートの蓋の各ウェル上に重なる位置にiPS細胞を含む培養懸濁液を液滴となるようにスポッティングし、マルチウェルプレートにかぶせて培養する。しかし、ハンギングドロップ法においては、細胞凝集体形成の成功率が低い、顕微鏡観察ができない、一度に形成できる細胞凝集体の量が少ない、操作が煩雑である、等の問題がある。
【0005】
特許文献1では、これら問題を解決するために、凹部を有する培養容器が記載されている。当該凹部に細胞を入れ、凝集体が形成されるが、開口幅が100μm〜300μmと狭く、また、容器形状も特殊であるので汎用性に高いとは言えない。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−200748号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
特許文献1に記載の技術を以てしてもなお、iPS細胞から、効率よく、質の高いiPS細胞凝集体を形成するという観点から、改善の余地があった。
【0008】
そこで、本発明は、より高いレベルにて、効率よく、質の高いiPS細胞凝集体を形成することを可能にするiPS細胞用培養容器を提供することを目的としている。
【課題を解決するための手段】
【0009】
そこで、本発明者等が鋭意検討した結果、2個以上のウェルを有する培養容器において
、各ウェルの内面を、水溶性樹脂を用いて細胞低接着化処理または細胞非接着化処理し、かつ、所定の形状とすることにより、細胞凝集塊溶媒が可能となり、その結果上記目的を達成することができることを見出して、本発明を完成させた。
【0010】
すなわち、このような目的は、下記(1)〜(4)に記載の本発明により達成される。(1)2個以上のウェルを有するiPS細胞用培養容器であって、
前記ウェルが、垂直方向における断面が略U字形状の底部及び、略円形の開口部を有し、かつ、前記底部内面の少なくとも曲面部分が細胞低接着性であると共に、前記底部内面の曲率半径(R')が、1.0mm以上、2.6mm以下であり、
前記細胞低接着性の表面は、水溶性樹脂を用いた細胞低接着化処理または細胞非接着化処理にて形成されることを特徴とするiPS細胞用培養容器。
(2)前記水溶性樹脂が、下記式(Ia)または(Ib)で表される化合物である(1)項記載のiPS細胞用培養容器。
【化1】

【化2】

(3)前記ウェルの最下部面に細胞低接着性の表面を有するくぼみが少なくとも一つ内設されていることを特徴とする(1)項または(2)項記載のiPS細胞用培養容器。
(4)前記各ウェルの内面全体が、細胞低接着性であることを特徴とする(1)項から(3)項のいずれか一項に記載のiPS細胞用培養容器。
【0011】
本発明によれば、より高いレベルにて、効率よく、質の高いiPS細胞凝集塊を形成することが可能になる。
【図面の簡単な説明】
【0012】
【図1】図1は、本発明によるiPS細胞培養容器の培養ウェルの断面を示す。
【図2】図2は、本発明によるウェルの最下部面に細胞低接着性の表面を有するくぼみの断面を示す。
【図3】図3は、本発明実施例1によるiPS細胞の凝集塊形成を示す。
【図4】図4は、本発明実施例2によるiPS細胞の凝集塊形成を示す。
【図5】図5は、本発明比較例1によるiPS細胞の培養状態を示す。
【図6】図6は、本発明比較例2によるiPS細胞の培養状態を示す。
【発明を実施するための形態】
【0013】
本発明の培養容器において重要な点は、図1にて示したように、ラウンドボトムやVボトムと呼ばれる側面が底面に向かって縮径し、縮径部分が半球若しくは円錐状のマルチウェルプレートを使用すると1ウェルに1個の細胞凝集塊が均一な大きさで形成されることであり、より質の高い細胞凝集塊を形成し、さらに胚様体を形成することを可能にする点にある。図1では、後述するように、垂直方向における断面が略U字形状の底部、及び、略円形の開口部を有するウェルを2個以上有し、かつ、前記底部内面の少なくとも曲面部分、好ましくはウェル内面全体が細胞低接着性であり、当該各ウェルの底部内面が所定の形状を有する態様を示す。このように縮径部分を円錐状、半球状になるようにウェルを形成することにより、細胞をウェルに播種した際に、細胞自身の自重により容器底面に集合し細胞凝集塊を形成しやすくなる。
【0014】
本発明の培養容器は、樹脂製の材料で成形することができる。この樹脂材料は、上記培養容器をディスポーザルタイプにすることができるのに加え、種々の形状を容易に成形することができる。上記樹脂材料としては、例えば、ポリプロピレン樹脂、ポリエチレン樹脂、エチレン-プロピレン共重合体等のポリオレフィン系樹脂または環状ポリオレフィン
系樹脂、ポリスチレン、アクリロニトリル−ブタジエン−スチレン系樹脂等のポリスチレン系樹脂、ポリカーボネート樹脂、ポリエチレンテレフタレート樹脂、ポリメチルメタクリレート樹脂等のメタクリル系樹脂、塩化ビニル樹脂、ポリブチレンテレフタレート樹脂、ポリアリレート樹脂、ポリサルホン樹脂、ポリエーテルサルホン樹脂、ポリエーテルエーテルケトン樹脂、ポリエーテルイミド樹脂、ポリテトラフルオロエチレン等のフッ素系樹脂、ポリメチルペンテン樹脂、ポリアクリロニトリル等のアクリル系樹脂、プロピオネート樹脂等の繊維素系樹脂等が挙げられる。これらの中でも培養容器に求められる成形性、滅菌性の点においてポリスチレン樹脂が特に好ましい。
【0015】
上記樹脂材料から本発明の培養容器を製造する場合、例えば射出成形、ブロー成形、インジェクションブロー成形により、製造することができる。
【0016】
また、本発明においては、各ウェルの底部内面の曲率半径(R')を2.6mm以下、好
ましくは2.0mm以下とする。これによりiPS細胞同士が充分な密度で集まり、より質の高い細胞凝集塊を形成することを可能にする。
また、底部内面の曲率半径(R')が2.6mmを越える従来の培養容器に比べて、ウェ
ル形状が底部(2)に向けて細くなるため、底部(2)から同じ高さで培地を吸引した場合の培地交換効率(培地全体量に対する吸引除去する培地量の割合)に優れる点も本発明の大きな特徴の一つである。
ES細胞培養であれば、底部内面の曲率半径(R')が3.5mm以下で有れば細胞凝集
塊であるEB体を作製するのに十分であるが、iPS細胞では3.5mmでは細胞が集まりが不十分であり、きれいな細胞凝集塊を作製できない。底部内面の曲率半径(R')が
2.6mm以下であれば、質の高い細胞凝集塊を形成することが可能である。
【0017】
更に、曲率半径(R')を1.0mm以上とすることにより、培養時に発生する死細胞
の底面への凝集が高密度になりすぎることなく倒立顕微鏡による顕鏡性に優れる為、ウェル内の細胞または胚様体の観察を正確に行うことができる。
【0018】
また、前述の略円形の開口部(3)の直径を4.0mm以上とすることでマルチディスペンサーを使用する場合の操作性に優れ、11.0mm以下とすることで培養容器1枚あたり48個以上の複数のウェルを設けることができる。
【0019】
ウェル(1)の容量は80μL以上、500μL以下であることが好ましい。こうすることで、1ウェルあたり1個の細胞、例えばマウスES細胞やヒトES細胞の胚様(EB)体を形成するに必要充分な量の培地を添加することができる。
より好ましくは80μL以上、200μL以下である。こうすることで、培地や試薬の使用量を減らすことができる。
【0020】
各培養ウェルは、以下の構造とすることがさらに好ましい。すなわち、図1に示すように、培養ウェル(1)の側面の稜線を上記培養ウェルの底部(2)を越えて延長した直線(a)と、上記開口部(3)の中心から垂直に前記培養ウェルの底部(2)を越えて延長した直線(b)と、が交差する角度(θ)が3°以上、30°以下であることが好ましい。こうすることで、培地中の細胞がより底部(2)に集まりやすくなり、更に培地交換の際のディスペンサーチップ操作も容易となる。5°以上、15°以下である。こうすることで略U字形状の底部(2)と側面がよりなだらかにつながる形状となり培地中の細胞が更に集まりやすくなり、より良好な形状のEB体を形成させることができる。
【0021】
また、図2に示したように、各ウェルの最下部面に細胞低接着性の表面を有するくぼみ(4)が少なくとも1つ内設されているのが好ましく、この構成により、播種した細胞が効率よくウェル最下部のくぼみに集まるため、細胞凝集塊の形成性に優れる。
【0022】
このくぼみ(4)の容量は限定されないが、1.0×10−8mL以上、5.0×10−2mL以下であれば、くぼみの中に細胞凝集塊が形成され、培地交換の際にくぼみの中の細胞凝集塊を吸い取らずに古い培地をディスペンサーで吸引する作業を容易におこなう事が出来る。くぼみの容量が、2.0×10−7mL以上、2.0×10−2mL以下であれば、くぼみの中の細胞凝集塊が成長しても、くぼみからはみ出すことなく、培地交換の際には古い培地の残量を少なくする事が出来るため好ましい。更に好ましくは、1.0×10−6mL以上、2.0×10−3mL以下であれば分化誘導研究に適したサイズの胚性幹細胞胚様体や刺激応答研究に適したサイズの上皮細胞凝集塊に対して効率よく培地交換をおこなう事が出来る。
【0023】
くぼみ(4)の形状は特に限定するものではないが、断面形状が略U字、略V字、略台形等の様に細胞が底部に集まりやすい形状であることが好ましく、略U字形状であれば細胞の凝集性に優れ、凝集塊形成後の位置的な安定性に優れるため特に好ましい。
【0024】
ひとつのウェルに内接されるくぼみの数は特に限定されず、必要に応じて1〜複数個形
成してもよい。但し、ウェルに播種した細胞がくぼみに集まるように、くぼみはウェルの最下部に形成されている必要がある。
【0025】
また、本発明においては、上述した各態様において、ウェルの細胞低接着性の表面は、以下の細胞低接着化処理または細胞非接着化処理を行うことで形成することができる。この細胞非接着化処理としては、基材表面の親水化処理であることが好ましい。ここで言うところの表面親水化処理には以下の処理方法がある。
(1)水溶性樹脂の培養容器内面での架橋固定
(2)親水性樹脂による表面塗布
【0026】
まず、(1)の方法について詳しく述べる。
この方法は、水溶性樹脂を培養容器内面に被覆させて架橋し水溶性被覆層を形成する水溶性樹脂被覆層を形成させることを特徴とする。
ここで言う水溶性樹脂とは、水分子とのイオンもしくは水素結合により水和し、その結果として水に溶解するものであり、言い換えれば、水溶性樹脂とは水に溶解するために分子内の主鎖に対して必要充分な量のイオン性もしくは極性の側鎖を持つ樹脂である。なお、ここで水溶性樹脂とは、25℃の水100gに対して1.0g以上溶解可能なものをいう。
【0027】
上記水溶性樹脂としては、例えば、ポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコール、ポリアクリルアミド、ポリメタアクリルアミド、ポリヒドロキシエチルメタアクリレート、ポリペンタエリスリトールトリアクリレート、ポリペンタエリスリトールテトラアクリレート、ポリジエチレングリコールジアクリレート、およびそれらを構成するモノマー同士の共重合体、また2−メタクリロイルオキシエチルホスホリルコリンと他のモノマー(例えばブチルメタクリレート等)との共重合体等が挙げられる。これらの中でもポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコールの中から選ばれる1種以上と上記反応基からなる構造が好ましい。これにより、種々の細胞に対する刺激を抑制し、細胞凝集塊の形成速度、形成率、および形成した細胞凝集塊の質を向上することができる。
【0028】
ここで、ポリ酢酸ビニルのケン化物とは、例えば、ポリビニルアルコールまたはビニルアルコールと他の化合物との共重合体をいう。さらには、例えば、ビニルアルコールと、親水基変性、疎水基変性、アニオン変性、カチオン変性、アミド基変性またはアセトアセチル基のような反応基変性させた変性酢酸ビニルのケン化物等も含まれる。
【0029】
また、前記水溶性樹脂として重合体を用いる場合、その平均重合度は、特に限定されないが、100〜10,000が好ましく、特に200〜5,000が好ましい。平均重合度が前記下限値未満であると細胞培養容器の表面に均一に皮膜を成形するのが困難となる場合があり、前記上限値を超えると前記水溶性樹脂の粘度が高くなり作業性が低下する場合がある。
【0030】
また、上記ポリ酢酸ビニルのケン化物を用いる場合、上記ポリ酢酸ビニルのケン化物のケン化度は特に限定されないが、該ポリ酢酸ビニル全体の20mol%以上、100mol%以下が好ましく、特に50mol%以上、95mol%以下が好ましい。
【0031】
このような水溶性樹脂としては、例えば下記式(Ia)または(Ib)で表される構成単位を含むものが好ましい。これにより、実用的な300〜500nmの波長で均一な皮膜を形成する事ができ、細胞の接着量を低減し、細胞凝集塊形成効果を低減する効果を特に向上することができる。
【0032】
【化3】

【0033】
【化4】

【0034】
前記水溶性樹脂の式(Ia)または(Ib)で表されるRはカルボニルとアミンを有するアルキル基であれば特に限定するものではないが、例えば下記式(II)で表されるものが好ましい。これにより前記極性の側鎖の合成が容易におこなえる。
細胞培養容器を、水溶性樹脂に浸漬する際、水溶性樹脂を溶媒に溶解した状態で浸漬することが好ましく、その際に使用する溶媒は水もしくは溶解度を高めるために水と有機溶媒の混合物を使用することができる。
【0035】
【化5】

【0036】
例えば、前記式(Ia)または(Ib)で示される水溶性樹脂を使用する場合には、5ないし40容量%のアルコール水溶液を前記溶媒に使用することで、水溶性樹脂の溶解性が高くなり、均一な被覆層を形成することができる。
溶解する水溶性樹脂の濃度は0.01ないし30重量%が好ましく、特に0.1ないし10重量%が好ましい。
ここで水溶性樹脂の濃度が低すぎても、高すぎても、均一な被覆層が得られず、充分な細胞の接着低減効果が得られず良好な細胞凝集塊が形成されない。
【0037】
上記水溶性樹脂を用いた被覆層の厚みとしては、100nm以上5,000nm以下が好ましく、150nm以上1,000nm以下がより好ましい。被覆層の厚みを上記下限値以上にすることにより細胞が基材から受ける物理的な刺激をより抑えることができ、厚みを上記上限値以下とすることにより被覆層に取り込まれるたんぱく質の量を少なくし、たんぱく質を介した細胞の接着を抑えることが出来るため、細胞凝集塊形成率を更に向上させることができる。
【0038】
上記水溶性樹脂を培養容器内面に被覆させる方法としては、例えば、スピンコート、ディッピング、または上記水溶性樹脂溶液を培養容器内面に分注した後、容器を傾けて溶液を排出する方法を用いることができる。この様な方法で培養容器内面に水溶性樹脂を接触させた後、培養容器内面に残留した水溶性樹脂溶液を乾燥させることで水溶性樹脂被覆層を形成することができる。
【0039】
本発明の製造方法においては、上記工程後に、上記水溶性樹脂被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程を有することを特徴とする。
上記水溶性樹脂被覆層を非水溶性硬化皮膜層とすることで、密度の高いイオン性もしくは極性の側鎖を持つ表面を構築することができる。この表面に構築されたイオン性もしくは極性の側鎖は、培養液と接触した際に、静電相互作用もしくは水素結合により水分子と水和し、培養容器表面は実質的に水分子の密な水和層となり、この水和層は細胞に対する基材表面からの刺激を抑制し、質的に良好な細胞凝集塊が迅速に形成されることとなる。こうすることで、培養液を接触させた際に、水溶性樹脂の被覆層が溶解、遊離することを防ぎ、培養容器として必要な耐水性を獲得することができる。
【0040】
上記水溶性樹脂被覆層を硬化させる方法は、特に限定するものではなく、水溶性樹脂の側鎖に、硬化させるための官能基、例えば放射線反応性、感光性、熱反応性の官能基を有する水溶性樹脂を導入し、この部分を硬化させることで可能となる。例えば、感光性の官能基であれば、ジアゾ基、アジド基、シンモナイル基等が挙げられ、また、熱反応性および放射線反応性の官能基であれば、ビニル基、エポキシ基等を挙げることができる。これ
らの中でも硬化処理を迅速におこなうことができ、簡易な設備で硬化させることができる感光性の官能基を有する水溶性樹脂が特に好ましい。
【0041】
上記感光性の官能基としては、式(Ia)、(Ib)に示したように、アジド基を含む官能基が特に好ましい。これを用いることにより、実用的な230〜500nmの波長で反応させることができ、更に優れた解像性により皮膜の形成性を向上することができる。このように、表面に予め水溶性樹脂被覆層を形成し、該被覆層を硬化させて非水溶性硬化皮膜層に変性する工程によって上記の厚みの被覆層と同等の厚みの皮膜層を得ることができる。
【0042】
水溶性樹脂を使用するもう一つの利点としては、硬化後に表面を水で洗浄することで、未反応の樹脂を容易に洗い流すことができるという点である。もし、硬化反応性が悪い等の原因で溶出物が確認された場合は、硬化後に洗浄工程を入れることにより、溶出物を低減し、更に良好な細胞凝集塊生成率を得ることができる。
【0043】
次に、(2)の方法について述べる。
塗布する親水性樹脂としては、ポリ−2−ヒドロキシエチルメタクリレート(ポリ−HEMA)、ホスホリルコリン基含有高分子化合物、ポリエチレングリコール鎖含有高分子化合物等があるが、特にこれらに限定する物ではない。
【0044】
例えば、ポリ−HEMAの2%エタノール溶液を、容器内に100μL分注しエタノールを蒸発させ容器表面にポリ−HEMAの層を形成させることができる。蒸発後、超純水や緩衝液で洗浄することで、容器表面に吸着していない余分なポリ−HEMA分子を除去することができる。
(1)の方法に比べ、(2)の方法は表面の親水化が高分子化合物の容器表面への吸着現象だけであるので効果は弱いが、方法が簡便であることが利点である。
【0045】
培養容器の必須条件である滅菌に関しては、例えば、エチレンオキサイドガス滅菌、乾熱滅菌、蒸気滅菌、放射線滅菌等が挙げられるが、γ線あるいは電子線を用いた放射線滅菌が好ましく、大量生産を行う場合は放射線透過性の点でγ線滅菌が特に好ましい。
放射線の吸収線量については特に限定するものではないが、吸収線量が低すぎると滅菌性は確保されず、高すぎると細胞培養容器および被覆層が劣化してしまう場合がある。
【0046】
前記のようにして作製された培養容器は、以下の特徴を有する。
基材表面が細胞非接着処理された円錐状、または半球状であるので細胞が底部に集まり易く、細胞凝集塊を形成しやすい。
また、形成した細胞凝集塊をそのままのプレートで蛍光、発光測定に用いることが可能である。
【実施例】
【0047】
以下、本発明を実施例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
【0048】
(実施例1)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)樹脂を用いて、射出成形により96ウェルマルチウェルプレートを成形した。各ウェルの形状は、図1に示したとおりであり、ウェル底面の曲率半径を2.0mmとした。
【0049】
得られたプレートにプラズマ処理装置(BRANSON/IPC社製 SERIES7000)を用いてプラズマ処理(酸素プラズマ10分)を行い、前処理としてプレート表
面に濡れ性を付与した。
【0050】
次に、水溶性樹脂として側鎖にアジド基を有するポリビニルアルコール(東洋合成工業社製 AWP:式(Ia)の化合物(水溶性樹脂の平均重合度1600、感光基の導入率0.65mol%)を着色樹脂にて遮光したポリプロプレン容器中で、25容量%エタノール水溶液に溶解し、0.3重量%の溶液を調整した。
【0051】
上述のプレートに、自動分注機(BioTec社製、オートセラウォッシャーAMW−96SX)を使用し、1ウェルにつき100μLの前述の水溶性樹脂溶液を加え、1分間浸漬した後、プレートを裏返して溶液を充分廃棄し、25℃で17時間一次乾燥した後、UVランプで250nmのUV光を2.0mW/cm2×30秒間照射して水溶性樹脂を硬化した後、超純水で3回繰り返し洗浄し、乾燥後、γ線を吸収線量5.8kGyで照射(ラジエ工業株式会社)して、本発明の培養容器(プレート)を得た。
【0052】
(実施例2)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)樹脂を用いて、射出成形により96ウェルマルチウェルプレートを成形し、ウェル底面の曲率半径を2.6mmとした以外は実施例1と同様にして培養容器(プレート)を得た。
【0053】
(比較例1)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)樹脂を用いて、射出成形により96ウェルマルチウェルプレートを成形し、ウェル底面の曲率半径3.2mmとした以外は実施例1と同様にして培養容器(プレート)を得た。
【0054】
(比較例2)
ウェルの底面が平面である35φシャーレ(住友ベークライト社製、MS−1035R)を使用した。
【0055】
実施例1、2および比較例1、2にて得られた培養容器のそれぞれについて、以下の評価を行った。
(1)ヒトiPS細胞を用いた胚様体の形成
ヒトiPS細胞201B7(iPSアカデミアジャパンより入手)をY−27632(CALBIOCHEM社製、688000)を10μM含む培養液(ダルベッコ改変MEM/F12培地+20%Knockout serum repracement+2mM グルタミン+1%非必須アミノ酸+0.1mMメルカプトエタノール)中で1時間培養した後、TrypLE Select(GIBCO社製)を使用し、ヒトiPS細胞を
単細胞に分散させ、Y−27632を10μM含む培養液を用いて、(1)90,000cells/mL、(2)60,000cells/mL、(3)30,000cells/mLで分散させた細胞懸濁液を調製し、前述のプレートに100μL/ウェルずつ分注し、37℃、5%CO2雰囲気下にて培養し、分注後、30分、2時間、4時間、96時間の時点で各ウェルについて胚様体の形成を顕微鏡下で確認した。
【0056】
図3,4に示すように本発明によるiPS細胞培養容器のウェル中では、正確に1個の凝集塊が形成されていることが分かる。一方、図5の比較例1では、主となる凝集塊の他に
小さい複数の凝集塊が形成されており、ウェル底面の曲率半径3.2mmでは、iPS細胞の単一の凝集塊が形成しにくいことがわかった。また、比較例2のウェル平面の培養器では、図6の様に凝集塊が複数個形成されており、本発明の目的には合わないことが明確となった。
【産業上の利用可能性】
【0057】
本発明のiPS用培養容器を用いることで、細胞機能を維持した培養が可能であり、さらに機能細胞を用いたアッセイにも使用可能である。
【特許請求の範囲】
【請求項1】
2個以上のウェルを有するiPS細胞用培養容器であって、
前記ウェルが、垂直方向における断面が略U字形状の底部及び、略円形の開口部を有し、かつ、前記底部内面の少なくとも曲面部分が細胞低接着性であると共に、前記底部内面の曲率半径(R')が、1.0mm以上、2.6mm以下であり、
前記細胞低接着性の表面は、水溶性樹脂を用いた細胞低接着化処理または細胞非接着化処理にて形成されることを特徴とするiPS細胞用培養容器。
【請求項2】
前記水溶性樹脂が、下記式(Ia)または(Ib)で表される化合物である請求項1記載のiPS細胞用培養容器。
【化1】

【化2】

【請求項3】
前記ウェルの最下部面に細胞低接着性の表面を有するくぼみが少なくとも一つ内設されていることを特徴とする請求項1または2記載のiPS細胞用培養容器。
【請求項4】
前記各ウェルの内面全体が、細胞低接着性であることを特徴とする請求項1から3のいずれか一項に記載のiPS細胞用培養容器。
【請求項1】
2個以上のウェルを有するiPS細胞用培養容器であって、
前記ウェルが、垂直方向における断面が略U字形状の底部及び、略円形の開口部を有し、かつ、前記底部内面の少なくとも曲面部分が細胞低接着性であると共に、前記底部内面の曲率半径(R')が、1.0mm以上、2.6mm以下であり、
前記細胞低接着性の表面は、水溶性樹脂を用いた細胞低接着化処理または細胞非接着化処理にて形成されることを特徴とするiPS細胞用培養容器。
【請求項2】
前記水溶性樹脂が、下記式(Ia)または(Ib)で表される化合物である請求項1記載のiPS細胞用培養容器。
【化1】

【化2】

【請求項3】
前記ウェルの最下部面に細胞低接着性の表面を有するくぼみが少なくとも一つ内設されていることを特徴とする請求項1または2記載のiPS細胞用培養容器。
【請求項4】
前記各ウェルの内面全体が、細胞低接着性であることを特徴とする請求項1から3のいずれか一項に記載のiPS細胞用培養容器。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−70636(P2013−70636A)
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願番号】特願2011−210338(P2011−210338)
【出願日】平成23年9月27日(2011.9.27)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成25年4月22日(2013.4.22)
【国際特許分類】
【出願日】平成23年9月27日(2011.9.27)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

