invivoにおいて単一プロトコルにより2以上の生体分子の相対流速を比較する方法
本発明は、アイソトープ標識水を1以上の組織又は個体に投与し、異なる化学クラスの生体分子を含む2以上の生体分子の分子流速を比較することによる、種々の生体分子の相対分子流速を測定及び比較するための技術に関する。本方法は、疾患、障害又は症状の診断、予後診断又はモニター、種々の疾患モデルにおける治療効果についての化学物質及び生物学的因子のin vivoハイスループットスクリーニング、並びに毒性作用についての化学物質及び生物学的因子のin vivoハイスループットスクリーニングを含む、複数の用途において使用しうる。


【発明の詳細な説明】
【技術分野】
【0001】
本発明は、国立衛生研究所によって与えられた承認(契約)番号R01−AI43866−01AI及びR01−AI43866−01AIの下、政府助成金によって行われた。政府は本発明に対して一定の権利を有する。
【0002】
関連出願
本出願は、2003年7月3日に出願の米国特許仮出願第60/484,626号の優先権を主張する。
【0003】
発明の分野
本発明は、生物系における同じクラス又は異なるクラスの生体分子の相対分子流速を測定及び比較するための技術に関する。より詳しくは、本発明は、アイソトープ標識水を1又は複数の組織又は個体に投与して、その生体分子が異なる化学クラスに属する場合でも、疾患又は疾患に対する薬物療法の影響に関連する2以上の生体分子の相対分子流速を比較する技術に関する。
【背景技術】
【0004】
薬剤の開発及び発見の分野において、仮定された遺伝子又はタンパク質標的の、及び候補薬剤の、仮定された表現型の結果を検証するための機能的生化学マーカーの必要性が長く認識されている。近年の候補標的及び薬剤を同定するための手段における急速な技術的進歩、特に治療の潜在的な標的(即ち「治療標的」)を見出すための高効率のゲノム及びプロテオーム手段、並びに非常に効率的なコンビナトリアルケミストリー及び化学的又は生物学的な候補治療リードを生成するためのハイスループットスクリーニングアッセイの発達のために、無効の又は毒性のある候補物質を除くための表現型スクリーニング手段の必要性が、薬剤の開発及び発見における1つの最大の課題となっている。製薬会社がそれらの全てを完全に追求するには、あまりに多くの標的及びあまりに多くのリード化合物が存在する。したがって、このように厖大な数の候補治療標的及びリード化合物は、薬剤開発過程の初期に無効の又は毒性のある候補物質を除くために篩にかける必要がある。しかし、現在、表現型特性決定又は毒性評価に利用できる市販のハイスループットスクリーニング手段はない。この欠陥は、医薬産業が提供する手段における深刻なギャップとなっている。
【0005】
動物での前臨床研究からヒト承認治験、例えばFDAフェーズIII臨床試験までの薬剤の開発及び発見過程の異なる段階で使用される試験の垂直統合の能力も、製薬会社のために非常に有用であろう。薬剤の開発過程の全てのレベルで同じ方法及び形式で使用することができる試験は、開発段階が進むに従い、各レベルでの比較及び薬剤作用の内部検証を可能にするであろう。
【0006】
技術的な限界のため、遺伝子型とは対照的に生化学的表現型を測定するためのハイスループット汎用スクリーニング法の発達が遅れた。このギャップの理由は、生物学において操作可能な機能(即ち表現型)の真の単位は遺伝子又はタンパク質単独ではなく、完全に統合された系における代謝経路を通しての分子の動的流れ(即ち分子の流動又は動態)であるということである。分子の濃度を測定するための研究手法(例えばイムノアッセイ、標準の臨床化学、ジェノミクス/プロテオミクス及び他の従来のハイスループット方法)は非常に進歩したが、分子流動を測定する研究手法はそれほど進んでいない。分子動態測定技術の欠如は、特にハイスループットの多重同時分子流速測定に当てはまる。複雑な代謝経路により変化した分子流動は基本的に全ての疾患の基礎をなすので、この欠陥は基本的な問題となる。(例えば、以下に完全に引用したStephanopoulosら;Hellerstein, Annu Rev Nutr. 2003; Kaczer及びBurnsを参照)。
【0007】
従来の濃度に基づくアッセイ、例えば臨床化学、イムノアッセイ及びジェノミクス/プロテオミクスは、全て静的測定である。映画がスナップ写真と異なるのと同様に、時間の次元が含まれることによって分子動態学は静的試験と異なる。分子の動的流動を測定するためには、分子の静的測定とは完全に異なるセットの手段が必要である。分子動態の測定技術は、時間の次元を導入するためにアイソトープトレーサーの使用を含めなければならない。(例えば、以下に完全に引用されているHellerstein及びNeese、Am J Physiol 1999; Hellerstein Annu Rev Nutr. 2003を参照)。アイソトープ標識は時間の非対称性をもたらし(標識は最初は存在しないが後に存在する)、それによって分子動態の測定を可能にする。
【0008】
アイソトープ標識技術は、一般的に一度に単一分子又は単一の生化学クラスの分子の分子流速(動態)に制限されていた。投与される各標識基質は、通常、単一の化学クラスの有機分子に制限される。例として、標識アミノ酸、例えば3H−ロイシン又は13C−リジンを対象の細胞又は生物内のタンパク質又は全てのタンパク質を生合成により標識するために用いることができるが、他のクラスの分子(例えば脂質、DNA、炭水化物)はアミノ酸から有効に、又は確実に標識されない。同様に、DNA及びRNA動態を測定するための標識では、脂質、タンパク質及び他のクラスの分子の動態測定が可能ではない。この理由から、以前の動態標識測定は、一つのプロトコルによって異なるクラスの複数の生体分子の相対分子流速についての情報を提供しなかった。
【0009】
薬剤又は遺伝標的の生化学的結果(表現型)に関して最も有益な情報を提供するのは、異なる分子流速の組み合わせ又は比較であることが多い(例えばHellerstein、Annu Rev Nutr. 2003;Stephanopoulosらを参照)。しかし、薬剤の治療効力又は疾患の診断若しくは予後を評価する際に、1つの種類の細胞の増殖速度と他の種類の細胞の速度との比較(例えば、様々な癌における腫瘍細胞対内皮細胞)がしばしば有用であるので、同じクラスであるが異なる種類の細胞又は組織からの生体分子を分析する必要もある。したがって、単純でハイスループットな方法により、複数のクラスの生体分子の分子流速を並行して分析及び比較する必要がある。更に、同じクラスであるが異なる細胞型又は組織の中に存在する生体分子をハイスループットの方法で分析する必要がある。
【発明の開示】
【発明が解決しようとする課題】
【0010】
これらのニーズに応ずるために、本出願は、アイソトープ標識水を投与することによって2以上の生体分子の相対分子流速を測定及び比較する方法に関する。一実施形態では、2以上の生体分子は同じ生化学クラスのものであり、異なる細胞型又は組織に由来する。他の実施形態では、2以上の生体分子は異なる生化学クラスからのものである。
【課題を解決するための手段】
【0011】
本発明者は、アイソトープ標識水が、ポリヌクレオチド、タンパク質、脂質、糖質、グリコサミノグリカン、セラミド、糖脂質、プロテオグリカンその他を含む、基本的にあらゆる主要なクラスの生体分子の生合成速度を測定するための汎用性標識であることを発見した。更に、アイソトープ標識水は、極めて容易な投与、体内におけるレベルの安定性及び長い半減期、組織分画又はプールの欠如、数週間又は数ヶ月という長期の投与の容易性、並びに細胞から動物(例えば齧歯動物)、更にヒトに至る全ての生物系への適用性などを含め、以前認識されなかった標識送達ビヒクルとしてのいくつかの利点を有する。更に、質量分析及び生化学単離プロトコルにおける技術的進歩が、今では薬剤開発及び発見のための有効なスクリーニング技術としての使用に必要なハイスループットを可能にする。
【0012】
更に、2以上の生体分子の相対分子流速を測定及び比較することは、1つの生体分子の単一の分子流速の測定と比較して、組織又は個体についての相当量の情報を提供する。2以上の生体分子の相対分子流速を測定及び比較することは、複雑な代謝ネットワークの制御理論の研究者によって議論されるように(例えばStephanopoulosを参照)、異なる生体分子間の動的な関係の決定を可能にする(例えば、「流量分布」又は「制御構造」)。生細胞又は生物のような複雑な生化学ネットワークの状態に関する最も有益な情報又は疾病の特徴についての情報をしばしば提供するのは、単独の1つの速度ではなく上述の関係である。異なる生体分子の流量の間での動的な関係を決定することができると、とりわけ疾患及び病態、治療化合物による治療並びに化合物の毒性と関連する分子動態の測定が可能になる。更に、それらの分子が異なる化学クラスのものであってもアイソトープ標識水の投与と合わせて2以上の生体分子の相対分子流速を測定及び比較することは、単一のプロトコルによって測定される複数のクラスの分子の相対分子流速を比較するハイスループットスクリーニング法に容易に適応させることができる。
【0013】
詳細には、本出願は、生体分子が1個体内の異なる化学クラスである場合も含めて、2以上の生体分子の相対分子流速を測定及び比較する方法に関し、この方法は、a)アイソトープ標識水を、その標識が2以上の生体分子に取り込まれて2以上のアイソトープ標識生体分子を形成するのに十分な時間にわたり個体に投与するステップと、b)組織又は個体から2つ以上のアイソトープ標識生体分子を含む1又は複数の生体試料を得るステップと、c)前記2以上の生体分子における標識の取り込みを測定して前記生体分子の分子流速を測定するステップと、d)前記生体分子の分子流速を比較してそれらの相対分子流速を分析するステップとにより実施される。
【0014】
アイソトープ標識水は2H2Oとすることができ、また経口、非経口、皮下、血管内(例えば、静脈内若しくは動脈内)、又は腹腔内などを含め、許容できるいかなる投与方法によって投与されてもよい。個体は、ヒトでありうる。
【0015】
アイソトープ標識水の投与は、連続的でも、単回投与でも、又は複数回投与でもよい。この方法は、生体試料を得る前に、アイソトープ標識水の投与を中断して脱標識が起こるまで待機する更なるステップを含んでもよい。
【0016】
一実施形態では、生体分子は異なる生化学クラスのものでもよい。他の実施形態では、生体分子は同じ生化学クラスからのものであるが異なる細胞型又は組織に由来してもよい。更に他の実施形態では、生体分子は既定構造を有する単一分子であってもよい。
【0017】
生体試料は、生前又は死後に得られたものとしうる。生体試料を得る方法は、組織試料を得るいかなる方法、及び体液試料を得るいかなる方法、例えば採血、採尿、組織生検又は当技術分野で公知の他の方法を含むいかなる方法でもよい。
【0018】
2以上の生体分子への標識の取り込みは、液体シンチレーションカウンター、NMR及び質量分析などの方法によって検出されうる。アイソトープ標識の取り込みは、生体分子をより簡単に検出可能な分子に化学変換した後に検出してもよい。例えば、生体分子は分析の前に分解、化学的修飾、又は化学的誘導体化してもよい。
【0019】
生体分子のアイソトープの濃縮は、アイソトープ濃縮又は標識パターンを質量アイソトポマー分布分析(MIDA)によって計算し、前駆体−生成物又は指数関数的減衰方程式を適用して2以上の生体分子の分子流速を決定することによって決定することができる。
【0020】
生体分子の相対分子流速を比較する。比較は、比率、グラフ上の関係又は当技術分野で公知の他の比較法により行いうる。
【0021】
生体分子は、クラス全体の分子、クラス内の特定の分子及び/又は器官若しくは細胞小器官などの特定の部位からのものでもよい。一実施形態では、第1の生体分子は細胞のDNAであり、第2の生体分子は細胞タンパク質である。他の実施形態では、第1の生体分子はタンパク質であり、第2の生体分子は細胞DNAであり、第3の生体分子は脂質である。他の実施形態では、第1の生体分子は細胞タンパク質であり、第2の生体分子はミトコンドリアDNAである。他の実施形態では、第1の生体分子は脂肪組織アシルグリセリドであり、第2の生体分子は細胞タンパク質又は細胞DNAでありうる。他の実施形態において、第1の生体分子は脂肪組織アシルグリセリドであり、第2の生体分子は細胞タンパク質であり、第3の生体分子は細胞DNAである。
【0022】
生体試料は、組織、例えば筋肉、肝臓、膵臓、脳、脂肪組織、脾臓、腸、心臓、肺、皮膚、前立腺、性腺、胸部、滑膜、血球、又は体の他の組織でありうる。他の態様において、第1の生体分子はタンパク質であり、第2の生体分子はmRNAである。更なる変形において、第1の生体分子はミトコンドリアカルジオリピンであり、第2の分子はミトコンドリアDNAである。他の変形において、第1の生体分子は皮膚ケラチンであり、第2の生体分子は皮膚ケラチン生成細胞DNAである。他の実施形態では、第1の生体分子はアミロイドβタンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAであり、第4の生体分子はガラクトセレブロシドである。他の実施形態において、第1の生体分子はアミロイドβタンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAである。他の実施形態では、第1の生体分子はアミロイド前駆体タンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAであり、第4の生体分子はガラクトセレブロシドである。他の実施形態において、第1の生体分子はアミロイド前駆体タンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAである。
【0023】
生体分子は、ある分子クラス内の特定の分子でもよい。一実施形態では、第1の生体分子はトリグリセリドであり、第2の生体分子は脂肪酸であり、任意選択で、組織は肝臓であってもよい。
【0024】
生体試料は、成長中の組織、例えば筋肉、肝臓、副腎組織、前立腺組織、結腸組織、子宮内膜組織、皮膚、胸部組織、脂肪組織又は体細胞成長が可能な他の組織から得られてもよい。生体試料は腫瘍細胞又は細菌でもよいし、又はそれらを含むことができる。前記2以上の生体分子は、同時に単離及び/又は検出することができる。
【0025】
他の態様において、本発明は個体の1又は複数の組織内で又は個体内で疾患又は病態の進行を検出、予後診断又はモニターする方法を含む。疾患又は病態のない組織又は個体の第1集団における2以上の生体分子の相対分子流速が、測定及び比較される。1又は複数の組織又は個体の第2集団における2以上の生体分子の相対分子流速が測定及び比較される。第1及び第2の集団の間の相対分子流速の相違を次に特定して、疾患又は病態の進行を検出、予後診断又はモニターするために利用する。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0026】
他の態様において、本発明は個体の1又は複数の組織内で又は個体内で疾患又は病態の進行を検出、予後診断又はモニターする方法を含む。組織又は個体からなる集団における2以上の生体分子の相対分子流速は、化合物の投与の前後に測定及び比較される。投与前後の相対分子流速の相違を次に特定して、疾患又は病態の進行を検出、予後診断又はモニターするために利用する。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0027】
例えば、間質性肺線維症(IPF)は、IPFと診断された1又は複数の個体からなる集団における肺コラーゲン及び肺線維芽細胞DNAの相対分子流速を非罹患者の試験集団と比較することによって、診断、予後診断又はモニターしうる。或いは、IPFと診断されたか又はそれが疑われる1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0028】
他の例では、高脂血症は、高脂血症と診断された1又は複数の個体からなる集団における血漿アポリポタンパク質B、トリグリセリド、リン脂質及びコレステロールの2以上の相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしうる。他の変形例では、家族性混合型高脂血症は、家族性混合型高脂血症と診断された1又は複数の個体からなる集団におけるアポリポタンパク質B、並びにトリグリセリド、リン脂質、コレステロール及び/又はコレステロールエステルの1又は複数の相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしてもよい。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0029】
更なる変形において、第1の生体分子はT細胞又はB細胞DNAであり、第2の生体分子は血漿免疫グロブリンである。細胞性免疫活性化の低下は、細胞性免疫活性化の低下と診断された1又は複数の個体からなる集団における血漿免疫グロブリンに対するT細胞又はB細胞DNAの相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしてもよい。T細胞又はB細胞DNAの相対分子流速の低下により、第2の集団における細胞性免疫活性化の低下の進行が同定される。更なる変形において、第1の分子は、血漿免疫グロブリン以外のT細胞又はB細胞に由来するタンパク質でよい。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0030】
更なる変形において、第1の生体分子は真皮コラーゲンであり、第2の生体分子は真皮エラスチンである。光老化は、光老化表現型(皮膚のしわ)を有する1又は複数の個体からなる集団における真皮エラスチンに対する真皮コラーゲンの相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしうる。試験集団における真皮エラスチンの分子流速と比較した真皮コラーゲンの分子流速の変化から、この評価集団における光老化の変化が同定される。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0031】
本発明は、治療化合物を必要とする第1の集団で2以上の生体分子の分子流速を測定及び比較し、同じ集団又は1若しくは複数の組織若しくは個体からなる第2の集団に対してその化合物を投与し、その化合物の投与後に同じ集団で、又は1若しくは複数の組織若しくは個体の第2の集団で前記2以上の生体分子の分子流速を測定及び比較することにより、その治療化合物の効力を測定する方法も含む。前記化合物の投与前後の第1の集団における、又は第1の集団及び第2の集団の間の相対分子流速の相違から、その化合物を必要とする組織又は個体におけるその治療薬の効果が測定される。
【0032】
本発明は、治療化合物を必要とする1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、前記1又は複数の組織又は個体の同じ集団に対してその化合物を投与し、その化合物の投与後に前記集団で前記2以上の生体分子の分子流速を測定及び比較することにより、その化合物の効力を測定する方法も含む。前記化合物の投与前後の前記集団における相対分子流速の相違から、その化合物を必要とする組織又は個体におけるその化合物の効果が測定される。
【0033】
化学療法剤の殺腫瘍又は腫瘍静止作用は、細胞タンパク質及び細胞DNAの相対分子流速を測定及び比較することによって決定することができる。タンパク質及びDNAの相対分子流速が化学療法剤で治療を受けた個体で変化しない場合は、その薬剤は殺腫瘍作用を有する。しかし、DNAの分子流速がタンパク質の分子流速よりも大きく変化する場合には、その化学療法剤は腫瘍静止作用を有する(即ち、細胞は死滅しておらず、タンパク質の合成を継続しているが、分裂中ではない)。化学療法剤の殺腫瘍又は腫瘍静止作用は、治療を受けた集団及び治療を受けていない集団で、又はその化学療法剤による治療の前後に単一の集団で、細胞タンパク質及び細胞DNAの相対分子流速を測定及び比較することによって同定することができる。
【0034】
アンドロゲン又は他の同化治療の治療効果は、筋肉タンパク質又は筋肉DNAの相対分子流速を脂肪組織トリグリセリドの相対分子流速と比較することによって、消耗性又は虚弱性の疾患若しくは障害を有する1又は複数の組織又は個体で測定することができる。筋肉タンパク質又は筋肉DNAの分子合成速度が脂肪組織トリグリセリドと比較して増加する場合には、そのアンドロゲンは消耗性又は虚弱性の疾患又は障害に治療効果を有する。消耗性又は虚弱性の疾患又は障害における成長ホルモンの治療効果も、同様の方法で同定することができる。
【0035】
他の態様において、乳癌治療における選択的エストロゲン受容体モジュレーター(SERM)の治療効果は、乳房上皮細胞のDNA又は子宮内膜細胞のDNAの相対分子流速、及び乳房間質組織のタンパク質又は脂質の合成を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。乳房上皮細胞DNA又は子宮内膜細胞DNAの分子合成速度が乳房間質組織のタンパク質又は脂質の分子の分子合成速度と比較して低下する場合には、そのSERMは乳房細胞増殖に対して治療効果を有する。
【0036】
骨粗鬆症におけるSERMの治療効果は、骨コラーゲンの相対分子流速及び乳房又は子宮内膜細胞のDNA合成を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。乳房又は内皮のDNA合成の分子流速と比較した骨コラーゲンの分子流速の増加は、乳房又は子宮内膜癌のリスクに対するその潜在的な有害作用と比較した、骨粗鬆症に対するSERMの治療効果を示す。
【0037】
アルツハイマー病におけるある化合物の治療効果は、脳アミロイドベータ(Aβ)タンパク質又はアミロイド前駆体タンパク質、及び脳脊髄液(CSF)中の基準分子の相対分子流速を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。CSF基準分子(例えばCSF中の構成脂質)の分子流速と比較した脳Aβタンパク質の分子流速の減少は、アルツハイマー病に対するその化合物の治療効果を示す。或いは、アルツハイマー病におけるある化合物の治療効果は、Aβタンパク質及び/又はアミロイド前駆体タンパク質(APP)、ニューロンDNA、及び/又は小グリア細胞DNAの相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち、「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。任意選択により、ガラクトセレブロシド(脳又は血漿)の分子流速も、測定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較したAβ、APP、ニューロンDNA、小グリア細胞DNA及びガラクトセレブロシド(又はそのいかなる組み合わせ)の1又は複数の流速の相違は、アルツハイマー病に対するその化合物の治療効果を示す。
【0038】
神経炎におけるある化合物の治療効果は、ニューロンDNA、小グリア細胞DNA、及び/又はガラクトセレブロシド(脳又は血漿)の相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。任意選択により、1又は複数の炎症性タンパク質、例えばインターロイキン6及び/又はインターロイキン12及び/又はグリア原線維酸性タンパク質(GFAP)及び/又はS100B(グリアカルシウムシグナル伝達タンパク質)の分子流速も、測定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較したニューロンDNA、小グリア細胞DNA、ガラクトセレブロシド、インターロイキン6、インターロイキン12、GFAP及びS100B(又はそのいかなる組み合わせ)の1又は複数の流量の相違は、神経炎に対するその化合物の治療効果を示す。
【0039】
乾癬におけるある化合物の治療効果は、ケラチン生成細胞DNA及び皮膚ケラチンの相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較したケラチン生成細胞DNA及び/又は皮膚ケラチンの流量の相違は、乾癬に対するその化合物の治療効果を示す。
【0040】
肝臓病(例えば、肝線維症、肝硬変、化学物質若しくは微生物による急性毒性、又はその他の疾患)におけるある化合物の治療効果は、全肝細胞DNA又は肝実質細胞DNA、及び肝臓コラーゲンの相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較した全肝細胞DNA又は肝実質細胞DNA及び肝臓コラーゲンの流量の相違は、肝臓病に対するその化合物の治療効果を示す。
【0041】
ある化合物の抗血管形成作用は、内皮細胞DNA及び腫瘍細胞DNAの相対分子流速を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。任意選択により、他の組織の内皮細胞DNA及び組織DNA、例えば肝臓内皮細胞DNA及び全肝細胞DNAの相対分子流速を測定してもよい。治療を受けていない組織又は個体と比較した、腫瘍内皮細胞DNA及び腫瘍細胞DNAの流量の低下は、殺腫瘍作用を有する化合物の抗血管形成作用を示す。治療を受けていない組織又は個体と比較した、腫瘍内皮細胞DNAの流量の低下及び腫瘍細胞DNAの流量の増加の抑制は、その化合物の抗血管形成作用及びその化合物の腫瘍静止作用を示す。治療を受けていない組織又は個体と比較した、腫瘍内皮細胞DNAの流量の低下及び腫瘍細胞DNAの流量への無影響は、抗血管形成作用を有するが腫瘍細胞への影響がないことを示す。他の組織の内皮細胞DNA及び他の組織のDNAと比較した、腫瘍内皮細胞DNA及び腫瘍細胞DNAの流量の相違は、その化合物の抗血管形成作用を決定する代替方法である。
【0042】
個体における有酸素的運動に対する筋組織の反応は、筋組織内の細胞タンパク質及びミトコンドリアDNAの相対分子流速を測定及び比較することによって測定することができる。有酸素的運動を受ける個体における、細胞タンパク質と比較したミトコンドリアDNAの分子流速の増加から、有酸素適応性の増加が同定される。
【0043】
転写調節又は翻訳調節に基づくタンパク質発現の変化の原因は、タンパク質及びそのタンパク質をコードしているmRNAの相対分子流速を2以上の時点で測定及び比較することによって同定することができる。mRNAと比較したタンパク質の分子流速の増加から翻訳調節の変化が同定され、mRNAと比較したタンパク質の安定又は減少した分子流速から転写調節の変化が同定される。
【0044】
個体における全質量又はタンパク質発現の変化の原因は、全細胞RNA及び全細胞DNAの相対分子流速を2以上の時点で測定及び比較することによって同定することができる。DNAの分子流速と比較したmRNAの分子流速の増加から、転写が全質量又はタンパク質発現の変化の原因として同定され、全細胞DNAの分子流速と比較した全細胞mRNAの分子流速の不変又は減少から、細胞分裂の変化が全質量又はタンパク質発現の変化の原因として同定される。
【0045】
生物学的因子の治療特性は、1又は複数の組織又は個体からなる第1の集団で2以上の生体分子の分子流速を測定及び比較し、1又は複数の組織又は個体からなる第2の集団に対してその生物学的因子を投与し、前記2集団で前記2以上の生体分子の相対分子流速を比較することにより、同定することができる。前記2集団間で比較された分子流速の相違から、その生物学的因子の治療特性が同定される。
【0046】
或いは、生物学的因子の治療特性は、1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、その集団に対してその生物学的因子を投与し、その生物学的因子の投与の前後に前記2以上の生体分子の相対分子流速を比較することにより、同定することができる。前記生物学的因子の投与の前後で比較された分子流速の相違から、その生物学的因子の治療特性が同定される。
【0047】
前記生物学的因子は、いかなる生物学的因子でもよい。前記生体分子を含む1又は複数の生体試料は組織培養物でもよく、又は、実験動物若しくはヒトから得られてもよい。一変形形態では、前記生体分子の少なくとも1つはDNAである。他の変形形態では、前記生体分子の少なくとも1つはタンパク質である。
【0048】
生物学的因子の毒性作用は、1又は複数の組織又は個体からなる第1の集団で2以上の生体分子の分子流速を測定及び比較し、1又は複数の組織又は個体からなる第2の集団に対してその生物学的因子を投与し、第1の集団と比較して第2の集団で前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。第1の集団及び第2の集団間で比較された分子流速の相違から、その生物学的因子の毒性作用が同定される。
【0049】
或いは、生物学的因子の毒性作用は、1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、その集団に対してその生物学的因子を投与し、投与前後の前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。前記生物学的因子の投与の前後で比較された分子流速の相違から、その生物学的因子の毒性作用が同定される。
【0050】
生体異物(例えば、新しい化学物質、薬剤、薬剤候補、薬剤リード、生物学的因子、環境化学物質、食品添加物、化成物、化粧品、又はその組み合わせ若しくは混合物)の毒性作用は、1又は複数の組織又は個体(例えば実験動物又はヒト)の第1の集団で2以上の生体分子の分子流速を測定及び比較し、1又は複数の組織又は個体からなる第2の集団に対してその生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)を投与し、第1の集団と比較して第2の集団で前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。第1の集団及び第2の集団間で比較された分子流速の相違から、その生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)の毒性作用が同定される。
【0051】
或いは、生体異物の毒性作用は、1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、その集団に対してその生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)を投与し、投与前後の前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。前記生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)の投与前後で比較された分子流速の相違から、その生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)の毒性作用が同定される。
【0052】
更に、本明細書で開示されている方法は、1又は複数の治療標的を同定するために使用してもよい。2以上の生体分子の分子流速を、1又は複数の組織又は個体からなる第1の集団で測定及び比較する。薬剤又は薬剤候補又は薬剤リード又は新しい化学物質又は生物学的因子又は既承認薬(又はそのいかなる組み合わせ若しくは混合物)を1又は複数の組織又は個体からなる第2の集団に対して投与し、第2の集団の前記2以上の生体分子の相対分子流速を第1の集団と比較する。第1の集団及び第2の集団間で比較された分子流速の相違から、治療標的が同定される。
【0053】
或いは、本明細書で開示されている方法は、1又は複数の組織又は個体からなる第1の集団で2以上の生体分子を測定及び比較し、その集団に対して薬剤又は薬剤候補又は薬剤リード又は新しい化学物質又は既承認薬又は生物学的因子(又はその組み合わせ若しくは混合物)を投与し、その薬剤又は薬剤候補又は薬剤リードの投与前後の前記2以上の生体分子の相対分子流速を測定及び比較することにより、1又は複数の治療標的を同定するために使用することができる。投与の前後で比較された分子流速の相違から、薬剤の標的が同定される。
【0054】
本明細書で開示されている全ての方法は、ハイスループット方法に容易に適応させることができる。複数の疾患及び障害、治療化合物(そのいかなる組み合わせ若しくは混合物を含め、薬剤、薬剤候補、薬剤リード、新しい化学物質、既承認薬又は生物学的因子)、生体異物並びに治療標的をスクリーニングすることができる。
【0055】
本発明は、2以上の生体分子の相対分子流速を分析、測定及び/又は比較するためのキットも含む。一態様では、キットは、アイソトープ標識水、及び組織又は個体にアイソトープ標識水を投与するための1又は複数の手段を含む。他の態様において、キットは、生体試料から生体分子を分離、部分精製、又は単離するための化学化合物又は試薬を含む。キットは、個体から試料を採取するための機器を含んでもよい。
【0056】
本発明は、1又は複数の安定アイソトープを含む、アイソトープで不安定化された分子も含む。アイソトープで不安定化された分子は、本明細書で記載されている標識方法の生成物である。アイソトープで不安定化された分子は、当技術分野で公知の試料採取法によって採取し、適当な分析手段を使用して分析する。
【0057】
本発明は、1又は複数のアイソトープで標識された、アイソトープで不安定化された分子も提供する。
【0058】
本発明は、本発明の方法によって同定され、かつ少なくとも部分的に特性決定された1又は複数の治療薬も提供する。
【0059】
図面の簡単な説明
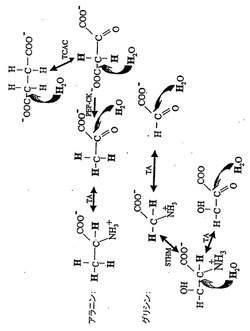
図1 図1A〜Bは、アイソトープ標識水から選択された遊離アミノ酸への標識水素交換の経路を表す図である。2つのNEAA(アラニン、グリシン)及びEAA(ロイシン)を例に示す。アラニン及びグリシンは、図2Aで示す。ロイシンは図2Bで示す。略語:TA、トランスアミナーゼ;PEP−CK、ホスホエノールピルビン酸カルボキシキナーゼ;TCAC、TCA回路;STHM、セリンテトラヒドロ葉酸メチル転移酵素。
【0060】
図1Cは、タンパク質合成のためのH218Oによる遊離アミノ酸の18O標識を表す図である。
【0061】
図2は、水からDNAのデオキシリボース(dR)への水素アイソトープ(この場合重水素)の取り込みを表す図である。
【0062】
図3は、10〜12週間、毎日50〜100mLの2H2Oを摂取した代表的なヒト被験者の体内水分中の2H2Oの濃縮を表す図である。データは、各被験者で体内水分の前駆体プールが数週間にわたって安定していることを示す。
【0063】
図4は、(a)体重の安定した雌ラットの心筋及び後肢筋におけるmtDNAと核DNAの合成の比較(平均±S.D.);f、部分置換、並びに(b)左、ラット後肢筋におけるミトコンドリア(mt)リン脂質の合成及び運動訓練(随意車輪運動)の影響を表す図である。動物には、2H2Oを8日間投与した。CL、カルジオリピン;PC、フォスファチジルコリン;PE、フォスファチジルエタノールアミン;P<0.05対対照ラット。右、(a)からのラットにおけるmtDNAとCLの合成の相関関係。
【0064】
図5は、対照マウス(n=7)及びob/obマウス(n=4)の4つの異なる脂肪貯蔵(子宮外膜、鼠径部、腸間膜、及び後腹膜)から単離された成熟脂肪細胞濃縮分画における細胞増殖速度の同時測定を表す図である。動物には、飲料水中4%2H2Oを21日間投与した。対照の体重は、2H2Oの投与開始時で18.5±0.2g(平均±S.E.)、終了時には20.8±0.4gであった。ob/obの体重は、それぞれ26.3±0.6g、35.7±0.9gであった。
【0065】
図6は、ob/obマウス及び対照において、TG及びパルミチン酸合成(新規の脂質生成又はDNLのマーカー)のための2つの異なる脂肪貯蔵(鼠径及び腸間膜)、並びに脂肪細胞増殖のための4つの異なる区画(子宮外膜、鼠径、腸間膜及び後腹膜)において同時に測定された、脂肪代謝成分の動態を表す図である。パネルa)は、トリグリセリド合成の影響を示す。パネルb)は、新規の脂質生成を示す。パネルc)は、脂肪細胞増殖を示す。食制限(ペアフィード)及びレプチン投与の影響は、このように比較される。
【0066】
図7は、2種の異なるマウスで同時に測定された、及び図8で示す両方のマウス種でのケラチン生成細胞DNA合成と同時に測定された、ケラチンにおけるアラニンのEM1濃縮によって示される、正常マウス(C57bl/6マウス)及び薄片状皮膚マウス(FSM又は「薄片状皮膚マウス」、乾癬のマウスモデル)における皮膚ケラチン代謝回転を表す図である。図7が示すように、ケラチン代謝回転は、正常マウスのケラチン代謝回転(右の緩い曲線)よりも乾癬マウスモデルの方が相当迅速である(左の急勾配曲線)。
【0067】
図8は、正常マウス(C57bl/6マウス)及び薄片状皮膚マウスにおけるケラチン生成細胞代謝回転(新規のDNA合成)を表す図である(f%=DNAの部分合成)。ケラチン生成細胞代謝回転は両方のマウス種で同時に、また、両方のマウス種における皮膚ケラチン代謝回転と共に測定された(皮膚ケラチン代謝回転は図7で示す)。
【0068】
図9は、雄balb/C nu/nuマウスにおける次第に高くした用量のゲムザー(Gemzar)(ゲムシタビン)を投与した後の腫瘍細胞、結腸細胞及び骨髄細胞の細胞増殖の同時測定を表す図である。図9が示すように、次第に高くした用量のGemは腫瘍及び骨髄細胞の増殖を抑制するが、結腸細胞の増殖に対する影響は比較的小さい(Gemは、実験的な低用量では結腸細胞の増殖に対して刺激効果を有する可能性がある)。
【0069】
図10は、対照動物と比較した、雌balb/C nu/nuマウスにおけるGem及びヒドロキシ尿素(HU)による腫瘍及び骨髄細胞の細胞増殖のin vivo抑制を表す図である。ヒドロキシ尿素は公知のDNA合成阻害剤であり、広く処方される化学療法剤である。図10が示すように、Gem及びHUの両者は、生理食塩水を投与した対照マウスと比較して骨髄細胞及び腫瘍細胞の細胞増殖を減少させた。
【0070】
図11は、ビヒクル対照と比較した微小管分解阻害剤であるパクリタキセルの次第に高くした用量による、ヌード・マウスの3種類の細胞に対する細胞増殖のin vivo抑制を表す図である。パネルa)は移植されたSW1573ヒト肺癌細胞を表し、パネルb)はマウス骨髄細胞を表し、パネルc)はマウス結腸細胞(結腸細胞)を表す。3種類全ての細胞は、並行して測定された。図11が示すように、腫瘍細胞及び結腸細胞の増殖はパクリタキセルによって用量依存的に抑制されたが、骨髄細胞増殖はそうではなかった。
【0071】
図12は、雌Sprague Dawleyラットのミトコンドリア赤腓腹筋における、カルジオリピン及びmtDNAの部分合成を表す図である。カルジオリピン及びmtDNAは、同時に測定された。Ex=運動。4週間運動したマウスと同じ期間運動を行わなかったマウスにおいて変化は観察されなかったが、ミトコンドリア生合成のバイオマーカーとしてカルジオリピンはmtDNAと同等であることが明らかになった。
【0072】
図13は、雌Sprague Dawleyラットの心臓のミトコンドリアにおけるカルジオリピン及びホスファチジルコリンの部分合成を示す。カルジオリピン及びホスファチジルコリンは同時に測定した。Ex=運動。4週間運動したマウスと同じ期間運動を行わなかったマウスにおいて変化は観察されなかったが、ホスファチジルコリンはミトコンドリア生合成のバイオマーカーとしてカルジオリピンと同等であることが示された。
【0073】
図14は、腫瘍内皮細胞増殖、肝臓内皮細胞増殖、腫瘍細胞増殖、及び総肝臓細胞増殖を示す。測定は同時に行った。詳細については上記の実施例15を参照のこと。
【0074】
図15は、2つの用量の四塩化炭素(CCl4)及びビヒクル対照に応答したC57B/6総肝臓細胞増殖を示す。図15は、ビヒクル対照と比較してCCl4の両方の用量が総肝臓細胞増殖を増大させたことを示す。総肝臓細胞増殖は、以下の図16に示す肝臓コラーゲン合成と同時に測定した。
【0075】
図16は、2つの用量のCCl4投与及びビヒクル対照に応答したC57B/6肝臓コラーゲン合成を示す。測定は、上記の図15に示す総肝臓細胞増殖と同時に実施した。図16は、高用量のCCl4のみが肝臓コラーゲン合成を増大し、低用量のCCl4は総肝臓細胞増殖を増大させるが、ビヒクル対照と比較して肝臓コラーゲン合成には影響を及ぼさなかった。
【0076】
図17は、グリセオフルビン投与(0.1、0.2、及び0.5%を5日)後のC57BL/6マウス肝臓細胞増殖を示す(全ての群についてp<0.05)。図17は、対照と比較して用量依存的に肝臓細胞増殖が増大したことを示している。最低用量のグリセオフルビンは肝臓細胞増殖に対して観察可能な作用を及ぼした。肝臓コラーゲン合成を肝臓細胞増殖と同時に測定した。CCl4(上記の図16)とは異なり、グリセオフルビンは試験した用量において肝臓コラーゲン合成に対して影響を及ぼさなかった(データは示さない)。
【発明を実施するための最良の形態】
【0077】
本出願人は、単一プロトコールによって、種々の生体分子、特には多様な生化学クラスに属する生体分子の相対分子流速を測定する方法を発見した。最初に、アイソトープ標識した水、すなわちユニバーサルな前駆体を、組織又は個体に投与する。2又はそれ以上の生体分子の分子流速が、その分子が異なる化学クラスのものであっても、同時にかつ単一プロトコールにより測定することができる。
【0078】
I.一般的な手法
本発明の実施は、他に断りがない限り、従来の手法、すなわち、分子生物学(組換え手法を含む)、微生物学、細胞生物学、生化学、および免疫学の手法を用いるが、これらは当技術分野の技能の範囲内である。そのような手法は、Molecular Cloning: A Laboratory Manual、第2版 (Sambrookら、1989年)、Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait編、1984年); Methods in Molecular Biology、Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis編、1998年)、Academic Press; Animal Cell Culture (R.I. Freshney編、1987年); Introduction to Cell and Tissue Culture ( J.P. Mather及びP.E. Roberts、1998年)、Plenum Press;Cell and Tissue Culture: Laboratory Procedures (A. Doyle、J.B. GriffithsおよびD.G. Newell編、1993〜8年)、J. Wiley and Sons;Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell編); Gene Transfer Vectors for Mammalian Cells (J.M. Miller及びM.P. Calos編、1987年); Current Protocols in Molecular Biology (F.M. Ausubelら編、1987年); PCR: The Polymerase Chain Reaction、(Mullisら編、1994年); Current Protocols in Immunology (J.E. Coliganら編、1991年); Short Protocols in Molecular Biology (Wiley and Sons、1999年);およびMass isotopomer distribution analysis at eight years: theoretical, analytic and experimental considerations by Hellerstein and Neese (Am J Physiol 276 (Endocrinol Metab. 39) E1146〜E1162、1999年)などの文献に詳しく説明されている。さらに、他に断りのない限り、市販のアッセイキットおよび試薬を用いた手順は、一般的に製造者規定のプロトコルにしたがって使用する。
【0079】
II.定義
他に定義しない限り、本明細書に使用されている全ての技術用語、表記法および他の科学的用語法は、この発明が関連する分野の技能を有する者が通常に理解する意味を持つことを意図している。ある場合には、通常に理解されている意味を持つ用語が、明確性のためおよび/または容易な参照のためにここで定義されるが、そのような定義を本明細書に含めることは、当分野において一般に理解されていることとの実質的な差異を表していると必ずしも理解されべきものではない。ここで説明または参照される手法や手順は、一般的によく理解されており、従来の方法論で当業者によって通常に用いられている。例えば、Hellerstein及びNeeseによるMass isotopomer distribution analysis at eight years: theoretical, analytic and experimental considerations (Am J Physiol 276 (Endocrinol Metab. 39) E1146〜E1162頁、1999年)である。必要に応じて、市販のキットおよび試薬の使用を伴う手順は、他に断らない限り、一般に製造者規定のプロトコルおよび/またはパラメータにしたがって実行される。
【0080】
「分子流速」は、生体分子の合成または産生および分解または除去の速度を指す。「分子流」は従って、分子のプールに出入りする流れと同義である。
【0081】
「アイソトポマー」は、例えばCH3NH2、CH3NHDおよびCH2DNH2のように、同一の元素組成を有するが、アイソトープの置換のために構成的および/または立体化学的に異性体であるアイソトープ異性体または種を指す。
【0082】
「アイソトポローグ」は、同一の元素および化学組成を有するが、アイソトープ含量において異なるアイソトープの同族体または分子種(例えば、上記例においてはCH3NH2とCH3NHD)を指す。アイソトポローグは、それらのアイソトープ組成によって定義され、従って各アイソトポローグは、単一の厳密な質量を有するが、単一の構造は有していない可能性がある。1つのアイソトポローグは、普通は、分子上のアイソトープの位置が異なるアイソトープ異性体(アイソトポマー)のファミリーを構成する(例えば、CH3NHDとCH2DNH2は同じアイソトポローグであるが、異なるアイソトポマーである)。
【0083】
「質量アイソトポマー」は、アイソトープ組成よりもむしろ名目上の質量に基づいて分類したアイソトープ異性体のファミリーを指す。質量アイソトポマーは、アイソトポローグと違って、異なるアイソトープ組成の分子を含むこともある(例えば、CH3NHD、13CH3NH2、CH315NH2は、同じ質量アイソトポマーのものであるが、異なるアイソトポローグである)。実際上の意味では、質量アイソトポマーは、質量分析計では分析できないアイソトポローグのファミリーである。このことは、四極子質量分析計にとっては、質量アイソトポマーが、ある1つの名目上の質量を共有するアイソトポローグのファミリーであることを意味する。すなわち、アイソトポローグであるCH3NH2とCH3NHDは、名目上の質量において異なり、異なる質量アイソトポマーとして識別されるが、アイソトポローグであるCH3NHD、CH2DNH2、13CH3NH2およびCH315NH2は、全て同じ名目上の質量のものであり、それ故に同じ質量アイソトポマーである。各質量アイソトポマーは、従って、典型的には二つ以上のアイソトポローグからなり、二つ以上の厳密な質量を有する。全ての個々のアイソトポローグは、四極子質量分析計を使って分析できず、そして、より高い質量分析能を有する質量分析計を使っても分析できないため、質量分析データからの計算は、アイソトポローグよりもむしろ質量アイソトポマーの存在度に対して行う必要がある。したがって、アイソトポローグと質量アイソトポマーとの区別は実際の場では有用である。質量が最低の質量アイソトポマーをM0として表し、これは、大半の有機分子では、12C、1H、10O、14Nなどを全て含有する種である。他の質量アイソトポマーは、それらの質量によりM0から識別される(M1、M2など)。所定の質量アイソトポマーにおいて、その分子内でのアイソトープの場所または位置は、特定されておらず、多様でありうる(すなわち、「位置的なアイソトポマー」は識別されない)。
【0084】
「質量アイソトポマーパターン」は、分子の質量アイソトポマーの存在度のヒストグラムを指す。典型的には、このパターンは、全ての存在度を最も多量の質量アイソトポマーの存在度に対して正規化した相対存在度百分率として表され、最も多量のアイソトポマーは100%である。しかしながら、確率分析を伴う本出願の好ましい形態が存在度比率または部分であり、すなわち、それぞれの種が全体の存在度に寄与する比率が使用される(下記を参照のこと)。アイソトープパターンという用語は、質量アイソトポマーパターンの代わりに使うこともある。ただし技術的には、前者の用語は、元素におけるアイソトープの存在度パターンにのみ適用されるものである。
【0085】
「個体」は、脊椎動物、好ましくは哺乳動物、より好ましくはヒトである。
【0086】
「生体分子」は、組織または個体中で合成される任意の1又は複数の分子を指す。生体分子は、限定されるものではないが、総細胞タンパク質のセット、ゲノムDNA、ミトコンドリアDNA、メッセンジャーRNA、またはリボソームRNAなどの分子クラスを指してもよい。あるいは、生体分子は、特定のタンパク質(例えば、アポリポタンパク質)もしくは特定のポリヌクレオチド配列(例えば、アポリポタンパク質をコードするポリヌクレオチド)などの、特定の構造的特徴または配列を有する特定の分子であってもよい。
【0087】
本明細書で用いる、「危険性のある」個体は、疾患状態または生理状態を発症する可能性が、危険性のない個体よりも高いと考えられる個体である。「危険性のある」個体は、疾患もしくは生理状態を示唆する検出可能な症候を有しても有さなくてもよく、また本明細書に開示される治療方法(例えば、治療的介入)の前に検出可能な疾患を示していてもいなくてもよい。「危険性のある」とは、個体が1つ以上のいわゆる危険因子を有するということである。1つ以上のこれらの危険因子を有する個体は、これらの危険因子を有さない個体よりも、1種以上の疾患または生理状態を発症する可能性が高い。これらの危険因子としては、限定されるものではないが、1種以上の疾患、関連する症状、もしくは病理を発症する家族員の履歴、以前の疾患の病歴、年齢、性別、人種、食事、前兆となる疾患の存在、遺伝子的(すなわち、遺伝的)考慮、および環境への曝露などが挙げられる。
【0088】
本明細書で用いる「アイソトープ標識水」には、水素又は酸素のいずれかの1以上の特定の重同位体で標識された水が含まれる。アイソトープ標識水の具体例としては、2H2O、3H2O、およびH218Oが挙げられる。
【0089】
「部分的に精製する」は、ある混合物の1または複数の成分を他の類似化合物から取り除く方法を指す。例えば、「タンパク質またはペプチドを部分的に精製する」は、1または複数の生体分子を1または複数の生体分子の混合物から取り除くことを指す。
【0090】
「単離する」は、化合物の混合物から1つの化合物を分離することを指す。例えば、「タンパク質またはペプチドを単離する」は、1つの特定のタンパク質またはペプチドを1または複数の生体分子の混合物中のほかの全ての生体分子から分離することを指す。
【0091】
「生体試料」は、組織または個体から得られる任意の試料を含む。この定義は、血液、および侵襲性が最小または非侵襲性の手法(例えば、蓄尿、採血、針吸引や、危険、不快感または困難度が最小の他の手順)による採取によって個体から入手可能な他の生体由来の液体試料を含む。この定義はまた、試料獲得後に、試薬による処理、可溶化、あるいは、タンパク質やポリヌクレオチドのような成分の濃縮のような、いかなる方法でも操作された試料も含む。「生体試料」という用語はまた、血清、血漿、他の生体液あるいは組織試料などの臨床の試料を含み、さらに培養中の細胞、細胞上清および細胞溶解を含む。
【0092】
「生体液」は、尿、血液、間質液、浮腫液、唾液、涙液、炎症性浸出物、滑液、膿瘍、蓄膿または他の感染液、脳脊髄、汗、肺分泌物(痰)、精液、糞便、胆汁、腸分泌物または他の体液を含むが、それらに限定されない。
【0093】
「化学物質」には、それが新規であっても公知であっても、研究中の可能性ある治療薬(薬剤、又は薬物候補もしくはリード薬物)の目的に対して生物学的又は生化学的活性について、あるいは解明された毒性作用(産業化学物、殺虫剤、除草剤、食品添加物、化粧品など)について、それをスクリーニングする目的で生体系に投与される、任意の分子、化学物又は化合物が含まれる。
【0094】
「リード薬物」又は「候補薬物」は、本明細書において、治療薬(薬剤)としての可能性があると評価された化学物質又は生体分子として定義される。「薬剤」又は「薬物」又は「化合物」は本明細書において互換的に用いられ、治療薬としての可能性あるものとして投与され、承認され又は試験中である、あるいは公知の治療薬である、任意の組成物(例えば、化学物質又は生物学的因子)を説明するものである。
【0095】
「公知の薬剤」又は「公知の薬物」又は「既に承認された薬剤」とは、合衆国又は他の管轄区域においてヒト又は動物において薬剤としての治療用途について承認された薬物(すなわち化学物質又は生物学的因子)を意味する。本発明において、用語「既に承認された薬剤」は、本明細書に開示の方法の用途について試験された適応症とは異なる適応症について承認を受けた薬剤を意味する。乾癬及びフルオキセチンを例として用いると、本発明の方法により、鬱病の治療についてFDAより承認を受けたフルオキセチンを、乾癬のバイオマーカー(例えば、ケラチン生成細胞増殖又はケラチン合成)に対する作用について試験することが可能となる。フルオキセチンによる乾癬の治療は、FDA又は他の管轄区域により承認されていない。このように、既に承認された薬剤(この例ではフルオキセチン)について、新たな用途(この例では抗乾癬作用)を見出すことができる。
【0096】
「生物学的因子」とは、生物学的又は生理学的活性(例えば、予防、治療及び/又は毒性作用)を有する生きた生物により生成される化合物(又は複数の化合物)を意味する。生物学的因子の例としては、限定されるものではないが、ワクチン、ポリクローナル又はモノクローナル抗体、組換えタンパク質、単離されたタンパク質、可溶性受容体、遺伝子治療産物などが挙げられる。本明細書において用いる用語「生物製剤(biologics)」は、「生物学的因子」と同義語である。
【0097】
本発明において、「化合物」とは、任意の新たな化学物質、化学物質、リード薬物、候補薬物、薬物、薬剤、治療剤、作用物質、公知の薬物、公知の薬剤、既に承認されている薬物、生物製剤、又は生物学的因子を意味する。
【0098】
「治療標的」は、疾病又は病状に関連する生理の変化を媒介する又は媒介すると考えられる生体内又は生体上の部位(例えば、1以上の代謝経路内の分子)を意味する。多くの場合、治療標的は未知であるが、以下により詳細に説明するように、本発明の方法により、1以上の化合物を組織若しくは個体又は組織若しくは個体の集団に投与し、分子流速の変化を測定することによって、1以上の治療標的が発見される。
【0099】
III.本発明の方法
本発明者は、アイソトープで標識した水が、組織及び個体において合成される本質的に全ての生体分子(特に種々の化学クラス)のユニバーサルな前駆体であることを発見した。したがって、アイソトープ標識水を組織又は個体に導入することによって、アイソトープ標識が該組織又は個体の生体分子に取込まれる。複数の生体分子の相対分子流速を測定し、比較することができる。生体分子の例を、これに限定されるものではないが、表1に例示する。測定可能な生物学的プロセスの例は表2に示す。
【0100】
従って、本出願は、個体において2又はそれ以上の生体分子の相対分子流速を測定し比較する方法に関し、a)アイソトープで標識した水を個体に投与するステップであって、該標識が、2又はそれ以上の生体分子が異なる化学クラスのものであってもその2又はそれ以上の生体分子に取込まれて2又はそれ以上のアイソトープで標識された生体分子を形成するのに十分な時間にわたって投与するステップ、b)組織又は個体から、2又はそれ以上のアイソトープで標識された生体分子を含有する1又はそれ以上の生体試料を得るステップ、c)上記2又はそれ以上の生体分子における標識の取込みを測定し、その生体分子の分子流速を決定するステップ、並びにd)上記生体分子の分子流速を比較し、相対分子流速を分析するステップ、により行う。
【0101】
A.1以上の組織又は個体へのアイソトープ標識水の投与
(1)2H、3H又は18Oアイソトープ標識水の取込みの理論
H2Oの利用能は、細胞における生合成反応におそらく限定されるものではないが(H2Oは細胞の内容物の70%近くであり、35モル濃度を超えるため)、H2Oの水素原子及び酸素原子が生合成経路に関与する多くの反応に化学量論的に寄与している:
【化1】

【0102】
結果として、H又はOアイソトープで標識された水の形態で提供されるアイソトープ標識は、合成経路の一部として生体分子中に取込まれる。水素の取込みは2つの経路において生じ、分子中の不安定な位置(すなわち、迅速に変換されるものであり、酵素触媒反応を必要としない)、又は安定な位置(すなわち、迅速には変換されず、酵素触媒を必要とする)への取込みがある。酸素の取込みは安定な位置において起こる。
【0103】
細胞中の水から生体分子中のC−H結合への水素取込みステップの中には、生合成反応順序の十分に確立された酵素触媒ステップの間においてのみ起こり、成熟最終生成分子に一度存在すれば不安定ではない(組織中の溶媒水と変換可能である)ものもある。例えば、グルコース上のC−H結合は、溶液中で変換可能ではない。対照的に、以下のC−H位置はそれぞれ特定の酵素反応の逆転過程で体内の水と変換する。クレブス回路におけるオキサロ酢酸/コハク酸連続反応及び乳酸/ピルビン酸反応におけるC−1及びC−6、グルコース−6−リン酸/フルクトース−6−リン酸反応におけるC−2、グリセルアルデヒド−3−リン酸/ジヒドロキシアセトン−リン酸反応におけるC−3及びC−4、3−ホスホグリセリン酸/グリセルアルデヒド−3−リン酸及びグルコース−6−リン酸/フルクトース−6−リン酸反応におけるC−5(Katz 1976)。
【0104】
それにより、分子の特定の不安定ではない位置に共有結合により取込まれた水からの標識水素又は酸素原子は、分子の「生合成の歴史」を明らかにする。すなわち、標識の取込みは、分子がアイソトープ標識水が細胞中の水に存在していた期間に合成されたことを表す。
【0105】
これらの生体分子中の不安定な水素(非共有結合する又は変換可能な共有結合中に存在する)は、分子の生合成の歴史を明らかにするものではない。しかしながら、不安定な水素原子は、非標識水(H2O)とのインキュベーションにより(すなわち、2H又は3Hが最初に取込まれると考えられる同じ非酵素変換反応の逆転により)容易に除去されうる:
【化2】

【0106】
結果として、生合成歴を反映しないが、合成によらない変換反応によって取込まれた、混入する可能性のある水素標識は、天然に存在するH2Oとのインキュベーションにより実際には容易に除去することができる。
【0107】
分析方法は、標識水素原子の生体分子への取込みを定量的に測定するために利用可能である(例えば、3Hについての液体シンチレーションカウンター、2H及び18Oについての質量分析法又はNMR分光法)。アイソトープ標識水の取込みの理論に関するさらなる議論については、例えばJungas 1968(参照により本明細書に組み入れる)を参照されたい。
【0108】
(2)アイソトープ標識水から生体分子へのアイソトープの取込み
アイソトープ標識水は、アイソトープ標識水の連続投与、アイソトープ標識水の不連続投与、又はアイソトープ標識水の投与の単回若しくは複数回投与により、投与することができる。アイソトープ標識水の連続投与においては、アイソトープ標識水は、一定時間にわたり個体における比較的一定の水の存在(濃縮)を維持するために十分な時間にわたって、個体に投与する。連続的方法において、標識水は、定常濃度を達成するために十分な期間(例えばヒトにおいて3〜8週間、げっ歯類において1〜2週間)にわたり投与することが最適である。
【0109】
アイソトープ標識水の不連続投与においては、ある量のアイソトープ標識水を測定して、その後1回以上投与し、続いてアイソトープ標識水への暴露を中断し、体内の水プールからアイソトープ標識水が洗い出されるようにする。その後、脱標識の時間経過をモニターしうる。水は、生体分子におけるレベルが検出可能となるように十分な期間にわたって投与することが最適である。
【0110】
アイソトープ標識水は、当技術分野で公知の種々の方法で個体又は組織に投与することができる。例えば、アイソトープ標識水は、経口、非経口、皮下、血管内(例えば動脈内若しくは静脈内)、又は腹腔内に投与する。2H2O及びH218Oの市販供与源がいくつかあり、例えばIsotec, Inc.(Miamisburg OH)及びCambridge Isotopes, Inc.(Andover, MA)がある。投与するアイソトープ標識水のアイソトープ含量は、約0.001%〜約20%の範囲とすることができ、これは生体分子のアイソトープ含量を測定するために用いられる機器の分析感度に応じて異なる。経口投与の場合、飲料水中4%2H2Oを投与する。ヒトの投与については、50mLの2H2Oを投与する。
【0111】
生体分子
アイソトープ標識水からのアイソトープ標識は、組織又は個体において合成される実質的に全ての生体分子に取り込まれる。生体分子の例としては、限定されるものではないが、タンパク質(特定のタンパク質、総細胞タンパク質、アポリポタンパク質、免疫グロブリン、コラーゲン、エラスチン及びケラチンなど)、ポリヌクレオチド(特定のDNA又はRNA配列、総細胞DNA、ゲノムDNA、ミトコンドリアDNA、総細胞RNA、メッセンジャーRNA、リボソームRNA、トランスファーRNAなど)、脂質及び脂質合成成分(例えばコレステロール、コレステロールエステル、トリグリセリド、脂肪酸及びアシルグリセリドなど)、糖質、グリコサミノグリカン、プロテオグリカン、及びこれらの組み合わせ又はポリマーが挙げられる。生体分子は、組織若しくは個体のもの、又は組織若しくは個体内に含まれる生物のものでありうる。生体分子の一部の非限定的な例示を表1に示す。
【表1】


【表2】


【0112】
生体分子としてのタンパク質
一実施形態において、アイソトープ標識水からのアイソトープ標識をタンパク質に取込むことができる。ペプチドおよびタンパク質のO−H結合及びN−H結合は水溶液中では不安定であるので、C−H結合上の水素原子が2H2O由来のタンパク質合成を測定するために有用なアミノ酸上の水素原子となる。2H2O由来の2H標識のO−H結合またはN−H結合への交換は、上述のように遊離アミノ酸からのタンパク質の合成なしに起こる。C−H結合は、特異的な酵素触媒による中間代謝反応の間にH2Oから遊離アミノ酸への取り込みを受ける(図1)。したがって、2H2O投与後のタンパク質結合アミノ酸のC−H結合における2H標識の存在は、タンパク質が2H2O暴露の期間中に遊離型であったアミノ酸から組み立てられたこと、すなわち、タンパク質が新たに合成されたことを意味する。分析的には、使用されたアミノ酸誘導体はC−H結合をすべて含まなくてはならないが、すべての混入の可能性があるN−H結合およびO−H結合を除去しなくてはならない。
【0113】
体内水分由来の水素原子は遊離アミノ酸に取り込まれうる。アイソトープ標識水由来の2Hまたは3Hは、中間代謝反応を介して細胞内の遊離アミノ酸に入ることができるが、2Hまたは3Hは、ペプチド結合中に存在するまたはトランスファーRNAに結合されたアミノ酸に入ることはできない。遊離の必須アミノ酸は体内水分由来の1個の水素原子をα炭素のC−H結合に、急速な可逆的アミノ基転移反応を介して、取り込みうる(図1)。もちろん、遊離の非必須アミノ酸はより多数の代謝的に交換可能なC−H結合を含み、したがって、新たに合成されたタンパク質中に、1分子あたりより高い2H2O由来のアイソトープ濃縮値を示すことが期待される(図1A〜B)。
【0114】
当業者は、体内水分由来の標識された水素原子が他の生化学的経路によって他のアミノ酸内に取り込まれうることを認識するであろう。例えば、水由来の水素原子がクエン酸回路において前駆体α−ケトグルタル酸の合成を経てグルタミン酸に取り込まれることは当技術分野において公知である。グルタミン酸は、順に、グルタミン、プロリン、およびアルギニンの生化学的前駆体になることが知られている。別の例として、体内水分由来の水素原子は3−メチルヒスチジンのメチル基、ヒドロキシプロリンまたはヒドロキシリジンのヒドロキシル基などのような翻訳後修飾されたアミノ酸に取り込まれる可能性がある。他のアミノ酸合成経路も当業者には公知である。
【0115】
また、酸素原子(H218O)も酵素触媒反応を介してアミノ酸に取り込まれうる。例えば、酵素触媒反応の際にアミノ酸のカルボン酸部分への酸素交換が起こりうる。標識した酸素のアミノ酸への取り込みは、図1Cに示すように当業者に公知である。また酸素原子は酵素触媒反応を介して18O2からアミノ酸(ヒドロキシプロリン、ヒドロキシリジン、または他の翻訳後修飾アミノ酸を含む)に取り込まれる可能性がある。
【0116】
アイソトープ標識水に由来する水素および酸素の標識はまた、翻訳後修飾を介してアミノ酸に取り込まれうる。一つの実施形態では、翻訳後修飾は翻訳後修飾に先立つ生合成経路により標識された水素または酸素をすでに含むことができる。別の実施形態では、翻訳後修飾は翻訳後修飾ステップ(例えば、メチル化、水酸化、リン酸化、プレニル化、硫酸化、カルボキシル化、アセチル化または他の公知の翻訳後修飾)の前または後のいずれかに、体内水分由来の遊離の交換標識水素に関わる代謝誘導体からの標識された水素、酸素、炭素、または窒素を取り込むことができる。
【0117】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するようなアミノ酸、ペプチド及びタンパク質に取込むことが可能である。表1に挙げられたアミノ酸、ペプチド及びタンパク質は例示にすぎず、任意のアミノ酸、ペプチド又はタンパク質にアイソトープ標識を取込むことができる。
【0118】
生体分子としてのポリヌクレオチド
アイソトープ標識水からのアイソトープ標識はまた、ポリヌクレオチドに取込むことが可能である(例えば図2参照)。ポリヌクレオチドとしては、限定されるものではないが、デオキシリボ核酸(DNA)及びリボ核酸(RNA)、例えばメッセンジャーRNA(mRNA)、リボソームRNA(rRNA)、トランスファーRNA(tRNA)及びウイルスRNAがある。ポリヌクレオチドは、任意の供与源、例えばゲノムDNA、ミトコンドリアDNA及び組織RNAなどに由来するものであってよい。ゲノムDNA及び核DNAは本明細書において互換的に用いられる。
【0119】
ポリヌクレオチド、ポリヌクレオシド、およびヌクレオチドまたはヌクレオシド前駆体のC−H結合上の水素原子は、アイソトープ標識水からのポリヌクレオチド合成を測定するために用いることができる。C−H結合はH2Oからポリヌクレオチド前駆体への交換を受ける。したがって、アイソトープ標識水投与後のポリヌクレオチド、ヌクレオシド、およびヌクレオチドまたはヌクレオシド前駆体のC−H結合における2H標識の存在は、ポリヌクレオチドがこの期間中に合成されたことを意味する。存在する標識の程度は実験的に測定することができ、また、ポリヌクレオチドもしくはヌクレオシドの標識化部位の数に基づいて推定することもできる。
【0120】
体内水分由来の水素原子は遊離のヌクレオシドまたはポリヌクレオチド中に取り込まれうる。アイソトープ標識水由来の2Hまたは3Hは中間代謝反応を介してこれらの分子に入ることができる。
【0121】
当業者は、体内水分由来の標識された水素原子が様々な生化学的経路によって他のポリヌクレオチド、ヌクレオチド、またはヌクレオシド内に取り込まれうることを認識するであろう。例えばグリシン、アスパラギン酸、グルタミン、およびテトラヒドロ葉酸はプリン環の公知の前駆体分子である。例えばカルバミルリン酸およびアスパラギン酸はピリミジン環の公知の前駆体分子である。リボースおよびリボースリン酸、ならびにそれらの合成経路はポリヌクレオチド合成の公知の前駆体である。
【0122】
また、酸素原子(H218O)も、上記に挙げられたものを含む酵素触媒による生化学反応を介してポリヌクレオチド、ヌクレオチド、またはヌクレオシドに取り込まれうる。また18O2(18H2)由来の酸素原子は、非酵素的な酸化反応を含む酸化反応(8−オキソグアニンおよび酸化型塩基または酸化型ヌクレオチドの形成のような酸化的傷害を含む)によってヌクレオチドに取り込まれうる。
【0123】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するような核酸又はその成分に取込むことが可能である。表1に挙げられた核酸及び核酸成分は例示にすぎず、任意の核酸又は核酸成分にアイソトープ標識を取込むことができる。
【0124】
生体分子としての脂質及び脂質成分
アイソトープ標識水からのアイソトープ標識はまた、当技術分野で公知の生化学経路により、脂肪酸、アシル−グリセロールのグリセロール部分(例えば限定されるものではないが、トリアシルグリセリド、リン脂質、及びカルジオリピン)、コレステロール及びその誘導体(例えば限定されるものではないが、コレステロール−エステル、胆汁酸、ステロイドホルモン)に取込むことが可能である。
【0125】
セレブロシド(N−アセチルガラクトサミン、N−アセチルグルコサミン硫酸、グルクロン酸、およびグルクロン酸硫酸を含むがそれに限定されない)の糖部分に対する前駆体である、糖脂質およびセレブロシドなどの複合脂質もまた、アイソトープ標識水から標識され得る。
【0126】
アイソトープ標識水からのアイソトープはまたグリコサミノグリカンおよびプロテオグリカンに取込むことも可能である。例えば、アイソトープ標識水からのアイソトープは、N−アセチルグルコサミン、N−アセチルガラクトサミン、グルクロン酸の糖部分、N−アセチルグルコサミン及びN−アセチルガラクトサミン、ガラクトース、イズロン酸などの種々の硫酸に取込むことができる。
【0127】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するような脂質又は脂質誘導体に取込むことが可能である。表1に挙げられた脂質及び脂質誘導体は例示にすぎず、任意の脂質又は脂質誘導体にアイソトープ標識を取込むことができる。
【0128】
生体分子としての糖質及び糖質誘導体
表1に挙げられる脂質及び脂質誘導体は例示にすぎず、アイソトープ標識は任意の脂質又は脂質誘導体にアイソトープ標識を取込むことができる。
【0129】
アイソトープ標識水からのアイソトープ標識は、糖質及び糖質誘導体に取込むことが可能である。これらには、当技術分野で公知の生化学経路による、単糖類(グルコース及びガラクトースが含まれるが限定されるものではない)、アミノ糖(N−アセチル−ガラクトサミンなど)、多糖類(グリコーゲンなど)、糖タンパク質(シアル酸など)、糖脂質(ガラクトセレブロシドなど)、グリコサミノグリカン(ヒアルロン酸、コンドロイチン−硫酸、及びヘパラン−硫酸など)が挙げられる。
【0130】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するような糖質又は糖質誘導体に取込むことが可能である。表1に挙げられた糖質又は糖質誘導体は例示にすぎず、任意の糖質又は糖質誘導体にアイソトープ標識を取込むことができる。
【0131】
上記は例示目的である。アイソトープ標識は他の任意の公知の生体分子に取込むことが可能である。
【0132】
B.1以上の組織又は個体からの1以上の生体試料の取得
1以上の生体試料は、組織又は個体から得られる。1以上の生体試料は、例えば採血、採尿、生検、または当技術分野において公知の他の方法によって取得できる。1以上の生体試料は1以上の生体液でありうる。生体試料はまた、筋肉、肝臓、副腎組織、前立腺組織、子宮内膜組織、血液、皮膚、および乳房組織のような特定の器管または組織から取得してもよい。生体試料は、腫瘍細胞または線維芽細胞のような特定の細胞の群から取得しうる。1以上の生体試料は、死前に又は死後に取得しうる。生体分子は、当技術分野において公知の標準的な生化学的方法を用いて生体試料から取得し、場合により、部分精製または単離を行ってもよい。
【0133】
1又はそれ以上の生体試料は一緒に、2又はそれ以上の生体分子を含む。例えば、全ての生体分子が1つの生体試料から得てもよい。あるいは、1つの生体分子が第1の生体試料から得られ、別の生体分子が第2の生体試料から得てもよい。2又はそれ以上の生体分子は、各生体試料から得てもよい。
【0134】
好ましい実施形態において、生体分子は、異なる化学クラスのものであってもよい。例えば、第1の生体分子は、組織又は個体の細胞タンパク質の混合物であり、第2の生体分子は組織又は個体のゲノムDNAでありうる。2又はそれ以上の生体分子はまた、種々の化学クラス内の特定の分子であってもよい。別の例として、第1の生体分子は特定のアミノ酸配列を有する特定のタンパク質であり、第2の生体分子は特定の核酸配列を有するポリヌクレオチドでありうる。
【0135】
生体試料採取の頻度は様々な要因によって変化し得る。このような要因としては、限定するものではないが、生体分子の性質、サンプル採取の容易性および安全性、生体分子又はその起源となる生体分子の分子流速、ならびに治療薬又は生物学的薬剤の半減期が含まれる。
【0136】
また生体分子は、高圧液体クロマトグラフィー(HPLC)、高速液体クロマトグラフィー(FPLC)、化学的抽出、薄層クロマトグラフィー、ガスクロマトグラフィー、ゲル電気泳動、および/または当業者に公知の他の分離法を含む従来の精製法によって部分精製することができ、場合により単離することもできる。
【0137】
別の実施形態では、生体分子は加水分解または別の方法で分解して、より小さい分子を形成させてもよい。加水分解法は、化学的加水分解(酸加水分解など)および生化学的加水分解(ペプチダーゼ、リパーゼ又はヌクレアーゼ分解など)を含むがそれらに限定されない、当技術分野において公知の任意の方法を含む。加水分解または分解は生体分子の精製および/もしくは単離の前後いずれかに行うことができる。また生体分子は、高圧液体クロマトグラフィー(HPLC)、高速液体クロマトグラフィー(FPLC)、ガスクロマトグラフィー、ゲル電気泳動、および/または当業者に公知の他の任意の化学的および/または生化学的化合物の分離法を含む従来の精製法によって部分精製することができ、場合により単離することもできる。
【0138】
C.2以上の生体分子におけるアイソトープ標識の取込みの検出
生体分子のアイソトープ濃縮は、ガスクロマトグラフフィー/質量分析(GC−MS)、アイソトープ比質量分析、GC−アイソトープ比−燃焼−MS、GC−アイソトープ比−熱分解−MS、液体クロマトグラフ−MS、エレクトロスプレーイオン化−MS、マトリックス支援レーザー脱離イオン化飛行時間型−MS、フーリエ変換イオンサイクロトロン共鳴−MS、サイクロイド−MS、核磁気共鳴(NMR)又は液体シンチレーションカウンターを含むがそれらに限定されない、質量分析などの様々な方法によって測定することができる。
【0139】
アイソトープ標識の生体分子への取込みは直接測定することができる。あるいは、アイソトープ標識の取込みは、生体分子の1以上の代謝誘導体、加水分解産物又は分解産物へのアイソトープ標識の取込みを測定することにより決定してもよい。加水分解産物又は分解産物は、場合により、公知の任意の分離方法により部分精製又は単離した後に測定してもよい。安定なアイソトープ標識物質は、1又はそれ以上の目的の代謝経路を含む生体分子に取り込まれる。このように、分子流速は、特定の時間間隔で、例えば質量分析計(上述)により標的分子中のアイソトープ含量及び/若しくはパターン、又はアイソトープ含量及び/若しくはパターンの変化の速度を測定し、当技術分野で公知の分析及び計算方法を用いて、目的の1又はそれ以上の代謝経路内の分子流速を決定することにより、決定することができる。
【0140】
生体分子中のアイソトープ標識は同時に検出することができる。例えば、質量分析計を用いて、種々の生体分子を物理的に分離、精製又は単離する必要なく、生体分子及び/又はその成分のイオンを同時に検出することができる。
【0141】
質量分析
質量分析計は生体分子及び/又はその成分を高速移動する気体イオンに変換し、質量対電荷比に基づいてそれらを分離するものである。したがって、イオンもしくはイオンフラグメントのアイソトープまたはアイソトポログの分布を用いて、2以上の生体分子のアイソトープ濃縮を測定することができる。
【0142】
一般に、質量分析計はイオン化手段および質量分析器を含む。多数の異なるタイプの質量分析器が当技術分野において知られている。これらには、磁場型分析器、静電分析器、四重極、イオントラップ、飛行時間型質量分析器、およびフーリエ変換分析器が含まれるが、それらに限定されない。さらに、1以上の質量分析器を連結(MS/MS)して、最初に前駆体イオンを分離し、続いて気相フラグメントイオンを分離して測定してもよい。
【0143】
また質量分析計は多数の異なるイオン化方法を含む。これらには、電子衝撃、化学イオン化、電界イオン化などの気相イオン化源、ならびに、電界脱離、高速原子衝撃、マトリックス支援レーザー脱離/イオン化、および表面増強レーザー脱離イオン化などの脱離源が含まれるが、それらに限定されない。
【0144】
さらに、質量分析計は、ガスクロマトグラフィー(GC)および高速液体クロマトグラフィー(HPLC)などの分離法と連結してもよい。ガスクロマトグラフフィー/質量分析(GC/MS)では、ガスクロマトグラフからのキャピラリーカラムが、場合によりジェットセパレーターを用いて、質量分析計と直接連結される。このような応用例では、ガスクロマトグラフィー(GC)カラムがサンプル気体混合物からサンプル成分を分離し、分離した成分を質量分析計でイオン化して化学的に分析する。
【0145】
GC/MS(または、小さい無機気体よりもむしろ有機分子のイオンを分析する他の質量分析計)を使用して有機分子の質量アイソトポマー存在度を測定する場合、アイソトープ標識水からの水素標識アイソトープの取り込みは、in vivoでアイソトープ標識水から有機分子に取り込まれた水素原子の数に応じて、3〜7倍に増幅される。
【0146】
液体シンチレーションカウンター
放射性アイソトープは、液体シンチレーションカウンターを用いて観察することができる。3Hなどの放射性アイソトープは、液体シンチレーション検出器により検出される放射線を発する。検出器は、放射線を電気シグナルに変換し、これを増幅する。これにより、生体分子中の放射性アイソトープの数が測定される。
【0147】
一実施形態において、生体試料中の放射性アイソトープ濃縮値は、液体シンチレーションにより直接測定することができる。別の実施形態において、放射性アイソトープは3Hである。
【0148】
別の実施形態において、生体分子又はその成分は、部分的に精製されているか又は場合により単離されており、その後、液体シンチレーションカウンターにより測定してもよい。
【0149】
分子流速の測定
分子流速は、コンビナトリアル分析により、手動で又はアルゴリズムによって計算しうる。質量アイソトポマー分布分析(MIDA)コンビナトリアルアルゴリズムの変形が、当業者に公知の多数の異なる出典において論じられている。具体的には、MIDA計算法は、米国特許第5,336,686号(参照により本明細書に組み入れる)の発明である。その方法はさらにHellersteinおよびNeese(1999)、ならびにChinkesら(1996)、KelleherおよびMasterson(1992)によっても論じられており、これらすべてを参照により本明細書にその全体を組み入れるものとする。
【0150】
前掲の文献に加えて、その方法を実行する計算ソフトウェアがカリフォルニア大学バークレー校のMarc Hellerstein教授から公表されて利用可能である。
【0151】
その後、前駆体−生成物の関係を当てはめることができる。連続標識法においては、アイソトープ濃縮は漸近的な(すなわち最大値の可能性の)濃縮と比較され、生体分子の動的なパラメータ(例えば生合成速度)は前駆体−生成物の式から計算される。不連続標識法においては、アイソトープ濃縮の減衰速度が計算され、生体分子の動的パラメータは指数関数的減衰式から計算される。
【0152】
生体分子の部分合成速度(ks)は連続標識用の前駆体−生成物の次式を適用することによって決定されうる:
ks=[−ln(1−f)]/t
〔式中、
f=部分合成=生成物濃縮/漸近的な前駆体濃縮、および
t=研究される系において接触させる標識投与の時間である〕。
【0153】
同様に、分解速度定数(kd)は指数関数的または他の速度論的減衰曲線に基づいて計算することができる:
kd=[−lnf]/t
【0154】
D.2以上の生体分子の2以上の分子流速の比較
2以上の生体分子の分子流速を比較する。この比較により、測定対象の種々の生体分子間の動的関係の分析が可能となる。
異なる生体分子の分子流速間の関係は、単一の分子流速が提供するよりも相当多くの情報を提供する。1組織や1個体において単一生体分子の分子流速を評価することは、1生体分子の名目上の分子流速に関する情報をもたらすにすぎない。しかし、相対分子流速を比較することは、分子流速の状況を提供する。例えば、全クラスの生体分子の相対分子流速を比較することは、1つのクラスの分子(例えばタンパク質)の分子流速が、もう1つのクラスの分子(例えば脂質やDNA)の分子流速より比例的に大きいかどうかを示す。単一の分子流速を測定するのみならば、組織又は個体の状況に関連した分子流速の比例関係は失われる。同一の生化学経路において特定の生体分子の相対分子流速を比較することは、1つの生体分子の分子流速の変化が、もう1つの生体分子の分子流速の変化に関係しているかどうかの分析に用いることが可能である。
【0155】
分子流速の比較は、何よりも疾病、障害、症状、治療化合物処置、及び生物学的剤や化学薬剤の毒性に関係する生体分子の動態の測定も可能にする。2以上の生体分子の相対分子流速を比較することは、単一生体分子の分子流速の名目上の変化を測定して比較するだけでは同定不能である疾病、障害、又は症状の同定に使用可能である。同様に、治療剤や生物学的薬剤の投与を原因とする相対的分子流速の変化を評価することが可能である。
【0156】
分子流速を比較することは、当技術分野で公知の技術のいずれの比較方法によっても達成可能である。例えば、2以上の生体分子の分子流速は、比率又はグラフ上の関係として表現可能である。
【0157】
疾病の発見
比較した分子流速は、疾病、障害又は病状の進行の検出、予後診断又はモニターに使用可能である。典型的ではあるが限定するものではない、測定可能な生化学的経過及び対応する疾病の例を、表2に提供する。疾病又は障害のない組織又は個体の群と、疾病又は障害のある第2の群との間の2以上の生体分子の分子流速の比較における相違は、疾病の進行の検出、予後診断、又はモニターに使用可能である。例えば、間質性肺線維症は、間質性肺線維症のある1又は複数の組織又は個体と、間質性肺線維症のないもう1つの組織又は個体との間において、肺のコラーゲン及び肺線維芽細胞DNAとの分子流速の比較における相違を比較することによって、診断、予後診断又はモニター可能である。あるいは、組織又は個体の単一群において2以上の生体分子の分子流速を2回以上比較した差は、疾病の進行の検出、予後診断又はモニターに使用可能である。
【0158】
高脂血症もまた、アポリポタンパク質B、トリグリセリド、リン脂質又はコレステロールのうち2以上の相対分子流速を、高脂血症を示す1又は複数の組織又は個体と、高脂血症を示さない1又は複数の組織又は個体と比較することによって、診断、予後診断又はモニターが可能である。1つの変形として、トリグリセリド、リン脂質又はコレステロールに関係したアポリポタンパク質Bの分子流速の上昇は、家族性複合型高脂血症の診断、予後診断又はモニターに使用可能である。例えば、その測定は、アポリポタンパク質Bの合成のトリグリセリド合成に対する比率を比較してもよい。あるいは、単一の組織又は個体の群において、分子流速を2回以上比較した差は、高脂血症の進行の発見、予後診断又はモニターに用いることが可能である。
【0159】
また、液性免疫と異なり、細胞性免疫の低下又は機能不全の状態は、T細胞又はB細胞のDNA又はタンパク質の相対分子流速を血漿免疫グロブリン(タンパク質)と比較することによって診断、予後診断又はモニターが可能である。血漿免疫グロブリンの分子流速に関連した、T細胞又はB細胞のDNAの分子流速の低下は、試験群における細胞性免疫活性化又は細胞性免疫機能の明確な低下を示す。あるいは、単一の組織又は個体の群において分子流速を2回以上比較した差は、細胞性免疫の低下又は機能不全の状態の進行の発見、予後診断又はモニターに使用可能である。
【0160】
加えて、光老化(皮膚のしわ)は、皮膚コラーゲン及び皮膚エラスチン又は皮膚脂質の相対分子流速を比較することによって、診断、予後診断又はモニターが可能である。エラスチンや脂質の分子流速に関連した皮膚コラーゲンにおける分子流速の変化は、第2の群における光老化速度の変化を示す。例えば、コラーゲン対エラスチンの合成比率の低下は、個体又は皮膚部位における、進行中の高速度の光老化と一致する。また、単一の組織又は個体の群において、分子流速を2回以上比較した差は、進行の発見、予後診断又はモニターに使用可能である。
【0161】
治療剤(化合物)試験
治療剤(すなわち化合物)の有効性は、本明細書に記載した方法を使用して試験可能である。治療剤投与群と非投与群である対照との間の2以上の生体分子の相対分子流速の差によって、投与群の組織又は個体における治療剤の有効性を同定又は測定する。また、1つの群における治療剤投与の前後での2以上の生体分子の相対分子流速の差によって、処置群の組織又は個体に対する治療剤の有効性を同定又は測定する。
【0162】
治療剤は、周知技術のいずれの化学物質又は組成物又は生物学的因子であってよい。治療剤は、例えば、The Merck Index第13版(米国版、Whitehouse Station、ニュージャージー州、米国;全文を引用することにより本明細書の一部とする)に開示されたいずれの化学物質又は組成物であってもよく、しかしこれに限定されるものではない。上述したように治療剤は生物学的因子であってもよく、この例は、モノクローナル抗体、可溶性受容体又はワクチンである。
【0163】
1つの例として、化学療法中に化学療法剤の殺腫瘍又は腫瘍静止作用を評価する方法は、細胞タンパク質と細胞DNAとの相対分子流速を比較することによって評価することが可能である。化学療法剤を投与した試験群と非投与の対照群との間の相対分子流速の差によって、化学療法剤を必要とする組織又は個体における化学療法剤の有効性を評価する。例えば、タンパク質合成に対するDNA合成の相対速度が、化学療法剤投与後に、又は化学療法剤非投与群と比較して投与群において低下する場合には、化学療法剤には腫瘍静止作用があると結論できるであろう。また、タンパク質合成に対するDNA合成の相対速度が、化学療法剤投与後又は化学療法剤非投与群と比較して投与群において依然としてほぼ同等である場合には、化学療法剤には殺腫瘍作用があると結論できるであろう。あるいは、1又は複数の組織又は個体における化学療法剤投与前後の相対分子流速の差によって、化学療法剤の有効性を評価する。
【0164】
抗生物質の殺作用や静止作用は、化学療法剤ではなく抗生物質を投与することによって同様に評価可能である。例えば、タンパク質合成に対するDNA合成の相対速度が、該抗生物質投与後に、又は抗生物質非投与群に比較して投与群において低下する場合には、該抗生物質には該組織や該個体において該感染生物に対する静止作用があると結論できるであろう。「殺作用」は、抗生物質によって標的感染生物を死滅させることを意味する。「静止作用」は、抗生物質によって標的感染生物の生育又は複製又は増殖又は再生を阻害することを意味する。感染生物が細菌である場合には、用語「殺菌性」は、抗生物質に適用する。同様に、用語「静菌性」は、細菌の生育又は複製又は増殖又は再生を阻害する抗生物質に適用する。
【0165】
もう1つの実施形態において、消耗性疾病又は虚弱性障害のある1又は複数の組織又は個体におけるアンドロゲンの1又は複数の有益な治療作用が評価可能である。アンドロゲンを投与した群とアンドロゲンを非投与の群との間における脂肪組織のトリグリセリドの分子流速に関連した筋肉タンパク質又はDNAの分子流速の差によって、有益な治療作用を同定又は測定する。あるいは、1又は複数の組織又は個体の群でのアンドロゲン投与の前後における相対分子流速の差によって、その有効性を評価する。脂肪組織のトリグリセリドの分子流速に関連した筋肉のタンパク質やDNAの分子流速が投与後に上昇することによって、消耗性疾病又は虚弱性障害に対するアンドロゲンの有益な治療作用を同定する。消耗性疾病又は虚弱性障害に対する、成長ホルモンといった他の筋肉タンパク質同化因子の有益な治療作用は、アンドロゲンではなく成長因子の投与によって、同様に同定可能である。
【0166】
本明細書に開示した方法は、タモキシフェンやラロキシフェン等の選択的エストロゲンモジュレーター(SERM)の1又は複数の有益な治療作用の同定にも、使用可能である。例えば、乳癌の予防におけるSERMの有益な治療作用は、SERMを投与した第1の群の組織又は個体をSERM非投与の個体又は複数個体と比較して、乳腺上皮細胞DNAの乳組織タンパク質や脂質に対する相対分子流速を評価することによって、同定可能である。第1の生体分子は、乳腺上皮細胞DNAであり、第2の生体分子は、乳房中の1又は複数のエストロゲン不感受性細胞からのタンパク質やDNAでありうる。エストロゲン不感受性細胞は、例えば脂肪、線維芽細胞、間質細胞、内皮細胞又は他の非上皮細胞由来としうる。また、SERM投与前後での1又は複数の組織又は個体の群の相対分子流速の差によって、有益な治療作用を同定する。乳房の組織タンパク質又は脂質の分子流速と関連した乳腺上皮細胞DNAの分子流速の低下によって、乳癌に対するSERMの有益な予防作用を同定する。
【0167】
高齢で体調不良の患者に有酸素能力(適応度)増強のために付与される、運動療法計画又は治療剤の有益な治療作用が、筋肉組織において、薬剤を投与していない群又は1若しくは複数の個体に対して、薬剤投与した1若しくは複数の個体の群のミトコンドリアDNA又はカルジオリピンの相対分子流速をゲノムDNA又は細胞タンパク質の混合物の相対分子流速と比較することによって、同定可能である。また有益な治療作用は、1又は複数の個体群の分子流速を、同一個体又は複数個体において薬剤投与前後に比較することによって同定可能である。筋肉のゲノムDNAや細胞タンパク質混合物の分子合成速度に対する筋肉のミトコンドリア又はカルジオリピンの分子合成速度の上昇によって、適応度に対する運動療法計画や治療剤の有益な治療作用を同定する。
【0168】
そのほかに、アルツハイマー病においては、ホルモン剤や他の治療剤の有益な治療作用が髄液又は血中アミロイドβタンパク質(脳における線維化のマーカー)、及び髄液又は血中25−ヒドロキシコレステロール(脳細胞の修復と代謝回転の一般的なマーカー)との相対分子流速を、1又は複数の個体群においてホルモン剤や他の治療剤投与の前後に比較することによって同定可能である。あるいは、有益な治療作用は、ホルモン剤や他の治療剤投与後に1又は複数の個体群において、これらの相対分子流速をホルモン剤や他の治療剤非投与のアルツハイマー病患者と比較することによって同定可能である。25−ヒドロキシコレステロールの分子流速に関連してアミロイドβタンパク質の分子流速が低下することによって、アルツハイマー病に対するホルモン剤や他の治療剤の有益な治療作用を同定する。
【0169】
本発明は、生物学的因子の治療特性の同定方法も含む。2以上の生体分子の相対分子流速は、生体分子を投与した1又は複数の組織又は個体の1群と生体分子を非投与の1又は複数の組織又は個体の1群とにおいて評価する。相対分子流速の差によって、生物学的因子の治療特性を同定する。また、治療特性は、1又は複数の個体の1群の分子流速を同一群において生物学的因子投与の前後に比較することによって、同定可能である。治療特性は、例えば既認可薬(すなわち「古い」薬)の未発見の特性でもよい。生体試料は培養細胞でもよく、個体は実験動物又はヒトでもよい。薬剤は、周知の技術のいずれの化学化合物もしくは生体化合物又は組成物でもよい。薬剤は、例えば、The Merck Index第13版(米国版、Whitehouse Station、ニュージャージー州、米国;全てを引用することにより本明細書の一部とする)に開示されたいずれの化学化合物又は組成物であってもよく、しかしこれに限定されるものではない。本方法は、ハイスループット方法での複数の薬剤のスクリーニングに使用可能である。
【0170】
生物学的因子を含む薬剤の毒性作用も、本発明の方法によって同定可能である。
【0171】
スクリーニング機能に使用した多重同時測定
アイソトープ標識水の使用によって、幅広い測定が可能なため、薬剤の予期せぬ作用もしくは未知の作用又は一般的タンパク質標的に対するスクリーニングが可能である。例えば、コレステロール合成に関連した、脳のミエリンもしくはβ−アミロイドの合成又は骨のコラーゲン動態に対するスタチン類(3−ヒドロキシ−3−メチルグルタリルCoA還元酵素阻害剤)の効果、脂肪のトリグリセリド合成又は肝臓のグルコース合成の速度に関連した結腸、膵臓又は他の細胞の増殖速度に対するグリタゾン類(例えばチアゾリジンジオン)の効果、脂肪組織のトリグリセリド又はゲノムDNAの合成に関連した筋肉のミトコンドリアDNA又はカルジオリピンの合成に対する抗レトロウイルス剤(逆転写酵素阻害剤)の効果を含む。一般的なスクリーニング手法として、脳のミエリン形成、骨のコラーゲン代謝回転、軟骨細胞の増殖、血管平滑筋細胞の増殖、組織の線維形成、関節腔のヒアルロン酸及びコンドロイチン硫酸の合成及び分解、脳のβ−アミロイド合成、精子形成、前立腺、乳房又は結腸の細胞増殖、皮膚コラーゲン合成、表皮のケラチン合成又はケラチン細胞の増殖、T細胞の増殖及び死、免疫グロブリンの合成、脂肪組織のトリグリセリドの合成及び分解、筋肉ミエリンの合成及び分解、ミトコンドリアの生合成、及び他の多くの分子流速(表1参照)を含む、多数の経路における薬剤や標的の作用の同時測定が挙げられ、それによって幅広いスクリーニングを実現可能な手法とすることが可能となる。
【0172】
多重並行(同時)測定のハイスループット
本明細書で開示する方法は、何百又は何千の動物における数週又は数ヶ月にわたる相対分子流速の試験を可能にするが、これはプロトコルの単純さによるものである。各動物(ヒト被験者)は、2H2O等の標識水を含む水の摂取のみが可能である。これは、標識プロトコルによって必要とされる限り持続する。2以上の生体分子の分子流速が質量分析によって評価される場合には、方法の完全自動化が可能である(自動採取、コンピュータ化したデータ分析、及び流速の計算)。
【0173】
アイソトープ標識水投与によって容易となる高容量は、従来の標識技術と異なるものである。従来の標識技術は、前駆体プールのアイソトープ濃縮の安定性を維持するために、労働集約的又は侵襲的又は持続的な投与プロトコル(例えば静注又は反復経口又は腹腔内の投与)を必要とし、異なるクラスの分子類の多数の流れを評価する場合には、多数の異なるトレーサーの投与も必要であった。このハイスループットの可能性は薬剤の開発や発見の鍵であり、開発や発見においては、きわめて多数の候補薬剤や候補ゲノムを試行錯誤方法で評価する必要があり、複数の分子流速の結果を評価項目として測定する必要がある。
【0174】
長期に緩徐に進行する毒性又は治療作用を評価する可能性
候補薬剤又は遺伝子の潜在的な毒性又は治療の作用に重要な多くの生物学的プロセスが、きわめて緩慢に進行する。これらの緩慢に進行するプロセスは、他の動態技術と異なり、アイソトープ標識水投与方法によってモニター可能である。これは2H2Oといった飲料水中のアイソトープ標識水の投与がきわめて容易で単純であることによるものである。2H2O標識試験は、最小限の努力で3〜6ヶ月にわたって実験動物及びヒト被験者(例えば図3を参照)において実施された。そういった緩慢に進行する、モニター可能なプロセスは、血管平滑筋、リンパ球、脳の構成物質、組織のミトコンドリア、上皮性幹細胞、並びに骨及び組織のコラーゲン、及び多くの他の動態を含む。
【0175】
キット
本発明は、in vivoにおける分子流速の測定及び比較のためのキットを提供する。本キットは、アイソトープ標識水(特に2H2O、3H2O、及びH218Oアイソトープ標識水又はその組み合わせ)、並びに好ましい実施形態においては、生体分子を分離、精製又は単離するための周知の技術の化学化合物、及び/又は組織試料採取に必要な化学物質、コンビナトリアル分析のための自動計算ソフトウエア、並びにキット使用のための取扱説明書を含んでもよい。
【0176】
水投与用の道具(例えば計量カップ、針、シリンジ、ピペット、IVチューブ)といった他のキット構成要素を、キットに任意に提供してもよい。同様に、被験体からの試料採取のための器材(例えば試料カップ、針、シリンジ、組織採取装置)を任意に提供してもよい。
【0177】
以下の実施例により本明細書に記載の発明をさらに説明するが、これに限定されるものではない。
【実施例1】
【0178】
成長組織におけるDNA:タンパク質の合成比率
2H2Oからの筋肉、肝臓又は他の組織のDNA:タンパク質への2H−取り込み比率により、組織の成長が過形成(新規細胞の追加)によるものなのか、それとも肥大(個々の細胞のサイズの成長で、新規細胞の追加はない)によるものなのかどうかが明らかとなる。この区別は、いずれの組織においても質量を変化させるように設計された、成長因子、遺伝子又は他の処置(介入)を評価するために必要となる。DNA:タンパク質の合成速度は、標識水を投与してDNA及びタンパク質におけるアイソトープ標識の取り込みを検出することで同時に測定する。
【実施例2】
【0179】
化学療法時の腫瘍細胞又は微生物におけるDNA:タンパク質の合成比率
抗生物質での化学療法時の細菌におけるDNA:タンパク質の動態の比率により、抗生物質製剤が殺菌(細胞を死滅させる)もしくは静菌(細胞の増殖を抑制するがそれらを死滅させない)で作用するのかどうかが明らかとなる。同様に、化学療法時の腫瘍におけるDNA:タンパク質の動態の比率により、細胞死が誘導されたのか又は増殖が停止したのか(殺腫瘍的又は静腫瘍的な作用)が明らかになる。DNA:タンパク質の合成速度は、標識水の投与とDNA及びタンパク質におけるアイソトープ標識の取り込みの検出によって同時に測定する。
【実施例3】
【0180】
細胞タンパク質又はゲノムDNAの合成速度に対するミトコンドリアDNAの合成速度の比率
組織の体細胞成長に依存しないミトコンドリア発生は、例えば有酸素運動に対する筋肉の学習応答において非常に重要となり得る。細胞タンパク質やゲノムDNAの合成に対するmtDNA合成の比率により、成長に依存しないミトコンドリアの形成と代謝回転とが明らかになり、有酸素運動の適性(aerobic fitness)のバイオマーカーを表す。mtDNA及び細胞タンパク質又はゲノムDNAの合成速度は、標識水投与とmtDNA及び細胞タンパク質又はゲノムDNAへのアイソトープ標識の取り込み(例えば図1及び2を参照)の検出によって同時に測定する。
【0181】
SimonsenからのSprague−Dawleyラット(体重210〜350g)を、1ケージに3匹、12時間の明暗サイクルの下に金網ケージで飼育した。全ての処置が、UC Berkeley Office of Laboratory Animal Careによって認可された。ラット用Purina飼料は、自由に与えた。若年のオス成長群(試験開始時に2〜4ヶ月齢)と老年のメス安定体重群(8〜10ヶ月齢)との2群のラットを用いた。若年群ラットの最初の平均体重は約210gであり、一方老年の安定体重群の平均体重は約225gであった。
【0182】
齧歯類における2H2Oの標識プロトコルは、体内水の2.0〜2.5%の濃縮となるように初回プライミング腹腔ボーラス法とした。体重の60%を水とした推定に基づいて、ラットにプライミング用量の2H2O(100%)を投与(例えば225gのラットには、135mLの2%又は2.7mLを分割用量で1時間間隔で投与)して、その後飲料水中の4%2H2Oを投与した。飲料水中の2H2Oの4%濃縮を、目的の生合成産物の十分な濃縮をもたらして周知の毒性がない都合の良い用量として選択した。2H2O(70%及び100%)は、Cambridge Isotopes(Andover、マサチューセッツ州)の市販品を購入した。摂水は自由であった。ラットは二酸化炭素による窒息で屠殺した。
【0183】
個々の動物から、骨髄と心臓(0.5g)及び後肢(0.3g)の筋肉の試料を、屠殺後直ちに切除した。筋肉試料をホモジナイズして、次に密度勾配遠心によってホモジェネートからミトコンドリアを単離した。核DNA(nDNA)の混入は、DNアーゼ処理で酵素的に除去した。筋肉試料においてnDNAの混入がないことは、ポリメラーゼ連鎖反応(PCR)を行い、次にゲル電気泳動を行って確認した。個々の動物におけるmtDNA動態の測定のために、0.3〜0.5gの筋肉組織から、十分なmtDNAを得た。
【0184】
骨髄nDNAは、Qiampカラム(Qiagen)を用いて当技術分野で周知の技術を使用して単離した。mtDNAは、組織のミトコンドリア画分を単離した後に、心筋、後肢筋、及び血小板からQiagenキット(Qiagen)を使用して単離した。mtDNA及びnDNAは、酵素的に加水分解して遊離デオキシリボヌクレオシドとした。他のデオキシリボヌクレオシドからdAを分離するために、LC18 SPEカラム(Supelco、Bellefone、PA)を使用した。カラムは100%メタノール(2mL)及び水(2mL)で洗浄した。次に、加水分解したDNA試料をカラムに導入して、dA以外のヌクレオシドをH2O洗浄(5mL)で溶出した。次にdAを50%エタノール(1ml)で溶出した。
【0185】
dAのデオキシリボース(dR)部分を、ペンタン四酢酸誘導体に転換した後にGC/MSで分析した。dRのアイソトープ濃縮は、GC/MS分析(m/z245及び246、それぞれM0及びM1の質量を表す)で評価した。DNAのデオキシリボース又は遊離デオキシリボヌクレオシドのC−H結合においては、溶媒水又は他の試料マトリクスでの水素イオンと水素原子との間の置換はなかった。分析された誘導体はdR部分のみを含み、プリン・デオキシリボヌクレオシドの塩基部分は含まず、塩基サルベージ経路を経由した塩基部分への標識の取り込みは、交絡因子ではなかった。
【0186】
測定されたアイソトープ比率が注入試料量に依存すること(存在感度)を確認するために、非標識dA(自然存在度)の標準を、解析毎に同時に分析した。この依存関係は、親イオンM+0(m/z245)の存在度対M+1イオンのM+0+M+1イオンに対する比率(246/245+246)をプロットすることによって、特徴付けられる。比率対M+0存在度の直線回帰を、上述したように計算した。次に回帰直線を、試料中の過剰な存在度を計算するために、どの個々のM0存在度においても自然存在比の計算に使用した。
【0187】
細胞の部分合成速度を、前駆体−生成物の関連性を使用して上述したように計算した。完全に(又は殆ど完全に)代謝回転した組織のアイソトープ濃縮は、対象の細胞に対する正味の前駆体濃縮尺度として使用可能である。プール・サイズが定常状態にある条件下では、部分合成速度は、部分置換速度(すなわち産生されるあらゆる細胞又は分子は、分解される細胞や分子と平衡しなければならないという仮定)を表す。mtDNAの2H2O標識後の置換定数(k)及び半減期(t1/2)は、上述したように計算した。前駆体−生成物の関連性計算の背後にある中心原理は、前駆体プールに全てが由来する産物のアイソトープ濃縮が、前駆体プールのアイソトープ濃縮に、指数曲線として近似するであろうというものである。
【0188】
体内水の2H2O濃縮は連続的に測定した。飲料水中4%2H2Oを維持したラットにおいて達成された、定常状態の体内2H2O濃縮は、個々の動物においては約3%であり長期に安定であった。
【0189】
若年オス・ラットを、体細胞成長を含んだミトコンドリア発生のモデルとして、最初に試験した。若年オス・ラットの体重は、2H2O標識の継続期間中に50%を超えて増加した。骨髄のnDNAの濃縮は、標識した11週にわたって9.5〜10.0%に安定維持された。心筋及び後肢のmtDNAの濃縮は、長期にわたって0.0〜3.5%と上昇した。後肢及び心臓の筋肉のmtDNAの部分合成(f)も、長期にわたって上昇した。約40〜50%のmtDNAが、2H2O標識の11週後に双方の組織で新規に合成され、後肢筋での値は約45%でプラトーに達した。
【0190】
組織の増加に関係したmtDNA合成と成長に依存しないmtDNAの置換とを区別するために、老年の体重安定なメス・ラットを試験した。体重は、これらの動物では長期にわたって予測通りに比較的安定であり、標識期間9週間にわたって10%増加したのみであった。骨髄のdA濃縮値は、安定して成長期のオス・ラットと変わらなかった。2H2O標識をした9週間にわたって組織を採取した。心筋では、2H2O標識8週後のmtDNA合成(約20%が新しい)は、体細胞の成長(約10%)よりも高かった。骨格筋では、mtDNA合成は規模において体細胞の成長と同様であり、この方法によっては成長に依存しない合成は示されなかった。合成の速度定数は、心筋においては1日あたり約0.4%であった。体細胞の成長(9週にわたって10%)を補正した後は、心筋mtDNAの部分置換速度の計算値は、0.2%/日であり、これはmtDNAの半減期350日と一致した。
【0191】
筋肉組織におけるmtDNA及びnDNAの合成の同時測定による比較
心臓と後肢の筋肉におけるnDNAとmtDNAの部分合成を、体重が安定なメス・ラットにおいて比較した。ゲノムDNAに比較して6〜9週後に約2倍の、mtDNAの高い合成速度が心臓と後肢の筋肉の組織双方で観察された(図5)。注目すべきは、骨格筋のnDNA合成は、これらの動物では全身のの成長(約10%)より規模が小さかったこと(9週後に約5%)であり、一方心筋のnDNA合成(約10%)は、体細胞の成長と同様であったことである。これらの組織におけるmtDNA合成がnDNA合成より高いという観察結果は、細胞分裂に依存しないmtDNAの複製とこれらの結果が一致するため、重要である。mtDNA合成を新規な筋細胞の増殖(nDNA合成)に対して補正した場合には、体細胞の成長に基づいて行ったように(上記参照)、非成長組織におけるmtDNAの半減期が評価可能である。計算した半減期は、心筋において約350日(置換速度定数は1日あたり0.2%)、骨格筋において約700日(置換速度定数は1日あたり0.1%)であった。
【0192】
上記結果から、正常ラットにおける後肢と心臓の筋肉のmtDNAの比較的緩慢な合成速度が確認される。心臓及び骨格の筋肉の双方におけるnDNA合成に対するmtDNA合成(図4)の比較を基にすると、正味の代謝回転(すなわち体細胞の成長がない場合の置換)が確かに生じたと思われる。組織の体細胞成長が、mtDNA合成の約50%を占めた。体重安定なラットにおいて、組織増殖の間に新規に加わるミトコンドリアに対して補正した後でのmtDNAの見かけの半減期は、心臓及び後肢の筋肉についてそれぞれ12〜24ヶ月に及んだ。
【実施例4】
【0193】
脂肪組織のアシルグリセリドの合成速度と他の体組織におけるタンパク質又はDNAの合成との間の関係
生体組成に対する処置(intervention)の作用を、脂肪組織のアシルグリセリド対筋肉及び肝臓又は他の体組織におけるタンパク質及びDNAの相対合成速度によって評価した。脂肪組織のトリグリセリド合成の抑制を伴った筋肉のタンパク質及びDNAの合成が刺激されることは、消耗性や脆弱性を呈する患者における、例えばアンドロゲンや組換え成長ホルモンといった薬剤の有益な治療作用を示す。脂肪組織のトリグリセリドと体組織のタンパク質及びDNAとの合成を、標識水の投与並びに脂肪組織のアシル化グリセリド及び体組織のタンパク質又はDNAへのアイソトープ標識物の取り込みの検出によって、同時に測定する。
【0194】
4週齢の老年のメスC57/bl6jマウス(Jacson Labs Bar Harbor、MI)を次の4群に分けた。すなわち、C57/bl6j+/?対照(con)、自由に摂食したC57/bl6jlep−/lep−(ob/ob)、レプチン処置したob/ob(ob−lep)及び摂食制限したob/ob(ob−r)である。全マウスを個別に吊り下げ式金網ケージで飼育し、飲水を自由とした。光周期は正午から午前0時まで点灯して平均温度は73°Fとした。飼料(Bio Serv、Frenchtown、NJ)は精製した製剤からなり、1gの「無塵」ペレットを摂食自由のマウスに、45mgを摂食制限したob/obmマウスに与えた。マウスは3日間で環境順応させたが、この間に何らかの体重減少を観察した。順応期間の終了後に、摂食制限又はレプチン処置を開始して、摂食量と体重を定期的に計測した。
【0195】
ob−r群の摂食は、1日あたり2.8gに制限した。ob−rにおいて、食事摂取による可能性ある混乱作用を避けるために、その食事は継続して与えた。吊り下げ式金網ケージに、試験期間中23分毎に単回の45mgペレットを連続的に給餌するペレット自動給餌機(Coulbourn Instruments、Allentown PA)を取り付けた。摂食制限は、2H2Oによる標識開始の5日前に開始した。
【0196】
ob−lepマウスは、マウス・レプチンの用量2μg/日(Amgen、Thousand Oaks、カリフォルニア州)を、皮下に埋め込んだAlzet小型浸透圧ポンプ(Alza Corp.、Palo Alto、カリフォルニア州)により28日間投与した。ポンプは、レプチン(0.35μg/μL)を毎時0.25μLの速度で皮下に持続注入で供給した。レプチン処置も、2H2Oによる標識開始の5日前に開始した。
【0197】
マウスには、身体の水プールの約2%濃縮を達成する用量で2H2O(重水素置換水)を注入した。正常飲用水は、次に4%2H2Oに濃縮した水で置換した。2H2O処置は、摂食や体重には影響がなかった。2H2O投与開始から21日後に、マウスを4時間絶食させ、イソフランで麻酔して心臓穿刺により放血させた。可能な場合は、同時に尿を採取した。
【0198】
血液測定
血漿グルコースをYSI(Yellow Spring、OH)自動分析器によって測定した。血漿のインスリン及びレプチンの測定は、Linco reserch(St.Charles、MO.)の測定サービスによって実施した。
【0199】
脂肪組織の調製と脂肪細胞の単離
脂肪体を以下の手順に従って単離切除した。鼠径部の脂肪体を、後肢の基部に始まり胸骨へと上行して背骨へと広がる皮下の目立たない脂肪体と見定めた。子宮外膜の脂肪体を確認して、卵巣と子宮から切除した。腸間膜脂肪は、小腸を外に伸展させて穏やかに脂肪やリンパ組織を取り除くことによって切除した。後腹膜の脂肪体は、腎臓の背部に位置して、子宮周辺の脂肪体の上端へと下行伸展するが、子宮の上端を境界として使用した。鼠径部及び後子宮周辺の脂肪体は、左右の側を分析用にプールした。
【0200】
骨髄細胞を後肢大腿骨から単離した。骨を切除して26ゲージ針を使用して中心をハンクス平衡塩類溶液(HBSS)によって押し出した。次に当技術分野で公知の技術(Neese, R.A.、Siler, S.Q.、Cesar, D.、Antelo, F.、Lee, D.、Misell, L.、Patel, K.、Tehrani, S.、Shah, P.、Hellerstein, M.K. Anal Biochem 2001 298巻、189〜195)を使用して骨髄のDNAを単離した。
【0201】
切除後直ちに脂肪体を、成熟脂肪細胞の単離のために、Rodbell(Rodbell, M. J.Biol.Chem(1964) 239巻、375〜380)の方法に従って秤量済みのチューブのCa含有HBSS中に入れた。脂肪体を秤量して、次にカミソリの刃によってガラス皿の中で十分に細切した。細切組織を3mLのHBSSの中に入れて、300μLの1%II型コラゲナーゼ(Worthington)を加えた。組織を37°で90分までインキュベートした。試料を、カットピペットで30分毎に穏やかにピペッティングすることによって混合した。試料を800rpmで10分間遠心した。遠心の結果、チューブの中で3層となり、上層に透明な脂質、中層に不透明な脂肪細胞含有画分、及びその下は細胞の残渣と血管間質細胞のペレットを含む液体であった。脂肪細胞画分を中層画分から慎重に取り除いて凍結した。それに続く顕微鏡分析は、このプロトコルが全ての血管間質組成物を完全に除くとは限らないことを明らかにした(考察を参照)。
【0202】
脂肪細胞からのDNAの単離と誘導体化
脂肪細胞の凍結スラリーを融解して、100〜200μLを二連でピペッティングにより秤量済みの滅菌エッペンドルフ・チューブに入れ、凍結乾燥した。試料の乾燥重量を測定して、次に試料を消化してQuiagen DNeasy組織キットを使用してDNAを単離した。各試料のDNA收率を、Pharmacia Biotec Genequant II分光分析装置で定量した。
【0203】
DNA10〜25μgを個々のリボ核酸に加水分解して、単離デオキシアデノシンを還元してアセチル化した。結果として生じた酢酸エチル中のペントース四酢酸(PTA)誘導体を、DNAのデオキシリボース部分のアイソトープ濃縮測定のために、GC/MSに注入した。
【0204】
TG、FA、及びH2Oの誘導体化及び分析
コラゲナーゼとのインキュベーション後に、脂肪のTG試料を採取した。10〜20μLの間の脂質を取り出して、0.01%β−ヒドロキシトルエンを含む約500μLのヘプタン中で凍結した。この溶液を2mLのクロロホルム:水(1:1)で抽出した。水層を捨てて、脂質画分を、3NメタノールHCl(Sigma-Aldrich)との55℃で60分間のインキュベーションによって、エステル交換した。脂肪酸メチルエステルを、5%NaClではなく水を水層に使用したFolch抽出変法によってグリセロールから分離した。次に遊離のグリセロールを含む水層を凍結乾燥して、グリセロールを、他報(Hellerstein, M.K.、Neese, R.A.、Schgwarz, J.M.、 Am J Physiol (1993) 265巻 E814〜820)に記載したように無水酢酸−ピリジン、2:1とインキュベートすることによって、グリセリン三酢酸エステルに変換した。脂肪酸メチルエステルを含む層を窒素下に濃縮して、直ちにGC/MSに注入した。
【0205】
体内水中の2H2O濃縮を、血漿試料から誘導した四臭化エチレンにおいて他報(Neese, R.A.、Siler, S.Q.、Cesar, D.、Antelo, F.、Lee, D.、Misell, L.、Patel, K.、Tehrani, S.、Shah, P.、Hellerstein, M.K. Anal Biochem 2001 298巻、189〜195)に記載したように測定した。
【0206】
GC/MS分析
5970型及び5971型のGC/MS又は5973型装置(Agilent、Palo Alto、カリフォルニア州)を、グリセリン三酢酸エステル・脂肪酸メチルエステル及び四臭化エチレンのアイソトープ濃縮の測定に使用した。グリセリン三酢酸エステルは、DB−225溶融シリカカラムを使用して、m/z159及びm/z160(親M0及びM1)又はm/z159、m/z160及びm/z161(M0、M1及びM2)でモニターして分析した。メタン化学イオン化法(CI)を選択イオンモニターで使用した。脂肪酸−メチルエステル組成物を、炎イオン化検出法で分析し、2H濃縮についてはGC/MSで分析した。四臭化アセチレンを、DB−225溶融シリカカラムを使用して、m/z265及びm/z266(親M0及びM1の質量)でモニターして分析した。2H2O濃縮の既知の標準曲線を、個々の試料群のの前後に使用して、アイソトープ濃縮を計算した。
【0207】
PTA試料を、6890GC及び自動試料採取装置(Agilent、Palo Alto、カリフォルニア州)を連結したHPの5973型MSで、重水素の取り込みについて分析した。メタンCIを、m/z245〜246(M0及びM1の質量を表す)での選択イオンのモニター下に、30mDB−225カラムで行った。自然存在度は(濃縮されていない)dA試料を同時に測定し、脂肪PTA試料中の過剰M1(EM1)の存在度は、差から計算(試料中のM1の存在度から濃縮されていない標準で測定したM1の存在度を差し引く)した。骨髄DNA試料を同時に分析にかけ、完全又はほぼ完全な代謝回転を表すために使用して、脂肪細胞の部分置換を計算した。
【0208】
計算
TG合成
標識期間中のTGの新規な合成の割合(%)を、TGグリセロールの最大の又は漸近的な濃縮を評価するために体内水の濃縮を使用して、前駆体−生成物の関連性に基づいて上述したように計算した。体内水濃縮とTGグリセロールの最大濃縮との関連性は、組み合わせの分析(アイソトポマー質量の分布分析 MIDA)により、また長期間の2H2O標識後に100%置換されたTGプールを測定することによって評価されている。アシルグリセリドのグリセロール部分には、そのC−H結合の5個の水素のうち4個に、H2O由来の2Hが取り込まれる(すなわちn=4又は80%の置換)。n=4の場合、漸近的なグリセロールM1濃縮(A1∞)はA1∞=−7.4625x2+3.3519x+0.0007と計算され、xは測定した体内水濃縮に等しく、M1は(m/z159)/(m/z159+160)と計算される。新規に合成されたTGの部分は、次に以下のように計算される:
部分合成(f)=EM1/A1∞
正味の脂肪分解の評価
定常状態下では、全身のTGプールは比較的一定であり、TG合成はTG分解(すなわち脂肪分解)と平衡しなければならない。このようにして測定したTG合成は、脂肪分解の評価に使用可能であるが脂肪組織TGのランダムな分解がない(すなわち最後に入り、最初に出る)場合には、TGの合成と分解のサイクルのいくつかは、現存するいずれの新規に合成されたTG分子に対しても生じる可能性がある。このために、この測定を正味の脂肪分解と称する。さらに、ここで試験した動物は脂肪質量が増大していたため、標識の取り込み測定から脂肪分解速度を評価するためにはプール・サイズの変化に対する補正が必要である:
正味の脂肪分解=合成されたTG−蓄積されたTG
レプチン処置マウスの場合、保持されるTGは負の値(すなわち体脂肪が損失した)であり、TG合成速度に、損失したTG量を加えて、正味の脂肪分解速度を得る。
【0209】
DNL(TGの全体部分・新規合成部分)
MIDAを、脂肪TGのパルミチン酸塩についてDNL部分を測定するために、上述及び米国特許5,338,686号(参照によりその全体を本明細書に組み入れる)に記載のように使用した。2H2O標識を使用した。
【0210】
MIDAによって測定した、DNL部分の計算値は、標識期間にDNL経路を経由して合成された貯蔵TGの部分を表す。この値は、既存の脂肪が存在する範囲であるが、新規に合成された貯蔵脂肪酸にしめるDNLの割合を表すものではない。すなわち、「非DNL」TGは、既存の脂肪又は非DNL経路から新規に合成されたTGのいずれかを表す可能性がある。この問題は、新規に合成されたTGの割合に対して補正することによって解決可能である。DNL−fのTG−fに対する比率によって、新規貯蔵脂肪の中の正味のDNL部分が明らかになる。部分DNLの割合が35%でありTGの部分合成が70%である場合には、新規合成TGにおける正味のDNL部分は、直接測定した35%fではなく0.35/0.7又は50%である。
【0211】
パルミチン酸エステルの絶対DNLを、DNL画分に脂肪体重量の0.8倍(脂肪組織中の推定TG画分)を乗じて、次に現存パルミチン酸エステルの%(炎イオン化検出法によって測定)を乗じることで計算した。この値は、標識期間に合成されたパルミチン酸エステルの絶対量(グラム)を表す。
【0212】
脂肪細胞の増殖(脂肪形成)
部分脂肪細胞増殖を、脂肪DNA中のEM1を骨髄DNA中のEM1で除することで計算した。骨髄DNAは、ここでは脂肪DNA中のA1∞値を評価するために使用するが、これはマウスでは7日後に骨髄細胞がほぼ完全に置換するためである。脂肪細胞の絶対合成を、部分合成に細胞総数を乗じることで計算した。
【0213】
結果
図5及び6は、同一の実験において3つの異なる代謝経路(新規の脂質生成、脂肪生成及びトリグリセリド合成)を同時測定したことを示す結果を表示する。レプチンの欠損及び置換は全3経路に同様に影響して、レプチンが脂肪組織代謝のこれらの状況において協同作用することが初め示された。
【実施例5】
【0214】
肺間質線維芽細胞(PIF)における肺のコラーゲン合成対線維芽細胞増殖(DNA合成)
PIFは、瘢痕組織(コラーゲン)によって進行的に肺が置換されることを特徴とする疾患である。肺の線維芽細胞によるコラーゲン貯蔵に対する炎症性又は線維形成のシグナルは知られていない。PIFの病因論及び治療法は、多数の活性化線維芽細胞対正常数の内因性で、より合成過剰な線維芽細胞を伴った個体の間で異なることがある。この区別は、2H2Oからの肺のコラーゲン合成速度を、2H2Oからの肺の線維芽細胞増殖速度(DNA合成)と比較することにより明らかとなる可能性がある。高比率(コラーゲン:DNA)は、合成過剰な線維芽細胞を示すであろう。個々のパラメータに対する高い絶対値を伴った低比率は、線維芽細胞の一般的な活性化を示すであろう。コラーゲン及びDNAの合成双方が、標識水の投与とコラーゲン及びDNAにおける放射性標識の取り込みの検出とによって同時測定される。
【実施例6】
【0215】
組織における、タンパク質対mRNA及びmRNA対DNAの合成速度の比率
mRNAに対するタンパク質の合成の相対分子流速は、翻訳対転写の制御が、組織におけるタンパク質発現の変化の原因であるかどうかを示す。同様に、組織でのDNAに対するRNAの合成の相対速度によって、全重量の変化又は組織におけるタンパク質の発現に対する原因メカニズムとして、転写作用対細胞分裂を区別する。これら(タンパク質、mRNA、DNA)の速度が、標識水の投与とタンパク質、mRNA、及びDNAにおける放射性標識物の取り込みの検出とによって、同時測定される。
【実施例7】
【0216】
トリグリセリド及び脂肪酸が肝臓で構築されるリポタンパク質へ流入する速度
超低密度リポタンパク質(VLDL)粒子の肝臓での構築は、高脂血症の多くの型の基礎であり、高脂血症治療の標的である。肝臓のVLDL構築には、いくつかのクラスの分子(ApoB、コレステロール、コレステロールエステル、トリグリセリド、リン脂質)の合成に関与し、その内いくつかはそれ自体が1又は複数の生合成経路に関与している(例えば、トリグリセリドとリン脂質の構築における脂肪酸及びアシル化グリセリド部分の合成、コレステロールエステルの合成におけるコレステロール及び脂肪酸部分の合成)。異なる種類のヒト高脂血症が、このリスト上の異なる経路の変化に因ると思われる。家族型脂質異常性高血圧症(又は高アポβ・リポプロテイン血症)と呼ばれる型は、ApoBの過剰分泌に因るものである。糖質誘導型高脂血症といった他の型は、トリグリセリド合成、脂肪酸合成又はVLDLからのトリグリセリドの除去の速度の変化を示す。これらの全ての成分の産生速度は、標識水の投与と個々の生体分子における放射性標識物の取り込みの検出とによって、同時測定される。
【実施例8】
【0217】
脂肪トリグリセリドの新規合成に対して補正した脂肪組織の脂肪増加に対する新規の脂質生成の寄与
食物脂肪の摂取(脂肪酸の摂取)と比較した新規の脂質生成(DNL)又は新規脂肪酸(身体によるパルミチン酸類)の内在性合成からの寄与は、体脂肪蓄積の生理における重要な差異を示す。新規の脂質生成の原因となる酵素及び適応となる薬剤治療は、内在性対食事型の体脂肪蓄積によって異なる。全トリグリセリド蓄積速度を知らなければならないため、脂肪トリグリセリドに対する新規の部分脂質生成の寄与を直接測定することは、正味の寄与比率を明らかにしない。例えば、脂肪パルミチン酸塩の5%が新規経路由来であることを測定値が示す場合には、これは新規に合成されたパルミチン酸塩の100%(組織中の全TGの5%だけが新規であるとしたとき)又は新規に合成されたパルミチン酸塩の5%(組織中の全TGの100%だけが新規であるとしたとき)を表すであろう。新規の脂質生成寄与を組織中のトリグリセリドの置換部分に対して補正すること(すなわち、新規のトリグリセリド合成に対する新規の脂肪酸合成の比率の計算)は、新規の合成からの新規の貯蔵脂質に対する正味の寄与の計算を可能にする。これらの測定は、本明細書に開示したように同時に実施して、下のデータに示す。
【0218】
正常被験者を広告で募集した。参加基準は、3ヶ月以上の体重安定、肥満度指数が28kg/m2以下、直前の3ヶ月以内に感染又は炎症の状態にない、全般に健康良好、臨床検査値(化学検査プロフィール、完全な血球数)が正常、HIV血清検査陰性、インフォームド・コンセント可能である。除外基準は、以前の代謝障害病歴(糖尿病、肥満、高脂血症)又は他の臓器系疾患(肝臓、腎臓、肺等)。潜在的な代謝作用のある薬剤使用(糖質コルチコイド、β−遮断薬、チアジド系利尿薬、フェニトイン、アドレナリン作動薬、アンドロゲン、タンパク質同化剤、エストロゲン又は経口避妊薬)、インフォームド・コンセント不可能を含んだ。計被験者19名が試験に参加した。正常被験者2群が参加した。第1群は、2H2Oを9週間摂取した(n=9)。第2群(n=10)は、2H2Oを5週間摂取した。この最初のサーベイ試験に脂肪組織の動態パラメータに変動を導入することを意図して、被験者の体脂肪の範囲、ウェストのヒップに対する比率、及び血液中代謝物の測定を含めた。第1群では男性5名、女性4名を試験したが、第2群は男性10名から成った。体重は試験開始時に、次に2〜3週間毎に測定した。身体組成物を、2H2O標識試験の開始時及び終了時に生体インピーダンス分析で測定した。血液濃度を、SF総合病院の臨床検査室で測定した。全ての試験と処置が、UC BerkeleyとUC San Franciscoのヒト研究に関する委員会の事前承認を受け、被験者は、参加前に書面のインフォームド・コンセントを渡した。
【0219】
2H2O標識プロトコル
2H2Oは経口投与した。初回投与用量をSF総合病院のGenerarl Clinical Reserch Center(GCRC)で投与した。被験者は、GCRCで計350〜400mLの2H2Oの投与を受け、体内水プールの約1%濃縮を達成するために18〜21時間の間に分割用量として投与(70mLの70%2H2Oを毎3〜4時間)された。2H2Oは、Isotec、.Inc.(Miamisburgh、OH)から購入して、滅菌容器に分注した。被験者は、次に70%2H2Oを50mL、1日3回、5日間、次に35〜50mLを1日2回、8〜10週の標識プロトコルの残る期間に投与された。このプロトコルによって5〜7日の間に大半の被験者でほぼ安定な体内2H2O濃縮(1.5〜2.0%、下を参照)を達成し、耐容性は良好であった。被験者は、2H2Oをプラスチック・バイアルに入った個別単位(70%2H2Oを35〜50mL)として投与され、プラスチック・バイアルは冷蔵庫に保管した。
【0220】
外来患者の2H2O摂取の順守は、毎週の来院(尿と唾液の採取のため)を通して計測用バイアルの返却によって確認した。
【0221】
体内水試料及び単球用血液の採取
血漿又は尿の試料を毎週全被験者から採取して、密閉容器で凍結した。血液をFicoll-Hypaque液に集め、遠心後に単核画分を採取した。血液単核球が、免疫磁気ビーズによってCD14+細胞として単離された。
【0222】
脂肪組織採取プロトコル及び成熟脂肪細胞に富んだ画分の単離
脂肪組織の吸引生検を、2H2O摂取の5週目と9週目に他報(Neese, R.、L. Misell、S. Turner、A. Chu、J. Kim、D. Cesar、R. Hoh、F. Antelo、A. Strawford、J.M. McCune、及びM. Hellerstein. Measurement in vivo of proliferation rates of slow turnover cells by 2H2O labeling of the deoxyribose moiety of DNA. Proc Natl Acad Sci USA 99巻、24号:15345〜50、2002)に記載された方法を使用して実施した。簡単に説明すると、皮下3カ所(臀部分(しり)、大腿部分(大腿)、及び横腹部分(中背))から来院の度に採取した。脂肪吸引方法には、リドカイン局所麻酔薬(1%、エピネフリンを1:100000で含む)を使用した。皮下脂肪を、14ゲージ針で3ccの注射筒に吸引し、次に滅菌チューブの中に入れて処理(同日)のために氷上に置いた。組織試料を鋭利な刃で細切し、次にII型コラゲナーゼ(Worthington、Lakewood NJ)で処理した。2単位/μL溶液1mLを各脂肪試料に加えて37℃で1時間インキュベートした。次に細胞懸濁液を、350μmメッシュのフィルター(Specrum Laboratories、Rancho Dominguez カリフォルニア州)上にゆっくりと注いだ。フィルター上の脂肪細胞を集め、脂質単離と顕微鏡分析のために処理をした。
【0223】
質量分析のための代謝物の単離
TG−グリセロール及び脂肪酸
組織試料を、1mLメタノール:クロロホルム(2:1)と共にKontes二重ガラス製組織破砕器(Kimble Kontes、Vineland、NJ)に入れて均一になるまで破砕し、次にタンパク質を除去するために遠心した。この溶液を2mLのクロロホルム:水(1:1)で抽出した。水層を取り除いて、3N HClメタノール(Sigma Aldrich)と共に55℃、60分インキュベートすることで脂質画分のエステル交換を行った。脂肪酸メチルエステルは、5%NaClではなく水を水層に使用した改変Folch抽出法でグリセロールと分離した。遊離のグリセロールを含む水層は、次に凍結乾燥して無水酢酸−ピリジン、2:1(32)とインキュベートすることによって、グリセロールをグリセロールトリアセテートに変換した。
【0224】
体内H2O
体内水の2H2O濃縮を、血漿又は尿で測定した。15〜20μLの試料を、排気したGCバイアル中で、アセチレンを産生するために炭化カルシウム(カーバイド)と反応させた。アセチレンガスをシリンジに移して、10%臭素を含む四塩化炭素を含んだ排気したGCバイアル中に注入し、四臭化エタンを産生するために室温で2時間インキュベートした。過剰の臭素は、10%シクロヘキセンを含む四塩化炭素、25μLで中和した。体内H2Oからの水素原子を含む四臭化エタンは、次にGC/MSで分析した。
【0225】
GC/MS分析
TG−グリセロール、脂肪酸、及びH2O
5970型及び5971型のGC/MS又は5973装置(Hewlett-Packard Inc、Palo Alto、カリフォルニア州)を、グリセロール、脂肪酸、及びH2Oのアイソトープ濃縮の測定に使用した。
【0226】
グリセロールトリアセテートは、DB−225溶融シリカカラムを使用して、m/z159及びm/z160(親M0及びM1)又はm/z159、m/z160及びm/z161(M1及びM2に対するM0)でモニターして分析した。メタン化学イオン化法を、選択イオン検出で使用した。脂肪酸メチルエステルを、組成物に対して炎イオン化検出法で、2H濃縮に対して、GC/MSで、他報(Hellerstein M.K.、M. Christiansen、S. Kaempfer、C. Kletke、K. Wu、J.S. Reid、K. Mulligan、N.S. Hellerstein、及びC.H. Shackleton. Measurement of de novo hepatic lipogenesis in humans using stable isotopes. J Clin Invest 87巻1841〜52、1991)に記載したように分析した。
【0227】
四臭化エタンを、DB−225溶融シリカカラムを使用して、m/z265及びm/z266(79Br79Br81Br(親−OAc)アイソトポマーの親M0及びM1の質量)でモニターして分析した。既知の濃縮の標準曲線を、各試料群のアイソトープ濃縮計算の前後に、使用した。
【0228】
GC/MS分析手順
濃縮した試料は、全GC/MS分析において存在率を基準(濃縮していない)試料と一致させた。使用した存在率の範囲は、他報(Neese, R.A.、S.Q. Siler、D. Cesar、F. Antelo、D. Lee、L. Misell、K. Patel、S. Tehrani、P. Shah、及びM.K. Hellerstein、Advances in the stable isotope-mass spectrometric measurement of DNA synthesis and cell proliferation. Anal Biochem 2001 298巻、189〜195)で記載したように理論質量アイソポトマー比率の1〜2%以内の値であった。存在率がこれらの精度のレベルに到達した基準と、この存在率の範囲に収まった試料とに対する分析結果のみを、計算に使用に許容可能と評価した。
【0229】
統計学的分析
群の比較は分散分析によった。統計学的に有意な差はp<0.05とした。測定における変動の原因は、変量効果モデルを使用して評価した。これらは被験者の変量効果(それは被験者間の変動を表す)、各被験者内の貯蔵の変量効果(それは貯蔵から貯蔵の変動を表す)、及び残る週から週の効果(それは、各被験者の各貯蔵の内での週から週の変動を表す)を含む。またこれらのモデルは、長期にわたる系統的変化の原因となる1固定週の効果を含む。脂肪TGの動態パラメータ類と標準(動的ではない)パラメータ類との間の相関関係も、回帰モデルを使用して分析した。ピアソン相関係数及びスピアマンの順位相関係数を、TG部分合成、絶対TG合成、DNL及び脂肪分解対インスリン、グルコース、及びトリグリセリドの血漿濃度、体脂肪率、全体脂肪、並びにウェスト:ヒップの比率に対して計算した。
【0230】
結果
脂肪組織のTG代謝回転
脂肪組織のTGの合成と置換の速度は、2HのTG−グリセロールへの取り込みから評価した。TG−グリセロールへの取り込みは、9週間の間にわたって増加した。3貯蔵試料での部分合成(f)は、5週後には約0.12〜0.15(12〜15%)、9週後には0.16〜0.22(16〜22%)であった。脂肪TGの部分置換速度は、1日あたり0.0030〜0.0045の幅であり、脂肪TGに対しておよそ200〜250日間、比較的一定のt1/2値を示していた。
【0231】
脂肪TG合成速度は、標識物投与の最初の5週間から第5〜9週の間で、若干緩慢に上昇すると思われる。生検を双方の時期に一致させた被験者において、fは臀部の貯蔵では、0.130±0.048%(第5週)及び0.158±0.057(第9週)であり、横腹ではそれぞれ0.151±0.098及び0.236±0.127であり、並びに大腿部ではそれぞれ0.125±0.042及び0.205±0.099であった。第9週の値は第5週の値より有意に高かった(p<0.05)。
【0232】
5週にわたる脂肪TGの合成と保持との全量は、1.80±0.98kg(n=18)、幅0.5〜4.4kgと計算された。したがって平均の脂肪TG合成速度(ここで採取した皮下貯蔵物は全体脂肪貯蔵部を代表すると仮定して)は、1週あたり約0.35kg又は1日あたり50gである。
【0233】
脂肪分解速度も、TG合成と体脂肪の平衡に基づいて計算することが可能であろう。これらの被験者は全身レベルで脂肪平衡がゼロ(安定体重で9週の標識期間にわたって身体組成に変化がない)であったため、脂肪TGの正味の脂肪分解は正味の合成と置換とに等しい。正味の脂肪分解速度は、各被験者から採取した3つの貯蔵物でのkの平均値に全身の脂肪プールサイズ(これらの被験者では平均約15kg)を乗じて計算した。これらの値は約50〜60gTG/日又は約0.4〜0.6mgTG/体重kg/分であった。
【0234】
DNLの脂肪組織TGへの寄与
TG−FAへの取り込みは、第0週〜9週の間でおおよそ線形に増加した。5週間の2H2O標識後に部分DNL(fDNL)は、臀部脂肪で平均0.020±0.0112(n=17)であり、横腹脂肪で0.023±0.016(n=17)であり、大腿脂肪で0.025±0.013(n=12)となった。9週間のH2O標識後に、fDNL値は臀部脂肪で平均0.040±0.0023(n=8)であり、横腹脂肪で0.041±0.024(n=6)であり、大腿脂肪で0.041±0.024(n=8)となった。新規に貯蔵された脂肪TG部分に対して補正した場合(すなわちTG−グリセロール合成に対して補正する)は、DNLから新規に貯蔵されたTG−パルミチン酸への部分の寄与は、殆どの個体の貯蔵部位間の平均値が約20%であって長期にわたり比較的一定であった。個体は自身の特徴的曲線上にあると思われたが、各個体内では、試験した全貯蔵部に関して長期にわたり一定の結果であった。
【0235】
この実施例で記載した手法は、脂肪組織のTG合成、正味の脂肪分解(TG分解)、及びヒト被験者において長期(すなわち週又は月)にわたって統合されたDNL経路からの寄与の同時(すなわち並行)測定を可能にする。さらに外来患者の重水摂取は単純で条件を満たしやすく、比較的高価ではないため、この手法には、ヒトでの脂肪組織成分の動態を評価する代替方法に対して、多数の実際的な利点がある。
【実施例9】
【0236】
ミトコンドリアでのカルジオリピン:DNAの合成速度に対する有酸素運動の作用
筋肉でのミトコンドリア生合成は、有酸素運動に反応して生じる(上記参照)。ミトコンドリアの生体分子は、mtDNAだけではなくリン脂質、特にミトコンドリアに比較的独自な分子−カルジオリピン(CL)に富んだ膜をも含む。ミトコンドリア等の細胞器官の統合された生合成は、mtDNA、ミトコンドリアのカルジオリピン、及びミトコンドリアのタンパク質の組織的な合成を必要とする。CLは3つのグリセロール部分を含み、したがってアシルグリセリドのグリセロール部分に対する2H2O標識の適用に理想的である。ラットにおける運動治療計画の開始は、mtDNAと同様にミトコンドリアのカルジオリピンの合成刺激に帰結して、2つのパラメータはよく相関する。したがってミトコンドリアのカルジオリピン合成の評価は、有酸素訓練の状態と治療計画との評価において有益(mtDNAより高感度な手法として)なことがある。ミトコンドリアのカルジオリピンとmtDNAとの並行した変化の知見は、どちらか一方の知見をそれ自体が大きく補強する。評価した2つの合成速度間が不一致という知見は、結果の再評価又はこの知見の新規原因の探求が必要と考えられるであろう。mtDNAとミトコンドリアのカルジオリピンとの分子流速は、アイソトープ標識水の投与並びにmtDNAとミトコンドリアのカルジオリピンとの検出によって、質量分析で同時(すなわち並行)測定する。
【0237】
簡単に説明すると、Sprague-Dawleyラット、3ヶ月齢のメスを、対照(運動なし)又は実験(回転ホイール運動を実施可能)群に無作為に割り付けた。動物は個別に金網底ケージに入れて、AIN−93M飼料を摂食させた。動物には、99%2H2Oを5%濃縮で屠殺前に8日間ボーラス投与して、飲料水は8%を維持した。動物は、4週後に赤色腓腹筋、心臓、及び血液を採取した。ミトコンドリアを新鮮組織から分画遠心によって単離した。ミトコンドリアは、mtDNA及びリン脂質(カルジオリピン及びフォスファチジルコリン)を後に分析するために、2つの個別のチューブに等分に入れた。血漿を体内水の2H2O濃縮評価に使用した。カルジオリピン及びフォスファチジルコリンを、上述した本発明の方法を使用して同時測定した。またカルジオリピン及びmtDNAを、上述した本発明の方法を使用して同時(すなわち並行)測定した。
【0238】
図12及び13は、mtDNA、カルジオリピン及びフォスファチジルコリンを含む3つのミトコンドリア生合成のマーカー間の比率を示す。図12は、mtDNA合成に比較した場合、カルジオリピンがミトコンドリアの生合成のバイオマーカーとしてmtDNAと同等であることを示す。同様に、図13は、フォスファチジルコリンがカルジオリピンと同等であることを示し、ミトコンドリアの生合成の評価においてこれらの3つのバイオマーカー全てが有用であることを示す。本方法によって、ミトコンドリアの生合成の評価のために、これらのバイオマーカーの2以上の同時測定が可能である。もう1つのバイオマーカー又は他のバイオマーカー双方に関連して、1つのバイオマーカーの変化が、代謝疾患とミトコンドリアの生合成の変化を含む代謝状態との診断、或いはミトコンドリアの生合成の刺激又は阻害に関して試験した化合物の治療活性を評価するための有用な情報を提供することがある。
【実施例10】
【0239】
T細胞のDNA対血漿免疫グロブリンの合成
細胞性免疫系及び液性免疫系は、身体の宿主防御系の別々の部門を表す。前者はTリンパ球の活性化及び増殖を示し、後者はBリンパ球による抗体(免疫グロブリン)合成を示す。免疫系のどの部門が疾病状態又は薬剤治療において活性化又は抑制されているのかを知ることは、重要である。血漿免疫グロブリンの合成速度に対するT細胞の増殖速度(T細胞のDNA合成)を比較することは、細胞性:液性の免疫活性化の評価を表す。T細胞のDNA及び免疫グロブリンの分子流速は、アイソトープ標識水の投与とT細胞のDNA及び免疫グロブリンを質量分析で検出することによって同時(すなわち並行)測定される。抗原特異的なT細胞及び/又は免疫グロブリンも上述のように測定される。
【実施例11】
【0240】
選択的エストロゲン受容体モジュレーター(SERM)で治療時の哺乳動物の上皮細胞及び子宮内膜細胞の増殖対骨コラーゲン分解及び脳β−アミロイド生成
SERMは、女性の健康を改善する可能性のある治療薬として大きな注目を浴びている。エストロゲンの作用は組織の相違によって大きく異なるが、個々の女性でのリスク:利益のバランスは、これらの対立作用次第である。エストロゲンは、哺乳動物の上皮細胞及び子宮内膜細胞の増殖を上昇させる傾向(その結果、乳癌及び子宮癌のリスクが増大)があり、一方骨コラーゲン分解の低下(その結果、骨粗鬆症のリスクが低下)させる傾向と、場合により脳β−アミロイドタンパク質増加を低下(その結果、アルツハイマー病のリスクが低下)させる傾向がある。SERMは細胞の増殖作用に対抗するが、他の作用は刺激又は未変化であるように企図された可能性がある。それらの薬剤には、公衆衛生及び市場での大きな有用性があるであろう。作用の最適の組み合わせをスクリーニングする手段は、明らかに有用であろう。言及した全てのプロセス(哺乳動物の上皮細胞及び子宮内膜細胞のDNA複製、骨コラーゲン及び脳β−アミロイドの動力学)が本明細書に記載したように同時(すなわち並行)測定される。
【実施例12】
【0241】
皮膚の光老化における皮膚のコラーゲン対エラスチンの合成及び分解
皮膚のしわは日光暴露で増加する。この分野は、化粧品及び薬剤の研究における非常に大きな市場に相当する。皮膚のしわ(光老化)の生化学はよく特徴決定されており、皮膚層のコラーゲンの減少(合成の低下及び分解の上昇)及びエラスチンや他のタンパク質の増加(合成の上昇に因る)から成る。皮膚エラスチン合成に対する皮膚コラーゲンの合成や分解の比率は、したがって動物モデル(例えばヘアレスマウス)及びヒトにおけるハイスループット方法での抗しわ治療試験に対する、光老化の直接のマーカーを表す可能性がある。これらの分子の合成は、アイソトープ標識水の投与と皮膚のコラーゲン及びエラスチンの相対分子流速を質量分析で比較することによって同時(すなわち並行)測定される。
【実施例13】
【0242】
乾癬でのケラチン代謝回転(タンパク質)対ケラチン生成細胞増殖(DNA)
乾癬は、乾燥した、きわめて限局性で、サイズが多様な、銀色に光る鱗屑性丘疹及びプラークを特徴とする一般的な慢性、再発性の疾病である。1つ又は2つの部位から広範な皮膚病へと重症度が異なり、無力関節又は落屑を伴うことがある。原因は不明であるが、厚い鱗屑は表皮の細胞増殖及び付随する皮膚の炎症によるものと伝統的に思われてきた。一般的な部位は、境界が明確で、掻痒感が多様で、卵形又は環状で、紅斑性の丘疹又はプラークであり、重なり合って、厚く、銀色に光る、雲母状又はやや乳光の輝く鱗屑で蔽われている。紅斑性の乾癬(落屑性乾癬性皮膚炎)は治療に抵抗することがある。皮膚表面全体は、赤色で細かい鱗屑に覆われており、一般的乾癬部位は、曖昧又は存在しないことがある。全般的な衰弱を招き、入院を必要とすることがある。
【0243】
ケラチンは、共通の構造を持った50以上の構造タンパク質のファミリーである。いくつかのケラチンは、皮膚に発現しており、主たる表皮タンパク質成分を構成する。表皮の基底細胞は娘細胞を産生して、娘細胞は皮膚表面に向かって移動し、ケラチンK1及びK10並びに脂質以外の少量を含むまで成熟する。これらの細胞は最終的に死んで多層の防御外部皮膚表面、角質層を形成する。ヒトの正常皮膚においては、新規のケラチンの合成から皮膚表面での脱落までに平均で約4週間を要する。乾癬は、皮膚の過剰増殖によって特徴的に特徴づけられ、皮膚のケラチン及びケラチン生成細胞通過時間は、したがって数週間ではなく数日を要することがある。
【0244】
ケラチンは、皮膚での代謝回転の利用可能なマーカーを提供する。ケラチンの代謝回転は、2つの方法でモニターが可能である。1つには、表皮全体を皮膚試料から単純なタンパク質分解処理で単離する。2つには、特別な付着性をもった細長いテープ片を皮膚表面に接着させて、最外部で死んだ組織と、同時に一層を取り除く。標識ケラチンが、重水投与に際して表皮全体に即座に出現するが、細長いテープ片でモニターしたヒト正常皮膚の表面にいずれかの標識が出現する前に、2週半を要する。正常皮膚で下層表皮で生きている部分に到達するためには、少なくとも30のテープを順次付着する必要がある。
【0245】
ケラチンは非常に不溶性であり、これは皮膚の他のタンパク質からのケラチン画分の分離を容易にする。同様の手順は、表皮全体及び細長いテープ片双方で奏功する。最初に試料をTritonX−100を含む高塩緩衝液中で抽出する。この溶液は基本的にケラチンを除いて全ての表皮タンパク質を溶解する。次にケラチンを溶解してドデシル硫酸ナトリウム中での煮沸によってケラチンを溶解する。髪もケラチン(少々異なる構造)から成るが、髪のケラチンはこの方法では溶解せず試料には混入しない。実質的に純粋な皮膚ケラチンをこの単純な抽出によって産生する。
【0246】
重水を投与した正常マウスでは、皮膚ケラチンでの重水濃縮は数週間プラトー状態に到達しない(図7)。一方薄片状(flaky)皮膚(FSN)マウスは皮膚の過剰増殖を伴った乾癬のモデルマウスで、僅か4日で全面的な代謝回転とほぼ等しくなる。正常マウス対FSNマウスの同様な対比が、表皮ケラチン生成細胞の増殖においてみられる(図8)。ケラチン測定(図7)とケラチン生成細胞の新規のDNA合成(図8)を同時(すなわち並行)測定した。ケラチン及びケラチン生成細胞の動態の並行変化は、組織内に存在する過剰増殖状態を確かなものとする。
【実施例14】
【0247】
異なる組織での化学療法剤の作用の比較
balb/C nu/nuマウスのオスの皮下に、マトリゲル中の非小細胞肺癌細胞(SW1573)を移植した。マウスを2H2Oで標識して漸増用量のゲムシタビン(Gem)を1日おきに投与して治療(図9に示す)した。5日後に、腫瘍、結腸、及び骨髄を周知の技術を使用して上述したように取りだした。細胞増殖を上述のように測定した。データは、細胞増殖が腫瘍と骨髄細胞において用量反応的に阻害されたが、一方結腸細胞では殆ど阻害を示さなかったことを示す。3つの細胞型全ての新規のDNA合成が、本発明の方法を使用して同時測定された。簡単に説明すると、重水(2H2O)を生存生物に投与した(飲料水中8%2H2O)。DNAを単離して遊離のdN類へと加水分解し、プリン又はピリミジンのdN類のデオキシリボース(dR)部分への重水素の取り込みを、ガス・クロマトグラフィー/質量分析装置(GC/MDS)で上述したように測定した。dAでの標識含有量は、新規のDNA合成(細胞増殖)を示す。
【0248】
balb/C nu/nuマウスのメスの皮下に、約106のマトリゲル中のEMT7マウス乳癌細胞を移植した。腫瘍は、約1500mm3の大きさに到達可能であった。マウスを2H2Oで標識してジェムザール(ゲムシタビン又はGem)125mg/kg又はヒドロキシウレア(HU)500mg/kgのいずれか一方を投与した。Gemは1日おきに、HUは毎日、対照生理食塩水は毎日投与した。5日後に腫瘍を取り出して、細胞増殖を上述のように測定した。データを図10に図示する。図10で示すように、Gem及びHUは、対照生理食塩水を投与した細胞に関連して、腫瘍及び骨髄細胞の双方で細胞増殖の低下を引き起こした。双方の細胞型の新規のDNA合成が、本発明の方法を使用して上述したように同時(すなわち並行)測定された。
【0249】
ヌード・マウスに、ヒトSW1573肺癌細胞(5×106細胞/動物)を移植して異なる用量のパクリタキセルを注射して2H2Oで24時間標識した。ビヒクル(エタノール:Cremephor ELの1:1(容量/容量)溶液)及びパクリタキセル貯蔵液(エタノール:Cremephor ELの1:1(容量/容量)溶液に溶解)の双方を、滅菌0.1Mリン酸緩衝生理食塩水(PBS)で1:6に希釈した後、動物注射した。腫瘍細胞及び骨髄細胞が、周知の技術を使用して上述したように取り出された。
【0250】
結腸細胞を以下のように取りだした。結腸を動物から取りだして0.1Mリン酸緩衝生理食塩水(PBS)で洗浄し、切開してII型コラゲナーゼ(72mg/mL)及びDNアーゼ(10μg/mL)を含むPBS中で37℃で40分穏やかに振盪してインキュベートした。インキュベーション後に、組織を穏やかに掻き取り、細胞を4℃、800×g、5分間の遠心で回収した。沈渣は45%パーコール含有1.6%JMEM培地中に均一に懸濁した。懸濁液を75%パーコール勾配中の5mLの45%パーコール・クッションの上に載せて、室温で350×g、30分間遠心した。結腸細胞を回収してPBSで2回洗浄した。次に残渣を、35mmのフィルターを使用して細胞懸濁液から分別した。3つの細胞型全ての新規のDNA合成が、本発明の方法を使用して上述したように、同時(すなわち並行)測定された。図11に結果を図示する。示されるように、パクリタキセルは、腫瘍細胞と結腸細胞に対して用量依存的に阻害効果を示したが、骨髄細胞には僅か又は殆ど効果がなかった。
【実施例15】
【0251】
異なる組織での血管形成及び組織細胞増殖の比較
本発明の方法は、血管形成に適用した場合は動物試験及びヒトの臨床試験双方で適用可能である。本方法は、早期の薬剤発見及びより進歩した臨床治療の設定において、可能な予防/抗血管形成剤の活性とその真の有効性との評価に対する迅速でより精確な技術を提供する。
【0252】
組織中の血管形成速度は、内皮細胞の増殖速度によって評価する。内皮細胞の増殖は、重水(2H2O)標識技術によって計量した。さまざまな組織(示したように)が、コラゲナーゼ(1mg/mL)で単一細胞懸濁液へと消化された。内皮細胞は、パーコール勾配遠心法とその後のFACS法(イソレクチン及びCD31の陽性細胞に関して)で濃縮した。
【0253】
特に血管形成の動態は、肝臓及び腫瘍の異種移植片で評価した。Balb/Nuマウスにヒト乳癌細胞を移植した。2H2Oで標識後、個々の動物を屠殺して、腫瘍組織及び肝臓組織双方を同一の動物から回収した。肝臓細胞及び肝臓の内皮細胞と同様に、腫瘍細胞及び腫瘍の内皮細胞の増殖速度(すなわち新規のDNA合成)を、本発明の方法を使用して上述したように同時(すなわち並行)測定した。図14に、結果を図示する。図14では、腫瘍の内皮細胞の増殖速度は、肝臓の内皮細胞増殖速度より有意に高値であることが示される。同様に、腫瘍細胞の増殖速度は肝臓に対する速度より高い(図14)。当業者は、この技術が血管形成阻害剤(すなわち抗血管形成化合物)の同定に使用可能と認識するであろう。例えば、1又は複数の化合物をBalb/Nuマウスの腫瘍異種移植片に直接投与した場合には、本発明の方法は、肝臓内皮細胞増殖に関連して腫瘍内皮細胞増殖の阻害、及び可能性として肝臓細胞増殖に関連して腫瘍細胞増殖の低下を検出(もし血管形成が腫瘍の成長に制限的であれば)するであろう。また、抗血管形成作用を持つ1又は複数の化合物を全身投与した場合には、次に腫瘍内皮細胞増殖及び肝臓内皮細胞増殖の速度は、双方とも比率が未変化のままであるように変化(すなわち減少するであろう)するであろう。腫瘍細胞増殖及び肝臓細胞増殖の速度の比率は、成長のための血管形成におけるそれらの相対的依存性によって、変化又は不変化のどちらか一方の可能性がある。
【実施例16】
【0254】
肝臓細胞増殖(DNA合成)及び肝臓線維形成(コラーゲン合成)の比較
薬剤誘導型肝臓疾病は、肝不全の重要な原因であり、市場からの薬剤回収の最も一般的な単独の原因である。壊死は、その毒性メカニズムにかかわらず肝細胞損傷の顕著な特徴である。アポトーシスも、薬剤誘導型肝臓疾病における重要な要素と考えられている。壊死及びアポトーシス双方に対する肝臓の反応は、細胞増殖であり、欠損した細胞量に置き換わる。毒性損傷の低い段階では、細胞増殖は、正常な組織学的外観及び肝細胞のプール・サイズの維持に十分なことがあり、それによって毒性損傷を補償して標準的な組織学的方法による検出を妨害する。損傷が肝臓自身の修復能を超えたときにのみ、肝臓毒性の従来型の特徴が明らかとなる(例えば肝臓機能検査値の上昇、壊死、線維化)。
【0255】
SVJマウスに、四塩化炭素又はビヒクル、1.0mL/kg又は0.25mL/kgを週に2回、4週にわたって注射した。細胞増殖が、2H2O投与及び四塩化炭素処置の後の2、7、14、21及び28日に、本発明の方法を使用して上述したように測定された。四塩化炭素は、双方の用量で細胞増殖を有意に上昇させた(図15)。100%近い新細胞が、四塩化炭素の繰り返し投与の4週後に存在することが示された。
【0256】
肝臓コラーゲンの合成が、同一の四塩化炭素処置SVJマウスにおいて新規のDNA合成と共に同時(すなわち並行)測定された。コラーゲンが、10mgの新鮮全肝ホモジェネートから以下のように精製された。ポリトロン・ホモジナイザーを使用して、100mM NaOH、0.5mL中でホモジナイズすることによって軟組織からコラーゲンを単離した。これらの条件下では、コラーゲンは引き続き不溶であるが、大半の他のタンパク質は容易に溶解する。4℃で7000×g、10分の遠心後に、上清を廃棄した。沈渣は、2mLのH2Oで手早く洗浄してLaemmliの還元試料用緩衝液(Bio-Rad、Hercules、カリフォルニア州)中で3分煮沸して溶解させた。溶解物は、SDS−PAGEによってサイズ分画を行った。次にタンパク質は、標準技術を使用してPVDF上に転写して、得られた膜からコラーゲンのαモノマーに相当するコラーゲン・バンドをクーマシーブルーで染色した後に切り出した。
【0257】
アセトン沈殿させた全肝タンパク質及びPVDF結合コラーゲンは、6N HClで110℃で16時間加水分解した。加水分解物は、乾燥させてPFBBr(PIERCE)を100℃、1時間、添加することで五フッ化ベンジル誘導体を生じた。ヒドロキシプロリンの水酸基を、メチル・イミジゾール/無水酢酸でさらに誘導体化した。ヒドロキシプロリンをDB225 GCカラム上で、開始温度100℃を10℃/分で220℃としてm/z352、m/z353の選択イオンモニタリングで分析した。
【0258】
ヒドロキシプロリンは、目的の分子でありOH−プロリンとして測定するが、本分子は基本的にコラーゲン固有である。この事実から、全肝タンパク質加水分解物は誘導体化が可能であり、ヒドロキシプロリンの2H濃縮は、GC/MSによって上述したように評価した。正常及び四塩化炭素処置動物のコラーゲンの部分合成が、全肝タンパク質由来のヒドロキシプロリンへの2Hの取り込みから本発明の方法を使用して上述したように計算された。図16に結果を図示する。図15及び16をまとめて考えると、本方法は、有意な細胞増殖が四塩化炭素の双方の用量で生じており、一方有意なコラーゲン合成が最高用量の四塩化炭素でのみ生じており、これによって肝臓毒性の2つのバイオマーカー間を区別可能な鋭敏な技術を提供していることを示すことが可能であった。
【0259】
細胞増殖及びコラーゲン合成(代謝回転)も、グリセオフルビン摂食マウス(C57BL/6及びBalb/c)で同時(すなわち並行)に評価された。グリセオフルビンは、肝毒物で細胞増殖とポルフィリン症を誘導すると認知されている。マウスに飼料に入れたグリセオフルビン(1%重量/重量)を5日間投与した。投与の5日後に、C57BL/6の細胞増殖(上述したように測定)が、対照に関連した増殖上昇を示した(図17)。特に観察可能な作用を示さないレベル(NOEL)以下のグリセオフルビンの投与は、5日後に明白な作用及び用量反応性を示した(図17)。またコラーゲン代謝回転が上述したように測定されたが、C57BL/6マウスに投与したグリセオフルビンの用量ではコラーゲン代謝回転の上昇は検出されなかった(データは示さない)。
【実施例17】
【0260】
神経細胞増殖、小グリア細胞増殖及び/又はミエリン合成に対するAβ合成又は他の脳タンパク質の比較
アルツハイマー病(AD)には、β−アミロイド(Aβ)タンパク質、アミロイド前駆体タンパク質(APP)、及びAPPのC端末フラグメント等の多様な脳タンパク質を含む多数の因子が含まれると考えられている。また、神経細胞増殖、神経組織の炎症、及びミエリンの動態変化といった他の因子も関与している。本発明の方法は、例えば化合物に、ADモデルマウス、ADを伴わない神経組織の炎症、神経毒性、又は他の神経組織変性の疾病又は症状における治療有効性があるかどうかを比較するために、これらの成分全て又はその成分の一部の同時(すなわち並行)測定を可能にする。
【0261】
脳タンパク質の単離及び測定
マウスを屠殺して脳組織を取りだしてAPP及びCTFを採取する。分泌APPは、マウスの脳脊髄液(CSF)又は脳から抽出する。タンパク質は中性緩衝液中で抽出して不溶性物質を取り除きタンパク質を沈殿させる。得られた物質をイオン交換緩衝液中で交換してイオン交換クロマトグラフィー、次にサイズ排除及び/又は逆相クロマトグラフィーによって精製する。精製タンパク質の同定は、ELISA及びウエスタン・ブロット法で確認する。
【0262】
Ab、APP、及びCTFの濃縮は、上述したように実施する。Ab、APP、及びCTFの分子流速は、上述したように計算する。
【0263】
海馬神経細胞の単離及び神経細胞増殖測定のための破傷風毒素染色
冷蔵庫からパパインのバイアルを取り出す。Hibernate A(BrainBits、LLC、Springfield、IL)3mLを加えて37℃の振盪装置中に置く。分注したDNアーゼを−20℃の冷凍庫から取りだした、氷上で融解させる。CO2を使用して安楽死させたマウスから、心臓穿刺で採血して血液を3000rpmで10分遠心して血漿を取り出す。脳を取りだしてHibernate A 5mLで洗浄する。海馬を切り出して0.5mmの切片に薄切してトリプシン処理用フラスコ中のHibernate A 2mLに移す。パパイン溶液3mLとDNアーゼ200μLとをトリプシン処理用フラスコに加える。37℃で30分消化する。15mLのスピッツ管に移して1500×gで3分間遠心して上清を取り出す。Hibernate A 2mLを加えて、3分タイマーを作動させて炎で丸めてシリコン処理したパスツールピペットを使用して1分以上で10回、ほぐす。2分間静置して、上清を15mLのスピッツ管に移す。
【0264】
細胞懸濁液6mLを得るために、上記のステップを2回繰り返す。
【0265】
1500×gで3分間遠心し、上清を取り出す。細胞分離緩衝液10mLに再懸濁する。5分間インキュベートする。1500×gで3分間遠心して上清を取り出す。
【0266】
4%パラホルムアルデヒド溶液5mLに再懸濁する。室温で1時間インキュベートする。Hibernate A 5mLを加えて1500×gで3分間遠心して上清を取り出す。Hibernate A 5mLで1回洗浄して1500×gで3分間遠心して上清を取り出す。
【0267】
Hibernate A 550μLに再懸濁する。50μLの陰性対照を取り出す。細胞懸濁液500μLに、rTTC 5μLを加える(1:100希釈)。
【0268】
室温で1時間インキュベートする。Hibernate A 5mLで2回洗浄して1500×gで3分間遠心して上清を取り出す。Hibernate A 200μLに再懸濁する。
【0269】
抗TTC抗体2.5μLを染色用試料に加えて室温で30〜45分インキュベートする。Hibernate A 5mLで2回洗浄して1500×gで3分間遠心して上清を取り出す。Hibernate A 500μLに再懸濁する。
【0270】
ヤギ抗マウス−ALEXA488 5μLを、Hibernate A 50μLで希釈する(1:10希釈)。希釈抗体の5μLを染色用試料に、0.5μLを陰性対照に加える。室温で15〜30分間インキュベートする。
【0271】
Hibernate A 5mLで2回洗浄して1500×gで3分間遠心して上清を取り出す。染色用試料は1mLのHibernate Aに、陰性対照は250μLのHibernate Aに再懸濁する。PIを1:500で試料に加えてソートする。
【0272】
DNA合成を上述したように測定する。
【0273】
アルツハイマー病や他の神経疾病(アルツハイマー病に関係しない神経組織の炎症等)における神経組織の炎症評価のための小グリア細胞の単離
マウスを2H2Oで適当期間標識する。マウスを麻酔して氷冷PBS 10mLで灌流(経心臓灌流)する。直ちに脳を回収して氷冷PBS中に置く。次に脳を細切して、0.05%DNアーゼ、0.25%トリプシン、0.8%グルコース、及び0.16%EDTAを加えたPBS 30mLを入れたバッフルフラスコ中で37℃で25分間振盪する。その後、各フラスコを氷冷培地(10%FBSを添加した1:1 DMEM:HAM氏F10 30mL)で中和して氷上に置く。次に、10mLピペットで組織の断片が分離するまで組織を繰り返しほぐす。得られた材料は、100μmのフィルターを通して濾過して、培地で洗浄して細胞以外の残渣を取り除くために不連続のパーコール勾配にかける。
【0274】
得られた細胞を、マクロファージ特異的マーカーF4/80及びCD11bで染色して4%パラホルムアルデヒド(PFA)で固定して次にFACSで単離する。また、細胞は、FACSやMACSで小グリア細胞や小グリア細胞サブセットをソートするために使用可能な、他の細胞表面又は細胞内のマーカーで標識が可能である。細胞は、4%PFAで固定せずに直ちにソートすることも可能である。本技術は、循環系から脳に入る浸潤白血球の単離にも使用可能である。
【0275】
DNA合成が、上述のように測定される。
【0276】
ミエリンの単離と測定
1セットの2mLマイクロ遠心チューブを秤量する。脳をマウスから回収してそれを秤量済みのマイクロ遠心チューブに入れる。マイクロ遠心チューブは、再度秤量する。正味の重量が、脳の重量である。脳は、氷冷したガラスプレート上に置いてBHTの結晶を10個加える。脳を、カミソリの刃を使用して1分間細切する。細切した脳は、薬匙を使用してマイクロ遠心チューブに戻し入れる。脳は、薬匙でよく細切する。細切した脳の一部を、組織が管の底部にあることを確認しながら直径13mm、長さ100mmのPTFE製ねじ蓋付きのガラス管に入れる。脳の残部は、マイクロ遠心チューブ中で−20℃で貯蔵する。BHTを含む、クロロホルム:メタノール 2:1(容量:容量)2mLをガラス管に加えて、組織全てが溶媒に浸漬していることを確認しながらチューブをボルテックス撹拌する。室温で3時間、暗所に静置する。ガラス管の蓋を外す。管は、2000×gで10分間、室温で遠心する。上清(脂質抽出物)は、2mLのねじ口バイアルに注ぎ、固形残渣は廃棄する。
【0277】
展開溶媒(クロロホルム−メタノール−水:69.15%:26.60%:4.26%)100mLを、TLCプレートを入れる1時間前にTLC展開槽に入れる。20mLピペットが、全セレブロシド標準品20mLをWhatman LK6DF シリカゲル60TLCプレートの1、10、19レーン上にスポットするために使用される。各試料には、20mLピペットが、脂質抽出物100μLを2つの隣接レーンにスポット(50mL/レーン)するために使用される。TLCプレートが視覚的に乾燥するまで待つ。TLCプレートは、展開槽の中で展開する。各槽には2枚のプレートを向き合わせに入れる。プレートが充分に展開するまでに、通常40〜45分を要する。TLCプレートを展開した後、プレートの乾燥を15分間待つ。ヨウ素結晶20個を、ヨウ素蒸気用に特に使用される槽に入れる。槽は、80℃に設定したヒートブロック上に置く。乾燥したTLCプレートは、ヨウ素槽に入れて二重結合を含む脂質のスポットを可視化する。全セレブロシド標準品のスポットを、それらの試料と一致させる。TLCプレート像は、コンピュータで走査する。シリカゲルは、秤量箱に回収して直径12mm、長さ75mmの使い捨てガラス管に移す。BHTを含むクロロホルム−メタノール2:1 1mLを加えてボルテックス撹拌する。シリカが沈むまで静置する。溶媒は、直径13mm、長さ100mmのねじ蓋付き管に入れる。固形残渣は廃棄する。3N HClメタノール1mLを管に加えて蓋をきつく締める。管は、80℃のヒートブロック上に2時間置く。次に、管をヒートブロックからおろして室温で冷却させる。H2O1.5mL及びヘキサン3mLを管に加えて管をボルテックス撹拌する。1.8〜2mLの底部の層(メチルグルコース及びメチルガラクトース)を、GCバイアルに移す。GCバイアルをJouan10.10スピードバックのはめ込み式ローターに入れてローターの釣り合いを取り、60℃に設定する。その管が乾燥するまで真空にする。GCバイアルに無水酢酸−ピリジン2:1(容量:容量)100μLを加えてバイアルに蓋をし、室温に1時間置く。バイアルは、乾燥するまでN2下に吹き付ける。酢酸エチル100μLをバイアルに加えてボルテックス撹拌する。混合物はGCインサートに移してバイアルは締め具で蓋をしめる。試料はGC/MSにかけてガラクトセレブロシドの濃縮は、上述したように評価した。
【0278】
本明細書に引用された全ての刊行物、特許、及び特許出願は、全ての目的のためにその全体が参照により本明細書に組み込まれ、それと同程度に、個々の印刷物、特許、及び特許出願は、引用によって組み込まれるように具体的かつ個別に示される。上述の本発明は、理解を明確にするために例示によってより詳しく記載されているが、本発明の教示に照らせば添付の特許請求の範囲の精神と範囲から逸脱することなく変更及び改変が可能であることは当業者には容易に明らかである。
【図面の簡単な説明】
【0279】
【図1A】図1A〜Bは、アイソトープ標識水から選択された遊離アミノ酸への標識水素交換の経路を表す図である。
【図1B】図1A〜Bは、アイソトープ標識水から選択された遊離アミノ酸への標識水素交換の経路を表す図である。
【図1C】タンパク質合成のためのH218Oによる遊離アミノ酸の18O標識を表す図である。
【図2】水からDNAのデオキシリボース(dR)への水素アイソトープ(この場合重水素)の取り込みを表す図である。
【図3】10〜12週間、毎日50〜100mLの2H2Oを摂取した代表的なヒト被験者の体内水分中の2H2Oの濃縮を表す図である。
【図4】(a)体重の安定した雌ラットの心筋及び後肢筋におけるmtDNAと核DNAの合成の比較(平均±S.D.);f、部分置換、並びに(b)左、ラット後肢筋におけるミトコンドリア(mt)リン脂質の合成及び運動訓練(随意車輪運動)の影響を表す図である。右、(a)からのラットにおけるmtDNAとCLの合成の相関関係。
【図5】対照マウス(n=7)及びob/obマウス(n=4)の4つの異なる脂肪貯蔵(子宮外膜、鼠径部、腸間膜、及び後腹膜)から単離された成熟脂肪細胞濃縮分画における細胞増殖速度の同時測定を表す図である。
【図6】ob/obマウス及び対照において、TG及びパルミチン酸合成(新規の脂質生成又はDNLのマーカー)のための2つの異なる脂肪貯蔵(鼠径及び腸間膜)、並びに脂肪細胞増殖のための4つの異なる区画(子宮外膜、鼠径、腸間膜及び後腹膜)において同時に測定された、脂肪代謝成分の動態を表す図である。
【図7】2種の異なるマウスで同時に測定された、及び図8で示す両方のマウス種でのケラチン生成細胞DNA合成と同時に測定された、ケラチンにおけるアラニンのEM1濃縮によって示される、正常マウス(C57bl/6マウス)及び薄片状皮膚マウス(FSM又は「薄片状皮膚マウス」、乾癬のマウスモデル)における皮膚ケラチン代謝回転を表す図である。
【図8】正常マウス(C57bl/6マウス)及び薄片状皮膚マウスにおけるケラチン生成細胞代謝回転(新規のDNA合成)を表す図である(f%=DNAの部分合成)。
【図9】雄balb/C nu/nuマウスにおける次第に高くした用量のゲムザー(Gemzar)(ゲムシタビン)を投与した後の腫瘍細胞、結腸細胞及び骨髄細胞の細胞増殖の同時測定を表す図である。
【図10】対照動物と比較した、雌balb/C nu/nuマウスにおけるGem及びヒドロキシ尿素(HU)による腫瘍及び骨髄細胞の細胞増殖のin vivo抑制を表す図である。
【図11】ビヒクル対照と比較した微小管分解阻害剤であるパクリタキセルの次第に高くした用量による、ヌード・マウスの3種類の細胞に対する細胞増殖のin vivo抑制を表す図である。
【図12】雌Sprague Dawleyラットのミトコンドリア赤腓腹筋における、カルジオリピン及びmtDNAの部分合成を表す図である。
【図13】雌Sprague Dawleyラットの心臓のミトコンドリアにおけるカルジオリピン及びホスファチジルコリンの部分合成を示す。
【図14】腫瘍内皮細胞増殖、肝臓内皮細胞増殖、腫瘍細胞増殖、及び総肝臓細胞増殖を示す。
【図15】2つの用量の四塩化炭素(CCl4)及びビヒクル対照に応答したC57B/6総肝臓細胞増殖を示す。
【図16】2つの用量のCCl4投与及びビヒクル対照に応答したC57B/6肝臓コラーゲン合成を示す。
【図17】グリセオフルビン投与(0.1、0.2、及び0.5%を5日)後のC57BL/6マウス肝臓細胞増殖を示す(全ての群についてp<0.05)。
【技術分野】
【0001】
本発明は、国立衛生研究所によって与えられた承認(契約)番号R01−AI43866−01AI及びR01−AI43866−01AIの下、政府助成金によって行われた。政府は本発明に対して一定の権利を有する。
【0002】
関連出願
本出願は、2003年7月3日に出願の米国特許仮出願第60/484,626号の優先権を主張する。
【0003】
発明の分野
本発明は、生物系における同じクラス又は異なるクラスの生体分子の相対分子流速を測定及び比較するための技術に関する。より詳しくは、本発明は、アイソトープ標識水を1又は複数の組織又は個体に投与して、その生体分子が異なる化学クラスに属する場合でも、疾患又は疾患に対する薬物療法の影響に関連する2以上の生体分子の相対分子流速を比較する技術に関する。
【背景技術】
【0004】
薬剤の開発及び発見の分野において、仮定された遺伝子又はタンパク質標的の、及び候補薬剤の、仮定された表現型の結果を検証するための機能的生化学マーカーの必要性が長く認識されている。近年の候補標的及び薬剤を同定するための手段における急速な技術的進歩、特に治療の潜在的な標的(即ち「治療標的」)を見出すための高効率のゲノム及びプロテオーム手段、並びに非常に効率的なコンビナトリアルケミストリー及び化学的又は生物学的な候補治療リードを生成するためのハイスループットスクリーニングアッセイの発達のために、無効の又は毒性のある候補物質を除くための表現型スクリーニング手段の必要性が、薬剤の開発及び発見における1つの最大の課題となっている。製薬会社がそれらの全てを完全に追求するには、あまりに多くの標的及びあまりに多くのリード化合物が存在する。したがって、このように厖大な数の候補治療標的及びリード化合物は、薬剤開発過程の初期に無効の又は毒性のある候補物質を除くために篩にかける必要がある。しかし、現在、表現型特性決定又は毒性評価に利用できる市販のハイスループットスクリーニング手段はない。この欠陥は、医薬産業が提供する手段における深刻なギャップとなっている。
【0005】
動物での前臨床研究からヒト承認治験、例えばFDAフェーズIII臨床試験までの薬剤の開発及び発見過程の異なる段階で使用される試験の垂直統合の能力も、製薬会社のために非常に有用であろう。薬剤の開発過程の全てのレベルで同じ方法及び形式で使用することができる試験は、開発段階が進むに従い、各レベルでの比較及び薬剤作用の内部検証を可能にするであろう。
【0006】
技術的な限界のため、遺伝子型とは対照的に生化学的表現型を測定するためのハイスループット汎用スクリーニング法の発達が遅れた。このギャップの理由は、生物学において操作可能な機能(即ち表現型)の真の単位は遺伝子又はタンパク質単独ではなく、完全に統合された系における代謝経路を通しての分子の動的流れ(即ち分子の流動又は動態)であるということである。分子の濃度を測定するための研究手法(例えばイムノアッセイ、標準の臨床化学、ジェノミクス/プロテオミクス及び他の従来のハイスループット方法)は非常に進歩したが、分子流動を測定する研究手法はそれほど進んでいない。分子動態測定技術の欠如は、特にハイスループットの多重同時分子流速測定に当てはまる。複雑な代謝経路により変化した分子流動は基本的に全ての疾患の基礎をなすので、この欠陥は基本的な問題となる。(例えば、以下に完全に引用したStephanopoulosら;Hellerstein, Annu Rev Nutr. 2003; Kaczer及びBurnsを参照)。
【0007】
従来の濃度に基づくアッセイ、例えば臨床化学、イムノアッセイ及びジェノミクス/プロテオミクスは、全て静的測定である。映画がスナップ写真と異なるのと同様に、時間の次元が含まれることによって分子動態学は静的試験と異なる。分子の動的流動を測定するためには、分子の静的測定とは完全に異なるセットの手段が必要である。分子動態の測定技術は、時間の次元を導入するためにアイソトープトレーサーの使用を含めなければならない。(例えば、以下に完全に引用されているHellerstein及びNeese、Am J Physiol 1999; Hellerstein Annu Rev Nutr. 2003を参照)。アイソトープ標識は時間の非対称性をもたらし(標識は最初は存在しないが後に存在する)、それによって分子動態の測定を可能にする。
【0008】
アイソトープ標識技術は、一般的に一度に単一分子又は単一の生化学クラスの分子の分子流速(動態)に制限されていた。投与される各標識基質は、通常、単一の化学クラスの有機分子に制限される。例として、標識アミノ酸、例えば3H−ロイシン又は13C−リジンを対象の細胞又は生物内のタンパク質又は全てのタンパク質を生合成により標識するために用いることができるが、他のクラスの分子(例えば脂質、DNA、炭水化物)はアミノ酸から有効に、又は確実に標識されない。同様に、DNA及びRNA動態を測定するための標識では、脂質、タンパク質及び他のクラスの分子の動態測定が可能ではない。この理由から、以前の動態標識測定は、一つのプロトコルによって異なるクラスの複数の生体分子の相対分子流速についての情報を提供しなかった。
【0009】
薬剤又は遺伝標的の生化学的結果(表現型)に関して最も有益な情報を提供するのは、異なる分子流速の組み合わせ又は比較であることが多い(例えばHellerstein、Annu Rev Nutr. 2003;Stephanopoulosらを参照)。しかし、薬剤の治療効力又は疾患の診断若しくは予後を評価する際に、1つの種類の細胞の増殖速度と他の種類の細胞の速度との比較(例えば、様々な癌における腫瘍細胞対内皮細胞)がしばしば有用であるので、同じクラスであるが異なる種類の細胞又は組織からの生体分子を分析する必要もある。したがって、単純でハイスループットな方法により、複数のクラスの生体分子の分子流速を並行して分析及び比較する必要がある。更に、同じクラスであるが異なる細胞型又は組織の中に存在する生体分子をハイスループットの方法で分析する必要がある。
【発明の開示】
【発明が解決しようとする課題】
【0010】
これらのニーズに応ずるために、本出願は、アイソトープ標識水を投与することによって2以上の生体分子の相対分子流速を測定及び比較する方法に関する。一実施形態では、2以上の生体分子は同じ生化学クラスのものであり、異なる細胞型又は組織に由来する。他の実施形態では、2以上の生体分子は異なる生化学クラスからのものである。
【課題を解決するための手段】
【0011】
本発明者は、アイソトープ標識水が、ポリヌクレオチド、タンパク質、脂質、糖質、グリコサミノグリカン、セラミド、糖脂質、プロテオグリカンその他を含む、基本的にあらゆる主要なクラスの生体分子の生合成速度を測定するための汎用性標識であることを発見した。更に、アイソトープ標識水は、極めて容易な投与、体内におけるレベルの安定性及び長い半減期、組織分画又はプールの欠如、数週間又は数ヶ月という長期の投与の容易性、並びに細胞から動物(例えば齧歯動物)、更にヒトに至る全ての生物系への適用性などを含め、以前認識されなかった標識送達ビヒクルとしてのいくつかの利点を有する。更に、質量分析及び生化学単離プロトコルにおける技術的進歩が、今では薬剤開発及び発見のための有効なスクリーニング技術としての使用に必要なハイスループットを可能にする。
【0012】
更に、2以上の生体分子の相対分子流速を測定及び比較することは、1つの生体分子の単一の分子流速の測定と比較して、組織又は個体についての相当量の情報を提供する。2以上の生体分子の相対分子流速を測定及び比較することは、複雑な代謝ネットワークの制御理論の研究者によって議論されるように(例えばStephanopoulosを参照)、異なる生体分子間の動的な関係の決定を可能にする(例えば、「流量分布」又は「制御構造」)。生細胞又は生物のような複雑な生化学ネットワークの状態に関する最も有益な情報又は疾病の特徴についての情報をしばしば提供するのは、単独の1つの速度ではなく上述の関係である。異なる生体分子の流量の間での動的な関係を決定することができると、とりわけ疾患及び病態、治療化合物による治療並びに化合物の毒性と関連する分子動態の測定が可能になる。更に、それらの分子が異なる化学クラスのものであってもアイソトープ標識水の投与と合わせて2以上の生体分子の相対分子流速を測定及び比較することは、単一のプロトコルによって測定される複数のクラスの分子の相対分子流速を比較するハイスループットスクリーニング法に容易に適応させることができる。
【0013】
詳細には、本出願は、生体分子が1個体内の異なる化学クラスである場合も含めて、2以上の生体分子の相対分子流速を測定及び比較する方法に関し、この方法は、a)アイソトープ標識水を、その標識が2以上の生体分子に取り込まれて2以上のアイソトープ標識生体分子を形成するのに十分な時間にわたり個体に投与するステップと、b)組織又は個体から2つ以上のアイソトープ標識生体分子を含む1又は複数の生体試料を得るステップと、c)前記2以上の生体分子における標識の取り込みを測定して前記生体分子の分子流速を測定するステップと、d)前記生体分子の分子流速を比較してそれらの相対分子流速を分析するステップとにより実施される。
【0014】
アイソトープ標識水は2H2Oとすることができ、また経口、非経口、皮下、血管内(例えば、静脈内若しくは動脈内)、又は腹腔内などを含め、許容できるいかなる投与方法によって投与されてもよい。個体は、ヒトでありうる。
【0015】
アイソトープ標識水の投与は、連続的でも、単回投与でも、又は複数回投与でもよい。この方法は、生体試料を得る前に、アイソトープ標識水の投与を中断して脱標識が起こるまで待機する更なるステップを含んでもよい。
【0016】
一実施形態では、生体分子は異なる生化学クラスのものでもよい。他の実施形態では、生体分子は同じ生化学クラスからのものであるが異なる細胞型又は組織に由来してもよい。更に他の実施形態では、生体分子は既定構造を有する単一分子であってもよい。
【0017】
生体試料は、生前又は死後に得られたものとしうる。生体試料を得る方法は、組織試料を得るいかなる方法、及び体液試料を得るいかなる方法、例えば採血、採尿、組織生検又は当技術分野で公知の他の方法を含むいかなる方法でもよい。
【0018】
2以上の生体分子への標識の取り込みは、液体シンチレーションカウンター、NMR及び質量分析などの方法によって検出されうる。アイソトープ標識の取り込みは、生体分子をより簡単に検出可能な分子に化学変換した後に検出してもよい。例えば、生体分子は分析の前に分解、化学的修飾、又は化学的誘導体化してもよい。
【0019】
生体分子のアイソトープの濃縮は、アイソトープ濃縮又は標識パターンを質量アイソトポマー分布分析(MIDA)によって計算し、前駆体−生成物又は指数関数的減衰方程式を適用して2以上の生体分子の分子流速を決定することによって決定することができる。
【0020】
生体分子の相対分子流速を比較する。比較は、比率、グラフ上の関係又は当技術分野で公知の他の比較法により行いうる。
【0021】
生体分子は、クラス全体の分子、クラス内の特定の分子及び/又は器官若しくは細胞小器官などの特定の部位からのものでもよい。一実施形態では、第1の生体分子は細胞のDNAであり、第2の生体分子は細胞タンパク質である。他の実施形態では、第1の生体分子はタンパク質であり、第2の生体分子は細胞DNAであり、第3の生体分子は脂質である。他の実施形態では、第1の生体分子は細胞タンパク質であり、第2の生体分子はミトコンドリアDNAである。他の実施形態では、第1の生体分子は脂肪組織アシルグリセリドであり、第2の生体分子は細胞タンパク質又は細胞DNAでありうる。他の実施形態において、第1の生体分子は脂肪組織アシルグリセリドであり、第2の生体分子は細胞タンパク質であり、第3の生体分子は細胞DNAである。
【0022】
生体試料は、組織、例えば筋肉、肝臓、膵臓、脳、脂肪組織、脾臓、腸、心臓、肺、皮膚、前立腺、性腺、胸部、滑膜、血球、又は体の他の組織でありうる。他の態様において、第1の生体分子はタンパク質であり、第2の生体分子はmRNAである。更なる変形において、第1の生体分子はミトコンドリアカルジオリピンであり、第2の分子はミトコンドリアDNAである。他の変形において、第1の生体分子は皮膚ケラチンであり、第2の生体分子は皮膚ケラチン生成細胞DNAである。他の実施形態では、第1の生体分子はアミロイドβタンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAであり、第4の生体分子はガラクトセレブロシドである。他の実施形態において、第1の生体分子はアミロイドβタンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAである。他の実施形態では、第1の生体分子はアミロイド前駆体タンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAであり、第4の生体分子はガラクトセレブロシドである。他の実施形態において、第1の生体分子はアミロイド前駆体タンパク質であり、第2の生体分子はニューロンDNAであり、第3の生体分子は小グリア細胞DNAである。
【0023】
生体分子は、ある分子クラス内の特定の分子でもよい。一実施形態では、第1の生体分子はトリグリセリドであり、第2の生体分子は脂肪酸であり、任意選択で、組織は肝臓であってもよい。
【0024】
生体試料は、成長中の組織、例えば筋肉、肝臓、副腎組織、前立腺組織、結腸組織、子宮内膜組織、皮膚、胸部組織、脂肪組織又は体細胞成長が可能な他の組織から得られてもよい。生体試料は腫瘍細胞又は細菌でもよいし、又はそれらを含むことができる。前記2以上の生体分子は、同時に単離及び/又は検出することができる。
【0025】
他の態様において、本発明は個体の1又は複数の組織内で又は個体内で疾患又は病態の進行を検出、予後診断又はモニターする方法を含む。疾患又は病態のない組織又は個体の第1集団における2以上の生体分子の相対分子流速が、測定及び比較される。1又は複数の組織又は個体の第2集団における2以上の生体分子の相対分子流速が測定及び比較される。第1及び第2の集団の間の相対分子流速の相違を次に特定して、疾患又は病態の進行を検出、予後診断又はモニターするために利用する。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0026】
他の態様において、本発明は個体の1又は複数の組織内で又は個体内で疾患又は病態の進行を検出、予後診断又はモニターする方法を含む。組織又は個体からなる集団における2以上の生体分子の相対分子流速は、化合物の投与の前後に測定及び比較される。投与前後の相対分子流速の相違を次に特定して、疾患又は病態の進行を検出、予後診断又はモニターするために利用する。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0027】
例えば、間質性肺線維症(IPF)は、IPFと診断された1又は複数の個体からなる集団における肺コラーゲン及び肺線維芽細胞DNAの相対分子流速を非罹患者の試験集団と比較することによって、診断、予後診断又はモニターしうる。或いは、IPFと診断されたか又はそれが疑われる1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0028】
他の例では、高脂血症は、高脂血症と診断された1又は複数の個体からなる集団における血漿アポリポタンパク質B、トリグリセリド、リン脂質及びコレステロールの2以上の相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしうる。他の変形例では、家族性混合型高脂血症は、家族性混合型高脂血症と診断された1又は複数の個体からなる集団におけるアポリポタンパク質B、並びにトリグリセリド、リン脂質、コレステロール及び/又はコレステロールエステルの1又は複数の相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしてもよい。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0029】
更なる変形において、第1の生体分子はT細胞又はB細胞DNAであり、第2の生体分子は血漿免疫グロブリンである。細胞性免疫活性化の低下は、細胞性免疫活性化の低下と診断された1又は複数の個体からなる集団における血漿免疫グロブリンに対するT細胞又はB細胞DNAの相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしてもよい。T細胞又はB細胞DNAの相対分子流速の低下により、第2の集団における細胞性免疫活性化の低下の進行が同定される。更なる変形において、第1の分子は、血漿免疫グロブリン以外のT細胞又はB細胞に由来するタンパク質でよい。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0030】
更なる変形において、第1の生体分子は真皮コラーゲンであり、第2の生体分子は真皮エラスチンである。光老化は、光老化表現型(皮膚のしわ)を有する1又は複数の個体からなる集団における真皮エラスチンに対する真皮コラーゲンの相対分子流速を試験集団と比較することによって、診断、予後診断又はモニターしうる。試験集団における真皮エラスチンの分子流速と比較した真皮コラーゲンの分子流速の変化から、この評価集団における光老化の変化が同定される。或いは、1又は複数の組織又は個体からなる集団の相対分子流速は、2以上の異なる時間に測定及び比較してもよい。
【0031】
本発明は、治療化合物を必要とする第1の集団で2以上の生体分子の分子流速を測定及び比較し、同じ集団又は1若しくは複数の組織若しくは個体からなる第2の集団に対してその化合物を投与し、その化合物の投与後に同じ集団で、又は1若しくは複数の組織若しくは個体の第2の集団で前記2以上の生体分子の分子流速を測定及び比較することにより、その治療化合物の効力を測定する方法も含む。前記化合物の投与前後の第1の集団における、又は第1の集団及び第2の集団の間の相対分子流速の相違から、その化合物を必要とする組織又は個体におけるその治療薬の効果が測定される。
【0032】
本発明は、治療化合物を必要とする1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、前記1又は複数の組織又は個体の同じ集団に対してその化合物を投与し、その化合物の投与後に前記集団で前記2以上の生体分子の分子流速を測定及び比較することにより、その化合物の効力を測定する方法も含む。前記化合物の投与前後の前記集団における相対分子流速の相違から、その化合物を必要とする組織又は個体におけるその化合物の効果が測定される。
【0033】
化学療法剤の殺腫瘍又は腫瘍静止作用は、細胞タンパク質及び細胞DNAの相対分子流速を測定及び比較することによって決定することができる。タンパク質及びDNAの相対分子流速が化学療法剤で治療を受けた個体で変化しない場合は、その薬剤は殺腫瘍作用を有する。しかし、DNAの分子流速がタンパク質の分子流速よりも大きく変化する場合には、その化学療法剤は腫瘍静止作用を有する(即ち、細胞は死滅しておらず、タンパク質の合成を継続しているが、分裂中ではない)。化学療法剤の殺腫瘍又は腫瘍静止作用は、治療を受けた集団及び治療を受けていない集団で、又はその化学療法剤による治療の前後に単一の集団で、細胞タンパク質及び細胞DNAの相対分子流速を測定及び比較することによって同定することができる。
【0034】
アンドロゲン又は他の同化治療の治療効果は、筋肉タンパク質又は筋肉DNAの相対分子流速を脂肪組織トリグリセリドの相対分子流速と比較することによって、消耗性又は虚弱性の疾患若しくは障害を有する1又は複数の組織又は個体で測定することができる。筋肉タンパク質又は筋肉DNAの分子合成速度が脂肪組織トリグリセリドと比較して増加する場合には、そのアンドロゲンは消耗性又は虚弱性の疾患又は障害に治療効果を有する。消耗性又は虚弱性の疾患又は障害における成長ホルモンの治療効果も、同様の方法で同定することができる。
【0035】
他の態様において、乳癌治療における選択的エストロゲン受容体モジュレーター(SERM)の治療効果は、乳房上皮細胞のDNA又は子宮内膜細胞のDNAの相対分子流速、及び乳房間質組織のタンパク質又は脂質の合成を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。乳房上皮細胞DNA又は子宮内膜細胞DNAの分子合成速度が乳房間質組織のタンパク質又は脂質の分子の分子合成速度と比較して低下する場合には、そのSERMは乳房細胞増殖に対して治療効果を有する。
【0036】
骨粗鬆症におけるSERMの治療効果は、骨コラーゲンの相対分子流速及び乳房又は子宮内膜細胞のDNA合成を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。乳房又は内皮のDNA合成の分子流速と比較した骨コラーゲンの分子流速の増加は、乳房又は子宮内膜癌のリスクに対するその潜在的な有害作用と比較した、骨粗鬆症に対するSERMの治療効果を示す。
【0037】
アルツハイマー病におけるある化合物の治療効果は、脳アミロイドベータ(Aβ)タンパク質又はアミロイド前駆体タンパク質、及び脳脊髄液(CSF)中の基準分子の相対分子流速を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。CSF基準分子(例えばCSF中の構成脂質)の分子流速と比較した脳Aβタンパク質の分子流速の減少は、アルツハイマー病に対するその化合物の治療効果を示す。或いは、アルツハイマー病におけるある化合物の治療効果は、Aβタンパク質及び/又はアミロイド前駆体タンパク質(APP)、ニューロンDNA、及び/又は小グリア細胞DNAの相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち、「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。任意選択により、ガラクトセレブロシド(脳又は血漿)の分子流速も、測定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較したAβ、APP、ニューロンDNA、小グリア細胞DNA及びガラクトセレブロシド(又はそのいかなる組み合わせ)の1又は複数の流速の相違は、アルツハイマー病に対するその化合物の治療効果を示す。
【0038】
神経炎におけるある化合物の治療効果は、ニューロンDNA、小グリア細胞DNA、及び/又はガラクトセレブロシド(脳又は血漿)の相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。任意選択により、1又は複数の炎症性タンパク質、例えばインターロイキン6及び/又はインターロイキン12及び/又はグリア原線維酸性タンパク質(GFAP)及び/又はS100B(グリアカルシウムシグナル伝達タンパク質)の分子流速も、測定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較したニューロンDNA、小グリア細胞DNA、ガラクトセレブロシド、インターロイキン6、インターロイキン12、GFAP及びS100B(又はそのいかなる組み合わせ)の1又は複数の流量の相違は、神経炎に対するその化合物の治療効果を示す。
【0039】
乾癬におけるある化合物の治療効果は、ケラチン生成細胞DNA及び皮膚ケラチンの相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較したケラチン生成細胞DNA及び/又は皮膚ケラチンの流量の相違は、乾癬に対するその化合物の治療効果を示す。
【0040】
肝臓病(例えば、肝線維症、肝硬変、化学物質若しくは微生物による急性毒性、又はその他の疾患)におけるある化合物の治療効果は、全肝細胞DNA又は肝実質細胞DNA、及び肝臓コラーゲンの相対分子流速を測定して、治療を受けていない組織又は個体、或いは疾患を有しない組織又は個体(即ち「対照」)と比較することによって、1又は複数の組織又は個体で決定することができる。罹患組織又は個体(例えば適当な動物疾患モデル)における、対照と比較した全肝細胞DNA又は肝実質細胞DNA及び肝臓コラーゲンの流量の相違は、肝臓病に対するその化合物の治療効果を示す。
【0041】
ある化合物の抗血管形成作用は、内皮細胞DNA及び腫瘍細胞DNAの相対分子流速を測定及び比較することによって、1又は複数の組織又は個体で決定することができる。任意選択により、他の組織の内皮細胞DNA及び組織DNA、例えば肝臓内皮細胞DNA及び全肝細胞DNAの相対分子流速を測定してもよい。治療を受けていない組織又は個体と比較した、腫瘍内皮細胞DNA及び腫瘍細胞DNAの流量の低下は、殺腫瘍作用を有する化合物の抗血管形成作用を示す。治療を受けていない組織又は個体と比較した、腫瘍内皮細胞DNAの流量の低下及び腫瘍細胞DNAの流量の増加の抑制は、その化合物の抗血管形成作用及びその化合物の腫瘍静止作用を示す。治療を受けていない組織又は個体と比較した、腫瘍内皮細胞DNAの流量の低下及び腫瘍細胞DNAの流量への無影響は、抗血管形成作用を有するが腫瘍細胞への影響がないことを示す。他の組織の内皮細胞DNA及び他の組織のDNAと比較した、腫瘍内皮細胞DNA及び腫瘍細胞DNAの流量の相違は、その化合物の抗血管形成作用を決定する代替方法である。
【0042】
個体における有酸素的運動に対する筋組織の反応は、筋組織内の細胞タンパク質及びミトコンドリアDNAの相対分子流速を測定及び比較することによって測定することができる。有酸素的運動を受ける個体における、細胞タンパク質と比較したミトコンドリアDNAの分子流速の増加から、有酸素適応性の増加が同定される。
【0043】
転写調節又は翻訳調節に基づくタンパク質発現の変化の原因は、タンパク質及びそのタンパク質をコードしているmRNAの相対分子流速を2以上の時点で測定及び比較することによって同定することができる。mRNAと比較したタンパク質の分子流速の増加から翻訳調節の変化が同定され、mRNAと比較したタンパク質の安定又は減少した分子流速から転写調節の変化が同定される。
【0044】
個体における全質量又はタンパク質発現の変化の原因は、全細胞RNA及び全細胞DNAの相対分子流速を2以上の時点で測定及び比較することによって同定することができる。DNAの分子流速と比較したmRNAの分子流速の増加から、転写が全質量又はタンパク質発現の変化の原因として同定され、全細胞DNAの分子流速と比較した全細胞mRNAの分子流速の不変又は減少から、細胞分裂の変化が全質量又はタンパク質発現の変化の原因として同定される。
【0045】
生物学的因子の治療特性は、1又は複数の組織又は個体からなる第1の集団で2以上の生体分子の分子流速を測定及び比較し、1又は複数の組織又は個体からなる第2の集団に対してその生物学的因子を投与し、前記2集団で前記2以上の生体分子の相対分子流速を比較することにより、同定することができる。前記2集団間で比較された分子流速の相違から、その生物学的因子の治療特性が同定される。
【0046】
或いは、生物学的因子の治療特性は、1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、その集団に対してその生物学的因子を投与し、その生物学的因子の投与の前後に前記2以上の生体分子の相対分子流速を比較することにより、同定することができる。前記生物学的因子の投与の前後で比較された分子流速の相違から、その生物学的因子の治療特性が同定される。
【0047】
前記生物学的因子は、いかなる生物学的因子でもよい。前記生体分子を含む1又は複数の生体試料は組織培養物でもよく、又は、実験動物若しくはヒトから得られてもよい。一変形形態では、前記生体分子の少なくとも1つはDNAである。他の変形形態では、前記生体分子の少なくとも1つはタンパク質である。
【0048】
生物学的因子の毒性作用は、1又は複数の組織又は個体からなる第1の集団で2以上の生体分子の分子流速を測定及び比較し、1又は複数の組織又は個体からなる第2の集団に対してその生物学的因子を投与し、第1の集団と比較して第2の集団で前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。第1の集団及び第2の集団間で比較された分子流速の相違から、その生物学的因子の毒性作用が同定される。
【0049】
或いは、生物学的因子の毒性作用は、1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、その集団に対してその生物学的因子を投与し、投与前後の前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。前記生物学的因子の投与の前後で比較された分子流速の相違から、その生物学的因子の毒性作用が同定される。
【0050】
生体異物(例えば、新しい化学物質、薬剤、薬剤候補、薬剤リード、生物学的因子、環境化学物質、食品添加物、化成物、化粧品、又はその組み合わせ若しくは混合物)の毒性作用は、1又は複数の組織又は個体(例えば実験動物又はヒト)の第1の集団で2以上の生体分子の分子流速を測定及び比較し、1又は複数の組織又は個体からなる第2の集団に対してその生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)を投与し、第1の集団と比較して第2の集団で前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。第1の集団及び第2の集団間で比較された分子流速の相違から、その生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)の毒性作用が同定される。
【0051】
或いは、生体異物の毒性作用は、1又は複数の組織又は個体からなる集団で2以上の生体分子の分子流速を測定及び比較し、その集団に対してその生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)を投与し、投与前後の前記2以上の生体分子の相対分子流速を測定及び比較することにより、決定することができる。前記生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)の投与前後で比較された分子流速の相違から、その生体異物(又は生体異物の組み合わせ若しくは生体異物の混合物)の毒性作用が同定される。
【0052】
更に、本明細書で開示されている方法は、1又は複数の治療標的を同定するために使用してもよい。2以上の生体分子の分子流速を、1又は複数の組織又は個体からなる第1の集団で測定及び比較する。薬剤又は薬剤候補又は薬剤リード又は新しい化学物質又は生物学的因子又は既承認薬(又はそのいかなる組み合わせ若しくは混合物)を1又は複数の組織又は個体からなる第2の集団に対して投与し、第2の集団の前記2以上の生体分子の相対分子流速を第1の集団と比較する。第1の集団及び第2の集団間で比較された分子流速の相違から、治療標的が同定される。
【0053】
或いは、本明細書で開示されている方法は、1又は複数の組織又は個体からなる第1の集団で2以上の生体分子を測定及び比較し、その集団に対して薬剤又は薬剤候補又は薬剤リード又は新しい化学物質又は既承認薬又は生物学的因子(又はその組み合わせ若しくは混合物)を投与し、その薬剤又は薬剤候補又は薬剤リードの投与前後の前記2以上の生体分子の相対分子流速を測定及び比較することにより、1又は複数の治療標的を同定するために使用することができる。投与の前後で比較された分子流速の相違から、薬剤の標的が同定される。
【0054】
本明細書で開示されている全ての方法は、ハイスループット方法に容易に適応させることができる。複数の疾患及び障害、治療化合物(そのいかなる組み合わせ若しくは混合物を含め、薬剤、薬剤候補、薬剤リード、新しい化学物質、既承認薬又は生物学的因子)、生体異物並びに治療標的をスクリーニングすることができる。
【0055】
本発明は、2以上の生体分子の相対分子流速を分析、測定及び/又は比較するためのキットも含む。一態様では、キットは、アイソトープ標識水、及び組織又は個体にアイソトープ標識水を投与するための1又は複数の手段を含む。他の態様において、キットは、生体試料から生体分子を分離、部分精製、又は単離するための化学化合物又は試薬を含む。キットは、個体から試料を採取するための機器を含んでもよい。
【0056】
本発明は、1又は複数の安定アイソトープを含む、アイソトープで不安定化された分子も含む。アイソトープで不安定化された分子は、本明細書で記載されている標識方法の生成物である。アイソトープで不安定化された分子は、当技術分野で公知の試料採取法によって採取し、適当な分析手段を使用して分析する。
【0057】
本発明は、1又は複数のアイソトープで標識された、アイソトープで不安定化された分子も提供する。
【0058】
本発明は、本発明の方法によって同定され、かつ少なくとも部分的に特性決定された1又は複数の治療薬も提供する。
【0059】
図面の簡単な説明
図1 図1A〜Bは、アイソトープ標識水から選択された遊離アミノ酸への標識水素交換の経路を表す図である。2つのNEAA(アラニン、グリシン)及びEAA(ロイシン)を例に示す。アラニン及びグリシンは、図2Aで示す。ロイシンは図2Bで示す。略語:TA、トランスアミナーゼ;PEP−CK、ホスホエノールピルビン酸カルボキシキナーゼ;TCAC、TCA回路;STHM、セリンテトラヒドロ葉酸メチル転移酵素。
【0060】
図1Cは、タンパク質合成のためのH218Oによる遊離アミノ酸の18O標識を表す図である。
【0061】
図2は、水からDNAのデオキシリボース(dR)への水素アイソトープ(この場合重水素)の取り込みを表す図である。
【0062】
図3は、10〜12週間、毎日50〜100mLの2H2Oを摂取した代表的なヒト被験者の体内水分中の2H2Oの濃縮を表す図である。データは、各被験者で体内水分の前駆体プールが数週間にわたって安定していることを示す。
【0063】
図4は、(a)体重の安定した雌ラットの心筋及び後肢筋におけるmtDNAと核DNAの合成の比較(平均±S.D.);f、部分置換、並びに(b)左、ラット後肢筋におけるミトコンドリア(mt)リン脂質の合成及び運動訓練(随意車輪運動)の影響を表す図である。動物には、2H2Oを8日間投与した。CL、カルジオリピン;PC、フォスファチジルコリン;PE、フォスファチジルエタノールアミン;P<0.05対対照ラット。右、(a)からのラットにおけるmtDNAとCLの合成の相関関係。
【0064】
図5は、対照マウス(n=7)及びob/obマウス(n=4)の4つの異なる脂肪貯蔵(子宮外膜、鼠径部、腸間膜、及び後腹膜)から単離された成熟脂肪細胞濃縮分画における細胞増殖速度の同時測定を表す図である。動物には、飲料水中4%2H2Oを21日間投与した。対照の体重は、2H2Oの投与開始時で18.5±0.2g(平均±S.E.)、終了時には20.8±0.4gであった。ob/obの体重は、それぞれ26.3±0.6g、35.7±0.9gであった。
【0065】
図6は、ob/obマウス及び対照において、TG及びパルミチン酸合成(新規の脂質生成又はDNLのマーカー)のための2つの異なる脂肪貯蔵(鼠径及び腸間膜)、並びに脂肪細胞増殖のための4つの異なる区画(子宮外膜、鼠径、腸間膜及び後腹膜)において同時に測定された、脂肪代謝成分の動態を表す図である。パネルa)は、トリグリセリド合成の影響を示す。パネルb)は、新規の脂質生成を示す。パネルc)は、脂肪細胞増殖を示す。食制限(ペアフィード)及びレプチン投与の影響は、このように比較される。
【0066】
図7は、2種の異なるマウスで同時に測定された、及び図8で示す両方のマウス種でのケラチン生成細胞DNA合成と同時に測定された、ケラチンにおけるアラニンのEM1濃縮によって示される、正常マウス(C57bl/6マウス)及び薄片状皮膚マウス(FSM又は「薄片状皮膚マウス」、乾癬のマウスモデル)における皮膚ケラチン代謝回転を表す図である。図7が示すように、ケラチン代謝回転は、正常マウスのケラチン代謝回転(右の緩い曲線)よりも乾癬マウスモデルの方が相当迅速である(左の急勾配曲線)。
【0067】
図8は、正常マウス(C57bl/6マウス)及び薄片状皮膚マウスにおけるケラチン生成細胞代謝回転(新規のDNA合成)を表す図である(f%=DNAの部分合成)。ケラチン生成細胞代謝回転は両方のマウス種で同時に、また、両方のマウス種における皮膚ケラチン代謝回転と共に測定された(皮膚ケラチン代謝回転は図7で示す)。
【0068】
図9は、雄balb/C nu/nuマウスにおける次第に高くした用量のゲムザー(Gemzar)(ゲムシタビン)を投与した後の腫瘍細胞、結腸細胞及び骨髄細胞の細胞増殖の同時測定を表す図である。図9が示すように、次第に高くした用量のGemは腫瘍及び骨髄細胞の増殖を抑制するが、結腸細胞の増殖に対する影響は比較的小さい(Gemは、実験的な低用量では結腸細胞の増殖に対して刺激効果を有する可能性がある)。
【0069】
図10は、対照動物と比較した、雌balb/C nu/nuマウスにおけるGem及びヒドロキシ尿素(HU)による腫瘍及び骨髄細胞の細胞増殖のin vivo抑制を表す図である。ヒドロキシ尿素は公知のDNA合成阻害剤であり、広く処方される化学療法剤である。図10が示すように、Gem及びHUの両者は、生理食塩水を投与した対照マウスと比較して骨髄細胞及び腫瘍細胞の細胞増殖を減少させた。
【0070】
図11は、ビヒクル対照と比較した微小管分解阻害剤であるパクリタキセルの次第に高くした用量による、ヌード・マウスの3種類の細胞に対する細胞増殖のin vivo抑制を表す図である。パネルa)は移植されたSW1573ヒト肺癌細胞を表し、パネルb)はマウス骨髄細胞を表し、パネルc)はマウス結腸細胞(結腸細胞)を表す。3種類全ての細胞は、並行して測定された。図11が示すように、腫瘍細胞及び結腸細胞の増殖はパクリタキセルによって用量依存的に抑制されたが、骨髄細胞増殖はそうではなかった。
【0071】
図12は、雌Sprague Dawleyラットのミトコンドリア赤腓腹筋における、カルジオリピン及びmtDNAの部分合成を表す図である。カルジオリピン及びmtDNAは、同時に測定された。Ex=運動。4週間運動したマウスと同じ期間運動を行わなかったマウスにおいて変化は観察されなかったが、ミトコンドリア生合成のバイオマーカーとしてカルジオリピンはmtDNAと同等であることが明らかになった。
【0072】
図13は、雌Sprague Dawleyラットの心臓のミトコンドリアにおけるカルジオリピン及びホスファチジルコリンの部分合成を示す。カルジオリピン及びホスファチジルコリンは同時に測定した。Ex=運動。4週間運動したマウスと同じ期間運動を行わなかったマウスにおいて変化は観察されなかったが、ホスファチジルコリンはミトコンドリア生合成のバイオマーカーとしてカルジオリピンと同等であることが示された。
【0073】
図14は、腫瘍内皮細胞増殖、肝臓内皮細胞増殖、腫瘍細胞増殖、及び総肝臓細胞増殖を示す。測定は同時に行った。詳細については上記の実施例15を参照のこと。
【0074】
図15は、2つの用量の四塩化炭素(CCl4)及びビヒクル対照に応答したC57B/6総肝臓細胞増殖を示す。図15は、ビヒクル対照と比較してCCl4の両方の用量が総肝臓細胞増殖を増大させたことを示す。総肝臓細胞増殖は、以下の図16に示す肝臓コラーゲン合成と同時に測定した。
【0075】
図16は、2つの用量のCCl4投与及びビヒクル対照に応答したC57B/6肝臓コラーゲン合成を示す。測定は、上記の図15に示す総肝臓細胞増殖と同時に実施した。図16は、高用量のCCl4のみが肝臓コラーゲン合成を増大し、低用量のCCl4は総肝臓細胞増殖を増大させるが、ビヒクル対照と比較して肝臓コラーゲン合成には影響を及ぼさなかった。
【0076】
図17は、グリセオフルビン投与(0.1、0.2、及び0.5%を5日)後のC57BL/6マウス肝臓細胞増殖を示す(全ての群についてp<0.05)。図17は、対照と比較して用量依存的に肝臓細胞増殖が増大したことを示している。最低用量のグリセオフルビンは肝臓細胞増殖に対して観察可能な作用を及ぼした。肝臓コラーゲン合成を肝臓細胞増殖と同時に測定した。CCl4(上記の図16)とは異なり、グリセオフルビンは試験した用量において肝臓コラーゲン合成に対して影響を及ぼさなかった(データは示さない)。
【発明を実施するための最良の形態】
【0077】
本出願人は、単一プロトコールによって、種々の生体分子、特には多様な生化学クラスに属する生体分子の相対分子流速を測定する方法を発見した。最初に、アイソトープ標識した水、すなわちユニバーサルな前駆体を、組織又は個体に投与する。2又はそれ以上の生体分子の分子流速が、その分子が異なる化学クラスのものであっても、同時にかつ単一プロトコールにより測定することができる。
【0078】
I.一般的な手法
本発明の実施は、他に断りがない限り、従来の手法、すなわち、分子生物学(組換え手法を含む)、微生物学、細胞生物学、生化学、および免疫学の手法を用いるが、これらは当技術分野の技能の範囲内である。そのような手法は、Molecular Cloning: A Laboratory Manual、第2版 (Sambrookら、1989年)、Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait編、1984年); Methods in Molecular Biology、Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis編、1998年)、Academic Press; Animal Cell Culture (R.I. Freshney編、1987年); Introduction to Cell and Tissue Culture ( J.P. Mather及びP.E. Roberts、1998年)、Plenum Press;Cell and Tissue Culture: Laboratory Procedures (A. Doyle、J.B. GriffithsおよびD.G. Newell編、1993〜8年)、J. Wiley and Sons;Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell編); Gene Transfer Vectors for Mammalian Cells (J.M. Miller及びM.P. Calos編、1987年); Current Protocols in Molecular Biology (F.M. Ausubelら編、1987年); PCR: The Polymerase Chain Reaction、(Mullisら編、1994年); Current Protocols in Immunology (J.E. Coliganら編、1991年); Short Protocols in Molecular Biology (Wiley and Sons、1999年);およびMass isotopomer distribution analysis at eight years: theoretical, analytic and experimental considerations by Hellerstein and Neese (Am J Physiol 276 (Endocrinol Metab. 39) E1146〜E1162、1999年)などの文献に詳しく説明されている。さらに、他に断りのない限り、市販のアッセイキットおよび試薬を用いた手順は、一般的に製造者規定のプロトコルにしたがって使用する。
【0079】
II.定義
他に定義しない限り、本明細書に使用されている全ての技術用語、表記法および他の科学的用語法は、この発明が関連する分野の技能を有する者が通常に理解する意味を持つことを意図している。ある場合には、通常に理解されている意味を持つ用語が、明確性のためおよび/または容易な参照のためにここで定義されるが、そのような定義を本明細書に含めることは、当分野において一般に理解されていることとの実質的な差異を表していると必ずしも理解されべきものではない。ここで説明または参照される手法や手順は、一般的によく理解されており、従来の方法論で当業者によって通常に用いられている。例えば、Hellerstein及びNeeseによるMass isotopomer distribution analysis at eight years: theoretical, analytic and experimental considerations (Am J Physiol 276 (Endocrinol Metab. 39) E1146〜E1162頁、1999年)である。必要に応じて、市販のキットおよび試薬の使用を伴う手順は、他に断らない限り、一般に製造者規定のプロトコルおよび/またはパラメータにしたがって実行される。
【0080】
「分子流速」は、生体分子の合成または産生および分解または除去の速度を指す。「分子流」は従って、分子のプールに出入りする流れと同義である。
【0081】
「アイソトポマー」は、例えばCH3NH2、CH3NHDおよびCH2DNH2のように、同一の元素組成を有するが、アイソトープの置換のために構成的および/または立体化学的に異性体であるアイソトープ異性体または種を指す。
【0082】
「アイソトポローグ」は、同一の元素および化学組成を有するが、アイソトープ含量において異なるアイソトープの同族体または分子種(例えば、上記例においてはCH3NH2とCH3NHD)を指す。アイソトポローグは、それらのアイソトープ組成によって定義され、従って各アイソトポローグは、単一の厳密な質量を有するが、単一の構造は有していない可能性がある。1つのアイソトポローグは、普通は、分子上のアイソトープの位置が異なるアイソトープ異性体(アイソトポマー)のファミリーを構成する(例えば、CH3NHDとCH2DNH2は同じアイソトポローグであるが、異なるアイソトポマーである)。
【0083】
「質量アイソトポマー」は、アイソトープ組成よりもむしろ名目上の質量に基づいて分類したアイソトープ異性体のファミリーを指す。質量アイソトポマーは、アイソトポローグと違って、異なるアイソトープ組成の分子を含むこともある(例えば、CH3NHD、13CH3NH2、CH315NH2は、同じ質量アイソトポマーのものであるが、異なるアイソトポローグである)。実際上の意味では、質量アイソトポマーは、質量分析計では分析できないアイソトポローグのファミリーである。このことは、四極子質量分析計にとっては、質量アイソトポマーが、ある1つの名目上の質量を共有するアイソトポローグのファミリーであることを意味する。すなわち、アイソトポローグであるCH3NH2とCH3NHDは、名目上の質量において異なり、異なる質量アイソトポマーとして識別されるが、アイソトポローグであるCH3NHD、CH2DNH2、13CH3NH2およびCH315NH2は、全て同じ名目上の質量のものであり、それ故に同じ質量アイソトポマーである。各質量アイソトポマーは、従って、典型的には二つ以上のアイソトポローグからなり、二つ以上の厳密な質量を有する。全ての個々のアイソトポローグは、四極子質量分析計を使って分析できず、そして、より高い質量分析能を有する質量分析計を使っても分析できないため、質量分析データからの計算は、アイソトポローグよりもむしろ質量アイソトポマーの存在度に対して行う必要がある。したがって、アイソトポローグと質量アイソトポマーとの区別は実際の場では有用である。質量が最低の質量アイソトポマーをM0として表し、これは、大半の有機分子では、12C、1H、10O、14Nなどを全て含有する種である。他の質量アイソトポマーは、それらの質量によりM0から識別される(M1、M2など)。所定の質量アイソトポマーにおいて、その分子内でのアイソトープの場所または位置は、特定されておらず、多様でありうる(すなわち、「位置的なアイソトポマー」は識別されない)。
【0084】
「質量アイソトポマーパターン」は、分子の質量アイソトポマーの存在度のヒストグラムを指す。典型的には、このパターンは、全ての存在度を最も多量の質量アイソトポマーの存在度に対して正規化した相対存在度百分率として表され、最も多量のアイソトポマーは100%である。しかしながら、確率分析を伴う本出願の好ましい形態が存在度比率または部分であり、すなわち、それぞれの種が全体の存在度に寄与する比率が使用される(下記を参照のこと)。アイソトープパターンという用語は、質量アイソトポマーパターンの代わりに使うこともある。ただし技術的には、前者の用語は、元素におけるアイソトープの存在度パターンにのみ適用されるものである。
【0085】
「個体」は、脊椎動物、好ましくは哺乳動物、より好ましくはヒトである。
【0086】
「生体分子」は、組織または個体中で合成される任意の1又は複数の分子を指す。生体分子は、限定されるものではないが、総細胞タンパク質のセット、ゲノムDNA、ミトコンドリアDNA、メッセンジャーRNA、またはリボソームRNAなどの分子クラスを指してもよい。あるいは、生体分子は、特定のタンパク質(例えば、アポリポタンパク質)もしくは特定のポリヌクレオチド配列(例えば、アポリポタンパク質をコードするポリヌクレオチド)などの、特定の構造的特徴または配列を有する特定の分子であってもよい。
【0087】
本明細書で用いる、「危険性のある」個体は、疾患状態または生理状態を発症する可能性が、危険性のない個体よりも高いと考えられる個体である。「危険性のある」個体は、疾患もしくは生理状態を示唆する検出可能な症候を有しても有さなくてもよく、また本明細書に開示される治療方法(例えば、治療的介入)の前に検出可能な疾患を示していてもいなくてもよい。「危険性のある」とは、個体が1つ以上のいわゆる危険因子を有するということである。1つ以上のこれらの危険因子を有する個体は、これらの危険因子を有さない個体よりも、1種以上の疾患または生理状態を発症する可能性が高い。これらの危険因子としては、限定されるものではないが、1種以上の疾患、関連する症状、もしくは病理を発症する家族員の履歴、以前の疾患の病歴、年齢、性別、人種、食事、前兆となる疾患の存在、遺伝子的(すなわち、遺伝的)考慮、および環境への曝露などが挙げられる。
【0088】
本明細書で用いる「アイソトープ標識水」には、水素又は酸素のいずれかの1以上の特定の重同位体で標識された水が含まれる。アイソトープ標識水の具体例としては、2H2O、3H2O、およびH218Oが挙げられる。
【0089】
「部分的に精製する」は、ある混合物の1または複数の成分を他の類似化合物から取り除く方法を指す。例えば、「タンパク質またはペプチドを部分的に精製する」は、1または複数の生体分子を1または複数の生体分子の混合物から取り除くことを指す。
【0090】
「単離する」は、化合物の混合物から1つの化合物を分離することを指す。例えば、「タンパク質またはペプチドを単離する」は、1つの特定のタンパク質またはペプチドを1または複数の生体分子の混合物中のほかの全ての生体分子から分離することを指す。
【0091】
「生体試料」は、組織または個体から得られる任意の試料を含む。この定義は、血液、および侵襲性が最小または非侵襲性の手法(例えば、蓄尿、採血、針吸引や、危険、不快感または困難度が最小の他の手順)による採取によって個体から入手可能な他の生体由来の液体試料を含む。この定義はまた、試料獲得後に、試薬による処理、可溶化、あるいは、タンパク質やポリヌクレオチドのような成分の濃縮のような、いかなる方法でも操作された試料も含む。「生体試料」という用語はまた、血清、血漿、他の生体液あるいは組織試料などの臨床の試料を含み、さらに培養中の細胞、細胞上清および細胞溶解を含む。
【0092】
「生体液」は、尿、血液、間質液、浮腫液、唾液、涙液、炎症性浸出物、滑液、膿瘍、蓄膿または他の感染液、脳脊髄、汗、肺分泌物(痰)、精液、糞便、胆汁、腸分泌物または他の体液を含むが、それらに限定されない。
【0093】
「化学物質」には、それが新規であっても公知であっても、研究中の可能性ある治療薬(薬剤、又は薬物候補もしくはリード薬物)の目的に対して生物学的又は生化学的活性について、あるいは解明された毒性作用(産業化学物、殺虫剤、除草剤、食品添加物、化粧品など)について、それをスクリーニングする目的で生体系に投与される、任意の分子、化学物又は化合物が含まれる。
【0094】
「リード薬物」又は「候補薬物」は、本明細書において、治療薬(薬剤)としての可能性があると評価された化学物質又は生体分子として定義される。「薬剤」又は「薬物」又は「化合物」は本明細書において互換的に用いられ、治療薬としての可能性あるものとして投与され、承認され又は試験中である、あるいは公知の治療薬である、任意の組成物(例えば、化学物質又は生物学的因子)を説明するものである。
【0095】
「公知の薬剤」又は「公知の薬物」又は「既に承認された薬剤」とは、合衆国又は他の管轄区域においてヒト又は動物において薬剤としての治療用途について承認された薬物(すなわち化学物質又は生物学的因子)を意味する。本発明において、用語「既に承認された薬剤」は、本明細書に開示の方法の用途について試験された適応症とは異なる適応症について承認を受けた薬剤を意味する。乾癬及びフルオキセチンを例として用いると、本発明の方法により、鬱病の治療についてFDAより承認を受けたフルオキセチンを、乾癬のバイオマーカー(例えば、ケラチン生成細胞増殖又はケラチン合成)に対する作用について試験することが可能となる。フルオキセチンによる乾癬の治療は、FDA又は他の管轄区域により承認されていない。このように、既に承認された薬剤(この例ではフルオキセチン)について、新たな用途(この例では抗乾癬作用)を見出すことができる。
【0096】
「生物学的因子」とは、生物学的又は生理学的活性(例えば、予防、治療及び/又は毒性作用)を有する生きた生物により生成される化合物(又は複数の化合物)を意味する。生物学的因子の例としては、限定されるものではないが、ワクチン、ポリクローナル又はモノクローナル抗体、組換えタンパク質、単離されたタンパク質、可溶性受容体、遺伝子治療産物などが挙げられる。本明細書において用いる用語「生物製剤(biologics)」は、「生物学的因子」と同義語である。
【0097】
本発明において、「化合物」とは、任意の新たな化学物質、化学物質、リード薬物、候補薬物、薬物、薬剤、治療剤、作用物質、公知の薬物、公知の薬剤、既に承認されている薬物、生物製剤、又は生物学的因子を意味する。
【0098】
「治療標的」は、疾病又は病状に関連する生理の変化を媒介する又は媒介すると考えられる生体内又は生体上の部位(例えば、1以上の代謝経路内の分子)を意味する。多くの場合、治療標的は未知であるが、以下により詳細に説明するように、本発明の方法により、1以上の化合物を組織若しくは個体又は組織若しくは個体の集団に投与し、分子流速の変化を測定することによって、1以上の治療標的が発見される。
【0099】
III.本発明の方法
本発明者は、アイソトープで標識した水が、組織及び個体において合成される本質的に全ての生体分子(特に種々の化学クラス)のユニバーサルな前駆体であることを発見した。したがって、アイソトープ標識水を組織又は個体に導入することによって、アイソトープ標識が該組織又は個体の生体分子に取込まれる。複数の生体分子の相対分子流速を測定し、比較することができる。生体分子の例を、これに限定されるものではないが、表1に例示する。測定可能な生物学的プロセスの例は表2に示す。
【0100】
従って、本出願は、個体において2又はそれ以上の生体分子の相対分子流速を測定し比較する方法に関し、a)アイソトープで標識した水を個体に投与するステップであって、該標識が、2又はそれ以上の生体分子が異なる化学クラスのものであってもその2又はそれ以上の生体分子に取込まれて2又はそれ以上のアイソトープで標識された生体分子を形成するのに十分な時間にわたって投与するステップ、b)組織又は個体から、2又はそれ以上のアイソトープで標識された生体分子を含有する1又はそれ以上の生体試料を得るステップ、c)上記2又はそれ以上の生体分子における標識の取込みを測定し、その生体分子の分子流速を決定するステップ、並びにd)上記生体分子の分子流速を比較し、相対分子流速を分析するステップ、により行う。
【0101】
A.1以上の組織又は個体へのアイソトープ標識水の投与
(1)2H、3H又は18Oアイソトープ標識水の取込みの理論
H2Oの利用能は、細胞における生合成反応におそらく限定されるものではないが(H2Oは細胞の内容物の70%近くであり、35モル濃度を超えるため)、H2Oの水素原子及び酸素原子が生合成経路に関与する多くの反応に化学量論的に寄与している:
【化1】

【0102】
結果として、H又はOアイソトープで標識された水の形態で提供されるアイソトープ標識は、合成経路の一部として生体分子中に取込まれる。水素の取込みは2つの経路において生じ、分子中の不安定な位置(すなわち、迅速に変換されるものであり、酵素触媒反応を必要としない)、又は安定な位置(すなわち、迅速には変換されず、酵素触媒を必要とする)への取込みがある。酸素の取込みは安定な位置において起こる。
【0103】
細胞中の水から生体分子中のC−H結合への水素取込みステップの中には、生合成反応順序の十分に確立された酵素触媒ステップの間においてのみ起こり、成熟最終生成分子に一度存在すれば不安定ではない(組織中の溶媒水と変換可能である)ものもある。例えば、グルコース上のC−H結合は、溶液中で変換可能ではない。対照的に、以下のC−H位置はそれぞれ特定の酵素反応の逆転過程で体内の水と変換する。クレブス回路におけるオキサロ酢酸/コハク酸連続反応及び乳酸/ピルビン酸反応におけるC−1及びC−6、グルコース−6−リン酸/フルクトース−6−リン酸反応におけるC−2、グリセルアルデヒド−3−リン酸/ジヒドロキシアセトン−リン酸反応におけるC−3及びC−4、3−ホスホグリセリン酸/グリセルアルデヒド−3−リン酸及びグルコース−6−リン酸/フルクトース−6−リン酸反応におけるC−5(Katz 1976)。
【0104】
それにより、分子の特定の不安定ではない位置に共有結合により取込まれた水からの標識水素又は酸素原子は、分子の「生合成の歴史」を明らかにする。すなわち、標識の取込みは、分子がアイソトープ標識水が細胞中の水に存在していた期間に合成されたことを表す。
【0105】
これらの生体分子中の不安定な水素(非共有結合する又は変換可能な共有結合中に存在する)は、分子の生合成の歴史を明らかにするものではない。しかしながら、不安定な水素原子は、非標識水(H2O)とのインキュベーションにより(すなわち、2H又は3Hが最初に取込まれると考えられる同じ非酵素変換反応の逆転により)容易に除去されうる:
【化2】

【0106】
結果として、生合成歴を反映しないが、合成によらない変換反応によって取込まれた、混入する可能性のある水素標識は、天然に存在するH2Oとのインキュベーションにより実際には容易に除去することができる。
【0107】
分析方法は、標識水素原子の生体分子への取込みを定量的に測定するために利用可能である(例えば、3Hについての液体シンチレーションカウンター、2H及び18Oについての質量分析法又はNMR分光法)。アイソトープ標識水の取込みの理論に関するさらなる議論については、例えばJungas 1968(参照により本明細書に組み入れる)を参照されたい。
【0108】
(2)アイソトープ標識水から生体分子へのアイソトープの取込み
アイソトープ標識水は、アイソトープ標識水の連続投与、アイソトープ標識水の不連続投与、又はアイソトープ標識水の投与の単回若しくは複数回投与により、投与することができる。アイソトープ標識水の連続投与においては、アイソトープ標識水は、一定時間にわたり個体における比較的一定の水の存在(濃縮)を維持するために十分な時間にわたって、個体に投与する。連続的方法において、標識水は、定常濃度を達成するために十分な期間(例えばヒトにおいて3〜8週間、げっ歯類において1〜2週間)にわたり投与することが最適である。
【0109】
アイソトープ標識水の不連続投与においては、ある量のアイソトープ標識水を測定して、その後1回以上投与し、続いてアイソトープ標識水への暴露を中断し、体内の水プールからアイソトープ標識水が洗い出されるようにする。その後、脱標識の時間経過をモニターしうる。水は、生体分子におけるレベルが検出可能となるように十分な期間にわたって投与することが最適である。
【0110】
アイソトープ標識水は、当技術分野で公知の種々の方法で個体又は組織に投与することができる。例えば、アイソトープ標識水は、経口、非経口、皮下、血管内(例えば動脈内若しくは静脈内)、又は腹腔内に投与する。2H2O及びH218Oの市販供与源がいくつかあり、例えばIsotec, Inc.(Miamisburg OH)及びCambridge Isotopes, Inc.(Andover, MA)がある。投与するアイソトープ標識水のアイソトープ含量は、約0.001%〜約20%の範囲とすることができ、これは生体分子のアイソトープ含量を測定するために用いられる機器の分析感度に応じて異なる。経口投与の場合、飲料水中4%2H2Oを投与する。ヒトの投与については、50mLの2H2Oを投与する。
【0111】
生体分子
アイソトープ標識水からのアイソトープ標識は、組織又は個体において合成される実質的に全ての生体分子に取り込まれる。生体分子の例としては、限定されるものではないが、タンパク質(特定のタンパク質、総細胞タンパク質、アポリポタンパク質、免疫グロブリン、コラーゲン、エラスチン及びケラチンなど)、ポリヌクレオチド(特定のDNA又はRNA配列、総細胞DNA、ゲノムDNA、ミトコンドリアDNA、総細胞RNA、メッセンジャーRNA、リボソームRNA、トランスファーRNAなど)、脂質及び脂質合成成分(例えばコレステロール、コレステロールエステル、トリグリセリド、脂肪酸及びアシルグリセリドなど)、糖質、グリコサミノグリカン、プロテオグリカン、及びこれらの組み合わせ又はポリマーが挙げられる。生体分子は、組織若しくは個体のもの、又は組織若しくは個体内に含まれる生物のものでありうる。生体分子の一部の非限定的な例示を表1に示す。
【表1】


【表2】


【0112】
生体分子としてのタンパク質
一実施形態において、アイソトープ標識水からのアイソトープ標識をタンパク質に取込むことができる。ペプチドおよびタンパク質のO−H結合及びN−H結合は水溶液中では不安定であるので、C−H結合上の水素原子が2H2O由来のタンパク質合成を測定するために有用なアミノ酸上の水素原子となる。2H2O由来の2H標識のO−H結合またはN−H結合への交換は、上述のように遊離アミノ酸からのタンパク質の合成なしに起こる。C−H結合は、特異的な酵素触媒による中間代謝反応の間にH2Oから遊離アミノ酸への取り込みを受ける(図1)。したがって、2H2O投与後のタンパク質結合アミノ酸のC−H結合における2H標識の存在は、タンパク質が2H2O暴露の期間中に遊離型であったアミノ酸から組み立てられたこと、すなわち、タンパク質が新たに合成されたことを意味する。分析的には、使用されたアミノ酸誘導体はC−H結合をすべて含まなくてはならないが、すべての混入の可能性があるN−H結合およびO−H結合を除去しなくてはならない。
【0113】
体内水分由来の水素原子は遊離アミノ酸に取り込まれうる。アイソトープ標識水由来の2Hまたは3Hは、中間代謝反応を介して細胞内の遊離アミノ酸に入ることができるが、2Hまたは3Hは、ペプチド結合中に存在するまたはトランスファーRNAに結合されたアミノ酸に入ることはできない。遊離の必須アミノ酸は体内水分由来の1個の水素原子をα炭素のC−H結合に、急速な可逆的アミノ基転移反応を介して、取り込みうる(図1)。もちろん、遊離の非必須アミノ酸はより多数の代謝的に交換可能なC−H結合を含み、したがって、新たに合成されたタンパク質中に、1分子あたりより高い2H2O由来のアイソトープ濃縮値を示すことが期待される(図1A〜B)。
【0114】
当業者は、体内水分由来の標識された水素原子が他の生化学的経路によって他のアミノ酸内に取り込まれうることを認識するであろう。例えば、水由来の水素原子がクエン酸回路において前駆体α−ケトグルタル酸の合成を経てグルタミン酸に取り込まれることは当技術分野において公知である。グルタミン酸は、順に、グルタミン、プロリン、およびアルギニンの生化学的前駆体になることが知られている。別の例として、体内水分由来の水素原子は3−メチルヒスチジンのメチル基、ヒドロキシプロリンまたはヒドロキシリジンのヒドロキシル基などのような翻訳後修飾されたアミノ酸に取り込まれる可能性がある。他のアミノ酸合成経路も当業者には公知である。
【0115】
また、酸素原子(H218O)も酵素触媒反応を介してアミノ酸に取り込まれうる。例えば、酵素触媒反応の際にアミノ酸のカルボン酸部分への酸素交換が起こりうる。標識した酸素のアミノ酸への取り込みは、図1Cに示すように当業者に公知である。また酸素原子は酵素触媒反応を介して18O2からアミノ酸(ヒドロキシプロリン、ヒドロキシリジン、または他の翻訳後修飾アミノ酸を含む)に取り込まれる可能性がある。
【0116】
アイソトープ標識水に由来する水素および酸素の標識はまた、翻訳後修飾を介してアミノ酸に取り込まれうる。一つの実施形態では、翻訳後修飾は翻訳後修飾に先立つ生合成経路により標識された水素または酸素をすでに含むことができる。別の実施形態では、翻訳後修飾は翻訳後修飾ステップ(例えば、メチル化、水酸化、リン酸化、プレニル化、硫酸化、カルボキシル化、アセチル化または他の公知の翻訳後修飾)の前または後のいずれかに、体内水分由来の遊離の交換標識水素に関わる代謝誘導体からの標識された水素、酸素、炭素、または窒素を取り込むことができる。
【0117】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するようなアミノ酸、ペプチド及びタンパク質に取込むことが可能である。表1に挙げられたアミノ酸、ペプチド及びタンパク質は例示にすぎず、任意のアミノ酸、ペプチド又はタンパク質にアイソトープ標識を取込むことができる。
【0118】
生体分子としてのポリヌクレオチド
アイソトープ標識水からのアイソトープ標識はまた、ポリヌクレオチドに取込むことが可能である(例えば図2参照)。ポリヌクレオチドとしては、限定されるものではないが、デオキシリボ核酸(DNA)及びリボ核酸(RNA)、例えばメッセンジャーRNA(mRNA)、リボソームRNA(rRNA)、トランスファーRNA(tRNA)及びウイルスRNAがある。ポリヌクレオチドは、任意の供与源、例えばゲノムDNA、ミトコンドリアDNA及び組織RNAなどに由来するものであってよい。ゲノムDNA及び核DNAは本明細書において互換的に用いられる。
【0119】
ポリヌクレオチド、ポリヌクレオシド、およびヌクレオチドまたはヌクレオシド前駆体のC−H結合上の水素原子は、アイソトープ標識水からのポリヌクレオチド合成を測定するために用いることができる。C−H結合はH2Oからポリヌクレオチド前駆体への交換を受ける。したがって、アイソトープ標識水投与後のポリヌクレオチド、ヌクレオシド、およびヌクレオチドまたはヌクレオシド前駆体のC−H結合における2H標識の存在は、ポリヌクレオチドがこの期間中に合成されたことを意味する。存在する標識の程度は実験的に測定することができ、また、ポリヌクレオチドもしくはヌクレオシドの標識化部位の数に基づいて推定することもできる。
【0120】
体内水分由来の水素原子は遊離のヌクレオシドまたはポリヌクレオチド中に取り込まれうる。アイソトープ標識水由来の2Hまたは3Hは中間代謝反応を介してこれらの分子に入ることができる。
【0121】
当業者は、体内水分由来の標識された水素原子が様々な生化学的経路によって他のポリヌクレオチド、ヌクレオチド、またはヌクレオシド内に取り込まれうることを認識するであろう。例えばグリシン、アスパラギン酸、グルタミン、およびテトラヒドロ葉酸はプリン環の公知の前駆体分子である。例えばカルバミルリン酸およびアスパラギン酸はピリミジン環の公知の前駆体分子である。リボースおよびリボースリン酸、ならびにそれらの合成経路はポリヌクレオチド合成の公知の前駆体である。
【0122】
また、酸素原子(H218O)も、上記に挙げられたものを含む酵素触媒による生化学反応を介してポリヌクレオチド、ヌクレオチド、またはヌクレオシドに取り込まれうる。また18O2(18H2)由来の酸素原子は、非酵素的な酸化反応を含む酸化反応(8−オキソグアニンおよび酸化型塩基または酸化型ヌクレオチドの形成のような酸化的傷害を含む)によってヌクレオチドに取り込まれうる。
【0123】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するような核酸又はその成分に取込むことが可能である。表1に挙げられた核酸及び核酸成分は例示にすぎず、任意の核酸又は核酸成分にアイソトープ標識を取込むことができる。
【0124】
生体分子としての脂質及び脂質成分
アイソトープ標識水からのアイソトープ標識はまた、当技術分野で公知の生化学経路により、脂肪酸、アシル−グリセロールのグリセロール部分(例えば限定されるものではないが、トリアシルグリセリド、リン脂質、及びカルジオリピン)、コレステロール及びその誘導体(例えば限定されるものではないが、コレステロール−エステル、胆汁酸、ステロイドホルモン)に取込むことが可能である。
【0125】
セレブロシド(N−アセチルガラクトサミン、N−アセチルグルコサミン硫酸、グルクロン酸、およびグルクロン酸硫酸を含むがそれに限定されない)の糖部分に対する前駆体である、糖脂質およびセレブロシドなどの複合脂質もまた、アイソトープ標識水から標識され得る。
【0126】
アイソトープ標識水からのアイソトープはまたグリコサミノグリカンおよびプロテオグリカンに取込むことも可能である。例えば、アイソトープ標識水からのアイソトープは、N−アセチルグルコサミン、N−アセチルガラクトサミン、グルクロン酸の糖部分、N−アセチルグルコサミン及びN−アセチルガラクトサミン、ガラクトース、イズロン酸などの種々の硫酸に取込むことができる。
【0127】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するような脂質又は脂質誘導体に取込むことが可能である。表1に挙げられた脂質及び脂質誘導体は例示にすぎず、任意の脂質又は脂質誘導体にアイソトープ標識を取込むことができる。
【0128】
生体分子としての糖質及び糖質誘導体
表1に挙げられる脂質及び脂質誘導体は例示にすぎず、アイソトープ標識は任意の脂質又は脂質誘導体にアイソトープ標識を取込むことができる。
【0129】
アイソトープ標識水からのアイソトープ標識は、糖質及び糖質誘導体に取込むことが可能である。これらには、当技術分野で公知の生化学経路による、単糖類(グルコース及びガラクトースが含まれるが限定されるものではない)、アミノ糖(N−アセチル−ガラクトサミンなど)、多糖類(グリコーゲンなど)、糖タンパク質(シアル酸など)、糖脂質(ガラクトセレブロシドなど)、グリコサミノグリカン(ヒアルロン酸、コンドロイチン−硫酸、及びヘパラン−硫酸など)が挙げられる。
【0130】
アイソトープ標識水からの水素及び酸素標識は、表1に列挙するような糖質又は糖質誘導体に取込むことが可能である。表1に挙げられた糖質又は糖質誘導体は例示にすぎず、任意の糖質又は糖質誘導体にアイソトープ標識を取込むことができる。
【0131】
上記は例示目的である。アイソトープ標識は他の任意の公知の生体分子に取込むことが可能である。
【0132】
B.1以上の組織又は個体からの1以上の生体試料の取得
1以上の生体試料は、組織又は個体から得られる。1以上の生体試料は、例えば採血、採尿、生検、または当技術分野において公知の他の方法によって取得できる。1以上の生体試料は1以上の生体液でありうる。生体試料はまた、筋肉、肝臓、副腎組織、前立腺組織、子宮内膜組織、血液、皮膚、および乳房組織のような特定の器管または組織から取得してもよい。生体試料は、腫瘍細胞または線維芽細胞のような特定の細胞の群から取得しうる。1以上の生体試料は、死前に又は死後に取得しうる。生体分子は、当技術分野において公知の標準的な生化学的方法を用いて生体試料から取得し、場合により、部分精製または単離を行ってもよい。
【0133】
1又はそれ以上の生体試料は一緒に、2又はそれ以上の生体分子を含む。例えば、全ての生体分子が1つの生体試料から得てもよい。あるいは、1つの生体分子が第1の生体試料から得られ、別の生体分子が第2の生体試料から得てもよい。2又はそれ以上の生体分子は、各生体試料から得てもよい。
【0134】
好ましい実施形態において、生体分子は、異なる化学クラスのものであってもよい。例えば、第1の生体分子は、組織又は個体の細胞タンパク質の混合物であり、第2の生体分子は組織又は個体のゲノムDNAでありうる。2又はそれ以上の生体分子はまた、種々の化学クラス内の特定の分子であってもよい。別の例として、第1の生体分子は特定のアミノ酸配列を有する特定のタンパク質であり、第2の生体分子は特定の核酸配列を有するポリヌクレオチドでありうる。
【0135】
生体試料採取の頻度は様々な要因によって変化し得る。このような要因としては、限定するものではないが、生体分子の性質、サンプル採取の容易性および安全性、生体分子又はその起源となる生体分子の分子流速、ならびに治療薬又は生物学的薬剤の半減期が含まれる。
【0136】
また生体分子は、高圧液体クロマトグラフィー(HPLC)、高速液体クロマトグラフィー(FPLC)、化学的抽出、薄層クロマトグラフィー、ガスクロマトグラフィー、ゲル電気泳動、および/または当業者に公知の他の分離法を含む従来の精製法によって部分精製することができ、場合により単離することもできる。
【0137】
別の実施形態では、生体分子は加水分解または別の方法で分解して、より小さい分子を形成させてもよい。加水分解法は、化学的加水分解(酸加水分解など)および生化学的加水分解(ペプチダーゼ、リパーゼ又はヌクレアーゼ分解など)を含むがそれらに限定されない、当技術分野において公知の任意の方法を含む。加水分解または分解は生体分子の精製および/もしくは単離の前後いずれかに行うことができる。また生体分子は、高圧液体クロマトグラフィー(HPLC)、高速液体クロマトグラフィー(FPLC)、ガスクロマトグラフィー、ゲル電気泳動、および/または当業者に公知の他の任意の化学的および/または生化学的化合物の分離法を含む従来の精製法によって部分精製することができ、場合により単離することもできる。
【0138】
C.2以上の生体分子におけるアイソトープ標識の取込みの検出
生体分子のアイソトープ濃縮は、ガスクロマトグラフフィー/質量分析(GC−MS)、アイソトープ比質量分析、GC−アイソトープ比−燃焼−MS、GC−アイソトープ比−熱分解−MS、液体クロマトグラフ−MS、エレクトロスプレーイオン化−MS、マトリックス支援レーザー脱離イオン化飛行時間型−MS、フーリエ変換イオンサイクロトロン共鳴−MS、サイクロイド−MS、核磁気共鳴(NMR)又は液体シンチレーションカウンターを含むがそれらに限定されない、質量分析などの様々な方法によって測定することができる。
【0139】
アイソトープ標識の生体分子への取込みは直接測定することができる。あるいは、アイソトープ標識の取込みは、生体分子の1以上の代謝誘導体、加水分解産物又は分解産物へのアイソトープ標識の取込みを測定することにより決定してもよい。加水分解産物又は分解産物は、場合により、公知の任意の分離方法により部分精製又は単離した後に測定してもよい。安定なアイソトープ標識物質は、1又はそれ以上の目的の代謝経路を含む生体分子に取り込まれる。このように、分子流速は、特定の時間間隔で、例えば質量分析計(上述)により標的分子中のアイソトープ含量及び/若しくはパターン、又はアイソトープ含量及び/若しくはパターンの変化の速度を測定し、当技術分野で公知の分析及び計算方法を用いて、目的の1又はそれ以上の代謝経路内の分子流速を決定することにより、決定することができる。
【0140】
生体分子中のアイソトープ標識は同時に検出することができる。例えば、質量分析計を用いて、種々の生体分子を物理的に分離、精製又は単離する必要なく、生体分子及び/又はその成分のイオンを同時に検出することができる。
【0141】
質量分析
質量分析計は生体分子及び/又はその成分を高速移動する気体イオンに変換し、質量対電荷比に基づいてそれらを分離するものである。したがって、イオンもしくはイオンフラグメントのアイソトープまたはアイソトポログの分布を用いて、2以上の生体分子のアイソトープ濃縮を測定することができる。
【0142】
一般に、質量分析計はイオン化手段および質量分析器を含む。多数の異なるタイプの質量分析器が当技術分野において知られている。これらには、磁場型分析器、静電分析器、四重極、イオントラップ、飛行時間型質量分析器、およびフーリエ変換分析器が含まれるが、それらに限定されない。さらに、1以上の質量分析器を連結(MS/MS)して、最初に前駆体イオンを分離し、続いて気相フラグメントイオンを分離して測定してもよい。
【0143】
また質量分析計は多数の異なるイオン化方法を含む。これらには、電子衝撃、化学イオン化、電界イオン化などの気相イオン化源、ならびに、電界脱離、高速原子衝撃、マトリックス支援レーザー脱離/イオン化、および表面増強レーザー脱離イオン化などの脱離源が含まれるが、それらに限定されない。
【0144】
さらに、質量分析計は、ガスクロマトグラフィー(GC)および高速液体クロマトグラフィー(HPLC)などの分離法と連結してもよい。ガスクロマトグラフフィー/質量分析(GC/MS)では、ガスクロマトグラフからのキャピラリーカラムが、場合によりジェットセパレーターを用いて、質量分析計と直接連結される。このような応用例では、ガスクロマトグラフィー(GC)カラムがサンプル気体混合物からサンプル成分を分離し、分離した成分を質量分析計でイオン化して化学的に分析する。
【0145】
GC/MS(または、小さい無機気体よりもむしろ有機分子のイオンを分析する他の質量分析計)を使用して有機分子の質量アイソトポマー存在度を測定する場合、アイソトープ標識水からの水素標識アイソトープの取り込みは、in vivoでアイソトープ標識水から有機分子に取り込まれた水素原子の数に応じて、3〜7倍に増幅される。
【0146】
液体シンチレーションカウンター
放射性アイソトープは、液体シンチレーションカウンターを用いて観察することができる。3Hなどの放射性アイソトープは、液体シンチレーション検出器により検出される放射線を発する。検出器は、放射線を電気シグナルに変換し、これを増幅する。これにより、生体分子中の放射性アイソトープの数が測定される。
【0147】
一実施形態において、生体試料中の放射性アイソトープ濃縮値は、液体シンチレーションにより直接測定することができる。別の実施形態において、放射性アイソトープは3Hである。
【0148】
別の実施形態において、生体分子又はその成分は、部分的に精製されているか又は場合により単離されており、その後、液体シンチレーションカウンターにより測定してもよい。
【0149】
分子流速の測定
分子流速は、コンビナトリアル分析により、手動で又はアルゴリズムによって計算しうる。質量アイソトポマー分布分析(MIDA)コンビナトリアルアルゴリズムの変形が、当業者に公知の多数の異なる出典において論じられている。具体的には、MIDA計算法は、米国特許第5,336,686号(参照により本明細書に組み入れる)の発明である。その方法はさらにHellersteinおよびNeese(1999)、ならびにChinkesら(1996)、KelleherおよびMasterson(1992)によっても論じられており、これらすべてを参照により本明細書にその全体を組み入れるものとする。
【0150】
前掲の文献に加えて、その方法を実行する計算ソフトウェアがカリフォルニア大学バークレー校のMarc Hellerstein教授から公表されて利用可能である。
【0151】
その後、前駆体−生成物の関係を当てはめることができる。連続標識法においては、アイソトープ濃縮は漸近的な(すなわち最大値の可能性の)濃縮と比較され、生体分子の動的なパラメータ(例えば生合成速度)は前駆体−生成物の式から計算される。不連続標識法においては、アイソトープ濃縮の減衰速度が計算され、生体分子の動的パラメータは指数関数的減衰式から計算される。
【0152】
生体分子の部分合成速度(ks)は連続標識用の前駆体−生成物の次式を適用することによって決定されうる:
ks=[−ln(1−f)]/t
〔式中、
f=部分合成=生成物濃縮/漸近的な前駆体濃縮、および
t=研究される系において接触させる標識投与の時間である〕。
【0153】
同様に、分解速度定数(kd)は指数関数的または他の速度論的減衰曲線に基づいて計算することができる:
kd=[−lnf]/t
【0154】
D.2以上の生体分子の2以上の分子流速の比較
2以上の生体分子の分子流速を比較する。この比較により、測定対象の種々の生体分子間の動的関係の分析が可能となる。
異なる生体分子の分子流速間の関係は、単一の分子流速が提供するよりも相当多くの情報を提供する。1組織や1個体において単一生体分子の分子流速を評価することは、1生体分子の名目上の分子流速に関する情報をもたらすにすぎない。しかし、相対分子流速を比較することは、分子流速の状況を提供する。例えば、全クラスの生体分子の相対分子流速を比較することは、1つのクラスの分子(例えばタンパク質)の分子流速が、もう1つのクラスの分子(例えば脂質やDNA)の分子流速より比例的に大きいかどうかを示す。単一の分子流速を測定するのみならば、組織又は個体の状況に関連した分子流速の比例関係は失われる。同一の生化学経路において特定の生体分子の相対分子流速を比較することは、1つの生体分子の分子流速の変化が、もう1つの生体分子の分子流速の変化に関係しているかどうかの分析に用いることが可能である。
【0155】
分子流速の比較は、何よりも疾病、障害、症状、治療化合物処置、及び生物学的剤や化学薬剤の毒性に関係する生体分子の動態の測定も可能にする。2以上の生体分子の相対分子流速を比較することは、単一生体分子の分子流速の名目上の変化を測定して比較するだけでは同定不能である疾病、障害、又は症状の同定に使用可能である。同様に、治療剤や生物学的薬剤の投与を原因とする相対的分子流速の変化を評価することが可能である。
【0156】
分子流速を比較することは、当技術分野で公知の技術のいずれの比較方法によっても達成可能である。例えば、2以上の生体分子の分子流速は、比率又はグラフ上の関係として表現可能である。
【0157】
疾病の発見
比較した分子流速は、疾病、障害又は病状の進行の検出、予後診断又はモニターに使用可能である。典型的ではあるが限定するものではない、測定可能な生化学的経過及び対応する疾病の例を、表2に提供する。疾病又は障害のない組織又は個体の群と、疾病又は障害のある第2の群との間の2以上の生体分子の分子流速の比較における相違は、疾病の進行の検出、予後診断、又はモニターに使用可能である。例えば、間質性肺線維症は、間質性肺線維症のある1又は複数の組織又は個体と、間質性肺線維症のないもう1つの組織又は個体との間において、肺のコラーゲン及び肺線維芽細胞DNAとの分子流速の比較における相違を比較することによって、診断、予後診断又はモニター可能である。あるいは、組織又は個体の単一群において2以上の生体分子の分子流速を2回以上比較した差は、疾病の進行の検出、予後診断又はモニターに使用可能である。
【0158】
高脂血症もまた、アポリポタンパク質B、トリグリセリド、リン脂質又はコレステロールのうち2以上の相対分子流速を、高脂血症を示す1又は複数の組織又は個体と、高脂血症を示さない1又は複数の組織又は個体と比較することによって、診断、予後診断又はモニターが可能である。1つの変形として、トリグリセリド、リン脂質又はコレステロールに関係したアポリポタンパク質Bの分子流速の上昇は、家族性複合型高脂血症の診断、予後診断又はモニターに使用可能である。例えば、その測定は、アポリポタンパク質Bの合成のトリグリセリド合成に対する比率を比較してもよい。あるいは、単一の組織又は個体の群において、分子流速を2回以上比較した差は、高脂血症の進行の発見、予後診断又はモニターに用いることが可能である。
【0159】
また、液性免疫と異なり、細胞性免疫の低下又は機能不全の状態は、T細胞又はB細胞のDNA又はタンパク質の相対分子流速を血漿免疫グロブリン(タンパク質)と比較することによって診断、予後診断又はモニターが可能である。血漿免疫グロブリンの分子流速に関連した、T細胞又はB細胞のDNAの分子流速の低下は、試験群における細胞性免疫活性化又は細胞性免疫機能の明確な低下を示す。あるいは、単一の組織又は個体の群において分子流速を2回以上比較した差は、細胞性免疫の低下又は機能不全の状態の進行の発見、予後診断又はモニターに使用可能である。
【0160】
加えて、光老化(皮膚のしわ)は、皮膚コラーゲン及び皮膚エラスチン又は皮膚脂質の相対分子流速を比較することによって、診断、予後診断又はモニターが可能である。エラスチンや脂質の分子流速に関連した皮膚コラーゲンにおける分子流速の変化は、第2の群における光老化速度の変化を示す。例えば、コラーゲン対エラスチンの合成比率の低下は、個体又は皮膚部位における、進行中の高速度の光老化と一致する。また、単一の組織又は個体の群において、分子流速を2回以上比較した差は、進行の発見、予後診断又はモニターに使用可能である。
【0161】
治療剤(化合物)試験
治療剤(すなわち化合物)の有効性は、本明細書に記載した方法を使用して試験可能である。治療剤投与群と非投与群である対照との間の2以上の生体分子の相対分子流速の差によって、投与群の組織又は個体における治療剤の有効性を同定又は測定する。また、1つの群における治療剤投与の前後での2以上の生体分子の相対分子流速の差によって、処置群の組織又は個体に対する治療剤の有効性を同定又は測定する。
【0162】
治療剤は、周知技術のいずれの化学物質又は組成物又は生物学的因子であってよい。治療剤は、例えば、The Merck Index第13版(米国版、Whitehouse Station、ニュージャージー州、米国;全文を引用することにより本明細書の一部とする)に開示されたいずれの化学物質又は組成物であってもよく、しかしこれに限定されるものではない。上述したように治療剤は生物学的因子であってもよく、この例は、モノクローナル抗体、可溶性受容体又はワクチンである。
【0163】
1つの例として、化学療法中に化学療法剤の殺腫瘍又は腫瘍静止作用を評価する方法は、細胞タンパク質と細胞DNAとの相対分子流速を比較することによって評価することが可能である。化学療法剤を投与した試験群と非投与の対照群との間の相対分子流速の差によって、化学療法剤を必要とする組織又は個体における化学療法剤の有効性を評価する。例えば、タンパク質合成に対するDNA合成の相対速度が、化学療法剤投与後に、又は化学療法剤非投与群と比較して投与群において低下する場合には、化学療法剤には腫瘍静止作用があると結論できるであろう。また、タンパク質合成に対するDNA合成の相対速度が、化学療法剤投与後又は化学療法剤非投与群と比較して投与群において依然としてほぼ同等である場合には、化学療法剤には殺腫瘍作用があると結論できるであろう。あるいは、1又は複数の組織又は個体における化学療法剤投与前後の相対分子流速の差によって、化学療法剤の有効性を評価する。
【0164】
抗生物質の殺作用や静止作用は、化学療法剤ではなく抗生物質を投与することによって同様に評価可能である。例えば、タンパク質合成に対するDNA合成の相対速度が、該抗生物質投与後に、又は抗生物質非投与群に比較して投与群において低下する場合には、該抗生物質には該組織や該個体において該感染生物に対する静止作用があると結論できるであろう。「殺作用」は、抗生物質によって標的感染生物を死滅させることを意味する。「静止作用」は、抗生物質によって標的感染生物の生育又は複製又は増殖又は再生を阻害することを意味する。感染生物が細菌である場合には、用語「殺菌性」は、抗生物質に適用する。同様に、用語「静菌性」は、細菌の生育又は複製又は増殖又は再生を阻害する抗生物質に適用する。
【0165】
もう1つの実施形態において、消耗性疾病又は虚弱性障害のある1又は複数の組織又は個体におけるアンドロゲンの1又は複数の有益な治療作用が評価可能である。アンドロゲンを投与した群とアンドロゲンを非投与の群との間における脂肪組織のトリグリセリドの分子流速に関連した筋肉タンパク質又はDNAの分子流速の差によって、有益な治療作用を同定又は測定する。あるいは、1又は複数の組織又は個体の群でのアンドロゲン投与の前後における相対分子流速の差によって、その有効性を評価する。脂肪組織のトリグリセリドの分子流速に関連した筋肉のタンパク質やDNAの分子流速が投与後に上昇することによって、消耗性疾病又は虚弱性障害に対するアンドロゲンの有益な治療作用を同定する。消耗性疾病又は虚弱性障害に対する、成長ホルモンといった他の筋肉タンパク質同化因子の有益な治療作用は、アンドロゲンではなく成長因子の投与によって、同様に同定可能である。
【0166】
本明細書に開示した方法は、タモキシフェンやラロキシフェン等の選択的エストロゲンモジュレーター(SERM)の1又は複数の有益な治療作用の同定にも、使用可能である。例えば、乳癌の予防におけるSERMの有益な治療作用は、SERMを投与した第1の群の組織又は個体をSERM非投与の個体又は複数個体と比較して、乳腺上皮細胞DNAの乳組織タンパク質や脂質に対する相対分子流速を評価することによって、同定可能である。第1の生体分子は、乳腺上皮細胞DNAであり、第2の生体分子は、乳房中の1又は複数のエストロゲン不感受性細胞からのタンパク質やDNAでありうる。エストロゲン不感受性細胞は、例えば脂肪、線維芽細胞、間質細胞、内皮細胞又は他の非上皮細胞由来としうる。また、SERM投与前後での1又は複数の組織又は個体の群の相対分子流速の差によって、有益な治療作用を同定する。乳房の組織タンパク質又は脂質の分子流速と関連した乳腺上皮細胞DNAの分子流速の低下によって、乳癌に対するSERMの有益な予防作用を同定する。
【0167】
高齢で体調不良の患者に有酸素能力(適応度)増強のために付与される、運動療法計画又は治療剤の有益な治療作用が、筋肉組織において、薬剤を投与していない群又は1若しくは複数の個体に対して、薬剤投与した1若しくは複数の個体の群のミトコンドリアDNA又はカルジオリピンの相対分子流速をゲノムDNA又は細胞タンパク質の混合物の相対分子流速と比較することによって、同定可能である。また有益な治療作用は、1又は複数の個体群の分子流速を、同一個体又は複数個体において薬剤投与前後に比較することによって同定可能である。筋肉のゲノムDNAや細胞タンパク質混合物の分子合成速度に対する筋肉のミトコンドリア又はカルジオリピンの分子合成速度の上昇によって、適応度に対する運動療法計画や治療剤の有益な治療作用を同定する。
【0168】
そのほかに、アルツハイマー病においては、ホルモン剤や他の治療剤の有益な治療作用が髄液又は血中アミロイドβタンパク質(脳における線維化のマーカー)、及び髄液又は血中25−ヒドロキシコレステロール(脳細胞の修復と代謝回転の一般的なマーカー)との相対分子流速を、1又は複数の個体群においてホルモン剤や他の治療剤投与の前後に比較することによって同定可能である。あるいは、有益な治療作用は、ホルモン剤や他の治療剤投与後に1又は複数の個体群において、これらの相対分子流速をホルモン剤や他の治療剤非投与のアルツハイマー病患者と比較することによって同定可能である。25−ヒドロキシコレステロールの分子流速に関連してアミロイドβタンパク質の分子流速が低下することによって、アルツハイマー病に対するホルモン剤や他の治療剤の有益な治療作用を同定する。
【0169】
本発明は、生物学的因子の治療特性の同定方法も含む。2以上の生体分子の相対分子流速は、生体分子を投与した1又は複数の組織又は個体の1群と生体分子を非投与の1又は複数の組織又は個体の1群とにおいて評価する。相対分子流速の差によって、生物学的因子の治療特性を同定する。また、治療特性は、1又は複数の個体の1群の分子流速を同一群において生物学的因子投与の前後に比較することによって、同定可能である。治療特性は、例えば既認可薬(すなわち「古い」薬)の未発見の特性でもよい。生体試料は培養細胞でもよく、個体は実験動物又はヒトでもよい。薬剤は、周知の技術のいずれの化学化合物もしくは生体化合物又は組成物でもよい。薬剤は、例えば、The Merck Index第13版(米国版、Whitehouse Station、ニュージャージー州、米国;全てを引用することにより本明細書の一部とする)に開示されたいずれの化学化合物又は組成物であってもよく、しかしこれに限定されるものではない。本方法は、ハイスループット方法での複数の薬剤のスクリーニングに使用可能である。
【0170】
生物学的因子を含む薬剤の毒性作用も、本発明の方法によって同定可能である。
【0171】
スクリーニング機能に使用した多重同時測定
アイソトープ標識水の使用によって、幅広い測定が可能なため、薬剤の予期せぬ作用もしくは未知の作用又は一般的タンパク質標的に対するスクリーニングが可能である。例えば、コレステロール合成に関連した、脳のミエリンもしくはβ−アミロイドの合成又は骨のコラーゲン動態に対するスタチン類(3−ヒドロキシ−3−メチルグルタリルCoA還元酵素阻害剤)の効果、脂肪のトリグリセリド合成又は肝臓のグルコース合成の速度に関連した結腸、膵臓又は他の細胞の増殖速度に対するグリタゾン類(例えばチアゾリジンジオン)の効果、脂肪組織のトリグリセリド又はゲノムDNAの合成に関連した筋肉のミトコンドリアDNA又はカルジオリピンの合成に対する抗レトロウイルス剤(逆転写酵素阻害剤)の効果を含む。一般的なスクリーニング手法として、脳のミエリン形成、骨のコラーゲン代謝回転、軟骨細胞の増殖、血管平滑筋細胞の増殖、組織の線維形成、関節腔のヒアルロン酸及びコンドロイチン硫酸の合成及び分解、脳のβ−アミロイド合成、精子形成、前立腺、乳房又は結腸の細胞増殖、皮膚コラーゲン合成、表皮のケラチン合成又はケラチン細胞の増殖、T細胞の増殖及び死、免疫グロブリンの合成、脂肪組織のトリグリセリドの合成及び分解、筋肉ミエリンの合成及び分解、ミトコンドリアの生合成、及び他の多くの分子流速(表1参照)を含む、多数の経路における薬剤や標的の作用の同時測定が挙げられ、それによって幅広いスクリーニングを実現可能な手法とすることが可能となる。
【0172】
多重並行(同時)測定のハイスループット
本明細書で開示する方法は、何百又は何千の動物における数週又は数ヶ月にわたる相対分子流速の試験を可能にするが、これはプロトコルの単純さによるものである。各動物(ヒト被験者)は、2H2O等の標識水を含む水の摂取のみが可能である。これは、標識プロトコルによって必要とされる限り持続する。2以上の生体分子の分子流速が質量分析によって評価される場合には、方法の完全自動化が可能である(自動採取、コンピュータ化したデータ分析、及び流速の計算)。
【0173】
アイソトープ標識水投与によって容易となる高容量は、従来の標識技術と異なるものである。従来の標識技術は、前駆体プールのアイソトープ濃縮の安定性を維持するために、労働集約的又は侵襲的又は持続的な投与プロトコル(例えば静注又は反復経口又は腹腔内の投与)を必要とし、異なるクラスの分子類の多数の流れを評価する場合には、多数の異なるトレーサーの投与も必要であった。このハイスループットの可能性は薬剤の開発や発見の鍵であり、開発や発見においては、きわめて多数の候補薬剤や候補ゲノムを試行錯誤方法で評価する必要があり、複数の分子流速の結果を評価項目として測定する必要がある。
【0174】
長期に緩徐に進行する毒性又は治療作用を評価する可能性
候補薬剤又は遺伝子の潜在的な毒性又は治療の作用に重要な多くの生物学的プロセスが、きわめて緩慢に進行する。これらの緩慢に進行するプロセスは、他の動態技術と異なり、アイソトープ標識水投与方法によってモニター可能である。これは2H2Oといった飲料水中のアイソトープ標識水の投与がきわめて容易で単純であることによるものである。2H2O標識試験は、最小限の努力で3〜6ヶ月にわたって実験動物及びヒト被験者(例えば図3を参照)において実施された。そういった緩慢に進行する、モニター可能なプロセスは、血管平滑筋、リンパ球、脳の構成物質、組織のミトコンドリア、上皮性幹細胞、並びに骨及び組織のコラーゲン、及び多くの他の動態を含む。
【0175】
キット
本発明は、in vivoにおける分子流速の測定及び比較のためのキットを提供する。本キットは、アイソトープ標識水(特に2H2O、3H2O、及びH218Oアイソトープ標識水又はその組み合わせ)、並びに好ましい実施形態においては、生体分子を分離、精製又は単離するための周知の技術の化学化合物、及び/又は組織試料採取に必要な化学物質、コンビナトリアル分析のための自動計算ソフトウエア、並びにキット使用のための取扱説明書を含んでもよい。
【0176】
水投与用の道具(例えば計量カップ、針、シリンジ、ピペット、IVチューブ)といった他のキット構成要素を、キットに任意に提供してもよい。同様に、被験体からの試料採取のための器材(例えば試料カップ、針、シリンジ、組織採取装置)を任意に提供してもよい。
【0177】
以下の実施例により本明細書に記載の発明をさらに説明するが、これに限定されるものではない。
【実施例1】
【0178】
成長組織におけるDNA:タンパク質の合成比率
2H2Oからの筋肉、肝臓又は他の組織のDNA:タンパク質への2H−取り込み比率により、組織の成長が過形成(新規細胞の追加)によるものなのか、それとも肥大(個々の細胞のサイズの成長で、新規細胞の追加はない)によるものなのかどうかが明らかとなる。この区別は、いずれの組織においても質量を変化させるように設計された、成長因子、遺伝子又は他の処置(介入)を評価するために必要となる。DNA:タンパク質の合成速度は、標識水を投与してDNA及びタンパク質におけるアイソトープ標識の取り込みを検出することで同時に測定する。
【実施例2】
【0179】
化学療法時の腫瘍細胞又は微生物におけるDNA:タンパク質の合成比率
抗生物質での化学療法時の細菌におけるDNA:タンパク質の動態の比率により、抗生物質製剤が殺菌(細胞を死滅させる)もしくは静菌(細胞の増殖を抑制するがそれらを死滅させない)で作用するのかどうかが明らかとなる。同様に、化学療法時の腫瘍におけるDNA:タンパク質の動態の比率により、細胞死が誘導されたのか又は増殖が停止したのか(殺腫瘍的又は静腫瘍的な作用)が明らかになる。DNA:タンパク質の合成速度は、標識水の投与とDNA及びタンパク質におけるアイソトープ標識の取り込みの検出によって同時に測定する。
【実施例3】
【0180】
細胞タンパク質又はゲノムDNAの合成速度に対するミトコンドリアDNAの合成速度の比率
組織の体細胞成長に依存しないミトコンドリア発生は、例えば有酸素運動に対する筋肉の学習応答において非常に重要となり得る。細胞タンパク質やゲノムDNAの合成に対するmtDNA合成の比率により、成長に依存しないミトコンドリアの形成と代謝回転とが明らかになり、有酸素運動の適性(aerobic fitness)のバイオマーカーを表す。mtDNA及び細胞タンパク質又はゲノムDNAの合成速度は、標識水投与とmtDNA及び細胞タンパク質又はゲノムDNAへのアイソトープ標識の取り込み(例えば図1及び2を参照)の検出によって同時に測定する。
【0181】
SimonsenからのSprague−Dawleyラット(体重210〜350g)を、1ケージに3匹、12時間の明暗サイクルの下に金網ケージで飼育した。全ての処置が、UC Berkeley Office of Laboratory Animal Careによって認可された。ラット用Purina飼料は、自由に与えた。若年のオス成長群(試験開始時に2〜4ヶ月齢)と老年のメス安定体重群(8〜10ヶ月齢)との2群のラットを用いた。若年群ラットの最初の平均体重は約210gであり、一方老年の安定体重群の平均体重は約225gであった。
【0182】
齧歯類における2H2Oの標識プロトコルは、体内水の2.0〜2.5%の濃縮となるように初回プライミング腹腔ボーラス法とした。体重の60%を水とした推定に基づいて、ラットにプライミング用量の2H2O(100%)を投与(例えば225gのラットには、135mLの2%又は2.7mLを分割用量で1時間間隔で投与)して、その後飲料水中の4%2H2Oを投与した。飲料水中の2H2Oの4%濃縮を、目的の生合成産物の十分な濃縮をもたらして周知の毒性がない都合の良い用量として選択した。2H2O(70%及び100%)は、Cambridge Isotopes(Andover、マサチューセッツ州)の市販品を購入した。摂水は自由であった。ラットは二酸化炭素による窒息で屠殺した。
【0183】
個々の動物から、骨髄と心臓(0.5g)及び後肢(0.3g)の筋肉の試料を、屠殺後直ちに切除した。筋肉試料をホモジナイズして、次に密度勾配遠心によってホモジェネートからミトコンドリアを単離した。核DNA(nDNA)の混入は、DNアーゼ処理で酵素的に除去した。筋肉試料においてnDNAの混入がないことは、ポリメラーゼ連鎖反応(PCR)を行い、次にゲル電気泳動を行って確認した。個々の動物におけるmtDNA動態の測定のために、0.3〜0.5gの筋肉組織から、十分なmtDNAを得た。
【0184】
骨髄nDNAは、Qiampカラム(Qiagen)を用いて当技術分野で周知の技術を使用して単離した。mtDNAは、組織のミトコンドリア画分を単離した後に、心筋、後肢筋、及び血小板からQiagenキット(Qiagen)を使用して単離した。mtDNA及びnDNAは、酵素的に加水分解して遊離デオキシリボヌクレオシドとした。他のデオキシリボヌクレオシドからdAを分離するために、LC18 SPEカラム(Supelco、Bellefone、PA)を使用した。カラムは100%メタノール(2mL)及び水(2mL)で洗浄した。次に、加水分解したDNA試料をカラムに導入して、dA以外のヌクレオシドをH2O洗浄(5mL)で溶出した。次にdAを50%エタノール(1ml)で溶出した。
【0185】
dAのデオキシリボース(dR)部分を、ペンタン四酢酸誘導体に転換した後にGC/MSで分析した。dRのアイソトープ濃縮は、GC/MS分析(m/z245及び246、それぞれM0及びM1の質量を表す)で評価した。DNAのデオキシリボース又は遊離デオキシリボヌクレオシドのC−H結合においては、溶媒水又は他の試料マトリクスでの水素イオンと水素原子との間の置換はなかった。分析された誘導体はdR部分のみを含み、プリン・デオキシリボヌクレオシドの塩基部分は含まず、塩基サルベージ経路を経由した塩基部分への標識の取り込みは、交絡因子ではなかった。
【0186】
測定されたアイソトープ比率が注入試料量に依存すること(存在感度)を確認するために、非標識dA(自然存在度)の標準を、解析毎に同時に分析した。この依存関係は、親イオンM+0(m/z245)の存在度対M+1イオンのM+0+M+1イオンに対する比率(246/245+246)をプロットすることによって、特徴付けられる。比率対M+0存在度の直線回帰を、上述したように計算した。次に回帰直線を、試料中の過剰な存在度を計算するために、どの個々のM0存在度においても自然存在比の計算に使用した。
【0187】
細胞の部分合成速度を、前駆体−生成物の関連性を使用して上述したように計算した。完全に(又は殆ど完全に)代謝回転した組織のアイソトープ濃縮は、対象の細胞に対する正味の前駆体濃縮尺度として使用可能である。プール・サイズが定常状態にある条件下では、部分合成速度は、部分置換速度(すなわち産生されるあらゆる細胞又は分子は、分解される細胞や分子と平衡しなければならないという仮定)を表す。mtDNAの2H2O標識後の置換定数(k)及び半減期(t1/2)は、上述したように計算した。前駆体−生成物の関連性計算の背後にある中心原理は、前駆体プールに全てが由来する産物のアイソトープ濃縮が、前駆体プールのアイソトープ濃縮に、指数曲線として近似するであろうというものである。
【0188】
体内水の2H2O濃縮は連続的に測定した。飲料水中4%2H2Oを維持したラットにおいて達成された、定常状態の体内2H2O濃縮は、個々の動物においては約3%であり長期に安定であった。
【0189】
若年オス・ラットを、体細胞成長を含んだミトコンドリア発生のモデルとして、最初に試験した。若年オス・ラットの体重は、2H2O標識の継続期間中に50%を超えて増加した。骨髄のnDNAの濃縮は、標識した11週にわたって9.5〜10.0%に安定維持された。心筋及び後肢のmtDNAの濃縮は、長期にわたって0.0〜3.5%と上昇した。後肢及び心臓の筋肉のmtDNAの部分合成(f)も、長期にわたって上昇した。約40〜50%のmtDNAが、2H2O標識の11週後に双方の組織で新規に合成され、後肢筋での値は約45%でプラトーに達した。
【0190】
組織の増加に関係したmtDNA合成と成長に依存しないmtDNAの置換とを区別するために、老年の体重安定なメス・ラットを試験した。体重は、これらの動物では長期にわたって予測通りに比較的安定であり、標識期間9週間にわたって10%増加したのみであった。骨髄のdA濃縮値は、安定して成長期のオス・ラットと変わらなかった。2H2O標識をした9週間にわたって組織を採取した。心筋では、2H2O標識8週後のmtDNA合成(約20%が新しい)は、体細胞の成長(約10%)よりも高かった。骨格筋では、mtDNA合成は規模において体細胞の成長と同様であり、この方法によっては成長に依存しない合成は示されなかった。合成の速度定数は、心筋においては1日あたり約0.4%であった。体細胞の成長(9週にわたって10%)を補正した後は、心筋mtDNAの部分置換速度の計算値は、0.2%/日であり、これはmtDNAの半減期350日と一致した。
【0191】
筋肉組織におけるmtDNA及びnDNAの合成の同時測定による比較
心臓と後肢の筋肉におけるnDNAとmtDNAの部分合成を、体重が安定なメス・ラットにおいて比較した。ゲノムDNAに比較して6〜9週後に約2倍の、mtDNAの高い合成速度が心臓と後肢の筋肉の組織双方で観察された(図5)。注目すべきは、骨格筋のnDNA合成は、これらの動物では全身のの成長(約10%)より規模が小さかったこと(9週後に約5%)であり、一方心筋のnDNA合成(約10%)は、体細胞の成長と同様であったことである。これらの組織におけるmtDNA合成がnDNA合成より高いという観察結果は、細胞分裂に依存しないmtDNAの複製とこれらの結果が一致するため、重要である。mtDNA合成を新規な筋細胞の増殖(nDNA合成)に対して補正した場合には、体細胞の成長に基づいて行ったように(上記参照)、非成長組織におけるmtDNAの半減期が評価可能である。計算した半減期は、心筋において約350日(置換速度定数は1日あたり0.2%)、骨格筋において約700日(置換速度定数は1日あたり0.1%)であった。
【0192】
上記結果から、正常ラットにおける後肢と心臓の筋肉のmtDNAの比較的緩慢な合成速度が確認される。心臓及び骨格の筋肉の双方におけるnDNA合成に対するmtDNA合成(図4)の比較を基にすると、正味の代謝回転(すなわち体細胞の成長がない場合の置換)が確かに生じたと思われる。組織の体細胞成長が、mtDNA合成の約50%を占めた。体重安定なラットにおいて、組織増殖の間に新規に加わるミトコンドリアに対して補正した後でのmtDNAの見かけの半減期は、心臓及び後肢の筋肉についてそれぞれ12〜24ヶ月に及んだ。
【実施例4】
【0193】
脂肪組織のアシルグリセリドの合成速度と他の体組織におけるタンパク質又はDNAの合成との間の関係
生体組成に対する処置(intervention)の作用を、脂肪組織のアシルグリセリド対筋肉及び肝臓又は他の体組織におけるタンパク質及びDNAの相対合成速度によって評価した。脂肪組織のトリグリセリド合成の抑制を伴った筋肉のタンパク質及びDNAの合成が刺激されることは、消耗性や脆弱性を呈する患者における、例えばアンドロゲンや組換え成長ホルモンといった薬剤の有益な治療作用を示す。脂肪組織のトリグリセリドと体組織のタンパク質及びDNAとの合成を、標識水の投与並びに脂肪組織のアシル化グリセリド及び体組織のタンパク質又はDNAへのアイソトープ標識物の取り込みの検出によって、同時に測定する。
【0194】
4週齢の老年のメスC57/bl6jマウス(Jacson Labs Bar Harbor、MI)を次の4群に分けた。すなわち、C57/bl6j+/?対照(con)、自由に摂食したC57/bl6jlep−/lep−(ob/ob)、レプチン処置したob/ob(ob−lep)及び摂食制限したob/ob(ob−r)である。全マウスを個別に吊り下げ式金網ケージで飼育し、飲水を自由とした。光周期は正午から午前0時まで点灯して平均温度は73°Fとした。飼料(Bio Serv、Frenchtown、NJ)は精製した製剤からなり、1gの「無塵」ペレットを摂食自由のマウスに、45mgを摂食制限したob/obmマウスに与えた。マウスは3日間で環境順応させたが、この間に何らかの体重減少を観察した。順応期間の終了後に、摂食制限又はレプチン処置を開始して、摂食量と体重を定期的に計測した。
【0195】
ob−r群の摂食は、1日あたり2.8gに制限した。ob−rにおいて、食事摂取による可能性ある混乱作用を避けるために、その食事は継続して与えた。吊り下げ式金網ケージに、試験期間中23分毎に単回の45mgペレットを連続的に給餌するペレット自動給餌機(Coulbourn Instruments、Allentown PA)を取り付けた。摂食制限は、2H2Oによる標識開始の5日前に開始した。
【0196】
ob−lepマウスは、マウス・レプチンの用量2μg/日(Amgen、Thousand Oaks、カリフォルニア州)を、皮下に埋め込んだAlzet小型浸透圧ポンプ(Alza Corp.、Palo Alto、カリフォルニア州)により28日間投与した。ポンプは、レプチン(0.35μg/μL)を毎時0.25μLの速度で皮下に持続注入で供給した。レプチン処置も、2H2Oによる標識開始の5日前に開始した。
【0197】
マウスには、身体の水プールの約2%濃縮を達成する用量で2H2O(重水素置換水)を注入した。正常飲用水は、次に4%2H2Oに濃縮した水で置換した。2H2O処置は、摂食や体重には影響がなかった。2H2O投与開始から21日後に、マウスを4時間絶食させ、イソフランで麻酔して心臓穿刺により放血させた。可能な場合は、同時に尿を採取した。
【0198】
血液測定
血漿グルコースをYSI(Yellow Spring、OH)自動分析器によって測定した。血漿のインスリン及びレプチンの測定は、Linco reserch(St.Charles、MO.)の測定サービスによって実施した。
【0199】
脂肪組織の調製と脂肪細胞の単離
脂肪体を以下の手順に従って単離切除した。鼠径部の脂肪体を、後肢の基部に始まり胸骨へと上行して背骨へと広がる皮下の目立たない脂肪体と見定めた。子宮外膜の脂肪体を確認して、卵巣と子宮から切除した。腸間膜脂肪は、小腸を外に伸展させて穏やかに脂肪やリンパ組織を取り除くことによって切除した。後腹膜の脂肪体は、腎臓の背部に位置して、子宮周辺の脂肪体の上端へと下行伸展するが、子宮の上端を境界として使用した。鼠径部及び後子宮周辺の脂肪体は、左右の側を分析用にプールした。
【0200】
骨髄細胞を後肢大腿骨から単離した。骨を切除して26ゲージ針を使用して中心をハンクス平衡塩類溶液(HBSS)によって押し出した。次に当技術分野で公知の技術(Neese, R.A.、Siler, S.Q.、Cesar, D.、Antelo, F.、Lee, D.、Misell, L.、Patel, K.、Tehrani, S.、Shah, P.、Hellerstein, M.K. Anal Biochem 2001 298巻、189〜195)を使用して骨髄のDNAを単離した。
【0201】
切除後直ちに脂肪体を、成熟脂肪細胞の単離のために、Rodbell(Rodbell, M. J.Biol.Chem(1964) 239巻、375〜380)の方法に従って秤量済みのチューブのCa含有HBSS中に入れた。脂肪体を秤量して、次にカミソリの刃によってガラス皿の中で十分に細切した。細切組織を3mLのHBSSの中に入れて、300μLの1%II型コラゲナーゼ(Worthington)を加えた。組織を37°で90分までインキュベートした。試料を、カットピペットで30分毎に穏やかにピペッティングすることによって混合した。試料を800rpmで10分間遠心した。遠心の結果、チューブの中で3層となり、上層に透明な脂質、中層に不透明な脂肪細胞含有画分、及びその下は細胞の残渣と血管間質細胞のペレットを含む液体であった。脂肪細胞画分を中層画分から慎重に取り除いて凍結した。それに続く顕微鏡分析は、このプロトコルが全ての血管間質組成物を完全に除くとは限らないことを明らかにした(考察を参照)。
【0202】
脂肪細胞からのDNAの単離と誘導体化
脂肪細胞の凍結スラリーを融解して、100〜200μLを二連でピペッティングにより秤量済みの滅菌エッペンドルフ・チューブに入れ、凍結乾燥した。試料の乾燥重量を測定して、次に試料を消化してQuiagen DNeasy組織キットを使用してDNAを単離した。各試料のDNA收率を、Pharmacia Biotec Genequant II分光分析装置で定量した。
【0203】
DNA10〜25μgを個々のリボ核酸に加水分解して、単離デオキシアデノシンを還元してアセチル化した。結果として生じた酢酸エチル中のペントース四酢酸(PTA)誘導体を、DNAのデオキシリボース部分のアイソトープ濃縮測定のために、GC/MSに注入した。
【0204】
TG、FA、及びH2Oの誘導体化及び分析
コラゲナーゼとのインキュベーション後に、脂肪のTG試料を採取した。10〜20μLの間の脂質を取り出して、0.01%β−ヒドロキシトルエンを含む約500μLのヘプタン中で凍結した。この溶液を2mLのクロロホルム:水(1:1)で抽出した。水層を捨てて、脂質画分を、3NメタノールHCl(Sigma-Aldrich)との55℃で60分間のインキュベーションによって、エステル交換した。脂肪酸メチルエステルを、5%NaClではなく水を水層に使用したFolch抽出変法によってグリセロールから分離した。次に遊離のグリセロールを含む水層を凍結乾燥して、グリセロールを、他報(Hellerstein, M.K.、Neese, R.A.、Schgwarz, J.M.、 Am J Physiol (1993) 265巻 E814〜820)に記載したように無水酢酸−ピリジン、2:1とインキュベートすることによって、グリセリン三酢酸エステルに変換した。脂肪酸メチルエステルを含む層を窒素下に濃縮して、直ちにGC/MSに注入した。
【0205】
体内水中の2H2O濃縮を、血漿試料から誘導した四臭化エチレンにおいて他報(Neese, R.A.、Siler, S.Q.、Cesar, D.、Antelo, F.、Lee, D.、Misell, L.、Patel, K.、Tehrani, S.、Shah, P.、Hellerstein, M.K. Anal Biochem 2001 298巻、189〜195)に記載したように測定した。
【0206】
GC/MS分析
5970型及び5971型のGC/MS又は5973型装置(Agilent、Palo Alto、カリフォルニア州)を、グリセリン三酢酸エステル・脂肪酸メチルエステル及び四臭化エチレンのアイソトープ濃縮の測定に使用した。グリセリン三酢酸エステルは、DB−225溶融シリカカラムを使用して、m/z159及びm/z160(親M0及びM1)又はm/z159、m/z160及びm/z161(M0、M1及びM2)でモニターして分析した。メタン化学イオン化法(CI)を選択イオンモニターで使用した。脂肪酸−メチルエステル組成物を、炎イオン化検出法で分析し、2H濃縮についてはGC/MSで分析した。四臭化アセチレンを、DB−225溶融シリカカラムを使用して、m/z265及びm/z266(親M0及びM1の質量)でモニターして分析した。2H2O濃縮の既知の標準曲線を、個々の試料群のの前後に使用して、アイソトープ濃縮を計算した。
【0207】
PTA試料を、6890GC及び自動試料採取装置(Agilent、Palo Alto、カリフォルニア州)を連結したHPの5973型MSで、重水素の取り込みについて分析した。メタンCIを、m/z245〜246(M0及びM1の質量を表す)での選択イオンのモニター下に、30mDB−225カラムで行った。自然存在度は(濃縮されていない)dA試料を同時に測定し、脂肪PTA試料中の過剰M1(EM1)の存在度は、差から計算(試料中のM1の存在度から濃縮されていない標準で測定したM1の存在度を差し引く)した。骨髄DNA試料を同時に分析にかけ、完全又はほぼ完全な代謝回転を表すために使用して、脂肪細胞の部分置換を計算した。
【0208】
計算
TG合成
標識期間中のTGの新規な合成の割合(%)を、TGグリセロールの最大の又は漸近的な濃縮を評価するために体内水の濃縮を使用して、前駆体−生成物の関連性に基づいて上述したように計算した。体内水濃縮とTGグリセロールの最大濃縮との関連性は、組み合わせの分析(アイソトポマー質量の分布分析 MIDA)により、また長期間の2H2O標識後に100%置換されたTGプールを測定することによって評価されている。アシルグリセリドのグリセロール部分には、そのC−H結合の5個の水素のうち4個に、H2O由来の2Hが取り込まれる(すなわちn=4又は80%の置換)。n=4の場合、漸近的なグリセロールM1濃縮(A1∞)はA1∞=−7.4625x2+3.3519x+0.0007と計算され、xは測定した体内水濃縮に等しく、M1は(m/z159)/(m/z159+160)と計算される。新規に合成されたTGの部分は、次に以下のように計算される:
部分合成(f)=EM1/A1∞
正味の脂肪分解の評価
定常状態下では、全身のTGプールは比較的一定であり、TG合成はTG分解(すなわち脂肪分解)と平衡しなければならない。このようにして測定したTG合成は、脂肪分解の評価に使用可能であるが脂肪組織TGのランダムな分解がない(すなわち最後に入り、最初に出る)場合には、TGの合成と分解のサイクルのいくつかは、現存するいずれの新規に合成されたTG分子に対しても生じる可能性がある。このために、この測定を正味の脂肪分解と称する。さらに、ここで試験した動物は脂肪質量が増大していたため、標識の取り込み測定から脂肪分解速度を評価するためにはプール・サイズの変化に対する補正が必要である:
正味の脂肪分解=合成されたTG−蓄積されたTG
レプチン処置マウスの場合、保持されるTGは負の値(すなわち体脂肪が損失した)であり、TG合成速度に、損失したTG量を加えて、正味の脂肪分解速度を得る。
【0209】
DNL(TGの全体部分・新規合成部分)
MIDAを、脂肪TGのパルミチン酸塩についてDNL部分を測定するために、上述及び米国特許5,338,686号(参照によりその全体を本明細書に組み入れる)に記載のように使用した。2H2O標識を使用した。
【0210】
MIDAによって測定した、DNL部分の計算値は、標識期間にDNL経路を経由して合成された貯蔵TGの部分を表す。この値は、既存の脂肪が存在する範囲であるが、新規に合成された貯蔵脂肪酸にしめるDNLの割合を表すものではない。すなわち、「非DNL」TGは、既存の脂肪又は非DNL経路から新規に合成されたTGのいずれかを表す可能性がある。この問題は、新規に合成されたTGの割合に対して補正することによって解決可能である。DNL−fのTG−fに対する比率によって、新規貯蔵脂肪の中の正味のDNL部分が明らかになる。部分DNLの割合が35%でありTGの部分合成が70%である場合には、新規合成TGにおける正味のDNL部分は、直接測定した35%fではなく0.35/0.7又は50%である。
【0211】
パルミチン酸エステルの絶対DNLを、DNL画分に脂肪体重量の0.8倍(脂肪組織中の推定TG画分)を乗じて、次に現存パルミチン酸エステルの%(炎イオン化検出法によって測定)を乗じることで計算した。この値は、標識期間に合成されたパルミチン酸エステルの絶対量(グラム)を表す。
【0212】
脂肪細胞の増殖(脂肪形成)
部分脂肪細胞増殖を、脂肪DNA中のEM1を骨髄DNA中のEM1で除することで計算した。骨髄DNAは、ここでは脂肪DNA中のA1∞値を評価するために使用するが、これはマウスでは7日後に骨髄細胞がほぼ完全に置換するためである。脂肪細胞の絶対合成を、部分合成に細胞総数を乗じることで計算した。
【0213】
結果
図5及び6は、同一の実験において3つの異なる代謝経路(新規の脂質生成、脂肪生成及びトリグリセリド合成)を同時測定したことを示す結果を表示する。レプチンの欠損及び置換は全3経路に同様に影響して、レプチンが脂肪組織代謝のこれらの状況において協同作用することが初め示された。
【実施例5】
【0214】
肺間質線維芽細胞(PIF)における肺のコラーゲン合成対線維芽細胞増殖(DNA合成)
PIFは、瘢痕組織(コラーゲン)によって進行的に肺が置換されることを特徴とする疾患である。肺の線維芽細胞によるコラーゲン貯蔵に対する炎症性又は線維形成のシグナルは知られていない。PIFの病因論及び治療法は、多数の活性化線維芽細胞対正常数の内因性で、より合成過剰な線維芽細胞を伴った個体の間で異なることがある。この区別は、2H2Oからの肺のコラーゲン合成速度を、2H2Oからの肺の線維芽細胞増殖速度(DNA合成)と比較することにより明らかとなる可能性がある。高比率(コラーゲン:DNA)は、合成過剰な線維芽細胞を示すであろう。個々のパラメータに対する高い絶対値を伴った低比率は、線維芽細胞の一般的な活性化を示すであろう。コラーゲン及びDNAの合成双方が、標識水の投与とコラーゲン及びDNAにおける放射性標識の取り込みの検出とによって同時測定される。
【実施例6】
【0215】
組織における、タンパク質対mRNA及びmRNA対DNAの合成速度の比率
mRNAに対するタンパク質の合成の相対分子流速は、翻訳対転写の制御が、組織におけるタンパク質発現の変化の原因であるかどうかを示す。同様に、組織でのDNAに対するRNAの合成の相対速度によって、全重量の変化又は組織におけるタンパク質の発現に対する原因メカニズムとして、転写作用対細胞分裂を区別する。これら(タンパク質、mRNA、DNA)の速度が、標識水の投与とタンパク質、mRNA、及びDNAにおける放射性標識物の取り込みの検出とによって、同時測定される。
【実施例7】
【0216】
トリグリセリド及び脂肪酸が肝臓で構築されるリポタンパク質へ流入する速度
超低密度リポタンパク質(VLDL)粒子の肝臓での構築は、高脂血症の多くの型の基礎であり、高脂血症治療の標的である。肝臓のVLDL構築には、いくつかのクラスの分子(ApoB、コレステロール、コレステロールエステル、トリグリセリド、リン脂質)の合成に関与し、その内いくつかはそれ自体が1又は複数の生合成経路に関与している(例えば、トリグリセリドとリン脂質の構築における脂肪酸及びアシル化グリセリド部分の合成、コレステロールエステルの合成におけるコレステロール及び脂肪酸部分の合成)。異なる種類のヒト高脂血症が、このリスト上の異なる経路の変化に因ると思われる。家族型脂質異常性高血圧症(又は高アポβ・リポプロテイン血症)と呼ばれる型は、ApoBの過剰分泌に因るものである。糖質誘導型高脂血症といった他の型は、トリグリセリド合成、脂肪酸合成又はVLDLからのトリグリセリドの除去の速度の変化を示す。これらの全ての成分の産生速度は、標識水の投与と個々の生体分子における放射性標識物の取り込みの検出とによって、同時測定される。
【実施例8】
【0217】
脂肪トリグリセリドの新規合成に対して補正した脂肪組織の脂肪増加に対する新規の脂質生成の寄与
食物脂肪の摂取(脂肪酸の摂取)と比較した新規の脂質生成(DNL)又は新規脂肪酸(身体によるパルミチン酸類)の内在性合成からの寄与は、体脂肪蓄積の生理における重要な差異を示す。新規の脂質生成の原因となる酵素及び適応となる薬剤治療は、内在性対食事型の体脂肪蓄積によって異なる。全トリグリセリド蓄積速度を知らなければならないため、脂肪トリグリセリドに対する新規の部分脂質生成の寄与を直接測定することは、正味の寄与比率を明らかにしない。例えば、脂肪パルミチン酸塩の5%が新規経路由来であることを測定値が示す場合には、これは新規に合成されたパルミチン酸塩の100%(組織中の全TGの5%だけが新規であるとしたとき)又は新規に合成されたパルミチン酸塩の5%(組織中の全TGの100%だけが新規であるとしたとき)を表すであろう。新規の脂質生成寄与を組織中のトリグリセリドの置換部分に対して補正すること(すなわち、新規のトリグリセリド合成に対する新規の脂肪酸合成の比率の計算)は、新規の合成からの新規の貯蔵脂質に対する正味の寄与の計算を可能にする。これらの測定は、本明細書に開示したように同時に実施して、下のデータに示す。
【0218】
正常被験者を広告で募集した。参加基準は、3ヶ月以上の体重安定、肥満度指数が28kg/m2以下、直前の3ヶ月以内に感染又は炎症の状態にない、全般に健康良好、臨床検査値(化学検査プロフィール、完全な血球数)が正常、HIV血清検査陰性、インフォームド・コンセント可能である。除外基準は、以前の代謝障害病歴(糖尿病、肥満、高脂血症)又は他の臓器系疾患(肝臓、腎臓、肺等)。潜在的な代謝作用のある薬剤使用(糖質コルチコイド、β−遮断薬、チアジド系利尿薬、フェニトイン、アドレナリン作動薬、アンドロゲン、タンパク質同化剤、エストロゲン又は経口避妊薬)、インフォームド・コンセント不可能を含んだ。計被験者19名が試験に参加した。正常被験者2群が参加した。第1群は、2H2Oを9週間摂取した(n=9)。第2群(n=10)は、2H2Oを5週間摂取した。この最初のサーベイ試験に脂肪組織の動態パラメータに変動を導入することを意図して、被験者の体脂肪の範囲、ウェストのヒップに対する比率、及び血液中代謝物の測定を含めた。第1群では男性5名、女性4名を試験したが、第2群は男性10名から成った。体重は試験開始時に、次に2〜3週間毎に測定した。身体組成物を、2H2O標識試験の開始時及び終了時に生体インピーダンス分析で測定した。血液濃度を、SF総合病院の臨床検査室で測定した。全ての試験と処置が、UC BerkeleyとUC San Franciscoのヒト研究に関する委員会の事前承認を受け、被験者は、参加前に書面のインフォームド・コンセントを渡した。
【0219】
2H2O標識プロトコル
2H2Oは経口投与した。初回投与用量をSF総合病院のGenerarl Clinical Reserch Center(GCRC)で投与した。被験者は、GCRCで計350〜400mLの2H2Oの投与を受け、体内水プールの約1%濃縮を達成するために18〜21時間の間に分割用量として投与(70mLの70%2H2Oを毎3〜4時間)された。2H2Oは、Isotec、.Inc.(Miamisburgh、OH)から購入して、滅菌容器に分注した。被験者は、次に70%2H2Oを50mL、1日3回、5日間、次に35〜50mLを1日2回、8〜10週の標識プロトコルの残る期間に投与された。このプロトコルによって5〜7日の間に大半の被験者でほぼ安定な体内2H2O濃縮(1.5〜2.0%、下を参照)を達成し、耐容性は良好であった。被験者は、2H2Oをプラスチック・バイアルに入った個別単位(70%2H2Oを35〜50mL)として投与され、プラスチック・バイアルは冷蔵庫に保管した。
【0220】
外来患者の2H2O摂取の順守は、毎週の来院(尿と唾液の採取のため)を通して計測用バイアルの返却によって確認した。
【0221】
体内水試料及び単球用血液の採取
血漿又は尿の試料を毎週全被験者から採取して、密閉容器で凍結した。血液をFicoll-Hypaque液に集め、遠心後に単核画分を採取した。血液単核球が、免疫磁気ビーズによってCD14+細胞として単離された。
【0222】
脂肪組織採取プロトコル及び成熟脂肪細胞に富んだ画分の単離
脂肪組織の吸引生検を、2H2O摂取の5週目と9週目に他報(Neese, R.、L. Misell、S. Turner、A. Chu、J. Kim、D. Cesar、R. Hoh、F. Antelo、A. Strawford、J.M. McCune、及びM. Hellerstein. Measurement in vivo of proliferation rates of slow turnover cells by 2H2O labeling of the deoxyribose moiety of DNA. Proc Natl Acad Sci USA 99巻、24号:15345〜50、2002)に記載された方法を使用して実施した。簡単に説明すると、皮下3カ所(臀部分(しり)、大腿部分(大腿)、及び横腹部分(中背))から来院の度に採取した。脂肪吸引方法には、リドカイン局所麻酔薬(1%、エピネフリンを1:100000で含む)を使用した。皮下脂肪を、14ゲージ針で3ccの注射筒に吸引し、次に滅菌チューブの中に入れて処理(同日)のために氷上に置いた。組織試料を鋭利な刃で細切し、次にII型コラゲナーゼ(Worthington、Lakewood NJ)で処理した。2単位/μL溶液1mLを各脂肪試料に加えて37℃で1時間インキュベートした。次に細胞懸濁液を、350μmメッシュのフィルター(Specrum Laboratories、Rancho Dominguez カリフォルニア州)上にゆっくりと注いだ。フィルター上の脂肪細胞を集め、脂質単離と顕微鏡分析のために処理をした。
【0223】
質量分析のための代謝物の単離
TG−グリセロール及び脂肪酸
組織試料を、1mLメタノール:クロロホルム(2:1)と共にKontes二重ガラス製組織破砕器(Kimble Kontes、Vineland、NJ)に入れて均一になるまで破砕し、次にタンパク質を除去するために遠心した。この溶液を2mLのクロロホルム:水(1:1)で抽出した。水層を取り除いて、3N HClメタノール(Sigma Aldrich)と共に55℃、60分インキュベートすることで脂質画分のエステル交換を行った。脂肪酸メチルエステルは、5%NaClではなく水を水層に使用した改変Folch抽出法でグリセロールと分離した。遊離のグリセロールを含む水層は、次に凍結乾燥して無水酢酸−ピリジン、2:1(32)とインキュベートすることによって、グリセロールをグリセロールトリアセテートに変換した。
【0224】
体内H2O
体内水の2H2O濃縮を、血漿又は尿で測定した。15〜20μLの試料を、排気したGCバイアル中で、アセチレンを産生するために炭化カルシウム(カーバイド)と反応させた。アセチレンガスをシリンジに移して、10%臭素を含む四塩化炭素を含んだ排気したGCバイアル中に注入し、四臭化エタンを産生するために室温で2時間インキュベートした。過剰の臭素は、10%シクロヘキセンを含む四塩化炭素、25μLで中和した。体内H2Oからの水素原子を含む四臭化エタンは、次にGC/MSで分析した。
【0225】
GC/MS分析
TG−グリセロール、脂肪酸、及びH2O
5970型及び5971型のGC/MS又は5973装置(Hewlett-Packard Inc、Palo Alto、カリフォルニア州)を、グリセロール、脂肪酸、及びH2Oのアイソトープ濃縮の測定に使用した。
【0226】
グリセロールトリアセテートは、DB−225溶融シリカカラムを使用して、m/z159及びm/z160(親M0及びM1)又はm/z159、m/z160及びm/z161(M1及びM2に対するM0)でモニターして分析した。メタン化学イオン化法を、選択イオン検出で使用した。脂肪酸メチルエステルを、組成物に対して炎イオン化検出法で、2H濃縮に対して、GC/MSで、他報(Hellerstein M.K.、M. Christiansen、S. Kaempfer、C. Kletke、K. Wu、J.S. Reid、K. Mulligan、N.S. Hellerstein、及びC.H. Shackleton. Measurement of de novo hepatic lipogenesis in humans using stable isotopes. J Clin Invest 87巻1841〜52、1991)に記載したように分析した。
【0227】
四臭化エタンを、DB−225溶融シリカカラムを使用して、m/z265及びm/z266(79Br79Br81Br(親−OAc)アイソトポマーの親M0及びM1の質量)でモニターして分析した。既知の濃縮の標準曲線を、各試料群のアイソトープ濃縮計算の前後に、使用した。
【0228】
GC/MS分析手順
濃縮した試料は、全GC/MS分析において存在率を基準(濃縮していない)試料と一致させた。使用した存在率の範囲は、他報(Neese, R.A.、S.Q. Siler、D. Cesar、F. Antelo、D. Lee、L. Misell、K. Patel、S. Tehrani、P. Shah、及びM.K. Hellerstein、Advances in the stable isotope-mass spectrometric measurement of DNA synthesis and cell proliferation. Anal Biochem 2001 298巻、189〜195)で記載したように理論質量アイソポトマー比率の1〜2%以内の値であった。存在率がこれらの精度のレベルに到達した基準と、この存在率の範囲に収まった試料とに対する分析結果のみを、計算に使用に許容可能と評価した。
【0229】
統計学的分析
群の比較は分散分析によった。統計学的に有意な差はp<0.05とした。測定における変動の原因は、変量効果モデルを使用して評価した。これらは被験者の変量効果(それは被験者間の変動を表す)、各被験者内の貯蔵の変量効果(それは貯蔵から貯蔵の変動を表す)、及び残る週から週の効果(それは、各被験者の各貯蔵の内での週から週の変動を表す)を含む。またこれらのモデルは、長期にわたる系統的変化の原因となる1固定週の効果を含む。脂肪TGの動態パラメータ類と標準(動的ではない)パラメータ類との間の相関関係も、回帰モデルを使用して分析した。ピアソン相関係数及びスピアマンの順位相関係数を、TG部分合成、絶対TG合成、DNL及び脂肪分解対インスリン、グルコース、及びトリグリセリドの血漿濃度、体脂肪率、全体脂肪、並びにウェスト:ヒップの比率に対して計算した。
【0230】
結果
脂肪組織のTG代謝回転
脂肪組織のTGの合成と置換の速度は、2HのTG−グリセロールへの取り込みから評価した。TG−グリセロールへの取り込みは、9週間の間にわたって増加した。3貯蔵試料での部分合成(f)は、5週後には約0.12〜0.15(12〜15%)、9週後には0.16〜0.22(16〜22%)であった。脂肪TGの部分置換速度は、1日あたり0.0030〜0.0045の幅であり、脂肪TGに対しておよそ200〜250日間、比較的一定のt1/2値を示していた。
【0231】
脂肪TG合成速度は、標識物投与の最初の5週間から第5〜9週の間で、若干緩慢に上昇すると思われる。生検を双方の時期に一致させた被験者において、fは臀部の貯蔵では、0.130±0.048%(第5週)及び0.158±0.057(第9週)であり、横腹ではそれぞれ0.151±0.098及び0.236±0.127であり、並びに大腿部ではそれぞれ0.125±0.042及び0.205±0.099であった。第9週の値は第5週の値より有意に高かった(p<0.05)。
【0232】
5週にわたる脂肪TGの合成と保持との全量は、1.80±0.98kg(n=18)、幅0.5〜4.4kgと計算された。したがって平均の脂肪TG合成速度(ここで採取した皮下貯蔵物は全体脂肪貯蔵部を代表すると仮定して)は、1週あたり約0.35kg又は1日あたり50gである。
【0233】
脂肪分解速度も、TG合成と体脂肪の平衡に基づいて計算することが可能であろう。これらの被験者は全身レベルで脂肪平衡がゼロ(安定体重で9週の標識期間にわたって身体組成に変化がない)であったため、脂肪TGの正味の脂肪分解は正味の合成と置換とに等しい。正味の脂肪分解速度は、各被験者から採取した3つの貯蔵物でのkの平均値に全身の脂肪プールサイズ(これらの被験者では平均約15kg)を乗じて計算した。これらの値は約50〜60gTG/日又は約0.4〜0.6mgTG/体重kg/分であった。
【0234】
DNLの脂肪組織TGへの寄与
TG−FAへの取り込みは、第0週〜9週の間でおおよそ線形に増加した。5週間の2H2O標識後に部分DNL(fDNL)は、臀部脂肪で平均0.020±0.0112(n=17)であり、横腹脂肪で0.023±0.016(n=17)であり、大腿脂肪で0.025±0.013(n=12)となった。9週間のH2O標識後に、fDNL値は臀部脂肪で平均0.040±0.0023(n=8)であり、横腹脂肪で0.041±0.024(n=6)であり、大腿脂肪で0.041±0.024(n=8)となった。新規に貯蔵された脂肪TG部分に対して補正した場合(すなわちTG−グリセロール合成に対して補正する)は、DNLから新規に貯蔵されたTG−パルミチン酸への部分の寄与は、殆どの個体の貯蔵部位間の平均値が約20%であって長期にわたり比較的一定であった。個体は自身の特徴的曲線上にあると思われたが、各個体内では、試験した全貯蔵部に関して長期にわたり一定の結果であった。
【0235】
この実施例で記載した手法は、脂肪組織のTG合成、正味の脂肪分解(TG分解)、及びヒト被験者において長期(すなわち週又は月)にわたって統合されたDNL経路からの寄与の同時(すなわち並行)測定を可能にする。さらに外来患者の重水摂取は単純で条件を満たしやすく、比較的高価ではないため、この手法には、ヒトでの脂肪組織成分の動態を評価する代替方法に対して、多数の実際的な利点がある。
【実施例9】
【0236】
ミトコンドリアでのカルジオリピン:DNAの合成速度に対する有酸素運動の作用
筋肉でのミトコンドリア生合成は、有酸素運動に反応して生じる(上記参照)。ミトコンドリアの生体分子は、mtDNAだけではなくリン脂質、特にミトコンドリアに比較的独自な分子−カルジオリピン(CL)に富んだ膜をも含む。ミトコンドリア等の細胞器官の統合された生合成は、mtDNA、ミトコンドリアのカルジオリピン、及びミトコンドリアのタンパク質の組織的な合成を必要とする。CLは3つのグリセロール部分を含み、したがってアシルグリセリドのグリセロール部分に対する2H2O標識の適用に理想的である。ラットにおける運動治療計画の開始は、mtDNAと同様にミトコンドリアのカルジオリピンの合成刺激に帰結して、2つのパラメータはよく相関する。したがってミトコンドリアのカルジオリピン合成の評価は、有酸素訓練の状態と治療計画との評価において有益(mtDNAより高感度な手法として)なことがある。ミトコンドリアのカルジオリピンとmtDNAとの並行した変化の知見は、どちらか一方の知見をそれ自体が大きく補強する。評価した2つの合成速度間が不一致という知見は、結果の再評価又はこの知見の新規原因の探求が必要と考えられるであろう。mtDNAとミトコンドリアのカルジオリピンとの分子流速は、アイソトープ標識水の投与並びにmtDNAとミトコンドリアのカルジオリピンとの検出によって、質量分析で同時(すなわち並行)測定する。
【0237】
簡単に説明すると、Sprague-Dawleyラット、3ヶ月齢のメスを、対照(運動なし)又は実験(回転ホイール運動を実施可能)群に無作為に割り付けた。動物は個別に金網底ケージに入れて、AIN−93M飼料を摂食させた。動物には、99%2H2Oを5%濃縮で屠殺前に8日間ボーラス投与して、飲料水は8%を維持した。動物は、4週後に赤色腓腹筋、心臓、及び血液を採取した。ミトコンドリアを新鮮組織から分画遠心によって単離した。ミトコンドリアは、mtDNA及びリン脂質(カルジオリピン及びフォスファチジルコリン)を後に分析するために、2つの個別のチューブに等分に入れた。血漿を体内水の2H2O濃縮評価に使用した。カルジオリピン及びフォスファチジルコリンを、上述した本発明の方法を使用して同時測定した。またカルジオリピン及びmtDNAを、上述した本発明の方法を使用して同時(すなわち並行)測定した。
【0238】
図12及び13は、mtDNA、カルジオリピン及びフォスファチジルコリンを含む3つのミトコンドリア生合成のマーカー間の比率を示す。図12は、mtDNA合成に比較した場合、カルジオリピンがミトコンドリアの生合成のバイオマーカーとしてmtDNAと同等であることを示す。同様に、図13は、フォスファチジルコリンがカルジオリピンと同等であることを示し、ミトコンドリアの生合成の評価においてこれらの3つのバイオマーカー全てが有用であることを示す。本方法によって、ミトコンドリアの生合成の評価のために、これらのバイオマーカーの2以上の同時測定が可能である。もう1つのバイオマーカー又は他のバイオマーカー双方に関連して、1つのバイオマーカーの変化が、代謝疾患とミトコンドリアの生合成の変化を含む代謝状態との診断、或いはミトコンドリアの生合成の刺激又は阻害に関して試験した化合物の治療活性を評価するための有用な情報を提供することがある。
【実施例10】
【0239】
T細胞のDNA対血漿免疫グロブリンの合成
細胞性免疫系及び液性免疫系は、身体の宿主防御系の別々の部門を表す。前者はTリンパ球の活性化及び増殖を示し、後者はBリンパ球による抗体(免疫グロブリン)合成を示す。免疫系のどの部門が疾病状態又は薬剤治療において活性化又は抑制されているのかを知ることは、重要である。血漿免疫グロブリンの合成速度に対するT細胞の増殖速度(T細胞のDNA合成)を比較することは、細胞性:液性の免疫活性化の評価を表す。T細胞のDNA及び免疫グロブリンの分子流速は、アイソトープ標識水の投与とT細胞のDNA及び免疫グロブリンを質量分析で検出することによって同時(すなわち並行)測定される。抗原特異的なT細胞及び/又は免疫グロブリンも上述のように測定される。
【実施例11】
【0240】
選択的エストロゲン受容体モジュレーター(SERM)で治療時の哺乳動物の上皮細胞及び子宮内膜細胞の増殖対骨コラーゲン分解及び脳β−アミロイド生成
SERMは、女性の健康を改善する可能性のある治療薬として大きな注目を浴びている。エストロゲンの作用は組織の相違によって大きく異なるが、個々の女性でのリスク:利益のバランスは、これらの対立作用次第である。エストロゲンは、哺乳動物の上皮細胞及び子宮内膜細胞の増殖を上昇させる傾向(その結果、乳癌及び子宮癌のリスクが増大)があり、一方骨コラーゲン分解の低下(その結果、骨粗鬆症のリスクが低下)させる傾向と、場合により脳β−アミロイドタンパク質増加を低下(その結果、アルツハイマー病のリスクが低下)させる傾向がある。SERMは細胞の増殖作用に対抗するが、他の作用は刺激又は未変化であるように企図された可能性がある。それらの薬剤には、公衆衛生及び市場での大きな有用性があるであろう。作用の最適の組み合わせをスクリーニングする手段は、明らかに有用であろう。言及した全てのプロセス(哺乳動物の上皮細胞及び子宮内膜細胞のDNA複製、骨コラーゲン及び脳β−アミロイドの動力学)が本明細書に記載したように同時(すなわち並行)測定される。
【実施例12】
【0241】
皮膚の光老化における皮膚のコラーゲン対エラスチンの合成及び分解
皮膚のしわは日光暴露で増加する。この分野は、化粧品及び薬剤の研究における非常に大きな市場に相当する。皮膚のしわ(光老化)の生化学はよく特徴決定されており、皮膚層のコラーゲンの減少(合成の低下及び分解の上昇)及びエラスチンや他のタンパク質の増加(合成の上昇に因る)から成る。皮膚エラスチン合成に対する皮膚コラーゲンの合成や分解の比率は、したがって動物モデル(例えばヘアレスマウス)及びヒトにおけるハイスループット方法での抗しわ治療試験に対する、光老化の直接のマーカーを表す可能性がある。これらの分子の合成は、アイソトープ標識水の投与と皮膚のコラーゲン及びエラスチンの相対分子流速を質量分析で比較することによって同時(すなわち並行)測定される。
【実施例13】
【0242】
乾癬でのケラチン代謝回転(タンパク質)対ケラチン生成細胞増殖(DNA)
乾癬は、乾燥した、きわめて限局性で、サイズが多様な、銀色に光る鱗屑性丘疹及びプラークを特徴とする一般的な慢性、再発性の疾病である。1つ又は2つの部位から広範な皮膚病へと重症度が異なり、無力関節又は落屑を伴うことがある。原因は不明であるが、厚い鱗屑は表皮の細胞増殖及び付随する皮膚の炎症によるものと伝統的に思われてきた。一般的な部位は、境界が明確で、掻痒感が多様で、卵形又は環状で、紅斑性の丘疹又はプラークであり、重なり合って、厚く、銀色に光る、雲母状又はやや乳光の輝く鱗屑で蔽われている。紅斑性の乾癬(落屑性乾癬性皮膚炎)は治療に抵抗することがある。皮膚表面全体は、赤色で細かい鱗屑に覆われており、一般的乾癬部位は、曖昧又は存在しないことがある。全般的な衰弱を招き、入院を必要とすることがある。
【0243】
ケラチンは、共通の構造を持った50以上の構造タンパク質のファミリーである。いくつかのケラチンは、皮膚に発現しており、主たる表皮タンパク質成分を構成する。表皮の基底細胞は娘細胞を産生して、娘細胞は皮膚表面に向かって移動し、ケラチンK1及びK10並びに脂質以外の少量を含むまで成熟する。これらの細胞は最終的に死んで多層の防御外部皮膚表面、角質層を形成する。ヒトの正常皮膚においては、新規のケラチンの合成から皮膚表面での脱落までに平均で約4週間を要する。乾癬は、皮膚の過剰増殖によって特徴的に特徴づけられ、皮膚のケラチン及びケラチン生成細胞通過時間は、したがって数週間ではなく数日を要することがある。
【0244】
ケラチンは、皮膚での代謝回転の利用可能なマーカーを提供する。ケラチンの代謝回転は、2つの方法でモニターが可能である。1つには、表皮全体を皮膚試料から単純なタンパク質分解処理で単離する。2つには、特別な付着性をもった細長いテープ片を皮膚表面に接着させて、最外部で死んだ組織と、同時に一層を取り除く。標識ケラチンが、重水投与に際して表皮全体に即座に出現するが、細長いテープ片でモニターしたヒト正常皮膚の表面にいずれかの標識が出現する前に、2週半を要する。正常皮膚で下層表皮で生きている部分に到達するためには、少なくとも30のテープを順次付着する必要がある。
【0245】
ケラチンは非常に不溶性であり、これは皮膚の他のタンパク質からのケラチン画分の分離を容易にする。同様の手順は、表皮全体及び細長いテープ片双方で奏功する。最初に試料をTritonX−100を含む高塩緩衝液中で抽出する。この溶液は基本的にケラチンを除いて全ての表皮タンパク質を溶解する。次にケラチンを溶解してドデシル硫酸ナトリウム中での煮沸によってケラチンを溶解する。髪もケラチン(少々異なる構造)から成るが、髪のケラチンはこの方法では溶解せず試料には混入しない。実質的に純粋な皮膚ケラチンをこの単純な抽出によって産生する。
【0246】
重水を投与した正常マウスでは、皮膚ケラチンでの重水濃縮は数週間プラトー状態に到達しない(図7)。一方薄片状(flaky)皮膚(FSN)マウスは皮膚の過剰増殖を伴った乾癬のモデルマウスで、僅か4日で全面的な代謝回転とほぼ等しくなる。正常マウス対FSNマウスの同様な対比が、表皮ケラチン生成細胞の増殖においてみられる(図8)。ケラチン測定(図7)とケラチン生成細胞の新規のDNA合成(図8)を同時(すなわち並行)測定した。ケラチン及びケラチン生成細胞の動態の並行変化は、組織内に存在する過剰増殖状態を確かなものとする。
【実施例14】
【0247】
異なる組織での化学療法剤の作用の比較
balb/C nu/nuマウスのオスの皮下に、マトリゲル中の非小細胞肺癌細胞(SW1573)を移植した。マウスを2H2Oで標識して漸増用量のゲムシタビン(Gem)を1日おきに投与して治療(図9に示す)した。5日後に、腫瘍、結腸、及び骨髄を周知の技術を使用して上述したように取りだした。細胞増殖を上述のように測定した。データは、細胞増殖が腫瘍と骨髄細胞において用量反応的に阻害されたが、一方結腸細胞では殆ど阻害を示さなかったことを示す。3つの細胞型全ての新規のDNA合成が、本発明の方法を使用して同時測定された。簡単に説明すると、重水(2H2O)を生存生物に投与した(飲料水中8%2H2O)。DNAを単離して遊離のdN類へと加水分解し、プリン又はピリミジンのdN類のデオキシリボース(dR)部分への重水素の取り込みを、ガス・クロマトグラフィー/質量分析装置(GC/MDS)で上述したように測定した。dAでの標識含有量は、新規のDNA合成(細胞増殖)を示す。
【0248】
balb/C nu/nuマウスのメスの皮下に、約106のマトリゲル中のEMT7マウス乳癌細胞を移植した。腫瘍は、約1500mm3の大きさに到達可能であった。マウスを2H2Oで標識してジェムザール(ゲムシタビン又はGem)125mg/kg又はヒドロキシウレア(HU)500mg/kgのいずれか一方を投与した。Gemは1日おきに、HUは毎日、対照生理食塩水は毎日投与した。5日後に腫瘍を取り出して、細胞増殖を上述のように測定した。データを図10に図示する。図10で示すように、Gem及びHUは、対照生理食塩水を投与した細胞に関連して、腫瘍及び骨髄細胞の双方で細胞増殖の低下を引き起こした。双方の細胞型の新規のDNA合成が、本発明の方法を使用して上述したように同時(すなわち並行)測定された。
【0249】
ヌード・マウスに、ヒトSW1573肺癌細胞(5×106細胞/動物)を移植して異なる用量のパクリタキセルを注射して2H2Oで24時間標識した。ビヒクル(エタノール:Cremephor ELの1:1(容量/容量)溶液)及びパクリタキセル貯蔵液(エタノール:Cremephor ELの1:1(容量/容量)溶液に溶解)の双方を、滅菌0.1Mリン酸緩衝生理食塩水(PBS)で1:6に希釈した後、動物注射した。腫瘍細胞及び骨髄細胞が、周知の技術を使用して上述したように取り出された。
【0250】
結腸細胞を以下のように取りだした。結腸を動物から取りだして0.1Mリン酸緩衝生理食塩水(PBS)で洗浄し、切開してII型コラゲナーゼ(72mg/mL)及びDNアーゼ(10μg/mL)を含むPBS中で37℃で40分穏やかに振盪してインキュベートした。インキュベーション後に、組織を穏やかに掻き取り、細胞を4℃、800×g、5分間の遠心で回収した。沈渣は45%パーコール含有1.6%JMEM培地中に均一に懸濁した。懸濁液を75%パーコール勾配中の5mLの45%パーコール・クッションの上に載せて、室温で350×g、30分間遠心した。結腸細胞を回収してPBSで2回洗浄した。次に残渣を、35mmのフィルターを使用して細胞懸濁液から分別した。3つの細胞型全ての新規のDNA合成が、本発明の方法を使用して上述したように、同時(すなわち並行)測定された。図11に結果を図示する。示されるように、パクリタキセルは、腫瘍細胞と結腸細胞に対して用量依存的に阻害効果を示したが、骨髄細胞には僅か又は殆ど効果がなかった。
【実施例15】
【0251】
異なる組織での血管形成及び組織細胞増殖の比較
本発明の方法は、血管形成に適用した場合は動物試験及びヒトの臨床試験双方で適用可能である。本方法は、早期の薬剤発見及びより進歩した臨床治療の設定において、可能な予防/抗血管形成剤の活性とその真の有効性との評価に対する迅速でより精確な技術を提供する。
【0252】
組織中の血管形成速度は、内皮細胞の増殖速度によって評価する。内皮細胞の増殖は、重水(2H2O)標識技術によって計量した。さまざまな組織(示したように)が、コラゲナーゼ(1mg/mL)で単一細胞懸濁液へと消化された。内皮細胞は、パーコール勾配遠心法とその後のFACS法(イソレクチン及びCD31の陽性細胞に関して)で濃縮した。
【0253】
特に血管形成の動態は、肝臓及び腫瘍の異種移植片で評価した。Balb/Nuマウスにヒト乳癌細胞を移植した。2H2Oで標識後、個々の動物を屠殺して、腫瘍組織及び肝臓組織双方を同一の動物から回収した。肝臓細胞及び肝臓の内皮細胞と同様に、腫瘍細胞及び腫瘍の内皮細胞の増殖速度(すなわち新規のDNA合成)を、本発明の方法を使用して上述したように同時(すなわち並行)測定した。図14に、結果を図示する。図14では、腫瘍の内皮細胞の増殖速度は、肝臓の内皮細胞増殖速度より有意に高値であることが示される。同様に、腫瘍細胞の増殖速度は肝臓に対する速度より高い(図14)。当業者は、この技術が血管形成阻害剤(すなわち抗血管形成化合物)の同定に使用可能と認識するであろう。例えば、1又は複数の化合物をBalb/Nuマウスの腫瘍異種移植片に直接投与した場合には、本発明の方法は、肝臓内皮細胞増殖に関連して腫瘍内皮細胞増殖の阻害、及び可能性として肝臓細胞増殖に関連して腫瘍細胞増殖の低下を検出(もし血管形成が腫瘍の成長に制限的であれば)するであろう。また、抗血管形成作用を持つ1又は複数の化合物を全身投与した場合には、次に腫瘍内皮細胞増殖及び肝臓内皮細胞増殖の速度は、双方とも比率が未変化のままであるように変化(すなわち減少するであろう)するであろう。腫瘍細胞増殖及び肝臓細胞増殖の速度の比率は、成長のための血管形成におけるそれらの相対的依存性によって、変化又は不変化のどちらか一方の可能性がある。
【実施例16】
【0254】
肝臓細胞増殖(DNA合成)及び肝臓線維形成(コラーゲン合成)の比較
薬剤誘導型肝臓疾病は、肝不全の重要な原因であり、市場からの薬剤回収の最も一般的な単独の原因である。壊死は、その毒性メカニズムにかかわらず肝細胞損傷の顕著な特徴である。アポトーシスも、薬剤誘導型肝臓疾病における重要な要素と考えられている。壊死及びアポトーシス双方に対する肝臓の反応は、細胞増殖であり、欠損した細胞量に置き換わる。毒性損傷の低い段階では、細胞増殖は、正常な組織学的外観及び肝細胞のプール・サイズの維持に十分なことがあり、それによって毒性損傷を補償して標準的な組織学的方法による検出を妨害する。損傷が肝臓自身の修復能を超えたときにのみ、肝臓毒性の従来型の特徴が明らかとなる(例えば肝臓機能検査値の上昇、壊死、線維化)。
【0255】
SVJマウスに、四塩化炭素又はビヒクル、1.0mL/kg又は0.25mL/kgを週に2回、4週にわたって注射した。細胞増殖が、2H2O投与及び四塩化炭素処置の後の2、7、14、21及び28日に、本発明の方法を使用して上述したように測定された。四塩化炭素は、双方の用量で細胞増殖を有意に上昇させた(図15)。100%近い新細胞が、四塩化炭素の繰り返し投与の4週後に存在することが示された。
【0256】
肝臓コラーゲンの合成が、同一の四塩化炭素処置SVJマウスにおいて新規のDNA合成と共に同時(すなわち並行)測定された。コラーゲンが、10mgの新鮮全肝ホモジェネートから以下のように精製された。ポリトロン・ホモジナイザーを使用して、100mM NaOH、0.5mL中でホモジナイズすることによって軟組織からコラーゲンを単離した。これらの条件下では、コラーゲンは引き続き不溶であるが、大半の他のタンパク質は容易に溶解する。4℃で7000×g、10分の遠心後に、上清を廃棄した。沈渣は、2mLのH2Oで手早く洗浄してLaemmliの還元試料用緩衝液(Bio-Rad、Hercules、カリフォルニア州)中で3分煮沸して溶解させた。溶解物は、SDS−PAGEによってサイズ分画を行った。次にタンパク質は、標準技術を使用してPVDF上に転写して、得られた膜からコラーゲンのαモノマーに相当するコラーゲン・バンドをクーマシーブルーで染色した後に切り出した。
【0257】
アセトン沈殿させた全肝タンパク質及びPVDF結合コラーゲンは、6N HClで110℃で16時間加水分解した。加水分解物は、乾燥させてPFBBr(PIERCE)を100℃、1時間、添加することで五フッ化ベンジル誘導体を生じた。ヒドロキシプロリンの水酸基を、メチル・イミジゾール/無水酢酸でさらに誘導体化した。ヒドロキシプロリンをDB225 GCカラム上で、開始温度100℃を10℃/分で220℃としてm/z352、m/z353の選択イオンモニタリングで分析した。
【0258】
ヒドロキシプロリンは、目的の分子でありOH−プロリンとして測定するが、本分子は基本的にコラーゲン固有である。この事実から、全肝タンパク質加水分解物は誘導体化が可能であり、ヒドロキシプロリンの2H濃縮は、GC/MSによって上述したように評価した。正常及び四塩化炭素処置動物のコラーゲンの部分合成が、全肝タンパク質由来のヒドロキシプロリンへの2Hの取り込みから本発明の方法を使用して上述したように計算された。図16に結果を図示する。図15及び16をまとめて考えると、本方法は、有意な細胞増殖が四塩化炭素の双方の用量で生じており、一方有意なコラーゲン合成が最高用量の四塩化炭素でのみ生じており、これによって肝臓毒性の2つのバイオマーカー間を区別可能な鋭敏な技術を提供していることを示すことが可能であった。
【0259】
細胞増殖及びコラーゲン合成(代謝回転)も、グリセオフルビン摂食マウス(C57BL/6及びBalb/c)で同時(すなわち並行)に評価された。グリセオフルビンは、肝毒物で細胞増殖とポルフィリン症を誘導すると認知されている。マウスに飼料に入れたグリセオフルビン(1%重量/重量)を5日間投与した。投与の5日後に、C57BL/6の細胞増殖(上述したように測定)が、対照に関連した増殖上昇を示した(図17)。特に観察可能な作用を示さないレベル(NOEL)以下のグリセオフルビンの投与は、5日後に明白な作用及び用量反応性を示した(図17)。またコラーゲン代謝回転が上述したように測定されたが、C57BL/6マウスに投与したグリセオフルビンの用量ではコラーゲン代謝回転の上昇は検出されなかった(データは示さない)。
【実施例17】
【0260】
神経細胞増殖、小グリア細胞増殖及び/又はミエリン合成に対するAβ合成又は他の脳タンパク質の比較
アルツハイマー病(AD)には、β−アミロイド(Aβ)タンパク質、アミロイド前駆体タンパク質(APP)、及びAPPのC端末フラグメント等の多様な脳タンパク質を含む多数の因子が含まれると考えられている。また、神経細胞増殖、神経組織の炎症、及びミエリンの動態変化といった他の因子も関与している。本発明の方法は、例えば化合物に、ADモデルマウス、ADを伴わない神経組織の炎症、神経毒性、又は他の神経組織変性の疾病又は症状における治療有効性があるかどうかを比較するために、これらの成分全て又はその成分の一部の同時(すなわち並行)測定を可能にする。
【0261】
脳タンパク質の単離及び測定
マウスを屠殺して脳組織を取りだしてAPP及びCTFを採取する。分泌APPは、マウスの脳脊髄液(CSF)又は脳から抽出する。タンパク質は中性緩衝液中で抽出して不溶性物質を取り除きタンパク質を沈殿させる。得られた物質をイオン交換緩衝液中で交換してイオン交換クロマトグラフィー、次にサイズ排除及び/又は逆相クロマトグラフィーによって精製する。精製タンパク質の同定は、ELISA及びウエスタン・ブロット法で確認する。
【0262】
Ab、APP、及びCTFの濃縮は、上述したように実施する。Ab、APP、及びCTFの分子流速は、上述したように計算する。
【0263】
海馬神経細胞の単離及び神経細胞増殖測定のための破傷風毒素染色
冷蔵庫からパパインのバイアルを取り出す。Hibernate A(BrainBits、LLC、Springfield、IL)3mLを加えて37℃の振盪装置中に置く。分注したDNアーゼを−20℃の冷凍庫から取りだした、氷上で融解させる。CO2を使用して安楽死させたマウスから、心臓穿刺で採血して血液を3000rpmで10分遠心して血漿を取り出す。脳を取りだしてHibernate A 5mLで洗浄する。海馬を切り出して0.5mmの切片に薄切してトリプシン処理用フラスコ中のHibernate A 2mLに移す。パパイン溶液3mLとDNアーゼ200μLとをトリプシン処理用フラスコに加える。37℃で30分消化する。15mLのスピッツ管に移して1500×gで3分間遠心して上清を取り出す。Hibernate A 2mLを加えて、3分タイマーを作動させて炎で丸めてシリコン処理したパスツールピペットを使用して1分以上で10回、ほぐす。2分間静置して、上清を15mLのスピッツ管に移す。
【0264】
細胞懸濁液6mLを得るために、上記のステップを2回繰り返す。
【0265】
1500×gで3分間遠心し、上清を取り出す。細胞分離緩衝液10mLに再懸濁する。5分間インキュベートする。1500×gで3分間遠心して上清を取り出す。
【0266】
4%パラホルムアルデヒド溶液5mLに再懸濁する。室温で1時間インキュベートする。Hibernate A 5mLを加えて1500×gで3分間遠心して上清を取り出す。Hibernate A 5mLで1回洗浄して1500×gで3分間遠心して上清を取り出す。
【0267】
Hibernate A 550μLに再懸濁する。50μLの陰性対照を取り出す。細胞懸濁液500μLに、rTTC 5μLを加える(1:100希釈)。
【0268】
室温で1時間インキュベートする。Hibernate A 5mLで2回洗浄して1500×gで3分間遠心して上清を取り出す。Hibernate A 200μLに再懸濁する。
【0269】
抗TTC抗体2.5μLを染色用試料に加えて室温で30〜45分インキュベートする。Hibernate A 5mLで2回洗浄して1500×gで3分間遠心して上清を取り出す。Hibernate A 500μLに再懸濁する。
【0270】
ヤギ抗マウス−ALEXA488 5μLを、Hibernate A 50μLで希釈する(1:10希釈)。希釈抗体の5μLを染色用試料に、0.5μLを陰性対照に加える。室温で15〜30分間インキュベートする。
【0271】
Hibernate A 5mLで2回洗浄して1500×gで3分間遠心して上清を取り出す。染色用試料は1mLのHibernate Aに、陰性対照は250μLのHibernate Aに再懸濁する。PIを1:500で試料に加えてソートする。
【0272】
DNA合成を上述したように測定する。
【0273】
アルツハイマー病や他の神経疾病(アルツハイマー病に関係しない神経組織の炎症等)における神経組織の炎症評価のための小グリア細胞の単離
マウスを2H2Oで適当期間標識する。マウスを麻酔して氷冷PBS 10mLで灌流(経心臓灌流)する。直ちに脳を回収して氷冷PBS中に置く。次に脳を細切して、0.05%DNアーゼ、0.25%トリプシン、0.8%グルコース、及び0.16%EDTAを加えたPBS 30mLを入れたバッフルフラスコ中で37℃で25分間振盪する。その後、各フラスコを氷冷培地(10%FBSを添加した1:1 DMEM:HAM氏F10 30mL)で中和して氷上に置く。次に、10mLピペットで組織の断片が分離するまで組織を繰り返しほぐす。得られた材料は、100μmのフィルターを通して濾過して、培地で洗浄して細胞以外の残渣を取り除くために不連続のパーコール勾配にかける。
【0274】
得られた細胞を、マクロファージ特異的マーカーF4/80及びCD11bで染色して4%パラホルムアルデヒド(PFA)で固定して次にFACSで単離する。また、細胞は、FACSやMACSで小グリア細胞や小グリア細胞サブセットをソートするために使用可能な、他の細胞表面又は細胞内のマーカーで標識が可能である。細胞は、4%PFAで固定せずに直ちにソートすることも可能である。本技術は、循環系から脳に入る浸潤白血球の単離にも使用可能である。
【0275】
DNA合成が、上述のように測定される。
【0276】
ミエリンの単離と測定
1セットの2mLマイクロ遠心チューブを秤量する。脳をマウスから回収してそれを秤量済みのマイクロ遠心チューブに入れる。マイクロ遠心チューブは、再度秤量する。正味の重量が、脳の重量である。脳は、氷冷したガラスプレート上に置いてBHTの結晶を10個加える。脳を、カミソリの刃を使用して1分間細切する。細切した脳は、薬匙を使用してマイクロ遠心チューブに戻し入れる。脳は、薬匙でよく細切する。細切した脳の一部を、組織が管の底部にあることを確認しながら直径13mm、長さ100mmのPTFE製ねじ蓋付きのガラス管に入れる。脳の残部は、マイクロ遠心チューブ中で−20℃で貯蔵する。BHTを含む、クロロホルム:メタノール 2:1(容量:容量)2mLをガラス管に加えて、組織全てが溶媒に浸漬していることを確認しながらチューブをボルテックス撹拌する。室温で3時間、暗所に静置する。ガラス管の蓋を外す。管は、2000×gで10分間、室温で遠心する。上清(脂質抽出物)は、2mLのねじ口バイアルに注ぎ、固形残渣は廃棄する。
【0277】
展開溶媒(クロロホルム−メタノール−水:69.15%:26.60%:4.26%)100mLを、TLCプレートを入れる1時間前にTLC展開槽に入れる。20mLピペットが、全セレブロシド標準品20mLをWhatman LK6DF シリカゲル60TLCプレートの1、10、19レーン上にスポットするために使用される。各試料には、20mLピペットが、脂質抽出物100μLを2つの隣接レーンにスポット(50mL/レーン)するために使用される。TLCプレートが視覚的に乾燥するまで待つ。TLCプレートは、展開槽の中で展開する。各槽には2枚のプレートを向き合わせに入れる。プレートが充分に展開するまでに、通常40〜45分を要する。TLCプレートを展開した後、プレートの乾燥を15分間待つ。ヨウ素結晶20個を、ヨウ素蒸気用に特に使用される槽に入れる。槽は、80℃に設定したヒートブロック上に置く。乾燥したTLCプレートは、ヨウ素槽に入れて二重結合を含む脂質のスポットを可視化する。全セレブロシド標準品のスポットを、それらの試料と一致させる。TLCプレート像は、コンピュータで走査する。シリカゲルは、秤量箱に回収して直径12mm、長さ75mmの使い捨てガラス管に移す。BHTを含むクロロホルム−メタノール2:1 1mLを加えてボルテックス撹拌する。シリカが沈むまで静置する。溶媒は、直径13mm、長さ100mmのねじ蓋付き管に入れる。固形残渣は廃棄する。3N HClメタノール1mLを管に加えて蓋をきつく締める。管は、80℃のヒートブロック上に2時間置く。次に、管をヒートブロックからおろして室温で冷却させる。H2O1.5mL及びヘキサン3mLを管に加えて管をボルテックス撹拌する。1.8〜2mLの底部の層(メチルグルコース及びメチルガラクトース)を、GCバイアルに移す。GCバイアルをJouan10.10スピードバックのはめ込み式ローターに入れてローターの釣り合いを取り、60℃に設定する。その管が乾燥するまで真空にする。GCバイアルに無水酢酸−ピリジン2:1(容量:容量)100μLを加えてバイアルに蓋をし、室温に1時間置く。バイアルは、乾燥するまでN2下に吹き付ける。酢酸エチル100μLをバイアルに加えてボルテックス撹拌する。混合物はGCインサートに移してバイアルは締め具で蓋をしめる。試料はGC/MSにかけてガラクトセレブロシドの濃縮は、上述したように評価した。
【0278】
本明細書に引用された全ての刊行物、特許、及び特許出願は、全ての目的のためにその全体が参照により本明細書に組み込まれ、それと同程度に、個々の印刷物、特許、及び特許出願は、引用によって組み込まれるように具体的かつ個別に示される。上述の本発明は、理解を明確にするために例示によってより詳しく記載されているが、本発明の教示に照らせば添付の特許請求の範囲の精神と範囲から逸脱することなく変更及び改変が可能であることは当業者には容易に明らかである。
【図面の簡単な説明】
【0279】
【図1A】図1A〜Bは、アイソトープ標識水から選択された遊離アミノ酸への標識水素交換の経路を表す図である。
【図1B】図1A〜Bは、アイソトープ標識水から選択された遊離アミノ酸への標識水素交換の経路を表す図である。
【図1C】タンパク質合成のためのH218Oによる遊離アミノ酸の18O標識を表す図である。
【図2】水からDNAのデオキシリボース(dR)への水素アイソトープ(この場合重水素)の取り込みを表す図である。
【図3】10〜12週間、毎日50〜100mLの2H2Oを摂取した代表的なヒト被験者の体内水分中の2H2Oの濃縮を表す図である。
【図4】(a)体重の安定した雌ラットの心筋及び後肢筋におけるmtDNAと核DNAの合成の比較(平均±S.D.);f、部分置換、並びに(b)左、ラット後肢筋におけるミトコンドリア(mt)リン脂質の合成及び運動訓練(随意車輪運動)の影響を表す図である。右、(a)からのラットにおけるmtDNAとCLの合成の相関関係。
【図5】対照マウス(n=7)及びob/obマウス(n=4)の4つの異なる脂肪貯蔵(子宮外膜、鼠径部、腸間膜、及び後腹膜)から単離された成熟脂肪細胞濃縮分画における細胞増殖速度の同時測定を表す図である。
【図6】ob/obマウス及び対照において、TG及びパルミチン酸合成(新規の脂質生成又はDNLのマーカー)のための2つの異なる脂肪貯蔵(鼠径及び腸間膜)、並びに脂肪細胞増殖のための4つの異なる区画(子宮外膜、鼠径、腸間膜及び後腹膜)において同時に測定された、脂肪代謝成分の動態を表す図である。
【図7】2種の異なるマウスで同時に測定された、及び図8で示す両方のマウス種でのケラチン生成細胞DNA合成と同時に測定された、ケラチンにおけるアラニンのEM1濃縮によって示される、正常マウス(C57bl/6マウス)及び薄片状皮膚マウス(FSM又は「薄片状皮膚マウス」、乾癬のマウスモデル)における皮膚ケラチン代謝回転を表す図である。
【図8】正常マウス(C57bl/6マウス)及び薄片状皮膚マウスにおけるケラチン生成細胞代謝回転(新規のDNA合成)を表す図である(f%=DNAの部分合成)。
【図9】雄balb/C nu/nuマウスにおける次第に高くした用量のゲムザー(Gemzar)(ゲムシタビン)を投与した後の腫瘍細胞、結腸細胞及び骨髄細胞の細胞増殖の同時測定を表す図である。
【図10】対照動物と比較した、雌balb/C nu/nuマウスにおけるGem及びヒドロキシ尿素(HU)による腫瘍及び骨髄細胞の細胞増殖のin vivo抑制を表す図である。
【図11】ビヒクル対照と比較した微小管分解阻害剤であるパクリタキセルの次第に高くした用量による、ヌード・マウスの3種類の細胞に対する細胞増殖のin vivo抑制を表す図である。
【図12】雌Sprague Dawleyラットのミトコンドリア赤腓腹筋における、カルジオリピン及びmtDNAの部分合成を表す図である。
【図13】雌Sprague Dawleyラットの心臓のミトコンドリアにおけるカルジオリピン及びホスファチジルコリンの部分合成を示す。
【図14】腫瘍内皮細胞増殖、肝臓内皮細胞増殖、腫瘍細胞増殖、及び総肝臓細胞増殖を示す。
【図15】2つの用量の四塩化炭素(CCl4)及びビヒクル対照に応答したC57B/6総肝臓細胞増殖を示す。
【図16】2つの用量のCCl4投与及びビヒクル対照に応答したC57B/6肝臓コラーゲン合成を示す。
【図17】グリセオフルビン投与(0.1、0.2、及び0.5%を5日)後のC57BL/6マウス肝臓細胞増殖を示す(全ての群についてp<0.05)。
【特許請求の範囲】
【請求項1】
1又は複数の組織又は個体において2以上の生体分子の相対分子流速を分析する方法であって、
(a)アイソトープ標識水を、前記標識がin vivoで2以上の生体分子に取り込まれて2以上のアイソトープ標識生体分子を形成するのに十分な時間にわたり、1又は複数の組織又は個体に投与するステップと、
(b)1又は複数の生体試料を前記1又は複数の組織又は個体から得るステップであって、前記1又は複数の生体試料が共に前記2以上のアイソトープ標識生体分子を含むものである、上記ステップと、
(c)前記2以上の生体分子のアイソトープ標識の含量、取り込み率及び/若しくはパターン、又は含量及び/若しくはパターンの変化率を測定して前記2以上の生体分子の分子流速を決定するステップと、
(d)前記2以上の生体分子の分子流速を比較して前記2以上の生体分子の相対分子流速を分析するステップと
を含む方法。
【請求項2】
前記アイソトープ標識水が2H2Oである、請求項1に記載の方法。
【請求項3】
前記アイソトープ標識水が、経口、非経口、皮下、血管内、又は腹腔内投与される、請求項1に記載の方法。
【請求項4】
前記アイソトープ標識水が経口投与される、請求項3に記載の方法。
【請求項5】
前記個体がヒトである、請求項1に記載の方法。
【請求項6】
ステップ(b)、(c)及び(d)を実施する前に前記投与ステップ(a)を中段する追加のステップを含む、請求項1に記載の方法。
【請求項7】
前記生体分子が異なる生化学クラスに属する、請求項1に記載の方法。
【請求項8】
前記アイソトープ標識水が単回投与で投与される、請求項1に記載の方法。
【請求項9】
前記標識水の投与が、連続投与、間欠投与、単回投与及び複数回投与から選択される、請求項1に記載の方法。
【請求項10】
前記生体試料が生前に得られる、請求項1に記載の方法。
【請求項11】
前記生体試料が採血、採尿又は生検によって得られる、請求項10に記載の方法。
【請求項12】
複数の生体試料が前記個体から得られる、請求項1に記載の方法。
【請求項13】
前記生体試料が死後採取される、請求項1に記載の方法。
【請求項14】
前記測定ステップ(c)が、前記2以上の生体分子のアイソトープ濃縮を質量アイソトポマー分布分析(MIDA)によって計算し、前駆体−生成物又は指数関数的減衰方程式を適用して前記2以上の生体分子の分子流速を決定することを含む、請求項1に記載の方法。
【請求項15】
測定ステップ(c)の前に前記生体分子を化学的に変換する追加のステップを更に含む、請求項1に記載の方法。
【請求項16】
前記化学変換ステップが前記生体分子を分解することを含む、請求項15に記載の方法。
【請求項17】
前記化学変換ステップが前記生体分子を化学修飾又は誘導体化することを含む、請求項15に記載の方法。
【請求項18】
前記比較ステップ(d)が前記分子流速の比率又はグラフ関係を測定することを含む、請求項1に記載の方法。
【請求項19】
ステップ(c)が液体シンチレーションカウンター、NMR又は質量分析によって前記2以上の生体分子を検出することを含む、請求項1に記載の方法。
【請求項20】
ステップ(c)が質量分析によって前記2以上の生体分子を検出することを含む、請求項19に記載の方法。
【請求項21】
前記2以上の生体分子が第1の生体分子及び第2の生体分子を含み、第1の生体分子がDNAであり、第2の生体分子がタンパク質である、請求項1に記載の方法。
【請求項22】
前記生体試料が、筋肉、肝臓、副腎組織、前立腺組織、結腸組織、子宮内膜組織、皮膚、胸部組織、脂肪組織、結腸、リンパ組織及び脳より選択される群から得られる、請求項21に記載の方法。
【請求項23】
前記DNA及び前記タンパク質が同時に測定される、請求項21に記載の方法。
【請求項24】
前記生体試料が腫瘍細胞を含む、請求項21に記載の方法。
【請求項25】
前記生体試料が細菌を含む、請求項21に記載の方法。
【請求項26】
前記タンパク質が細胞タンパク質であり、前記DNAがミトコンドリアDNAである、請求項21に記載の方法。
【請求項27】
前記タンパク質が細胞タンパク質であり、前記DNAがゲノムDNAである、請求項21に記載の方法。
【請求項28】
第1の生体分子が脂肪組織アシルグリセリドであり、第2の生体分子がタンパク質又はDNAである、請求項21に記載の方法。
【請求項29】
更に第3の生体分子を含み、第2の生体分子がタンパク質であり、第3の生体分子がDNAである、請求項28に記載の方法。
【請求項30】
前記1又は複数の生体試料が体組織から得られる、請求項1に記載の方法。
【請求項31】
前記体組織が、筋肉、肝臓、副腎組織、前立腺組織、結腸組織、子宮内膜組織、皮膚、脂肪組織、胸部組織、結腸、リンパ組織及び脳から選択される、請求項30に記載の方法。
【請求項32】
第1の生体分子が肺コラーゲンであり、第2の生体分子が肺線維芽細胞DNAである、請求項21に記載の方法。
【請求項33】
第1の生体分子がタンパク質であり、第2の生体分子がmRNAである、請求項21に記載の方法。
【請求項34】
第1の生体分子がmRNAであり、第2の生体分子がDNAである、請求項1に記載の方法。
【請求項35】
前記2以上の生体分子が、アポリポタンパク質B、トリグリセリド、リン脂質、コレステロール及びコレステロールエステルから選択される、請求項1に記載の方法。
【請求項36】
前記1又は複数の生体試料が肝臓及び血液から選択される、請求項35に記載の方法。
【請求項37】
第1の生体分子がトリグリセリドのグリセロール部分であり、第2の生体分子がトリグリセリドの脂肪酸部分である、請求項21に記載の方法。
【請求項38】
第1の生体分子がミトコンドリアカルジオリピンであり、第2の生体分子がミトコンドリアDNAである、請求項21に記載の方法。
【請求項39】
第1の生体分子がB細胞DNAであり、第2の生体分子が血漿免疫グロブリンである、請求項21に記載の方法。
【請求項40】
第1の生体分子が真皮コラーゲンであり、第2の生体分子が真皮エラスチンである、請求項21に記載の方法。
【請求項41】
第1の生体分子が皮膚ケラチンであり、第2の生体分子がケラチン生成細胞DNAである、請求項21に記載の方法。
【請求項42】
個体の1又は複数の組織内又は個体内における疾患、障害又は病態の進行を検出、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が前記疾患、障害又は病態を有さない組織又は個体を含むものである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
c)第1及び第2の集団における分子流速の相違を決定して、前記疾患、障害又は病態の進行を検出、予後診断又はモニターするステップと
を含む方法。
【請求項43】
間質性肺線維症の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における、2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が前記間質性肺線維症を有さない組織又は個体を含み、前記2以上の生体分子が肺コラーゲン及び線維芽細胞DNAを含むものである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が肺コラーゲン及び線維芽細胞DNAを含むものである、上記ステップと、
c)第1及び第2の集団の分子流速の相違を決定して、間質性肺線維症の進行を診断、予後診断又はモニターするステップと
を含む方法。
【請求項44】
高脂血症の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が高脂血症を有さない組織又は個体を含み、前記2以上の生体分子がアポリポタンパク質B、トリグリセリド、リン脂質、コレステロールから選択される、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子がアポリポタンパク質B、トリグリセリド、リン脂質、コレステロールから選択される、上記ステップと、
c)第1及び第2の集団の分子流速の相違を決定して、高脂血症の進行を診断、予後診断又はモニターするステップと
を含む方法。
【請求項45】
家族性混合型高脂血症の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が家族性混合型高脂血症を有さない組織及び個体を含み、前記2以上の生体分子が、アポリポタンパク質Bとトリグリセリド、リン脂質、コレステロール及びコレステロールエステルから選択される生体分子である、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
c)第1及び第2の集団の分子流速の相違を決定して、第2の集団における家族性混合型高脂血症の進行を診断、予後診断又はモニターするステップと
を含む方法。
【請求項46】
細胞免疫活性化の障害の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1又は第2の集団が細胞免疫活性化の障害を有さない組織又は個体を含み、前記生体分子がT細胞DNA及び血漿免疫グロブリンである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
c)第1及び第2の集団において比較された分子流速の相違を決定して、細胞免疫活性化の障害の進行を診断、予後診断又はモニターするステップであって、第1の集団と比較した第2の集団において血漿免疫グロブリン分子流速に対してT細胞DNA分子流速が低下していることにより、第2の集団における細胞免疫活性化の障害の進行が同定される、上記ステップと
を含む方法。
【請求項47】
光老化(皮膚のしわ)の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が検出可能な光老化を有さない組織又は個体を含み、前記2以上の生体分子が真皮コラーゲン及び真皮エラスチンである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が真皮コラーゲン及び真皮エラスチンである、上記ステップと、
c)第1及び第2の集団において比較された分子流速の相違を決定して、光老化を診断、予後診断又はモニターするステップであって、第1の集団と比較した第2の集団において真皮エラスチン分子流速に対して真皮コラーゲン分子流速が変化していることにより、第2の集団における光老化の変化が同定されるステップと
を含む方法。
【請求項48】
治療薬の有効性を決定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団の前記1又は複数の組織又は個体が前記治療薬を必要としている、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記治療薬を投与するステップであって、第2の集団の1又は複数の組織又は個体が前記治療薬を必要としている、上記ステップと、
c)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1及び第2の集団において比較された分子流速の相違により、前記治療薬を必要とする組織又は個体における前記治療薬の有効性が測定される、上記ステップと
を含む方法。
【請求項49】
治療薬の有効性を決定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記集団の前記1又は複数の組織又は個体が前記治療薬を必要としている、上記ステップと、
b)前記集団に前記治療薬を投与するステップと、
c)1又は複数の組織又は個体からなる前記集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記治療薬の投与前後に前記集団において比較された分子流速の相違により、前記治療薬を必要とする組織又は個体における前記治療薬の有効性が測定される、上記ステップと
を含む方法。
【請求項50】
化学療法剤の殺腫瘍又は腫瘍静止作用を決定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における、2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が細胞タンパク質及び細胞DNAであり、第1の集団の前記1又は複数の組織又は個体が治療を必要としている、上記ステップと、
b)前記化学療法剤を必要とする1又は複数の組織又は個体からなる第2の集団に対して前記化学療法剤を投与するステップと、
c)第2の集団において前記細胞タンパク質及び細胞DNAの分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と第2の集団の間の相対分子流速の相違により、前記化学療法剤を必要とする組織又は個体において前記化学療法剤が、DNA及びタンパク質の流れに対してほぼ同等の作用を有する場合は殺腫瘍作用があり、タンパク質よりもDNAに対する影響が大きい場合は腫瘍静止作用があることが示される、上記ステップと
を含む方法。
【請求項51】
化学療法剤の殺腫瘍又は腫瘍静止作用を決定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が細胞タンパク質及び細胞DNAであり、前記1又は複数の組織又は個体が前記化学療法剤を必要としている、上記ステップと、
b)前記個体又は集団に前記化学療法剤を投与するステップと、
c)前記化学療法剤の投与後に前記1又は複数の組織又は個体からなる集団における前記2以上の生体分子の分子流速を測定及び比較して前記化学療法剤の殺腫瘍又は腫瘍静止作用を決定するステップと
を含む方法。
【請求項52】
抗生物質の殺生作用又は静止作用を決定する方法であって、
a)前記組織又は個体において1又は複数の感染性生物からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が前記1又は複数の感染性生物に由来するタンパク質及びDNAであり、第1の集団の前記1又は複数の組織又は個体が前記抗生物質を必要としている、上記ステップと、
b)前記組織又は個体における1又は複数の感染性生物からなる第2の集団に対して前記抗生物質を投与するステップであって、第2の集団の前記1又は複数の組織が前記抗生物質を必要としている、上記ステップと、
c)1又は複数の組織又は個体において感染性生物からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
d)感染性生物の第1及び第2の集団において前記2以上の生体分子の相対分子流速の相違を決定して前記抗生物質の殺生作用又は静止作用を決定するステップと
を含む方法。
【請求項53】
治療中の抗生物質の殺生作用又は静止作用を決定する方法であって、
a)前記組織又は個体において1又は複数の感染性生物からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が前記感染性生物に由来するタンパク質及びDNAであり、第1の集団の前記1又は複数の組織又は個体が前記抗生物質を必要としている、上記ステップと、
b)前記集団に対して前記抗生物質を投与するステップであって、前記集団の前記1又は複数の組織又は個体が前記抗生物質を必要としている、上記ステップと、
c)前記1又は複数の組織又は個体において感染性生物からなる前記集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して前記抗生物質の殺生作用又は静止作用を決定するステップと
を含む方法。
【請求項54】
消耗性又は虚弱性の疾患又は障害を有する1又は複数の組織又は個体においてアンドロゲンの治療効果を同定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドであり、第1の集団の前記1又は複数の組織又は個体が前記消耗性又は虚弱性の障害と診断されている、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記アンドロゲンを投与するステップであって、第2の集団の前記1又は複数の組織又は個体が消耗性又は虚弱性の障害と診断されているステップと、
c)前記1又は複数の組織又は個体からなる第2の集団における第1及び第2の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
d)第1及び第2の集団の相対分子流速の相違を決定して、前記アンドロゲンの治療効果を同定するステップと
を含む方法。
【請求項55】
消耗性又は虚弱性の疾患又は障害を有する1又は複数の組織又は個体においてアンドロゲンの治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドであり、前記集団の前記1又は複数の組織又は個体が前記消耗性又は虚弱性の障害と診断されている、上記ステップと、
b)前記集団に前記アンドロゲンを投与するステップと、
c)前記集団において第1及び第2の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記治療薬の投与後の前記集団において前記脂肪組織トリグリセリドの分子流速に対して前記筋肉タンパク質又は筋肉DNAの分子流速が増加していることにより、消耗性又は虚弱性の疾患又は障害における前記アンドロゲンの治療効果が同定される、上記ステップと
を含む方法。
【請求項56】
消耗性又は虚弱性の疾患又は障害における成長因子又はタンパク質同化剤の治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記成長因子又はタンパク質同化剤を投与するステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において第1及び第2の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記脂肪組織トリグリセリドの分子流速に対する前記筋肉タンパク質又は筋肉DNAの分子流速が増加していることにより、消耗性又は虚弱性の疾患又は障害における前記成長因子又はタンパク質同化剤の有益な治療効果が同定される、上記ステップと、
d)第1及び第2の集団において前記2以上の生体分子の相対分子流速の相違を決定して前記成長因子又はタンパク質同化剤の治療効果を同定するステップと
を含む方法。
【請求項57】
消耗性又は虚弱性の疾患又は障害における成長因子又はタンパク質同化剤の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドである、上記ステップと、
b)前記集団に対して前記成長因子又はタンパク質同化剤を投与するステップと、
c)前記成長因子又はタンパク質同化剤の投与後に前記集団において第1及び第2の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記成長因子又はタンパク質同化剤の投与後の前記集団において前記脂肪組織トリグリセリドの分子流速に対する前記筋肉タンパク質又は筋肉DNAの分子流速が増加していることにより、消耗性又は虚弱性の疾患又は障害における前記成長因子又はタンパク質同化剤の有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項58】
乳癌治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が乳房上皮細胞DNA又は子宮内膜細胞DNAであり、第2の生体分子が乳房内のエストロゲン非感受性細胞に由来するタンパク質又はDNAであり、前記エストロゲン非感受性細胞が脂肪細胞、線維芽細胞、間質細胞、内皮細胞又は他の非上皮細胞から選択され、第1の集団の前記1又は複数の組織又は個体が乳癌と診断されている、上記ステップと、
b)前記1又は複数の組織又は個体からなる第2の集団に対して前記SERMを投与するステップであって、第2の集団の前記1又は複数の組織又は個体が乳癌と診断されている、上記ステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団におけるエストロゲン非感受性細胞に由来する前記タンパク質又はDNAの分子流速に対する前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速が減少していることにより、乳癌に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項59】
乳癌治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が乳房上皮細胞DNA又が子宮内膜細胞DNAであり、第2の生体分子が乳房の脂肪細胞、線維芽細胞、間質細胞、内皮細胞及び他の非上皮細胞から選択される乳房内のエストロゲン非感受性細胞に由来するタンパク質又はDNAであり、第1の集団の前記1又は複数の組織又は個体が乳癌と診断されている、上記ステップと、
b)前記組織又は個体からなる集団に前記SERMを投与するステップと、
c)前記組織又は個体からなる集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記SERMの投与後の前記集団において乳房内のエストロゲン非感受性細胞に由来する前記タンパク質又はDNAの分子流速に対して前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速が減少していることにより、乳癌に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項60】
骨粗鬆症治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が骨コラーゲンであり、第2の生体分子が乳房上皮細胞DNA又は子宮内膜細胞DNAであり、第1の集団の前記1又は複数の組織又は個体が骨粗鬆症と診断されている、上記ステップと、
b)前記1又は複数の組織又は個体からなる第2の集団に対して前記SERMを投与するステップであって、前記1又は複数の組織又は個体が骨粗鬆症と診断されている、上記ステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速に対する骨コラーゲンの分子流速が増加していることにより、骨粗鬆症に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項61】
骨粗鬆症治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が骨コラーゲンであり、第2の生体分子が乳房上皮細胞DNA又は子宮内膜細胞DNAであり、前記集団の前記1又は複数の個体が骨粗鬆症と診断されている、上記ステップと、
b)1又は複数の組織又は個体からなる前記集団に対して前記SERMを投与するステップと、
c)前記SERMの投与後に前記集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記SERMの投与後の前記集団において前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速に対して骨コラーゲンの分子流速が増加していることにより、骨粗鬆症に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項62】
アルツハイマー病の治療における治療薬の有効性を測定する方法であって、
a)1つ又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が脳アミロイドβタンパク質であり、第2の生体分子が脳25−ヒドロキシコレステロールであり、前記1又は複数の組織がアルツハイマー病と診断された患者から得られ、あるいは個体がアルツハイマー病と診断されている、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記治療薬を投与するステップであって、前記1又は複数の組織がアルツハイマー病と診断された患者から得られ、或いは個体がアルツハイマー病と診断されている、上記ステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記25−ヒドロキシコレステロールの分子流速に対する前記脳アミロイドβタンパク質の分子流速が減少していることにより、アルツハイマー病の治療における前記治療薬の有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項63】
アルツハイマー病の治療における治療薬の有効性を測定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が脳アミロイドβタンパク質であり、第2の生体分子が脳25−ヒドロキシコレステロールであり、前記1又は複数の組織がアルツハイマー病と診断された患者から得られ、あるいは前記集団の個体がアルツハイマー病と診断されている、上記ステップと、
b)前記1又は複数の組織又は個体からなる前記集団に対して前記治療薬を投与するステップと、
c)前記ホルモン又は他の治療薬の投与後に前記1又は複数の組織又は個体からなる集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記治療薬の投与後に前記集団における前記25−ヒドロキシコレステロールの分子流速に対する前記脳アミロイドβタンパク質の分子流速が減少していることにより、アルツハイマー病の治療における前記治療薬の有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項64】
個体における有酸素運動に対する筋組織の反応を決定する方法であって、
a)2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が細胞タンパク質及びミトコンドリアDNAであり、生体試料が筋組織を含む、上記ステップと、
b)個体に有酸素運動を受けさせることと、
c)前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して前記有酸素運動に対する前記筋組織の反応を決定するステップであって、前記生体試料が筋組織を含み、前記細胞タンパク質の分子流速に対して前記ミトコンドリアDNAの分子流速が増加していることにより有酸素適応性の増加が同定される、上記ステップと
を含む方法。
【請求項65】
組織又は個体におけるタンパク質発現の変化の原因を同定する方法であって、
a)第1の時点で2以上の生体分子の分子流速を、請求項1記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子がタンパク質及び前記タンパク質をコードするmRNA分子である、上記ステップと、
b)第2の時点で前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して前記タンパク質の発現の変化の原因を同定するステップであって、
前記mRNAに対して前記タンパク質の分子流速が増加していることにより翻訳調節の変化が特定され、
前記mRNAに対して前記タンパク質の分子流速が増加していることにより転写調節の変化が特定される、上記ステップと
を含む方法。
【請求項66】
全質量又はタンパク質発現の変化の原因を同定する方法であって、
a)第1の時点で2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が全細胞mRNA及び全細胞DNAである、上記ステップと、
b)第2の時点で前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して全質量又はタンパク質発現の変化の原因を特定するステップであって、
前記DNAの前記分子流速に対して前記mRNAの前記分子流速が増加していることにより、転写が全質量又はタンパク質発現の変化の原因として同定され、
全細胞DNAの前記分子流速に対して全細胞mRNAの前記分子流速が減少していることにより、細胞分裂の変化が全質量又はタンパク質発現の変化の原因として同定される、上記ステップと
を含む方法。
【請求項67】
生物学的因子の治療特性を同定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記生物学的因子を投与するステップと、
c)第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と第2の集団の間で比較された分子流速の相違から前記生物学的因子の治療特性が同定される、上記ステップと
を含む方法。
【請求項68】
生物学的因子の治療特性を同定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は個体の前記集団に対して前記生物学的因子を投与するステップと、
c)前記生物学的因子の投与後に前記集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記集団において前記生物学的因子の投与の前後で比較された分子流速が相違していることにより、前記生物学的因子の治療特性が同定される、上記ステップと
を含む方法。
【請求項69】
前記生体試料が組織培養物である、請求項67に記載の方法。
【請求項70】
前記個体が実験動物である、請求項67に記載の方法。
【請求項71】
前記個体がヒトである、請求項67に記載の方法。
【請求項72】
前記2以上の生体分子の少なくとも1つがDNAである、請求項67に記載の方法。
【請求項73】
前記2以上の生体分子の少なくとも1つがタンパク質である、請求項67に記載の方法。
【請求項74】
請求項67に記載の方法に従ってハイスループットで複数の生物学的因子をスクリーニングする方法。
【請求項75】
生物学的因子の1又は複数の毒性作用を決定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は生体分子(個体)からなる第2の集団に対して前記生物学的因子を投与するステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における第2の生体分子に対する第1の生体分子の分子流速が相違することにより、前記生物学的因子の毒性作用が同定される、、上記ステップと
を含む方法。
【請求項76】
1又は複数の化合物の毒性作用を決定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)前記集団に前記1又は複数の化合物を投与するステップと、
c)前記1又は複数の化合物の投与後に前記集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記1又は複数の化合物の投与前後の前記集団において第2の生体分子に対する第1の生体分子の分子流速が相違することにより、前記1又は複数の化合物の毒性作用が同定される、上記ステップと
を含む方法。
【請求項77】
治療標的を同定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は生体分子(個体)からなる第2の集団に対して1又は複数の化合物を投与するステップと、
c)1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記2以上の生体分子の分子流速が相違することにより治療標的が同定される、上記ステップと
を含む方法。
【請求項78】
治療標的を同定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)前記集団に1又は複数の化合物を投与するステップと、
c)前記1又は複数の化合物の投与後に1又は複数の組織又は個体の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記集団において前記1又は複数の化合物の投与の前後で比較された前記2以上の生体分子の分子流速が相違することにより治療標的が同定される、上記ステップと
を含む方法。
【請求項79】
1又は複数の組織又は個体において2以上の生体分子の相対分子流速を測定及び比較するためのキットであって、
a)標識水、及び
b)前記標識水を組織又は個体に投与するための1又は複数の手段
を含み、前記組織又は個体における前記2以上の生体分子の相対分子流速を測定及び比較するために使用されるキット。
【請求項80】
前記1又は複数の生体分子を尿、骨又は筋肉から単離するための化学化合物を更に含む、請求項79に記載のキット。
【請求項81】
前駆体分子の投与のための手段を更に含む、請求項79に記載のキット。
【請求項82】
被験体から試料を採取するための器具を更に含む、請求項79に記載のキット。
【請求項83】
請求項1に記載の方法によって生成された、アイソトープで不安定化された分子。
【請求項84】
タンパク質、脂質、核酸、グリコサミノグリカン、プロテオグリカン、ポルフィリン及び炭水化物分子から選択される、請求項83に記載のアイソトープで不安定化された分子。
【請求項1】
1又は複数の組織又は個体において2以上の生体分子の相対分子流速を分析する方法であって、
(a)アイソトープ標識水を、前記標識がin vivoで2以上の生体分子に取り込まれて2以上のアイソトープ標識生体分子を形成するのに十分な時間にわたり、1又は複数の組織又は個体に投与するステップと、
(b)1又は複数の生体試料を前記1又は複数の組織又は個体から得るステップであって、前記1又は複数の生体試料が共に前記2以上のアイソトープ標識生体分子を含むものである、上記ステップと、
(c)前記2以上の生体分子のアイソトープ標識の含量、取り込み率及び/若しくはパターン、又は含量及び/若しくはパターンの変化率を測定して前記2以上の生体分子の分子流速を決定するステップと、
(d)前記2以上の生体分子の分子流速を比較して前記2以上の生体分子の相対分子流速を分析するステップと
を含む方法。
【請求項2】
前記アイソトープ標識水が2H2Oである、請求項1に記載の方法。
【請求項3】
前記アイソトープ標識水が、経口、非経口、皮下、血管内、又は腹腔内投与される、請求項1に記載の方法。
【請求項4】
前記アイソトープ標識水が経口投与される、請求項3に記載の方法。
【請求項5】
前記個体がヒトである、請求項1に記載の方法。
【請求項6】
ステップ(b)、(c)及び(d)を実施する前に前記投与ステップ(a)を中段する追加のステップを含む、請求項1に記載の方法。
【請求項7】
前記生体分子が異なる生化学クラスに属する、請求項1に記載の方法。
【請求項8】
前記アイソトープ標識水が単回投与で投与される、請求項1に記載の方法。
【請求項9】
前記標識水の投与が、連続投与、間欠投与、単回投与及び複数回投与から選択される、請求項1に記載の方法。
【請求項10】
前記生体試料が生前に得られる、請求項1に記載の方法。
【請求項11】
前記生体試料が採血、採尿又は生検によって得られる、請求項10に記載の方法。
【請求項12】
複数の生体試料が前記個体から得られる、請求項1に記載の方法。
【請求項13】
前記生体試料が死後採取される、請求項1に記載の方法。
【請求項14】
前記測定ステップ(c)が、前記2以上の生体分子のアイソトープ濃縮を質量アイソトポマー分布分析(MIDA)によって計算し、前駆体−生成物又は指数関数的減衰方程式を適用して前記2以上の生体分子の分子流速を決定することを含む、請求項1に記載の方法。
【請求項15】
測定ステップ(c)の前に前記生体分子を化学的に変換する追加のステップを更に含む、請求項1に記載の方法。
【請求項16】
前記化学変換ステップが前記生体分子を分解することを含む、請求項15に記載の方法。
【請求項17】
前記化学変換ステップが前記生体分子を化学修飾又は誘導体化することを含む、請求項15に記載の方法。
【請求項18】
前記比較ステップ(d)が前記分子流速の比率又はグラフ関係を測定することを含む、請求項1に記載の方法。
【請求項19】
ステップ(c)が液体シンチレーションカウンター、NMR又は質量分析によって前記2以上の生体分子を検出することを含む、請求項1に記載の方法。
【請求項20】
ステップ(c)が質量分析によって前記2以上の生体分子を検出することを含む、請求項19に記載の方法。
【請求項21】
前記2以上の生体分子が第1の生体分子及び第2の生体分子を含み、第1の生体分子がDNAであり、第2の生体分子がタンパク質である、請求項1に記載の方法。
【請求項22】
前記生体試料が、筋肉、肝臓、副腎組織、前立腺組織、結腸組織、子宮内膜組織、皮膚、胸部組織、脂肪組織、結腸、リンパ組織及び脳より選択される群から得られる、請求項21に記載の方法。
【請求項23】
前記DNA及び前記タンパク質が同時に測定される、請求項21に記載の方法。
【請求項24】
前記生体試料が腫瘍細胞を含む、請求項21に記載の方法。
【請求項25】
前記生体試料が細菌を含む、請求項21に記載の方法。
【請求項26】
前記タンパク質が細胞タンパク質であり、前記DNAがミトコンドリアDNAである、請求項21に記載の方法。
【請求項27】
前記タンパク質が細胞タンパク質であり、前記DNAがゲノムDNAである、請求項21に記載の方法。
【請求項28】
第1の生体分子が脂肪組織アシルグリセリドであり、第2の生体分子がタンパク質又はDNAである、請求項21に記載の方法。
【請求項29】
更に第3の生体分子を含み、第2の生体分子がタンパク質であり、第3の生体分子がDNAである、請求項28に記載の方法。
【請求項30】
前記1又は複数の生体試料が体組織から得られる、請求項1に記載の方法。
【請求項31】
前記体組織が、筋肉、肝臓、副腎組織、前立腺組織、結腸組織、子宮内膜組織、皮膚、脂肪組織、胸部組織、結腸、リンパ組織及び脳から選択される、請求項30に記載の方法。
【請求項32】
第1の生体分子が肺コラーゲンであり、第2の生体分子が肺線維芽細胞DNAである、請求項21に記載の方法。
【請求項33】
第1の生体分子がタンパク質であり、第2の生体分子がmRNAである、請求項21に記載の方法。
【請求項34】
第1の生体分子がmRNAであり、第2の生体分子がDNAである、請求項1に記載の方法。
【請求項35】
前記2以上の生体分子が、アポリポタンパク質B、トリグリセリド、リン脂質、コレステロール及びコレステロールエステルから選択される、請求項1に記載の方法。
【請求項36】
前記1又は複数の生体試料が肝臓及び血液から選択される、請求項35に記載の方法。
【請求項37】
第1の生体分子がトリグリセリドのグリセロール部分であり、第2の生体分子がトリグリセリドの脂肪酸部分である、請求項21に記載の方法。
【請求項38】
第1の生体分子がミトコンドリアカルジオリピンであり、第2の生体分子がミトコンドリアDNAである、請求項21に記載の方法。
【請求項39】
第1の生体分子がB細胞DNAであり、第2の生体分子が血漿免疫グロブリンである、請求項21に記載の方法。
【請求項40】
第1の生体分子が真皮コラーゲンであり、第2の生体分子が真皮エラスチンである、請求項21に記載の方法。
【請求項41】
第1の生体分子が皮膚ケラチンであり、第2の生体分子がケラチン生成細胞DNAである、請求項21に記載の方法。
【請求項42】
個体の1又は複数の組織内又は個体内における疾患、障害又は病態の進行を検出、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が前記疾患、障害又は病態を有さない組織又は個体を含むものである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
c)第1及び第2の集団における分子流速の相違を決定して、前記疾患、障害又は病態の進行を検出、予後診断又はモニターするステップと
を含む方法。
【請求項43】
間質性肺線維症の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における、2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が前記間質性肺線維症を有さない組織又は個体を含み、前記2以上の生体分子が肺コラーゲン及び線維芽細胞DNAを含むものである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が肺コラーゲン及び線維芽細胞DNAを含むものである、上記ステップと、
c)第1及び第2の集団の分子流速の相違を決定して、間質性肺線維症の進行を診断、予後診断又はモニターするステップと
を含む方法。
【請求項44】
高脂血症の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が高脂血症を有さない組織又は個体を含み、前記2以上の生体分子がアポリポタンパク質B、トリグリセリド、リン脂質、コレステロールから選択される、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子がアポリポタンパク質B、トリグリセリド、リン脂質、コレステロールから選択される、上記ステップと、
c)第1及び第2の集団の分子流速の相違を決定して、高脂血症の進行を診断、予後診断又はモニターするステップと
を含む方法。
【請求項45】
家族性混合型高脂血症の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が家族性混合型高脂血症を有さない組織及び個体を含み、前記2以上の生体分子が、アポリポタンパク質Bとトリグリセリド、リン脂質、コレステロール及びコレステロールエステルから選択される生体分子である、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
c)第1及び第2の集団の分子流速の相違を決定して、第2の集団における家族性混合型高脂血症の進行を診断、予後診断又はモニターするステップと
を含む方法。
【請求項46】
細胞免疫活性化の障害の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1又は第2の集団が細胞免疫活性化の障害を有さない組織又は個体を含み、前記生体分子がT細胞DNA及び血漿免疫グロブリンである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
c)第1及び第2の集団において比較された分子流速の相違を決定して、細胞免疫活性化の障害の進行を診断、予後診断又はモニターするステップであって、第1の集団と比較した第2の集団において血漿免疫グロブリン分子流速に対してT細胞DNA分子流速が低下していることにより、第2の集団における細胞免疫活性化の障害の進行が同定される、上記ステップと
を含む方法。
【請求項47】
光老化(皮膚のしわ)の進行を診断、予後診断又はモニターする方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団が検出可能な光老化を有さない組織又は個体を含み、前記2以上の生体分子が真皮コラーゲン及び真皮エラスチンである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が真皮コラーゲン及び真皮エラスチンである、上記ステップと、
c)第1及び第2の集団において比較された分子流速の相違を決定して、光老化を診断、予後診断又はモニターするステップであって、第1の集団と比較した第2の集団において真皮エラスチン分子流速に対して真皮コラーゲン分子流速が変化していることにより、第2の集団における光老化の変化が同定されるステップと
を含む方法。
【請求項48】
治療薬の有効性を決定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団の前記1又は複数の組織又は個体が前記治療薬を必要としている、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記治療薬を投与するステップであって、第2の集団の1又は複数の組織又は個体が前記治療薬を必要としている、上記ステップと、
c)1又は複数の組織又は個体からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1及び第2の集団において比較された分子流速の相違により、前記治療薬を必要とする組織又は個体における前記治療薬の有効性が測定される、上記ステップと
を含む方法。
【請求項49】
治療薬の有効性を決定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記集団の前記1又は複数の組織又は個体が前記治療薬を必要としている、上記ステップと、
b)前記集団に前記治療薬を投与するステップと、
c)1又は複数の組織又は個体からなる前記集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記治療薬の投与前後に前記集団において比較された分子流速の相違により、前記治療薬を必要とする組織又は個体における前記治療薬の有効性が測定される、上記ステップと
を含む方法。
【請求項50】
化学療法剤の殺腫瘍又は腫瘍静止作用を決定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における、2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が細胞タンパク質及び細胞DNAであり、第1の集団の前記1又は複数の組織又は個体が治療を必要としている、上記ステップと、
b)前記化学療法剤を必要とする1又は複数の組織又は個体からなる第2の集団に対して前記化学療法剤を投与するステップと、
c)第2の集団において前記細胞タンパク質及び細胞DNAの分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と第2の集団の間の相対分子流速の相違により、前記化学療法剤を必要とする組織又は個体において前記化学療法剤が、DNA及びタンパク質の流れに対してほぼ同等の作用を有する場合は殺腫瘍作用があり、タンパク質よりもDNAに対する影響が大きい場合は腫瘍静止作用があることが示される、上記ステップと
を含む方法。
【請求項51】
化学療法剤の殺腫瘍又は腫瘍静止作用を決定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が細胞タンパク質及び細胞DNAであり、前記1又は複数の組織又は個体が前記化学療法剤を必要としている、上記ステップと、
b)前記個体又は集団に前記化学療法剤を投与するステップと、
c)前記化学療法剤の投与後に前記1又は複数の組織又は個体からなる集団における前記2以上の生体分子の分子流速を測定及び比較して前記化学療法剤の殺腫瘍又は腫瘍静止作用を決定するステップと
を含む方法。
【請求項52】
抗生物質の殺生作用又は静止作用を決定する方法であって、
a)前記組織又は個体において1又は複数の感染性生物からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が前記1又は複数の感染性生物に由来するタンパク質及びDNAであり、第1の集団の前記1又は複数の組織又は個体が前記抗生物質を必要としている、上記ステップと、
b)前記組織又は個体における1又は複数の感染性生物からなる第2の集団に対して前記抗生物質を投与するステップであって、第2の集団の前記1又は複数の組織が前記抗生物質を必要としている、上記ステップと、
c)1又は複数の組織又は個体において感染性生物からなる第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
d)感染性生物の第1及び第2の集団において前記2以上の生体分子の相対分子流速の相違を決定して前記抗生物質の殺生作用又は静止作用を決定するステップと
を含む方法。
【請求項53】
治療中の抗生物質の殺生作用又は静止作用を決定する方法であって、
a)前記組織又は個体において1又は複数の感染性生物からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が前記感染性生物に由来するタンパク質及びDNAであり、第1の集団の前記1又は複数の組織又は個体が前記抗生物質を必要としている、上記ステップと、
b)前記集団に対して前記抗生物質を投与するステップであって、前記集団の前記1又は複数の組織又は個体が前記抗生物質を必要としている、上記ステップと、
c)前記1又は複数の組織又は個体において感染性生物からなる前記集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して前記抗生物質の殺生作用又は静止作用を決定するステップと
を含む方法。
【請求項54】
消耗性又は虚弱性の疾患又は障害を有する1又は複数の組織又は個体においてアンドロゲンの治療効果を同定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドであり、第1の集団の前記1又は複数の組織又は個体が前記消耗性又は虚弱性の障害と診断されている、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記アンドロゲンを投与するステップであって、第2の集団の前記1又は複数の組織又は個体が消耗性又は虚弱性の障害と診断されているステップと、
c)前記1又は複数の組織又は個体からなる第2の集団における第1及び第2の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
d)第1及び第2の集団の相対分子流速の相違を決定して、前記アンドロゲンの治療効果を同定するステップと
を含む方法。
【請求項55】
消耗性又は虚弱性の疾患又は障害を有する1又は複数の組織又は個体においてアンドロゲンの治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドであり、前記集団の前記1又は複数の組織又は個体が前記消耗性又は虚弱性の障害と診断されている、上記ステップと、
b)前記集団に前記アンドロゲンを投与するステップと、
c)前記集団において第1及び第2の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記治療薬の投与後の前記集団において前記脂肪組織トリグリセリドの分子流速に対して前記筋肉タンパク質又は筋肉DNAの分子流速が増加していることにより、消耗性又は虚弱性の疾患又は障害における前記アンドロゲンの治療効果が同定される、上記ステップと
を含む方法。
【請求項56】
消耗性又は虚弱性の疾患又は障害における成長因子又はタンパク質同化剤の治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドである、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記成長因子又はタンパク質同化剤を投与するステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において第1及び第2の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記脂肪組織トリグリセリドの分子流速に対する前記筋肉タンパク質又は筋肉DNAの分子流速が増加していることにより、消耗性又は虚弱性の疾患又は障害における前記成長因子又はタンパク質同化剤の有益な治療効果が同定される、上記ステップと、
d)第1及び第2の集団において前記2以上の生体分子の相対分子流速の相違を決定して前記成長因子又はタンパク質同化剤の治療効果を同定するステップと
を含む方法。
【請求項57】
消耗性又は虚弱性の疾患又は障害における成長因子又はタンパク質同化剤の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が筋肉タンパク質又は筋肉DNAであり、第2の生体分子が脂肪組織トリグリセリドである、上記ステップと、
b)前記集団に対して前記成長因子又はタンパク質同化剤を投与するステップと、
c)前記成長因子又はタンパク質同化剤の投与後に前記集団において第1及び第2の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記成長因子又はタンパク質同化剤の投与後の前記集団において前記脂肪組織トリグリセリドの分子流速に対する前記筋肉タンパク質又は筋肉DNAの分子流速が増加していることにより、消耗性又は虚弱性の疾患又は障害における前記成長因子又はタンパク質同化剤の有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項58】
乳癌治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が乳房上皮細胞DNA又は子宮内膜細胞DNAであり、第2の生体分子が乳房内のエストロゲン非感受性細胞に由来するタンパク質又はDNAであり、前記エストロゲン非感受性細胞が脂肪細胞、線維芽細胞、間質細胞、内皮細胞又は他の非上皮細胞から選択され、第1の集団の前記1又は複数の組織又は個体が乳癌と診断されている、上記ステップと、
b)前記1又は複数の組織又は個体からなる第2の集団に対して前記SERMを投与するステップであって、第2の集団の前記1又は複数の組織又は個体が乳癌と診断されている、上記ステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団におけるエストロゲン非感受性細胞に由来する前記タンパク質又はDNAの分子流速に対する前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速が減少していることにより、乳癌に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項59】
乳癌治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が乳房上皮細胞DNA又が子宮内膜細胞DNAであり、第2の生体分子が乳房の脂肪細胞、線維芽細胞、間質細胞、内皮細胞及び他の非上皮細胞から選択される乳房内のエストロゲン非感受性細胞に由来するタンパク質又はDNAであり、第1の集団の前記1又は複数の組織又は個体が乳癌と診断されている、上記ステップと、
b)前記組織又は個体からなる集団に前記SERMを投与するステップと、
c)前記組織又は個体からなる集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記SERMの投与後の前記集団において乳房内のエストロゲン非感受性細胞に由来する前記タンパク質又はDNAの分子流速に対して前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速が減少していることにより、乳癌に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項60】
骨粗鬆症治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が骨コラーゲンであり、第2の生体分子が乳房上皮細胞DNA又は子宮内膜細胞DNAであり、第1の集団の前記1又は複数の組織又は個体が骨粗鬆症と診断されている、上記ステップと、
b)前記1又は複数の組織又は個体からなる第2の集団に対して前記SERMを投与するステップであって、前記1又は複数の組織又は個体が骨粗鬆症と診断されている、上記ステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速に対する骨コラーゲンの分子流速が増加していることにより、骨粗鬆症に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項61】
骨粗鬆症治療における選択的エストロゲン受容体モジュレーター(SERM)の有益な治療効果を同定する方法であって、
a)前記1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が骨コラーゲンであり、第2の生体分子が乳房上皮細胞DNA又は子宮内膜細胞DNAであり、前記集団の前記1又は複数の個体が骨粗鬆症と診断されている、上記ステップと、
b)1又は複数の組織又は個体からなる前記集団に対して前記SERMを投与するステップと、
c)前記SERMの投与後に前記集団において前記2以上の生体分子の相対分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記SERMの投与後の前記集団において前記乳房上皮細胞DNA又は子宮内膜細胞DNAの分子流速に対して骨コラーゲンの分子流速が増加していることにより、骨粗鬆症に対する前記SERMの有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項62】
アルツハイマー病の治療における治療薬の有効性を測定する方法であって、
a)1つ又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が脳アミロイドβタンパク質であり、第2の生体分子が脳25−ヒドロキシコレステロールであり、前記1又は複数の組織がアルツハイマー病と診断された患者から得られ、あるいは個体がアルツハイマー病と診断されている、上記ステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記治療薬を投与するステップであって、前記1又は複数の組織がアルツハイマー病と診断された患者から得られ、或いは個体がアルツハイマー病と診断されている、上記ステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記25−ヒドロキシコレステロールの分子流速に対する前記脳アミロイドβタンパク質の分子流速が減少していることにより、アルツハイマー病の治療における前記治療薬の有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項63】
アルツハイマー病の治療における治療薬の有効性を測定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の生体分子が脳アミロイドβタンパク質であり、第2の生体分子が脳25−ヒドロキシコレステロールであり、前記1又は複数の組織がアルツハイマー病と診断された患者から得られ、あるいは前記集団の個体がアルツハイマー病と診断されている、上記ステップと、
b)前記1又は複数の組織又は個体からなる前記集団に対して前記治療薬を投与するステップと、
c)前記ホルモン又は他の治療薬の投与後に前記1又は複数の組織又は個体からなる集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記治療薬の投与後に前記集団における前記25−ヒドロキシコレステロールの分子流速に対する前記脳アミロイドβタンパク質の分子流速が減少していることにより、アルツハイマー病の治療における前記治療薬の有益な治療効果が同定される、上記ステップと
を含む方法。
【請求項64】
個体における有酸素運動に対する筋組織の反応を決定する方法であって、
a)2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が細胞タンパク質及びミトコンドリアDNAであり、生体試料が筋組織を含む、上記ステップと、
b)個体に有酸素運動を受けさせることと、
c)前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して前記有酸素運動に対する前記筋組織の反応を決定するステップであって、前記生体試料が筋組織を含み、前記細胞タンパク質の分子流速に対して前記ミトコンドリアDNAの分子流速が増加していることにより有酸素適応性の増加が同定される、上記ステップと
を含む方法。
【請求項65】
組織又は個体におけるタンパク質発現の変化の原因を同定する方法であって、
a)第1の時点で2以上の生体分子の分子流速を、請求項1記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子がタンパク質及び前記タンパク質をコードするmRNA分子である、上記ステップと、
b)第2の時点で前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して前記タンパク質の発現の変化の原因を同定するステップであって、
前記mRNAに対して前記タンパク質の分子流速が増加していることにより翻訳調節の変化が特定され、
前記mRNAに対して前記タンパク質の分子流速が増加していることにより転写調節の変化が特定される、上記ステップと
を含む方法。
【請求項66】
全質量又はタンパク質発現の変化の原因を同定する方法であって、
a)第1の時点で2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記2以上の生体分子が全細胞mRNA及び全細胞DNAである、上記ステップと、
b)第2の時点で前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較して全質量又はタンパク質発現の変化の原因を特定するステップであって、
前記DNAの前記分子流速に対して前記mRNAの前記分子流速が増加していることにより、転写が全質量又はタンパク質発現の変化の原因として同定され、
全細胞DNAの前記分子流速に対して全細胞mRNAの前記分子流速が減少していることにより、細胞分裂の変化が全質量又はタンパク質発現の変化の原因として同定される、上記ステップと
を含む方法。
【請求項67】
生物学的因子の治療特性を同定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は個体からなる第2の集団に対して前記生物学的因子を投与するステップと、
c)第2の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と第2の集団の間で比較された分子流速の相違から前記生物学的因子の治療特性が同定される、上記ステップと
を含む方法。
【請求項68】
生物学的因子の治療特性を同定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は個体の前記集団に対して前記生物学的因子を投与するステップと、
c)前記生物学的因子の投与後に前記集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記集団において前記生物学的因子の投与の前後で比較された分子流速が相違していることにより、前記生物学的因子の治療特性が同定される、上記ステップと
を含む方法。
【請求項69】
前記生体試料が組織培養物である、請求項67に記載の方法。
【請求項70】
前記個体が実験動物である、請求項67に記載の方法。
【請求項71】
前記個体がヒトである、請求項67に記載の方法。
【請求項72】
前記2以上の生体分子の少なくとも1つがDNAである、請求項67に記載の方法。
【請求項73】
前記2以上の生体分子の少なくとも1つがタンパク質である、請求項67に記載の方法。
【請求項74】
請求項67に記載の方法に従ってハイスループットで複数の生物学的因子をスクリーニングする方法。
【請求項75】
生物学的因子の1又は複数の毒性作用を決定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は生体分子(個体)からなる第2の集団に対して前記生物学的因子を投与するステップと、
c)前記1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における第2の生体分子に対する第1の生体分子の分子流速が相違することにより、前記生物学的因子の毒性作用が同定される、、上記ステップと
を含む方法。
【請求項76】
1又は複数の化合物の毒性作用を決定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)前記集団に前記1又は複数の化合物を投与するステップと、
c)前記1又は複数の化合物の投与後に前記集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記1又は複数の化合物の投与前後の前記集団において第2の生体分子に対する第1の生体分子の分子流速が相違することにより、前記1又は複数の化合物の毒性作用が同定される、上記ステップと
を含む方法。
【請求項77】
治療標的を同定する方法であって、
a)1又は複数の組織又は個体からなる第1の集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)1又は複数の組織又は生体分子(個体)からなる第2の集団に対して1又は複数の化合物を投与するステップと、
c)1又は複数の組織又は個体からなる第2の集団において前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、第1の集団と比較した第2の集団における前記2以上の生体分子の分子流速が相違することにより治療標的が同定される、上記ステップと
を含む方法。
【請求項78】
治療標的を同定する方法であって、
a)1又は複数の組織又は個体からなる集団における2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップと、
b)前記集団に1又は複数の化合物を投与するステップと、
c)前記1又は複数の化合物の投与後に1又は複数の組織又は個体の集団における前記2以上の生体分子の分子流速を、請求項1に記載の方法に従って測定及び比較するステップであって、前記集団において前記1又は複数の化合物の投与の前後で比較された前記2以上の生体分子の分子流速が相違することにより治療標的が同定される、上記ステップと
を含む方法。
【請求項79】
1又は複数の組織又は個体において2以上の生体分子の相対分子流速を測定及び比較するためのキットであって、
a)標識水、及び
b)前記標識水を組織又は個体に投与するための1又は複数の手段
を含み、前記組織又は個体における前記2以上の生体分子の相対分子流速を測定及び比較するために使用されるキット。
【請求項80】
前記1又は複数の生体分子を尿、骨又は筋肉から単離するための化学化合物を更に含む、請求項79に記載のキット。
【請求項81】
前駆体分子の投与のための手段を更に含む、請求項79に記載のキット。
【請求項82】
被験体から試料を採取するための器具を更に含む、請求項79に記載のキット。
【請求項83】
請求項1に記載の方法によって生成された、アイソトープで不安定化された分子。
【請求項84】
タンパク質、脂質、核酸、グリコサミノグリカン、プロテオグリカン、ポルフィリン及び炭水化物分子から選択される、請求項83に記載のアイソトープで不安定化された分子。
【図1A】


【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公表番号】特表2007−524835(P2007−524835A)
【公表日】平成19年8月30日(2007.8.30)
【国際特許分類】
【出願番号】特願2006−517808(P2006−517808)
【出願日】平成16年6月29日(2004.6.29)
【国際出願番号】PCT/US2004/021063
【国際公開番号】WO2005/033652
【国際公開日】平成17年4月14日(2005.4.14)
【出願人】(592130699)ザ・レジェンツ・オブ・ザ・ユニバーシティ・オブ・カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
【公表日】平成19年8月30日(2007.8.30)
【国際特許分類】
【出願日】平成16年6月29日(2004.6.29)
【国際出願番号】PCT/US2004/021063
【国際公開番号】WO2005/033652
【国際公開日】平成17年4月14日(2005.4.14)
【出願人】(592130699)ザ・レジェンツ・オブ・ザ・ユニバーシティ・オブ・カリフォルニア (364)
【氏名又は名称原語表記】The Regents of The University of California
【Fターム(参考)】
[ Back to top ]

