junB遺伝子発現促進剤
【課題】発がん抑制剤として応用が期待される、新規なjunB遺伝子発現促進剤を提供する。
【解決手段】グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を、junB遺伝子発現促進剤の成分として用いる。
【解決手段】グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を、junB遺伝子発現促進剤の成分として用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、がんを抑制する因子であるjunB遺伝子の発現促進剤に関する。
【背景技術】
【0002】
現在、日本人の死亡原因の第一位であり、その3割強を占めているがんの中には、近年の研究により、治療薬や治療法が確立され、治癒率の高いがんもある一方で、根本的な治療薬や治療法がないがんも多い。これは、がん発症のメカニズムは多様である一方で、これまでに確立された治療薬や治療法は、特定のメカニズムにのみ有効である場合が多いためである。
がん発症のメカニズムとして、c-jun遺伝子が関与するメカニズムが知られている。c-jun遺伝子の産物であるJUNタンパク質は、FOSやRAF等のタンパク質と転写調節因子AP1複合体を形成し、細胞の分化や増殖を促進し、細胞のがん化を促すことが知られている(非特許文献1)。
junB遺伝子は、c-jun遺伝子と同じくjun遺伝子ファミリーに属しており、junB遺伝子の産物であるJUNBタンパク質は、JUNタンパク質と類似の構造を有し、一部共通の機能も有する(非特許文献2)。しかしながら、JUNBタンパク質は、JNK(c-jun n-terminal kinase)結合部位を有しないため、JNKにより活性化されない。そのため、JUNBタンパク質の発現量が増大すれば、JUNタンパク質によるAP1複合体形成が阻害され、細胞のがん化が抑制されることが知られている(非特許文献3)。すなわち、junB遺伝子はがん抑制遺伝子として働くことが明らかになっている(非特許文献3、4など)。また、皮膚疾患の1つである乾癬症では、患部においてjunB遺伝子の発現が低下していることなども知られている(非特許文献5)。また、全身性炎症反応症候群(systemic inflammatory response syndrome: SIRS)の病態においては、JUNタンパク質やFOSタンパク質により転写調節因子AP1転写領域が活性化されていることが知られている(非特許文献6)。
【0003】
グリチルリチン(グリチルリチン酸)は、グリチルレチン酸と2分子のグルクロン酸とからなる化合物であり、抗炎症作用(抗アレルギー作用、アラキドンサン代謝系酵素の阻害作用)を有することが知られている。また、該化合物は、消化器の潰瘍治癒作用、免疫調節作用、肝細胞障害抑制作用、解毒作用、ウイルス増殖抑制・不活化作用等を有することも知られている。該化合物は、特に、肝臓疾患用剤(非特許文献7)、及びアレルギー用薬としては、広く臨床領域で用いられている。また、該化合物は、肝がん発症を抑制することが知られている。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Eferl R. et al., Liver tumor development, c-jun antagonizes the proapoptotic activity of p53, Cell, 2003, 112, 181-92
【非特許文献2】Passegue E. et al., JunB can substitute for Jun in mouse development and cell proliferation, Nat. Genet., 2002, 30, 158-66
【非特許文献3】Shaulian E. et al., AP-1in cell proliferation and survival, Oncogene, 2001, 20, 2390-400
【非特許文献4】Zenz R. et al., Jun signaling in the epidermis: From developmental defects to psoriasis and skin tumors, Int, J. Biochem. Cell Biol., 2006, 38, 1043-9
【非特許文献5】Zenz R. et al., Psoriasis-like skin disease and arthritis caused by inducible epidermal deletion of Jun proteins, NATURE, 2005, 437, 15
【非特許文献6】松田直之、周術期炎症管理の戦略−炎症に対する遺伝子治療−、フォーラム富山「創薬」第22回研究会 講演要旨、2007年(http://www.sugitani.u-toyama.ac.jp/sangaku/forum/souyaku22/2.matsuda.pdf)
【非特許文献7】Suzuki H. et al., Effects of glycyrrhizin on biochemical tests in patients with chronic hepatitis, Double blind trial, ASIAN MED. J., 1983, 26, 423-438
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、新規なjunB遺伝子発現促進剤を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、上記課題を解決すべく、種々の化合物について、junB遺伝子の発現量への影響を研究してきた結果、グリチルリチンモノアンモニウム(MAG)が、junB遺伝子の発現を促進し、JUNBタンパク質の産生を促進する作用を有することを見い出し、本発明を完成させた。
すなわち、本発明は、以下のとおりである。
【0007】
(1)グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を含む、junB遺伝子発現促進剤。
(2)前記薬学上許容される塩が、グリチルリチンモノアンモニウムである、(1)に記載のjunB遺伝子発現促進剤。
【発明の効果】
【0008】
本発明のjunB遺伝子発現促進剤は、junB遺伝子の発現を有意に促進し、JUNBタンパク質の発現量を増大させる。一方、本発明のjunB遺伝子発現促進剤は、c-jun遺伝子の産物であるJUNタンパク質の発現量には影響を与えない。従って、本発明のjunB遺伝子発現促進剤は、JUNタンパク質によるAP1複合体の形成を阻害することができ、細胞のがん化の抑制、SIRSの治療などに有効である。
【図面の簡単な説明】
【0009】
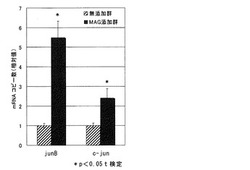
【図1】グリチルリチンモノアンモニウム(MAG)添加群における、junB及びc-junのmRNAコピー数を示す図である。
【図2】MAG添加群における、JUNBタンパク質及びJUNタンパク質の発現量を示す図(写真)である。
【図3】MAG添加群における、junB遺伝子プロモーター活性(ルシフェラーゼアッセイの結果)を示す図である。
【図4】MAG添加群における、junB mRNAコピー数に与えるMAPK阻害剤の添加の影響を示す図である。
【図5】MAG添加群における、junB mRNAコピー数に与えるJAK阻害剤の添加の影響を示す図である。
【図6】MAG添加群における、junB mRNAコピー数に与えるPKC阻害剤の添加の影響を示す図である。
【発明を実施するための形態】
【0010】
本発明のjunB遺伝子発現促進剤は、グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を含む。
【0011】
本発明のjunB遺伝子発現促進剤において、グリチルリチンは、例えば、甘草から常法により抽出して用いることができる。また、市販品を用いてもよい。
グリチルリチンの薬学上許容される塩としては、グリチルリチンモノアンモニウム、グリチルリチンジアンモニウム;グリチルリチンモノナトリウム、グリチルリチンジナトリウム、グリチルリチンモノカリウム、グリチルリチンジカリウム等のアルカリ金属塩;あるいは、グリチルリチンコリン等を挙げることができる。さらにこれら以外にも、カルシウム塩、マグネシウム塩、アルミニウム塩等も用いることができる。好ましくは、グリチルリチンモノアンモニウムが用いられる。
また、グリチルリチン及びその薬学上許容される塩から選ばれる化合物は、単独で、又は2種以上を組み合わせて用いることができる。
【0012】
本発明のjunB遺伝子発現促進剤の剤形は、特に限定されず、錠剤、散剤、顆粒剤、カプセル剤、細粒剤、水薬等の経口剤、吸入剤、座剤あるいは注射剤等の非経口剤とすることができる。これらは、常法により製造できる。
【0013】
本発明のjunB遺伝子発現促進剤は、必要に応じて、賦形剤、滑沢剤、可塑剤、界面活性剤、結合剤、崩壊剤、湿潤剤、安定剤、矯味剤、防腐剤、着色剤、香料、緩衝剤等を配合し、製剤化することができる。
【0014】
本発明のjunB遺伝子発現促進剤におけるグリチルリチン及びその薬学上許容される塩から選ばれる化合物の含有量は、投与対象等によって適宜調節される。
【0015】
本発明のjunB遺伝子発現促進剤の投与方法としては、経口、非経口のいずれでもよい。投与量は、患者の年齢、症状等により適宜選択することができる。
【0016】
上述したように、junB遺伝子の発現を促進することによりJUNBタンパク質の発現量が増大すれば、JUNタンパク質を含むAP1複合体の形成が阻害され、よって、細胞のがん化が抑制されることが既に知られている。従って、本発明のjunB遺伝子発現促進剤は、発がん抑制剤として用いることができる。対象のがんとしては、JUNタンパク質の発現が原因の一つであるがんであり、乳癌、皮膚癌、大腸癌、白血病が挙げられる。もちろん、本発明のjunB遺伝子発現促進剤は、肝がんの発症の抑制にも有効である。しかしながら、グリチルリチンが肝がん発症を抑制することは、そのメカニズムは解明されていなかったものの、知られているので(非特許文献7)、本発明の範囲から好ましくは肝がん抑制剤は除かれる。また、皮膚疾患の1つである乾癬症では、患部においてjunB遺伝子の発現が低下していることなどが知られていることから(非特許文献5)、本発明のjunB遺伝子発現促進剤は、乾癬症の予防又は治療剤として用いることもできる。また、SIRSの病態においては、JUNタンパク質やFOSタンパク質により転写調節因子AP1転写領域が活性化されていることが知られ(非特許文献6)、これよりAP1転写領域の活性を抑制することがSIRSの予防又は治療に有効であることが期待されることから、本発明のjunB遺伝子発現促進剤は、SIRSの予防又は治療剤として用いることもできる。
【実施例】
【0017】
1.被験物質
グリチルリチンモノアンモニウム(以下MAGと表記)について、junB mRNA発現量、c-jun mRNA発現量、JUNBタンパク質発現量、JUNタンパク質発現量及びjunB遺伝子プロモーター活性に与える影響などを調べた。
2.細胞
細胞はヒト肝芽細胞がん由来の細胞株HepG2を使用した。10% FBSを含むダルベッコ変法イーグル培地(DMEM:ニッスイ)に適量の10%炭酸水素ナトリウムと終濃度60 μg/mlのカナマイシンと終濃度8 mMのグルタミンを添加したものを用いて、37℃・5% CO2条件下のCO2インキュベーター内で培養した。培養には、100 mmの細胞培養ディッシュ(FALCON)を使用した。
【0018】
3.junB遺伝子発現量に対する影響
3−1:スタンダード用プラスミドDNA構築
リアルタイムRT-PCR用に設計されたjunBプライマー(配列番号3及び4、TAKARABio)が増幅する領域を囲い込むプライマーを設計し(配列番号1及び2、Operon)、HotStar HiFidelity Polymerase Kit (QIAGEN)を用いて増幅した。Templateには、Human Genomic DNA (ROCHE)を使用した。アガロースゲルで泳動分離し、目的のPCR産物をQIAquick Gel Extraction Kit (QIAGEN)を用いて精製した後、得られたPCR産物をpGEM-T easy Vector (Promega)にサブクローニングした。
得られたプラスミドをコンピテントセルDH5α(Promega)に導入、LB Broth (DIFCO)で培養し、GenElute Plasmid Miniprep Kit (SIGMA)を用いて精製した。
【0019】
3−2: Reverse transcriptase-polymerase chain reaction (RT-PCR)
24 well plate (IWAKI)に1 well当たり5×104個のHepG2細胞を散布し、CO2インキュベーター内で18時間培養し、プレート底面に細胞を定着させた。
well内の培地を、MAGを添加した培地(濃度:5 mg/ml)に置き換え、24時間培養し、培地を吸引後、RNA精製を行わずに直接、培養細胞から一本鎖cDNAが調製可能なFastLane Cell cDNA (QIAGEN)と、RNA液からゲノムなどを除去するRNeasy Mini Kit (QIAGEN)を使用し、細胞からcDNAを調製した。また、調製したcDNAは-80℃に保存した。また、無添加群として、上記の方法において、well内の培地を、MAGを加えない培地に置き換えて、24時間培養し、同様にcDNAを調製した。
【0020】
3−3:リアルタイム PCR
Quantitect SYBR Green PCR kit (QIAGEN)を使用し、リアルタイムRT-PCR用junBプライマー(配列番号3及び4、TAKARABio)を用いて、cDNA中のjunB mRNAのコピー数を測定した。
反応条件は、95℃/15分×1サイクル、(94℃/15秒・60℃/25秒・72℃/12秒)×30サイクルで行い、その後に融解曲線解析(95℃/0秒・58℃/15秒・95℃/0秒、0.5℃刻み上昇)を行った。
また、c-jun mRNAのコピー数も同様にリアルタイム用c-junプライマー(配列番号5及び6、TAKARABio)を用いて測定した。反応条件は、junBコピー数の測定時と同じ、95℃/15分×1サイクル、(94℃/15秒・60℃/25秒・72℃/12秒)×30サイクルで行い、その後に融解曲線解析(95℃/0秒・58℃/15秒・95℃/0秒、0.5℃刻み上昇)を行った。
コピー数はコントロールであるGAPDH遺伝子mRNAをLightCycler Faststart DNA Master SYBR Green 1、LightCycler-Primer Set Human GAPDH (共にROCHE)で測定(反応条件はプロトコールに準拠)したものを用いて補正した。
【0021】
3−4:結果
MAG添加群におけるjunB mRNA及びc-jun mRNAのコピー数の、無添加群における前記コピー数に対する相対値を図1に示す。
MAG添加群におけるjunB mRNAのコピー数は、無添加群のそれに比べ5倍以上であり、t検定を行うと有意な差があった。また、MAG添加群におけるc-jun mRNAのコピー数は、無添加群のそれに比べ約2倍であった。
以上より、MAGは、junB遺伝子の発現を促進する作用を有していることが示唆された。また、MAGは、c-jun遺伝子の発現を促進する作用を有していることが示唆された。
【0022】
4.JUNBタンパク質の発現量に対する影響
4−1:細胞の培養及び核タンパク質抽出
HepG2を用いて、MAG添加群について、JUNBタンパク質及びJUNタンパク質の発現量を調べた。
JUNBタンパク質及びJUNタンパク質は核内に局在することから、核タンパク質を抽出して、実験に用いた。具体的な方法は以下のとおりである。
60mmプレート(IWAKI)にプレート当たり1×107個の細胞を散布し、CO2インキュベーター内で18時間培養し、プレート底面に細胞を定着させた。翌日、プレート内の培地を、5 mg/ml MAG添加培地20 mlに置き換え、24時間培養した後、培地を除き、氷冷PBSで2回洗浄した。洗浄後、10 ml PBSに、セルスクレーパーを用いて細胞を回収し、回収した細胞からQproteome Nuclear Protein Kit (QIAGEN)を用いて核タンパク質を抽出した。また、無添加群として、上記の方法において、well内の培地をMAGを加えない培地に置き換えて、24時間培養し、同様に核タンパク質を調製した。
抽出した核タンパク質におけるタンパク質の濃度は、Biorad protein assay (Biorad)を用いて測定した。
【0023】
4−2:SDS-PAGE
核タンパク質抽出液30μg当量に、6×loading buffer (125 mM Tris-HCl pH6.8 / 4% SDS / 10% DTT / 20% Glycerol / 0.25% BPB)とdH2Oを全量が12μlとなるよう加え、5分間100℃加熱し、サンプルを調製した。
電気泳動層にセットしたSDSポリアクリルアミドゲル(BIO-RAD)にサンプルをアプライし、泳動buffer (25 mM Tris-HCl pH7.5 / 192mM Glycin / 0.1% SDS)を用いて、定電圧150 mVの条件で泳動を行った。
【0024】
4−3:トランスファー
ゲルの大きさにカットしたPVDFメンブレン(Millipore)をメタノールに浸した。続いて、ブロッティング用緩衝液(25 mM Tris-HCl pH7.5 / 192 mM Glycin / 0.1% SDS / 10% MtOH)に移し替え、室温で放置した。また、メンブレンと同じ大きさにカットしたろ紙も予め同じブロッティング緩衝液に浸しておいた。
セミドライトランスファーブロッティング装置にろ紙(3枚)、メンブレン、ゲル、ろ紙(3枚)の順に重ね合わせ、ブロッティング装置にセットし、定電圧100mAで80分間転写を行った。
【0025】
4−4:ブロッティング
タンパク質をトランスファーしたメンブレンを、抗体の非特異的吸着を防ぐためスキムミルク溶液(5% スキムミルク / 1% BSA / 0.5M Tris / 9% NaCl / 0.05% Tween20)中で、1時間室温で振とうし、ブロッキングした。
一次抗体(抗JUNB抗体、抗JUN抗体、抗SP1抗体(コントロール)(全てsantacruz))をスキムミルク溶液でそれぞれ200倍、200倍、100倍に希釈し、ブロッキングしたメンブレンと18時間、4℃で反応させた。
反応後、メンブレンをTBST溶液(0.5M Tris / 9% NaCl / 0.05% Tween20)で30分間、2回振とう洗浄し、スキムミルク溶液で1000倍希釈した二次抗体(AP化抗ウサギ抗体(santacruz))と室温で1時間反応させた。
反応後、同様にメンブレンをTBST溶液でで30分間、2回振とう洗浄し、TBS溶液 (0.5 M Tris / 9% NaCl)中で5分間振とう洗浄した。洗浄後、BCIP/NBT solution (WAKO)と発色反応させ、バンドが検出された後、0.01%酢酸溶液で発色反応を停止させ、dH20中で5分間振とうし、室温で乾燥させた。
【0026】
4−5:結果
結果を図2に示す。
MAG添加群におけるJUNBタンパク質の発現量は、無添加群のそれと比べて著しく大きかった。一方、JUNタンパク質発現量は、無添加群のそれと比べ大きな差が見られなかった。また、コントロールであるSP1タンパク質発現量も、NAC添加群と無添加群との間で差が見られなかった。
【0027】
この結果から、MAGは、junB mRNA発現を促進し、これによりJUNBタンパク質の発現量を顕著に増大することが判った。また、MAGは、c-jun mRNA発現を促進するものの、これは、JUNタンパク質の発現量に影響を与えない程度のものであることが判った。従来知られていたJUNBタンパク質のがん化抑制についての知見を併せて得られた結果を考察すると、MAGは、細胞のがん化抑制に有効であることが推認される。
【0028】
5.junB遺伝子プロモーター活性に対する影響
5−1:ヒトjunB遺伝子プロモーター領域の決定と活性の評価
ヒトjunB遺伝子のプロモーター領域を決定するため、ゲノムのデータベースであるEnsemble Genome Browser (http://www.ensembl.org/index.html)から遺伝子配列が既知である、マウスのjunB遺伝子の上流5kbを取得し、相同解析ツールVISTA(http://genome.lbl.gov/vista/index.shtml)を用いて、解析した。
その結果、ヒトjunB遺伝子の上流3kbpまでの領域に、マウスと高い相同性があることがわかった。また、ヒトjunB遺伝子の上流3kbp以上の領域は、マウスとほとんど相同性を有しないことがわかった。
このヒトjunB遺伝子上流の3kbpまでの領域を組み込んだルシフェラーゼベクターpGL4 (luc2CP、Promega)(以下、3kbUPベクターとする)を0.25〜2μg/mlの濃度でHepG2細胞に導入し、その活性を測定した。その結果、強いルシフェラーゼ活性が測定され、該活性は、ベクターの濃度に依存して上昇した。
以上より、ヒトjunB遺伝子の上流3kbpまでの領域にプロモーター活性があることが判った。
この知見をもとに、以下の実験において、3kbUPベクターを用いて、MAGのjunB遺伝子プロモーター活性に対する影響を調べた。
【0029】
5−2:テストベクターの構築
junB遺伝子プロモーター領域を、DNA断片の5'末端にEcoRVが、3'末端にHindIIIサイトが付随するように設計したプライマー(配列番号7及び8、OPERON)を用いてPCRで増幅し、アガロースゲルで泳動し、QIAquick Gel Extraction Kitを用いて精製した。
精製したDNA断片とルシフェラーゼベクターpGL4.12 (luc2CP、Promega)をEcoRV、HindIIIで制限酵素処理し、QIAquick PCR Purification Kit (QIAGEN)を用いて精製、DNA Ligation Kit (TAKARA)でサブクローニングした。
得られたプラスミドをコンピテントセルDH5α、TAM1 (PROMEGA)に導入、LB Broth (DIFCO)で培養し、plasmid Maxi Kit (QIAGEN)を用いて精製し、テストベクターを作製した。
【0030】
5−3:ルシフェラーゼアッセイ
24 well plate に1 well当たり5×104個のHepG2を散布、CO2インキュベーター内で18時間培養し、プレート底面に細胞を定着させた。
翌日、テストベクターを2.5μg/ml、内部補正用ベクター(薬剤を暴露する等、細胞の状態が変化しても常に一定のルシフェラーゼ活性を示すベクター)を50μg/mlになるよう無血清DMEMで希釈し、リポフェクション試薬Tfx-20 Reagent (Promega)をベクターの3倍当量添加した。プレート中の培地を吸引し、作製したベクター液を添加、CO2インキュベーター内で1時間培養し、そこに血清添加DMEMを加え、CO2インキュベーター内で48時間培養を行った。
培養後、MAGを添加した培地(濃度は、上記と同じ。)を加え、さらに6時間培養し、培地を吸引後、PBSで細胞を洗い、Dual Luciferase Assay System (Promega)を用いてルシフェラーゼタンパク質lysateを抽出し、活性の測定(プロトコールに準拠)を行った。
なお、Dual Luciferase Assayに用いるテストベクターを用いて産生されるルシフェラーゼタンパク質と、内部補正用ベクターを用いて産生されるルシフェラーゼタンパク質は発光基質が異なる。そのため、細胞に両ベクターを導入し、細胞抽出液に両ベクターから産生されるルシフェラーゼタンパク質が混在していても、各発光基質溶液を別に添加することで、各ベクターにより産生されたルシフェラーゼタンパク質の活性を測定することができる。
【0031】
5−4:結果
MAG添加群のルシフェラーゼ活性の、無添加群のルシフェラーゼ活性に対する相対値を図3に示す。
MAGは、junB遺伝子のプロモーター活性を減少させた。MAGがjunB遺伝子のプロモーター活性を減少させた理由の一つとして、以下が考えられる。ルシフェラーゼベクターに組み込んだDNAは、内在性のjunB遺伝子のようにクロマチン構造をとっていないため、内在性のjunB遺伝子プロモーターとは異なる発現を示したことが考えられる。
また、MAGは、junB遺伝子のプロモーター活性を増大させる作用を有していない可能性も考えられる。すなわち、MAGは、junB遺伝子の転写量を増加させるのではなく、junB遺伝子のmRNAの細胞内での安定性を上げ、分解されにくくすることで、junB遺伝子のmRNA量、JUNタンパク質の翻訳量を増加している可能性も考えられる。
【0032】
6.junB遺伝子発現活性化に至るシグナルカスケードの探索
MAGが、どのような経路を経てjunB mRNA発現を促進するのかを解明するため、MAGとともに各種シグナルカスケード阻害剤を添加した試験群を作製し、上述したリアルタイムRT-PCRにより、junB mRNAコピー数を測定した。すなわち、コピー数はコントロールであるGAPDH遺伝子mRNAを用いて内部補正した。
シグナルカスケード阻害剤としては、UO126 (ERK阻害剤、WAKO)、SB203580 (p38阻害剤、WAKO)、JNKI1 (JNK阻害剤、CALBIOCHEM)、AG490 (JAK阻害剤、CALBIOCHEM)、PKCinhibitorpeptide (PKC阻害剤、CALBIOCHEM)を使用した。各阻害剤の濃度は過去の論文とIC50(50%効果濃度)を参考に決定した。
【0033】
結果を図4〜6に示す。各グラフにおけるjunB mRNAのコピー数は、コントロールにおけるコピー数を1としたときの相対値で表される。
全ての阻害剤添加群で、阻害剤無添加群に比べ、junB mRNAのコピー数の減少傾向は見られなかった。
これより、MAGによるjunB遺伝子の発現の促進は、何れの阻害剤によっても阻害されないことが判った。すなわち、MAGによるjunB遺伝子の発現の促進は、これまでに報告されているMAPキナーゼ、JAK/STAT経路やPKC経路とは、別の経路を介して起こっていることが示唆された。
【産業上の利用可能性】
【0034】
本発明のjunB遺伝子発現促進剤は、発がん抑制の目的で使用できる。また、本発明のjunB遺伝子発現促進剤は、SIRSの予防又は治療の目的で使用できる。
【技術分野】
【0001】
本発明は、がんを抑制する因子であるjunB遺伝子の発現促進剤に関する。
【背景技術】
【0002】
現在、日本人の死亡原因の第一位であり、その3割強を占めているがんの中には、近年の研究により、治療薬や治療法が確立され、治癒率の高いがんもある一方で、根本的な治療薬や治療法がないがんも多い。これは、がん発症のメカニズムは多様である一方で、これまでに確立された治療薬や治療法は、特定のメカニズムにのみ有効である場合が多いためである。
がん発症のメカニズムとして、c-jun遺伝子が関与するメカニズムが知られている。c-jun遺伝子の産物であるJUNタンパク質は、FOSやRAF等のタンパク質と転写調節因子AP1複合体を形成し、細胞の分化や増殖を促進し、細胞のがん化を促すことが知られている(非特許文献1)。
junB遺伝子は、c-jun遺伝子と同じくjun遺伝子ファミリーに属しており、junB遺伝子の産物であるJUNBタンパク質は、JUNタンパク質と類似の構造を有し、一部共通の機能も有する(非特許文献2)。しかしながら、JUNBタンパク質は、JNK(c-jun n-terminal kinase)結合部位を有しないため、JNKにより活性化されない。そのため、JUNBタンパク質の発現量が増大すれば、JUNタンパク質によるAP1複合体形成が阻害され、細胞のがん化が抑制されることが知られている(非特許文献3)。すなわち、junB遺伝子はがん抑制遺伝子として働くことが明らかになっている(非特許文献3、4など)。また、皮膚疾患の1つである乾癬症では、患部においてjunB遺伝子の発現が低下していることなども知られている(非特許文献5)。また、全身性炎症反応症候群(systemic inflammatory response syndrome: SIRS)の病態においては、JUNタンパク質やFOSタンパク質により転写調節因子AP1転写領域が活性化されていることが知られている(非特許文献6)。
【0003】
グリチルリチン(グリチルリチン酸)は、グリチルレチン酸と2分子のグルクロン酸とからなる化合物であり、抗炎症作用(抗アレルギー作用、アラキドンサン代謝系酵素の阻害作用)を有することが知られている。また、該化合物は、消化器の潰瘍治癒作用、免疫調節作用、肝細胞障害抑制作用、解毒作用、ウイルス増殖抑制・不活化作用等を有することも知られている。該化合物は、特に、肝臓疾患用剤(非特許文献7)、及びアレルギー用薬としては、広く臨床領域で用いられている。また、該化合物は、肝がん発症を抑制することが知られている。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Eferl R. et al., Liver tumor development, c-jun antagonizes the proapoptotic activity of p53, Cell, 2003, 112, 181-92
【非特許文献2】Passegue E. et al., JunB can substitute for Jun in mouse development and cell proliferation, Nat. Genet., 2002, 30, 158-66
【非特許文献3】Shaulian E. et al., AP-1in cell proliferation and survival, Oncogene, 2001, 20, 2390-400
【非特許文献4】Zenz R. et al., Jun signaling in the epidermis: From developmental defects to psoriasis and skin tumors, Int, J. Biochem. Cell Biol., 2006, 38, 1043-9
【非特許文献5】Zenz R. et al., Psoriasis-like skin disease and arthritis caused by inducible epidermal deletion of Jun proteins, NATURE, 2005, 437, 15
【非特許文献6】松田直之、周術期炎症管理の戦略−炎症に対する遺伝子治療−、フォーラム富山「創薬」第22回研究会 講演要旨、2007年(http://www.sugitani.u-toyama.ac.jp/sangaku/forum/souyaku22/2.matsuda.pdf)
【非特許文献7】Suzuki H. et al., Effects of glycyrrhizin on biochemical tests in patients with chronic hepatitis, Double blind trial, ASIAN MED. J., 1983, 26, 423-438
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は、新規なjunB遺伝子発現促進剤を提供することを課題とする。
【課題を解決するための手段】
【0006】
本発明者らは、上記課題を解決すべく、種々の化合物について、junB遺伝子の発現量への影響を研究してきた結果、グリチルリチンモノアンモニウム(MAG)が、junB遺伝子の発現を促進し、JUNBタンパク質の産生を促進する作用を有することを見い出し、本発明を完成させた。
すなわち、本発明は、以下のとおりである。
【0007】
(1)グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を含む、junB遺伝子発現促進剤。
(2)前記薬学上許容される塩が、グリチルリチンモノアンモニウムである、(1)に記載のjunB遺伝子発現促進剤。
【発明の効果】
【0008】
本発明のjunB遺伝子発現促進剤は、junB遺伝子の発現を有意に促進し、JUNBタンパク質の発現量を増大させる。一方、本発明のjunB遺伝子発現促進剤は、c-jun遺伝子の産物であるJUNタンパク質の発現量には影響を与えない。従って、本発明のjunB遺伝子発現促進剤は、JUNタンパク質によるAP1複合体の形成を阻害することができ、細胞のがん化の抑制、SIRSの治療などに有効である。
【図面の簡単な説明】
【0009】
【図1】グリチルリチンモノアンモニウム(MAG)添加群における、junB及びc-junのmRNAコピー数を示す図である。
【図2】MAG添加群における、JUNBタンパク質及びJUNタンパク質の発現量を示す図(写真)である。
【図3】MAG添加群における、junB遺伝子プロモーター活性(ルシフェラーゼアッセイの結果)を示す図である。
【図4】MAG添加群における、junB mRNAコピー数に与えるMAPK阻害剤の添加の影響を示す図である。
【図5】MAG添加群における、junB mRNAコピー数に与えるJAK阻害剤の添加の影響を示す図である。
【図6】MAG添加群における、junB mRNAコピー数に与えるPKC阻害剤の添加の影響を示す図である。
【発明を実施するための形態】
【0010】
本発明のjunB遺伝子発現促進剤は、グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を含む。
【0011】
本発明のjunB遺伝子発現促進剤において、グリチルリチンは、例えば、甘草から常法により抽出して用いることができる。また、市販品を用いてもよい。
グリチルリチンの薬学上許容される塩としては、グリチルリチンモノアンモニウム、グリチルリチンジアンモニウム;グリチルリチンモノナトリウム、グリチルリチンジナトリウム、グリチルリチンモノカリウム、グリチルリチンジカリウム等のアルカリ金属塩;あるいは、グリチルリチンコリン等を挙げることができる。さらにこれら以外にも、カルシウム塩、マグネシウム塩、アルミニウム塩等も用いることができる。好ましくは、グリチルリチンモノアンモニウムが用いられる。
また、グリチルリチン及びその薬学上許容される塩から選ばれる化合物は、単独で、又は2種以上を組み合わせて用いることができる。
【0012】
本発明のjunB遺伝子発現促進剤の剤形は、特に限定されず、錠剤、散剤、顆粒剤、カプセル剤、細粒剤、水薬等の経口剤、吸入剤、座剤あるいは注射剤等の非経口剤とすることができる。これらは、常法により製造できる。
【0013】
本発明のjunB遺伝子発現促進剤は、必要に応じて、賦形剤、滑沢剤、可塑剤、界面活性剤、結合剤、崩壊剤、湿潤剤、安定剤、矯味剤、防腐剤、着色剤、香料、緩衝剤等を配合し、製剤化することができる。
【0014】
本発明のjunB遺伝子発現促進剤におけるグリチルリチン及びその薬学上許容される塩から選ばれる化合物の含有量は、投与対象等によって適宜調節される。
【0015】
本発明のjunB遺伝子発現促進剤の投与方法としては、経口、非経口のいずれでもよい。投与量は、患者の年齢、症状等により適宜選択することができる。
【0016】
上述したように、junB遺伝子の発現を促進することによりJUNBタンパク質の発現量が増大すれば、JUNタンパク質を含むAP1複合体の形成が阻害され、よって、細胞のがん化が抑制されることが既に知られている。従って、本発明のjunB遺伝子発現促進剤は、発がん抑制剤として用いることができる。対象のがんとしては、JUNタンパク質の発現が原因の一つであるがんであり、乳癌、皮膚癌、大腸癌、白血病が挙げられる。もちろん、本発明のjunB遺伝子発現促進剤は、肝がんの発症の抑制にも有効である。しかしながら、グリチルリチンが肝がん発症を抑制することは、そのメカニズムは解明されていなかったものの、知られているので(非特許文献7)、本発明の範囲から好ましくは肝がん抑制剤は除かれる。また、皮膚疾患の1つである乾癬症では、患部においてjunB遺伝子の発現が低下していることなどが知られていることから(非特許文献5)、本発明のjunB遺伝子発現促進剤は、乾癬症の予防又は治療剤として用いることもできる。また、SIRSの病態においては、JUNタンパク質やFOSタンパク質により転写調節因子AP1転写領域が活性化されていることが知られ(非特許文献6)、これよりAP1転写領域の活性を抑制することがSIRSの予防又は治療に有効であることが期待されることから、本発明のjunB遺伝子発現促進剤は、SIRSの予防又は治療剤として用いることもできる。
【実施例】
【0017】
1.被験物質
グリチルリチンモノアンモニウム(以下MAGと表記)について、junB mRNA発現量、c-jun mRNA発現量、JUNBタンパク質発現量、JUNタンパク質発現量及びjunB遺伝子プロモーター活性に与える影響などを調べた。
2.細胞
細胞はヒト肝芽細胞がん由来の細胞株HepG2を使用した。10% FBSを含むダルベッコ変法イーグル培地(DMEM:ニッスイ)に適量の10%炭酸水素ナトリウムと終濃度60 μg/mlのカナマイシンと終濃度8 mMのグルタミンを添加したものを用いて、37℃・5% CO2条件下のCO2インキュベーター内で培養した。培養には、100 mmの細胞培養ディッシュ(FALCON)を使用した。
【0018】
3.junB遺伝子発現量に対する影響
3−1:スタンダード用プラスミドDNA構築
リアルタイムRT-PCR用に設計されたjunBプライマー(配列番号3及び4、TAKARABio)が増幅する領域を囲い込むプライマーを設計し(配列番号1及び2、Operon)、HotStar HiFidelity Polymerase Kit (QIAGEN)を用いて増幅した。Templateには、Human Genomic DNA (ROCHE)を使用した。アガロースゲルで泳動分離し、目的のPCR産物をQIAquick Gel Extraction Kit (QIAGEN)を用いて精製した後、得られたPCR産物をpGEM-T easy Vector (Promega)にサブクローニングした。
得られたプラスミドをコンピテントセルDH5α(Promega)に導入、LB Broth (DIFCO)で培養し、GenElute Plasmid Miniprep Kit (SIGMA)を用いて精製した。
【0019】
3−2: Reverse transcriptase-polymerase chain reaction (RT-PCR)
24 well plate (IWAKI)に1 well当たり5×104個のHepG2細胞を散布し、CO2インキュベーター内で18時間培養し、プレート底面に細胞を定着させた。
well内の培地を、MAGを添加した培地(濃度:5 mg/ml)に置き換え、24時間培養し、培地を吸引後、RNA精製を行わずに直接、培養細胞から一本鎖cDNAが調製可能なFastLane Cell cDNA (QIAGEN)と、RNA液からゲノムなどを除去するRNeasy Mini Kit (QIAGEN)を使用し、細胞からcDNAを調製した。また、調製したcDNAは-80℃に保存した。また、無添加群として、上記の方法において、well内の培地を、MAGを加えない培地に置き換えて、24時間培養し、同様にcDNAを調製した。
【0020】
3−3:リアルタイム PCR
Quantitect SYBR Green PCR kit (QIAGEN)を使用し、リアルタイムRT-PCR用junBプライマー(配列番号3及び4、TAKARABio)を用いて、cDNA中のjunB mRNAのコピー数を測定した。
反応条件は、95℃/15分×1サイクル、(94℃/15秒・60℃/25秒・72℃/12秒)×30サイクルで行い、その後に融解曲線解析(95℃/0秒・58℃/15秒・95℃/0秒、0.5℃刻み上昇)を行った。
また、c-jun mRNAのコピー数も同様にリアルタイム用c-junプライマー(配列番号5及び6、TAKARABio)を用いて測定した。反応条件は、junBコピー数の測定時と同じ、95℃/15分×1サイクル、(94℃/15秒・60℃/25秒・72℃/12秒)×30サイクルで行い、その後に融解曲線解析(95℃/0秒・58℃/15秒・95℃/0秒、0.5℃刻み上昇)を行った。
コピー数はコントロールであるGAPDH遺伝子mRNAをLightCycler Faststart DNA Master SYBR Green 1、LightCycler-Primer Set Human GAPDH (共にROCHE)で測定(反応条件はプロトコールに準拠)したものを用いて補正した。
【0021】
3−4:結果
MAG添加群におけるjunB mRNA及びc-jun mRNAのコピー数の、無添加群における前記コピー数に対する相対値を図1に示す。
MAG添加群におけるjunB mRNAのコピー数は、無添加群のそれに比べ5倍以上であり、t検定を行うと有意な差があった。また、MAG添加群におけるc-jun mRNAのコピー数は、無添加群のそれに比べ約2倍であった。
以上より、MAGは、junB遺伝子の発現を促進する作用を有していることが示唆された。また、MAGは、c-jun遺伝子の発現を促進する作用を有していることが示唆された。
【0022】
4.JUNBタンパク質の発現量に対する影響
4−1:細胞の培養及び核タンパク質抽出
HepG2を用いて、MAG添加群について、JUNBタンパク質及びJUNタンパク質の発現量を調べた。
JUNBタンパク質及びJUNタンパク質は核内に局在することから、核タンパク質を抽出して、実験に用いた。具体的な方法は以下のとおりである。
60mmプレート(IWAKI)にプレート当たり1×107個の細胞を散布し、CO2インキュベーター内で18時間培養し、プレート底面に細胞を定着させた。翌日、プレート内の培地を、5 mg/ml MAG添加培地20 mlに置き換え、24時間培養した後、培地を除き、氷冷PBSで2回洗浄した。洗浄後、10 ml PBSに、セルスクレーパーを用いて細胞を回収し、回収した細胞からQproteome Nuclear Protein Kit (QIAGEN)を用いて核タンパク質を抽出した。また、無添加群として、上記の方法において、well内の培地をMAGを加えない培地に置き換えて、24時間培養し、同様に核タンパク質を調製した。
抽出した核タンパク質におけるタンパク質の濃度は、Biorad protein assay (Biorad)を用いて測定した。
【0023】
4−2:SDS-PAGE
核タンパク質抽出液30μg当量に、6×loading buffer (125 mM Tris-HCl pH6.8 / 4% SDS / 10% DTT / 20% Glycerol / 0.25% BPB)とdH2Oを全量が12μlとなるよう加え、5分間100℃加熱し、サンプルを調製した。
電気泳動層にセットしたSDSポリアクリルアミドゲル(BIO-RAD)にサンプルをアプライし、泳動buffer (25 mM Tris-HCl pH7.5 / 192mM Glycin / 0.1% SDS)を用いて、定電圧150 mVの条件で泳動を行った。
【0024】
4−3:トランスファー
ゲルの大きさにカットしたPVDFメンブレン(Millipore)をメタノールに浸した。続いて、ブロッティング用緩衝液(25 mM Tris-HCl pH7.5 / 192 mM Glycin / 0.1% SDS / 10% MtOH)に移し替え、室温で放置した。また、メンブレンと同じ大きさにカットしたろ紙も予め同じブロッティング緩衝液に浸しておいた。
セミドライトランスファーブロッティング装置にろ紙(3枚)、メンブレン、ゲル、ろ紙(3枚)の順に重ね合わせ、ブロッティング装置にセットし、定電圧100mAで80分間転写を行った。
【0025】
4−4:ブロッティング
タンパク質をトランスファーしたメンブレンを、抗体の非特異的吸着を防ぐためスキムミルク溶液(5% スキムミルク / 1% BSA / 0.5M Tris / 9% NaCl / 0.05% Tween20)中で、1時間室温で振とうし、ブロッキングした。
一次抗体(抗JUNB抗体、抗JUN抗体、抗SP1抗体(コントロール)(全てsantacruz))をスキムミルク溶液でそれぞれ200倍、200倍、100倍に希釈し、ブロッキングしたメンブレンと18時間、4℃で反応させた。
反応後、メンブレンをTBST溶液(0.5M Tris / 9% NaCl / 0.05% Tween20)で30分間、2回振とう洗浄し、スキムミルク溶液で1000倍希釈した二次抗体(AP化抗ウサギ抗体(santacruz))と室温で1時間反応させた。
反応後、同様にメンブレンをTBST溶液でで30分間、2回振とう洗浄し、TBS溶液 (0.5 M Tris / 9% NaCl)中で5分間振とう洗浄した。洗浄後、BCIP/NBT solution (WAKO)と発色反応させ、バンドが検出された後、0.01%酢酸溶液で発色反応を停止させ、dH20中で5分間振とうし、室温で乾燥させた。
【0026】
4−5:結果
結果を図2に示す。
MAG添加群におけるJUNBタンパク質の発現量は、無添加群のそれと比べて著しく大きかった。一方、JUNタンパク質発現量は、無添加群のそれと比べ大きな差が見られなかった。また、コントロールであるSP1タンパク質発現量も、NAC添加群と無添加群との間で差が見られなかった。
【0027】
この結果から、MAGは、junB mRNA発現を促進し、これによりJUNBタンパク質の発現量を顕著に増大することが判った。また、MAGは、c-jun mRNA発現を促進するものの、これは、JUNタンパク質の発現量に影響を与えない程度のものであることが判った。従来知られていたJUNBタンパク質のがん化抑制についての知見を併せて得られた結果を考察すると、MAGは、細胞のがん化抑制に有効であることが推認される。
【0028】
5.junB遺伝子プロモーター活性に対する影響
5−1:ヒトjunB遺伝子プロモーター領域の決定と活性の評価
ヒトjunB遺伝子のプロモーター領域を決定するため、ゲノムのデータベースであるEnsemble Genome Browser (http://www.ensembl.org/index.html)から遺伝子配列が既知である、マウスのjunB遺伝子の上流5kbを取得し、相同解析ツールVISTA(http://genome.lbl.gov/vista/index.shtml)を用いて、解析した。
その結果、ヒトjunB遺伝子の上流3kbpまでの領域に、マウスと高い相同性があることがわかった。また、ヒトjunB遺伝子の上流3kbp以上の領域は、マウスとほとんど相同性を有しないことがわかった。
このヒトjunB遺伝子上流の3kbpまでの領域を組み込んだルシフェラーゼベクターpGL4 (luc2CP、Promega)(以下、3kbUPベクターとする)を0.25〜2μg/mlの濃度でHepG2細胞に導入し、その活性を測定した。その結果、強いルシフェラーゼ活性が測定され、該活性は、ベクターの濃度に依存して上昇した。
以上より、ヒトjunB遺伝子の上流3kbpまでの領域にプロモーター活性があることが判った。
この知見をもとに、以下の実験において、3kbUPベクターを用いて、MAGのjunB遺伝子プロモーター活性に対する影響を調べた。
【0029】
5−2:テストベクターの構築
junB遺伝子プロモーター領域を、DNA断片の5'末端にEcoRVが、3'末端にHindIIIサイトが付随するように設計したプライマー(配列番号7及び8、OPERON)を用いてPCRで増幅し、アガロースゲルで泳動し、QIAquick Gel Extraction Kitを用いて精製した。
精製したDNA断片とルシフェラーゼベクターpGL4.12 (luc2CP、Promega)をEcoRV、HindIIIで制限酵素処理し、QIAquick PCR Purification Kit (QIAGEN)を用いて精製、DNA Ligation Kit (TAKARA)でサブクローニングした。
得られたプラスミドをコンピテントセルDH5α、TAM1 (PROMEGA)に導入、LB Broth (DIFCO)で培養し、plasmid Maxi Kit (QIAGEN)を用いて精製し、テストベクターを作製した。
【0030】
5−3:ルシフェラーゼアッセイ
24 well plate に1 well当たり5×104個のHepG2を散布、CO2インキュベーター内で18時間培養し、プレート底面に細胞を定着させた。
翌日、テストベクターを2.5μg/ml、内部補正用ベクター(薬剤を暴露する等、細胞の状態が変化しても常に一定のルシフェラーゼ活性を示すベクター)を50μg/mlになるよう無血清DMEMで希釈し、リポフェクション試薬Tfx-20 Reagent (Promega)をベクターの3倍当量添加した。プレート中の培地を吸引し、作製したベクター液を添加、CO2インキュベーター内で1時間培養し、そこに血清添加DMEMを加え、CO2インキュベーター内で48時間培養を行った。
培養後、MAGを添加した培地(濃度は、上記と同じ。)を加え、さらに6時間培養し、培地を吸引後、PBSで細胞を洗い、Dual Luciferase Assay System (Promega)を用いてルシフェラーゼタンパク質lysateを抽出し、活性の測定(プロトコールに準拠)を行った。
なお、Dual Luciferase Assayに用いるテストベクターを用いて産生されるルシフェラーゼタンパク質と、内部補正用ベクターを用いて産生されるルシフェラーゼタンパク質は発光基質が異なる。そのため、細胞に両ベクターを導入し、細胞抽出液に両ベクターから産生されるルシフェラーゼタンパク質が混在していても、各発光基質溶液を別に添加することで、各ベクターにより産生されたルシフェラーゼタンパク質の活性を測定することができる。
【0031】
5−4:結果
MAG添加群のルシフェラーゼ活性の、無添加群のルシフェラーゼ活性に対する相対値を図3に示す。
MAGは、junB遺伝子のプロモーター活性を減少させた。MAGがjunB遺伝子のプロモーター活性を減少させた理由の一つとして、以下が考えられる。ルシフェラーゼベクターに組み込んだDNAは、内在性のjunB遺伝子のようにクロマチン構造をとっていないため、内在性のjunB遺伝子プロモーターとは異なる発現を示したことが考えられる。
また、MAGは、junB遺伝子のプロモーター活性を増大させる作用を有していない可能性も考えられる。すなわち、MAGは、junB遺伝子の転写量を増加させるのではなく、junB遺伝子のmRNAの細胞内での安定性を上げ、分解されにくくすることで、junB遺伝子のmRNA量、JUNタンパク質の翻訳量を増加している可能性も考えられる。
【0032】
6.junB遺伝子発現活性化に至るシグナルカスケードの探索
MAGが、どのような経路を経てjunB mRNA発現を促進するのかを解明するため、MAGとともに各種シグナルカスケード阻害剤を添加した試験群を作製し、上述したリアルタイムRT-PCRにより、junB mRNAコピー数を測定した。すなわち、コピー数はコントロールであるGAPDH遺伝子mRNAを用いて内部補正した。
シグナルカスケード阻害剤としては、UO126 (ERK阻害剤、WAKO)、SB203580 (p38阻害剤、WAKO)、JNKI1 (JNK阻害剤、CALBIOCHEM)、AG490 (JAK阻害剤、CALBIOCHEM)、PKCinhibitorpeptide (PKC阻害剤、CALBIOCHEM)を使用した。各阻害剤の濃度は過去の論文とIC50(50%効果濃度)を参考に決定した。
【0033】
結果を図4〜6に示す。各グラフにおけるjunB mRNAのコピー数は、コントロールにおけるコピー数を1としたときの相対値で表される。
全ての阻害剤添加群で、阻害剤無添加群に比べ、junB mRNAのコピー数の減少傾向は見られなかった。
これより、MAGによるjunB遺伝子の発現の促進は、何れの阻害剤によっても阻害されないことが判った。すなわち、MAGによるjunB遺伝子の発現の促進は、これまでに報告されているMAPキナーゼ、JAK/STAT経路やPKC経路とは、別の経路を介して起こっていることが示唆された。
【産業上の利用可能性】
【0034】
本発明のjunB遺伝子発現促進剤は、発がん抑制の目的で使用できる。また、本発明のjunB遺伝子発現促進剤は、SIRSの予防又は治療の目的で使用できる。
【特許請求の範囲】
【請求項1】
グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を含む、junB遺伝子発現促進剤。
【請求項2】
前記薬学上許容される塩が、グリチルリチンモノアンモニウムである、請求項1に記載のjunB遺伝子発現促進剤。
【請求項1】
グリチルリチン及びその薬学的に許容される塩から選ばれる化合物を含む、junB遺伝子発現促進剤。
【請求項2】
前記薬学上許容される塩が、グリチルリチンモノアンモニウムである、請求項1に記載のjunB遺伝子発現促進剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−42623(P2011−42623A)
【公開日】平成23年3月3日(2011.3.3)
【国際特許分類】
【出願番号】特願2009−192118(P2009−192118)
【出願日】平成21年8月21日(2009.8.21)
【出願人】(000170358)株式会社ミノファーゲン製薬 (16)
【出願人】(000173588)財団法人癌研究会 (34)
【Fターム(参考)】
【公開日】平成23年3月3日(2011.3.3)
【国際特許分類】
【出願日】平成21年8月21日(2009.8.21)
【出願人】(000170358)株式会社ミノファーゲン製薬 (16)
【出願人】(000173588)財団法人癌研究会 (34)
【Fターム(参考)】
[ Back to top ]

