miRNA導入による新規hiPSC作製法
【課題】多能性幹細胞を誘導する新規の化合物組成物、および未分化細胞マーカー発現調節剤の提供。
【解決手段】特定の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。この多能性幹細胞誘導剤は、細胞を多能性幹細胞へ誘導するsmall RNAを含有する。特定の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤。
【解決手段】特定の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。この多能性幹細胞誘導剤は、細胞を多能性幹細胞へ誘導するsmall RNAを含有する。特定の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規のsmall RNA、多能性幹細胞誘導剤、悪性腫瘍治療薬、または多能性幹細胞等に関する。
【背景技術】
【0002】
iPS細胞の作成技術は、近年の医療業界で特に注目されている分野である。代表的なiPS細胞の作成技術としては、特許文献1に記載の方法が挙げられる。この文献には、4つの遺伝子(Oct3/4、Klf4、Sox2、c−Myc)を細胞に導入することでiPS細胞を作成したことが記載されている。この技術が開発された頃から、iPS細胞に関連する研究成果の報告数は急速に増えている。例えば、特許文献2には、3つの遺伝子(Oct3/4、Klf4、Sox2)と、1つのmiRNA(hsa−miR−372等)を細胞に導入することでiPS細胞を作成したことが記載されている。非特許文献1には、上記の4つまたは3つの遺伝子を導入する場合にiPS化させる細胞のp53遺伝子を欠損させておくと、iPS細胞の作成効率が上昇したことが記載されている。非特許文献2には、pre−miRNAのクラスター(miR−302a〜miR−302d)を導入することで、癌細胞からiPS細胞を作成したことが記載されている。
【0003】
一方で、製薬会社が近年特に資金を投入している分野は、癌分野である。癌はメカニズムが複雑で不明な点が多く、他の疾患に比べて有効な治療薬が少ない。そのため、この分野の新規の治療薬の開発が待たれている。本願発明者らは非特許文献3において、癌のバイオマーカーとしてhTERT mRNAを適用できることを報告している。また非特許文献4において、hTERT mRNAの発現はRGM249 mRNAと関連しており、RGM249 mRNAに対するshRNAまたはsiRNAによってhTERT mRNAの発現量が減少することを報告している。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第2007/069666号
【特許文献2】国際公開第2009/075119号
【非特許文献】
【0005】
【非特許文献1】'Suppression of induced pluripotent stem cell generation by the p53-p21 pathway.' Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.
【非特許文献2】'Mir-302 reprograms human skin cancer cells into a pluripotent ES-cell-like state.' Lin et al., RNA. 2008 Oct;14(10):2115-24. Epub 2008 Aug 28.
【非特許文献3】'A novel biomarker TERT mRNA is applicable for early detection of hepatoma.' Miura et al., BMC Gastroenterol. 2010 May 18;10:46.
【非特許文献4】'A noncoding RNA gene on chromosome 10p15.3 may function upstream of hTERT.' Miura et al., BMC Mol Biol. 2009 Feb 2;10:5.
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
上記文献においてiPS細胞の作成方法が徐々に明らかになってきているが、より効率的に、より高品質のiPS細胞を開発するには、新しい作成方法を明らかにし、iPS細胞に関する情報を蓄積していく必要があった。
【0007】
個々の文献について見てみると、特許文献1では癌原遺伝子であるc−Mycを使用しているため、iPS細胞が癌化するリスクを秘めていた。特許文献2ではc−Mycを使用していないが、遺伝子3つとmiRNA1つを細胞に導入させる工程は、複雑であり効率的な作成方法とはいえなかった。非特許文献1ではc−Mycを使用していないが、癌抑制遺伝子であるp53遺伝子を欠損させているので、細胞の癌化や不安定化等のリスクを負っていた。非特許文献2は、miR−302のクラスターを使用しているが、miR−302は腫瘍抑制因子であるPTEN(phosphatase and tensin homolog deleted on chromosome 10)を標的とするmiRNAであることが報告されている(Poliseno et al., Sci Signal. 2010 Apr 13;3(117):ra29)。そのため細胞の癌化のリスクを負っていた。
【0008】
一方で、上記文献において悪性腫瘍のメカニズムが徐々に明らかになってきているが、それだけでは十分とはいえず、新規の医薬品または治療戦略立案のためには、新しい抗悪性腫瘍物質を明らかにし、悪性腫瘍に関する情報を蓄積していく必要があった。
【0009】
非特許文献3および4では、hTERT mRNAが癌形成に関連していることと、RGM249 mRNAに対するshRNAまたはsiRNAによってhTERT mRNAが減少することが記載されているが、癌に治療効果のある物質は何ら明らかにされていない。
【0010】
本発明は上記事情に鑑みてなされたものであり、多能性幹細胞を誘導する新規の化合物を提供することを目的とする。または、未分化細胞マーカー発現調節剤を提供することを目的とする。また別の目的は、多能性幹細胞のp53発現促進剤を提供することである。また他の目的は、新規の悪性腫瘍治療薬を提供することである。また他の目的は、新規の多能性幹細胞を提供することである。
【課題を解決するための手段】
【0011】
本発明によれば、配列番号41の塩基配列を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤が提供される。
【0012】
この多能性幹細胞誘導剤は、後述する実施例で、細胞を多能性幹細胞へ誘導することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、この多能性幹細胞誘導剤を用いれば、細胞を多能性幹細胞へ誘導することができる。
【0013】
また本発明によれば、配列番号41の塩基配列を含む、small RNAを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤が提供される。
【0014】
この多能性幹細胞誘導剤は、後述する実施例で細胞を多能性幹細胞へ誘導することが実証されているsmall RNAを含有する。そのため、この多能性幹細胞誘導剤を用いれば、細胞を多能性幹細胞へ誘導することができる。
【0015】
また本発明によれば、配列番号43の塩基配列を含むポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤が提供される。
【0016】
この多能性幹細胞誘導剤は、後述する実施例で細胞を多能性幹細胞へ誘導することが実証されているポリヌクレオチドを含有する。そのため、この多能性幹細胞誘導剤を用いれば、細胞を多能性幹細胞へ誘導することができる。
【0017】
また本発明によれば、配列番号41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤が提供される。
【0018】
この未分化細胞マーカー発現調節剤は、後述する実施例で細胞内の未分化細胞マーカーを促進または抑制することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、この未分化細胞マーカー発現調節剤を用いれば、細胞内の未分化細胞マーカーの発現量を調節することができる。
【0019】
また本発明によれば、配列番号41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有し、多能性幹細胞におけるp53の発現量を促進する、多能性幹細胞のp53発現促進剤が提供される。
【0020】
このp53発現促進剤は、後述する実施例で多能性幹細胞におけるp53の発現量を促進することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、このp53発現促進剤を用いれば、多能性幹細胞におけるp53の発現量を促進することができる。
【0021】
また本発明によれば、配列番号41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法が提供される。
【0022】
この生産方法は、後述する実施例で多能性幹細胞を作成するために利用できることが実証されている。そのため、この生産方法を用いれば、多能性幹細胞を生産することができる。
【0023】
また本発明によれば、配列番41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有する、悪性腫瘍の治療薬が提供される。
【0024】
この悪性腫瘍の治療薬は、後述する実施例で悪性腫瘍を抑制することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、この悪性腫瘍の治療薬を用いれば、悪性腫瘍の治療をすることができる。
【0025】
また本発明によれば、配列番号41の塩基配列を含むポリヌクレオチドを含むポリヌクレオチドを含むベクターが提供される。
【0026】
このベクターを利用すれば、配列番号41を含む、1本鎖または2本鎖のポリヌクレオチドを発現させることができる。そのため、このベクターを用いれば、細胞を多能性幹細胞へ誘導、未分化細胞マーカーの発現量の調節、多能性幹細胞のp53の発現量を促進、または癌悪性腫瘍の治療をするための物質を生産することができる。
【0027】
また本発明によれば、配列番号41の塩基配列を含むポリヌクレオチドを含む、多能性幹細胞誘導用、未分化細胞マーカー発現調節用、多能性幹細胞のp53発現促進用、または悪性腫瘍の治療用のキットが提供される。
【0028】
このキットを利用すれば、後述する実施例において、細胞を多能性幹細胞へ誘導すること、未分化細胞マーカーの発現量を調節すること、多能性幹細胞におけるp53の発現量を促進すること、または悪性腫瘍を抑制することが実証されている1本鎖または2本鎖のポリヌクレオチドを簡易に使用することができる。そのため、このキットを用いれば、細胞を多能性幹細胞へ誘導、未分化細胞マーカーの発現量の調節、多能性幹細胞のp53の発現量を促進、または悪性腫瘍の治療をすることができる。
【0029】
なお、上記のいずれかの多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、p53発現促進剤、多能性幹細胞の生産方法、悪性腫瘍の治療薬、ベクター、およびキットにおいて、配列番号41の塩基配列の1〜3個の塩基が欠失、置換もしくは付加されていたとしてもよい。または、配列番号42の塩基配列の1〜5個の塩基が欠失、置換もしくは付加されていたとしてもよい。または、配列番号43の塩基配列の1〜4個の塩基が欠失、置換もしくは付加されていたとしてもよい。
【発明の効果】
【0030】
本発明によれば、多能性幹細胞を誘導する新規の化合物が得られる。または、未分化細胞マーカーの発現を調節する新規の化合物が得られる。または、多能性幹細胞のp53発現促進剤が得られる。または、新規の悪性腫瘍治療薬が得られる。
【図面の簡単な説明】
【0031】
【図1A】図1Aは、RGM249の2次元構造を表した図である。
【図1B】図1Bは、RGM249 shRNAとRGM249m−1 shRNAの2次元構造を表した図である。
【図1C】図1Cは、RGM249 shRNA皮下注射後の腫瘍ボリュームの変化を調査した結果である。
【図1D】図1Dは、RGM249 shRNAプラスミド等を皮下注射した際の、腫瘍ボリュームの目視的な観察結果である。
【図2A】図2Aは、RGM249 shRNAプラスミド等を皮下注射から35日後に、腫瘍で発現している遺伝子の発現抑制効果を調査した結果である。
【図2B】図2Bは、RGM249 shRNAプラスミド等を静脈注射から28日後に、腫瘍で発現している遺伝子の発現抑制効果を調査した結果である。
【図3A】図3Aは、RGM249 mRNAと、内部の3つのmiRNAに相当する部位を表した結果である。
【図3B】図3Bは、3つのmiRNAの2次構造を表した図である。
【図3C】図3Cは、3つのmiRNAと、3つのsiRNAのアンチセンス鎖との配列を比較した結果である。
【図3D】図3Dは、3つのsiRNAをHMV−Iへトランスフェクションした後の、癌細胞増殖の抑制効果を調査した結果である。
【図3E】図3Eは、3siRNA混合物を同時にトランスフェクションしたHMV−IからRNA抽出を行い、miR−47、miR−101、miR−197の発現レベルを調査した結果である。
【図3F】図3Fは、3siRNA混合物による形質転換体の転写発現プロファイリングを、癌、多分化能、幹細胞性に関連する遺伝子について評価した結果である。
【図4】図4は、3siRNA混合物+DDSの皮下投与による、HMV−I細胞の増殖性の抑制を調査した結果である。
【図5A】図5Aは、評価した腫瘍のあるパーツ表した図である。
【図5B】図5Bは、3siRNA混合物による、miR−47、miR−101、miR−197それぞれの発現抑制効果を評価した結果である。
【図5C】図5Cは、siRNAで処理した腫瘍を顕微鏡で観察した写真である。
【図5D】図5Dは、3siRNA混合物を投与した場合の腫瘍、分化、多能性の関連遺伝子の転写レベルを調査した結果である。
【図6A】図6Aは、miR−197 siRNAを293FT細胞にトランスフェクションした後、顕微鏡で観察した写真である。
【図6B】図6Bは、hsa−mir−520dの2次構造を表した図である。
【図6C】図6Cは、miR−197 siRNAをトランスフェクションした293FT細胞を、顕微鏡で免疫組織化学的に観察した写真である。
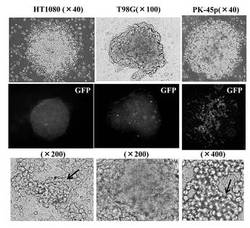
【図6D】図6Dは、hsa−mir−520dをHT1080細胞にウイルスベクターで感染させ、強制発現させた後、免疫組織科学的試験で未分化マーカーの発現量を観察した結果である。
【図6E】図6Eは、hsa−mir−520dをT98G細胞にウイルスベクターで感染させ、強制発現させた後、免疫組織科学的試験で未分化マーカーの発現量を観察した結果である。
【図6F】図6Fは、hsa−mir−520dをPK−45p細胞にウイルスベクターで感染させ、強制発現させた後、免疫組織科学的試験で未分化マーカーの発現量を観察した結果である。
【図7A】図7Aは、miR−197 siRNAとhsa−mir−520を用いて作成したiPS細胞における各種遺伝子の転写量を調査した結果である。
【図7B】図7Bは、hiPSCと293FT細胞におけるmiRNA−197とhsa−mir−520dの、miRNA発現レベルの関連性をツーステップリアルタイムRT−qPCR(n=5)で評価した結果である。
【図8A】図8Aは、293FT細胞へのhas-mir-520dのウイルス導入後に出現した浮遊細胞集団を顕微鏡的に評価した結果である。
【図8B】図8Bは、520d-293FTの幹性化転換を免疫細胞化学に基づき確認した結果である。
【図8C】図8Cは、520d-293FTのGFP陽性とNANOG陽性状態を調査した結果である。
【図9A】図9Aは、細胞のp53、hTERT等の発現量をRT-PCRで調査した結果である。
【図9B】図9Bは、細胞のp53、hTERT等の発現量をウエスタンブロットで調査した結果である。
【図9C】図9Cは、細胞のmiRNAの発現量を調査した結果である。
【図9D】図9Dは、has-mir-520dの過剰発現時の細胞のmiRNAの発現量を調査した結果である。
【図10A】図10Aは、293FT、mock-293FT、520d-293FTの細胞周期解析の結果である。
【図10B】図10Bは、293FT、mock-293FT、520d-293FTにおけるDNMT 1、HDAC、Sin3A、MBD3の発現量比を調査した結果である。
【図11A】図11Aは、520d-HLFの形態学的変化を調査した結果である。
【図11B】図11Bは、520d-HLFにおける各種mRNAの発現量比を調査した結果である。
【図11C】図11Cは、mock-HLF、520d-HLFの浸潤する性質を調査した結果である。
【図11D】図11Dは、HLF、mock-HLF、520d-HLFにおける各種蛋白質の発現量を、ウエスタンブロットで調査した結果である。
【図12A】図12Aは、mock-HLF、520d-HLFの細胞周期解析の結果である。
【図12B】図12Bは、HLF、hiPSC、520d-HLFにおける各種mRNAの発現量比を調査した結果である。
【図13】図13は、HLF、mock-HLF、520d-HLFにおけるDNMT 1、HDAC、Sin3A、MBD3の発現量比を調査した結果である。
【図14A】図14Aは、腫瘍形成を示す写真である。
【図14B】図14Bは、白色結節を示す写真である。
【図14C】図14Cは、正常肝組織へと転換したことを示す写真である。
【図14D】図14Dは、腺腫様過形成を示す写真である。
【図14E】図14Eは、生成した奇形腫と肝組織を示す写真である。
【図15】図15は、520d-HLFの分化を調査した結果である。
【図16】図16は、520d-HLFを骨分化誘導した結果である。
【図17】図17は、has-mir-520dウイルスが感染したHuh7の形態学的変化等を調査した結果である。
【図18】図18は、has-mir-520dウイルスが感染したT98Gの形態学的変化等を調査した結果である。
【図19】図19は、has-mir-520dウイルスが感染したPK-9の形態学的変化等を調査した結果である。
【図20】図20は、has-mir-520dウイルスが感染したHT1080の形態学的変化等を調査した結果である。
【図21】図21は、siRNA生成ウイルス感染後のHMV-1において、MTT assayを実施した結果である。
【図22】図22は、siRNA生成ウイルス感染後のHMV-1の蛍光顕微鏡写真と増殖曲線である。
【図23】図23は、siRNA生成ウイルス感染後のHMV-1において、colony formation assayを実施した結果である。
【発明を実施するための最良の形態】
【0032】
以下、本発明の実施の形態について詳細に説明する。なお、同様な内容については、繰り返しの煩雑を避けるために適宜説明を省略する。
【0033】
(1)特定の塩基配列を含むポリヌクレオチド
本発明の一実施形態は、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドである。この1または複数本鎖のポリヌクレオチドは、後述する実施例で細胞を多能性幹細胞に誘導することが示唆されている。そのため、この1または複数本鎖のポリヌクレオチドは、細胞を多能性幹細胞へ誘導するために好適に使用できる。
【0034】
また、この1または複数本鎖のポリヌクレオチドは、後述する実施例で未分化細胞マーカーの発現の促進または抑制をすること、多能性幹細胞におけるp53の発現量を促進すること、または悪性腫瘍の抑制に効果があることが示唆されている。そのため、この1または複数本鎖のポリヌクレオチドは、未分化細胞マーカーの発現を調節するために好適に使用できる。または、この1または複数本鎖のポリヌクレオチドは、多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、この1または複数本鎖のポリヌクレオチドは、悪性腫瘍の治療に好適に使用できる。
【0035】
他の実施形態は、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤である。ここで、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果は、上述したとおりである。そのため、この多能性幹細胞誘導剤は、細胞を多能性幹細胞へ誘導するために好適に使用できる。または、この多能性幹細胞誘導剤は、未分化細胞マーカーの発現を調節するために好適に使用できる。または、この多能性幹細胞誘導剤は、多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、この多能性幹細胞誘導剤は、悪性腫瘍の治療に好適に使用できる。
【0036】
他の実施形態は、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドを含有する、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、または悪性腫瘍の治療薬である。ここで、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果は、上述したとおりである。そのため、この未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、または悪性腫瘍の治療薬は、未分化細胞マーカーの発現を調節するために好適に使用できる。または、それらは細胞を多能性幹細胞へ誘導するために好適に使用できる。または、それらは多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、それらは悪性腫瘍の治療に好適に使用できる。
【0037】
他の実施形態は、配列番号41の塩基配列を含むポリヌクレオチドを含有する、shRNAまたはpre−miRNAである。ここで、配列番号41の塩基配列を含むポリヌクレオチドの有する効果は、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果と同様である。そのため、このshRNAまたはpre−miRNAは、細胞を多能性幹細胞へ誘導するために好適に使用できる。または、このshRNAまたはpre−miRNAは、未分化細胞マーカーの発現を調節するために好適に使用できる。または、このshRNAまたはpre−miRNAは、多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、このshRNAまたはpre−miRNAは、悪性腫瘍の治療に好適に使用できる。
【0038】
他の実施形態は、配列番号41の塩基配列に相補的な塩基配列を含むポリヌクレオチドを含有する、ベクターである。このベクターは、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドを発現、又は生産するために好適に使用できる。そのため、このベクターは上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の用途(多能性幹細胞誘導剤、治療薬等)に使用できる。
【0039】
またこのベクターは、さらに、配列番号42の塩基配列に相補的な塩基配列を含んでいてもよい。この場合、配列番号41の塩基配列を含むポリヌクレオチドに対して、塩基対を形成可能なポリヌクレオチドを発現、又は生産するために好適に使用できる。また、配列番号41の塩基配列を含むポリヌクレオチドを含有するsiRNA、miRNA、pre−miRNAまたはshRNAを発現、又は生産するために好適に使用できる。
【0040】
上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドは、さらに、配列番号42の塩基配列を含んでいてもよい。この場合、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドが発揮する、RNAiまたはmiRNAの作用効率が上昇すると考えられる。なぜならば、配列番号41の塩基配列と配列番号42の塩基配列とが塩基対を形成することで、RISCに取り込まれやすくなると考えられるためである。また、上記の、1または複数本鎖が1本鎖である場合には、shRNAまたはpre−miRNAの構造をとることができる。また、配列番号42の塩基配列を含む場合、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドがより安定化されると考えられる。また、上記の配列番号41の塩基配列を含む、1または複数本鎖のポリヌクレオチドが、配列番号41の塩基配列からなるRNA鎖の相補鎖を含んでいても同様の効果が得られると考えられる。さらには、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドは、配列番号43の塩基配列を含む1本鎖のポリヌクレオチドであってもよい。この場合、shRNAまたはpre−miRNAとして好適に使用できる。
【0041】
他の実施形態は、配列番号43の塩基配列を含むポリヌクレオチドである。このポリヌクレオチドは、後述する実施例で細胞を多能性幹細胞に誘導すること、未分化細胞マーカーの発現の促進または抑制をすること、多能性幹細胞におけるp53の発現量を促進すること、または悪性腫瘍の抑制に効果があることが示唆されている。そのため、このポリヌクレオチドは、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬の用途に使用できる。また、shRNA、pre−miRNAまたはベクターとしても使用可能である。
【0042】
また、配列番号1、2、3、8、または44〜47の1つ以上の塩基配列を含む1または複数本鎖のポリヌクレオチドは、上述したような配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果と、同様の効果を発揮しうることが、後述する実施例で示唆されている。そのため、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬、siRNA(またはmiRNA)もしくはshRNA(またはpre−miRNA)、またはベクターの用途に使用できる。なお、配列番号1、2、3、8、または44〜47の1つ以上の塩基配列を含む1または複数本鎖のポリヌクレオチドは、それらの相補鎖、またはそれぞれ配列番号4、5、6、9、または48〜51の1つ以上の塩基配列を含むポリヌクレオチドをさらに含んでいても良い。また、配列番号8の塩基配列を含む1または複数本鎖のポリヌクレオチドは、配列番号10の塩基配列を含む1本鎖のポリヌクレオチドであってもよい。また、配列番号44〜47の塩基配列を含む1または複数本鎖のポリヌクレオチドは、それぞれ配列番号52〜55もしくはそれぞれ56〜59の塩基配列を含む1または複数本鎖のポリヌクレオチドであってもよい。
【0043】
これと同様のことは、配列番号7の塩基配列を含むRNA鎖を、ダイサーで処理して得られるRNA鎖に対して相補的な塩基配列(以下、「ダイサー処理後の相補的な塩基配列」と称することもある)を含む、1または複数本鎖のポリヌクレオチドでもいえる。即ち、ダイサー処理後の相補的な塩基配列を含む、1または複数本鎖のポリヌクレオチドは、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬、siRNA(またはmiRNA)もしくはshRNA(またはpre−miRNA)、またはベクターの用途に使用できる。この1または複数本鎖のポリヌクレオチドは、ダイサー処理後の相補的な塩基配列に相補的な配列をさらに含んでいても良い。また、ダイサー処理後の相補的な塩基配列は、配列番号11、12、および13からなる群から選ばれる1種以上の塩基配列を含むRNA鎖に対して、RNAi作用を有する1本鎖または2本鎖のポリヌクレオチドであっても良い。
【0044】
これと同様のことは、配列番号7の塩基配列を含むRNA鎖に対してRNAi作用を有する1本鎖または2本鎖のポリヌクレオチドでもいえる。即ち、配列番号7の塩基配列を含むRNA鎖に対してRNAi作用を有する1本鎖または2本鎖のポリヌクレオチドは、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬、siRNA(またはmiRNA)もしくはshRNA(またはpre−miRNA)、またはベクターの用途に使用できる。
【0045】
(2)実施形態に係るポリヌクレオチドが導入された細胞
他の実施形態は、上記のいずれかの1または複数本鎖のポリヌクレオチド、または上記のいずれかのベクターが導入された細胞である。この細胞は多能性が誘導されているため、再生医療等の医療材料や研究材料として好適に使用できる。
【0046】
またこの細胞は、外来性のc−Mycが無く、内在性のp53が発現しているため、悪性腫瘍化のリスクが低い。このp53の発現量は、例えば、hiPSCのHPS0002:253G1株のp53発現量に対して、1、1.2、1.4、1.6、1.8、2.0、3.0、4.0、5.0、10、100、または1000倍であるが、それらに限定されない。またこの発現量は、ここで例示したいずれか2つの値の範囲内であってもよい。また、p53の発現量の測定方法は、測定精度および簡便性の面からリアルタイムPCRが好ましい。詳しい測定条件については、後述する実施例におけるリアルタイムPCRの測定条件を用いることができる。
【0047】
(3)多能性幹細胞及びその生産方法
他の実施形態は、上記のいずれかの1または複数本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法である。又は、上記のいずれかのベクターを、細胞に導入する工程を含む、多能性幹細胞の生産方法である。この方法を適切に用いれば、多能性幹細胞を生産することができる。なおポリヌクレオチドまたはベクターの細胞への導入、および培養方法は、当該技術分野で公知の方法に従って行うことができる。細胞への導入は、例えば、リン酸カルシウム法、リポフェクション法、エレクトロポレーション法、ウイルス(アデノウイルス、レトロウイルス、HIV等)を用いた方法、またはマイクロインジェクションなどを使用できる[改訂第4版 新 遺伝子工学ハンドブック, 羊土社(2003):152−179.]。また薬剤耐性やセルソーター等を利用して、導入された細胞のみを選択することができる。培地は、例えば、霊長類ES細胞用培地(コスモ・バイオ社)や通常のヒト細胞用の培地(例えば、DMEMやRPMIベースの培地)等を使用できる。一般的にES細胞を樹立する際にはフィーダー細胞と共培養することが多いが、本実施形態の多能性幹細胞はフィーダー細胞の非存在下でも樹立可能である。フィーダー細胞は、例えばEuropean Collection of Cell Culturesより入手できる。さらに、本実施形態の多能性幹細胞は、いずれもF-12 HAM[DMEM(15mM HEPES+1mM Sodium Pyruvate+pyridoxine+NaHCO3+5mML-glutamine)], RPMI-1640+L-glutamine, DMEM+high glucose+L-glutamine+0.1mM NEAA および REPROSTEM(REPROCell社):bFGF 3-10ng/mlからなる群から選ばれる1種以上の培地で37℃、5% CO2、10% FBSの条件で培養可能である。そのため、いわゆるiPS細胞の有する培養上の困難性を克服することにも成功している。
【0048】
他の実施形態は、上記生産方法で得られる多能性幹細胞である。または、HPS0002:253G1株に比べて内在性のp53の発現量が増大している、多能性幹細胞である。または、上記のいずれかの1または複数本鎖のポリヌクレオチドの発現量が増大している、多能性幹細胞である。これらの細胞は、内在性のp53が発現しているため、悪性腫瘍化のリスクが低い。
【0049】
(4)実施形態に係るポリヌクレオチドに関連する配列
ここで、上記の配列番号1〜10、および41〜59の塩基配列は、ある程度であれば変異を受けていてもよい。そのような変異を有している塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。変異型の塩基配列を含むポリヌクレオチドは、人工的に作成することが可能であり、その場合には改変型の塩基配列を含むポリヌクレオチドと呼ぶこともできる。
【0050】
なお、RNAiやmiRNA等の用途で用いる場合には、配列番号4〜6、9、42、48〜51、および56〜59の塩基配列の変異は、配列番号1〜3、8、41、44〜47、および52〜55の塩基配列の変異より大きくても、その機能に変動が生じにくい。なぜならば、配列番号1〜3、8、41、44〜47、および52〜55の塩基配列は、RNAiやmiRNA等の機能を特徴付ける重要な配列であるが、一方で、配列番号4〜6、9、42、48〜51、および56〜59の塩基配列は補助的な配列なためである。
【0051】
また、上記の配列番号1〜10、および41〜59の塩基配列は、それぞれの塩基配列の1もしくは数個の塩基が欠失、置換もしくは付加された塩基配列であっても良い。そのような塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。ここで上記「1もしくは数個」は好ましくは10個以下であり、より好ましくは5個以下であり、より好ましくは4個以下であり、より好ましくは3個以下であり、より好ましくは2個以下であり、さらに好ましくは1個である。なぜならば、上記「1もしくは数個」が少ないほど、野生型に近い特性を有していることになるからである。なお、上記「付加」には挿入の概念を含む。
【0052】
また、上記の配列番号1〜10、および41〜59の塩基配列は、それぞれの塩基配列に対して、80%以上の相同性を有する塩基配列であっても良い。そのような塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。ここで上記「80%以上」は好ましくは85%以上であり、より好ましくは90%以上であり、より好ましくは95%以上であり、より好ましくは96%以上であり、より好ましくは97%以上であり、さらに好ましくは98%以上であり、最も好ましくは99%以上である。なぜならば、上記「80%以上」が大きいほど、野生型に近い特性を有していることになるからである。
【0053】
また、上記の配列番号1〜10、および41〜59の塩基配列は、それぞれの塩基配列に相補的な塩基配列からなるポリヌクレオチドに対して、ストリンジェントな条件でハイブリダイズするポリヌクレオチドであっても良い。そのような塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。
【0054】
本明細書において「相同性」とは、2つもしくは複数間の塩基配列の同一の塩基数の割合を、当該技術分野で公知の方法に従って算定したものである。割合を算定する前には、比較する塩基配列群の塩基配列を整列させ、同一の割合を最大にするために必要である場合は塩基配列の一部に間隙を導入する。また、最適に整列した状態において、オーバーラップする塩基を含めた全塩基に対する、同一の塩基数の割合を意味する。整列のための方法、割合の算定方法、およびそれらに関連するコンピュータプログラムは、当該技術分野で従来からよく知られており、一般的な配列分析プログラム(例えば、GENETYX、GeneChip Sequence Analysisなど)を使用して測定することができる。
【0055】
本明細書において「ストリンジェントな条件」とは、例えば(1)洗浄のための低イオン強度と高温度、例えば、50℃において0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウムを用いる、(2)ハイブリダイゼーション中にホルムアミド等の変性剤、例えば、42℃において50%(vol/vol)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウムバッファー(pH6.5)、および750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いる、または(3)42℃において50%ホルムアミド、5×SSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5×デンハート液、超音波処理サケ精子DNA(50μg/ml)、0.1%SDS、および10%のデキストラン硫酸と、42℃において0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)中での洗浄および55℃のホルムアミド、次いで55℃におけるEDTAを含む0.1×SSCにてストリンジェントな洗浄を含む条件であっても良い。また中程度にストリンジェントな条件の例は、20%ホルムアミド、5×SSC、50mMリン酸ナトリウム(pH7.6)、5×デンハート液、10%デキストラン硫酸、および20mg/mlの変性剪断サケ精子DNAを含む溶液中において、37℃で一晩インキュベーション、次いで1×SSC中37〜50℃でのフィルターの洗浄のような条件である。なお、ハイブリダイゼーション反応のストリンジェンシーは、当業者によって容易に決定でき、一般的にプローブ長、洗浄温度、および塩濃度に依存する。一般に、長いプローブは適当なアニーリングのために高温を必要とし、短いプローブは低温を必要とする。また一般に、ストリンジェンシーは塩濃度に逆比例する。
【0056】
通常、遺伝子工学や生命工学の分野では、ポリヌクレオチド中の塩基がある程度の変異や欠失等をしていても、野生型と同様の機能が保たれることが知られている。また、2つのポリヌクレオチド間での塩基のミスマッチについてもある程度許容されることが知られている。後述する実施例においても、実際にポリヌクレオチド中の塩基の欠失や、ミスマッチが存在する。例えば、RGM249 shRNAに1塩基の欠失があっても、悪性腫瘍抑制効果がみられている(図1B、図1D)。このことは、ある程度の欠失等が生じても、野生型と同様の機能が保たれることを示唆している。miR−47 siRNAの配列をみると、ガイド鎖とパッセンジャー鎖の間に3つのミスマッチが存在している(図3B)。miR−101 siRNAの配列をみると、ガイド鎖とパッセンジャー鎖間に1つのミスマッチが存在している(図3B)。miR−47とmiR−47 siRNAのガイド鎖の間に3つのミスマッチが存在している(図3C)。これらのことは、RNAiまたはmiRNAの機能は、2本鎖がある程度ミスマッチを有していても生じることを示唆している。
【0057】
(5)実施形態に係るポリヌクレオチドに関連するその他の特徴
本明細書において「多能性幹細胞」とは、多能性を有しており、様々な細胞へ分化することができる細胞である。例えば、国際公開第2007/069666号や、文献[Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.]に生産方法や特性の例が記載されている。また、多能性幹細胞は当業者であれば認識できるが、例えば、ヒト人工多能性幹細胞であるhiPSC(HPS0002 253G1)に比べて、いずれかの未分化マーカーを同程度かそれ以上発現している細胞を含む。
【0058】
本明細書において「未分化細胞マーカー」とは、未分化の細胞で特異的に発現しているDNA鎖、RNA鎖、または蛋白質等の化合物の総称である。例えば、Klf4、c−Myc、Oct4、Sox2、PROM1、Nanog、SSEA−1、ALP、eRas、Esg1、Ecat1、Fgf4、Gdf3、REX−1などが挙げられる。多能性幹細胞マーカーということもある。
【0059】
本明細書において「RNAi」とは、siRNA(short interfering RNA)やshRNA(short hairpin RNA)、短鎖または長鎖の1または複数本鎖RNA等によって、標的遺伝子やmRNA等の機能が抑制される現象である。一般的に、この抑制は配列特異的であり、様々な生物種に存在する。siRNAを用いた場合の、典型的な哺乳類におけるRNAiのメカニズムは以下の通りである。まず、siRNAを細胞内に導入すると、siRNAの一本鎖化が起こり、その後RISC(RNA-induced Silencing Complex)を形成する。RISCは取り込まれた1本鎖RNAをガイド分子として、この1本鎖RNAと相補性の高い配列を持つ標的RNA鎖を認識する。標的RNA鎖はRISC内のAGO2によって、siRNAの中心部分で切断される。その後、切断された標的RNA鎖は分解される。以上が典型的なメカニズムであるが、その他に、生体内のmiRNAを標的として抑制した例が文献[Krutzfeldt et al., Nucleic Acids Res. 2007;35(9):2885-92. Epub 2007 Apr 16.]に記載されている。なお、本明細書において「RNAi作用を有する分子」は、RNAi作用を引き起こすことができる分子であり、例えば、siRNA、shRNA等を含む。
【0060】
本明細書において「siRNA」とは、RNAiを引き起こす2本鎖のポリヌクレオチドである。一般的にsiRNAの2本鎖はガイド鎖とパッセンジャー鎖に分けることができ、ガイド鎖がRISCに取り込まれる。RISCに取り込まれたガイド鎖は、標的RNAを認識するために使われる。RNAi研究では主に人工的に作成したものが使用されるが、生体内において内在的に存在するものも知られている。
【0061】
本明細書において「miRNA(microRNA)」とは、siRNAと類似の機能を有しているポリヌクレオチドであり、標的RNA鎖の翻訳抑制や分解をすることが知られている。pre−miRNAは、miRNAの前駆体である。miRNAとsiRNAとの違いは、一般的に生成経路と、詳細なメカニズムにある。生体内におけるmiRNAの典型的な生成経路は以下の通りである。まず、miRNA遺伝子から長いpri−RNA(primary miRNA)として転写される。このpri−miRNAの中には、後にmiRNAになる配列が含まれており、その部分はヘアピン構造をとっている。このヘアピン構造の根本をDroshaが切断する。切り出されたヘアピンはpre−miRNAと呼ばれる。このpre−miRNAはExportin−5によって細胞質に運ばれる。次に細胞質においてDicerがpre−miRNAを切断することで2本鎖のmiRNAができ、さらにこれが1本鎖化してRISCを形成する。この1本鎖RNAがガイド分子として働いて、標的RNA鎖を認識し、切断または翻訳抑制する。以上が典型的なmiRNAの生成経路である。なお、本明細書において「miRNA作用を有する分子」は、miRNA作用を引き起こすことができる分子であり、例えば、miRNA、pre−miRNA、pri−miRNA等を含む。
【0062】
本明細書において「shRNA」とは、ヘアピン状に折りたたまれた構造(ヘアピン様構造)を形成可能な1本鎖のポリヌクレオチドであり、RNAiを誘導する機能を有する。pre−miRNAと類似の構造をしており、通常細胞内ではDicerによって切断され、siRNAが切り出される。このsiRNAによって標的RNAの切断が生じることが知られている。
【0063】
本明細書において「small RNA」とは、比較的小さいRNAをいい、例えば、siRNA、miRNA、shRNA、pre−miRNA、1または複数本鎖の低分子RNAなどを挙げることができるが、それらに限定されない。塩基数は、例えば15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90、または100塩基であるが、それらに限定されない。またこの塩基数は、ここで例示したいずれか2つの値の範囲内であってもよい。
【0064】
本明細書において「ダイサー(Dicer)」は、siRNAやmiRNA等の前駆体を切断して、siRNAやmiRNA等を切りだす機能を有している酵素を含む。例えば、dsRNAをsiRNAへ、pre−miRNAをmiRNAへ、shRNAをsiRNAへと導くことができる。また、ダイサーは上記以外のいくつかの機能を有していることが知られている。
【0065】
上記の1または複数本鎖は、1本鎖または2本鎖であってもよい。この場合、siRNA、miRNA、shRNA、またはアンチセンスRNAのメカニズムを利用することができる。
【0066】
上記の1または複数本鎖のポリヌクレオチドは、いずれかを個々で使用してもよいが、2つ以上を併用してもよい。そのような場合でも、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、または悪性腫瘍の治療薬として好適に使用できる。なお2つ以上を併用する場合の併用割合は特に限定しない。
【0067】
上記の1または複数本鎖のポリヌクレオチドは、RNAi作用を有していてもよい。この場合、標的とするRNA鎖をRNAi作用によって分解することが可能である。
【0068】
上記の1または複数本鎖のポリヌクレオチドは、small RNAであってもよい。この場合、インターフェロン応答等の不利益な現象が生じるリスクが低い。インターフェロン応答とは、一般的に細胞が2重鎖RNA(dsRNA)を感知することによって抗ウイルス状態になる現象として知られている。長鎖のdsRNAを細胞に導入した場合に、dsRNA応答性プロテインキナーゼ(PKR)が活性化し、インターフェロン反応が誘導されることが報告されている(Gil et al., Apoptosis. 2000 Apr;5(2):107-14.)。その結果、非特異的な遺伝子発現の抑制やアポトーシスが誘導されるといわれている。
【0069】
上記の1または複数本鎖のポリヌクレオチドは、例えば、15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90、100、200、または500ヌクレオチドであるが、それらに限定されない。この数は、ここで例示したいずれか2つの値の範囲内であってもよい。この数が15以上であれば、標的のポリヌクレオチドに対して精度よく結合できる可能性が高まる。また、この数が100以下であれば、インターフェロン応答等の不利益な現象が生じるリスクが低くなる。この現象は、ヌクレオチド数が少ないほど生じにくいと考えられる。
【0070】
上記の1または複数本鎖のポリヌクレオチドは、1本鎖の場合にはshRNAであってもよく、2本鎖の場合にはsiRNAであってもよい。この場合、標的とするRNA鎖をRNAi作用によって分解することが可能である。また、塩基対を形成しているため、RISCに取り込まれやすくなり効率的にRNAiが生じる(Martinez et al., Cell. 2002 Sep 6;110(5):563-74.)。また、2本鎖の場合には、miRNAであっても良い。この場合、標的とするRNA鎖をmiRNA作用によってサイレンシングすることが可能である。また、1本鎖でshRNAのようなへアピン構造を有していない場合であってもよい。そのような構造でも、標的RNA鎖の発現抑制を奏することが文献[Hohjoh et al., FEBS Lett. 2002 Jun 19;521(1-3):195-9.]に記載されている。
【0071】
また、上記shRNAは35以上のヌクレオチドから構成されていてもよい。35以上であれば、shRNAに特有のへアピン様構造を精度よく形成できる可能性が高まる。また、上記shRNAは100以下のヌクレオチドから構成されていてもよい。100以下であれば、インターフェロン応答等の不利益な現象が生じるリスクが低くなる。但し、一般的にshRNAと構造および機能が類似しているpre−miRNAの多くが、100ヌクレオチド程度またはそれ以上の長さを有していることから、shRNAの長さは必ずしも100ヌクレオチド以下でなくても、shRNAとして機能できると考えられる。また、文献[Lin et al., RNA. 2008 Oct;14(10):2115-24. Epub 2008 Aug 28.]には、人工的にpre−miRNAを4つ結合させた大きな分子でも機能できることが示唆されている。そのため、この数はshRNAとして機能できれば限定されず、例えば、35、36、37、38、39、40、45、50、55、60、65、70、75、80、85、90、95、100、200、または500ヌクレオチドである。またこの数は、ここで例示したいずれか2つの値の範囲内であってもよい。また、pre−miRNAも同様の理由から、shRNAと同程度の数のヌクレオチドを有していても良い。
【0072】
また、上記siRNAまたはmiRNAのガイド鎖は15以上のヌクレオチドから構成されていてもよい。15以上であれば、標的のポリヌクレオチドに対して精度よく結合できる可能性が高まる。また、それらガイド鎖は40以下のヌクレオチドから構成されていてもよい。40以下であれば、インターフェロン応答等の不利益な現象が生じるリスクが低くなる。この数は、例えば15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、または40ヌクレオチドであるが、それらに限定されない。またこの数は、ここで例示したいずれか2つの値の範囲内であってもよい。
【0073】
上記の1または複数本鎖のポリヌクレオチド、shRNA、siRNA、miRNA、およびpre−miRNAは、1〜5ヌクレオチドからなるオーバーハングを含んでいてもよい。この場合、RNAiの効率が上昇すると考えられる。この数は、例えば5、4、3、2、または1ヌクレオチドであるが、それらに限定されない。またこの数は、ここで例示したいずれか2つの値の範囲内であってもよい。
【0074】
上記のベクターとしては、大腸菌由来のプラスミド(例えば、pBR322、pBR325、pUC12、pUC13)、枯草菌由来のプラスミド(例、pUB110、pTP5、pC194)、酵母由来プラスミド(例、pSH19、pSH15)、λファージなどのバクテリオファージ、HIV、アデノウイルス、レトロウイルス、ワクシニアウイルス、バキュロウイルスなどのウイルス由来のベクター、pA1−11、pXT1、pRc/CMV、pRc/RSV、pcDNAI/Neo、pSUPER(OligoEngine社)、BLOCK-it Inducible H1 RNAi Entry Vector(インビトロジェン社)、pRNATin-H1.4/Lenti (GenScript, corp., NJ, USA)などを用いることができる。
【0075】
上記の多能性幹細胞誘導剤は、体細胞を多能性幹細胞へ誘導する機能を有していてもよい。この場合、体細胞から多能性幹細胞を作成することができる。本明細書において「体細胞」とは、生殖細胞を除いた他の細胞のことで、皮膚由来の細胞、線維芽細胞等が含まれる。体細胞は通常、多能性が限定されているかまたは消失している。本明細書において「多能性幹細胞誘導剤」とは、細胞を多能性幹細のような多能性を有している細胞に近づける作用を持った物質のことである。本明細書において「リプログラミング」とは細胞を多能性幹細のような多能性を有している細胞に近づける作用のことである。
【0076】
上記の多能性幹細胞誘導剤は、悪性腫瘍細胞を多能性幹細胞へ誘導する誘導剤であってもよい。この場合、悪性腫瘍細胞から多能性幹細胞を作成することができる。本明細書において「悪性腫瘍」とは、正常な細胞が突然変異を起こして増殖を続けることで起こる疾患を含む。また、癌腫、肉腫を含む。悪性腫瘍は全身のあらゆる臓器や組織から生じ、悪性腫瘍細胞が増殖すると、かたまりとなって周囲の正常な組織に侵入し破壊することが知られている。癌は、例えば、肺癌、食道癌、胃癌、肝臓癌、膵臓癌、腎臓癌、副腎癌、胆道癌、乳癌、大腸癌、小腸癌、子宮頸癌、子宮体癌、卵巣癌、膀胱癌、前立腺癌、尿管癌、腎盂癌、尿管癌、陰茎癌、精巣癌、脳腫瘍、中枢神経系の癌、末梢神経系の癌、頭頸部癌(口腔癌、咽頭癌、喉頭癌、鼻腔・副鼻腔癌、唾液腺癌、甲状腺癌等)、グリオーマ、多形性膠芽腫、皮膚癌、メラノーマ、甲状腺癌、唾液腺癌、血液の癌、または悪性リンパ腫などを含む。
【0077】
上記の多能性幹細胞誘導剤は、肝臓癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍の細胞を多能性幹細胞へ誘導する誘導剤であってもよい。この場合、それらの悪性腫瘍細胞から多能性幹細胞を作成することができる。悪性腫瘍細胞を多能性幹細胞へ誘導することはこれまでにほとんど報告されておらず、新しい革新的な悪性腫瘍の治療方法として期待できる。
【0078】
上記の多能性幹細胞は、内在性のp53を発現していてもよい。この場合、悪性腫瘍化が生じにくいと考えられる。なお、p53の発現量は、コントロール試料(例えば、p53ノックアウト細胞、正常細胞、またはそれらに由来する試料等)に比べて有意に高発現していることが好ましい。明細書において「有意に」とは、例えばコントロール群と被検査群との間の統計学的有意差をスチューデント(Student)のt検定を使用して評価し、p<0.05であるときを含む。本明細書において「コントロール群」とは、被検査群と異なる条件下に置かれた試料のことであり、当該技術分野において通常使用される範囲内の概念で表すことができる。
【0079】
p53は一般的に悪性腫瘍抑制遺伝子に分類される遺伝子であり、DNAが損傷したときに活性化されて、細胞分裂の停止と損傷の修復を誘導する機能が知られている。一方で、p53をノックアウトやノックダウンさせると、iPS細胞の作成効率が上昇することが報告されている(Zhao et al., Cell Stem Cell. 2008 Nov 6;3(5):475-9.、 Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.)。これらことは、p53による悪性腫瘍抑制とiPS細胞作成の効率化は、トレードオフの関係にあることを示している。また、p53を欠損したES細胞は染色体が不安定であることや、分化誘導に対して抵抗性を持つことが報告されている(Lin et al., Nat Cell Biol. 2005 Feb;7(2):165-71. Epub 2004 Dec 26.)。これは分化誘導後に未分化細胞が残存する可能性が高いことを意味している。そのため、再生医療においてp53を欠損させた細胞を移植した場合に、悪性腫瘍形成のリスクが高まると考えられる。従って、この面からもp53は細胞にとって重要な分子であることがわかる。
【0080】
本明細書において「内在性」とは、被検物質が細胞の内部のメカニズムに由来して存在していることを表している。例えば、細胞内で恒常的に発現している蛋白質は、その発現した蛋白質に限っては内在性に含まれる。
【0081】
上記の未分化細胞マーカー発現調節剤において、未分化細胞マーカーはKlf4、c−Myc、Oct4、Sox2、PROM1からなる群から選ばれる1種以上の未分化細胞マーカーであってもよい。未分化細胞マーカーや各種蛋白質は、RT−PCR(Reverse Transcription Polymerase Chain Reaction)などの公知の方法を用いて検出することができる。RT−PCRは、RNA鎖を鋳型に逆転写を行い、生成されたcDNAに対してPCRを行う方法である。なお、トータルRNAは細胞からグアニジンチオシアネート法、市販の試薬またはキットを使用して抽出できる。細胞は、インビトロジェン株式会社、三光純薬株式会社、タカラバイオ株式会社等から購入できる。また未分化細胞マーカーや各種蛋白質は、さらにリアルタイムPCRと組み合わせて検出することもできる。そのような方法は、リアルタイムRT−PCRと呼ばれる。リアルタイムPCRは、PCRによって増幅する核酸をリアルタイムでモニタリングする方法である。例えば、文献[原理からよくわかるリアルタイムPCR実験ガイド、羊土社、2007/12]に記載の手順によって行うことができる。上記モニタリングの方法としては、インターカレーション法、ハイブリダイゼーション法、LUX(Light Upon eXtensyon)法などが挙げられる。インターカレーション法の典型的な方法は、SYBR(r) Green Iなどの蛍光物質が二本鎖の核酸に入り込み、励起光の照射によって発光を発する特性を利用して核酸量を測定する方法である。蛍光の強さは核酸の量に比例して強くなるため、蛍光強度を測定することによって核酸の増幅量を知る事ができる。また、リアルタイムPCRを使用した定量方法では、大きく分けて絶対定量法と相対定量法の2つの定量方法がありそれらを適宜使用できる。
【0082】
本明細書において「発現調節剤」とは、標的蛋白質またはmRNAの発現量を増加または減少させることが可能な物質を含む。ここで、増加または減少する量は、コントロール細胞に比べて有意差があることが好ましい。
【0083】
上記の悪性腫瘍の治療薬は、さらに、DDS(Drug Delivery System)を含んでいてもよい。この場合、ポリヌクレオチドを細胞内に効率的に導入できる。DDSとしては、ゼラチンハイドロゲルまたはアテロコラーゲンを含む。本明細書において「ゼラチンハイドロゲル」とは、ゼラチンを原料としたハイドロゲルでDDSとして使用できる。ゼラチンハイドロゲルは生体適合性、生体吸収性に優れている。本明細書において「アテロコラーゲン」とは、アテロコラーゲンを原料としたDDSである。細胞への導入効率や安全性に優れている。アテロコラーゲンとは、一般的にコラーゲンに含まれるテロペプチドを酵素的に分解したもので、免疫反応を誘発し難い。
【0084】
上記の悪性腫瘍の治療薬において、悪性腫瘍は肝臓癌、肺癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍であってもよい。この場合、それらの悪性腫瘍の治療が可能になる。特にこれらの悪性腫瘍はいずれも革新的な治療方法が無いために、上記の悪性腫瘍の治療薬は有望な治療薬である。
【0085】
本明細書において「肝臓癌」とは、肝臓の細胞が増殖を続けることで起こる疾患を含む。肝臓癌を生起させることができる肝細胞は胆管、門静脈のような血管の細胞、樹状細胞または肝細胞を含む。また、原発性肝癌と転移性肝癌を含む。原発性肝癌の多くは肝細胞癌(hepatocellular carcinoma)であることが知られている。
【0086】
本明細書において「肺癌」とは、気管、気管支、肺胞の上皮細胞等に発生する悪性腫瘍を含み、病理学的には、腺癌、扁平上皮癌、大細胞癌、小細胞癌に分類できる。進展形式や治療反応性などが小細胞癌とその他の癌とでは異なるため、腺癌、扁平上皮癌および大細胞癌はまとめて非小細胞癌とも呼ばれる。カルチノイドや円柱種など、小細胞癌および非小細胞癌に含まれない少数の腫瘍もある。
【0087】
本明細書において「膵臓癌」とは、膵臓から発生した悪性腫瘍を含む。膵臓は、膵液を産生する腺房、膵液を運ぶ膵管、および内分泌腺であるランゲルハンス島などからなる。癌はいずれの組織からも発生しうる。例えば、浸潤性膵管癌、膵内分泌腫瘍、膵管内乳頭粘液性腫瘍、粘液性嚢胞腫瘍、腺房細胞癌、漿液性嚢胞腺癌等が挙げられる。
【0088】
本明細書において「肉腫」とは、骨、軟骨、脂肪、筋肉、血管等の非上皮性細胞由来の結合組織細胞に発生する悪性腫瘍を含む。例えば、線維肉腫、悪性線維性組織球腫、皮膚線維肉腫、脂肪肉腫、横紋筋肉腫、平滑筋肉腫、血管肉腫、カポジ肉腫、リンパ管肉腫、滑膜肉腫、胞巣状軟部肉腫、骨外性軟骨肉腫、骨外性骨肉腫、悪性末梢神経鞘腫瘍、骨肉腫、軟骨肉腫、顆粒球肉腫、ユーイング肉腫、骨原発の線維肉腫、悪性骨巨細胞腫、骨原発の脂肪肉腫、骨原発の血管肉腫等が挙げられる。
【0089】
本明細書において「グリオーマ」とは、神経膠細胞から発生する悪性腫瘍を含む。例えば、星状膠細胞系腫瘍、稀突起膠細胞系腫瘍、上衣系腫瘍、脈絡叢腫瘍、多形性膠芽腫等が挙げられる。
【0090】
本明細書において「メラノーマ」とは、皮膚、眼窩内組織、口腔粘膜上皮などに発生するメラノサイト由来の悪性腫瘍を含む。例えば、悪性黒子型黒色腫、表在拡大型黒色腫、結節型黒色腫、末端黒子型黒色腫等が挙げられる。
【0091】
本明細書において「ポリヌクレオチド」とは、ヌクレオチドもしくは塩基、またはそれらの等価物が、複数結合した形態で構成されているものを含む。ヌクレオチドおよび塩基は、DNA塩基またはRNA塩基を含む。上記の等価物は、例えばDNA塩基またはRNA塩基がメチル化等の化学修飾を受けているもの、またはヌクレオチドアナログを含む。ヌクレオチドアナログは、非天然のヌクレオチドを含む。「DNA鎖」とは、DNA塩基またはそれらの等価物が2個以上連結した形態のことを表す。「RNA鎖」とは、RNA塩基またはそれらの等価物が2個以上連結した形態のことを表す。「塩基配列」とは、ポリヌクレオチドを構成するヌクレオチドまたはその等価物の配列である。一般的に塩基配列は、A(アデニン)、G(グアニン)、C(シトシン)、T(チミン)によって表すことができる。また、TとU(ウラシル)は、用途に合わせて互いに読み替えることが可能である。例えば、代表的なデータベースであるNCBI Reference Sequenceにおいて、DNA鎖およびRNA鎖の塩基配列を表すときにA、G、C、Tが用いられている。なお、ポリヌクレオチドはDNA/RNA合成装置を用いて合成可能である。その他、DNA塩基またはRNA塩基合成の受託会社(例えば、インビトロジェン社やタカラバイオ社等)から購入することもできる。また、siRNA、miRNA、shRNA、pre−miRNA、またはそれらをコードするベクターの合成も各メーカーに委託することができる。
【0092】
そのようなsiRNA等のデザインには、Stealth RNAi designer(Invitrogen)やsiDirect 2.0(Naito et al., BMC Bioinformatics. 2009 Nov 30;10:392.)等を使用できる。RNAi作用またはmiRNA作用の確認は、リアルタイムRT−PCRによるRNA鎖発現量の定量によって行なうことができる。または、ノザンブロットによるRNA鎖発現量の解析や、ウェスタンブロットによる蛋白量の解析・表現型の観察等の方法でも行うことができる。特にリアルタイムRT−PCRによる方法が効率的である。
【0093】
本明細書において「相補鎖」とは、一つのポルヌクレオチドに対して、ハイブリダイズすることが可能な相補性の高い他のポリヌクレオチドである。本明細書において「ハイブリダイズ」とは、複数のポリヌクレオチド間において、塩基間の水素結合等によって塩基対ができる性質のことを表す。塩基対はワトソン・クリック型塩基対、フーグスティーン型塩基対、または任意の他の配列特異的な形で生じうる。2つの1本鎖がハイブリダイズした状態は2本鎖と呼ばれる。また「相補的」とは、例えば一つのポリヌクレオチドに対して、AにはT、GにはCが対応する形で、他のポリヌクレオチドがハイブリダイズすることが可能な形態を含む。
【0094】
本明細書において「治療」とは、被験者の疾患または疾患に伴う1つ以上の症状の、予防または症状改善効果を発揮しうることをいう。
【0095】
本明細書において「被験者」とは、ヒトもしくはその他哺乳動物(例えば、マウス、ラット、ウサギ、ウシ、サル、チンパンジー、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)を含む。好ましくは、マウス、ラット、サル、チンパンジー、またはヒトであり、特に好ましくはヒトである。なぜならば、ヒトであればヒトの疾患の治療や、ヒト用の治療薬または診断薬の開発等に、上記の1または複数本鎖のポリヌクレオチドを利用できるためである。また、マウス、ラット、サル、およびチンパンジーは、世界中で研究用のモデル動物として汎用され多くの特性が明らかになっているため、これらの生物に対して、上記の1または複数本鎖のポリヌクレオチドの薬効薬理を調査することで、より優れた治療薬等の開発のために特に有用な情報が得られる。
【0096】
また、上記の1または複数本鎖のポリヌクレオチドを治療薬または予防薬として使用する場合、単独で投与することも可能ではあるが、通常はDDSまたは薬理学的に許容される1つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野においてよく知られる任意の方法により製造した医薬製剤として提供するのが好ましい。また、上記の1または複数本鎖のポリヌクレオチドを直接使用せずに、上記の1または複数本鎖のポリヌクレオチドの前駆体を投与することも可能である。
【0097】
また、上記の1または複数本鎖のポリヌクレオチドを生体に投与する際の投与経路は、治療に際して最も効果的なものを使用するのが好ましく、経口投与または口腔内、気道内、直腸内、皮下、筋肉内、腹腔内、眼内または静脈内などの非経口投与をあげることができ、全身または局部的に投与することができる。投与経路は、好ましくは非経口投与あげることができる。後述する実施例のように、皮下または静脈内投与であっても良い。この場合、1または複数本鎖のポリヌクレオチドが患部へ到達する効率が高い。
【0098】
その他の投与形態としては、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、注射剤、座剤、噴霧剤、軟膏、テープ剤などがあげられる。経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤などがあげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖などの糖類、ポリエチレングリコール、プロピレングリコールなどのグリコール類、ゴマ油、オリーブ油、大豆油などの油類、p−ヒドロキシ安息香酸エステル類などの防腐剤、ストロベリーフレーバー、ペパーミントなどのフレーバー類などを添加剤として用いて製造できる。さらに、カプセル剤、錠剤、散剤、顆粒剤などは、乳糖、ブドウ糖、ショ糖、マンニトールなどの賦形剤、デンプン、アルギン酸ナトリウムなどの崩壊剤、ステアリン酸マグネシウム、タルクなどの滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチンなどの結合剤、脂肪酸エステルなどの界面活性剤、グリセリンなどの可塑剤などを添加剤として用いて製造できる。
【0099】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤などがあげられる。注射用の水溶液としては、例えば生理食塩水、ブドウ糖やその他の補助薬を含む等張液、例えばD−ソルビトール、D−マンノース、D−マンニトール、塩化ナトリウムが挙げられ、適当な溶解補助剤、例えばアルコール、具体的にはエタノール、ポリアルコール、例えばプロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤、例えばポリソルベート80(TM)、HCO−50と併用してもよい。座剤はカカオ脂、水素化脂肪またはカルボン酸などの担体を用いて調製することができる。また、噴霧剤は上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤、ないしは受容者の口腔および気道粘膜を刺激せず、かつ上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤を微細な粒子として分散させ吸収を容易にさせる担体、などを用いて調製することができる。この担体としては具体的には乳糖、グリセリンなどが例示できる。上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤と、用いる担体の性質により、エアロゾル、ドライパウダーなどの製剤化が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0100】
また、上記の治療薬または予防薬は、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調製された注射液は通常、適当なアンプルに充填される。このようにして得られる製剤は安全で低毒性であるので、例えば、ヒトや哺乳動物(例えば、ラット、マウス、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して投与することができる。
【0101】
また、投与方法は被験者の年齢、症状、対象臓器等により適宜選択することができる。上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤を含有する医薬組成物の投与量としては、例えば、一回につき体重1kgあたり0.0001mgから1000mgの範囲で選ぶことが可能である。あるいは、例えば、被験者あたり0.001〜100000mg/bodyの範囲で投与量を選ぶことができるが、これらの数値に必ずしも制限されるものではない。体重1kgあたりの投与量は、例えば0.0001、0.01、1、50、100、250、500、または1000mgである。この投与量は、ここで例示したいずれか2つの値の範囲内であってもよい。投与量は目的とする治療効果、投与方法、治療期間、年齢、体重などにより異なる。投与量、投与方法は、被験者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。また、適切な化学療法薬と併用で投与してもよい。
【0102】
上記の1または複数本鎖のポリヌクレオチドは、悪性細胞の抑制等の効果を通して、畜産において動物の成育を補助するための添加剤などにも使用できる。
【0103】
また本発明の他の実施形態は、上記の1または複数本鎖のポリヌクレオチドを含む、試薬またはキットである。この試薬またはキットは、上記の1または複数本鎖のポリヌクレオチドの有する効果を通して、研究用の試薬もしくはキット、または医療用のキットとして使用できる。たとえば、iPS細胞作成用、人工臓器作成用、悪性腫瘍細胞抑制用、未分化マーカー発現調節用、またはp53発現細胞作成用の添加物、補助物質として使用できる。また、キットには上記の1または複数本鎖のポリヌクレオチドを用いる際の使用方法もしくは使用例を記載した指示書、その指示書の所在を記載した文面、または種々のバッファーを含んでいてもよい。
なお、本発明の一実施形態は、以下の(1)〜(33)のいずれかの実施形態を含んでいてもよい。
(1)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(2)
前記1本鎖または2本鎖のポリヌクレオチドが、miRNA作用を有する、(1)に記載の多能性幹細胞誘導剤。
(3)
前記1本鎖または2本鎖のポリヌクレオチドが、small RNAである、(1)に記載の多能性幹細胞誘導剤。
(4)
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖または2本鎖のRNA鎖である、(1)に記載の多能性幹細胞誘導剤。
(5)
前記1本鎖または2本鎖のポリヌクレオチドが、15以上のヌクレオチドからなる、(1)に記載の多能性幹細胞誘導剤。
(6)
前記1本鎖または2本鎖のポリヌクレオチドが、100以下のヌクレオチドからなる、(5)に記載の多能性幹細胞誘導剤。
(7)
前記1本鎖のポリヌクレオチドがshRNAまたはpre−miRNAであり、前記2本鎖のポリヌクレオチドがsiRNAまたはmiRNAである、(1)に記載の多能性幹細胞誘導剤。
(8)
前記shRNAまたはpre−miRNAが35〜100ヌクレオチドからなり、前記siRNAまたはmiRNAのガイド鎖が15〜40ヌクレオチドからなる、(7)に記載の多能性幹細胞誘導剤。
(9)
前記shRNA、前記pre−miRNA、前記siRNA、および前記miRNAが、1〜5ヌクレオチドからなるオーバーハングを含む、(7)に記載の多能性幹細胞誘導剤。
(10)
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号42の塩基配列、またはその塩基配列に対して1〜5個の塩基が欠失、置換もしくは付加された塩基配列を含む、(1)に記載の多能性幹細胞誘導剤。
(11)
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号41の塩基配列からなるポリヌクレオチドの相補鎖を含む、(1)に記載の多能性幹細胞誘導剤。
(12)
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖のポリヌクレオチドであり、且つpre−miRNAである、(1)に記載の多能性幹細胞誘導剤。
(13)
前記1本鎖のポリヌクレオチドが、配列番号43の塩基配列、またはその塩基配列に対して1〜4個の塩基が欠失、置換もしくは付加された塩基配列を含む、(12)に記載の多能性幹細胞誘導剤。
(14)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含むsmall RNAを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(15)
a)配列番号43の塩基配列、
b)配列番号43の塩基配列に対して、80%以上の相同性を有する塩基配列、
c)配列番号43の塩基配列において1もしくは数個の塩基が欠失、置換もしくは付加された塩基配列、
d)配列番号43の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含むポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(16)
体細胞を多能性幹細胞へ誘導する、(1)に記載の多能性幹細胞誘導剤。
(17)
悪性腫瘍細胞を多能性幹細胞へ誘導する、(1)に記載の多能性幹細胞誘導剤。
(18)
前記悪性腫瘍が、肝臓癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、(17)に記載の多能性幹細胞誘導剤。
(19)
前記多能性幹細胞が、内在性のp53を発現している、(1)に記載の多能性幹細胞誘導剤。
(20)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤。
(21)
(20)に記載の未分化細胞マーカー発現調節剤であって、前記未分化細胞マーカーが、Klf4、c−Myc、Oct4、Sox2、PROM1からなる群から選ばれる1種以上の未分化細胞マーカーである、未分化細胞マーカー発現調節剤。
(22)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、多能性幹細胞におけるp53の発現量を促進する、多能性幹細胞のp53発現促進剤。
(23)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法。
(24)
(23)に記載の生産方法で得られる、多能性幹細胞。
(25)
HPS0002:253G1株に比べて内在性のp53の発現量が増大している、(24)に記載の多能性幹細胞。
(26)
フィーダー細胞の非存在下で培養可能である、(25)に記載の多能性幹細胞。
(27)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有する、悪性腫瘍の治療薬。
(28)
(27)に記載の悪性腫瘍の治療薬であって、前記悪性腫瘍が、肝臓癌、肺癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、悪性腫瘍の治療薬。
(29)
前記悪性腫瘍が肉腫である、(27)に記載の悪性腫瘍の治療薬。
(30)
配列番号41の塩基配列に相補的な塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列をコードするポリヌクレオチドを含む、ベクター。
(31)
(30)に記載のベクターを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(32)
(30)に記載のベクターを含む、悪性腫瘍の治療薬。
(33)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列を含むポリヌクレオチドを含む、
多能性幹細胞誘導用、未分化細胞マーカー発現調節用、多能性幹細胞のp53発現促進用、または悪性腫瘍の治療用のキット。
【0104】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【実施例】
【0105】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0106】
<実施例1:RGM249 shRNAのマウスへの投与と、抗癌作用の評価>
(1−1)RGM249 shRNAの作成
Stealth RNAi designer(Invitrogen, CA, USA)によってRGM249 shRNAの配列をデザインし、BLOCK-it Inducible H1 RNAi Entry Vector (Invitrogen, CA, USA)を用いてRGM249 shRNAを生成するベクター(RGM249 shRNAプラスミド)を作成した。このRGM249 shRNAは、生体内においてRGM249 mRNAに対するRNAiを誘導するように設計されたsmall RNAである。
【0107】
ここで、RGM249 mRNAの塩基配列は、5'-GGAAAACUAAAAUGAGAGAAUGGGUGUCCAAGAGGACAAGUUCAUGCUCACCCGGUGAUGAGAGUUUGAUUGCAGAAUAAGGCUAGACAAAGGGAAGCUGAACAUGACCAAAGCCAUGUGACAUCGUAUGAUCCUCGAAUCUCACAGUAUCUAUGUAUCUAUAAUCAGAUACAUCCCUAGACUUUCCAGGAAUUCUGGUACUUCACGAGGAUGUGAGAAGACUCUGAACAAAAUAAUACACUGCUCGUG-3'(配列番号7)である。RGM249 shRNAプラスミド内のトップストランドにおいて、RGM249 shRNAをコードする配列は、5'-CACCGCAGAATAAGGCTAGACAAAGCGAACTTTGTCTAGCCTTATTCTGC-3'(配列番号11)である。ボトムストランドにおいて、上記トップストランドと2重鎖を形成している配列は、5'-AAAAGCAGAATAAGGCTAGACAAAGTTCGCTTTGTCTAGCCTTATTCTGC-3'(配列番号12)である。図1AにRGM249 mRNAの2次構造と、RGM249 shRNAのターゲット部位を示す。
【0108】
RGM249 shRNAの塩基配列は、5'-GCAGAAUAAGGCUAGACAAAGUUCGCUUUGUCUAGCCUUAUUCUGCGGUG-3'(配列番号10)である。プラスミドから転写後はヘアピン様構造を形成すると考えられる(図1B)。図中の下線部は、水素結合を形成可能な部分である。RGM249 shRNAの塩基配列において、RGM249 mRNAの一部に相補的な配列は、5'-CUUUGUCUAGCCUUAUUCUGC-3'(配列番号8)である。この配列番号8に相当する部分は、RGM249 shRNAの塩基配列中の5'-GCAGAAUAAGGCUAGACAAAG-3'(配列番号9)と水素結合を形成し、へアピン様構造を形成すると考えられる。RGM249 shRNAによってRNAiを誘導する際には、この配列番号8に相当する部分がRGM249 mRNAに対してハイブリダイズすると考えられる。UUCGはループ部分に相当する。GGUGはオーバーハングしていると考えられる。
【0109】
また、RGM249 shRNAのチミンの一つが欠損したRGM249m−1 shRNAを発現するベクター(RGM249m−1 shRNAプラスミド)を作成した。RGM249m−1 shRNAプラスミド内のトップストランドにおいて、RGM249m−1 shRNAをコードする配列は、5'-CACCGCAGAATAAGGCTAGACAAAGCGAACTTTGTCAGCCTTATTCTGC-3'(配列番号13)である。ボトムストランドにおいて、上記トップストランドと2重鎖を形成している配列は、5'-AAAAGCAGAATAAGGCTGACAAAGTTCGCTTTGTCTAGCCTTATTCTGC-3'(配列番号14)である。コントロールにはLacZ shRNAを使用した。
【0110】
RGM249m−1 shRNAの塩基配列は、5'-GCAGAAUAAGGCUGACAAAGUUCGCUUUGUCUAGCCUUAUUCUGCGGUG-3'(配列番号15)である。配列番号15の塩基配列が配列番号10の塩基配列と異なるのは、配列番号10の5末端から14番目のAが欠失している点である。RGM249 mRNAに一部に相補的な配列は、上記RGM249 shRNAの場合と同じである。
【0111】
(1−2)RGM249 shRNAの腫瘍抑制効果
胸腺欠損マウスの右側腹に、HLF細胞を皮下注射によって播種した。またそのマウスの右側腹に、5日毎にRGM249 shRNAプラスミド+DDS、RGM249m−1 shRNAプラスミド+DDS、またはLacZ shRNAプラスミド+DDSを皮下注射した。この皮下注射は、DDS1mg当たり数μg〜数十μgの生理活性物質を混ぜ、マウス20〜30gに対して行った。このときの腫瘍ボリュームの変化を調査した(図1C)。その結果、投与から21日後、LacZ shRNAグループと比較してRGM249 shRNAグループによる有意な腫瘍抑制効果が見られた。なお、DDS(Drug Delivery System)としてはカチオン化ゼラチンハイドロゲル(MedGel社製)を使用した。プラスミドとDDSは、メーカーのプロトコールに従い各100nMで混合した。グラフには標準誤差を示してある。データ(n=5)はマン・ホイットニーテストによって分析した(P<0.01)。また、最初の投与から4週間後、RGM249 shRNAグループは、RGM249−m1 shRNAグループとLacZ shRNAグループに比較して、有意に腫瘍抑制効果を示した(P=0.034、P=0.021)。
【0112】
図1Dの3つの写真は、上記それぞれのプラスミドを皮下注射した際の、腫瘍ボリュームの目視的な観察結果である。皮下注射から約28日後に、RGM249 shRNAグループは平均で80%の抑制効果を示していた。また、RGM249m−1 shRNAグループは平均で50%未満に腫瘍ボリュームを抑制していた。
【0113】
(1−3)RGM249 shRNA投与によるmRNA発現の抑制効果
(1−3−1)皮下投与
また皮下注射から35日後に、腫瘍で発現している遺伝子の発現抑制効果を調査した(図2A)。細胞からmirVana miRNA Isolation kitを用いてmiRNAを抽出した後、Mir-XTM miRNA qRT-PCR SYBR(R) Kitを用いてmiRNAの発現量を調べた。その結果、RGM249 shRNAプラスミド+DDS、またはRGM249m−1 shRNAプラスミド+DDSを投与した場合において、RGM249 mRNAおよびhTERT mRNAの発現レベルが、LacZ shRNAと比較して有意に低下していた(RGM249 mRNAとhTERTmRNAのP値は、それぞれP=0.036、P=0.025)。これらのデータはマン・ホイットニーテストによって分析した。クローズドの四角はRGM249の発現を示し、オープンの四角はhTERT mRNAの発現を示す。
【0114】
(1−3−2)尾静脈投与
一方で、上記のそれぞれのプラスミドを尾静脈へ静脈注射した場合において、28日後に腫瘍で発現している遺伝子の発現抑制効果を調査した(図2B)。DDSには、アテロコラーゲン(AteloGeneTM)(Jo, J., Yamamoto et al., J Nanosci Nanotechnol 6, 2853-2859 (2006).、Takeshita et al., Mol Ther 18, 181-187 (2010).)を用いた。プラスミドとDDSは、メーカーのプロトコールに従い各100μMで混合した。その結果、RGM249 shRNAプラスミド+DDSを投与した場合において、RGM249 mRNAおよびhTERT mRNAの発現レベルが、LacZ shRNAと比較して有意に低下していた。これらのデータはマン・ホイットニーテストによって分析した(P<0.05)。クローズドの四角はRGM249の発現を示し、オープンの四角はhTERT mRNAの発現を示す。以上のように、RGM249 shRNAグループにおけるRGM249 mRNAとhTERT mRNAの発現は、LacZ shRNAグループと比較して、両方とも有意に抑制された(それぞれP=0.049、0.046)。
【0115】
(1−4)RGM249 shRNA投与による癌転移抑制効果
また静脈注射から28日後に、肝臓の内外の結節を目視的に観察した。HLF細胞のみのグループ(data not shown)と、LacZ shRNAグループにおいて癌結節が目視的に見られた。また、顕微鏡でみた場合、全てのマウスの肝臓または肺に転移性の病巣が、1匹のマウスで左腎への転移が見られた。
【0116】
目視的に観察した結果、RGM249 shRNAグループでは、1匹のマウスでのみ肝臓に結節の存在が確認された(表1)。また、1匹のマウスでのみ腎臓に結節を有していることが確認された。この結果は、RGM249 shRNAグループが他のグループと比較して腫瘍形成と転移を抑制したことを表す。即ち、RGM249 shRNAグループは静脈注射で与えたときに腹腔内の発癌を抑制した。また、注入されたヒト由来の腫瘍を、ヒト特異的なRGM249 mRNAを標的として治療したことを意味する。
【0117】
【表1】

【0118】
以上の結果より、RGM249 mRNAをRNAi作用によって分解すると、癌抑制と腫瘍減少、hTERT mRNAの減少、および癌の転移抑制に効果があることが示された。このことから、RGM249 mRNAが、癌になんらかのメカニズムを経て影響していると考えられた。またRGM249m−1 shRNAは、RGM249 shRNAに比べて若干効果は劣るが、癌の抑制効果を奏する等、RGM249 shRNAと類似の効果を有していた。次に、RGM249 mRNAから生成されるmiRNAと、そのmiRNAに対するsiRNAによる癌への影響を調べた。
【0119】
<実施例2:3つのsiRNAによる癌細胞増殖抑制と、未分化マーカーへの影響の評価>
(2−1)miR−47 siRNA、miR−101 siRNA、miR−197 siRNAのコンストラクト
RGM249を、pRNAT-U6.1/neoベクター(GenScript USA社、ニュージャージー、米国)に連結した。T7 RNAポリメラーゼにより生成されたRGM249 mRNAを、Dicer酵素(Genlantis社、カリフォルニア、米国)を使用して消化した。miRNAを、mirVANA miRNA単離キット(日本Ambion社、東京、日本)により分画し、 ヒト抗Ago2ビーズを用いたmiRNA単離キット(和光純薬工業株式会社、東京、日本)を用いて精製した。また、小RNAがAgo2に結合しない可能性があるため抗Ago2を用いずにも精製した。消化したsmall RNAsを、miRCAT-microRNAクローニングキット(Integrated DNA Technologies社、アイオワ、米国)を使用してクローニングし、TOPOベクター(Invitrogen社、カリフォルニア、米国)を使用してシークエンシングした。そして、二次構造を予測した(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)。small RNAsの配列相同性を、miRBasを使用して検討した。以上の結果、miR−47、miR−101、miR−197の3つのmiRNAが得られた。miRNA前駆遺伝子であるRGM249 mRNAと、内部の3つのmiRNAに相当する部位を図3Aに示す。
【0120】
miR−47の塩基配列は5'-CUCACCCGGUGAUGAGAGUUUGAUU-3'(配列番号16)、miR−101の塩基配列は5'-AACAUGACCAAAGCCAUGUG-3'(配列番号17)、miR−197の塩基配列は5'-GUACUUCACGAGGAUGUG-3'(配列番号18)である。
【0121】
上記3つのmiRNAに対するsiRNAを生成するコンストラクト(shRNA)を作成する場合、pRNATin-H1.4/Lentiを使用した。また、3つのsiRNA(miR−47 siRNA、miR−101 siRNA、miR−197 siRNA)をInvitrogen社のsiRNA designerを用いて合成した。各siRNAの推定2次構造を図3Bに示す。miR−47 siRNAの塩基配列はセンス鎖が5'-CUCACCCGGUGAUGAGAGUUUGA-3'(配列番号4)、アンチセンス鎖が5'-AAUCAAACUCUCACCGGGUGAG-3' (配列番号1)である。miR−101 siRNAの塩基配列はセンス鎖が5'-AACAUGACCAAAGCCCAUGUGUU-3'(配列番号19)、アンチセンス鎖が5'-CACAUGGCUUUGGUCAUGUU-3' (配列番号2)である。miR−101 siRNAのセンス鎖は、3'末端においてチミンが2塩基突出している。この2塩基を除いた配列は、5'-AACAUGACCAAAGCCCAUGUG-3'(配列番号5)である。miR−197 siRNAの塩基配列はセンス鎖が5'-GUACUUCACGAGGAUGUGUU-3'(配列番号20)、アンチセンス鎖が5'-CACAUCCUCGUGAAGUAC-3'(配列番号3)である。miR−197 siRNAのセンス鎖は、3'末端においてチミンが2塩基突出している。この2塩基を除いた配列は、5'−GUACUUCACGAGGAUGUG−3'(配列番号6)である。また、3つのmiRNAと、3つのsiRNAのアンチセンス鎖との配列比較を図3Cに示す。
【0122】
(2−2)細胞増殖の抑制効果
miR−47 siRNA、miR−101 siRNA、miR−197 siRNA、またはそれらの混合物(3siRNA混合物)各50nMを高レベルのRGM249を発現するHMV−Iへトランスフェクションした。トランスフェクションにはFuGeneキット(Roche社製)を使用した。トランスフェクションから24時間経過後の形質転換体を収集した。
【0123】
細胞数を測定した結果、DDSで処理したコントロール細胞と比較して、それぞれのsiRNAを単独で使用した場合に、若干の癌細胞増殖の抑制効果がみられた(図3D)。さらには、3siRNA混合物をトランスフェクションした場合、癌細胞増殖の顕著な抑制効果がみられた。これは、3つのsiRNAが相乗的に働いたためと考えられる。一方で、siRNAを2つ組み合わせて使用した場合には、同等の効果は見られなかった。このことは、2つでは相乗効果が生じにくく、むしろ1つ当たりの濃度が低くなったことが癌細胞増殖の抑制効果を弱めたと考えられる。
【0124】
この結果から、3つのmiRNAを阻害すると、癌細胞の増殖抑制効果があることが強く示唆された。この結果は実施例1とも矛盾なく、RGM249 mRNAが3つのmiRNAに分解され、その3つのmiRNAが癌に関与するメカニズムが、生体内で働いていると考えられる。上記の3つのsiRNAはこのメカニズムを遮断することで、癌細胞の増殖抑制効果を発揮したと考えられる。
【0125】
(2−3)siRNAによるmiRNA発現レベルの変化
上記(2−2)において3siRNA混合物を同時にトランスフェクションしたHMV−IからRNA抽出を行い、miR−47、miR−101、miR−197の発現レベルを調査した(図3E)。
【0126】
(2−4)siRNAによる未分化マーカー量の変化
形質転換体の転写発現プロファイリングを、癌(hTERT、c−Myc、p53)、多分化能(Oct4、Sox2、Klf4)、幹細胞性(PROM1)に関連する遺伝子について評価した(図3F)。3siRNA混合物を使用した場合、Oct4、Sox2、hTERT、p53遺伝子は3siRNA混合物による処理に伴いアップレギュレイトし、c−MycとKlf4遺伝子はダウンレギュレイトした。一方でPROM1への影響は見られなかった。またmiR−47 siRNAは、Oct3/4およびhTERT遺伝子をアップレギュレイトし、c−MycおよびKlf4遺伝子をダウンレギュレイトした。図3D中の*は、mRNAの発現をβ−actin mRNAと比較した時に有意差があることを示す。
【0127】
以上の結果、miR−47 siRNAの使用によって未分化マーカー(Oct3/4)の発現がアップレギュレイトしたことから、HMV−Iは未分化状態に変換したか、少なくとも未分化状態に誘導されたと考えられる。また、癌遺伝子であるc−Mycがダウンレギュレイトしたことから、未分化状態に誘導された細胞は癌化が抑制された状態にあると考えられる。
【0128】
さらには、3siRNA混合物を使用した場合には、2つの未分化マーカー(Oct3/4、Sox2)の発現がアップレギュレイトした。c−MycはmiR−47 siRNAを使用した場合と同様に、ダウンレギュレイトした。また、癌抑制遺伝子であるp53がアップレギュレイトした。即ち、未分化状態に誘導された細胞は、c−Mycおよびp53の両面から癌化が抑制された状態にあると考えられる。
【0129】
以上の結果から、3つのmiRNAは、癌と、分化のメカニズムに関与していることが示唆された。また、3つのsiRNAは癌抑制と、癌細胞のリプログラミングの機能を有していることが示唆された。次に、siRNAをマウスに投与することで、癌抑制と癌細胞のリプログラミングについてさらに詳しく調査した。
【0130】
<実施例3:3siRNA混合物のマウスへの投与と、抗癌作用の評価>
(3−1)siRNAの皮下投与
3siRNA混合物+DDSの皮下投与は、DDSのみのコントロール投与に比べて、HMV−I細胞の増殖性の抑制を示した(Kruskal-WallisテストにおいてP<0.01、n=5)(図4)。この試験には胸腺欠損マウスを用いた。DDSはアテロコラーゲン(AteloGeneTM)を用いた。3siRNA混合物とDDSは、メーカーのプロトコールに従い各100μMで混合した。図4中の上部に示した写真は、RNAを含まないアテロコラーゲン(mock)を皮下注射したときの写真である。下部に示した写真は、3siRNA混合物+DDSを皮下注射したときの写真である。*はRNAを含まないものとsiRNAを含むものの間に有意差(P<0.01)があることを示す。また、コントロールマウスは肺(15.8±1.9 結節)と腹腔内(0.8±0.6 結節)に複数の結節を示した(表2)。いくつかの転移性の病巣が腹腔内および腹腔外で観察され、皮下浸潤も観察された。
【0131】
【表2】

【0132】
(3−2)siRNAの静脈投与
胸腺欠損マウスにHLF細胞を投与した後1週間後から、3siRNA混合物+DDSを毎週静脈注射した。マウス当たりに1×107細胞を含む200 μlをインジェクションした。DDSはアテロコラーゲン(AteloGeneTM)を使用した。3siRNA混合物とDDSは、メーカーのプロトコールに従い各100μMで混合した。28日後にその動物を屠殺し、肝内腫瘍と腹腔内転移の試験を行なった(表3)。この結果、3siRNA混合物+DDSの静脈投与は、HMV−1細胞の抗転移能を有意に誘導した(P<0.05、肺と肝臓それぞれ)。肝臓と肺では転移がほとんど見られず、1匹のマウスのみで腹腔内への転移が見られた。
【0133】
【表3】

【0134】
以上の結果、3siRNA混合物をマウスに投与することで、癌の増殖と、転移を有意に抑制できることが示された。
【0135】
<実施例4:3siRNA混合物のマウスへの投与と、未分化マーカーの発現レベルの評価>
(4−1)腫瘍におけるmiRNAとmRNAの発現レベルの評価方法
siRNAで処理した腫瘍を用いてmiR−47、miR−101、miR−197の発現レベルの評価を以下の通り行った。miRNAの発現量は、細胞または組織からmirVana miRNA Isolation kit を用いてmiRNAを抽出した後、Mir-XTM miRNA qRT-PCR SYBR(R) Kit を用いて調べた。これにより、siRNAによるmiRNAの発現抑制効果、およびmiRNAの発現量の変化を確認した。
【0136】
mRNAを定量化するために用いたプライマーセットの配列を表4に示す。ウエスタンブロット法はi−Blotゲル転写システムを用いて行った。抗体(抗hTERT抗体、抗p53抗体、抗c−Myc抗体、抗Oct4抗体、抗PROM1抗体)は1:500倍に希釈し、抗βアクチン抗体は1:1000倍に希釈した。LAS-4000を使用して、化学発光シグナルを1分以内に検出した。
【0137】
【表4】

【0138】
(4−1−1)皮下投与
皮下による異種移植によって、3つのmiRNAの抑制効果を実証した。前記異種移植は、1 × 107個のHMV-I細胞を右側腹へ接種することにより確立した。触知できる腫瘍は播種から7日後に確認できた。10匹のマウスをランダムに2グループに分け、3siRNA混合物(100 μM)(n=5)、または等量のDDS(n=5)を投与した。3siRNA混合物をトランスフェクションした細胞は、in vitroで増殖が抑制された。5週間後、腫瘍を分析するためにマウスを屠殺した。腫瘍ボリュームはボリューム = π/6×横幅×縦幅×高さの式によって評価した。
【0139】
(4−1−2)尾静脈投与
siRNA混合物(400 μM)またはDDSで処理する1週間前に、HMV−I細胞(1×107 細胞)を胸腺欠損マウスの尾静脈にインジェクションした。siRNA混合物またはDDSは毎週投与し、腫瘍ボリュームまたは転移を5週間後に調査した。全てのマウスはJapanese Association for Accreditation for Laboratory Animal Care-approved facilitiesで保管および飼育した。動物実験および取り扱いはfederal Institutional Animal Care and Use Committee guidelinesを厳格に遵守した。
【0140】
図5Aに示すように腫瘍のあるパーツ毎に分けて評価した。1は表面、2は内部、3は中央部分である。なお腫瘍はもろいため、わけ方はおおよそのものである。
【0141】
(4−2)腫瘍におけるmiRNAの発現レベルの評価結果
腫瘍内のRNAの定量化、および高い再現性のシークエンシングを行ない、3siRNA混合物による、miR−47、miR−101、miR−197それぞれの発現抑制効果を評価した結果を図5Bに示す。データはクラスカル・ワーリステスト(n=5)を用いて分析した。*はDDS処理した腫瘍に対してmiRNA発現レベルに有意差(P<0.01)があることを示す。3つのmiRNAはの量は、3siRNA混合物を投与することによって減少する傾向が見られた。
【0142】
(4−3)ヘマトキシリン・エオシン染色
上記(4−1−2)で得られた腫瘍について、顕微鏡による調査結果(HE(ヘマトキシリン・エオシン染色); ×400)を図5Cに示す。上部はコントロールを、下部はsiRNAで処理した腫瘍を示す。siRNAで処理した腫瘍はHMV−I細胞で減少し、フィブロシスによる置き換わりに伴って腫瘍は壊死し、新血管新生は抑制された。
【0143】
(4−4)腫瘍における未分化マーカーの発現レベルの評価結果
上記(4−1−2)で得られた腫瘍について、腫瘍、分化、多能性の関連遺伝子の転写レベルを試験した結果を図5Dに示す(*: P<0.05, **: P<0.01)。Oct4、Klf4、p53、hTERT、PROM1、Sox2は多能性、腫瘍形成、または癌幹細胞性に関与すると考えられる。2−△△法を用いてβ−actin mRNAの発現を比較した。図5D中においてCntlはコントロール(DDSのみ)を表し、3 mixは3siRNA混合物+DDSを表す。この結果、3siRNA混合物はp53およびSox2のmRNAの上昇を誘導した。一方で、hTERT、PROM1、Oct3/4、Klf4は減少した。
【0144】
以上の結果、3siRNA混合物をマウスに投与することで、3つのmiRNAはダウンレギュレイトし、未分化マーカーであるSox2と、癌抑制遺伝子であるp53はアップレギュレイトすることが示された。次に、免疫組織科学的試験を利用して、癌細胞のリプログラミングについてさらに詳細に調査した。
【0145】
<実施例5:癌細胞のリプログラミングと、iPS細胞の評価>
(5−1)miRNA−197の抑制と、hsa−mir−520dのアップレギュレーションの評価
FuGeneキット(Roche社製)を用いて、miR−197 siRNAを293FT細胞にトランスフェクションした後、顕微鏡で観察した(図6A)。また、ウイルスベクター(pMIRNA1、System Bioscience:SBI社製)を用いて、hsa−mir−520d(Accession:MI0003164)をヒトの線維芽細胞細胞(TIG−1−20)に感染させた後、顕微鏡で観察した。このhsa−mir−520dは、RGM249 shRNAをトランスフェクションすることによってアップレギュレイトされるmiRNAである(A noncoding RNA gene on chromosome 10p15.3 may function upstream of hTERT. Miura et al., BMC Mol Biol. 2009 Feb 2;10:5.)。上記ウイルスベクターから発現するhsa−mir−520dの塩基配列は5'-UCUCAAGCUGUGAGUCUACAAAGGGAAGCCCUUUCUGUUGUCUAAAAGAAAAGAAAGUGCUUCUCUUUGGUGGGUUACGGUUUGAGA-3'(配列番号43)である。その推定2次構造を図6Bに示す。この配列において、ガイド鎖に相当する配列は5'-UCUACAAAGGGAAGCCCUUUCUG-3'(配列番号41)、パッセンジャー鎖に相当する配列は5'-AAAGUGCUUCUCUUUGGUGGGU-3'(配列番号42)である。
【0146】
miR−197 siRNAとhsa−mir−520dの発現量は、各RNA鎖とともに発現しているGFPプロテインを検出することで評価した。図6Aの上部はmiR−197 siRNAで処理した細胞の写真である(拡大率: ×40)。円形細胞が培地に出現した後、ES細胞のための培地(ReproCELL社)に移して観察した。下部は、hsa−mir−520dで処理した細胞の写真である(拡大率: ×100)。以上により、miR−197 siRNAとhsa−mir−520dの発現が確認された。こうして、miRNA−197の抑制またはhsa−mir−520dのアップレギュレーションを行った。
【0147】
(5−2)miR−197 siRNA投与後の未分化マーカーの発現量の評価
miR−197 siRNAをトランスフェクションした293FT細胞(ヒト胎児腎臓由来細胞株)を、顕微鏡で免疫組織化学的に観察した結果を図6Cに示す。図6Cは未分化マーカーであるOct4とNANOGを検出している。上部(0hr)の3つは、トランスフェクションしていない293FT細胞を顕微鏡(拡大率: ×40)で観察した写真である。左の列は身染色、真ん中の列は抗Oct4抗体によるローダミン染色、右の列は抗NANOG抗体によるローダミン染色を施した結果である。細胞の染色は各1週間行った。
【0148】
真ん中(24hr)の3つは、未分化状態の細胞をmiR−197 siRNAで誘導してから24時間後に、顕微鏡で免疫組織化学的に観察した写真である。下部(48hr)の3つは、48時間後に、同様に顕微鏡で免疫組織化学的に観察した写真である。その結果、Oct4(真ん中の列、拡大率: ×100)とNANOG(右の列、拡大率: ×200)が強く発現していた。
【0149】
以上の結果、miR−197 siRNAで処理した293FT細胞は、Oct4またはNANOGを発現したことから、リプログラミングされ、iPS細胞化したと考えられる。またその効率も良く、106細胞から20〜100程度のiPS細胞が作成できた。この293FT細胞は、一般的にES細胞やiPS細胞にみられる細胞形状を有していた。また、培地中で7日後も未分化状態を維持していた。iPS細胞化した293FT細胞は、ES細胞用培養液で培養できるが、一般培養用の培養液でも十分培養可能であった。フィーダー細胞は不要であり、培養面のコーティングはコラーゲンでもマトリゲルでもよかった。
【0150】
(5−3)hsa−mir−520d投与後の未分化マーカーの発現量の評価
hsa−mir−520dを各種癌細胞にウイルスベクター(pMIRNA1、System Bioscience:SBI社製)で感染させ、強制発現させた。その後、上述の免疫組織科学的試験と同様の方法で未分化マーカーの発現量を観察した。その結果を図6D、図6E、図6Fに示す。使用した癌細胞は、HT1080細胞(ヒト線維肉腫細胞株)、T98G細胞(ヒトグリオーマ細胞株)、PK−45p細胞(ヒト膵臓癌由来細胞株)、HMV−I細胞(ヒト悪性黒色腫由来細胞株)、HLF細胞(ヒト肝癌由来細胞株)である。またHMV−I細胞、およびHLF細胞においては、未分化マーカーであるOct4またはNANOGを発現していた。
【0151】
以上の結果、hsa−mir−520dで処理した癌細胞は、リプログラミングされ、iPS細胞化したと考えられる。なおこのhsa−mir−520dを強制発現させた癌細胞は、一般的にES細胞やiPS細胞にみられる細胞形状を有していた。
【0152】
(5−4)生成したiPS細胞の各種遺伝子発現量の評価、およびhiPSCとの比較
上記ようにして生成したiPS細胞における各種遺伝子の転写量を図7Aに示す。miR−197 siRNAで処理した293FT細胞、およびhsa−mir−520dが過剰発現した293FT細胞における各種遺伝子の転写量は同じであった。図7Aは、その2つの細胞の転写量を、hiPSC(HPS0002 253G1)('Generation of mouse-induced pluripotent stem cells with plasmid vectors.' Okita et al., Nat Protoc 5, 418-428 (2010).)の発現量に対して比較した結果である。転写レベルはワンステップリアルタイムRT−qPCRで調査した。図中、hiPSCの発現量を0として表している。上部は、293FT細胞用の培地において293FT細胞にトランスフェクションまたは感染させてから48時間後の転写量である。下部は、その後2週間、ES細胞のための培地で維持したときの転写量である。
【0153】
トランスフェクションまたは感染させてから48時間後、Oct4、p53、RGM249 mRNAは、hiPSCに比べてハイレベルで発現していた。その後2週間、ES細胞のための培地で維持後は、RGM249 mRNAのみハイレベルで発現していた。他の遺伝子は、2週間後hiPSCとほとんど同レベルの発現量であった。
【0154】
hiPSCと293FT細胞におけるmiRNA−197とhsa−mir−520dの、miRNA発現レベルの関連性をツーステップリアルタイムRT−qPCR (n=5)で評価した結果を図7Bに示す。左のパネルはhsa−mir−520dの発現量を示す。左から、hiPSC、hsa−mir−520dを過剰発現している293FT細胞、miR−197 siRNAで処理した293FT細胞、293FT細胞である。また右のパネルはmiRNA−197の発現量を示す。これにより形質転換体におけるmiRNA−197サイレンシングとmir−520d過剰発現を確認した。
【0155】
左のパネルから、生成したiPS細胞のhsa−mir−520dの発現量はhiPSCと類似していることがわかる。一方で、293FT細胞においてはhsa−mir−520dの発現量は有意にダウンレギュレイトしていることがわかる。右のパネルからは、生成したiPS細胞はmiRNA−197をhiPSCと同じくらい弱く発現していることがわかる。一方で、293FT細胞においてはmiRNA−197を他の細胞と比較して10倍多く発現していた。
【0156】
<実施例6:>hsa-mir-520dに関する実験方法と結果
(6−1)細胞
in vitroとin vivoにおけるhsa-mir-520d発現の効果を評価するために、複数種類の細胞株とレンチウイルスベクターとを使用した。ヒトメサンギウム細胞株である293FTは、日本Invitrogen社(東京、日本)から提供され、10%FBS、0.1mM MEM非必須アミノ酸溶液、2mM L-グルタミン、および1%ペニシリン/ストレプトマイシンを添加したダルベッコ改変イーグル培地中で培養した。強力なRGM249発現を有するヒト未成熟または未分化肝細胞株(HLF)とRGM249の弱い発現を有する高分化肝癌細胞株(Huh7)を、アメリカ培養細胞系統保存機関(American Type Culture Collection)から購入し、10%FBSおよび1%ペニシリン/ストレプトマイシンを添加したRPMI培地中で培養した。ウイルス処理により形質転換した細胞の未分化状態を維持するため、5ng/mlのbFGF-2を有するReproStem培地(ReproCell社、東京、日本)中で、細胞を培養した。ヒト誘導多能性幹細胞(HPS0001、HPS0002)は、理研バイオリソースセンターの細胞バンク(Riken Bioresource Center Cell Bank)から提供された。
【0157】
(6−2)レンチウイルスベクター作製、及びトランスフェクション
pMIRNA1-mir-520d/GFP(20μg)(System Biosciences社、Mountain View、米国)とモック(mock)ベクターとしてのpCDH(20μg)とを各々、(10cm培養プレートあたり5 × 106細胞の)293FT細胞へトランスフェクトした。 上清中のウイルス粒子を回収するために、4℃、120分間、170000 × gで遠心後、ウイルスペレットを回収し、Lenti-XTM(商標)qRT-PCR滴定キット(Clontech社、カリフォルニア、米国)を使用して力価測定を行った。293FTまたはHLF細胞へのレンチウイルス感染のために、10cm培養プレート当たり100万個のウイルスを使用した。ポジティブコントロールとして使用したRGM249miRNA-197 siRNAを、ステルスRNAiデザイナー(Stealth RNAi designer)(https://rnaidesigner.invitrogen.com/rnaiexpress/)を用いて設計し、FuGENE HDトランスフェクション試薬(Roche Diagnostics社、バーゼル、スイス)を用いて、50nMの合成オリゴヌクレオチドを、293FT細胞へトランスフェクトした。また、520d-HLF細胞が骨芽細胞へと分化誘導することを確認するために、通常のRPMI1640培地中に2Mのpurmorphamineを添加して、その細胞を一週間処理した。
【0158】
(6−3)免疫不全マウスとin vivo試験方法
レンチウイルス感染後のHLFを回収し、1マウス当たり5 × 107個のHLF細胞を、各々のマウスの腹腔内および皮下(右側腹)へ接種した。注入体積は、200μlであった。6週齢の免疫不全マウス(KSN/Slc)(清水実験材料株式会社、京都、日本)を、4週間通常給餌した。KSN/Slcマウスを、100 mg/kgのネンブタールを腹腔内注射することにより麻酔し、解剖および組織学的検査のために屠殺した。皮下への異種移植を使用して、hsa-mir-520dの抑制効果を実証した。体積評価は、以下の式を使用して決定した:体積 = π/6 × 幅 × 長さ × 高さ。全ての動物は、日本実験動物管理公認協会承認施設で保管および飼育した。動物の研究と取り扱いについては国際動物実験委員会のガイドラインを厳格に遵守した。
【0159】
(6−4)RT-PCR
small RNA分画を含んだトータルRNAを、培養細胞またはホモジェナイズしたマウス組織から、mirVana miRNA分離キット(Ambion社、オースチン、米国)を使用して抽出した。Mir-X(商標)miRNA qRT-PCR SYBR(登録商標)キット(Clontech社、Mountain View、米国)を製造元のマニュアル(Clontech)に従って使用することにより、成熟型miRNAsの定量を実施した。U6 small nuclear RNAをインターナルコントロールとして使用した。トータルRNA(50ng/μl)を、OneStep RT-PCRキット(日本QIAGEN社、東京、日本)を用いて逆転写および増幅した。PCR解析とデータ収集解析とは、LineGene(東洋紡、名古屋、日本)を使用して実施した。サンプルの発現レベルを、検量線方法(2-ΔΔ法)を使用して決定した。全てのデータ(hTERTのものを除く)を、インターナルコントロールであるβ-アクチンに対して標準化した。hTERTの推定は、本発明者が以前開発した定量方法に従って、コピー数により行った。そのRNA定量を、シークエンシングによって、高い再現性をもって確認した。miRNA(25ng/μl)を、Mir-X miRNA qRT-PCR SYBRキット(タカラバイオ(株)、東京、日本)を使用して定量した。siRNAによる抑制を確認するために、miRNA発現変化を評価した。mRNAまたはmiRNA定量用のプライマー配列を、表4に示す。有意差を、*: P<0.05、**: P<0.01として示した。
【0160】
(6−5)ウエスタンブロット
20μg/μlのタンパク質とi-Blotゲル転写システムとを用いてウエスタンブロット解析した。製造元のマニュアルに従って、抗β-アクチン抗体以外の抗体(抗hTERT抗体、抗p53抗体、抗Oct4抗体、抗DICER1抗体、抗AID抗体、抗Alb抗体、および抗GFAP抗体)を1:500倍に希釈し、抗β-アクチン抗体を1:1,000倍に希釈した。LAS-4000(富士フイルム、東京、日本)を使用して、化学発光シグナルを1分以内に検出した。
【0161】
(6−6)免疫細胞化学
製造元(R&D Systems社、ミネアポリス、米国)のマニュアルに従って、多能性幹細胞マーカー(抗Oct3/4抗体および抗NANOG抗体)ならびに胚性幹細胞マーカー抗体パネル(Embryonic Stem Cell Marker Antibody Panel)を用いて、免疫組織化学的検査を実施した。293FT細胞およびHLF細胞に、miRNA-197に対するsiRNAもしくはhas-mir-520dを含むレンチウイルス粒子をトランスフェクトまたは感染させた。浮遊するトランスフェクタント(つまり、トランスフェクトされた細胞)を回収し、顕微鏡観察用の新しい培養プレートまたは免疫染色用スライドチャンバーに移した。Huh7においても、293FTとHLFと同一の処理を、免疫細胞化学検査のために行った。
【0162】
(6−7)免疫組織化学
免疫組織化学解析のために、4%パラフォルムアルデヒド中で固定された肝臓組織標本を、常法により処理した。この試験で用いられたモノクローナル抗体は、以下のものである:抗アルブミン抗体(Sigma社、セントルイス、米国)、抗AFP抗体(Sigma社)、および抗GFAP抗体(Sigma社)。ネガティブコントロールとしては、一次抗体を省略して染色工程を実行した。発現の程度は、病理専門家が評価した。
【0163】
(6−8)細胞周期解析
細胞周期解析を実行するために、単一細胞懸濁物を、冷却したPBSで一度洗浄した。細胞ペレットを、その後、穏やかにチューブを振とうすることによりほぐして、ddH2O中の3.7%ホルマリンを滴下して固定した。細胞を、少なくとも一晩、-20℃でインキュベートした。固定後、細胞を冷却したPBSを用いて二回洗浄してEtOHを除去した。その後、細胞を、100U/mlのRNaseA含有PBS中に、1 × 106細胞/mlにて再懸濁し、37℃で50分間インキュベートした。50μg/mlのヨウ化プロピジウムを直接加えて、光を遮蔽して氷上において40分間インキュベートした。DNA含量を、EXPO32 ADC解析ソフトウエアを搭載したフローサイトメーター(EPICS ALTRA; Beckman Coulter社)により解析した。DNA含量は、pMIRNA1-mir-520d/GFPクローンをトランスフェクト後に、約20000イベントで評価した。GFP陽性細胞を、Moflo XDPセルソーター(EPICS ALTRA、Beckman Coulter社)により分取(ソート)した。
【0164】
(6−9)組織学的検査
腫瘍体積、ならびに肺、肝臓、腹腔内、および後腹膜腔への転移がんを、明視野イメージング機能を備えた解剖顕微鏡下または肉眼で検査および計測した。組織サンプルは、10%緩衝ホルマリン溶液中で一晩固定し、PBSで洗浄し、70%エタノールへ移した。その後、パラフィンに包埋し、薄切し、ヘマトキシリン・エオシンを用いて染色した。
【0165】
(6−10)細胞における蛍光検出
レンチウイルスmir-520d発現ベクターによる感染効率を評価するために、緑色蛍光発現を検出した。
【0166】
(6−11)統計解析
一観察変数を有し、P<0.05を有意なものと見なすMann-Whitney Uテストを用いて、3つの群(コントロール群、モック(mock)群、およびmir-520d群)間で比較した。*: P<0.05、**: P<0.01である。
【0167】
(6−12)結果
(6−12−1)293FT細胞へのhas-mir-520dのウイルス感染によるin vitro試験
表現系の変化を、顕微鏡的に評価した。図8Aは、293FT細胞へのhas-mir-520dのウイルス導入後に出現した浮遊細胞集団を示す。GFP陽性浮遊細胞(図8A(a))を、ES細胞用のフィーダー細胞不含有培地中で培養し、GFP発現を有するトランスフェクタントの増殖過程をタイムラプスモードで観察した(図8A(c))。has-mir-520dがウイルス感染した293FT細胞は、24時間以内にシート状の層を形成した。幹性化転換を、免疫細胞化学(図8B)に基づき確認した。GFP陽性細胞は、抗Oct4抗体により強く染色された。3日から1週間後、細胞はより大きなコロニーに生育し、NANOG陽性状態を維持していた(図8C)。トランスフェクタントの遺伝子発現を、RT-PCR、Western blot、および定量的miRNA RT-PCRにより評価した。
【0168】
ヒト誘導多能性幹細胞(hiPSCs)またはRGM249 miRNA197 siRNAによるトランスフェクタントと比較すると、has-mir-520dが過剰発現した293FT(520d-293FT)は、p53とRGM249とを強力に転写的にアップレギュレートし、Oct4とhTERTとをより弱く発現した。293FTと比較すると、p53、RGM249、およびOct4は、より強くアップレギュレートされるが、hTERTは、同じレベルで発現されていた(図9A)。ヒト誘導多能性幹細胞(hiPSCs)と比較すると、浮遊状態にある520d-293FTでは、p53とOct4とがより強く転写的にアップレギュレートされていた。hTERTは、同等に発現されていた。293FT (0日目)と比較すると、p53とOct4とは、より強くアップレギュレートされていたが、hTERTは同じレベルで発現されていた(図9B)。Dicer1はアップレギュレートされていて、そのことは、520dが成熟する過程にDicer1が必要なことを示唆した。さらに、520d-293FTにてhas-mir-520dの過剰発現と、およびRGM249 miRNA-197 siRNAによるトランスフェクタント中におけるRGM249 miRNA-197の抑制とを確認後では、RGM249 miRNA-197発現はhiPSC中でのものと同等であった。2種類のオリゴヌクレオチドを用いて処理することにより、hiPSCレベルのmiRNA発現を有する細胞へと、293FT細胞を有意に誘導した(図9C)。has-mir-520dの過剰発現は、RGM249 miRNA-197のダウンレギュレーションを生じた(図9D)。has-mir-520dのウイルス感染後、293FTは、培地中の接着性細胞もしくは浮遊性細胞のいずれか中で、mir-520dを安定的に発現した。ウイルス感染効率は、GFP陽性細胞ソーティングを用いて決定したところ、99.2%以上であった(データは示されない)。このことは、これらが、in vivo用に適応できる材料であることも示唆している。細胞周期解析によると、293FTおよびモックウイルス感染293FT(mock-293FT)と比較して、520d-293FTは、G0期が増加し、S期が減少していた(図10A)。520d-293FT細胞中のエピジェネティックマーカー(HDAC:ヒストン脱アセチル化酵素、Sin3A、およびMBD3:メチル-CpG結合ドメインタンパク質3) は、mock-293FTと比較した場合、高レベルで有意に維持されていた(P<0.01)。しかし、DNMT 1(DNA(シトシン-5-)-メチルトランスフェラーゼ)は、293FTまたはmock-293FT中でのものと同程度であった(図10B)。
【0169】
(6−12−2)HLF細胞へのhas-mir-520dウイルス感染によるin vitro試験
has-mir-520d発現ベクターを受容したHLF細胞(以下「520d-HLF」と称することもある)を、10cmプレート当たり20〜50個の新規細胞集団へと転換した。図11A(左上図)に形態学的変化を示す。これらの細胞は、GFP(右上)および多能性マーカー(右下)を発現していた。その中で、Oct4およびNANOGは、転写的にアップレギュレートされていた。対照的に、RGM249、CD44、Alb、およびp53は、有意にダウンレギュレートされていた(**: P<0.01;図11B)。浸潤アッセイにおいては、多能性マーカー陽性細胞のほとんどは、フィブロネクチン膜(6穴プレート当たり5μg/ml)を通過して移動することはできなかった。対照的に、mock-HLF細胞は、容易に移動することができた(図11C)。ウエスタンブロットは、Oct4およびp53のアップレギュレーションを示した。has-mir-520d発現HLF(520d-HLF)細胞中で、DICER1が抑制されていた(図11D)。mock-HLF細胞と比較した場合、520d-HLF細胞では、メチル化マーカー(HDAC、Sin3A、およびMBD3)が有意に低いレベルで維持されていた(P<0.01) (図11B)。細胞周期解析によると、mock-HLFと比較して、520d-HLF細胞はS期が増加し、G0期が減少していたことを示した(図12A)。mir-520dを安定的に発現する10クローンのHLF細胞を、ES用培地で一ヶ月間に渡り培養した後には、HLFのものと比べて、520d-HLF細胞中でのhTERTおよびアルブミン(Alb)はダウンレギュレートされていた。520d-HLF細胞中での、Oct4およびp53はアップレギュレートされていた。がん幹細胞マーカー(PROM1:CD133)は、HLF、hiPSC、520d-HLF細胞間では有意差はなかった(図12B)。CD44発現は有意に減少していた(P<0.01) (データは示されない)。さらにまた、mir-520dによるHuh7細胞(高分化肝癌細胞株)における多能性誘導を検証した。小さく丸い細胞集団におけるOct4およびNANOG発現は、モックベクターによる誘導と比較して、より上昇していた。また、2μMのpurmorphamine添加により、ALP、SPP1、およびIBSPのアップレギュレーションを有する骨芽細胞へと、520d-HLF細胞を誘導した。
【0170】
図13はHLF細胞の場合の初期化レベルを検討するためのグラフである。293FT細胞と共通しているのは、AID, DNMT1の発現レベルのみであり、293FTではHDAC, Sin3A, MBD3が有意に発現を高めるのに対し、HLFではそれらの発現が有意に低下した。
【0171】
(6−12−3)has-mir-520dウイルスが感染したHLF細胞によるin vivo試験
has-mir-520dのレンチウイルス発現ベクターまたはモックベクターにより、HLF細胞を感染したのち、その細胞(5 × 107細胞)を、免疫不全マウス(KSN/Slc)の腹腔内間隙へ注射した。has-mir-520dを発現したHLF細胞を注入したマウス群の75%は、腹腔内または注射針の刺入部分に沿って腫瘍を形成した(図14A)。対照的に、100%のモック感染群は、白色結節(HE染色(×40)にて組織学的に未分化肝癌細胞)を、腹腔内または肝臓に形成した(図14B)。12.5%(1/8)のマウス群中の520d-HLF細胞は、(肝細胞索、中心静脈、胆管(右図;白矢印)を有し、部分的に腺腫様過形成を内部に有する(図14D)(右から2番目の図))正常肝組織へと転換した(図14C、下図:HE染色組織標本)。37.5%(3/8)のHLF細胞は、表皮を有する類皮嚢胞と、汗腺(左図;白矢印)(図14A、図14D、および図14C上図;HE染色組織標本)とおよび皮脂腺(左から2番目;白矢印)とからなる奇形腫に形質転換した。生成した奇形腫と肝組織は、GFPタンパク質を発現していた(図14E)(左図:HEおよび右図:GFP)。肝組織中のほとんど全ての肝細胞がヒトアルブミンを強く発現しているのを免疫組織化学染色により確認した。肝星細胞(HSC)/筋線維芽細胞(MFs)のマーカーである、グリア線維性酸性タンパク質(GFAP)およびアルファフェトプロテイン(AFP)は、弱く発現していた。このことは、一ヶ月間に、520d-HLF細胞が未成熟肝組織へと分化したことを示唆する。50%(4/8)は、全く腫瘍および特定組織を形成しなかった。
【0172】
(6−12−4)has-mir-520dウイルスが感染したHLF細胞の分化
また、免疫組織化学的分析により、未分化な肝臓組織のマーカーを用いて肝組織を構成する肝細胞、胆管、静脈、星細胞などの存在を確認できた(図15)。骨分化誘導によりOsteopontin, sialoprotein陽性の骨芽細胞を得たことから、内・中・外胚葉へ分化できる間葉系幹細胞(MSC)に形質転換できた。(図16)。
【0173】
(6−12−5)has-mir-520dウイルスが感染した各種悪性腫瘍細胞の評価
図17は高分化型肝癌(Huh7)細胞について評価した結果である。肝癌細胞においては分化度に関わらず、同等に多能性マーカー強陽性に変化させることができた。図18は多形性膠芽腫(T98G)細胞について評価した結果である。未分化脳腫瘍においても幹性誘導し、in vivoで腫瘍を形成せずに正常組織に生着した。図19は膵癌(PK−9)細胞について評価した結果である。膵癌においても幹性誘導が見られた。図20は線維肉腫(HT1080)細胞について評価した結果である。非上皮性悪性腫瘍である肉腫細胞(HT1080)をも幹性誘導し、脂肪細胞へ分化させることができた。
【0174】
<実施例7: hsa-mir-192 siRNA等に関する実験方法と結果>
(7−1)細胞
HMV-I(ヒト悪性黒色腫)
T98G(ヒト神経膠芽腫)
HT1080(ヒト線維芽肉腫)
Pk-45(ヒト肝臓癌)
【0175】
(7−2)検討したmiRNA
【表5】

【0176】
(7−3)shRNA
表5のmiRNAに対するshRNA(hsa-mir-192 shRNA、hsa-mir-196a-1 shRNA、hsa-mir-423-3p shRNA、has-mir-222 shRNA)をコードするベクターは、GenScript corp.,(NJ, USA)から購入した。このベクターは、pRNATin-H1.4/Lenti (GenScript, corp.,)に上記shRNAをコードする塩基配列が組込まれたものである(以下、「siRNA生成ウイルス)と証することもある)。細胞に導入後、shRNAを発現し、さらにsiRNAを生成することができる。
【0177】
(7−4)siRNA
表5のmiRNAに対するsiRNA(hsa-mir-192 siRNA、hsa-mir-196a-1 siRNA、hsa-mir-423-3p siRNA、has-mir-222 siRNA)は、Stealth RNAi designer(Invitrogen社)によって入手した。配列を表6に示す。これらsiRNAが細胞増殖抑制等の効果を有していることを確認した後、上記(7−3)のshRNAでさらに細胞増殖抑制等の効果がみられるかどうかを検証するという流れで実験を行った。
【表6】

【0178】
なお、hsa-mir-192 siRNA、hsa-mir-196a-1 siRNA、hsa-mir-423-3p siRNA、has-mir-222 siRNA(hsa-mir-192 siRNA等)のアンチセンス鎖において、表5のmiRNAの配列に対して、相補的な関係にある部分の配列を表7に示す。この相補的な部分が、RNAi又はmiRNAの作用において特に重要な部分と考えられる。また、さらにその部分に相補的なセンス鎖の配列を併せて示す。
【0179】
【表7】

【0180】
(7−5)細胞へのレンチウイルスのinfection
細胞へのinfectionは、まず、293FTまたは293H細胞へレンチウイルスベクター(pRNATin-H1.4/Lenti)をtransfectionし、上清を回収し、遺伝子実験施設にある超遠心機で、27,000rpm、2時間遠心してウイルスを回収し、ペレットをPBSに溶解し、力価を検討後、−80度で保存した。そのウイルスを用いて、力価に基づき、各50μlずつ細胞に感染させた。また、3種類のsiRNA ( has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA) 共感染または4種類のsiRNA (hsa-mir-192 siRNA / has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA)共感染では、1種類のウイルス粒子が有効に作用する力価で感染させた。
【0181】
(7−6)RNAの抽出
mirVana(tm) miRNA Isolation Kit ( Ambion , TX , USA )を使用してmiRNA , totalRNAを抽出した。washした細胞にTorizol Reagent( Life Technologies Carlabad , CA , USA )を添加し、3分間インキュベート後Torizol Reagentの1/5量のchloroform( ニッポンジーン , Tokyo , Japan )を添加した。15秒間振盪後、14,000rpmで15分間遠心を行った。得られた上清の1/10量の100%エタノールを加え、数回転倒混和しspin columnに入れ、10,000g で15秒遠心した。カラムをwashするためmiRNA Wash Solution 1を700μl加え、10,000g で15秒遠心した。更にWash Solution 2/3を500μl加え、同様に遠心した。この作業を2回繰り返し、あらかじめ、95度に温めておいたRNase , DNase Free Waterを100μl加え、同様に遠心、そして、この過程を2回繰り返した。その後、真空濃縮を40分間し、そのうち2μlを使用し、NanoDrop( バイオメディカルサイエンス, Tokyo, Japan )を用いて濃度を測定した。
【0182】
(7−7)real time RT-PCR
RGM249 , hTERT , Sox2 , p53 , c-Myc , Oct4 , PROM1の7種類の発現を調べるためにQIAGEN OneStep RT-PCR Kit ( Qiagen , Tokyo , Japan )を使用した。GAPDH , β-actinをコントロールとした。検討した遺伝子は多能性関連マーカー、未分化マーカー及び分化マーカー、テロメレース関連遺伝子を使用した。
【0183】
(7−8)蛋白質抽出
PBS(-)でwashした細胞をtrypsin処理した後、エッペンドルフチューブに回収し、蛋白分解酵素阻害剤 Complete, Mini ( Roche Japan , Tokyo , Japan ) を含むCell Lysis Buffer ( SIGMA , Tokyo , Japan ) 22μlを加え、たんぱく質抽出液を得た。そのうちの2μlをNanoDropを用いて濃度測定に使用した。
【0184】
(7−9)Western Blot解析
iBlotTM ドライブロッティングシステム( Invitorogen , Tokyo , Japan )を使用し、電気泳動したゲルをセミドライ状態でメンブレンに転写した。その後WesternBreeze(r)イムノディテクションキット( Invitorogen , Tokyo , Japan )を使用し、ブロッキング30分、リンス5分×2、一次抗体60分、wash 5分×4、二次抗体30分、wash 5分×4、リンス2分×2を行った。そして、ケミルミネッセンス2.5mlをメンブレンに添加し5分後、遺伝子実験施設のLas-1000plus (FUJIFILM , Kanagawa , Japan ) で検出した。
【0185】
(7−10)cell cycle 解析
1×106個の細胞をwashした後、trypsin処理し15mlチューブに回収した。その後、95%エタノールを5ml加え、オーバーナイトで固定した。翌日1μg/mlのRNaseを1ml加え、1時間37度でインキュベートした後、PIを5μl加え、30分以上4度、遮光で遺伝子実験施設のEPICS ALTRA ( Beckman coulter , Tokyo Japan ) で解析を行った。
【0186】
(7−11)MTT assay
PBS ( - )で washした細胞をtrypsin処理した後、96wallプレートに1×106個の細胞を100μlずつ蒔いた。Promega社のCellTiter96(R) Non-Radioactive Cell Proliferation Assay kitを使用して細胞増殖能を検討した。
【0187】
(7−12)colony formation assay
soft agerを使用して、形質転換を起こした細胞の足場依存性及び腫瘍形成能を検討した。60mmディッシュにボトムアガロース( 0.5-0.6% )を2-3ml入れ、ある固形化した後、トップアガロース( 0.4% )で重層した。そして、そのディッシュに細胞を播き、1-2週間培養し、その後、細胞をカウントした。
【0188】
(7−13)miRNA の定量
Takara ( Tokyo , Japan ) 社のmir-x miRNA定量kitを用いて定量した。指定されたプロトコールに準じて施行した。
【0189】
(7−14)ゲノムへのウイルスベクターの取り込み検討
感染効率はレンチウイルスベクターの情報に準じて評価した。感染をGFP発現に関して蛍光顕微鏡で可視化して判定し、neomycinの導入、miRNAの導入を感染細胞の一部よりDNAまたはRNAを抽出し、PCRで増幅後、電気泳動で可視化して評価した。ゲノムへの取り込み部位の検討は施行しなかった。
【0190】
(7−15)実験結果
(7−15−1)siRNA生成Lentivirus感染後のHMV-1におけるMTT assay
各siRNA生成ウイルスを感染させたHMV-1でのMTT assayを3日間施行した(図21)。3種類のsiRNA ( has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA) 共感染または4種類のsiRNA (hsa-mir-192 siRNA / has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA)共感染細胞で有意に増殖抑制を確認した。統計学的有意差を* ( p<0.05 ) で示した ( Mann-Whitney test ) 。
【0191】
(7−15−2)siRNA生成Lentivirus感染2週間後でのHMV-1の蛍光顕微鏡写真と増殖曲線
各siRNA生成ウイルス感染による導入はmiRNA発現を阻害した。また、細胞の増殖抑制を示す経時的変化を示した(図22)。図中のトップパネルは、1週間後のmockとhsa-mir-196a-1 / hsa-mir-423-3p / hsa-mir-222でのGFP検出のための蛍光顕微鏡写真である。図中のボトムパネルは、ウイルス感染後の HMV-1の増殖曲線である。コントロール、mock、hsa-mir-192、hsa-mir-196a-1 siRNA、hsa-mir-222 siRNAと比較して、3種類のsiRNA ( has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA) 共感染または4種類のsiRNA (hsa-mir-192 siRNA / has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA)共感染で顕著な増殖抑制を観察し、感染細胞は3週間以内にアポトーシスに至った。
【0192】
(7−15−3)HMV-1のsiRNA生成レンチウイルス感染における colony formation assay
miRNAに対するsiRNAを生成するウイルスベクターに感染させ、siRNAが導入されたHMV-1において、腫瘍形成能を評価するためにsoft agerを用いて、colony formation assayを行った(図23)。コントロールではコロニーを多数形成しているのに対し、hsa-mir-192単独導入、4種類 (has-mir-192 / -196a-1 / -423-3p / -222 ) のmiRNAの共発現で、顕著にコロニー形成能が抑制された。hsa-mir-192に対するsiRNAでは途中までコロニー形成を認めたが、その後、増殖は止まり、そのまま細胞の断片化を起こしてアポトーシスに至った。また、4 種類 (has-mir-192 / -196a-1 / -423-3p / -222)の共感染ではコロニーを形成することはなかった。
【0193】
以上の実施例における各種材料および操作方法は、特に記載のない限り、以下の通り行なった。
・アンタゴマーの合成
アンタゴマー(miRNAを標的としたsmall RNA)のデザインと合成はInvitrogen社(Stealth RNAi designer (https://rnaidesigner.invitrogen.com/rnaiexpress/))とGenScript社へ委託した(pRNATin-H1.4/Lenti, pRNAT-T6.1/neo)。shRNA−generatingベクターはBLOCK-it Inducible H1 RNAi Entry Vector (Invitrogen, CA, USA)を用いて、プロトコールに沿って作成した。
【0194】
・セルライン
HLF細胞ラインとHMV−I細胞ラインはAmerican Type Culture CollectionとTohoku Universityからそれぞれ購入し、10% FBSと1% ペニシリン/ストレプトマイシンを添加したRPMI培地で培養した。アンタゴマー処理の場合、HMV−1細胞を50 nMのantagomirとともにインキュベーションした。
【0195】
・RNAi
FuGene HD transfection Reagent (Roche Diagnostic GmbH)を使用して、HLFまたはHMV−I細胞に、50 nM siRNA、コントロールのオリゴヌクレオチド、または空のベクターをトランスフェクションした。ダイサー(Dicer enzyme)はGenlantisから購入し、プロトコールに沿って使用した。3つのmiRNAは、ダイサーで消化したものをmiRCAT-microRNA cloning kit (Integrated DNA Technologies)でクローニングすることによって得た。免疫不全マウスは、Charles riverからCAnN Cg-Foxn1 BALB/c-nuを、SHIMIZU Laboratory Supplies Co., Ltd.からKSN/Slcを購入した。
【0196】
・RNAの単離とmiRNAの定量
トータルRNA、small RNAフラクションは、培養細胞またはホモジナイズしたマウス組織から、mirVana miRNA Isolation Kit (Ambion)を用いて抽出した。miRNAの成熟化の定量は、Mir-XTM miRNA qRT-PCR SYBR(R) kit (Takara Bio Company)を用いて説明書に従って行った。U6 small nuclear RNAをインターナルコントロールとして使用した。
【0197】
・mRNAのリアルタイムPCR
トータルRNAは、OneStep RT-PCR kit (QIAGEN)を用いて逆転写及び増幅させた。PCRとデータ収集分析はLineGene (TOYOBO)を用いて行った。サンプルの発現レベルは、検量線方法(2-ΔΔ法)を使用して決定した。全てのデータ(hTERTおよびRGM249のものを除く)を、インターナルコントロールであるβ-アクチンに対して標準化した。hTERTおよびRGM249の推定は、本発明者が以前開発した定量方法に従って、コピー数により行った。mRNAに関しては50ng/μlで、small RNAに関しては100ng/μlで試験した。
【0198】
・免疫ブロッティング
ウエスタンブロット解析をi-Blotゲル転写システム(Invitrogen社)を使用して実行した。目的バイオマーカー遺伝子に対するそれぞれの抗体を、製造元のマニュアルに従った希釈率を用いて使用した。20μgの細胞抽出物を試験した。
【0199】
・腫瘍形成および転移に関する実験
取大学動物実験委員会で承認されたプロトコルに基づいて、動物実験を実施した。腫瘍細胞接種、検死、および組織学的解析を、実験方法セクションに記載したように実施した。播種から7日後、ショートサイレンスオリゴヌクレオチドによる処理を、マウスの尾静脈または右側腹の皮下に、siRNAまたはshRNA (100μM)を週一回のペースで4〜5週にわたって行なった。腫瘍を摘出して計量した。腫瘍体積、ならびに肺、肝臓、腹腔内、および腹腔外(postperitoneal)転移がんを、明視野イメージング機能を備えた解剖顕微鏡下または肉眼で検査および計測した。組織サンプルは、10%緩衝ホルマリン溶液中で一晩固定し、PBSで洗浄し、70%エタノールへ移した。その後、パラフィンに包埋し、薄切し、ヘマトキシリン・エオシンを用いて染色した。転移プロセスの後期ステージにおけるantagomirの効果を評価するために、胸腺欠損マウスの尾静脈を介するかまたは皮下に腫瘍細胞を移植した。次に、腫瘍細胞移植7日後に、同所性の実験に使用したと同一の用量と頻度でantagomir治療を開始した。静脈内投与の場合は全身性転移によって、または、皮下接種の場合は肝臓転移もしくは腹腔内転移によって、マウスは30日目には瀕死の状態になり、安楽死させた。
【0200】
・毒性の評価
胸腺欠損マウスを、1グループにつき5匹に分けて、PBS+DDSまたは50 μMのアンタゴマーを、週一回のペースで4〜5週間にわたって6回、静脈投与した。体重は2週に1回のペースで測定した。マウスは最後の投与後6日で安楽死させ、組織を収集した。全血の一定分量をEDTAで処理したチューブに集めた。遠心分離により血球細胞を除去して、血漿を得た。サンプルを、オリンパス社製Bioanalyzerを使用して解析し、血液の生化学的値を測定した。全ての可能な病理状態に関して、肺または肝臓の切片を検査した。
【0201】
・ヒト正常細胞への誘導
miRNA−47、−101、−197に対するsiRNAをトランスフェクションすることにより、293FT細胞はヒト正常細胞へと誘導された。その後、RT−PCRとウエスタンブロット法を用いて関連遺伝子の発現の変化を評価した。
【0202】
・免疫組織化学試験
製造元(R&D Systems、ミネアポリス、米国)のマニュアルに従って、未分化マーカー(抗Oct-4抗体)ならびに胚性幹細胞マーカー抗体パネル(Embryonic Stem Cell Marker Antibody Panel)を用いて、免疫組織化学検査を実施した。細胞に、miRNA-197に対するsiRNAをトランスフェクトまたは感染した。浮遊するトランスフェクタントを回収し、顕微鏡観察用の新しい培養プレートまたは免疫染色用スライドチャンバーに移した。
【0203】
・hiPSC(Human-induced pluripotent stem cells)
ヒト人工多能性幹細胞であるhiPSC(HPS0002 253G1)はRiken Bioresource Center Cell Bank('Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts.' Nakagawa M et al., Nat Biotechnol 26, 101-106 (2008))から提供された。
【0204】
・培養条件
miR−197 siRNAまたはhsa−mir−520dを導入して作成した多能性幹細胞は、ES細胞用培養液で培養できるが、F-12 HAM[DMEM(15mM HEPES+1mM Sodium Pyruvate+pyridoxine+NaHCO3+5mML-glutamine)], RPMI-1640+L-glutamine, DMEM+high glucose+L-glutamine+0.1mM NEAA およびREPROSTEM(REPROCell社):bFGF 3-10ng/mlからなる群から選ばれる1種以上の培地で37℃、5%CO2、10%FBSの条件で培養可能であった。
【0205】
・フローサイトメトリー
miRNA-197に対応するsiRNAをトランスフェクトした293FT細胞を使用して、トリプシンにより分離脱着した細胞上で、フローサイトメトリーを実行した。単一細胞懸濁物を、冷却したPBSで一度洗浄した。細胞ペレットを、その後、穏やかにチューブを振とうすることによりほぐして、ddH2O中の冷却70%EtOHを滴下して固定した。細胞を、少なくとも一晩、-20℃でインキュベートした。固定後、細胞を冷却したPBSを用いて二回洗浄してEtOHを除去した。その後、細胞を、100U/mlのRNAaseA含有PBS中に、1 × 106細胞/mlにて再懸濁し、37℃で50分間インキュベートした。50μg/mlのヨウ化プロピジウムを直接加えて、光を遮蔽して氷上において40分間インキュベートした。DNA含量を、フローサイトメーター(EPICS ALTRA; Beckman Coulter社)により解析した。リプログラムされた細胞の発現を評価するために、EXPO32 ADC解析ソフトウエアを搭載したフローサイトメーターにより、siRNA-197をトランスフェクション後、約20000イベントで、iPS細胞を評価した。GFP発現細胞もしくはPE陽性細胞のフローサイトメトリーを用いた精製に関しては、ウイルストランスダクション過程の完了24時間後に、(未分化状態を維持して2週間培養後の)293FT細胞またはHLF細胞を、5%FCSを添加したリン酸緩衝液(PBS)中に再懸濁した。PE抱合抗アルカリホスファターゼ(ALP)抗体で、細胞を染色後、GFP陽性細胞またはPE陽性細胞を、Moflo XDP(Beckman Coulter社、カリフォルニア、米国)を使用して分取および解析した。1×108細胞を、アルゴンレーザー(488nm、100mW)を用いて、フォワードスキャッター、サイドスキャッター、ならびにPEおよびGFP蛍光に関して解析した。検出器としては、各々、GFPに関してはFL1を、PEに関してはFL2を使用した。
【0206】
・頭蓋内注入方法
免疫不全マウスをペントバルビタールナトリウム(50mg/kg、腹腔内注射)を用いて麻酔し、定位固定装置中に配置した。外科手術中、動物の体温を、加熱パッドを使用して、37℃に維持した。頭蓋を露出し、左線条体の上に、小規模な開頭を作製した。ポリエチレンの管を介して10μlのハミルトンシリンジに連結された30Gの注射針を、細胞移植用に使用した。注射針を、左線条体に定位的に挿入(ブレグマからA(前方) 0.5mm、L(側方) 2.0mm、D(深さ) 2.5mm)し、5μlの細胞懸濁物(108細胞/μl)を圧力注射した。注射後、その注射針をゆっくりと引き抜いて、頭蓋の孔を、歯科用セメントを用いて被覆した。切開部を、6-0プロレン(Prolene)を用いて縫合した。外科手術から回復後、動物を元の飼育ケージへと戻した。
【0207】
<結果の考察>
以上の結果を踏まえて考察する。実施例の結果、RGM249 shRNAは悪性腫瘍の増殖抑制、悪性腫瘍の転移抑制、細胞内RGM249 mRNA量の抑制、または細胞内hTERT mRNA量の抑制の効果を有していることが示された。また、3つのsiRNAは、悪性腫瘍の増殖抑制、悪性腫瘍の転移抑制、細胞内の3つのmiRNA量の抑制、未分化マーカーのアップレギュレイト、p53のアップレギュレイト、または正常細胞もしくは悪性腫瘍細胞のリプログラミングの効果を有していることが示された。hsa−mir−520dは、未分化マーカーのアップレギュレイト、p53のアップレギュレイト、または正常細胞もしくは悪性腫瘍細胞のリプログラミング、悪性腫瘍の増殖抑制等の効果を有していることが示された。また、hsa-mir-192 siRNA等についても類似の効果が見られた。マウスで見られた悪性腫瘍の抑制は、悪性腫瘍細胞のリプログラミングが要因のひとつであると考えられる。また、未分化型だけでなく高分化型肝癌細胞でもOct4陽性かつNANOG陽性細胞になり、分化型によらない幹性化効果が見られた。なお、RGM249 shRNAと3つのsiRNAは、RGM249 mRNAから始まるカスケードを遮断する点で機能が共通しており、この機能が上記の悪性腫瘍の抑制や悪性腫瘍細胞のリプログラミング等の効果に関与していると考えられる。hsa−mir−520dはこのときアップレギュレイトしていると考えられる。以上から、RGM249 shRNA、3つのsiRNA、hsa−mir−520d、hsa-mir-192 siRNA等はいずれも悪性腫瘍治療に好適に使用できると考えられる。
【0208】
さらには、これらsmall RNAは体内外で細胞を多能性幹細胞へと誘導する誘導剤、または多能性幹細胞を生産するための試薬として好適に使用できると考えられる。特に、癌遺伝子を使用しない点、悪性腫瘍細胞をリプログラミングできる点、単剤でリプログラミングできる点、p53のアップレギュレイトが生じる点、または培養時にフィーダー細胞が不要である点において従来の多能性幹細胞を生産するために研究されてきた化合物よりも優れた特性を有していると考えられる。
【0209】
特に悪性腫瘍細胞のリプログラミングについては世界的にほとんど研究成果がでていない領域であり、今後の悪性腫瘍治療の新たな可能性を秘めている。また、p53については、そのノックアウトやノックダウンがiPS細胞の作成効率を上昇させることが報告されている(Zhao et al., Cell Stem Cell. 2008 Nov 6;3(5):475-9.、 Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.)ため、上記small RNAを用いて得られた多能性幹細胞が、p53をアップレギュレイトしていたことは驚くべき結果であった。そしてこの多能性幹細胞は、p53が発現しているため悪性腫瘍化しにくいと考えられる。
【0210】
なお、上記small RNAを導入した細胞の腫瘍化は、導入後未分化維持環境を持続させる場合に生じ、生体内では腫瘍は発生しにくかった。そのため、細胞にsmall RNA導入後は1週間以内に治療に用いることが好ましい。
【0211】
またRGM249 shRNA、3つのsiRNA、hsa−mir−520dは、それぞれへアピン様構造の1本鎖、2本鎖、pre−miRNA様構造の1本鎖からなっている。このことは、siRNAまたはmiRNAが機能するときの2次構造は必ずしも固定されたものではなく、ある程度の範囲を許容できることを示唆している。
【0212】
なお上記実施例において3つのsiRNA、hsa−mir−520d、またはhsa−mir−192 siRNA等は、標的RNA鎖をRNAiまたはmiRNAの作用でサイレンシングしていると考えられる。しかし仮に他のメカニズムが働いていたとしても、3つのsiRNAのセンス鎖(配列番号4、配列番号5、または配列番号6)およびアンチセンス鎖(配列番号1、配列番号2、または配列番号3)、hsa−mir−520d(配列番号43)、またはhsa−mir−192 siRNA等(配列番号44等)を使用すれば、上記のような効果が得られることは明らかである。または、ここで示されない標的RNA鎖と反応していても同様である。
【0213】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【技術分野】
【0001】
本発明は、新規のsmall RNA、多能性幹細胞誘導剤、悪性腫瘍治療薬、または多能性幹細胞等に関する。
【背景技術】
【0002】
iPS細胞の作成技術は、近年の医療業界で特に注目されている分野である。代表的なiPS細胞の作成技術としては、特許文献1に記載の方法が挙げられる。この文献には、4つの遺伝子(Oct3/4、Klf4、Sox2、c−Myc)を細胞に導入することでiPS細胞を作成したことが記載されている。この技術が開発された頃から、iPS細胞に関連する研究成果の報告数は急速に増えている。例えば、特許文献2には、3つの遺伝子(Oct3/4、Klf4、Sox2)と、1つのmiRNA(hsa−miR−372等)を細胞に導入することでiPS細胞を作成したことが記載されている。非特許文献1には、上記の4つまたは3つの遺伝子を導入する場合にiPS化させる細胞のp53遺伝子を欠損させておくと、iPS細胞の作成効率が上昇したことが記載されている。非特許文献2には、pre−miRNAのクラスター(miR−302a〜miR−302d)を導入することで、癌細胞からiPS細胞を作成したことが記載されている。
【0003】
一方で、製薬会社が近年特に資金を投入している分野は、癌分野である。癌はメカニズムが複雑で不明な点が多く、他の疾患に比べて有効な治療薬が少ない。そのため、この分野の新規の治療薬の開発が待たれている。本願発明者らは非特許文献3において、癌のバイオマーカーとしてhTERT mRNAを適用できることを報告している。また非特許文献4において、hTERT mRNAの発現はRGM249 mRNAと関連しており、RGM249 mRNAに対するshRNAまたはsiRNAによってhTERT mRNAの発現量が減少することを報告している。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開第2007/069666号
【特許文献2】国際公開第2009/075119号
【非特許文献】
【0005】
【非特許文献1】'Suppression of induced pluripotent stem cell generation by the p53-p21 pathway.' Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.
【非特許文献2】'Mir-302 reprograms human skin cancer cells into a pluripotent ES-cell-like state.' Lin et al., RNA. 2008 Oct;14(10):2115-24. Epub 2008 Aug 28.
【非特許文献3】'A novel biomarker TERT mRNA is applicable for early detection of hepatoma.' Miura et al., BMC Gastroenterol. 2010 May 18;10:46.
【非特許文献4】'A noncoding RNA gene on chromosome 10p15.3 may function upstream of hTERT.' Miura et al., BMC Mol Biol. 2009 Feb 2;10:5.
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
上記文献においてiPS細胞の作成方法が徐々に明らかになってきているが、より効率的に、より高品質のiPS細胞を開発するには、新しい作成方法を明らかにし、iPS細胞に関する情報を蓄積していく必要があった。
【0007】
個々の文献について見てみると、特許文献1では癌原遺伝子であるc−Mycを使用しているため、iPS細胞が癌化するリスクを秘めていた。特許文献2ではc−Mycを使用していないが、遺伝子3つとmiRNA1つを細胞に導入させる工程は、複雑であり効率的な作成方法とはいえなかった。非特許文献1ではc−Mycを使用していないが、癌抑制遺伝子であるp53遺伝子を欠損させているので、細胞の癌化や不安定化等のリスクを負っていた。非特許文献2は、miR−302のクラスターを使用しているが、miR−302は腫瘍抑制因子であるPTEN(phosphatase and tensin homolog deleted on chromosome 10)を標的とするmiRNAであることが報告されている(Poliseno et al., Sci Signal. 2010 Apr 13;3(117):ra29)。そのため細胞の癌化のリスクを負っていた。
【0008】
一方で、上記文献において悪性腫瘍のメカニズムが徐々に明らかになってきているが、それだけでは十分とはいえず、新規の医薬品または治療戦略立案のためには、新しい抗悪性腫瘍物質を明らかにし、悪性腫瘍に関する情報を蓄積していく必要があった。
【0009】
非特許文献3および4では、hTERT mRNAが癌形成に関連していることと、RGM249 mRNAに対するshRNAまたはsiRNAによってhTERT mRNAが減少することが記載されているが、癌に治療効果のある物質は何ら明らかにされていない。
【0010】
本発明は上記事情に鑑みてなされたものであり、多能性幹細胞を誘導する新規の化合物を提供することを目的とする。または、未分化細胞マーカー発現調節剤を提供することを目的とする。また別の目的は、多能性幹細胞のp53発現促進剤を提供することである。また他の目的は、新規の悪性腫瘍治療薬を提供することである。また他の目的は、新規の多能性幹細胞を提供することである。
【課題を解決するための手段】
【0011】
本発明によれば、配列番号41の塩基配列を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤が提供される。
【0012】
この多能性幹細胞誘導剤は、後述する実施例で、細胞を多能性幹細胞へ誘導することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、この多能性幹細胞誘導剤を用いれば、細胞を多能性幹細胞へ誘導することができる。
【0013】
また本発明によれば、配列番号41の塩基配列を含む、small RNAを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤が提供される。
【0014】
この多能性幹細胞誘導剤は、後述する実施例で細胞を多能性幹細胞へ誘導することが実証されているsmall RNAを含有する。そのため、この多能性幹細胞誘導剤を用いれば、細胞を多能性幹細胞へ誘導することができる。
【0015】
また本発明によれば、配列番号43の塩基配列を含むポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤が提供される。
【0016】
この多能性幹細胞誘導剤は、後述する実施例で細胞を多能性幹細胞へ誘導することが実証されているポリヌクレオチドを含有する。そのため、この多能性幹細胞誘導剤を用いれば、細胞を多能性幹細胞へ誘導することができる。
【0017】
また本発明によれば、配列番号41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤が提供される。
【0018】
この未分化細胞マーカー発現調節剤は、後述する実施例で細胞内の未分化細胞マーカーを促進または抑制することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、この未分化細胞マーカー発現調節剤を用いれば、細胞内の未分化細胞マーカーの発現量を調節することができる。
【0019】
また本発明によれば、配列番号41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有し、多能性幹細胞におけるp53の発現量を促進する、多能性幹細胞のp53発現促進剤が提供される。
【0020】
このp53発現促進剤は、後述する実施例で多能性幹細胞におけるp53の発現量を促進することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、このp53発現促進剤を用いれば、多能性幹細胞におけるp53の発現量を促進することができる。
【0021】
また本発明によれば、配列番号41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法が提供される。
【0022】
この生産方法は、後述する実施例で多能性幹細胞を作成するために利用できることが実証されている。そのため、この生産方法を用いれば、多能性幹細胞を生産することができる。
【0023】
また本発明によれば、配列番41の塩基配列を含む、1本鎖または2本鎖のポリヌクレオチドを含有する、悪性腫瘍の治療薬が提供される。
【0024】
この悪性腫瘍の治療薬は、後述する実施例で悪性腫瘍を抑制することが実証されている1本鎖または2本鎖のポリヌクレオチドを含有する。そのため、この悪性腫瘍の治療薬を用いれば、悪性腫瘍の治療をすることができる。
【0025】
また本発明によれば、配列番号41の塩基配列を含むポリヌクレオチドを含むポリヌクレオチドを含むベクターが提供される。
【0026】
このベクターを利用すれば、配列番号41を含む、1本鎖または2本鎖のポリヌクレオチドを発現させることができる。そのため、このベクターを用いれば、細胞を多能性幹細胞へ誘導、未分化細胞マーカーの発現量の調節、多能性幹細胞のp53の発現量を促進、または癌悪性腫瘍の治療をするための物質を生産することができる。
【0027】
また本発明によれば、配列番号41の塩基配列を含むポリヌクレオチドを含む、多能性幹細胞誘導用、未分化細胞マーカー発現調節用、多能性幹細胞のp53発現促進用、または悪性腫瘍の治療用のキットが提供される。
【0028】
このキットを利用すれば、後述する実施例において、細胞を多能性幹細胞へ誘導すること、未分化細胞マーカーの発現量を調節すること、多能性幹細胞におけるp53の発現量を促進すること、または悪性腫瘍を抑制することが実証されている1本鎖または2本鎖のポリヌクレオチドを簡易に使用することができる。そのため、このキットを用いれば、細胞を多能性幹細胞へ誘導、未分化細胞マーカーの発現量の調節、多能性幹細胞のp53の発現量を促進、または悪性腫瘍の治療をすることができる。
【0029】
なお、上記のいずれかの多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、p53発現促進剤、多能性幹細胞の生産方法、悪性腫瘍の治療薬、ベクター、およびキットにおいて、配列番号41の塩基配列の1〜3個の塩基が欠失、置換もしくは付加されていたとしてもよい。または、配列番号42の塩基配列の1〜5個の塩基が欠失、置換もしくは付加されていたとしてもよい。または、配列番号43の塩基配列の1〜4個の塩基が欠失、置換もしくは付加されていたとしてもよい。
【発明の効果】
【0030】
本発明によれば、多能性幹細胞を誘導する新規の化合物が得られる。または、未分化細胞マーカーの発現を調節する新規の化合物が得られる。または、多能性幹細胞のp53発現促進剤が得られる。または、新規の悪性腫瘍治療薬が得られる。
【図面の簡単な説明】
【0031】
【図1A】図1Aは、RGM249の2次元構造を表した図である。
【図1B】図1Bは、RGM249 shRNAとRGM249m−1 shRNAの2次元構造を表した図である。
【図1C】図1Cは、RGM249 shRNA皮下注射後の腫瘍ボリュームの変化を調査した結果である。
【図1D】図1Dは、RGM249 shRNAプラスミド等を皮下注射した際の、腫瘍ボリュームの目視的な観察結果である。
【図2A】図2Aは、RGM249 shRNAプラスミド等を皮下注射から35日後に、腫瘍で発現している遺伝子の発現抑制効果を調査した結果である。
【図2B】図2Bは、RGM249 shRNAプラスミド等を静脈注射から28日後に、腫瘍で発現している遺伝子の発現抑制効果を調査した結果である。
【図3A】図3Aは、RGM249 mRNAと、内部の3つのmiRNAに相当する部位を表した結果である。
【図3B】図3Bは、3つのmiRNAの2次構造を表した図である。
【図3C】図3Cは、3つのmiRNAと、3つのsiRNAのアンチセンス鎖との配列を比較した結果である。
【図3D】図3Dは、3つのsiRNAをHMV−Iへトランスフェクションした後の、癌細胞増殖の抑制効果を調査した結果である。
【図3E】図3Eは、3siRNA混合物を同時にトランスフェクションしたHMV−IからRNA抽出を行い、miR−47、miR−101、miR−197の発現レベルを調査した結果である。
【図3F】図3Fは、3siRNA混合物による形質転換体の転写発現プロファイリングを、癌、多分化能、幹細胞性に関連する遺伝子について評価した結果である。
【図4】図4は、3siRNA混合物+DDSの皮下投与による、HMV−I細胞の増殖性の抑制を調査した結果である。
【図5A】図5Aは、評価した腫瘍のあるパーツ表した図である。
【図5B】図5Bは、3siRNA混合物による、miR−47、miR−101、miR−197それぞれの発現抑制効果を評価した結果である。
【図5C】図5Cは、siRNAで処理した腫瘍を顕微鏡で観察した写真である。
【図5D】図5Dは、3siRNA混合物を投与した場合の腫瘍、分化、多能性の関連遺伝子の転写レベルを調査した結果である。
【図6A】図6Aは、miR−197 siRNAを293FT細胞にトランスフェクションした後、顕微鏡で観察した写真である。
【図6B】図6Bは、hsa−mir−520dの2次構造を表した図である。
【図6C】図6Cは、miR−197 siRNAをトランスフェクションした293FT細胞を、顕微鏡で免疫組織化学的に観察した写真である。
【図6D】図6Dは、hsa−mir−520dをHT1080細胞にウイルスベクターで感染させ、強制発現させた後、免疫組織科学的試験で未分化マーカーの発現量を観察した結果である。
【図6E】図6Eは、hsa−mir−520dをT98G細胞にウイルスベクターで感染させ、強制発現させた後、免疫組織科学的試験で未分化マーカーの発現量を観察した結果である。
【図6F】図6Fは、hsa−mir−520dをPK−45p細胞にウイルスベクターで感染させ、強制発現させた後、免疫組織科学的試験で未分化マーカーの発現量を観察した結果である。
【図7A】図7Aは、miR−197 siRNAとhsa−mir−520を用いて作成したiPS細胞における各種遺伝子の転写量を調査した結果である。
【図7B】図7Bは、hiPSCと293FT細胞におけるmiRNA−197とhsa−mir−520dの、miRNA発現レベルの関連性をツーステップリアルタイムRT−qPCR(n=5)で評価した結果である。
【図8A】図8Aは、293FT細胞へのhas-mir-520dのウイルス導入後に出現した浮遊細胞集団を顕微鏡的に評価した結果である。
【図8B】図8Bは、520d-293FTの幹性化転換を免疫細胞化学に基づき確認した結果である。
【図8C】図8Cは、520d-293FTのGFP陽性とNANOG陽性状態を調査した結果である。
【図9A】図9Aは、細胞のp53、hTERT等の発現量をRT-PCRで調査した結果である。
【図9B】図9Bは、細胞のp53、hTERT等の発現量をウエスタンブロットで調査した結果である。
【図9C】図9Cは、細胞のmiRNAの発現量を調査した結果である。
【図9D】図9Dは、has-mir-520dの過剰発現時の細胞のmiRNAの発現量を調査した結果である。
【図10A】図10Aは、293FT、mock-293FT、520d-293FTの細胞周期解析の結果である。
【図10B】図10Bは、293FT、mock-293FT、520d-293FTにおけるDNMT 1、HDAC、Sin3A、MBD3の発現量比を調査した結果である。
【図11A】図11Aは、520d-HLFの形態学的変化を調査した結果である。
【図11B】図11Bは、520d-HLFにおける各種mRNAの発現量比を調査した結果である。
【図11C】図11Cは、mock-HLF、520d-HLFの浸潤する性質を調査した結果である。
【図11D】図11Dは、HLF、mock-HLF、520d-HLFにおける各種蛋白質の発現量を、ウエスタンブロットで調査した結果である。
【図12A】図12Aは、mock-HLF、520d-HLFの細胞周期解析の結果である。
【図12B】図12Bは、HLF、hiPSC、520d-HLFにおける各種mRNAの発現量比を調査した結果である。
【図13】図13は、HLF、mock-HLF、520d-HLFにおけるDNMT 1、HDAC、Sin3A、MBD3の発現量比を調査した結果である。
【図14A】図14Aは、腫瘍形成を示す写真である。
【図14B】図14Bは、白色結節を示す写真である。
【図14C】図14Cは、正常肝組織へと転換したことを示す写真である。
【図14D】図14Dは、腺腫様過形成を示す写真である。
【図14E】図14Eは、生成した奇形腫と肝組織を示す写真である。
【図15】図15は、520d-HLFの分化を調査した結果である。
【図16】図16は、520d-HLFを骨分化誘導した結果である。
【図17】図17は、has-mir-520dウイルスが感染したHuh7の形態学的変化等を調査した結果である。
【図18】図18は、has-mir-520dウイルスが感染したT98Gの形態学的変化等を調査した結果である。
【図19】図19は、has-mir-520dウイルスが感染したPK-9の形態学的変化等を調査した結果である。
【図20】図20は、has-mir-520dウイルスが感染したHT1080の形態学的変化等を調査した結果である。
【図21】図21は、siRNA生成ウイルス感染後のHMV-1において、MTT assayを実施した結果である。
【図22】図22は、siRNA生成ウイルス感染後のHMV-1の蛍光顕微鏡写真と増殖曲線である。
【図23】図23は、siRNA生成ウイルス感染後のHMV-1において、colony formation assayを実施した結果である。
【発明を実施するための最良の形態】
【0032】
以下、本発明の実施の形態について詳細に説明する。なお、同様な内容については、繰り返しの煩雑を避けるために適宜説明を省略する。
【0033】
(1)特定の塩基配列を含むポリヌクレオチド
本発明の一実施形態は、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドである。この1または複数本鎖のポリヌクレオチドは、後述する実施例で細胞を多能性幹細胞に誘導することが示唆されている。そのため、この1または複数本鎖のポリヌクレオチドは、細胞を多能性幹細胞へ誘導するために好適に使用できる。
【0034】
また、この1または複数本鎖のポリヌクレオチドは、後述する実施例で未分化細胞マーカーの発現の促進または抑制をすること、多能性幹細胞におけるp53の発現量を促進すること、または悪性腫瘍の抑制に効果があることが示唆されている。そのため、この1または複数本鎖のポリヌクレオチドは、未分化細胞マーカーの発現を調節するために好適に使用できる。または、この1または複数本鎖のポリヌクレオチドは、多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、この1または複数本鎖のポリヌクレオチドは、悪性腫瘍の治療に好適に使用できる。
【0035】
他の実施形態は、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤である。ここで、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果は、上述したとおりである。そのため、この多能性幹細胞誘導剤は、細胞を多能性幹細胞へ誘導するために好適に使用できる。または、この多能性幹細胞誘導剤は、未分化細胞マーカーの発現を調節するために好適に使用できる。または、この多能性幹細胞誘導剤は、多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、この多能性幹細胞誘導剤は、悪性腫瘍の治療に好適に使用できる。
【0036】
他の実施形態は、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドを含有する、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、または悪性腫瘍の治療薬である。ここで、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果は、上述したとおりである。そのため、この未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、または悪性腫瘍の治療薬は、未分化細胞マーカーの発現を調節するために好適に使用できる。または、それらは細胞を多能性幹細胞へ誘導するために好適に使用できる。または、それらは多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、それらは悪性腫瘍の治療に好適に使用できる。
【0037】
他の実施形態は、配列番号41の塩基配列を含むポリヌクレオチドを含有する、shRNAまたはpre−miRNAである。ここで、配列番号41の塩基配列を含むポリヌクレオチドの有する効果は、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果と同様である。そのため、このshRNAまたはpre−miRNAは、細胞を多能性幹細胞へ誘導するために好適に使用できる。または、このshRNAまたはpre−miRNAは、未分化細胞マーカーの発現を調節するために好適に使用できる。または、このshRNAまたはpre−miRNAは、多能性幹細胞のp53の発現量を促進するために好適に使用できる。または、このshRNAまたはpre−miRNAは、悪性腫瘍の治療に好適に使用できる。
【0038】
他の実施形態は、配列番号41の塩基配列に相補的な塩基配列を含むポリヌクレオチドを含有する、ベクターである。このベクターは、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドを発現、又は生産するために好適に使用できる。そのため、このベクターは上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の用途(多能性幹細胞誘導剤、治療薬等)に使用できる。
【0039】
またこのベクターは、さらに、配列番号42の塩基配列に相補的な塩基配列を含んでいてもよい。この場合、配列番号41の塩基配列を含むポリヌクレオチドに対して、塩基対を形成可能なポリヌクレオチドを発現、又は生産するために好適に使用できる。また、配列番号41の塩基配列を含むポリヌクレオチドを含有するsiRNA、miRNA、pre−miRNAまたはshRNAを発現、又は生産するために好適に使用できる。
【0040】
上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドは、さらに、配列番号42の塩基配列を含んでいてもよい。この場合、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドが発揮する、RNAiまたはmiRNAの作用効率が上昇すると考えられる。なぜならば、配列番号41の塩基配列と配列番号42の塩基配列とが塩基対を形成することで、RISCに取り込まれやすくなると考えられるためである。また、上記の、1または複数本鎖が1本鎖である場合には、shRNAまたはpre−miRNAの構造をとることができる。また、配列番号42の塩基配列を含む場合、上記の配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドがより安定化されると考えられる。また、上記の配列番号41の塩基配列を含む、1または複数本鎖のポリヌクレオチドが、配列番号41の塩基配列からなるRNA鎖の相補鎖を含んでいても同様の効果が得られると考えられる。さらには、配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドは、配列番号43の塩基配列を含む1本鎖のポリヌクレオチドであってもよい。この場合、shRNAまたはpre−miRNAとして好適に使用できる。
【0041】
他の実施形態は、配列番号43の塩基配列を含むポリヌクレオチドである。このポリヌクレオチドは、後述する実施例で細胞を多能性幹細胞に誘導すること、未分化細胞マーカーの発現の促進または抑制をすること、多能性幹細胞におけるp53の発現量を促進すること、または悪性腫瘍の抑制に効果があることが示唆されている。そのため、このポリヌクレオチドは、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬の用途に使用できる。また、shRNA、pre−miRNAまたはベクターとしても使用可能である。
【0042】
また、配列番号1、2、3、8、または44〜47の1つ以上の塩基配列を含む1または複数本鎖のポリヌクレオチドは、上述したような配列番号41の塩基配列を含む1または複数本鎖のポリヌクレオチドの有する効果と、同様の効果を発揮しうることが、後述する実施例で示唆されている。そのため、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬、siRNA(またはmiRNA)もしくはshRNA(またはpre−miRNA)、またはベクターの用途に使用できる。なお、配列番号1、2、3、8、または44〜47の1つ以上の塩基配列を含む1または複数本鎖のポリヌクレオチドは、それらの相補鎖、またはそれぞれ配列番号4、5、6、9、または48〜51の1つ以上の塩基配列を含むポリヌクレオチドをさらに含んでいても良い。また、配列番号8の塩基配列を含む1または複数本鎖のポリヌクレオチドは、配列番号10の塩基配列を含む1本鎖のポリヌクレオチドであってもよい。また、配列番号44〜47の塩基配列を含む1または複数本鎖のポリヌクレオチドは、それぞれ配列番号52〜55もしくはそれぞれ56〜59の塩基配列を含む1または複数本鎖のポリヌクレオチドであってもよい。
【0043】
これと同様のことは、配列番号7の塩基配列を含むRNA鎖を、ダイサーで処理して得られるRNA鎖に対して相補的な塩基配列(以下、「ダイサー処理後の相補的な塩基配列」と称することもある)を含む、1または複数本鎖のポリヌクレオチドでもいえる。即ち、ダイサー処理後の相補的な塩基配列を含む、1または複数本鎖のポリヌクレオチドは、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬、siRNA(またはmiRNA)もしくはshRNA(またはpre−miRNA)、またはベクターの用途に使用できる。この1または複数本鎖のポリヌクレオチドは、ダイサー処理後の相補的な塩基配列に相補的な配列をさらに含んでいても良い。また、ダイサー処理後の相補的な塩基配列は、配列番号11、12、および13からなる群から選ばれる1種以上の塩基配列を含むRNA鎖に対して、RNAi作用を有する1本鎖または2本鎖のポリヌクレオチドであっても良い。
【0044】
これと同様のことは、配列番号7の塩基配列を含むRNA鎖に対してRNAi作用を有する1本鎖または2本鎖のポリヌクレオチドでもいえる。即ち、配列番号7の塩基配列を含むRNA鎖に対してRNAi作用を有する1本鎖または2本鎖のポリヌクレオチドは、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、悪性腫瘍の治療薬、siRNA(またはmiRNA)もしくはshRNA(またはpre−miRNA)、またはベクターの用途に使用できる。
【0045】
(2)実施形態に係るポリヌクレオチドが導入された細胞
他の実施形態は、上記のいずれかの1または複数本鎖のポリヌクレオチド、または上記のいずれかのベクターが導入された細胞である。この細胞は多能性が誘導されているため、再生医療等の医療材料や研究材料として好適に使用できる。
【0046】
またこの細胞は、外来性のc−Mycが無く、内在性のp53が発現しているため、悪性腫瘍化のリスクが低い。このp53の発現量は、例えば、hiPSCのHPS0002:253G1株のp53発現量に対して、1、1.2、1.4、1.6、1.8、2.0、3.0、4.0、5.0、10、100、または1000倍であるが、それらに限定されない。またこの発現量は、ここで例示したいずれか2つの値の範囲内であってもよい。また、p53の発現量の測定方法は、測定精度および簡便性の面からリアルタイムPCRが好ましい。詳しい測定条件については、後述する実施例におけるリアルタイムPCRの測定条件を用いることができる。
【0047】
(3)多能性幹細胞及びその生産方法
他の実施形態は、上記のいずれかの1または複数本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法である。又は、上記のいずれかのベクターを、細胞に導入する工程を含む、多能性幹細胞の生産方法である。この方法を適切に用いれば、多能性幹細胞を生産することができる。なおポリヌクレオチドまたはベクターの細胞への導入、および培養方法は、当該技術分野で公知の方法に従って行うことができる。細胞への導入は、例えば、リン酸カルシウム法、リポフェクション法、エレクトロポレーション法、ウイルス(アデノウイルス、レトロウイルス、HIV等)を用いた方法、またはマイクロインジェクションなどを使用できる[改訂第4版 新 遺伝子工学ハンドブック, 羊土社(2003):152−179.]。また薬剤耐性やセルソーター等を利用して、導入された細胞のみを選択することができる。培地は、例えば、霊長類ES細胞用培地(コスモ・バイオ社)や通常のヒト細胞用の培地(例えば、DMEMやRPMIベースの培地)等を使用できる。一般的にES細胞を樹立する際にはフィーダー細胞と共培養することが多いが、本実施形態の多能性幹細胞はフィーダー細胞の非存在下でも樹立可能である。フィーダー細胞は、例えばEuropean Collection of Cell Culturesより入手できる。さらに、本実施形態の多能性幹細胞は、いずれもF-12 HAM[DMEM(15mM HEPES+1mM Sodium Pyruvate+pyridoxine+NaHCO3+5mML-glutamine)], RPMI-1640+L-glutamine, DMEM+high glucose+L-glutamine+0.1mM NEAA および REPROSTEM(REPROCell社):bFGF 3-10ng/mlからなる群から選ばれる1種以上の培地で37℃、5% CO2、10% FBSの条件で培養可能である。そのため、いわゆるiPS細胞の有する培養上の困難性を克服することにも成功している。
【0048】
他の実施形態は、上記生産方法で得られる多能性幹細胞である。または、HPS0002:253G1株に比べて内在性のp53の発現量が増大している、多能性幹細胞である。または、上記のいずれかの1または複数本鎖のポリヌクレオチドの発現量が増大している、多能性幹細胞である。これらの細胞は、内在性のp53が発現しているため、悪性腫瘍化のリスクが低い。
【0049】
(4)実施形態に係るポリヌクレオチドに関連する配列
ここで、上記の配列番号1〜10、および41〜59の塩基配列は、ある程度であれば変異を受けていてもよい。そのような変異を有している塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。変異型の塩基配列を含むポリヌクレオチドは、人工的に作成することが可能であり、その場合には改変型の塩基配列を含むポリヌクレオチドと呼ぶこともできる。
【0050】
なお、RNAiやmiRNA等の用途で用いる場合には、配列番号4〜6、9、42、48〜51、および56〜59の塩基配列の変異は、配列番号1〜3、8、41、44〜47、および52〜55の塩基配列の変異より大きくても、その機能に変動が生じにくい。なぜならば、配列番号1〜3、8、41、44〜47、および52〜55の塩基配列は、RNAiやmiRNA等の機能を特徴付ける重要な配列であるが、一方で、配列番号4〜6、9、42、48〜51、および56〜59の塩基配列は補助的な配列なためである。
【0051】
また、上記の配列番号1〜10、および41〜59の塩基配列は、それぞれの塩基配列の1もしくは数個の塩基が欠失、置換もしくは付加された塩基配列であっても良い。そのような塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。ここで上記「1もしくは数個」は好ましくは10個以下であり、より好ましくは5個以下であり、より好ましくは4個以下であり、より好ましくは3個以下であり、より好ましくは2個以下であり、さらに好ましくは1個である。なぜならば、上記「1もしくは数個」が少ないほど、野生型に近い特性を有していることになるからである。なお、上記「付加」には挿入の概念を含む。
【0052】
また、上記の配列番号1〜10、および41〜59の塩基配列は、それぞれの塩基配列に対して、80%以上の相同性を有する塩基配列であっても良い。そのような塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。ここで上記「80%以上」は好ましくは85%以上であり、より好ましくは90%以上であり、より好ましくは95%以上であり、より好ましくは96%以上であり、より好ましくは97%以上であり、さらに好ましくは98%以上であり、最も好ましくは99%以上である。なぜならば、上記「80%以上」が大きいほど、野生型に近い特性を有していることになるからである。
【0053】
また、上記の配列番号1〜10、および41〜59の塩基配列は、それぞれの塩基配列に相補的な塩基配列からなるポリヌクレオチドに対して、ストリンジェントな条件でハイブリダイズするポリヌクレオチドであっても良い。そのような塩基配列を含む1または複数本鎖のポリヌクレオチドは、野生型の塩基配列を含む1または複数本鎖のポリヌクレオチドと同様の効果を有すると考えられる。
【0054】
本明細書において「相同性」とは、2つもしくは複数間の塩基配列の同一の塩基数の割合を、当該技術分野で公知の方法に従って算定したものである。割合を算定する前には、比較する塩基配列群の塩基配列を整列させ、同一の割合を最大にするために必要である場合は塩基配列の一部に間隙を導入する。また、最適に整列した状態において、オーバーラップする塩基を含めた全塩基に対する、同一の塩基数の割合を意味する。整列のための方法、割合の算定方法、およびそれらに関連するコンピュータプログラムは、当該技術分野で従来からよく知られており、一般的な配列分析プログラム(例えば、GENETYX、GeneChip Sequence Analysisなど)を使用して測定することができる。
【0055】
本明細書において「ストリンジェントな条件」とは、例えば(1)洗浄のための低イオン強度と高温度、例えば、50℃において0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウムを用いる、(2)ハイブリダイゼーション中にホルムアミド等の変性剤、例えば、42℃において50%(vol/vol)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウムバッファー(pH6.5)、および750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いる、または(3)42℃において50%ホルムアミド、5×SSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5×デンハート液、超音波処理サケ精子DNA(50μg/ml)、0.1%SDS、および10%のデキストラン硫酸と、42℃において0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)中での洗浄および55℃のホルムアミド、次いで55℃におけるEDTAを含む0.1×SSCにてストリンジェントな洗浄を含む条件であっても良い。また中程度にストリンジェントな条件の例は、20%ホルムアミド、5×SSC、50mMリン酸ナトリウム(pH7.6)、5×デンハート液、10%デキストラン硫酸、および20mg/mlの変性剪断サケ精子DNAを含む溶液中において、37℃で一晩インキュベーション、次いで1×SSC中37〜50℃でのフィルターの洗浄のような条件である。なお、ハイブリダイゼーション反応のストリンジェンシーは、当業者によって容易に決定でき、一般的にプローブ長、洗浄温度、および塩濃度に依存する。一般に、長いプローブは適当なアニーリングのために高温を必要とし、短いプローブは低温を必要とする。また一般に、ストリンジェンシーは塩濃度に逆比例する。
【0056】
通常、遺伝子工学や生命工学の分野では、ポリヌクレオチド中の塩基がある程度の変異や欠失等をしていても、野生型と同様の機能が保たれることが知られている。また、2つのポリヌクレオチド間での塩基のミスマッチについてもある程度許容されることが知られている。後述する実施例においても、実際にポリヌクレオチド中の塩基の欠失や、ミスマッチが存在する。例えば、RGM249 shRNAに1塩基の欠失があっても、悪性腫瘍抑制効果がみられている(図1B、図1D)。このことは、ある程度の欠失等が生じても、野生型と同様の機能が保たれることを示唆している。miR−47 siRNAの配列をみると、ガイド鎖とパッセンジャー鎖の間に3つのミスマッチが存在している(図3B)。miR−101 siRNAの配列をみると、ガイド鎖とパッセンジャー鎖間に1つのミスマッチが存在している(図3B)。miR−47とmiR−47 siRNAのガイド鎖の間に3つのミスマッチが存在している(図3C)。これらのことは、RNAiまたはmiRNAの機能は、2本鎖がある程度ミスマッチを有していても生じることを示唆している。
【0057】
(5)実施形態に係るポリヌクレオチドに関連するその他の特徴
本明細書において「多能性幹細胞」とは、多能性を有しており、様々な細胞へ分化することができる細胞である。例えば、国際公開第2007/069666号や、文献[Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.]に生産方法や特性の例が記載されている。また、多能性幹細胞は当業者であれば認識できるが、例えば、ヒト人工多能性幹細胞であるhiPSC(HPS0002 253G1)に比べて、いずれかの未分化マーカーを同程度かそれ以上発現している細胞を含む。
【0058】
本明細書において「未分化細胞マーカー」とは、未分化の細胞で特異的に発現しているDNA鎖、RNA鎖、または蛋白質等の化合物の総称である。例えば、Klf4、c−Myc、Oct4、Sox2、PROM1、Nanog、SSEA−1、ALP、eRas、Esg1、Ecat1、Fgf4、Gdf3、REX−1などが挙げられる。多能性幹細胞マーカーということもある。
【0059】
本明細書において「RNAi」とは、siRNA(short interfering RNA)やshRNA(short hairpin RNA)、短鎖または長鎖の1または複数本鎖RNA等によって、標的遺伝子やmRNA等の機能が抑制される現象である。一般的に、この抑制は配列特異的であり、様々な生物種に存在する。siRNAを用いた場合の、典型的な哺乳類におけるRNAiのメカニズムは以下の通りである。まず、siRNAを細胞内に導入すると、siRNAの一本鎖化が起こり、その後RISC(RNA-induced Silencing Complex)を形成する。RISCは取り込まれた1本鎖RNAをガイド分子として、この1本鎖RNAと相補性の高い配列を持つ標的RNA鎖を認識する。標的RNA鎖はRISC内のAGO2によって、siRNAの中心部分で切断される。その後、切断された標的RNA鎖は分解される。以上が典型的なメカニズムであるが、その他に、生体内のmiRNAを標的として抑制した例が文献[Krutzfeldt et al., Nucleic Acids Res. 2007;35(9):2885-92. Epub 2007 Apr 16.]に記載されている。なお、本明細書において「RNAi作用を有する分子」は、RNAi作用を引き起こすことができる分子であり、例えば、siRNA、shRNA等を含む。
【0060】
本明細書において「siRNA」とは、RNAiを引き起こす2本鎖のポリヌクレオチドである。一般的にsiRNAの2本鎖はガイド鎖とパッセンジャー鎖に分けることができ、ガイド鎖がRISCに取り込まれる。RISCに取り込まれたガイド鎖は、標的RNAを認識するために使われる。RNAi研究では主に人工的に作成したものが使用されるが、生体内において内在的に存在するものも知られている。
【0061】
本明細書において「miRNA(microRNA)」とは、siRNAと類似の機能を有しているポリヌクレオチドであり、標的RNA鎖の翻訳抑制や分解をすることが知られている。pre−miRNAは、miRNAの前駆体である。miRNAとsiRNAとの違いは、一般的に生成経路と、詳細なメカニズムにある。生体内におけるmiRNAの典型的な生成経路は以下の通りである。まず、miRNA遺伝子から長いpri−RNA(primary miRNA)として転写される。このpri−miRNAの中には、後にmiRNAになる配列が含まれており、その部分はヘアピン構造をとっている。このヘアピン構造の根本をDroshaが切断する。切り出されたヘアピンはpre−miRNAと呼ばれる。このpre−miRNAはExportin−5によって細胞質に運ばれる。次に細胞質においてDicerがpre−miRNAを切断することで2本鎖のmiRNAができ、さらにこれが1本鎖化してRISCを形成する。この1本鎖RNAがガイド分子として働いて、標的RNA鎖を認識し、切断または翻訳抑制する。以上が典型的なmiRNAの生成経路である。なお、本明細書において「miRNA作用を有する分子」は、miRNA作用を引き起こすことができる分子であり、例えば、miRNA、pre−miRNA、pri−miRNA等を含む。
【0062】
本明細書において「shRNA」とは、ヘアピン状に折りたたまれた構造(ヘアピン様構造)を形成可能な1本鎖のポリヌクレオチドであり、RNAiを誘導する機能を有する。pre−miRNAと類似の構造をしており、通常細胞内ではDicerによって切断され、siRNAが切り出される。このsiRNAによって標的RNAの切断が生じることが知られている。
【0063】
本明細書において「small RNA」とは、比較的小さいRNAをいい、例えば、siRNA、miRNA、shRNA、pre−miRNA、1または複数本鎖の低分子RNAなどを挙げることができるが、それらに限定されない。塩基数は、例えば15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90、または100塩基であるが、それらに限定されない。またこの塩基数は、ここで例示したいずれか2つの値の範囲内であってもよい。
【0064】
本明細書において「ダイサー(Dicer)」は、siRNAやmiRNA等の前駆体を切断して、siRNAやmiRNA等を切りだす機能を有している酵素を含む。例えば、dsRNAをsiRNAへ、pre−miRNAをmiRNAへ、shRNAをsiRNAへと導くことができる。また、ダイサーは上記以外のいくつかの機能を有していることが知られている。
【0065】
上記の1または複数本鎖は、1本鎖または2本鎖であってもよい。この場合、siRNA、miRNA、shRNA、またはアンチセンスRNAのメカニズムを利用することができる。
【0066】
上記の1または複数本鎖のポリヌクレオチドは、いずれかを個々で使用してもよいが、2つ以上を併用してもよい。そのような場合でも、多能性幹細胞誘導剤、未分化細胞マーカー発現調節剤、多能性幹細胞のp53発現促進剤、または悪性腫瘍の治療薬として好適に使用できる。なお2つ以上を併用する場合の併用割合は特に限定しない。
【0067】
上記の1または複数本鎖のポリヌクレオチドは、RNAi作用を有していてもよい。この場合、標的とするRNA鎖をRNAi作用によって分解することが可能である。
【0068】
上記の1または複数本鎖のポリヌクレオチドは、small RNAであってもよい。この場合、インターフェロン応答等の不利益な現象が生じるリスクが低い。インターフェロン応答とは、一般的に細胞が2重鎖RNA(dsRNA)を感知することによって抗ウイルス状態になる現象として知られている。長鎖のdsRNAを細胞に導入した場合に、dsRNA応答性プロテインキナーゼ(PKR)が活性化し、インターフェロン反応が誘導されることが報告されている(Gil et al., Apoptosis. 2000 Apr;5(2):107-14.)。その結果、非特異的な遺伝子発現の抑制やアポトーシスが誘導されるといわれている。
【0069】
上記の1または複数本鎖のポリヌクレオチドは、例えば、15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90、100、200、または500ヌクレオチドであるが、それらに限定されない。この数は、ここで例示したいずれか2つの値の範囲内であってもよい。この数が15以上であれば、標的のポリヌクレオチドに対して精度よく結合できる可能性が高まる。また、この数が100以下であれば、インターフェロン応答等の不利益な現象が生じるリスクが低くなる。この現象は、ヌクレオチド数が少ないほど生じにくいと考えられる。
【0070】
上記の1または複数本鎖のポリヌクレオチドは、1本鎖の場合にはshRNAであってもよく、2本鎖の場合にはsiRNAであってもよい。この場合、標的とするRNA鎖をRNAi作用によって分解することが可能である。また、塩基対を形成しているため、RISCに取り込まれやすくなり効率的にRNAiが生じる(Martinez et al., Cell. 2002 Sep 6;110(5):563-74.)。また、2本鎖の場合には、miRNAであっても良い。この場合、標的とするRNA鎖をmiRNA作用によってサイレンシングすることが可能である。また、1本鎖でshRNAのようなへアピン構造を有していない場合であってもよい。そのような構造でも、標的RNA鎖の発現抑制を奏することが文献[Hohjoh et al., FEBS Lett. 2002 Jun 19;521(1-3):195-9.]に記載されている。
【0071】
また、上記shRNAは35以上のヌクレオチドから構成されていてもよい。35以上であれば、shRNAに特有のへアピン様構造を精度よく形成できる可能性が高まる。また、上記shRNAは100以下のヌクレオチドから構成されていてもよい。100以下であれば、インターフェロン応答等の不利益な現象が生じるリスクが低くなる。但し、一般的にshRNAと構造および機能が類似しているpre−miRNAの多くが、100ヌクレオチド程度またはそれ以上の長さを有していることから、shRNAの長さは必ずしも100ヌクレオチド以下でなくても、shRNAとして機能できると考えられる。また、文献[Lin et al., RNA. 2008 Oct;14(10):2115-24. Epub 2008 Aug 28.]には、人工的にpre−miRNAを4つ結合させた大きな分子でも機能できることが示唆されている。そのため、この数はshRNAとして機能できれば限定されず、例えば、35、36、37、38、39、40、45、50、55、60、65、70、75、80、85、90、95、100、200、または500ヌクレオチドである。またこの数は、ここで例示したいずれか2つの値の範囲内であってもよい。また、pre−miRNAも同様の理由から、shRNAと同程度の数のヌクレオチドを有していても良い。
【0072】
また、上記siRNAまたはmiRNAのガイド鎖は15以上のヌクレオチドから構成されていてもよい。15以上であれば、標的のポリヌクレオチドに対して精度よく結合できる可能性が高まる。また、それらガイド鎖は40以下のヌクレオチドから構成されていてもよい。40以下であれば、インターフェロン応答等の不利益な現象が生じるリスクが低くなる。この数は、例えば15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、または40ヌクレオチドであるが、それらに限定されない。またこの数は、ここで例示したいずれか2つの値の範囲内であってもよい。
【0073】
上記の1または複数本鎖のポリヌクレオチド、shRNA、siRNA、miRNA、およびpre−miRNAは、1〜5ヌクレオチドからなるオーバーハングを含んでいてもよい。この場合、RNAiの効率が上昇すると考えられる。この数は、例えば5、4、3、2、または1ヌクレオチドであるが、それらに限定されない。またこの数は、ここで例示したいずれか2つの値の範囲内であってもよい。
【0074】
上記のベクターとしては、大腸菌由来のプラスミド(例えば、pBR322、pBR325、pUC12、pUC13)、枯草菌由来のプラスミド(例、pUB110、pTP5、pC194)、酵母由来プラスミド(例、pSH19、pSH15)、λファージなどのバクテリオファージ、HIV、アデノウイルス、レトロウイルス、ワクシニアウイルス、バキュロウイルスなどのウイルス由来のベクター、pA1−11、pXT1、pRc/CMV、pRc/RSV、pcDNAI/Neo、pSUPER(OligoEngine社)、BLOCK-it Inducible H1 RNAi Entry Vector(インビトロジェン社)、pRNATin-H1.4/Lenti (GenScript, corp., NJ, USA)などを用いることができる。
【0075】
上記の多能性幹細胞誘導剤は、体細胞を多能性幹細胞へ誘導する機能を有していてもよい。この場合、体細胞から多能性幹細胞を作成することができる。本明細書において「体細胞」とは、生殖細胞を除いた他の細胞のことで、皮膚由来の細胞、線維芽細胞等が含まれる。体細胞は通常、多能性が限定されているかまたは消失している。本明細書において「多能性幹細胞誘導剤」とは、細胞を多能性幹細のような多能性を有している細胞に近づける作用を持った物質のことである。本明細書において「リプログラミング」とは細胞を多能性幹細のような多能性を有している細胞に近づける作用のことである。
【0076】
上記の多能性幹細胞誘導剤は、悪性腫瘍細胞を多能性幹細胞へ誘導する誘導剤であってもよい。この場合、悪性腫瘍細胞から多能性幹細胞を作成することができる。本明細書において「悪性腫瘍」とは、正常な細胞が突然変異を起こして増殖を続けることで起こる疾患を含む。また、癌腫、肉腫を含む。悪性腫瘍は全身のあらゆる臓器や組織から生じ、悪性腫瘍細胞が増殖すると、かたまりとなって周囲の正常な組織に侵入し破壊することが知られている。癌は、例えば、肺癌、食道癌、胃癌、肝臓癌、膵臓癌、腎臓癌、副腎癌、胆道癌、乳癌、大腸癌、小腸癌、子宮頸癌、子宮体癌、卵巣癌、膀胱癌、前立腺癌、尿管癌、腎盂癌、尿管癌、陰茎癌、精巣癌、脳腫瘍、中枢神経系の癌、末梢神経系の癌、頭頸部癌(口腔癌、咽頭癌、喉頭癌、鼻腔・副鼻腔癌、唾液腺癌、甲状腺癌等)、グリオーマ、多形性膠芽腫、皮膚癌、メラノーマ、甲状腺癌、唾液腺癌、血液の癌、または悪性リンパ腫などを含む。
【0077】
上記の多能性幹細胞誘導剤は、肝臓癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍の細胞を多能性幹細胞へ誘導する誘導剤であってもよい。この場合、それらの悪性腫瘍細胞から多能性幹細胞を作成することができる。悪性腫瘍細胞を多能性幹細胞へ誘導することはこれまでにほとんど報告されておらず、新しい革新的な悪性腫瘍の治療方法として期待できる。
【0078】
上記の多能性幹細胞は、内在性のp53を発現していてもよい。この場合、悪性腫瘍化が生じにくいと考えられる。なお、p53の発現量は、コントロール試料(例えば、p53ノックアウト細胞、正常細胞、またはそれらに由来する試料等)に比べて有意に高発現していることが好ましい。明細書において「有意に」とは、例えばコントロール群と被検査群との間の統計学的有意差をスチューデント(Student)のt検定を使用して評価し、p<0.05であるときを含む。本明細書において「コントロール群」とは、被検査群と異なる条件下に置かれた試料のことであり、当該技術分野において通常使用される範囲内の概念で表すことができる。
【0079】
p53は一般的に悪性腫瘍抑制遺伝子に分類される遺伝子であり、DNAが損傷したときに活性化されて、細胞分裂の停止と損傷の修復を誘導する機能が知られている。一方で、p53をノックアウトやノックダウンさせると、iPS細胞の作成効率が上昇することが報告されている(Zhao et al., Cell Stem Cell. 2008 Nov 6;3(5):475-9.、 Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.)。これらことは、p53による悪性腫瘍抑制とiPS細胞作成の効率化は、トレードオフの関係にあることを示している。また、p53を欠損したES細胞は染色体が不安定であることや、分化誘導に対して抵抗性を持つことが報告されている(Lin et al., Nat Cell Biol. 2005 Feb;7(2):165-71. Epub 2004 Dec 26.)。これは分化誘導後に未分化細胞が残存する可能性が高いことを意味している。そのため、再生医療においてp53を欠損させた細胞を移植した場合に、悪性腫瘍形成のリスクが高まると考えられる。従って、この面からもp53は細胞にとって重要な分子であることがわかる。
【0080】
本明細書において「内在性」とは、被検物質が細胞の内部のメカニズムに由来して存在していることを表している。例えば、細胞内で恒常的に発現している蛋白質は、その発現した蛋白質に限っては内在性に含まれる。
【0081】
上記の未分化細胞マーカー発現調節剤において、未分化細胞マーカーはKlf4、c−Myc、Oct4、Sox2、PROM1からなる群から選ばれる1種以上の未分化細胞マーカーであってもよい。未分化細胞マーカーや各種蛋白質は、RT−PCR(Reverse Transcription Polymerase Chain Reaction)などの公知の方法を用いて検出することができる。RT−PCRは、RNA鎖を鋳型に逆転写を行い、生成されたcDNAに対してPCRを行う方法である。なお、トータルRNAは細胞からグアニジンチオシアネート法、市販の試薬またはキットを使用して抽出できる。細胞は、インビトロジェン株式会社、三光純薬株式会社、タカラバイオ株式会社等から購入できる。また未分化細胞マーカーや各種蛋白質は、さらにリアルタイムPCRと組み合わせて検出することもできる。そのような方法は、リアルタイムRT−PCRと呼ばれる。リアルタイムPCRは、PCRによって増幅する核酸をリアルタイムでモニタリングする方法である。例えば、文献[原理からよくわかるリアルタイムPCR実験ガイド、羊土社、2007/12]に記載の手順によって行うことができる。上記モニタリングの方法としては、インターカレーション法、ハイブリダイゼーション法、LUX(Light Upon eXtensyon)法などが挙げられる。インターカレーション法の典型的な方法は、SYBR(r) Green Iなどの蛍光物質が二本鎖の核酸に入り込み、励起光の照射によって発光を発する特性を利用して核酸量を測定する方法である。蛍光の強さは核酸の量に比例して強くなるため、蛍光強度を測定することによって核酸の増幅量を知る事ができる。また、リアルタイムPCRを使用した定量方法では、大きく分けて絶対定量法と相対定量法の2つの定量方法がありそれらを適宜使用できる。
【0082】
本明細書において「発現調節剤」とは、標的蛋白質またはmRNAの発現量を増加または減少させることが可能な物質を含む。ここで、増加または減少する量は、コントロール細胞に比べて有意差があることが好ましい。
【0083】
上記の悪性腫瘍の治療薬は、さらに、DDS(Drug Delivery System)を含んでいてもよい。この場合、ポリヌクレオチドを細胞内に効率的に導入できる。DDSとしては、ゼラチンハイドロゲルまたはアテロコラーゲンを含む。本明細書において「ゼラチンハイドロゲル」とは、ゼラチンを原料としたハイドロゲルでDDSとして使用できる。ゼラチンハイドロゲルは生体適合性、生体吸収性に優れている。本明細書において「アテロコラーゲン」とは、アテロコラーゲンを原料としたDDSである。細胞への導入効率や安全性に優れている。アテロコラーゲンとは、一般的にコラーゲンに含まれるテロペプチドを酵素的に分解したもので、免疫反応を誘発し難い。
【0084】
上記の悪性腫瘍の治療薬において、悪性腫瘍は肝臓癌、肺癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍であってもよい。この場合、それらの悪性腫瘍の治療が可能になる。特にこれらの悪性腫瘍はいずれも革新的な治療方法が無いために、上記の悪性腫瘍の治療薬は有望な治療薬である。
【0085】
本明細書において「肝臓癌」とは、肝臓の細胞が増殖を続けることで起こる疾患を含む。肝臓癌を生起させることができる肝細胞は胆管、門静脈のような血管の細胞、樹状細胞または肝細胞を含む。また、原発性肝癌と転移性肝癌を含む。原発性肝癌の多くは肝細胞癌(hepatocellular carcinoma)であることが知られている。
【0086】
本明細書において「肺癌」とは、気管、気管支、肺胞の上皮細胞等に発生する悪性腫瘍を含み、病理学的には、腺癌、扁平上皮癌、大細胞癌、小細胞癌に分類できる。進展形式や治療反応性などが小細胞癌とその他の癌とでは異なるため、腺癌、扁平上皮癌および大細胞癌はまとめて非小細胞癌とも呼ばれる。カルチノイドや円柱種など、小細胞癌および非小細胞癌に含まれない少数の腫瘍もある。
【0087】
本明細書において「膵臓癌」とは、膵臓から発生した悪性腫瘍を含む。膵臓は、膵液を産生する腺房、膵液を運ぶ膵管、および内分泌腺であるランゲルハンス島などからなる。癌はいずれの組織からも発生しうる。例えば、浸潤性膵管癌、膵内分泌腫瘍、膵管内乳頭粘液性腫瘍、粘液性嚢胞腫瘍、腺房細胞癌、漿液性嚢胞腺癌等が挙げられる。
【0088】
本明細書において「肉腫」とは、骨、軟骨、脂肪、筋肉、血管等の非上皮性細胞由来の結合組織細胞に発生する悪性腫瘍を含む。例えば、線維肉腫、悪性線維性組織球腫、皮膚線維肉腫、脂肪肉腫、横紋筋肉腫、平滑筋肉腫、血管肉腫、カポジ肉腫、リンパ管肉腫、滑膜肉腫、胞巣状軟部肉腫、骨外性軟骨肉腫、骨外性骨肉腫、悪性末梢神経鞘腫瘍、骨肉腫、軟骨肉腫、顆粒球肉腫、ユーイング肉腫、骨原発の線維肉腫、悪性骨巨細胞腫、骨原発の脂肪肉腫、骨原発の血管肉腫等が挙げられる。
【0089】
本明細書において「グリオーマ」とは、神経膠細胞から発生する悪性腫瘍を含む。例えば、星状膠細胞系腫瘍、稀突起膠細胞系腫瘍、上衣系腫瘍、脈絡叢腫瘍、多形性膠芽腫等が挙げられる。
【0090】
本明細書において「メラノーマ」とは、皮膚、眼窩内組織、口腔粘膜上皮などに発生するメラノサイト由来の悪性腫瘍を含む。例えば、悪性黒子型黒色腫、表在拡大型黒色腫、結節型黒色腫、末端黒子型黒色腫等が挙げられる。
【0091】
本明細書において「ポリヌクレオチド」とは、ヌクレオチドもしくは塩基、またはそれらの等価物が、複数結合した形態で構成されているものを含む。ヌクレオチドおよび塩基は、DNA塩基またはRNA塩基を含む。上記の等価物は、例えばDNA塩基またはRNA塩基がメチル化等の化学修飾を受けているもの、またはヌクレオチドアナログを含む。ヌクレオチドアナログは、非天然のヌクレオチドを含む。「DNA鎖」とは、DNA塩基またはそれらの等価物が2個以上連結した形態のことを表す。「RNA鎖」とは、RNA塩基またはそれらの等価物が2個以上連結した形態のことを表す。「塩基配列」とは、ポリヌクレオチドを構成するヌクレオチドまたはその等価物の配列である。一般的に塩基配列は、A(アデニン)、G(グアニン)、C(シトシン)、T(チミン)によって表すことができる。また、TとU(ウラシル)は、用途に合わせて互いに読み替えることが可能である。例えば、代表的なデータベースであるNCBI Reference Sequenceにおいて、DNA鎖およびRNA鎖の塩基配列を表すときにA、G、C、Tが用いられている。なお、ポリヌクレオチドはDNA/RNA合成装置を用いて合成可能である。その他、DNA塩基またはRNA塩基合成の受託会社(例えば、インビトロジェン社やタカラバイオ社等)から購入することもできる。また、siRNA、miRNA、shRNA、pre−miRNA、またはそれらをコードするベクターの合成も各メーカーに委託することができる。
【0092】
そのようなsiRNA等のデザインには、Stealth RNAi designer(Invitrogen)やsiDirect 2.0(Naito et al., BMC Bioinformatics. 2009 Nov 30;10:392.)等を使用できる。RNAi作用またはmiRNA作用の確認は、リアルタイムRT−PCRによるRNA鎖発現量の定量によって行なうことができる。または、ノザンブロットによるRNA鎖発現量の解析や、ウェスタンブロットによる蛋白量の解析・表現型の観察等の方法でも行うことができる。特にリアルタイムRT−PCRによる方法が効率的である。
【0093】
本明細書において「相補鎖」とは、一つのポルヌクレオチドに対して、ハイブリダイズすることが可能な相補性の高い他のポリヌクレオチドである。本明細書において「ハイブリダイズ」とは、複数のポリヌクレオチド間において、塩基間の水素結合等によって塩基対ができる性質のことを表す。塩基対はワトソン・クリック型塩基対、フーグスティーン型塩基対、または任意の他の配列特異的な形で生じうる。2つの1本鎖がハイブリダイズした状態は2本鎖と呼ばれる。また「相補的」とは、例えば一つのポリヌクレオチドに対して、AにはT、GにはCが対応する形で、他のポリヌクレオチドがハイブリダイズすることが可能な形態を含む。
【0094】
本明細書において「治療」とは、被験者の疾患または疾患に伴う1つ以上の症状の、予防または症状改善効果を発揮しうることをいう。
【0095】
本明細書において「被験者」とは、ヒトもしくはその他哺乳動物(例えば、マウス、ラット、ウサギ、ウシ、サル、チンパンジー、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)を含む。好ましくは、マウス、ラット、サル、チンパンジー、またはヒトであり、特に好ましくはヒトである。なぜならば、ヒトであればヒトの疾患の治療や、ヒト用の治療薬または診断薬の開発等に、上記の1または複数本鎖のポリヌクレオチドを利用できるためである。また、マウス、ラット、サル、およびチンパンジーは、世界中で研究用のモデル動物として汎用され多くの特性が明らかになっているため、これらの生物に対して、上記の1または複数本鎖のポリヌクレオチドの薬効薬理を調査することで、より優れた治療薬等の開発のために特に有用な情報が得られる。
【0096】
また、上記の1または複数本鎖のポリヌクレオチドを治療薬または予防薬として使用する場合、単独で投与することも可能ではあるが、通常はDDSまたは薬理学的に許容される1つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野においてよく知られる任意の方法により製造した医薬製剤として提供するのが好ましい。また、上記の1または複数本鎖のポリヌクレオチドを直接使用せずに、上記の1または複数本鎖のポリヌクレオチドの前駆体を投与することも可能である。
【0097】
また、上記の1または複数本鎖のポリヌクレオチドを生体に投与する際の投与経路は、治療に際して最も効果的なものを使用するのが好ましく、経口投与または口腔内、気道内、直腸内、皮下、筋肉内、腹腔内、眼内または静脈内などの非経口投与をあげることができ、全身または局部的に投与することができる。投与経路は、好ましくは非経口投与あげることができる。後述する実施例のように、皮下または静脈内投与であっても良い。この場合、1または複数本鎖のポリヌクレオチドが患部へ到達する効率が高い。
【0098】
その他の投与形態としては、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、注射剤、座剤、噴霧剤、軟膏、テープ剤などがあげられる。経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤などがあげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖などの糖類、ポリエチレングリコール、プロピレングリコールなどのグリコール類、ゴマ油、オリーブ油、大豆油などの油類、p−ヒドロキシ安息香酸エステル類などの防腐剤、ストロベリーフレーバー、ペパーミントなどのフレーバー類などを添加剤として用いて製造できる。さらに、カプセル剤、錠剤、散剤、顆粒剤などは、乳糖、ブドウ糖、ショ糖、マンニトールなどの賦形剤、デンプン、アルギン酸ナトリウムなどの崩壊剤、ステアリン酸マグネシウム、タルクなどの滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチンなどの結合剤、脂肪酸エステルなどの界面活性剤、グリセリンなどの可塑剤などを添加剤として用いて製造できる。
【0099】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤などがあげられる。注射用の水溶液としては、例えば生理食塩水、ブドウ糖やその他の補助薬を含む等張液、例えばD−ソルビトール、D−マンノース、D−マンニトール、塩化ナトリウムが挙げられ、適当な溶解補助剤、例えばアルコール、具体的にはエタノール、ポリアルコール、例えばプロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤、例えばポリソルベート80(TM)、HCO−50と併用してもよい。座剤はカカオ脂、水素化脂肪またはカルボン酸などの担体を用いて調製することができる。また、噴霧剤は上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤、ないしは受容者の口腔および気道粘膜を刺激せず、かつ上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤を微細な粒子として分散させ吸収を容易にさせる担体、などを用いて調製することができる。この担体としては具体的には乳糖、グリセリンなどが例示できる。上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤と、用いる担体の性質により、エアロゾル、ドライパウダーなどの製剤化が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0100】
また、上記の治療薬または予防薬は、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調製された注射液は通常、適当なアンプルに充填される。このようにして得られる製剤は安全で低毒性であるので、例えば、ヒトや哺乳動物(例えば、ラット、マウス、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して投与することができる。
【0101】
また、投与方法は被験者の年齢、症状、対象臓器等により適宜選択することができる。上記の1または複数本鎖のポリヌクレオチドを含有するいずれかの薬剤を含有する医薬組成物の投与量としては、例えば、一回につき体重1kgあたり0.0001mgから1000mgの範囲で選ぶことが可能である。あるいは、例えば、被験者あたり0.001〜100000mg/bodyの範囲で投与量を選ぶことができるが、これらの数値に必ずしも制限されるものではない。体重1kgあたりの投与量は、例えば0.0001、0.01、1、50、100、250、500、または1000mgである。この投与量は、ここで例示したいずれか2つの値の範囲内であってもよい。投与量は目的とする治療効果、投与方法、治療期間、年齢、体重などにより異なる。投与量、投与方法は、被験者の体重や年齢、症状などにより変動するが、当業者であれば適宜選択することが可能である。また、適切な化学療法薬と併用で投与してもよい。
【0102】
上記の1または複数本鎖のポリヌクレオチドは、悪性細胞の抑制等の効果を通して、畜産において動物の成育を補助するための添加剤などにも使用できる。
【0103】
また本発明の他の実施形態は、上記の1または複数本鎖のポリヌクレオチドを含む、試薬またはキットである。この試薬またはキットは、上記の1または複数本鎖のポリヌクレオチドの有する効果を通して、研究用の試薬もしくはキット、または医療用のキットとして使用できる。たとえば、iPS細胞作成用、人工臓器作成用、悪性腫瘍細胞抑制用、未分化マーカー発現調節用、またはp53発現細胞作成用の添加物、補助物質として使用できる。また、キットには上記の1または複数本鎖のポリヌクレオチドを用いる際の使用方法もしくは使用例を記載した指示書、その指示書の所在を記載した文面、または種々のバッファーを含んでいてもよい。
なお、本発明の一実施形態は、以下の(1)〜(33)のいずれかの実施形態を含んでいてもよい。
(1)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(2)
前記1本鎖または2本鎖のポリヌクレオチドが、miRNA作用を有する、(1)に記載の多能性幹細胞誘導剤。
(3)
前記1本鎖または2本鎖のポリヌクレオチドが、small RNAである、(1)に記載の多能性幹細胞誘導剤。
(4)
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖または2本鎖のRNA鎖である、(1)に記載の多能性幹細胞誘導剤。
(5)
前記1本鎖または2本鎖のポリヌクレオチドが、15以上のヌクレオチドからなる、(1)に記載の多能性幹細胞誘導剤。
(6)
前記1本鎖または2本鎖のポリヌクレオチドが、100以下のヌクレオチドからなる、(5)に記載の多能性幹細胞誘導剤。
(7)
前記1本鎖のポリヌクレオチドがshRNAまたはpre−miRNAであり、前記2本鎖のポリヌクレオチドがsiRNAまたはmiRNAである、(1)に記載の多能性幹細胞誘導剤。
(8)
前記shRNAまたはpre−miRNAが35〜100ヌクレオチドからなり、前記siRNAまたはmiRNAのガイド鎖が15〜40ヌクレオチドからなる、(7)に記載の多能性幹細胞誘導剤。
(9)
前記shRNA、前記pre−miRNA、前記siRNA、および前記miRNAが、1〜5ヌクレオチドからなるオーバーハングを含む、(7)に記載の多能性幹細胞誘導剤。
(10)
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号42の塩基配列、またはその塩基配列に対して1〜5個の塩基が欠失、置換もしくは付加された塩基配列を含む、(1)に記載の多能性幹細胞誘導剤。
(11)
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号41の塩基配列からなるポリヌクレオチドの相補鎖を含む、(1)に記載の多能性幹細胞誘導剤。
(12)
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖のポリヌクレオチドであり、且つpre−miRNAである、(1)に記載の多能性幹細胞誘導剤。
(13)
前記1本鎖のポリヌクレオチドが、配列番号43の塩基配列、またはその塩基配列に対して1〜4個の塩基が欠失、置換もしくは付加された塩基配列を含む、(12)に記載の多能性幹細胞誘導剤。
(14)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含むsmall RNAを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(15)
a)配列番号43の塩基配列、
b)配列番号43の塩基配列に対して、80%以上の相同性を有する塩基配列、
c)配列番号43の塩基配列において1もしくは数個の塩基が欠失、置換もしくは付加された塩基配列、
d)配列番号43の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含むポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(16)
体細胞を多能性幹細胞へ誘導する、(1)に記載の多能性幹細胞誘導剤。
(17)
悪性腫瘍細胞を多能性幹細胞へ誘導する、(1)に記載の多能性幹細胞誘導剤。
(18)
前記悪性腫瘍が、肝臓癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、(17)に記載の多能性幹細胞誘導剤。
(19)
前記多能性幹細胞が、内在性のp53を発現している、(1)に記載の多能性幹細胞誘導剤。
(20)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤。
(21)
(20)に記載の未分化細胞マーカー発現調節剤であって、前記未分化細胞マーカーが、Klf4、c−Myc、Oct4、Sox2、PROM1からなる群から選ばれる1種以上の未分化細胞マーカーである、未分化細胞マーカー発現調節剤。
(22)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、多能性幹細胞におけるp53の発現量を促進する、多能性幹細胞のp53発現促進剤。
(23)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法。
(24)
(23)に記載の生産方法で得られる、多能性幹細胞。
(25)
HPS0002:253G1株に比べて内在性のp53の発現量が増大している、(24)に記載の多能性幹細胞。
(26)
フィーダー細胞の非存在下で培養可能である、(25)に記載の多能性幹細胞。
(27)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有する、悪性腫瘍の治療薬。
(28)
(27)に記載の悪性腫瘍の治療薬であって、前記悪性腫瘍が、肝臓癌、肺癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、悪性腫瘍の治療薬。
(29)
前記悪性腫瘍が肉腫である、(27)に記載の悪性腫瘍の治療薬。
(30)
配列番号41の塩基配列に相補的な塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列をコードするポリヌクレオチドを含む、ベクター。
(31)
(30)に記載のベクターを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
(32)
(30)に記載のベクターを含む、悪性腫瘍の治療薬。
(33)
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列を含むポリヌクレオチドを含む、
多能性幹細胞誘導用、未分化細胞マーカー発現調節用、多能性幹細胞のp53発現促進用、または悪性腫瘍の治療用のキット。
【0104】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【実施例】
【0105】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0106】
<実施例1:RGM249 shRNAのマウスへの投与と、抗癌作用の評価>
(1−1)RGM249 shRNAの作成
Stealth RNAi designer(Invitrogen, CA, USA)によってRGM249 shRNAの配列をデザインし、BLOCK-it Inducible H1 RNAi Entry Vector (Invitrogen, CA, USA)を用いてRGM249 shRNAを生成するベクター(RGM249 shRNAプラスミド)を作成した。このRGM249 shRNAは、生体内においてRGM249 mRNAに対するRNAiを誘導するように設計されたsmall RNAである。
【0107】
ここで、RGM249 mRNAの塩基配列は、5'-GGAAAACUAAAAUGAGAGAAUGGGUGUCCAAGAGGACAAGUUCAUGCUCACCCGGUGAUGAGAGUUUGAUUGCAGAAUAAGGCUAGACAAAGGGAAGCUGAACAUGACCAAAGCCAUGUGACAUCGUAUGAUCCUCGAAUCUCACAGUAUCUAUGUAUCUAUAAUCAGAUACAUCCCUAGACUUUCCAGGAAUUCUGGUACUUCACGAGGAUGUGAGAAGACUCUGAACAAAAUAAUACACUGCUCGUG-3'(配列番号7)である。RGM249 shRNAプラスミド内のトップストランドにおいて、RGM249 shRNAをコードする配列は、5'-CACCGCAGAATAAGGCTAGACAAAGCGAACTTTGTCTAGCCTTATTCTGC-3'(配列番号11)である。ボトムストランドにおいて、上記トップストランドと2重鎖を形成している配列は、5'-AAAAGCAGAATAAGGCTAGACAAAGTTCGCTTTGTCTAGCCTTATTCTGC-3'(配列番号12)である。図1AにRGM249 mRNAの2次構造と、RGM249 shRNAのターゲット部位を示す。
【0108】
RGM249 shRNAの塩基配列は、5'-GCAGAAUAAGGCUAGACAAAGUUCGCUUUGUCUAGCCUUAUUCUGCGGUG-3'(配列番号10)である。プラスミドから転写後はヘアピン様構造を形成すると考えられる(図1B)。図中の下線部は、水素結合を形成可能な部分である。RGM249 shRNAの塩基配列において、RGM249 mRNAの一部に相補的な配列は、5'-CUUUGUCUAGCCUUAUUCUGC-3'(配列番号8)である。この配列番号8に相当する部分は、RGM249 shRNAの塩基配列中の5'-GCAGAAUAAGGCUAGACAAAG-3'(配列番号9)と水素結合を形成し、へアピン様構造を形成すると考えられる。RGM249 shRNAによってRNAiを誘導する際には、この配列番号8に相当する部分がRGM249 mRNAに対してハイブリダイズすると考えられる。UUCGはループ部分に相当する。GGUGはオーバーハングしていると考えられる。
【0109】
また、RGM249 shRNAのチミンの一つが欠損したRGM249m−1 shRNAを発現するベクター(RGM249m−1 shRNAプラスミド)を作成した。RGM249m−1 shRNAプラスミド内のトップストランドにおいて、RGM249m−1 shRNAをコードする配列は、5'-CACCGCAGAATAAGGCTAGACAAAGCGAACTTTGTCAGCCTTATTCTGC-3'(配列番号13)である。ボトムストランドにおいて、上記トップストランドと2重鎖を形成している配列は、5'-AAAAGCAGAATAAGGCTGACAAAGTTCGCTTTGTCTAGCCTTATTCTGC-3'(配列番号14)である。コントロールにはLacZ shRNAを使用した。
【0110】
RGM249m−1 shRNAの塩基配列は、5'-GCAGAAUAAGGCUGACAAAGUUCGCUUUGUCUAGCCUUAUUCUGCGGUG-3'(配列番号15)である。配列番号15の塩基配列が配列番号10の塩基配列と異なるのは、配列番号10の5末端から14番目のAが欠失している点である。RGM249 mRNAに一部に相補的な配列は、上記RGM249 shRNAの場合と同じである。
【0111】
(1−2)RGM249 shRNAの腫瘍抑制効果
胸腺欠損マウスの右側腹に、HLF細胞を皮下注射によって播種した。またそのマウスの右側腹に、5日毎にRGM249 shRNAプラスミド+DDS、RGM249m−1 shRNAプラスミド+DDS、またはLacZ shRNAプラスミド+DDSを皮下注射した。この皮下注射は、DDS1mg当たり数μg〜数十μgの生理活性物質を混ぜ、マウス20〜30gに対して行った。このときの腫瘍ボリュームの変化を調査した(図1C)。その結果、投与から21日後、LacZ shRNAグループと比較してRGM249 shRNAグループによる有意な腫瘍抑制効果が見られた。なお、DDS(Drug Delivery System)としてはカチオン化ゼラチンハイドロゲル(MedGel社製)を使用した。プラスミドとDDSは、メーカーのプロトコールに従い各100nMで混合した。グラフには標準誤差を示してある。データ(n=5)はマン・ホイットニーテストによって分析した(P<0.01)。また、最初の投与から4週間後、RGM249 shRNAグループは、RGM249−m1 shRNAグループとLacZ shRNAグループに比較して、有意に腫瘍抑制効果を示した(P=0.034、P=0.021)。
【0112】
図1Dの3つの写真は、上記それぞれのプラスミドを皮下注射した際の、腫瘍ボリュームの目視的な観察結果である。皮下注射から約28日後に、RGM249 shRNAグループは平均で80%の抑制効果を示していた。また、RGM249m−1 shRNAグループは平均で50%未満に腫瘍ボリュームを抑制していた。
【0113】
(1−3)RGM249 shRNA投与によるmRNA発現の抑制効果
(1−3−1)皮下投与
また皮下注射から35日後に、腫瘍で発現している遺伝子の発現抑制効果を調査した(図2A)。細胞からmirVana miRNA Isolation kitを用いてmiRNAを抽出した後、Mir-XTM miRNA qRT-PCR SYBR(R) Kitを用いてmiRNAの発現量を調べた。その結果、RGM249 shRNAプラスミド+DDS、またはRGM249m−1 shRNAプラスミド+DDSを投与した場合において、RGM249 mRNAおよびhTERT mRNAの発現レベルが、LacZ shRNAと比較して有意に低下していた(RGM249 mRNAとhTERTmRNAのP値は、それぞれP=0.036、P=0.025)。これらのデータはマン・ホイットニーテストによって分析した。クローズドの四角はRGM249の発現を示し、オープンの四角はhTERT mRNAの発現を示す。
【0114】
(1−3−2)尾静脈投与
一方で、上記のそれぞれのプラスミドを尾静脈へ静脈注射した場合において、28日後に腫瘍で発現している遺伝子の発現抑制効果を調査した(図2B)。DDSには、アテロコラーゲン(AteloGeneTM)(Jo, J., Yamamoto et al., J Nanosci Nanotechnol 6, 2853-2859 (2006).、Takeshita et al., Mol Ther 18, 181-187 (2010).)を用いた。プラスミドとDDSは、メーカーのプロトコールに従い各100μMで混合した。その結果、RGM249 shRNAプラスミド+DDSを投与した場合において、RGM249 mRNAおよびhTERT mRNAの発現レベルが、LacZ shRNAと比較して有意に低下していた。これらのデータはマン・ホイットニーテストによって分析した(P<0.05)。クローズドの四角はRGM249の発現を示し、オープンの四角はhTERT mRNAの発現を示す。以上のように、RGM249 shRNAグループにおけるRGM249 mRNAとhTERT mRNAの発現は、LacZ shRNAグループと比較して、両方とも有意に抑制された(それぞれP=0.049、0.046)。
【0115】
(1−4)RGM249 shRNA投与による癌転移抑制効果
また静脈注射から28日後に、肝臓の内外の結節を目視的に観察した。HLF細胞のみのグループ(data not shown)と、LacZ shRNAグループにおいて癌結節が目視的に見られた。また、顕微鏡でみた場合、全てのマウスの肝臓または肺に転移性の病巣が、1匹のマウスで左腎への転移が見られた。
【0116】
目視的に観察した結果、RGM249 shRNAグループでは、1匹のマウスでのみ肝臓に結節の存在が確認された(表1)。また、1匹のマウスでのみ腎臓に結節を有していることが確認された。この結果は、RGM249 shRNAグループが他のグループと比較して腫瘍形成と転移を抑制したことを表す。即ち、RGM249 shRNAグループは静脈注射で与えたときに腹腔内の発癌を抑制した。また、注入されたヒト由来の腫瘍を、ヒト特異的なRGM249 mRNAを標的として治療したことを意味する。
【0117】
【表1】

【0118】
以上の結果より、RGM249 mRNAをRNAi作用によって分解すると、癌抑制と腫瘍減少、hTERT mRNAの減少、および癌の転移抑制に効果があることが示された。このことから、RGM249 mRNAが、癌になんらかのメカニズムを経て影響していると考えられた。またRGM249m−1 shRNAは、RGM249 shRNAに比べて若干効果は劣るが、癌の抑制効果を奏する等、RGM249 shRNAと類似の効果を有していた。次に、RGM249 mRNAから生成されるmiRNAと、そのmiRNAに対するsiRNAによる癌への影響を調べた。
【0119】
<実施例2:3つのsiRNAによる癌細胞増殖抑制と、未分化マーカーへの影響の評価>
(2−1)miR−47 siRNA、miR−101 siRNA、miR−197 siRNAのコンストラクト
RGM249を、pRNAT-U6.1/neoベクター(GenScript USA社、ニュージャージー、米国)に連結した。T7 RNAポリメラーゼにより生成されたRGM249 mRNAを、Dicer酵素(Genlantis社、カリフォルニア、米国)を使用して消化した。miRNAを、mirVANA miRNA単離キット(日本Ambion社、東京、日本)により分画し、 ヒト抗Ago2ビーズを用いたmiRNA単離キット(和光純薬工業株式会社、東京、日本)を用いて精製した。また、小RNAがAgo2に結合しない可能性があるため抗Ago2を用いずにも精製した。消化したsmall RNAsを、miRCAT-microRNAクローニングキット(Integrated DNA Technologies社、アイオワ、米国)を使用してクローニングし、TOPOベクター(Invitrogen社、カリフォルニア、米国)を使用してシークエンシングした。そして、二次構造を予測した(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)。small RNAsの配列相同性を、miRBasを使用して検討した。以上の結果、miR−47、miR−101、miR−197の3つのmiRNAが得られた。miRNA前駆遺伝子であるRGM249 mRNAと、内部の3つのmiRNAに相当する部位を図3Aに示す。
【0120】
miR−47の塩基配列は5'-CUCACCCGGUGAUGAGAGUUUGAUU-3'(配列番号16)、miR−101の塩基配列は5'-AACAUGACCAAAGCCAUGUG-3'(配列番号17)、miR−197の塩基配列は5'-GUACUUCACGAGGAUGUG-3'(配列番号18)である。
【0121】
上記3つのmiRNAに対するsiRNAを生成するコンストラクト(shRNA)を作成する場合、pRNATin-H1.4/Lentiを使用した。また、3つのsiRNA(miR−47 siRNA、miR−101 siRNA、miR−197 siRNA)をInvitrogen社のsiRNA designerを用いて合成した。各siRNAの推定2次構造を図3Bに示す。miR−47 siRNAの塩基配列はセンス鎖が5'-CUCACCCGGUGAUGAGAGUUUGA-3'(配列番号4)、アンチセンス鎖が5'-AAUCAAACUCUCACCGGGUGAG-3' (配列番号1)である。miR−101 siRNAの塩基配列はセンス鎖が5'-AACAUGACCAAAGCCCAUGUGUU-3'(配列番号19)、アンチセンス鎖が5'-CACAUGGCUUUGGUCAUGUU-3' (配列番号2)である。miR−101 siRNAのセンス鎖は、3'末端においてチミンが2塩基突出している。この2塩基を除いた配列は、5'-AACAUGACCAAAGCCCAUGUG-3'(配列番号5)である。miR−197 siRNAの塩基配列はセンス鎖が5'-GUACUUCACGAGGAUGUGUU-3'(配列番号20)、アンチセンス鎖が5'-CACAUCCUCGUGAAGUAC-3'(配列番号3)である。miR−197 siRNAのセンス鎖は、3'末端においてチミンが2塩基突出している。この2塩基を除いた配列は、5'−GUACUUCACGAGGAUGUG−3'(配列番号6)である。また、3つのmiRNAと、3つのsiRNAのアンチセンス鎖との配列比較を図3Cに示す。
【0122】
(2−2)細胞増殖の抑制効果
miR−47 siRNA、miR−101 siRNA、miR−197 siRNA、またはそれらの混合物(3siRNA混合物)各50nMを高レベルのRGM249を発現するHMV−Iへトランスフェクションした。トランスフェクションにはFuGeneキット(Roche社製)を使用した。トランスフェクションから24時間経過後の形質転換体を収集した。
【0123】
細胞数を測定した結果、DDSで処理したコントロール細胞と比較して、それぞれのsiRNAを単独で使用した場合に、若干の癌細胞増殖の抑制効果がみられた(図3D)。さらには、3siRNA混合物をトランスフェクションした場合、癌細胞増殖の顕著な抑制効果がみられた。これは、3つのsiRNAが相乗的に働いたためと考えられる。一方で、siRNAを2つ組み合わせて使用した場合には、同等の効果は見られなかった。このことは、2つでは相乗効果が生じにくく、むしろ1つ当たりの濃度が低くなったことが癌細胞増殖の抑制効果を弱めたと考えられる。
【0124】
この結果から、3つのmiRNAを阻害すると、癌細胞の増殖抑制効果があることが強く示唆された。この結果は実施例1とも矛盾なく、RGM249 mRNAが3つのmiRNAに分解され、その3つのmiRNAが癌に関与するメカニズムが、生体内で働いていると考えられる。上記の3つのsiRNAはこのメカニズムを遮断することで、癌細胞の増殖抑制効果を発揮したと考えられる。
【0125】
(2−3)siRNAによるmiRNA発現レベルの変化
上記(2−2)において3siRNA混合物を同時にトランスフェクションしたHMV−IからRNA抽出を行い、miR−47、miR−101、miR−197の発現レベルを調査した(図3E)。
【0126】
(2−4)siRNAによる未分化マーカー量の変化
形質転換体の転写発現プロファイリングを、癌(hTERT、c−Myc、p53)、多分化能(Oct4、Sox2、Klf4)、幹細胞性(PROM1)に関連する遺伝子について評価した(図3F)。3siRNA混合物を使用した場合、Oct4、Sox2、hTERT、p53遺伝子は3siRNA混合物による処理に伴いアップレギュレイトし、c−MycとKlf4遺伝子はダウンレギュレイトした。一方でPROM1への影響は見られなかった。またmiR−47 siRNAは、Oct3/4およびhTERT遺伝子をアップレギュレイトし、c−MycおよびKlf4遺伝子をダウンレギュレイトした。図3D中の*は、mRNAの発現をβ−actin mRNAと比較した時に有意差があることを示す。
【0127】
以上の結果、miR−47 siRNAの使用によって未分化マーカー(Oct3/4)の発現がアップレギュレイトしたことから、HMV−Iは未分化状態に変換したか、少なくとも未分化状態に誘導されたと考えられる。また、癌遺伝子であるc−Mycがダウンレギュレイトしたことから、未分化状態に誘導された細胞は癌化が抑制された状態にあると考えられる。
【0128】
さらには、3siRNA混合物を使用した場合には、2つの未分化マーカー(Oct3/4、Sox2)の発現がアップレギュレイトした。c−MycはmiR−47 siRNAを使用した場合と同様に、ダウンレギュレイトした。また、癌抑制遺伝子であるp53がアップレギュレイトした。即ち、未分化状態に誘導された細胞は、c−Mycおよびp53の両面から癌化が抑制された状態にあると考えられる。
【0129】
以上の結果から、3つのmiRNAは、癌と、分化のメカニズムに関与していることが示唆された。また、3つのsiRNAは癌抑制と、癌細胞のリプログラミングの機能を有していることが示唆された。次に、siRNAをマウスに投与することで、癌抑制と癌細胞のリプログラミングについてさらに詳しく調査した。
【0130】
<実施例3:3siRNA混合物のマウスへの投与と、抗癌作用の評価>
(3−1)siRNAの皮下投与
3siRNA混合物+DDSの皮下投与は、DDSのみのコントロール投与に比べて、HMV−I細胞の増殖性の抑制を示した(Kruskal-WallisテストにおいてP<0.01、n=5)(図4)。この試験には胸腺欠損マウスを用いた。DDSはアテロコラーゲン(AteloGeneTM)を用いた。3siRNA混合物とDDSは、メーカーのプロトコールに従い各100μMで混合した。図4中の上部に示した写真は、RNAを含まないアテロコラーゲン(mock)を皮下注射したときの写真である。下部に示した写真は、3siRNA混合物+DDSを皮下注射したときの写真である。*はRNAを含まないものとsiRNAを含むものの間に有意差(P<0.01)があることを示す。また、コントロールマウスは肺(15.8±1.9 結節)と腹腔内(0.8±0.6 結節)に複数の結節を示した(表2)。いくつかの転移性の病巣が腹腔内および腹腔外で観察され、皮下浸潤も観察された。
【0131】
【表2】

【0132】
(3−2)siRNAの静脈投与
胸腺欠損マウスにHLF細胞を投与した後1週間後から、3siRNA混合物+DDSを毎週静脈注射した。マウス当たりに1×107細胞を含む200 μlをインジェクションした。DDSはアテロコラーゲン(AteloGeneTM)を使用した。3siRNA混合物とDDSは、メーカーのプロトコールに従い各100μMで混合した。28日後にその動物を屠殺し、肝内腫瘍と腹腔内転移の試験を行なった(表3)。この結果、3siRNA混合物+DDSの静脈投与は、HMV−1細胞の抗転移能を有意に誘導した(P<0.05、肺と肝臓それぞれ)。肝臓と肺では転移がほとんど見られず、1匹のマウスのみで腹腔内への転移が見られた。
【0133】
【表3】

【0134】
以上の結果、3siRNA混合物をマウスに投与することで、癌の増殖と、転移を有意に抑制できることが示された。
【0135】
<実施例4:3siRNA混合物のマウスへの投与と、未分化マーカーの発現レベルの評価>
(4−1)腫瘍におけるmiRNAとmRNAの発現レベルの評価方法
siRNAで処理した腫瘍を用いてmiR−47、miR−101、miR−197の発現レベルの評価を以下の通り行った。miRNAの発現量は、細胞または組織からmirVana miRNA Isolation kit を用いてmiRNAを抽出した後、Mir-XTM miRNA qRT-PCR SYBR(R) Kit を用いて調べた。これにより、siRNAによるmiRNAの発現抑制効果、およびmiRNAの発現量の変化を確認した。
【0136】
mRNAを定量化するために用いたプライマーセットの配列を表4に示す。ウエスタンブロット法はi−Blotゲル転写システムを用いて行った。抗体(抗hTERT抗体、抗p53抗体、抗c−Myc抗体、抗Oct4抗体、抗PROM1抗体)は1:500倍に希釈し、抗βアクチン抗体は1:1000倍に希釈した。LAS-4000を使用して、化学発光シグナルを1分以内に検出した。
【0137】
【表4】

【0138】
(4−1−1)皮下投与
皮下による異種移植によって、3つのmiRNAの抑制効果を実証した。前記異種移植は、1 × 107個のHMV-I細胞を右側腹へ接種することにより確立した。触知できる腫瘍は播種から7日後に確認できた。10匹のマウスをランダムに2グループに分け、3siRNA混合物(100 μM)(n=5)、または等量のDDS(n=5)を投与した。3siRNA混合物をトランスフェクションした細胞は、in vitroで増殖が抑制された。5週間後、腫瘍を分析するためにマウスを屠殺した。腫瘍ボリュームはボリューム = π/6×横幅×縦幅×高さの式によって評価した。
【0139】
(4−1−2)尾静脈投与
siRNA混合物(400 μM)またはDDSで処理する1週間前に、HMV−I細胞(1×107 細胞)を胸腺欠損マウスの尾静脈にインジェクションした。siRNA混合物またはDDSは毎週投与し、腫瘍ボリュームまたは転移を5週間後に調査した。全てのマウスはJapanese Association for Accreditation for Laboratory Animal Care-approved facilitiesで保管および飼育した。動物実験および取り扱いはfederal Institutional Animal Care and Use Committee guidelinesを厳格に遵守した。
【0140】
図5Aに示すように腫瘍のあるパーツ毎に分けて評価した。1は表面、2は内部、3は中央部分である。なお腫瘍はもろいため、わけ方はおおよそのものである。
【0141】
(4−2)腫瘍におけるmiRNAの発現レベルの評価結果
腫瘍内のRNAの定量化、および高い再現性のシークエンシングを行ない、3siRNA混合物による、miR−47、miR−101、miR−197それぞれの発現抑制効果を評価した結果を図5Bに示す。データはクラスカル・ワーリステスト(n=5)を用いて分析した。*はDDS処理した腫瘍に対してmiRNA発現レベルに有意差(P<0.01)があることを示す。3つのmiRNAはの量は、3siRNA混合物を投与することによって減少する傾向が見られた。
【0142】
(4−3)ヘマトキシリン・エオシン染色
上記(4−1−2)で得られた腫瘍について、顕微鏡による調査結果(HE(ヘマトキシリン・エオシン染色); ×400)を図5Cに示す。上部はコントロールを、下部はsiRNAで処理した腫瘍を示す。siRNAで処理した腫瘍はHMV−I細胞で減少し、フィブロシスによる置き換わりに伴って腫瘍は壊死し、新血管新生は抑制された。
【0143】
(4−4)腫瘍における未分化マーカーの発現レベルの評価結果
上記(4−1−2)で得られた腫瘍について、腫瘍、分化、多能性の関連遺伝子の転写レベルを試験した結果を図5Dに示す(*: P<0.05, **: P<0.01)。Oct4、Klf4、p53、hTERT、PROM1、Sox2は多能性、腫瘍形成、または癌幹細胞性に関与すると考えられる。2−△△法を用いてβ−actin mRNAの発現を比較した。図5D中においてCntlはコントロール(DDSのみ)を表し、3 mixは3siRNA混合物+DDSを表す。この結果、3siRNA混合物はp53およびSox2のmRNAの上昇を誘導した。一方で、hTERT、PROM1、Oct3/4、Klf4は減少した。
【0144】
以上の結果、3siRNA混合物をマウスに投与することで、3つのmiRNAはダウンレギュレイトし、未分化マーカーであるSox2と、癌抑制遺伝子であるp53はアップレギュレイトすることが示された。次に、免疫組織科学的試験を利用して、癌細胞のリプログラミングについてさらに詳細に調査した。
【0145】
<実施例5:癌細胞のリプログラミングと、iPS細胞の評価>
(5−1)miRNA−197の抑制と、hsa−mir−520dのアップレギュレーションの評価
FuGeneキット(Roche社製)を用いて、miR−197 siRNAを293FT細胞にトランスフェクションした後、顕微鏡で観察した(図6A)。また、ウイルスベクター(pMIRNA1、System Bioscience:SBI社製)を用いて、hsa−mir−520d(Accession:MI0003164)をヒトの線維芽細胞細胞(TIG−1−20)に感染させた後、顕微鏡で観察した。このhsa−mir−520dは、RGM249 shRNAをトランスフェクションすることによってアップレギュレイトされるmiRNAである(A noncoding RNA gene on chromosome 10p15.3 may function upstream of hTERT. Miura et al., BMC Mol Biol. 2009 Feb 2;10:5.)。上記ウイルスベクターから発現するhsa−mir−520dの塩基配列は5'-UCUCAAGCUGUGAGUCUACAAAGGGAAGCCCUUUCUGUUGUCUAAAAGAAAAGAAAGUGCUUCUCUUUGGUGGGUUACGGUUUGAGA-3'(配列番号43)である。その推定2次構造を図6Bに示す。この配列において、ガイド鎖に相当する配列は5'-UCUACAAAGGGAAGCCCUUUCUG-3'(配列番号41)、パッセンジャー鎖に相当する配列は5'-AAAGUGCUUCUCUUUGGUGGGU-3'(配列番号42)である。
【0146】
miR−197 siRNAとhsa−mir−520dの発現量は、各RNA鎖とともに発現しているGFPプロテインを検出することで評価した。図6Aの上部はmiR−197 siRNAで処理した細胞の写真である(拡大率: ×40)。円形細胞が培地に出現した後、ES細胞のための培地(ReproCELL社)に移して観察した。下部は、hsa−mir−520dで処理した細胞の写真である(拡大率: ×100)。以上により、miR−197 siRNAとhsa−mir−520dの発現が確認された。こうして、miRNA−197の抑制またはhsa−mir−520dのアップレギュレーションを行った。
【0147】
(5−2)miR−197 siRNA投与後の未分化マーカーの発現量の評価
miR−197 siRNAをトランスフェクションした293FT細胞(ヒト胎児腎臓由来細胞株)を、顕微鏡で免疫組織化学的に観察した結果を図6Cに示す。図6Cは未分化マーカーであるOct4とNANOGを検出している。上部(0hr)の3つは、トランスフェクションしていない293FT細胞を顕微鏡(拡大率: ×40)で観察した写真である。左の列は身染色、真ん中の列は抗Oct4抗体によるローダミン染色、右の列は抗NANOG抗体によるローダミン染色を施した結果である。細胞の染色は各1週間行った。
【0148】
真ん中(24hr)の3つは、未分化状態の細胞をmiR−197 siRNAで誘導してから24時間後に、顕微鏡で免疫組織化学的に観察した写真である。下部(48hr)の3つは、48時間後に、同様に顕微鏡で免疫組織化学的に観察した写真である。その結果、Oct4(真ん中の列、拡大率: ×100)とNANOG(右の列、拡大率: ×200)が強く発現していた。
【0149】
以上の結果、miR−197 siRNAで処理した293FT細胞は、Oct4またはNANOGを発現したことから、リプログラミングされ、iPS細胞化したと考えられる。またその効率も良く、106細胞から20〜100程度のiPS細胞が作成できた。この293FT細胞は、一般的にES細胞やiPS細胞にみられる細胞形状を有していた。また、培地中で7日後も未分化状態を維持していた。iPS細胞化した293FT細胞は、ES細胞用培養液で培養できるが、一般培養用の培養液でも十分培養可能であった。フィーダー細胞は不要であり、培養面のコーティングはコラーゲンでもマトリゲルでもよかった。
【0150】
(5−3)hsa−mir−520d投与後の未分化マーカーの発現量の評価
hsa−mir−520dを各種癌細胞にウイルスベクター(pMIRNA1、System Bioscience:SBI社製)で感染させ、強制発現させた。その後、上述の免疫組織科学的試験と同様の方法で未分化マーカーの発現量を観察した。その結果を図6D、図6E、図6Fに示す。使用した癌細胞は、HT1080細胞(ヒト線維肉腫細胞株)、T98G細胞(ヒトグリオーマ細胞株)、PK−45p細胞(ヒト膵臓癌由来細胞株)、HMV−I細胞(ヒト悪性黒色腫由来細胞株)、HLF細胞(ヒト肝癌由来細胞株)である。またHMV−I細胞、およびHLF細胞においては、未分化マーカーであるOct4またはNANOGを発現していた。
【0151】
以上の結果、hsa−mir−520dで処理した癌細胞は、リプログラミングされ、iPS細胞化したと考えられる。なおこのhsa−mir−520dを強制発現させた癌細胞は、一般的にES細胞やiPS細胞にみられる細胞形状を有していた。
【0152】
(5−4)生成したiPS細胞の各種遺伝子発現量の評価、およびhiPSCとの比較
上記ようにして生成したiPS細胞における各種遺伝子の転写量を図7Aに示す。miR−197 siRNAで処理した293FT細胞、およびhsa−mir−520dが過剰発現した293FT細胞における各種遺伝子の転写量は同じであった。図7Aは、その2つの細胞の転写量を、hiPSC(HPS0002 253G1)('Generation of mouse-induced pluripotent stem cells with plasmid vectors.' Okita et al., Nat Protoc 5, 418-428 (2010).)の発現量に対して比較した結果である。転写レベルはワンステップリアルタイムRT−qPCRで調査した。図中、hiPSCの発現量を0として表している。上部は、293FT細胞用の培地において293FT細胞にトランスフェクションまたは感染させてから48時間後の転写量である。下部は、その後2週間、ES細胞のための培地で維持したときの転写量である。
【0153】
トランスフェクションまたは感染させてから48時間後、Oct4、p53、RGM249 mRNAは、hiPSCに比べてハイレベルで発現していた。その後2週間、ES細胞のための培地で維持後は、RGM249 mRNAのみハイレベルで発現していた。他の遺伝子は、2週間後hiPSCとほとんど同レベルの発現量であった。
【0154】
hiPSCと293FT細胞におけるmiRNA−197とhsa−mir−520dの、miRNA発現レベルの関連性をツーステップリアルタイムRT−qPCR (n=5)で評価した結果を図7Bに示す。左のパネルはhsa−mir−520dの発現量を示す。左から、hiPSC、hsa−mir−520dを過剰発現している293FT細胞、miR−197 siRNAで処理した293FT細胞、293FT細胞である。また右のパネルはmiRNA−197の発現量を示す。これにより形質転換体におけるmiRNA−197サイレンシングとmir−520d過剰発現を確認した。
【0155】
左のパネルから、生成したiPS細胞のhsa−mir−520dの発現量はhiPSCと類似していることがわかる。一方で、293FT細胞においてはhsa−mir−520dの発現量は有意にダウンレギュレイトしていることがわかる。右のパネルからは、生成したiPS細胞はmiRNA−197をhiPSCと同じくらい弱く発現していることがわかる。一方で、293FT細胞においてはmiRNA−197を他の細胞と比較して10倍多く発現していた。
【0156】
<実施例6:>hsa-mir-520dに関する実験方法と結果
(6−1)細胞
in vitroとin vivoにおけるhsa-mir-520d発現の効果を評価するために、複数種類の細胞株とレンチウイルスベクターとを使用した。ヒトメサンギウム細胞株である293FTは、日本Invitrogen社(東京、日本)から提供され、10%FBS、0.1mM MEM非必須アミノ酸溶液、2mM L-グルタミン、および1%ペニシリン/ストレプトマイシンを添加したダルベッコ改変イーグル培地中で培養した。強力なRGM249発現を有するヒト未成熟または未分化肝細胞株(HLF)とRGM249の弱い発現を有する高分化肝癌細胞株(Huh7)を、アメリカ培養細胞系統保存機関(American Type Culture Collection)から購入し、10%FBSおよび1%ペニシリン/ストレプトマイシンを添加したRPMI培地中で培養した。ウイルス処理により形質転換した細胞の未分化状態を維持するため、5ng/mlのbFGF-2を有するReproStem培地(ReproCell社、東京、日本)中で、細胞を培養した。ヒト誘導多能性幹細胞(HPS0001、HPS0002)は、理研バイオリソースセンターの細胞バンク(Riken Bioresource Center Cell Bank)から提供された。
【0157】
(6−2)レンチウイルスベクター作製、及びトランスフェクション
pMIRNA1-mir-520d/GFP(20μg)(System Biosciences社、Mountain View、米国)とモック(mock)ベクターとしてのpCDH(20μg)とを各々、(10cm培養プレートあたり5 × 106細胞の)293FT細胞へトランスフェクトした。 上清中のウイルス粒子を回収するために、4℃、120分間、170000 × gで遠心後、ウイルスペレットを回収し、Lenti-XTM(商標)qRT-PCR滴定キット(Clontech社、カリフォルニア、米国)を使用して力価測定を行った。293FTまたはHLF細胞へのレンチウイルス感染のために、10cm培養プレート当たり100万個のウイルスを使用した。ポジティブコントロールとして使用したRGM249miRNA-197 siRNAを、ステルスRNAiデザイナー(Stealth RNAi designer)(https://rnaidesigner.invitrogen.com/rnaiexpress/)を用いて設計し、FuGENE HDトランスフェクション試薬(Roche Diagnostics社、バーゼル、スイス)を用いて、50nMの合成オリゴヌクレオチドを、293FT細胞へトランスフェクトした。また、520d-HLF細胞が骨芽細胞へと分化誘導することを確認するために、通常のRPMI1640培地中に2Mのpurmorphamineを添加して、その細胞を一週間処理した。
【0158】
(6−3)免疫不全マウスとin vivo試験方法
レンチウイルス感染後のHLFを回収し、1マウス当たり5 × 107個のHLF細胞を、各々のマウスの腹腔内および皮下(右側腹)へ接種した。注入体積は、200μlであった。6週齢の免疫不全マウス(KSN/Slc)(清水実験材料株式会社、京都、日本)を、4週間通常給餌した。KSN/Slcマウスを、100 mg/kgのネンブタールを腹腔内注射することにより麻酔し、解剖および組織学的検査のために屠殺した。皮下への異種移植を使用して、hsa-mir-520dの抑制効果を実証した。体積評価は、以下の式を使用して決定した:体積 = π/6 × 幅 × 長さ × 高さ。全ての動物は、日本実験動物管理公認協会承認施設で保管および飼育した。動物の研究と取り扱いについては国際動物実験委員会のガイドラインを厳格に遵守した。
【0159】
(6−4)RT-PCR
small RNA分画を含んだトータルRNAを、培養細胞またはホモジェナイズしたマウス組織から、mirVana miRNA分離キット(Ambion社、オースチン、米国)を使用して抽出した。Mir-X(商標)miRNA qRT-PCR SYBR(登録商標)キット(Clontech社、Mountain View、米国)を製造元のマニュアル(Clontech)に従って使用することにより、成熟型miRNAsの定量を実施した。U6 small nuclear RNAをインターナルコントロールとして使用した。トータルRNA(50ng/μl)を、OneStep RT-PCRキット(日本QIAGEN社、東京、日本)を用いて逆転写および増幅した。PCR解析とデータ収集解析とは、LineGene(東洋紡、名古屋、日本)を使用して実施した。サンプルの発現レベルを、検量線方法(2-ΔΔ法)を使用して決定した。全てのデータ(hTERTのものを除く)を、インターナルコントロールであるβ-アクチンに対して標準化した。hTERTの推定は、本発明者が以前開発した定量方法に従って、コピー数により行った。そのRNA定量を、シークエンシングによって、高い再現性をもって確認した。miRNA(25ng/μl)を、Mir-X miRNA qRT-PCR SYBRキット(タカラバイオ(株)、東京、日本)を使用して定量した。siRNAによる抑制を確認するために、miRNA発現変化を評価した。mRNAまたはmiRNA定量用のプライマー配列を、表4に示す。有意差を、*: P<0.05、**: P<0.01として示した。
【0160】
(6−5)ウエスタンブロット
20μg/μlのタンパク質とi-Blotゲル転写システムとを用いてウエスタンブロット解析した。製造元のマニュアルに従って、抗β-アクチン抗体以外の抗体(抗hTERT抗体、抗p53抗体、抗Oct4抗体、抗DICER1抗体、抗AID抗体、抗Alb抗体、および抗GFAP抗体)を1:500倍に希釈し、抗β-アクチン抗体を1:1,000倍に希釈した。LAS-4000(富士フイルム、東京、日本)を使用して、化学発光シグナルを1分以内に検出した。
【0161】
(6−6)免疫細胞化学
製造元(R&D Systems社、ミネアポリス、米国)のマニュアルに従って、多能性幹細胞マーカー(抗Oct3/4抗体および抗NANOG抗体)ならびに胚性幹細胞マーカー抗体パネル(Embryonic Stem Cell Marker Antibody Panel)を用いて、免疫組織化学的検査を実施した。293FT細胞およびHLF細胞に、miRNA-197に対するsiRNAもしくはhas-mir-520dを含むレンチウイルス粒子をトランスフェクトまたは感染させた。浮遊するトランスフェクタント(つまり、トランスフェクトされた細胞)を回収し、顕微鏡観察用の新しい培養プレートまたは免疫染色用スライドチャンバーに移した。Huh7においても、293FTとHLFと同一の処理を、免疫細胞化学検査のために行った。
【0162】
(6−7)免疫組織化学
免疫組織化学解析のために、4%パラフォルムアルデヒド中で固定された肝臓組織標本を、常法により処理した。この試験で用いられたモノクローナル抗体は、以下のものである:抗アルブミン抗体(Sigma社、セントルイス、米国)、抗AFP抗体(Sigma社)、および抗GFAP抗体(Sigma社)。ネガティブコントロールとしては、一次抗体を省略して染色工程を実行した。発現の程度は、病理専門家が評価した。
【0163】
(6−8)細胞周期解析
細胞周期解析を実行するために、単一細胞懸濁物を、冷却したPBSで一度洗浄した。細胞ペレットを、その後、穏やかにチューブを振とうすることによりほぐして、ddH2O中の3.7%ホルマリンを滴下して固定した。細胞を、少なくとも一晩、-20℃でインキュベートした。固定後、細胞を冷却したPBSを用いて二回洗浄してEtOHを除去した。その後、細胞を、100U/mlのRNaseA含有PBS中に、1 × 106細胞/mlにて再懸濁し、37℃で50分間インキュベートした。50μg/mlのヨウ化プロピジウムを直接加えて、光を遮蔽して氷上において40分間インキュベートした。DNA含量を、EXPO32 ADC解析ソフトウエアを搭載したフローサイトメーター(EPICS ALTRA; Beckman Coulter社)により解析した。DNA含量は、pMIRNA1-mir-520d/GFPクローンをトランスフェクト後に、約20000イベントで評価した。GFP陽性細胞を、Moflo XDPセルソーター(EPICS ALTRA、Beckman Coulter社)により分取(ソート)した。
【0164】
(6−9)組織学的検査
腫瘍体積、ならびに肺、肝臓、腹腔内、および後腹膜腔への転移がんを、明視野イメージング機能を備えた解剖顕微鏡下または肉眼で検査および計測した。組織サンプルは、10%緩衝ホルマリン溶液中で一晩固定し、PBSで洗浄し、70%エタノールへ移した。その後、パラフィンに包埋し、薄切し、ヘマトキシリン・エオシンを用いて染色した。
【0165】
(6−10)細胞における蛍光検出
レンチウイルスmir-520d発現ベクターによる感染効率を評価するために、緑色蛍光発現を検出した。
【0166】
(6−11)統計解析
一観察変数を有し、P<0.05を有意なものと見なすMann-Whitney Uテストを用いて、3つの群(コントロール群、モック(mock)群、およびmir-520d群)間で比較した。*: P<0.05、**: P<0.01である。
【0167】
(6−12)結果
(6−12−1)293FT細胞へのhas-mir-520dのウイルス感染によるin vitro試験
表現系の変化を、顕微鏡的に評価した。図8Aは、293FT細胞へのhas-mir-520dのウイルス導入後に出現した浮遊細胞集団を示す。GFP陽性浮遊細胞(図8A(a))を、ES細胞用のフィーダー細胞不含有培地中で培養し、GFP発現を有するトランスフェクタントの増殖過程をタイムラプスモードで観察した(図8A(c))。has-mir-520dがウイルス感染した293FT細胞は、24時間以内にシート状の層を形成した。幹性化転換を、免疫細胞化学(図8B)に基づき確認した。GFP陽性細胞は、抗Oct4抗体により強く染色された。3日から1週間後、細胞はより大きなコロニーに生育し、NANOG陽性状態を維持していた(図8C)。トランスフェクタントの遺伝子発現を、RT-PCR、Western blot、および定量的miRNA RT-PCRにより評価した。
【0168】
ヒト誘導多能性幹細胞(hiPSCs)またはRGM249 miRNA197 siRNAによるトランスフェクタントと比較すると、has-mir-520dが過剰発現した293FT(520d-293FT)は、p53とRGM249とを強力に転写的にアップレギュレートし、Oct4とhTERTとをより弱く発現した。293FTと比較すると、p53、RGM249、およびOct4は、より強くアップレギュレートされるが、hTERTは、同じレベルで発現されていた(図9A)。ヒト誘導多能性幹細胞(hiPSCs)と比較すると、浮遊状態にある520d-293FTでは、p53とOct4とがより強く転写的にアップレギュレートされていた。hTERTは、同等に発現されていた。293FT (0日目)と比較すると、p53とOct4とは、より強くアップレギュレートされていたが、hTERTは同じレベルで発現されていた(図9B)。Dicer1はアップレギュレートされていて、そのことは、520dが成熟する過程にDicer1が必要なことを示唆した。さらに、520d-293FTにてhas-mir-520dの過剰発現と、およびRGM249 miRNA-197 siRNAによるトランスフェクタント中におけるRGM249 miRNA-197の抑制とを確認後では、RGM249 miRNA-197発現はhiPSC中でのものと同等であった。2種類のオリゴヌクレオチドを用いて処理することにより、hiPSCレベルのmiRNA発現を有する細胞へと、293FT細胞を有意に誘導した(図9C)。has-mir-520dの過剰発現は、RGM249 miRNA-197のダウンレギュレーションを生じた(図9D)。has-mir-520dのウイルス感染後、293FTは、培地中の接着性細胞もしくは浮遊性細胞のいずれか中で、mir-520dを安定的に発現した。ウイルス感染効率は、GFP陽性細胞ソーティングを用いて決定したところ、99.2%以上であった(データは示されない)。このことは、これらが、in vivo用に適応できる材料であることも示唆している。細胞周期解析によると、293FTおよびモックウイルス感染293FT(mock-293FT)と比較して、520d-293FTは、G0期が増加し、S期が減少していた(図10A)。520d-293FT細胞中のエピジェネティックマーカー(HDAC:ヒストン脱アセチル化酵素、Sin3A、およびMBD3:メチル-CpG結合ドメインタンパク質3) は、mock-293FTと比較した場合、高レベルで有意に維持されていた(P<0.01)。しかし、DNMT 1(DNA(シトシン-5-)-メチルトランスフェラーゼ)は、293FTまたはmock-293FT中でのものと同程度であった(図10B)。
【0169】
(6−12−2)HLF細胞へのhas-mir-520dウイルス感染によるin vitro試験
has-mir-520d発現ベクターを受容したHLF細胞(以下「520d-HLF」と称することもある)を、10cmプレート当たり20〜50個の新規細胞集団へと転換した。図11A(左上図)に形態学的変化を示す。これらの細胞は、GFP(右上)および多能性マーカー(右下)を発現していた。その中で、Oct4およびNANOGは、転写的にアップレギュレートされていた。対照的に、RGM249、CD44、Alb、およびp53は、有意にダウンレギュレートされていた(**: P<0.01;図11B)。浸潤アッセイにおいては、多能性マーカー陽性細胞のほとんどは、フィブロネクチン膜(6穴プレート当たり5μg/ml)を通過して移動することはできなかった。対照的に、mock-HLF細胞は、容易に移動することができた(図11C)。ウエスタンブロットは、Oct4およびp53のアップレギュレーションを示した。has-mir-520d発現HLF(520d-HLF)細胞中で、DICER1が抑制されていた(図11D)。mock-HLF細胞と比較した場合、520d-HLF細胞では、メチル化マーカー(HDAC、Sin3A、およびMBD3)が有意に低いレベルで維持されていた(P<0.01) (図11B)。細胞周期解析によると、mock-HLFと比較して、520d-HLF細胞はS期が増加し、G0期が減少していたことを示した(図12A)。mir-520dを安定的に発現する10クローンのHLF細胞を、ES用培地で一ヶ月間に渡り培養した後には、HLFのものと比べて、520d-HLF細胞中でのhTERTおよびアルブミン(Alb)はダウンレギュレートされていた。520d-HLF細胞中での、Oct4およびp53はアップレギュレートされていた。がん幹細胞マーカー(PROM1:CD133)は、HLF、hiPSC、520d-HLF細胞間では有意差はなかった(図12B)。CD44発現は有意に減少していた(P<0.01) (データは示されない)。さらにまた、mir-520dによるHuh7細胞(高分化肝癌細胞株)における多能性誘導を検証した。小さく丸い細胞集団におけるOct4およびNANOG発現は、モックベクターによる誘導と比較して、より上昇していた。また、2μMのpurmorphamine添加により、ALP、SPP1、およびIBSPのアップレギュレーションを有する骨芽細胞へと、520d-HLF細胞を誘導した。
【0170】
図13はHLF細胞の場合の初期化レベルを検討するためのグラフである。293FT細胞と共通しているのは、AID, DNMT1の発現レベルのみであり、293FTではHDAC, Sin3A, MBD3が有意に発現を高めるのに対し、HLFではそれらの発現が有意に低下した。
【0171】
(6−12−3)has-mir-520dウイルスが感染したHLF細胞によるin vivo試験
has-mir-520dのレンチウイルス発現ベクターまたはモックベクターにより、HLF細胞を感染したのち、その細胞(5 × 107細胞)を、免疫不全マウス(KSN/Slc)の腹腔内間隙へ注射した。has-mir-520dを発現したHLF細胞を注入したマウス群の75%は、腹腔内または注射針の刺入部分に沿って腫瘍を形成した(図14A)。対照的に、100%のモック感染群は、白色結節(HE染色(×40)にて組織学的に未分化肝癌細胞)を、腹腔内または肝臓に形成した(図14B)。12.5%(1/8)のマウス群中の520d-HLF細胞は、(肝細胞索、中心静脈、胆管(右図;白矢印)を有し、部分的に腺腫様過形成を内部に有する(図14D)(右から2番目の図))正常肝組織へと転換した(図14C、下図:HE染色組織標本)。37.5%(3/8)のHLF細胞は、表皮を有する類皮嚢胞と、汗腺(左図;白矢印)(図14A、図14D、および図14C上図;HE染色組織標本)とおよび皮脂腺(左から2番目;白矢印)とからなる奇形腫に形質転換した。生成した奇形腫と肝組織は、GFPタンパク質を発現していた(図14E)(左図:HEおよび右図:GFP)。肝組織中のほとんど全ての肝細胞がヒトアルブミンを強く発現しているのを免疫組織化学染色により確認した。肝星細胞(HSC)/筋線維芽細胞(MFs)のマーカーである、グリア線維性酸性タンパク質(GFAP)およびアルファフェトプロテイン(AFP)は、弱く発現していた。このことは、一ヶ月間に、520d-HLF細胞が未成熟肝組織へと分化したことを示唆する。50%(4/8)は、全く腫瘍および特定組織を形成しなかった。
【0172】
(6−12−4)has-mir-520dウイルスが感染したHLF細胞の分化
また、免疫組織化学的分析により、未分化な肝臓組織のマーカーを用いて肝組織を構成する肝細胞、胆管、静脈、星細胞などの存在を確認できた(図15)。骨分化誘導によりOsteopontin, sialoprotein陽性の骨芽細胞を得たことから、内・中・外胚葉へ分化できる間葉系幹細胞(MSC)に形質転換できた。(図16)。
【0173】
(6−12−5)has-mir-520dウイルスが感染した各種悪性腫瘍細胞の評価
図17は高分化型肝癌(Huh7)細胞について評価した結果である。肝癌細胞においては分化度に関わらず、同等に多能性マーカー強陽性に変化させることができた。図18は多形性膠芽腫(T98G)細胞について評価した結果である。未分化脳腫瘍においても幹性誘導し、in vivoで腫瘍を形成せずに正常組織に生着した。図19は膵癌(PK−9)細胞について評価した結果である。膵癌においても幹性誘導が見られた。図20は線維肉腫(HT1080)細胞について評価した結果である。非上皮性悪性腫瘍である肉腫細胞(HT1080)をも幹性誘導し、脂肪細胞へ分化させることができた。
【0174】
<実施例7: hsa-mir-192 siRNA等に関する実験方法と結果>
(7−1)細胞
HMV-I(ヒト悪性黒色腫)
T98G(ヒト神経膠芽腫)
HT1080(ヒト線維芽肉腫)
Pk-45(ヒト肝臓癌)
【0175】
(7−2)検討したmiRNA
【表5】

【0176】
(7−3)shRNA
表5のmiRNAに対するshRNA(hsa-mir-192 shRNA、hsa-mir-196a-1 shRNA、hsa-mir-423-3p shRNA、has-mir-222 shRNA)をコードするベクターは、GenScript corp.,(NJ, USA)から購入した。このベクターは、pRNATin-H1.4/Lenti (GenScript, corp.,)に上記shRNAをコードする塩基配列が組込まれたものである(以下、「siRNA生成ウイルス)と証することもある)。細胞に導入後、shRNAを発現し、さらにsiRNAを生成することができる。
【0177】
(7−4)siRNA
表5のmiRNAに対するsiRNA(hsa-mir-192 siRNA、hsa-mir-196a-1 siRNA、hsa-mir-423-3p siRNA、has-mir-222 siRNA)は、Stealth RNAi designer(Invitrogen社)によって入手した。配列を表6に示す。これらsiRNAが細胞増殖抑制等の効果を有していることを確認した後、上記(7−3)のshRNAでさらに細胞増殖抑制等の効果がみられるかどうかを検証するという流れで実験を行った。
【表6】

【0178】
なお、hsa-mir-192 siRNA、hsa-mir-196a-1 siRNA、hsa-mir-423-3p siRNA、has-mir-222 siRNA(hsa-mir-192 siRNA等)のアンチセンス鎖において、表5のmiRNAの配列に対して、相補的な関係にある部分の配列を表7に示す。この相補的な部分が、RNAi又はmiRNAの作用において特に重要な部分と考えられる。また、さらにその部分に相補的なセンス鎖の配列を併せて示す。
【0179】
【表7】

【0180】
(7−5)細胞へのレンチウイルスのinfection
細胞へのinfectionは、まず、293FTまたは293H細胞へレンチウイルスベクター(pRNATin-H1.4/Lenti)をtransfectionし、上清を回収し、遺伝子実験施設にある超遠心機で、27,000rpm、2時間遠心してウイルスを回収し、ペレットをPBSに溶解し、力価を検討後、−80度で保存した。そのウイルスを用いて、力価に基づき、各50μlずつ細胞に感染させた。また、3種類のsiRNA ( has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA) 共感染または4種類のsiRNA (hsa-mir-192 siRNA / has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA)共感染では、1種類のウイルス粒子が有効に作用する力価で感染させた。
【0181】
(7−6)RNAの抽出
mirVana(tm) miRNA Isolation Kit ( Ambion , TX , USA )を使用してmiRNA , totalRNAを抽出した。washした細胞にTorizol Reagent( Life Technologies Carlabad , CA , USA )を添加し、3分間インキュベート後Torizol Reagentの1/5量のchloroform( ニッポンジーン , Tokyo , Japan )を添加した。15秒間振盪後、14,000rpmで15分間遠心を行った。得られた上清の1/10量の100%エタノールを加え、数回転倒混和しspin columnに入れ、10,000g で15秒遠心した。カラムをwashするためmiRNA Wash Solution 1を700μl加え、10,000g で15秒遠心した。更にWash Solution 2/3を500μl加え、同様に遠心した。この作業を2回繰り返し、あらかじめ、95度に温めておいたRNase , DNase Free Waterを100μl加え、同様に遠心、そして、この過程を2回繰り返した。その後、真空濃縮を40分間し、そのうち2μlを使用し、NanoDrop( バイオメディカルサイエンス, Tokyo, Japan )を用いて濃度を測定した。
【0182】
(7−7)real time RT-PCR
RGM249 , hTERT , Sox2 , p53 , c-Myc , Oct4 , PROM1の7種類の発現を調べるためにQIAGEN OneStep RT-PCR Kit ( Qiagen , Tokyo , Japan )を使用した。GAPDH , β-actinをコントロールとした。検討した遺伝子は多能性関連マーカー、未分化マーカー及び分化マーカー、テロメレース関連遺伝子を使用した。
【0183】
(7−8)蛋白質抽出
PBS(-)でwashした細胞をtrypsin処理した後、エッペンドルフチューブに回収し、蛋白分解酵素阻害剤 Complete, Mini ( Roche Japan , Tokyo , Japan ) を含むCell Lysis Buffer ( SIGMA , Tokyo , Japan ) 22μlを加え、たんぱく質抽出液を得た。そのうちの2μlをNanoDropを用いて濃度測定に使用した。
【0184】
(7−9)Western Blot解析
iBlotTM ドライブロッティングシステム( Invitorogen , Tokyo , Japan )を使用し、電気泳動したゲルをセミドライ状態でメンブレンに転写した。その後WesternBreeze(r)イムノディテクションキット( Invitorogen , Tokyo , Japan )を使用し、ブロッキング30分、リンス5分×2、一次抗体60分、wash 5分×4、二次抗体30分、wash 5分×4、リンス2分×2を行った。そして、ケミルミネッセンス2.5mlをメンブレンに添加し5分後、遺伝子実験施設のLas-1000plus (FUJIFILM , Kanagawa , Japan ) で検出した。
【0185】
(7−10)cell cycle 解析
1×106個の細胞をwashした後、trypsin処理し15mlチューブに回収した。その後、95%エタノールを5ml加え、オーバーナイトで固定した。翌日1μg/mlのRNaseを1ml加え、1時間37度でインキュベートした後、PIを5μl加え、30分以上4度、遮光で遺伝子実験施設のEPICS ALTRA ( Beckman coulter , Tokyo Japan ) で解析を行った。
【0186】
(7−11)MTT assay
PBS ( - )で washした細胞をtrypsin処理した後、96wallプレートに1×106個の細胞を100μlずつ蒔いた。Promega社のCellTiter96(R) Non-Radioactive Cell Proliferation Assay kitを使用して細胞増殖能を検討した。
【0187】
(7−12)colony formation assay
soft agerを使用して、形質転換を起こした細胞の足場依存性及び腫瘍形成能を検討した。60mmディッシュにボトムアガロース( 0.5-0.6% )を2-3ml入れ、ある固形化した後、トップアガロース( 0.4% )で重層した。そして、そのディッシュに細胞を播き、1-2週間培養し、その後、細胞をカウントした。
【0188】
(7−13)miRNA の定量
Takara ( Tokyo , Japan ) 社のmir-x miRNA定量kitを用いて定量した。指定されたプロトコールに準じて施行した。
【0189】
(7−14)ゲノムへのウイルスベクターの取り込み検討
感染効率はレンチウイルスベクターの情報に準じて評価した。感染をGFP発現に関して蛍光顕微鏡で可視化して判定し、neomycinの導入、miRNAの導入を感染細胞の一部よりDNAまたはRNAを抽出し、PCRで増幅後、電気泳動で可視化して評価した。ゲノムへの取り込み部位の検討は施行しなかった。
【0190】
(7−15)実験結果
(7−15−1)siRNA生成Lentivirus感染後のHMV-1におけるMTT assay
各siRNA生成ウイルスを感染させたHMV-1でのMTT assayを3日間施行した(図21)。3種類のsiRNA ( has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA) 共感染または4種類のsiRNA (hsa-mir-192 siRNA / has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA)共感染細胞で有意に増殖抑制を確認した。統計学的有意差を* ( p<0.05 ) で示した ( Mann-Whitney test ) 。
【0191】
(7−15−2)siRNA生成Lentivirus感染2週間後でのHMV-1の蛍光顕微鏡写真と増殖曲線
各siRNA生成ウイルス感染による導入はmiRNA発現を阻害した。また、細胞の増殖抑制を示す経時的変化を示した(図22)。図中のトップパネルは、1週間後のmockとhsa-mir-196a-1 / hsa-mir-423-3p / hsa-mir-222でのGFP検出のための蛍光顕微鏡写真である。図中のボトムパネルは、ウイルス感染後の HMV-1の増殖曲線である。コントロール、mock、hsa-mir-192、hsa-mir-196a-1 siRNA、hsa-mir-222 siRNAと比較して、3種類のsiRNA ( has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA) 共感染または4種類のsiRNA (hsa-mir-192 siRNA / has-mir-196a-1 siRNA / has-mir-423-3p siRNA / has-mir-222 siRNA)共感染で顕著な増殖抑制を観察し、感染細胞は3週間以内にアポトーシスに至った。
【0192】
(7−15−3)HMV-1のsiRNA生成レンチウイルス感染における colony formation assay
miRNAに対するsiRNAを生成するウイルスベクターに感染させ、siRNAが導入されたHMV-1において、腫瘍形成能を評価するためにsoft agerを用いて、colony formation assayを行った(図23)。コントロールではコロニーを多数形成しているのに対し、hsa-mir-192単独導入、4種類 (has-mir-192 / -196a-1 / -423-3p / -222 ) のmiRNAの共発現で、顕著にコロニー形成能が抑制された。hsa-mir-192に対するsiRNAでは途中までコロニー形成を認めたが、その後、増殖は止まり、そのまま細胞の断片化を起こしてアポトーシスに至った。また、4 種類 (has-mir-192 / -196a-1 / -423-3p / -222)の共感染ではコロニーを形成することはなかった。
【0193】
以上の実施例における各種材料および操作方法は、特に記載のない限り、以下の通り行なった。
・アンタゴマーの合成
アンタゴマー(miRNAを標的としたsmall RNA)のデザインと合成はInvitrogen社(Stealth RNAi designer (https://rnaidesigner.invitrogen.com/rnaiexpress/))とGenScript社へ委託した(pRNATin-H1.4/Lenti, pRNAT-T6.1/neo)。shRNA−generatingベクターはBLOCK-it Inducible H1 RNAi Entry Vector (Invitrogen, CA, USA)を用いて、プロトコールに沿って作成した。
【0194】
・セルライン
HLF細胞ラインとHMV−I細胞ラインはAmerican Type Culture CollectionとTohoku Universityからそれぞれ購入し、10% FBSと1% ペニシリン/ストレプトマイシンを添加したRPMI培地で培養した。アンタゴマー処理の場合、HMV−1細胞を50 nMのantagomirとともにインキュベーションした。
【0195】
・RNAi
FuGene HD transfection Reagent (Roche Diagnostic GmbH)を使用して、HLFまたはHMV−I細胞に、50 nM siRNA、コントロールのオリゴヌクレオチド、または空のベクターをトランスフェクションした。ダイサー(Dicer enzyme)はGenlantisから購入し、プロトコールに沿って使用した。3つのmiRNAは、ダイサーで消化したものをmiRCAT-microRNA cloning kit (Integrated DNA Technologies)でクローニングすることによって得た。免疫不全マウスは、Charles riverからCAnN Cg-Foxn1 BALB/c-nuを、SHIMIZU Laboratory Supplies Co., Ltd.からKSN/Slcを購入した。
【0196】
・RNAの単離とmiRNAの定量
トータルRNA、small RNAフラクションは、培養細胞またはホモジナイズしたマウス組織から、mirVana miRNA Isolation Kit (Ambion)を用いて抽出した。miRNAの成熟化の定量は、Mir-XTM miRNA qRT-PCR SYBR(R) kit (Takara Bio Company)を用いて説明書に従って行った。U6 small nuclear RNAをインターナルコントロールとして使用した。
【0197】
・mRNAのリアルタイムPCR
トータルRNAは、OneStep RT-PCR kit (QIAGEN)を用いて逆転写及び増幅させた。PCRとデータ収集分析はLineGene (TOYOBO)を用いて行った。サンプルの発現レベルは、検量線方法(2-ΔΔ法)を使用して決定した。全てのデータ(hTERTおよびRGM249のものを除く)を、インターナルコントロールであるβ-アクチンに対して標準化した。hTERTおよびRGM249の推定は、本発明者が以前開発した定量方法に従って、コピー数により行った。mRNAに関しては50ng/μlで、small RNAに関しては100ng/μlで試験した。
【0198】
・免疫ブロッティング
ウエスタンブロット解析をi-Blotゲル転写システム(Invitrogen社)を使用して実行した。目的バイオマーカー遺伝子に対するそれぞれの抗体を、製造元のマニュアルに従った希釈率を用いて使用した。20μgの細胞抽出物を試験した。
【0199】
・腫瘍形成および転移に関する実験
取大学動物実験委員会で承認されたプロトコルに基づいて、動物実験を実施した。腫瘍細胞接種、検死、および組織学的解析を、実験方法セクションに記載したように実施した。播種から7日後、ショートサイレンスオリゴヌクレオチドによる処理を、マウスの尾静脈または右側腹の皮下に、siRNAまたはshRNA (100μM)を週一回のペースで4〜5週にわたって行なった。腫瘍を摘出して計量した。腫瘍体積、ならびに肺、肝臓、腹腔内、および腹腔外(postperitoneal)転移がんを、明視野イメージング機能を備えた解剖顕微鏡下または肉眼で検査および計測した。組織サンプルは、10%緩衝ホルマリン溶液中で一晩固定し、PBSで洗浄し、70%エタノールへ移した。その後、パラフィンに包埋し、薄切し、ヘマトキシリン・エオシンを用いて染色した。転移プロセスの後期ステージにおけるantagomirの効果を評価するために、胸腺欠損マウスの尾静脈を介するかまたは皮下に腫瘍細胞を移植した。次に、腫瘍細胞移植7日後に、同所性の実験に使用したと同一の用量と頻度でantagomir治療を開始した。静脈内投与の場合は全身性転移によって、または、皮下接種の場合は肝臓転移もしくは腹腔内転移によって、マウスは30日目には瀕死の状態になり、安楽死させた。
【0200】
・毒性の評価
胸腺欠損マウスを、1グループにつき5匹に分けて、PBS+DDSまたは50 μMのアンタゴマーを、週一回のペースで4〜5週間にわたって6回、静脈投与した。体重は2週に1回のペースで測定した。マウスは最後の投与後6日で安楽死させ、組織を収集した。全血の一定分量をEDTAで処理したチューブに集めた。遠心分離により血球細胞を除去して、血漿を得た。サンプルを、オリンパス社製Bioanalyzerを使用して解析し、血液の生化学的値を測定した。全ての可能な病理状態に関して、肺または肝臓の切片を検査した。
【0201】
・ヒト正常細胞への誘導
miRNA−47、−101、−197に対するsiRNAをトランスフェクションすることにより、293FT細胞はヒト正常細胞へと誘導された。その後、RT−PCRとウエスタンブロット法を用いて関連遺伝子の発現の変化を評価した。
【0202】
・免疫組織化学試験
製造元(R&D Systems、ミネアポリス、米国)のマニュアルに従って、未分化マーカー(抗Oct-4抗体)ならびに胚性幹細胞マーカー抗体パネル(Embryonic Stem Cell Marker Antibody Panel)を用いて、免疫組織化学検査を実施した。細胞に、miRNA-197に対するsiRNAをトランスフェクトまたは感染した。浮遊するトランスフェクタントを回収し、顕微鏡観察用の新しい培養プレートまたは免疫染色用スライドチャンバーに移した。
【0203】
・hiPSC(Human-induced pluripotent stem cells)
ヒト人工多能性幹細胞であるhiPSC(HPS0002 253G1)はRiken Bioresource Center Cell Bank('Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts.' Nakagawa M et al., Nat Biotechnol 26, 101-106 (2008))から提供された。
【0204】
・培養条件
miR−197 siRNAまたはhsa−mir−520dを導入して作成した多能性幹細胞は、ES細胞用培養液で培養できるが、F-12 HAM[DMEM(15mM HEPES+1mM Sodium Pyruvate+pyridoxine+NaHCO3+5mML-glutamine)], RPMI-1640+L-glutamine, DMEM+high glucose+L-glutamine+0.1mM NEAA およびREPROSTEM(REPROCell社):bFGF 3-10ng/mlからなる群から選ばれる1種以上の培地で37℃、5%CO2、10%FBSの条件で培養可能であった。
【0205】
・フローサイトメトリー
miRNA-197に対応するsiRNAをトランスフェクトした293FT細胞を使用して、トリプシンにより分離脱着した細胞上で、フローサイトメトリーを実行した。単一細胞懸濁物を、冷却したPBSで一度洗浄した。細胞ペレットを、その後、穏やかにチューブを振とうすることによりほぐして、ddH2O中の冷却70%EtOHを滴下して固定した。細胞を、少なくとも一晩、-20℃でインキュベートした。固定後、細胞を冷却したPBSを用いて二回洗浄してEtOHを除去した。その後、細胞を、100U/mlのRNAaseA含有PBS中に、1 × 106細胞/mlにて再懸濁し、37℃で50分間インキュベートした。50μg/mlのヨウ化プロピジウムを直接加えて、光を遮蔽して氷上において40分間インキュベートした。DNA含量を、フローサイトメーター(EPICS ALTRA; Beckman Coulter社)により解析した。リプログラムされた細胞の発現を評価するために、EXPO32 ADC解析ソフトウエアを搭載したフローサイトメーターにより、siRNA-197をトランスフェクション後、約20000イベントで、iPS細胞を評価した。GFP発現細胞もしくはPE陽性細胞のフローサイトメトリーを用いた精製に関しては、ウイルストランスダクション過程の完了24時間後に、(未分化状態を維持して2週間培養後の)293FT細胞またはHLF細胞を、5%FCSを添加したリン酸緩衝液(PBS)中に再懸濁した。PE抱合抗アルカリホスファターゼ(ALP)抗体で、細胞を染色後、GFP陽性細胞またはPE陽性細胞を、Moflo XDP(Beckman Coulter社、カリフォルニア、米国)を使用して分取および解析した。1×108細胞を、アルゴンレーザー(488nm、100mW)を用いて、フォワードスキャッター、サイドスキャッター、ならびにPEおよびGFP蛍光に関して解析した。検出器としては、各々、GFPに関してはFL1を、PEに関してはFL2を使用した。
【0206】
・頭蓋内注入方法
免疫不全マウスをペントバルビタールナトリウム(50mg/kg、腹腔内注射)を用いて麻酔し、定位固定装置中に配置した。外科手術中、動物の体温を、加熱パッドを使用して、37℃に維持した。頭蓋を露出し、左線条体の上に、小規模な開頭を作製した。ポリエチレンの管を介して10μlのハミルトンシリンジに連結された30Gの注射針を、細胞移植用に使用した。注射針を、左線条体に定位的に挿入(ブレグマからA(前方) 0.5mm、L(側方) 2.0mm、D(深さ) 2.5mm)し、5μlの細胞懸濁物(108細胞/μl)を圧力注射した。注射後、その注射針をゆっくりと引き抜いて、頭蓋の孔を、歯科用セメントを用いて被覆した。切開部を、6-0プロレン(Prolene)を用いて縫合した。外科手術から回復後、動物を元の飼育ケージへと戻した。
【0207】
<結果の考察>
以上の結果を踏まえて考察する。実施例の結果、RGM249 shRNAは悪性腫瘍の増殖抑制、悪性腫瘍の転移抑制、細胞内RGM249 mRNA量の抑制、または細胞内hTERT mRNA量の抑制の効果を有していることが示された。また、3つのsiRNAは、悪性腫瘍の増殖抑制、悪性腫瘍の転移抑制、細胞内の3つのmiRNA量の抑制、未分化マーカーのアップレギュレイト、p53のアップレギュレイト、または正常細胞もしくは悪性腫瘍細胞のリプログラミングの効果を有していることが示された。hsa−mir−520dは、未分化マーカーのアップレギュレイト、p53のアップレギュレイト、または正常細胞もしくは悪性腫瘍細胞のリプログラミング、悪性腫瘍の増殖抑制等の効果を有していることが示された。また、hsa-mir-192 siRNA等についても類似の効果が見られた。マウスで見られた悪性腫瘍の抑制は、悪性腫瘍細胞のリプログラミングが要因のひとつであると考えられる。また、未分化型だけでなく高分化型肝癌細胞でもOct4陽性かつNANOG陽性細胞になり、分化型によらない幹性化効果が見られた。なお、RGM249 shRNAと3つのsiRNAは、RGM249 mRNAから始まるカスケードを遮断する点で機能が共通しており、この機能が上記の悪性腫瘍の抑制や悪性腫瘍細胞のリプログラミング等の効果に関与していると考えられる。hsa−mir−520dはこのときアップレギュレイトしていると考えられる。以上から、RGM249 shRNA、3つのsiRNA、hsa−mir−520d、hsa-mir-192 siRNA等はいずれも悪性腫瘍治療に好適に使用できると考えられる。
【0208】
さらには、これらsmall RNAは体内外で細胞を多能性幹細胞へと誘導する誘導剤、または多能性幹細胞を生産するための試薬として好適に使用できると考えられる。特に、癌遺伝子を使用しない点、悪性腫瘍細胞をリプログラミングできる点、単剤でリプログラミングできる点、p53のアップレギュレイトが生じる点、または培養時にフィーダー細胞が不要である点において従来の多能性幹細胞を生産するために研究されてきた化合物よりも優れた特性を有していると考えられる。
【0209】
特に悪性腫瘍細胞のリプログラミングについては世界的にほとんど研究成果がでていない領域であり、今後の悪性腫瘍治療の新たな可能性を秘めている。また、p53については、そのノックアウトやノックダウンがiPS細胞の作成効率を上昇させることが報告されている(Zhao et al., Cell Stem Cell. 2008 Nov 6;3(5):475-9.、 Hong et al., Nature. 2009 Aug 27;460(7259):1132-5. Epub 2009 Aug 9.)ため、上記small RNAを用いて得られた多能性幹細胞が、p53をアップレギュレイトしていたことは驚くべき結果であった。そしてこの多能性幹細胞は、p53が発現しているため悪性腫瘍化しにくいと考えられる。
【0210】
なお、上記small RNAを導入した細胞の腫瘍化は、導入後未分化維持環境を持続させる場合に生じ、生体内では腫瘍は発生しにくかった。そのため、細胞にsmall RNA導入後は1週間以内に治療に用いることが好ましい。
【0211】
またRGM249 shRNA、3つのsiRNA、hsa−mir−520dは、それぞれへアピン様構造の1本鎖、2本鎖、pre−miRNA様構造の1本鎖からなっている。このことは、siRNAまたはmiRNAが機能するときの2次構造は必ずしも固定されたものではなく、ある程度の範囲を許容できることを示唆している。
【0212】
なお上記実施例において3つのsiRNA、hsa−mir−520d、またはhsa−mir−192 siRNA等は、標的RNA鎖をRNAiまたはmiRNAの作用でサイレンシングしていると考えられる。しかし仮に他のメカニズムが働いていたとしても、3つのsiRNAのセンス鎖(配列番号4、配列番号5、または配列番号6)およびアンチセンス鎖(配列番号1、配列番号2、または配列番号3)、hsa−mir−520d(配列番号43)、またはhsa−mir−192 siRNA等(配列番号44等)を使用すれば、上記のような効果が得られることは明らかである。または、ここで示されない標的RNA鎖と反応していても同様である。
【0213】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【特許請求の範囲】
【請求項1】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項2】
前記1本鎖または2本鎖のポリヌクレオチドが、miRNA作用を有する、請求項1に記載の多能性幹細胞誘導剤。
【請求項3】
前記1本鎖または2本鎖のポリヌクレオチドが、small RNAである、請求項1に記載の多能性幹細胞誘導剤。
【請求項4】
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖または2本鎖のRNA鎖である、請求項1に記載の多能性幹細胞誘導剤。
【請求項5】
前記1本鎖または2本鎖のポリヌクレオチドが、15以上のヌクレオチドからなる、請求項1に記載の多能性幹細胞誘導剤。
【請求項6】
前記1本鎖または2本鎖のポリヌクレオチドが、100以下のヌクレオチドからなる、請求項5に記載の多能性幹細胞誘導剤。
【請求項7】
前記1本鎖のポリヌクレオチドがshRNAまたはpre−miRNAであり、前記2本鎖のポリヌクレオチドがsiRNAまたはmiRNAである、請求項1に記載の多能性幹細胞誘導剤。
【請求項8】
前記shRNAまたはpre−miRNAが35〜100ヌクレオチドからなり、前記siRNAまたはmiRNAのガイド鎖が15〜40ヌクレオチドからなる、請求項7に記載の多能性幹細胞誘導剤。
【請求項9】
前記shRNA、前記pre−miRNA、前記siRNA、および前記miRNAが、1〜5ヌクレオチドからなるオーバーハングを含む、請求項7に記載の多能性幹細胞誘導剤。
【請求項10】
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号42の塩基配列、またはその塩基配列に対して1〜5個の塩基が欠失、置換もしくは付加された塩基配列を含む、
請求項1に記載の多能性幹細胞誘導剤。
【請求項11】
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号41の塩基配列からなるポリヌクレオチドの相補鎖を含む、請求項1に記載の多能性幹細胞誘導剤。
【請求項12】
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖のポリヌクレオチドであり、且つpre−miRNAである、請求項1に記載の多能性幹細胞誘導剤。
【請求項13】
前記1本鎖のポリヌクレオチドが、配列番号43の塩基配列、またはその塩基配列に対して1〜4個の塩基が欠失、置換もしくは付加された塩基配列を含む、
請求項12に記載の多能性幹細胞誘導剤。
【請求項14】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含むsmall RNAを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項15】
a)配列番号43の塩基配列、
b)配列番号43の塩基配列に対して、80%以上の相同性を有する塩基配列、
c)配列番号43の塩基配列において1もしくは数個の塩基が欠失、置換もしくは付加された塩基配列、
d)配列番号43の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含むポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項16】
体細胞を多能性幹細胞へ誘導する、請求項1に記載の多能性幹細胞誘導剤。
【請求項17】
悪性腫瘍細胞を多能性幹細胞へ誘導する、請求項1に記載の多能性幹細胞誘導剤。
【請求項18】
前記悪性腫瘍が、肝臓癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、請求項17に記載の多能性幹細胞誘導剤。
【請求項19】
前記多能性幹細胞が、内在性のp53を発現している、請求項1に記載の多能性幹細胞誘導剤。
【請求項20】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤。
【請求項21】
請求項20に記載の未分化細胞マーカー発現調節剤であって、
前記未分化細胞マーカーが、Klf4、c−Myc、Oct4、Sox2、PROM1からなる群から選ばれる1種以上の未分化細胞マーカーである、未分化細胞マーカー発現調節剤。
【請求項22】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、多能性幹細胞におけるp53の発現量を促進する、多能性幹細胞のp53発現促進剤。
【請求項23】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法。
【請求項24】
請求項23に記載の生産方法で得られる、多能性幹細胞。
【請求項25】
HPS0002:253G1株に比べて内在性のp53の発現量が増大している、請求項24に記載の多能性幹細胞。
【請求項26】
フィーダー細胞の非存在下で培養可能である、請求項25に記載の多能性幹細胞。
【請求項27】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有する、悪性腫瘍の治療薬。
【請求項28】
請求項27に記載の悪性腫瘍の治療薬であって、
前記悪性腫瘍が、肝臓癌、肺癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、悪性腫瘍の治療薬。
【請求項29】
前記悪性腫瘍が肉腫である、請求項27に記載の悪性腫瘍の治療薬。
【請求項30】
配列番号41の塩基配列に相補的な塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列をコードするポリヌクレオチドを含む、ベクター。
【請求項31】
請求項30に記載のベクターを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項32】
請求項30に記載のベクターを含む、悪性腫瘍の治療薬。
【請求項33】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列を含むポリヌクレオチドを含む、
多能性幹細胞誘導用、未分化細胞マーカー発現調節用、多能性幹細胞のp53発現促進用、または悪性腫瘍の治療用のキット。
【請求項1】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項2】
前記1本鎖または2本鎖のポリヌクレオチドが、miRNA作用を有する、請求項1に記載の多能性幹細胞誘導剤。
【請求項3】
前記1本鎖または2本鎖のポリヌクレオチドが、small RNAである、請求項1に記載の多能性幹細胞誘導剤。
【請求項4】
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖または2本鎖のRNA鎖である、請求項1に記載の多能性幹細胞誘導剤。
【請求項5】
前記1本鎖または2本鎖のポリヌクレオチドが、15以上のヌクレオチドからなる、請求項1に記載の多能性幹細胞誘導剤。
【請求項6】
前記1本鎖または2本鎖のポリヌクレオチドが、100以下のヌクレオチドからなる、請求項5に記載の多能性幹細胞誘導剤。
【請求項7】
前記1本鎖のポリヌクレオチドがshRNAまたはpre−miRNAであり、前記2本鎖のポリヌクレオチドがsiRNAまたはmiRNAである、請求項1に記載の多能性幹細胞誘導剤。
【請求項8】
前記shRNAまたはpre−miRNAが35〜100ヌクレオチドからなり、前記siRNAまたはmiRNAのガイド鎖が15〜40ヌクレオチドからなる、請求項7に記載の多能性幹細胞誘導剤。
【請求項9】
前記shRNA、前記pre−miRNA、前記siRNA、および前記miRNAが、1〜5ヌクレオチドからなるオーバーハングを含む、請求項7に記載の多能性幹細胞誘導剤。
【請求項10】
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号42の塩基配列、またはその塩基配列に対して1〜5個の塩基が欠失、置換もしくは付加された塩基配列を含む、
請求項1に記載の多能性幹細胞誘導剤。
【請求項11】
前記1本鎖または2本鎖のポリヌクレオチドが、さらに、配列番号41の塩基配列からなるポリヌクレオチドの相補鎖を含む、請求項1に記載の多能性幹細胞誘導剤。
【請求項12】
前記1本鎖または2本鎖のポリヌクレオチドが、1本鎖のポリヌクレオチドであり、且つpre−miRNAである、請求項1に記載の多能性幹細胞誘導剤。
【請求項13】
前記1本鎖のポリヌクレオチドが、配列番号43の塩基配列、またはその塩基配列に対して1〜4個の塩基が欠失、置換もしくは付加された塩基配列を含む、
請求項12に記載の多能性幹細胞誘導剤。
【請求項14】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含むsmall RNAを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項15】
a)配列番号43の塩基配列、
b)配列番号43の塩基配列に対して、80%以上の相同性を有する塩基配列、
c)配列番号43の塩基配列において1もしくは数個の塩基が欠失、置換もしくは付加された塩基配列、
d)配列番号43の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含むポリヌクレオチドを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項16】
体細胞を多能性幹細胞へ誘導する、請求項1に記載の多能性幹細胞誘導剤。
【請求項17】
悪性腫瘍細胞を多能性幹細胞へ誘導する、請求項1に記載の多能性幹細胞誘導剤。
【請求項18】
前記悪性腫瘍が、肝臓癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、請求項17に記載の多能性幹細胞誘導剤。
【請求項19】
前記多能性幹細胞が、内在性のp53を発現している、請求項1に記載の多能性幹細胞誘導剤。
【請求項20】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、未分化細胞マーカーの発現を調節する、未分化細胞マーカー発現調節剤。
【請求項21】
請求項20に記載の未分化細胞マーカー発現調節剤であって、
前記未分化細胞マーカーが、Klf4、c−Myc、Oct4、Sox2、PROM1からなる群から選ばれる1種以上の未分化細胞マーカーである、未分化細胞マーカー発現調節剤。
【請求項22】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有し、多能性幹細胞におけるp53の発現量を促進する、多能性幹細胞のp53発現促進剤。
【請求項23】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを、細胞に導入する工程を含む、多能性幹細胞の生産方法。
【請求項24】
請求項23に記載の生産方法で得られる、多能性幹細胞。
【請求項25】
HPS0002:253G1株に比べて内在性のp53の発現量が増大している、請求項24に記載の多能性幹細胞。
【請求項26】
フィーダー細胞の非存在下で培養可能である、請求項25に記載の多能性幹細胞。
【請求項27】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列、
を含む1本鎖または2本鎖のポリヌクレオチドを含有する、悪性腫瘍の治療薬。
【請求項28】
請求項27に記載の悪性腫瘍の治療薬であって、
前記悪性腫瘍が、肝臓癌、肺癌、膵臓癌、線維肉腫、多形性膠芽腫、メラノーマからなる群から選ばれる1種以上の悪性腫瘍である、悪性腫瘍の治療薬。
【請求項29】
前記悪性腫瘍が肉腫である、請求項27に記載の悪性腫瘍の治療薬。
【請求項30】
配列番号41の塩基配列に相補的な塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列をコードするポリヌクレオチドを含む、ベクター。
【請求項31】
請求項30に記載のベクターを含有し、細胞を多能性幹細胞へ誘導する、多能性幹細胞誘導剤。
【請求項32】
請求項30に記載のベクターを含む、悪性腫瘍の治療薬。
【請求項33】
配列番号41の塩基配列、またはその塩基配列に対して1〜3個の塩基が欠失、置換もしくは付加された塩基配列を含むポリヌクレオチドを含む、
多能性幹細胞誘導用、未分化細胞マーカー発現調節用、多能性幹細胞のp53発現促進用、または悪性腫瘍の治療用のキット。
【図1A】


【図1B】


【図1C】


【図1D】


【図2A】


【図2B】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図3F】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図6F】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【図9A】


【図9B】


【図9C】


【図9D】


【図10A】


【図10B】


【図11A】


【図11B】


【図11C】


【図11D】


【図12A】


【図12B】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図14E】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】




【図1B】


【図1C】


【図1D】


【図2A】


【図2B】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図3F】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図6F】


【図7A】


【図7B】


【図8A】


【図8B】


【図8C】


【図9A】


【図9B】


【図9C】


【図9D】


【図10A】


【図10B】


【図11A】


【図11B】


【図11C】


【図11D】


【図12A】


【図12B】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図14E】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【公開番号】特開2013−34479(P2013−34479A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2012−202509(P2012−202509)
【出願日】平成24年9月14日(2012.9.14)
【分割の表示】特願2011−530189(P2011−530189)の分割
【原出願日】平成23年6月28日(2011.6.28)
【出願人】(504150461)国立大学法人鳥取大学 (271)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成24年9月14日(2012.9.14)
【分割の表示】特願2011−530189(P2011−530189)の分割
【原出願日】平成23年6月28日(2011.6.28)
【出願人】(504150461)国立大学法人鳥取大学 (271)
【Fターム(参考)】
[ Back to top ]

