pH応答性リポソーム
【課題】pHに応答して内容物を放出でき、ひいては細胞の細胞質へ目的物質を効率的に送達できるリポソームを提供することを課題とする。
【解決手段】少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持してなることを特徴とするpH応答性リポソームにより、上記の課題を解決する。
【解決手段】少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持してなることを特徴とするpH応答性リポソームにより、上記の課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、中性以上のpH条件下では安定であるが、穏やかな酸性条件下で膜融合性となって内包物を放出できるpH応答性リポソームに関する。
【背景技術】
【0002】
樹状細胞(Dendritic Cell: DC)は免疫系の司令細胞であり、取り込んだ外来物質(抗原)を他の免疫系の細胞に伝え、獲得免疫反応を起動させる役割(抗原提示)を果たしている。
近年、このDCを利用した免疫療法が注目を集めている。DCは、次の2種類の免疫を誘導できる。内在性抗原がプロセシングを受け、MHC(主要組織適合複合体)クラスI上に提示されて誘導される細胞性免疫と、外来性抗原がエンドソーム系でプロセシングを受け、MHCクラスII上に提示されて誘導される液性免疫である。
免疫療法の成功のためには細胞性免疫を誘導することが必要であるが、多くの場合、抗原タンパク質をDCに導入してもMHCクラスII上に提示されてしまう。
したがって、細胞性免疫を誘導するために、DCの細胞質へ抗原タンパク質を送達できる方法の開発が望まれている。
【0003】
DCの細胞質へタンパク質を効率的に送達する方法として、pH応答性リポソームを用いることが知られている。この原理は、次のとおりである。細胞へのリポソームの取り込み経路がエンドサイトーシスであることが知られている。よって、細胞にリポソームが取り込まれると、リポソームはエンドソーム(エンドサイトーシスにより形成されるリソソームへの運搬小胞)に捕捉される。エンドソーム内は穏やかな酸性環境であるので、酸性条件下で膜融合性となり得るpH応答性リポソームを用いれば、リポソームがエンドソーム及びリソソームを不安定化するか及び/又はエンドソーム及びリソソームと融合して、リポソーム内容物を放出できる。
【0004】
本発明者らは、以前に、サクシニル化ポリグリシドール(SucPG)、及びより疎水性の高い側鎖構造を有する3-メチルグルタリル化ポリグリシドール(MGluPG)などを有する修飾リポソームによる内包物の細胞内導入について検討を行ってきた(非特許文献1及び2)。SucPG及びMGluPGは、弱酸性条件下において側鎖カルボキシル基がプロトン化されることで疎水化し、膜融合性となるため、SucPG又はMGluPGで修飾したリポソームは、細胞内のエンドソームにおいて膜融合した。
実際に、モデルタンパク質としてオブアルブミン(OVA)を封入したMGluPGリポソームは、マウス樹状細胞由来株DC2.4細胞の細胞質にOVAを効率良く導入し、さらにMGluPGリポソームを用いて経粘膜免疫を行ったマウスからは、極めて高い細胞性免疫が誘導された(非特許文献3)。
【0005】
しかし、ポリグリシドールは合成高分子であり、生体への応用を考えた場合に、好ましくない場合がある。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】K. Konoら、Biochimica et Biophysica Acta、1325、1997年、143〜154頁
【非特許文献2】N. Sakaguchiら、Bioconjugate Chem.、2008年、19、1040〜1048頁
【非特許文献3】E. Yubaら、Biomaterials、31、2010年、943〜951頁
【発明の概要】
【発明が解決しようとする課題】
【0007】
そこで、本発明者らは、ポリグリシドールの代わりに、生体由来高分子である多糖を用いて生体適合性の高いpH応答性リポソームを創製できるのではないかと考えた。
DCはマンノースレセプターなどの糖鎖認識レセプター(レクチン)を有しているので、多糖を用いることによりDCへのリポソームの取り込み効率の向上が期待できる。さらに、リポソームのpH応答能によって、DCへの取り込み機能と、細胞質送達機能との2つの機能を併せ持つ新規機能性分子が開発できる。
【0008】
したがって、本発明は、生体適合性がより高く、DCの細胞質へ効率良く抗原を送達できるpH応答性リポソームを提供することを目的とする。
【課題を解決するための手段】
【0009】
よって、本発明は、少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持してなるpH応答性リポソームである。
また、本発明は、上記のpH応答性リポソームと薬剤とからなるpH応答性薬剤放出システムも提供する。
【発明の効果】
【0010】
本発明のpH応答性リポソームは、生体由来高分子である多糖をリポソーム膜表面に有するので、生体に投与した場合であっても、生体内で望ましくない反応を引き起こす可能性が低い。また、本発明のpH応答性リポソームは、pH応答性の特性を有するので、細胞内のエンドソームでの弱酸性条件下でエンドソーム及びリソソームを不安定化するか及び/又はエンドソーム及びリソソームの膜と融合して、リポソーム膜内に保持された内包物を放出し、よって内包物を細胞質(サイトソル)へと効率よく送達できる。よって、樹状細胞の細胞質への抗原の特異的な送達を実現できる。
【図面の簡単な説明】
【0011】
【図1A】メチルグルタリル化デキストランA(MGlu-Dex)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図1B】メチルグルタリル化デキストランB(MGlu-Dex)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図2A】pH応答性物質A(MGlu70-Dex-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図2B】pH応答性物質B(MGlu24-Dex-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図3A】メチルグルタリル化マンナンC(MGlu-Man)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図3B】メチルグルタリル化マンナンD(MGlu-Man)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図4A】pH応答性物質C(MGlu57-Man-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図4B】pH応答性物質D(MGlu68-Man-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図5A】対照のリポソームのパイラニン放出率の経時変化を示すグラフである。
【図5B】脂質:pH応答性物質の重量比が8:2のpH応答性リポソーム(実施例1)のパイラニン放出率の経時変化を示すグラフである。
【図5C】脂質:pH応答性物質の重量比が7:3のpH応答性リポソーム(実施例2)のパイラニン放出率の経時変化を示すグラフである。
【図5D】脂質:pH応答性物質の重量比が6:4のpH応答性リポソーム(実施例3)のパイラニン放出率の経時変化を示すグラフである。
【図5E】脂質:pH応答性物質の重量比が5:5のpH応答性リポソーム(実施例4)のパイラニン放出率の経時変化を示すグラフである。
【図5F】脂質:pH応答性物質の重量比が8:2のpH応答性リポソーム(実施例5)のパイラニン放出率の経時変化を示すグラフである。
【図5G】脂質:pH応答性物質の重量比が7:3のpH応答性リポソーム(実施例6)のパイラニン放出率の経時変化を示すグラフである。
【図5H】脂質:pH応答性物質の重量比が6:4のpH応答性リポソーム(実施例7)のパイラニン放出率の経時変化を示すグラフである。
【図6A】10分間のインキュベーション後のMGlu70-Dexリポソームからのパイラニン放出率(%)をpHに対してプロットしたグラフである。
【図6B】10分間のインキュベーション後のMGlu24-Dexリポソームからのパイラニン放出率(%)をpHに対してプロットしたグラフである。
【図7A】脂質:pH応答性物質の重量比が1:5のpH応答性リポソーム(実施例8)のパイラニン放出率の経時変化を示すグラフである。
【図7B】脂質:pH応答性物質の重量比が1:5のpH応答性リポソーム(実施例9)のパイラニン放出率の経時変化を示すグラフである。
【図8】10分間のインキュベーション後の実施例8及び9のリポソームからのパイラニン放出率(%)をpHに対してプロットしたグラフである。
【図9A】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu70-Dex-C10リポソームとインキュベートしたDC2.4細胞の共焦点レーザー顕微鏡(CLSM)画像である。脂質(赤色)又はパイラニン(緑色)の細胞内の局在をCLSMにより決定した。DICは、微分干渉顕微鏡による画像を示す。
【図9B】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu24-Dex-C10リポソームとインキュベートしたDC2.4細胞のCLSM画像である。脂質(赤色)又はパイラニン(緑色)の細胞内の局在をCLSMにより決定した。DICは、微分干渉顕微鏡による画像を示す。
【図10A】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu70-Dex-C10リポソームとインキュベートしたDC2.4細胞の蛍光強度を、Rh-PE及びパイラニンについてフローサイトメーターにより測定し、対照リポソームについての蛍光強度を1とした場合の相対値として示すグラフである。
【図10B】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu24-Dex-C10リポソームとインキュベートしたDC2.4細胞の蛍光強度を、Rh-PE及びパイラニンについてフローサイトメーターにより測定し、対照リポソームについての蛍光強度を1とした場合の相対値として示すグラフである。
【図11A】リポソームを投与しなかったE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図11B】OVAを内包する対照のEYPCリポソームを投与したE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図11C】OVAを内包するMGlu70-Dex-C10リポソームを投与したE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図11D】OVAを内包するMGlu24-Dex-C10リポソームを投与したE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図12】処置なし、OVAを内包する対照のEYPCリポソーム、OVAを内包するMGlu70-Dex-C10リポソーム及びOVAを内包するMGlu24-Dex-C10リポソームをそれぞれ投与したE.G7-OVA細胞接種マウスにおける腫瘍サイズの変化を比較するグラフである。各群の結果は、4匹のマウスにおける腫瘍サイズの平均値を示す。
【発明を実施するための形態】
【0012】
本明細書において、「pH応答性リポソーム」とは、中性以上のpH条件下では安定であるが、弱酸性以下のpH条件下で、リポソーム膜で囲まれた閉鎖空間に内包された物質の一部又は全部をリポソーム膜外に放出できるリポソームのことをいう。この内包物の放出は、リポソーム膜自体を不安定化するリポソームの能力、リポソーム膜が別の脂質二重膜などと融合することによるリポソームの膜融合性の増加のいずれか又は両方によるものであると考えられる。
【0013】
本明細書において、「弱酸性以下のpH条件」とは、pH6.9以下、より好ましくはpH6.7以下、さらにより好ましくはpH6.6以下、さらにより好ましくはpH6.5以下、さらにより好ましくはpH6.4以下、さらにより好ましくはpH6.3以下、さらにより好ましくはpH6.2以下、さらにより好ましくはpH6.1以下、さらにより好ましくはpH6.0以下のことをいう。また、本発明のリポソームが内包物を放出できるpH条件の下限としては、特に限定されないが、生体内で生じ得るpH条件が考えられ、それは、通常、pH4以上、より好ましくはpH4.5以上である。
【0014】
本明細書において、「内包物の一部」とは、リポソーム膜で囲まれた閉鎖空間に内包された物質の少なくとも10%、より好ましくは少なくとも15%、さらにより好ましくは少なくとも20%、さらにより好ましくは少なくとも30%、さらにより好ましくは少なくとも40%、さらにより好ましくは少なくとも50%、さらにより好ましくは少なくとも60%、さらにより好ましくは少なくとも70%、さらにより好ましくは少なくとも80%、さらにより好ましくは少なくとも90%、さらにより好ましくは少なくとも95%、最も好ましくは少なくとも99%のことである。
【0015】
本明細書において、「リポソーム膜に保持する」とは、保持される成分の少なくとも一部分がリポソーム膜を構成する膜脂質成分中に疎水性相互作用などにより埋め込まれている状態のことをいう。
本明細書において、「生体(に)由来(する)」とは、天然に生体内で見出されることをいう。
【0016】
<pH応答性物質>
本発明のpH応答性リポソームは、少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持する。pH応答性物質は、カルボキシル基含有多糖由来部分が有するカルボキシル基が弱酸性以下のpHでプロトン化されて多糖が脂質二重膜と相互作用することが可能になる。よって、弱酸性以下のpHでは、pH応答性リポソーム膜が不安定化され、かつ/又はpH応答性リポソームが取り込まれたエンドソーム及びリソソームの膜構造を不安定化でき、かつ/又はエンドソーム及びリソソームの膜とpH応答性リポソームの膜とが融合することが可能になる。また、pH応答性物質は、疎水性部分の少なくとも一部分がリポソームの脂質二重膜と疎水性相互作用などにより結合することにより、リポソーム膜に保持される。
【0017】
カルボキシル基含有多糖由来部分は、カルボキシル基を有する生体に由来する多糖及び生体由来多糖を用いて得られるカルボキシル基含有半合成多糖から選択されるカルボキシル基含有多糖に由来する。カルボキシル基含有生体由来多糖としては、グルクロン酸、ガラクツロン酸、マンヌロン酸などのウロン酸を分子内に持つ化合物、例えばヒアルロン酸、コンドロイチン、ペクチン、ヘパリン、キサンタンガム、アラビアゴム、グアーガム、へパラン硫酸、アルギン酸及びそれらの誘導体が挙げられる。カルボキシル基含有半合成多糖は、多糖が有するヒドロキシ基にエーテル結合によりカルボキシル基を導入したもの(例えばカルボキシメチルセルロース、カルボキシメチルキチン、カルボキシメチルデンプン、カルボキシメチルデキストランなど)、ヒドロキシ基にエステル結合によりカルボキシル基を導入したもの(例えば、多糖とジカルボン酸とのアシル化反応生成物)、ヒドロキシ基にウレタン結合やカーボネート結合によりカルボキシル基を導入したものなどが挙げられる。カルボキシル基の量を調整できる点で、カルボキシル基含有多糖は、カルボキシル基含有半合成多糖が好ましい。
【0018】
カルボキシル基含有半合成多糖が由来する多糖は、単糖(ポリヒドロキシアルデヒド及びポリヒドロキシケトン)又はその誘導体(例えばアセチルグルコサミン)がグリコシド結合で連結された構造を有する分子であれば特に限定されず、ホモ多糖及びヘテロ多糖のいずれであってもよい。多糖は、好ましくは、生体由来多糖又はその派生物である。生体由来多糖としては、例えばデンプン、アミロース、アミロペクチン、ペクチン、キシラン、マンナン、ガラクタン、デキストラン、デキストリン、シクロデキストリン、キチン、ヒアルロン酸、コンドロイチン、ペプチドグリカン類、アルギン酸、プルラン、グリコーゲン、βグルカン(セルロース、レンチナン、ラミナラン、カロース、カードラン、シゾフィラン)などが挙げられる。生体由来多糖の派生物としては、例えばこれらの多糖の分解産物などが挙げられる。
【0019】
多糖としてマンナンを用いる場合、細胞がマンノースレセプターを有するので、このようなpH応答性物質で修飾されたリポソームは、細胞により認識されて取り込みが促進されると考えられる。よって、マンナンは、本発明において好ましい多糖の1つである。同様の理由から、細胞がそれに対する認識レセプターを有すると考えられる多糖を用いると、リポソームの取り込みが促進されると考えられるので、このような実施形態が好ましい。また、カードランやシゾフィランは、アジュバント効果(免疫賦活化効果)を有することが知られているので、このような多糖を用いる実施形態は、本発明のリポソームをワクチンとして用いる場合に好ましい。
【0020】
カルボキシル基含有多糖部分の分子量は、特に限定されないが、取り扱い及び入手が容易な点で、1,000〜40,000,000であり、より好ましくは5,000〜250,000である。
【0021】
カルボキシル基含有半合成多糖において、多糖が有する全てのヒドロキシ基の数に対するカルボキシル基と結合したヒドロキシ基の数を表すカルボキシル基結合率(%)は、100%が好ましいが、上限は95%であってもよく、例えば90%であってもよく、80%であってもよい。また、下限は、10%であってもよく、20%であってもよく、30%であってもよい。このような結合率は、実施例に示すように、1H-NMRを用いて決定できる。
以下の実施例に示すように、カルボキシル基結合率を調節することにより、pH応答性リポソームが内包物を放出するpHを調節できると考えられる。
【0022】
多糖のヒドロキシ基にエステル結合によりカルボキシル基を導入したカルボキシル基含有半合成多糖としては、多糖とジカルボン酸無水物又はハロゲン化ジカルボン酸とのアシル化反応生成物が挙げられる。用い得るジカルボン酸は、HOOC−R1−COOH(R1は、結合手、主鎖部分の炭素数が1〜10で直鎖状若しくは分岐鎖状であってよいアルキレン基(分岐鎖の炭素数は1〜4である)、環状部分の炭素数が3〜10で、置換されていてもよいシクロアルキレン基(置換基は炭素数1〜4のアルキル基である)、炭素数1〜4のアルキル基で置換されていてもよいフェニレン基、炭素数1〜4のアルキル基で置換されていてもよいフェニルアルキレン基(フェニルアルキレン基のアルキル部分の炭素数は1〜4である)で表されるジカルボン酸である。このようなジカルボン酸としては、シュウ酸、マロン酸、コハク酸、グルタル酸、2-若しくは3-メチルグルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、o−、m−若しくはp−フタル酸、1,2-、1,3-若しくは1,4-シクロヘキサンジカルボン酸、及び不飽和結合を持つジカルボン酸(マレイン酸、フマル酸、シトラコン酸、メサコン酸、2−ペンテン二酸、メチレンコハク酸、アリルマロン酸、イソプロピリデンコハク酸、2,4−ヘキサジエン二酸、アセチレンジカルボン酸など)などが挙げられる。
【0023】
多糖のヒドロキシ基にエーテル結合によりカルボキシル基を導入したカルボキシル基含有半合成多糖も、当該技術において公知の方法により製造できる。また、このような物質は、工業的にも製造されているので、市販品をカルボキシル基含有多糖として本発明において用いることもできる。
【0024】
pH応答性物質が有する疎水性部分は、pH応答性物質をリポソーム膜に保持するように機能する部分である。
よって、疎水性部分は、脂質二重膜に保持され得る疎水性基であればよい。脂質二重膜に保持され得る疎水性基としては、例えば主鎖の炭素数が6〜22で直鎖状又は分岐鎖状の脂肪族基、環状部分の炭素数が合計で19〜29、好ましくは19〜27の脂環式基(これらの脂肪族基及び脂環式基は、窒素原子、酸素原子などのヘテロ原子を有してもよく、不飽和結合を含んでいてもよい)、リン脂質に由来する基などが挙げられる。
上記の脂肪族基としては、主鎖の炭素数が6〜22の直鎖状又は分岐鎖状のアルキル基、主鎖の炭素数が6〜22で1〜4個の不飽和結合を有する直鎖状又は分岐鎖状のアルケニル又はアルキニル基などが挙げられる。上記の脂環式基としては、ステロール骨格を有する基(例えばコレステリル基)が挙げられる。リン脂質に由来する基としては、ホスファチジルエタノールアミン、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロールなどのリン脂質に由来する基が挙げられる。これらのリン脂質の構成脂肪酸としては、ミリスチン酸、パルミチン酸、ステアリン酸、アラキドン酸、オレイン酸、リノール酸、リノレン酸などが挙げられる。
【0025】
疎水性部分は、カルボキシル基含有多糖のヒドロキシ基に結合してもよく(すなわち多糖の主鎖に結合する)、カルボキシル基含有多糖のカルボキシル基に結合してもよい(すなわち多糖の側鎖に結合する)。
よって、疎水性部分とカルボキシル基含有多糖由来部分との間の結合は、エーテル結合、ウレタン結合、尿素結合、エステル結合、アミド結合及びカーボネート結合から選択できる。
【0026】
pH応答性物質は、カルボキシル基含有多糖と、疎水性基を有する物質とを、当業者に公知の反応により反応させて上記のいずれかの結合を形成させることにより得ることができる。
【0027】
カルボキシル基含有多糖が有するカルボキシル基の全数に対する疎水性部分と結合したカルボキシル基の数で表されるアンカー率(%)は、1〜20%が好ましく、5〜15%がより好ましい。このような結合率は、実施例に示すように、1H-NMRを用いて決定できる。
【0028】
上記の反応において、反応させるカルボキシル基含有多糖と疎水性基を有する物質との重量比は、pH応答性物質に導入される疎水性基の所望の量に応じて、適宜選択できる。
【0029】
<pH応答性リポソーム>
本発明のpH応答性リポソームは、上記のpH応答性物質を保持してなる。
pH応答性リポソームの粒径は、動的光散乱(25℃及び40℃)により測定して、0.03〜10μmが好ましく、より好ましくは0.05〜0.2μm、さらにより好ましくは0.05〜0.15μmである。
pH応答性リポソームは、上記の範囲の粒径を有していれば、一層の脂質二重膜からなる単層リポソーム、又は複数の脂質二重層からなる多重層リポソームのいずれであってもよい。
【0030】
pH応答性リポソームを構成するリポソーム膜構成脂質は、リポソームに通常用いられる両親媒性の脂質を用いることができる。このような脂質としては、例えばホスファチジン酸、ホスファチジルエタノールアミン、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルグリセロール、ホスファチジルイノシトール、カルジオリピン、スフィンゴミエリン、大豆ホスファチジルコリン、卵黄ホスファチジルコリンなどのリン脂質が挙げられる。これらのリン脂質の構成脂肪酸としては、ミリスチン酸、パルミチン酸、ステアリン酸、アラキドン酸、オレイン酸、リノール酸、リノレン酸などが挙げられる。これらは単独で又は2種以上組み合わせて使用できる。特に、ホスファチジルコリン、ホスファチジルエタノールアミンが好ましい。
【0031】
また、リポソーム膜構成脂質としては、上記のリン脂質の他に、公知のカチオン性の合成脂質を用いることもできる。このようなカチオン性の合成脂質としては、例えばN−(α−トリメチルアンモニオアセチル)−ジドデシルグルタメート、N−〔1−(2,3−ジオレイルオキシ)プロピル〕−N,N,N−トリメチルアンモニウムクロリド及び1,2−ビス(オレオイルオキシ)−3−(トリメチルアンモニオ)プロパンなどの第4級アンモニウム塩が挙げられる。これらの脂質は、単独で又は2種以上組み合わせて用いることができる。
リポソーム膜構成脂質には、コレステロール、ラノステロール、エルゴステロールなどのステロールが含まれていてもよい。
【0032】
本発明のpH応答性リポソームにおいて、リポソームの膜構成脂質とpH応答性物質との重量比は、1:0.01〜10が好ましく、より好ましくは1:0.05〜9であり、さらにより好ましくは1:0.1〜1である。
【0033】
pH応答性リポソームは、そのpH応答性が損なわれないことを条件として、上記の膜構成脂質以外のリポソームの構成成分として通常用い得る成分を含むこともできる。リポソームの構成成分として通常用い得る成分としては、例えばポリエチレングリコール脂質、ガングリオシドのような糖脂質などが挙げられる。
【0034】
pH応答性リポソームは、上記のpH応答性物質とリポソーム膜構成脂質と所望により上記のリポソームの構成成分として通常用い得る成分とを用いて、それ自体公知のリポソームの製造方法により得ることができる。
それ自体公知のリポソームの製造方法としては、エクストルーダー法、超音波法、フレンチプレス法などが挙げられる。
【0035】
例えば、エクストルーダー法によりpH応答性リポソームを製造する方法について説明する。所定量のリポソーム膜構成脂質を、クロロホルム、メタノール、ヘキサンなどの適当な有機溶媒に溶解させた溶液をエバポレーターに入れて溶媒を除去し、容器壁に薄膜を形成させる。ここに、pH応答性物質を上記のような適当な有機溶媒に溶解させた溶液を入れ、エバポレーターで溶媒を除去し、混合薄膜を形成させる。この膜は、さらに3〜12時間程度真空乾燥させることが好ましい。次いで、この容器内に緩衝液などの適当な溶液を投入し、超音波処理又はボルテックスミキサーなどを用いて強く攪拌することによりリポソームを形成させることができる。得られたリポソーム分散液をエクストルーダーに通し、そのフィルタ孔径を適宜設定することにより、リポソームの粒径を調節することができる。
【0036】
上記のようにして得られたリポソーム分散液から、リポソームに含まれなかったリポソーム膜構成脂質などを、ゲルろ過法、超遠心法、透析法などにより除去することができる。除去したい物質が電荷を有する場合には、イオン交換クロマトグラフィーを用いることもできる。
【0037】
また、リポソーム膜構成成分を用いて上記のようなエクストルーダー法などにより予めリポソームを形成させた後に、pH応答性物質の溶液を加えて、pH応答性物質をリポソーム膜に保持させることもできる。
【0038】
<pH応答性薬剤放出システム>
上記のpH応答性リポソームと薬剤とからなるpH応答性薬剤放出システムも、本発明の一つである。
上記の薬剤は、親水性物質及び疎水性物質のいずれであってもよい。親水性物質である場合は、薬剤は、pH応答性リポソームの内部の閉鎖空間の親水性領域に内包され、疎水性物質である場合は、pH応答性リポソーム膜に保持されることとなる。
【0039】
上記の薬剤は、抗癌剤、サイトカイン、抗生物質、抗ウイルス剤、抗炎症剤、核酸、抗原(免疫原、ワクチン)など、リポソームを用いて送達し得る薬剤であれば特に限定されない。特に、本発明のpH応答性リポソームの特性を考慮すると、樹状細胞の細胞質へ特異的に送達して細胞性免疫を誘導するための抗原(免疫原、ワクチン)であることが有利である。
このような抗原は、当該技術において知られている疾患を予防及び/又は治療するための抗原であってよく、例えば癌抗原(例えば癌胎児抗原(CEA)、WT1、HER2、MAGE、MART-1、gp100、チロシナーゼ、α−フェトプロテイン(AFP)、AFPレクチン分画(AFP-L3%)、ヒト絨毛性ゴナドトロピン(hCG)、塩基性フェトプロテイン(BFP)、扁平上皮癌関連抗原(SCC抗原)、BCA225、CA15-3、CA19-9、CA50、CA54/61、CA72-4、CA125、CA130、CA602、シアリルLex抗原(CSLEX)、膵癌関連糖タンパク抗原(DUPAN-2)、KMO-1、NCC-ST-439、シアリルLex-i抗原(SLX)、Span-1、シアリルTn抗原(STN)、サイトケラチン19フラグメント(CYFRA)、組織ポリペプチド抗原(TPA)、免疫抑制酸性タンパク質(IAP)、I型コラーゲンCテロペプチド(ICTP)、I型コラーゲン架橋Cテロペプチド(CTx)、膀胱腫瘍抗原(BTA)、核マトリクスプロテイン22 (NMP22)、PIVKA-II、前立腺特異抗原(PSA)、妊娠特異タンパク(SP1)、神経特異エノラーゼ(NSE)、フェリチン、エラスターゼ1、p53抗体、ガストリン放出ペプチド前駆体(ProGRP)、前立腺酸性ホスファターゼ(PAP)、アルカリホスファターゼ(ALP)、胎盤性ALP (PL-ALP)、癌関連ガラクトース転移酵素(GAT)、乳酸脱水素酵素(LDH)、ペプシノゲン(PG) I/II比、erbB-2、γ−セミノプロテイン(γ-Sm)、Dpyr、ポリアミン、カテコールアミン、バニリルマンデル酸(VMA)、BJPなど)、感染疾患治療用の抗原(例えば感染性細菌、真菌及びウイルス由来の抗原など)などが挙げられる。
【0040】
上記の抗癌剤としては、シスプラチン、カルボプラチン、テトラプラチン、イプロプラチンなどの金属錯体;アドリアマイシン(ADR)、マイトマイシン、アクチノマイシン、アンサマイトシン、ブレオマイシン、Ara-C、ダウノマイシンなどの制癌抗生物質;5-FU、メトトレキセート、TAC-788などの代謝拮抗剤;BCNU、CCNUなどのアルキル化剤;インターフェロン(α、β、γ)、各種インターロイキンなどのリンホカインなどが挙げられる。また、抗炎症剤としては、プレドニン、リンデロン、セレスタミンなどが挙げられる。
【0041】
上記の核酸としては、例えば、重症複合型免疫不全症の治療のためのアデノシンデアミナーゼ遺伝子、家族性高コレステロール血症の治療のためのLDL受容体遺伝子、癌治療のためのインターフェロン(IFN)−α、β又はγ遺伝子、顆粒球マクロファージコロニー刺激因子(GM-CSF)遺伝子、各種インターロイキン(IL)遺伝子、腫瘍壊死因子(TNF)−α遺伝子、リンホトキシン(LT)−β遺伝子、顆粒球コロニー刺激因子(G-CSF)遺伝子、T細胞活性化共刺激因子遺伝子などが挙げられる。その他、アルツハイマー病、脊椎損傷、パーキンソン病、動脈硬化症、糖尿病、高血圧症などの治療のための遺伝子も挙げられる。
上記の薬剤の量は特に限定されず、薬剤の種類などにより適宜選択することができる。
【0042】
上記のpH応答性薬剤放出システムの製造において、pH応答性リポソームに薬剤を含有させる方法としては、薬剤の種類に応じて公知の方法を用いることができる。該方法としては限定されないが、例えば上記のpH応答性リポソームの製造方法に従ってpH応答性リポソームを形成させた後に、薬剤を含む溶液に該リポソームを浸漬させて薬剤をリポソームの内部に取り込ませる方法、上記のpH応答性リポソームの製造方法において薄膜が形成された容器内に、薬剤を含む溶液を投入した後にリポソーム膜構造を形成させて薬剤を封入する方法などが挙げられる。
【0043】
本発明のpH応答性薬剤放出システムは、さらに少なくとも1種の医薬添加剤を含むのが好ましい。該pH応答性薬剤放出システムは、錠剤、粉末、カプセルなどの固形製剤の形態、注射製剤、点眼剤、点鼻薬のような液体製剤の形態、パッチ、パスタ剤、ゲルのような塗布/貼付製剤の形態などのいずれであってもよい。該液体製剤は、用時に水又は他の適切な賦形剤で再生する乾燥製品として提供してもよい。
【0044】
上記の錠剤及びカプセルは、通常の方法により腸溶コーティングを施すことが望ましい。腸溶コーティングとしては、当該分野において通常用いられるものを利用できる。また、カプセルは粉末又は液体のいずれを含有することもできる。
【0045】
上記のpH感受性薬剤放出システムが液体製剤である場合、医薬添加剤は、担体(例えば生理食塩水、滅菌水、緩衝液など)、膜安定剤(例えばコレステロールなど)、等張化剤(例えば塩化ナトリウム、グルコース、グリセリンなど)、抗酸化剤(例えばトコフェロール、アスコルビン酸、グルタチオンなど)、防腐剤(例えばクロルブタノール、パラベンなど)などを含み得る。上記の担体は、pH応答性リポソームを製造する際に用いる溶媒であり得る。
【0046】
上記のpH応答性薬剤放出システムが固形製剤である場合、医薬添加剤は、賦形剤(例えば乳糖、ショ糖のような糖類、トウモロコシデンプンのようなデンプン類、結晶セルロースのようなセルロース類、アラビアゴム、メタケイ酸アルミン酸マグネシウム、リン酸カルシウムなど)、滑沢剤(例えばステアリン酸マグネシウム、タルク、ポリエチレングリコールなど)、結合剤(例えばマンニトール、ショ糖のような糖類、結晶セルロース、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロースなど)、崩壊剤(例えば馬鈴薯澱粉のようなデンプン類、カルボキシメチルセルロースのようなセルロース類、架橋ポリビニルピロリドンなど)、着色剤、矯味矯臭剤などを含み得る。
【0047】
上記のpH応答性薬剤放出システムが塗布/貼付製剤である場合、医薬添加剤は、溶剤(例えば水、グリセリン、アルコールなど)、基剤(例えばアルギン酸ナトリウムのような親水性ポリマーなど)、乳化剤(例えば界面活性剤など)などを含み得る。
【0048】
上記のpH応答性薬剤放出システムは、上記の薬剤を含むpH応答性リポソームをそのまま、又は凍結乾燥させて、上記の医薬添加剤と混合することにより製造することができる。薬剤を含むpH応答性リポソームを凍結乾燥する場合、凍結乾燥する前に適当な賦形剤を添加しておくのがよい。
【0049】
上述したように、本発明のpH応答性リポソームは、弱酸性以下のpHでその内包物を放出できるので、例えば細胞性免疫を誘導するために特に樹状細胞の細胞質へ目的の抗原を送達することができる。
よって、本発明は、対象者に、上記のpH応答性薬剤放出システムの有効量を投与することを含む、対象者に細胞性免疫を誘導する方法も提供する。
上記の対象者は、哺乳動物が好ましく、特に好ましくはヒトである。
細胞性免疫を誘導する対象者としては、細胞性免疫を誘導することにより治療され得る免疫疾患に罹患した対象者又は免疫疾患を予防することを意図する対象者が好ましい。このような免疫疾患としては、癌、ウイルス感染などが挙げられる。
【0050】
上記のpH応答性薬剤放出システムは、非経口及び経口経路のいずれによっても投与することができる。非経口経路としては、当該技術において公知の非経口経路による投与を用いることができ、静脈注射、経皮投与、経鼻投与などが挙げられる。
上記のpH応答性薬剤放出システムの投与量は、対象者の疾患の重篤度及びリポソームに含有される薬剤の量に応じて適宜選択することができる。
【実施例】
【0051】
本発明を、以下の実施例を用いてより詳細に説明するが、本発明は以下の実施例により何ら限定されるものではない。
【0052】
1.pH応答性物質の製造
多糖としてデキストラン又はマンナンを用い、ジカルボン酸として3-メチルグルタリル酸を用い、疎水性基としてデシル基を用いて、以下のような手順でpH応答性物質を製造した。
1-1.試薬
デキストラン(デキストラン70)及びn-デシルアミンは東京化成工業から購入した。マンナン(マンナン、Saccharomyces cerevisiae由来)及び3-メチルグルタリル酸無水物はSigmaから購入した。LiClはナカライテスクから購入した。4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチルモルホリニウムクロライドn-水和物(DMT-MM)、ジメチルホルムアミド(DMF)、炭酸水素ナトリウム及びリン酸水素二ナトリウムは和光純薬工業から購入した。透析膜はSpectra/Por 6 (分画分子量 10000, FE-0526-33)をSpectrum Laboratories Inc.から購入した。
【0053】
1-2.合成
1-2-1.デキストランとジカルボン酸無水物との反応
デキストラン(分子量(Mw):70000)とLiClをDMFに溶解させ、そこに3-メチルグルタリル酸無水物を加え、120℃、アルゴン雰囲気下で24時間撹拌を行った。ロータリーエバポレーターにより溶媒を減圧留去した後、炭酸水素ナトリウム水溶液で中和し、3日間透析することで未反応の3-メチルグルタリル酸を除去し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量は、以下の表1に記載する。
得られた化合物を、メチルグルタリル化デキストラン、MGlu-Dexと称する。
【0054】
1-2-2.疎水性基との反応
得られたMGlu-Dexを蒸留水に溶解させ、そこにn-デシルアミンを加えた。1.0M HCl溶液を用いてpHを7.4に調整した。ここにDMT-MMを加え、アルゴン雰囲気下、室温遮光下で3日間撹拌した。pHを7.4に調整して透析により精製し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量を、以下の表2に記載する。
得られた化合物を、MGlu-Dex-C10と称する。
【0055】
1-2-3.マンナンとジカルボン酸無水物との反応
マンナン(Mw:55000)とLiClをDMFに溶解させ、そこに3-メチルグルタリル酸無水物を加え、120℃、アルゴン雰囲気下で24時間撹拌を行った。ロータリーエバポレーターにより溶媒を減圧留去した後、炭酸水素ナトリウム水溶液で中和し、3日間透析することで未反応の3-メチルグルタリル酸を除去し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量を、以下の表3に記載する。
得られた化合物を、メチルグルタリル化マンナン、MGlu-Manと称する。
【0056】
1-2-4.疎水性基との反応
得られたMGlu-Manを蒸留水に溶解させ、そこにn-デシルアミンを加えた。1.0M HCl溶液を用いてpHを8.0に調整した。ここにDMT-MMを加え、アルゴン雰囲気下、室温遮光下で3日間撹拌した。pHを8.0に調整して透析により精製し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量を、以下の表4に記載する。
得られた化合物を、MGlu-Man-C10と称する。
【0057】
1-3.分析
1-3-1.デキストランを用いたpH応答性物質の分析
まず、MGlu-Dexの合成について、用いた試薬の量、収量、収率及びMGlu基の導入率を以下の表1に示す。
3-メチルグルタリル酸無水物の量を調整することで、MGlu基の導入率の異なる2種類の多糖を合成できたことがわかる。
化合物の同定を行った1H-NMRチャートを、表1のAのものを図1Aに、表1のBのものを図1Bにそれぞれ示す。ピークa〜fは、デキストランがもつプロトンのピークである。これに、MGlu基の持つプロトンのピークg及びhが併せて存在することから、多糖がメチルグルタリル化されたことが確認できる。
なお、MGlu基の導入率については、b〜fの積分値を基準にとり、その値に対するg及びhの積分値から算出した。すなわち、これは、多糖が有するヒドロキシル基の何%にメチルグルタリル基が導入されたかを表す。
【0058】
【表1】

【0059】
次に、MGlu-Dex-C10の合成について、用いた試薬の量、収量、収率、並びにMGlu基及び疎水性基(以下、アンカーともいう)の導入率を以下の表2に示す。
表1で示した2種類のMGlu-DexA、Bに、それぞれアンカーを導入した。
化合物の同定を行った1H-NMRチャートを、表2のAのものを図2Aに、表2のBのものを図2Bに示す。
デキストランのもつプロトンのピーク(a〜f)、MGlu基のピーク(g、h)に加え、新たにi〜kのデシル鎖に由来するプロトンのピークが確認されたことから、アンカーが導入されたことが確認できた。
なお、アンカーの導入率は、MGlu基のピーク(g、h)の積分値を基準にとり、その値に対するi〜kの積分値から算出した。すなわち、これは、メチルグルタリル酸に由来するカルボキシル基の何%に疎水性基が導入されたかを表す。
以下において、表2のAのpH応答性物質をMGlu70-Dex-C10、BのものをMGlu24-Dex-C10と称する。
【0060】
【表2】

【0061】
1-3-2.マンナンを用いたpH応答性物質の分析
MGlu-Manの合成について、用いた試薬の量、収量、収率及びMGlu基の導入率を以下の表3に示す。
1-3-1と同様に、3-メチルグルタリル酸無水物の量を調整することで、MGlu基の導入率の異なる2種類の多糖を合成できたことがわかる。
化合物の同定を行った1H-NMRチャートを、表3のCのものを図3Aに、表3のDのものを図3Bにそれぞれ示す。ピークa〜fは、マンナンのもつプロトンのピークである。これに、MGlu基の持つプロトンのピークg及びhが併せて存在することから、多糖がメチルグルタリル化されたことが確認できる。
なお、MGlu基の導入率については、上記と同様に、b〜fの積分値を基準にとり、その値に対するg及びhの積分値から算出した。
【0062】
【表3】

【0063】
次に、MGlu-Man-C10の合成について、用いた試薬の量、収量、収率並びにMGlu基及びアンカーの導入率を以下の表4に示す。
表4で示した2種類のMGlu-ManA、Bに、それぞれアンカーを導入した。
化合物の同定を行った1H-NMRチャートを、表4のCのものを図4Aに、表4のDのものを表4Bに示す。
これに関しても1-3-1と同様に、マンナンのもつプロトンのピーク(a〜f)、MGlu基のピーク(g、h)に加え、新たにi〜kのデシル鎖に由来するプロトンのピークが確認されたことから、アンカーが導入されたことが確認できた。
なお、アンカーの導入率は、MGlu基のピーク(g、h)の積分値を基準にとり、その値に対するi〜kの積分値から算出した。
以下において、表4のCのものをMGlu57-Man-C10、DのものをMGlu68-Man-C10と称する。
【0064】
【表4】

【0065】
2.pH応答性リポソームの製造及び分析
1.で作製したpH応答性物質を用いて、pH応答性リポソームを以下のような手順で製造した。また、製造したpH応答性リポソームのpH応答性を評価し、DC2.4細胞内での挙動を検討した。さらに、モデル抗原を内包したpH応答性リポソームをマウスに投与して、生体内での免疫誘導を試みた。
【0066】
2-1.試薬
卵黄ホスファチジルコリン(EYPC、COATSOME NC-50)は日本油脂より提供された。ローダミン-PE (Rh-PE)はAvanti Polar Lipid社から購入した。パイラニン(Pyranine)は東京化成工業から購入した。DPX (p-キシレン-ビス(N-ピリジニウムブロミド))はInvitrogenから購入した。リン酸水素二ナトリウム(12水和物) (Na2HPO4・12H2O)、Triton X-100はキシダ化学株式会社から購入した。ベンジルペニシリンカリウム、ストレプトマイシン硫酸塩は和光純薬工業より購入した。RPMI-1640液体培地はSigmaより、ウシ胎児血清(FBS)はMP Biomedical, Inc.から購入した。2-メルカプトエタノール、ピルビン酸ナトリウム溶液、Minimum Essential Medium非必須アミノ酸溶液はGIBCOより購入した。OVA(オブアルブミン)、MPL(モノホスホリルリピッドA)はSigmaより購入した。
【0067】
2-2.マウス
C57BL/6Nマウスはオリエンタル酵母工業(株)より購入し、通常の施設にて飼育及び維持した。動物実験は、大阪府立大学動物実験規定に基づき行った。
【0068】
2-3.pH応答性リポソームの製造とそのpH応答性評価
2-3-1.MGlu-Dex-C10を保持するpH応答性リポソームの製造
EYPC(10 mg/ml)クロロホルム溶液を所定量採り、ロータリーエバポレーターにより溶媒を除去し薄膜を形成した。MGlu-Dex-C10(10 mg/ml)メタノール溶液を所定量加え、ロータリーエバポレーターにより溶媒を除去し混合薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。薄膜の脂質量1.25×10-5molに対して、組成がパイラニン35 mM、DPX 50 mM、Na2HPO4 25 mM、pH 7.4の溶液を480μl加え分散し、バス型超音波照射装置により超音波を2分間照射して薄膜を剥がした。NaOH及びHClを用いてpH7.4に調整した。凍結融解を5回行い、エクストルーダーに膜孔100 nmの膜を挟み、リポソーム溶液を15回通すことによって、リポソーム粒径を100 nmにそろえた。リポソームを、Sepharose4Bを充填させたカラムにより精製した。外相にはPBS溶液pH7.4を使用した。
【0069】
2-3-2. MGlu-Man-C10を保持するpH応答性リポソームの製造
2-3-2-1. EYPCリポソームの作製
EYPC(10 mg/ml)クロロホルム溶液を所定量採り、ロータリーエバポレーターにより溶媒を除去し薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。薄膜の脂質量1.25×10-5molに対して、組成がパイラニン35 mM、DPX 50 mM、Na2HPO4 25 mM、pH 7.4の溶液を480μl加え分散し、バス型超音波照射装置により超音波を2分間照射し薄膜を剥がした。NaOH及びHClを用いてpH7.4に調製した。凍結融解を5回行い、エクストルーダーに膜孔100 nmの膜を挟み、リポソーム溶液を15回通すことによって、リポソーム粒径を100 nmにそろえた。リポソームを、Sepharose4Bを充填させたカラムにより精製した。外相にはPBS溶液pH7.4を使用した。
【0070】
2-3-2-2. MGlu-Man-C10を保持するリポソームの製造
上記のEYPCリポソーム1mmolに対してMGlu-Man-C10が7.82×10-2 mmolとなるように加えて、pH8.5のPBS 溶液中で1時間静置した。その後、混合溶液を、Sepharose4Bを充填させたカラムで精製した。外相にはPBS溶液pH8.5を使用した。
【0071】
2-3-3.脂質の定量
リン脂質の定量は、リン脂質Cテストワコー(和光純薬工業)を用いて、コリンオキシターゼ・DAOS(N-エチル-N-(2-ヒドロキシ-3-スルホプロリル)-3,5-ジメトキシアニリンナトリウム)法によって行った。試料溶液(リポソ―ム溶液)、ブランク溶液及び標準溶液をそれぞれ発色溶液と混合し、37℃で5分間インキュベートした。波長600 nmで試料溶液の吸光度を日本分光(株)製V-560型紫外・可視光光度計を用いて測定し、得られた吸光度から試料溶液中のリン脂質の濃度を決定した。
【0072】
2-3-4.リポソームのpH応答性評価
上記のようにして製造したパイラニン内包pH応答性リポソームから放出されるパイラニンを416 nmの光で励起し、発せられる蛍光を512 nmで測定することにより、pH応答性リポソームのpH及び温度応答性の評価を行った。
石英セル内に、各pHに調製したPBS溶液を加え、蛍光分光光度計内に設置した。表示温度が37℃になったことを確認した後、蛍光分光光度計で石英セル内の脂質濃度が0.02 mMとなるようにリポソーム溶液を各pHに調整したPBSに加えた(最終体積2.5 ml)。10分間インキュベーションした時のパイラニンの放出量を調べた。最後に10%Triton X-100を25μl加えてリポソームを破壊した。そのときの蛍光強度を100%として、各リポソームからの内包物の放出割合を求めた。
蛍光強度の測定は、分光蛍光光度計(JASCO製 FP-6200、FP-6500)及び温度コントローラ(JASCO製 ETC-272T)を用いて37℃で行った。
【0073】
2-4. MGlu-Dex-C10を保持するpH応答性リポソームのDC2.4細胞への取り込み評価
2-4-1.細胞培養
マウス由来の樹状細胞の細胞培養株であるDC2.4細胞は、Dr. Rock (Harvard Medical School, USA)及びDr. Kadowaki (Kyoto University, Japan)から提供され、10% FBS、0.1 mg/mlベンジルペニシリンカリウム、0.1 mg/mlストレプトマイシン硫酸塩、2 mM L-グルタミン、0.1 mM MEM非必須アミノ酸溶液及び0.55 mM 2-メルカプトエタノールを含むRPMI-1640培地中、CO2インキュベーター内で、CO2濃度5%、37℃で培養した。
【0074】
2-4-2.パイラニン内包Rh-PEラベル化リポソームの作製
上記と同様のリポソームの製造工程において、ローダミン-PE(0.5 mg/ml)クロロホルム溶液を、各リポソーム構成膜脂質の全脂質量に対して0.1モル%加え、ロータリーエバポレーターで溶媒を除去し薄膜を形成させ、4時間真空乾燥することで溶媒を完全に除去した。それぞれの薄膜の脂質量1.25×10-5molに対して、組成がパイラニン47.5mM、Na2HPO4 25mM、pH7.4の溶液を960μl加え分散し、バス型超音波照射装置により超音波を2分間照射し薄膜を剥がした。凍結融解を5回行い、エクストルーダーに膜孔100 nmの膜を挟み、リポソーム溶液を15回通すことによって、リポソーム粒径を100 nmにそろえた。リポソームを、Sepharose4Bを充填させたカラムにより精製した。外相にはPBS溶液pH7.4を使用した。
【0075】
2-4-3.共焦点レーザー顕微鏡によるリポソームの細胞内挙動の観察
pH応答性リポソームのDC2.4細胞内での動態を、レーザー共焦点顕微鏡にて観察した。DC2.4細胞を松並ガラスボトムディッシュ1穴当たり2×105個になるように撒き、血清含有RPMI培地(2ml)中、37℃で二晩培養した。その後、HBSS (Hanks' Balanced Salt Solution)で細胞を2回洗浄し、血清含有RPMI培地を、リポソーム溶液添加後の全量が2mlとなるように加え、そこへリポソーム溶液を脂質濃度が0.5 mMとなるように加えた(全量2ml)。37℃で4時間インキュベーションすることで、リポソームを細胞に取り込ませた。HBSSで3回洗浄することで、細胞に取り込まれていないリポソームを除去し、新たにHBSSを加えてレーザー共焦点顕微鏡LSM 5 EXCITER(Carl Zeiss)による観察を行った。
【0076】
2-4-2.フローサイトメトリーによるリポソームの細胞への取り込み量の測定
DC2.4細胞を1×105/ウェルとなるように24ウェルプレートに播き、二晩培養した。HBSSで2回洗浄した後、血清含有RPMI培地をリポソーム溶液添加後の全量が1mlとなるように加え、そこへリポソーム溶液を脂質濃度が0.5mMとなるように加えた(全量1ml)。37℃で4時間インキュベーションすることで、リポソームを細胞に取り込ませた。HBSSで3回洗浄したのち、1穴につき300μlのトリプシン水溶液(トリプシン(DIFCO)250 mg、エチレンジアミン四酢酸二ナトリウム(EDTA)1mg、PBS 100 ml)を用いて細胞を剥離し、フローサイトメーター用のチューブに回収した。回収した細胞溶液について、フローサイトメーターBeckman Coulter.XLを用いて細胞の蛍光強度を測定し、細胞へのリポソームの取り込み量を評価した。
【0077】
2.5. MGlu-Dex-C10を保持するリポソームのマウスへの皮下投与による抗腫瘍効果
2-5-1.抗原内包リポソームの調製
抗原としてオブアルブミン(OVA)を内包するpH応答性リポソーム及び対照のリポソームを調製した。
EYPC(10 mg/ml)クロロホルム溶液を所定量採り、脂質1mol当たり4gのモノホスホリルリピッドA(MPL)をアジュバントとして加え、ロータリーエバポレーターにより溶媒を除去し薄膜を形成した。MGlu-Dex-C10(10 mg/ml)メタノール溶液を所定量加え、ロータリーエバポレーターにより溶媒を除去し混合薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。
対照としてのEYPCリポソームについて、EYPC(10 mg/ml)クロロホルム溶液を所定量加え、さらに脂質1mol当たり4gのMPLをアジュバントとして加え、ロータリーエバポレーターで溶媒を除去し薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。
それぞれの薄膜に、4mg/mlのオブアルブミン(OVA)のPBS溶液を適量加え、超音波照射によって脂質膜を剥がした。凍結融解を5回行い、Sepharose4Bカラムにより抗原内封リポソームの精製を行った。脂質の定量はテストワコーにより行った。
【0078】
2-5-2.マウスへのリポソームの皮下注射による腫瘍退縮実験
マウス1匹当たりに、OVAを抗原として発現する癌細胞であるE.G7-OVA細胞を1×106個、マウス左側部に担癌した。癌細胞の接種から7日後に100μgのOVAを含む各リポソームをマウス右側部に皮下投与し(各群4匹のマウス)、癌細胞の接種から14日後にも同様にOVAを含む各リポソームをマウス右側部に皮下投与した。その間、腫瘍サイズを測定した。
【0079】
2-6.結果
2-6-1.MGlu-Dex-C10を保持するpH応答性リポソームのpH応答性の評価
MGlu70-Dex-C10及びMGlu24-Dex-C10を保持し、パイラニンを内包するpH応答性リポソーム(以下、それぞれMGlu70-Dexリポソーム、MGlu24-Dexリポソームともいう)のパイラニン放出に対するpHの影響について検討した。
製造したMGlu70-Dexリポソーム及びMGlu24-Dexリポソームは、脂質とpH応答性物質との重量比(w/w)が以下のものである。
対照:EYPC/ MGlu70-Dex-C10 =10/0
実施例1:EYPC/ MGlu70-Dex-C10 =8/2
実施例2:EYPC/ MGlu70-Dex-C10 =7/3
実施例3:EYPC/ MGlu70-Dex-C10 =6/4
実施例4:EYPC/ MGlu70-Dex-C10 =5/5
実施例5:EYPC/ MGlu24-Dex-C10 =8/2
実施例6:EYPC/ MGlu24-Dex-C10 =7/3
実施例7:EYPC/ MGlu24-Dex-C10 =6/4
【0080】
上記の対照、MGlu70-Dexリポソーム及びMGlu24-Dexリポソームを各pHにおいて37℃で10分間インキュベーションしたときのパイラニン放出率の経時変化を、図5A〜Hに示す(それぞれ、順に対照及び実施例1〜7に対応する)。
なお、測定における脂質濃度は、2×10-5Mであった。
【0081】
pH応答性物質を保持していない対照のリポソーム(EYPCリポソーム)では、pHが変化しても内包物がリポソームから放出されない。このことから、リポソーム自体はpH応答性能がないことが分かる。
一方、pH応答性物質を保持するpH応答性リポソームはそれぞれ、高pH条件下では内包物が放出されないのに対し、pHが低下するとリポソームからの内包物の放出が見られる。これは、リポソーム表面のMGlu鎖のカルボキシル基がpH低下に伴いプロトン化することで、リポソーム膜の不安定化が誘起され、内包物の放出が起こったと考えられる。
また、MGlu70-DexリポソームとMGlu24-Dexリポソームにおいて、同じ脂質:pH応答性物質の重量比のものでは、MGlu70-Dexリポソームのほうがより高いpHにおいて内包物が放出されることがわかる。これは、リポソームを修飾しているカルボキシル基の量の違いによるか、又はMGlu70-DexリポソームとMGlu24-Dexリポソームの側鎖のカルボキシル基のpKa値が異なっていることによるのではないかと考えられる。
【0082】
次に、それぞれのリポソームの10分後のパイラニン放出率(%)をpHに対してプロットし、各リポソームのpH応答性を比較した。そのグラフを図6A及びBに示す。図6AがMGlu70-Dexリポソーム、図6BがMGlu24-Dexリポソームについてのグラフである。
なお、測定における脂質濃度は、2×10-5Mであった。
この結果から、リポソーム膜脂質に対するMGlu-Dex-C10の割合を変化させることで、得られるリポソームが内包物を放出し始めるpHが異なることが分かる。これは、リポソームに存在するカルボキシル基の量が異なるので、リポソーム膜を不安定化できるpH領域が違うからだと考えられる。
【0083】
2-6-2. MGlu-Man-C10を保持するpH応答性リポソームのpH応答性の評価
MGlu57-Man-C10及びMGlu68-Man-C10を保持するパイラニン内包リポソーム(以下、それぞれMGlu57-Manリポソーム及びMGlu68-Manリポソームともいう)のパイラニン放出に対するpHの影響について検討した。
製造したMGlu57-Manリポソーム及びMGlu68-Manリポソームは、脂質とpH応答性物質との重量比(w/w)が以下のものである。
対照:EYPC/ MGlu57-Man-C10 =10/0
実施例8:EYPC/ MGlu57-Man-C10 =1/5
実施例9:EYPC/ MGlu68-Man-C10 =1/5
【0084】
上記のMGlu57-Manリポソーム及びMGlu68-Manリポソームを各pHにおいて37℃で10分インキュベーションしたときのパイラニン放出率の経時変化を、図7A及びBにそれぞれ示す。
なお、測定における脂質濃度は、2×10-5Mであった。
【0085】
pH応答性物質を保持するpH応答性リポソームはそれぞれ高pH条件下では内包物が放出されないのに対し、pHが低下するとリポソームからの内包物の放出が見られる。これは、2-6-1でも述べたように、リポソーム表面のMGlu鎖のカルボキシル基がpH低下に伴いプロトン化することで、リポソーム膜の不安定化が誘起され、内包物の放出が起こったと考えられる。
【0086】
次に、それぞれのリポソームの10分後のパイラニン放出率(%)をpHに対してプロットし、各リポソームのpH応答性を比較した。その結果を図8に示す。MGlu57-Manリポソーム及びMGlu68-Manリポソームは、それぞれのpHによって、その放出率に大きな変化は見られず、どちらもpH6付近で内包物の放出が見られ始めた。どちらのリポソームも、カルボキシル基のプロトン化によって同程度の疎水度を持つためだと考えられる。
【0087】
2-6-3. MGlu-Dex-C10を保持するpH応答性リポソームのDC2.4細胞内での挙動
2-6-1のMGlu-Dex-C10リポソームのpH応答性評価の結果から、細胞内エンドソームのpH領域であるpH5〜6付近で本発明のリポソームがpH応答性を示すことが明らかになった。そこで、DC2.4細胞を用いて、モデル低分子薬物であるパイラニンの細胞質内への輸送について調べた。
【0088】
パイラニンを内包した種々のRh-PEラベル化リポソームを作製し、DC2.4細胞の培養液に加えて、その取り込みを共焦点レーザー顕微鏡で観察した。また、フローサイトメーターによりリポソームの取り込み量を評価した。
なお、作製したRh-PEラベル化リポソームの脂質とpH応答性物質との重量比(w/w)は、次のとおりである:
対照(EYPC):EYPC/ MGlu70-Dex-C10 =10/0
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =9/1
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =8/2
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =7/3
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =6/4
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =5/5
EYPC/ MGlu24-Dex-C10又はMGlu24-Dex-C10 =8/2
EYPC/ MGlu24-Dex-C10又はMGlu24-Dex-C10 =7/3
EYPC/ MGlu24-Dex-C10又はMGlu24-Dex-C10 =6/4
【0089】
対照のEYPCリポソームと各MGlu70-Dex-C10リポソーム、及び対照のEYPCリポソームと各MGlu24-Dex-C10リポソームの共焦点レーザー顕微鏡での観察結果を、それぞれ図9A及びBに示す。
Rh-PEの蛍光については、いずれのリポソームで処理した細胞においても蛍光が輝点状に観察される。このことから、すべてのリポソームがDC2.4細胞内に取り込まれたことが示唆される。
次に、パイラニンの蛍光は、細胞全体に広がって見える。特に、MGlu-Dex-C10リポソームとインキュベートした細胞では、対照リポソームとインキュベートした細胞よりも強い蛍光が観察される。これはリポソームに内包されたパイラニンがエンドソーム内から細胞質中に放出されたことを示しており、MGlu-Dex-C10リポソームが、対照リポソームと比較して、より効率良く内包物を運搬していると考えられる。
【0090】
図10Aは、対照のEYPCリポソームと上記の各MGlu70-Dex-C10リポソームの細胞取込み量を、図10Bは、対照のEYPCリポソームと上記の各MGlu24-Dex-C10リポソームの細胞取込み量を、それぞれフローサイトメーターを用いて調べた結果であり、EYPCリポソームでの平均蛍光強度を基準として相対値を示す。
Rh-PEの蛍光強度は、どのMGlu-Dex-C10リポソームにおいても1以上の値を示している。このことから、MGlu-Dex-C10リポソームは、EYPCリポソームと比較してより多く細胞に取り込まれたことが示唆される。これは、MGlu-Dex-C10の側鎖のカルボキシル基が、DC2.4細胞上に発現している負電荷を認識するスカベンジャーレセプターに認識され、取り込みが促進されたのではないかと考えられる。
また、MGlu-Dex-C10リポソームは、pH応答性物質の含有率が増えると、細胞への取り込み量が増大した。これは、リポソーム表面にカルボキシル基が多くなったため、よりレセプターに認識されやすくなり、取り込み量が増大したからではないかと考えられる。
【0091】
2-6-4. MGlu-Dex-C10を保持するpH応答性リポソームのマウスへの皮下注射による腫瘍の退縮
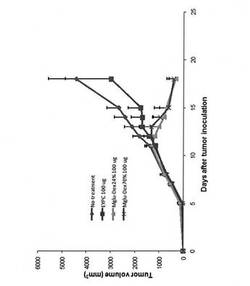
モデル抗原としてオボアルブミンを内包させたMGlu-Dex-C10リポソームを、OVA発現癌細胞を接種したC57BL/6マウスに投与することで、実際に免疫が誘導されるかどうかを調べた。癌細胞を播種した日を0日目とし、7日目及び14日目に所定量のリポソームを皮下投与した。その間、腫瘍サイズの大きさを観察した。種々のリポソームを投与した場合の腫瘍退縮実験の結果を、図11A〜Dに示す。
図11Aは、リポソームを投与しなかった癌細胞接種マウスにおける腫瘍サイズの変化を示す。図11Bは、OVAを内包する対照のEYPCリポソーム、図11Cは、OVAを内包するMGlu70-Dex-C10リポソーム、図11Dは、OVAを内包するMGlu24-Dex-C10リポソームをそれぞれ投与した場合の癌細胞接種マウスにおける腫瘍サイズの変化を示す。
【0092】
何も処理をしなかったマウスは日ごとに腫瘍体積の増大がみられた(図11A)。また、EYPCリポソームを投与したマウスでは、一時的に腫瘍の抑制がみられたが、再度腫瘍体積の増大が確認された(図11B)。
一方、MGlu70-Dex-C10リポソーム及びMGlu24-Dex-C10リポソームを投与したマウスでは、投与後に明らかな腫瘍の縮退が確認され、中には腫瘍が消失したマウスもいることが分かる(図11C及びD)。この腫瘍成長抑制効果のメカニズムについては、これらのリポソームが抗原タンパク質を細胞質内に送達したことで、MHCクラスIを介してキラーT細胞の活性化が起こり、OVAを発現した腫瘍細胞の成長を阻害したことによる細胞性免疫の効果だと考えられる。また液性免疫だけでなく細胞性免疫も活性化されたことによる効果も考えられる。
【0093】
これらのデータをまとめたものを図12に示す。OVAを内包するMGlu70-Dex-C10リポソーム及びMGlu24-Dex-C10リポソームを投与したマウスの腫瘍の退縮はほぼ同じ時期に起こったので、これらのリポソームが同程度の作用を及ぼしていることがわかる。MGlu70-Dex-C10リポソームとMGlu24-Dex-C10リポソームとでは内包物の放出が起こるpH領域は異なるものの、in vivoでは内包物が十分に細胞質内に放出されると考えられる。
【0094】
これらの結果から、本発明のpH応答性リポソームは、pH応答性を示し、弱酸性環境において内包物を放出することが確認できた。また、本発明のpH応答性リポソームは、樹状細胞に効率的に取り込まれ、内包物を効率よく細胞内に送達すること、及び抗原タンパク質を内包した本発明のpH応答性リポソームは、癌化したマウスに投与することで、免疫誘導により腫瘍を退縮させることがわかった。
【技術分野】
【0001】
本発明は、中性以上のpH条件下では安定であるが、穏やかな酸性条件下で膜融合性となって内包物を放出できるpH応答性リポソームに関する。
【背景技術】
【0002】
樹状細胞(Dendritic Cell: DC)は免疫系の司令細胞であり、取り込んだ外来物質(抗原)を他の免疫系の細胞に伝え、獲得免疫反応を起動させる役割(抗原提示)を果たしている。
近年、このDCを利用した免疫療法が注目を集めている。DCは、次の2種類の免疫を誘導できる。内在性抗原がプロセシングを受け、MHC(主要組織適合複合体)クラスI上に提示されて誘導される細胞性免疫と、外来性抗原がエンドソーム系でプロセシングを受け、MHCクラスII上に提示されて誘導される液性免疫である。
免疫療法の成功のためには細胞性免疫を誘導することが必要であるが、多くの場合、抗原タンパク質をDCに導入してもMHCクラスII上に提示されてしまう。
したがって、細胞性免疫を誘導するために、DCの細胞質へ抗原タンパク質を送達できる方法の開発が望まれている。
【0003】
DCの細胞質へタンパク質を効率的に送達する方法として、pH応答性リポソームを用いることが知られている。この原理は、次のとおりである。細胞へのリポソームの取り込み経路がエンドサイトーシスであることが知られている。よって、細胞にリポソームが取り込まれると、リポソームはエンドソーム(エンドサイトーシスにより形成されるリソソームへの運搬小胞)に捕捉される。エンドソーム内は穏やかな酸性環境であるので、酸性条件下で膜融合性となり得るpH応答性リポソームを用いれば、リポソームがエンドソーム及びリソソームを不安定化するか及び/又はエンドソーム及びリソソームと融合して、リポソーム内容物を放出できる。
【0004】
本発明者らは、以前に、サクシニル化ポリグリシドール(SucPG)、及びより疎水性の高い側鎖構造を有する3-メチルグルタリル化ポリグリシドール(MGluPG)などを有する修飾リポソームによる内包物の細胞内導入について検討を行ってきた(非特許文献1及び2)。SucPG及びMGluPGは、弱酸性条件下において側鎖カルボキシル基がプロトン化されることで疎水化し、膜融合性となるため、SucPG又はMGluPGで修飾したリポソームは、細胞内のエンドソームにおいて膜融合した。
実際に、モデルタンパク質としてオブアルブミン(OVA)を封入したMGluPGリポソームは、マウス樹状細胞由来株DC2.4細胞の細胞質にOVAを効率良く導入し、さらにMGluPGリポソームを用いて経粘膜免疫を行ったマウスからは、極めて高い細胞性免疫が誘導された(非特許文献3)。
【0005】
しかし、ポリグリシドールは合成高分子であり、生体への応用を考えた場合に、好ましくない場合がある。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】K. Konoら、Biochimica et Biophysica Acta、1325、1997年、143〜154頁
【非特許文献2】N. Sakaguchiら、Bioconjugate Chem.、2008年、19、1040〜1048頁
【非特許文献3】E. Yubaら、Biomaterials、31、2010年、943〜951頁
【発明の概要】
【発明が解決しようとする課題】
【0007】
そこで、本発明者らは、ポリグリシドールの代わりに、生体由来高分子である多糖を用いて生体適合性の高いpH応答性リポソームを創製できるのではないかと考えた。
DCはマンノースレセプターなどの糖鎖認識レセプター(レクチン)を有しているので、多糖を用いることによりDCへのリポソームの取り込み効率の向上が期待できる。さらに、リポソームのpH応答能によって、DCへの取り込み機能と、細胞質送達機能との2つの機能を併せ持つ新規機能性分子が開発できる。
【0008】
したがって、本発明は、生体適合性がより高く、DCの細胞質へ効率良く抗原を送達できるpH応答性リポソームを提供することを目的とする。
【課題を解決するための手段】
【0009】
よって、本発明は、少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持してなるpH応答性リポソームである。
また、本発明は、上記のpH応答性リポソームと薬剤とからなるpH応答性薬剤放出システムも提供する。
【発明の効果】
【0010】
本発明のpH応答性リポソームは、生体由来高分子である多糖をリポソーム膜表面に有するので、生体に投与した場合であっても、生体内で望ましくない反応を引き起こす可能性が低い。また、本発明のpH応答性リポソームは、pH応答性の特性を有するので、細胞内のエンドソームでの弱酸性条件下でエンドソーム及びリソソームを不安定化するか及び/又はエンドソーム及びリソソームの膜と融合して、リポソーム膜内に保持された内包物を放出し、よって内包物を細胞質(サイトソル)へと効率よく送達できる。よって、樹状細胞の細胞質への抗原の特異的な送達を実現できる。
【図面の簡単な説明】
【0011】
【図1A】メチルグルタリル化デキストランA(MGlu-Dex)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図1B】メチルグルタリル化デキストランB(MGlu-Dex)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図2A】pH応答性物質A(MGlu70-Dex-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図2B】pH応答性物質B(MGlu24-Dex-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図3A】メチルグルタリル化マンナンC(MGlu-Man)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図3B】メチルグルタリル化マンナンD(MGlu-Man)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図4A】pH応答性物質C(MGlu57-Man-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図4B】pH応答性物質D(MGlu68-Man-C10)の1H-NMRチャートである(400 MHz、D2O+NaOD)。
【図5A】対照のリポソームのパイラニン放出率の経時変化を示すグラフである。
【図5B】脂質:pH応答性物質の重量比が8:2のpH応答性リポソーム(実施例1)のパイラニン放出率の経時変化を示すグラフである。
【図5C】脂質:pH応答性物質の重量比が7:3のpH応答性リポソーム(実施例2)のパイラニン放出率の経時変化を示すグラフである。
【図5D】脂質:pH応答性物質の重量比が6:4のpH応答性リポソーム(実施例3)のパイラニン放出率の経時変化を示すグラフである。
【図5E】脂質:pH応答性物質の重量比が5:5のpH応答性リポソーム(実施例4)のパイラニン放出率の経時変化を示すグラフである。
【図5F】脂質:pH応答性物質の重量比が8:2のpH応答性リポソーム(実施例5)のパイラニン放出率の経時変化を示すグラフである。
【図5G】脂質:pH応答性物質の重量比が7:3のpH応答性リポソーム(実施例6)のパイラニン放出率の経時変化を示すグラフである。
【図5H】脂質:pH応答性物質の重量比が6:4のpH応答性リポソーム(実施例7)のパイラニン放出率の経時変化を示すグラフである。
【図6A】10分間のインキュベーション後のMGlu70-Dexリポソームからのパイラニン放出率(%)をpHに対してプロットしたグラフである。
【図6B】10分間のインキュベーション後のMGlu24-Dexリポソームからのパイラニン放出率(%)をpHに対してプロットしたグラフである。
【図7A】脂質:pH応答性物質の重量比が1:5のpH応答性リポソーム(実施例8)のパイラニン放出率の経時変化を示すグラフである。
【図7B】脂質:pH応答性物質の重量比が1:5のpH応答性リポソーム(実施例9)のパイラニン放出率の経時変化を示すグラフである。
【図8】10分間のインキュベーション後の実施例8及び9のリポソームからのパイラニン放出率(%)をpHに対してプロットしたグラフである。
【図9A】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu70-Dex-C10リポソームとインキュベートしたDC2.4細胞の共焦点レーザー顕微鏡(CLSM)画像である。脂質(赤色)又はパイラニン(緑色)の細胞内の局在をCLSMにより決定した。DICは、微分干渉顕微鏡による画像を示す。
【図9B】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu24-Dex-C10リポソームとインキュベートしたDC2.4細胞のCLSM画像である。脂質(赤色)又はパイラニン(緑色)の細胞内の局在をCLSMにより決定した。DICは、微分干渉顕微鏡による画像を示す。
【図10A】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu70-Dex-C10リポソームとインキュベートしたDC2.4細胞の蛍光強度を、Rh-PE及びパイラニンについてフローサイトメーターにより測定し、対照リポソームについての蛍光強度を1とした場合の相対値として示すグラフである。
【図10B】ローダミン-PE (Rh-PE)で標識し、パイラニンを内包するMGlu24-Dex-C10リポソームとインキュベートしたDC2.4細胞の蛍光強度を、Rh-PE及びパイラニンについてフローサイトメーターにより測定し、対照リポソームについての蛍光強度を1とした場合の相対値として示すグラフである。
【図11A】リポソームを投与しなかったE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図11B】OVAを内包する対照のEYPCリポソームを投与したE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図11C】OVAを内包するMGlu70-Dex-C10リポソームを投与したE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図11D】OVAを内包するMGlu24-Dex-C10リポソームを投与したE.G7-OVA細胞接種マウス(n=4)における腫瘍サイズの変化を示すグラフである。4匹のマウスのそれぞれの結果を示す。
【図12】処置なし、OVAを内包する対照のEYPCリポソーム、OVAを内包するMGlu70-Dex-C10リポソーム及びOVAを内包するMGlu24-Dex-C10リポソームをそれぞれ投与したE.G7-OVA細胞接種マウスにおける腫瘍サイズの変化を比較するグラフである。各群の結果は、4匹のマウスにおける腫瘍サイズの平均値を示す。
【発明を実施するための形態】
【0012】
本明細書において、「pH応答性リポソーム」とは、中性以上のpH条件下では安定であるが、弱酸性以下のpH条件下で、リポソーム膜で囲まれた閉鎖空間に内包された物質の一部又は全部をリポソーム膜外に放出できるリポソームのことをいう。この内包物の放出は、リポソーム膜自体を不安定化するリポソームの能力、リポソーム膜が別の脂質二重膜などと融合することによるリポソームの膜融合性の増加のいずれか又は両方によるものであると考えられる。
【0013】
本明細書において、「弱酸性以下のpH条件」とは、pH6.9以下、より好ましくはpH6.7以下、さらにより好ましくはpH6.6以下、さらにより好ましくはpH6.5以下、さらにより好ましくはpH6.4以下、さらにより好ましくはpH6.3以下、さらにより好ましくはpH6.2以下、さらにより好ましくはpH6.1以下、さらにより好ましくはpH6.0以下のことをいう。また、本発明のリポソームが内包物を放出できるpH条件の下限としては、特に限定されないが、生体内で生じ得るpH条件が考えられ、それは、通常、pH4以上、より好ましくはpH4.5以上である。
【0014】
本明細書において、「内包物の一部」とは、リポソーム膜で囲まれた閉鎖空間に内包された物質の少なくとも10%、より好ましくは少なくとも15%、さらにより好ましくは少なくとも20%、さらにより好ましくは少なくとも30%、さらにより好ましくは少なくとも40%、さらにより好ましくは少なくとも50%、さらにより好ましくは少なくとも60%、さらにより好ましくは少なくとも70%、さらにより好ましくは少なくとも80%、さらにより好ましくは少なくとも90%、さらにより好ましくは少なくとも95%、最も好ましくは少なくとも99%のことである。
【0015】
本明細書において、「リポソーム膜に保持する」とは、保持される成分の少なくとも一部分がリポソーム膜を構成する膜脂質成分中に疎水性相互作用などにより埋め込まれている状態のことをいう。
本明細書において、「生体(に)由来(する)」とは、天然に生体内で見出されることをいう。
【0016】
<pH応答性物質>
本発明のpH応答性リポソームは、少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持する。pH応答性物質は、カルボキシル基含有多糖由来部分が有するカルボキシル基が弱酸性以下のpHでプロトン化されて多糖が脂質二重膜と相互作用することが可能になる。よって、弱酸性以下のpHでは、pH応答性リポソーム膜が不安定化され、かつ/又はpH応答性リポソームが取り込まれたエンドソーム及びリソソームの膜構造を不安定化でき、かつ/又はエンドソーム及びリソソームの膜とpH応答性リポソームの膜とが融合することが可能になる。また、pH応答性物質は、疎水性部分の少なくとも一部分がリポソームの脂質二重膜と疎水性相互作用などにより結合することにより、リポソーム膜に保持される。
【0017】
カルボキシル基含有多糖由来部分は、カルボキシル基を有する生体に由来する多糖及び生体由来多糖を用いて得られるカルボキシル基含有半合成多糖から選択されるカルボキシル基含有多糖に由来する。カルボキシル基含有生体由来多糖としては、グルクロン酸、ガラクツロン酸、マンヌロン酸などのウロン酸を分子内に持つ化合物、例えばヒアルロン酸、コンドロイチン、ペクチン、ヘパリン、キサンタンガム、アラビアゴム、グアーガム、へパラン硫酸、アルギン酸及びそれらの誘導体が挙げられる。カルボキシル基含有半合成多糖は、多糖が有するヒドロキシ基にエーテル結合によりカルボキシル基を導入したもの(例えばカルボキシメチルセルロース、カルボキシメチルキチン、カルボキシメチルデンプン、カルボキシメチルデキストランなど)、ヒドロキシ基にエステル結合によりカルボキシル基を導入したもの(例えば、多糖とジカルボン酸とのアシル化反応生成物)、ヒドロキシ基にウレタン結合やカーボネート結合によりカルボキシル基を導入したものなどが挙げられる。カルボキシル基の量を調整できる点で、カルボキシル基含有多糖は、カルボキシル基含有半合成多糖が好ましい。
【0018】
カルボキシル基含有半合成多糖が由来する多糖は、単糖(ポリヒドロキシアルデヒド及びポリヒドロキシケトン)又はその誘導体(例えばアセチルグルコサミン)がグリコシド結合で連結された構造を有する分子であれば特に限定されず、ホモ多糖及びヘテロ多糖のいずれであってもよい。多糖は、好ましくは、生体由来多糖又はその派生物である。生体由来多糖としては、例えばデンプン、アミロース、アミロペクチン、ペクチン、キシラン、マンナン、ガラクタン、デキストラン、デキストリン、シクロデキストリン、キチン、ヒアルロン酸、コンドロイチン、ペプチドグリカン類、アルギン酸、プルラン、グリコーゲン、βグルカン(セルロース、レンチナン、ラミナラン、カロース、カードラン、シゾフィラン)などが挙げられる。生体由来多糖の派生物としては、例えばこれらの多糖の分解産物などが挙げられる。
【0019】
多糖としてマンナンを用いる場合、細胞がマンノースレセプターを有するので、このようなpH応答性物質で修飾されたリポソームは、細胞により認識されて取り込みが促進されると考えられる。よって、マンナンは、本発明において好ましい多糖の1つである。同様の理由から、細胞がそれに対する認識レセプターを有すると考えられる多糖を用いると、リポソームの取り込みが促進されると考えられるので、このような実施形態が好ましい。また、カードランやシゾフィランは、アジュバント効果(免疫賦活化効果)を有することが知られているので、このような多糖を用いる実施形態は、本発明のリポソームをワクチンとして用いる場合に好ましい。
【0020】
カルボキシル基含有多糖部分の分子量は、特に限定されないが、取り扱い及び入手が容易な点で、1,000〜40,000,000であり、より好ましくは5,000〜250,000である。
【0021】
カルボキシル基含有半合成多糖において、多糖が有する全てのヒドロキシ基の数に対するカルボキシル基と結合したヒドロキシ基の数を表すカルボキシル基結合率(%)は、100%が好ましいが、上限は95%であってもよく、例えば90%であってもよく、80%であってもよい。また、下限は、10%であってもよく、20%であってもよく、30%であってもよい。このような結合率は、実施例に示すように、1H-NMRを用いて決定できる。
以下の実施例に示すように、カルボキシル基結合率を調節することにより、pH応答性リポソームが内包物を放出するpHを調節できると考えられる。
【0022】
多糖のヒドロキシ基にエステル結合によりカルボキシル基を導入したカルボキシル基含有半合成多糖としては、多糖とジカルボン酸無水物又はハロゲン化ジカルボン酸とのアシル化反応生成物が挙げられる。用い得るジカルボン酸は、HOOC−R1−COOH(R1は、結合手、主鎖部分の炭素数が1〜10で直鎖状若しくは分岐鎖状であってよいアルキレン基(分岐鎖の炭素数は1〜4である)、環状部分の炭素数が3〜10で、置換されていてもよいシクロアルキレン基(置換基は炭素数1〜4のアルキル基である)、炭素数1〜4のアルキル基で置換されていてもよいフェニレン基、炭素数1〜4のアルキル基で置換されていてもよいフェニルアルキレン基(フェニルアルキレン基のアルキル部分の炭素数は1〜4である)で表されるジカルボン酸である。このようなジカルボン酸としては、シュウ酸、マロン酸、コハク酸、グルタル酸、2-若しくは3-メチルグルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、o−、m−若しくはp−フタル酸、1,2-、1,3-若しくは1,4-シクロヘキサンジカルボン酸、及び不飽和結合を持つジカルボン酸(マレイン酸、フマル酸、シトラコン酸、メサコン酸、2−ペンテン二酸、メチレンコハク酸、アリルマロン酸、イソプロピリデンコハク酸、2,4−ヘキサジエン二酸、アセチレンジカルボン酸など)などが挙げられる。
【0023】
多糖のヒドロキシ基にエーテル結合によりカルボキシル基を導入したカルボキシル基含有半合成多糖も、当該技術において公知の方法により製造できる。また、このような物質は、工業的にも製造されているので、市販品をカルボキシル基含有多糖として本発明において用いることもできる。
【0024】
pH応答性物質が有する疎水性部分は、pH応答性物質をリポソーム膜に保持するように機能する部分である。
よって、疎水性部分は、脂質二重膜に保持され得る疎水性基であればよい。脂質二重膜に保持され得る疎水性基としては、例えば主鎖の炭素数が6〜22で直鎖状又は分岐鎖状の脂肪族基、環状部分の炭素数が合計で19〜29、好ましくは19〜27の脂環式基(これらの脂肪族基及び脂環式基は、窒素原子、酸素原子などのヘテロ原子を有してもよく、不飽和結合を含んでいてもよい)、リン脂質に由来する基などが挙げられる。
上記の脂肪族基としては、主鎖の炭素数が6〜22の直鎖状又は分岐鎖状のアルキル基、主鎖の炭素数が6〜22で1〜4個の不飽和結合を有する直鎖状又は分岐鎖状のアルケニル又はアルキニル基などが挙げられる。上記の脂環式基としては、ステロール骨格を有する基(例えばコレステリル基)が挙げられる。リン脂質に由来する基としては、ホスファチジルエタノールアミン、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロールなどのリン脂質に由来する基が挙げられる。これらのリン脂質の構成脂肪酸としては、ミリスチン酸、パルミチン酸、ステアリン酸、アラキドン酸、オレイン酸、リノール酸、リノレン酸などが挙げられる。
【0025】
疎水性部分は、カルボキシル基含有多糖のヒドロキシ基に結合してもよく(すなわち多糖の主鎖に結合する)、カルボキシル基含有多糖のカルボキシル基に結合してもよい(すなわち多糖の側鎖に結合する)。
よって、疎水性部分とカルボキシル基含有多糖由来部分との間の結合は、エーテル結合、ウレタン結合、尿素結合、エステル結合、アミド結合及びカーボネート結合から選択できる。
【0026】
pH応答性物質は、カルボキシル基含有多糖と、疎水性基を有する物質とを、当業者に公知の反応により反応させて上記のいずれかの結合を形成させることにより得ることができる。
【0027】
カルボキシル基含有多糖が有するカルボキシル基の全数に対する疎水性部分と結合したカルボキシル基の数で表されるアンカー率(%)は、1〜20%が好ましく、5〜15%がより好ましい。このような結合率は、実施例に示すように、1H-NMRを用いて決定できる。
【0028】
上記の反応において、反応させるカルボキシル基含有多糖と疎水性基を有する物質との重量比は、pH応答性物質に導入される疎水性基の所望の量に応じて、適宜選択できる。
【0029】
<pH応答性リポソーム>
本発明のpH応答性リポソームは、上記のpH応答性物質を保持してなる。
pH応答性リポソームの粒径は、動的光散乱(25℃及び40℃)により測定して、0.03〜10μmが好ましく、より好ましくは0.05〜0.2μm、さらにより好ましくは0.05〜0.15μmである。
pH応答性リポソームは、上記の範囲の粒径を有していれば、一層の脂質二重膜からなる単層リポソーム、又は複数の脂質二重層からなる多重層リポソームのいずれであってもよい。
【0030】
pH応答性リポソームを構成するリポソーム膜構成脂質は、リポソームに通常用いられる両親媒性の脂質を用いることができる。このような脂質としては、例えばホスファチジン酸、ホスファチジルエタノールアミン、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルグリセロール、ホスファチジルイノシトール、カルジオリピン、スフィンゴミエリン、大豆ホスファチジルコリン、卵黄ホスファチジルコリンなどのリン脂質が挙げられる。これらのリン脂質の構成脂肪酸としては、ミリスチン酸、パルミチン酸、ステアリン酸、アラキドン酸、オレイン酸、リノール酸、リノレン酸などが挙げられる。これらは単独で又は2種以上組み合わせて使用できる。特に、ホスファチジルコリン、ホスファチジルエタノールアミンが好ましい。
【0031】
また、リポソーム膜構成脂質としては、上記のリン脂質の他に、公知のカチオン性の合成脂質を用いることもできる。このようなカチオン性の合成脂質としては、例えばN−(α−トリメチルアンモニオアセチル)−ジドデシルグルタメート、N−〔1−(2,3−ジオレイルオキシ)プロピル〕−N,N,N−トリメチルアンモニウムクロリド及び1,2−ビス(オレオイルオキシ)−3−(トリメチルアンモニオ)プロパンなどの第4級アンモニウム塩が挙げられる。これらの脂質は、単独で又は2種以上組み合わせて用いることができる。
リポソーム膜構成脂質には、コレステロール、ラノステロール、エルゴステロールなどのステロールが含まれていてもよい。
【0032】
本発明のpH応答性リポソームにおいて、リポソームの膜構成脂質とpH応答性物質との重量比は、1:0.01〜10が好ましく、より好ましくは1:0.05〜9であり、さらにより好ましくは1:0.1〜1である。
【0033】
pH応答性リポソームは、そのpH応答性が損なわれないことを条件として、上記の膜構成脂質以外のリポソームの構成成分として通常用い得る成分を含むこともできる。リポソームの構成成分として通常用い得る成分としては、例えばポリエチレングリコール脂質、ガングリオシドのような糖脂質などが挙げられる。
【0034】
pH応答性リポソームは、上記のpH応答性物質とリポソーム膜構成脂質と所望により上記のリポソームの構成成分として通常用い得る成分とを用いて、それ自体公知のリポソームの製造方法により得ることができる。
それ自体公知のリポソームの製造方法としては、エクストルーダー法、超音波法、フレンチプレス法などが挙げられる。
【0035】
例えば、エクストルーダー法によりpH応答性リポソームを製造する方法について説明する。所定量のリポソーム膜構成脂質を、クロロホルム、メタノール、ヘキサンなどの適当な有機溶媒に溶解させた溶液をエバポレーターに入れて溶媒を除去し、容器壁に薄膜を形成させる。ここに、pH応答性物質を上記のような適当な有機溶媒に溶解させた溶液を入れ、エバポレーターで溶媒を除去し、混合薄膜を形成させる。この膜は、さらに3〜12時間程度真空乾燥させることが好ましい。次いで、この容器内に緩衝液などの適当な溶液を投入し、超音波処理又はボルテックスミキサーなどを用いて強く攪拌することによりリポソームを形成させることができる。得られたリポソーム分散液をエクストルーダーに通し、そのフィルタ孔径を適宜設定することにより、リポソームの粒径を調節することができる。
【0036】
上記のようにして得られたリポソーム分散液から、リポソームに含まれなかったリポソーム膜構成脂質などを、ゲルろ過法、超遠心法、透析法などにより除去することができる。除去したい物質が電荷を有する場合には、イオン交換クロマトグラフィーを用いることもできる。
【0037】
また、リポソーム膜構成成分を用いて上記のようなエクストルーダー法などにより予めリポソームを形成させた後に、pH応答性物質の溶液を加えて、pH応答性物質をリポソーム膜に保持させることもできる。
【0038】
<pH応答性薬剤放出システム>
上記のpH応答性リポソームと薬剤とからなるpH応答性薬剤放出システムも、本発明の一つである。
上記の薬剤は、親水性物質及び疎水性物質のいずれであってもよい。親水性物質である場合は、薬剤は、pH応答性リポソームの内部の閉鎖空間の親水性領域に内包され、疎水性物質である場合は、pH応答性リポソーム膜に保持されることとなる。
【0039】
上記の薬剤は、抗癌剤、サイトカイン、抗生物質、抗ウイルス剤、抗炎症剤、核酸、抗原(免疫原、ワクチン)など、リポソームを用いて送達し得る薬剤であれば特に限定されない。特に、本発明のpH応答性リポソームの特性を考慮すると、樹状細胞の細胞質へ特異的に送達して細胞性免疫を誘導するための抗原(免疫原、ワクチン)であることが有利である。
このような抗原は、当該技術において知られている疾患を予防及び/又は治療するための抗原であってよく、例えば癌抗原(例えば癌胎児抗原(CEA)、WT1、HER2、MAGE、MART-1、gp100、チロシナーゼ、α−フェトプロテイン(AFP)、AFPレクチン分画(AFP-L3%)、ヒト絨毛性ゴナドトロピン(hCG)、塩基性フェトプロテイン(BFP)、扁平上皮癌関連抗原(SCC抗原)、BCA225、CA15-3、CA19-9、CA50、CA54/61、CA72-4、CA125、CA130、CA602、シアリルLex抗原(CSLEX)、膵癌関連糖タンパク抗原(DUPAN-2)、KMO-1、NCC-ST-439、シアリルLex-i抗原(SLX)、Span-1、シアリルTn抗原(STN)、サイトケラチン19フラグメント(CYFRA)、組織ポリペプチド抗原(TPA)、免疫抑制酸性タンパク質(IAP)、I型コラーゲンCテロペプチド(ICTP)、I型コラーゲン架橋Cテロペプチド(CTx)、膀胱腫瘍抗原(BTA)、核マトリクスプロテイン22 (NMP22)、PIVKA-II、前立腺特異抗原(PSA)、妊娠特異タンパク(SP1)、神経特異エノラーゼ(NSE)、フェリチン、エラスターゼ1、p53抗体、ガストリン放出ペプチド前駆体(ProGRP)、前立腺酸性ホスファターゼ(PAP)、アルカリホスファターゼ(ALP)、胎盤性ALP (PL-ALP)、癌関連ガラクトース転移酵素(GAT)、乳酸脱水素酵素(LDH)、ペプシノゲン(PG) I/II比、erbB-2、γ−セミノプロテイン(γ-Sm)、Dpyr、ポリアミン、カテコールアミン、バニリルマンデル酸(VMA)、BJPなど)、感染疾患治療用の抗原(例えば感染性細菌、真菌及びウイルス由来の抗原など)などが挙げられる。
【0040】
上記の抗癌剤としては、シスプラチン、カルボプラチン、テトラプラチン、イプロプラチンなどの金属錯体;アドリアマイシン(ADR)、マイトマイシン、アクチノマイシン、アンサマイトシン、ブレオマイシン、Ara-C、ダウノマイシンなどの制癌抗生物質;5-FU、メトトレキセート、TAC-788などの代謝拮抗剤;BCNU、CCNUなどのアルキル化剤;インターフェロン(α、β、γ)、各種インターロイキンなどのリンホカインなどが挙げられる。また、抗炎症剤としては、プレドニン、リンデロン、セレスタミンなどが挙げられる。
【0041】
上記の核酸としては、例えば、重症複合型免疫不全症の治療のためのアデノシンデアミナーゼ遺伝子、家族性高コレステロール血症の治療のためのLDL受容体遺伝子、癌治療のためのインターフェロン(IFN)−α、β又はγ遺伝子、顆粒球マクロファージコロニー刺激因子(GM-CSF)遺伝子、各種インターロイキン(IL)遺伝子、腫瘍壊死因子(TNF)−α遺伝子、リンホトキシン(LT)−β遺伝子、顆粒球コロニー刺激因子(G-CSF)遺伝子、T細胞活性化共刺激因子遺伝子などが挙げられる。その他、アルツハイマー病、脊椎損傷、パーキンソン病、動脈硬化症、糖尿病、高血圧症などの治療のための遺伝子も挙げられる。
上記の薬剤の量は特に限定されず、薬剤の種類などにより適宜選択することができる。
【0042】
上記のpH応答性薬剤放出システムの製造において、pH応答性リポソームに薬剤を含有させる方法としては、薬剤の種類に応じて公知の方法を用いることができる。該方法としては限定されないが、例えば上記のpH応答性リポソームの製造方法に従ってpH応答性リポソームを形成させた後に、薬剤を含む溶液に該リポソームを浸漬させて薬剤をリポソームの内部に取り込ませる方法、上記のpH応答性リポソームの製造方法において薄膜が形成された容器内に、薬剤を含む溶液を投入した後にリポソーム膜構造を形成させて薬剤を封入する方法などが挙げられる。
【0043】
本発明のpH応答性薬剤放出システムは、さらに少なくとも1種の医薬添加剤を含むのが好ましい。該pH応答性薬剤放出システムは、錠剤、粉末、カプセルなどの固形製剤の形態、注射製剤、点眼剤、点鼻薬のような液体製剤の形態、パッチ、パスタ剤、ゲルのような塗布/貼付製剤の形態などのいずれであってもよい。該液体製剤は、用時に水又は他の適切な賦形剤で再生する乾燥製品として提供してもよい。
【0044】
上記の錠剤及びカプセルは、通常の方法により腸溶コーティングを施すことが望ましい。腸溶コーティングとしては、当該分野において通常用いられるものを利用できる。また、カプセルは粉末又は液体のいずれを含有することもできる。
【0045】
上記のpH感受性薬剤放出システムが液体製剤である場合、医薬添加剤は、担体(例えば生理食塩水、滅菌水、緩衝液など)、膜安定剤(例えばコレステロールなど)、等張化剤(例えば塩化ナトリウム、グルコース、グリセリンなど)、抗酸化剤(例えばトコフェロール、アスコルビン酸、グルタチオンなど)、防腐剤(例えばクロルブタノール、パラベンなど)などを含み得る。上記の担体は、pH応答性リポソームを製造する際に用いる溶媒であり得る。
【0046】
上記のpH応答性薬剤放出システムが固形製剤である場合、医薬添加剤は、賦形剤(例えば乳糖、ショ糖のような糖類、トウモロコシデンプンのようなデンプン類、結晶セルロースのようなセルロース類、アラビアゴム、メタケイ酸アルミン酸マグネシウム、リン酸カルシウムなど)、滑沢剤(例えばステアリン酸マグネシウム、タルク、ポリエチレングリコールなど)、結合剤(例えばマンニトール、ショ糖のような糖類、結晶セルロース、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロースなど)、崩壊剤(例えば馬鈴薯澱粉のようなデンプン類、カルボキシメチルセルロースのようなセルロース類、架橋ポリビニルピロリドンなど)、着色剤、矯味矯臭剤などを含み得る。
【0047】
上記のpH応答性薬剤放出システムが塗布/貼付製剤である場合、医薬添加剤は、溶剤(例えば水、グリセリン、アルコールなど)、基剤(例えばアルギン酸ナトリウムのような親水性ポリマーなど)、乳化剤(例えば界面活性剤など)などを含み得る。
【0048】
上記のpH応答性薬剤放出システムは、上記の薬剤を含むpH応答性リポソームをそのまま、又は凍結乾燥させて、上記の医薬添加剤と混合することにより製造することができる。薬剤を含むpH応答性リポソームを凍結乾燥する場合、凍結乾燥する前に適当な賦形剤を添加しておくのがよい。
【0049】
上述したように、本発明のpH応答性リポソームは、弱酸性以下のpHでその内包物を放出できるので、例えば細胞性免疫を誘導するために特に樹状細胞の細胞質へ目的の抗原を送達することができる。
よって、本発明は、対象者に、上記のpH応答性薬剤放出システムの有効量を投与することを含む、対象者に細胞性免疫を誘導する方法も提供する。
上記の対象者は、哺乳動物が好ましく、特に好ましくはヒトである。
細胞性免疫を誘導する対象者としては、細胞性免疫を誘導することにより治療され得る免疫疾患に罹患した対象者又は免疫疾患を予防することを意図する対象者が好ましい。このような免疫疾患としては、癌、ウイルス感染などが挙げられる。
【0050】
上記のpH応答性薬剤放出システムは、非経口及び経口経路のいずれによっても投与することができる。非経口経路としては、当該技術において公知の非経口経路による投与を用いることができ、静脈注射、経皮投与、経鼻投与などが挙げられる。
上記のpH応答性薬剤放出システムの投与量は、対象者の疾患の重篤度及びリポソームに含有される薬剤の量に応じて適宜選択することができる。
【実施例】
【0051】
本発明を、以下の実施例を用いてより詳細に説明するが、本発明は以下の実施例により何ら限定されるものではない。
【0052】
1.pH応答性物質の製造
多糖としてデキストラン又はマンナンを用い、ジカルボン酸として3-メチルグルタリル酸を用い、疎水性基としてデシル基を用いて、以下のような手順でpH応答性物質を製造した。
1-1.試薬
デキストラン(デキストラン70)及びn-デシルアミンは東京化成工業から購入した。マンナン(マンナン、Saccharomyces cerevisiae由来)及び3-メチルグルタリル酸無水物はSigmaから購入した。LiClはナカライテスクから購入した。4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチルモルホリニウムクロライドn-水和物(DMT-MM)、ジメチルホルムアミド(DMF)、炭酸水素ナトリウム及びリン酸水素二ナトリウムは和光純薬工業から購入した。透析膜はSpectra/Por 6 (分画分子量 10000, FE-0526-33)をSpectrum Laboratories Inc.から購入した。
【0053】
1-2.合成
1-2-1.デキストランとジカルボン酸無水物との反応
デキストラン(分子量(Mw):70000)とLiClをDMFに溶解させ、そこに3-メチルグルタリル酸無水物を加え、120℃、アルゴン雰囲気下で24時間撹拌を行った。ロータリーエバポレーターにより溶媒を減圧留去した後、炭酸水素ナトリウム水溶液で中和し、3日間透析することで未反応の3-メチルグルタリル酸を除去し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量は、以下の表1に記載する。
得られた化合物を、メチルグルタリル化デキストラン、MGlu-Dexと称する。
【0054】
1-2-2.疎水性基との反応
得られたMGlu-Dexを蒸留水に溶解させ、そこにn-デシルアミンを加えた。1.0M HCl溶液を用いてpHを7.4に調整した。ここにDMT-MMを加え、アルゴン雰囲気下、室温遮光下で3日間撹拌した。pHを7.4に調整して透析により精製し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量を、以下の表2に記載する。
得られた化合物を、MGlu-Dex-C10と称する。
【0055】
1-2-3.マンナンとジカルボン酸無水物との反応
マンナン(Mw:55000)とLiClをDMFに溶解させ、そこに3-メチルグルタリル酸無水物を加え、120℃、アルゴン雰囲気下で24時間撹拌を行った。ロータリーエバポレーターにより溶媒を減圧留去した後、炭酸水素ナトリウム水溶液で中和し、3日間透析することで未反応の3-メチルグルタリル酸を除去し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量を、以下の表3に記載する。
得られた化合物を、メチルグルタリル化マンナン、MGlu-Manと称する。
【0056】
1-2-4.疎水性基との反応
得られたMGlu-Manを蒸留水に溶解させ、そこにn-デシルアミンを加えた。1.0M HCl溶液を用いてpHを8.0に調整した。ここにDMT-MMを加え、アルゴン雰囲気下、室温遮光下で3日間撹拌した。pHを8.0に調整して透析により精製し、一晩凍結乾燥して白色固体を得た。化合物の同定は1H-NMRによって行った。用いた試薬の量を、以下の表4に記載する。
得られた化合物を、MGlu-Man-C10と称する。
【0057】
1-3.分析
1-3-1.デキストランを用いたpH応答性物質の分析
まず、MGlu-Dexの合成について、用いた試薬の量、収量、収率及びMGlu基の導入率を以下の表1に示す。
3-メチルグルタリル酸無水物の量を調整することで、MGlu基の導入率の異なる2種類の多糖を合成できたことがわかる。
化合物の同定を行った1H-NMRチャートを、表1のAのものを図1Aに、表1のBのものを図1Bにそれぞれ示す。ピークa〜fは、デキストランがもつプロトンのピークである。これに、MGlu基の持つプロトンのピークg及びhが併せて存在することから、多糖がメチルグルタリル化されたことが確認できる。
なお、MGlu基の導入率については、b〜fの積分値を基準にとり、その値に対するg及びhの積分値から算出した。すなわち、これは、多糖が有するヒドロキシル基の何%にメチルグルタリル基が導入されたかを表す。
【0058】
【表1】

【0059】
次に、MGlu-Dex-C10の合成について、用いた試薬の量、収量、収率、並びにMGlu基及び疎水性基(以下、アンカーともいう)の導入率を以下の表2に示す。
表1で示した2種類のMGlu-DexA、Bに、それぞれアンカーを導入した。
化合物の同定を行った1H-NMRチャートを、表2のAのものを図2Aに、表2のBのものを図2Bに示す。
デキストランのもつプロトンのピーク(a〜f)、MGlu基のピーク(g、h)に加え、新たにi〜kのデシル鎖に由来するプロトンのピークが確認されたことから、アンカーが導入されたことが確認できた。
なお、アンカーの導入率は、MGlu基のピーク(g、h)の積分値を基準にとり、その値に対するi〜kの積分値から算出した。すなわち、これは、メチルグルタリル酸に由来するカルボキシル基の何%に疎水性基が導入されたかを表す。
以下において、表2のAのpH応答性物質をMGlu70-Dex-C10、BのものをMGlu24-Dex-C10と称する。
【0060】
【表2】

【0061】
1-3-2.マンナンを用いたpH応答性物質の分析
MGlu-Manの合成について、用いた試薬の量、収量、収率及びMGlu基の導入率を以下の表3に示す。
1-3-1と同様に、3-メチルグルタリル酸無水物の量を調整することで、MGlu基の導入率の異なる2種類の多糖を合成できたことがわかる。
化合物の同定を行った1H-NMRチャートを、表3のCのものを図3Aに、表3のDのものを図3Bにそれぞれ示す。ピークa〜fは、マンナンのもつプロトンのピークである。これに、MGlu基の持つプロトンのピークg及びhが併せて存在することから、多糖がメチルグルタリル化されたことが確認できる。
なお、MGlu基の導入率については、上記と同様に、b〜fの積分値を基準にとり、その値に対するg及びhの積分値から算出した。
【0062】
【表3】

【0063】
次に、MGlu-Man-C10の合成について、用いた試薬の量、収量、収率並びにMGlu基及びアンカーの導入率を以下の表4に示す。
表4で示した2種類のMGlu-ManA、Bに、それぞれアンカーを導入した。
化合物の同定を行った1H-NMRチャートを、表4のCのものを図4Aに、表4のDのものを表4Bに示す。
これに関しても1-3-1と同様に、マンナンのもつプロトンのピーク(a〜f)、MGlu基のピーク(g、h)に加え、新たにi〜kのデシル鎖に由来するプロトンのピークが確認されたことから、アンカーが導入されたことが確認できた。
なお、アンカーの導入率は、MGlu基のピーク(g、h)の積分値を基準にとり、その値に対するi〜kの積分値から算出した。
以下において、表4のCのものをMGlu57-Man-C10、DのものをMGlu68-Man-C10と称する。
【0064】
【表4】

【0065】
2.pH応答性リポソームの製造及び分析
1.で作製したpH応答性物質を用いて、pH応答性リポソームを以下のような手順で製造した。また、製造したpH応答性リポソームのpH応答性を評価し、DC2.4細胞内での挙動を検討した。さらに、モデル抗原を内包したpH応答性リポソームをマウスに投与して、生体内での免疫誘導を試みた。
【0066】
2-1.試薬
卵黄ホスファチジルコリン(EYPC、COATSOME NC-50)は日本油脂より提供された。ローダミン-PE (Rh-PE)はAvanti Polar Lipid社から購入した。パイラニン(Pyranine)は東京化成工業から購入した。DPX (p-キシレン-ビス(N-ピリジニウムブロミド))はInvitrogenから購入した。リン酸水素二ナトリウム(12水和物) (Na2HPO4・12H2O)、Triton X-100はキシダ化学株式会社から購入した。ベンジルペニシリンカリウム、ストレプトマイシン硫酸塩は和光純薬工業より購入した。RPMI-1640液体培地はSigmaより、ウシ胎児血清(FBS)はMP Biomedical, Inc.から購入した。2-メルカプトエタノール、ピルビン酸ナトリウム溶液、Minimum Essential Medium非必須アミノ酸溶液はGIBCOより購入した。OVA(オブアルブミン)、MPL(モノホスホリルリピッドA)はSigmaより購入した。
【0067】
2-2.マウス
C57BL/6Nマウスはオリエンタル酵母工業(株)より購入し、通常の施設にて飼育及び維持した。動物実験は、大阪府立大学動物実験規定に基づき行った。
【0068】
2-3.pH応答性リポソームの製造とそのpH応答性評価
2-3-1.MGlu-Dex-C10を保持するpH応答性リポソームの製造
EYPC(10 mg/ml)クロロホルム溶液を所定量採り、ロータリーエバポレーターにより溶媒を除去し薄膜を形成した。MGlu-Dex-C10(10 mg/ml)メタノール溶液を所定量加え、ロータリーエバポレーターにより溶媒を除去し混合薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。薄膜の脂質量1.25×10-5molに対して、組成がパイラニン35 mM、DPX 50 mM、Na2HPO4 25 mM、pH 7.4の溶液を480μl加え分散し、バス型超音波照射装置により超音波を2分間照射して薄膜を剥がした。NaOH及びHClを用いてpH7.4に調整した。凍結融解を5回行い、エクストルーダーに膜孔100 nmの膜を挟み、リポソーム溶液を15回通すことによって、リポソーム粒径を100 nmにそろえた。リポソームを、Sepharose4Bを充填させたカラムにより精製した。外相にはPBS溶液pH7.4を使用した。
【0069】
2-3-2. MGlu-Man-C10を保持するpH応答性リポソームの製造
2-3-2-1. EYPCリポソームの作製
EYPC(10 mg/ml)クロロホルム溶液を所定量採り、ロータリーエバポレーターにより溶媒を除去し薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。薄膜の脂質量1.25×10-5molに対して、組成がパイラニン35 mM、DPX 50 mM、Na2HPO4 25 mM、pH 7.4の溶液を480μl加え分散し、バス型超音波照射装置により超音波を2分間照射し薄膜を剥がした。NaOH及びHClを用いてpH7.4に調製した。凍結融解を5回行い、エクストルーダーに膜孔100 nmの膜を挟み、リポソーム溶液を15回通すことによって、リポソーム粒径を100 nmにそろえた。リポソームを、Sepharose4Bを充填させたカラムにより精製した。外相にはPBS溶液pH7.4を使用した。
【0070】
2-3-2-2. MGlu-Man-C10を保持するリポソームの製造
上記のEYPCリポソーム1mmolに対してMGlu-Man-C10が7.82×10-2 mmolとなるように加えて、pH8.5のPBS 溶液中で1時間静置した。その後、混合溶液を、Sepharose4Bを充填させたカラムで精製した。外相にはPBS溶液pH8.5を使用した。
【0071】
2-3-3.脂質の定量
リン脂質の定量は、リン脂質Cテストワコー(和光純薬工業)を用いて、コリンオキシターゼ・DAOS(N-エチル-N-(2-ヒドロキシ-3-スルホプロリル)-3,5-ジメトキシアニリンナトリウム)法によって行った。試料溶液(リポソ―ム溶液)、ブランク溶液及び標準溶液をそれぞれ発色溶液と混合し、37℃で5分間インキュベートした。波長600 nmで試料溶液の吸光度を日本分光(株)製V-560型紫外・可視光光度計を用いて測定し、得られた吸光度から試料溶液中のリン脂質の濃度を決定した。
【0072】
2-3-4.リポソームのpH応答性評価
上記のようにして製造したパイラニン内包pH応答性リポソームから放出されるパイラニンを416 nmの光で励起し、発せられる蛍光を512 nmで測定することにより、pH応答性リポソームのpH及び温度応答性の評価を行った。
石英セル内に、各pHに調製したPBS溶液を加え、蛍光分光光度計内に設置した。表示温度が37℃になったことを確認した後、蛍光分光光度計で石英セル内の脂質濃度が0.02 mMとなるようにリポソーム溶液を各pHに調整したPBSに加えた(最終体積2.5 ml)。10分間インキュベーションした時のパイラニンの放出量を調べた。最後に10%Triton X-100を25μl加えてリポソームを破壊した。そのときの蛍光強度を100%として、各リポソームからの内包物の放出割合を求めた。
蛍光強度の測定は、分光蛍光光度計(JASCO製 FP-6200、FP-6500)及び温度コントローラ(JASCO製 ETC-272T)を用いて37℃で行った。
【0073】
2-4. MGlu-Dex-C10を保持するpH応答性リポソームのDC2.4細胞への取り込み評価
2-4-1.細胞培養
マウス由来の樹状細胞の細胞培養株であるDC2.4細胞は、Dr. Rock (Harvard Medical School, USA)及びDr. Kadowaki (Kyoto University, Japan)から提供され、10% FBS、0.1 mg/mlベンジルペニシリンカリウム、0.1 mg/mlストレプトマイシン硫酸塩、2 mM L-グルタミン、0.1 mM MEM非必須アミノ酸溶液及び0.55 mM 2-メルカプトエタノールを含むRPMI-1640培地中、CO2インキュベーター内で、CO2濃度5%、37℃で培養した。
【0074】
2-4-2.パイラニン内包Rh-PEラベル化リポソームの作製
上記と同様のリポソームの製造工程において、ローダミン-PE(0.5 mg/ml)クロロホルム溶液を、各リポソーム構成膜脂質の全脂質量に対して0.1モル%加え、ロータリーエバポレーターで溶媒を除去し薄膜を形成させ、4時間真空乾燥することで溶媒を完全に除去した。それぞれの薄膜の脂質量1.25×10-5molに対して、組成がパイラニン47.5mM、Na2HPO4 25mM、pH7.4の溶液を960μl加え分散し、バス型超音波照射装置により超音波を2分間照射し薄膜を剥がした。凍結融解を5回行い、エクストルーダーに膜孔100 nmの膜を挟み、リポソーム溶液を15回通すことによって、リポソーム粒径を100 nmにそろえた。リポソームを、Sepharose4Bを充填させたカラムにより精製した。外相にはPBS溶液pH7.4を使用した。
【0075】
2-4-3.共焦点レーザー顕微鏡によるリポソームの細胞内挙動の観察
pH応答性リポソームのDC2.4細胞内での動態を、レーザー共焦点顕微鏡にて観察した。DC2.4細胞を松並ガラスボトムディッシュ1穴当たり2×105個になるように撒き、血清含有RPMI培地(2ml)中、37℃で二晩培養した。その後、HBSS (Hanks' Balanced Salt Solution)で細胞を2回洗浄し、血清含有RPMI培地を、リポソーム溶液添加後の全量が2mlとなるように加え、そこへリポソーム溶液を脂質濃度が0.5 mMとなるように加えた(全量2ml)。37℃で4時間インキュベーションすることで、リポソームを細胞に取り込ませた。HBSSで3回洗浄することで、細胞に取り込まれていないリポソームを除去し、新たにHBSSを加えてレーザー共焦点顕微鏡LSM 5 EXCITER(Carl Zeiss)による観察を行った。
【0076】
2-4-2.フローサイトメトリーによるリポソームの細胞への取り込み量の測定
DC2.4細胞を1×105/ウェルとなるように24ウェルプレートに播き、二晩培養した。HBSSで2回洗浄した後、血清含有RPMI培地をリポソーム溶液添加後の全量が1mlとなるように加え、そこへリポソーム溶液を脂質濃度が0.5mMとなるように加えた(全量1ml)。37℃で4時間インキュベーションすることで、リポソームを細胞に取り込ませた。HBSSで3回洗浄したのち、1穴につき300μlのトリプシン水溶液(トリプシン(DIFCO)250 mg、エチレンジアミン四酢酸二ナトリウム(EDTA)1mg、PBS 100 ml)を用いて細胞を剥離し、フローサイトメーター用のチューブに回収した。回収した細胞溶液について、フローサイトメーターBeckman Coulter.XLを用いて細胞の蛍光強度を測定し、細胞へのリポソームの取り込み量を評価した。
【0077】
2.5. MGlu-Dex-C10を保持するリポソームのマウスへの皮下投与による抗腫瘍効果
2-5-1.抗原内包リポソームの調製
抗原としてオブアルブミン(OVA)を内包するpH応答性リポソーム及び対照のリポソームを調製した。
EYPC(10 mg/ml)クロロホルム溶液を所定量採り、脂質1mol当たり4gのモノホスホリルリピッドA(MPL)をアジュバントとして加え、ロータリーエバポレーターにより溶媒を除去し薄膜を形成した。MGlu-Dex-C10(10 mg/ml)メタノール溶液を所定量加え、ロータリーエバポレーターにより溶媒を除去し混合薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。
対照としてのEYPCリポソームについて、EYPC(10 mg/ml)クロロホルム溶液を所定量加え、さらに脂質1mol当たり4gのMPLをアジュバントとして加え、ロータリーエバポレーターで溶媒を除去し薄膜を形成した。その後、4時間真空乾燥することで溶媒を完全に除去した。
それぞれの薄膜に、4mg/mlのオブアルブミン(OVA)のPBS溶液を適量加え、超音波照射によって脂質膜を剥がした。凍結融解を5回行い、Sepharose4Bカラムにより抗原内封リポソームの精製を行った。脂質の定量はテストワコーにより行った。
【0078】
2-5-2.マウスへのリポソームの皮下注射による腫瘍退縮実験
マウス1匹当たりに、OVAを抗原として発現する癌細胞であるE.G7-OVA細胞を1×106個、マウス左側部に担癌した。癌細胞の接種から7日後に100μgのOVAを含む各リポソームをマウス右側部に皮下投与し(各群4匹のマウス)、癌細胞の接種から14日後にも同様にOVAを含む各リポソームをマウス右側部に皮下投与した。その間、腫瘍サイズを測定した。
【0079】
2-6.結果
2-6-1.MGlu-Dex-C10を保持するpH応答性リポソームのpH応答性の評価
MGlu70-Dex-C10及びMGlu24-Dex-C10を保持し、パイラニンを内包するpH応答性リポソーム(以下、それぞれMGlu70-Dexリポソーム、MGlu24-Dexリポソームともいう)のパイラニン放出に対するpHの影響について検討した。
製造したMGlu70-Dexリポソーム及びMGlu24-Dexリポソームは、脂質とpH応答性物質との重量比(w/w)が以下のものである。
対照:EYPC/ MGlu70-Dex-C10 =10/0
実施例1:EYPC/ MGlu70-Dex-C10 =8/2
実施例2:EYPC/ MGlu70-Dex-C10 =7/3
実施例3:EYPC/ MGlu70-Dex-C10 =6/4
実施例4:EYPC/ MGlu70-Dex-C10 =5/5
実施例5:EYPC/ MGlu24-Dex-C10 =8/2
実施例6:EYPC/ MGlu24-Dex-C10 =7/3
実施例7:EYPC/ MGlu24-Dex-C10 =6/4
【0080】
上記の対照、MGlu70-Dexリポソーム及びMGlu24-Dexリポソームを各pHにおいて37℃で10分間インキュベーションしたときのパイラニン放出率の経時変化を、図5A〜Hに示す(それぞれ、順に対照及び実施例1〜7に対応する)。
なお、測定における脂質濃度は、2×10-5Mであった。
【0081】
pH応答性物質を保持していない対照のリポソーム(EYPCリポソーム)では、pHが変化しても内包物がリポソームから放出されない。このことから、リポソーム自体はpH応答性能がないことが分かる。
一方、pH応答性物質を保持するpH応答性リポソームはそれぞれ、高pH条件下では内包物が放出されないのに対し、pHが低下するとリポソームからの内包物の放出が見られる。これは、リポソーム表面のMGlu鎖のカルボキシル基がpH低下に伴いプロトン化することで、リポソーム膜の不安定化が誘起され、内包物の放出が起こったと考えられる。
また、MGlu70-DexリポソームとMGlu24-Dexリポソームにおいて、同じ脂質:pH応答性物質の重量比のものでは、MGlu70-Dexリポソームのほうがより高いpHにおいて内包物が放出されることがわかる。これは、リポソームを修飾しているカルボキシル基の量の違いによるか、又はMGlu70-DexリポソームとMGlu24-Dexリポソームの側鎖のカルボキシル基のpKa値が異なっていることによるのではないかと考えられる。
【0082】
次に、それぞれのリポソームの10分後のパイラニン放出率(%)をpHに対してプロットし、各リポソームのpH応答性を比較した。そのグラフを図6A及びBに示す。図6AがMGlu70-Dexリポソーム、図6BがMGlu24-Dexリポソームについてのグラフである。
なお、測定における脂質濃度は、2×10-5Mであった。
この結果から、リポソーム膜脂質に対するMGlu-Dex-C10の割合を変化させることで、得られるリポソームが内包物を放出し始めるpHが異なることが分かる。これは、リポソームに存在するカルボキシル基の量が異なるので、リポソーム膜を不安定化できるpH領域が違うからだと考えられる。
【0083】
2-6-2. MGlu-Man-C10を保持するpH応答性リポソームのpH応答性の評価
MGlu57-Man-C10及びMGlu68-Man-C10を保持するパイラニン内包リポソーム(以下、それぞれMGlu57-Manリポソーム及びMGlu68-Manリポソームともいう)のパイラニン放出に対するpHの影響について検討した。
製造したMGlu57-Manリポソーム及びMGlu68-Manリポソームは、脂質とpH応答性物質との重量比(w/w)が以下のものである。
対照:EYPC/ MGlu57-Man-C10 =10/0
実施例8:EYPC/ MGlu57-Man-C10 =1/5
実施例9:EYPC/ MGlu68-Man-C10 =1/5
【0084】
上記のMGlu57-Manリポソーム及びMGlu68-Manリポソームを各pHにおいて37℃で10分インキュベーションしたときのパイラニン放出率の経時変化を、図7A及びBにそれぞれ示す。
なお、測定における脂質濃度は、2×10-5Mであった。
【0085】
pH応答性物質を保持するpH応答性リポソームはそれぞれ高pH条件下では内包物が放出されないのに対し、pHが低下するとリポソームからの内包物の放出が見られる。これは、2-6-1でも述べたように、リポソーム表面のMGlu鎖のカルボキシル基がpH低下に伴いプロトン化することで、リポソーム膜の不安定化が誘起され、内包物の放出が起こったと考えられる。
【0086】
次に、それぞれのリポソームの10分後のパイラニン放出率(%)をpHに対してプロットし、各リポソームのpH応答性を比較した。その結果を図8に示す。MGlu57-Manリポソーム及びMGlu68-Manリポソームは、それぞれのpHによって、その放出率に大きな変化は見られず、どちらもpH6付近で内包物の放出が見られ始めた。どちらのリポソームも、カルボキシル基のプロトン化によって同程度の疎水度を持つためだと考えられる。
【0087】
2-6-3. MGlu-Dex-C10を保持するpH応答性リポソームのDC2.4細胞内での挙動
2-6-1のMGlu-Dex-C10リポソームのpH応答性評価の結果から、細胞内エンドソームのpH領域であるpH5〜6付近で本発明のリポソームがpH応答性を示すことが明らかになった。そこで、DC2.4細胞を用いて、モデル低分子薬物であるパイラニンの細胞質内への輸送について調べた。
【0088】
パイラニンを内包した種々のRh-PEラベル化リポソームを作製し、DC2.4細胞の培養液に加えて、その取り込みを共焦点レーザー顕微鏡で観察した。また、フローサイトメーターによりリポソームの取り込み量を評価した。
なお、作製したRh-PEラベル化リポソームの脂質とpH応答性物質との重量比(w/w)は、次のとおりである:
対照(EYPC):EYPC/ MGlu70-Dex-C10 =10/0
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =9/1
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =8/2
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =7/3
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =6/4
EYPC/ MGlu70-Dex-C10又はMGlu24-Dex-C10 =5/5
EYPC/ MGlu24-Dex-C10又はMGlu24-Dex-C10 =8/2
EYPC/ MGlu24-Dex-C10又はMGlu24-Dex-C10 =7/3
EYPC/ MGlu24-Dex-C10又はMGlu24-Dex-C10 =6/4
【0089】
対照のEYPCリポソームと各MGlu70-Dex-C10リポソーム、及び対照のEYPCリポソームと各MGlu24-Dex-C10リポソームの共焦点レーザー顕微鏡での観察結果を、それぞれ図9A及びBに示す。
Rh-PEの蛍光については、いずれのリポソームで処理した細胞においても蛍光が輝点状に観察される。このことから、すべてのリポソームがDC2.4細胞内に取り込まれたことが示唆される。
次に、パイラニンの蛍光は、細胞全体に広がって見える。特に、MGlu-Dex-C10リポソームとインキュベートした細胞では、対照リポソームとインキュベートした細胞よりも強い蛍光が観察される。これはリポソームに内包されたパイラニンがエンドソーム内から細胞質中に放出されたことを示しており、MGlu-Dex-C10リポソームが、対照リポソームと比較して、より効率良く内包物を運搬していると考えられる。
【0090】
図10Aは、対照のEYPCリポソームと上記の各MGlu70-Dex-C10リポソームの細胞取込み量を、図10Bは、対照のEYPCリポソームと上記の各MGlu24-Dex-C10リポソームの細胞取込み量を、それぞれフローサイトメーターを用いて調べた結果であり、EYPCリポソームでの平均蛍光強度を基準として相対値を示す。
Rh-PEの蛍光強度は、どのMGlu-Dex-C10リポソームにおいても1以上の値を示している。このことから、MGlu-Dex-C10リポソームは、EYPCリポソームと比較してより多く細胞に取り込まれたことが示唆される。これは、MGlu-Dex-C10の側鎖のカルボキシル基が、DC2.4細胞上に発現している負電荷を認識するスカベンジャーレセプターに認識され、取り込みが促進されたのではないかと考えられる。
また、MGlu-Dex-C10リポソームは、pH応答性物質の含有率が増えると、細胞への取り込み量が増大した。これは、リポソーム表面にカルボキシル基が多くなったため、よりレセプターに認識されやすくなり、取り込み量が増大したからではないかと考えられる。
【0091】
2-6-4. MGlu-Dex-C10を保持するpH応答性リポソームのマウスへの皮下注射による腫瘍の退縮
モデル抗原としてオボアルブミンを内包させたMGlu-Dex-C10リポソームを、OVA発現癌細胞を接種したC57BL/6マウスに投与することで、実際に免疫が誘導されるかどうかを調べた。癌細胞を播種した日を0日目とし、7日目及び14日目に所定量のリポソームを皮下投与した。その間、腫瘍サイズの大きさを観察した。種々のリポソームを投与した場合の腫瘍退縮実験の結果を、図11A〜Dに示す。
図11Aは、リポソームを投与しなかった癌細胞接種マウスにおける腫瘍サイズの変化を示す。図11Bは、OVAを内包する対照のEYPCリポソーム、図11Cは、OVAを内包するMGlu70-Dex-C10リポソーム、図11Dは、OVAを内包するMGlu24-Dex-C10リポソームをそれぞれ投与した場合の癌細胞接種マウスにおける腫瘍サイズの変化を示す。
【0092】
何も処理をしなかったマウスは日ごとに腫瘍体積の増大がみられた(図11A)。また、EYPCリポソームを投与したマウスでは、一時的に腫瘍の抑制がみられたが、再度腫瘍体積の増大が確認された(図11B)。
一方、MGlu70-Dex-C10リポソーム及びMGlu24-Dex-C10リポソームを投与したマウスでは、投与後に明らかな腫瘍の縮退が確認され、中には腫瘍が消失したマウスもいることが分かる(図11C及びD)。この腫瘍成長抑制効果のメカニズムについては、これらのリポソームが抗原タンパク質を細胞質内に送達したことで、MHCクラスIを介してキラーT細胞の活性化が起こり、OVAを発現した腫瘍細胞の成長を阻害したことによる細胞性免疫の効果だと考えられる。また液性免疫だけでなく細胞性免疫も活性化されたことによる効果も考えられる。
【0093】
これらのデータをまとめたものを図12に示す。OVAを内包するMGlu70-Dex-C10リポソーム及びMGlu24-Dex-C10リポソームを投与したマウスの腫瘍の退縮はほぼ同じ時期に起こったので、これらのリポソームが同程度の作用を及ぼしていることがわかる。MGlu70-Dex-C10リポソームとMGlu24-Dex-C10リポソームとでは内包物の放出が起こるpH領域は異なるものの、in vivoでは内包物が十分に細胞質内に放出されると考えられる。
【0094】
これらの結果から、本発明のpH応答性リポソームは、pH応答性を示し、弱酸性環境において内包物を放出することが確認できた。また、本発明のpH応答性リポソームは、樹状細胞に効率的に取り込まれ、内包物を効率よく細胞内に送達すること、及び抗原タンパク質を内包した本発明のpH応答性リポソームは、癌化したマウスに投与することで、免疫誘導により腫瘍を退縮させることがわかった。
【特許請求の範囲】
【請求項1】
少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持してなるpH応答性リポソーム。
【請求項2】
カルボキシル基含有多糖由来部分が、生体由来多糖を用いて得られるカルボキシル基含有半合成多糖に由来し、生体由来多糖が、デンプン、アミロース、アミロペクチン、セルロース、ペクチン、キシラン、マンナン、ガラクタン、デキストラン、デキストリン、シクロデキストリン、キチン、ヒアルロン酸、コンドロイチン、ペプチドグリカン類、アルギン酸、プルラン、グリコーゲン、レンチナン、ラミナラン、カロース、カードラン、シゾフィランとそれらの派生物からなる群より選択される生体由来多糖である請求項1に記載のリポソーム。
【請求項3】
カルボキシル基含有多糖由来部分が、生体由来多糖とジカルボン酸とから得られ、ジカルボン酸が、シュウ酸、マロン酸、コハク酸、グルタル酸、2-若しくは3-メチルグルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、o−、m−若しくはp−フタル酸、1,2-、1,3-若しくは1,4-シクロヘキサンジカルボン酸、マレイン酸、フマル酸、シトラコン酸、メサコン酸、2−ペンテン二酸、メチレンコハク酸、アリルマロン酸、イソプロピリデンコハク酸、2,4−ヘキサジエン二酸及びアセチレンジカルボン酸からなる群より選択される請求項1又は2に記載のリポソーム。
【請求項4】
疎水性部分が、主鎖の炭素数が6〜22で直鎖状又は分岐鎖状の脂肪族基、及び環状部分の炭素数が合計で19〜29の脂環式基(これらの脂肪族基及び脂環式基は、窒素原子、酸素原子などのヘテロ原子を有してもよく、不飽和結合を含有していてもよい)及びリン脂質に由来する基からなる群より選択される請求項1〜3のいずれか1項に記載のリポソーム。
【請求項5】
リポソームの膜を構成する脂質とpH応答性物質との重量比が、1:0.01〜10である請求項1〜4のいずれか1項に記載のリポソーム。
【請求項6】
請求項1〜5のいずれか1項に記載のリポソームと、薬剤とからなるpH応答性薬剤放出システム。
【請求項7】
薬剤が、抗原である請求項6に記載のpH応答性薬剤放出システム。
【請求項1】
少なくとも1つのカルボキシル基を有するカルボキシル基含有多糖由来部分と疎水性部分とを有するpH応答性物質をリポソーム膜に保持してなるpH応答性リポソーム。
【請求項2】
カルボキシル基含有多糖由来部分が、生体由来多糖を用いて得られるカルボキシル基含有半合成多糖に由来し、生体由来多糖が、デンプン、アミロース、アミロペクチン、セルロース、ペクチン、キシラン、マンナン、ガラクタン、デキストラン、デキストリン、シクロデキストリン、キチン、ヒアルロン酸、コンドロイチン、ペプチドグリカン類、アルギン酸、プルラン、グリコーゲン、レンチナン、ラミナラン、カロース、カードラン、シゾフィランとそれらの派生物からなる群より選択される生体由来多糖である請求項1に記載のリポソーム。
【請求項3】
カルボキシル基含有多糖由来部分が、生体由来多糖とジカルボン酸とから得られ、ジカルボン酸が、シュウ酸、マロン酸、コハク酸、グルタル酸、2-若しくは3-メチルグルタル酸、アジピン酸、ピメリン酸、スベリン酸、アゼライン酸、セバシン酸、o−、m−若しくはp−フタル酸、1,2-、1,3-若しくは1,4-シクロヘキサンジカルボン酸、マレイン酸、フマル酸、シトラコン酸、メサコン酸、2−ペンテン二酸、メチレンコハク酸、アリルマロン酸、イソプロピリデンコハク酸、2,4−ヘキサジエン二酸及びアセチレンジカルボン酸からなる群より選択される請求項1又は2に記載のリポソーム。
【請求項4】
疎水性部分が、主鎖の炭素数が6〜22で直鎖状又は分岐鎖状の脂肪族基、及び環状部分の炭素数が合計で19〜29の脂環式基(これらの脂肪族基及び脂環式基は、窒素原子、酸素原子などのヘテロ原子を有してもよく、不飽和結合を含有していてもよい)及びリン脂質に由来する基からなる群より選択される請求項1〜3のいずれか1項に記載のリポソーム。
【請求項5】
リポソームの膜を構成する脂質とpH応答性物質との重量比が、1:0.01〜10である請求項1〜4のいずれか1項に記載のリポソーム。
【請求項6】
請求項1〜5のいずれか1項に記載のリポソームと、薬剤とからなるpH応答性薬剤放出システム。
【請求項7】
薬剤が、抗原である請求項6に記載のpH応答性薬剤放出システム。
【図1A】


【図1B】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図5G】


【図5H】


【図6A】


【図6B】


【図7A】


【図7B】


【図8】


【図9A】


【図9B】


【図10A】


【図10B】


【図11A】


【図11B】


【図11C】


【図11D】


【図12】




【図1B】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図5G】


【図5H】


【図6A】


【図6B】


【図7A】


【図7B】


【図8】


【図9A】


【図9B】


【図10A】


【図10B】


【図11A】


【図11B】


【図11C】


【図11D】


【図12】


【公開番号】特開2012−232949(P2012−232949A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−103692(P2011−103692)
【出願日】平成23年5月6日(2011.5.6)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年5月6日(2011.5.6)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
[ Back to top ]

