siRNA、抗原提示細胞、制御性T細胞及び治療薬
【課題】siRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用手段を提供する。
【解決手段】siRNAで修飾されると共に抗原を感作された抗原提示細胞(siRNA修飾・抗原感作APC)である修飾APC。siRNA修飾・抗原感作APCを用いてナイーブT細胞から誘導される抗原特異的な制御性T細胞(抗原特異的Treg)。抗原特異的Tregを有効成分とする治療薬。その他。
【解決手段】siRNAで修飾されると共に抗原を感作された抗原提示細胞(siRNA修飾・抗原感作APC)である修飾APC。siRNA修飾・抗原感作APCを用いてナイーブT細胞から誘導される抗原特異的な制御性T細胞(抗原特異的Treg)。抗原特異的Tregを有効成分とする治療薬。その他。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はsiRNA、抗原提示細胞、制御性T細胞及び治療薬に関する。更に詳しくは本発明は、抗原提示細胞修飾用のsiRNAと、siRNAによる抗原提示細胞の修飾方法と、siRNAで修飾した抗原提示細胞と、siRNAで修飾し又はsiRNAで修飾すると共に抗原を感作させた抗原提示細胞を用いる制御性T細胞の誘導方法と、この方法により誘導される抗原特異的又は抗原非特異的な制御性T細胞と、それらを利用した治療薬に関する。
【背景技術】
【0002】
抗原提示細胞(APC:Antigen
Presenting Cell)は血球の一種であり、生体内に侵入した細菌、ウイルス感染細胞等の抗原を取込んでペプチドに分解・断片化し、これを細胞表面上の主要組織適合抗原複合体(MHC:Major Histcompatibility Complex)に提示してT細胞を活性化する細胞である。抗原提示に特化した細胞として、樹状細胞、B細胞、マクロファージが代表的に例示される。
【0003】
上記した抗原提示細胞との接触により、T細胞から、「Treg」とも略称される制御性T細胞(Regulatory T Cell)が誘導される。制御性T細胞は免疫寛容の機構に関与するT細胞である。
【0004】
一方、RNA干渉(RNAi:RNA
interference)と呼ばれる遺伝子の転写後発現抑制が知られている。RNA干渉とは、二本鎖RNAと相補的な塩基配列をもつmRNAが分解される現象であって、任意の遺伝子をターゲットとする二本鎖RNAを生体内に導入すると、当該遺伝子のmRNAを介する転写後発現が阻害・抑制される。哺乳動物に関してはsiRNA(small
interfering RNA)と呼ばれる21塩基の短い二本鎖RNAを用いてRNA干渉を起こさせることが可能であり、siRNAを生体外で動物の培養細胞へ導入することもできる。
【0005】
下記の特許文献1は、脊椎動物個体内での抗原特異的な制御性T細胞分化誘導方法に関するもので、対象とする抗原を認識するT細胞に対し、野生型抗原とはT細胞の活性化能の強さが異なる変異型抗原を作成し、変異型抗原におけるT細胞活性化能の野生型抗原に対する相対的な強さに応じて、当該変異型抗原を脊椎動物個体の胸腺に投与し、あるいは脊椎動物個体の末梢組織に投与する方法を開示している。しかし、その開示内容は、要するに「変異型抗原の作成とその利用」にとどまる。
【0006】
下記の特許文献2は、アレルギー性鼻炎および喘息のためのRNAiベースの治療に関するもので、例えばIgE媒介性過敏症によって媒介される病状および疾患の処置のための1以上のRNAi因子(例えばsiRNA、sh
RNAまたはRNAiベクター)を含有する組成物ならびにこの目的に有効なRNAi因子を同定するための系について開示している。しかしその開示内容は、要するに「アレルギー性鼻炎や喘息等の疾患に対するRNAi因子の直接的投与」にとどまる。
【0007】
又、抗CD3抗体、抗CD28抗体、IL-2、TGF-β等を用いて、生体外で制御性T細胞を誘導するという方法が報告され、現在研究されている。しかし、例えば下記の非特許文献1に示唆されるように、この方法では抗原非特異的な制御性T細胞が誘導されるのみである。更に、上記の方法では、抗CD3抗体や抗CD28抗体が投与時に制御性T細胞に混入して、抗体による副作用が出現する可能性もある。実際、下記の非特許文献2に示すように、糖尿病治療における抗CD3モノクローナル抗体の短期間投与によって伝染性単核球症様の症候発症の報告がある。上記の副作用が抗CD3抗体そのものによる副作用か、抗CD3抗体によって誘導された抗原非特異的制御性T細胞によるものか不詳であるが、より安全な治療法が期待されている。
【0008】
下記の非特許文献3は、siRNAで修飾した骨髄由来の抗原提示細胞にアレルギーを引起こす特定の抗原を感作させ、これを利用してマウスのアレルギーの治療を試みたことが開示されている。但し、siRNAとしてはCD40特異的siRNAを用いており、抗原提示細胞としては樹状細胞を用いている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2007−137772号公報
【特許文献2】特表2007−527240号公報
【非特許文献】
【0010】
【非特許文献1】HoffmannP, Eder R, Kunz-Schughart LA, Andreesen R, Edinger M. “Large-scalein vitro expansion of polyclonal human CD4(+)CD25 high regulatory T cells.” Blood. 2004 Aug1;104(3):895-903. Epub 2004 Apr 15.
【非特許文献2】KeymeulenB, Vandemeulebroucke E, Ziegler AG, Mathieu C, Kaufman L, Hale G, Gorus F,Goldman M, Walter M, Candon S, Schandene L, Crenier L, De Block C, SeigneurinJM, De Pauw P, Pierard D, Weets I, Rebello P, Bird P, Berrie E, Frewin M,Waldmann H, Bach JF, Pipeleers D, Chatenoud L. “Insulin needs after CD3-antibodytherapy in new-onset type 1 diabetes.” N Engl J Med. 2005 Jun 23;352(25):2598-608.
【非特許文献3】M.Suzuki, X. Zheng, X. Zhang, Z. Zhang, T. E. Ichim, H. Sun, Y. Nakamura, A.Inagaki, M. Beduhn, A. Shunnar, B. Garcia, and W. P. Min. “A novel allergen-specific therapy forallergy using CD40-silenced dendritic cells” J. Allergy Clin. Immunol. March 2010 737-743
【発明の概要】
【発明が解決しようとする課題】
【0011】
前記のように、RNA干渉を利用した特定遺伝子の転写後発現抑制が知られており、siRNAは哺乳動物のRNA干渉における重要な技術的手段である。一方、制御性T細胞はアレルギー、膠原病、糖尿病、ウイルス疾患等の様々な疾患における治療手段として期待されており、抗原提示細胞は制御性T細胞の誘導に関与していると考えられている。
【0012】
そこで本発明は、アレルギー、膠原病、糖尿病、ウイルス疾患等の各種疾患の治療におけるsiRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用手段を提供することを、解決すべき課題とする。
【0013】
本願発明者は、上記課題の解決手段を追求する過程で、(1)特定遺伝子に特異的なsiRNAで修飾された抗原提示細胞においても標的遺伝子の転写後発現の選択的抑制が起こること、(2)siRNAで修飾されると共に抗原に感作された抗原提示細胞は抗原特異的な制御性T細胞を誘導できること、(3)抗原特異的な制御性T細胞は極めて強力な疾患抑制効果を持ち、副作用もないこと、(4)従って修飾用siRNAと感作抗原との種類を適切にマッチングさせて得られた抗原特異的制御性T細胞は、特定疾患に対する非常に効果的な治療手段となること、等の重要な知見を得るに至り、本発明を完成した。
【課題を解決するための手段】
【0014】
(第1発明の構成)
上記課題を解決するための第1発明の構成は、siRNAで修飾された抗原提示細胞(siRNA修飾APC)である修飾APCである。
【0015】
「抗原提示細胞」とは、主要組織適合抗原複合体(MHC)又はその部分に結合する抗原を細胞表面上に提示する細胞を言う。抗原提示細胞には、樹状細胞、B細胞、マクロファージ、単球、線維芽細胞、血管内皮細胞、甲状腺濾胞細胞等が包含される。
【0016】
「siRNA」とは、生体内又は細胞内に導入されたとき、標的遺伝子のmRNAを分解させ遺伝子の転写後発現を抑制する機能を持つ短鎖の二本鎖RNAをいう。標的遺伝子の種類は、抗原提示細胞が備える遺伝子である限りにおいて限定されないが、本発明の前記課題を考慮した場合、例えば第4発明に関して後述するように、抗原提示細胞とT細胞との相互作用に関与する各種の遺伝子をターゲットとするsiRNAが好ましく例示される。
【0017】
siRNAによる抗原提示細胞の修飾は、培養中の動物細胞等について、生体外で行うことができる。生体外での抗原提示細胞に対するsiRNA修飾を行う際には、例えばGeneSilence reagent(Gene Therapy Systems社)、TransIT-TKOやRiboJuice siRNA Transfection Reagent(共にタカラバイオ社)等の市販のsiRNA導入用試薬を利用することができる。
【0018】
又、siRNAによる抗原提示細胞の修飾を、例えば動物体内、特に好ましくは非ヒト動物体内で行うことができる。このような動物体内での抗原提示細胞の修飾は、siRNAの注射、内服、点鼻その他の投与手段によって行うことができる。又、動物体内で修飾されたsiRNA修飾APCは、例えば当該動物体又はその血液から分離して回収することができる。このように、非ヒト動物体内でsiRNAによる抗原提示細胞の修飾を行い、siRNAで修飾された抗原提示細胞を回収することは可能である。
【0019】
このような非ヒト動物体内での操作は、後述する第2発明で述べる「非ヒト動物体内でのAPC又はsiRNA修飾APCに対する抗原感作」、第5発明で述べる「非ヒト動物体内での抗原特異的Tregの誘導」、第9発明で述べる「非ヒト動物体内での抗原非特異的Tregの誘導」においても、基本的に同様に行うことができる。
【0020】
非ヒト動物体内でのsiRNAによる抗原提示細胞の修飾は、例えば研究目的、siRNAで修飾された抗原提示細胞の回収目的等で行うことができる。
【0021】
本発明において「非ヒト動物」の範囲は限定されないが、例えば、マウス、ラット、ウサギ、サル、イヌ、ブタその他の非ヒト哺乳動物が好ましく例示される。非ヒト動物としては、その他にもカエル、魚等の非哺乳類動物も例示される。
【0022】
「siRNA修飾APC」においては、一定の遺伝子をターゲットとするsiRNAが抗原提示細胞内に導入され、当該細胞内における当該遺伝子の転写後発現の抑制(サイレンシング)が行われている。
【0023】
(第2発明の構成)
上記課題を解決するための第2発明の構成は、siRNAで修飾されると共に抗原を感作された抗原提示細胞(siRNA修飾・抗原感作APC)である修飾APCである。
【0024】
抗原提示細胞に感作する抗原の種類は限定されず、野生型抗原、天然抗原、ウイルス抗原、自己抗原、変化抗原、合成抗原あるいは腫瘍関連抗原等が適宜に選択して用いられる。抗原としては、各種のアレルゲン等が好ましく例示される。アレルゲンとしては、卵白アルブミン(OVA)、KLH(keyhole
limpet hemocyanin)、スギ花粉、ダニ、犬や猫等の動物、真菌、昆虫等の具体例が挙げられる。
【0025】
siRNA修飾・抗原感作APCの調製においては、予めsiRNAで修飾された抗原提示細胞(siRNA修飾APC)に対して抗原を感作させることができるが、予め抗原を感作させた抗原提示細胞(抗原感作APC)に対してsiRNAによる修飾を行うこともできる。
【0026】
抗原提示細胞又はsiRNA修飾APCに対する抗原の感作は、培養中の動物細胞等について、生体外で抗原と接触させることにより行うことができる。又、例えば動物体内、特に好ましくは非ヒト動物体内で行うことができる。非ヒト動物体内での抗原の感作は、例えば研究目的、抗原感作APCの回収目的等で行うことができる。
【0027】
(第3発明の構成)
上記課題を解決するための第3発明の構成は、前記第1発明又は第2発明に係るsiRNA修飾APCにおいて、抗原提示細胞が樹状細胞又はB細胞である。
【0028】
抗原提示細胞としては、樹状細胞、B細胞、マクロファージ等の抗原提示機能を有する細胞が包含されるが、樹状細胞又はB細胞が特に好ましい。
【0029】
(第4発明の構成)
上記課題を解決するための第4発明の構成は、前記第1発明〜第3発明のいずれかに係るsiRNA修飾APCにおいて、siRNAが抗原提示細胞とT細胞との相互作用に関与する遺伝子に特異的なsiRNAである。
【0030】
siRNA修飾APCにおける抗原提示細胞を修飾しているsiRNAの種類は、抗原提示細胞が備える任意の遺伝子に特異的なsiRNAである限りにおいて限定されないが、本発明の課題を考慮すると、第4発明に規定するsiRNAが好ましい。特に好ましい具体例として、CD86特異的siRNA、TNF-α特異的siRNA、CD80特異的siRNA、VCAM-1特異的siRNA、ICAM-1特異的siRNA、CD40特異的siRNA、IL-4特異的siRNA等を例示することができる。
【0031】
上記の具体例の内、例えばCD86は「細胞表面抗原(表面マーカー)の一種であって、T細胞活性化の共刺激分子である」とされており、TNF-αは「細胞が放出する腫瘍壊死因子であり、免疫等に関与するサイトカインである」とされている。そして、後述の実施例では、CD86特異的siRNA、及び/又は、TNF-α特異的siRNAで修飾されたOVA抗原特異的Tregを用いた場合、CD86やTNF-αの発現が抑制されると共に、Foxp3 mRNAの発現量が有意に増大する。Foxp3は「自己免疫疾患抑制機能を有するCD4+CD25+ Tregの分子マーカーであり、Treg分化のマスター遺伝子である」とされている。以上の結果、実施例ではOVAアレルギーに対する高い治療効果を得ている。
【0032】
(第5発明の構成)
上記課題を解決するための第5発明の構成は、第2発明〜第4発明のいずれかに記載のsiRNA修飾・抗原感作APCを用いてナイーブT細胞から抗原特異的な制御性T細胞(抗原特異的Treg)を誘導するTreg誘導方法である。
【0033】
前記したように、抗原感作APCを用いてナイーブT細胞からTregを誘導することは知られているが、その場合に得られるのは抗原非特異的(ポリクローナル)なTregであり、治療目的に用いた場合の効果が低く、しかも非特異的に免疫細胞に作用するため副作用や新たな疾患発症の懸念がある。これに対して、第5発明のようにsiRNA修飾・抗原感作APCを用いると、ナイーブT細胞から抗原特異的Tregを誘導できるという極めて重要な知見が得られた。抗原特異的Tregは、従来の抗原非特異的Tregに比較して治療目的に用いた場合の効果が数十倍も強く、しかも「抗原特異的」であるため副作用や新たな疾患発症の懸念もない。
【0034】
「ナイーブT細胞」とは、未だ抗原提示細胞の作用を受けたことがなく、抗原提示細胞よって活性化される以前のT細胞をいう。
【0035】
siRNA修飾・抗原感作APCを用いた抗原特異的Tregの誘導は、培養中の動物細胞等について、生体外で行うことができる。又、上記の抗原特異的Tregの誘導を、例えば動物体内、特に好ましくは非ヒト動物体内で行うこともできる。このような動物体内での操作は、例えば研究目的、抗原特異的Tregの回収目的等で行うことができる。
【0036】
(第6発明の構成)
上記課題を解決するための第6発明の構成は、第5発明に記載のTreg誘導方法により得られる抗原特異的Tregである。
【0037】
(第7発明の構成)
上記課題を解決するための第7発明の構成は、第6発明に記載の抗原特異的Tregを有効成分とする治療薬である。
【0038】
本願の各発明において「治療薬」とは、有効成分である細胞のみからなり、又は有効成分である細胞を含む組成物であり、あるいは上記の細胞又は細胞含有組成物を含んで構成される治療薬キットである。「細胞を含む組成物」とはin vitro又はin vivoでの診断あるいは治療での使用に適する剤型の組成物であって、医薬的に許容可能なキャリアーとして、例えばリン酸バッファー塩類溶液、水、油/水系あるいは水/油系のエマルジョン、湿性剤、安定剤、保存剤等を含むものをいう。
【0039】
抗原特異的Tregを有効成分とする治療薬は、感作させる抗原の選択により、種々の適応症を持つ強力な治療薬とすることができる。例えばスギ花粉症の治療においては、スギ抗原特異的Tregを有効成分とする治療薬を投与することができる。卵白アルブミン(OVA)アレルギーの治療においては、OVA抗原特異的Tregを有効成分とする治療薬を投与することができる。
【0040】
第7発明の治療薬の対象疾患は抗原特異的Tregの治療効果に応じて定まり、特段に限定されないが、広義には自己免疫疾患、癌、アレルギー、移植、ウイルス疾患等と言ったカテゴリーの疾患群が例示される。更に具体的に述べれば、それらの疾患群の内でも、喘息、花粉症、膠原病等の疾患が例示される。
【0041】
(第7発明の参考発明の構成)
上記課題を解決するための第7発明の参考発明の構成は、第7発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は、第7発明の場合と同様である。
【0042】
(第8発明の構成)
上記課題を解決するための第8発明の構成は、第6発明に記載の抗原特異的Tregを抗体で増幅したものを有効成分とする治療薬である。
【0043】
上記第8発明において「抗原特異的Tregを抗体で増幅する」とは、例えば抗CD3抗体等にてTregを刺激して増幅するような操作をいう。
【0044】
このようにして増幅された有効成分を含む治療薬においては、前記第7発明の効果が一層増強される。
【0045】
第8発明の治療薬の対象疾患は抗原特異的Tregの治療効果に応じて定まり、特段に限定されないが、基本的に第7発明に関して述べたところと同様である。
【0046】
(第8発明の参考発明の構成)
上記課題を解決するための第8発明の参考発明の構成は、第8発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は、第8発明の場合と同様である。
【0047】
(第9発明の構成)
上記課題を解決するための第9発明の構成は、第1発明、第3発明、第4発明のいずれかに記載のsiRNA修飾APCを用いてナイーブT細胞から抗原非特異的な制御性T細胞(抗原非特異的Treg)を誘導するTreg誘導方法である。
【0048】
siRNA修飾APCを用いた抗原非特異的Tregの誘導は、培養中の動物細胞等について、生体外で行うことができる。又、上記の抗原非特異的Tregの誘導を、例えば動物体内、特に好ましくは非ヒト動物体内で行うこともできる。このような動物体内での操作は、例えば研究目的、抗原非特異的Tregの回収目的等で行うことができる。
【0049】
(第10発明の構成)
上記課題を解決するための第10発明の構成は、第9発明に記載のTreg誘導方法により得られる抗原非特異的Tregである。
【0050】
抗原非特異的Treg自体は公知であるが、第10発明に係る抗原非特異的なTregにおいては、siRNAに誘導されたTregであるという点において、従来の抗原非特異的Tregと異なる。
【0051】
(第11発明の構成)
上記課題を解決するための第11発明の構成は、第10発明に記載の抗原非特異的Tregを有効成分とする治療薬である。
【0052】
第11発明の治療薬は、抗原非特異的Tregを有効成分とする点を逆に利用して、例えば原因抗原が不詳な疾患や複数の抗原による疾患(例えばスギ花粉、ダニ抗原、真菌抗原等の多数に感作されているアレルギー疾患)に対する治療薬として用いることができる。
【0053】
(第11発明の参考発明の構成)
上記課題を解決するための第11発明の参考発明の構成は、第11発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は第11発明の場合と同様である。
【0054】
(第12発明の構成)
上記課題を解決するための第12発明の構成は、第6発明に記載の抗原特異的Treg又は第10発明に記載の抗原非特異的Tregを用いて修飾された免疫細胞を有効成分とする治療薬である。
【0055】
上記の第12発明において、「抗原特異的Treg又は抗原非特異的Tregを用いて免疫細胞を修飾する」とは、抗原特異的Treg又は抗原非特異的Tregによってin
vitroでB細胞等の免疫細胞を免疫寛容状態とすることを言う。そして、その免疫寛容状態となった免疫細胞を治療薬として投与することができる。
【0056】
このような修飾を受けた免疫細胞は生体内で抗原特異的Treg又は抗原非特異的Tregの作用を受けた場合と同様の活性化示すため、Treg投与によって生じる副作用の軽減等の点において有利な治療薬となる。
【0057】
第12発明の治療薬の対象疾患は抗原特異的Treg又は抗原非特異的Tregの治療効果に応じて定まり、特段に限定されないが、基本的には第7発明又は第11発明の治療薬の場合と同等である。
【0058】
(第12発明の参考発明の構成)
上記課題を解決するための第12発明の参考発明の構成は、第12発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は、第12発明の場合と同様である。
【発明の効果】
【0059】
上記した本願の各発明により、siRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用形態が提供される。より具体的には、以下に列挙する効果が得られる。
【0060】
(1)APC修飾用siRNAにおける標的遺伝子は限定されないので、目的に応じて、抗原提示細胞が備える任意の遺伝子をノックダウンさせることができる。従って、siRNAの種類を変えることにより、様々なタイプのTregを誘導できる可能性がある。更に、siRNAを直接生体に投与しなくても実施できるので、安全性が高い。
【0061】
(2)非特許文献1に開示される、抗CD3抗体、抗CD28抗体、IL-2、TGF-β等を用いて生体外で制御性T細胞を誘導する方法とは異なり、生体への投与時、抗CD3抗体、抗CD28抗体の混入がなく、抗CD3抗体、抗CD28抗体による副作用の可能性もなく、安全である。
【0062】
(3)siRNA修飾APCにより抗原非特異的Tregの誘導が可能である。抗原非特異的Tregは、例えば、原因抗原が不詳な疾患や複数の抗原による疾患(例えばスギ花粉、ダニ抗原、真菌抗原等の多数に感作されているアレルギー疾患)の治療薬として利用できる。
【0063】
(4)抗原を感作したsiRNA修飾APCにより抗原特異的Tregの誘導が可能である。抗原特異的Tregは抗原非特異的(ポリクローナル)なTregよりも数十倍強力な抑制効果を持つ。又、抗原非特異的Tregのように非特異的に免疫細胞に作用することがないため、副作用や新しい疾患発症を考えなくても良い。
【0064】
(5)本発明に係る治療薬は、その有効成分である抗原特異的Treg又は抗原非特異的Tregを誘導するsiRNA修飾APCにおけるsiRNAの種類の選択、あるいはsiRNA修飾APCに感作させる抗原の種類の選択により、種々の対象疾患に対する治療薬とすることができる。従って、治療薬の好ましい適応症は一律には規定できないが、例えば以下のものを例示できる。
【0065】
該当し得る適応症
I型糖尿病またはインスリン依存性糖尿病、全身性ループス、クローン病、心筋症、溶血性貧血、線維筋痛、グレーブス病、潰瘍性大腸炎、血管炎、多発性硬化症、重症筋無力症、筋炎、好中球減少症、乾癬、慢性疲労症候群、若年性関節炎、若年性糖尿病、強皮症、乾癬性関節炎、シェーグレン症候群、リウマチ熱、慢性関節リウマチ、サルコイドーシス、特発性血小板減少性紫斑病(ITP)、橋本病、複合性結合織疾患、間質性膀胱炎、悪性貧血、白質脳炎、円形脱毛症、強直性脊椎炎、原発性胆汁性肝硬変、抗GBM腎炎、抗TBM腎炎、抗リン脂質症候群、リウマチ性多発筋痛、多発性筋炎、自己免疫性アジソン病、慢性活動性肝炎、尋常性白斑、自己免疫性高脂血症、自己免疫性心筋炎、側頭動脈炎、自己免疫性甲状腺疾患、軸索型および神経性ニューロパシー、ベーチェット病、水疱性類天疱瘡、アレルギー性喘息、アトピー性皮膚炎、骨関節炎、シャーガス病、ブドウ膜炎、慢性炎症性脱髄性多発性根神経障害(CIDP)、瘢痕性類天疱瘡/良性粘膜類天疱瘡、コーガン症候群、先天性心ブロック、コクサッキー心筋炎、脱髄性ニューロパシー、皮膚筋炎、円板状ルーパス、レンズ抗原性ブドウ膜炎、結節性多発動脈炎、ドレスラー症候群、本態性混合性クリオグロブリン血症、エヴァンズ症候群、グッドパスチャー症候群、アレルギー性鼻炎、ギラン・バレー症候群、低γグロブリン血症、封入体筋炎、小水疱水疱性皮膚症、ヴェゲナー肉芽腫症、メニエール病、ランバート-イートン症候群、モーレン潰瘍、非典型的セリアック病、眼球瘢痕性類天疱瘡、尋常性天疱瘡、静脈周囲性脳脊髄炎、心膜切開後症候群、強膜炎、精子および睾丸自己免疫、全身強直症候群、亜急性細菌性心内膜炎(SBE)、交感性眼炎、横断性脊髄炎および壊死性ミエロパシー、多腺性自己免疫性症候群1型、多腺性自己免疫性症候群2型、悪性貧血、子宮内膜症。
【図面の簡単な説明】
【0066】
【図1】CD86 siRNAによるCD86発現の抑制(樹状細胞)を示す。
【図2】CD86 siRNAによるTNF-α発現への影響(樹状細胞)を示す。
【図3】CD86 siRNAによるCD40発現への影響(樹状細胞)を示す。
【図4】TNF-αsiRNAによるTNF-α発現の抑制(樹状細胞)を示す。
【図5】TNF-αsiRNAによるCD86発現への影響(樹状細胞)を示す。
【図6】TNF-αsiRNAによるCD40発現への影響(樹状細胞)を示す。
【図7】TNF-αsiRNAとCD86 siRNAによるTNF-α発現の抑制(樹状細胞)を示す。
【図8】TNF-αsiRNAとCD86 siRNAによるCD86発現の抑制(樹状細胞)を示す。
【図9】樹状細胞によるFoxp3発現の誘導を示す。
【図10】OVA抗原特異的制御性T細胞による抗原特異的T細胞反応への影響を示す。
【図11】OVA抗原特異的制御性T細胞によるOVA誘発鼻症状の抑制を示す。
【図12】OVA抗原特異的制御性T細胞による血清中IgEの抑制を示す。
【図13】OVA抗原特異的制御性T細胞による脾臓産生サイトカインの抑制を示す。
【図14】OVA抗原特異的制御性T細胞によるOVA誘発鼻粘膜浸潤好酸球の抑制を示す。
【図15】OVA抗原特異的制御性T細胞によるKLH誘発鼻症状への影響を示す。
【図16】OVA抗原特異的制御性T細胞によるKLH特異的IgEへの影響を示す。
【図17】OVA抗原特異的制御性T細胞によるKLH誘発鼻粘膜好酸球浸潤への影響を示す。
【図18】CD86 siRNAによるCD86発現への影響(B細胞)を示す。
【図19】CD86 siRNAによるCD40発現への影響(B細胞)を示す。
【図20】CD40 siRNAによるCD40発現への影響(B細胞)を示す。
【図21】CD40 siRNAによるCD86発現への影響(B細胞)を示す。
【図22】B細胞によるFoxp3発現の誘導を示す。
【図23】B細胞により誘導されたOVA抗原特異的制御性T細胞の効果を示す。
【図24】B細胞により誘導された制御性T細胞によるOVA誘発鼻症状の抑制を示す。
【図25】B細胞により誘導された制御性T細胞による血清中IgEの抑制を示す。
【発明を実施するための形態】
【0067】
次に本発明の実施形態を、その最良の形態を含めて説明する。
【0068】
〔第1発明〜第12発明の実施形態〕
抗原提示細胞は、例えばヒト又は適宜な非ヒト動物(例えばマウス)から採取した血液より分離したり、ヒトの例えば胸骨等の骨髄の骨髄前駆細胞から樹立したり、更には適宜な非ヒト動物(例えばマウス)から採取した脾臓から分離したり、適宜な非ヒト動物(例えばマウス)から採取した肺、鼻、皮膚等の局所組織から分離することによって得ることができる。
【0069】
血液からの抗原提示細胞の分離には、抗体やビーズ等の手段を用いることができる。骨髄前駆細胞から樹状細胞を樹立するにあたっては、マウス等の例えば大腿骨、脛骨、上腕骨、前腕骨等を用い、これをフラッシュして骨髄前駆細胞を採取すると共に、この骨髄前駆細胞をサイトカインと一緒に培養することにより、樹立することができる。
【0070】
得られた抗原提示細胞に、例えば生体外にてsiRNA導入用試薬を用いてsiRNAを導入し、抗原提示細胞を修飾する。
【0071】
次に、siRNAにより修飾された抗原提示細胞(siRNA修飾APC)と、血液より採取したT細胞(例えばCD4+CD25-T細胞)を例えば生体外にて混ぜあわせ、反応させる。「生体外にて」とは、例えばFCSを含むRPMI 1640中、CO2インキュベーター中等でsiRNA修飾APCとT細胞を接触させることをいう。反応させることによって、制御性T細胞(Treg)が誘導される。誘導されたTregを、抗体(CD4、CD25抗体等)、ビーズ等を用いて取り出す。こうして取り出したTregを直接体内に投与して、疾患を治療する。もしくはTregを用いて生体外で修飾し、修飾した免疫細胞を用いて治療する。siRNAは全ての遺伝子をターゲットにできる。Tregにも様々なタイプが存在するが、siRNAの種類を変えることによって、様々なTregを誘導できる可能性がある。
【0072】
以上は抗原非特異的Tregに関するが、siRNA修飾APCに抗原を感作すれば、抗原特異的抗原提示細胞を作製できる。上記と同様のプロセスにより、抗原特異的抗原提示細胞とT細胞を生体外にて混ぜあわせ、反応させることによって、抗原特異的なTregが誘導される。誘導された抗原特異的Tregを抗体やビーズ等を用いて取り出す。この抗原特異的Tregを治療薬として生体内に投与することができる。抗原特異的なTregであるため、抗原特異的な治療が可能である。
【0073】
また、抗原特異的Tregは抗原非特異的(ポリクローナル)Tregよりも数十倍強力な抑制効果をもつことが報告されている。例えばスギ花粉症の患者にスギ抗原特異的Tregを投与すればスギ花粉症に対する特異的な治療となる。抗原非特異的Tregは非特異的に免疫細胞に作用するため、様々な副作用が起こり得る。従って、抗原非特異的Tregを生体に投与した場合、目的とする疾患は改善されるが、新たな疾患が発症する可能性がある。これらの問題点を考えた場合、抗原特異的Tregは非常に有用な手段である。
【0074】
〔第1発明〜第12発明の特徴〕
前記した本願の第1発明〜第12発明の特徴として、以下の点が挙げられる。
【0075】
(1)抗原特異的Tregの誘導が可能である。
【0076】
(2)抗原特異的Tregは抗原非特異的(ポリクローナル)Tregよりも数十倍強力な抑制効果を持つ。
【0077】
(3)抗原特異的Tregは特異的に免疫細胞に作用するので、抗原非特異的Tregによる副作用や新しい疾患発症を考えなくても良い。
【0078】
(4)抗CD3抗体、抗CD28抗体を使用しないので安全である。即ち、生体への投与時に抗CD3抗体、抗CD28抗体の混入がない。
【0079】
(5)抗CD3抗体、抗CD28抗体による副作用の可能性がない。
【0080】
(6)siRNAを直接生体に投与しないので、安全性が高い。
【0081】
(7)Tregにも様々なタイプが存在するが、siRNAの種類を変えることによって、様々なTregを誘導できる可能性がある。
【実施例】
【0082】
次に本発明の実施例を説明する。本発明の技術的範囲は以下の実施例によって限定されない。
〔第1実施例:樹状細胞〕
(実験の概要)
マウスの骨髄細胞より樹状細胞を樹立し、樹立した樹状細胞にCD86特異的siRNA、TNF-α特異的siRNAを導入した後、OVA(卵白アルブミン)を感作して、ノックダウンOVA特異的樹状細胞(CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞、CD86-TNF-αノックダウンOVA樹状細胞)を作製した。
【0083】
脾臓より分離したCD4+T細胞とノックダウン樹状細胞を共に6穴プレートに入れ、反応させた。5日後、ノックダウンOVA樹状細胞群はコントロール群より有意にFoxp3陽性制御性T細胞の陽性率とFoxp3 mRNAの発現を増やしていた。CD86-TNF-αノックダウンOVA樹状細胞、CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞の中では、CD86-TNF-αノックダウンOVA樹状細胞が最も高率にFoxp3 mRNAの発現を増やしていた(図7)。
【0084】
ノックダウンOVA樹状細胞によって誘導された制御性T細胞(OVA抗原特異的制御性T細胞)はOVA特異的T細胞反応を抑制した。しかし、OVA抗原特異的制御性T細胞はKLH特異的T細胞反応、スギ特異的T細胞反応等の他のT細胞反応は抑制しなかった(図8)。
【0085】
OVA抗原によるアレルギー性鼻炎モデルマウスにノックダウンOVA抗原特異的制御性抗原提示細胞によって誘導された制御性T細胞(OVA抗原特異的制御性T細胞)を投与してその効果を検討した。OVA抗原特異的制御性T細胞を投与した群、CD4+CD25-細胞を投与した群、PBSのみを投与した群の3群を作製して、比較検討した。OVA抗原特異的制御性T細胞は他のコントロール2群と比べて有意に血中OVA特異的IgE抗体、OVA刺激によって脾臓細胞から産生されるIL-4、IL-5、鼻粘膜の好酸球浸潤、くしゃみ回数、鼻掻き回数を抑制した。また、OVA抗原特異的制御性T細胞はKLH抗原によるアレルギー性鼻炎モデルマウスのKLH特異的IgE抗体、KLH刺激によって脾臓細胞から産生されるIL-4、IL-5、鼻粘膜の好酸球浸潤、くしゃみ回数、鼻掻き回数を抑制しなかった(図9〜図15)。
【0086】
(実験方法)
骨髄細胞由来樹状細胞の樹立
下記参考文献1の記載に準じて、樹状細胞は骨髄前駆細胞から作製した。即ち、マウスの大腿骨、脛骨をフラッシュして骨髄前駆細胞を採取した。骨髄前駆細胞を洗浄した後、24穴プレートにて培養した。コンプリートミディアム2ml(2 mM L-glutamine、100 U/ml penicillin、100μg/ml streptomycin、50μM 2-ME、10%FCSを含むRPMI 1640)に10 ng/mlリコンビナントGM-CSFとIL-4を加え、4 x 106の骨髄前駆細胞を入れて、37℃ 5%CO2インキュベーターの中で培養することにより樹状細胞を樹立した。
【0087】
(参考文献1)M. Suzuki, X. Zheng, X. Zhang, M. Li, C. Vladau, T. E. Ichim, H.
Sun, L. R. Min, B. Garcia, and W. P. Min. 2008. “Novel vaccination for allergy
through gene silencing of CD40 using small interfering RNA” J. Immunol. 180:8461。
【0088】
siRNAの感作
GeneSilencer
reagent (Gene Therapy Systems)を用いてsiRNAを抗原提示細胞に感作した。siRNA (2 μg)、GeneSilencer
reagent(20μl)を50μl のRPMI 1640に混ぜ30分間、室温にて留置した。留置後、この混合液を12穴プレート中にある400μlの抗原提示細胞に加えた。siRNAとしてはCD86に対して特異的なsiRNA(CD86 siRNA)、TNF-αに対して特異的なsiRNA(TNF-αsiRNA)、コントロールとしてコントロールsiRNAを用いた。また、もう一つのコントロールとしてsiRNAを使用しないコントロール群(No siRNA)も作製した。4時間後、同量のミディアム(20%FBS, 20 ng/ml GM-CSF
(PeproTech)、20 ng/ml IL-4を含んだRPMI 1640を加えた。
【0089】
制御性T細胞の作製
樹立した樹状細胞に配列表の配列番号1に示すCD86特異的siRNA(CD86, 5′-AUAAUUGAUCCUGUGGGUGGC-3)、配列表の配列番号2に示すTNF-α特異的siRNA(5-GACAACCAACUAGUGGUGC-3)を導入し、OVA(卵白アルブミン)を感作して、ノックダウンOVA特異的樹状細胞(CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞、CD86-TNF-αノックダウンOVA樹状細胞)を作製した。脾臓より分離したT細胞(1X105/ウェル)とノックダウンOVA樹状細胞(1X105/ウェル)を共に6穴プレートに入れ、5日間反応させた。
【0090】
Real-time PCR
TRIzol
(Invitrogen)を用いて樹状細胞よりTotal RNAを抽出した(参考文献1参照)。10 U DNase I を用いて20μg RNAを分解(37℃下で30分間)、phenol:chloroform (3:1)で抽出、ethanolで凝結、70% ethanolで洗浄した。その後、20 μl 水(Rnaseを除去した水)を用いて溶解した。SuperScript
Preamplification System (Invitrogen)を用いてFirst-strand cDNAを作製した。Real-time PCRはSYBR Green PCR Master
mix (Stratagene)と100 nM 遺伝子特異的プライマーを用いて施行した。PCRのコンディションは95℃ 10 分, 95℃ 30秒, 58℃ 1分, 72℃ 30秒 (40 サイクル)とした。コントロールとしてはGAPDHプライマーを使用した。以下の(1)〜(5)に示す10種の塩基配列を、その順に、配列表の配列番号3〜12に示す。
【0091】
(1) CD40 5’-TCTAGAGTCCCGGATGCGAG-3’ (forward)
5’-GGATCCTCAAGGCTATGCTGTC G-3’ (reverse)
(2) CD86 5’-GTATGTCACAAGAAGCCGAATCA-3’ (forward)
5’-TTAAACAAAGCAAGACAAATAGA-3’ (reverse)
(3) TNF-α
5’-CTCCCTCCAGAAAAGACACCAT-3’ (forward)
5’-ATCACCCCGAAGTTCAGTAGACAG-3’ (reverse
(4) Foxp3 5’-CAGCTGCCTACAGTGCCCCTAG-3’ (forward)
5’-CATTTGCCAGCAGTGGGTAG-3’ (reverse)
(5) GAPDH 5’-TGATGACATCAAGAAGGTGGTGAA-3’ (forward)
5’-TCCTTGGAGGCCATGTAGGCCAT-3’ (reverse)
制御性T細胞(Treg)の分離
制御性T細胞(Treg)としてCD4+CD25+ T細胞を分離した。MACS system を用いてCD4+CD25+ T細胞を抗原提示細胞とT細胞の共培養液より採取した。まずMACS negative selection CD4 isolation kit (Miltenyi Biotec)を用いてCD4+ T細胞を分離した。次に、anti-CD25 MACS beads (Miltenyi Biotec)を用いてCD4+CD25+T細胞とCD4+CD25- T細胞を分離した。
【0092】
感作、免疫と治療
8週齢の雄BALB/cマウスを用いた。10 μg OVA と 4 mg Al(OH3)をDay 0とDay 14の2回腹腔内に投与した。Day 21からDay 27 に毎日卵白アルブミン(ovalbumin、OVA、600 μg)を点鼻投与して、OVAに対するアレルギー性鼻炎モデルマウスを作製した。
【0093】
Day28にOVA特異的CD4+CD25+制御性T細胞(1X106)を静脈投与した(CD4+CD25+制御性T細胞投与群、CD4+CD25-T細胞投与群、PBS投与群の3群を作製した)。Day 28からDay 34に再度卵白アルブミン(OVA、 600 μg)を点鼻投与した。下記参考文献2の記載に準じてDay34の点鼻チャレンジの後、20分間の鼻掻き回数とくしゃみ回数を数えて、比較検討した。Day35に血液、脾臓、鼻粘膜組織を採取した。
【0094】
(参考文献2)M. Suzuki, N. Ohta,
W. P. Min, T. Matsumoto, R. Min, X. Zhang, K. Toida, and S. Murakami. 2007.
“Immunotherapy with CpG DNA conjugated with T-cell epitope peptide of an
allergenic Cry j 2 protein is useful for control of allergic conditions in
mice” Int. Immunopharmacol. 7:46。
【0095】
又、KLHに対するアレルギー性鼻炎モデルマウスも作製して、同様の実験を行った。具体的には10 μg KLH と 4 mg Al(OH3)をDay0とDay 14の2回腹腔内に投与した。Day 21からDay 27 に毎日KLH(30 μg)を点鼻投与して、KLHに対するアレルギー性鼻炎モデルマウスを作製した。
【0096】
Day28にOVA特異的CD4+CD25+制御性T細胞(1X106)を静脈投与した(CD4+CD25+制御性T細胞投与群、CD4+CD25-T細胞投与群、PBS投与群の3群を作製した)。Day 28からDay 34に再度KLH(30 μg)を点鼻投与した。Day34の点鼻チャレンジの後、20分間鼻掻き回数とくしゃみ回数を数えた。Day35に血液、脾臓、鼻粘膜組織を採取した。
【0097】
血清特異的IgEの測定
ELISAを用いてマウス血清特異的IgEを測定した。抗マウス特異的IgE抗体をELISA プレートにコートした後、ブロッキングバッファーを加え非特異的結合を防いだ。血清を加え37℃で2時間インキュベイトした後、3回洗浄した。ビオチン化スギ抗原を加え、洗浄した。アビジン−パーオキシダ−ゼを加えインキュベイトした後、洗浄した。TMB Microwell
Peroxidase Substrate systemを用いて発色させた。ODは450nmで測定した。
【0098】
OVA抗原特異的T細胞反応
アレルギーモデルマウスより採取した脾臓からFicoll-Paqueを用いてT細胞を分離した。分離したT細胞をコンプリートミディアムに溶かし、96穴プレートに入れ(4 x 105 cells/1ウェル)、OVA(100 μg/ml)抗原の存在下で72時間培養した。1 μCi の[3H]thymidineを加え、16時間培養した。[3H]thymidineの取り込みはシンチレーションカウンターを用いて測定した。3回測定して、cpm(counts per minute)の平均を結果として用いた。
【0099】
OVA抗原特異的T細胞反応によって産生されるIL-4、IL-5の測定
OVA抗原特異的T細胞反応培養上清中のIL-4、IL-5を特異的抗体を用いたサンドイッチELISAにて測定した。抗IL-4モノクローナル抗体もしくは抗IL-5モノクローナル抗体をプレートに吸着後、培養上清を加えた。洗浄後、ビオチン化した抗IL-4モノクローナル抗体もしくは抗IL-5モノクローナル抗体を加え、アビジン−パーオキシダ−ゼ、TMB Microwell
Peroxidase Substrate systemを用いて発色させた。リコンビナントサイトカインを用いて、スタンダードカーブを作製した。
【0100】
TregによるOVA特異的T細胞反応の抑制
アレルギーマウスの脾臓より分離したT細胞を96穴プレートに入れ(5 x 105/ウェル)、400 μg/ml OVAと反応させた(OVA抗原特異的T細胞反応)。CD4+CD25+ 制御性T細胞もしくはCD4+CD25- T細胞を加え、制御性T細胞のT細胞反応抑制能力を[3H]thymidineの取り込みにて評価した。
【0101】
病理
頭部を切り離して10% formalinで固定した後、脱灰して、薄片に切り分けた。鼻組織を3μMの厚さで切った後、Luna染色で染めた。鼻中隔に存在する好酸球の数をカウントした。強拡(10 x 40)で認められる好酸球数を測定した。
【0102】
統計学的解析
one-way ANOVA(Newman-Keuls Test)を用いて解析した。P < 0.05の場合、統計学的に有意と判断した。
【0103】
(結果)
siRNA感作による遺伝子ノックダウン効果
樹立した樹状細胞にCD86 siRNA、TNF-αsiRNAもしくはCD86 siRNAとTNF-αsiRNAの両方を感作した後、OVA抗原を導入、CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞、CD86-TNF-αノックダウンOVA樹状細胞を作製した。ノックダウンOVA樹状細胞のRNAを抽出、Real time PCRを施行した。
【0104】
その結果、図1に示すように、CD86 ノックダウンOVA樹状細胞では有意にCD86発現が抑制していた。しかし、CD86 ノックダウンOVA樹状細胞ではTNF-α(図2)、CD40(図3)、CD80等の他の遺伝子の発現を抑制していなかった。又、図4に示すように、TNF-α
ノックダウンOVA樹状細胞ではTNF-αの発現が抑制していた。しかし、TNF-α ノックダウンOVA樹状細胞ではCD86(図5)、CD40(図6)、CD80等の他の遺伝子発現を抑制していなかった。
【0105】
更に、CD86siRNAとTNF-αsiRNAの双方を用いて両方をノックダウンさせたOVA樹状細胞であるCD86TNF-αノックダウンOVA樹状細胞では、図7に示すようにTNF-αの発現が抑制し、かつ、図8に示すようにCD86の発現が抑制していた。
【0106】
なお、図1〜図8において、「No siRNA」の表記はsiRNAを感作していない樹状細胞を意味し、「Scrambled siRNA」の表記は効果のないsiRNAを感作したコントロールとしての樹状細胞を意味する。
【0107】
樹状細胞によるFoxp3発現の誘導
脾臓より分離したT細胞とノックダウンOVA樹状細胞を共にプレートに入れ反応させた。5日後、ノックダウンOVA樹状細胞群はコントロール群より有意にFoxp3 mRNAの発現を増やしていた。また、ノックダウンOVA樹状細胞の中では、CD86-TNF-αノックダウンOVA樹状細胞が最も高率にFoxp3 mRNAの発現を増やしていた(図9)。
【0108】
なお、図9において、「CD86」の表記はCD86 siRNAによって感作された樹状細胞を、「TNF-α」の表記はTNF-α siRNAによって感作された樹状細胞を、「CD86 TNF-α半量」の表記は上記「CD86」の場合の半量のCD86 siRNA及び上記「TNF-α」の場合の半量のTNF-α siRNAによって感作された樹状細胞を、「CD86
TNF-α同量」の表記は上記「CD86」の場合と同量のCD86
siRNA及び上記「TNF-α」の場合と同量のTNF-α siRNAによって感作された樹状細胞を、それぞれ示す。
【0109】
制御性T細胞による抗原特異的T細胞反応への影響
抗原(OVA、KLHもしくはスギ花粉)特異的T細胞に、CD86-TNF-αノックダウン樹状細胞に誘導された制御性T細胞(CD4+CD25+制御性T細胞)を加えて、抗原特異的T細胞反応への影響をIn vitroにて検討した。
【0110】
CD86-TNF-αノックダウンOVA樹状細胞によって誘導されたCD4+CD25+制御性T細胞はOVA抗原特異的T細胞反応を抑制したが、KLH抗原特異的T細胞反応やスギ花粉抗原特異的T細胞反応を抑制しなかった(図10)。
【0111】
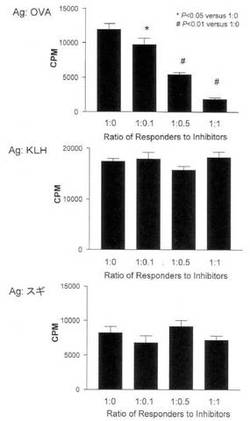
なお、図10において、「Responder」とはT細胞反応に関与するT細胞を意味し、具体的にはCD4+CD25-T細胞である。「Inhibitor」とはT細胞反応を抑制するT細胞を意味し、具体的にはCD4+CD25+制御性T細胞である。従って「Ratio of Responders to Inhibitors」、即ちResponderに対するInhibitorの比率が高まるにつれてCPM(Counts per minutes:T細胞反応を意味するサイミジンの取り込みを示す値)が低下する場合、抗原特異的T細胞反応が有効に抑制されていることを示す。
【0112】
制御性T細胞による症状の抑制
CD86TNF-αノックダウンOVA樹状細胞によって誘導されたCD4+CD25+制御性T細胞(OVA抗原特異的制御性T細胞)の効果をIn vivoにて検討した。OVA抗原によるアレルギー性鼻炎モデルマウスにOVA抗原特異的制御性T細胞を投与した。
【0113】
即ち、以下の3群を作製して、比較検討した。
【0114】
(1)抗原特異的制御性T細胞(CD4+CD25+T細胞)を投与した群。この群はCD86-TNF-αノックダウン樹状細胞に誘導されたCD4+CD25+T細胞を投与した群であり、図11〜図17においては「CD4+CD25+」と表記されている。
【0115】
(2)CD4+CD25-T細胞を投与した群。この群はScrambled siRNA感作樹状細胞に誘導されたCD4+CD25-T細胞を投与したコントロール群であり、図11〜図17においては「CD4+CD25-」と表記されている。
【0116】
(3)PBS(Phosphate buffered saline)のみを投与したコントロール群。この群は図11〜図17においては「PBS alone」と表記されている。
【0117】
その結果、OVA抗原特異的制御性T細胞は、他のコントロール2群と比べて有意にくしゃみ回数、鼻掻き回数(図11)、血中OVA特異的IgE抗体(図12)、OVA刺激によって脾臓細胞から産生されるIL-4、IL-5(図13)、鼻粘膜の好酸球浸潤(図14)を抑制した。また、OVA抗原特異的制御性T細胞はKLH抗原によるアレルギー性鼻炎モデルマウスのくしゃみ回数、鼻掻き回数、KLH特異的IgE抗体、鼻粘膜の好酸球浸潤を抑制しなかった(図15〜図17)。
〔第2実施例:B細胞〕
(実験の概要)
マウスの脾臓細胞よりB細胞を分離し、分離したB細胞にCD86特異的siRNA、CD40特異的siRNAを導入した。次いでこれらのB細胞にOVA(卵白アルブミン)を感作して、ノックダウンOVA特異的B細胞(CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞)を作製した。CD86ノックダウンOVA B細胞、CD40ノックダウンOVA
B細胞にT細胞を反応させると、有意にOVA抗原特異的制御性T細胞が誘導された。また誘導された抗原特異的制御性T細胞はOVA抗原特異的T細胞反応を抑制したが、KLH抗原特異的T細胞反応を抑制しなかった(後述する図23)。
【0118】
(実験方法)
B細胞の分離
正常マウスの脾臓を採取し、脾臓よりCD19マイクロビーズを用いてB細胞を分離した。
【0119】
siRNAの感作
GeneSilencer
reagent (Gene Therapy Systems)を用いてsiRNAをB細胞に感作した。siRNA (2 μg)、GeneSilencer
reagent(20μl)を50μl のRPMI 1640に混ぜ30分間、室温にて留置した。留置後、この混合液を12穴プレート中にある400μlのB細胞に加えた。siRNAとしてはCD86に対して特異的なsiRNA(CD86 siRNA)、CD40に対して特異的なsiRNA(CD40 siRNA)を用いた。又、もう一つのコントロールとしてsiRNAを使用しないコントロール群(No siRNA)も作製した。4時間後、同量のミディアム(20%FBS, 20 ng/ml GM-CSF
(PeproTech)、20 ng/ml IL-4を含んだRPMI 1640を加えた。
【0120】
制御性T細胞の作製
分離したB細胞に、前記した配列表の配列番号1に示すCD86特異的siRNA、配列表の配列番号13に示すCD40特異的siRNA(5- UUCUCAGCCCAGUGGAACA -3)と配列表の配列番号14に示すCD86特異的siRNA(5- AUAAUUGAUCCUGUGGGUGGC -3)を導入し、OVA(卵白アルブミン)を感作して、ノックダウンOVA特異的B細胞(CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞)を作製した。脾臓より分離したB細胞(1X105/ウェル)とノックダウンOVA B細胞(1X105/ウェル)を共に6穴プレートに入れ、5日間反応させた。
【0121】
Real-time PCR
TRIzol (Invitrogen)を用いてB細胞よりTotal RNAを抽出した(参考文献1参照)。10 U DNase I を用いて20μg RNAを分解(37℃下で30分間)、phenol:chloroform (3:1)で抽出、ethanolで凝結、70% ethanolで洗浄した。その後、20 μl 水(Rnaseを除去した水)を用いて溶解した。SuperScript
Preamplification System (Invitrogen)を用いてFirst-strand cDNAを作製した。Real-time PCRはSYBR Green PCR Master mix (Stratagene)と100 nM 遺伝子特異的プライマーを用いて施行した。PCRのコンディションは95℃ 10 分, 95℃ 30秒, 58℃ 1分, 72℃ 30秒 (40 サイクル)とした。コントロールとしてはGAPDHプライマーを使用した。プライマーの塩基配列は、前記した第1実施例における「Real-time PCR」の欄で示した(1)、(2)、(4)、(5)の通りである。
【0122】
制御性T細胞(Treg)の分離
制御性T細胞(Treg)としてCD4+CD25+ T細胞を分離した。MACS system を用いてCD4+CD25+ T細胞を抗原提示細胞とT細胞の共培養液より採取した。まずMACS negative
selection CD4 isolation kit (Miltenyi Biotec)を用いてCD4+ T細胞を分離した。次に、anti-CD25 MACS beads
(Miltenyi Biotec)を用いてCD4+CD25+T細胞とCD4+CD25- T細胞を分離した。
【0123】
感作、免疫と治療
8週齢の雄BALB/cマウスを用いた。10 μg OVA と 4 mg Al(OH3)をDay 0とDay 14の2回腹腔内に投与した。Day 21からDay 27 に毎日卵白アルブミン(ovalbumin、OVA、600 μg)を点鼻投与して、OVAに対するアレルギー性鼻炎モデルマウスを作製した。
【0124】
Day28にOVA特異的CD4+CD25+制御性T細胞(1X106)を静脈投与した(CD4+CD25+制御性T細胞投与群、CD4+CD25-T細胞投与群、PBS投与群の3群を作製した)。Day 28からDay 34に再度卵白アルブミン(OVA、 600 μg)を点鼻投与した。下記参考文献2の記載に準じてDay34の点鼻チャレンジの後、20分間の鼻掻き回数とくしゃみ回数を数えて、比較検討した。Day35に血液、脾臓、鼻粘膜組織を採取した。
【0125】
血清特異的IgEの測定
ELISAを用いてマウス血清特異的IgEを測定した。抗マウス特異的IgE抗体をELISA プレートにコートした後、ブロッキングバッファーを加え非特異的結合を防いだ。血清を加え37℃で2時間インキュベイトした後、3回洗浄した。ビオチン化スギ抗原を加え、洗浄した。アビジン−パーオキシダ−ゼを加えインキュベイトした後、洗浄した。TMB Microwell Peroxidase Substrate
systemを用いて発色させた。ODは450nmで測定した。
【0126】
OVA抗原特異的T細胞反応
アレルギーモデルマウスより採取した脾臓からFicoll-Paqueを用いてT細胞を分離した。分離したT細胞をコンプリートミディアムに溶かし、96穴プレートに入れ(4 x 105 cells/1ウェル)、OVA(100 μg/ml)抗原の存在下で72時間培養した。1 μCi の[3H]thymidineを加え、16時間培養した。[3H]thymidineの取り込みはシンチレーションカウンターを用いて測定した。3回測定して、cpm(count per minute)の平均を結果として用いた。
【0127】
TregによるOVA特異的T細胞反応の抑制
アレルギーマウスの脾臓より分離したT細胞を96穴プレートに入れ(5 x 105/ウェル)、400 μg/ml OVAと反応させた(OVA抗原特異的T細胞反応)。CD4+CD25+ 制御性T細胞もしくはCD4+CD25- T細胞を加え、制御性T細胞のT細胞反応抑制能力を[3H]thymidineの取り込みにて評価した。
【0128】
統計学的解析
one-way ANOVA(Newman-Keuls Test)を用いて解析した。P < 0.05の場合、統計学的に有意と判断した。
【0129】
(結果)
siRNA感作による遺伝子ノックダウン効果
分離したB細胞にCD86
siRNA又はCD40 siRNAを感作した後、OVA抗原を導入して、CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞を作製した。ノックダウンOVA B細胞のRNAを抽出し、Real time PCRを施行した。
【0130】
その結果、図18に示すように、CD86ノックダウンOVA B細胞では有意にCD86発現が抑制していた。しかし、CD86 ノックダウンOVA B細胞ではCD40の遺伝子の発現を抑制していなかった(図19)。又、図20に示すように、CD40ノックダウンOVA B細胞ではCD40の発現が抑制していた。しかし、CD40ノックダウンOVA B細胞ではCD86の遺伝子発現を抑制していなかった(図21)。
【0131】
B細胞によるFoxp3発現の誘導
この実験では、CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞に加えて、分離したB細胞にCD86 siRNA及びCD40 siRNAを感作した後、OVA抗原を導入してなるCD40-CD86-ノックダウンOVA B細胞も用いた。
【0132】
脾臓より分離したT細胞とノックダウンOVA B細胞を共にプレートに入れ反応させた。5日後、ノックダウンOVA B細胞群はコントロール群より有意にFoxp3 mRNAの発現を増やしていた。又、ノックダウンOVA B細胞群の中では、CD40-CD86-ノックダウンOVA B細胞が最も高率にFoxp3 mRNAの発現を増やしていた(図22)。
【0133】
なお、図22において、「CD86」の表記はCD86 siRNAによって感作されたB細胞を、「CD40」の表記はCD40 siRNAによって感作されたB細胞を、「CD40 CD86半量」の表記は上記「CD40」の場合の半量のCD40 siRNA及び上記「CD86」の場合の半量のCD86 siRNAによって感作されたB細胞を、「CD40
CD86同量」の表記は上記「CD40」の場合と同量のCD40 siRNA及び上記「CD86」の場合と同量のCD86 siRNAによって感作されたB細胞を、それぞれ示す。
【0134】
制御性T細胞による抗原特異的T細胞反応への影響
抗原(OVA又はKLH)特異的T細胞に、CD40-CD86-ノックダウンOVA B細胞に誘導された制御性T細胞(CD4+CD25+制御性T細胞)を加えて、抗原特異的T細胞反応への影響をIn vitroにて検討した。CD40-CD86-ノックダウンOVA B細胞によって誘導されたCD4+CD25+制御性T細胞はOVA抗原特異的T細胞反応を抑制したが、KLH抗原特異的T細胞反応を抑制しなかった(図23)。
【0135】
なお、図23において、「Responder」、「Inhibitor」の意味は図10に関して説明した通りである。
【0136】
感作、免疫と治療
前記「(実験方法)」中の「感作、免疫と治療」の項における鼻掻き回数とくしゃみ回数を数えた結果を図24に示す。図24において、「PBS
alone」はPBS投与群を、「CD25-」はCD4+CD25-T細胞投与群を、「CD25+」はCD4+CD25+制御性T細胞投与群をそれぞれ示すが、OVA抗原特異的制御性T細胞は他のコントロール2群と比べて有意にくしゃみ回数、鼻掻き回数を抑制した。
【0137】
制御性T細胞による症状の抑制
CD40-CD86-ノックダウンOVA B細胞によって誘導されたCD4+CD25+制御性T細胞(OVA抗原特異的制御性T細胞)の効果をIn vivoにて検討した(図25)。OVA抗原によるアレルギー性鼻炎モデルマウスにOVA抗原特異的制御性T細胞を投与した。
【0138】
即ち、以下の3群を作製して、比較検討した。
【0139】
(1)抗原特異的制御性T細胞(CD4+CD25+T細胞)を投与した群。この群はCD40-CD86-ノックダウンOVA B細胞に誘導されたCD4+CD25+T細胞を投与した群であり、図25においては「CD4+CD25+」と表記されている。
【0140】
(2)CD4+CD25-T細胞を投与した群。この群はScrambled siRNA感作B細胞に誘導されたCD4+CD25-T細胞を投与したコントロール群であって、図25においては「CD4+CD25-」と表記されている。
【0141】
(3)PBSのみを投与したコントロール群。この群は図25において「PBS alone」と表記されている。
【0142】
その結果、OVA抗原特異的制御性T細胞は、他のコントロール2群と比べて、アレルギー性鼻炎モデルマウスの血中OVA特異的IgE抗体を有意に抑制した(図25)。
【産業上の利用可能性】
【0143】
本発明により、siRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用手段が提供される。
【技術分野】
【0001】
本発明はsiRNA、抗原提示細胞、制御性T細胞及び治療薬に関する。更に詳しくは本発明は、抗原提示細胞修飾用のsiRNAと、siRNAによる抗原提示細胞の修飾方法と、siRNAで修飾した抗原提示細胞と、siRNAで修飾し又はsiRNAで修飾すると共に抗原を感作させた抗原提示細胞を用いる制御性T細胞の誘導方法と、この方法により誘導される抗原特異的又は抗原非特異的な制御性T細胞と、それらを利用した治療薬に関する。
【背景技術】
【0002】
抗原提示細胞(APC:Antigen
Presenting Cell)は血球の一種であり、生体内に侵入した細菌、ウイルス感染細胞等の抗原を取込んでペプチドに分解・断片化し、これを細胞表面上の主要組織適合抗原複合体(MHC:Major Histcompatibility Complex)に提示してT細胞を活性化する細胞である。抗原提示に特化した細胞として、樹状細胞、B細胞、マクロファージが代表的に例示される。
【0003】
上記した抗原提示細胞との接触により、T細胞から、「Treg」とも略称される制御性T細胞(Regulatory T Cell)が誘導される。制御性T細胞は免疫寛容の機構に関与するT細胞である。
【0004】
一方、RNA干渉(RNAi:RNA
interference)と呼ばれる遺伝子の転写後発現抑制が知られている。RNA干渉とは、二本鎖RNAと相補的な塩基配列をもつmRNAが分解される現象であって、任意の遺伝子をターゲットとする二本鎖RNAを生体内に導入すると、当該遺伝子のmRNAを介する転写後発現が阻害・抑制される。哺乳動物に関してはsiRNA(small
interfering RNA)と呼ばれる21塩基の短い二本鎖RNAを用いてRNA干渉を起こさせることが可能であり、siRNAを生体外で動物の培養細胞へ導入することもできる。
【0005】
下記の特許文献1は、脊椎動物個体内での抗原特異的な制御性T細胞分化誘導方法に関するもので、対象とする抗原を認識するT細胞に対し、野生型抗原とはT細胞の活性化能の強さが異なる変異型抗原を作成し、変異型抗原におけるT細胞活性化能の野生型抗原に対する相対的な強さに応じて、当該変異型抗原を脊椎動物個体の胸腺に投与し、あるいは脊椎動物個体の末梢組織に投与する方法を開示している。しかし、その開示内容は、要するに「変異型抗原の作成とその利用」にとどまる。
【0006】
下記の特許文献2は、アレルギー性鼻炎および喘息のためのRNAiベースの治療に関するもので、例えばIgE媒介性過敏症によって媒介される病状および疾患の処置のための1以上のRNAi因子(例えばsiRNA、sh
RNAまたはRNAiベクター)を含有する組成物ならびにこの目的に有効なRNAi因子を同定するための系について開示している。しかしその開示内容は、要するに「アレルギー性鼻炎や喘息等の疾患に対するRNAi因子の直接的投与」にとどまる。
【0007】
又、抗CD3抗体、抗CD28抗体、IL-2、TGF-β等を用いて、生体外で制御性T細胞を誘導するという方法が報告され、現在研究されている。しかし、例えば下記の非特許文献1に示唆されるように、この方法では抗原非特異的な制御性T細胞が誘導されるのみである。更に、上記の方法では、抗CD3抗体や抗CD28抗体が投与時に制御性T細胞に混入して、抗体による副作用が出現する可能性もある。実際、下記の非特許文献2に示すように、糖尿病治療における抗CD3モノクローナル抗体の短期間投与によって伝染性単核球症様の症候発症の報告がある。上記の副作用が抗CD3抗体そのものによる副作用か、抗CD3抗体によって誘導された抗原非特異的制御性T細胞によるものか不詳であるが、より安全な治療法が期待されている。
【0008】
下記の非特許文献3は、siRNAで修飾した骨髄由来の抗原提示細胞にアレルギーを引起こす特定の抗原を感作させ、これを利用してマウスのアレルギーの治療を試みたことが開示されている。但し、siRNAとしてはCD40特異的siRNAを用いており、抗原提示細胞としては樹状細胞を用いている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2007−137772号公報
【特許文献2】特表2007−527240号公報
【非特許文献】
【0010】
【非特許文献1】HoffmannP, Eder R, Kunz-Schughart LA, Andreesen R, Edinger M. “Large-scalein vitro expansion of polyclonal human CD4(+)CD25 high regulatory T cells.” Blood. 2004 Aug1;104(3):895-903. Epub 2004 Apr 15.
【非特許文献2】KeymeulenB, Vandemeulebroucke E, Ziegler AG, Mathieu C, Kaufman L, Hale G, Gorus F,Goldman M, Walter M, Candon S, Schandene L, Crenier L, De Block C, SeigneurinJM, De Pauw P, Pierard D, Weets I, Rebello P, Bird P, Berrie E, Frewin M,Waldmann H, Bach JF, Pipeleers D, Chatenoud L. “Insulin needs after CD3-antibodytherapy in new-onset type 1 diabetes.” N Engl J Med. 2005 Jun 23;352(25):2598-608.
【非特許文献3】M.Suzuki, X. Zheng, X. Zhang, Z. Zhang, T. E. Ichim, H. Sun, Y. Nakamura, A.Inagaki, M. Beduhn, A. Shunnar, B. Garcia, and W. P. Min. “A novel allergen-specific therapy forallergy using CD40-silenced dendritic cells” J. Allergy Clin. Immunol. March 2010 737-743
【発明の概要】
【発明が解決しようとする課題】
【0011】
前記のように、RNA干渉を利用した特定遺伝子の転写後発現抑制が知られており、siRNAは哺乳動物のRNA干渉における重要な技術的手段である。一方、制御性T細胞はアレルギー、膠原病、糖尿病、ウイルス疾患等の様々な疾患における治療手段として期待されており、抗原提示細胞は制御性T細胞の誘導に関与していると考えられている。
【0012】
そこで本発明は、アレルギー、膠原病、糖尿病、ウイルス疾患等の各種疾患の治療におけるsiRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用手段を提供することを、解決すべき課題とする。
【0013】
本願発明者は、上記課題の解決手段を追求する過程で、(1)特定遺伝子に特異的なsiRNAで修飾された抗原提示細胞においても標的遺伝子の転写後発現の選択的抑制が起こること、(2)siRNAで修飾されると共に抗原に感作された抗原提示細胞は抗原特異的な制御性T細胞を誘導できること、(3)抗原特異的な制御性T細胞は極めて強力な疾患抑制効果を持ち、副作用もないこと、(4)従って修飾用siRNAと感作抗原との種類を適切にマッチングさせて得られた抗原特異的制御性T細胞は、特定疾患に対する非常に効果的な治療手段となること、等の重要な知見を得るに至り、本発明を完成した。
【課題を解決するための手段】
【0014】
(第1発明の構成)
上記課題を解決するための第1発明の構成は、siRNAで修飾された抗原提示細胞(siRNA修飾APC)である修飾APCである。
【0015】
「抗原提示細胞」とは、主要組織適合抗原複合体(MHC)又はその部分に結合する抗原を細胞表面上に提示する細胞を言う。抗原提示細胞には、樹状細胞、B細胞、マクロファージ、単球、線維芽細胞、血管内皮細胞、甲状腺濾胞細胞等が包含される。
【0016】
「siRNA」とは、生体内又は細胞内に導入されたとき、標的遺伝子のmRNAを分解させ遺伝子の転写後発現を抑制する機能を持つ短鎖の二本鎖RNAをいう。標的遺伝子の種類は、抗原提示細胞が備える遺伝子である限りにおいて限定されないが、本発明の前記課題を考慮した場合、例えば第4発明に関して後述するように、抗原提示細胞とT細胞との相互作用に関与する各種の遺伝子をターゲットとするsiRNAが好ましく例示される。
【0017】
siRNAによる抗原提示細胞の修飾は、培養中の動物細胞等について、生体外で行うことができる。生体外での抗原提示細胞に対するsiRNA修飾を行う際には、例えばGeneSilence reagent(Gene Therapy Systems社)、TransIT-TKOやRiboJuice siRNA Transfection Reagent(共にタカラバイオ社)等の市販のsiRNA導入用試薬を利用することができる。
【0018】
又、siRNAによる抗原提示細胞の修飾を、例えば動物体内、特に好ましくは非ヒト動物体内で行うことができる。このような動物体内での抗原提示細胞の修飾は、siRNAの注射、内服、点鼻その他の投与手段によって行うことができる。又、動物体内で修飾されたsiRNA修飾APCは、例えば当該動物体又はその血液から分離して回収することができる。このように、非ヒト動物体内でsiRNAによる抗原提示細胞の修飾を行い、siRNAで修飾された抗原提示細胞を回収することは可能である。
【0019】
このような非ヒト動物体内での操作は、後述する第2発明で述べる「非ヒト動物体内でのAPC又はsiRNA修飾APCに対する抗原感作」、第5発明で述べる「非ヒト動物体内での抗原特異的Tregの誘導」、第9発明で述べる「非ヒト動物体内での抗原非特異的Tregの誘導」においても、基本的に同様に行うことができる。
【0020】
非ヒト動物体内でのsiRNAによる抗原提示細胞の修飾は、例えば研究目的、siRNAで修飾された抗原提示細胞の回収目的等で行うことができる。
【0021】
本発明において「非ヒト動物」の範囲は限定されないが、例えば、マウス、ラット、ウサギ、サル、イヌ、ブタその他の非ヒト哺乳動物が好ましく例示される。非ヒト動物としては、その他にもカエル、魚等の非哺乳類動物も例示される。
【0022】
「siRNA修飾APC」においては、一定の遺伝子をターゲットとするsiRNAが抗原提示細胞内に導入され、当該細胞内における当該遺伝子の転写後発現の抑制(サイレンシング)が行われている。
【0023】
(第2発明の構成)
上記課題を解決するための第2発明の構成は、siRNAで修飾されると共に抗原を感作された抗原提示細胞(siRNA修飾・抗原感作APC)である修飾APCである。
【0024】
抗原提示細胞に感作する抗原の種類は限定されず、野生型抗原、天然抗原、ウイルス抗原、自己抗原、変化抗原、合成抗原あるいは腫瘍関連抗原等が適宜に選択して用いられる。抗原としては、各種のアレルゲン等が好ましく例示される。アレルゲンとしては、卵白アルブミン(OVA)、KLH(keyhole
limpet hemocyanin)、スギ花粉、ダニ、犬や猫等の動物、真菌、昆虫等の具体例が挙げられる。
【0025】
siRNA修飾・抗原感作APCの調製においては、予めsiRNAで修飾された抗原提示細胞(siRNA修飾APC)に対して抗原を感作させることができるが、予め抗原を感作させた抗原提示細胞(抗原感作APC)に対してsiRNAによる修飾を行うこともできる。
【0026】
抗原提示細胞又はsiRNA修飾APCに対する抗原の感作は、培養中の動物細胞等について、生体外で抗原と接触させることにより行うことができる。又、例えば動物体内、特に好ましくは非ヒト動物体内で行うことができる。非ヒト動物体内での抗原の感作は、例えば研究目的、抗原感作APCの回収目的等で行うことができる。
【0027】
(第3発明の構成)
上記課題を解決するための第3発明の構成は、前記第1発明又は第2発明に係るsiRNA修飾APCにおいて、抗原提示細胞が樹状細胞又はB細胞である。
【0028】
抗原提示細胞としては、樹状細胞、B細胞、マクロファージ等の抗原提示機能を有する細胞が包含されるが、樹状細胞又はB細胞が特に好ましい。
【0029】
(第4発明の構成)
上記課題を解決するための第4発明の構成は、前記第1発明〜第3発明のいずれかに係るsiRNA修飾APCにおいて、siRNAが抗原提示細胞とT細胞との相互作用に関与する遺伝子に特異的なsiRNAである。
【0030】
siRNA修飾APCにおける抗原提示細胞を修飾しているsiRNAの種類は、抗原提示細胞が備える任意の遺伝子に特異的なsiRNAである限りにおいて限定されないが、本発明の課題を考慮すると、第4発明に規定するsiRNAが好ましい。特に好ましい具体例として、CD86特異的siRNA、TNF-α特異的siRNA、CD80特異的siRNA、VCAM-1特異的siRNA、ICAM-1特異的siRNA、CD40特異的siRNA、IL-4特異的siRNA等を例示することができる。
【0031】
上記の具体例の内、例えばCD86は「細胞表面抗原(表面マーカー)の一種であって、T細胞活性化の共刺激分子である」とされており、TNF-αは「細胞が放出する腫瘍壊死因子であり、免疫等に関与するサイトカインである」とされている。そして、後述の実施例では、CD86特異的siRNA、及び/又は、TNF-α特異的siRNAで修飾されたOVA抗原特異的Tregを用いた場合、CD86やTNF-αの発現が抑制されると共に、Foxp3 mRNAの発現量が有意に増大する。Foxp3は「自己免疫疾患抑制機能を有するCD4+CD25+ Tregの分子マーカーであり、Treg分化のマスター遺伝子である」とされている。以上の結果、実施例ではOVAアレルギーに対する高い治療効果を得ている。
【0032】
(第5発明の構成)
上記課題を解決するための第5発明の構成は、第2発明〜第4発明のいずれかに記載のsiRNA修飾・抗原感作APCを用いてナイーブT細胞から抗原特異的な制御性T細胞(抗原特異的Treg)を誘導するTreg誘導方法である。
【0033】
前記したように、抗原感作APCを用いてナイーブT細胞からTregを誘導することは知られているが、その場合に得られるのは抗原非特異的(ポリクローナル)なTregであり、治療目的に用いた場合の効果が低く、しかも非特異的に免疫細胞に作用するため副作用や新たな疾患発症の懸念がある。これに対して、第5発明のようにsiRNA修飾・抗原感作APCを用いると、ナイーブT細胞から抗原特異的Tregを誘導できるという極めて重要な知見が得られた。抗原特異的Tregは、従来の抗原非特異的Tregに比較して治療目的に用いた場合の効果が数十倍も強く、しかも「抗原特異的」であるため副作用や新たな疾患発症の懸念もない。
【0034】
「ナイーブT細胞」とは、未だ抗原提示細胞の作用を受けたことがなく、抗原提示細胞よって活性化される以前のT細胞をいう。
【0035】
siRNA修飾・抗原感作APCを用いた抗原特異的Tregの誘導は、培養中の動物細胞等について、生体外で行うことができる。又、上記の抗原特異的Tregの誘導を、例えば動物体内、特に好ましくは非ヒト動物体内で行うこともできる。このような動物体内での操作は、例えば研究目的、抗原特異的Tregの回収目的等で行うことができる。
【0036】
(第6発明の構成)
上記課題を解決するための第6発明の構成は、第5発明に記載のTreg誘導方法により得られる抗原特異的Tregである。
【0037】
(第7発明の構成)
上記課題を解決するための第7発明の構成は、第6発明に記載の抗原特異的Tregを有効成分とする治療薬である。
【0038】
本願の各発明において「治療薬」とは、有効成分である細胞のみからなり、又は有効成分である細胞を含む組成物であり、あるいは上記の細胞又は細胞含有組成物を含んで構成される治療薬キットである。「細胞を含む組成物」とはin vitro又はin vivoでの診断あるいは治療での使用に適する剤型の組成物であって、医薬的に許容可能なキャリアーとして、例えばリン酸バッファー塩類溶液、水、油/水系あるいは水/油系のエマルジョン、湿性剤、安定剤、保存剤等を含むものをいう。
【0039】
抗原特異的Tregを有効成分とする治療薬は、感作させる抗原の選択により、種々の適応症を持つ強力な治療薬とすることができる。例えばスギ花粉症の治療においては、スギ抗原特異的Tregを有効成分とする治療薬を投与することができる。卵白アルブミン(OVA)アレルギーの治療においては、OVA抗原特異的Tregを有効成分とする治療薬を投与することができる。
【0040】
第7発明の治療薬の対象疾患は抗原特異的Tregの治療効果に応じて定まり、特段に限定されないが、広義には自己免疫疾患、癌、アレルギー、移植、ウイルス疾患等と言ったカテゴリーの疾患群が例示される。更に具体的に述べれば、それらの疾患群の内でも、喘息、花粉症、膠原病等の疾患が例示される。
【0041】
(第7発明の参考発明の構成)
上記課題を解決するための第7発明の参考発明の構成は、第7発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は、第7発明の場合と同様である。
【0042】
(第8発明の構成)
上記課題を解決するための第8発明の構成は、第6発明に記載の抗原特異的Tregを抗体で増幅したものを有効成分とする治療薬である。
【0043】
上記第8発明において「抗原特異的Tregを抗体で増幅する」とは、例えば抗CD3抗体等にてTregを刺激して増幅するような操作をいう。
【0044】
このようにして増幅された有効成分を含む治療薬においては、前記第7発明の効果が一層増強される。
【0045】
第8発明の治療薬の対象疾患は抗原特異的Tregの治療効果に応じて定まり、特段に限定されないが、基本的に第7発明に関して述べたところと同様である。
【0046】
(第8発明の参考発明の構成)
上記課題を解決するための第8発明の参考発明の構成は、第8発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は、第8発明の場合と同様である。
【0047】
(第9発明の構成)
上記課題を解決するための第9発明の構成は、第1発明、第3発明、第4発明のいずれかに記載のsiRNA修飾APCを用いてナイーブT細胞から抗原非特異的な制御性T細胞(抗原非特異的Treg)を誘導するTreg誘導方法である。
【0048】
siRNA修飾APCを用いた抗原非特異的Tregの誘導は、培養中の動物細胞等について、生体外で行うことができる。又、上記の抗原非特異的Tregの誘導を、例えば動物体内、特に好ましくは非ヒト動物体内で行うこともできる。このような動物体内での操作は、例えば研究目的、抗原非特異的Tregの回収目的等で行うことができる。
【0049】
(第10発明の構成)
上記課題を解決するための第10発明の構成は、第9発明に記載のTreg誘導方法により得られる抗原非特異的Tregである。
【0050】
抗原非特異的Treg自体は公知であるが、第10発明に係る抗原非特異的なTregにおいては、siRNAに誘導されたTregであるという点において、従来の抗原非特異的Tregと異なる。
【0051】
(第11発明の構成)
上記課題を解決するための第11発明の構成は、第10発明に記載の抗原非特異的Tregを有効成分とする治療薬である。
【0052】
第11発明の治療薬は、抗原非特異的Tregを有効成分とする点を逆に利用して、例えば原因抗原が不詳な疾患や複数の抗原による疾患(例えばスギ花粉、ダニ抗原、真菌抗原等の多数に感作されているアレルギー疾患)に対する治療薬として用いることができる。
【0053】
(第11発明の参考発明の構成)
上記課題を解決するための第11発明の参考発明の構成は、第11発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は第11発明の場合と同様である。
【0054】
(第12発明の構成)
上記課題を解決するための第12発明の構成は、第6発明に記載の抗原特異的Treg又は第10発明に記載の抗原非特異的Tregを用いて修飾された免疫細胞を有効成分とする治療薬である。
【0055】
上記の第12発明において、「抗原特異的Treg又は抗原非特異的Tregを用いて免疫細胞を修飾する」とは、抗原特異的Treg又は抗原非特異的Tregによってin
vitroでB細胞等の免疫細胞を免疫寛容状態とすることを言う。そして、その免疫寛容状態となった免疫細胞を治療薬として投与することができる。
【0056】
このような修飾を受けた免疫細胞は生体内で抗原特異的Treg又は抗原非特異的Tregの作用を受けた場合と同様の活性化示すため、Treg投与によって生じる副作用の軽減等の点において有利な治療薬となる。
【0057】
第12発明の治療薬の対象疾患は抗原特異的Treg又は抗原非特異的Tregの治療効果に応じて定まり、特段に限定されないが、基本的には第7発明又は第11発明の治療薬の場合と同等である。
【0058】
(第12発明の参考発明の構成)
上記課題を解決するための第12発明の参考発明の構成は、第12発明に記載の治療薬を用いて疾患の予防、治療又は診断を行う方法である。「疾患」の内容は、第12発明の場合と同様である。
【発明の効果】
【0059】
上記した本願の各発明により、siRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用形態が提供される。より具体的には、以下に列挙する効果が得られる。
【0060】
(1)APC修飾用siRNAにおける標的遺伝子は限定されないので、目的に応じて、抗原提示細胞が備える任意の遺伝子をノックダウンさせることができる。従って、siRNAの種類を変えることにより、様々なタイプのTregを誘導できる可能性がある。更に、siRNAを直接生体に投与しなくても実施できるので、安全性が高い。
【0061】
(2)非特許文献1に開示される、抗CD3抗体、抗CD28抗体、IL-2、TGF-β等を用いて生体外で制御性T細胞を誘導する方法とは異なり、生体への投与時、抗CD3抗体、抗CD28抗体の混入がなく、抗CD3抗体、抗CD28抗体による副作用の可能性もなく、安全である。
【0062】
(3)siRNA修飾APCにより抗原非特異的Tregの誘導が可能である。抗原非特異的Tregは、例えば、原因抗原が不詳な疾患や複数の抗原による疾患(例えばスギ花粉、ダニ抗原、真菌抗原等の多数に感作されているアレルギー疾患)の治療薬として利用できる。
【0063】
(4)抗原を感作したsiRNA修飾APCにより抗原特異的Tregの誘導が可能である。抗原特異的Tregは抗原非特異的(ポリクローナル)なTregよりも数十倍強力な抑制効果を持つ。又、抗原非特異的Tregのように非特異的に免疫細胞に作用することがないため、副作用や新しい疾患発症を考えなくても良い。
【0064】
(5)本発明に係る治療薬は、その有効成分である抗原特異的Treg又は抗原非特異的Tregを誘導するsiRNA修飾APCにおけるsiRNAの種類の選択、あるいはsiRNA修飾APCに感作させる抗原の種類の選択により、種々の対象疾患に対する治療薬とすることができる。従って、治療薬の好ましい適応症は一律には規定できないが、例えば以下のものを例示できる。
【0065】
該当し得る適応症
I型糖尿病またはインスリン依存性糖尿病、全身性ループス、クローン病、心筋症、溶血性貧血、線維筋痛、グレーブス病、潰瘍性大腸炎、血管炎、多発性硬化症、重症筋無力症、筋炎、好中球減少症、乾癬、慢性疲労症候群、若年性関節炎、若年性糖尿病、強皮症、乾癬性関節炎、シェーグレン症候群、リウマチ熱、慢性関節リウマチ、サルコイドーシス、特発性血小板減少性紫斑病(ITP)、橋本病、複合性結合織疾患、間質性膀胱炎、悪性貧血、白質脳炎、円形脱毛症、強直性脊椎炎、原発性胆汁性肝硬変、抗GBM腎炎、抗TBM腎炎、抗リン脂質症候群、リウマチ性多発筋痛、多発性筋炎、自己免疫性アジソン病、慢性活動性肝炎、尋常性白斑、自己免疫性高脂血症、自己免疫性心筋炎、側頭動脈炎、自己免疫性甲状腺疾患、軸索型および神経性ニューロパシー、ベーチェット病、水疱性類天疱瘡、アレルギー性喘息、アトピー性皮膚炎、骨関節炎、シャーガス病、ブドウ膜炎、慢性炎症性脱髄性多発性根神経障害(CIDP)、瘢痕性類天疱瘡/良性粘膜類天疱瘡、コーガン症候群、先天性心ブロック、コクサッキー心筋炎、脱髄性ニューロパシー、皮膚筋炎、円板状ルーパス、レンズ抗原性ブドウ膜炎、結節性多発動脈炎、ドレスラー症候群、本態性混合性クリオグロブリン血症、エヴァンズ症候群、グッドパスチャー症候群、アレルギー性鼻炎、ギラン・バレー症候群、低γグロブリン血症、封入体筋炎、小水疱水疱性皮膚症、ヴェゲナー肉芽腫症、メニエール病、ランバート-イートン症候群、モーレン潰瘍、非典型的セリアック病、眼球瘢痕性類天疱瘡、尋常性天疱瘡、静脈周囲性脳脊髄炎、心膜切開後症候群、強膜炎、精子および睾丸自己免疫、全身強直症候群、亜急性細菌性心内膜炎(SBE)、交感性眼炎、横断性脊髄炎および壊死性ミエロパシー、多腺性自己免疫性症候群1型、多腺性自己免疫性症候群2型、悪性貧血、子宮内膜症。
【図面の簡単な説明】
【0066】
【図1】CD86 siRNAによるCD86発現の抑制(樹状細胞)を示す。
【図2】CD86 siRNAによるTNF-α発現への影響(樹状細胞)を示す。
【図3】CD86 siRNAによるCD40発現への影響(樹状細胞)を示す。
【図4】TNF-αsiRNAによるTNF-α発現の抑制(樹状細胞)を示す。
【図5】TNF-αsiRNAによるCD86発現への影響(樹状細胞)を示す。
【図6】TNF-αsiRNAによるCD40発現への影響(樹状細胞)を示す。
【図7】TNF-αsiRNAとCD86 siRNAによるTNF-α発現の抑制(樹状細胞)を示す。
【図8】TNF-αsiRNAとCD86 siRNAによるCD86発現の抑制(樹状細胞)を示す。
【図9】樹状細胞によるFoxp3発現の誘導を示す。
【図10】OVA抗原特異的制御性T細胞による抗原特異的T細胞反応への影響を示す。
【図11】OVA抗原特異的制御性T細胞によるOVA誘発鼻症状の抑制を示す。
【図12】OVA抗原特異的制御性T細胞による血清中IgEの抑制を示す。
【図13】OVA抗原特異的制御性T細胞による脾臓産生サイトカインの抑制を示す。
【図14】OVA抗原特異的制御性T細胞によるOVA誘発鼻粘膜浸潤好酸球の抑制を示す。
【図15】OVA抗原特異的制御性T細胞によるKLH誘発鼻症状への影響を示す。
【図16】OVA抗原特異的制御性T細胞によるKLH特異的IgEへの影響を示す。
【図17】OVA抗原特異的制御性T細胞によるKLH誘発鼻粘膜好酸球浸潤への影響を示す。
【図18】CD86 siRNAによるCD86発現への影響(B細胞)を示す。
【図19】CD86 siRNAによるCD40発現への影響(B細胞)を示す。
【図20】CD40 siRNAによるCD40発現への影響(B細胞)を示す。
【図21】CD40 siRNAによるCD86発現への影響(B細胞)を示す。
【図22】B細胞によるFoxp3発現の誘導を示す。
【図23】B細胞により誘導されたOVA抗原特異的制御性T細胞の効果を示す。
【図24】B細胞により誘導された制御性T細胞によるOVA誘発鼻症状の抑制を示す。
【図25】B細胞により誘導された制御性T細胞による血清中IgEの抑制を示す。
【発明を実施するための形態】
【0067】
次に本発明の実施形態を、その最良の形態を含めて説明する。
【0068】
〔第1発明〜第12発明の実施形態〕
抗原提示細胞は、例えばヒト又は適宜な非ヒト動物(例えばマウス)から採取した血液より分離したり、ヒトの例えば胸骨等の骨髄の骨髄前駆細胞から樹立したり、更には適宜な非ヒト動物(例えばマウス)から採取した脾臓から分離したり、適宜な非ヒト動物(例えばマウス)から採取した肺、鼻、皮膚等の局所組織から分離することによって得ることができる。
【0069】
血液からの抗原提示細胞の分離には、抗体やビーズ等の手段を用いることができる。骨髄前駆細胞から樹状細胞を樹立するにあたっては、マウス等の例えば大腿骨、脛骨、上腕骨、前腕骨等を用い、これをフラッシュして骨髄前駆細胞を採取すると共に、この骨髄前駆細胞をサイトカインと一緒に培養することにより、樹立することができる。
【0070】
得られた抗原提示細胞に、例えば生体外にてsiRNA導入用試薬を用いてsiRNAを導入し、抗原提示細胞を修飾する。
【0071】
次に、siRNAにより修飾された抗原提示細胞(siRNA修飾APC)と、血液より採取したT細胞(例えばCD4+CD25-T細胞)を例えば生体外にて混ぜあわせ、反応させる。「生体外にて」とは、例えばFCSを含むRPMI 1640中、CO2インキュベーター中等でsiRNA修飾APCとT細胞を接触させることをいう。反応させることによって、制御性T細胞(Treg)が誘導される。誘導されたTregを、抗体(CD4、CD25抗体等)、ビーズ等を用いて取り出す。こうして取り出したTregを直接体内に投与して、疾患を治療する。もしくはTregを用いて生体外で修飾し、修飾した免疫細胞を用いて治療する。siRNAは全ての遺伝子をターゲットにできる。Tregにも様々なタイプが存在するが、siRNAの種類を変えることによって、様々なTregを誘導できる可能性がある。
【0072】
以上は抗原非特異的Tregに関するが、siRNA修飾APCに抗原を感作すれば、抗原特異的抗原提示細胞を作製できる。上記と同様のプロセスにより、抗原特異的抗原提示細胞とT細胞を生体外にて混ぜあわせ、反応させることによって、抗原特異的なTregが誘導される。誘導された抗原特異的Tregを抗体やビーズ等を用いて取り出す。この抗原特異的Tregを治療薬として生体内に投与することができる。抗原特異的なTregであるため、抗原特異的な治療が可能である。
【0073】
また、抗原特異的Tregは抗原非特異的(ポリクローナル)Tregよりも数十倍強力な抑制効果をもつことが報告されている。例えばスギ花粉症の患者にスギ抗原特異的Tregを投与すればスギ花粉症に対する特異的な治療となる。抗原非特異的Tregは非特異的に免疫細胞に作用するため、様々な副作用が起こり得る。従って、抗原非特異的Tregを生体に投与した場合、目的とする疾患は改善されるが、新たな疾患が発症する可能性がある。これらの問題点を考えた場合、抗原特異的Tregは非常に有用な手段である。
【0074】
〔第1発明〜第12発明の特徴〕
前記した本願の第1発明〜第12発明の特徴として、以下の点が挙げられる。
【0075】
(1)抗原特異的Tregの誘導が可能である。
【0076】
(2)抗原特異的Tregは抗原非特異的(ポリクローナル)Tregよりも数十倍強力な抑制効果を持つ。
【0077】
(3)抗原特異的Tregは特異的に免疫細胞に作用するので、抗原非特異的Tregによる副作用や新しい疾患発症を考えなくても良い。
【0078】
(4)抗CD3抗体、抗CD28抗体を使用しないので安全である。即ち、生体への投与時に抗CD3抗体、抗CD28抗体の混入がない。
【0079】
(5)抗CD3抗体、抗CD28抗体による副作用の可能性がない。
【0080】
(6)siRNAを直接生体に投与しないので、安全性が高い。
【0081】
(7)Tregにも様々なタイプが存在するが、siRNAの種類を変えることによって、様々なTregを誘導できる可能性がある。
【実施例】
【0082】
次に本発明の実施例を説明する。本発明の技術的範囲は以下の実施例によって限定されない。
〔第1実施例:樹状細胞〕
(実験の概要)
マウスの骨髄細胞より樹状細胞を樹立し、樹立した樹状細胞にCD86特異的siRNA、TNF-α特異的siRNAを導入した後、OVA(卵白アルブミン)を感作して、ノックダウンOVA特異的樹状細胞(CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞、CD86-TNF-αノックダウンOVA樹状細胞)を作製した。
【0083】
脾臓より分離したCD4+T細胞とノックダウン樹状細胞を共に6穴プレートに入れ、反応させた。5日後、ノックダウンOVA樹状細胞群はコントロール群より有意にFoxp3陽性制御性T細胞の陽性率とFoxp3 mRNAの発現を増やしていた。CD86-TNF-αノックダウンOVA樹状細胞、CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞の中では、CD86-TNF-αノックダウンOVA樹状細胞が最も高率にFoxp3 mRNAの発現を増やしていた(図7)。
【0084】
ノックダウンOVA樹状細胞によって誘導された制御性T細胞(OVA抗原特異的制御性T細胞)はOVA特異的T細胞反応を抑制した。しかし、OVA抗原特異的制御性T細胞はKLH特異的T細胞反応、スギ特異的T細胞反応等の他のT細胞反応は抑制しなかった(図8)。
【0085】
OVA抗原によるアレルギー性鼻炎モデルマウスにノックダウンOVA抗原特異的制御性抗原提示細胞によって誘導された制御性T細胞(OVA抗原特異的制御性T細胞)を投与してその効果を検討した。OVA抗原特異的制御性T細胞を投与した群、CD4+CD25-細胞を投与した群、PBSのみを投与した群の3群を作製して、比較検討した。OVA抗原特異的制御性T細胞は他のコントロール2群と比べて有意に血中OVA特異的IgE抗体、OVA刺激によって脾臓細胞から産生されるIL-4、IL-5、鼻粘膜の好酸球浸潤、くしゃみ回数、鼻掻き回数を抑制した。また、OVA抗原特異的制御性T細胞はKLH抗原によるアレルギー性鼻炎モデルマウスのKLH特異的IgE抗体、KLH刺激によって脾臓細胞から産生されるIL-4、IL-5、鼻粘膜の好酸球浸潤、くしゃみ回数、鼻掻き回数を抑制しなかった(図9〜図15)。
【0086】
(実験方法)
骨髄細胞由来樹状細胞の樹立
下記参考文献1の記載に準じて、樹状細胞は骨髄前駆細胞から作製した。即ち、マウスの大腿骨、脛骨をフラッシュして骨髄前駆細胞を採取した。骨髄前駆細胞を洗浄した後、24穴プレートにて培養した。コンプリートミディアム2ml(2 mM L-glutamine、100 U/ml penicillin、100μg/ml streptomycin、50μM 2-ME、10%FCSを含むRPMI 1640)に10 ng/mlリコンビナントGM-CSFとIL-4を加え、4 x 106の骨髄前駆細胞を入れて、37℃ 5%CO2インキュベーターの中で培養することにより樹状細胞を樹立した。
【0087】
(参考文献1)M. Suzuki, X. Zheng, X. Zhang, M. Li, C. Vladau, T. E. Ichim, H.
Sun, L. R. Min, B. Garcia, and W. P. Min. 2008. “Novel vaccination for allergy
through gene silencing of CD40 using small interfering RNA” J. Immunol. 180:8461。
【0088】
siRNAの感作
GeneSilencer
reagent (Gene Therapy Systems)を用いてsiRNAを抗原提示細胞に感作した。siRNA (2 μg)、GeneSilencer
reagent(20μl)を50μl のRPMI 1640に混ぜ30分間、室温にて留置した。留置後、この混合液を12穴プレート中にある400μlの抗原提示細胞に加えた。siRNAとしてはCD86に対して特異的なsiRNA(CD86 siRNA)、TNF-αに対して特異的なsiRNA(TNF-αsiRNA)、コントロールとしてコントロールsiRNAを用いた。また、もう一つのコントロールとしてsiRNAを使用しないコントロール群(No siRNA)も作製した。4時間後、同量のミディアム(20%FBS, 20 ng/ml GM-CSF
(PeproTech)、20 ng/ml IL-4を含んだRPMI 1640を加えた。
【0089】
制御性T細胞の作製
樹立した樹状細胞に配列表の配列番号1に示すCD86特異的siRNA(CD86, 5′-AUAAUUGAUCCUGUGGGUGGC-3)、配列表の配列番号2に示すTNF-α特異的siRNA(5-GACAACCAACUAGUGGUGC-3)を導入し、OVA(卵白アルブミン)を感作して、ノックダウンOVA特異的樹状細胞(CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞、CD86-TNF-αノックダウンOVA樹状細胞)を作製した。脾臓より分離したT細胞(1X105/ウェル)とノックダウンOVA樹状細胞(1X105/ウェル)を共に6穴プレートに入れ、5日間反応させた。
【0090】
Real-time PCR
TRIzol
(Invitrogen)を用いて樹状細胞よりTotal RNAを抽出した(参考文献1参照)。10 U DNase I を用いて20μg RNAを分解(37℃下で30分間)、phenol:chloroform (3:1)で抽出、ethanolで凝結、70% ethanolで洗浄した。その後、20 μl 水(Rnaseを除去した水)を用いて溶解した。SuperScript
Preamplification System (Invitrogen)を用いてFirst-strand cDNAを作製した。Real-time PCRはSYBR Green PCR Master
mix (Stratagene)と100 nM 遺伝子特異的プライマーを用いて施行した。PCRのコンディションは95℃ 10 分, 95℃ 30秒, 58℃ 1分, 72℃ 30秒 (40 サイクル)とした。コントロールとしてはGAPDHプライマーを使用した。以下の(1)〜(5)に示す10種の塩基配列を、その順に、配列表の配列番号3〜12に示す。
【0091】
(1) CD40 5’-TCTAGAGTCCCGGATGCGAG-3’ (forward)
5’-GGATCCTCAAGGCTATGCTGTC G-3’ (reverse)
(2) CD86 5’-GTATGTCACAAGAAGCCGAATCA-3’ (forward)
5’-TTAAACAAAGCAAGACAAATAGA-3’ (reverse)
(3) TNF-α
5’-CTCCCTCCAGAAAAGACACCAT-3’ (forward)
5’-ATCACCCCGAAGTTCAGTAGACAG-3’ (reverse
(4) Foxp3 5’-CAGCTGCCTACAGTGCCCCTAG-3’ (forward)
5’-CATTTGCCAGCAGTGGGTAG-3’ (reverse)
(5) GAPDH 5’-TGATGACATCAAGAAGGTGGTGAA-3’ (forward)
5’-TCCTTGGAGGCCATGTAGGCCAT-3’ (reverse)
制御性T細胞(Treg)の分離
制御性T細胞(Treg)としてCD4+CD25+ T細胞を分離した。MACS system を用いてCD4+CD25+ T細胞を抗原提示細胞とT細胞の共培養液より採取した。まずMACS negative selection CD4 isolation kit (Miltenyi Biotec)を用いてCD4+ T細胞を分離した。次に、anti-CD25 MACS beads (Miltenyi Biotec)を用いてCD4+CD25+T細胞とCD4+CD25- T細胞を分離した。
【0092】
感作、免疫と治療
8週齢の雄BALB/cマウスを用いた。10 μg OVA と 4 mg Al(OH3)をDay 0とDay 14の2回腹腔内に投与した。Day 21からDay 27 に毎日卵白アルブミン(ovalbumin、OVA、600 μg)を点鼻投与して、OVAに対するアレルギー性鼻炎モデルマウスを作製した。
【0093】
Day28にOVA特異的CD4+CD25+制御性T細胞(1X106)を静脈投与した(CD4+CD25+制御性T細胞投与群、CD4+CD25-T細胞投与群、PBS投与群の3群を作製した)。Day 28からDay 34に再度卵白アルブミン(OVA、 600 μg)を点鼻投与した。下記参考文献2の記載に準じてDay34の点鼻チャレンジの後、20分間の鼻掻き回数とくしゃみ回数を数えて、比較検討した。Day35に血液、脾臓、鼻粘膜組織を採取した。
【0094】
(参考文献2)M. Suzuki, N. Ohta,
W. P. Min, T. Matsumoto, R. Min, X. Zhang, K. Toida, and S. Murakami. 2007.
“Immunotherapy with CpG DNA conjugated with T-cell epitope peptide of an
allergenic Cry j 2 protein is useful for control of allergic conditions in
mice” Int. Immunopharmacol. 7:46。
【0095】
又、KLHに対するアレルギー性鼻炎モデルマウスも作製して、同様の実験を行った。具体的には10 μg KLH と 4 mg Al(OH3)をDay0とDay 14の2回腹腔内に投与した。Day 21からDay 27 に毎日KLH(30 μg)を点鼻投与して、KLHに対するアレルギー性鼻炎モデルマウスを作製した。
【0096】
Day28にOVA特異的CD4+CD25+制御性T細胞(1X106)を静脈投与した(CD4+CD25+制御性T細胞投与群、CD4+CD25-T細胞投与群、PBS投与群の3群を作製した)。Day 28からDay 34に再度KLH(30 μg)を点鼻投与した。Day34の点鼻チャレンジの後、20分間鼻掻き回数とくしゃみ回数を数えた。Day35に血液、脾臓、鼻粘膜組織を採取した。
【0097】
血清特異的IgEの測定
ELISAを用いてマウス血清特異的IgEを測定した。抗マウス特異的IgE抗体をELISA プレートにコートした後、ブロッキングバッファーを加え非特異的結合を防いだ。血清を加え37℃で2時間インキュベイトした後、3回洗浄した。ビオチン化スギ抗原を加え、洗浄した。アビジン−パーオキシダ−ゼを加えインキュベイトした後、洗浄した。TMB Microwell
Peroxidase Substrate systemを用いて発色させた。ODは450nmで測定した。
【0098】
OVA抗原特異的T細胞反応
アレルギーモデルマウスより採取した脾臓からFicoll-Paqueを用いてT細胞を分離した。分離したT細胞をコンプリートミディアムに溶かし、96穴プレートに入れ(4 x 105 cells/1ウェル)、OVA(100 μg/ml)抗原の存在下で72時間培養した。1 μCi の[3H]thymidineを加え、16時間培養した。[3H]thymidineの取り込みはシンチレーションカウンターを用いて測定した。3回測定して、cpm(counts per minute)の平均を結果として用いた。
【0099】
OVA抗原特異的T細胞反応によって産生されるIL-4、IL-5の測定
OVA抗原特異的T細胞反応培養上清中のIL-4、IL-5を特異的抗体を用いたサンドイッチELISAにて測定した。抗IL-4モノクローナル抗体もしくは抗IL-5モノクローナル抗体をプレートに吸着後、培養上清を加えた。洗浄後、ビオチン化した抗IL-4モノクローナル抗体もしくは抗IL-5モノクローナル抗体を加え、アビジン−パーオキシダ−ゼ、TMB Microwell
Peroxidase Substrate systemを用いて発色させた。リコンビナントサイトカインを用いて、スタンダードカーブを作製した。
【0100】
TregによるOVA特異的T細胞反応の抑制
アレルギーマウスの脾臓より分離したT細胞を96穴プレートに入れ(5 x 105/ウェル)、400 μg/ml OVAと反応させた(OVA抗原特異的T細胞反応)。CD4+CD25+ 制御性T細胞もしくはCD4+CD25- T細胞を加え、制御性T細胞のT細胞反応抑制能力を[3H]thymidineの取り込みにて評価した。
【0101】
病理
頭部を切り離して10% formalinで固定した後、脱灰して、薄片に切り分けた。鼻組織を3μMの厚さで切った後、Luna染色で染めた。鼻中隔に存在する好酸球の数をカウントした。強拡(10 x 40)で認められる好酸球数を測定した。
【0102】
統計学的解析
one-way ANOVA(Newman-Keuls Test)を用いて解析した。P < 0.05の場合、統計学的に有意と判断した。
【0103】
(結果)
siRNA感作による遺伝子ノックダウン効果
樹立した樹状細胞にCD86 siRNA、TNF-αsiRNAもしくはCD86 siRNAとTNF-αsiRNAの両方を感作した後、OVA抗原を導入、CD86ノックダウンOVA樹状細胞、TNF-αノックダウンOVA樹状細胞、CD86-TNF-αノックダウンOVA樹状細胞を作製した。ノックダウンOVA樹状細胞のRNAを抽出、Real time PCRを施行した。
【0104】
その結果、図1に示すように、CD86 ノックダウンOVA樹状細胞では有意にCD86発現が抑制していた。しかし、CD86 ノックダウンOVA樹状細胞ではTNF-α(図2)、CD40(図3)、CD80等の他の遺伝子の発現を抑制していなかった。又、図4に示すように、TNF-α
ノックダウンOVA樹状細胞ではTNF-αの発現が抑制していた。しかし、TNF-α ノックダウンOVA樹状細胞ではCD86(図5)、CD40(図6)、CD80等の他の遺伝子発現を抑制していなかった。
【0105】
更に、CD86siRNAとTNF-αsiRNAの双方を用いて両方をノックダウンさせたOVA樹状細胞であるCD86TNF-αノックダウンOVA樹状細胞では、図7に示すようにTNF-αの発現が抑制し、かつ、図8に示すようにCD86の発現が抑制していた。
【0106】
なお、図1〜図8において、「No siRNA」の表記はsiRNAを感作していない樹状細胞を意味し、「Scrambled siRNA」の表記は効果のないsiRNAを感作したコントロールとしての樹状細胞を意味する。
【0107】
樹状細胞によるFoxp3発現の誘導
脾臓より分離したT細胞とノックダウンOVA樹状細胞を共にプレートに入れ反応させた。5日後、ノックダウンOVA樹状細胞群はコントロール群より有意にFoxp3 mRNAの発現を増やしていた。また、ノックダウンOVA樹状細胞の中では、CD86-TNF-αノックダウンOVA樹状細胞が最も高率にFoxp3 mRNAの発現を増やしていた(図9)。
【0108】
なお、図9において、「CD86」の表記はCD86 siRNAによって感作された樹状細胞を、「TNF-α」の表記はTNF-α siRNAによって感作された樹状細胞を、「CD86 TNF-α半量」の表記は上記「CD86」の場合の半量のCD86 siRNA及び上記「TNF-α」の場合の半量のTNF-α siRNAによって感作された樹状細胞を、「CD86
TNF-α同量」の表記は上記「CD86」の場合と同量のCD86
siRNA及び上記「TNF-α」の場合と同量のTNF-α siRNAによって感作された樹状細胞を、それぞれ示す。
【0109】
制御性T細胞による抗原特異的T細胞反応への影響
抗原(OVA、KLHもしくはスギ花粉)特異的T細胞に、CD86-TNF-αノックダウン樹状細胞に誘導された制御性T細胞(CD4+CD25+制御性T細胞)を加えて、抗原特異的T細胞反応への影響をIn vitroにて検討した。
【0110】
CD86-TNF-αノックダウンOVA樹状細胞によって誘導されたCD4+CD25+制御性T細胞はOVA抗原特異的T細胞反応を抑制したが、KLH抗原特異的T細胞反応やスギ花粉抗原特異的T細胞反応を抑制しなかった(図10)。
【0111】
なお、図10において、「Responder」とはT細胞反応に関与するT細胞を意味し、具体的にはCD4+CD25-T細胞である。「Inhibitor」とはT細胞反応を抑制するT細胞を意味し、具体的にはCD4+CD25+制御性T細胞である。従って「Ratio of Responders to Inhibitors」、即ちResponderに対するInhibitorの比率が高まるにつれてCPM(Counts per minutes:T細胞反応を意味するサイミジンの取り込みを示す値)が低下する場合、抗原特異的T細胞反応が有効に抑制されていることを示す。
【0112】
制御性T細胞による症状の抑制
CD86TNF-αノックダウンOVA樹状細胞によって誘導されたCD4+CD25+制御性T細胞(OVA抗原特異的制御性T細胞)の効果をIn vivoにて検討した。OVA抗原によるアレルギー性鼻炎モデルマウスにOVA抗原特異的制御性T細胞を投与した。
【0113】
即ち、以下の3群を作製して、比較検討した。
【0114】
(1)抗原特異的制御性T細胞(CD4+CD25+T細胞)を投与した群。この群はCD86-TNF-αノックダウン樹状細胞に誘導されたCD4+CD25+T細胞を投与した群であり、図11〜図17においては「CD4+CD25+」と表記されている。
【0115】
(2)CD4+CD25-T細胞を投与した群。この群はScrambled siRNA感作樹状細胞に誘導されたCD4+CD25-T細胞を投与したコントロール群であり、図11〜図17においては「CD4+CD25-」と表記されている。
【0116】
(3)PBS(Phosphate buffered saline)のみを投与したコントロール群。この群は図11〜図17においては「PBS alone」と表記されている。
【0117】
その結果、OVA抗原特異的制御性T細胞は、他のコントロール2群と比べて有意にくしゃみ回数、鼻掻き回数(図11)、血中OVA特異的IgE抗体(図12)、OVA刺激によって脾臓細胞から産生されるIL-4、IL-5(図13)、鼻粘膜の好酸球浸潤(図14)を抑制した。また、OVA抗原特異的制御性T細胞はKLH抗原によるアレルギー性鼻炎モデルマウスのくしゃみ回数、鼻掻き回数、KLH特異的IgE抗体、鼻粘膜の好酸球浸潤を抑制しなかった(図15〜図17)。
〔第2実施例:B細胞〕
(実験の概要)
マウスの脾臓細胞よりB細胞を分離し、分離したB細胞にCD86特異的siRNA、CD40特異的siRNAを導入した。次いでこれらのB細胞にOVA(卵白アルブミン)を感作して、ノックダウンOVA特異的B細胞(CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞)を作製した。CD86ノックダウンOVA B細胞、CD40ノックダウンOVA
B細胞にT細胞を反応させると、有意にOVA抗原特異的制御性T細胞が誘導された。また誘導された抗原特異的制御性T細胞はOVA抗原特異的T細胞反応を抑制したが、KLH抗原特異的T細胞反応を抑制しなかった(後述する図23)。
【0118】
(実験方法)
B細胞の分離
正常マウスの脾臓を採取し、脾臓よりCD19マイクロビーズを用いてB細胞を分離した。
【0119】
siRNAの感作
GeneSilencer
reagent (Gene Therapy Systems)を用いてsiRNAをB細胞に感作した。siRNA (2 μg)、GeneSilencer
reagent(20μl)を50μl のRPMI 1640に混ぜ30分間、室温にて留置した。留置後、この混合液を12穴プレート中にある400μlのB細胞に加えた。siRNAとしてはCD86に対して特異的なsiRNA(CD86 siRNA)、CD40に対して特異的なsiRNA(CD40 siRNA)を用いた。又、もう一つのコントロールとしてsiRNAを使用しないコントロール群(No siRNA)も作製した。4時間後、同量のミディアム(20%FBS, 20 ng/ml GM-CSF
(PeproTech)、20 ng/ml IL-4を含んだRPMI 1640を加えた。
【0120】
制御性T細胞の作製
分離したB細胞に、前記した配列表の配列番号1に示すCD86特異的siRNA、配列表の配列番号13に示すCD40特異的siRNA(5- UUCUCAGCCCAGUGGAACA -3)と配列表の配列番号14に示すCD86特異的siRNA(5- AUAAUUGAUCCUGUGGGUGGC -3)を導入し、OVA(卵白アルブミン)を感作して、ノックダウンOVA特異的B細胞(CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞)を作製した。脾臓より分離したB細胞(1X105/ウェル)とノックダウンOVA B細胞(1X105/ウェル)を共に6穴プレートに入れ、5日間反応させた。
【0121】
Real-time PCR
TRIzol (Invitrogen)を用いてB細胞よりTotal RNAを抽出した(参考文献1参照)。10 U DNase I を用いて20μg RNAを分解(37℃下で30分間)、phenol:chloroform (3:1)で抽出、ethanolで凝結、70% ethanolで洗浄した。その後、20 μl 水(Rnaseを除去した水)を用いて溶解した。SuperScript
Preamplification System (Invitrogen)を用いてFirst-strand cDNAを作製した。Real-time PCRはSYBR Green PCR Master mix (Stratagene)と100 nM 遺伝子特異的プライマーを用いて施行した。PCRのコンディションは95℃ 10 分, 95℃ 30秒, 58℃ 1分, 72℃ 30秒 (40 サイクル)とした。コントロールとしてはGAPDHプライマーを使用した。プライマーの塩基配列は、前記した第1実施例における「Real-time PCR」の欄で示した(1)、(2)、(4)、(5)の通りである。
【0122】
制御性T細胞(Treg)の分離
制御性T細胞(Treg)としてCD4+CD25+ T細胞を分離した。MACS system を用いてCD4+CD25+ T細胞を抗原提示細胞とT細胞の共培養液より採取した。まずMACS negative
selection CD4 isolation kit (Miltenyi Biotec)を用いてCD4+ T細胞を分離した。次に、anti-CD25 MACS beads
(Miltenyi Biotec)を用いてCD4+CD25+T細胞とCD4+CD25- T細胞を分離した。
【0123】
感作、免疫と治療
8週齢の雄BALB/cマウスを用いた。10 μg OVA と 4 mg Al(OH3)をDay 0とDay 14の2回腹腔内に投与した。Day 21からDay 27 に毎日卵白アルブミン(ovalbumin、OVA、600 μg)を点鼻投与して、OVAに対するアレルギー性鼻炎モデルマウスを作製した。
【0124】
Day28にOVA特異的CD4+CD25+制御性T細胞(1X106)を静脈投与した(CD4+CD25+制御性T細胞投与群、CD4+CD25-T細胞投与群、PBS投与群の3群を作製した)。Day 28からDay 34に再度卵白アルブミン(OVA、 600 μg)を点鼻投与した。下記参考文献2の記載に準じてDay34の点鼻チャレンジの後、20分間の鼻掻き回数とくしゃみ回数を数えて、比較検討した。Day35に血液、脾臓、鼻粘膜組織を採取した。
【0125】
血清特異的IgEの測定
ELISAを用いてマウス血清特異的IgEを測定した。抗マウス特異的IgE抗体をELISA プレートにコートした後、ブロッキングバッファーを加え非特異的結合を防いだ。血清を加え37℃で2時間インキュベイトした後、3回洗浄した。ビオチン化スギ抗原を加え、洗浄した。アビジン−パーオキシダ−ゼを加えインキュベイトした後、洗浄した。TMB Microwell Peroxidase Substrate
systemを用いて発色させた。ODは450nmで測定した。
【0126】
OVA抗原特異的T細胞反応
アレルギーモデルマウスより採取した脾臓からFicoll-Paqueを用いてT細胞を分離した。分離したT細胞をコンプリートミディアムに溶かし、96穴プレートに入れ(4 x 105 cells/1ウェル)、OVA(100 μg/ml)抗原の存在下で72時間培養した。1 μCi の[3H]thymidineを加え、16時間培養した。[3H]thymidineの取り込みはシンチレーションカウンターを用いて測定した。3回測定して、cpm(count per minute)の平均を結果として用いた。
【0127】
TregによるOVA特異的T細胞反応の抑制
アレルギーマウスの脾臓より分離したT細胞を96穴プレートに入れ(5 x 105/ウェル)、400 μg/ml OVAと反応させた(OVA抗原特異的T細胞反応)。CD4+CD25+ 制御性T細胞もしくはCD4+CD25- T細胞を加え、制御性T細胞のT細胞反応抑制能力を[3H]thymidineの取り込みにて評価した。
【0128】
統計学的解析
one-way ANOVA(Newman-Keuls Test)を用いて解析した。P < 0.05の場合、統計学的に有意と判断した。
【0129】
(結果)
siRNA感作による遺伝子ノックダウン効果
分離したB細胞にCD86
siRNA又はCD40 siRNAを感作した後、OVA抗原を導入して、CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞を作製した。ノックダウンOVA B細胞のRNAを抽出し、Real time PCRを施行した。
【0130】
その結果、図18に示すように、CD86ノックダウンOVA B細胞では有意にCD86発現が抑制していた。しかし、CD86 ノックダウンOVA B細胞ではCD40の遺伝子の発現を抑制していなかった(図19)。又、図20に示すように、CD40ノックダウンOVA B細胞ではCD40の発現が抑制していた。しかし、CD40ノックダウンOVA B細胞ではCD86の遺伝子発現を抑制していなかった(図21)。
【0131】
B細胞によるFoxp3発現の誘導
この実験では、CD86ノックダウンOVA B細胞、CD40ノックダウンOVA B細胞に加えて、分離したB細胞にCD86 siRNA及びCD40 siRNAを感作した後、OVA抗原を導入してなるCD40-CD86-ノックダウンOVA B細胞も用いた。
【0132】
脾臓より分離したT細胞とノックダウンOVA B細胞を共にプレートに入れ反応させた。5日後、ノックダウンOVA B細胞群はコントロール群より有意にFoxp3 mRNAの発現を増やしていた。又、ノックダウンOVA B細胞群の中では、CD40-CD86-ノックダウンOVA B細胞が最も高率にFoxp3 mRNAの発現を増やしていた(図22)。
【0133】
なお、図22において、「CD86」の表記はCD86 siRNAによって感作されたB細胞を、「CD40」の表記はCD40 siRNAによって感作されたB細胞を、「CD40 CD86半量」の表記は上記「CD40」の場合の半量のCD40 siRNA及び上記「CD86」の場合の半量のCD86 siRNAによって感作されたB細胞を、「CD40
CD86同量」の表記は上記「CD40」の場合と同量のCD40 siRNA及び上記「CD86」の場合と同量のCD86 siRNAによって感作されたB細胞を、それぞれ示す。
【0134】
制御性T細胞による抗原特異的T細胞反応への影響
抗原(OVA又はKLH)特異的T細胞に、CD40-CD86-ノックダウンOVA B細胞に誘導された制御性T細胞(CD4+CD25+制御性T細胞)を加えて、抗原特異的T細胞反応への影響をIn vitroにて検討した。CD40-CD86-ノックダウンOVA B細胞によって誘導されたCD4+CD25+制御性T細胞はOVA抗原特異的T細胞反応を抑制したが、KLH抗原特異的T細胞反応を抑制しなかった(図23)。
【0135】
なお、図23において、「Responder」、「Inhibitor」の意味は図10に関して説明した通りである。
【0136】
感作、免疫と治療
前記「(実験方法)」中の「感作、免疫と治療」の項における鼻掻き回数とくしゃみ回数を数えた結果を図24に示す。図24において、「PBS
alone」はPBS投与群を、「CD25-」はCD4+CD25-T細胞投与群を、「CD25+」はCD4+CD25+制御性T細胞投与群をそれぞれ示すが、OVA抗原特異的制御性T細胞は他のコントロール2群と比べて有意にくしゃみ回数、鼻掻き回数を抑制した。
【0137】
制御性T細胞による症状の抑制
CD40-CD86-ノックダウンOVA B細胞によって誘導されたCD4+CD25+制御性T細胞(OVA抗原特異的制御性T細胞)の効果をIn vivoにて検討した(図25)。OVA抗原によるアレルギー性鼻炎モデルマウスにOVA抗原特異的制御性T細胞を投与した。
【0138】
即ち、以下の3群を作製して、比較検討した。
【0139】
(1)抗原特異的制御性T細胞(CD4+CD25+T細胞)を投与した群。この群はCD40-CD86-ノックダウンOVA B細胞に誘導されたCD4+CD25+T細胞を投与した群であり、図25においては「CD4+CD25+」と表記されている。
【0140】
(2)CD4+CD25-T細胞を投与した群。この群はScrambled siRNA感作B細胞に誘導されたCD4+CD25-T細胞を投与したコントロール群であって、図25においては「CD4+CD25-」と表記されている。
【0141】
(3)PBSのみを投与したコントロール群。この群は図25において「PBS alone」と表記されている。
【0142】
その結果、OVA抗原特異的制御性T細胞は、他のコントロール2群と比べて、アレルギー性鼻炎モデルマウスの血中OVA特異的IgE抗体を有意に抑制した(図25)。
【産業上の利用可能性】
【0143】
本発明により、siRNA、抗原提示細胞及び制御性T細胞の新規で有用な利用手段が提供される。
【特許請求の範囲】
【請求項1】
siRNAで修飾された抗原提示細胞(siRNA修飾APC)である修飾APC。
【請求項2】
siRNAで修飾されると共に抗原を感作された抗原提示細胞(siRNA修飾・抗原感作APC)である修飾APC。
【請求項3】
前記抗原提示細胞が樹状細胞又はB細胞である請求項1又は請求項2に記載の修飾APC。
【請求項4】
前記siRNAが抗原提示細胞とT細胞との相互作用に関与する遺伝子に特異的なsiRNAである請求項1〜請求項3のいずれかに記載の修飾APC。
【請求項5】
請求項2〜請求項4のいずれかに記載のsiRNA修飾・抗原感作APCを用いてナイーブT細胞から抗原特異的な制御性T細胞(抗原特異的Treg)を誘導するTreg誘導方法。
【請求項6】
請求項5に記載のTreg誘導方法により得られる抗原特異的Treg。
【請求項7】
請求項6に記載の抗原特異的Tregを有効成分とする治療薬。
【請求項8】
請求項6に記載の抗原特異的Tregを抗体で増幅したものを有効成分とする治療薬。
【請求項9】
請求項1、請求項3、請求項4のいずれかに記載のsiRNA修飾APCを用いてナイーブT細胞から抗原非特異的な制御性T細胞(抗原非特異的Treg)を誘導するTreg誘導方法。
【請求項10】
請求項9に記載のTreg誘導方法により得られる抗原非特異的Treg。
【請求項11】
請求項10に記載の抗原非特異的Tregを有効成分とする治療薬。
【請求項12】
請求項6に記載の抗原特異的Treg又は請求項10に記載の抗原非特異的Tregを用いて修飾された免疫細胞を有効成分とする治療薬。
【請求項1】
siRNAで修飾された抗原提示細胞(siRNA修飾APC)である修飾APC。
【請求項2】
siRNAで修飾されると共に抗原を感作された抗原提示細胞(siRNA修飾・抗原感作APC)である修飾APC。
【請求項3】
前記抗原提示細胞が樹状細胞又はB細胞である請求項1又は請求項2に記載の修飾APC。
【請求項4】
前記siRNAが抗原提示細胞とT細胞との相互作用に関与する遺伝子に特異的なsiRNAである請求項1〜請求項3のいずれかに記載の修飾APC。
【請求項5】
請求項2〜請求項4のいずれかに記載のsiRNA修飾・抗原感作APCを用いてナイーブT細胞から抗原特異的な制御性T細胞(抗原特異的Treg)を誘導するTreg誘導方法。
【請求項6】
請求項5に記載のTreg誘導方法により得られる抗原特異的Treg。
【請求項7】
請求項6に記載の抗原特異的Tregを有効成分とする治療薬。
【請求項8】
請求項6に記載の抗原特異的Tregを抗体で増幅したものを有効成分とする治療薬。
【請求項9】
請求項1、請求項3、請求項4のいずれかに記載のsiRNA修飾APCを用いてナイーブT細胞から抗原非特異的な制御性T細胞(抗原非特異的Treg)を誘導するTreg誘導方法。
【請求項10】
請求項9に記載のTreg誘導方法により得られる抗原非特異的Treg。
【請求項11】
請求項10に記載の抗原非特異的Tregを有効成分とする治療薬。
【請求項12】
請求項6に記載の抗原特異的Treg又は請求項10に記載の抗原非特異的Tregを用いて修飾された免疫細胞を有効成分とする治療薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【公開番号】特開2013−59295(P2013−59295A)
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2011−200844(P2011−200844)
【出願日】平成23年9月14日(2011.9.14)
【出願人】(506218664)公立大学法人名古屋市立大学 (48)
【Fターム(参考)】
【公開日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成23年9月14日(2011.9.14)
【出願人】(506218664)公立大学法人名古屋市立大学 (48)
【Fターム(参考)】
[ Back to top ]

