uPARに対して向けられる標的化結合剤および該結合剤の使用
抗原uPARに対して向けられる標的化結合剤、およびこうした抗体の使用を記載する。特に、抗原uPARに対して向けられる完全ヒト・モノクローナル抗体。重鎖および軽鎖免疫グロブリン分子をコードするヌクレオチド配列、および該分子を含むアミノ酸配列、特に、フレームワーク領域および/または相補性決定領域(CDR)に渡る、特にFR1〜FR4、またはCDR1〜CDR3の隣接する重鎖および軽鎖配列に対応する配列。こうした免疫グロブリン分子およびモノクローナル抗体を発現しているハイブリドーマまたは他の細胞株。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願に対するクロスリファレンス
[0001]本出願は、35U.S.C.§119のもとに、2006年4月10日出願の米国仮出願第60/790,642号に優先権を請求し、該出願は、その全体が本明細書に援用される。
【0002】
分野
[0002]本発明は、ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR)に対する標的化結合剤およびこうした剤の使用に関する。より具体的には、本発明は、uPARに対して向けられる完全ヒト・モノクローナル抗体に関する。記載する結合剤は、uPARの活性および/または過剰産生と関連する疾患の診断法として、そして該疾患の治療に有用である。
【背景技術】
【0003】
背景
[0003]ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR、CD87)、GenBank寄託番号NP_002650は、55〜60kDaの非常にグリコシル化された313残基ポリペプチドであり、グリコホスファチジルイノシトール(GPI)−アンカーによって、細胞膜の外葉に連結されている。該タンパク質は、3つの非常に相同なドメイン、DI、DIIおよびDIIIにフォールディングされる(Huaiら, Science 311: 656−659 2006)。uPARのN末端は、ウロキナーゼ・プラスミノーゲン活性化因子(uPA)結合部位(DI)を提供する(Gardsvollら, J Biol Chem 274: 37995−38003 1999)。証拠によって、ドメイン3中の残基が、リガンド結合部位の組み立てに関与し、そしてドメイン2および3がドメイン1へのuPA結合のアフィニティーを増加させることが示唆されている(Liangら, J Biol Chem 276: 28946−28953 2001)。C末端ドメイン(DIII)はプロセシングされて、残基ser282、gly283、ala284を含むグリコホスファチジルイノシトール(GPI)−アンカーが付加される。DIおよびDIIの間のリンカー領域中(Hoyer−Hansenら, Eur J Biochem 243: 21−26 1997; Andolfoら, Thromb Hemost 88: 298−306 2002)、ならびにC末端ドメイン内の残基(Beaufortら, J Immunol 172: 5450−549 2004)のタンパク質分解的切断の結果、DIIおよびDIIIを含む膜係留型、ならびにDI−DIIIまたはDII−DIIIを含むuPARの可溶性型(suPAR)の両方が存在する。糖脂質アンカーの切断はまた、細胞表面からuPARを遊離させうる(Wilhelmら, J Cell Physiol 180: 225−235 1999)。DIを取り込んだ可溶性uPARは、ウロキナーゼに結合する能力を保持する(Higaziら, J Biol Chem 270: 17375−17380 1995)。
【0004】
[0004]uPARは、循環白血球、血管平滑筋細胞、血管新生内皮細胞、骨髄細胞、および線維芽細胞を含む、多くの種類の細胞表面上で発現される。細胞表面でのuPAR発現の上方制御、およびプラスミノーゲン活性化は、炎症、創傷修復、関節炎(Szekaneczら, J Clin Pathol 50: 314−319 1997)、アテローム性動脈硬化症(Carmelietら, Nature Genetics, 17: 439−444 1997)、血管新生、ならびに腫瘍浸潤および転移を含む、いくつかの状態に結びつけられてきている。血漿中に可溶性uPARが上昇したレベルで存在すると、結腸直腸癌の予後マーカーとなることが示されてきている(Stephensら, J Natl Cancer Inst 91: 869−874 1999)。
【0005】
[0005]不活性酵素前駆体プラスミノーゲンのセリンプロテアーゼ・プラスミンへの活性化は、線維素溶解を制御する重要な事象である。2つのプラスミノーゲン活性化因子、組織プラスミノーゲン活性化因子(tPA)およびウロキナーゼ・プラスミノーゲン活性化因子(uPA)がある。tPAは、血漿中の重要なプラスミノーゲン活性化因子であるようであるが、uPAは、uPARへの結合の結果として、細胞表面プラスミノーゲン活性化と関連する。ウロキナーゼは、非常に低い生得的酵素活性を示すか、またはまったく該活性を示さない、一本鎖酵素前駆体(scuPA)として分泌される。プラスミンによって酵素的に切断された後、scuPAは、ジスルフィド結合で連結された活性二鎖高分子量(HMV)−uPAに変換される。このHMW−uPAは、A鎖(aa 1−158)およびB鎖またはLMW−uPA(aa 159−411)で構成される。uPARとuPAの主な相互作用は、アミノ末端断片(ATF)に位置する、A鎖中のuPAの増殖因子ドメイン(GFD)aa 1−48を通じて仲介される。uPARと相互作用するuPA中の第二の部位(連結ペプチド、aa 136−143)が同定されてきている。
【0006】
[0006]uPARに関するuPAの結合アフィニティーは、約1nM(Kd)である。異なる種の間で、uPARの一次構造を比較すると、ヒトuPARは、カニクイザル(Cynomolgus monkey)(マカカ・ファシキュラリス(Macaca fascicularis))のものと95%同一であり、そしてマウス(ムス・ムスキュルス(Mus musculus))のものと60%しか同一でない。さらに、uPAおよびuPARの高アフィニティー結合は、種特異的である。種を渡る、uPARに対するuPA(例えばラットuPARへのヒトuPA)のアフィニティーは、少なくとも2桁異なる。
【0007】
[0007]uPARへのuPAの細胞表面補充は、細胞表面プラスミノーゲン活性化を制御する:scuPAは、受容体が結合している際、より効率的に活性化される(Ellisら, J Biol Chem 264: 2185−2188 1989);受容体に結合したuPAの触媒効率は、溶液相中のuPAに比較して増加する(Higaziら, J Biol Chem 270: 17375−17380 1995); PAI−1は、受容体に結合したuPAの阻害剤として、より効率的でない(Ellisら, J Biol Chem 265: 9904−9908 1990)。今度は、プラスミノーゲンが、低および高アフィニティー相互作用を通じて、細胞表面に補充され、そして細胞表面でプラスミン生成がより効率的に進行し、そしてプラスミン生成はまた、その生理学的阻害剤に、より感受性でない。腫瘍細胞表面では、プラスミノーゲン活性化によって、腫瘍進行に寄与するいくつかのプロセスが促進され、こうしたプロセスには、マトリックス−メタロプロテアーゼの活性化、細胞外マトリックスタンパク質の分解、腫瘍増殖および浸潤を駆動する増殖因子の放出および活性化が含まれる(Andreasenら, Int J Cancer 72: 1−22 1997)。
【0008】
[0008]プラスミノーゲン活性化における、よく確立された役割に加えて、より最近、ビトロネクチンの接着受容体としてのuPARの役割、uPAR、uPAおよびPAI−1を伴う複雑な相互作用が、証拠によって確立されてきている(WaltzおよびChapman, J Biol Chem 269: 14746−14750 1994; Czekayら, J Cell Biol 160: 781−791 2003; Liら, J Biol Chem 278: 29925−29932 2003)。細胞表面uPARの切断によって、in vitroで走化性があることが示されているDIIドメイン上のエピトープが曝露される(Degryseら, J Biol Chem 280: 24792−24803 2005)。インテグリン受容体との相互作用が報告されており(例えば、Weiら, J Cell Biol 168: 501−511 2005; Weiら, Mol Biol Cell 12: 2975−2986 2001)、そしてuPA結合の結果としての細胞シグナル伝達経路の活性化が立証されている(BlasiおよびCarmeliet, Nature Rev Mol Cell Biol 3: 932−943 2002に概説される)。
【0009】
[0009]uPARおよびウロキナーゼ発現の増加は、乳癌、膀胱癌、胃癌、子宮内膜癌、結腸直腸癌を含む、ある範囲のヒト癌において、腫瘍進行と相関している(Edo de BockおよびWang, Med Res Reviews 24: 13−39 2004)。uPAR遺伝子発現は、腫瘍プロモーター、増殖因子、サイトカインおよびホルモンによって、ならびにアテローム生成性リポタンパク質または低酸素症によって増加する。免疫組織化学およびin situハイブリダイゼーション研究によって、uPA/uPAR複合体が、腫瘍の浸潤縁に位置し(Pykeら, Am J Pathol 138: 1059−1067 1991)、そして腫瘍浸潤と相関することが示された。uPA、uPARまたはPAI−1各々の高発現レベルは、異なる種類の腫瘍において、劣った予後に関連づけられている(DuffyおよびDuggan, Clin Biochem 37: 541−548 2004)。
【0010】
[0010]他の研究者らは、ポリクローナル・ウロキナーゼ受容体抗体が腫瘍体積を減少させ、そしてin vivoで潜在性の腫瘍転移の存在を検出しうることを示している(RabbaniおよびGladu, Cancer Res. 62:2390−7 2002)。アデノウイルスが仲介するuPA−ATFの送達(Liら, Gene Therapy 5 1105−1113 1998; Human Gene Therapy 16: 1157−1167 2005)、uPA−ATFの安定トランスフェクション(Zhuら, DNA Cell Biol 20: 297−305 2001)、アンチセンスuPAR(Mohanら, Cancer Res 59: 3369−3373 1999)または組み合わせアンチセンスuPAR/uPA(Gondiら, Oncogene 22: 5967−5975 2003)によって、uPAR活性の遮断または喪失、ならびにin vitroの浸潤、ならびにin vivoの腫瘍増殖および浸潤の阻害が生じた。さらに、ウロキナーゼ・プラスミノーゲン活性化因子(uPA)の非受容体結合領域由来のペプチドは、腫瘍進行および血管新生を阻害し、そしてin vivoで腫瘍細胞死を誘導した(Guoら, FASEB J. 14:1400−1410 2000)。
【発明の開示】
【0011】
概要
[0011]本発明の態様は、uPARに特異的に結合し、そしてそれによってプラスミノーゲン活性化および特定のマトリックス−メタロプロテアーゼの活性化を阻害する、完全ヒト標的化結合剤に関する。標的化結合剤はまた、腫瘍細胞接着および/または浸潤、ならびに/あるいは細胞性転移も阻害する。さらに、標的化結合剤は、腫瘍増殖を減少させるのに有用である。これが達成可能な機構には、uPAのその受容体uPARへの結合を阻害するか、uPAR/uPA限局性uPA酵素活性を阻害するか、インテグリンまたはビトロネクチンなどの細胞外マトリックスタンパク質との相互作用を抑止して、それによってuPARの有効濃度を減少させることのいずれかを含むことも可能であり、そしてこれらに限定されない。
【0012】
[0012]したがって、本発明の1つの態様は、uPARに特異的に結合し、そしてuPAのuPARへの結合を阻害する、標的化結合剤である。標的化結合剤は、100μM、10μM、1μM、100nM、10nM、1nM、500pM、400pM、300pM、200pM、100pMまたは50pM未満のKdで、uPARに結合可能である。
【0013】
[0013]さらに別の態様は、uPARに結合し、そして100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い抗体濃度で、U937細胞に対するプラスミノーゲン活性化の90%より多くを阻害する、標的化結合剤である。
【0014】
[0014]さらに別の態様は、uPARに結合し、そして10μg/ml、1μg/ml、0.1μg/ml、0.08μg/ml、0.06μg/ml、0.04μg/ml、0.02μg/mlまたは0.01μg/ml未満のIC50で、U937細胞に対するプラスミノーゲン活性化を阻害する、標的化結合剤である。
【0015】
[0015]さらに別の態様は、uPARに結合し、そして100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い標的化結合剤濃度で、uPARが仲介する、ビトロネクチンへのU937細胞の細胞接着の90%より多くを阻害する、標的化結合剤である。さらに別の態様は、uPARに結合し、そして100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い標的化結合剤濃度で、uPARが仲介する、ビトロネクチンへのU937細胞の細胞接着の80%より多くを阻害する、標的化結合剤である。
【0016】
[0016]さらに別の態様は、uPARに結合し、そして1000μg/ml、100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い標的化結合剤濃度で、MatrigelTMへのHT−1080細胞の浸潤の90%より多くを阻害する、標的化結合剤である。
【0017】
[0017]別の態様において、標的化結合剤は、表18に示すような相補性決定領域(CDR)、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2およびCDR3配列を含む配列を含んでもよい。一般の当業者が、CDR決定を容易に達成可能であることが注目される。例えば、Kabatら, Sequences of Proteins of Immunological Interest, 第5版, NIH Publication 91−3242, メリーランド州ベセスダ(1991), 第1−3巻を参照されたい。
【0018】
[0018]別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0019】
[0019]別の態様において、標的化結合剤は、表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すようなCDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0020】
[0020]別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)または4.18.1(ATCC寄託番号PTA−7476)のいずれかの任意の1つの、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0021】
[0021]別の態様において、標的化結合剤は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0022】
[0022]別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つ、および表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含む。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ、および表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2およびCDR3配列、ならびに表19に示すようなCDR1、CDR2およびCDR3配列を含む。
【0023】
[0023]別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つ、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含む。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列、ならびに表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む。
【0024】
[0024]別の態様において、標的化結合剤は、表18に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列を含む配列を含む。別の態様において、標的化結合剤は、表18に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列を含む配列を含む。別の態様において、標的化結合剤は、表18に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列、ならびに表19に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列を含む配列を含む。
【0025】
[0025]本発明の1つの態様において、標的化結合剤は抗体である。本発明の1つの態様において、標的化結合剤はモノクローナル抗体である。本発明の1つの態様において、標的化結合剤は完全ヒト・モノクローナル抗体である。
【0026】
[0026]別の態様において、uPARに結合し、そして表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む軽鎖アミノ酸配列を含む抗体がある。別の態様において、uPARに結合し、そして表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む軽鎖アミノ酸配列を含む抗体がある。別の態様において、uPARに結合し、そして表19に示すようなCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む抗体がある。特定の態様において、抗体は完全ヒト・モノクローナル抗体である。
【0027】
[0027]さらに別の態様は、uPARに結合し、そして表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む重鎖アミノ酸配列を含む抗体である。別の態様において、uPARに結合し、そして表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む重鎖アミノ酸配列を含む抗体がある。別の態様において、uPARに結合し、そして表18に示すようなCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列を含む抗体がある。特定の態様において、抗体は完全ヒト・モノクローナル抗体である。
【0028】
[0028]別の態様において、uPARに結合する抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含むアミノ酸配列を含んでもよい。
【0029】
[0029]別の態様において、uPARに結合する抗体は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含むアミノ酸配列を含んでもよい。
【0030】
[0030]別の態様において、uPARに結合する抗体は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む重鎖アミノ酸配列、および表19に示すようなCDR1、CDR2またはCDR3配列の1つを含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つを含む重鎖アミノ酸配列、および表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すようなCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すようなCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。
【0031】
[0031]別の態様において、uPARに結合する抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む重鎖アミノ酸配列、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つを含む重鎖アミノ酸配列、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。
【0032】
[0032]別の態様において、抗体は、表18に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。
【0033】
[0033]本発明のさらなる態様は、本発明の標的化結合剤または抗体と、uPARへの結合に関して交差競合する、標的化結合剤である。本発明の別の態様において、本発明の標的化結合剤または抗体と、uPARへの結合に関して交差競合する抗体がある。
【0034】
[0034]別の態様において、標的化結合剤または抗体は、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと、uPARへの結合に関して交差競合する。本発明の1つの態様において、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと、uPARへの結合に関して交差競合する抗体がある。
【0035】
[0035]本発明のさらなる態様は、uPAR上の、本発明の標的化結合剤または抗体と同じエピトープに結合する、標的化結合剤である。本発明の別の態様において、uPAR上の、本発明の標的化結合剤または抗体と同じエピトープに結合する、抗体がある。
【0036】
[0036]本発明の1つの態様において、uPAR上の、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと同じエピトープに結合する、標的化結合剤がある。本発明の1つの態様において、uPAR上の、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと同じエピトープに結合する、抗体がある。
【0037】
[0037]1つの態様において、標的化結合剤は、以下により詳細に論じるように、uPARに特異的に結合する、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および/または4.18.1(ATCC寄託番号PTA−7476)の1以上を含む。
【0038】
[0038]1つの態様において、ATCC寄託番号PTA−7474、ATCC寄託番号PTA−7475およびATCC寄託番号PTA−7476より選択されるハイブリドーマによって産生される、標的化結合剤または抗体を提供する。1つの態様において、ATCC寄託番号PTA−7474、ATCC寄託番号PTA−7475およびATCC寄託番号PTA−7476より選択されるハイブリドーマによって産生される抗体より誘導可能な標的化結合剤または抗体を提供する。
【0039】
[0039]1つの態様において、標的化結合剤は、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および/または4.18.1(ATCC寄託番号PTA−7476)の1以上から誘導可能な抗体を含む。
【0040】
[0040]1つの態様において、標的化結合剤は、配列番号26、30または50の配列を有するポリペプチドを含む。1つの態様において、標的化結合剤は、配列番号28、32または52の配列を有するポリペプチドを含む。1つの態様において、本発明の抗体は、配列番号26、30または50の配列を有する重鎖ポリペプチドを含む。1つの態様において、本発明の抗体は、配列番号28、32または52の配列を有する軽鎖ポリペプチドを含む。
【0041】
[0041]1つの態様において、本発明の標的化結合剤は、配列番号26の配列を含むポリペプチドを含み、該配列は、表15の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号30の配列を含むポリペプチドを含み、該配列は、表13の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号50の配列を含むポリペプチドを含み、該配列は、表17の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号28の配列を含むポリペプチドを含み、該配列は、表14の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号32の配列を含むポリペプチドを含み、該配列は、表12の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号52の配列を含むポリペプチドを含み、該配列は、表16の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。
【0042】
[0042]1つの態様において、本発明の抗体は、配列番号26の配列を含む重鎖ポリペプチドを含み、該配列は、表15の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号30の配列を含む重鎖ポリペプチドを含み、該配列は、表13の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号50の配列を含む重鎖ポリペプチドを含み、該配列は、表17の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号28の配列を含む軽鎖ポリペプチドを含み、該配列は、表14の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号32の配列を含む軽鎖ポリペプチドを含み、該配列は、表12の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号52の配列を含む軽鎖ポリペプチドを含み、該配列は、表16の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。
【0043】
[0043]本発明はさらに、患者試料中のuPARのレベルをアッセイするための方法であって、本発明の標的化結合剤または抗uPAR抗体と、患者由来の生物学的試料を接触させ、そして前記試料中の前記抗体およびuPAR間の結合レベルを検出する工程を含む、前記方法を提供する。より具体的な態様において、生物学的試料は、血液、血漿、唾液、脳脊髄液、骨髄または尿である。
【0044】
[0044]他の態様において、本発明は、本発明の標的化結合剤または該剤の結合性断片、および薬学的に許容されうるキャリアーを含む、組成物を提供する。他の態様において、本発明は、本発明の抗体またはその結合性断片、および薬学的に許容されうるキャリアーを含む、組成物を提供する。
【0045】
[0045]本発明は、悪性腫瘍の治療が必要な動物を選択し、そしてuPARに結合する、本発明の標的化結合剤の療法的有効用量を該動物に投与することによって、動物において悪性腫瘍を治療する方法を提供する。特定の態様において、動物はヒトである。特定の態様において、標的化結合剤は本発明の抗体であり、そして2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および4.18.1(ATCC寄託番号PTA−7476)からなる群より選択されることも可能である。
【0046】
[0046]特定の態様において、悪性腫瘍は:黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、膵臓癌、食道癌、頭部および頸部癌、中皮腫、肉腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍、ならびに類表皮癌からなる群より選択されることも可能である。
【0047】
[0047]本発明のさらにさらなる態様には、細胞接着および/または浸潤関連疾患を患う動物を効率的に治療する方法であって、細胞接着および/または浸潤関連疾患の治療が必要な動物を選択し、そしてuPARに特異的に結合する、本発明の標的化結合剤の療法的有効用量を該動物に投与する工程を含む、前記方法が含まれる。特定の態様において、動物はヒトである。特定の態様において、標的化結合剤は、完全ヒト・モノクローナル抗体である。特定の態様において、細胞接着または細胞浸潤関連疾患は、腫瘍転移である。特定の態様において、標的化結合剤は本発明の抗体であり、そして2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および4.18.1(ATCC寄託番号PTA−7476)からなる群より選択されることも可能である。
【0048】
[0048]治療可能な細胞接着および浸潤関連疾患には、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、膵臓癌、食道癌、頭部および頸部癌、中皮腫、肉腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍、ならびに類表皮癌が含まれる。
【0049】
[0049]治療可能な細胞接着および浸潤関連疾患には、非新生物疾患、例えば炎症性、または過剰増殖性疾患が含まれ、これらには、限定されるわけではないが、関節炎、アテローム性動脈硬化症、アレルギー性結膜炎が含まれる。
【0050】
[0050]本発明のさらなる態様には、動物において、uPARが誘導する細胞接着および/または浸潤を阻害する方法が含まれる。これらの方法には、uPARが誘導する細胞接着および浸潤の治療が必要な動物を選択し、そして本発明の標的化結合剤または完全ヒト・モノクローナル抗体の療法的有効用量を、前記動物に投与する工程が含まれ、ここで前記抗体はuPARに特異的に結合する。
【0051】
[0051]本発明のさらなる態様には、動物における細胞接着または浸潤関連疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗体の使用が含まれ、ここで前記モノクローナル抗体は、uPARに特異的に結合する。
【0052】
[0052]さらにさらなる態様において、本明細書記載の標的化結合剤を、動物における、uPARが誘導する細胞接着、および/または浸潤の有効な治療用の薬剤の調製に用いてもよく、ここで前記標的化結合剤は、uPARに特異的に結合する。さらにさらなる態様において、本明細書記載の抗体を、動物における、uPARが誘導する細胞接着、および/または浸潤の有効な治療用の薬剤の調製に用いてもよく、ここで前記抗体は、uPARに特異的に結合する。
【0053】
[0053]本明細書記載の本発明の態様は、uPARに結合し、そしてuPAR機能に影響を及ぼす標的化結合剤に関する。本明細書記載の本発明の他の態様は、uPARに結合し、そしてuPAR機能に影響を及ぼすモノクローナル抗体に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の抗uPAR抗体に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の抗uPAR抗体の調製に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の完全ヒト抗uPAR抗体に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の完全ヒト抗uPAR抗体の調製に関する。
【0054】
[0054]1つの態様において、本発明には、非常に高いアフィニティー(Kd)でuPARに結合する抗体が含まれる。例えば、限定されるわけではないが、10−5、10−6、10−7、10−8、10−9、10−10または10−11M未満、あるいはこれらの中の任意の範囲または値のKdで、uPARに結合可能な、ヒト、ウサギ、マウス、キメラまたはヒト化抗体。本明細書に記載するように、KinExA(登録商標)および/またはBIACORE(登録商標)によって、アフィニティーおよび/またはアビディティー測定値を測定してもよい。
【0055】
[0055]本発明の1つの態様には、uPARに結合する単離抗体、またはこれらの抗体の断片が含まれる。当該技術分野に知られるように、抗体は、例えば、ポリクローナル、オリゴクローナル、モノクローナル、キメラ、ヒト化、および/または完全ヒト抗体であってもよい。本明細書記載の本発明の態様はまた、これらの抗体を産生するための細胞も提供する。
【0056】
[0056]本発明の態様が、抗体、あるいは生成法または産生法のいかなる特定の型にも限定されないことが認識されるであろう。例えば、本発明の抗uPAR抗体は、全長抗体(例えば損なわれていない(intact)ヒトFc領域を有する)または抗体断片(例えば、Fab、Fab’、F(ab’)2、FvまたはDab(Dabは、ヒト抗体の最小機能結合単位である))であってもよい。さらに、抗体を分泌するハイブリドーマから、あるいは抗体をコードする単数または複数の遺伝子で形質転換されたかまたはトランスフェクションされている組換え的に産生された細胞から、抗体を製造してもよい。
【0057】
[0057]本発明の他の態様には、本明細書に記載するような標的化結合剤、抗体またはその断片のいずれかをコードする単離核酸分子、抗uPAR抗体をコードする単離核酸分子を有するベクター、あるいはこうした核酸分子のいずれかで形質転換されている宿主細胞が含まれる。さらに、本発明の1つの態様は、核酸分子を発現させて抗体を産生する条件下で、宿主細胞を培養した後、抗体を回収することによって、本発明の抗uPAR抗体を産生する方法である。本発明の態様にはまた、抗体産生のために宿主細胞内にトランスフェクションした際、抗体またはその断片の収量を増加させるために最適化された核酸配列を含む、本発明の抗体または抗体の断片をコードする、いかなる核酸分子も含まれることを理解すべきである。
【0058】
[0058]さらなる態様には、ヒトuPARまたはその断片、および1以上のオルソロガス配列またはその断片で哺乳動物を免疫することによって、uPARに対する高アフィニティー抗体を産生する方法が含まれる。
【0059】
[0059]他の態様は、uPARに特異的に結合する単離抗体の生成および同定に基づく。uPARは、新生物疾患などの細胞接着および/または浸潤関連疾患において、上昇したレベルで発現される。uPARの生物学的活性を阻害すると、uPARが誘導する細胞接着および浸潤、ならびに他の望ましい効果が防止されうる。
【0060】
[0060]本発明の別の態様には、疾患または状態を診断する方法であって、本明細書に記載するように調製した抗体を利用して、患者試料中のuPARのレベルを検出する、前記方法が含まれる。1つの態様において、患者試料は、血液または血清である。さらなる態様において、抗uPAR抗体を用いた、uPARの過剰発現の同定を伴う、リスク要因の同定法、疾患の診断法、および疾患の病期診断法を提示する。
【0061】
[0061]本発明の別の態様には、本発明の標的化結合剤または抗uPAR抗体と、血清または細胞を接触させ、そしてその後、uPARの存在を検出することによって、細胞中のuPARの発現と関連する状態を診断する方法が含まれる。好ましい状態には、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌腫を含む、細胞接着および/または浸潤関連疾患が含まれる。
【0062】
[0062]別の態様において、本発明には、哺乳動物組織、細胞、または体液中のuPARを検出して、uPAR関連疾患に関してスクリーニングするためのアッセイキットが含まれる。該キットには、uPARに結合する、本発明の標的化結合剤または抗体、ならびに存在するならば、uPARと抗体の反応を示すための手段が含まれる。1つの態様において、抗体はモノクローナル抗体である。別の態様において、uPARに結合する抗体は標識されている。さらに別の態様において、抗体は、非標識一次抗体であり、そしてキットにはさらに、一次抗体を検出するための手段が含まれる。1つの態様において、検出するための手段には、抗免疫グロブリンである、標識二次抗体が含まれる。蛍光色素、酵素、放射性核種および放射線不透過性物質からなる群より選択されるマーカーで、該抗体を標識してもよい。
【0063】
[0063]本発明の他の態様には、薬学的に許容されうるキャリアーまたは希釈剤と混合された、本発明の標的化結合剤または抗uPAR抗体の有効量を有する薬学的組成物が含まれる。さらに他の態様において、本発明の標的化結合剤または抗uPAR抗体、あるいはその断片を、療法剤にコンジュゲート化する。療法剤は、例えば、毒素または放射性同位体であってもよい。
【0064】
[0064]さらに別の態様には、本発明の標的化結合剤または抗uPAR抗体の有効量を、患者に投与することによって、患者におけるuPARの発現と関連する疾患または状態を治療するための方法が含まれる。本発明の標的化結合剤または抗uPAR抗体を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。例えば、細胞接着および/または浸潤を遮断するuPAR抗体のモノクローナル、オリゴクローナルまたはポリクローナル混合物を、腫瘍細胞増殖を直接阻害することが示された薬剤と組み合わせて投与してもよい。該方法をin vivoで実行してもよく、そして患者は、好ましくはヒト患者である。好ましい態様において、該方法は、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌腫を含む、細胞接着および/または浸潤関連疾患の治療に関する。
【0065】
[0065]別の態様において、本発明は、容器を含む製品を提供する。容器には、本発明の標的化結合剤または抗uPAR抗体を含有する組成物、ならびにuPARの過剰発現によって特徴付けられる細胞接着および/または浸潤関連疾患を治療するために該組成物を使用可能であることを示す、パッケージ挿入物またはラベルが含まれる。
【0066】
[0066]いくつかの態様において、本発明の標的化結合剤または抗uPAR抗体を患者に投与した後、除去剤を投与して、過剰な循環抗体を血液から除去する。
[0067]さらに別の態様は、細胞接着および/または浸潤関連疾患などの疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。1つの態様において、細胞接着および/または浸潤関連疾患には、癌腫、例えば、乳房、卵巣、胃、子宮内膜、唾液腺、肺、腎臓、結腸、結腸直腸、食道、甲状腺、膵臓、前立腺および膀胱の癌が含まれる。別の態様において、細胞接着および/または浸潤関連疾患には、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、肉腫、頭部および頸部癌、中皮腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍および神経膠芽腫が含まれる。
【0067】
[0068]さらに別の態様は、動物における悪性腫瘍の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。
[0069]本発明のさらに別の態様は、非新生物疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。本発明のさらに別の態様は、限定されるわけではないが、関節炎、アテローム性動脈硬化症、アレルギー性結膜炎を含む、炎症性、または過剰増殖性疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。
【0068】
詳細な説明
[0079]本発明の態様は、ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR)に結合する標的化結合剤に関する。いくつかの態様において、結合剤はuPARに結合し、そしてウロキナーゼ型プラスミノーゲン活性化因子(uPA)のその受容体uPARへの結合を阻害する。1つの態様において、標的化結合剤はモノクローナル抗体またはその結合性断片である。
【0069】
[0080]本発明の他の態様には、完全ヒト抗uPAR抗体、および療法的に有用な抗体調製物が含まれる。1つの態様において、本発明の抗uPAR抗体の調製物は、uPARに関する強い結合アフィニティー、in vitroでプラスミノーゲン活性化を阻害する能力、ならびにuPARが誘導する細胞接着および浸潤をin vitroおよびin vivoで阻害する能力を含む、望ましい療法特性を有する。
【0070】
[0081]本発明の態様にはまた、抗uPAR抗体の単離結合性断片も含まれる。1つの態様において、結合性断片は、完全ヒト抗uPAR抗体に由来する。典型的な断片には、以下により詳細に記載するように、Fv、Fab’、Dab、または他の周知の抗体断片が含まれる。本発明の態様にはまた、uPARに対する完全ヒト抗体を発現する細胞も含まれる。細胞の例には、ハイブリドーマ、または組換え的に生成された細胞、例えば、uPARに対する抗体を産生する、チャイニーズハムスター卵巣(CHO)細胞、CHO細胞の変異体(例えばDG44)およびNS0細胞が含まれる。CHO細胞の変異体に関するさらなる情報は、本明細書にその全体が援用される、AndersenおよびReilly(2004) Current Opinion in Biotechnology 15, 456−462に見いだされうる。
【0071】
[0082]さらに、本発明の態様には、疾患を治療するためにこれらの抗体を使用する方法が含まれる。本発明の抗uPAR抗体は、uPARが仲介するプラスミノーゲン活性化を防止し、それによって細胞接着および/または浸潤を阻害するのに有用である。いかなる特定の理論にも限定されることなく、この阻害の作用機構には、uPAがその受容体uPARに結合することからの阻害が含まれることも可能である。本発明の抗uPAR抗体はまた、uPAR/uPA限局性uPA酵素活性を阻害して、それによってuPARの有効濃度を減少させることも可能である。本発明の抗uPAR抗体は、uPARに依存する、ビトロネクチンへの細胞の接着を阻害することも可能であり、そしてまた、インテグリンが仲介する細胞接着のuPAR修飾を混乱させることも可能である。本発明の抗uPAR抗体はまた、uPARへのuPA結合を阻害するか、またはインテグリンおよび増殖因子受容体とのuPAR相互作用を混乱させた結果、細胞内シグナル伝達を修飾することも可能である。この阻害機構を通じて治療可能な疾患には、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌および腫瘍が含まれる。
【0072】
[0083]本発明の他の態様には、生物学的試料中のuPARの量を特異的に決定するための診断アッセイが含まれる。アッセイキットには、こうした抗体を検出するのに必要な標識とともに、本発明の抗uPAR抗体が含まれてもよい。これらの診断アッセイは、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌腫を含む、細胞接着および浸潤関連疾患に関してスクリーニングするのに有用である。
【0073】
[0084]本発明の別の側面は、uPARに結合する、uPARの生物学的活性のアンタゴニストである。1つの態様において、アンタゴニストは、抗体などの標的化結合剤である。アンタゴニストは:
i)uPAR;または
ii)uPA/uPAR複合体
、あるいはこれらの組み合わせに結合してもよい。1つの態様において、アンタゴニストは、in vitroおよびin vivoでuPARの生物学的活性に拮抗することが可能である。アンタゴニストは、本明細書記載の抗体、例えば、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および4.18.1(ATCC寄託番号PTA−7476)から選択可能である。
【0074】
[0085]1つの態様において、uPARの生物学的活性のアンタゴニストは、uPARに結合可能であり、そしてそれによってuPARが仲介するプラスミノーゲン活性化を防止し、それによって細胞接着および/または浸潤を阻害することも可能である。この阻害作用の機構には、アンタゴニストがuPARに結合し、そしてuPAのその受容体uPARへの結合を阻害することが含まれうる。いかなる特定の理論的考慮にも束縛されることは望まないが、uPARの生物学的活性の拮抗を達成可能な機構には、限定されるわけではないが、uPAの受容体uPARへの結合の阻害、またはuPAR/uPA限局性uPA酵素活性の阻害が含まれる。
【0075】
[0086]1つの態様は、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1と同じ、単数または複数のエピトープに結合する、標的化結合剤である。
【0076】
[0087]1つの態様は、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1と同じ、単数または複数のエピトープに結合する、抗体である。
[0088]1つの態様において、標的化結合剤は、1ナノモル濃度(nM)未満のKdでuPARに結合する。標的化結合剤は、500ピコモル濃度(pM)未満のKdで結合してもよい。標的化結合剤は、400ピコモル濃度(pM)未満のKdで結合してもよい。標的化結合剤は、300ピコモル濃度(pM)未満のKdで結合してもよい。別の態様において、標的化結合剤は、200pM未満のKdで結合する。
【0077】
[0089]1つの態様は、上述のような標的化結合剤を産生するハイブリドーマである。1つの態様は、上述のような抗体の軽鎖および/または重鎖を産生するハイブリドーマである。1つの態様において、ハイブリドーマは、完全ヒト・モノクローナル抗体の軽鎖および/または重鎖を産生する。別の態様において、ハイブリドーマは、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1の軽鎖および/または重鎖を産生する。あるいは、ハイブリドーマは、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1と同じ単数または複数のエピトープに結合する抗体を産生してもよい。
【0078】
[0090]別の態様は、上述のような標的化結合剤をコードする核酸分子である。1つの態様は、上述のような抗体の軽鎖または重鎖をコードする核酸分子である。1つの態様において、核酸分子は、完全ヒト・モノクローナル抗体の軽鎖または重鎖をコードする。さらに別の態様は、抗体2.19.2、2.6.1または4.18.1より選択される完全ヒト・モノクローナル抗体の軽鎖または重鎖をコードする核酸分子である。
【0079】
[0091]本発明の別の態様は、上述のような単数または複数の核酸分子を含むベクターであり、該ベクターは、上に定義するような標的化結合剤をコードする。本発明の1つの態様は、上述のような単数または複数の核酸分子を含むベクターであり、該ベクターは、上に定義するような抗体の軽鎖および/または重鎖をコードする。
【0080】
[0092]本発明のさらに別の態様は、上に定義するようなベクターを含む宿主細胞である。あるいは、宿主細胞は、1より多いベクターを含んでもよい。
[0093]さらに、本発明の1つの態様は、標的化結合剤を産生する方法、または核酸分子を発現させて標的化結合剤を産生する条件下で、宿主細胞を培養した後、標的化結合剤を回収することによる、本発明の方法である。本発明の1つの態様は、核酸分子を発現させて抗体を産生する条件下で、宿主細胞を培養した後、抗体を回収することによって、本発明の抗体を産生する方法である。
【0081】
[0094]1つの態様において、本発明には、上述のような標的化結合剤をコードする、少なくとも1つの核酸分子で、少なくとも1つの宿主細胞をトランスフェクションし、宿主細胞中で核酸分子を発現させ、そして標的化結合剤を単離することによって、標的化結合剤を作製する方法が含まれる。1つの態様において、本発明には、上述のような抗体をコードする、少なくとも1つの核酸分子で、少なくとも1つの宿主細胞をトランスフェクションし、宿主細胞中で核酸分子を発現させ、そして抗体を単離することによって、抗体を作製する方法が含まれる。
【0082】
[0095]別の側面にしたがって、本発明には、本明細書に記載するようなアンタゴニストを投与することによって、uPARの生物学的活性に拮抗する方法が含まれる。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性のアンタゴニストの療法的有効用量を該動物に投与する工程が含まれてもよい。
【0083】
[0096]本発明の別の側面には、上述のような標的化結合剤を投与することによって、uPARの生物学的活性に拮抗する方法が含まれる。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する標的化結合剤の療法的有効用量を該動物に投与する工程が含まれてもよい。
【0084】
[0097]本発明の別の側面には、上述のような抗体を投与することによって、uPARの生物学的活性に拮抗する方法が含まれる。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する抗体の療法的有効用量を該動物に投与する工程が含まれてもよい。
【0085】
[0098]別の側面にしたがって、uPARの生物学的活性のアンタゴニストの療法的有効量を投与することによって、哺乳動物における疾患関連細胞接着および/または浸潤を治療する方法を提供する。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性のアンタゴニストの療法的有効用量を該動物に投与する工程が含まれてもよい。
【0086】
[0099]別の側面にしたがって、uPARの生物学的活性に拮抗する標的化結合剤の療法的有効量を投与することによって、哺乳動物における疾患関連細胞接着および/または浸潤を治療する方法を提供する。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する標的化結合剤の療法的有効用量を該動物に投与する工程が含まれてもよい。標的化結合剤を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0087】
[0100]別の側面にしたがって、uPARの生物学的活性に拮抗する抗体の療法的有効量を投与することによって、哺乳動物における疾患関連細胞接着および/または浸潤を治療する方法を提供する。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する抗体の療法的有効用量を該動物に投与する工程が含まれてもよい。抗体を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0088】
[0101]別の側面にしたがって、uPARの生物学的活性のアンタゴニストの療法的有効量を投与することによって、哺乳動物における癌を治療する方法を提供する。該方法には、癌の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗するアンタゴニストの療法的有効用量を該動物に投与する工程が含まれてもよい。アンタゴニストを単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0089】
[0102]別の側面にしたがって、uPARの生物学的活性に拮抗する標的化結合剤の療法的有効量を投与することによって、哺乳動物における癌を治療する方法を提供する。該方法には、癌の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する標的化結合剤の療法的有効用量を該動物に投与する工程が含まれてもよい。標的化結合剤を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0090】
[0103]別の側面にしたがって、uPARの生物学的活性に拮抗する抗体の療法的有効量を投与することによって、哺乳動物における癌を治療する方法を提供する。該方法には、癌の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する抗体の療法的有効用量を該動物に投与する工程が含まれてもよい。抗体を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0091】
[0104]本発明の別の側面にしたがって、疾患関連細胞接着および/または浸潤の治療用の薬剤の製造のための、uPARの生物学的活性のアンタゴニストの使用を提供する。
【0092】
[0105]本発明の別の側面にしたがって、疾患関連細胞接着および/または浸潤の治療用の薬剤の製造のための、uPARの生物学的活性に拮抗する標的化結合剤の使用を提供する。
【0093】
[0106]本発明の別の側面にしたがって、疾患関連細胞接着および/または浸潤の治療用の薬剤の製造のための、uPARの生物学的活性に拮抗する抗体の使用を提供する。
【0094】
[0107]1つの態様において、本発明は、uPAR受容体のみに、またはuPAR受容体に部分的に依存する腫瘍を持つ患者において、uPARに拮抗する際の使用に特に適している。
【0095】
[0108]本発明の別の態様には、哺乳動物組織、細胞、または体液中のuPARを検出して、細胞接着および浸潤関連疾患に関してスクリーニングするためのアッセイキットが含まれる。該キットには、uPARに結合する標的化結合剤、および存在するならば、uPARと標的化結合剤の反応を示すための手段が含まれる。1つの態様において、uPARに結合する標的化結合剤は標識されている。別の態様において、標的化結合剤は、標識されず、そしてキットはさらに、標的化結合剤を検出するための手段を含む。好ましくは、標的化結合剤は、蛍光色素、酵素、放射性核種および放射線不透過性物質からなる群より選択されるマーカーで、標識される。
【0096】
[0109]本発明の別の態様には、哺乳動物組織、細胞、または体液中のuPARを検出して、細胞接着および浸潤関連疾患に関してスクリーニングするためのアッセイキットが含まれる。該キットには、uPARに結合する抗体、および存在するならば、uPARと抗体の反応を示すための手段が含まれる。抗体はモノクローナル抗体であってもよい。1つの態様において、uPARに結合する抗体は標識されている。別の態様において、抗体は、非標識一次抗体であり、そしてキットはさらに、一次抗体を検出するための手段を含む。1つの態様において、手段には、抗免疫グロブリンである、標識二次抗体が含まれる。好ましくは、該抗体は、蛍光色素、酵素、放射性核種および放射線不透過性物質からなる群より選択されるマーカーで、標識される。
【0097】
[0110]抗uPAR抗体に関するさらなる態様、特徴等を、以下にさらに詳細に提供する。
配列表
[0111]本発明の態様には、表1に以下に列挙する特定の抗uPAR抗体が含まれる。この表は、対応する重鎖および軽鎖遺伝子の可変ドメインの配列番号とともに、各抗uPAR抗体の同定番号を報告する。各抗体は、2つの小数点で区切られた3つの数字を含む同定番号を与えられている。
【0098】
表1
【0099】
【表1−1】

【0100】
【表1−2】

【0101】
定義
[0112]別に定義しない限り、本明細書に用いる科学的用語および技術的用語は、一般の当業者に通常理解される意味を有するものとする。さらに、文脈によって別に必要とされない限り、単数形の用語は複数形を含み、そして複数形の用語は単数形を含むものとする。一般的に、本明細書に記載する細胞および組織培養、分子生物学、ならびにタンパク質およびオリゴまたはポリヌクレオチド化学およびハイブリダイゼーションと関連して利用する用語、およびこれらの技術は、当該技術分野に周知であり、そして一般的に用いられるものである。
【0102】
[0113]組換えDNA、オリゴヌクレオチド合成、ならびに組織培養および形質転換には、標準的技術を用いる(例えばエレクトロポレーション、リポフェクション)。製造者の指定にしたがい、または当該技術分野で一般的に達成されるように、または本明細書に記載するように、酵素反応および精製技術を行う。当該技術分野に周知の慣用法にしたがって、そして本明細書全体で引用し、そして論じる、多様な一般的なおよびより具体的な参考文献に記載されるように、一般的に、前述の技術および方法を行う。例えば、本明細書に援用される、Sambrookら Molecular Cloning: A Laboratory Manual(第3版, Cold Spring Harbor Laboratory Press, ニューヨーク州コールドスプリングハーバー(2001))を参照されたい。本明細書に記載する分析化学、合成有機化学、ならびに医学的および薬学的化学と関連して利用する用語、ならびにこれらの実験法および技術は、当該技術分野に周知であり、そして一般的に用いられるものである。化学合成、化学分析、薬学的調製、配合、および送達、ならびに患者の治療には、標準的技術を用いる。
【0103】
[0114]本開示にしたがって利用した際、以下の用語は、別に示さない限り、以下の意味を有すると理解されるものとする:
[0115]アンタゴニストは、ポリペプチド、核酸、炭水化物、脂質、小分子量化合物、オリゴヌクレオチド、オリゴペプチド、RNA干渉(RNAi)、アンチセンス、組換えタンパク質、抗体、あるいはこれらの断片またはこれらのコンジュゲートもしくは融合タンパク質であってもよい。RNAiの概説には、Milhavet O, Gary DS, Mattson MP.(Pharmacol Rev. 2003 Dec;55(4):629−48. 概説)を参照されたく、そしてアンチセンスの概説には、Opalinska JB, Gewirtz AM.(Sci STKE. 2003 Oct 28;2003(206):pe47.)を参照されたい。
【0104】
[0116]疾患関連細胞接着および/または浸潤は、いかなる異常な、望ましくない、または病的な細胞接着および/または浸潤であってもよく、例えば腫瘍関連細胞接着および/または浸潤であってもよい。細胞接着および/または浸潤関連疾患には、限定されるわけではないが、非固形腫瘍、例えば、白血病、多発性骨髄腫またはリンパ腫、そしてまた、固形腫瘍、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、甲状腺、胆管、骨、胃、脳/CNS、頭部および頸部、肝臓系、胃、前立腺、乳房、腎臓、精巣、卵巣、皮膚、子宮頸部、肺、筋肉、ニューロン、食道、膀胱、肺、子宮、膣、子宮内膜、腎臓、結腸直腸、膵臓、胸膜/腹膜、唾液腺、および表皮(epidermous)の癌腫が含まれる。
【0105】
[0117]化合物は、約2000ダルトン未満の分子量を持つ、いかなる小分子量化合物も指す。
[0118]用語「uPAR」は、分子、ウロキナーゼ型プラスミノーゲン活性化因子受容体を指す。
【0106】
[0119]用語「中和」は、抗体などの標的化結合剤を指す場合、抗体が、標的抗原の活性を排除するか、または有意に減少させる能力に関する。したがって、本発明の「中和」抗uPAR抗体は、uPARの活性を排除するかまたは有意に減少させることが可能である。中和uPAR抗体は、例えば、uPAのその受容体uPARへの結合を遮断することによって作用可能である。この結合を遮断することによって、uPAが仲介するプラスミノーゲン活性化は、有意に、または完全に、排除される。理想的には、uPARに対する中和抗体は、細胞接着および/または浸潤を阻害する。
【0107】
[0120]用語「ポリペプチド」は、本明細書において、ポリペプチド配列の天然タンパク質、断片または類似体を指す、一般的な用語として用いられる。したがって、天然タンパク質、断片、および類似体は、ポリペプチド属の種である。本発明にしたがった、好ましいポリペプチドは、ヒト重鎖免疫グロブリン分子およびヒト・カッパ軽鎖免疫グロブリン分子、ならびにカッパまたはラムダ軽鎖免疫グロブリン分子などの軽鎖免疫グロブリン分子とともに、重鎖免疫グロブリンを含む組み合わせ、およびその逆によって形成される抗体分子、ならびにその断片および類似体を含む。本発明にしたがった、好ましいポリペプチドはまた、単に、ヒト重鎖免疫グロブリン分子またはその断片も含んでもよい。
【0108】
[0121]用語「天然存在」は、本明細書において、対象に適用した際、対象が天然で見られうるという事実を指す。例えば、天然供給源から単離可能であり、そして人間によって、実験室において、または別の方式で、意図的に修飾されていない、生物(ウイルスを含む)中に存在するポリペプチドまたはポリヌクレオチド配列は、天然存在である。
【0109】
[0122]用語「機能可能であるように連結された」は、本明細書において、その意図される方式で機能することが可能にされた関係にある、そのように記載された構成要素の位置を指す。例えば、コード配列に「機能可能であるように連結された」制御配列は、コード配列の発現が、制御配列と適合する条件下で達成される方式で連結されている。
【0110】
[0123]用語「ポリヌクレオチド」は、本明細書において、リボヌクレオチドもしくはデオキシヌクレオチドのいずれか、またはいずれかの種類のヌクレオチドの修飾型、あるいはRNA−DNAへテロ二重鎖の、少なくとも長さ10塩基のヌクレオチドのポリマー型を意味する。この用語には、DNAの一本鎖および二本鎖型が含まれる。
【0111】
[0124]本明細書で称される用語「オリゴヌクレオチド」には、天然存在連結および非天然存在連結によって一緒に連結された、天然存在ヌクレオチドおよび修飾ヌクレオチドが含まれる。オリゴヌクレオチドは、一般的に200塩基以下の長さを含む、ポリヌクレオチド・サブセットである。好ましくは、オリゴヌクレオチドは、長さ10〜60塩基、そして最も好ましくは、長さ12、13、14、15、16、17、18、19、または20〜40塩基である。オリゴヌクレオチドは、通常、例えばプローブ用に、一本鎖であるが;オリゴヌクレオチドは、例えば遺伝子突然変異体の構築で使用するため、二本鎖であってもよい。オリゴヌクレオチドは、センスまたはアンチセンス・オリゴヌクレオチドのいずれかであってもよい。
【0112】
[0125]本明細書で称される用語「天然存在ヌクレオチド」には、デオキシリボヌクレオチドおよびリボヌクレオチドが含まれる。本明細書で称される用語「修飾ヌクレオチド」には、修飾されたまたは置換された糖基等を含むヌクレオチドが含まれる。本明細書で称される用語「オリゴヌクレオチド連結」には、ホスホロチオエート、ホスホロジチオエート、ホスホロセレノエート、ホスホロジセレノエート、ホスホロアニロチオエート、ホスホルアニラデート(phosphoraniladate)、ホスホロアミデート等のオリゴヌクレオチド連結が含まれる。例えば、その開示が本明細書に援用される、LaPlancheら Nucl. Acids Res. 14:9081(1986); Stecら J. Am. Chem. Soc. 106:6077(1984); Steinら Nucl. Acids Res. 16:3209(1988); Zonら Anti−Cancer Drug Design 6:539(1991); Zonら Oligonucleotides and Analogues: A Practical Approach, pp. 87−108(F. Eckstein監修, Oxford University Press, 英国オックスフォード(1991)); Stecら、米国特許第5,151,510号; UhlmannおよびPeyman Chemical Reviews 90:543(1990)を参照されたい。所望の場合、オリゴヌクレオチドには、検出のための標識が含まれてもよい。
【0113】
[0126]2つのアミノ酸配列間に部分的なまたは完全な同一性がある場合、これらの配列は「相同」である。例えば、85%の相同性は、2つの配列を最大マッチングになるように並列させた場合、85%のアミノ酸が同一であることを意味する。マッチングを最大にする際、ギャップ(マッチングさせている2つの配列のいずれかにおけるもの)が許可され;5以下のギャップ長が好ましく、2以下がより好ましい。あるいは、そして好ましくは、突然変異データマトリックスおよび6以上のギャップペナルティを伴い、プログラムALIGNを用いて、5(標準偏差単位)よりも高い並列スコアを有するならば、本明細書でこの用語を用いた場合、2つのタンパク質配列(または少なくとも長さ約30アミノ酸の該タンパク質配列に由来するポリペプチド配列)は相同である。Dayhoff, M.O., Atlas of Protein Sequence and Structure中, pp. 101−110(第5巻, National Biomedical Research Foundation(1972))およびこの巻の補遺2、pp. 1−10を参照されたい。2つの配列またはその部分は、より好ましくは、これらのアミノ酸が、ALIGNプログラムを用いて最適に並列された際、50%以上同一であるならば、相同である。2つのオルソロガス配列内に、相同性が異なる領域がありうることを認識しなければならない。例えば、マウスおよびヒトのオルソログの機能部位は、非機能領域より高い度合いの相同性を有しうる。
【0114】
[0127]用語「に対応する」は、本明細書において、ポリヌクレオチド配列が、参照ポリヌクレオチド配列のすべてまたは一部に相同である(すなわち、厳密に進化的に関連せずに、同一である)か、あるいはポリペプチド配列が参照ポリペプチド配列と同一であることを意味する。
【0115】
[0128]対照的に、用語「に相補的」は、本明細書において、相補配列が、参照ポリヌクレオチド配列のすべてまたは一部に相同であることを意味する。例えば、ヌクレオチド配列「TATAC」は、参照配列「TATAC」に対応し、そして参照配列「GTATA」に相補的である。
【0116】
[0129]用語「配列同一性」は、2つのポリヌクレオチドまたはアミノ酸配列が、比較ウィンドウに渡って同一である(すなわちヌクレオチドごとまたは残基ごとに基づいて)ことを意味する。用語「配列同一性パーセント」は、2つの最適に並列された配列を、比較ウィンドウに渡って比較し、同一核酸塩基(例えばA、T、C、G、U、またはI)またはアミノ酸残基が両方の配列に生じる位の数を決定して、マッチした位の数を得て、マッチした位の数を比較ウィンドウ中の位の総数(すなわちウィンドウサイズ)によって割り、そして結果に100を乗じて、配列同一性パーセントを得ることによって、計算される。用語「実質的同一性」は、本明細書において、ポリヌクレオチドまたはアミノ酸が、少なくとも18ヌクレオチド(6アミノ酸)位の比較ウィンドウに渡って、しばしば、少なくとも24〜48ヌクレオチド(8〜16アミノ酸)位のウィンドウに渡って、参照配列に比較した際、少なくとも85パーセントの配列同一性、好ましくは少なくとも90〜95パーセントの配列同一性、より好ましくは少なくとも99パーセントの配列同一性を有する配列を含み、比較ウィンドウに渡って、全部で参照配列の20パーセント以下の欠失または付加を含んでもよい配列に、参照配列を比較することによって、配列同一性パーセントを計算する、ポリヌクレオチドまたはアミノ酸配列の特徴を意味する。参照配列はより大きい配列のサブセットであってもよい。
【0117】
[0130]本明細書において、20の慣用的なアミノ酸およびその略語は、慣用的な用法にしたがう。本明細書に援用される、Immunology− A Synthesis(第2版, E.S. GolubおよびD.R. Gren監修, Sinauer Associates, マサチューセッツ州サンダーランド(1991))を参照されたい。20の慣用的アミノ酸の立体異性体(例えばD−アミノ酸)、α,α−二置換アミノ酸などの非天然アミノ酸、N−アルキルアミノ酸、乳酸、および他の非慣用的アミノ酸もまた、本発明のポリペプチドに適した構成要素でありうる。非慣用的なアミノ酸の例には:4−ヒドロキシプロリン、γ−カルボキシグルタメート、ε−N,N,N−トリメチルリジン、ε−N−アセチルリジン、O−ホスホセリン、N−アセチルセリン、N−ホルミルメチオニン、3−メチルヒスチジン、5−ヒドロキシリジン、σ−N−メチルアルギニン、ならびに他の類似のアミノ酸およびイミノ酸(例えば4−ヒドロキシプロリン)が含まれる。本明細書で用いるポリペプチド表記法において、標準的な用法および慣例にしたがって、左側はアミノ末端方向であり、そして右側はカルボキシ末端方向である。
【0118】
[0131]同様に、別に明記しない限り、一本鎖ポリヌクレオチド配列の左側は5’端であり;二本鎖ポリヌクレオチド配列の左側は5’方向と称される。新生RNA転写物の5’から3’付加の方向は、転写方向と称され;RNAと同じ配列を有し、そしてRNA転写物の5’端より5’であるDNA鎖上の配列領域は、「上流配列」と称され;RNAと同じ配列を有し、そしてRNA転写物の3’端より3’であるDNA鎖上の配列領域は、「下流配列」と称される。
【0119】
[0132]ポリペプチドに適用した際、用語「実質的同一性」は、2つのペプチド配列が、デフォルトギャップ加重を用いて、プログラムGAPまたはBESTFITによるなどで、最適に並列された際、少なくとも80パーセントの配列同一性、好ましくは少なくとも90パーセントの配列同一性、より好ましくは少なくとも95パーセントの配列同一性、そして最も好ましくは少なくとも99パーセントの配列同一性を共有することを意味する。好ましくは、同一でない残基位は、保存的アミノ酸置換によって異なる。保存的アミノ酸置換は、類似の側鎖を有する残基の互換性を指す。例えば、脂肪族側鎖を有するアミノ酸群は、グリシン、アラニン、バリン、ロイシン、およびイソロイシンであり;脂肪族ヒドロキシル側鎖を有するアミノ酸群は、セリンおよびスレオニンであり;アミド含有側鎖を有するアミノ酸群は、アスパラギンおよびグルタミンであり;芳香族側鎖を有するアミノ酸群は、フェニルアラニン、チロシン、およびトリプトファンであり;塩基性側鎖を有するアミノ酸群は、リジン、アルギニン、およびヒスチジンであり;そしてイオウ含有側鎖を有するアミノ酸群は、システインおよびメチオニンである。好ましい保存的アミノ酸置換群は:バリン−ロイシン−イソロイシン、フェニルアラニン−チロシン、リジン−アルギニン、アラニン−バリン、グルタミン酸−アスパラギン酸、およびアスパラギン−グルタミンである。
【0120】
[0133]本明細書に論じるように、抗体または免疫グロブリン分子のアミノ酸配列における重要でない変動は、アミノ酸配列中のこうした変動が、本明細書記載の抗体または免疫グロブリン分子に対する、少なくとも75%、より好ましくは少なくとも80%、90%、95%、そして最も好ましくは99%の配列同一性を維持するならば、本発明に含まれると意図される。特に、保存的アミノ酸置換が意図される。保存的置換は、関連側鎖を有するアミノ酸ファミリー内で起こるものである。遺伝的にコードされるアミノ酸は、一般的に、ファミリーに分けられる:(1)酸性=アスパラギン酸、グルタミン酸;(2)塩基性=リジン、アルギニン、ヒスチジン;(3)非極性=アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン;および(4)非荷電極性=グリシン、アスパラギン、グルタミン、システイン、セリン、スレオニン、チロシン。より好ましいファミリーは:セリンおよびスレオニンは、脂肪族ヒドロキシファミリーであり;アスパラギンおよびグルタミンは、アミド含有ファミリーであり;アラニン、バリン、ロイシンおよびイソロイシンは、脂肪族ファミリーであり;そしてフェニルアラニン、トリプトファン、およびチロシンは、芳香族ファミリーである。例えば、イソロイシンまたはバリンでのロイシン、グルタミン酸でのアスパラギン酸、セリンでのスレオニンの単一の置換、あるいは構造的に関連するアミノ酸でのアミノ酸の類似の置換は、特に、その置換がフレームワーク部位内のアミノ酸を伴わない場合、生じる分子の結合機能または特性に大きな影響を及ぼさないであろうと予測することは妥当である。アミノ酸変化によって、機能するペプチドが生じるかどうかは、ポリペプチド誘導体の比活性をアッセイすることによって、容易に決定可能である。アッセイは、本明細書に詳細に記載される。抗体または免疫グロブリン分子の断片または類似体は、一般の当業者によって容易に調製可能である。断片または類似体の好ましいアミノ末端およびカルボキシ末端は、機能ドメインの境界近くに存在する。構造ドメインおよび機能ドメインは、公的または私的な配列データベースに、ヌクレオチドおよび/またはアミノ酸配列データを比較することによって、同定可能である。好ましくは、コンピュータ化比較法を用いて、既知の構造および/または機能の他のタンパク質に存在する配列モチーフまたは予測されるタンパク質コンホメーションドメインを同定する。既知の三次元構造にフォールディングするタンパク質配列を同定する方法が知られる。Bowieら Science 253:164(1991)。したがって、前述の例は、当業者が、本明細書記載の抗体に一致して、構造ドメインおよび機能ドメインを定義するのに使用可能な、配列モチーフおよび構造コンホメーションを認識可能であることを示す。
【0121】
[0134]好ましいアミノ酸置換は:(1)タンパク質分解に対する感受性を減少させ、(2)酸化に対する感受性を減少させ、(3)タンパク質複合体を形成するため、結合アフィニティーを改変し、(4)結合アフィニティーを改変し、そして(4)こうした類似体に他の物理化学特性または機能特性を与えるかあるいはこうした類似体のこうした特性を修正するものである。類似体には、天然存在ペプチド配列以外の配列の多様な突然変異タンパク質が含まれうる。例えば、単数または多数のアミノ酸置換(好ましくは、保存的アミノ酸置換)を、天然存在配列において(好ましくは、分子間接触を形成するドメイン(単数または複数)外のポリペプチドの部分において)行うことも可能である。保存的アミノ酸置換は、親配列の構造特徴を実質的に変化させてはならない(例えば置換アミノ酸は、親配列に存在するらせんを破壊するか、または親配列を特徴付ける他の種類の二次構造を破壊する傾向があってはならない)。当該技術分野に認識されるポリペプチド二次構造および三次構造の例が、Proteins, Structures and Molecular Principles(Creighton監修, W.H. Freeman and Company, ニューヨーク(1984)); Introduction to Protein Structure(C. BrandenおよびJ. Tooze監修, Garland Publishing, ニューヨーク州ニューヨーク(1991));およびThorntonら Nature 354:105(1991)に記載され、これらは各々、本明細書に援用される。
【0122】
[0135]用語「ポリペプチド断片」は、本明細書において、アミノ末端および/またはカルボキシ末端欠失を有するが、残っているアミノ酸配列が、例えば、全長cDNA配列から推定される天然存在配列中の対応する位と同一であるポリペプチドを指す。断片は、典型的には、少なくとも長さ5、6、8、または10アミノ酸、好ましくは少なくとも長さ14アミノ酸、より好ましくは少なくとも長さ20アミノ酸、通常、少なくとも長さ50アミノ酸、そしてさらにより好ましくは少なくとも長さ70アミノ酸である。用語「類似体」は、本明細書において、推定されるアミノ酸配列の一部に実質的な同一性を有し、そして以下の特性の少なくとも1つを有する、少なくとも25アミノ酸のセグメントで構成されるポリペプチドを指す:(1)適切な結合条件下での、uPARへの特異的な結合、(2)適切なuPA/uPAR結合を遮断する能力、または(3)uPA活性を阻害する能力。典型的には、ポリペプチド類似体は、天然存在配列に関して保存的アミノ酸置換(または付加または欠失)を含む。類似体は、典型的には、少なくとも長さ20アミノ酸、好ましくは少なくとも長さ50アミノ酸以上であり、そしてしばしば、全長天然存在ポリペプチドと同じくらい長いことも可能である。
【0123】
[0136]ペプチド類似体は、一般的に、薬学産業において、テンプレート・ペプチドのものと類似の特性を持つ、非ペプチド薬剤として用いられる。これらの種類の非ペプチド化合物は、「ペプチド模倣体」(「peptide mimetics」または「peptidomimetics」)と称される。本明細書に援用される、Fauchere, J. Adv. Drug Res. 15:29(1986); VeberおよびFreidinger TINS p.392(1985);およびEvansら J. Med. Chem. 30:1229(1987)。こうした化合物は、しばしば、コンピュータ化分子モデリングの補助で開発される。療法的に有用なペプチドに構造的に類似のペプチド模倣体を用いて、同等の療法効果または予防効果を生じることも可能である。一般的に、ペプチド模倣体は、ヒト抗体などの模範(paradigm)ポリペプチド(すなわち生化学的特性または薬理学的活性を有するポリペプチド)に構造的に類似であるが、当該技術分野に周知の方法によって:−−CH2NH−−、−−CH2S−−、−−CH2−CH2−−、−−CH=CH−(シスおよびトランス)、−−COCH2−−、−−CH(OH)CH2−−、および−−CH2SO−−からなる群より選択される連結により、場合によって置換された1以上のペプチド連結を有する。コンセンサス配列の1以上のアミノ酸を、同じ種類のD−アミノ酸(例えばL−リジンの代わりにD−リジン)で体系的に置換して、より安定なペプチドを生成することも可能である。さらに、コンセンサス配列または実質的に同一なコンセンサス配列変動を含む、制約された(constrained)ペプチドを、当該技術分野に知られる方法(本明細書に援用される、RizoおよびGierasch Ann. Rev. Biochem. 61:387(1992))によって生成することも可能であり;これは例えば、ペプチドを環状化する、分子内ジスルフィド架橋を形成可能な内部システイン残基を付加することによる。
【0124】
[0137]本明細書において、用語「抗体」は、抗原の抗原性決定基の特徴に相補的な内部表面形状および電荷分布を持つ三次元結合空間を有するポリペプチド鎖のフォールディングから形成される、少なくとも1つの結合ドメインで構成されるポリペプチドまたはポリペプチド群を指す。抗体は、典型的には四量体型を有し、2つの同一のポリペプチド鎖対を含み、各々の対は、1つの「軽」鎖および1つの「重」鎖を有する。各軽鎖/重鎖対の可変領域は、抗体結合部位を形成する。
【0125】
[0138]本明細書において、標的化結合剤、標的化結合タンパク質、特異的結合タンパク質等の用語は、標的部位に優先的に結合する抗体またはその結合性断片を指す。1つの態様において、標的化結合剤は、1つの標的部位に対してのみ特異的である。他の態様において、標的化結合剤は、1より多い標的部位に特異的である。1つの態様において、標的化結合剤はモノクローナル抗体であってもよく、そして標的部位はエピトープであってもよい。
【0126】
[0139]抗体の「結合性断片」は、組換えDNA技術によって、あるいは損なわれていない(intact)抗体の酵素的または化学的切断によって産生される。結合性断片には、Fab、Fab’、F(ab’)2、Fv、Dabおよび一本鎖抗体が含まれる。「二重特異性」または「二官能性」抗体以外の抗体は、同一の各結合部位を有すると理解される。抗体は、過剰な抗体が、少なくとも約20%、40%、60%、または80%、そしてより一般的には約85%(in vitro競合結合アッセイで測定した際)を超えて、対抗受容体に結合する受容体の量を減少させる場合、対抗受容体への受容体の接着を、実質的に阻害する。
【0127】
[0140]抗体は、オリゴクローナル、ポリクローナル抗体、モノクローナル抗体、キメラ抗体、CDR移植抗体、多重特異性抗体、二重特異性抗体、触媒性抗体、キメラ抗体、ヒト化抗体、完全ヒト抗体、抗イディオタイプ抗体、ならびに可溶性型または結合型で標識されていてもよい抗体、ならびに、単独の、または既知の技術によって提供される他のアミノ酸配列と組み合わせたその断片、変異体または誘導体であってもよい。抗体はいかなる種由来であってもよい。用語、抗体にはまた、本発明の抗体の結合性断片も含まれる;典型的な断片には、Fv、Fab、Fab’、一本鎖抗体(svFC)、二量体性可変領域(ディアボディ)およびジスルフィド安定化可変領域(dsFv)が含まれる。
【0128】
[0141]用語「エピトープ」には、免疫グロブリンまたはT細胞受容体に特異的に結合可能ないかなるタンパク質決定基も含まれる。エピトープ決定基は、通常、アミノ酸または糖側鎖などの分子の化学的活性表面群からなり、そして常にではないが、特定の三次元構造特性とともに、特定の電荷特性を有することも可能である。抗体は、解離定数が≦1μM、好ましくは≦100nM、そして最も好ましくは≦10nMである場合、抗原に特異的に結合すると言われる。
【0129】
[0142]用語「剤」は、本明細書において、化学的化合物、化学的化合物の混合物、生物学的巨大分子、または生物学的物質から作製される抽出物を意味する。
[0143]uPARポリペプチドに関する「活性である」または「活性」は、天然uPARポリペプチドの生物学的または免疫学的活性を有するuPARポリペプチドの部分を指す。「生物学的」は、本明細書で用いた際、天然uPARポリペプチドの活性から生じる生物学的機能を指す。好ましいuPAR生物学的活性には、例えば、uPARが誘導する細胞接着および浸潤が含まれる。
【0130】
[0144]「哺乳動物」は、本明細書で用いた際、哺乳動物と見なされるいかなる動物も指す。好ましくは、哺乳動物はヒトである。
[0145]酵素、パパインでの抗体の消化は、「Fab」断片としても知られる、2つの同一の抗原結合性断片、および抗原結合活性を持たないが、結晶化する能力を有する「Fc」断片を生じる。酵素、ペプシンでの抗体の消化は、抗体分子の2つのアームが連結されたままであり、そして2つの抗原結合部位を含む、F(ab’)2断片を生じる。F(ab’)2断片は、抗原を架橋する能力を有する。
【0131】
[0146]「Fv」は、本明細書で用いた際、抗原認識部位および抗原結合部位の両方を保持する抗体の最少断片を指す。
[0147]「Fab」は、本明細書で用いた際、軽鎖の定常ドメインおよび重鎖のCH1ドメインを含む抗体断片を指す。
【0132】
[0148]「Dab」は、本明細書で用いた際、ヒト抗体の最小機能結合単位である抗体断片を指す。
[0149]用語「mAb」は、モノクローナル抗体を指す。
【0133】
[0150]「リポソーム」は、本明細書で用いた際、本発明のuPARポリペプチド、またはこうしたuPARポリペプチドに対する抗体を含んでもよい薬剤を哺乳動物に送達するのに有用でありうる小胞を指す。
【0134】
[0151]「標識」または「標識された」は、本明細書において、ポリペプチドに対する検出可能部分、例えば放射標識、蛍光標識、酵素標識、化学発光標識基またはビオチニル基の付加を指す。放射性同位体または放射性核種には、3H、14C、15N、35S、90Y、99Tc、111In、125I、131Iが含まれてもよく、蛍光標識には、ローダミン、ランタニド、リンまたはFITCが含まれてもよく、そして酵素標識には、西洋ワサビ(horseradish)・ペルオキシダーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、アルカリホスファターゼが含まれてもよい。
【0135】
[0152]用語「薬学的剤または薬剤」は、本明細書において、患者に適切に投与された際、所望の療法効果を誘導可能な化学的化合物または組成物を指す。本明細書の他の化学用語は、The McGraw−Hill Dictionary of Chemical Terms(Parker, S.監修, McGraw−Hill, サンフランシスコ(1985))、(本明細書に援用される)に例示されるように、当該技術分野における慣用的用法にしたがって用いられる。
【0136】
[0153]本明細書において、「実質的に純粋な」は、対象種が、存在する主な種である(すなわちモル濃度に基づいて、組成物中の他の個々の種いずれよりもより豊富である)ことを意味し、そして好ましくは、実質的に純粋な分画は、対象種が、存在するすべての巨大分子種の少なくとも約50パーセント(モル濃度に基づいて)を構成する組成物である。一般的に、実質的に純粋な組成物は、組成物中に存在するすべての巨大分子種の約80%より多くを構成し、より好ましくは、約85%、90%、95%、および99%より多くを構成するであろう。最も好ましくは、対象種は、本質的に均質に精製され(慣用的検出法によって、組成物中に混入種が検出不能である)、ここで組成物は本質的に単一の巨大分子種からなる。
【0137】
[0154]用語「患者」には、ヒトおよび獣医学的被験体が含まれる。
ヒト抗体および抗体のヒト化
[0155]ヒト抗体は、ネズミまたはラットの可変および/または定常領域を所持する抗体に付随する問題のいくつかを回避する。こうしたネズミまたはラット由来タンパク質の存在は、抗体の迅速なクリアランスを導く可能性もあるし、あるいは患者によって抗体に対する免疫応答が生成されるのを導く可能性もある。ネズミまたはラット由来抗体の利用を回避するため、げっ歯類、他の哺乳動物または動物が完全ヒト抗体を産生するように、げっ歯類、他の哺乳動物または動物内に、機能するヒト抗体遺伝子座を導入することによって、完全ヒト抗体を生成してもよい。
【0138】
[0156]完全ヒト抗体を生成するための1つの方法は、ヒト重鎖遺伝子座およびカッパ軽鎖遺伝子座の、1000kbまでであるが、1000kb未満である大きさの生殖系列設定断片を含有するように操作されている、マウスのXenoMouse(登録商標)系統の使用を通じる。Mendezら Nature Genetics 15:146−156(1997)、ならびにGreenおよびJakobovits J. Exp. Med. 188:483−495(1998)を参照されたい。XenoMouse(登録商標)系統は、Abgenix, Inc.(カリフォルニア州フレモント)より入手可能である。
【0139】
[0157]マウスのXenoMouse(登録商標)系統の産生は、米国特許出願第07/466,008号、1990年1月12日出願、第07/610,515号、1990年11月8日出願、第07/919,297号、1992年7月24日出願、第07/922,649号、1992年7月30日出願、第08/031,801号、1993年3月15日出願、第08/112,848号、1993年8月27日出願、第08/234,145号、1994年4月28日出願、第08/376,279号、1995年1月20日出願、第08/430,938号、1995年4月27日出願、第08/464,584号、1995年6月5日出願、第08/464,582号、1995年6月5日出願、第08/463,191号、1995年6月5日出願、第08/462,837号、1995年6月5日出願、第08/486,853号、1995年6月5日出願、第08/486,857号、1995年6月5日出願、第08/486,859号、1995年6月5日出願、第08/462,513号、1995年6月5日出願、第08/724,752号、1996年10月2日出願、第08/759,620号、1996年12月3日出願、米国公報第2003/0093820号、2001年11月30日出願、ならびに米国特許第6,162,963号、第6,150,584号、第6,114,598号、第6,075,181号、および第5,939,598号、および日本国特許第3 068 180 B2号、第3 068 506 B2号、および第3 068 507 B2号にさらに論じられ、そして描写される。欧州特許第EP 0 463 151 B1号、1996年6月12日付与公表(grant published)、国際特許出願第WO 94/02602号、1994年2月3日公表、国際特許出願第WO 96/34096号、1996年10月31日公表、第WO 98/24893号、1998年6月11日公表、第WO 00/76310号、2000年12月21日公表もまた、参照されたい。上記引用特許、出願、および参考文献各々の開示は、その全体が本明細書に援用される。
【0140】
[0158]別のアプローチにおいて、GenPharm International, Inc.を含む他のグループは、「ミニ遺伝子座」アプローチを利用した。ミニ遺伝子座アプローチでは、Ig遺伝子座由来の片(個々の遺伝子)の包含を通じて、外因性Ig遺伝子座を模倣する。したがって、1以上のVH遺伝子、1以上のDH遺伝子、1以上のJH遺伝子、mu定常領域、および通常は第二の定常領域(好ましくはガンマ定常領域)を、動物内に挿入するための構築物になるように形成する。このアプローチは、Suraniらに対する米国特許第5,545,807号、ならびに各々、LonbergおよびKayに対する米国特許第5,545,806号、第5,625,825号、第5,625,126号、第5,633,425号、第5,661,016号、第5,770,429号、第5,789,650号、第5,814,318号、第5,877,397号、第5,874,299号、および第6,255,458号、KrimpenfortおよびBernsに対する米国特許第5,591,669号および第6,023,010号、Bernsらに対する米国特許第5,612,205号、第5,721,367号、および第5,789,215号、ならびにChoiおよびDunnに対する米国特許第5,643,763号、ならびにGenPharm International、米国特許出願第07/574,748号、1990年8月29日出願、第07/575,962号、1990年8月31日出願、第07/810,279号、1991年12月17日出願、第07/853,408号、1992年3月18日出願、第07/904,068号、1992年6月23日出願、第07/990,860号、1992年12月16日出願、第08/053,131号、1993年4月26日出願、第08/096,762号、1993年7月22日出願、第08/155,301号、1993年11月18日出願、第08/161,739号、1993年12月3日出願、第08/165,699号、1993年12月10日出願、第08/209,741号、1994年3月9日出願に記載され、これらの開示は本明細書に援用される。その開示が全体として本明細書に援用される、欧州特許第0 546 073 B1号、国際特許出願第WO 92/03918号、第WO 92/22645号、第WO 92/22647号、第WO 92/22670号、第WO 93/12227号、第WO 94/00569号、第WO 94/25585号、第WO 96/14436号、第WO 97/13852号、および第WO 98/24884号、ならびに米国特許第5,981,175号もまた、参照されたい。その開示が全体として本明細書に援用される、Taylorら、1992、Chenら、1993、Tuaillonら、1993、Choiら、1993、Lonbergら(1994)、Taylorら(1994)、およびTuaillonら(1995)、Fishwildら(1996)もさらに参照されたい。
【0141】
[0159]キリンもまた、微小細胞(microcell)融合を通じて、染色体の大きな片、または全染色体が導入されているマウスからのヒト抗体の生成を立証した。その開示が本明細書に援用される、欧州特許出願第773 288号および第843 961号を参照されたい。さらに、キリンのTcマウスとMedarexのミニ遺伝子座(Humab)マウスの交雑育種の結果である、KMTMマウスが生成された。これらのマウスは、キリン・マウスのヒトIgHトランス染色体(transchromosome)およびGenpharmマウスのカッパ鎖導入遺伝子を所持する(Ishidaら, Cloning Stem Cells, (2002)4:91−102)。
【0142】
[0160]ヒト抗体はまた、in vitro法によっても得られうる。適切な例には、限定されるわけではないが、ファージディスプレイ(CAT、Morphosys、Dyax、Biosite/Medarex、Xoma、Symphogen、Alexion(以前のProliferon)、Affimed)リボソームディスプレイ(CAT)、酵母ディスプレイ等が含まれる。
【0143】
抗体の調製
[0161]本明細書記載の抗体は、以下に記載するように、XenoMouse(登録商標)技術の利用を通じて調製された。その結果、こうしたマウスは、ヒト免疫グロブリン分子および抗体を産生可能であり、そしてネズミ免疫グロブリン分子および抗体の産生は欠損している。これを達成するために利用される技術は、本明細書の背景セクションに開示する特許、出願、および参考文献に開示される。しかし、特に、マウスおよび該マウス由来の抗体のトランスジェニック産生の好ましい態様が、米国特許出願第08/759,620号、1996年12月3日出願、ならびに国際特許出願第WO 98/24893号、1998年6月11日公表、および第WO 00/76310号、2000年12月21日公表に開示され、これらの開示は、本明細書に援用される。その開示が本明細書に援用される、Mendezら Nature Genetics 15:146−156(1997)もまた参照されたい。
【0144】
[0162]こうした技術の使用を通じて、多様な抗原に対する完全ヒト・モノクローナル抗体を産生した。本質的に、マウスのXenoMouse(登録商標)系統を、目的の抗原(例えばuPAR)で免疫し、リンパ系細胞(B細胞など)を過免疫(hyper−immunized)マウスから回収し、そして回収したリンパ球を骨髄腫型細胞株と融合させて、不死ハイブリドーマ細胞株を調製する。これらのハイブリドーマ細胞株をスクリーニングし、そして選択して、目的の抗原に特異的な抗体を産生するハイブリドーマ細胞株を同定する。本明細書に提供するのは、uPARに特異的な抗体を産生する多数のハイブリドーマ細胞株の産生法である。さらに、本明細書に提供するのは、こうした抗体の重鎖および軽鎖のヌクレオチドおよびアミノ酸配列分析を含む、こうした細胞株によって産生される抗体の性質決定である。
【0145】
[0163]あるいは、骨髄腫細胞に融合させてハイブリドーマを生成する代わりに、B細胞を直接アッセイしてもよい。例えば、CD19+ B細胞を過免疫XenoMouse(登録商標)マウスから単離し、そして増殖させ、そして抗体分泌形質細胞に分化させてもよい。次いで、細胞上清由来の抗体を、uPAR免疫原に対する反応性に関して、ELISAによってスクリーニングする。また、上清を、uPARの断片に対する免疫反応性に関してスクリーニングして、uPAR上の機能的に関心が持たれるドメインに対する結合に関して、異なる抗体をさらにマッピングしてもよい。また、他の関連ヒト受容体に対して、そしてuPARのラット、マウス、およびカニクイザルなどの非ヒト霊長類のオルソログに対して、抗体をスクリーニングしてもよく、後者は、種交差反応性を決定するためである。個々のウェルまたはプールしたウェルのいずれかからハイブリドーマを作製する融合を含む多様な方法によって、あるいはEBVでの感染または既知の不死化遺伝子によるトランスフェクション、そしてその後の適切な培地中でのプレーティングによって、目的の抗体を含有するウェル由来のB細胞を、不死化してもよい。あるいは、次いで、uPAR特異的溶血プラークアッセイ(例えばBabcookら, Proc. Natl. Acad. Sci. USA 93:7843−48(1996)を参照されたい)を用いて、望ましい特異性を持つ抗体を分泌する単一の形質細胞を単離する。溶解の標的とされる細胞は、好ましくは、uPAR抗原でコーティングされたヒツジ赤血球(SRBC)である。
【0146】
[0164]目的の免疫グロブリンおよび補体を分泌する形質細胞を含有するB細胞培養の存在下で、プラークの形成は、目的の形質細胞を取り巻くヒツジ赤血球の、uPARが仲介する特異的溶解を示す。プラーク中心の単一の抗原特異的形質細胞を単離してもよく、そして抗体の特異性をコードする遺伝的情報を、単一の形質細胞から単離する。逆転写後のPCR(RT−PCR)を用いて、抗体の重鎖および軽鎖の可変領域をコードするDNAをクローニングしてもよい。次いで、こうしたクローニングされたDNAを、適切な発現ベクター、好ましくは、pcDNAなどのベクターカセット、より好ましくは免疫グロブリン重鎖および軽鎖の定常ドメインを含有するpcDNAベクターに、さらに挿入してもよい。次いで、生成したベクターを、宿主細胞、例えばHEK293細胞、CHO細胞内にトランスフェクションし、そして転写を誘導するか、形質転換体を選択するか、または所望の配列をコードする遺伝子を増幅するのに適するように修飾した、慣用的な栄養培地中で培養してもよい。
【0147】
[0165]一般的に、融合ハイブリドーマによって産生される抗体は、完全ヒト・カッパまたはラムダ軽鎖を含むヒトIgG2重鎖であった。本明細書に記載する抗体は、ヒトIgG4重鎖ならびにIgG2重鎖を所持する。抗体はまた、IgG1を含む他のヒト・アイソタイプのものであってもよい。抗体は、高いアフィニティーを所持し、固相および溶液相技術によって測定した際、典型的には約10−6〜約10−12Mまたはそれ未満のKdを所持する。uPARの活性を阻害するには、少なくとも10−11MのKDを所持する抗体が好ましい。
【0148】
[0166]認識されるであろうように、ハイブリドーマ細胞株以外の細胞株で、抗体を発現させてもよい。特定の抗体をコードする配列を用いて、適切な哺乳動物宿主細胞を形質転換してもよい。形質転換は、例えばウイルスにおける(またはウイルスベクター内への)ポリヌクレオチドのパッケージング、およびウイルス(またはベクター)での宿主細胞の形質導入を含む、宿主細胞内へのポリヌクレオチドの導入のために知られる任意の方法によっても、または米国特許第4,399,216号、第4,912,040号、第4,740,461号、および第4,959,455号(これらの特許は本明細書に援用される)に例示されるように、当該技術分野に知られるトランスフェクション法によってもよい。用いる形質転換法は、形質転換しようとする宿主に応じる。哺乳動物細胞内に異種ポリヌクレオチドを導入するための方法は、当該技術分野に周知であり、そしてこれには、デキストラン仲介トランスフェクション、リン酸カルシウム沈殿、ポリブレン仲介トランスフェクション、プロトプラスト融合、エレクトロポレーション、リポソーム中のポリヌクレオチド(単数または複数)の被包、および核内へのDNAの直接マイクロインジェクションが含まれる。
【0149】
[0167]発現の宿主として利用可能な哺乳動物細胞株は当該技術分野に周知であり、そしてアメリカン・タイプ・カルチャー・コレクション(ATCC)から入手可能な多くの不死化細胞株が含まれ、限定されるわけではないが、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎臓(BHK)細胞、サル腎臓細胞(COS)、ヒト肝細胞癌細胞(例えばHep G2)、ヒト上皮腎293細胞、およびいくつかの他の細胞株が含まれる。どの細胞株が高発現レベルを有し、そして恒常的なuPAR結合特性を持つ抗体を産生するかを決定することによって、特に好ましい細胞株を選択する。
【0150】
[0168]mAbがuPAR活性を有意に中和する能力(以下の実施例において立証されるようなもの)に基づいて、これらの抗体は、uPAR発現から生じる症状および状態を治療する際に療法効果を有するであろう。特定の態様において、本明細書の抗体および方法は、uPARが誘導する細胞接着、浸潤および細胞内シグナル伝達から生じる症状の治療に関する。
【0151】
[0169]本発明の別の側面にしたがって、uPARの生物学的活性のアンタゴニスト、および薬学的に許容されうるキャリアーを含む薬学的組成物を提供する。1つの態様において、アンタゴニストは抗体を含む。本発明の別の側面にしたがって、uPARの生物学的活性のアンタゴニスト、および薬学的に許容されうるキャリアーを含む、薬学的組成物を提供する。1つの態様において、アンタゴニストは抗体を含む。
【0152】
[0170]抗uPAR抗体は、患者試料におけるuPARの検出に有用であり、そしてしたがって、本明細書に記載するような疾患状態の診断として有用である。さらに、uPA活性を有意に阻害する能力(以下の実施例に立証するようなもの)に基づいて、抗uPAR抗体は、uPAR発現から生じる症状および状態を治療する際に療法効果を有する。特定の態様において、本明細書の抗体および方法は、uPARが誘導する細胞接着、浸潤および細胞内シグナル伝達から生じる症状の治療に関する。さらなる態様は、本明細書記載の抗体および方法を用いて、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、および膵臓癌を含む、細胞接着および浸潤関連疾患を治療することを伴う。抗体はまた、関節炎、アテローム性動脈硬化症および血管新生を伴う疾患における細胞接着および/または浸潤を治療する際にも有用でありうる。
【0153】
療法的投与および配合
[0171]本発明の態様には、疾患に対する治療として有用な抗uPAR抗体の無菌薬学的配合物が含まれる。こうした配合物は、uPAのその受容体uPARへの結合を阻害し、それによって、例えば、血清または組織uPARが異常に上昇している病的状態を有効に治療するであろう。抗uPAR抗体は、好ましくは、uPAを強力に阻害し、そして好ましくは、ヒトにおける低頻度の投薬を可能にする、適切な作用期間を有する。作用期間延長は、皮下または筋内注射などの別の非経口投与経路による、より頻繁でなく、そしてより好適な投薬スケジュールを可能にするであろう。
【0154】
[0172]例えば、抗体の凍結乾燥および再構成の前または後に、無菌ろ過膜を通じたろ過によって、無菌配合物を生成してもよい。抗体は、通常、凍結乾燥型で、または溶液中で、保存されるであろう。療法抗体組成物は、一般的に、無菌アクセスポートを有する容器、例えば静脈内溶液バッグ、または皮下注射針によって貫通可能な栓などの、配合物の回収を可能にするアダプターを有するバイアルに入れられる。
【0155】
[0173]抗体投与経路は、既知の方法にしたがって、例えば、静脈内、腹腔内、脳内、筋内、眼内、動脈内、クモ膜下腔内、吸入または病巣内経路による注射または注入であるか、腫瘍部位への直接注射であるか、あるいは以下に示すような持続放出系による。抗体は、好ましくは、注入によって、またはボーラス注射によって、連続投与される。
【0156】
[0174]療法的に使用しようとする抗体の有効量は、例えば、療法目的、投与経路、および患者の状態に応じるであろう。したがって、最適療法効果を得るために、治療専門家が、必要に応じて、投薬量を力価決定し、そして投与経路を修飾することが好ましい。典型的には、臨床医は、望ましい効果を達成する投薬量に達するまで、抗体を投与するであろう。この療法の進行は、慣用的アッセイによって、または本明細書記載のアッセイによって、容易に監視される。
【0157】
[0175]本明細書に記載するような抗体は、薬学的に許容されうるキャリアーと混合して調製可能である。この療法組成物を、静脈内投与してもよいし、あるいは好ましくは液体または粉末エアロゾル(凍結乾燥)として、鼻または肺を通じて投与してもよい。組成物はまた、所望に応じて、非経口投与してもまたは皮下投与してもよい。全身投与する場合、療法組成物は、無菌、発熱物質不含で、そしてpH、等張性、および安定性を十分顧慮して、非経口的に許容されうる溶液中になければならない。これらの条件は、当業者に知られる。簡潔には、所望の度合いの純度を有する化合物を、薬学的に許容されうるキャリアー、賦形剤、または安定化剤と混合することによって、保存または投与のために、本明細書記載の化合物の投薬配合物を調製する。こうした物質は、使用する投薬量および濃度で、レシピエントに対して毒性でなく、そしてこうした物質には、TRIS HCl、リン酸、クエン酸、酢酸、および他の有機酸塩などの緩衝剤;アスコルビン酸などの酸化防止剤;ポリアルギニンなどの低分子量(約10残基未満)ペプチド、血清アルブミン、ゼラチン、または免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン酸、アスパラギン酸、またはアルギニンなどのアミノ酸;単糖、二糖、およびセルロースもしくはその誘導体、グルコース、マンノース、またはデキストリンを含む他の炭水化物;EDTAなどのキレート剤;マンニトールまたはソルビトールなどの糖アルコール;TWEEN、PLURONICSまたはポリエチレングリコールなどのナトリウムおよび/または非イオン性界面活性剤などの対イオンが含まれる。
【0158】
[0176]Remington: The Science and Practice of Pharmacy(第20版, Lippincott Williams & Wilkens Publishers(2003))に記載されるように、慣用的薬学的実施にしたがって、注射用の無菌組成物を配合してもよい。例えば、水、あるいはゴマ油、ピーナツ油または綿実油のような天然存在植物油、あるいはオレイン酸エチル等のような合成脂肪性ビヒクルなどの薬学的に許容されうるキャリアー中での活性化合物の溶解または懸濁が望ましい可能性もある。許容される薬学的実施にしたがって、緩衝剤、保存剤、酸化防止剤等を取り込んでもよい。
【0159】
[0177]持続放出調製物の適切な例には、ポリペプチドを含有する固形疎水性ポリマーの半透性マトリックスが含まれ、こうしたマトリックスは、成形された物品、フィルムまたはマイクロカプセルの形である。持続放出マトリックスの例には、ポリエステル、ヒドロゲル(例えば、Langerら, J. Biomed Mater. Res., (1981)15:167−277およびLanger, Chem. Tech., (1982)12:98−105に記載されるようなポリ(2−ヒドロキシエチル−メタクリレート)、またはポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号、EP 58,481)、L−グルタミン酸およびガンマ・エチル−L−グルタメートのコポリマー(Sidmanら, Biopolymers, (1983)22:547−556)、分解不能エチレン−酢酸ビニル(Langerら、上記)、分解可能乳酸−グリコール酸コポリマー、例えばLUPRON DepotTM(乳酸−グリコール酸コポリマー、および酢酸ロイプロリドで構成される注射可能微小球体)、およびポリ−(D)−(−)−3−ヒドロキシ酪酸(EP 133,988)が含まれる。
【0160】
[0178]エチレン−酢酸ビニルおよび乳酸−グリコール酸などのポリマーは、100日間に渡って分子の放出を可能にする一方、特定のヒドロゲルは、より短い期間でタンパク質を放出する。被包されたタンパク質が、体内に長期間残ると、37℃で湿気に曝露された結果として、変性するかまたは凝集し、生物学的活性の喪失およびもしかすると免疫原性の変化を生じる可能性もある。関与する機構に応じて、タンパク質安定化のための合理的戦略を考案してもよい。例えば、凝集機構が、ジスルフィド交換を通じた分子間S−S結合形成であることが発見されたならば、スルフィドリル残基を修飾し、酸性溶液から凍結乾燥させ、水分含量を調節し、適切な添加剤を用い、そして特定のポリマーマトリックス組成を発展させることによって、安定化を達成してもよい。
【0161】
[0179]持続放出組成物にはまた、結晶を懸濁中に維持することが可能な適切な配合物中に懸濁された抗体の結晶の調製物も含まれる。これらの調製物は、皮下または腹腔内注射されると、持続放出効果を生じうる。他の組成物にはまた、リポソームに捕捉された抗体も含まれる。こうした抗体を含有するリポソームは、それ自体知られる方法によって調製される:米国特許第DE 3,218,121号; Epsteinら, Proc. Natl. Acad. Sci. USA, (1985)82:3688−3692; Hwangら, Proc. Natl. Acad. Sci. USA, (1980)77:4030−4034; EP 52,322; EP 36,676; EP 88,046; EP 143,949; 142,641;日本国特許出願第83−118008号;米国特許第4,485,045号および第4,544,545号;ならびにEP 102,324。
【0162】
[0180]所定の患者に対する抗体配合物の投薬量は、疾患の重症度および種類、体重、性別、食餌、投与時間および経路、他の薬剤および他の関連する臨床要因を含む、薬剤作用を修飾することが知られる多様な要因を考慮して、主治医によって決定されるであろう。in vitro法またはin vivo法のいずれかによって、療法的有効投薬量を決定してもよい。
【0163】
[0181]療法的に使用しようとする、本明細書記載の抗体の有効量は、例えば、療法目的、投与経路、および患者の状態に応じるであろう。したがって、治療専門家が、投薬量を力価決定し、そして最適療法効果を得るために、必要に応じて、投与経路を修飾することが好ましい。典型的な1日投薬量は、上述の要因に応じて、約0.001mg/kg、0.01mg/kg、0.1mg/kg、1mg/kg、10mg/kgから最大100mg/kg、1000mg/kg、10000mg/kgまでの範囲、またはそれより多くてもよい。典型的には、臨床医は、望ましい効果を達成する投薬量に達するまで、療法抗体を投与するであろう。この療法の進行は、慣用的アッセイによって、または本明細書に記載するように、容易に監視される。
【0164】
[0182]本明細書の組成物および方法にしたがった、療法実体の投与は、改善された輸送、送達、耐性等を提供するために、配合物内に取り込まれる、適切なキャリアー、賦形剤、および他の剤とともに投与されるであろうことが認識されるであろう。これらの配合物には、例えば、粉末、ペースト、軟膏、ゼリー、ワックス、油、脂質、脂質(陽イオン性または陰イオン性)含有小胞(LipofectinTMなど)、DNAコンジュゲート、無水吸収ペースト、水中油および油中水エマルジョン、エマルジョン・カルボワックス(多様な分子量のポリエチレングリコール)、半固体ゲル、およびカルボワックス含有半固体混合物が含まれる。前述の混合物のいずれも、配合物中の活性成分が配合によって不活化されず、そして配合物が投与経路に生理学的に適合し、そして耐性であるならば、本発明にしたがった治療および療法において適切でありうる。薬学的化学者に周知の配合物、賦形剤、およびキャリアーに関連するさらなる情報に関しては、Baldrick P. “Pharmaceutical excipient development: the need for preclinical guidance” Regul. Toxicol. Pharmacol. 32(2):210−8(2000), Wang W. “Lyophilization and development of solid protein pharmaceuticals.” Int. J. Pharm. 203(1−2):1−60(2000), Charman WN “Lipids, lipophilic drugs, and oral drug delivery−some emerging concepts.” J Pharm Sci .89(8):967−78(2000), Powellら “Compendium of excipients for parenteral formulations” PDA J Pharm Sci Technol. 52:238−311(1998)、およびこれら文献中の引用文献もまた、参照されたい。
【0165】
他の療法剤の設計および生成
[0183]本発明にしたがって、そしてuPARに関する、本明細書で産生し、そして性質決定する抗体の活性に基づいて、抗体部分より勝る他の療法様式の設計を容易にする。こうした様式には、限定されるわけではないが、進化した抗体療法剤、例えば、二重特異性抗体、免疫毒素、および放射標識療法、単一ドメイン抗体、抗体断片、例えば、Fab、Fab’、F(ab’)2、FvまたはDab、ペプチド療法剤の生成、新規足場中のuPAR結合ドメイン、遺伝子治療、特にイントラボディ、アンチセンス療法、および小分子が含まれる。
【0166】
[0184]進化した抗体療法剤の生成と関連して、補体結合が望ましい特質である場合、例えば、二重特異性抗体、免疫毒素、または放射標識の使用を通じて、細胞殺傷のための補体に対する依存性を回避することも可能でありうる。
【0167】
[0185](i)一方はuPARに対する特異性を持ち、そして他方は第二の分子に対する特異性を持ち、ともにコンジュゲート化されている、2つの抗体、(ii)uPARに対して特異的な1つの鎖、および第二の分子に対して特異的な第二の鎖を有する、単一抗体、または(iii)uPARおよび他の分子に対する特異性を有する一本鎖抗体を含む、二重特異性抗体を生成してもよい。こうした二重特異性抗体は、周知である技術を用いて生成可能であり;例えば(i)および(ii)に関連して、例えば、Fangerら Immunol Methods 4:72−81(1994)、ならびにWrightおよびHarris、上記を、そして(iii)に関連して、例えば、Trauneckerら Int. J. Cancer(補遺)7:51−52(1992)を参照されたい。どちらの場合も、限定されるわけではないが、CD16またはCD64(例えばDeoら Immunol. Today 18:127(1997)を参照されたい)、あるいはCD89(例えばValeriusら Blood 90:4485−4492(1997))を含む、重鎖活性化受容体に対して、第二の特異性を作製してもよい。
【0168】
[0186]当業者に周知の技術を利用して、免疫毒素として作用するように、抗体を修飾することもまた可能である。例えば、Vitetta Immunol Today 14:252(1993)を参照されたい。また、米国特許第5,194,594号も参照されたい。放射標識抗体の調製と関連して、当該技術分野に周知の技術を利用して、こうした修飾抗体を容易に調製可能である。例えば、Junghansら Cancer Chemotherapy and Biotherapy中 655−686(第2版, ChafnerおよびLongo監修, Lippincott Raven(1996))を参照されたい。また、米国特許第4,681,581号、第4,735,210号、第5,101,827号、第5,102,990号(RE 35,500)、第5,648,471号、および第5,697,902号もまた参照されたい。
【0169】
併用
[0187]本明細書において定義する抗腫瘍治療を、単一療法として適用してもよいし、または抗腫瘍治療は、本発明の化合物に加えて、慣用的な手術または放射線療法または化学療法を伴ってもよい。こうした化学療法には、1以上の以下のカテゴリーの抗腫瘍剤が含まれてもよい:
(i)内科的腫瘍学で用いられるような、他の抗増殖/抗新生物薬剤およびその併用、例えばアルキル化剤(例えばシスプラチン、オキサリプラチン、カルボプラチン、シクロホスファミド、ナイトロジェンマスタード、メルファラン、クロラムブシル、ブスルファン、テモゾラミド(temozolamide)およびニトロソ尿素);代謝拮抗剤(例えば、ゲムシタビン、ならびに5−フルオロウラシルおよびテガフールのようなフルオロピリミジンなどの抗葉酸剤、ラルチトレキセド、メトトレキサート、シトシンアラビノシドおよびヒドロキシ尿素);抗腫瘍抗生物質(例えばアドリアマイシン、ブレオマイシン、ドキソルビシン、ダウノマイシン、エピルビシン、イダルビシン、マイトマイシン−C、ダクチノマイシンおよびミトラマイシンのようなアントラサイクリン);抗有糸分裂剤(例えばビンクリスチン、ビンブラスチン、ビンデシンおよびビノレルビンのようなビンカアルカロイド、ならびにタキソールおよびタキソテールのようなタキソイド、ならびにポロキナーゼ阻害剤);およびトポイソメラーゼ阻害剤(例えばエトポシドおよびテニポシドのようなエピポドフィロトキシン、アムサクリン、トポテカンならびにカンプトテシン);
(ii)細胞増殖抑制剤、例えば抗エストロゲン剤(例えばタモキシフェン、フルベストラント、トレミフェン、ラロキシフェン、ドロロキシフェンおよびヨードキシフェン)、抗アンドロゲン剤(例えばビカルタミド、フルタミド、ニルタミドおよび酢酸シプロテロン)、LHRHアンタゴニストまたはLHRHアゴニスト(例えばゴセレリン、リュープロレリンおよびブセレリン)、プロゲストゲン(例えば酢酸メゲストロール)、アロマターゼ阻害剤(例えばアナストロゾール、レトロゾール、ボラゾール(vorazole)およびエキセメスタン)および5αレダクターゼの阻害剤、例えばフィナステリド;
(iii)抗浸潤剤(例えば、4−(6−クロロ−2,3−メチレンジオキシアニリノ)−7−[2−(4−メチルピペラジン−1−イル)エトキシ]−5−テトラヒドロピラン−4−イルオキシキナゾリン(AZD0530;国際特許出願WO 01/94341)およびN−(2−クロロ−6−メチルフェニル)−2−{6−[4−(2−ヒドロキシエチル)ピペラジン−1−イル]−2−メチルピリミジン−4−イルアミノ}チアゾール−5−カルボキサミド(ダサチニブ、BMS−354825; J. Med. Chem., 2004, 47, 6658−6661)のようなc−Srcキナーゼファミリー阻害剤、ならびにマリマスタットのようなメタロプロテイナーゼ阻害剤、ウロキナーゼ・プラスミノーゲン活性化因子受容体機能の他の阻害剤、またはカテプシンの阻害剤、セリンプロテアーゼ、例えばマトリプターゼ、ヘプシン、ウロキナーゼの阻害剤、ヘパラナーゼの阻害剤);
(iv)増殖因子機能の阻害剤:例えばこうした阻害剤には、増殖因子抗体および増殖因子受容体抗体(例えば抗erbB2抗体トラスツズマブ[ハーセプチンTM]、抗EGFR抗体パニツムマブ、抗erbB1抗体セツキシマブ[エルビタックス、C225]およびSternら Critical reviews in oncology/haematology, 2005, Vol.54, pp11−29に開示される任意の増殖因子または増殖因子受容体)が含まれ;こうした阻害剤にはまた、チロシンキナーゼ阻害剤、例えば上皮増殖因子ファミリーの阻害剤(例えばEGFRファミリー・チロシンキナーゼ阻害剤、例えばN−(3−クロロ−4−フルオロフェニル)−7−メトキシ−6−(3−モルホリノプロポキシ)キナゾリン−4−アミン(ゲフィチニブ、ZD1839)、N−(3−エチニルフェニル)−6,7−ビス(2−メトキシエトキシ)キナゾリン−4−アミン(エルロチニブ、OSI−774)および6−アクリルアミド−N−(3−クロロ−4−フルオロフェニル)−7−(3−モルホリノプロポキシ)−キナゾリン−4−アミン(CI 1033)、ラパチニブなどのerbB2チロシンキナーゼ阻害剤、肝細胞増殖因子ファミリーの阻害剤、イマチニブなどの血小板由来増殖因子ファミリーの阻害剤、セリン/スレオニンキナーゼの阻害剤(例えば、ファルネシル・トランスフェラーゼ阻害剤などのRas/Rafシグナル伝達阻害剤、例えばソラフェニブ(BAY43−9006))、MEKおよび/またはAKTキナーゼを通じた細胞シグナル伝達の阻害剤、肝細胞増殖因子ファミリーの阻害剤、c−kit阻害剤、ablキナーゼ阻害剤、IGF受容体(インスリン様増殖因子)キナーゼ阻害剤;オーロラキナーゼ阻害剤(例えば、AZD1152、PH739358、VX−680、MLN8054、R763、MP235、MP529、VX−528およびAX39459)、ならびにCDK2および/またはCDK4阻害剤などのサイクリン依存性キナーゼ阻害剤が含まれる;
(v)抗血管新生剤、例えば血管内皮増殖因子の効果を阻害するもの[例えば抗血管内皮細胞増殖因子抗体ベバシズマブ(アバスチンTM)、ならびに4−(4−ブロモ−2−フルオロアニリノ)−6−メトキシ−7−(1−メチルピペリジン−4−イルメトキシ)キナゾリン(ZD6474; WO 01/32651の実施例2)、4−(4−フルオロ−2−メチルインドール−5−イルオキシ)−6−メトキシ−7−(3−ピロリジン−1−イルプロポキシ)キナゾリン(AZD2171; WO 00/47212内の実施例240)、バタラニブ(PTK787; WO 98/35985)およびSU11248(スニチニブ; WO 01/60814)などのVEGF受容体チロシンキナーゼ阻害剤、国際特許出願WO 97/22596、WO 97/30035、WO 97/32856およびWO 98/13354に開示するものなどの化合物、ならびに他の機構によって作用する化合物(例えば、インテグリンαvβ3機能の阻害剤であるリノミド(linomide)およびアンジオスタチン];
(vi)血管損傷剤、例えばコンブレタスタチンA4、ならびに国際特許出願WO 99/02166、WO 00/40529、WO 00/41669、WO 01/92224、WO 02/04434およびWO 02/08213に開示される化合物;
(vii)アンチセンス療法、例えば抗rasアンチセンスであるISIS 2503などの上に列挙する標的に対して向けられるもの;
(viii)例えば、異常なp53、あるいは異常なBRCA1またはBRCA2などの異常な遺伝子を置換するアプローチ、シトシンデアミナーゼ、チミジンキナーゼまたは細菌ニトロレダクターゼ酵素を用いるものなどのGDEPT(遺伝子指向性酵素プロドラッグ療法)アプローチ、および多剤耐性遺伝子治療などの化学療法または放射線療法に対する患者耐性を増加させるアプローチを含む、遺伝子治療アプローチ;ならびに
(ix)例えば、患者腫瘍細胞の免疫原性を増加させるex−vivoおよびin−vivoアプローチ、例えばインターロイキン2、インターロイキン4または顆粒球−マクロファージ・コロニー刺激因子などのサイトカインでのトランスフェクション、T細胞アネルギーを減少させるアプローチ、サイトカインでトランスフェクションした樹状細胞などのトランスフェクションした免疫細胞を用いたアプローチ、サイトカインでトランスフェクションした腫瘍細胞株を用いたアプローチおよび抗イディオタイプ抗体を用いたアプローチを含む、免疫療法アプローチ。
【0170】
[0188]1つの態様において、本明細書に定義する抗腫瘍治療は、本発明の化合物に加えて、内科的腫瘍学で用いられるような、他の抗増殖/抗新生物薬剤およびその併用、例えばアルキル化剤(例えばシスプラチン、オキサリプラチン、カルボプラチン、シクロホスファミド、ナイトロジェンマスタード、メルファラン、クロラムブシル、ブスルファン、テモゾラミド、およびニトロソ尿素);代謝拮抗剤(例えば、ゲムシタビン、ならびに5−フルオロウラシルおよびテガフールのようなフルオロピリミジンなどの抗葉酸剤、ラルチトレキセド、メトトレキサート、シトシンアラビノシド、およびヒドロキシ尿素);抗腫瘍抗生物質(例えばアドリアマイシン、ブレオマイシン、ドキソルビシン、ダウノマイシン、エピルビシン、イダルビシン、マイトマイシン−C、ダクチノマイシンおよびミトラマイシンのようなアントラサイクリン);抗有糸分裂剤(例えばビンクリスチン、ビンブラスチン、ビンデシンおよびビノレルビンのようなビンカアルカロイド、ならびにタキソールおよびタキソテールのようなタキソイド、ならびにポロキナーゼ阻害剤);およびトポイソメラーゼ阻害剤(例えばエトポシドおよびテニポシドのようなエピポドフィロトキシン、アムサクリン、トポテカンならびにカンプトテシン)での治療を伴ってもよい。
【0171】
[0189]1つの態様において、本明細書に定義する抗腫瘍治療は、本発明の化合物に加えて、ゲムシタビンでの治療を伴ってもよい。
[0190]治療の個々の構成要素を同時に、連続してまたは別個に投与することによって、こうした共同の治療を達成してもよい。こうした併用産物は、本明細書において上述する投薬量範囲内の本発明の化合物またはその薬学的に許容されうる塩、および認可された投薬量範囲内の他の薬学的活性剤を使用する。
【実施例】
【0172】
[0191]以下の実施例は、行う実験および達成される結果を含めて、例示目的のみのために提供され、そして本明細書の解説を制限するとは見なされないものとする。
実施例1
免疫および力価決定
免疫
[0192]それぞれ、可溶性uPAR(組換えヒトuPAR/His6、カタログ番号807−UK−100、R&D Systems, Inc.)および細胞結合uPAR(細胞表面にヒトuPARを発現しているB300.19トランスフェクタント)を用いて、免疫を行った。B300.19トランスフェクタントを生成するため、pcDNA3発現ベクター内にヒト全長uPAR cDNAを挿入した。エレクトロポレーションを介して、B300.19細胞を一過性にトランスフェクションした。蛍光活性化細胞分取(FACS)分析によって、細胞表面上のヒトuPARの発現が免疫に適したレベルであることを確認した。その開示が本明細書に援用される米国特許出願第08/759,620号、1996年12月3日出願、および国際特許出願第WO 98/24893号、1998年6月11日公表、および第WO 00/76310号、2000年12月21日公表に開示される方法にしたがって、XenoMouseTMにおける免疫のため、作戦1では、10μg/マウスの可溶性タンパク質を、そして作戦2では、1x107細胞/マウスのB300.19トランスフェクション細胞を用いた。免疫プログラムを表2に要約する。
【0173】
力価による採取用動物の選択
[0193]ヒトuPARに対する抗体の力価をFACSによって試験した。免疫プログラム終了時、実施例2に記載するように、エレクトロポレーションによって、マウス骨髄腫細胞、ならびに免疫したマウスの脾臓およびリンパ節から単離したリンパ球を用いて、融合を実行した。
【0174】
表2:免疫プログラムの要約
【0175】
【表2】

【0176】
「Fp」は、「足蹠」を指す。
実施例2
リンパ球回収、B細胞単離、融合およびハイブリドーマの生成
[0194]免疫したマウスを頸椎脱臼によって屠殺し、そして流入領域リンパ節を採取し、そして各コホートからプールした。DMEM中ですりつぶすことによって、リンパ系細胞を解離させて、組織から細胞を遊離させ、そして細胞をDMEM中に懸濁した。細胞を計数し、そして1億個のリンパ球あたり0.9mlのDMEMを細胞ペレットに添加して、細胞を穏やかにしかし完全に再懸濁した。1億個の細胞あたり、100μlのCD90+磁気ビーズを用いて、磁気ビーズと細胞を4℃で15分間インキュベーションすることによって、細胞を標識した。最大108陽性細胞(または最大2x109総細胞)を含有する磁気標識細胞懸濁物をLS+カラム上に装填し、そしてカラムをDMEMで洗浄した。総流出物をCD90陰性分画(これらの細胞の大部分は、B細胞であると期待された)として収集した。
【0177】
[0195]上記由来の洗浄した濃縮B細胞およびATCCから購入した、非分泌性骨髄腫P3X63Ag8.653細胞、カタログ番号CRL 1580(Kearneyら, J. Immunol. 123, 1979, 1548−1550)を1:1の比で混合することによって、融合を行った。800xgの遠心分離によって、細胞混合物を穏やかにペレットにした。上清を完全に除去した後、2〜4mlのプロナーゼ溶液(CalBiochem、カタログ番号53702;PBS中、0.5mg/ml)で2分を超えずに、細胞を処理した。次いで、3〜5mlのFBSを添加して、酵素活性を停止し、そしてエレクトロ細胞融合溶液(ECFS、0.3Mスクロース、Sigma、カタログ番号S7903、0.1mM酢酸マグネシウム、Sigma、カタログ番号M2545、0.1mM酢酸カルシウム、Sigma、カタログ番号C4705)を用いて、懸濁物を40ml総体積に調整した。遠心分離後に上清を除去し、そして40ml ECFS中に細胞を再懸濁した。この洗浄工程を反復し、そして再び、細胞をECFS中に再懸濁して、2x106細胞/mlの濃度にした。
【0178】
[0196]融合生成装置(モデルECM2001、Genetronic, Inc.、カリフォルニア州サンディエゴ)を用いて、エレクトロ細胞融合を行った。用いた融合チャンバーサイズは2.0mlであり、以下の装置設定を用いた:
[0197]調節条件:電圧:50V、時間:50秒。
[0198]電圧:3000V、時間:30μ秒で膜破壊
[0199]融合後保持時間:3秒
[0200]ECF後、細胞懸濁物を、無菌条件下で、融合チャンバーから注意深く除去し、そしてL−グルタミン、pen/strep、OPI(オキサロ酢酸、ピルビン酸、ウシ・インスリン)(すべてSigma)およびIL−6(Boehringer Mannheim)を補充した、同体積のハイブリドーマ培地(DMEM、JRH Biosciences)、15%FBS(Hyclone)を含有する無菌試験管内に移した。細胞を37℃で15〜30分間インキュベーションし、そして次いで、400xg(1000rpm)で5分間遠心分離した。小体積のハイブリドーマ選択培地(0.5xHA(Sigma、カタログ番号A9666)を補充したハイブリドーマ培地)中に細胞を穏やかに再懸濁し、そして96ウェルプレートあたり、総数5x106 B細胞およびウェルあたり200μlの最終プレーティングに基づいて、さらなるハイブリドーマ選択培地を用いて、体積を適切に調整した。細胞を穏やかに混合し、そして96ウェルプレート内にピペッティングし、そして増殖を可能にした。第7日または第10日、培地の半分を除去し、そして細胞にハイブリドーマ選択培地を再供給した。
【0179】
[0201]選択培地中でルーチンとして、ハイブリドーマを増殖させた。潜在的に抗ヒトuPAR抗体を産生するハイブリドーマから収集した消耗上清を、続くスクリーニングアッセイに供した。
【0180】
実施例3
細胞に結合したhu−uPARへの結合
[0202]蛍光測定微量体積アッセイ技術(FMAT)を用いて、ヒトuPARを発現するようにトランスフェクションしたネズミ・プレB細胞株B300.19(ATCC)、および対照としてのB300.19親細胞を用いて、細胞に結合したuPARへの抗体の結合を試験した。アッセイに、5,000細胞/ウェルを使用した。マウス抗ヒトuPAR mAb(R&E Systems、MAB807)を陽性対照試薬として用い、一方、G2 KLH上清(1:10)を陰性対照試薬として用いた。400ng/mlのヤギ抗ヒトIgG Cy5コンジュゲート(マウス抗体対照には、ヤギ抗マウスIgG Cy5コンジュゲート)を用いて、結合した抗体を検出した。それぞれ、5μg/mlおよび2.5μg/mlのヤギ抗ヒトκ−PEまたはヤギ抗ヒトγ−Cy5コンジュゲート(どちらもJackson Immune Researchから購入した)の両方を用いて、結合した抗体を検出することによって、FACS分析によって陽性株を確認した。染色された各色素に関して、陽性および陰性細胞の間の幾何平均値の比を表にした。1.95より高い比をヒットと見なした。各融合由来のヒトγおよびκ特異的ヒットの数を表3に列挙する。
【0181】
表3.FACS分析によって確認されるような、細胞に結合したhu−uPARに結合した抗体の数
【0182】
【表3】

【0183】
実施例4
競合的結合
[0203]このアッセイにおいて、FACS分析によって、抗体が、細胞に結合したuPARへのヒトuPAの結合を阻害する能力を試験した。簡潔には、ネズミ線維芽細胞L929細胞(ATCC)をトランスフェクションして、ヒトuPARを発現させた。99%生存率のトランスフェクタントを、1:2希釈の上清と、4℃で一晩インキュベーションした。洗浄後、細胞を500ng/ml FITC標識tc−uPA(Molecular Systemsから購入)と1時間インキュベーションした。ビオチンとコンジュゲート化されたウサギ抗FITC(2.5μg/ml、Molecular Probesから購入)を用いて、結合したFITC−uPAを検出した。シグナルを増幅するため、三次検出試薬、ストレプトアビジン(strapavidin)−Cy5コンジュゲート(SA−Cy5、2.5μg/ml、Jackson Immune Researchから購入)を使用した。モノクローナル抗ヒトuPAR抗体MAB807(R&D Systems、受容体−リガンド結合を中和)を陽性対照試薬として用いた。
【0184】
[0204]ハイブリドーマ株由来の総数433の上清(結合剤)を試験し、そして50%の阻害を陽性と見なした。各融合由来の陽性株(中和剤)を表4に要約する。4回の融合の中で、uPAのuPARへの結合を阻害可能な総数102の株がある。
【0185】
表4.uPA/uPAR結合を阻害したAbの数
【0186】
【表4】

【0187】
実施例5
非ヒト霊長類に対する交差反応性
[0205]カニクイザル由来のuPARをクローニングし、そしてCHOK1細胞表面上で発現させた。このアッセイにおいて、FACS分析によって、細胞に結合したカニクイザルuPARへの抗体の結合(親細胞を陰性対照とする)を試験した。ネズミ抗ヒトuPAR抗体MAB807(R&D Systems)を陽性対照試薬として使用した。簡潔には、99%生存率のCHOK1/cyno−uPARトランスフェクタントを、1:2希釈の上清と、4℃でインキュベーションした。どちらもJackson Immune Researchから購入した、ヤギ抗ヒトγ鎖Cy5コンジュゲート(5μg/ml)および抗ヒトκ鎖PEコンジュゲート(2.5μg/ml)両方を用いて、結合したヒト抗体を検出した。染色された各色素に関して、陽性および陰性細胞の間の幾何平均値の比を見いだした。1.95より高い比をヒットと見なした。uPA/uPAR結合に阻害活性を示した株(中和剤)のみをこのアッセイに供した。表5に要約するように、試験した102株のうち90が、CHOK1細胞表面上に発現されるcyno−uPARに結合する能力を示した。以下の実施例12に示すように、30の候補をクローニングし、そして精製した後、カニクイザルuPARに対する交差反応性が確認された。
【0188】
表5.カニクイザルuPARを発現している細胞に結合した抗体の数
【0189】
【表5】

【0190】
実施例6
動力学的アッセイ
高抗原(HA)定量化(ELISA)
[0206]以下に記載する限定抗原定量化アッセイと比較して、より多量のuPARで、ELISAプレートをコーティングした(4.2μg/ml)。抗体(Ab)を含有する試料を、uPARでコーティングしたELISAプレート上で力価決定し、そして一晩インキュベーションして、適切な平衡までAb結合を可能にした。試料中のAbの力価決定は、1:200〜1:19,531の希釈範囲を含んだ。既知の濃度のuPAR特異的抗体の標準曲線を用いて、アッセイの直線範囲を定義した。直線範囲内のデータを用いて、各力価決定試料中のuPAR特異的Abの相対的濃度を得た。高uPAR濃度および一晩インキュベーションは、Abアフィニティーの効果を限定し、各試料中に存在するuPAR特異的Abの相対量の定量化を可能にした。
【0191】
限定抗原(LA)定量化(ELISA)
[0207]以下に記載する高抗原定量化アッセイと比較して、より少量のuPARで、ELISAプレートをコーティングした(320、160、80、40および20ng/ml)。抗体(Ab)(1:25希釈)の1つの濃度を含有する試料を一晩インキュベーションして、Ab結合が平衡に近づくのを可能にした。低抗原濃度は、抗体濃度の効果を限定し、相対的アフィニティーに基づいた、抗体のランキングを可能にした。
【0192】
[0208]HA/LA動力学アッセイによって、uPA/uPAR結合を阻害する能力を有する102株(中和剤)を試験した。uPA/uPAR結合阻害およびFACSに基づく結合の有効性と組み合わせて、結果を分析した。表6は、望ましい中和活性および好ましい結合動力学を有する30のハイブリドーマ株に関する結果を要約する。
【0193】
実施例7
特異性研究
[0209]uPARに最も近い相同体は、ヒトLy6eである(約36%類似性)。この研究では、Ly6eに交差反応したすべての抗体を同定し、そして排除した。
【0194】
[0210]標準的プロトコルにしたがって、ヒトLy6e(Genbank寄託番号BC119709)をクローニングし、そしてHEK293T細胞中で発現させた。適切な検出抗体を欠いているため、Ly6eに融合しているmycタグを探査し(probing)、それとともに、同じ抗myc抗体を用いたウェスタンブロット上で、発現されたタンパク質の分子サイズが正しいことを立証することによって、Ly6eの発現が信頼できることを確認した。
【0195】
[0211]1:2ハイブリドーマ上清を用いたFACS分析によって、Ly6eを発現するようにトランスフェクションされたHEK293Tに対する抗体の反応性を決定し、そしてCy5とコンジュゲート化されたヤギ抗ヒトγ鎖(2.5mg/ml、Jackson Immune Research)で探査した。トランスフェクタントへの抗myc抗体(10μg/ml、Invitrogen)の結合が、陽性対照として働き、そして(Ly6e陰性)親細胞へのこの抗体の結合が、陰性対照として働いた。1.95の陽性対陰性の幾何平均比を閾値として用いた。1.95を超える読み取り値を結合剤と見なした。その結果、102の中和剤の中で、4.67および4.50株のみが、Ly6e発現細胞に結合することが見いだされた。他のものは、Ly6eに交差反応性を持たなかった。表6は、クローニングのために選択された30株の特性を要約する。
【0196】
表6.細胞クローニング用の30株の選択に関する要約
【0197】
【表6】

【0198】
[0212]一次および二次スクリーニングアッセイを通じて、表6に要約するような、細胞に結合したヒトuPAR、uPA/uPAR結合の阻害、および動力学ランキングに基づいて、総数30のハイブリドーマ株を同定した。この中で、2つの株は、細胞表面上のcyno−uPARに結合しなかった。抗体はいずれも、ネズミuPARと反応せず、そして選択した株のいずれも、uPARに最も近い相同体であるLy6eと反応しなかった。
【0199】
[0213]これらの30株をクローニングし、そして以下に記載するように、さらに性質決定した。
実施例8
プラスミノーゲン活性化アッセイ
[0214]uPARを発現することが知られるヒト組織細胞(histocytic)リンパ腫細胞株U937(ATCC)をこのアッセイに使用した。細胞表面uPARに結合した際、一本鎖ウロキナーゼ型プラスミノーゲン活性化因子(scuPA)は活性化されてuPAになることが可能であり、そしてプラスミノーゲンをプラスミンに切断することが可能である。後者は、D−Val−Leu−Lys 7−アミド−4−メチルクマリン(VLK−AMC、Sigmaカタログ番号V3138)を切断して、そして蛍光AMC色素を放出する。したがって、アッセイ系中の蛍光単位の強度は、細胞表面uPARに結合したuPAの量の指標となる。uPARに対する中和mAbは、scuPAの結合を阻害し、そしてしたがって、蛍光を抑制すると期待された。
【0200】
[0215]U937細胞を維持し、そして5%CO2、37℃で、1.5g/l重炭酸ナトリウム、4.5g/lグルコース、10mM HEPES、1.0mMピルビン酸ナトリウム、および10%FBSを含有するように調整された、2mM L−グルタミンを含むRPMI 1640培地中で増殖させた。アッセイを実行するため、U937細胞を60,000細胞/ウェルの密度でV底プレート内に植え付け、そして1,500rpmで3分間細胞を回転させて落とすことによって、冷反応緩衝液(0.05M Tris.HCl、0.1M NaCl、pH=7.4、2%BSAを含む)で洗浄した。再懸濁後、示す最終濃度で、氷上で1時間、細胞をmAbで処理した。処理した細胞懸濁物を、3nMの最終濃度のscuPAでスパイク処理した。細胞懸濁物を、氷上で1時間インキュベーションした後、冷反応緩衝液で洗浄した。50μlの1μM Glu−プラスミノーゲンおよび400μM VLK−AMC基質を細胞懸濁物に添加して、その体積を200μlに調整した。Tecan読み取り装置での蛍光測定のため、混合物をFMATプレートに移した。
【0201】
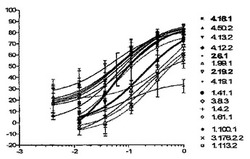
[0216]30のmAbをプラスミノーゲン活性化アッセイにおいて、まず試験した。次いで、他のものより高いプラスミノーゲン活性化阻害活性を持つ15の候補を、さらなる試験のために選択した。図1に示すように、多様な濃度で阻害活性を試験することによって、15の選択したmAbに関する用量−反応関係曲線を生成した。各mAb濃度に関して、3つ組で試験を行った。各mAbに関する定量的指標、IC50を、表11に含める。
【0202】
[0217]抗体4.19.1および1.41.1に関する曲線の間に、明らかなギャップがあることが注目された。ギャップの左側の曲線(8つのmAb、すなわち、4.18.1、4.50.2、4.13.2、4.12.2、2.6.1、1.99.1、2.19.2、および4.19.1を含む)は、より高い有効性および強度を有した。これらは、1μg/ml程度の低い濃度で、90%を超えて、プラスミノーゲン活性化を阻害した。したがって、これらの8つのmAbを、さらなる性質決定のために選択した。
【0203】
実施例9
接着アッセイ
[0218]96ウェル・マイクロタイタープレートを、リン酸ナトリウム(pH9)中、ビトロネクチン(5μg/ml)で、4℃で一晩コーティングした。次いで、プレートを3%BSAで、室温で少なくとも1時間ブロッキングした。2.5mlの50mMグリシン−HClおよび100mM NaCl(pH3.0)を用いて、U937細胞を氷上で3分間、酸ストリッピングした。次いで、0.5mlの500mM HEPESおよび100mM NaCl(pH7.0)によって、酸性細胞懸濁物を中和した。
【0204】
[0219]次いで、あらかじめ温めた血清不含培地で2回、そして1%BSAを含有しそしてMn2+を含まないHBBSで再び2回、細胞を洗浄した後、最終的に、180,000細胞/100μlでHBBS中に再懸濁した。次いで、酸ストリッピングした細胞を、10μg/mlのあらかじめ選択したmAbと、4℃で1時間インキュベーションした。続いて、細胞を25nM scuPAでスパイク処理した。
【0205】
[0220]50μlの細胞およびそのあらかじめ選択したmAbを、マイクロタイタープレート中のビトロネクチンをコーティングした各ウェルに添加した。37℃で40分間、細胞をプレートに接着させた。温HBSSを用いて、結合していない細胞を洗い落とした。プレートを−80℃で1時間置くことによって、結合した細胞を凍結した。次いで、細胞を室温で融解した。100mlのCyQuant色素/溶解緩衝液を各ウェルに添加し、そして485nm励起および530nm発光で、蛍光を読み取った。
【0206】
[0221]実施例8由来の15の選択したmAbを、最初は2μg/mlで、接着アッセイに供した。接着を阻害した8つのmAbが見いだされた際、図2に例示するように、これらに関する用量−反応関係曲線を3つ組で得た。残った7つのmAbは、明示する実験条件下で、明らかな阻害効果を示さなかった。
【0207】
[0222]ヒト・アイソタイプIgGまたはヤギIgG対照のいずれも、ビトロネクチンへのU937の接着を阻害しなかった。既知の中和剤であるヤギ抗uPAR(黒い太い点線、図2)と同様、これらの阻害性の8つのmAbは、用量依存方式で、ビトロネクチンへの細胞接着を阻害した。グラフ中の曲線の最も左側のグループは、mAb 4.18.1、2.6.1、2.19.2、および4.50.2で構成される。アッセイ中で試験した最大mAb濃度は、2μg/mlであった。この濃度で、少なくともmAb 2.19.2および2.6.1は、90%阻害に到達し、そしてmAb 4.18.1は、uPARが仲介するビトロネクチンへの細胞接着の90%阻害に近づく。この実験を3回繰り返し、同様の結果を得た。
【0208】
[0223]抗体の他の特徴に対する抗接着活性の相関を表11に要約する。
実施例10
浸潤アッセイ
[0224]MatrigelTM(BD Bioscienceカタログ番号356237、ロット番号007024−7.7mg/ml)を4℃の冷蔵庫中、氷上で一晩、解凍した。孔サイズ8μmのBD 24ウェルTranswellプレート中の各ウェルに、80μlのゲルを添加し、そして細胞接着前に、37℃で90分間インキュベーションした。細胞解離溶液(Sigma)を用いて、DMEM(0.2%FCS)培地中、1x105細胞/mlで、HT−1080細胞を再懸濁した。100μl(1x104細胞)の細胞懸濁物を無菌エッペンドルフ試験管にアリコットし、そしてときどき混合しながら、0.1、1.0、および10μg/mlの最終濃度のmAbと、37℃で1時間プレインキュベーションした。未処理対照試料もまた、ときどき混合しながら、37℃で1時間プレインキュベーションした。
【0209】
[0225]0.1、1.0、および10μg/mlのmAbを補充した750μlのDMEM(10%FCS)培地を、下部トランスウェル・チャンバーの適切なウェルに添加した。750μlのDMEM(10%FCS)培地を、対照試料の下部チャンバーに添加した。固形化MatrigelTMを含有する上部チャンバーを下部トランスウェル・チャンバー内に挿入し、そして100μl(1x104細胞)のプレインキュベーション細胞懸濁物を、適切なウェルの上部チャンバーにアリコットし、そしてチャンバーを37℃で3日間インキュベーションした。−20℃メタノール中に室温で20分間浸すことによって、トランスウェルを固定した。Hoechst 33342(Sigmaカタログ番号B2261)(10μM)で染色する前に、トランスウェルをPBSで2回洗浄した。染色後、ウェルをPBSで2回洗浄した。20x対物レンズを用いて、MatrigelTM最上部の細胞およびMatrigelTMに浸潤した細胞の20μmの連続切片の光学的イメージを得た。Image−ProPlus(Media Cybernetics、メリーランド州ベセスダ)画像分析ソフトウェアパッケージを使用して、各切片での細胞数を計算した。各試料に関して、すべての切片中に存在する、明記した距離(60〜200μm)を超えて浸潤した細胞のパーセント数としてデータを提示した。
【0210】
[0226]実施例8由来の15のmAbを、アイソタイプ対照(IgG2に関してはPK16.3.1、IgG4に関しては108.2.1)とともに、0.1、1.0、および10μg/mlのmAb濃度でアッセイに使用した。60μmの距離を超えて浸潤した細胞数を、「IgG2およびIgG4アイソタイプ対照を超えた倍変化」に基準化した。図3中の3つのパネルは、上から下に、それぞれ、0.1、1.0、および10μg/mlのmAb濃度で収集したデータに相当する。試験した大部分のmAbは、細胞浸潤を阻害することが見いだされた。抗体2.19.1、2.6.1および4.18.1は、最適な有効性および強度を有した。10μg/mlの濃度で、mAb 2.19.1は、60μmの距離を超えた浸潤を完全に阻害し、そしてmAb 2.6.1および4.18.1はどちらも90%阻害を達成した。続いて、2.6.1、2.19.2および4.18.1の分析を0.1〜100ng/mlの濃度範囲に渡って行い、そして80μMの深さでMatrigelTMに浸潤した細胞の数によって浸潤を決定した。図5に示すように、100ng/mlの濃度のmAb 2.6.1、2.19.2および4.18.1は、80μmまでの細胞移動を有意に阻害する(>70%阻害)ことが見いだされた。
【0211】
実施例11
低および高解像度BIACORETMを用いたアフィニティーの決定
低解像度BiacoreTM
[0227]低解像度BiacoreTM試験のため、アフィニティー決定に関して、31のハイブリドーマ細胞株産物またはハイブリドーマ上清のセレクションを試験した。ルーチンのアミンカップリングを用いて、CM5 BiacoreTMチップ上の高密度ヤギ抗ヒト抗体表面を調製した。100μg/ml BSAを含有するHBS−P泳動緩衝液(10mM HEPES[pH7.4]、150nM NaCl、0.005%サーファクタントP20)中、すべてのmAbをおよそ6μg/mlに希釈した。10μl/分で30秒間の接触時間を用い、その後、mAbベースラインの安定化のため、100μl/分の流速で5分間の洗浄を行って、各mAbを別個のフローセル上で捕捉した。次に、hu−uPAR(R&D Systems、ロットALH01402A)を、全表面に312nM(23℃)で90秒間注入した後、5分間解離させた(100μl/分の流速)。4分間のhu−uPAR注入(312nM、50μl/分の流速)で、4つのmAbを再分析した。泳動緩衝液中ですべての抗原試料を調製した。全捕捉/注入サイクル後に、146mMリン酸(pH1.5)を15秒間1回パルス処理して、表面を再生した。
【0212】
[0228]各サイクルに関して、各抗原注入前の緩衝液注入のベースラインドリフトを減じた。
[0229]CLAMP(David G. MyszkaおよびThomas Morton(1998)“CLAMP(c): a biosensor kinetic data analysis program,” TIBS 23, 149−150)を用いて、1:1相互作用モデルにデータを広範囲で適合させて、結合動力学を決定した。データを適合させる際に、物質移動係数を用いた。動力学分析結果を表7aに列挙する。分析中に用いたmAb上清もまた示す。高アフィニティーから低アフィニティーにmAbをランキングする。
【0213】
表7a.低解像度BiacoreTMから得た、ハイブリドーマ株に関するアフィニティー決定結果
【0214】
【表7−1】

【0215】
[0230]大部分のAbは、1:1モデルに非常によく適合する。mAb 3.133および3.167の解離速度(off−rate)データは、ある程度の複雑さを示したが、動力学的パラメータは、許容されうる概算値である。mAb 1.163の分析において、会合速度(association rate)が緩慢である(103M−1s−1の桁)ため、注入時間をより長い4分間にしてもなお、有意な曲率は生じなかった。
【0216】
高解像度BiacoreTM
[0231]大部分のmAbが1:1モデルに非常によく適合したことを考慮すると、株産物低解像度BiacoreTMから得たアフィニティーランキングは、信頼性があると考えられた。3つのクローニングおよび精製mAbの高解像度BiacoreTMを用いたKd決定を、別個の実験で行った。
【0217】
[0232]3つの精製mAb各々(2.19.2、2.6.1および4.18.1)を、CM5 BiacoreTMチップの異なるフローセル表面上にアミンカップリングし、そしてヒトuPARへの結合アフィニティーに関して試験した。固定のため、すべてのmAbを、10mM酢酸ナトリウム、pH4.0中に希釈した。すべての実験に関して、泳動緩衝液および試料調製緩衝液は、100μg/ml BSAを含有する脱気HBS−P(10mM HEPES[pH7.4]、150nM NaCl、0.005%サーファクタントP20)であった。100μl/分の流速、23℃で、すべての実験を行った。二重参照のため、いくつかの緩衝液注入を分散させて、連続希釈(2倍)uPAR試料を3つ組で90秒間、ランダムに注入した。すべての高解像度実験に、BiacoreTM 2000バイオセンサー装置を用いた。物質移動期間を含めて、1:1相互作用モデルにデータを広範囲で適合させた。生じたKD値を表7bに要約する。
【0218】
表7b.高解像度BiacoreTMから得た、クローニングおよび精製mAbに関するアフィニティー決定結果
【0219】
【表7−2】

【0220】
[0233]抗体2.19.2、2.6.1、および4.18.1のKd値は、それぞれ、175pM、249pM、および446pMであった。高解像度BiacoreTMでの各抗体のKdランキングは、低解像度BiacoreTMで得たものと一致した。
【0221】
実施例12
マウスおよびサルuPARに対する交差反応性
[0234]マウス交差反応性を決定するため、過剰な可溶性マウスuPARを用いた競合アッセイにおいて、U937細胞表面上に発現されたヒトuPARへのmAb結合を検出した。アッセイ中、uPARを発現している細胞にmAbを曝露する前に、過剰量の組換えマウスuPARをmAbとプレインキュベーションした。mAbがマウスuPARと交差反応する場合、プレインキュベーションはmAbをマスキングし、したがって、mAbはヒトuPARに結合しないであろう。
【0222】
[0235]マウスuPAR/ヒトIgG Fcキメラ(uPARHuIgG)(R&D Systems、カタログ番号531−PA−100)をマウスuPARとして用いた。1μg/ml、50μlの各mAbを、等体積のマウスuPARHuIgG 40μg/mlと混合した。mAbおよびマウスuPARの最終濃度は、それぞれ500ng/mlおよび20μg/mlであった(Mo−uPARHuIgのおよその分子量は66〜90Kdである)。混合物は、FACS緩衝液(1%BSAおよび0.05% NaN3を補充したPBS)中であり、そしてこれを30分間インキュベーションした。続いて、20,000のU397細胞を混合物に添加し、氷上でさらに30分間インキュベーションした。インキュベーション終了時、FACS緩衝液を用いて5回洗浄することによって、結合していないmAbを徹底的に除去した。FACSCaliburフローサイトメーター(BD Biosciences、カリフォルニア州サンノゼ)を用いて、Cy5(Cy5−ビス−OSU、N,N’−ビスカルボキシペンチル−5,5’−ジスルホナトインドジカルボシアニン、Amersham Life Science、カタログ番号PA15000)−標識ヤギ抗Hu IgG Fc(5.0μg/ml)および7AAD(5.0μg/ml)で、結合したmAbを検出した。
【0223】
[0236]過剰量の可溶性組換えマウスuPARが、細胞に結合したヒトuPARへのいかなるmAbの結合も遮断せず(データ未提示)、mAbがいずれもマウスuPARに交差反応しなかったことが示されることが、結果によって示された。マウス交差反応性結果を決定的にするため、FACS分析を用いて、細胞に結合したマウスuPARへのmAbの直接結合を測定した。結合組織由来のマウス細胞株、NCTC L929をFACS分析に使用した。FACS緩衝液を用いて、採取した細胞を50,000細胞/ウェルに再懸濁して、V底プレート内に入れて、氷上においた。6.25μg/mlの最終濃度のuPAR mAbをウェルに添加し、そして氷上で1時間インキュベーションした。洗浄後、5μg/mlのCy5標識ヤギ抗ヒトIgG Fcおよび5μg/mlの7AADを添加した。混合物を氷上で15分間インキュベーションし、洗浄し、そしてFACS分析のため、冷FACS緩衝液中に再懸濁した。
【0224】
[0237]表8は、FACS結果を要約する。マウス抗原と交差反応するラット抗uPARは大きなシフトを生じ、幾何平均は248.07であった。対照的に、検出のための二次抗体を伴う、マウス抗uPAR mAb(マウス抗原に対する反応性を欠く)、ラット、マウスおよびヒト由来のアイソタイプ対照に関する幾何平均値は、3.14〜13.07の範囲であった。完全ヒトuPAR mAbはすべて、9〜12の間の幾何平均を示し、これは、上記の陰性対照でみられるバックグラウンドに匹敵した。したがって、mAbはいずれも、細胞表面マウスuPARには結合しないと結論づけられた。
【0225】
表8.FACS分析結果の要約
【0226】
【表8】

【0227】
[0238]クローニング前に、30の選択したハイブリドーマ株のうち2つ(3.133および3.167)は、サルuPARに対する交差反応性を欠くことが示された。クローニング後、FACS分析を用いて、293T細胞表面上に組換え的に発現されたサルuPARに対する交差反応性を確認した。FACS分析結果を図4に要約する。
【0228】
[0239]陰性対照抗体に比較して、抗uPAR mAbはすべて、細胞に結合したサルuPARに結合したが、幾何平均値は、非常に多様であった。弱い結合剤には、mAb 1.159.1、1.163.1、3.14.1およびmAb 1.100.1が含まれた。mAb 2.19.2、2.6.1、および4.18.1は、サル抗原に非常に強く交差反応することが見いだされた(図4)。
【0229】
実施例13
カニクイザル・アフィニティー
[0240]KinExA(登録商標)法を用いて、いくつかの抗体の動力学的測定を評価した。この方法は、平衡時の正式なアフィニティー測定の、溶液に基づく測定を伴う。R&D Systemsから購入した組換えヒトuPAR(アミノ酸1〜303)を、NHS−Sepharoseビーズにカップリングした。1M Tris中の10mg/ml BSAで、ビーズ上の残った活性基をブロッキングし、そして製造者に推奨されるように、ブロッキング溶液中に保存した。ヒトuPARとカップリングしているビーズが固相として働く、自動化フローイムノアッセイ系KinExA 3000を用いて、KinExA実験を実行した。
【0230】
[0241]配列番号81として示すヌクレオチド配列は、C末端にインフレームHisタグを持つカニクイザル・タンパク質の細胞外ドメイン(ECD)をコードする(配列番号82)。製造者の推奨にしたがって、タンパク質産生のFreestyle発現系(Invitrogen)を用いて、HEK293細胞において、このヌクレオチド配列を含有する発現ベクターを一過性にトランスフェクションすることによって、カニクイザルuPARを産生した。この一過性トランスフェクション由来の馴化培地を、上述のようなアフィニティー決定に用いた。
【0231】
[0242]簡潔には、一定量の2.6.1または2.19.2抗uPAR抗体(5nMまたは500pM)を、およそ625nMから始まる組換えカニクイザルuPAR ECDを含有する馴化培地の力価決定濃度と、インキュベーションした。抗原/抗体複合体を、室温で48時間〜168時間インキュベーションして、平衡に到達するのを可能にした。ヒトuPARカップリングビーズを用いて混合物を引きつけて、結合していない抗体を集積させた。試料緩衝液中、Cy5コンジュゲート化ヤギ抗ヒトIgG重鎖および軽鎖特異的二次抗体を含有する溶液を用いて、捕捉された抗体を検出した。結合したシグナルを、hIL−13の非存在下での対照の比率として、相対値に変換した。すべての平衡実験に関して、各試料の3つの複製物を測定した。結果を以下の表9に要約する。KinExAソフトウェア内に含有される、未知のリガンド濃度での1部位均質結合モデルを用いたデータの非線形回帰分析から、平衡解離定数(KD)を得た。該ソフトウェアは、KDを計算し、そして理論的KD曲線にデータ点を適合させることによって、95%信頼区間を決定する。95%信頼区間は、KD低およびKD高として提供される。
【0232】
表9.カニクイザル結合活性に関するKinExA結果の要約
【0233】
【表9】

【0234】
実施例14
内在化アッセイ
[0243]U937細胞を用いたuPAR内在化を誘導する能力に関して、実施例8由来の8つのmAbを試験した。100,000細胞を含有する細胞懸濁物を、2つ組で、V底プレートの各ウェル内にピペッティングした。2つのV底プレートを用意し、一方は抗体複合体での内在化の間、37℃で維持し、そしてもう一方は4℃でインキュベーションした。8つのuPAR mAbの各々を、5μg/mlで、氷上でU937細胞と15分間インキュベーションした。氷上でのインキュベーションは、一次mAbの内在化を防止するために必要であった。次いで、細胞を冷FACS緩衝液で洗浄した。続いて、冷FACS緩衝液中、5μg/mlのalexa647標識ヤギ抗ヒトF(ab)(Invitrogenカタログ番号A21249)100μl中、細胞を氷上で15分間インキュベーションした。これによって、いかなる内在化も許さずに、結合したuPAR mAbにヤギFABが結合することが可能になった。氷上で15分間インキュベーションした後、1つのプレートを氷上に維持し、一方、他方のプレートを37℃で1時間インキュベーションした。
【0235】
[0244]mAb−FAB複合体と1時間インキュベーションした後、細胞を冷5%FACS緩衝液で2回洗浄し、そしてストリッピング剤として200μlのTris(2−カルボキシエチル)ホスフィンHCl(TCEP)を各ウェルに添加した。プレートをどちらもTCEPと氷上で1時間インキュベーションした後、洗浄し、そしてFACS緩衝液に再懸濁した。4μlの7−アミノ−アクチノマイシンD(7AAD)を各ウェルに添加した後、氷上で10分間インキュベーションし、その後、FACS分析を行った。
【0236】
[0245]以下の等式を用いて、内在化の割合を計算した:
[0246][(37ストリップ−4ストリップ)/(4ストリップなし−4ストリップ)]x100
[0247]式中、「37ストリップ」は、TCEPを用いた、37℃での幾何平均であり;
「4ストリップ」は、TCEPを用いた、氷上での幾何平均であり;
「4ストリップなし」は、TCEPを用いない、氷上での幾何平均である(表10を参照されたい)。
【0237】
表10.内在化アッセイの要約
【0238】
【表10】

【0239】
[0248]表10に要約するように、37℃で1時間インキュベーションした後、あるとしても、非常にわずかな内在化しか検出されなかった。実験を2回反復して、類似の結果を得た。
【0240】
[0249]表11は、実施例8由来の15の候補のin vitro性質決定の結果を要約する。
表11. 15のuPAR mAbのin vitro性質決定アッセイ結果の要約
【0241】
【表11】

【0242】
*括弧内の数字は、各カテゴリーに関するランクキング順を示す。
実施例15
uPAR抗体の構造分析
[0250]抗体の可変重鎖および可変軽鎖を配列決定して、DNA配列を決定した。各ガンマおよびカッパ鎖の組み合わせに関して、ヌクレオチドおよびアミノ酸配列を含めて、配列表に、抗uPAR抗体の完全配列情報を提供する。可変重鎖配列を分析して、VHファミリー、D領域配列およびJ領域配列を決定した。次いで、配列を翻訳して、一次アミノ酸配列を決定し、そして生殖系列VH、DおよびJ領域配列に比較して、体細胞超変異を評価した。
【0243】
[0251]表18は、同族(cognate)生殖系列重鎖領域に、抗体重鎖領域を比較する表である。表19は、同族生殖系列軽鎖領域に、抗体カッパ軽鎖領域を比較する表である。
【0244】
[0252]免疫グロブリン鎖の可変(V)領域は、多数の生殖系列DNAセグメントにコードされ、B細胞個体発生中に、これらが連結されて機能性可変領域(VHDJHまたはVKJK)になる。uPARに対する抗体反応の分子多様性および遺伝的多様性を詳細に研究した。これらのアッセイによって、抗uPAR抗体に特異的ないくつかの点が明らかになった。
【0245】
[0253]各ハイブリドーマから収集したシスター・クローンの中のアミノ酸配列が同一であることを認識すべきである。例えば、mAb 2.19.3の重鎖および軽鎖配列は、mAb 2.19および2.19.1の配列と同一であろう。
【0246】
[0254]配列決定データによると、2.6.1および4.18.1の重鎖の一次構造は類似であるが、同一ではない。2.19.2は、他の2つと構造的に異なる。
[0255]特定の抗体が、アミノ酸レベルで、それぞれの生殖系列配列と異なる場合、抗体配列を生殖系列配列に突然変異させ直してもよいこともまた認識すべきである。こうした訂正突然変異は、標準的分子生物学的技術を用いて、1つ、2つ、3つまたはそれより多い位で、あるいは突然変異位のいずれかの組み合わせで、生じてもよい。限定されない例として、表19は、mAb 4.18.1の軽鎖配列(配列番号52)が、FR1領域中のSerからPheの突然変異(突然変異1)、FR1領域中のValからMetの突然変異(突然変異2)、FR2領域中のLysからThrの突然変異(突然変異3)、FR3領域中のIleからPheの突然変異(突然変異4)、およびFR3領域中のSerからIleの突然変異(突然変異5)を通じて、対応する生殖系列配列(配列番号66)と異なることを示す。したがって、mAb 4.18.1の軽鎖をコードするアミノ酸またはヌクレオチド配列を修飾して、突然変異1を変化させて、突然変異1の部位で生殖系列配列を得てもよい。さらに、mAb 4.18.1の軽鎖をコードするアミノ酸またはヌクレオチド配列を修飾して、突然変異2または突然変異3を変化させて、突然変異2または突然変異3の部位で生殖系列配列を得てもよい。さらに、mAb 4.18.1の軽鎖をコードするアミノ酸またはヌクレオチド配列を修飾して、突然変異1および突然変異2の両方、または2以上の突然変異の任意の他の組み合わせを変化させて、これらの特定の部位で生殖系列配列を得てもよい。以下の表12〜17は、mAb 2.19.2、2.6.1および4.18.1に関して、生殖系列からのこうした変動の位置を例示する。各列は、太字で示した位置の生殖系列および非生殖系列残基のユニークな組み合わせを表す。
【0247】
表12. 示した残基番号での生殖系列に対するmAb 2.19.2軽鎖(配列番号32)の典型的な突然変異
【0248】
【表12−1】

【0249】
【表12−2】

【0250】
【表12−3】

【0251】
【表12−4】

【0252】
表13. 示した残基番号での生殖系列に対するmAb 2.19.2重鎖(配列番号30)の典型的な突然変異
【0253】
【表13】

【0254】
表14. 示した残基番号での生殖系列に対するmAb 2.6.1軽鎖(配列番号28)の典型的な突然変異
【0255】
【表14】

【0256】
表15. 示した残基番号での生殖系列に対するmAb 2.6.1重鎖(配列番号26)の典型的な突然変異
【0257】
【表15−1】

【0258】
【表15−2】

【0259】
【表15−3】

【0260】
【表15−4】

【0261】
【表15−5】

【0262】
【表15−6】

【0263】
【表15−7】

【0264】
【表15−8】

【0265】
【表15−9】

【0266】
【表15−10】

【0267】
【表15−11】

【0268】
【表15−12】

【0269】
【表15−13】

【0270】
【表15−14】

【0271】
【表15−15】

【0272】
【表15−16】

【0273】
【表15−17】

【0274】
【表15−18】

【0275】
【表15−19】

【0276】
【表15−20】

【0277】
【表15−21】

【0278】
【表15−22】

【0279】
【表15−23】

【0280】
【表15−24】

【0281】
【表15−25】

【0282】
【表15−26】

【0283】
【表15−27】

【0284】
【表15−28】

【0285】
【表15−29】

【0286】
【表15−30】

【0287】
【表15−31】

【0288】
【表15−32】

【0289】
表16. 示した残基番号での生殖系列に対するmAb 4.18.1軽鎖(配列番号52)の典型的な突然変異
【0290】
【表16−1】

【0291】
【表16−2】

【0292】
【表16−3】

【0293】
【表16−4】

【0294】
【表16−5】

【0295】
【表16−6】

【0296】
【表16−7】

【0297】
【表16−8】

【0298】
表17. 示した残基番号での生殖系列に対するmAb 4.18.1重鎖(配列番号50)の典型的な突然変異
【0299】
【表17−1】

【0300】
【表17−2】

【0301】
【表17−3】

【0302】
【表17−4】

【0303】
【表17−5】

【0304】
【表17−6】

【0305】
【表17−7】

【0306】
【表17−8】

【0307】
表18.重鎖分析
【0308】
【表18−1】

【0309】
【表18−2】

【0310】
【表18−3】

【0311】
【表18−4】

【0312】
表19.軽鎖分析
【0313】
【表19−1】

【0314】
【表19−2】

【0315】
【表19−3】

【0316】
実施例16
uPAR結合エピトープの同定
[0256]抗uPAR抗体がマウスuPARと交差反応するのに失敗したため、本発明者らは、いくつかのマウスuPAR−ヒトuPARキメラタンパク質を生成して、抗体結合に関与するドメインを同定した。各々、C末端Hisタグを含む、ネズミD1/ヒトD2D3;ネズミD1/ヒトD2/ネズミD3;およびヒトD1D2/ネズミD3uPARを含むキメラ・ヒト−ネズミuPARを、HEK293T細胞中、分泌タンパク質として発現した。培養上清のウェスタンブロッティングによって、2.6.1、2.19.2、および4.18.1の結合部位を決定し;抗His mAbを用いた検出によって、適切な組換えタンパク質が発現されていることを立証した。2.19.2の結合エピトープはドメインIに存在し、そして2.6.1は、主に、ドメインII/III内のエピトープと相互作用し、そして4.18.1はドメインII中のエピトープと相互作用する(図6を参照されたい)。
【0317】
[0257]エピトープ・ビニングに用いたタンパク質をコードするヌクレオチド配列および翻訳されたアミノ酸配列を以下の表20に示す。
表20.エピトープ・ビニングに用いたヌクレオチドおよびアミノ酸配列
【0318】
【表20】

【0319】
実施例17
in vivoでの腫瘍増殖および転移の阻害
[0258]安定してGFP(MDA MB231−GFP細胞)を発現しているMDA MB231細胞を培養中で増殖させて、そして85%集密で採取した。総数5x105の腫瘍細胞を生理食塩水/20%MatrigelTM中で、雌Balb/c nu/nuマウスの乳房脂肪体内に接種した。移植3日後、マウスに以下を投与した:対照の非特異的アイソタイプ一致IgG4;ドキソルビシンRx、5mg/kg i.p.、週1回、2週間;対照または抗ヒトuPAR mAb 0.5mg/マウスi.p.、実験期間中、週1回。キャリパーを用いて、週1回、腫瘍増殖を測定し、そして公式(axb2/2)、式中、a−長径の長さであり、b−垂直小径の幅である、にしたがって腫瘍体積を計算した(図7)。未治療対照腫瘍増殖(図7には示さない)は、IgG4アイソタイプ対照に比較して、有意には異ならなかった。
【0320】
[0259]研究終了時、原発腫瘍を固定し、そしてさらなる分析のため、対照および実験動物から、肺、肝臓および脾臓を除去した。標準的免疫組織化学技術を用いて、以下のタンパク質に関して、組織切片を染色した:Ki67;CD31;MAPK;ホスホ−MAPK;FAK;ホスホ−FAK。BioQuant画像分析ソフトウェアを用いて、染色強度を測定し、そして治療群あたり6匹の動物由来のデータを記録した(図8)。
【0321】
[0260]肺、肝臓、および脾臓組織を同様に処理し、そして蛍光顕微鏡によって腫瘍細胞を同定し、そして転移数を記録した(図9)。
[0261]図7〜9に立証するように、抗uPAR抗体は、原発腫瘍増殖を阻害し、そして離れた臓器への転移発生を有意に阻害した。原発腫瘍の免疫組織化学検査は、増殖マーカーKi67に対する効果をまったく示さなかったが、対照に比較して、pMAPKおよびpFAKのレベルの一貫した阻害があった。予期せぬことに、CD31染色もまた、染色強度のある程度の減少を示したが、ネズミuPARとの抗体交差反応性が存在せず、機構は、局所腫瘍関連uPA活性の結果としての、間接的なものであると仮定しなければならない。
【0322】
実施例18
免疫組織化学
[0262]凍結細胞ペレットおよび正常ヒト組織マイクロアレイ(TriStar Technology Group)に対して、IgG4アイソタイプ対照抗体と一緒に、2.6.1、2.19.2および4.18.1の結合プロフィールを評価した。American Diagnostica Inc.のマウス抗uPAR(カタログ番号3936、ロット番号041223)が、研究における陽性対照Abであった。0〜3+のスケール(±はっきりしない染色;1+弱い染色;2+中程度の染色;3+強い染色)を用いて、目によって、染色強度を概算した。PC3ヒト前立腺癌由来の凍結細胞ペレットおよびU937ヒト組織細胞リンパ腫U937細胞ペレットを陽性対照として用い、そして膜および細胞質染色の両方を観察した(表21を参照されたい)。陰性対照抗体でバックグラウンド染色が観察された場合、染色がバックグラウンドより強く、そして/またはバックグラウンドから区別可能である場合のみ、または染色が、陰性対照抗体で染色されない試験組織内の細胞中にある場合のみ、陽性染色と報告した(以下の表23を参照されたい)。
【0323】
表21.細胞ペレット中の染色強度
【0324】
【表21】

【0325】
[0263]ヒト組織マイクロアレイの染色のため、2.6.1、2.19.2および4.18.1をビオチンでコンジュゲート化し、U937細胞への結合に関して再評価して(以下の表22を参照されたい)、そして次いで、組織マイクロアレイを染色するのに用いた。
【0326】
表22.ビオチン−コンジュゲート化mAbを用いた細胞ペレット中の染色強度
【0327】
【表22】

【0328】
[0264]組織マイクロアレイを、20μg/mlの濃度のビオチン・コンジュゲート化抗体で染色した。結果を表23に示す。示す場合、c=細胞質であり、そしてm=膜染色パターンである。
【0329】
表23.組織マイクロアレイ染色パターン
【0330】
【表23−1】

【0331】
【表23−2】

【0332】
実施例19
ヒト患者における腫瘍細胞増殖の阻害
[0265]膵臓癌と診断されたヒト癌患者群を、治療群にランダム化する。各患者群を、本明細書記載のmAb 2.6.1、2.19.2または4.18.1の毎週静脈内注射で治療する。各患者に、5mg/kg/週〜15mg/kg/週の範囲の抗体の有効量を4〜8ヶ月間、投薬する。対照群には、標準的な化学療法措置のみを与える。
【0333】
[0266]治療措置中および措置後、定期的に、磁気共鳴画像法(MRI)によって腫瘍負荷を評価する。mAb 2.6.1、2.19.2または4.18.1での毎週抗体治療を受けた患者が、抗体治療を受けなかった患者に比較して、腫瘍サイズの有意な減少、進行までの遅延、または生存延長を示すことが見いだされる。何人かの治療患者では、腫瘍はもはや検出不能である。対照的に、対照群においては、腫瘍サイズは、増加するか、または実質的に同じままである。
【0334】
実施例20
ヒト患者における腫瘍細胞増殖の阻害
[0267]甲状腺癌と診断されたヒト癌患者群を、治療群にランダム化する。各患者群を、本明細書記載のmAb 2.6.1、2.19.2または4.18.1の静脈内注射で、3週間ごとに、治療する。各患者に、5mg/kg/週〜15mg/kg/週の範囲の抗体の有効量を4〜8ヶ月間、およびゲムシタビンの有効療法用量を投薬する。対照群には、標準的な化学療法措置のみを与える。治療措置中および措置後、定期的に、磁気共鳴画像法(MRI)によって腫瘍負荷を評価する。mAb 2.6.1、2.19.2または4.18.1での3週間の抗体治療およびゲムシタビン治療を受けた患者が、抗体およびゲムシタビン治療を受けなかった患者に比較して、腫瘍サイズの有意な減少、進行までの遅延、または生存延長を示すことが見いだされる。何人かの治療患者では、腫瘍はもはや検出不能である。対照的に、対照群においては、腫瘍サイズは、増加するか、または実質的に同じままである。
【0335】
実施例21
ヒト患者における腫瘍転移の阻害
[0268]非小細胞肺癌と診断されたヒト癌患者群を、治療群にランダム化する。標準的化学療法措置に加えて、各患者群を、本明細書記載のmAb 2.6.1、2.19.2または4.18.1の静脈内注射で、毎週、治療する。各患者に、5mg/kg/週〜15mg/kg/週の範囲の抗体の有効量を2〜8ヶ月間、投薬する。対照群には、標準的な化学療法措置のみを与える。
【0336】
[0269]治療措置中および措置後、定期的に、陽電子放出断層撮影法(PET)によって転移病巣を評価する。mAb 2.6.1、2.19.2または4.18.1で毎週抗体治療を受けた患者が、抗体治療を受けなかった患者に比較して、転移病巣の数およびサイズの有意な減少を示すことが見いだされる。
【0337】
実施例22
ヒト患者におけるエストロゲン受容体陽性乳癌の治療
[0270]成人女性が、エストロゲン受容体陽性乳癌と診断される。患者を、mAb 2.19.2および抗ホルモン剤の静脈内注射で、2〜8ヶ月の期間に渡って2週間ごとに治療する。その結果、患者は、進行がない生存の延長を経験する。
【0338】
実施例23
ヒト患者におけるHER2陽性乳癌の治療
[0271]成人女性が、HER2陽性乳癌と診断される。患者を、mAb 2.19.2および抗her2剤の静脈内注射で、2〜8ヶ月の期間に渡って毎週治療する。その結果、患者は、腫瘍サイズの有意な減少を経験する。
【0339】
実施例24
ヒト患者におけるEGFR発現性肺癌の治療
[0272]成人男性が、EGFR発現性肺癌と診断される。患者を、mAb 2.19.2および受容体チロシンキナーゼ阻害剤の静脈内注射で、2〜8ヶ月の期間に渡って毎週治療する。その結果、患者は、進行までの時間の有意な遅延を経験する。
【0340】
実施例25
ヒト患者における関節炎の治療
[0273]成人女性が、重度の関節炎と診断される。患者を、mAb 2.19.2の静脈内注射で、3週間の期間に渡って2週間ごとに治療する。その結果、患者は、関節炎症状の有意な減少を経験する。
【0341】
実施例27
ヒト患者におけるアテローム性動脈硬化症の治療
[0274]成人男性が、アテローム性動脈硬化症と診断される。患者を、mAb 4.18.1の静脈内注射で、1年間の期間に渡って1週間おきに治療する。その結果、患者は、狭心症などのアテローム性動脈硬化症の症状の減少を経験する。
【0342】
援用
[0275]特許、特許出願、論文、教科書等を含む、本明細書に引用するすべての参考文献、および該文献に引用される参考文献は、すでにそうでない度合いまで、その全体が本明細書に援用される。
【0343】
同等物
[0276]前述の記載した明細書は、当業者が本発明を実施可能となるのに十分であると見なされる。前述の説明および実施例は、本発明の特定の好ましい態様を詳述し、そして発明者らが意図する最適の様式を記載する。しかし、前述の記述がテキスト中でいかに詳細であるかに関わらず、本発明を多くの方式で実施してもよく、そして本発明は付随する請求項およびその任意の同等物にしたがって解釈されるべきであることが認識されるであろう。
【図面の簡単な説明】
【0344】
【図1】[0070]図1は、プラスミノーゲン活性化阻害アッセイにおける、15の抗uPARモノクローナル抗体の阻害効果を示す線グラフである。各mAbに関する用量−反応関係曲線を例示する。最高の有効性および強度を示す8つの抗体を垂直のブラケットによって示す。太字のレジェンドは、最強の阻害を示した抗体を示す。Log[mAb](μg/ml)の単位を持つ抗体濃度の関数として、阻害パーセント(「阻害%」)を示す。
【図2】[0071]図2は、uPAR mAbが、ビトロネクチンへのU937細胞の接着を阻害する能力を示す線グラフである。8つのmAb、ならびにヒトおよびヤギ・アイソタイプ陰性対照およびヤギ抗uPAR陽性対照に関する用量−反応関係曲線を示す。Log[mAb](ng/ml)の単位を持つ抗体濃度の関数として、阻害パーセント(「阻害%」)を示す。
【図3】[0072]図3は、MatrigelTM膜調製物へのHT−1080浸潤に対するuPAR mAbの阻害効果を示す。0.1μg/ml(上部グラフ)、1.0μg/ml)(中央部グラフ)、および10μg/ml(下部グラフ)の濃度の抗体を試験した。アイソタイプ対照に対して、処理によって60マイクロメートル(μm)を超えてMatrigelTMに浸潤した細胞数の比をプロットする。
【図4】[0073]図4は、293T細胞表面上に発現されるサル(カニクイザル)uPARへの抗uPARモノクローナル抗体の結合を示す棒グラフである。ヒストグラフ(histograph)ピークシフトのFACS分析から得られる幾何平均値をプロットする。
【図5】[0074]図5は、腫瘍細胞浸潤に対する抗uPAR mAbの効果を示す棒グラフである。0.1〜100ng/mlの範囲の濃度の各抗体に関して、80マイクロメートル(μM)を超えてMatrigelTMに浸潤したHT−1080細胞の割合を示す。
【図6】[0075]図6は、ウェスタンブロッティングによる、抗ヒトuPAR mAbのエピトープ結合分析の結果を示す。ヒト−ネズミuPARキメラ(Hisタグ化)をHEK293T細胞中で発現させ、そして示すような抗ヒトuPAR mAbを用いて、uPAR発現を検出した。レーン1−ネズミDI/DIII−ヒトDII;レーン2−ネズミDI/DII−ヒトDIII;レーン3−ネズミDI−ヒトDII/DIII;レーン4−ヒトDI/DII−ネズミDIII;レーン5−ヒトuPAR。
【図7】[0076]図7は、MDA−MB231−GFP正所性異種移植片の固形腫瘍増殖に対する抗uPAR mAbの効果を示す線グラフである。試験した各抗体に関して、そしてIgG4アイソタイプおよびドキソルビシン対照に関して、移植後の時点(移植後の週数)の平均腫瘍体積(cm3)を示す。未治療対照腫瘍増殖(未提示)は、IgG4アイソタイプ対照と有意には異ならなかった。
【図8】[0077]図8A〜Fは、MDA−MB231−GFP正所性異種移植片の原発性腫瘍中で測定される、腫瘍バイオマーカー発現に対する抗uPARモノクローナル抗体の活性を示す棒グラフである。データは、治療群あたり6匹の動物の腫瘍から測定した、染色強度(密度)の平均+/−標準偏差を表す;ki−67(図8a)、CD31(図8b)、MAPK(図8c)、pMAPK(図8d)、FAK(図8e)、pFAK(図8f)、未治療、ドキソルビシンおよびIgG4対照を含む。
【図9】[0078]図9A〜Bは、MDA−MB231−GFP正所性異種移植片を持つマウスにおいて、抗uPAR mAbが転移を阻害する活性を表す棒グラフである。データは、示すような治療群あたり6匹の動物由来の、肺(図9A)または肝臓(図9B)由来の組織切片における10の視野中の腫瘍病巣数の平均+/−標準偏差を表す。
【技術分野】
【0001】
関連出願に対するクロスリファレンス
[0001]本出願は、35U.S.C.§119のもとに、2006年4月10日出願の米国仮出願第60/790,642号に優先権を請求し、該出願は、その全体が本明細書に援用される。
【0002】
分野
[0002]本発明は、ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR)に対する標的化結合剤およびこうした剤の使用に関する。より具体的には、本発明は、uPARに対して向けられる完全ヒト・モノクローナル抗体に関する。記載する結合剤は、uPARの活性および/または過剰産生と関連する疾患の診断法として、そして該疾患の治療に有用である。
【背景技術】
【0003】
背景
[0003]ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR、CD87)、GenBank寄託番号NP_002650は、55〜60kDaの非常にグリコシル化された313残基ポリペプチドであり、グリコホスファチジルイノシトール(GPI)−アンカーによって、細胞膜の外葉に連結されている。該タンパク質は、3つの非常に相同なドメイン、DI、DIIおよびDIIIにフォールディングされる(Huaiら, Science 311: 656−659 2006)。uPARのN末端は、ウロキナーゼ・プラスミノーゲン活性化因子(uPA)結合部位(DI)を提供する(Gardsvollら, J Biol Chem 274: 37995−38003 1999)。証拠によって、ドメイン3中の残基が、リガンド結合部位の組み立てに関与し、そしてドメイン2および3がドメイン1へのuPA結合のアフィニティーを増加させることが示唆されている(Liangら, J Biol Chem 276: 28946−28953 2001)。C末端ドメイン(DIII)はプロセシングされて、残基ser282、gly283、ala284を含むグリコホスファチジルイノシトール(GPI)−アンカーが付加される。DIおよびDIIの間のリンカー領域中(Hoyer−Hansenら, Eur J Biochem 243: 21−26 1997; Andolfoら, Thromb Hemost 88: 298−306 2002)、ならびにC末端ドメイン内の残基(Beaufortら, J Immunol 172: 5450−549 2004)のタンパク質分解的切断の結果、DIIおよびDIIIを含む膜係留型、ならびにDI−DIIIまたはDII−DIIIを含むuPARの可溶性型(suPAR)の両方が存在する。糖脂質アンカーの切断はまた、細胞表面からuPARを遊離させうる(Wilhelmら, J Cell Physiol 180: 225−235 1999)。DIを取り込んだ可溶性uPARは、ウロキナーゼに結合する能力を保持する(Higaziら, J Biol Chem 270: 17375−17380 1995)。
【0004】
[0004]uPARは、循環白血球、血管平滑筋細胞、血管新生内皮細胞、骨髄細胞、および線維芽細胞を含む、多くの種類の細胞表面上で発現される。細胞表面でのuPAR発現の上方制御、およびプラスミノーゲン活性化は、炎症、創傷修復、関節炎(Szekaneczら, J Clin Pathol 50: 314−319 1997)、アテローム性動脈硬化症(Carmelietら, Nature Genetics, 17: 439−444 1997)、血管新生、ならびに腫瘍浸潤および転移を含む、いくつかの状態に結びつけられてきている。血漿中に可溶性uPARが上昇したレベルで存在すると、結腸直腸癌の予後マーカーとなることが示されてきている(Stephensら, J Natl Cancer Inst 91: 869−874 1999)。
【0005】
[0005]不活性酵素前駆体プラスミノーゲンのセリンプロテアーゼ・プラスミンへの活性化は、線維素溶解を制御する重要な事象である。2つのプラスミノーゲン活性化因子、組織プラスミノーゲン活性化因子(tPA)およびウロキナーゼ・プラスミノーゲン活性化因子(uPA)がある。tPAは、血漿中の重要なプラスミノーゲン活性化因子であるようであるが、uPAは、uPARへの結合の結果として、細胞表面プラスミノーゲン活性化と関連する。ウロキナーゼは、非常に低い生得的酵素活性を示すか、またはまったく該活性を示さない、一本鎖酵素前駆体(scuPA)として分泌される。プラスミンによって酵素的に切断された後、scuPAは、ジスルフィド結合で連結された活性二鎖高分子量(HMV)−uPAに変換される。このHMW−uPAは、A鎖(aa 1−158)およびB鎖またはLMW−uPA(aa 159−411)で構成される。uPARとuPAの主な相互作用は、アミノ末端断片(ATF)に位置する、A鎖中のuPAの増殖因子ドメイン(GFD)aa 1−48を通じて仲介される。uPARと相互作用するuPA中の第二の部位(連結ペプチド、aa 136−143)が同定されてきている。
【0006】
[0006]uPARに関するuPAの結合アフィニティーは、約1nM(Kd)である。異なる種の間で、uPARの一次構造を比較すると、ヒトuPARは、カニクイザル(Cynomolgus monkey)(マカカ・ファシキュラリス(Macaca fascicularis))のものと95%同一であり、そしてマウス(ムス・ムスキュルス(Mus musculus))のものと60%しか同一でない。さらに、uPAおよびuPARの高アフィニティー結合は、種特異的である。種を渡る、uPARに対するuPA(例えばラットuPARへのヒトuPA)のアフィニティーは、少なくとも2桁異なる。
【0007】
[0007]uPARへのuPAの細胞表面補充は、細胞表面プラスミノーゲン活性化を制御する:scuPAは、受容体が結合している際、より効率的に活性化される(Ellisら, J Biol Chem 264: 2185−2188 1989);受容体に結合したuPAの触媒効率は、溶液相中のuPAに比較して増加する(Higaziら, J Biol Chem 270: 17375−17380 1995); PAI−1は、受容体に結合したuPAの阻害剤として、より効率的でない(Ellisら, J Biol Chem 265: 9904−9908 1990)。今度は、プラスミノーゲンが、低および高アフィニティー相互作用を通じて、細胞表面に補充され、そして細胞表面でプラスミン生成がより効率的に進行し、そしてプラスミン生成はまた、その生理学的阻害剤に、より感受性でない。腫瘍細胞表面では、プラスミノーゲン活性化によって、腫瘍進行に寄与するいくつかのプロセスが促進され、こうしたプロセスには、マトリックス−メタロプロテアーゼの活性化、細胞外マトリックスタンパク質の分解、腫瘍増殖および浸潤を駆動する増殖因子の放出および活性化が含まれる(Andreasenら, Int J Cancer 72: 1−22 1997)。
【0008】
[0008]プラスミノーゲン活性化における、よく確立された役割に加えて、より最近、ビトロネクチンの接着受容体としてのuPARの役割、uPAR、uPAおよびPAI−1を伴う複雑な相互作用が、証拠によって確立されてきている(WaltzおよびChapman, J Biol Chem 269: 14746−14750 1994; Czekayら, J Cell Biol 160: 781−791 2003; Liら, J Biol Chem 278: 29925−29932 2003)。細胞表面uPARの切断によって、in vitroで走化性があることが示されているDIIドメイン上のエピトープが曝露される(Degryseら, J Biol Chem 280: 24792−24803 2005)。インテグリン受容体との相互作用が報告されており(例えば、Weiら, J Cell Biol 168: 501−511 2005; Weiら, Mol Biol Cell 12: 2975−2986 2001)、そしてuPA結合の結果としての細胞シグナル伝達経路の活性化が立証されている(BlasiおよびCarmeliet, Nature Rev Mol Cell Biol 3: 932−943 2002に概説される)。
【0009】
[0009]uPARおよびウロキナーゼ発現の増加は、乳癌、膀胱癌、胃癌、子宮内膜癌、結腸直腸癌を含む、ある範囲のヒト癌において、腫瘍進行と相関している(Edo de BockおよびWang, Med Res Reviews 24: 13−39 2004)。uPAR遺伝子発現は、腫瘍プロモーター、増殖因子、サイトカインおよびホルモンによって、ならびにアテローム生成性リポタンパク質または低酸素症によって増加する。免疫組織化学およびin situハイブリダイゼーション研究によって、uPA/uPAR複合体が、腫瘍の浸潤縁に位置し(Pykeら, Am J Pathol 138: 1059−1067 1991)、そして腫瘍浸潤と相関することが示された。uPA、uPARまたはPAI−1各々の高発現レベルは、異なる種類の腫瘍において、劣った予後に関連づけられている(DuffyおよびDuggan, Clin Biochem 37: 541−548 2004)。
【0010】
[0010]他の研究者らは、ポリクローナル・ウロキナーゼ受容体抗体が腫瘍体積を減少させ、そしてin vivoで潜在性の腫瘍転移の存在を検出しうることを示している(RabbaniおよびGladu, Cancer Res. 62:2390−7 2002)。アデノウイルスが仲介するuPA−ATFの送達(Liら, Gene Therapy 5 1105−1113 1998; Human Gene Therapy 16: 1157−1167 2005)、uPA−ATFの安定トランスフェクション(Zhuら, DNA Cell Biol 20: 297−305 2001)、アンチセンスuPAR(Mohanら, Cancer Res 59: 3369−3373 1999)または組み合わせアンチセンスuPAR/uPA(Gondiら, Oncogene 22: 5967−5975 2003)によって、uPAR活性の遮断または喪失、ならびにin vitroの浸潤、ならびにin vivoの腫瘍増殖および浸潤の阻害が生じた。さらに、ウロキナーゼ・プラスミノーゲン活性化因子(uPA)の非受容体結合領域由来のペプチドは、腫瘍進行および血管新生を阻害し、そしてin vivoで腫瘍細胞死を誘導した(Guoら, FASEB J. 14:1400−1410 2000)。
【発明の開示】
【0011】
概要
[0011]本発明の態様は、uPARに特異的に結合し、そしてそれによってプラスミノーゲン活性化および特定のマトリックス−メタロプロテアーゼの活性化を阻害する、完全ヒト標的化結合剤に関する。標的化結合剤はまた、腫瘍細胞接着および/または浸潤、ならびに/あるいは細胞性転移も阻害する。さらに、標的化結合剤は、腫瘍増殖を減少させるのに有用である。これが達成可能な機構には、uPAのその受容体uPARへの結合を阻害するか、uPAR/uPA限局性uPA酵素活性を阻害するか、インテグリンまたはビトロネクチンなどの細胞外マトリックスタンパク質との相互作用を抑止して、それによってuPARの有効濃度を減少させることのいずれかを含むことも可能であり、そしてこれらに限定されない。
【0012】
[0012]したがって、本発明の1つの態様は、uPARに特異的に結合し、そしてuPAのuPARへの結合を阻害する、標的化結合剤である。標的化結合剤は、100μM、10μM、1μM、100nM、10nM、1nM、500pM、400pM、300pM、200pM、100pMまたは50pM未満のKdで、uPARに結合可能である。
【0013】
[0013]さらに別の態様は、uPARに結合し、そして100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い抗体濃度で、U937細胞に対するプラスミノーゲン活性化の90%より多くを阻害する、標的化結合剤である。
【0014】
[0014]さらに別の態様は、uPARに結合し、そして10μg/ml、1μg/ml、0.1μg/ml、0.08μg/ml、0.06μg/ml、0.04μg/ml、0.02μg/mlまたは0.01μg/ml未満のIC50で、U937細胞に対するプラスミノーゲン活性化を阻害する、標的化結合剤である。
【0015】
[0015]さらに別の態様は、uPARに結合し、そして100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い標的化結合剤濃度で、uPARが仲介する、ビトロネクチンへのU937細胞の細胞接着の90%より多くを阻害する、標的化結合剤である。さらに別の態様は、uPARに結合し、そして100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い標的化結合剤濃度で、uPARが仲介する、ビトロネクチンへのU937細胞の細胞接着の80%より多くを阻害する、標的化結合剤である。
【0016】
[0016]さらに別の態様は、uPARに結合し、そして1000μg/ml、100μg/ml、10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml、または100pg/ml以下程度に低い標的化結合剤濃度で、MatrigelTMへのHT−1080細胞の浸潤の90%より多くを阻害する、標的化結合剤である。
【0017】
[0017]別の態様において、標的化結合剤は、表18に示すような相補性決定領域(CDR)、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2およびCDR3配列を含む配列を含んでもよい。一般の当業者が、CDR決定を容易に達成可能であることが注目される。例えば、Kabatら, Sequences of Proteins of Immunological Interest, 第5版, NIH Publication 91−3242, メリーランド州ベセスダ(1991), 第1−3巻を参照されたい。
【0018】
[0018]別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0019】
[0019]別の態様において、標的化結合剤は、表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すようなCDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0020】
[0020]別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)または4.18.1(ATCC寄託番号PTA−7476)のいずれかの任意の1つの、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0021】
[0021]別の態様において、標的化結合剤は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む配列を含んでもよい。別の態様において、標的化結合剤は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む配列を含んでもよい。
【0022】
[0022]別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つ、および表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含む。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ、および表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む。別の態様において、標的化結合剤は、表18に示すようなCDR1、CDR2およびCDR3配列、ならびに表19に示すようなCDR1、CDR2およびCDR3配列を含む。
【0023】
[0023]別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つ、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む配列を含む。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む。別の態様において、標的化結合剤は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列、ならびに表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む。
【0024】
[0024]別の態様において、標的化結合剤は、表18に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列を含む配列を含む。別の態様において、標的化結合剤は、表18に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列を含む配列を含む。別の態様において、標的化結合剤は、表18に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列、ならびに表19に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列を含む配列を含む。
【0025】
[0025]本発明の1つの態様において、標的化結合剤は抗体である。本発明の1つの態様において、標的化結合剤はモノクローナル抗体である。本発明の1つの態様において、標的化結合剤は完全ヒト・モノクローナル抗体である。
【0026】
[0026]別の態様において、uPARに結合し、そして表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む軽鎖アミノ酸配列を含む抗体がある。別の態様において、uPARに結合し、そして表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む軽鎖アミノ酸配列を含む抗体がある。別の態様において、uPARに結合し、そして表19に示すようなCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む抗体がある。特定の態様において、抗体は完全ヒト・モノクローナル抗体である。
【0027】
[0027]さらに別の態様は、uPARに結合し、そして表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む重鎖アミノ酸配列を含む抗体である。別の態様において、uPARに結合し、そして表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む重鎖アミノ酸配列を含む抗体がある。別の態様において、uPARに結合し、そして表18に示すようなCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列を含む抗体がある。特定の態様において、抗体は完全ヒト・モノクローナル抗体である。
【0028】
[0028]別の態様において、uPARに結合する抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含むアミノ酸配列を含んでもよい。
【0029】
[0029]別の態様において、uPARに結合する抗体は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含むアミノ酸配列を含んでもよい。別の態様において、抗体は、表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含むアミノ酸配列を含んでもよい。
【0030】
[0030]別の態様において、uPARに結合する抗体は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか1つを含む重鎖アミノ酸配列、および表19に示すようなCDR1、CDR2またはCDR3配列の1つを含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すようなCDR1、CDR2またはCDR3配列のいずれか2つを含む重鎖アミノ酸配列、および表19に示すようなCDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すようなCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すようなCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。
【0031】
[0031]別の態様において、uPARに結合する抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む重鎖アミノ酸配列、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか1つを含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つを含む重鎖アミノ酸配列、および表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2またはCDR3配列のいずれか2つ(すなわち、CDR1およびCDR2、CDR1およびCDR3、またはCDR2およびCDR3のいずれか)を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1のいずれかの、CDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。
【0032】
[0032]別の態様において、抗体は、表18に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.19.2のCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような完全ヒト・モノクローナル抗体2.6.1のCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。別の態様において、抗体は、表18に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列を含む重鎖アミノ酸配列、ならびに表19に示すような完全ヒト・モノクローナル抗体4.18.1のCDR1、CDR2およびCDR3配列を含む軽鎖アミノ酸配列を含む。
【0033】
[0033]本発明のさらなる態様は、本発明の標的化結合剤または抗体と、uPARへの結合に関して交差競合する、標的化結合剤である。本発明の別の態様において、本発明の標的化結合剤または抗体と、uPARへの結合に関して交差競合する抗体がある。
【0034】
[0034]別の態様において、標的化結合剤または抗体は、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと、uPARへの結合に関して交差競合する。本発明の1つの態様において、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと、uPARへの結合に関して交差競合する抗体がある。
【0035】
[0035]本発明のさらなる態様は、uPAR上の、本発明の標的化結合剤または抗体と同じエピトープに結合する、標的化結合剤である。本発明の別の態様において、uPAR上の、本発明の標的化結合剤または抗体と同じエピトープに結合する、抗体がある。
【0036】
[0036]本発明の1つの態様において、uPAR上の、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと同じエピトープに結合する、標的化結合剤がある。本発明の1つの態様において、uPAR上の、完全ヒト・モノクローナル抗体2.19.2、2.6.1および4.18.1のいずれか1つと同じエピトープに結合する、抗体がある。
【0037】
[0037]1つの態様において、標的化結合剤は、以下により詳細に論じるように、uPARに特異的に結合する、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および/または4.18.1(ATCC寄託番号PTA−7476)の1以上を含む。
【0038】
[0038]1つの態様において、ATCC寄託番号PTA−7474、ATCC寄託番号PTA−7475およびATCC寄託番号PTA−7476より選択されるハイブリドーマによって産生される、標的化結合剤または抗体を提供する。1つの態様において、ATCC寄託番号PTA−7474、ATCC寄託番号PTA−7475およびATCC寄託番号PTA−7476より選択されるハイブリドーマによって産生される抗体より誘導可能な標的化結合剤または抗体を提供する。
【0039】
[0039]1つの態様において、標的化結合剤は、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および/または4.18.1(ATCC寄託番号PTA−7476)の1以上から誘導可能な抗体を含む。
【0040】
[0040]1つの態様において、標的化結合剤は、配列番号26、30または50の配列を有するポリペプチドを含む。1つの態様において、標的化結合剤は、配列番号28、32または52の配列を有するポリペプチドを含む。1つの態様において、本発明の抗体は、配列番号26、30または50の配列を有する重鎖ポリペプチドを含む。1つの態様において、本発明の抗体は、配列番号28、32または52の配列を有する軽鎖ポリペプチドを含む。
【0041】
[0041]1つの態様において、本発明の標的化結合剤は、配列番号26の配列を含むポリペプチドを含み、該配列は、表15の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号30の配列を含むポリペプチドを含み、該配列は、表13の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号50の配列を含むポリペプチドを含み、該配列は、表17の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号28の配列を含むポリペプチドを含み、該配列は、表14の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号32の配列を含むポリペプチドを含み、該配列は、表12の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の標的化結合剤は、配列番号52の配列を含むポリペプチドを含み、該配列は、表16の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。
【0042】
[0042]1つの態様において、本発明の抗体は、配列番号26の配列を含む重鎖ポリペプチドを含み、該配列は、表15の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号30の配列を含む重鎖ポリペプチドを含み、該配列は、表13の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号50の配列を含む重鎖ポリペプチドを含み、該配列は、表17の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号28の配列を含む軽鎖ポリペプチドを含み、該配列は、表14の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号32の配列を含む軽鎖ポリペプチドを含み、該配列は、表12の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。1つの態様において、本発明の抗体は、配列番号52の配列を含む軽鎖ポリペプチドを含み、該配列は、表16の各行によって示される生殖系列および非生殖系列残基のユニークな組み合わせのいずれか1つを有する。
【0043】
[0043]本発明はさらに、患者試料中のuPARのレベルをアッセイするための方法であって、本発明の標的化結合剤または抗uPAR抗体と、患者由来の生物学的試料を接触させ、そして前記試料中の前記抗体およびuPAR間の結合レベルを検出する工程を含む、前記方法を提供する。より具体的な態様において、生物学的試料は、血液、血漿、唾液、脳脊髄液、骨髄または尿である。
【0044】
[0044]他の態様において、本発明は、本発明の標的化結合剤または該剤の結合性断片、および薬学的に許容されうるキャリアーを含む、組成物を提供する。他の態様において、本発明は、本発明の抗体またはその結合性断片、および薬学的に許容されうるキャリアーを含む、組成物を提供する。
【0045】
[0045]本発明は、悪性腫瘍の治療が必要な動物を選択し、そしてuPARに結合する、本発明の標的化結合剤の療法的有効用量を該動物に投与することによって、動物において悪性腫瘍を治療する方法を提供する。特定の態様において、動物はヒトである。特定の態様において、標的化結合剤は本発明の抗体であり、そして2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および4.18.1(ATCC寄託番号PTA−7476)からなる群より選択されることも可能である。
【0046】
[0046]特定の態様において、悪性腫瘍は:黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、膵臓癌、食道癌、頭部および頸部癌、中皮腫、肉腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍、ならびに類表皮癌からなる群より選択されることも可能である。
【0047】
[0047]本発明のさらにさらなる態様には、細胞接着および/または浸潤関連疾患を患う動物を効率的に治療する方法であって、細胞接着および/または浸潤関連疾患の治療が必要な動物を選択し、そしてuPARに特異的に結合する、本発明の標的化結合剤の療法的有効用量を該動物に投与する工程を含む、前記方法が含まれる。特定の態様において、動物はヒトである。特定の態様において、標的化結合剤は、完全ヒト・モノクローナル抗体である。特定の態様において、細胞接着または細胞浸潤関連疾患は、腫瘍転移である。特定の態様において、標的化結合剤は本発明の抗体であり、そして2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および4.18.1(ATCC寄託番号PTA−7476)からなる群より選択されることも可能である。
【0048】
[0048]治療可能な細胞接着および浸潤関連疾患には、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、膵臓癌、食道癌、頭部および頸部癌、中皮腫、肉腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍、ならびに類表皮癌が含まれる。
【0049】
[0049]治療可能な細胞接着および浸潤関連疾患には、非新生物疾患、例えば炎症性、または過剰増殖性疾患が含まれ、これらには、限定されるわけではないが、関節炎、アテローム性動脈硬化症、アレルギー性結膜炎が含まれる。
【0050】
[0050]本発明のさらなる態様には、動物において、uPARが誘導する細胞接着および/または浸潤を阻害する方法が含まれる。これらの方法には、uPARが誘導する細胞接着および浸潤の治療が必要な動物を選択し、そして本発明の標的化結合剤または完全ヒト・モノクローナル抗体の療法的有効用量を、前記動物に投与する工程が含まれ、ここで前記抗体はuPARに特異的に結合する。
【0051】
[0051]本発明のさらなる態様には、動物における細胞接着または浸潤関連疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗体の使用が含まれ、ここで前記モノクローナル抗体は、uPARに特異的に結合する。
【0052】
[0052]さらにさらなる態様において、本明細書記載の標的化結合剤を、動物における、uPARが誘導する細胞接着、および/または浸潤の有効な治療用の薬剤の調製に用いてもよく、ここで前記標的化結合剤は、uPARに特異的に結合する。さらにさらなる態様において、本明細書記載の抗体を、動物における、uPARが誘導する細胞接着、および/または浸潤の有効な治療用の薬剤の調製に用いてもよく、ここで前記抗体は、uPARに特異的に結合する。
【0053】
[0053]本明細書記載の本発明の態様は、uPARに結合し、そしてuPAR機能に影響を及ぼす標的化結合剤に関する。本明細書記載の本発明の他の態様は、uPARに結合し、そしてuPAR機能に影響を及ぼすモノクローナル抗体に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の抗uPAR抗体に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の抗uPAR抗体の調製に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の完全ヒト抗uPAR抗体に関する。他の態様は、uPARに関する高い結合アフィニティー、in vitroおよびin vivoでuPARを中和する能力、ならびにuPARが誘導する細胞接着および/または浸潤および/または腫瘍増殖を阻害する能力を含む、療法的観点から望ましい特性を持つ、本発明の完全ヒト抗uPAR抗体の調製に関する。
【0054】
[0054]1つの態様において、本発明には、非常に高いアフィニティー(Kd)でuPARに結合する抗体が含まれる。例えば、限定されるわけではないが、10−5、10−6、10−7、10−8、10−9、10−10または10−11M未満、あるいはこれらの中の任意の範囲または値のKdで、uPARに結合可能な、ヒト、ウサギ、マウス、キメラまたはヒト化抗体。本明細書に記載するように、KinExA(登録商標)および/またはBIACORE(登録商標)によって、アフィニティーおよび/またはアビディティー測定値を測定してもよい。
【0055】
[0055]本発明の1つの態様には、uPARに結合する単離抗体、またはこれらの抗体の断片が含まれる。当該技術分野に知られるように、抗体は、例えば、ポリクローナル、オリゴクローナル、モノクローナル、キメラ、ヒト化、および/または完全ヒト抗体であってもよい。本明細書記載の本発明の態様はまた、これらの抗体を産生するための細胞も提供する。
【0056】
[0056]本発明の態様が、抗体、あるいは生成法または産生法のいかなる特定の型にも限定されないことが認識されるであろう。例えば、本発明の抗uPAR抗体は、全長抗体(例えば損なわれていない(intact)ヒトFc領域を有する)または抗体断片(例えば、Fab、Fab’、F(ab’)2、FvまたはDab(Dabは、ヒト抗体の最小機能結合単位である))であってもよい。さらに、抗体を分泌するハイブリドーマから、あるいは抗体をコードする単数または複数の遺伝子で形質転換されたかまたはトランスフェクションされている組換え的に産生された細胞から、抗体を製造してもよい。
【0057】
[0057]本発明の他の態様には、本明細書に記載するような標的化結合剤、抗体またはその断片のいずれかをコードする単離核酸分子、抗uPAR抗体をコードする単離核酸分子を有するベクター、あるいはこうした核酸分子のいずれかで形質転換されている宿主細胞が含まれる。さらに、本発明の1つの態様は、核酸分子を発現させて抗体を産生する条件下で、宿主細胞を培養した後、抗体を回収することによって、本発明の抗uPAR抗体を産生する方法である。本発明の態様にはまた、抗体産生のために宿主細胞内にトランスフェクションした際、抗体またはその断片の収量を増加させるために最適化された核酸配列を含む、本発明の抗体または抗体の断片をコードする、いかなる核酸分子も含まれることを理解すべきである。
【0058】
[0058]さらなる態様には、ヒトuPARまたはその断片、および1以上のオルソロガス配列またはその断片で哺乳動物を免疫することによって、uPARに対する高アフィニティー抗体を産生する方法が含まれる。
【0059】
[0059]他の態様は、uPARに特異的に結合する単離抗体の生成および同定に基づく。uPARは、新生物疾患などの細胞接着および/または浸潤関連疾患において、上昇したレベルで発現される。uPARの生物学的活性を阻害すると、uPARが誘導する細胞接着および浸潤、ならびに他の望ましい効果が防止されうる。
【0060】
[0060]本発明の別の態様には、疾患または状態を診断する方法であって、本明細書に記載するように調製した抗体を利用して、患者試料中のuPARのレベルを検出する、前記方法が含まれる。1つの態様において、患者試料は、血液または血清である。さらなる態様において、抗uPAR抗体を用いた、uPARの過剰発現の同定を伴う、リスク要因の同定法、疾患の診断法、および疾患の病期診断法を提示する。
【0061】
[0061]本発明の別の態様には、本発明の標的化結合剤または抗uPAR抗体と、血清または細胞を接触させ、そしてその後、uPARの存在を検出することによって、細胞中のuPARの発現と関連する状態を診断する方法が含まれる。好ましい状態には、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌腫を含む、細胞接着および/または浸潤関連疾患が含まれる。
【0062】
[0062]別の態様において、本発明には、哺乳動物組織、細胞、または体液中のuPARを検出して、uPAR関連疾患に関してスクリーニングするためのアッセイキットが含まれる。該キットには、uPARに結合する、本発明の標的化結合剤または抗体、ならびに存在するならば、uPARと抗体の反応を示すための手段が含まれる。1つの態様において、抗体はモノクローナル抗体である。別の態様において、uPARに結合する抗体は標識されている。さらに別の態様において、抗体は、非標識一次抗体であり、そしてキットにはさらに、一次抗体を検出するための手段が含まれる。1つの態様において、検出するための手段には、抗免疫グロブリンである、標識二次抗体が含まれる。蛍光色素、酵素、放射性核種および放射線不透過性物質からなる群より選択されるマーカーで、該抗体を標識してもよい。
【0063】
[0063]本発明の他の態様には、薬学的に許容されうるキャリアーまたは希釈剤と混合された、本発明の標的化結合剤または抗uPAR抗体の有効量を有する薬学的組成物が含まれる。さらに他の態様において、本発明の標的化結合剤または抗uPAR抗体、あるいはその断片を、療法剤にコンジュゲート化する。療法剤は、例えば、毒素または放射性同位体であってもよい。
【0064】
[0064]さらに別の態様には、本発明の標的化結合剤または抗uPAR抗体の有効量を、患者に投与することによって、患者におけるuPARの発現と関連する疾患または状態を治療するための方法が含まれる。本発明の標的化結合剤または抗uPAR抗体を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。例えば、細胞接着および/または浸潤を遮断するuPAR抗体のモノクローナル、オリゴクローナルまたはポリクローナル混合物を、腫瘍細胞増殖を直接阻害することが示された薬剤と組み合わせて投与してもよい。該方法をin vivoで実行してもよく、そして患者は、好ましくはヒト患者である。好ましい態様において、該方法は、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌腫を含む、細胞接着および/または浸潤関連疾患の治療に関する。
【0065】
[0065]別の態様において、本発明は、容器を含む製品を提供する。容器には、本発明の標的化結合剤または抗uPAR抗体を含有する組成物、ならびにuPARの過剰発現によって特徴付けられる細胞接着および/または浸潤関連疾患を治療するために該組成物を使用可能であることを示す、パッケージ挿入物またはラベルが含まれる。
【0066】
[0066]いくつかの態様において、本発明の標的化結合剤または抗uPAR抗体を患者に投与した後、除去剤を投与して、過剰な循環抗体を血液から除去する。
[0067]さらに別の態様は、細胞接着および/または浸潤関連疾患などの疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。1つの態様において、細胞接着および/または浸潤関連疾患には、癌腫、例えば、乳房、卵巣、胃、子宮内膜、唾液腺、肺、腎臓、結腸、結腸直腸、食道、甲状腺、膵臓、前立腺および膀胱の癌が含まれる。別の態様において、細胞接着および/または浸潤関連疾患には、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、肉腫、頭部および頸部癌、中皮腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍および神経膠芽腫が含まれる。
【0067】
[0068]さらに別の態様は、動物における悪性腫瘍の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。
[0069]本発明のさらに別の態様は、非新生物疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。本発明のさらに別の態様は、限定されるわけではないが、関節炎、アテローム性動脈硬化症、アレルギー性結膜炎を含む、炎症性、または過剰増殖性疾患の治療用の薬剤の調製における、本発明の標的化結合剤または抗uPAR抗体の使用である。
【0068】
詳細な説明
[0079]本発明の態様は、ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR)に結合する標的化結合剤に関する。いくつかの態様において、結合剤はuPARに結合し、そしてウロキナーゼ型プラスミノーゲン活性化因子(uPA)のその受容体uPARへの結合を阻害する。1つの態様において、標的化結合剤はモノクローナル抗体またはその結合性断片である。
【0069】
[0080]本発明の他の態様には、完全ヒト抗uPAR抗体、および療法的に有用な抗体調製物が含まれる。1つの態様において、本発明の抗uPAR抗体の調製物は、uPARに関する強い結合アフィニティー、in vitroでプラスミノーゲン活性化を阻害する能力、ならびにuPARが誘導する細胞接着および浸潤をin vitroおよびin vivoで阻害する能力を含む、望ましい療法特性を有する。
【0070】
[0081]本発明の態様にはまた、抗uPAR抗体の単離結合性断片も含まれる。1つの態様において、結合性断片は、完全ヒト抗uPAR抗体に由来する。典型的な断片には、以下により詳細に記載するように、Fv、Fab’、Dab、または他の周知の抗体断片が含まれる。本発明の態様にはまた、uPARに対する完全ヒト抗体を発現する細胞も含まれる。細胞の例には、ハイブリドーマ、または組換え的に生成された細胞、例えば、uPARに対する抗体を産生する、チャイニーズハムスター卵巣(CHO)細胞、CHO細胞の変異体(例えばDG44)およびNS0細胞が含まれる。CHO細胞の変異体に関するさらなる情報は、本明細書にその全体が援用される、AndersenおよびReilly(2004) Current Opinion in Biotechnology 15, 456−462に見いだされうる。
【0071】
[0082]さらに、本発明の態様には、疾患を治療するためにこれらの抗体を使用する方法が含まれる。本発明の抗uPAR抗体は、uPARが仲介するプラスミノーゲン活性化を防止し、それによって細胞接着および/または浸潤を阻害するのに有用である。いかなる特定の理論にも限定されることなく、この阻害の作用機構には、uPAがその受容体uPARに結合することからの阻害が含まれることも可能である。本発明の抗uPAR抗体はまた、uPAR/uPA限局性uPA酵素活性を阻害して、それによってuPARの有効濃度を減少させることも可能である。本発明の抗uPAR抗体は、uPARに依存する、ビトロネクチンへの細胞の接着を阻害することも可能であり、そしてまた、インテグリンが仲介する細胞接着のuPAR修飾を混乱させることも可能である。本発明の抗uPAR抗体はまた、uPARへのuPA結合を阻害するか、またはインテグリンおよび増殖因子受容体とのuPAR相互作用を混乱させた結果、細胞内シグナル伝達を修飾することも可能である。この阻害機構を通じて治療可能な疾患には、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌および腫瘍が含まれる。
【0072】
[0083]本発明の他の態様には、生物学的試料中のuPARの量を特異的に決定するための診断アッセイが含まれる。アッセイキットには、こうした抗体を検出するのに必要な標識とともに、本発明の抗uPAR抗体が含まれてもよい。これらの診断アッセイは、限定されるわけではないが、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、ならびに甲状腺、胃、前立腺、乳房、卵巣、膀胱、肺、子宮、腎臓、結腸、および膵臓、唾液腺、および結腸直腸の癌腫を含む、細胞接着および浸潤関連疾患に関してスクリーニングするのに有用である。
【0073】
[0084]本発明の別の側面は、uPARに結合する、uPARの生物学的活性のアンタゴニストである。1つの態様において、アンタゴニストは、抗体などの標的化結合剤である。アンタゴニストは:
i)uPAR;または
ii)uPA/uPAR複合体
、あるいはこれらの組み合わせに結合してもよい。1つの態様において、アンタゴニストは、in vitroおよびin vivoでuPARの生物学的活性に拮抗することが可能である。アンタゴニストは、本明細書記載の抗体、例えば、完全ヒト・モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)、2.6.1(ATCC寄託番号PTA−7475)および4.18.1(ATCC寄託番号PTA−7476)から選択可能である。
【0074】
[0085]1つの態様において、uPARの生物学的活性のアンタゴニストは、uPARに結合可能であり、そしてそれによってuPARが仲介するプラスミノーゲン活性化を防止し、それによって細胞接着および/または浸潤を阻害することも可能である。この阻害作用の機構には、アンタゴニストがuPARに結合し、そしてuPAのその受容体uPARへの結合を阻害することが含まれうる。いかなる特定の理論的考慮にも束縛されることは望まないが、uPARの生物学的活性の拮抗を達成可能な機構には、限定されるわけではないが、uPAの受容体uPARへの結合の阻害、またはuPAR/uPA限局性uPA酵素活性の阻害が含まれる。
【0075】
[0086]1つの態様は、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1と同じ、単数または複数のエピトープに結合する、標的化結合剤である。
【0076】
[0087]1つの態様は、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1と同じ、単数または複数のエピトープに結合する、抗体である。
[0088]1つの態様において、標的化結合剤は、1ナノモル濃度(nM)未満のKdでuPARに結合する。標的化結合剤は、500ピコモル濃度(pM)未満のKdで結合してもよい。標的化結合剤は、400ピコモル濃度(pM)未満のKdで結合してもよい。標的化結合剤は、300ピコモル濃度(pM)未満のKdで結合してもよい。別の態様において、標的化結合剤は、200pM未満のKdで結合する。
【0077】
[0089]1つの態様は、上述のような標的化結合剤を産生するハイブリドーマである。1つの態様は、上述のような抗体の軽鎖および/または重鎖を産生するハイブリドーマである。1つの態様において、ハイブリドーマは、完全ヒト・モノクローナル抗体の軽鎖および/または重鎖を産生する。別の態様において、ハイブリドーマは、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1の軽鎖および/または重鎖を産生する。あるいは、ハイブリドーマは、完全ヒト・モノクローナル抗体2.19.2、2.6.1または4.18.1と同じ単数または複数のエピトープに結合する抗体を産生してもよい。
【0078】
[0090]別の態様は、上述のような標的化結合剤をコードする核酸分子である。1つの態様は、上述のような抗体の軽鎖または重鎖をコードする核酸分子である。1つの態様において、核酸分子は、完全ヒト・モノクローナル抗体の軽鎖または重鎖をコードする。さらに別の態様は、抗体2.19.2、2.6.1または4.18.1より選択される完全ヒト・モノクローナル抗体の軽鎖または重鎖をコードする核酸分子である。
【0079】
[0091]本発明の別の態様は、上述のような単数または複数の核酸分子を含むベクターであり、該ベクターは、上に定義するような標的化結合剤をコードする。本発明の1つの態様は、上述のような単数または複数の核酸分子を含むベクターであり、該ベクターは、上に定義するような抗体の軽鎖および/または重鎖をコードする。
【0080】
[0092]本発明のさらに別の態様は、上に定義するようなベクターを含む宿主細胞である。あるいは、宿主細胞は、1より多いベクターを含んでもよい。
[0093]さらに、本発明の1つの態様は、標的化結合剤を産生する方法、または核酸分子を発現させて標的化結合剤を産生する条件下で、宿主細胞を培養した後、標的化結合剤を回収することによる、本発明の方法である。本発明の1つの態様は、核酸分子を発現させて抗体を産生する条件下で、宿主細胞を培養した後、抗体を回収することによって、本発明の抗体を産生する方法である。
【0081】
[0094]1つの態様において、本発明には、上述のような標的化結合剤をコードする、少なくとも1つの核酸分子で、少なくとも1つの宿主細胞をトランスフェクションし、宿主細胞中で核酸分子を発現させ、そして標的化結合剤を単離することによって、標的化結合剤を作製する方法が含まれる。1つの態様において、本発明には、上述のような抗体をコードする、少なくとも1つの核酸分子で、少なくとも1つの宿主細胞をトランスフェクションし、宿主細胞中で核酸分子を発現させ、そして抗体を単離することによって、抗体を作製する方法が含まれる。
【0082】
[0095]別の側面にしたがって、本発明には、本明細書に記載するようなアンタゴニストを投与することによって、uPARの生物学的活性に拮抗する方法が含まれる。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性のアンタゴニストの療法的有効用量を該動物に投与する工程が含まれてもよい。
【0083】
[0096]本発明の別の側面には、上述のような標的化結合剤を投与することによって、uPARの生物学的活性に拮抗する方法が含まれる。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する標的化結合剤の療法的有効用量を該動物に投与する工程が含まれてもよい。
【0084】
[0097]本発明の別の側面には、上述のような抗体を投与することによって、uPARの生物学的活性に拮抗する方法が含まれる。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する抗体の療法的有効用量を該動物に投与する工程が含まれてもよい。
【0085】
[0098]別の側面にしたがって、uPARの生物学的活性のアンタゴニストの療法的有効量を投与することによって、哺乳動物における疾患関連細胞接着および/または浸潤を治療する方法を提供する。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性のアンタゴニストの療法的有効用量を該動物に投与する工程が含まれてもよい。
【0086】
[0099]別の側面にしたがって、uPARの生物学的活性に拮抗する標的化結合剤の療法的有効量を投与することによって、哺乳動物における疾患関連細胞接着および/または浸潤を治療する方法を提供する。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する標的化結合剤の療法的有効用量を該動物に投与する工程が含まれてもよい。標的化結合剤を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0087】
[0100]別の側面にしたがって、uPARの生物学的活性に拮抗する抗体の療法的有効量を投与することによって、哺乳動物における疾患関連細胞接着および/または浸潤を治療する方法を提供する。該方法には、疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する抗体の療法的有効用量を該動物に投与する工程が含まれてもよい。抗体を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0088】
[0101]別の側面にしたがって、uPARの生物学的活性のアンタゴニストの療法的有効量を投与することによって、哺乳動物における癌を治療する方法を提供する。該方法には、癌の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗するアンタゴニストの療法的有効用量を該動物に投与する工程が含まれてもよい。アンタゴニストを単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0089】
[0102]別の側面にしたがって、uPARの生物学的活性に拮抗する標的化結合剤の療法的有効量を投与することによって、哺乳動物における癌を治療する方法を提供する。該方法には、癌の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する標的化結合剤の療法的有効用量を該動物に投与する工程が含まれてもよい。標的化結合剤を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0090】
[0103]別の側面にしたがって、uPARの生物学的活性に拮抗する抗体の療法的有効量を投与することによって、哺乳動物における癌を治療する方法を提供する。該方法には、癌の治療が必要な動物を選択し、そしてuPARの生物学的活性に拮抗する抗体の療法的有効用量を該動物に投与する工程が含まれてもよい。抗体を単独で投与してもよいし、あるいはさらなる抗体または化学療法薬剤または放射線療法と組み合わせて投与してもよい。
【0091】
[0104]本発明の別の側面にしたがって、疾患関連細胞接着および/または浸潤の治療用の薬剤の製造のための、uPARの生物学的活性のアンタゴニストの使用を提供する。
【0092】
[0105]本発明の別の側面にしたがって、疾患関連細胞接着および/または浸潤の治療用の薬剤の製造のための、uPARの生物学的活性に拮抗する標的化結合剤の使用を提供する。
【0093】
[0106]本発明の別の側面にしたがって、疾患関連細胞接着および/または浸潤の治療用の薬剤の製造のための、uPARの生物学的活性に拮抗する抗体の使用を提供する。
【0094】
[0107]1つの態様において、本発明は、uPAR受容体のみに、またはuPAR受容体に部分的に依存する腫瘍を持つ患者において、uPARに拮抗する際の使用に特に適している。
【0095】
[0108]本発明の別の態様には、哺乳動物組織、細胞、または体液中のuPARを検出して、細胞接着および浸潤関連疾患に関してスクリーニングするためのアッセイキットが含まれる。該キットには、uPARに結合する標的化結合剤、および存在するならば、uPARと標的化結合剤の反応を示すための手段が含まれる。1つの態様において、uPARに結合する標的化結合剤は標識されている。別の態様において、標的化結合剤は、標識されず、そしてキットはさらに、標的化結合剤を検出するための手段を含む。好ましくは、標的化結合剤は、蛍光色素、酵素、放射性核種および放射線不透過性物質からなる群より選択されるマーカーで、標識される。
【0096】
[0109]本発明の別の態様には、哺乳動物組織、細胞、または体液中のuPARを検出して、細胞接着および浸潤関連疾患に関してスクリーニングするためのアッセイキットが含まれる。該キットには、uPARに結合する抗体、および存在するならば、uPARと抗体の反応を示すための手段が含まれる。抗体はモノクローナル抗体であってもよい。1つの態様において、uPARに結合する抗体は標識されている。別の態様において、抗体は、非標識一次抗体であり、そしてキットはさらに、一次抗体を検出するための手段を含む。1つの態様において、手段には、抗免疫グロブリンである、標識二次抗体が含まれる。好ましくは、該抗体は、蛍光色素、酵素、放射性核種および放射線不透過性物質からなる群より選択されるマーカーで、標識される。
【0097】
[0110]抗uPAR抗体に関するさらなる態様、特徴等を、以下にさらに詳細に提供する。
配列表
[0111]本発明の態様には、表1に以下に列挙する特定の抗uPAR抗体が含まれる。この表は、対応する重鎖および軽鎖遺伝子の可変ドメインの配列番号とともに、各抗uPAR抗体の同定番号を報告する。各抗体は、2つの小数点で区切られた3つの数字を含む同定番号を与えられている。
【0098】
表1
【0099】
【表1−1】

【0100】
【表1−2】

【0101】
定義
[0112]別に定義しない限り、本明細書に用いる科学的用語および技術的用語は、一般の当業者に通常理解される意味を有するものとする。さらに、文脈によって別に必要とされない限り、単数形の用語は複数形を含み、そして複数形の用語は単数形を含むものとする。一般的に、本明細書に記載する細胞および組織培養、分子生物学、ならびにタンパク質およびオリゴまたはポリヌクレオチド化学およびハイブリダイゼーションと関連して利用する用語、およびこれらの技術は、当該技術分野に周知であり、そして一般的に用いられるものである。
【0102】
[0113]組換えDNA、オリゴヌクレオチド合成、ならびに組織培養および形質転換には、標準的技術を用いる(例えばエレクトロポレーション、リポフェクション)。製造者の指定にしたがい、または当該技術分野で一般的に達成されるように、または本明細書に記載するように、酵素反応および精製技術を行う。当該技術分野に周知の慣用法にしたがって、そして本明細書全体で引用し、そして論じる、多様な一般的なおよびより具体的な参考文献に記載されるように、一般的に、前述の技術および方法を行う。例えば、本明細書に援用される、Sambrookら Molecular Cloning: A Laboratory Manual(第3版, Cold Spring Harbor Laboratory Press, ニューヨーク州コールドスプリングハーバー(2001))を参照されたい。本明細書に記載する分析化学、合成有機化学、ならびに医学的および薬学的化学と関連して利用する用語、ならびにこれらの実験法および技術は、当該技術分野に周知であり、そして一般的に用いられるものである。化学合成、化学分析、薬学的調製、配合、および送達、ならびに患者の治療には、標準的技術を用いる。
【0103】
[0114]本開示にしたがって利用した際、以下の用語は、別に示さない限り、以下の意味を有すると理解されるものとする:
[0115]アンタゴニストは、ポリペプチド、核酸、炭水化物、脂質、小分子量化合物、オリゴヌクレオチド、オリゴペプチド、RNA干渉(RNAi)、アンチセンス、組換えタンパク質、抗体、あるいはこれらの断片またはこれらのコンジュゲートもしくは融合タンパク質であってもよい。RNAiの概説には、Milhavet O, Gary DS, Mattson MP.(Pharmacol Rev. 2003 Dec;55(4):629−48. 概説)を参照されたく、そしてアンチセンスの概説には、Opalinska JB, Gewirtz AM.(Sci STKE. 2003 Oct 28;2003(206):pe47.)を参照されたい。
【0104】
[0116]疾患関連細胞接着および/または浸潤は、いかなる異常な、望ましくない、または病的な細胞接着および/または浸潤であってもよく、例えば腫瘍関連細胞接着および/または浸潤であってもよい。細胞接着および/または浸潤関連疾患には、限定されるわけではないが、非固形腫瘍、例えば、白血病、多発性骨髄腫またはリンパ腫、そしてまた、固形腫瘍、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、神経膠芽腫、甲状腺、胆管、骨、胃、脳/CNS、頭部および頸部、肝臓系、胃、前立腺、乳房、腎臓、精巣、卵巣、皮膚、子宮頸部、肺、筋肉、ニューロン、食道、膀胱、肺、子宮、膣、子宮内膜、腎臓、結腸直腸、膵臓、胸膜/腹膜、唾液腺、および表皮(epidermous)の癌腫が含まれる。
【0105】
[0117]化合物は、約2000ダルトン未満の分子量を持つ、いかなる小分子量化合物も指す。
[0118]用語「uPAR」は、分子、ウロキナーゼ型プラスミノーゲン活性化因子受容体を指す。
【0106】
[0119]用語「中和」は、抗体などの標的化結合剤を指す場合、抗体が、標的抗原の活性を排除するか、または有意に減少させる能力に関する。したがって、本発明の「中和」抗uPAR抗体は、uPARの活性を排除するかまたは有意に減少させることが可能である。中和uPAR抗体は、例えば、uPAのその受容体uPARへの結合を遮断することによって作用可能である。この結合を遮断することによって、uPAが仲介するプラスミノーゲン活性化は、有意に、または完全に、排除される。理想的には、uPARに対する中和抗体は、細胞接着および/または浸潤を阻害する。
【0107】
[0120]用語「ポリペプチド」は、本明細書において、ポリペプチド配列の天然タンパク質、断片または類似体を指す、一般的な用語として用いられる。したがって、天然タンパク質、断片、および類似体は、ポリペプチド属の種である。本発明にしたがった、好ましいポリペプチドは、ヒト重鎖免疫グロブリン分子およびヒト・カッパ軽鎖免疫グロブリン分子、ならびにカッパまたはラムダ軽鎖免疫グロブリン分子などの軽鎖免疫グロブリン分子とともに、重鎖免疫グロブリンを含む組み合わせ、およびその逆によって形成される抗体分子、ならびにその断片および類似体を含む。本発明にしたがった、好ましいポリペプチドはまた、単に、ヒト重鎖免疫グロブリン分子またはその断片も含んでもよい。
【0108】
[0121]用語「天然存在」は、本明細書において、対象に適用した際、対象が天然で見られうるという事実を指す。例えば、天然供給源から単離可能であり、そして人間によって、実験室において、または別の方式で、意図的に修飾されていない、生物(ウイルスを含む)中に存在するポリペプチドまたはポリヌクレオチド配列は、天然存在である。
【0109】
[0122]用語「機能可能であるように連結された」は、本明細書において、その意図される方式で機能することが可能にされた関係にある、そのように記載された構成要素の位置を指す。例えば、コード配列に「機能可能であるように連結された」制御配列は、コード配列の発現が、制御配列と適合する条件下で達成される方式で連結されている。
【0110】
[0123]用語「ポリヌクレオチド」は、本明細書において、リボヌクレオチドもしくはデオキシヌクレオチドのいずれか、またはいずれかの種類のヌクレオチドの修飾型、あるいはRNA−DNAへテロ二重鎖の、少なくとも長さ10塩基のヌクレオチドのポリマー型を意味する。この用語には、DNAの一本鎖および二本鎖型が含まれる。
【0111】
[0124]本明細書で称される用語「オリゴヌクレオチド」には、天然存在連結および非天然存在連結によって一緒に連結された、天然存在ヌクレオチドおよび修飾ヌクレオチドが含まれる。オリゴヌクレオチドは、一般的に200塩基以下の長さを含む、ポリヌクレオチド・サブセットである。好ましくは、オリゴヌクレオチドは、長さ10〜60塩基、そして最も好ましくは、長さ12、13、14、15、16、17、18、19、または20〜40塩基である。オリゴヌクレオチドは、通常、例えばプローブ用に、一本鎖であるが;オリゴヌクレオチドは、例えば遺伝子突然変異体の構築で使用するため、二本鎖であってもよい。オリゴヌクレオチドは、センスまたはアンチセンス・オリゴヌクレオチドのいずれかであってもよい。
【0112】
[0125]本明細書で称される用語「天然存在ヌクレオチド」には、デオキシリボヌクレオチドおよびリボヌクレオチドが含まれる。本明細書で称される用語「修飾ヌクレオチド」には、修飾されたまたは置換された糖基等を含むヌクレオチドが含まれる。本明細書で称される用語「オリゴヌクレオチド連結」には、ホスホロチオエート、ホスホロジチオエート、ホスホロセレノエート、ホスホロジセレノエート、ホスホロアニロチオエート、ホスホルアニラデート(phosphoraniladate)、ホスホロアミデート等のオリゴヌクレオチド連結が含まれる。例えば、その開示が本明細書に援用される、LaPlancheら Nucl. Acids Res. 14:9081(1986); Stecら J. Am. Chem. Soc. 106:6077(1984); Steinら Nucl. Acids Res. 16:3209(1988); Zonら Anti−Cancer Drug Design 6:539(1991); Zonら Oligonucleotides and Analogues: A Practical Approach, pp. 87−108(F. Eckstein監修, Oxford University Press, 英国オックスフォード(1991)); Stecら、米国特許第5,151,510号; UhlmannおよびPeyman Chemical Reviews 90:543(1990)を参照されたい。所望の場合、オリゴヌクレオチドには、検出のための標識が含まれてもよい。
【0113】
[0126]2つのアミノ酸配列間に部分的なまたは完全な同一性がある場合、これらの配列は「相同」である。例えば、85%の相同性は、2つの配列を最大マッチングになるように並列させた場合、85%のアミノ酸が同一であることを意味する。マッチングを最大にする際、ギャップ(マッチングさせている2つの配列のいずれかにおけるもの)が許可され;5以下のギャップ長が好ましく、2以下がより好ましい。あるいは、そして好ましくは、突然変異データマトリックスおよび6以上のギャップペナルティを伴い、プログラムALIGNを用いて、5(標準偏差単位)よりも高い並列スコアを有するならば、本明細書でこの用語を用いた場合、2つのタンパク質配列(または少なくとも長さ約30アミノ酸の該タンパク質配列に由来するポリペプチド配列)は相同である。Dayhoff, M.O., Atlas of Protein Sequence and Structure中, pp. 101−110(第5巻, National Biomedical Research Foundation(1972))およびこの巻の補遺2、pp. 1−10を参照されたい。2つの配列またはその部分は、より好ましくは、これらのアミノ酸が、ALIGNプログラムを用いて最適に並列された際、50%以上同一であるならば、相同である。2つのオルソロガス配列内に、相同性が異なる領域がありうることを認識しなければならない。例えば、マウスおよびヒトのオルソログの機能部位は、非機能領域より高い度合いの相同性を有しうる。
【0114】
[0127]用語「に対応する」は、本明細書において、ポリヌクレオチド配列が、参照ポリヌクレオチド配列のすべてまたは一部に相同である(すなわち、厳密に進化的に関連せずに、同一である)か、あるいはポリペプチド配列が参照ポリペプチド配列と同一であることを意味する。
【0115】
[0128]対照的に、用語「に相補的」は、本明細書において、相補配列が、参照ポリヌクレオチド配列のすべてまたは一部に相同であることを意味する。例えば、ヌクレオチド配列「TATAC」は、参照配列「TATAC」に対応し、そして参照配列「GTATA」に相補的である。
【0116】
[0129]用語「配列同一性」は、2つのポリヌクレオチドまたはアミノ酸配列が、比較ウィンドウに渡って同一である(すなわちヌクレオチドごとまたは残基ごとに基づいて)ことを意味する。用語「配列同一性パーセント」は、2つの最適に並列された配列を、比較ウィンドウに渡って比較し、同一核酸塩基(例えばA、T、C、G、U、またはI)またはアミノ酸残基が両方の配列に生じる位の数を決定して、マッチした位の数を得て、マッチした位の数を比較ウィンドウ中の位の総数(すなわちウィンドウサイズ)によって割り、そして結果に100を乗じて、配列同一性パーセントを得ることによって、計算される。用語「実質的同一性」は、本明細書において、ポリヌクレオチドまたはアミノ酸が、少なくとも18ヌクレオチド(6アミノ酸)位の比較ウィンドウに渡って、しばしば、少なくとも24〜48ヌクレオチド(8〜16アミノ酸)位のウィンドウに渡って、参照配列に比較した際、少なくとも85パーセントの配列同一性、好ましくは少なくとも90〜95パーセントの配列同一性、より好ましくは少なくとも99パーセントの配列同一性を有する配列を含み、比較ウィンドウに渡って、全部で参照配列の20パーセント以下の欠失または付加を含んでもよい配列に、参照配列を比較することによって、配列同一性パーセントを計算する、ポリヌクレオチドまたはアミノ酸配列の特徴を意味する。参照配列はより大きい配列のサブセットであってもよい。
【0117】
[0130]本明細書において、20の慣用的なアミノ酸およびその略語は、慣用的な用法にしたがう。本明細書に援用される、Immunology− A Synthesis(第2版, E.S. GolubおよびD.R. Gren監修, Sinauer Associates, マサチューセッツ州サンダーランド(1991))を参照されたい。20の慣用的アミノ酸の立体異性体(例えばD−アミノ酸)、α,α−二置換アミノ酸などの非天然アミノ酸、N−アルキルアミノ酸、乳酸、および他の非慣用的アミノ酸もまた、本発明のポリペプチドに適した構成要素でありうる。非慣用的なアミノ酸の例には:4−ヒドロキシプロリン、γ−カルボキシグルタメート、ε−N,N,N−トリメチルリジン、ε−N−アセチルリジン、O−ホスホセリン、N−アセチルセリン、N−ホルミルメチオニン、3−メチルヒスチジン、5−ヒドロキシリジン、σ−N−メチルアルギニン、ならびに他の類似のアミノ酸およびイミノ酸(例えば4−ヒドロキシプロリン)が含まれる。本明細書で用いるポリペプチド表記法において、標準的な用法および慣例にしたがって、左側はアミノ末端方向であり、そして右側はカルボキシ末端方向である。
【0118】
[0131]同様に、別に明記しない限り、一本鎖ポリヌクレオチド配列の左側は5’端であり;二本鎖ポリヌクレオチド配列の左側は5’方向と称される。新生RNA転写物の5’から3’付加の方向は、転写方向と称され;RNAと同じ配列を有し、そしてRNA転写物の5’端より5’であるDNA鎖上の配列領域は、「上流配列」と称され;RNAと同じ配列を有し、そしてRNA転写物の3’端より3’であるDNA鎖上の配列領域は、「下流配列」と称される。
【0119】
[0132]ポリペプチドに適用した際、用語「実質的同一性」は、2つのペプチド配列が、デフォルトギャップ加重を用いて、プログラムGAPまたはBESTFITによるなどで、最適に並列された際、少なくとも80パーセントの配列同一性、好ましくは少なくとも90パーセントの配列同一性、より好ましくは少なくとも95パーセントの配列同一性、そして最も好ましくは少なくとも99パーセントの配列同一性を共有することを意味する。好ましくは、同一でない残基位は、保存的アミノ酸置換によって異なる。保存的アミノ酸置換は、類似の側鎖を有する残基の互換性を指す。例えば、脂肪族側鎖を有するアミノ酸群は、グリシン、アラニン、バリン、ロイシン、およびイソロイシンであり;脂肪族ヒドロキシル側鎖を有するアミノ酸群は、セリンおよびスレオニンであり;アミド含有側鎖を有するアミノ酸群は、アスパラギンおよびグルタミンであり;芳香族側鎖を有するアミノ酸群は、フェニルアラニン、チロシン、およびトリプトファンであり;塩基性側鎖を有するアミノ酸群は、リジン、アルギニン、およびヒスチジンであり;そしてイオウ含有側鎖を有するアミノ酸群は、システインおよびメチオニンである。好ましい保存的アミノ酸置換群は:バリン−ロイシン−イソロイシン、フェニルアラニン−チロシン、リジン−アルギニン、アラニン−バリン、グルタミン酸−アスパラギン酸、およびアスパラギン−グルタミンである。
【0120】
[0133]本明細書に論じるように、抗体または免疫グロブリン分子のアミノ酸配列における重要でない変動は、アミノ酸配列中のこうした変動が、本明細書記載の抗体または免疫グロブリン分子に対する、少なくとも75%、より好ましくは少なくとも80%、90%、95%、そして最も好ましくは99%の配列同一性を維持するならば、本発明に含まれると意図される。特に、保存的アミノ酸置換が意図される。保存的置換は、関連側鎖を有するアミノ酸ファミリー内で起こるものである。遺伝的にコードされるアミノ酸は、一般的に、ファミリーに分けられる:(1)酸性=アスパラギン酸、グルタミン酸;(2)塩基性=リジン、アルギニン、ヒスチジン;(3)非極性=アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン;および(4)非荷電極性=グリシン、アスパラギン、グルタミン、システイン、セリン、スレオニン、チロシン。より好ましいファミリーは:セリンおよびスレオニンは、脂肪族ヒドロキシファミリーであり;アスパラギンおよびグルタミンは、アミド含有ファミリーであり;アラニン、バリン、ロイシンおよびイソロイシンは、脂肪族ファミリーであり;そしてフェニルアラニン、トリプトファン、およびチロシンは、芳香族ファミリーである。例えば、イソロイシンまたはバリンでのロイシン、グルタミン酸でのアスパラギン酸、セリンでのスレオニンの単一の置換、あるいは構造的に関連するアミノ酸でのアミノ酸の類似の置換は、特に、その置換がフレームワーク部位内のアミノ酸を伴わない場合、生じる分子の結合機能または特性に大きな影響を及ぼさないであろうと予測することは妥当である。アミノ酸変化によって、機能するペプチドが生じるかどうかは、ポリペプチド誘導体の比活性をアッセイすることによって、容易に決定可能である。アッセイは、本明細書に詳細に記載される。抗体または免疫グロブリン分子の断片または類似体は、一般の当業者によって容易に調製可能である。断片または類似体の好ましいアミノ末端およびカルボキシ末端は、機能ドメインの境界近くに存在する。構造ドメインおよび機能ドメインは、公的または私的な配列データベースに、ヌクレオチドおよび/またはアミノ酸配列データを比較することによって、同定可能である。好ましくは、コンピュータ化比較法を用いて、既知の構造および/または機能の他のタンパク質に存在する配列モチーフまたは予測されるタンパク質コンホメーションドメインを同定する。既知の三次元構造にフォールディングするタンパク質配列を同定する方法が知られる。Bowieら Science 253:164(1991)。したがって、前述の例は、当業者が、本明細書記載の抗体に一致して、構造ドメインおよび機能ドメインを定義するのに使用可能な、配列モチーフおよび構造コンホメーションを認識可能であることを示す。
【0121】
[0134]好ましいアミノ酸置換は:(1)タンパク質分解に対する感受性を減少させ、(2)酸化に対する感受性を減少させ、(3)タンパク質複合体を形成するため、結合アフィニティーを改変し、(4)結合アフィニティーを改変し、そして(4)こうした類似体に他の物理化学特性または機能特性を与えるかあるいはこうした類似体のこうした特性を修正するものである。類似体には、天然存在ペプチド配列以外の配列の多様な突然変異タンパク質が含まれうる。例えば、単数または多数のアミノ酸置換(好ましくは、保存的アミノ酸置換)を、天然存在配列において(好ましくは、分子間接触を形成するドメイン(単数または複数)外のポリペプチドの部分において)行うことも可能である。保存的アミノ酸置換は、親配列の構造特徴を実質的に変化させてはならない(例えば置換アミノ酸は、親配列に存在するらせんを破壊するか、または親配列を特徴付ける他の種類の二次構造を破壊する傾向があってはならない)。当該技術分野に認識されるポリペプチド二次構造および三次構造の例が、Proteins, Structures and Molecular Principles(Creighton監修, W.H. Freeman and Company, ニューヨーク(1984)); Introduction to Protein Structure(C. BrandenおよびJ. Tooze監修, Garland Publishing, ニューヨーク州ニューヨーク(1991));およびThorntonら Nature 354:105(1991)に記載され、これらは各々、本明細書に援用される。
【0122】
[0135]用語「ポリペプチド断片」は、本明細書において、アミノ末端および/またはカルボキシ末端欠失を有するが、残っているアミノ酸配列が、例えば、全長cDNA配列から推定される天然存在配列中の対応する位と同一であるポリペプチドを指す。断片は、典型的には、少なくとも長さ5、6、8、または10アミノ酸、好ましくは少なくとも長さ14アミノ酸、より好ましくは少なくとも長さ20アミノ酸、通常、少なくとも長さ50アミノ酸、そしてさらにより好ましくは少なくとも長さ70アミノ酸である。用語「類似体」は、本明細書において、推定されるアミノ酸配列の一部に実質的な同一性を有し、そして以下の特性の少なくとも1つを有する、少なくとも25アミノ酸のセグメントで構成されるポリペプチドを指す:(1)適切な結合条件下での、uPARへの特異的な結合、(2)適切なuPA/uPAR結合を遮断する能力、または(3)uPA活性を阻害する能力。典型的には、ポリペプチド類似体は、天然存在配列に関して保存的アミノ酸置換(または付加または欠失)を含む。類似体は、典型的には、少なくとも長さ20アミノ酸、好ましくは少なくとも長さ50アミノ酸以上であり、そしてしばしば、全長天然存在ポリペプチドと同じくらい長いことも可能である。
【0123】
[0136]ペプチド類似体は、一般的に、薬学産業において、テンプレート・ペプチドのものと類似の特性を持つ、非ペプチド薬剤として用いられる。これらの種類の非ペプチド化合物は、「ペプチド模倣体」(「peptide mimetics」または「peptidomimetics」)と称される。本明細書に援用される、Fauchere, J. Adv. Drug Res. 15:29(1986); VeberおよびFreidinger TINS p.392(1985);およびEvansら J. Med. Chem. 30:1229(1987)。こうした化合物は、しばしば、コンピュータ化分子モデリングの補助で開発される。療法的に有用なペプチドに構造的に類似のペプチド模倣体を用いて、同等の療法効果または予防効果を生じることも可能である。一般的に、ペプチド模倣体は、ヒト抗体などの模範(paradigm)ポリペプチド(すなわち生化学的特性または薬理学的活性を有するポリペプチド)に構造的に類似であるが、当該技術分野に周知の方法によって:−−CH2NH−−、−−CH2S−−、−−CH2−CH2−−、−−CH=CH−(シスおよびトランス)、−−COCH2−−、−−CH(OH)CH2−−、および−−CH2SO−−からなる群より選択される連結により、場合によって置換された1以上のペプチド連結を有する。コンセンサス配列の1以上のアミノ酸を、同じ種類のD−アミノ酸(例えばL−リジンの代わりにD−リジン)で体系的に置換して、より安定なペプチドを生成することも可能である。さらに、コンセンサス配列または実質的に同一なコンセンサス配列変動を含む、制約された(constrained)ペプチドを、当該技術分野に知られる方法(本明細書に援用される、RizoおよびGierasch Ann. Rev. Biochem. 61:387(1992))によって生成することも可能であり;これは例えば、ペプチドを環状化する、分子内ジスルフィド架橋を形成可能な内部システイン残基を付加することによる。
【0124】
[0137]本明細書において、用語「抗体」は、抗原の抗原性決定基の特徴に相補的な内部表面形状および電荷分布を持つ三次元結合空間を有するポリペプチド鎖のフォールディングから形成される、少なくとも1つの結合ドメインで構成されるポリペプチドまたはポリペプチド群を指す。抗体は、典型的には四量体型を有し、2つの同一のポリペプチド鎖対を含み、各々の対は、1つの「軽」鎖および1つの「重」鎖を有する。各軽鎖/重鎖対の可変領域は、抗体結合部位を形成する。
【0125】
[0138]本明細書において、標的化結合剤、標的化結合タンパク質、特異的結合タンパク質等の用語は、標的部位に優先的に結合する抗体またはその結合性断片を指す。1つの態様において、標的化結合剤は、1つの標的部位に対してのみ特異的である。他の態様において、標的化結合剤は、1より多い標的部位に特異的である。1つの態様において、標的化結合剤はモノクローナル抗体であってもよく、そして標的部位はエピトープであってもよい。
【0126】
[0139]抗体の「結合性断片」は、組換えDNA技術によって、あるいは損なわれていない(intact)抗体の酵素的または化学的切断によって産生される。結合性断片には、Fab、Fab’、F(ab’)2、Fv、Dabおよび一本鎖抗体が含まれる。「二重特異性」または「二官能性」抗体以外の抗体は、同一の各結合部位を有すると理解される。抗体は、過剰な抗体が、少なくとも約20%、40%、60%、または80%、そしてより一般的には約85%(in vitro競合結合アッセイで測定した際)を超えて、対抗受容体に結合する受容体の量を減少させる場合、対抗受容体への受容体の接着を、実質的に阻害する。
【0127】
[0140]抗体は、オリゴクローナル、ポリクローナル抗体、モノクローナル抗体、キメラ抗体、CDR移植抗体、多重特異性抗体、二重特異性抗体、触媒性抗体、キメラ抗体、ヒト化抗体、完全ヒト抗体、抗イディオタイプ抗体、ならびに可溶性型または結合型で標識されていてもよい抗体、ならびに、単独の、または既知の技術によって提供される他のアミノ酸配列と組み合わせたその断片、変異体または誘導体であってもよい。抗体はいかなる種由来であってもよい。用語、抗体にはまた、本発明の抗体の結合性断片も含まれる;典型的な断片には、Fv、Fab、Fab’、一本鎖抗体(svFC)、二量体性可変領域(ディアボディ)およびジスルフィド安定化可変領域(dsFv)が含まれる。
【0128】
[0141]用語「エピトープ」には、免疫グロブリンまたはT細胞受容体に特異的に結合可能ないかなるタンパク質決定基も含まれる。エピトープ決定基は、通常、アミノ酸または糖側鎖などの分子の化学的活性表面群からなり、そして常にではないが、特定の三次元構造特性とともに、特定の電荷特性を有することも可能である。抗体は、解離定数が≦1μM、好ましくは≦100nM、そして最も好ましくは≦10nMである場合、抗原に特異的に結合すると言われる。
【0129】
[0142]用語「剤」は、本明細書において、化学的化合物、化学的化合物の混合物、生物学的巨大分子、または生物学的物質から作製される抽出物を意味する。
[0143]uPARポリペプチドに関する「活性である」または「活性」は、天然uPARポリペプチドの生物学的または免疫学的活性を有するuPARポリペプチドの部分を指す。「生物学的」は、本明細書で用いた際、天然uPARポリペプチドの活性から生じる生物学的機能を指す。好ましいuPAR生物学的活性には、例えば、uPARが誘導する細胞接着および浸潤が含まれる。
【0130】
[0144]「哺乳動物」は、本明細書で用いた際、哺乳動物と見なされるいかなる動物も指す。好ましくは、哺乳動物はヒトである。
[0145]酵素、パパインでの抗体の消化は、「Fab」断片としても知られる、2つの同一の抗原結合性断片、および抗原結合活性を持たないが、結晶化する能力を有する「Fc」断片を生じる。酵素、ペプシンでの抗体の消化は、抗体分子の2つのアームが連結されたままであり、そして2つの抗原結合部位を含む、F(ab’)2断片を生じる。F(ab’)2断片は、抗原を架橋する能力を有する。
【0131】
[0146]「Fv」は、本明細書で用いた際、抗原認識部位および抗原結合部位の両方を保持する抗体の最少断片を指す。
[0147]「Fab」は、本明細書で用いた際、軽鎖の定常ドメインおよび重鎖のCH1ドメインを含む抗体断片を指す。
【0132】
[0148]「Dab」は、本明細書で用いた際、ヒト抗体の最小機能結合単位である抗体断片を指す。
[0149]用語「mAb」は、モノクローナル抗体を指す。
【0133】
[0150]「リポソーム」は、本明細書で用いた際、本発明のuPARポリペプチド、またはこうしたuPARポリペプチドに対する抗体を含んでもよい薬剤を哺乳動物に送達するのに有用でありうる小胞を指す。
【0134】
[0151]「標識」または「標識された」は、本明細書において、ポリペプチドに対する検出可能部分、例えば放射標識、蛍光標識、酵素標識、化学発光標識基またはビオチニル基の付加を指す。放射性同位体または放射性核種には、3H、14C、15N、35S、90Y、99Tc、111In、125I、131Iが含まれてもよく、蛍光標識には、ローダミン、ランタニド、リンまたはFITCが含まれてもよく、そして酵素標識には、西洋ワサビ(horseradish)・ペルオキシダーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、アルカリホスファターゼが含まれてもよい。
【0135】
[0152]用語「薬学的剤または薬剤」は、本明細書において、患者に適切に投与された際、所望の療法効果を誘導可能な化学的化合物または組成物を指す。本明細書の他の化学用語は、The McGraw−Hill Dictionary of Chemical Terms(Parker, S.監修, McGraw−Hill, サンフランシスコ(1985))、(本明細書に援用される)に例示されるように、当該技術分野における慣用的用法にしたがって用いられる。
【0136】
[0153]本明細書において、「実質的に純粋な」は、対象種が、存在する主な種である(すなわちモル濃度に基づいて、組成物中の他の個々の種いずれよりもより豊富である)ことを意味し、そして好ましくは、実質的に純粋な分画は、対象種が、存在するすべての巨大分子種の少なくとも約50パーセント(モル濃度に基づいて)を構成する組成物である。一般的に、実質的に純粋な組成物は、組成物中に存在するすべての巨大分子種の約80%より多くを構成し、より好ましくは、約85%、90%、95%、および99%より多くを構成するであろう。最も好ましくは、対象種は、本質的に均質に精製され(慣用的検出法によって、組成物中に混入種が検出不能である)、ここで組成物は本質的に単一の巨大分子種からなる。
【0137】
[0154]用語「患者」には、ヒトおよび獣医学的被験体が含まれる。
ヒト抗体および抗体のヒト化
[0155]ヒト抗体は、ネズミまたはラットの可変および/または定常領域を所持する抗体に付随する問題のいくつかを回避する。こうしたネズミまたはラット由来タンパク質の存在は、抗体の迅速なクリアランスを導く可能性もあるし、あるいは患者によって抗体に対する免疫応答が生成されるのを導く可能性もある。ネズミまたはラット由来抗体の利用を回避するため、げっ歯類、他の哺乳動物または動物が完全ヒト抗体を産生するように、げっ歯類、他の哺乳動物または動物内に、機能するヒト抗体遺伝子座を導入することによって、完全ヒト抗体を生成してもよい。
【0138】
[0156]完全ヒト抗体を生成するための1つの方法は、ヒト重鎖遺伝子座およびカッパ軽鎖遺伝子座の、1000kbまでであるが、1000kb未満である大きさの生殖系列設定断片を含有するように操作されている、マウスのXenoMouse(登録商標)系統の使用を通じる。Mendezら Nature Genetics 15:146−156(1997)、ならびにGreenおよびJakobovits J. Exp. Med. 188:483−495(1998)を参照されたい。XenoMouse(登録商標)系統は、Abgenix, Inc.(カリフォルニア州フレモント)より入手可能である。
【0139】
[0157]マウスのXenoMouse(登録商標)系統の産生は、米国特許出願第07/466,008号、1990年1月12日出願、第07/610,515号、1990年11月8日出願、第07/919,297号、1992年7月24日出願、第07/922,649号、1992年7月30日出願、第08/031,801号、1993年3月15日出願、第08/112,848号、1993年8月27日出願、第08/234,145号、1994年4月28日出願、第08/376,279号、1995年1月20日出願、第08/430,938号、1995年4月27日出願、第08/464,584号、1995年6月5日出願、第08/464,582号、1995年6月5日出願、第08/463,191号、1995年6月5日出願、第08/462,837号、1995年6月5日出願、第08/486,853号、1995年6月5日出願、第08/486,857号、1995年6月5日出願、第08/486,859号、1995年6月5日出願、第08/462,513号、1995年6月5日出願、第08/724,752号、1996年10月2日出願、第08/759,620号、1996年12月3日出願、米国公報第2003/0093820号、2001年11月30日出願、ならびに米国特許第6,162,963号、第6,150,584号、第6,114,598号、第6,075,181号、および第5,939,598号、および日本国特許第3 068 180 B2号、第3 068 506 B2号、および第3 068 507 B2号にさらに論じられ、そして描写される。欧州特許第EP 0 463 151 B1号、1996年6月12日付与公表(grant published)、国際特許出願第WO 94/02602号、1994年2月3日公表、国際特許出願第WO 96/34096号、1996年10月31日公表、第WO 98/24893号、1998年6月11日公表、第WO 00/76310号、2000年12月21日公表もまた、参照されたい。上記引用特許、出願、および参考文献各々の開示は、その全体が本明細書に援用される。
【0140】
[0158]別のアプローチにおいて、GenPharm International, Inc.を含む他のグループは、「ミニ遺伝子座」アプローチを利用した。ミニ遺伝子座アプローチでは、Ig遺伝子座由来の片(個々の遺伝子)の包含を通じて、外因性Ig遺伝子座を模倣する。したがって、1以上のVH遺伝子、1以上のDH遺伝子、1以上のJH遺伝子、mu定常領域、および通常は第二の定常領域(好ましくはガンマ定常領域)を、動物内に挿入するための構築物になるように形成する。このアプローチは、Suraniらに対する米国特許第5,545,807号、ならびに各々、LonbergおよびKayに対する米国特許第5,545,806号、第5,625,825号、第5,625,126号、第5,633,425号、第5,661,016号、第5,770,429号、第5,789,650号、第5,814,318号、第5,877,397号、第5,874,299号、および第6,255,458号、KrimpenfortおよびBernsに対する米国特許第5,591,669号および第6,023,010号、Bernsらに対する米国特許第5,612,205号、第5,721,367号、および第5,789,215号、ならびにChoiおよびDunnに対する米国特許第5,643,763号、ならびにGenPharm International、米国特許出願第07/574,748号、1990年8月29日出願、第07/575,962号、1990年8月31日出願、第07/810,279号、1991年12月17日出願、第07/853,408号、1992年3月18日出願、第07/904,068号、1992年6月23日出願、第07/990,860号、1992年12月16日出願、第08/053,131号、1993年4月26日出願、第08/096,762号、1993年7月22日出願、第08/155,301号、1993年11月18日出願、第08/161,739号、1993年12月3日出願、第08/165,699号、1993年12月10日出願、第08/209,741号、1994年3月9日出願に記載され、これらの開示は本明細書に援用される。その開示が全体として本明細書に援用される、欧州特許第0 546 073 B1号、国際特許出願第WO 92/03918号、第WO 92/22645号、第WO 92/22647号、第WO 92/22670号、第WO 93/12227号、第WO 94/00569号、第WO 94/25585号、第WO 96/14436号、第WO 97/13852号、および第WO 98/24884号、ならびに米国特許第5,981,175号もまた、参照されたい。その開示が全体として本明細書に援用される、Taylorら、1992、Chenら、1993、Tuaillonら、1993、Choiら、1993、Lonbergら(1994)、Taylorら(1994)、およびTuaillonら(1995)、Fishwildら(1996)もさらに参照されたい。
【0141】
[0159]キリンもまた、微小細胞(microcell)融合を通じて、染色体の大きな片、または全染色体が導入されているマウスからのヒト抗体の生成を立証した。その開示が本明細書に援用される、欧州特許出願第773 288号および第843 961号を参照されたい。さらに、キリンのTcマウスとMedarexのミニ遺伝子座(Humab)マウスの交雑育種の結果である、KMTMマウスが生成された。これらのマウスは、キリン・マウスのヒトIgHトランス染色体(transchromosome)およびGenpharmマウスのカッパ鎖導入遺伝子を所持する(Ishidaら, Cloning Stem Cells, (2002)4:91−102)。
【0142】
[0160]ヒト抗体はまた、in vitro法によっても得られうる。適切な例には、限定されるわけではないが、ファージディスプレイ(CAT、Morphosys、Dyax、Biosite/Medarex、Xoma、Symphogen、Alexion(以前のProliferon)、Affimed)リボソームディスプレイ(CAT)、酵母ディスプレイ等が含まれる。
【0143】
抗体の調製
[0161]本明細書記載の抗体は、以下に記載するように、XenoMouse(登録商標)技術の利用を通じて調製された。その結果、こうしたマウスは、ヒト免疫グロブリン分子および抗体を産生可能であり、そしてネズミ免疫グロブリン分子および抗体の産生は欠損している。これを達成するために利用される技術は、本明細書の背景セクションに開示する特許、出願、および参考文献に開示される。しかし、特に、マウスおよび該マウス由来の抗体のトランスジェニック産生の好ましい態様が、米国特許出願第08/759,620号、1996年12月3日出願、ならびに国際特許出願第WO 98/24893号、1998年6月11日公表、および第WO 00/76310号、2000年12月21日公表に開示され、これらの開示は、本明細書に援用される。その開示が本明細書に援用される、Mendezら Nature Genetics 15:146−156(1997)もまた参照されたい。
【0144】
[0162]こうした技術の使用を通じて、多様な抗原に対する完全ヒト・モノクローナル抗体を産生した。本質的に、マウスのXenoMouse(登録商標)系統を、目的の抗原(例えばuPAR)で免疫し、リンパ系細胞(B細胞など)を過免疫(hyper−immunized)マウスから回収し、そして回収したリンパ球を骨髄腫型細胞株と融合させて、不死ハイブリドーマ細胞株を調製する。これらのハイブリドーマ細胞株をスクリーニングし、そして選択して、目的の抗原に特異的な抗体を産生するハイブリドーマ細胞株を同定する。本明細書に提供するのは、uPARに特異的な抗体を産生する多数のハイブリドーマ細胞株の産生法である。さらに、本明細書に提供するのは、こうした抗体の重鎖および軽鎖のヌクレオチドおよびアミノ酸配列分析を含む、こうした細胞株によって産生される抗体の性質決定である。
【0145】
[0163]あるいは、骨髄腫細胞に融合させてハイブリドーマを生成する代わりに、B細胞を直接アッセイしてもよい。例えば、CD19+ B細胞を過免疫XenoMouse(登録商標)マウスから単離し、そして増殖させ、そして抗体分泌形質細胞に分化させてもよい。次いで、細胞上清由来の抗体を、uPAR免疫原に対する反応性に関して、ELISAによってスクリーニングする。また、上清を、uPARの断片に対する免疫反応性に関してスクリーニングして、uPAR上の機能的に関心が持たれるドメインに対する結合に関して、異なる抗体をさらにマッピングしてもよい。また、他の関連ヒト受容体に対して、そしてuPARのラット、マウス、およびカニクイザルなどの非ヒト霊長類のオルソログに対して、抗体をスクリーニングしてもよく、後者は、種交差反応性を決定するためである。個々のウェルまたはプールしたウェルのいずれかからハイブリドーマを作製する融合を含む多様な方法によって、あるいはEBVでの感染または既知の不死化遺伝子によるトランスフェクション、そしてその後の適切な培地中でのプレーティングによって、目的の抗体を含有するウェル由来のB細胞を、不死化してもよい。あるいは、次いで、uPAR特異的溶血プラークアッセイ(例えばBabcookら, Proc. Natl. Acad. Sci. USA 93:7843−48(1996)を参照されたい)を用いて、望ましい特異性を持つ抗体を分泌する単一の形質細胞を単離する。溶解の標的とされる細胞は、好ましくは、uPAR抗原でコーティングされたヒツジ赤血球(SRBC)である。
【0146】
[0164]目的の免疫グロブリンおよび補体を分泌する形質細胞を含有するB細胞培養の存在下で、プラークの形成は、目的の形質細胞を取り巻くヒツジ赤血球の、uPARが仲介する特異的溶解を示す。プラーク中心の単一の抗原特異的形質細胞を単離してもよく、そして抗体の特異性をコードする遺伝的情報を、単一の形質細胞から単離する。逆転写後のPCR(RT−PCR)を用いて、抗体の重鎖および軽鎖の可変領域をコードするDNAをクローニングしてもよい。次いで、こうしたクローニングされたDNAを、適切な発現ベクター、好ましくは、pcDNAなどのベクターカセット、より好ましくは免疫グロブリン重鎖および軽鎖の定常ドメインを含有するpcDNAベクターに、さらに挿入してもよい。次いで、生成したベクターを、宿主細胞、例えばHEK293細胞、CHO細胞内にトランスフェクションし、そして転写を誘導するか、形質転換体を選択するか、または所望の配列をコードする遺伝子を増幅するのに適するように修飾した、慣用的な栄養培地中で培養してもよい。
【0147】
[0165]一般的に、融合ハイブリドーマによって産生される抗体は、完全ヒト・カッパまたはラムダ軽鎖を含むヒトIgG2重鎖であった。本明細書に記載する抗体は、ヒトIgG4重鎖ならびにIgG2重鎖を所持する。抗体はまた、IgG1を含む他のヒト・アイソタイプのものであってもよい。抗体は、高いアフィニティーを所持し、固相および溶液相技術によって測定した際、典型的には約10−6〜約10−12Mまたはそれ未満のKdを所持する。uPARの活性を阻害するには、少なくとも10−11MのKDを所持する抗体が好ましい。
【0148】
[0166]認識されるであろうように、ハイブリドーマ細胞株以外の細胞株で、抗体を発現させてもよい。特定の抗体をコードする配列を用いて、適切な哺乳動物宿主細胞を形質転換してもよい。形質転換は、例えばウイルスにおける(またはウイルスベクター内への)ポリヌクレオチドのパッケージング、およびウイルス(またはベクター)での宿主細胞の形質導入を含む、宿主細胞内へのポリヌクレオチドの導入のために知られる任意の方法によっても、または米国特許第4,399,216号、第4,912,040号、第4,740,461号、および第4,959,455号(これらの特許は本明細書に援用される)に例示されるように、当該技術分野に知られるトランスフェクション法によってもよい。用いる形質転換法は、形質転換しようとする宿主に応じる。哺乳動物細胞内に異種ポリヌクレオチドを導入するための方法は、当該技術分野に周知であり、そしてこれには、デキストラン仲介トランスフェクション、リン酸カルシウム沈殿、ポリブレン仲介トランスフェクション、プロトプラスト融合、エレクトロポレーション、リポソーム中のポリヌクレオチド(単数または複数)の被包、および核内へのDNAの直接マイクロインジェクションが含まれる。
【0149】
[0167]発現の宿主として利用可能な哺乳動物細胞株は当該技術分野に周知であり、そしてアメリカン・タイプ・カルチャー・コレクション(ATCC)から入手可能な多くの不死化細胞株が含まれ、限定されるわけではないが、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎臓(BHK)細胞、サル腎臓細胞(COS)、ヒト肝細胞癌細胞(例えばHep G2)、ヒト上皮腎293細胞、およびいくつかの他の細胞株が含まれる。どの細胞株が高発現レベルを有し、そして恒常的なuPAR結合特性を持つ抗体を産生するかを決定することによって、特に好ましい細胞株を選択する。
【0150】
[0168]mAbがuPAR活性を有意に中和する能力(以下の実施例において立証されるようなもの)に基づいて、これらの抗体は、uPAR発現から生じる症状および状態を治療する際に療法効果を有するであろう。特定の態様において、本明細書の抗体および方法は、uPARが誘導する細胞接着、浸潤および細胞内シグナル伝達から生じる症状の治療に関する。
【0151】
[0169]本発明の別の側面にしたがって、uPARの生物学的活性のアンタゴニスト、および薬学的に許容されうるキャリアーを含む薬学的組成物を提供する。1つの態様において、アンタゴニストは抗体を含む。本発明の別の側面にしたがって、uPARの生物学的活性のアンタゴニスト、および薬学的に許容されうるキャリアーを含む、薬学的組成物を提供する。1つの態様において、アンタゴニストは抗体を含む。
【0152】
[0170]抗uPAR抗体は、患者試料におけるuPARの検出に有用であり、そしてしたがって、本明細書に記載するような疾患状態の診断として有用である。さらに、uPA活性を有意に阻害する能力(以下の実施例に立証するようなもの)に基づいて、抗uPAR抗体は、uPAR発現から生じる症状および状態を治療する際に療法効果を有する。特定の態様において、本明細書の抗体および方法は、uPARが誘導する細胞接着、浸潤および細胞内シグナル伝達から生じる症状の治療に関する。さらなる態様は、本明細書記載の抗体および方法を用いて、新生物疾患、例えば、黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、および膵臓癌を含む、細胞接着および浸潤関連疾患を治療することを伴う。抗体はまた、関節炎、アテローム性動脈硬化症および血管新生を伴う疾患における細胞接着および/または浸潤を治療する際にも有用でありうる。
【0153】
療法的投与および配合
[0171]本発明の態様には、疾患に対する治療として有用な抗uPAR抗体の無菌薬学的配合物が含まれる。こうした配合物は、uPAのその受容体uPARへの結合を阻害し、それによって、例えば、血清または組織uPARが異常に上昇している病的状態を有効に治療するであろう。抗uPAR抗体は、好ましくは、uPAを強力に阻害し、そして好ましくは、ヒトにおける低頻度の投薬を可能にする、適切な作用期間を有する。作用期間延長は、皮下または筋内注射などの別の非経口投与経路による、より頻繁でなく、そしてより好適な投薬スケジュールを可能にするであろう。
【0154】
[0172]例えば、抗体の凍結乾燥および再構成の前または後に、無菌ろ過膜を通じたろ過によって、無菌配合物を生成してもよい。抗体は、通常、凍結乾燥型で、または溶液中で、保存されるであろう。療法抗体組成物は、一般的に、無菌アクセスポートを有する容器、例えば静脈内溶液バッグ、または皮下注射針によって貫通可能な栓などの、配合物の回収を可能にするアダプターを有するバイアルに入れられる。
【0155】
[0173]抗体投与経路は、既知の方法にしたがって、例えば、静脈内、腹腔内、脳内、筋内、眼内、動脈内、クモ膜下腔内、吸入または病巣内経路による注射または注入であるか、腫瘍部位への直接注射であるか、あるいは以下に示すような持続放出系による。抗体は、好ましくは、注入によって、またはボーラス注射によって、連続投与される。
【0156】
[0174]療法的に使用しようとする抗体の有効量は、例えば、療法目的、投与経路、および患者の状態に応じるであろう。したがって、最適療法効果を得るために、治療専門家が、必要に応じて、投薬量を力価決定し、そして投与経路を修飾することが好ましい。典型的には、臨床医は、望ましい効果を達成する投薬量に達するまで、抗体を投与するであろう。この療法の進行は、慣用的アッセイによって、または本明細書記載のアッセイによって、容易に監視される。
【0157】
[0175]本明細書に記載するような抗体は、薬学的に許容されうるキャリアーと混合して調製可能である。この療法組成物を、静脈内投与してもよいし、あるいは好ましくは液体または粉末エアロゾル(凍結乾燥)として、鼻または肺を通じて投与してもよい。組成物はまた、所望に応じて、非経口投与してもまたは皮下投与してもよい。全身投与する場合、療法組成物は、無菌、発熱物質不含で、そしてpH、等張性、および安定性を十分顧慮して、非経口的に許容されうる溶液中になければならない。これらの条件は、当業者に知られる。簡潔には、所望の度合いの純度を有する化合物を、薬学的に許容されうるキャリアー、賦形剤、または安定化剤と混合することによって、保存または投与のために、本明細書記載の化合物の投薬配合物を調製する。こうした物質は、使用する投薬量および濃度で、レシピエントに対して毒性でなく、そしてこうした物質には、TRIS HCl、リン酸、クエン酸、酢酸、および他の有機酸塩などの緩衝剤;アスコルビン酸などの酸化防止剤;ポリアルギニンなどの低分子量(約10残基未満)ペプチド、血清アルブミン、ゼラチン、または免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン酸、アスパラギン酸、またはアルギニンなどのアミノ酸;単糖、二糖、およびセルロースもしくはその誘導体、グルコース、マンノース、またはデキストリンを含む他の炭水化物;EDTAなどのキレート剤;マンニトールまたはソルビトールなどの糖アルコール;TWEEN、PLURONICSまたはポリエチレングリコールなどのナトリウムおよび/または非イオン性界面活性剤などの対イオンが含まれる。
【0158】
[0176]Remington: The Science and Practice of Pharmacy(第20版, Lippincott Williams & Wilkens Publishers(2003))に記載されるように、慣用的薬学的実施にしたがって、注射用の無菌組成物を配合してもよい。例えば、水、あるいはゴマ油、ピーナツ油または綿実油のような天然存在植物油、あるいはオレイン酸エチル等のような合成脂肪性ビヒクルなどの薬学的に許容されうるキャリアー中での活性化合物の溶解または懸濁が望ましい可能性もある。許容される薬学的実施にしたがって、緩衝剤、保存剤、酸化防止剤等を取り込んでもよい。
【0159】
[0177]持続放出調製物の適切な例には、ポリペプチドを含有する固形疎水性ポリマーの半透性マトリックスが含まれ、こうしたマトリックスは、成形された物品、フィルムまたはマイクロカプセルの形である。持続放出マトリックスの例には、ポリエステル、ヒドロゲル(例えば、Langerら, J. Biomed Mater. Res., (1981)15:167−277およびLanger, Chem. Tech., (1982)12:98−105に記載されるようなポリ(2−ヒドロキシエチル−メタクリレート)、またはポリ(ビニルアルコール))、ポリラクチド(米国特許第3,773,919号、EP 58,481)、L−グルタミン酸およびガンマ・エチル−L−グルタメートのコポリマー(Sidmanら, Biopolymers, (1983)22:547−556)、分解不能エチレン−酢酸ビニル(Langerら、上記)、分解可能乳酸−グリコール酸コポリマー、例えばLUPRON DepotTM(乳酸−グリコール酸コポリマー、および酢酸ロイプロリドで構成される注射可能微小球体)、およびポリ−(D)−(−)−3−ヒドロキシ酪酸(EP 133,988)が含まれる。
【0160】
[0178]エチレン−酢酸ビニルおよび乳酸−グリコール酸などのポリマーは、100日間に渡って分子の放出を可能にする一方、特定のヒドロゲルは、より短い期間でタンパク質を放出する。被包されたタンパク質が、体内に長期間残ると、37℃で湿気に曝露された結果として、変性するかまたは凝集し、生物学的活性の喪失およびもしかすると免疫原性の変化を生じる可能性もある。関与する機構に応じて、タンパク質安定化のための合理的戦略を考案してもよい。例えば、凝集機構が、ジスルフィド交換を通じた分子間S−S結合形成であることが発見されたならば、スルフィドリル残基を修飾し、酸性溶液から凍結乾燥させ、水分含量を調節し、適切な添加剤を用い、そして特定のポリマーマトリックス組成を発展させることによって、安定化を達成してもよい。
【0161】
[0179]持続放出組成物にはまた、結晶を懸濁中に維持することが可能な適切な配合物中に懸濁された抗体の結晶の調製物も含まれる。これらの調製物は、皮下または腹腔内注射されると、持続放出効果を生じうる。他の組成物にはまた、リポソームに捕捉された抗体も含まれる。こうした抗体を含有するリポソームは、それ自体知られる方法によって調製される:米国特許第DE 3,218,121号; Epsteinら, Proc. Natl. Acad. Sci. USA, (1985)82:3688−3692; Hwangら, Proc. Natl. Acad. Sci. USA, (1980)77:4030−4034; EP 52,322; EP 36,676; EP 88,046; EP 143,949; 142,641;日本国特許出願第83−118008号;米国特許第4,485,045号および第4,544,545号;ならびにEP 102,324。
【0162】
[0180]所定の患者に対する抗体配合物の投薬量は、疾患の重症度および種類、体重、性別、食餌、投与時間および経路、他の薬剤および他の関連する臨床要因を含む、薬剤作用を修飾することが知られる多様な要因を考慮して、主治医によって決定されるであろう。in vitro法またはin vivo法のいずれかによって、療法的有効投薬量を決定してもよい。
【0163】
[0181]療法的に使用しようとする、本明細書記載の抗体の有効量は、例えば、療法目的、投与経路、および患者の状態に応じるであろう。したがって、治療専門家が、投薬量を力価決定し、そして最適療法効果を得るために、必要に応じて、投与経路を修飾することが好ましい。典型的な1日投薬量は、上述の要因に応じて、約0.001mg/kg、0.01mg/kg、0.1mg/kg、1mg/kg、10mg/kgから最大100mg/kg、1000mg/kg、10000mg/kgまでの範囲、またはそれより多くてもよい。典型的には、臨床医は、望ましい効果を達成する投薬量に達するまで、療法抗体を投与するであろう。この療法の進行は、慣用的アッセイによって、または本明細書に記載するように、容易に監視される。
【0164】
[0182]本明細書の組成物および方法にしたがった、療法実体の投与は、改善された輸送、送達、耐性等を提供するために、配合物内に取り込まれる、適切なキャリアー、賦形剤、および他の剤とともに投与されるであろうことが認識されるであろう。これらの配合物には、例えば、粉末、ペースト、軟膏、ゼリー、ワックス、油、脂質、脂質(陽イオン性または陰イオン性)含有小胞(LipofectinTMなど)、DNAコンジュゲート、無水吸収ペースト、水中油および油中水エマルジョン、エマルジョン・カルボワックス(多様な分子量のポリエチレングリコール)、半固体ゲル、およびカルボワックス含有半固体混合物が含まれる。前述の混合物のいずれも、配合物中の活性成分が配合によって不活化されず、そして配合物が投与経路に生理学的に適合し、そして耐性であるならば、本発明にしたがった治療および療法において適切でありうる。薬学的化学者に周知の配合物、賦形剤、およびキャリアーに関連するさらなる情報に関しては、Baldrick P. “Pharmaceutical excipient development: the need for preclinical guidance” Regul. Toxicol. Pharmacol. 32(2):210−8(2000), Wang W. “Lyophilization and development of solid protein pharmaceuticals.” Int. J. Pharm. 203(1−2):1−60(2000), Charman WN “Lipids, lipophilic drugs, and oral drug delivery−some emerging concepts.” J Pharm Sci .89(8):967−78(2000), Powellら “Compendium of excipients for parenteral formulations” PDA J Pharm Sci Technol. 52:238−311(1998)、およびこれら文献中の引用文献もまた、参照されたい。
【0165】
他の療法剤の設計および生成
[0183]本発明にしたがって、そしてuPARに関する、本明細書で産生し、そして性質決定する抗体の活性に基づいて、抗体部分より勝る他の療法様式の設計を容易にする。こうした様式には、限定されるわけではないが、進化した抗体療法剤、例えば、二重特異性抗体、免疫毒素、および放射標識療法、単一ドメイン抗体、抗体断片、例えば、Fab、Fab’、F(ab’)2、FvまたはDab、ペプチド療法剤の生成、新規足場中のuPAR結合ドメイン、遺伝子治療、特にイントラボディ、アンチセンス療法、および小分子が含まれる。
【0166】
[0184]進化した抗体療法剤の生成と関連して、補体結合が望ましい特質である場合、例えば、二重特異性抗体、免疫毒素、または放射標識の使用を通じて、細胞殺傷のための補体に対する依存性を回避することも可能でありうる。
【0167】
[0185](i)一方はuPARに対する特異性を持ち、そして他方は第二の分子に対する特異性を持ち、ともにコンジュゲート化されている、2つの抗体、(ii)uPARに対して特異的な1つの鎖、および第二の分子に対して特異的な第二の鎖を有する、単一抗体、または(iii)uPARおよび他の分子に対する特異性を有する一本鎖抗体を含む、二重特異性抗体を生成してもよい。こうした二重特異性抗体は、周知である技術を用いて生成可能であり;例えば(i)および(ii)に関連して、例えば、Fangerら Immunol Methods 4:72−81(1994)、ならびにWrightおよびHarris、上記を、そして(iii)に関連して、例えば、Trauneckerら Int. J. Cancer(補遺)7:51−52(1992)を参照されたい。どちらの場合も、限定されるわけではないが、CD16またはCD64(例えばDeoら Immunol. Today 18:127(1997)を参照されたい)、あるいはCD89(例えばValeriusら Blood 90:4485−4492(1997))を含む、重鎖活性化受容体に対して、第二の特異性を作製してもよい。
【0168】
[0186]当業者に周知の技術を利用して、免疫毒素として作用するように、抗体を修飾することもまた可能である。例えば、Vitetta Immunol Today 14:252(1993)を参照されたい。また、米国特許第5,194,594号も参照されたい。放射標識抗体の調製と関連して、当該技術分野に周知の技術を利用して、こうした修飾抗体を容易に調製可能である。例えば、Junghansら Cancer Chemotherapy and Biotherapy中 655−686(第2版, ChafnerおよびLongo監修, Lippincott Raven(1996))を参照されたい。また、米国特許第4,681,581号、第4,735,210号、第5,101,827号、第5,102,990号(RE 35,500)、第5,648,471号、および第5,697,902号もまた参照されたい。
【0169】
併用
[0187]本明細書において定義する抗腫瘍治療を、単一療法として適用してもよいし、または抗腫瘍治療は、本発明の化合物に加えて、慣用的な手術または放射線療法または化学療法を伴ってもよい。こうした化学療法には、1以上の以下のカテゴリーの抗腫瘍剤が含まれてもよい:
(i)内科的腫瘍学で用いられるような、他の抗増殖/抗新生物薬剤およびその併用、例えばアルキル化剤(例えばシスプラチン、オキサリプラチン、カルボプラチン、シクロホスファミド、ナイトロジェンマスタード、メルファラン、クロラムブシル、ブスルファン、テモゾラミド(temozolamide)およびニトロソ尿素);代謝拮抗剤(例えば、ゲムシタビン、ならびに5−フルオロウラシルおよびテガフールのようなフルオロピリミジンなどの抗葉酸剤、ラルチトレキセド、メトトレキサート、シトシンアラビノシドおよびヒドロキシ尿素);抗腫瘍抗生物質(例えばアドリアマイシン、ブレオマイシン、ドキソルビシン、ダウノマイシン、エピルビシン、イダルビシン、マイトマイシン−C、ダクチノマイシンおよびミトラマイシンのようなアントラサイクリン);抗有糸分裂剤(例えばビンクリスチン、ビンブラスチン、ビンデシンおよびビノレルビンのようなビンカアルカロイド、ならびにタキソールおよびタキソテールのようなタキソイド、ならびにポロキナーゼ阻害剤);およびトポイソメラーゼ阻害剤(例えばエトポシドおよびテニポシドのようなエピポドフィロトキシン、アムサクリン、トポテカンならびにカンプトテシン);
(ii)細胞増殖抑制剤、例えば抗エストロゲン剤(例えばタモキシフェン、フルベストラント、トレミフェン、ラロキシフェン、ドロロキシフェンおよびヨードキシフェン)、抗アンドロゲン剤(例えばビカルタミド、フルタミド、ニルタミドおよび酢酸シプロテロン)、LHRHアンタゴニストまたはLHRHアゴニスト(例えばゴセレリン、リュープロレリンおよびブセレリン)、プロゲストゲン(例えば酢酸メゲストロール)、アロマターゼ阻害剤(例えばアナストロゾール、レトロゾール、ボラゾール(vorazole)およびエキセメスタン)および5αレダクターゼの阻害剤、例えばフィナステリド;
(iii)抗浸潤剤(例えば、4−(6−クロロ−2,3−メチレンジオキシアニリノ)−7−[2−(4−メチルピペラジン−1−イル)エトキシ]−5−テトラヒドロピラン−4−イルオキシキナゾリン(AZD0530;国際特許出願WO 01/94341)およびN−(2−クロロ−6−メチルフェニル)−2−{6−[4−(2−ヒドロキシエチル)ピペラジン−1−イル]−2−メチルピリミジン−4−イルアミノ}チアゾール−5−カルボキサミド(ダサチニブ、BMS−354825; J. Med. Chem., 2004, 47, 6658−6661)のようなc−Srcキナーゼファミリー阻害剤、ならびにマリマスタットのようなメタロプロテイナーゼ阻害剤、ウロキナーゼ・プラスミノーゲン活性化因子受容体機能の他の阻害剤、またはカテプシンの阻害剤、セリンプロテアーゼ、例えばマトリプターゼ、ヘプシン、ウロキナーゼの阻害剤、ヘパラナーゼの阻害剤);
(iv)増殖因子機能の阻害剤:例えばこうした阻害剤には、増殖因子抗体および増殖因子受容体抗体(例えば抗erbB2抗体トラスツズマブ[ハーセプチンTM]、抗EGFR抗体パニツムマブ、抗erbB1抗体セツキシマブ[エルビタックス、C225]およびSternら Critical reviews in oncology/haematology, 2005, Vol.54, pp11−29に開示される任意の増殖因子または増殖因子受容体)が含まれ;こうした阻害剤にはまた、チロシンキナーゼ阻害剤、例えば上皮増殖因子ファミリーの阻害剤(例えばEGFRファミリー・チロシンキナーゼ阻害剤、例えばN−(3−クロロ−4−フルオロフェニル)−7−メトキシ−6−(3−モルホリノプロポキシ)キナゾリン−4−アミン(ゲフィチニブ、ZD1839)、N−(3−エチニルフェニル)−6,7−ビス(2−メトキシエトキシ)キナゾリン−4−アミン(エルロチニブ、OSI−774)および6−アクリルアミド−N−(3−クロロ−4−フルオロフェニル)−7−(3−モルホリノプロポキシ)−キナゾリン−4−アミン(CI 1033)、ラパチニブなどのerbB2チロシンキナーゼ阻害剤、肝細胞増殖因子ファミリーの阻害剤、イマチニブなどの血小板由来増殖因子ファミリーの阻害剤、セリン/スレオニンキナーゼの阻害剤(例えば、ファルネシル・トランスフェラーゼ阻害剤などのRas/Rafシグナル伝達阻害剤、例えばソラフェニブ(BAY43−9006))、MEKおよび/またはAKTキナーゼを通じた細胞シグナル伝達の阻害剤、肝細胞増殖因子ファミリーの阻害剤、c−kit阻害剤、ablキナーゼ阻害剤、IGF受容体(インスリン様増殖因子)キナーゼ阻害剤;オーロラキナーゼ阻害剤(例えば、AZD1152、PH739358、VX−680、MLN8054、R763、MP235、MP529、VX−528およびAX39459)、ならびにCDK2および/またはCDK4阻害剤などのサイクリン依存性キナーゼ阻害剤が含まれる;
(v)抗血管新生剤、例えば血管内皮増殖因子の効果を阻害するもの[例えば抗血管内皮細胞増殖因子抗体ベバシズマブ(アバスチンTM)、ならびに4−(4−ブロモ−2−フルオロアニリノ)−6−メトキシ−7−(1−メチルピペリジン−4−イルメトキシ)キナゾリン(ZD6474; WO 01/32651の実施例2)、4−(4−フルオロ−2−メチルインドール−5−イルオキシ)−6−メトキシ−7−(3−ピロリジン−1−イルプロポキシ)キナゾリン(AZD2171; WO 00/47212内の実施例240)、バタラニブ(PTK787; WO 98/35985)およびSU11248(スニチニブ; WO 01/60814)などのVEGF受容体チロシンキナーゼ阻害剤、国際特許出願WO 97/22596、WO 97/30035、WO 97/32856およびWO 98/13354に開示するものなどの化合物、ならびに他の機構によって作用する化合物(例えば、インテグリンαvβ3機能の阻害剤であるリノミド(linomide)およびアンジオスタチン];
(vi)血管損傷剤、例えばコンブレタスタチンA4、ならびに国際特許出願WO 99/02166、WO 00/40529、WO 00/41669、WO 01/92224、WO 02/04434およびWO 02/08213に開示される化合物;
(vii)アンチセンス療法、例えば抗rasアンチセンスであるISIS 2503などの上に列挙する標的に対して向けられるもの;
(viii)例えば、異常なp53、あるいは異常なBRCA1またはBRCA2などの異常な遺伝子を置換するアプローチ、シトシンデアミナーゼ、チミジンキナーゼまたは細菌ニトロレダクターゼ酵素を用いるものなどのGDEPT(遺伝子指向性酵素プロドラッグ療法)アプローチ、および多剤耐性遺伝子治療などの化学療法または放射線療法に対する患者耐性を増加させるアプローチを含む、遺伝子治療アプローチ;ならびに
(ix)例えば、患者腫瘍細胞の免疫原性を増加させるex−vivoおよびin−vivoアプローチ、例えばインターロイキン2、インターロイキン4または顆粒球−マクロファージ・コロニー刺激因子などのサイトカインでのトランスフェクション、T細胞アネルギーを減少させるアプローチ、サイトカインでトランスフェクションした樹状細胞などのトランスフェクションした免疫細胞を用いたアプローチ、サイトカインでトランスフェクションした腫瘍細胞株を用いたアプローチおよび抗イディオタイプ抗体を用いたアプローチを含む、免疫療法アプローチ。
【0170】
[0188]1つの態様において、本明細書に定義する抗腫瘍治療は、本発明の化合物に加えて、内科的腫瘍学で用いられるような、他の抗増殖/抗新生物薬剤およびその併用、例えばアルキル化剤(例えばシスプラチン、オキサリプラチン、カルボプラチン、シクロホスファミド、ナイトロジェンマスタード、メルファラン、クロラムブシル、ブスルファン、テモゾラミド、およびニトロソ尿素);代謝拮抗剤(例えば、ゲムシタビン、ならびに5−フルオロウラシルおよびテガフールのようなフルオロピリミジンなどの抗葉酸剤、ラルチトレキセド、メトトレキサート、シトシンアラビノシド、およびヒドロキシ尿素);抗腫瘍抗生物質(例えばアドリアマイシン、ブレオマイシン、ドキソルビシン、ダウノマイシン、エピルビシン、イダルビシン、マイトマイシン−C、ダクチノマイシンおよびミトラマイシンのようなアントラサイクリン);抗有糸分裂剤(例えばビンクリスチン、ビンブラスチン、ビンデシンおよびビノレルビンのようなビンカアルカロイド、ならびにタキソールおよびタキソテールのようなタキソイド、ならびにポロキナーゼ阻害剤);およびトポイソメラーゼ阻害剤(例えばエトポシドおよびテニポシドのようなエピポドフィロトキシン、アムサクリン、トポテカンならびにカンプトテシン)での治療を伴ってもよい。
【0171】
[0189]1つの態様において、本明細書に定義する抗腫瘍治療は、本発明の化合物に加えて、ゲムシタビンでの治療を伴ってもよい。
[0190]治療の個々の構成要素を同時に、連続してまたは別個に投与することによって、こうした共同の治療を達成してもよい。こうした併用産物は、本明細書において上述する投薬量範囲内の本発明の化合物またはその薬学的に許容されうる塩、および認可された投薬量範囲内の他の薬学的活性剤を使用する。
【実施例】
【0172】
[0191]以下の実施例は、行う実験および達成される結果を含めて、例示目的のみのために提供され、そして本明細書の解説を制限するとは見なされないものとする。
実施例1
免疫および力価決定
免疫
[0192]それぞれ、可溶性uPAR(組換えヒトuPAR/His6、カタログ番号807−UK−100、R&D Systems, Inc.)および細胞結合uPAR(細胞表面にヒトuPARを発現しているB300.19トランスフェクタント)を用いて、免疫を行った。B300.19トランスフェクタントを生成するため、pcDNA3発現ベクター内にヒト全長uPAR cDNAを挿入した。エレクトロポレーションを介して、B300.19細胞を一過性にトランスフェクションした。蛍光活性化細胞分取(FACS)分析によって、細胞表面上のヒトuPARの発現が免疫に適したレベルであることを確認した。その開示が本明細書に援用される米国特許出願第08/759,620号、1996年12月3日出願、および国際特許出願第WO 98/24893号、1998年6月11日公表、および第WO 00/76310号、2000年12月21日公表に開示される方法にしたがって、XenoMouseTMにおける免疫のため、作戦1では、10μg/マウスの可溶性タンパク質を、そして作戦2では、1x107細胞/マウスのB300.19トランスフェクション細胞を用いた。免疫プログラムを表2に要約する。
【0173】
力価による採取用動物の選択
[0193]ヒトuPARに対する抗体の力価をFACSによって試験した。免疫プログラム終了時、実施例2に記載するように、エレクトロポレーションによって、マウス骨髄腫細胞、ならびに免疫したマウスの脾臓およびリンパ節から単離したリンパ球を用いて、融合を実行した。
【0174】
表2:免疫プログラムの要約
【0175】
【表2】

【0176】
「Fp」は、「足蹠」を指す。
実施例2
リンパ球回収、B細胞単離、融合およびハイブリドーマの生成
[0194]免疫したマウスを頸椎脱臼によって屠殺し、そして流入領域リンパ節を採取し、そして各コホートからプールした。DMEM中ですりつぶすことによって、リンパ系細胞を解離させて、組織から細胞を遊離させ、そして細胞をDMEM中に懸濁した。細胞を計数し、そして1億個のリンパ球あたり0.9mlのDMEMを細胞ペレットに添加して、細胞を穏やかにしかし完全に再懸濁した。1億個の細胞あたり、100μlのCD90+磁気ビーズを用いて、磁気ビーズと細胞を4℃で15分間インキュベーションすることによって、細胞を標識した。最大108陽性細胞(または最大2x109総細胞)を含有する磁気標識細胞懸濁物をLS+カラム上に装填し、そしてカラムをDMEMで洗浄した。総流出物をCD90陰性分画(これらの細胞の大部分は、B細胞であると期待された)として収集した。
【0177】
[0195]上記由来の洗浄した濃縮B細胞およびATCCから購入した、非分泌性骨髄腫P3X63Ag8.653細胞、カタログ番号CRL 1580(Kearneyら, J. Immunol. 123, 1979, 1548−1550)を1:1の比で混合することによって、融合を行った。800xgの遠心分離によって、細胞混合物を穏やかにペレットにした。上清を完全に除去した後、2〜4mlのプロナーゼ溶液(CalBiochem、カタログ番号53702;PBS中、0.5mg/ml)で2分を超えずに、細胞を処理した。次いで、3〜5mlのFBSを添加して、酵素活性を停止し、そしてエレクトロ細胞融合溶液(ECFS、0.3Mスクロース、Sigma、カタログ番号S7903、0.1mM酢酸マグネシウム、Sigma、カタログ番号M2545、0.1mM酢酸カルシウム、Sigma、カタログ番号C4705)を用いて、懸濁物を40ml総体積に調整した。遠心分離後に上清を除去し、そして40ml ECFS中に細胞を再懸濁した。この洗浄工程を反復し、そして再び、細胞をECFS中に再懸濁して、2x106細胞/mlの濃度にした。
【0178】
[0196]融合生成装置(モデルECM2001、Genetronic, Inc.、カリフォルニア州サンディエゴ)を用いて、エレクトロ細胞融合を行った。用いた融合チャンバーサイズは2.0mlであり、以下の装置設定を用いた:
[0197]調節条件:電圧:50V、時間:50秒。
[0198]電圧:3000V、時間:30μ秒で膜破壊
[0199]融合後保持時間:3秒
[0200]ECF後、細胞懸濁物を、無菌条件下で、融合チャンバーから注意深く除去し、そしてL−グルタミン、pen/strep、OPI(オキサロ酢酸、ピルビン酸、ウシ・インスリン)(すべてSigma)およびIL−6(Boehringer Mannheim)を補充した、同体積のハイブリドーマ培地(DMEM、JRH Biosciences)、15%FBS(Hyclone)を含有する無菌試験管内に移した。細胞を37℃で15〜30分間インキュベーションし、そして次いで、400xg(1000rpm)で5分間遠心分離した。小体積のハイブリドーマ選択培地(0.5xHA(Sigma、カタログ番号A9666)を補充したハイブリドーマ培地)中に細胞を穏やかに再懸濁し、そして96ウェルプレートあたり、総数5x106 B細胞およびウェルあたり200μlの最終プレーティングに基づいて、さらなるハイブリドーマ選択培地を用いて、体積を適切に調整した。細胞を穏やかに混合し、そして96ウェルプレート内にピペッティングし、そして増殖を可能にした。第7日または第10日、培地の半分を除去し、そして細胞にハイブリドーマ選択培地を再供給した。
【0179】
[0201]選択培地中でルーチンとして、ハイブリドーマを増殖させた。潜在的に抗ヒトuPAR抗体を産生するハイブリドーマから収集した消耗上清を、続くスクリーニングアッセイに供した。
【0180】
実施例3
細胞に結合したhu−uPARへの結合
[0202]蛍光測定微量体積アッセイ技術(FMAT)を用いて、ヒトuPARを発現するようにトランスフェクションしたネズミ・プレB細胞株B300.19(ATCC)、および対照としてのB300.19親細胞を用いて、細胞に結合したuPARへの抗体の結合を試験した。アッセイに、5,000細胞/ウェルを使用した。マウス抗ヒトuPAR mAb(R&E Systems、MAB807)を陽性対照試薬として用い、一方、G2 KLH上清(1:10)を陰性対照試薬として用いた。400ng/mlのヤギ抗ヒトIgG Cy5コンジュゲート(マウス抗体対照には、ヤギ抗マウスIgG Cy5コンジュゲート)を用いて、結合した抗体を検出した。それぞれ、5μg/mlおよび2.5μg/mlのヤギ抗ヒトκ−PEまたはヤギ抗ヒトγ−Cy5コンジュゲート(どちらもJackson Immune Researchから購入した)の両方を用いて、結合した抗体を検出することによって、FACS分析によって陽性株を確認した。染色された各色素に関して、陽性および陰性細胞の間の幾何平均値の比を表にした。1.95より高い比をヒットと見なした。各融合由来のヒトγおよびκ特異的ヒットの数を表3に列挙する。
【0181】
表3.FACS分析によって確認されるような、細胞に結合したhu−uPARに結合した抗体の数
【0182】
【表3】

【0183】
実施例4
競合的結合
[0203]このアッセイにおいて、FACS分析によって、抗体が、細胞に結合したuPARへのヒトuPAの結合を阻害する能力を試験した。簡潔には、ネズミ線維芽細胞L929細胞(ATCC)をトランスフェクションして、ヒトuPARを発現させた。99%生存率のトランスフェクタントを、1:2希釈の上清と、4℃で一晩インキュベーションした。洗浄後、細胞を500ng/ml FITC標識tc−uPA(Molecular Systemsから購入)と1時間インキュベーションした。ビオチンとコンジュゲート化されたウサギ抗FITC(2.5μg/ml、Molecular Probesから購入)を用いて、結合したFITC−uPAを検出した。シグナルを増幅するため、三次検出試薬、ストレプトアビジン(strapavidin)−Cy5コンジュゲート(SA−Cy5、2.5μg/ml、Jackson Immune Researchから購入)を使用した。モノクローナル抗ヒトuPAR抗体MAB807(R&D Systems、受容体−リガンド結合を中和)を陽性対照試薬として用いた。
【0184】
[0204]ハイブリドーマ株由来の総数433の上清(結合剤)を試験し、そして50%の阻害を陽性と見なした。各融合由来の陽性株(中和剤)を表4に要約する。4回の融合の中で、uPAのuPARへの結合を阻害可能な総数102の株がある。
【0185】
表4.uPA/uPAR結合を阻害したAbの数
【0186】
【表4】

【0187】
実施例5
非ヒト霊長類に対する交差反応性
[0205]カニクイザル由来のuPARをクローニングし、そしてCHOK1細胞表面上で発現させた。このアッセイにおいて、FACS分析によって、細胞に結合したカニクイザルuPARへの抗体の結合(親細胞を陰性対照とする)を試験した。ネズミ抗ヒトuPAR抗体MAB807(R&D Systems)を陽性対照試薬として使用した。簡潔には、99%生存率のCHOK1/cyno−uPARトランスフェクタントを、1:2希釈の上清と、4℃でインキュベーションした。どちらもJackson Immune Researchから購入した、ヤギ抗ヒトγ鎖Cy5コンジュゲート(5μg/ml)および抗ヒトκ鎖PEコンジュゲート(2.5μg/ml)両方を用いて、結合したヒト抗体を検出した。染色された各色素に関して、陽性および陰性細胞の間の幾何平均値の比を見いだした。1.95より高い比をヒットと見なした。uPA/uPAR結合に阻害活性を示した株(中和剤)のみをこのアッセイに供した。表5に要約するように、試験した102株のうち90が、CHOK1細胞表面上に発現されるcyno−uPARに結合する能力を示した。以下の実施例12に示すように、30の候補をクローニングし、そして精製した後、カニクイザルuPARに対する交差反応性が確認された。
【0188】
表5.カニクイザルuPARを発現している細胞に結合した抗体の数
【0189】
【表5】

【0190】
実施例6
動力学的アッセイ
高抗原(HA)定量化(ELISA)
[0206]以下に記載する限定抗原定量化アッセイと比較して、より多量のuPARで、ELISAプレートをコーティングした(4.2μg/ml)。抗体(Ab)を含有する試料を、uPARでコーティングしたELISAプレート上で力価決定し、そして一晩インキュベーションして、適切な平衡までAb結合を可能にした。試料中のAbの力価決定は、1:200〜1:19,531の希釈範囲を含んだ。既知の濃度のuPAR特異的抗体の標準曲線を用いて、アッセイの直線範囲を定義した。直線範囲内のデータを用いて、各力価決定試料中のuPAR特異的Abの相対的濃度を得た。高uPAR濃度および一晩インキュベーションは、Abアフィニティーの効果を限定し、各試料中に存在するuPAR特異的Abの相対量の定量化を可能にした。
【0191】
限定抗原(LA)定量化(ELISA)
[0207]以下に記載する高抗原定量化アッセイと比較して、より少量のuPARで、ELISAプレートをコーティングした(320、160、80、40および20ng/ml)。抗体(Ab)(1:25希釈)の1つの濃度を含有する試料を一晩インキュベーションして、Ab結合が平衡に近づくのを可能にした。低抗原濃度は、抗体濃度の効果を限定し、相対的アフィニティーに基づいた、抗体のランキングを可能にした。
【0192】
[0208]HA/LA動力学アッセイによって、uPA/uPAR結合を阻害する能力を有する102株(中和剤)を試験した。uPA/uPAR結合阻害およびFACSに基づく結合の有効性と組み合わせて、結果を分析した。表6は、望ましい中和活性および好ましい結合動力学を有する30のハイブリドーマ株に関する結果を要約する。
【0193】
実施例7
特異性研究
[0209]uPARに最も近い相同体は、ヒトLy6eである(約36%類似性)。この研究では、Ly6eに交差反応したすべての抗体を同定し、そして排除した。
【0194】
[0210]標準的プロトコルにしたがって、ヒトLy6e(Genbank寄託番号BC119709)をクローニングし、そしてHEK293T細胞中で発現させた。適切な検出抗体を欠いているため、Ly6eに融合しているmycタグを探査し(probing)、それとともに、同じ抗myc抗体を用いたウェスタンブロット上で、発現されたタンパク質の分子サイズが正しいことを立証することによって、Ly6eの発現が信頼できることを確認した。
【0195】
[0211]1:2ハイブリドーマ上清を用いたFACS分析によって、Ly6eを発現するようにトランスフェクションされたHEK293Tに対する抗体の反応性を決定し、そしてCy5とコンジュゲート化されたヤギ抗ヒトγ鎖(2.5mg/ml、Jackson Immune Research)で探査した。トランスフェクタントへの抗myc抗体(10μg/ml、Invitrogen)の結合が、陽性対照として働き、そして(Ly6e陰性)親細胞へのこの抗体の結合が、陰性対照として働いた。1.95の陽性対陰性の幾何平均比を閾値として用いた。1.95を超える読み取り値を結合剤と見なした。その結果、102の中和剤の中で、4.67および4.50株のみが、Ly6e発現細胞に結合することが見いだされた。他のものは、Ly6eに交差反応性を持たなかった。表6は、クローニングのために選択された30株の特性を要約する。
【0196】
表6.細胞クローニング用の30株の選択に関する要約
【0197】
【表6】

【0198】
[0212]一次および二次スクリーニングアッセイを通じて、表6に要約するような、細胞に結合したヒトuPAR、uPA/uPAR結合の阻害、および動力学ランキングに基づいて、総数30のハイブリドーマ株を同定した。この中で、2つの株は、細胞表面上のcyno−uPARに結合しなかった。抗体はいずれも、ネズミuPARと反応せず、そして選択した株のいずれも、uPARに最も近い相同体であるLy6eと反応しなかった。
【0199】
[0213]これらの30株をクローニングし、そして以下に記載するように、さらに性質決定した。
実施例8
プラスミノーゲン活性化アッセイ
[0214]uPARを発現することが知られるヒト組織細胞(histocytic)リンパ腫細胞株U937(ATCC)をこのアッセイに使用した。細胞表面uPARに結合した際、一本鎖ウロキナーゼ型プラスミノーゲン活性化因子(scuPA)は活性化されてuPAになることが可能であり、そしてプラスミノーゲンをプラスミンに切断することが可能である。後者は、D−Val−Leu−Lys 7−アミド−4−メチルクマリン(VLK−AMC、Sigmaカタログ番号V3138)を切断して、そして蛍光AMC色素を放出する。したがって、アッセイ系中の蛍光単位の強度は、細胞表面uPARに結合したuPAの量の指標となる。uPARに対する中和mAbは、scuPAの結合を阻害し、そしてしたがって、蛍光を抑制すると期待された。
【0200】
[0215]U937細胞を維持し、そして5%CO2、37℃で、1.5g/l重炭酸ナトリウム、4.5g/lグルコース、10mM HEPES、1.0mMピルビン酸ナトリウム、および10%FBSを含有するように調整された、2mM L−グルタミンを含むRPMI 1640培地中で増殖させた。アッセイを実行するため、U937細胞を60,000細胞/ウェルの密度でV底プレート内に植え付け、そして1,500rpmで3分間細胞を回転させて落とすことによって、冷反応緩衝液(0.05M Tris.HCl、0.1M NaCl、pH=7.4、2%BSAを含む)で洗浄した。再懸濁後、示す最終濃度で、氷上で1時間、細胞をmAbで処理した。処理した細胞懸濁物を、3nMの最終濃度のscuPAでスパイク処理した。細胞懸濁物を、氷上で1時間インキュベーションした後、冷反応緩衝液で洗浄した。50μlの1μM Glu−プラスミノーゲンおよび400μM VLK−AMC基質を細胞懸濁物に添加して、その体積を200μlに調整した。Tecan読み取り装置での蛍光測定のため、混合物をFMATプレートに移した。
【0201】
[0216]30のmAbをプラスミノーゲン活性化アッセイにおいて、まず試験した。次いで、他のものより高いプラスミノーゲン活性化阻害活性を持つ15の候補を、さらなる試験のために選択した。図1に示すように、多様な濃度で阻害活性を試験することによって、15の選択したmAbに関する用量−反応関係曲線を生成した。各mAb濃度に関して、3つ組で試験を行った。各mAbに関する定量的指標、IC50を、表11に含める。
【0202】
[0217]抗体4.19.1および1.41.1に関する曲線の間に、明らかなギャップがあることが注目された。ギャップの左側の曲線(8つのmAb、すなわち、4.18.1、4.50.2、4.13.2、4.12.2、2.6.1、1.99.1、2.19.2、および4.19.1を含む)は、より高い有効性および強度を有した。これらは、1μg/ml程度の低い濃度で、90%を超えて、プラスミノーゲン活性化を阻害した。したがって、これらの8つのmAbを、さらなる性質決定のために選択した。
【0203】
実施例9
接着アッセイ
[0218]96ウェル・マイクロタイタープレートを、リン酸ナトリウム(pH9)中、ビトロネクチン(5μg/ml)で、4℃で一晩コーティングした。次いで、プレートを3%BSAで、室温で少なくとも1時間ブロッキングした。2.5mlの50mMグリシン−HClおよび100mM NaCl(pH3.0)を用いて、U937細胞を氷上で3分間、酸ストリッピングした。次いで、0.5mlの500mM HEPESおよび100mM NaCl(pH7.0)によって、酸性細胞懸濁物を中和した。
【0204】
[0219]次いで、あらかじめ温めた血清不含培地で2回、そして1%BSAを含有しそしてMn2+を含まないHBBSで再び2回、細胞を洗浄した後、最終的に、180,000細胞/100μlでHBBS中に再懸濁した。次いで、酸ストリッピングした細胞を、10μg/mlのあらかじめ選択したmAbと、4℃で1時間インキュベーションした。続いて、細胞を25nM scuPAでスパイク処理した。
【0205】
[0220]50μlの細胞およびそのあらかじめ選択したmAbを、マイクロタイタープレート中のビトロネクチンをコーティングした各ウェルに添加した。37℃で40分間、細胞をプレートに接着させた。温HBSSを用いて、結合していない細胞を洗い落とした。プレートを−80℃で1時間置くことによって、結合した細胞を凍結した。次いで、細胞を室温で融解した。100mlのCyQuant色素/溶解緩衝液を各ウェルに添加し、そして485nm励起および530nm発光で、蛍光を読み取った。
【0206】
[0221]実施例8由来の15の選択したmAbを、最初は2μg/mlで、接着アッセイに供した。接着を阻害した8つのmAbが見いだされた際、図2に例示するように、これらに関する用量−反応関係曲線を3つ組で得た。残った7つのmAbは、明示する実験条件下で、明らかな阻害効果を示さなかった。
【0207】
[0222]ヒト・アイソタイプIgGまたはヤギIgG対照のいずれも、ビトロネクチンへのU937の接着を阻害しなかった。既知の中和剤であるヤギ抗uPAR(黒い太い点線、図2)と同様、これらの阻害性の8つのmAbは、用量依存方式で、ビトロネクチンへの細胞接着を阻害した。グラフ中の曲線の最も左側のグループは、mAb 4.18.1、2.6.1、2.19.2、および4.50.2で構成される。アッセイ中で試験した最大mAb濃度は、2μg/mlであった。この濃度で、少なくともmAb 2.19.2および2.6.1は、90%阻害に到達し、そしてmAb 4.18.1は、uPARが仲介するビトロネクチンへの細胞接着の90%阻害に近づく。この実験を3回繰り返し、同様の結果を得た。
【0208】
[0223]抗体の他の特徴に対する抗接着活性の相関を表11に要約する。
実施例10
浸潤アッセイ
[0224]MatrigelTM(BD Bioscienceカタログ番号356237、ロット番号007024−7.7mg/ml)を4℃の冷蔵庫中、氷上で一晩、解凍した。孔サイズ8μmのBD 24ウェルTranswellプレート中の各ウェルに、80μlのゲルを添加し、そして細胞接着前に、37℃で90分間インキュベーションした。細胞解離溶液(Sigma)を用いて、DMEM(0.2%FCS)培地中、1x105細胞/mlで、HT−1080細胞を再懸濁した。100μl(1x104細胞)の細胞懸濁物を無菌エッペンドルフ試験管にアリコットし、そしてときどき混合しながら、0.1、1.0、および10μg/mlの最終濃度のmAbと、37℃で1時間プレインキュベーションした。未処理対照試料もまた、ときどき混合しながら、37℃で1時間プレインキュベーションした。
【0209】
[0225]0.1、1.0、および10μg/mlのmAbを補充した750μlのDMEM(10%FCS)培地を、下部トランスウェル・チャンバーの適切なウェルに添加した。750μlのDMEM(10%FCS)培地を、対照試料の下部チャンバーに添加した。固形化MatrigelTMを含有する上部チャンバーを下部トランスウェル・チャンバー内に挿入し、そして100μl(1x104細胞)のプレインキュベーション細胞懸濁物を、適切なウェルの上部チャンバーにアリコットし、そしてチャンバーを37℃で3日間インキュベーションした。−20℃メタノール中に室温で20分間浸すことによって、トランスウェルを固定した。Hoechst 33342(Sigmaカタログ番号B2261)(10μM)で染色する前に、トランスウェルをPBSで2回洗浄した。染色後、ウェルをPBSで2回洗浄した。20x対物レンズを用いて、MatrigelTM最上部の細胞およびMatrigelTMに浸潤した細胞の20μmの連続切片の光学的イメージを得た。Image−ProPlus(Media Cybernetics、メリーランド州ベセスダ)画像分析ソフトウェアパッケージを使用して、各切片での細胞数を計算した。各試料に関して、すべての切片中に存在する、明記した距離(60〜200μm)を超えて浸潤した細胞のパーセント数としてデータを提示した。
【0210】
[0226]実施例8由来の15のmAbを、アイソタイプ対照(IgG2に関してはPK16.3.1、IgG4に関しては108.2.1)とともに、0.1、1.0、および10μg/mlのmAb濃度でアッセイに使用した。60μmの距離を超えて浸潤した細胞数を、「IgG2およびIgG4アイソタイプ対照を超えた倍変化」に基準化した。図3中の3つのパネルは、上から下に、それぞれ、0.1、1.0、および10μg/mlのmAb濃度で収集したデータに相当する。試験した大部分のmAbは、細胞浸潤を阻害することが見いだされた。抗体2.19.1、2.6.1および4.18.1は、最適な有効性および強度を有した。10μg/mlの濃度で、mAb 2.19.1は、60μmの距離を超えた浸潤を完全に阻害し、そしてmAb 2.6.1および4.18.1はどちらも90%阻害を達成した。続いて、2.6.1、2.19.2および4.18.1の分析を0.1〜100ng/mlの濃度範囲に渡って行い、そして80μMの深さでMatrigelTMに浸潤した細胞の数によって浸潤を決定した。図5に示すように、100ng/mlの濃度のmAb 2.6.1、2.19.2および4.18.1は、80μmまでの細胞移動を有意に阻害する(>70%阻害)ことが見いだされた。
【0211】
実施例11
低および高解像度BIACORETMを用いたアフィニティーの決定
低解像度BiacoreTM
[0227]低解像度BiacoreTM試験のため、アフィニティー決定に関して、31のハイブリドーマ細胞株産物またはハイブリドーマ上清のセレクションを試験した。ルーチンのアミンカップリングを用いて、CM5 BiacoreTMチップ上の高密度ヤギ抗ヒト抗体表面を調製した。100μg/ml BSAを含有するHBS−P泳動緩衝液(10mM HEPES[pH7.4]、150nM NaCl、0.005%サーファクタントP20)中、すべてのmAbをおよそ6μg/mlに希釈した。10μl/分で30秒間の接触時間を用い、その後、mAbベースラインの安定化のため、100μl/分の流速で5分間の洗浄を行って、各mAbを別個のフローセル上で捕捉した。次に、hu−uPAR(R&D Systems、ロットALH01402A)を、全表面に312nM(23℃)で90秒間注入した後、5分間解離させた(100μl/分の流速)。4分間のhu−uPAR注入(312nM、50μl/分の流速)で、4つのmAbを再分析した。泳動緩衝液中ですべての抗原試料を調製した。全捕捉/注入サイクル後に、146mMリン酸(pH1.5)を15秒間1回パルス処理して、表面を再生した。
【0212】
[0228]各サイクルに関して、各抗原注入前の緩衝液注入のベースラインドリフトを減じた。
[0229]CLAMP(David G. MyszkaおよびThomas Morton(1998)“CLAMP(c): a biosensor kinetic data analysis program,” TIBS 23, 149−150)を用いて、1:1相互作用モデルにデータを広範囲で適合させて、結合動力学を決定した。データを適合させる際に、物質移動係数を用いた。動力学分析結果を表7aに列挙する。分析中に用いたmAb上清もまた示す。高アフィニティーから低アフィニティーにmAbをランキングする。
【0213】
表7a.低解像度BiacoreTMから得た、ハイブリドーマ株に関するアフィニティー決定結果
【0214】
【表7−1】

【0215】
[0230]大部分のAbは、1:1モデルに非常によく適合する。mAb 3.133および3.167の解離速度(off−rate)データは、ある程度の複雑さを示したが、動力学的パラメータは、許容されうる概算値である。mAb 1.163の分析において、会合速度(association rate)が緩慢である(103M−1s−1の桁)ため、注入時間をより長い4分間にしてもなお、有意な曲率は生じなかった。
【0216】
高解像度BiacoreTM
[0231]大部分のmAbが1:1モデルに非常によく適合したことを考慮すると、株産物低解像度BiacoreTMから得たアフィニティーランキングは、信頼性があると考えられた。3つのクローニングおよび精製mAbの高解像度BiacoreTMを用いたKd決定を、別個の実験で行った。
【0217】
[0232]3つの精製mAb各々(2.19.2、2.6.1および4.18.1)を、CM5 BiacoreTMチップの異なるフローセル表面上にアミンカップリングし、そしてヒトuPARへの結合アフィニティーに関して試験した。固定のため、すべてのmAbを、10mM酢酸ナトリウム、pH4.0中に希釈した。すべての実験に関して、泳動緩衝液および試料調製緩衝液は、100μg/ml BSAを含有する脱気HBS−P(10mM HEPES[pH7.4]、150nM NaCl、0.005%サーファクタントP20)であった。100μl/分の流速、23℃で、すべての実験を行った。二重参照のため、いくつかの緩衝液注入を分散させて、連続希釈(2倍)uPAR試料を3つ組で90秒間、ランダムに注入した。すべての高解像度実験に、BiacoreTM 2000バイオセンサー装置を用いた。物質移動期間を含めて、1:1相互作用モデルにデータを広範囲で適合させた。生じたKD値を表7bに要約する。
【0218】
表7b.高解像度BiacoreTMから得た、クローニングおよび精製mAbに関するアフィニティー決定結果
【0219】
【表7−2】

【0220】
[0233]抗体2.19.2、2.6.1、および4.18.1のKd値は、それぞれ、175pM、249pM、および446pMであった。高解像度BiacoreTMでの各抗体のKdランキングは、低解像度BiacoreTMで得たものと一致した。
【0221】
実施例12
マウスおよびサルuPARに対する交差反応性
[0234]マウス交差反応性を決定するため、過剰な可溶性マウスuPARを用いた競合アッセイにおいて、U937細胞表面上に発現されたヒトuPARへのmAb結合を検出した。アッセイ中、uPARを発現している細胞にmAbを曝露する前に、過剰量の組換えマウスuPARをmAbとプレインキュベーションした。mAbがマウスuPARと交差反応する場合、プレインキュベーションはmAbをマスキングし、したがって、mAbはヒトuPARに結合しないであろう。
【0222】
[0235]マウスuPAR/ヒトIgG Fcキメラ(uPARHuIgG)(R&D Systems、カタログ番号531−PA−100)をマウスuPARとして用いた。1μg/ml、50μlの各mAbを、等体積のマウスuPARHuIgG 40μg/mlと混合した。mAbおよびマウスuPARの最終濃度は、それぞれ500ng/mlおよび20μg/mlであった(Mo−uPARHuIgのおよその分子量は66〜90Kdである)。混合物は、FACS緩衝液(1%BSAおよび0.05% NaN3を補充したPBS)中であり、そしてこれを30分間インキュベーションした。続いて、20,000のU397細胞を混合物に添加し、氷上でさらに30分間インキュベーションした。インキュベーション終了時、FACS緩衝液を用いて5回洗浄することによって、結合していないmAbを徹底的に除去した。FACSCaliburフローサイトメーター(BD Biosciences、カリフォルニア州サンノゼ)を用いて、Cy5(Cy5−ビス−OSU、N,N’−ビスカルボキシペンチル−5,5’−ジスルホナトインドジカルボシアニン、Amersham Life Science、カタログ番号PA15000)−標識ヤギ抗Hu IgG Fc(5.0μg/ml)および7AAD(5.0μg/ml)で、結合したmAbを検出した。
【0223】
[0236]過剰量の可溶性組換えマウスuPARが、細胞に結合したヒトuPARへのいかなるmAbの結合も遮断せず(データ未提示)、mAbがいずれもマウスuPARに交差反応しなかったことが示されることが、結果によって示された。マウス交差反応性結果を決定的にするため、FACS分析を用いて、細胞に結合したマウスuPARへのmAbの直接結合を測定した。結合組織由来のマウス細胞株、NCTC L929をFACS分析に使用した。FACS緩衝液を用いて、採取した細胞を50,000細胞/ウェルに再懸濁して、V底プレート内に入れて、氷上においた。6.25μg/mlの最終濃度のuPAR mAbをウェルに添加し、そして氷上で1時間インキュベーションした。洗浄後、5μg/mlのCy5標識ヤギ抗ヒトIgG Fcおよび5μg/mlの7AADを添加した。混合物を氷上で15分間インキュベーションし、洗浄し、そしてFACS分析のため、冷FACS緩衝液中に再懸濁した。
【0224】
[0237]表8は、FACS結果を要約する。マウス抗原と交差反応するラット抗uPARは大きなシフトを生じ、幾何平均は248.07であった。対照的に、検出のための二次抗体を伴う、マウス抗uPAR mAb(マウス抗原に対する反応性を欠く)、ラット、マウスおよびヒト由来のアイソタイプ対照に関する幾何平均値は、3.14〜13.07の範囲であった。完全ヒトuPAR mAbはすべて、9〜12の間の幾何平均を示し、これは、上記の陰性対照でみられるバックグラウンドに匹敵した。したがって、mAbはいずれも、細胞表面マウスuPARには結合しないと結論づけられた。
【0225】
表8.FACS分析結果の要約
【0226】
【表8】

【0227】
[0238]クローニング前に、30の選択したハイブリドーマ株のうち2つ(3.133および3.167)は、サルuPARに対する交差反応性を欠くことが示された。クローニング後、FACS分析を用いて、293T細胞表面上に組換え的に発現されたサルuPARに対する交差反応性を確認した。FACS分析結果を図4に要約する。
【0228】
[0239]陰性対照抗体に比較して、抗uPAR mAbはすべて、細胞に結合したサルuPARに結合したが、幾何平均値は、非常に多様であった。弱い結合剤には、mAb 1.159.1、1.163.1、3.14.1およびmAb 1.100.1が含まれた。mAb 2.19.2、2.6.1、および4.18.1は、サル抗原に非常に強く交差反応することが見いだされた(図4)。
【0229】
実施例13
カニクイザル・アフィニティー
[0240]KinExA(登録商標)法を用いて、いくつかの抗体の動力学的測定を評価した。この方法は、平衡時の正式なアフィニティー測定の、溶液に基づく測定を伴う。R&D Systemsから購入した組換えヒトuPAR(アミノ酸1〜303)を、NHS−Sepharoseビーズにカップリングした。1M Tris中の10mg/ml BSAで、ビーズ上の残った活性基をブロッキングし、そして製造者に推奨されるように、ブロッキング溶液中に保存した。ヒトuPARとカップリングしているビーズが固相として働く、自動化フローイムノアッセイ系KinExA 3000を用いて、KinExA実験を実行した。
【0230】
[0241]配列番号81として示すヌクレオチド配列は、C末端にインフレームHisタグを持つカニクイザル・タンパク質の細胞外ドメイン(ECD)をコードする(配列番号82)。製造者の推奨にしたがって、タンパク質産生のFreestyle発現系(Invitrogen)を用いて、HEK293細胞において、このヌクレオチド配列を含有する発現ベクターを一過性にトランスフェクションすることによって、カニクイザルuPARを産生した。この一過性トランスフェクション由来の馴化培地を、上述のようなアフィニティー決定に用いた。
【0231】
[0242]簡潔には、一定量の2.6.1または2.19.2抗uPAR抗体(5nMまたは500pM)を、およそ625nMから始まる組換えカニクイザルuPAR ECDを含有する馴化培地の力価決定濃度と、インキュベーションした。抗原/抗体複合体を、室温で48時間〜168時間インキュベーションして、平衡に到達するのを可能にした。ヒトuPARカップリングビーズを用いて混合物を引きつけて、結合していない抗体を集積させた。試料緩衝液中、Cy5コンジュゲート化ヤギ抗ヒトIgG重鎖および軽鎖特異的二次抗体を含有する溶液を用いて、捕捉された抗体を検出した。結合したシグナルを、hIL−13の非存在下での対照の比率として、相対値に変換した。すべての平衡実験に関して、各試料の3つの複製物を測定した。結果を以下の表9に要約する。KinExAソフトウェア内に含有される、未知のリガンド濃度での1部位均質結合モデルを用いたデータの非線形回帰分析から、平衡解離定数(KD)を得た。該ソフトウェアは、KDを計算し、そして理論的KD曲線にデータ点を適合させることによって、95%信頼区間を決定する。95%信頼区間は、KD低およびKD高として提供される。
【0232】
表9.カニクイザル結合活性に関するKinExA結果の要約
【0233】
【表9】

【0234】
実施例14
内在化アッセイ
[0243]U937細胞を用いたuPAR内在化を誘導する能力に関して、実施例8由来の8つのmAbを試験した。100,000細胞を含有する細胞懸濁物を、2つ組で、V底プレートの各ウェル内にピペッティングした。2つのV底プレートを用意し、一方は抗体複合体での内在化の間、37℃で維持し、そしてもう一方は4℃でインキュベーションした。8つのuPAR mAbの各々を、5μg/mlで、氷上でU937細胞と15分間インキュベーションした。氷上でのインキュベーションは、一次mAbの内在化を防止するために必要であった。次いで、細胞を冷FACS緩衝液で洗浄した。続いて、冷FACS緩衝液中、5μg/mlのalexa647標識ヤギ抗ヒトF(ab)(Invitrogenカタログ番号A21249)100μl中、細胞を氷上で15分間インキュベーションした。これによって、いかなる内在化も許さずに、結合したuPAR mAbにヤギFABが結合することが可能になった。氷上で15分間インキュベーションした後、1つのプレートを氷上に維持し、一方、他方のプレートを37℃で1時間インキュベーションした。
【0235】
[0244]mAb−FAB複合体と1時間インキュベーションした後、細胞を冷5%FACS緩衝液で2回洗浄し、そしてストリッピング剤として200μlのTris(2−カルボキシエチル)ホスフィンHCl(TCEP)を各ウェルに添加した。プレートをどちらもTCEPと氷上で1時間インキュベーションした後、洗浄し、そしてFACS緩衝液に再懸濁した。4μlの7−アミノ−アクチノマイシンD(7AAD)を各ウェルに添加した後、氷上で10分間インキュベーションし、その後、FACS分析を行った。
【0236】
[0245]以下の等式を用いて、内在化の割合を計算した:
[0246][(37ストリップ−4ストリップ)/(4ストリップなし−4ストリップ)]x100
[0247]式中、「37ストリップ」は、TCEPを用いた、37℃での幾何平均であり;
「4ストリップ」は、TCEPを用いた、氷上での幾何平均であり;
「4ストリップなし」は、TCEPを用いない、氷上での幾何平均である(表10を参照されたい)。
【0237】
表10.内在化アッセイの要約
【0238】
【表10】

【0239】
[0248]表10に要約するように、37℃で1時間インキュベーションした後、あるとしても、非常にわずかな内在化しか検出されなかった。実験を2回反復して、類似の結果を得た。
【0240】
[0249]表11は、実施例8由来の15の候補のin vitro性質決定の結果を要約する。
表11. 15のuPAR mAbのin vitro性質決定アッセイ結果の要約
【0241】
【表11】

【0242】
*括弧内の数字は、各カテゴリーに関するランクキング順を示す。
実施例15
uPAR抗体の構造分析
[0250]抗体の可変重鎖および可変軽鎖を配列決定して、DNA配列を決定した。各ガンマおよびカッパ鎖の組み合わせに関して、ヌクレオチドおよびアミノ酸配列を含めて、配列表に、抗uPAR抗体の完全配列情報を提供する。可変重鎖配列を分析して、VHファミリー、D領域配列およびJ領域配列を決定した。次いで、配列を翻訳して、一次アミノ酸配列を決定し、そして生殖系列VH、DおよびJ領域配列に比較して、体細胞超変異を評価した。
【0243】
[0251]表18は、同族(cognate)生殖系列重鎖領域に、抗体重鎖領域を比較する表である。表19は、同族生殖系列軽鎖領域に、抗体カッパ軽鎖領域を比較する表である。
【0244】
[0252]免疫グロブリン鎖の可変(V)領域は、多数の生殖系列DNAセグメントにコードされ、B細胞個体発生中に、これらが連結されて機能性可変領域(VHDJHまたはVKJK)になる。uPARに対する抗体反応の分子多様性および遺伝的多様性を詳細に研究した。これらのアッセイによって、抗uPAR抗体に特異的ないくつかの点が明らかになった。
【0245】
[0253]各ハイブリドーマから収集したシスター・クローンの中のアミノ酸配列が同一であることを認識すべきである。例えば、mAb 2.19.3の重鎖および軽鎖配列は、mAb 2.19および2.19.1の配列と同一であろう。
【0246】
[0254]配列決定データによると、2.6.1および4.18.1の重鎖の一次構造は類似であるが、同一ではない。2.19.2は、他の2つと構造的に異なる。
[0255]特定の抗体が、アミノ酸レベルで、それぞれの生殖系列配列と異なる場合、抗体配列を生殖系列配列に突然変異させ直してもよいこともまた認識すべきである。こうした訂正突然変異は、標準的分子生物学的技術を用いて、1つ、2つ、3つまたはそれより多い位で、あるいは突然変異位のいずれかの組み合わせで、生じてもよい。限定されない例として、表19は、mAb 4.18.1の軽鎖配列(配列番号52)が、FR1領域中のSerからPheの突然変異(突然変異1)、FR1領域中のValからMetの突然変異(突然変異2)、FR2領域中のLysからThrの突然変異(突然変異3)、FR3領域中のIleからPheの突然変異(突然変異4)、およびFR3領域中のSerからIleの突然変異(突然変異5)を通じて、対応する生殖系列配列(配列番号66)と異なることを示す。したがって、mAb 4.18.1の軽鎖をコードするアミノ酸またはヌクレオチド配列を修飾して、突然変異1を変化させて、突然変異1の部位で生殖系列配列を得てもよい。さらに、mAb 4.18.1の軽鎖をコードするアミノ酸またはヌクレオチド配列を修飾して、突然変異2または突然変異3を変化させて、突然変異2または突然変異3の部位で生殖系列配列を得てもよい。さらに、mAb 4.18.1の軽鎖をコードするアミノ酸またはヌクレオチド配列を修飾して、突然変異1および突然変異2の両方、または2以上の突然変異の任意の他の組み合わせを変化させて、これらの特定の部位で生殖系列配列を得てもよい。以下の表12〜17は、mAb 2.19.2、2.6.1および4.18.1に関して、生殖系列からのこうした変動の位置を例示する。各列は、太字で示した位置の生殖系列および非生殖系列残基のユニークな組み合わせを表す。
【0247】
表12. 示した残基番号での生殖系列に対するmAb 2.19.2軽鎖(配列番号32)の典型的な突然変異
【0248】
【表12−1】

【0249】
【表12−2】

【0250】
【表12−3】

【0251】
【表12−4】

【0252】
表13. 示した残基番号での生殖系列に対するmAb 2.19.2重鎖(配列番号30)の典型的な突然変異
【0253】
【表13】

【0254】
表14. 示した残基番号での生殖系列に対するmAb 2.6.1軽鎖(配列番号28)の典型的な突然変異
【0255】
【表14】

【0256】
表15. 示した残基番号での生殖系列に対するmAb 2.6.1重鎖(配列番号26)の典型的な突然変異
【0257】
【表15−1】

【0258】
【表15−2】

【0259】
【表15−3】

【0260】
【表15−4】

【0261】
【表15−5】

【0262】
【表15−6】

【0263】
【表15−7】

【0264】
【表15−8】

【0265】
【表15−9】

【0266】
【表15−10】

【0267】
【表15−11】

【0268】
【表15−12】

【0269】
【表15−13】

【0270】
【表15−14】

【0271】
【表15−15】

【0272】
【表15−16】

【0273】
【表15−17】

【0274】
【表15−18】

【0275】
【表15−19】

【0276】
【表15−20】

【0277】
【表15−21】

【0278】
【表15−22】

【0279】
【表15−23】

【0280】
【表15−24】

【0281】
【表15−25】

【0282】
【表15−26】

【0283】
【表15−27】

【0284】
【表15−28】

【0285】
【表15−29】

【0286】
【表15−30】

【0287】
【表15−31】

【0288】
【表15−32】

【0289】
表16. 示した残基番号での生殖系列に対するmAb 4.18.1軽鎖(配列番号52)の典型的な突然変異
【0290】
【表16−1】

【0291】
【表16−2】

【0292】
【表16−3】

【0293】
【表16−4】

【0294】
【表16−5】

【0295】
【表16−6】

【0296】
【表16−7】

【0297】
【表16−8】

【0298】
表17. 示した残基番号での生殖系列に対するmAb 4.18.1重鎖(配列番号50)の典型的な突然変異
【0299】
【表17−1】

【0300】
【表17−2】

【0301】
【表17−3】

【0302】
【表17−4】

【0303】
【表17−5】

【0304】
【表17−6】

【0305】
【表17−7】

【0306】
【表17−8】

【0307】
表18.重鎖分析
【0308】
【表18−1】

【0309】
【表18−2】

【0310】
【表18−3】

【0311】
【表18−4】

【0312】
表19.軽鎖分析
【0313】
【表19−1】

【0314】
【表19−2】

【0315】
【表19−3】

【0316】
実施例16
uPAR結合エピトープの同定
[0256]抗uPAR抗体がマウスuPARと交差反応するのに失敗したため、本発明者らは、いくつかのマウスuPAR−ヒトuPARキメラタンパク質を生成して、抗体結合に関与するドメインを同定した。各々、C末端Hisタグを含む、ネズミD1/ヒトD2D3;ネズミD1/ヒトD2/ネズミD3;およびヒトD1D2/ネズミD3uPARを含むキメラ・ヒト−ネズミuPARを、HEK293T細胞中、分泌タンパク質として発現した。培養上清のウェスタンブロッティングによって、2.6.1、2.19.2、および4.18.1の結合部位を決定し;抗His mAbを用いた検出によって、適切な組換えタンパク質が発現されていることを立証した。2.19.2の結合エピトープはドメインIに存在し、そして2.6.1は、主に、ドメインII/III内のエピトープと相互作用し、そして4.18.1はドメインII中のエピトープと相互作用する(図6を参照されたい)。
【0317】
[0257]エピトープ・ビニングに用いたタンパク質をコードするヌクレオチド配列および翻訳されたアミノ酸配列を以下の表20に示す。
表20.エピトープ・ビニングに用いたヌクレオチドおよびアミノ酸配列
【0318】
【表20】

【0319】
実施例17
in vivoでの腫瘍増殖および転移の阻害
[0258]安定してGFP(MDA MB231−GFP細胞)を発現しているMDA MB231細胞を培養中で増殖させて、そして85%集密で採取した。総数5x105の腫瘍細胞を生理食塩水/20%MatrigelTM中で、雌Balb/c nu/nuマウスの乳房脂肪体内に接種した。移植3日後、マウスに以下を投与した:対照の非特異的アイソタイプ一致IgG4;ドキソルビシンRx、5mg/kg i.p.、週1回、2週間;対照または抗ヒトuPAR mAb 0.5mg/マウスi.p.、実験期間中、週1回。キャリパーを用いて、週1回、腫瘍増殖を測定し、そして公式(axb2/2)、式中、a−長径の長さであり、b−垂直小径の幅である、にしたがって腫瘍体積を計算した(図7)。未治療対照腫瘍増殖(図7には示さない)は、IgG4アイソタイプ対照に比較して、有意には異ならなかった。
【0320】
[0259]研究終了時、原発腫瘍を固定し、そしてさらなる分析のため、対照および実験動物から、肺、肝臓および脾臓を除去した。標準的免疫組織化学技術を用いて、以下のタンパク質に関して、組織切片を染色した:Ki67;CD31;MAPK;ホスホ−MAPK;FAK;ホスホ−FAK。BioQuant画像分析ソフトウェアを用いて、染色強度を測定し、そして治療群あたり6匹の動物由来のデータを記録した(図8)。
【0321】
[0260]肺、肝臓、および脾臓組織を同様に処理し、そして蛍光顕微鏡によって腫瘍細胞を同定し、そして転移数を記録した(図9)。
[0261]図7〜9に立証するように、抗uPAR抗体は、原発腫瘍増殖を阻害し、そして離れた臓器への転移発生を有意に阻害した。原発腫瘍の免疫組織化学検査は、増殖マーカーKi67に対する効果をまったく示さなかったが、対照に比較して、pMAPKおよびpFAKのレベルの一貫した阻害があった。予期せぬことに、CD31染色もまた、染色強度のある程度の減少を示したが、ネズミuPARとの抗体交差反応性が存在せず、機構は、局所腫瘍関連uPA活性の結果としての、間接的なものであると仮定しなければならない。
【0322】
実施例18
免疫組織化学
[0262]凍結細胞ペレットおよび正常ヒト組織マイクロアレイ(TriStar Technology Group)に対して、IgG4アイソタイプ対照抗体と一緒に、2.6.1、2.19.2および4.18.1の結合プロフィールを評価した。American Diagnostica Inc.のマウス抗uPAR(カタログ番号3936、ロット番号041223)が、研究における陽性対照Abであった。0〜3+のスケール(±はっきりしない染色;1+弱い染色;2+中程度の染色;3+強い染色)を用いて、目によって、染色強度を概算した。PC3ヒト前立腺癌由来の凍結細胞ペレットおよびU937ヒト組織細胞リンパ腫U937細胞ペレットを陽性対照として用い、そして膜および細胞質染色の両方を観察した(表21を参照されたい)。陰性対照抗体でバックグラウンド染色が観察された場合、染色がバックグラウンドより強く、そして/またはバックグラウンドから区別可能である場合のみ、または染色が、陰性対照抗体で染色されない試験組織内の細胞中にある場合のみ、陽性染色と報告した(以下の表23を参照されたい)。
【0323】
表21.細胞ペレット中の染色強度
【0324】
【表21】

【0325】
[0263]ヒト組織マイクロアレイの染色のため、2.6.1、2.19.2および4.18.1をビオチンでコンジュゲート化し、U937細胞への結合に関して再評価して(以下の表22を参照されたい)、そして次いで、組織マイクロアレイを染色するのに用いた。
【0326】
表22.ビオチン−コンジュゲート化mAbを用いた細胞ペレット中の染色強度
【0327】
【表22】

【0328】
[0264]組織マイクロアレイを、20μg/mlの濃度のビオチン・コンジュゲート化抗体で染色した。結果を表23に示す。示す場合、c=細胞質であり、そしてm=膜染色パターンである。
【0329】
表23.組織マイクロアレイ染色パターン
【0330】
【表23−1】

【0331】
【表23−2】

【0332】
実施例19
ヒト患者における腫瘍細胞増殖の阻害
[0265]膵臓癌と診断されたヒト癌患者群を、治療群にランダム化する。各患者群を、本明細書記載のmAb 2.6.1、2.19.2または4.18.1の毎週静脈内注射で治療する。各患者に、5mg/kg/週〜15mg/kg/週の範囲の抗体の有効量を4〜8ヶ月間、投薬する。対照群には、標準的な化学療法措置のみを与える。
【0333】
[0266]治療措置中および措置後、定期的に、磁気共鳴画像法(MRI)によって腫瘍負荷を評価する。mAb 2.6.1、2.19.2または4.18.1での毎週抗体治療を受けた患者が、抗体治療を受けなかった患者に比較して、腫瘍サイズの有意な減少、進行までの遅延、または生存延長を示すことが見いだされる。何人かの治療患者では、腫瘍はもはや検出不能である。対照的に、対照群においては、腫瘍サイズは、増加するか、または実質的に同じままである。
【0334】
実施例20
ヒト患者における腫瘍細胞増殖の阻害
[0267]甲状腺癌と診断されたヒト癌患者群を、治療群にランダム化する。各患者群を、本明細書記載のmAb 2.6.1、2.19.2または4.18.1の静脈内注射で、3週間ごとに、治療する。各患者に、5mg/kg/週〜15mg/kg/週の範囲の抗体の有効量を4〜8ヶ月間、およびゲムシタビンの有効療法用量を投薬する。対照群には、標準的な化学療法措置のみを与える。治療措置中および措置後、定期的に、磁気共鳴画像法(MRI)によって腫瘍負荷を評価する。mAb 2.6.1、2.19.2または4.18.1での3週間の抗体治療およびゲムシタビン治療を受けた患者が、抗体およびゲムシタビン治療を受けなかった患者に比較して、腫瘍サイズの有意な減少、進行までの遅延、または生存延長を示すことが見いだされる。何人かの治療患者では、腫瘍はもはや検出不能である。対照的に、対照群においては、腫瘍サイズは、増加するか、または実質的に同じままである。
【0335】
実施例21
ヒト患者における腫瘍転移の阻害
[0268]非小細胞肺癌と診断されたヒト癌患者群を、治療群にランダム化する。標準的化学療法措置に加えて、各患者群を、本明細書記載のmAb 2.6.1、2.19.2または4.18.1の静脈内注射で、毎週、治療する。各患者に、5mg/kg/週〜15mg/kg/週の範囲の抗体の有効量を2〜8ヶ月間、投薬する。対照群には、標準的な化学療法措置のみを与える。
【0336】
[0269]治療措置中および措置後、定期的に、陽電子放出断層撮影法(PET)によって転移病巣を評価する。mAb 2.6.1、2.19.2または4.18.1で毎週抗体治療を受けた患者が、抗体治療を受けなかった患者に比較して、転移病巣の数およびサイズの有意な減少を示すことが見いだされる。
【0337】
実施例22
ヒト患者におけるエストロゲン受容体陽性乳癌の治療
[0270]成人女性が、エストロゲン受容体陽性乳癌と診断される。患者を、mAb 2.19.2および抗ホルモン剤の静脈内注射で、2〜8ヶ月の期間に渡って2週間ごとに治療する。その結果、患者は、進行がない生存の延長を経験する。
【0338】
実施例23
ヒト患者におけるHER2陽性乳癌の治療
[0271]成人女性が、HER2陽性乳癌と診断される。患者を、mAb 2.19.2および抗her2剤の静脈内注射で、2〜8ヶ月の期間に渡って毎週治療する。その結果、患者は、腫瘍サイズの有意な減少を経験する。
【0339】
実施例24
ヒト患者におけるEGFR発現性肺癌の治療
[0272]成人男性が、EGFR発現性肺癌と診断される。患者を、mAb 2.19.2および受容体チロシンキナーゼ阻害剤の静脈内注射で、2〜8ヶ月の期間に渡って毎週治療する。その結果、患者は、進行までの時間の有意な遅延を経験する。
【0340】
実施例25
ヒト患者における関節炎の治療
[0273]成人女性が、重度の関節炎と診断される。患者を、mAb 2.19.2の静脈内注射で、3週間の期間に渡って2週間ごとに治療する。その結果、患者は、関節炎症状の有意な減少を経験する。
【0341】
実施例27
ヒト患者におけるアテローム性動脈硬化症の治療
[0274]成人男性が、アテローム性動脈硬化症と診断される。患者を、mAb 4.18.1の静脈内注射で、1年間の期間に渡って1週間おきに治療する。その結果、患者は、狭心症などのアテローム性動脈硬化症の症状の減少を経験する。
【0342】
援用
[0275]特許、特許出願、論文、教科書等を含む、本明細書に引用するすべての参考文献、および該文献に引用される参考文献は、すでにそうでない度合いまで、その全体が本明細書に援用される。
【0343】
同等物
[0276]前述の記載した明細書は、当業者が本発明を実施可能となるのに十分であると見なされる。前述の説明および実施例は、本発明の特定の好ましい態様を詳述し、そして発明者らが意図する最適の様式を記載する。しかし、前述の記述がテキスト中でいかに詳細であるかに関わらず、本発明を多くの方式で実施してもよく、そして本発明は付随する請求項およびその任意の同等物にしたがって解釈されるべきであることが認識されるであろう。
【図面の簡単な説明】
【0344】
【図1】[0070]図1は、プラスミノーゲン活性化阻害アッセイにおける、15の抗uPARモノクローナル抗体の阻害効果を示す線グラフである。各mAbに関する用量−反応関係曲線を例示する。最高の有効性および強度を示す8つの抗体を垂直のブラケットによって示す。太字のレジェンドは、最強の阻害を示した抗体を示す。Log[mAb](μg/ml)の単位を持つ抗体濃度の関数として、阻害パーセント(「阻害%」)を示す。
【図2】[0071]図2は、uPAR mAbが、ビトロネクチンへのU937細胞の接着を阻害する能力を示す線グラフである。8つのmAb、ならびにヒトおよびヤギ・アイソタイプ陰性対照およびヤギ抗uPAR陽性対照に関する用量−反応関係曲線を示す。Log[mAb](ng/ml)の単位を持つ抗体濃度の関数として、阻害パーセント(「阻害%」)を示す。
【図3】[0072]図3は、MatrigelTM膜調製物へのHT−1080浸潤に対するuPAR mAbの阻害効果を示す。0.1μg/ml(上部グラフ)、1.0μg/ml)(中央部グラフ)、および10μg/ml(下部グラフ)の濃度の抗体を試験した。アイソタイプ対照に対して、処理によって60マイクロメートル(μm)を超えてMatrigelTMに浸潤した細胞数の比をプロットする。
【図4】[0073]図4は、293T細胞表面上に発現されるサル(カニクイザル)uPARへの抗uPARモノクローナル抗体の結合を示す棒グラフである。ヒストグラフ(histograph)ピークシフトのFACS分析から得られる幾何平均値をプロットする。
【図5】[0074]図5は、腫瘍細胞浸潤に対する抗uPAR mAbの効果を示す棒グラフである。0.1〜100ng/mlの範囲の濃度の各抗体に関して、80マイクロメートル(μM)を超えてMatrigelTMに浸潤したHT−1080細胞の割合を示す。
【図6】[0075]図6は、ウェスタンブロッティングによる、抗ヒトuPAR mAbのエピトープ結合分析の結果を示す。ヒト−ネズミuPARキメラ(Hisタグ化)をHEK293T細胞中で発現させ、そして示すような抗ヒトuPAR mAbを用いて、uPAR発現を検出した。レーン1−ネズミDI/DIII−ヒトDII;レーン2−ネズミDI/DII−ヒトDIII;レーン3−ネズミDI−ヒトDII/DIII;レーン4−ヒトDI/DII−ネズミDIII;レーン5−ヒトuPAR。
【図7】[0076]図7は、MDA−MB231−GFP正所性異種移植片の固形腫瘍増殖に対する抗uPAR mAbの効果を示す線グラフである。試験した各抗体に関して、そしてIgG4アイソタイプおよびドキソルビシン対照に関して、移植後の時点(移植後の週数)の平均腫瘍体積(cm3)を示す。未治療対照腫瘍増殖(未提示)は、IgG4アイソタイプ対照と有意には異ならなかった。
【図8】[0077]図8A〜Fは、MDA−MB231−GFP正所性異種移植片の原発性腫瘍中で測定される、腫瘍バイオマーカー発現に対する抗uPARモノクローナル抗体の活性を示す棒グラフである。データは、治療群あたり6匹の動物の腫瘍から測定した、染色強度(密度)の平均+/−標準偏差を表す;ki−67(図8a)、CD31(図8b)、MAPK(図8c)、pMAPK(図8d)、FAK(図8e)、pFAK(図8f)、未治療、ドキソルビシンおよびIgG4対照を含む。
【図9】[0078]図9A〜Bは、MDA−MB231−GFP正所性異種移植片を持つマウスにおいて、抗uPAR mAbが転移を阻害する活性を表す棒グラフである。データは、示すような治療群あたり6匹の動物由来の、肺(図9A)または肝臓(図9B)由来の組織切片における10の視野中の腫瘍病巣数の平均+/−標準偏差を表す。
【特許請求の範囲】
【請求項1】
ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR)に特異的に結合し、そしてウロキナーゼ型プラスミノーゲン活性化因子(uPA)のuPARへの結合を阻害する、単離された標的化結合剤。
【請求項2】
U937細胞に対するプラスミノーゲン活性化を90%より多く阻害する、請求項1の標的化結合剤。
【請求項3】
0.08μg/ml未満のIC50で、U937細胞に対するプラスミノーゲン活性化を阻害する、請求項1の標的化結合剤。
【請求項4】
uPARが仲介する、2μg/mlの濃度のビトロネクチンへのU937細胞の細胞接着の80%より多くを阻害する、請求項1の標的化結合剤。
【請求項5】
10μg/mlの濃度のMatrigelTMへの細胞浸潤の90%より多くを阻害する、請求項1の標的化結合剤。
【請求項6】
哺乳動物における腫瘍増殖および転移を阻害する、先行する請求項のいずれか一項の標的化結合剤。
【請求項7】
500ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項8】
400ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項9】
300ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項10】
200ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項11】
モノクローナル抗体である、先行する請求項のいずれか一項の標的化結合剤。
【請求項12】
表1に示すようなモノクローナル抗体のいずれか1つである、先行する請求項のいずれか一項の標的化結合剤。
【請求項13】
モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)である、請求項12の標的化結合剤。
【請求項14】
モノクローナル抗体2.6.1(ATCC寄託番号PTA−7475)である、請求項12の標的化結合剤。
【請求項15】
モノクローナル抗体4.18.1(ATCC寄託番号PTA−7476)である、請求項12の標的化結合剤。
【請求項16】
ATCC寄託番号PTA−7474、ATCC寄託番号PTA−7475およびATCC寄託番号PTA−7476より選択されるハイブリドーマによって産生されるモノクローナル抗体である、標的化結合剤。
【請求項17】
請求項12〜16のいずれか一項のモノクローナル抗体から誘導可能である、標的化結合剤。
【請求項18】
完全ヒト・モノクローナル抗体である、先行する請求項のいずれか一項の標的化結合剤。
【請求項19】
完全ヒト・モノクローナル抗体の結合性断片である、請求項1〜17のいずれか一項の標的化結合剤。
【請求項20】
Fab、Fab’、F(ab’)2、FvおよびDabからなる群より選択される、請求項19の標的化結合剤。
【請求項21】
配列番号26の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項22】
配列番号26が、表15の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項21の標的化結合剤。
【請求項23】
配列番号28の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項24】
配列番号28が、表14の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項23の標的化結合剤。
【請求項25】
配列番号30の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項26】
配列番号30が、表13の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項25の標的化結合剤。
【請求項27】
配列番号32の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項28】
配列番号32が、表12の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項27の標的化結合剤。
【請求項29】
配列番号50の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項30】
配列番号50が、表17の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項29の標的化結合剤。
【請求項31】
配列番号52の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項32】
配列番号52が、表16の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項31の標的化結合剤。
【請求項33】
uPARへの結合に関して、請求項1〜17の標的化結合剤のいずれか1つと交差競合する、標的化結合剤。
【請求項34】
請求項1〜17の標的化結合剤のいずれか1つと同じ、uPAR上のエピトープに結合する、標的化結合剤。
【請求項35】
a)表18または表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つ;
b)表18に示すようなCDR1、CDR2およびCDR3配列;
c)表19に示すようなCDR1、CDR2およびCDR3配列;または
d)表18に示すようなCDR1、CDR2およびCDR3配列、ならびに表19に示すようなCDR1、CDR2およびCDR3配列
を含むアミノ配列を含む、標的化結合剤。
【請求項36】
抗体である、請求項21〜35のいずれか一項記載の標的化結合剤。
【請求項37】
完全ヒト・モノクローナル抗体である、請求項36記載の標的化結合剤。
【請求項38】
完全ヒト・モノクローナル抗体の結合性断片である、請求項37記載の標的化結合剤。
【請求項39】
先行する請求項のいずれか一項の標的化結合剤をコードする、核酸分子。
【請求項40】
請求項39の核酸分子を含む、ベクター。
【請求項41】
請求項40のベクターを含む、宿主細胞。
【請求項42】
動物において、悪性腫瘍を治療する方法であって:
悪性腫瘍の治療が必要な動物を選択し;そして
先行する請求項のいずれか一項の標的化結合剤の療法的有効用量を前記動物に投与する
工程を含む、前記方法。
【請求項43】
前記動物がヒトである、請求項42の方法。
【請求項44】
前記標的化結合剤が請求項13〜16の標的化結合剤のいずれか1つである、請求項42の方法。
【請求項45】
前記悪性腫瘍が:黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、膵臓癌、食道癌、頭部および頸部癌、中皮腫、肉腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍、ならびに類表皮癌からなる群より選択される、請求項42〜44の方法。
【請求項46】
uPARが誘導する疾患関連細胞接着および/または浸潤を治療する方法であって:
疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し;そして
請求項1〜38のいずれか一項の標的化結合剤の療法的有効用量を前記動物に投与する
工程を含む、前記方法。
【請求項47】
前記動物がヒトである、請求項46の方法。
【請求項48】
前記標的化結合剤が完全ヒト・モノクローナル抗体である、請求項46の方法。
【請求項49】
前記疾患関連細胞接着および/または浸潤が腫瘍転移である、請求項46〜48の方法。
【請求項50】
前記標的化結合剤が請求項13〜16の標的化結合剤のいずれか1つより選択される、請求項46の方法。
【請求項51】
非新生物疾患を治療する方法であって:
非新生物疾患の治療が必要な動物を選択し;そして
請求項1〜38のいずれか一項の標的化結合剤の療法的有効用量を前記動物に投与する
工程を含む、前記方法。
【請求項52】
前記動物がヒトである、請求項51の方法。
【請求項53】
前記標的化結合剤が完全ヒト・モノクローナル抗体である、請求項51の方法。
【請求項54】
前記標的化結合剤が請求項13〜16の標的化結合剤のいずれか1つより選択される、請求項51の方法。
【請求項55】
非新生物疾患が、関節炎、アテローム性動脈硬化症およびアレルギー性結膜炎からなる群より選択される、請求項51〜54のいずれか一項の方法。
【請求項56】
請求項1〜38のいずれか一項の標的化結合剤または該剤の結合性断片、および療法剤を含む、コンジュゲート。
【請求項57】
療法剤が毒素である、請求項56のコンジュゲート。
【請求項58】
療法剤が放射性同位体である、請求項56のコンジュゲート。
【請求項59】
療法剤が薬学的組成物である、請求項56のコンジュゲート。
【請求項60】
悪性腫瘍の治療用の薬剤の調製における、請求項1〜38のいずれかの標的化結合剤の使用。
【請求項61】
uPARが誘導する細胞接着および/または浸潤の治療用の薬剤の調製における、請求項1〜38のいずれかの標的化結合剤の使用。
【請求項62】
非新生物疾患の治療用の薬剤の調製における、請求項1〜38のいずれかの標的化結合剤の使用。
【請求項63】
薬学的に許容されうるキャリアーと混合された、請求項1〜38のいずれかの標的化結合剤。
【請求項1】
ウロキナーゼ型プラスミノーゲン活性化因子受容体(uPAR)に特異的に結合し、そしてウロキナーゼ型プラスミノーゲン活性化因子(uPA)のuPARへの結合を阻害する、単離された標的化結合剤。
【請求項2】
U937細胞に対するプラスミノーゲン活性化を90%より多く阻害する、請求項1の標的化結合剤。
【請求項3】
0.08μg/ml未満のIC50で、U937細胞に対するプラスミノーゲン活性化を阻害する、請求項1の標的化結合剤。
【請求項4】
uPARが仲介する、2μg/mlの濃度のビトロネクチンへのU937細胞の細胞接着の80%より多くを阻害する、請求項1の標的化結合剤。
【請求項5】
10μg/mlの濃度のMatrigelTMへの細胞浸潤の90%より多くを阻害する、請求項1の標的化結合剤。
【請求項6】
哺乳動物における腫瘍増殖および転移を阻害する、先行する請求項のいずれか一項の標的化結合剤。
【請求項7】
500ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項8】
400ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項9】
300ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項10】
200ピコモル濃度(pM)未満のKdでuPARに結合する、請求項1〜6のいずれか一項の標的化結合剤。
【請求項11】
モノクローナル抗体である、先行する請求項のいずれか一項の標的化結合剤。
【請求項12】
表1に示すようなモノクローナル抗体のいずれか1つである、先行する請求項のいずれか一項の標的化結合剤。
【請求項13】
モノクローナル抗体2.19.2(ATCC寄託番号PTA−7474)である、請求項12の標的化結合剤。
【請求項14】
モノクローナル抗体2.6.1(ATCC寄託番号PTA−7475)である、請求項12の標的化結合剤。
【請求項15】
モノクローナル抗体4.18.1(ATCC寄託番号PTA−7476)である、請求項12の標的化結合剤。
【請求項16】
ATCC寄託番号PTA−7474、ATCC寄託番号PTA−7475およびATCC寄託番号PTA−7476より選択されるハイブリドーマによって産生されるモノクローナル抗体である、標的化結合剤。
【請求項17】
請求項12〜16のいずれか一項のモノクローナル抗体から誘導可能である、標的化結合剤。
【請求項18】
完全ヒト・モノクローナル抗体である、先行する請求項のいずれか一項の標的化結合剤。
【請求項19】
完全ヒト・モノクローナル抗体の結合性断片である、請求項1〜17のいずれか一項の標的化結合剤。
【請求項20】
Fab、Fab’、F(ab’)2、FvおよびDabからなる群より選択される、請求項19の標的化結合剤。
【請求項21】
配列番号26の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項22】
配列番号26が、表15の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項21の標的化結合剤。
【請求項23】
配列番号28の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項24】
配列番号28が、表14の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項23の標的化結合剤。
【請求項25】
配列番号30の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項26】
配列番号30が、表13の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項25の標的化結合剤。
【請求項27】
配列番号32の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項28】
配列番号32が、表12の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項27の標的化結合剤。
【請求項29】
配列番号50の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項30】
配列番号50が、表17の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項29の標的化結合剤。
【請求項31】
配列番号52の配列を有するポリペプチドを含む、請求項1の標的化結合剤。
【請求項32】
配列番号52が、表16の各行によって示される生殖系列および非生殖系列残基の組み合わせのいずれか1つを有する、請求項31の標的化結合剤。
【請求項33】
uPARへの結合に関して、請求項1〜17の標的化結合剤のいずれか1つと交差競合する、標的化結合剤。
【請求項34】
請求項1〜17の標的化結合剤のいずれか1つと同じ、uPAR上のエピトープに結合する、標的化結合剤。
【請求項35】
a)表18または表19に示すようなCDR1、CDR2またはCDR3配列のいずれか1つ;
b)表18に示すようなCDR1、CDR2およびCDR3配列;
c)表19に示すようなCDR1、CDR2およびCDR3配列;または
d)表18に示すようなCDR1、CDR2およびCDR3配列、ならびに表19に示すようなCDR1、CDR2およびCDR3配列
を含むアミノ配列を含む、標的化結合剤。
【請求項36】
抗体である、請求項21〜35のいずれか一項記載の標的化結合剤。
【請求項37】
完全ヒト・モノクローナル抗体である、請求項36記載の標的化結合剤。
【請求項38】
完全ヒト・モノクローナル抗体の結合性断片である、請求項37記載の標的化結合剤。
【請求項39】
先行する請求項のいずれか一項の標的化結合剤をコードする、核酸分子。
【請求項40】
請求項39の核酸分子を含む、ベクター。
【請求項41】
請求項40のベクターを含む、宿主細胞。
【請求項42】
動物において、悪性腫瘍を治療する方法であって:
悪性腫瘍の治療が必要な動物を選択し;そして
先行する請求項のいずれか一項の標的化結合剤の療法的有効用量を前記動物に投与する
工程を含む、前記方法。
【請求項43】
前記動物がヒトである、請求項42の方法。
【請求項44】
前記標的化結合剤が請求項13〜16の標的化結合剤のいずれか1つである、請求項42の方法。
【請求項45】
前記悪性腫瘍が:黒色腫、小細胞肺癌、非小細胞肺癌、神経膠腫、肝細胞(肝臓)癌、甲状腺腫瘍、胃癌、前立腺癌、乳癌、卵巣癌、膀胱癌、肺癌、神経膠芽腫、子宮内膜癌、腎臓癌、結腸癌、膵臓癌、食道癌、頭部および頸部癌、中皮腫、肉腫、胆道(胆管)癌、小腸腺癌、小児悪性腫瘍、ならびに類表皮癌からなる群より選択される、請求項42〜44の方法。
【請求項46】
uPARが誘導する疾患関連細胞接着および/または浸潤を治療する方法であって:
疾患関連細胞接着および/または浸潤の治療が必要な動物を選択し;そして
請求項1〜38のいずれか一項の標的化結合剤の療法的有効用量を前記動物に投与する
工程を含む、前記方法。
【請求項47】
前記動物がヒトである、請求項46の方法。
【請求項48】
前記標的化結合剤が完全ヒト・モノクローナル抗体である、請求項46の方法。
【請求項49】
前記疾患関連細胞接着および/または浸潤が腫瘍転移である、請求項46〜48の方法。
【請求項50】
前記標的化結合剤が請求項13〜16の標的化結合剤のいずれか1つより選択される、請求項46の方法。
【請求項51】
非新生物疾患を治療する方法であって:
非新生物疾患の治療が必要な動物を選択し;そして
請求項1〜38のいずれか一項の標的化結合剤の療法的有効用量を前記動物に投与する
工程を含む、前記方法。
【請求項52】
前記動物がヒトである、請求項51の方法。
【請求項53】
前記標的化結合剤が完全ヒト・モノクローナル抗体である、請求項51の方法。
【請求項54】
前記標的化結合剤が請求項13〜16の標的化結合剤のいずれか1つより選択される、請求項51の方法。
【請求項55】
非新生物疾患が、関節炎、アテローム性動脈硬化症およびアレルギー性結膜炎からなる群より選択される、請求項51〜54のいずれか一項の方法。
【請求項56】
請求項1〜38のいずれか一項の標的化結合剤または該剤の結合性断片、および療法剤を含む、コンジュゲート。
【請求項57】
療法剤が毒素である、請求項56のコンジュゲート。
【請求項58】
療法剤が放射性同位体である、請求項56のコンジュゲート。
【請求項59】
療法剤が薬学的組成物である、請求項56のコンジュゲート。
【請求項60】
悪性腫瘍の治療用の薬剤の調製における、請求項1〜38のいずれかの標的化結合剤の使用。
【請求項61】
uPARが誘導する細胞接着および/または浸潤の治療用の薬剤の調製における、請求項1〜38のいずれかの標的化結合剤の使用。
【請求項62】
非新生物疾患の治療用の薬剤の調製における、請求項1〜38のいずれかの標的化結合剤の使用。
【請求項63】
薬学的に許容されうるキャリアーと混合された、請求項1〜38のいずれかの標的化結合剤。
【図1】


【図2】


【図3A】


【図3B】


【図3C】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3A】


【図3B】


【図3C】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2009−533446(P2009−533446A)
【公表日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願番号】特願2009−505447(P2009−505447)
【出願日】平成19年4月9日(2007.4.9)
【国際出願番号】PCT/US2007/008913
【国際公開番号】WO2007/120693
【国際公開日】平成19年10月25日(2007.10.25)
【出願人】(300022641)アストラゼネカ アクチボラグ (581)
【Fターム(参考)】
【公表日】平成21年9月17日(2009.9.17)
【国際特許分類】
【出願日】平成19年4月9日(2007.4.9)
【国際出願番号】PCT/US2007/008913
【国際公開番号】WO2007/120693
【国際公開日】平成19年10月25日(2007.10.25)
【出願人】(300022641)アストラゼネカ アクチボラグ (581)
【Fターム(参考)】
[ Back to top ]

