乳酸生産方法
【課題】、乳酸生産酵母において効率的に乳酸を生産する乳酸生産方法を提供する。
【解決手段】 乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える遺伝子組換え乳酸生産酵母を培養する培養工程、を備え、前記培養工程においては、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養する工程を備える、乳酸生産方法とする。
【解決手段】 乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える遺伝子組換え乳酸生産酵母を培養する培養工程、を備え、前記培養工程においては、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養する工程を備える、乳酸生産方法とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、乳酸生産方法に関する。
【背景技術】
【0002】
近年、L−乳酸などの乳酸を、遺伝子組換え酵母を利用して生産することが試みられている。例えば、サッカロマイセス・セレビシエなどの酵母において強力なプロモーターであるピルビン酸脱炭酸酵素(PDC)プロモーターやアルコール脱水素酵素(ADH)プロモーターの制御下で乳酸脱水素酵素(LDH)遺伝子を発現させることが行われている(特許文献1、非特許文献1)。しかしながら、酵母の乳酸生産能をより効果的に利用して安定かつ効率的な工業的乳酸生産には、遺伝子組換え乳酸生産酵母特有の乳酸発酵条件を確立することが重要である。
【0003】
【特許文献1】特開2003−164295号
【非特許文献1】Enzyme and Microbaial Technology 33(2003)p.38−46
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明者らによれば、遺伝子組換え乳酸生産酵母は乳酸生産が強力なプロモーターを用いることによって強力に促進されているものの、発酵条件のわずかな変動により一定期間における乳酸収量が変動すること、すなわち、乳酸生産速度が変動するという不都合があることがわかった。発酵速度が低下して一定量の収量を得るための発酵が遅延化すれば、培養工程の生産管理上不確定なファクターが発生することになり好ましくない。また、発酵速度が低下しているにもかかわらず、一定時間で発酵を終了すれば、培養液中に原料たる糖分が残留することになる。残留糖分は、乳酸精製工程における乳酸比率を低下させるとともに、得られた乳酸を重合して得られるポリ乳酸の着色の一因となる。
【0005】
そこで、本発明では、遺伝子組換え乳酸生産酵母を培養して乳酸を生産する方法において、効率的に乳酸を生産することを一つの目的とする。また、本発明は、遺伝子組換え乳酸生産酵母を培養して乳酸を生産する方法において、発酵期間、発酵速度、収率などの発酵特性をコントロールすることを他の一つの目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、遺伝子組換え乳酸生産酵母について、その乳酸生産速度の変動や乳酸収量の変動などの原因を検討したところ、酸素移動容量係数(kLa)の変動に大きく依存していることを見出した。kLaは、発酵生産における発酵条件の一つであるが、遺伝子組換え乳酸生産酵母においては特に酸素移動容量係数に感受性が高く、低い酸素移動容量係数領域におけるわずかな差によって、乳酸生産特性、すなわち、乳酸生産速度、乳酸収量が異なってくることがわかった。本発明者らは、これらの知見に基づき、培養期間および一定の培養期間内における乳酸収量を容易に制御できることを見出し、本発明を完成した。すなわち、本発明によれば、以下の手段が提供される。
【0007】
本発明の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える遺伝子組換え乳酸生産酵母を培養する培養工程、を備え、前記培養工程においては、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養する工程を備える、乳酸生産方法が提供される。この形態においては、酸素移動容量係数(hr−1)が16以下の範囲で培養することも好ましい一態様であり、酸素移動容量係数(hr−1)が16超の範囲で培養することも好ましい一態様である。さらに、これらの上記いずれかの乳酸生産方法において、前記培養工程においては、酸素移動容量係数(hr−1)を変化させることが好ましい。
【0008】
また、本発明の他の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、を備え、前記培養工程において酸素移動容量係数(hr−1)を変化させる、乳酸生産方法が提供される。この形態においては、前記培養工程は、(a)前記乳酸生産酵母を酸素移動容量係数(hr−1)が16以下の範囲で培養する工程と、(b)前記乳酸生産酵母を酸素移動容量係数(hr−1)が16超の範囲で培養する工程と、を含むことが好ましく、さらに、前記(a)工程を実施後に前記(b)工程を実施することが好ましい。
【0009】
さらにまた、本発明の他の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を通気攪拌下で培養する工程を備える、乳酸生産方法が提供される。
【0010】
また、本発明の他の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養液の通気および/または攪拌下、該培養液の溶存酸素量が1mg/L以下の範囲で培養する工程を備える、乳酸生産方法が提供される。この形態においては、前記培養工程における培養液の溶存酸素量が0.5mg/L以下であることがより好ましい態様である。
【0011】
上記いずれかの乳酸生産方法においては、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、ピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられていることも好ましい態様である。さらに、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、酵母染色体上のピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられていることが好ましい態様である。さらに、前記乳酸生産酵母は、ピルビン酸脱炭酸酵素および/またはアルコール脱水素酵素活性が低下されていることが好ましい態様であり、酵母染色体上のピルビン酸脱炭酸酵素遺伝子が破壊されていることも好ましい態様である。さらにまた、前記乳酸生産酵母は、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を二以上備えていることも好ましい態様である。
【発明を実施するための最良の形態】
【0012】
本発明の乳酸生産方法は、乳酸脱水素酵素活性を有する遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、を備えている。本発明の第1の形態においては、前記培養工程においては、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養することを特徴としている。酸素移動容量係数(以下、単にkLaという。)(hr−1)が6以上36以下の範囲において、乳酸生産酵母の乳酸生産速度、乳酸収量、乳酸比率(生産物における乳酸の比率)について好ましい特徴を有する。このためこの範囲内のkLaで乳酸生産酵母を培養することで、効率的な乳酸生産が可能となる。kLa(hr−1)が6未満では、乳酸生産速度が遅くなる傾向があり、kLa(hr−1)が36を超えると乳酸収量が低下する傾向にある。
【0013】
また、本発明の第2の形態においては、前記培養工程においては、kLa(hr−1)を変化させることを特徴としている。前記乳酸生産酵母は、その乳酸生産速度がkLa(hr−1)に依存する傾向が強いため、kLa(hr−1)を調整することで目的とする培養期間での乳酸生産を実現することができる。また、一定の培養期間内において残留糖分を抑制して高い乳酸収量や乳酸比率を得ることができる。
【0014】
さらに、本発明の第3の形態においては、前記培養工程は、前記乳酸生産酵母を通気攪拌下で培養する工程を備えることを特徴としている。従来この種の酵母や乳酸菌において用いられていない通気攪拌下での培養によって予想外に良好な乳酸収量、乳酸比率を得ることができるとともに、乳酸生産速度も容易に制御できる。
【0015】
さらに、本発明の第4の形態においては、前記培養工程は、前記乳酸生産酵母を培養液の通気および/または攪拌下、該培養液の溶存酸素濃度が1mg/L以下の範囲で培養することを特徴とする。こうした酸素条件で培養することで、予想外に良好な乳酸収量、乳酸比率を得ることができるとともに、乳酸生産速度も容易に制御できる。
【0016】
以下、本発明の実施の形態について、詳細に説明する。
【0017】
(遺伝子組換え乳酸生産酵母)
(酵母)
本発明の乳酸生産形質転換酵母は、外来の乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を有する形質転換酵母である。本乳酸生産酵母を得るための酵母としては、アルコール発酵を行う酵母であって、サッカロマイセス・セレビシエ、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)などのサッカロマイセス属酵母、ピキア・パストリス(Pichia pastoris)、などの酵母を挙げることができる。より好ましくは、サッカロマイセス・セレビシエなどのサッカロマイセス属を始めとする酵母である。好ましい酵母の一例としては、サッカロマイセス・セレビシエIFO2260株や同YPH株を例示できる。
【0018】
なお、本乳酸生産酵母および乳酸生産方法において乳酸とは、L−乳酸、D−乳酸、及びDL−乳酸があるが、これらのいずれであってもよい。
【0019】
(ピルビン酸脱炭酸酵素活性あるいはアルコール脱水素酵素活性の低下)
本乳酸生産酵母においては、ピルビン酸脱炭酸酵素(PDC)活性および/またはアルコール脱水素酵素(ADH)活性が低下されていることが好ましい。これらの酵素は、酵母のアルコール発酵経路の酵素であり、アルコール発酵を行う酵母がその染色体上に本来的に有している酵素である。ピルビン酸脱炭酸酵素は、いわゆるオートレギュレーション機構を有する酵素であり、ピルビン酸脱炭酸酵素1〜6等がある。これらのうちいずれか1種あるいは2種以上が破壊されていればよいが、好ましくは最も活性が高いあるいは大量に発現されているピルビン酸脱炭酸酵素1(PDC1)の活性が低下されていることが好ましい。また、アルコール脱水素酵素においても各種の亜種(ADH1〜ADH7)があるが、アルコール脱水素酵素1(ADH1)が大量に発現されている。したがってアルコール脱水素酵素1の活性が低下されていることが好ましい。
【0020】
ピルビン酸脱炭酸酵素活性および/またはアルコール脱水素酵素活性が低下されているとは、人工的な操作によりあるいはスクリーニングによって、野生型よりも低い活性の該酵素が生産されているかあるいは該酵素の生産量が野生型よりも少ないものであることが好ましい。このような酵素活性の低下のための人工的操作としては、この酵素遺伝子を破壊(ノックアウト)することが好ましい。染色体上の特定遺伝子を破壊する手法は、当業者において周知である。
【0021】
(乳酸脱水素酵素)
本乳酸生産酵母は、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子(LDH遺伝子)を保持している。LDH遺伝子は、酵母においては外来性である。乳酸脱水素酵素(LDH)としては、生物の種類に応じてあるいは生体内においても各種同族体が存在する。本発明において使用する乳酸脱水素酵素としては、天然由来のLDHの他、化学合成的あるいは遺伝子工学的に人工的に合成されたLDHも包含している。LDHとしては、好ましくは、ラクトバシルス・ヘルベティカス、ラクトバシルス・カゼイ、クルイベロマイセス・サーモトレランス、トルラスポラ・デルブルッキ、シゾサッカロミセス・ポンビ、リゾプス・オリゼ、B.メガテリウムなどの原核生物もしくはカビなどの真核微生物由来であり、より好ましくは、植物、動物、昆虫などの高等真核生物由来であり、さらに好ましくは、ウシを始めとする哺乳類を含む高等真核生物由来である。例えば、ウシ由来のLDH(L−LDH)である。例えば、ウシ由来のLDHとして配列番号:2に示すアミノ酸配列からなるタンパク質を挙げることができる。また、かかるLDHをコードするDNAとしては、配列番号:1に記載される塩基配列からなるDNAを挙げることができる。さらに、本発明におけるLDHは、これらのLDHのホモログも包含している。LDHホモログは、天然由来のLDHのアミノ酸配列において、1もしくは数個のアミノ酸の置換、欠失、挿入および/または付加されたアミノ酸でありかつLDH活性を有しているタンパク質、および、天然由来のLDHとアミノ配列の相同性が少なくとも70%、好ましくは80%以上を有しかつLDH活性を有しているタンパク質を含んでいる。したがってLDH遺伝子として、これらのいずれかのLDHをコードするDNAを用いることができる。本乳酸生産酵母は、LDH遺伝子を少なくとも一つ、好ましくは二以上保持している。より好ましくは三以上保持している。さらに好ましくは四つ以上保持している。
【0022】
(PDCプロモーター)
LDH遺伝子は、強力なプロモーター活性を有するプロモーターの制御下に発現可能に備えられていることが好ましい。例えば、ピルビン酸脱炭酸酵素遺伝子プロモーター(PDCプロモーター)の制御下に発現可能に備えられていることが好ましい。なかでも、十分に強力なプロモーターであるPDC1プロモーターを用いることが好ましい。より好ましくは、サッカロマイセス属(好ましくはセレビシエ)のPDC1プロモーターである。
【0023】
例えば、PDC1プロモーターとしては、配列番号:3に記載の塩基配列からなるDNAの他、同等の機能を有する限り、該DNAとストリンジェントな条件でハイブリダイズするDNA、該塩基配列において1あるいは2以上の塩基が置換、欠失、付加、及び/又は挿入された配列からなるDNA、あるいは、該DNAとの相同性が70%以上、より好ましくは80%以上、さらに好ましくは90%以上、最も好ましくは95%以上であるDNAを用いることができる。すなわち、酵母染色体上のPDC1プロモーターが、同一ではないが同等の機能を有するこれらのプロモーター活性を有するDNAによって相同組換え等を介して置換されていてもよい。
【0024】
本明細書においてストリンジェントな条件とは、50%ホルムアミド存在下でハイブリダイゼーション温度が37℃であるハイブリダイゼーション条件あるいはこれと同様のストリンジェンシーのハイブリダイゼーション条件を意味している。よりストリンジェンシーの高い条件によれば、より相同性の高いDNAを単離できる。かかるハイブリダイゼーション条件としては、例えば、50%ホルムアミド存在下でハイブリダイゼーション温度が約42℃、さらにストリンジェンシーの高い条件としては、50%ホルムアミド存在下で約65℃のハイブリダイゼーション条件を挙げることができる。
【0025】
また、本明細書において、DNAなどの核酸の相同性については、DNAの塩基配列のホモロジーは、遺伝子解析プログラムBLASTなどによって決定することができる。なお、DNAの塩基配列のホモロジーは、遺伝子解析プログラムBLAST(http://blast.genome.ad.jp),FASTA(http://fasta.genome.ad.jp/SIT/FASTA.html)などによって決定することができる。
【0026】
(他のプロモーター)
また、LDH遺伝子は、ADH遺伝子のプロモーター(ADHプロモーター)を初めとする他の各種プロモーターの制御下に発現可能に備えることもできる。ADHは既に述べたようにアルコール発酵経路においてPDCのすぐ後段の酵素である。ADHプロモーターとしては、十分に強力なプロモーターであるADH1プロモーターを用いることが好ましい。
【0027】
また、この他、LDH遺伝子は、酵母サッカロマイセス・セレビジエの高浸透圧応答7遺伝子(HOR7遺伝子)、グリセルアルデヒド3リン酸脱水素酵素2遺伝子(TDH2遺伝子)、ヘキソース輸送タンパク質7遺伝子(HXT7遺伝子)、熱ショックタンパク質30遺伝子(HSP30遺伝子)、チオレドキシンペルオキシダーゼ1遺伝子(AHP1遺伝子)、膜タンパク質1関連遺伝子(MRH1遺伝子)の遺伝子、ホスホグリセレートキナーゼ遺伝子(PGK遺伝子)、グリセルアルデヒド3リン酸脱水素酵素3遺伝子(TDH3遺伝子)、ガラクトース1リン酸キナーゼ1遺伝子(GAL1遺伝子)および転写エンハンサー因子1遺伝子(TEF1遺伝子)のプロモーターの制御下に発現可能に導入することもできる。
【0028】
なお、これらの他のプロモーターは、酵母の染色体上における各プロモーターと同等の機能を有する限り、該プロモーターのDNAとストリンジェントな条件でハイブリダイズするDNA、該塩基配列において1あるいは2以上の塩基が置換、欠失、付加、及び/又は挿入された配列からなるDNA、あるいは、ADH1プロモーターとの相同性が70%以上、好ましくは80%以上、より好ましくは90%以上、最も好ましくは95%以上であるDNAを用いることができる。
【0029】
LDH遺伝子は、酵母染色体外で維持されるプラスミドやYACなどにおいて保持されていてもよいが、好ましくは酵母染色体に組み込まれて保持される。
【0030】
LDH遺伝子は、好ましくは、酵母染色体において上記各種プロモーターの制御下に発現可能に備えられている。したがって、上記各種プロモーターとLDH遺伝子とを含む発現カセットを構築して、酵母染色体に導入することができる。また、LDH遺伝子は、酵母染色体上にあるこれらの各種プロモーターの制御下にある内在性遺伝子を破壊するとともに該プロモーターの制御下に発現可能に組み込まれることもできる。また、これらの各種プロモーターの制御下に発現可能に連結したLDH遺伝子を、PDC遺伝子および/またはADH遺伝子を破壊するように酵母染色体に組み込みこともできる。
【0031】
さらに、PDCプロモーターやADHプロモーターの制御下にLDH遺伝子を発現可能に備えるようにするには、酵母染色体におけるこれらのプロモーターの本来の位置においてこれらのプロモーターによって制御可能であってかつPDC遺伝子を破壊するように酵母染色体に組み込まれていることが好ましい。こうすることで、PDC活性やADH活性を低下させてアルコール発酵を抑制できるとともに、本来PDC遺伝子発現に作用していた強力なPDCプロモーターやADHプロモーター活性をLDH遺伝子発現にスイッチさせることができる。破壊されそしてそれらのプロモーターがLDH遺伝子の発現に利用される遺伝子は、好ましくはPDC1遺伝子やADH1遺伝子である。最も強力なPDC1プロモーターによって制御されるPDC1遺伝子が破壊されてLDH遺伝子が代わりに発現されることで効果的にPDC活性低下とLDH活性発現とを実現できる。
【0032】
なお、PDC1遺伝子は、本発明者らが既に開示しているように、オートレギュレーション機構が存在する遺伝子である(特開2003−164295号)。オートレギュレーション機構とは、同じ機能を有する遺伝子が同一生物において複数存在し、通常、そのうちの少なくとも一つは発現しているが、残りは抑制されており、通常発現している遺伝子が破壊などにより機能しなくなった場合にのみ、残りの遺伝子が発現されてその機能を継続する機構を意味している。かかる機構が発現するため、例えば、酵母のPDC1遺伝子が破壊されたとしても、酵母の生理的機能が維持されることになる。このようなオートレギュレーション機構が存在する遺伝子を破壊することで、生物自体の生存、増殖機能を維持することができて、結果として、外来DNAを保持する形質転換体の増殖を維持しながら目的産物を効果的に生産させることができる。
【0033】
なお、明らかなように、PDCプロモーター、ADHプロモーター及び他のプロモーターのDNAは、ゲノムDNAであってもよく、また、化学的に合成されたDNAであってもよい。
【0034】
以上のように、本乳酸生産酵母においては、上記したPDC活性及びADH活性を低下させる態様、各種のLDH遺伝子発現態様を各種組み合わせて採ることができる。好ましい乳酸生産酵母は、染色体上のPDC(好ましくはPDC1)遺伝子が破壊されるとともに破壊された該遺伝子のプロモーターの制御下にLDH遺伝子を発現可能に備えている。同時に、染色体上のADH(好ましくはADH1)遺伝子が破壊されていてもよい。また、この態様において、破壊された該ADH(好ましくはADH1)遺伝子のプロモーターの制御下にLDH遺伝子を発現可能に備えることもできる。こうした乳酸生産酵母においては、好ましくは2以上、より好ましくは4以上、さらに好ましくは6以上、最も好ましくは8以上のLDH遺伝子を染色体上に備えている。
【0035】
本乳酸生産酵母を取得するには、宿主酵母に対して、PDC遺伝子及びADH遺伝子の破壊を行うとともに、LDH遺伝子を発現可能に導入して形質転換することが好ましい。酵母に対してこのような遺伝子修飾を行うには、組換え用DNA構築物を利用する。組換え用DNA構築物は、特に限定しないで、線状等のDNA断片、プラスミド(DNA)、ウイルス(DNA)、レトロトランスポゾン(DNA)、人工染色体(YAC)を、外来遺伝子の導入形態(染色体外あるいは染色体内)等に応じて選択してベクターとしての形態をとることができる。
【0036】
PDC遺伝子あるいはADH遺伝子の破壊のためのDNA構築物は、これらの遺伝子部位に導入して遺伝子を破壊するために相同組換え用の配列を備えることができる。相同組換え用DNA配列は、破壊しようとするPDC遺伝子及びADH遺伝子であるターゲット部位あるいはその近傍のDNA配列と相同なDNA配列である。相同組換え用DNA配列は、一つのターゲット遺伝子あるいはその近傍の少なくとも1箇所に相同である1の配列を有しており、好ましくは、ターゲット遺伝子あるいはその近傍の少なくとも2箇所にそれぞれ相同な配列を備えている。例えば、2個の相同組換え用DNA配列を、染色体上のターゲット遺伝子の上流側と下流側のDNAとのそれぞれに相同なDNA配列とし、これらの相同組換え用DNA配列の間に遺伝子を破壊するためのDNAを備えるDNA構築物を酵母染色体に相同組換えにより導入することでターゲット部位の遺伝子を破壊することができる。
【0037】
このような染色体上への組み込みを実現するための相同組換え用DNAの選択は、当業者において周知であり、当業者であれば必要に応じて適切な相同組換え用DNAを選択して相同組換え用DNA構築物を構成することができる。例えば、PDCプロモーターの少なくとも一部と、PDC遺伝子あるいはターミネーターの少なくとも一部とにそれぞれ相同なDNA配列を相同組換え用DNA配列として用いることができる。同様に、ADHプロモーターの少なくとも一部とADH遺伝子あるいはターミネーターの少なくとも一部とにそれぞれ相同なDNA配列を相同組換え用DNA配列として用いることができる。
【0038】
PDC遺伝子を破壊するDNA構築物には、PDC遺伝子をターゲットとするための相同組換え用DNAとともにPDC遺伝子を置換可能な形態でLDH遺伝子を有することができる。このようなDNA構築物によれば、PDC遺伝子の破壊とともにPDCプロモーターの制御下にLDH遺伝子を発現可能に導入できる。
【0039】
また、PDC遺伝子を破壊するとともに、破壊した該PDC遺伝子のプロモーターの制御下にLDH遺伝子を導入することもできるが、相同組換えにより染色体上のPDCプロモーターに替えて同等のプロモーターを導入することもできる。例えば、既に述べたPDC1プロモーターのホモログ等である。
【0040】
なお、使用するDNA構築物には、CYC1ターミネーターやTDH3ターミネーターなどのターミネーター他、必要に応じてエンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)を連結することができる。選択マーカーとしては、特に限定しないで、薬剤抵抗性遺伝子、栄養要求性遺伝子などを始めとする公知の各種選択マーカー遺伝子を利用できる。例えば、アンピシリン耐性遺伝子、カナマイシン耐性G418遺伝子、ハイグロマイシン耐性遺伝子、ブレオマイシン耐性遺伝子、ネオマイシン耐性遺伝子、ジヒドロ葉酸還元酵素遺伝子、クロラムフェニコール耐性遺伝子、シクロヘキサミド耐性遺伝子等を使用することができる。
【0041】
(乳酸の生産方法)
本乳酸生産酵母を適当な炭素源の存在下で培養することにより、培養物中にLDH遺伝子の発現産物である乳酸を生成させることができる。本乳酸生産方法によれば、培養系から乳酸を分離する工程を実施することにより、乳酸を得ることができる。なお、本発明において培養物とは、培養上清の他、培養細胞あるいは菌体、細胞若しくは菌体の破砕物を包含している。
【0042】
本発明の乳酸生産酵母の培養にあたっては、酵母の種類に応じて培養方法や培養条件を選択することができる。例えば、ジャーファーメンターを用いた液体培養法を挙げることができ、回分培養、半回分培養などの培養形式を採用できる。また、酵母を培養する培地としては、微生物が資化可能な炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれも使用することができる。炭素源としては、グルコース、フルクトース、スクロース、デンプン、セルロース等の炭水化物、酢酸、プロピオン酸等の有機酸、エタノール、プロパノール等のアルコールを用いることができる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム等の無機酸もしくは有機酸のアンモニウム塩またはその他の含窒素化合物の他、ペプトン、肉エキス、コーンスティープリカー等を用いることができる。無機物としては、リン酸第一カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウムなどを用いることができる。
【0043】
培養温度は、用いる乳酸生産酵母の生育可能な範囲で選択することができ、例えば、約20℃〜約40℃とすることができる。また、培地pHは、pHは2.0〜6.0に保持することが好ましく、必要に応じて産物である乳酸等の中和を行うかあるいは、連続的に乳酸を除去する等の処理を行うこともできる。
【0044】
また、培養期間は、他の培養条件、特に、後述するようにkLa(hr−1)によって大きく異なるが6〜72時間程度とすることが好ましく、より好ましくは48時間程度とする。
【0045】
本乳酸生産方法は、乳酸生産酵母を通気攪拌下で、あるいは微好気状態よりも好気状態で培養することが好ましい。一般に、乳酸菌による乳酸発酵や酵母によるエタノール発酵では、通気を行わない微好気状態で発酵を行う。これに対して、本方法では、酵母による発酵生産においては従来用いられていない通気攪拌によって得られる培養液中の酸素条件を用いることを特徴としている。すなわち、微好気状態よりも好気的な酸素条件で発酵を行うことを特徴としている。乳酸生産酵母については、このような酸素条件下において初めて効率的な乳酸発酵が実現される。特に、遺伝子組換え乳酸生産酵母、なかでも、PDC活性が低下するなどアルコール発酵が抑制された乳酸生産酵母あるいはPDC遺伝子のプロモーター下の制御下においてLDH遺伝子が発現可能に備えられた乳酸生産酵母においては、理由は明らかではないが、こうした酸素条件において初めて実用的な乳酸生産特性を得ることができる。なお、本生産方法においては、微好気状態よりも好気的な状態が得られる限り、通気および攪拌の双方を行うことのほか、通気および攪拌のうち一方のみを行ってもよい。
【0046】
本方法の培養工程において得ようとする酸素条件は、使用する乳酸生産酵母が乳酸発酵可能なあるいは乳酸発酵を促進可能な程度であればよい。例えば、かかる酸素条件は、例えば、kLa(hr−1)として表現することができる。kLa(hr−1)は、通気攪拌培養時において、単位時間に気相から液相へ酸素を移動させ溶存酸素を生成させる能力を示すものであり、以下の式(1)で表すことができる。また、kLa(hr−1)(以下、単にkLaと略す。)は、通気攪拌培養時において、気相から供給される酸素と微生物によって消費される酸素とによって表される培養液中の酸素の収支式(2)において用いられる(生物工学実験書、日本生物工学会編、培風館、p.310(1992))。
【0047】
dC/dt=kLa×(C*−C) (1)
dC/dt=kLa×(C*−C)−Q02×X (2)
ここで、C:培養液中の溶存酸素濃度DO(ppm)、C*:微生物による酸素の消費がない場合の気相と平衡の溶存酸素濃度DO(ppm)、X:菌体濃度(g/L)、Q02:比呼吸速度(mgO2/(g・cell・h)kLa:酸素移動容量係数(hr−1)である。
【0048】
通気攪拌培養装置におけるkLaは、亜硫酸酸化法(バッチ法・連続法)、気体置換法(Gassing out法(スタティック法、ダイナミック法))、排気ガス分析法などで測定できる(前掲生物工学実験書、p311等)。以下に、気体置換法(ダイナミック法)によるkLaの測定の一例を示す。通気攪拌培養装置に水あるいは使用する培地をいれ、これらの液体中の酸素を窒素ガスにより置換するかあるいは亜硫酸ナトリムをほぼ飽和濃度に達する程度に加えることなどにより脱酸素するかして該液体の酸素濃度を低下させる。次いで、かかる液体中に溶存酸素濃度電極を差し込み、通気速度、攪拌速度および温度を設定して所定の通気攪拌下での溶存酸素の上昇過程を測定する。ここで、式(1)より、下記式(3)が導かれるため、通気した時間に対して、C*−Cの対数をプロットすることで、kLaを求めることができる。
In(C*−C)=−kLa×t (3)
【0049】
本発明においては、いくつかの通気条件と攪拌条件とを組み合わせた通気攪拌条件を設定して、これらの各種通気攪拌条件とkLaとの関係を予め求めた上、使用する通気攪拌培養装置についてkLaが6以上36以下となる通気攪拌条件を予め設定することが好ましい。各種の通気攪拌条件に対するkLaは、各通気攪拌条件に設定した通気攪拌培養装置を上記記載の方法に従って運転し、溶存酸素濃度の上昇過程と平衡溶存酸素濃度とを測定することで求めることができる。
【0050】
kLaが6以上36以下の範囲においては、乳酸生産酵母の乳酸生産速度、乳酸収量および残留糖分について好ましい培養特性を得ることができるため、安定して効率的な乳酸生産が実現できる。また、このkLaの範囲内で変化させて培養工程を実施することで、所望の培養期間で乳酸収量や残留糖分の好ましいレベルを確保して培養を終了させることができる。また、乳酸生産酵母はkLaがこの範囲内で低い場合には、乳酸生産速度が遅くなる傾向があり、kLaが高い場合には、乳酸生産速度が速くなる傾向がある。したがって、例えば、比較的長い培養期間を設定する場合には、このkLa範囲において相対的に低いkLaを設定することができ、比較的短い培養期間を設定する場合には、相対的に高いkLaを設定することができる。
【0051】
例えば、kLaが16以下で培養することにより、最終的な乳酸収量を増大させることができる。kLaが16以下の場合には、おおよそLDH遺伝子のコピー数によらずに良好な最終乳酸収量を得ることができることが本発明者らより確認されている。また、このような傾向はkLaが小さいほど顕著である。さらに、kLaが小さいほど乳酸比率が高くなる傾向がある。一方、kLaが16超で培養することにより、乳酸生産速度を向上させることができる。乳酸生産速度を向上させることで、培養工程時間を制御することが可能となる。より顕著に乳酸生産速度を向上させるには、kLaを18以上とすることが好ましく、kLaを20以上とすることがより好ましく、kLaが22以上であることが一層好ましい。
【0052】
培養工程においては、kLaを一定とすることもできるが、培養工程においてkLaを変化させることもできる。すなわち、予め異なるkLaによる培養期間を設定しておくこともできるし、kLaを一定に設定して開始した培養工程における乳酸濃度や糖分濃度のモニタリング結果に応じて、異なるkLaの培養期間を新たに追加設定したりもできる。さらに、予め異なるkLaの培養工程を設定しておいてもよいし、こうした培養工程においても培養のモニタリング結果に応じてそれぞれの培養工程時間を変化させてもよい。このような培養工程におけるkLaの調整により、都合のよい培養工程時間内に好ましい乳酸収量や乳酸比率を得ることができる。
【0053】
例えば、kLa一定の培養工程におけるモニタリングにおいて所定時点における残留糖分および/または乳酸濃度が予定値を下回る場合には、kLaをより高く、好ましくは16超、さらに好ましくは18以上、より好ましくは20以上、一層好ましくは22以上に変化させることで、培養工程時間を大きく延長することなく好ましい残留糖分および/または乳酸収量を確保できる。
【0054】
培養工程には、kLaが16以下の第1の培養期間と、kLaが16超の第2の培養期間とを備えることができる。kLaが16以下であるとき、kLaが16超の範囲内にあるときよりも乳酸生産酵母の乳酸生産速度は遅いがその速度が持続される傾向にあり、最終的な乳酸収量や乳酸比率を向上させることができる。kLaは14以下であることがより好ましく、さらに好ましくは11以下である。kLaが14以下さらに11以下とすることでかかる傾向が顕著になるからである。なお、第1の培養期間におけるkLaは6以上であれば、乳酸生産速度が遅くなりすぎることがないため好ましい。一方、kLaが16超の範囲にあるとき、最終的な乳酸収量が低下する傾向にはあるものの乳酸生産速度は早い傾向にあるため、第2の培養期間を設定することで、培養期間を短縮することができる。kLaは18以上であることがより好ましく、さらに好ましくは20以上であり、一層好ましくは22以上である。なお、第2の培養期間における上限は36以下であれば、乳酸収量を大きく低下させることがない。
【0055】
このように、異なるkLa領域での培養期間をそれぞれ備えることで、所望の培養期間、高い乳酸収量および乳酸比率、低い残留糖分を適宜得ることができる。異なるkLa領域での培養工程を組み合わせる場合、より低いkLa領域の培養工程を実施し、より高い領域の培養工程を実施することが好ましい。こうすることで、乳酸収量と乳酸生産速度の双方のバランスを容易に図ることができる。例えば、上記した第1の培養期間を実施後に上記第2の培養期間を実施することが好ましい。こうした順序で異なるkLaの培養期間を実施することで、培養期間、乳酸収量、乳酸比率および残留糖分等について好ましい特性を得ることができるとともに、培養工程の状況変化に対応することが容易となる。なお、異なるkLa領域の培養工程を備える場合、2種のkLaによる各培養工程を備えるほか、3種以上のkLaの各培養工程を備えることもできる。
【0056】
また、本培養工程において得ようとする酸素条件は、乳酸生産酵母の培養工程における培養液の溶存酸素量として表現することもできる。乳酸生産酵母の培養工程においては、溶存酸素量は、1mg/L以下であることが好ましい。1mg/L以下であると乳酸の収量を一定以上に確保できるからである。より好ましくは0.5mg/L以下である。0.5mg/L以下であると、高い乳酸収率が得られるからである。なお、こうした溶存酸素濃度下においても微好気状態よりも好気状態であることが好ましい。こういった酸素条件は、培養液を通気のみでもまた攪拌のみでも得られることがあり、これらを双方組み合わせることによっても得ることができる。培養液の溶存酸素量は、培養工程全体を通じて上記濃度以下であることが好ましい。また、溶存酸素量の測定は、培養槽の酸素条件を代表できるような測定位置および測定個所における測定値から得られる数値を用いることが好ましい。
【0057】
培養終了後、培養物から乳酸あるいはその塩を分離するには、通常の乳酸精製手段を使用することができる。例えば、酵母内に生産された場合は、常法により菌体を超音波破壊処理、摩砕処理、加圧破砕などに細胞を破壊して,遺伝子産物を細胞と分離することができる。この場合、必要に応じてプロテアーゼを添加する。また、菌体外に乳酸が生産された場合には、この培養液等を、ろ過、遠心分離などにより固形分を除去する。
【0058】
これらの粗抽出画分に対しては、従来公知の各種精製分離法等を利用して、乳酸を精製することができる。また、必要に応じて、当該粗抽出画分及びその精製物に対してエステル化等を行うことにより、各種の乳酸誘導体を得ることができる。
【実施例1】
【0059】
以下に、本発明の具体例を記載するが、本発明を以下の具体例に限定する趣旨ではなく、本発明の要旨を逸脱しない範囲で種々の態様で実施できる。なお、以下の実施例においては、kLaは特に断りのない限りkLa(hr−1)を意味している。
【0060】
(乳酸生産形質転換酵母の作製)
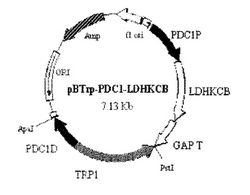
LDH遺伝子(ウシL−LDH由来)を導入したサッカロマイセス・セレビシエを、本発明者らが既に構築したpBTrp−PDC1−LDHKCBベクター(特開2003−259878号公報に記載)を用いて調製した。本ベクターは、酵母の12番染色体上のPDC1遺伝子をターゲットとする染色体導入型ベクターであり、染色体上のPDC1プロモーターをコードするDNA配列とPDC1遺伝子の下流側との相同組換え部位とを有している(図1)。このベクターが染色体上のPDC1遺伝子に導入されれば、PDC1プロモーターの制御下においてLDH遺伝子が発現されることになる。なお、酵母への遺伝子導入法は、Itoらの手法(Ito, H., Y. Fukuda, K.Murata and A. Kimura, Transformation of intact yeast cells treated with alkali cations J. Bacteriol. Vol.153, p163-168)に従った。すなわち、宿主である酵母IFO2260株(社団法人発酵研究所に登録されているサッカロマイセス。セレビジエ菌株)のトリプトファン合成能を欠損した株を、10mlYPD培地にて30℃で対数増殖期まで培養を行い、集菌およびTEバッファによる洗浄を行い、次に、0.5mlTEバッファと0.5ml 0.2Mの酢酸リチウムを加え、30℃にて1時間の振とう培養を行った後に、染色体導入型ベクターであるpBTrp−PDCl−LDHKCBベクターを、制限酵素ApaIおよびSacI(いずれも宝酒造)で処理して、これを添加した。
【0061】
本酵母懸濁液を30℃で30分振とう培養後、150μlの70%ポリエチレングリコール4000(和光純薬)を加え、よく攪拌した。さらに、30℃にて1時間振とう培養した後、42℃にて5分間ヒートショックを与え、菌体を洗浄した後、200μlの水に懸濁したものをトリプトファン選択培地に塗沫した。
【0062】
得られたコロニーを新たなトリプトファン選択培地に画線培養し、安定性が確認できた選抜株について、遺伝子導入の有無をPCR解析によって確認した。安定したトリプトファン合成能を有し、かつ、これらのプライマーのもとでPCR増幅が確認できたものを、LDHKCB遺伝子が適切に導入された形質転換株(2コピー体)と判断した。この2コピー体は、図2に示すように、酵母の12番染色体のPDC1遺伝子を上記染色体導入型ベクターのDNAにて置換したものである。
【0063】
本実施例では、さらに、図2に示す酵母染色体(7番染色体および12番染色体)の所定位置への染色体導入型ベクターを、上記pBTrp−PDCl−LDHKCBベクターに準じてそれぞれ構築し、既に得られた2コピー体に対して導入し形質転換を行い、6コピー体、8コピー体および10コピー体を作製した。
【実施例2】
【0064】
(発酵試験1)
通気攪拌式の培養装置(千代田化工社製TFLシリーズ、ジャー容量1L)における各種の通気攪拌条件において、回分法にて発酵試験を行うとともに、各通気攪拌条件に対するkLaを、窒素ガスを用いるダイナミック法により求めた。発酵試験は、表1に示す通気攪拌条件下で行った。
【0065】
実施例1で作製したT167−10B株(LDH8コピー体)を、YPD培地100mlバッフル付き三角フラスコを80rpmで24時間振とう培養後、菌体を遠心分離により回収し前培養菌体とした。ケーンジュースを蒸留水で希釈して糖濃度を15wt%としたケーンジュース培地(121℃、30分で加熱滅菌)500mLに、この前培養菌体を初発菌体濃度がOD600=1〜3となるように接種し、温度32℃に設定し表1に示す各種の通気攪拌条件下で培養した。なお、培養中、中和剤としてアンモニア水を用いて随時pHを4.8〜5.4の間に調整した。培養開始後24時間、36時間および48時間で培養液を採取して、乳酸濃度を測定した。乳酸濃度の測定は、酵素センサー(王子計測機器、バイオセンサBF−4)を用いて行った。
【0066】
発酵試験後、溶存酸素電極を用いるダイナミック法により各発酵条件におけるkLaを測定した。まず、発酵試験に採用した同一の通気攪拌条件および温度条件下で水500mLを投入し、溶存酸素電極(メトラートレド製Tタイプ)を挿入し、窒素ガスを十分に水中に吹き込んで電極値が最低値となった時点で溶存酸素電極のゼロ校正を行い、窒素ガスから空気に通気ガスを変更して培養装置の運転を開始し、溶存酸素濃度の経時変化を測定してkLaを求めた。得られたkLaを併せて表1に示す。また、kLaを横軸に乳酸濃度を縦軸にしてプロットした結果を図3に示す。
【0067】
【表1】

【0068】
図3に示すように、kLaが高い場合に乳酸生産速度は速くなるが、kLaが36.0を超えると最終的な乳酸収量が低下する傾向にあった。また、kLaが低い場合には初期の乳酸生産速度が遅く、kLaが7.2より小さくなるとその傾向が強かった。さらに、kLaが6.0以上で36.0以下においては試験した培養期間においてはおおよそ安定した乳酸収量が得られ残留糖分もほとんどないが、kLaが18.0程度であるとき最も生産性が高かった。
【0069】
以上のことから、乳酸生産酵母は、40以下の低いkLa領域における一定のkLa範囲内において好ましい乳酸生産特性を発揮することがわかった。一方、このkLa範囲内においても、乳酸生産速度が大きく変化し、一定の培養期間内における乳酸収量や残留糖分に大きく影響することがわかった。
【実施例3】
【0070】
(発酵試験2)
次に、同一のkLaとなる各種の通気攪拌条件を設定して発酵試験を行い、乳酸生産酵母のkLa依存性を確認した。kLaと通気攪拌条件との関係を表2に示す。発酵試験は、表2に示す各種の通気攪拌条件を用いて行う以外は発酵試験1と同様に行った。結果を図4に示す。
【0071】
【表2】

【0072】
図4に示すように、kLaが18となる各種の通気攪拌条件で発酵試験を行った結果は、通気攪拌条件にかかわらずほぼ同一の乳酸生産特性を示した。これらの結果は、乳酸生産酵母の発酵特性が、通気や攪拌のそれぞれに依存せず、これらについて設定された条件によって得られる単位時間に気相から液相へ酸素を移動させ溶存酸素を生成させる能力に依存するものであることを支持した。
【実施例4】
【0073】
(発酵試験3)
本発酵試験では、乳酸生産酵母として実施例1で作製したPDC1p−LDH2コピー体、6コピー体および10コピー体を用いて、これらの各種乳酸生産酵母に対して各種のkLa(6、11、16、22および29)を設定して乳酸発酵を行い、LDHコピー数あるいはkLaと発酵特性との関係を確認した。発酵試験は、これらの乳酸生産酵母を用い、発酵用培地として初発糖濃度が10wt%となるように蒸留水で希釈したケーンジュース培地を用いて所定のkLaで最大72時間まで発酵を行った以外は、発酵試験1と同様に行った。なお、乳酸濃度に加えて、エタノール濃度およびグルコース濃度を、酵素センサー(王子計測機器、バイオセンサBF−4)を用いて測定した。なお、kLaと通気攪拌条件との関係は以下のとおりである。
【0074】
kLa 通気量(L/分) 攪拌速度(rpm)
6 0.3 60
11 0.3 150
16 0.3 230
22 0.3 270
29 0.3 290
【0075】
発酵48時間までの最大乳酸収量と該最大乳酸収量時におけるエタノール量、グルコース量および乳酸比率(%)(ただし、乳酸比率(%)=乳酸濃度/(乳酸濃度+2×エタノール濃度)×100とした。)を表3〜表5に示し、各種乳酸生産酵母についての最大72時間までの乳酸生産量のグラフを図5〜図7に示す。
【0076】
【表3】

【表4】

【表5】

【0077】
表3〜表5および図5〜図7に示すように、LDHのコピー数の観点からは、コピー数が多いほど乳酸生産速度は低下するが、乳酸収量や乳酸比率は増大する傾向にあった。また、LDHコピー数によりkLaに対する感受性が異なり、LDHコピー数が多いほど、kLaによって乳酸生産速度が大きく変化する傾向があることわかった。すなわち、LDHコピー数が多くなるほど、kLaが大きいときに乳酸生産速度が向上する傾向にあり、kLaが小さいときに乳酸生産速度が低下する傾向にあった。一方、kLaの観点からは、kLaが小さいほど、最終的な乳酸収量および乳酸比率が増大する傾向があることがわかった。以上のことから、乳酸生産酵母は、乳酸生産速度、乳酸収量および乳酸比率についてkLaに影響を受けるとともに、これらの影響は乳酸収量の大きいLDHのマルチコピー体においてより大きいことがわかった。したがって、乳酸生産酵母においては所望の乳酸生産特性を得るにはkLaの制御が有効であり、特にLDHのマルチコピー体については、kLaの制御によって発酵時間などのプロセス管理を容易に行いうることがわかった。
【実施例5】
【0078】
(発酵試験4)
本発酵試験は、kLaを培養工程において変化させたときの乳酸生産特性に与える影響を確認した。kLaが10.8の通気攪拌条件(通気量:0.3L/分、攪拌速度:150rpm)で発酵を開始し、6時間経過後および12時間経過後にkLaを18.0(通気量:0.3L/分、攪拌速度:240rpm)に切り換えて最大55時間培養した点、およびケーンジュースを初発糖濃度15wt%とした培地を用いる点以外は、発酵試験1と同様に発酵試験を行った。結果を図8に示す。
【0079】
図7に示すように、kLaを18.0に切り換えた以降において乳酸生産速度は明らかに速くなり、糖分を消費するまでの発酵時間を5〜10時間早めることができた。すなわち、培養工程の途中においてkLaを切り換えしたときにおいても、切り換え後のkLaに応じた乳酸生産酵母の乳酸生産特性が発現されることがわかった。このことから、培養工程中にkLaを変化させて乳酸生産速度を調整することにより、一定以上の乳酸収量や乳酸比率を確保しつつ乳酸生産酵母を用いた乳酸生産工程の培養期間を調整できることがわかった。以上のことは、乳酸生産速度がkLaに高度に依存していることを支持しており、同時に、kLaの制御あるいは培養工程におけるkLaの変化が、乳酸生産速度を調整して糖を消費するまでの発酵終了時間を制御するのに有効であることを支持している。
【0080】
(発酵試験5)
本発酵試験では、乳酸生産酵母として実施例1で作製したPDC1p−LDH10コピー体を用いて、この乳酸生産酵母に対して2種類のkLa(16および29)を設定して乳酸発酵を行い、発酵中、溶存酸素電極(メトラートレド製Tタイプ)を用いて溶存酸素濃度を測定した。発酵試験は、所定のkLaで発酵を行った以外は、発酵試験1と同様に行った。各kLa条件での発酵液の乳酸濃度と溶存酸素濃度についての測定結果を図9および図10に示す。
【0081】
図9および図10に示すように、溶存酸素濃度は、発酵試験を通じて1ppm以下であり、乳酸生産量に優れるkLa=16の条件においては、発酵試験を通じて0.5ppm以下であった。
【図面の簡単な説明】
【0082】
【図1】pBTrp−PDCl−LDHKCBベクターの構造を示す図。
【図2】実施例1で作製したLDH遺伝子導入酵母である2コピー体、6コピー体、8コピー体および10コピー体における染色体上のLDH遺伝子導入部位を示す図。
【図3】kLaを横軸に乳酸濃度を縦軸にしてプロットしたグラフ図。
【図4】kLa(18)一定の異なる通気攪拌条件下での乳酸生産量の変化を示すグラフ図。
【図5】LDH2コピー体について異なるkLa下での乳酸生産量の変化を示すグラフ図。
【図6】LDH6コピー体について異なるkLa下での乳酸生産量の変化を示すグラフ図。
【図7】LDH10コピー体について異なるkLa下での乳酸生産量の変化を示すグラフ図。
【図8】培養工程中にkLaを変化させた場合の乳酸生産量の変化を示すグラフ図。
【図9】発酵試験5における溶存酸素濃度の変化を示す図。
【図10】発酵試験5における乳酸濃度の変化を示す図。
【技術分野】
【0001】
本発明は、乳酸生産方法に関する。
【背景技術】
【0002】
近年、L−乳酸などの乳酸を、遺伝子組換え酵母を利用して生産することが試みられている。例えば、サッカロマイセス・セレビシエなどの酵母において強力なプロモーターであるピルビン酸脱炭酸酵素(PDC)プロモーターやアルコール脱水素酵素(ADH)プロモーターの制御下で乳酸脱水素酵素(LDH)遺伝子を発現させることが行われている(特許文献1、非特許文献1)。しかしながら、酵母の乳酸生産能をより効果的に利用して安定かつ効率的な工業的乳酸生産には、遺伝子組換え乳酸生産酵母特有の乳酸発酵条件を確立することが重要である。
【0003】
【特許文献1】特開2003−164295号
【非特許文献1】Enzyme and Microbaial Technology 33(2003)p.38−46
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明者らによれば、遺伝子組換え乳酸生産酵母は乳酸生産が強力なプロモーターを用いることによって強力に促進されているものの、発酵条件のわずかな変動により一定期間における乳酸収量が変動すること、すなわち、乳酸生産速度が変動するという不都合があることがわかった。発酵速度が低下して一定量の収量を得るための発酵が遅延化すれば、培養工程の生産管理上不確定なファクターが発生することになり好ましくない。また、発酵速度が低下しているにもかかわらず、一定時間で発酵を終了すれば、培養液中に原料たる糖分が残留することになる。残留糖分は、乳酸精製工程における乳酸比率を低下させるとともに、得られた乳酸を重合して得られるポリ乳酸の着色の一因となる。
【0005】
そこで、本発明では、遺伝子組換え乳酸生産酵母を培養して乳酸を生産する方法において、効率的に乳酸を生産することを一つの目的とする。また、本発明は、遺伝子組換え乳酸生産酵母を培養して乳酸を生産する方法において、発酵期間、発酵速度、収率などの発酵特性をコントロールすることを他の一つの目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、遺伝子組換え乳酸生産酵母について、その乳酸生産速度の変動や乳酸収量の変動などの原因を検討したところ、酸素移動容量係数(kLa)の変動に大きく依存していることを見出した。kLaは、発酵生産における発酵条件の一つであるが、遺伝子組換え乳酸生産酵母においては特に酸素移動容量係数に感受性が高く、低い酸素移動容量係数領域におけるわずかな差によって、乳酸生産特性、すなわち、乳酸生産速度、乳酸収量が異なってくることがわかった。本発明者らは、これらの知見に基づき、培養期間および一定の培養期間内における乳酸収量を容易に制御できることを見出し、本発明を完成した。すなわち、本発明によれば、以下の手段が提供される。
【0007】
本発明の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える遺伝子組換え乳酸生産酵母を培養する培養工程、を備え、前記培養工程においては、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養する工程を備える、乳酸生産方法が提供される。この形態においては、酸素移動容量係数(hr−1)が16以下の範囲で培養することも好ましい一態様であり、酸素移動容量係数(hr−1)が16超の範囲で培養することも好ましい一態様である。さらに、これらの上記いずれかの乳酸生産方法において、前記培養工程においては、酸素移動容量係数(hr−1)を変化させることが好ましい。
【0008】
また、本発明の他の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、を備え、前記培養工程において酸素移動容量係数(hr−1)を変化させる、乳酸生産方法が提供される。この形態においては、前記培養工程は、(a)前記乳酸生産酵母を酸素移動容量係数(hr−1)が16以下の範囲で培養する工程と、(b)前記乳酸生産酵母を酸素移動容量係数(hr−1)が16超の範囲で培養する工程と、を含むことが好ましく、さらに、前記(a)工程を実施後に前記(b)工程を実施することが好ましい。
【0009】
さらにまた、本発明の他の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を通気攪拌下で培養する工程を備える、乳酸生産方法が提供される。
【0010】
また、本発明の他の一つの形態によれば、乳酸生産方法であって、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養液の通気および/または攪拌下、該培養液の溶存酸素量が1mg/L以下の範囲で培養する工程を備える、乳酸生産方法が提供される。この形態においては、前記培養工程における培養液の溶存酸素量が0.5mg/L以下であることがより好ましい態様である。
【0011】
上記いずれかの乳酸生産方法においては、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、ピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられていることも好ましい態様である。さらに、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、酵母染色体上のピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられていることが好ましい態様である。さらに、前記乳酸生産酵母は、ピルビン酸脱炭酸酵素および/またはアルコール脱水素酵素活性が低下されていることが好ましい態様であり、酵母染色体上のピルビン酸脱炭酸酵素遺伝子が破壊されていることも好ましい態様である。さらにまた、前記乳酸生産酵母は、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を二以上備えていることも好ましい態様である。
【発明を実施するための最良の形態】
【0012】
本発明の乳酸生産方法は、乳酸脱水素酵素活性を有する遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、を備えている。本発明の第1の形態においては、前記培養工程においては、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養することを特徴としている。酸素移動容量係数(以下、単にkLaという。)(hr−1)が6以上36以下の範囲において、乳酸生産酵母の乳酸生産速度、乳酸収量、乳酸比率(生産物における乳酸の比率)について好ましい特徴を有する。このためこの範囲内のkLaで乳酸生産酵母を培養することで、効率的な乳酸生産が可能となる。kLa(hr−1)が6未満では、乳酸生産速度が遅くなる傾向があり、kLa(hr−1)が36を超えると乳酸収量が低下する傾向にある。
【0013】
また、本発明の第2の形態においては、前記培養工程においては、kLa(hr−1)を変化させることを特徴としている。前記乳酸生産酵母は、その乳酸生産速度がkLa(hr−1)に依存する傾向が強いため、kLa(hr−1)を調整することで目的とする培養期間での乳酸生産を実現することができる。また、一定の培養期間内において残留糖分を抑制して高い乳酸収量や乳酸比率を得ることができる。
【0014】
さらに、本発明の第3の形態においては、前記培養工程は、前記乳酸生産酵母を通気攪拌下で培養する工程を備えることを特徴としている。従来この種の酵母や乳酸菌において用いられていない通気攪拌下での培養によって予想外に良好な乳酸収量、乳酸比率を得ることができるとともに、乳酸生産速度も容易に制御できる。
【0015】
さらに、本発明の第4の形態においては、前記培養工程は、前記乳酸生産酵母を培養液の通気および/または攪拌下、該培養液の溶存酸素濃度が1mg/L以下の範囲で培養することを特徴とする。こうした酸素条件で培養することで、予想外に良好な乳酸収量、乳酸比率を得ることができるとともに、乳酸生産速度も容易に制御できる。
【0016】
以下、本発明の実施の形態について、詳細に説明する。
【0017】
(遺伝子組換え乳酸生産酵母)
(酵母)
本発明の乳酸生産形質転換酵母は、外来の乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を有する形質転換酵母である。本乳酸生産酵母を得るための酵母としては、アルコール発酵を行う酵母であって、サッカロマイセス・セレビシエ、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)などのサッカロマイセス属酵母、ピキア・パストリス(Pichia pastoris)、などの酵母を挙げることができる。より好ましくは、サッカロマイセス・セレビシエなどのサッカロマイセス属を始めとする酵母である。好ましい酵母の一例としては、サッカロマイセス・セレビシエIFO2260株や同YPH株を例示できる。
【0018】
なお、本乳酸生産酵母および乳酸生産方法において乳酸とは、L−乳酸、D−乳酸、及びDL−乳酸があるが、これらのいずれであってもよい。
【0019】
(ピルビン酸脱炭酸酵素活性あるいはアルコール脱水素酵素活性の低下)
本乳酸生産酵母においては、ピルビン酸脱炭酸酵素(PDC)活性および/またはアルコール脱水素酵素(ADH)活性が低下されていることが好ましい。これらの酵素は、酵母のアルコール発酵経路の酵素であり、アルコール発酵を行う酵母がその染色体上に本来的に有している酵素である。ピルビン酸脱炭酸酵素は、いわゆるオートレギュレーション機構を有する酵素であり、ピルビン酸脱炭酸酵素1〜6等がある。これらのうちいずれか1種あるいは2種以上が破壊されていればよいが、好ましくは最も活性が高いあるいは大量に発現されているピルビン酸脱炭酸酵素1(PDC1)の活性が低下されていることが好ましい。また、アルコール脱水素酵素においても各種の亜種(ADH1〜ADH7)があるが、アルコール脱水素酵素1(ADH1)が大量に発現されている。したがってアルコール脱水素酵素1の活性が低下されていることが好ましい。
【0020】
ピルビン酸脱炭酸酵素活性および/またはアルコール脱水素酵素活性が低下されているとは、人工的な操作によりあるいはスクリーニングによって、野生型よりも低い活性の該酵素が生産されているかあるいは該酵素の生産量が野生型よりも少ないものであることが好ましい。このような酵素活性の低下のための人工的操作としては、この酵素遺伝子を破壊(ノックアウト)することが好ましい。染色体上の特定遺伝子を破壊する手法は、当業者において周知である。
【0021】
(乳酸脱水素酵素)
本乳酸生産酵母は、乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子(LDH遺伝子)を保持している。LDH遺伝子は、酵母においては外来性である。乳酸脱水素酵素(LDH)としては、生物の種類に応じてあるいは生体内においても各種同族体が存在する。本発明において使用する乳酸脱水素酵素としては、天然由来のLDHの他、化学合成的あるいは遺伝子工学的に人工的に合成されたLDHも包含している。LDHとしては、好ましくは、ラクトバシルス・ヘルベティカス、ラクトバシルス・カゼイ、クルイベロマイセス・サーモトレランス、トルラスポラ・デルブルッキ、シゾサッカロミセス・ポンビ、リゾプス・オリゼ、B.メガテリウムなどの原核生物もしくはカビなどの真核微生物由来であり、より好ましくは、植物、動物、昆虫などの高等真核生物由来であり、さらに好ましくは、ウシを始めとする哺乳類を含む高等真核生物由来である。例えば、ウシ由来のLDH(L−LDH)である。例えば、ウシ由来のLDHとして配列番号:2に示すアミノ酸配列からなるタンパク質を挙げることができる。また、かかるLDHをコードするDNAとしては、配列番号:1に記載される塩基配列からなるDNAを挙げることができる。さらに、本発明におけるLDHは、これらのLDHのホモログも包含している。LDHホモログは、天然由来のLDHのアミノ酸配列において、1もしくは数個のアミノ酸の置換、欠失、挿入および/または付加されたアミノ酸でありかつLDH活性を有しているタンパク質、および、天然由来のLDHとアミノ配列の相同性が少なくとも70%、好ましくは80%以上を有しかつLDH活性を有しているタンパク質を含んでいる。したがってLDH遺伝子として、これらのいずれかのLDHをコードするDNAを用いることができる。本乳酸生産酵母は、LDH遺伝子を少なくとも一つ、好ましくは二以上保持している。より好ましくは三以上保持している。さらに好ましくは四つ以上保持している。
【0022】
(PDCプロモーター)
LDH遺伝子は、強力なプロモーター活性を有するプロモーターの制御下に発現可能に備えられていることが好ましい。例えば、ピルビン酸脱炭酸酵素遺伝子プロモーター(PDCプロモーター)の制御下に発現可能に備えられていることが好ましい。なかでも、十分に強力なプロモーターであるPDC1プロモーターを用いることが好ましい。より好ましくは、サッカロマイセス属(好ましくはセレビシエ)のPDC1プロモーターである。
【0023】
例えば、PDC1プロモーターとしては、配列番号:3に記載の塩基配列からなるDNAの他、同等の機能を有する限り、該DNAとストリンジェントな条件でハイブリダイズするDNA、該塩基配列において1あるいは2以上の塩基が置換、欠失、付加、及び/又は挿入された配列からなるDNA、あるいは、該DNAとの相同性が70%以上、より好ましくは80%以上、さらに好ましくは90%以上、最も好ましくは95%以上であるDNAを用いることができる。すなわち、酵母染色体上のPDC1プロモーターが、同一ではないが同等の機能を有するこれらのプロモーター活性を有するDNAによって相同組換え等を介して置換されていてもよい。
【0024】
本明細書においてストリンジェントな条件とは、50%ホルムアミド存在下でハイブリダイゼーション温度が37℃であるハイブリダイゼーション条件あるいはこれと同様のストリンジェンシーのハイブリダイゼーション条件を意味している。よりストリンジェンシーの高い条件によれば、より相同性の高いDNAを単離できる。かかるハイブリダイゼーション条件としては、例えば、50%ホルムアミド存在下でハイブリダイゼーション温度が約42℃、さらにストリンジェンシーの高い条件としては、50%ホルムアミド存在下で約65℃のハイブリダイゼーション条件を挙げることができる。
【0025】
また、本明細書において、DNAなどの核酸の相同性については、DNAの塩基配列のホモロジーは、遺伝子解析プログラムBLASTなどによって決定することができる。なお、DNAの塩基配列のホモロジーは、遺伝子解析プログラムBLAST(http://blast.genome.ad.jp),FASTA(http://fasta.genome.ad.jp/SIT/FASTA.html)などによって決定することができる。
【0026】
(他のプロモーター)
また、LDH遺伝子は、ADH遺伝子のプロモーター(ADHプロモーター)を初めとする他の各種プロモーターの制御下に発現可能に備えることもできる。ADHは既に述べたようにアルコール発酵経路においてPDCのすぐ後段の酵素である。ADHプロモーターとしては、十分に強力なプロモーターであるADH1プロモーターを用いることが好ましい。
【0027】
また、この他、LDH遺伝子は、酵母サッカロマイセス・セレビジエの高浸透圧応答7遺伝子(HOR7遺伝子)、グリセルアルデヒド3リン酸脱水素酵素2遺伝子(TDH2遺伝子)、ヘキソース輸送タンパク質7遺伝子(HXT7遺伝子)、熱ショックタンパク質30遺伝子(HSP30遺伝子)、チオレドキシンペルオキシダーゼ1遺伝子(AHP1遺伝子)、膜タンパク質1関連遺伝子(MRH1遺伝子)の遺伝子、ホスホグリセレートキナーゼ遺伝子(PGK遺伝子)、グリセルアルデヒド3リン酸脱水素酵素3遺伝子(TDH3遺伝子)、ガラクトース1リン酸キナーゼ1遺伝子(GAL1遺伝子)および転写エンハンサー因子1遺伝子(TEF1遺伝子)のプロモーターの制御下に発現可能に導入することもできる。
【0028】
なお、これらの他のプロモーターは、酵母の染色体上における各プロモーターと同等の機能を有する限り、該プロモーターのDNAとストリンジェントな条件でハイブリダイズするDNA、該塩基配列において1あるいは2以上の塩基が置換、欠失、付加、及び/又は挿入された配列からなるDNA、あるいは、ADH1プロモーターとの相同性が70%以上、好ましくは80%以上、より好ましくは90%以上、最も好ましくは95%以上であるDNAを用いることができる。
【0029】
LDH遺伝子は、酵母染色体外で維持されるプラスミドやYACなどにおいて保持されていてもよいが、好ましくは酵母染色体に組み込まれて保持される。
【0030】
LDH遺伝子は、好ましくは、酵母染色体において上記各種プロモーターの制御下に発現可能に備えられている。したがって、上記各種プロモーターとLDH遺伝子とを含む発現カセットを構築して、酵母染色体に導入することができる。また、LDH遺伝子は、酵母染色体上にあるこれらの各種プロモーターの制御下にある内在性遺伝子を破壊するとともに該プロモーターの制御下に発現可能に組み込まれることもできる。また、これらの各種プロモーターの制御下に発現可能に連結したLDH遺伝子を、PDC遺伝子および/またはADH遺伝子を破壊するように酵母染色体に組み込みこともできる。
【0031】
さらに、PDCプロモーターやADHプロモーターの制御下にLDH遺伝子を発現可能に備えるようにするには、酵母染色体におけるこれらのプロモーターの本来の位置においてこれらのプロモーターによって制御可能であってかつPDC遺伝子を破壊するように酵母染色体に組み込まれていることが好ましい。こうすることで、PDC活性やADH活性を低下させてアルコール発酵を抑制できるとともに、本来PDC遺伝子発現に作用していた強力なPDCプロモーターやADHプロモーター活性をLDH遺伝子発現にスイッチさせることができる。破壊されそしてそれらのプロモーターがLDH遺伝子の発現に利用される遺伝子は、好ましくはPDC1遺伝子やADH1遺伝子である。最も強力なPDC1プロモーターによって制御されるPDC1遺伝子が破壊されてLDH遺伝子が代わりに発現されることで効果的にPDC活性低下とLDH活性発現とを実現できる。
【0032】
なお、PDC1遺伝子は、本発明者らが既に開示しているように、オートレギュレーション機構が存在する遺伝子である(特開2003−164295号)。オートレギュレーション機構とは、同じ機能を有する遺伝子が同一生物において複数存在し、通常、そのうちの少なくとも一つは発現しているが、残りは抑制されており、通常発現している遺伝子が破壊などにより機能しなくなった場合にのみ、残りの遺伝子が発現されてその機能を継続する機構を意味している。かかる機構が発現するため、例えば、酵母のPDC1遺伝子が破壊されたとしても、酵母の生理的機能が維持されることになる。このようなオートレギュレーション機構が存在する遺伝子を破壊することで、生物自体の生存、増殖機能を維持することができて、結果として、外来DNAを保持する形質転換体の増殖を維持しながら目的産物を効果的に生産させることができる。
【0033】
なお、明らかなように、PDCプロモーター、ADHプロモーター及び他のプロモーターのDNAは、ゲノムDNAであってもよく、また、化学的に合成されたDNAであってもよい。
【0034】
以上のように、本乳酸生産酵母においては、上記したPDC活性及びADH活性を低下させる態様、各種のLDH遺伝子発現態様を各種組み合わせて採ることができる。好ましい乳酸生産酵母は、染色体上のPDC(好ましくはPDC1)遺伝子が破壊されるとともに破壊された該遺伝子のプロモーターの制御下にLDH遺伝子を発現可能に備えている。同時に、染色体上のADH(好ましくはADH1)遺伝子が破壊されていてもよい。また、この態様において、破壊された該ADH(好ましくはADH1)遺伝子のプロモーターの制御下にLDH遺伝子を発現可能に備えることもできる。こうした乳酸生産酵母においては、好ましくは2以上、より好ましくは4以上、さらに好ましくは6以上、最も好ましくは8以上のLDH遺伝子を染色体上に備えている。
【0035】
本乳酸生産酵母を取得するには、宿主酵母に対して、PDC遺伝子及びADH遺伝子の破壊を行うとともに、LDH遺伝子を発現可能に導入して形質転換することが好ましい。酵母に対してこのような遺伝子修飾を行うには、組換え用DNA構築物を利用する。組換え用DNA構築物は、特に限定しないで、線状等のDNA断片、プラスミド(DNA)、ウイルス(DNA)、レトロトランスポゾン(DNA)、人工染色体(YAC)を、外来遺伝子の導入形態(染色体外あるいは染色体内)等に応じて選択してベクターとしての形態をとることができる。
【0036】
PDC遺伝子あるいはADH遺伝子の破壊のためのDNA構築物は、これらの遺伝子部位に導入して遺伝子を破壊するために相同組換え用の配列を備えることができる。相同組換え用DNA配列は、破壊しようとするPDC遺伝子及びADH遺伝子であるターゲット部位あるいはその近傍のDNA配列と相同なDNA配列である。相同組換え用DNA配列は、一つのターゲット遺伝子あるいはその近傍の少なくとも1箇所に相同である1の配列を有しており、好ましくは、ターゲット遺伝子あるいはその近傍の少なくとも2箇所にそれぞれ相同な配列を備えている。例えば、2個の相同組換え用DNA配列を、染色体上のターゲット遺伝子の上流側と下流側のDNAとのそれぞれに相同なDNA配列とし、これらの相同組換え用DNA配列の間に遺伝子を破壊するためのDNAを備えるDNA構築物を酵母染色体に相同組換えにより導入することでターゲット部位の遺伝子を破壊することができる。
【0037】
このような染色体上への組み込みを実現するための相同組換え用DNAの選択は、当業者において周知であり、当業者であれば必要に応じて適切な相同組換え用DNAを選択して相同組換え用DNA構築物を構成することができる。例えば、PDCプロモーターの少なくとも一部と、PDC遺伝子あるいはターミネーターの少なくとも一部とにそれぞれ相同なDNA配列を相同組換え用DNA配列として用いることができる。同様に、ADHプロモーターの少なくとも一部とADH遺伝子あるいはターミネーターの少なくとも一部とにそれぞれ相同なDNA配列を相同組換え用DNA配列として用いることができる。
【0038】
PDC遺伝子を破壊するDNA構築物には、PDC遺伝子をターゲットとするための相同組換え用DNAとともにPDC遺伝子を置換可能な形態でLDH遺伝子を有することができる。このようなDNA構築物によれば、PDC遺伝子の破壊とともにPDCプロモーターの制御下にLDH遺伝子を発現可能に導入できる。
【0039】
また、PDC遺伝子を破壊するとともに、破壊した該PDC遺伝子のプロモーターの制御下にLDH遺伝子を導入することもできるが、相同組換えにより染色体上のPDCプロモーターに替えて同等のプロモーターを導入することもできる。例えば、既に述べたPDC1プロモーターのホモログ等である。
【0040】
なお、使用するDNA構築物には、CYC1ターミネーターやTDH3ターミネーターなどのターミネーター他、必要に応じてエンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー、リボソーム結合配列(SD配列)を連結することができる。選択マーカーとしては、特に限定しないで、薬剤抵抗性遺伝子、栄養要求性遺伝子などを始めとする公知の各種選択マーカー遺伝子を利用できる。例えば、アンピシリン耐性遺伝子、カナマイシン耐性G418遺伝子、ハイグロマイシン耐性遺伝子、ブレオマイシン耐性遺伝子、ネオマイシン耐性遺伝子、ジヒドロ葉酸還元酵素遺伝子、クロラムフェニコール耐性遺伝子、シクロヘキサミド耐性遺伝子等を使用することができる。
【0041】
(乳酸の生産方法)
本乳酸生産酵母を適当な炭素源の存在下で培養することにより、培養物中にLDH遺伝子の発現産物である乳酸を生成させることができる。本乳酸生産方法によれば、培養系から乳酸を分離する工程を実施することにより、乳酸を得ることができる。なお、本発明において培養物とは、培養上清の他、培養細胞あるいは菌体、細胞若しくは菌体の破砕物を包含している。
【0042】
本発明の乳酸生産酵母の培養にあたっては、酵母の種類に応じて培養方法や培養条件を選択することができる。例えば、ジャーファーメンターを用いた液体培養法を挙げることができ、回分培養、半回分培養などの培養形式を採用できる。また、酵母を培養する培地としては、微生物が資化可能な炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行うことができる培地であれば、天然培地、合成培地のいずれも使用することができる。炭素源としては、グルコース、フルクトース、スクロース、デンプン、セルロース等の炭水化物、酢酸、プロピオン酸等の有機酸、エタノール、プロパノール等のアルコールを用いることができる。窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム等の無機酸もしくは有機酸のアンモニウム塩またはその他の含窒素化合物の他、ペプトン、肉エキス、コーンスティープリカー等を用いることができる。無機物としては、リン酸第一カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウムなどを用いることができる。
【0043】
培養温度は、用いる乳酸生産酵母の生育可能な範囲で選択することができ、例えば、約20℃〜約40℃とすることができる。また、培地pHは、pHは2.0〜6.0に保持することが好ましく、必要に応じて産物である乳酸等の中和を行うかあるいは、連続的に乳酸を除去する等の処理を行うこともできる。
【0044】
また、培養期間は、他の培養条件、特に、後述するようにkLa(hr−1)によって大きく異なるが6〜72時間程度とすることが好ましく、より好ましくは48時間程度とする。
【0045】
本乳酸生産方法は、乳酸生産酵母を通気攪拌下で、あるいは微好気状態よりも好気状態で培養することが好ましい。一般に、乳酸菌による乳酸発酵や酵母によるエタノール発酵では、通気を行わない微好気状態で発酵を行う。これに対して、本方法では、酵母による発酵生産においては従来用いられていない通気攪拌によって得られる培養液中の酸素条件を用いることを特徴としている。すなわち、微好気状態よりも好気的な酸素条件で発酵を行うことを特徴としている。乳酸生産酵母については、このような酸素条件下において初めて効率的な乳酸発酵が実現される。特に、遺伝子組換え乳酸生産酵母、なかでも、PDC活性が低下するなどアルコール発酵が抑制された乳酸生産酵母あるいはPDC遺伝子のプロモーター下の制御下においてLDH遺伝子が発現可能に備えられた乳酸生産酵母においては、理由は明らかではないが、こうした酸素条件において初めて実用的な乳酸生産特性を得ることができる。なお、本生産方法においては、微好気状態よりも好気的な状態が得られる限り、通気および攪拌の双方を行うことのほか、通気および攪拌のうち一方のみを行ってもよい。
【0046】
本方法の培養工程において得ようとする酸素条件は、使用する乳酸生産酵母が乳酸発酵可能なあるいは乳酸発酵を促進可能な程度であればよい。例えば、かかる酸素条件は、例えば、kLa(hr−1)として表現することができる。kLa(hr−1)は、通気攪拌培養時において、単位時間に気相から液相へ酸素を移動させ溶存酸素を生成させる能力を示すものであり、以下の式(1)で表すことができる。また、kLa(hr−1)(以下、単にkLaと略す。)は、通気攪拌培養時において、気相から供給される酸素と微生物によって消費される酸素とによって表される培養液中の酸素の収支式(2)において用いられる(生物工学実験書、日本生物工学会編、培風館、p.310(1992))。
【0047】
dC/dt=kLa×(C*−C) (1)
dC/dt=kLa×(C*−C)−Q02×X (2)
ここで、C:培養液中の溶存酸素濃度DO(ppm)、C*:微生物による酸素の消費がない場合の気相と平衡の溶存酸素濃度DO(ppm)、X:菌体濃度(g/L)、Q02:比呼吸速度(mgO2/(g・cell・h)kLa:酸素移動容量係数(hr−1)である。
【0048】
通気攪拌培養装置におけるkLaは、亜硫酸酸化法(バッチ法・連続法)、気体置換法(Gassing out法(スタティック法、ダイナミック法))、排気ガス分析法などで測定できる(前掲生物工学実験書、p311等)。以下に、気体置換法(ダイナミック法)によるkLaの測定の一例を示す。通気攪拌培養装置に水あるいは使用する培地をいれ、これらの液体中の酸素を窒素ガスにより置換するかあるいは亜硫酸ナトリムをほぼ飽和濃度に達する程度に加えることなどにより脱酸素するかして該液体の酸素濃度を低下させる。次いで、かかる液体中に溶存酸素濃度電極を差し込み、通気速度、攪拌速度および温度を設定して所定の通気攪拌下での溶存酸素の上昇過程を測定する。ここで、式(1)より、下記式(3)が導かれるため、通気した時間に対して、C*−Cの対数をプロットすることで、kLaを求めることができる。
In(C*−C)=−kLa×t (3)
【0049】
本発明においては、いくつかの通気条件と攪拌条件とを組み合わせた通気攪拌条件を設定して、これらの各種通気攪拌条件とkLaとの関係を予め求めた上、使用する通気攪拌培養装置についてkLaが6以上36以下となる通気攪拌条件を予め設定することが好ましい。各種の通気攪拌条件に対するkLaは、各通気攪拌条件に設定した通気攪拌培養装置を上記記載の方法に従って運転し、溶存酸素濃度の上昇過程と平衡溶存酸素濃度とを測定することで求めることができる。
【0050】
kLaが6以上36以下の範囲においては、乳酸生産酵母の乳酸生産速度、乳酸収量および残留糖分について好ましい培養特性を得ることができるため、安定して効率的な乳酸生産が実現できる。また、このkLaの範囲内で変化させて培養工程を実施することで、所望の培養期間で乳酸収量や残留糖分の好ましいレベルを確保して培養を終了させることができる。また、乳酸生産酵母はkLaがこの範囲内で低い場合には、乳酸生産速度が遅くなる傾向があり、kLaが高い場合には、乳酸生産速度が速くなる傾向がある。したがって、例えば、比較的長い培養期間を設定する場合には、このkLa範囲において相対的に低いkLaを設定することができ、比較的短い培養期間を設定する場合には、相対的に高いkLaを設定することができる。
【0051】
例えば、kLaが16以下で培養することにより、最終的な乳酸収量を増大させることができる。kLaが16以下の場合には、おおよそLDH遺伝子のコピー数によらずに良好な最終乳酸収量を得ることができることが本発明者らより確認されている。また、このような傾向はkLaが小さいほど顕著である。さらに、kLaが小さいほど乳酸比率が高くなる傾向がある。一方、kLaが16超で培養することにより、乳酸生産速度を向上させることができる。乳酸生産速度を向上させることで、培養工程時間を制御することが可能となる。より顕著に乳酸生産速度を向上させるには、kLaを18以上とすることが好ましく、kLaを20以上とすることがより好ましく、kLaが22以上であることが一層好ましい。
【0052】
培養工程においては、kLaを一定とすることもできるが、培養工程においてkLaを変化させることもできる。すなわち、予め異なるkLaによる培養期間を設定しておくこともできるし、kLaを一定に設定して開始した培養工程における乳酸濃度や糖分濃度のモニタリング結果に応じて、異なるkLaの培養期間を新たに追加設定したりもできる。さらに、予め異なるkLaの培養工程を設定しておいてもよいし、こうした培養工程においても培養のモニタリング結果に応じてそれぞれの培養工程時間を変化させてもよい。このような培養工程におけるkLaの調整により、都合のよい培養工程時間内に好ましい乳酸収量や乳酸比率を得ることができる。
【0053】
例えば、kLa一定の培養工程におけるモニタリングにおいて所定時点における残留糖分および/または乳酸濃度が予定値を下回る場合には、kLaをより高く、好ましくは16超、さらに好ましくは18以上、より好ましくは20以上、一層好ましくは22以上に変化させることで、培養工程時間を大きく延長することなく好ましい残留糖分および/または乳酸収量を確保できる。
【0054】
培養工程には、kLaが16以下の第1の培養期間と、kLaが16超の第2の培養期間とを備えることができる。kLaが16以下であるとき、kLaが16超の範囲内にあるときよりも乳酸生産酵母の乳酸生産速度は遅いがその速度が持続される傾向にあり、最終的な乳酸収量や乳酸比率を向上させることができる。kLaは14以下であることがより好ましく、さらに好ましくは11以下である。kLaが14以下さらに11以下とすることでかかる傾向が顕著になるからである。なお、第1の培養期間におけるkLaは6以上であれば、乳酸生産速度が遅くなりすぎることがないため好ましい。一方、kLaが16超の範囲にあるとき、最終的な乳酸収量が低下する傾向にはあるものの乳酸生産速度は早い傾向にあるため、第2の培養期間を設定することで、培養期間を短縮することができる。kLaは18以上であることがより好ましく、さらに好ましくは20以上であり、一層好ましくは22以上である。なお、第2の培養期間における上限は36以下であれば、乳酸収量を大きく低下させることがない。
【0055】
このように、異なるkLa領域での培養期間をそれぞれ備えることで、所望の培養期間、高い乳酸収量および乳酸比率、低い残留糖分を適宜得ることができる。異なるkLa領域での培養工程を組み合わせる場合、より低いkLa領域の培養工程を実施し、より高い領域の培養工程を実施することが好ましい。こうすることで、乳酸収量と乳酸生産速度の双方のバランスを容易に図ることができる。例えば、上記した第1の培養期間を実施後に上記第2の培養期間を実施することが好ましい。こうした順序で異なるkLaの培養期間を実施することで、培養期間、乳酸収量、乳酸比率および残留糖分等について好ましい特性を得ることができるとともに、培養工程の状況変化に対応することが容易となる。なお、異なるkLa領域の培養工程を備える場合、2種のkLaによる各培養工程を備えるほか、3種以上のkLaの各培養工程を備えることもできる。
【0056】
また、本培養工程において得ようとする酸素条件は、乳酸生産酵母の培養工程における培養液の溶存酸素量として表現することもできる。乳酸生産酵母の培養工程においては、溶存酸素量は、1mg/L以下であることが好ましい。1mg/L以下であると乳酸の収量を一定以上に確保できるからである。より好ましくは0.5mg/L以下である。0.5mg/L以下であると、高い乳酸収率が得られるからである。なお、こうした溶存酸素濃度下においても微好気状態よりも好気状態であることが好ましい。こういった酸素条件は、培養液を通気のみでもまた攪拌のみでも得られることがあり、これらを双方組み合わせることによっても得ることができる。培養液の溶存酸素量は、培養工程全体を通じて上記濃度以下であることが好ましい。また、溶存酸素量の測定は、培養槽の酸素条件を代表できるような測定位置および測定個所における測定値から得られる数値を用いることが好ましい。
【0057】
培養終了後、培養物から乳酸あるいはその塩を分離するには、通常の乳酸精製手段を使用することができる。例えば、酵母内に生産された場合は、常法により菌体を超音波破壊処理、摩砕処理、加圧破砕などに細胞を破壊して,遺伝子産物を細胞と分離することができる。この場合、必要に応じてプロテアーゼを添加する。また、菌体外に乳酸が生産された場合には、この培養液等を、ろ過、遠心分離などにより固形分を除去する。
【0058】
これらの粗抽出画分に対しては、従来公知の各種精製分離法等を利用して、乳酸を精製することができる。また、必要に応じて、当該粗抽出画分及びその精製物に対してエステル化等を行うことにより、各種の乳酸誘導体を得ることができる。
【実施例1】
【0059】
以下に、本発明の具体例を記載するが、本発明を以下の具体例に限定する趣旨ではなく、本発明の要旨を逸脱しない範囲で種々の態様で実施できる。なお、以下の実施例においては、kLaは特に断りのない限りkLa(hr−1)を意味している。
【0060】
(乳酸生産形質転換酵母の作製)
LDH遺伝子(ウシL−LDH由来)を導入したサッカロマイセス・セレビシエを、本発明者らが既に構築したpBTrp−PDC1−LDHKCBベクター(特開2003−259878号公報に記載)を用いて調製した。本ベクターは、酵母の12番染色体上のPDC1遺伝子をターゲットとする染色体導入型ベクターであり、染色体上のPDC1プロモーターをコードするDNA配列とPDC1遺伝子の下流側との相同組換え部位とを有している(図1)。このベクターが染色体上のPDC1遺伝子に導入されれば、PDC1プロモーターの制御下においてLDH遺伝子が発現されることになる。なお、酵母への遺伝子導入法は、Itoらの手法(Ito, H., Y. Fukuda, K.Murata and A. Kimura, Transformation of intact yeast cells treated with alkali cations J. Bacteriol. Vol.153, p163-168)に従った。すなわち、宿主である酵母IFO2260株(社団法人発酵研究所に登録されているサッカロマイセス。セレビジエ菌株)のトリプトファン合成能を欠損した株を、10mlYPD培地にて30℃で対数増殖期まで培養を行い、集菌およびTEバッファによる洗浄を行い、次に、0.5mlTEバッファと0.5ml 0.2Mの酢酸リチウムを加え、30℃にて1時間の振とう培養を行った後に、染色体導入型ベクターであるpBTrp−PDCl−LDHKCBベクターを、制限酵素ApaIおよびSacI(いずれも宝酒造)で処理して、これを添加した。
【0061】
本酵母懸濁液を30℃で30分振とう培養後、150μlの70%ポリエチレングリコール4000(和光純薬)を加え、よく攪拌した。さらに、30℃にて1時間振とう培養した後、42℃にて5分間ヒートショックを与え、菌体を洗浄した後、200μlの水に懸濁したものをトリプトファン選択培地に塗沫した。
【0062】
得られたコロニーを新たなトリプトファン選択培地に画線培養し、安定性が確認できた選抜株について、遺伝子導入の有無をPCR解析によって確認した。安定したトリプトファン合成能を有し、かつ、これらのプライマーのもとでPCR増幅が確認できたものを、LDHKCB遺伝子が適切に導入された形質転換株(2コピー体)と判断した。この2コピー体は、図2に示すように、酵母の12番染色体のPDC1遺伝子を上記染色体導入型ベクターのDNAにて置換したものである。
【0063】
本実施例では、さらに、図2に示す酵母染色体(7番染色体および12番染色体)の所定位置への染色体導入型ベクターを、上記pBTrp−PDCl−LDHKCBベクターに準じてそれぞれ構築し、既に得られた2コピー体に対して導入し形質転換を行い、6コピー体、8コピー体および10コピー体を作製した。
【実施例2】
【0064】
(発酵試験1)
通気攪拌式の培養装置(千代田化工社製TFLシリーズ、ジャー容量1L)における各種の通気攪拌条件において、回分法にて発酵試験を行うとともに、各通気攪拌条件に対するkLaを、窒素ガスを用いるダイナミック法により求めた。発酵試験は、表1に示す通気攪拌条件下で行った。
【0065】
実施例1で作製したT167−10B株(LDH8コピー体)を、YPD培地100mlバッフル付き三角フラスコを80rpmで24時間振とう培養後、菌体を遠心分離により回収し前培養菌体とした。ケーンジュースを蒸留水で希釈して糖濃度を15wt%としたケーンジュース培地(121℃、30分で加熱滅菌)500mLに、この前培養菌体を初発菌体濃度がOD600=1〜3となるように接種し、温度32℃に設定し表1に示す各種の通気攪拌条件下で培養した。なお、培養中、中和剤としてアンモニア水を用いて随時pHを4.8〜5.4の間に調整した。培養開始後24時間、36時間および48時間で培養液を採取して、乳酸濃度を測定した。乳酸濃度の測定は、酵素センサー(王子計測機器、バイオセンサBF−4)を用いて行った。
【0066】
発酵試験後、溶存酸素電極を用いるダイナミック法により各発酵条件におけるkLaを測定した。まず、発酵試験に採用した同一の通気攪拌条件および温度条件下で水500mLを投入し、溶存酸素電極(メトラートレド製Tタイプ)を挿入し、窒素ガスを十分に水中に吹き込んで電極値が最低値となった時点で溶存酸素電極のゼロ校正を行い、窒素ガスから空気に通気ガスを変更して培養装置の運転を開始し、溶存酸素濃度の経時変化を測定してkLaを求めた。得られたkLaを併せて表1に示す。また、kLaを横軸に乳酸濃度を縦軸にしてプロットした結果を図3に示す。
【0067】
【表1】

【0068】
図3に示すように、kLaが高い場合に乳酸生産速度は速くなるが、kLaが36.0を超えると最終的な乳酸収量が低下する傾向にあった。また、kLaが低い場合には初期の乳酸生産速度が遅く、kLaが7.2より小さくなるとその傾向が強かった。さらに、kLaが6.0以上で36.0以下においては試験した培養期間においてはおおよそ安定した乳酸収量が得られ残留糖分もほとんどないが、kLaが18.0程度であるとき最も生産性が高かった。
【0069】
以上のことから、乳酸生産酵母は、40以下の低いkLa領域における一定のkLa範囲内において好ましい乳酸生産特性を発揮することがわかった。一方、このkLa範囲内においても、乳酸生産速度が大きく変化し、一定の培養期間内における乳酸収量や残留糖分に大きく影響することがわかった。
【実施例3】
【0070】
(発酵試験2)
次に、同一のkLaとなる各種の通気攪拌条件を設定して発酵試験を行い、乳酸生産酵母のkLa依存性を確認した。kLaと通気攪拌条件との関係を表2に示す。発酵試験は、表2に示す各種の通気攪拌条件を用いて行う以外は発酵試験1と同様に行った。結果を図4に示す。
【0071】
【表2】

【0072】
図4に示すように、kLaが18となる各種の通気攪拌条件で発酵試験を行った結果は、通気攪拌条件にかかわらずほぼ同一の乳酸生産特性を示した。これらの結果は、乳酸生産酵母の発酵特性が、通気や攪拌のそれぞれに依存せず、これらについて設定された条件によって得られる単位時間に気相から液相へ酸素を移動させ溶存酸素を生成させる能力に依存するものであることを支持した。
【実施例4】
【0073】
(発酵試験3)
本発酵試験では、乳酸生産酵母として実施例1で作製したPDC1p−LDH2コピー体、6コピー体および10コピー体を用いて、これらの各種乳酸生産酵母に対して各種のkLa(6、11、16、22および29)を設定して乳酸発酵を行い、LDHコピー数あるいはkLaと発酵特性との関係を確認した。発酵試験は、これらの乳酸生産酵母を用い、発酵用培地として初発糖濃度が10wt%となるように蒸留水で希釈したケーンジュース培地を用いて所定のkLaで最大72時間まで発酵を行った以外は、発酵試験1と同様に行った。なお、乳酸濃度に加えて、エタノール濃度およびグルコース濃度を、酵素センサー(王子計測機器、バイオセンサBF−4)を用いて測定した。なお、kLaと通気攪拌条件との関係は以下のとおりである。
【0074】
kLa 通気量(L/分) 攪拌速度(rpm)
6 0.3 60
11 0.3 150
16 0.3 230
22 0.3 270
29 0.3 290
【0075】
発酵48時間までの最大乳酸収量と該最大乳酸収量時におけるエタノール量、グルコース量および乳酸比率(%)(ただし、乳酸比率(%)=乳酸濃度/(乳酸濃度+2×エタノール濃度)×100とした。)を表3〜表5に示し、各種乳酸生産酵母についての最大72時間までの乳酸生産量のグラフを図5〜図7に示す。
【0076】
【表3】

【表4】

【表5】

【0077】
表3〜表5および図5〜図7に示すように、LDHのコピー数の観点からは、コピー数が多いほど乳酸生産速度は低下するが、乳酸収量や乳酸比率は増大する傾向にあった。また、LDHコピー数によりkLaに対する感受性が異なり、LDHコピー数が多いほど、kLaによって乳酸生産速度が大きく変化する傾向があることわかった。すなわち、LDHコピー数が多くなるほど、kLaが大きいときに乳酸生産速度が向上する傾向にあり、kLaが小さいときに乳酸生産速度が低下する傾向にあった。一方、kLaの観点からは、kLaが小さいほど、最終的な乳酸収量および乳酸比率が増大する傾向があることがわかった。以上のことから、乳酸生産酵母は、乳酸生産速度、乳酸収量および乳酸比率についてkLaに影響を受けるとともに、これらの影響は乳酸収量の大きいLDHのマルチコピー体においてより大きいことがわかった。したがって、乳酸生産酵母においては所望の乳酸生産特性を得るにはkLaの制御が有効であり、特にLDHのマルチコピー体については、kLaの制御によって発酵時間などのプロセス管理を容易に行いうることがわかった。
【実施例5】
【0078】
(発酵試験4)
本発酵試験は、kLaを培養工程において変化させたときの乳酸生産特性に与える影響を確認した。kLaが10.8の通気攪拌条件(通気量:0.3L/分、攪拌速度:150rpm)で発酵を開始し、6時間経過後および12時間経過後にkLaを18.0(通気量:0.3L/分、攪拌速度:240rpm)に切り換えて最大55時間培養した点、およびケーンジュースを初発糖濃度15wt%とした培地を用いる点以外は、発酵試験1と同様に発酵試験を行った。結果を図8に示す。
【0079】
図7に示すように、kLaを18.0に切り換えた以降において乳酸生産速度は明らかに速くなり、糖分を消費するまでの発酵時間を5〜10時間早めることができた。すなわち、培養工程の途中においてkLaを切り換えしたときにおいても、切り換え後のkLaに応じた乳酸生産酵母の乳酸生産特性が発現されることがわかった。このことから、培養工程中にkLaを変化させて乳酸生産速度を調整することにより、一定以上の乳酸収量や乳酸比率を確保しつつ乳酸生産酵母を用いた乳酸生産工程の培養期間を調整できることがわかった。以上のことは、乳酸生産速度がkLaに高度に依存していることを支持しており、同時に、kLaの制御あるいは培養工程におけるkLaの変化が、乳酸生産速度を調整して糖を消費するまでの発酵終了時間を制御するのに有効であることを支持している。
【0080】
(発酵試験5)
本発酵試験では、乳酸生産酵母として実施例1で作製したPDC1p−LDH10コピー体を用いて、この乳酸生産酵母に対して2種類のkLa(16および29)を設定して乳酸発酵を行い、発酵中、溶存酸素電極(メトラートレド製Tタイプ)を用いて溶存酸素濃度を測定した。発酵試験は、所定のkLaで発酵を行った以外は、発酵試験1と同様に行った。各kLa条件での発酵液の乳酸濃度と溶存酸素濃度についての測定結果を図9および図10に示す。
【0081】
図9および図10に示すように、溶存酸素濃度は、発酵試験を通じて1ppm以下であり、乳酸生産量に優れるkLa=16の条件においては、発酵試験を通じて0.5ppm以下であった。
【図面の簡単な説明】
【0082】
【図1】pBTrp−PDCl−LDHKCBベクターの構造を示す図。
【図2】実施例1で作製したLDH遺伝子導入酵母である2コピー体、6コピー体、8コピー体および10コピー体における染色体上のLDH遺伝子導入部位を示す図。
【図3】kLaを横軸に乳酸濃度を縦軸にしてプロットしたグラフ図。
【図4】kLa(18)一定の異なる通気攪拌条件下での乳酸生産量の変化を示すグラフ図。
【図5】LDH2コピー体について異なるkLa下での乳酸生産量の変化を示すグラフ図。
【図6】LDH6コピー体について異なるkLa下での乳酸生産量の変化を示すグラフ図。
【図7】LDH10コピー体について異なるkLa下での乳酸生産量の変化を示すグラフ図。
【図8】培養工程中にkLaを変化させた場合の乳酸生産量の変化を示すグラフ図。
【図9】発酵試験5における溶存酸素濃度の変化を示す図。
【図10】発酵試験5における乳酸濃度の変化を示す図。
【特許請求の範囲】
【請求項1】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、
を備え、
前記培養工程は、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養する工程を備える、乳酸生産方法。
【請求項2】
前記培養工程は、酸素移動容量係数(hr−1)が16以下の範囲で培養する工程である、請求項1に記載の乳酸生産方法。
【請求項3】
前記培養工程は、酸素移動容量係数(hr−1)が16超の範囲で培養する工程である、請求項1に記載の乳酸生産方法。
【請求項4】
前記培養工程において酸素移動容量係数(hr−1)を変化させる、請求項1〜3のいずれかに記載の乳酸生産方法。
【請求項5】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、
を備え、
前記培養工程において酸素移動容量係数(hr−1)を変化させる、乳酸生産方法。
【請求項6】
前記培養工程は、
(a)前記遺伝子組換え乳酸生産酵母を酸素移動容量係数(hr−1)が16以下の範囲で培養する工程と、
(b)前記遺伝子組換え乳酸生産酵母を酸素移動容量係数(hr−1)が16超の範囲で培養する工程と、
を含む、請求項5に記載の乳酸生産方法。
【請求項7】
前記(a)工程を実施後に前記(b)工程を実施する、請求項6に記載の乳酸生産方法。
【請求項8】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を通気攪拌下で培養する工程を備える、乳酸生産方法。
【請求項9】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養液の通気および/または攪拌下で酸素を供給して該培養液の溶存酸素量が1mg/L以下の範囲で培養する工程を備える、乳酸生産方法。
【請求項10】
前記培養工程における培養液の溶存酸素量は0.5ppm以下である、請求項9に記載の乳酸生産方法。
【請求項11】
前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、ピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられている、請求項1〜10のいずれかに記載の乳酸生産方法。
【請求項12】
前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、酵母染色体上のピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられている、請求項1〜11のいずれかに記載の乳酸生産方法。
【請求項13】
前記乳酸生産酵母は、ピルビン酸脱炭酸酵素および/またはアルコール脱水素酵素活性が低下されている、請求項1〜12のいずれかに記載の乳酸生産方法。
【請求項14】
前記乳酸生産酵母の酵母染色体上のピルビン酸脱炭酸酵素遺伝子が破壊されている、請求項1〜13のいずれかに記載の乳酸生産方法。
【請求項15】
前記乳酸生産酵母は、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を二以上備えている、請求項1〜14のいずれかに記載の乳酸生産方法。
【請求項1】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、
を備え、
前記培養工程は、酸素移動容量係数(hr−1)が6以上36以下の範囲で培養する工程を備える、乳酸生産方法。
【請求項2】
前記培養工程は、酸素移動容量係数(hr−1)が16以下の範囲で培養する工程である、請求項1に記載の乳酸生産方法。
【請求項3】
前記培養工程は、酸素移動容量係数(hr−1)が16超の範囲で培養する工程である、請求項1に記載の乳酸生産方法。
【請求項4】
前記培養工程において酸素移動容量係数(hr−1)を変化させる、請求項1〜3のいずれかに記載の乳酸生産方法。
【請求項5】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養する培養工程、
を備え、
前記培養工程において酸素移動容量係数(hr−1)を変化させる、乳酸生産方法。
【請求項6】
前記培養工程は、
(a)前記遺伝子組換え乳酸生産酵母を酸素移動容量係数(hr−1)が16以下の範囲で培養する工程と、
(b)前記遺伝子組換え乳酸生産酵母を酸素移動容量係数(hr−1)が16超の範囲で培養する工程と、
を含む、請求項5に記載の乳酸生産方法。
【請求項7】
前記(a)工程を実施後に前記(b)工程を実施する、請求項6に記載の乳酸生産方法。
【請求項8】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を通気攪拌下で培養する工程を備える、乳酸生産方法。
【請求項9】
乳酸生産方法であって、
乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を発現可能に備える乳酸生産酵母を培養液の通気および/または攪拌下で酸素を供給して該培養液の溶存酸素量が1mg/L以下の範囲で培養する工程を備える、乳酸生産方法。
【請求項10】
前記培養工程における培養液の溶存酸素量は0.5ppm以下である、請求項9に記載の乳酸生産方法。
【請求項11】
前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、ピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられている、請求項1〜10のいずれかに記載の乳酸生産方法。
【請求項12】
前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子は、酵母染色体上のピルビン酸脱炭酸酵素遺伝子プロモーターの制御下で発現可能に備えられている、請求項1〜11のいずれかに記載の乳酸生産方法。
【請求項13】
前記乳酸生産酵母は、ピルビン酸脱炭酸酵素および/またはアルコール脱水素酵素活性が低下されている、請求項1〜12のいずれかに記載の乳酸生産方法。
【請求項14】
前記乳酸生産酵母の酵母染色体上のピルビン酸脱炭酸酵素遺伝子が破壊されている、請求項1〜13のいずれかに記載の乳酸生産方法。
【請求項15】
前記乳酸生産酵母は、前記乳酸脱水素酵素活性を有するタンパク質をコードする遺伝子を二以上備えている、請求項1〜14のいずれかに記載の乳酸生産方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2006−20602(P2006−20602A)
【公開日】平成18年1月26日(2006.1.26)
【国際特許分類】
【出願番号】特願2004−203714(P2004−203714)
【出願日】平成16年7月9日(2004.7.9)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
【公開日】平成18年1月26日(2006.1.26)
【国際特許分類】
【出願日】平成16年7月9日(2004.7.9)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【Fターム(参考)】
[ Back to top ]

