レツク・フアーマシユーテイカルズ・デー・デーにより出願された特許
11 - 20 / 60
医薬剤形の活性コーティング
本発明は、1つの実施形態において、フィルムコーティング内に、20℃、約pH7の水中で測定した場合に約10mg/mL以下の低水溶性によって規定される、または20℃、約pH7の水中に置かれた場合に分散状態を提示することによって規定される活性医薬成分、およびポリビニルアルコールとポリエチレングリコールのコポリマーを含有するコーティング組成物について記載する。好ましくは、前記活性医薬成分は、任意に同一もしくは相違する活性医薬成分を含むコア上に水性コーティングビヒクル内に分散させて適用されている。本発明はさらにまた、医薬単一単位剤形を調製するための方法であって、単一単位剤形のコアを提供する工程と;任意に前記コア上に1つ以上のサブコーティング層を提供する工程と;前記コアに、水性コーティングビヒクル、ポリビニルアルコールとポリエチレングリコールのコポリマー、および前記水性コーティングビヒクル上に分散させた少なくとも1つの活性医薬成分を含む組成物を使用するフィルムコーティングにかける工程とを含み、このとき前記コポリマーは前記組成物の少なくとも7.0重量%、好ましくは少なくとも9.4重量%を占め、前記コポリマー対前記活性医薬成分の重量比は1:1から5:1の範囲内にある方法について記載する。その他の方法実施形態もまた記載されている。高薬物装填量、薬物装填量の均一性、および医薬単一単位剤形のフィルムコーティングからの活性医薬成分の高速の溶解速度が本発明によると達成できる。 (もっと読む)
エゼチミブおよびシンバスタチンを含む医薬組成物
本発明は、製薬工業の分野に属し、シンバスタチンおよびエゼチミブを含有する剤形を調製するための方法であって、シンバスタチンを含有する第1組成物を提供する段階と、エゼチミブを含有する第2組成物を提供する段階と少なくとも2つの別個の区間を含む1つの剤形を形成する段階とを含み、1つの区画は第1もしくは第2組成物のいずれかを使用して形成され、もう1つの区画は他の組成物を使用して形成される方法に関する。本発明は、シンバスタチンおよびエゼチミブを含有する剤形を調製するための方法であって、直接圧縮段階を含む方法にさらに関する。さらに、本発明は、この方法によって得られる剤形であって、少なくとも2つの別個の区画を含む剤形に関するが、このとき1つの区画はシンバスタチンを含有し、1つの区画はエゼチミブを含有する。最後に、本発明は、剤形の2つの個別区画内に存在するシンバスタチンおよびエゼチミブの組み合わせを含む複合剤形に関する。 (もっと読む)
スニチニブマレートの新たな結晶形
本発明は、スニチニブマレートの新規結晶形、この調製方法およびこれを含有する医薬組成物に関する。 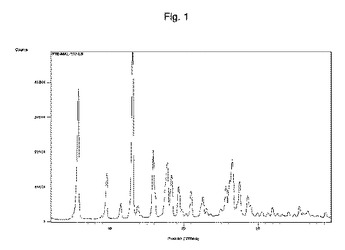 (もっと読む)
(もっと読む)
スニチニブの新規な塩
本発明は、スニチニブの新規な医薬的に許容される塩類、これらを調製する方法およびこれらを含む医薬組成物に関する。 (もっと読む)
エゼチミブを含む配合物
(i)粒状形態にある適切な親水性賦形剤と配合されるとき、親水性賦形剤の粒子の表面上に吸着することを可能にする、一次粒子の形態にあるエゼチミブの存在;(ii)特定のタイプの賦形剤の選択;および/または(iii)エゼチミブの配合物を得る方法の慎重な制御に、代わりに、または必要に応じて組み合わせて注意が払われる、エゼチミブの配合物が記述される。 (もっと読む)
エゼチミブを合成する方法およびこのために有用な中間体
本発明は、特徴的なZ−異性体構造を共有する、エゼチミブ(EZT)の合成のための新規で有用な中間体を開示する。Z−5−(4−フルオロフェニル)−ペント−4−エン酸、およびさらなるZ−中間体を経る合成の進行に基づいて、全合成は、高収率で最終エゼチミブを得るために示される。 (もっと読む)
ラメルテオンの調製における中間体としての6,7−ジヒドロ−1H−インデノ[5,4−B]フラン−8(2H)−オンの合成
本発明は、ラメルテオンの調製における重要な中間体である式Vの6,7−ジヒドロ−1H−インデノ[5,4−b]フラン−8(2H)−オンの調製を記載する。本発明は、6,7−ジヒドロ−1H−インデノ[5,4−b]フラン−8(2H)−オンの合成に有用な先行する中間化合物をもさらに記載する。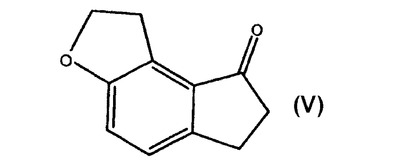
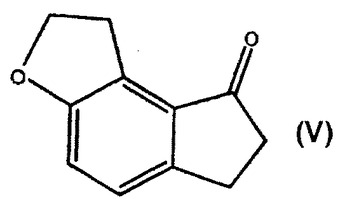 (もっと読む)
(もっと読む)
新規のトリネム抗生物質およびベータラクタマーゼの阻害剤
本発明は、式(I)の化合物、詳細には式(Ia)の化合物、治療有効量の、広域スペクトル抗生物質としての式(I)または(Ia)の1種または複数の化合物の使用、およびヒトまたは動物の細菌感染の治療のための前記化合物を含む医薬組成物の使用に関する。
 (もっと読む)
(もっと読む)
エゼチミブおよびそれを含む組成物の調製方法
本発明は、触媒的水素化により4−(p−ヒドロキシフェニル)保護基を脱保護するステップを含み、触媒は、脱保護反応に使用される化合物の重量に対して0.7重量%以下の量で使用される、保護された化合物からエゼチミブ(EZT)を製造する方法について記載する。脱保護反応のステップを実施した後、この方法は好ましくは:a)反応生成物を酢酸エチル中に溶解させるまたは酢酸エチルで抽出するステップ、およびb)酢酸エチル溶液を塩水溶液で洗浄するステップを含む。本発明は、粗EZTは0.1g/ml未満の濃度で溶媒中に溶解し、結晶化ステップはこの溶液から実施される、純粋なEZTを得るための方法についてさらに記載する。これらの手段は、それぞれ単独で、また特に組み合わせて、本明細書で記載されている重大な不純物を含まないエゼチミブ(EZT)を得、したがって、著しく純粋なエゼチミブ(EZT)を使用して、薬学的に許容される担体または賦形剤と一緒に医薬組成物に製剤するのに寄与するものである。 (もっと読む)
医薬品有効成分の造粒
本発明は、混合物中に、50重量%を超える医薬品有効成分、および液体物質から選択される1から10重量%の個々の任意の非水性賦形剤を含む乾式製剤または顆粒を開示する。好ましい実施形態において、乾式製剤または顆粒の調製のいずれのステップにおいても水または低級アルコールは全く加えられず、液体物質から選択される非水性賦形剤は医薬品有効成分により、および/またはさらなる固体賦形剤により吸収され、乾固される。このような乾式製剤または顆粒に基づく医薬製剤およびこれらの調製方法も同様に記載する。乾式製剤または顆粒は、例えば、ブリケッティング、スラッギング、篩過、製粉、打錠、さらには細粒造粒、直接圧縮などを含む、能動的乾燥を必要としない乾式条件下で、確実で有効に加工される。 (もっと読む)
11 - 20 / 60
[ Back to top ]

