Fターム[2G041DA09]の内容
その他の電気的手段による材料の調査、分析 (22,023) | イオン源 (4,018) | CI、化学イオン化 (444)
Fターム[2G041DA09]の下位に属するFターム
コロナ放電 (101)
NICI、負イオン化学イオン化 (28)
Fターム[2G041DA09]に分類される特許
241 - 260 / 315
子宮体癌の検出方法
【課題】未だ見出されていない子宮体癌の特異的腫瘍マーカーとなり得る生体要素を見出し、これを基とする子宮体癌を検出する手段を提供すること。
【解決手段】被験者の血液検体中のタンパク質における分子量1000〜200000Daの範囲の質量分布と発現強度を測定し、当該質量分布と相対発現強度のパターンを、健常人におけるパターンと比較して見出される差異を指標として、当該被験者における子宮体癌を検出する検出方法を提供することにより、上記の課題を解決し得ることを見出した。
(もっと読む)
マルチモードイオン化源及び分子スクリーニング方法
【課題】 単独のイオン化チャンバー及びネブライザーを利用して、効率的かつ効果的にESIイオン及びAPCIイオンの両方を発生することが可能なマルチモードイオン化源を利用する複合検体の検出方法を提供する。
【解決手段】 本発明の検出方法は、(a)前記複合検体をエレクトロスプレーイオン化源に導入して帯電エアロゾルを発生し、(b)前記エレクトロスプレーイオン化源に隣接する赤外線放射体で前記帯電エアロゾルを乾燥し、(c)前記エレクトロスプレーイオン化源より下流の大気圧イオン化源を利用して前記乾燥されたエアロゾルをイオン化し、(d)前記複合検体からのイオンを検出することを含むことを特徴とする。
(もっと読む)
イオントラップ質量分析計を用いた探知方法及び探知装置
【課題】タンデム質量分析法は、通常の質量分析法に比べて時間がかかるため、探知装置に求められる探知スピードが達成できなかった。
【解決手段】質量分析装置を用いた分析方法において、質量スペクトルを取得するステップ(201)と、固有のm/zのイオンが存在するか判定するステップ(202)を用いて高速でスクリーニングを行う。前記判定するステップ(202)の判定結果に応じて分析条件をデータベースから読み込み、タンデム質量分析を行うステップ(203)に切り替え、精査する。タンデム質量分析法で得られた結果から、固有のm/zのイオンが存在するか判定するステップ(204)を行う。
(もっと読む)
イオン及び荷電粒子を混合するための方法及び構成
【課題】 荷電粒子を衝突セルに導入するための装置を提供する。
【解決手段】 本発明の装置は、イオンと荷電粒子とを混合するための装置であって、イオン出口端を有する多重極装置と、イオン出口端に接続されている質量分析器と、質量分析器に接続されている荷電粒子源とを備え、荷電粒子源によって生成される荷電粒子が質量分析器を通って、イオン出口端を介して、多重極装置内に入るように構成されていることを特徴とする。
(もっと読む)
代謝物の定量方法
【課題】
本発明の課題は、生体内における代謝物の網羅的な定量方法を見出すことにある。
【解決手段】
代謝的に同位体標識された第一の代謝物群を調製し、サンプルと混合して質量分析装置で測定することにより、サンプル(例えば、組織、生体液、細胞など)中の複数の代謝物を精度よく定量することが可能となった。また、代謝的に同位体標識された第一の代謝物群中の代謝物を定量しておくことにより、代謝物の網羅的な絶対定量が可能となった。
(もっと読む)
保持時間整合を行うための方法および装置
前駆体イオンを、1つ以上の関連産物イオンと整合させる方法は、サンプル注入から得られる入力データ集合を提供すること、データ集合の各々は、前駆体イオンおよび1つ以上の産物イオンを含み、前駆体イオンについての単一の保持時間によって入力データ集合を正規化させること、どの産物イオンが、単一の保持時間に関して所定の保持時間枠内にあるかを決定すること、および産物イオンが、特定数の入力データ集合に関して所定の保持時間枠内にある場合、産物イオンが、単一の保持時間を有する前駆体に関連していると決定することを含む。サンプルを分析する装置は、クロマトグラフィーモジュール、クロマトグラフィーモジュールと連携している質量分析計モジュール、およびクロマトグラフィーモジュールおよび質量分析計モジュールと連携している制御ユニットを含む。  (もっと読む)
(もっと読む)
質量分析計
イオン検出器からの電圧信号が分析される質量分析方法が開示される。各電圧信号の二階微分を取得し、観測された電圧ピークの開始及び終了時間を決定する。次いで、各電圧ピークの強度及び平均時間を決定し、その強度及び時間値を記憶する。次いで、複数回の実験実行から観測された各電圧ピークに関係する強度及び時間値を組み合わせることにより、中間の合成マススペクトルを形成する。次いで、時間及び強度データの種々のペアを積分して平滑な連続マススペクトルを生成する。次いで、連続マススペクトルは、連続マススペクトルの二階微分を決定することによってさらに処理し得る。連続マススペクトルにおいて観測される質量ピークの開始及び終了時間を決定し得る。次いで、連続マススペクトルにおいて観測される各質量ピークの強度及び質量電荷比を決定し得る。次いで、イオン種ごとの強度値及び質量電荷比だけを含む最終の離散マススペクトルを表示又は出力し得る。 (もっと読む)
イオントラップ内にイオンを導入する方法及びイオン蓄積装置
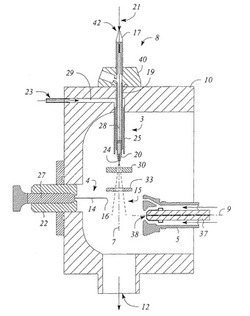
イオンをイオントラップ内に導入する方法及びイオン蓄積装置について記述している。導入手段を使用し、イオントラップに対する導入開口部を通じて第1イオンをイオントラップ内に導入する。導入手段の動作条件を調節し、第1イオンとは異なる極性の第2イオンを同一の導入開口部を通じてイオントラップ内に導入している。  (もっと読む)
(もっと読む)
質量分析計
入口電極(2)及び出口電極(3)を有するイオンガイド又はイオントラップ(1)が開示される。出口電極(3)の電位は、比較的短期間の間、周期的に降下され、いくつかのイオンがイオンガイド又はイオントラップ(1)から出口電極(3)における開口を介して脱出することを可能にする。出口電極(3)の電位が降下される期間は、漸次増加され、イオンは、イオンガイド又はイオントラップ(1)から質量電荷比に依存して出現する。イオンガイド又はイオントラップ(1)は、質量セパレータ又は低分解能質量分析器として動作され得る。 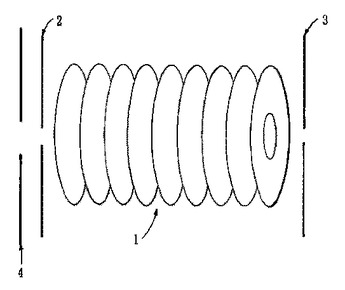 (もっと読む)
(もっと読む)
コレステロール代謝および輸送の測定方法
本発明は、コレステロール逆輸送(RCT)を測定するための生化学的方法に関する。具体的には、RCTの3つの成分(流出成分、血漿成分および排出成分)を、同位体標識コレステロールまたはコレステロール関連分子もしくはコレステロール関連複合体を投与するステップ、および続いて種々のコレステロールまたはコレステロール関連分子もしくはコレステロール関連複合体での同位体の希釈または出現、ならびにステロール最終産物(RCTの一部分である)中への回収を測定するステップにより、in vivoで測定する。生体で初めて、組織から血中へのコレステロール流出速度と血液から体外へのコレステロール排出速度との組み合わせを表す、包括的RCT流(Global RCT flux)のパラメータが作成される。そのような方法は、創薬および薬物開発、アテローム硬化その他の血管疾患および症状の診断および予後診断、疾患治療のための適正な用量の選択、ならびにRCT流を標的とする治療法のための被験体の選択に用いられる。 (もっと読む)
質量分析法
質量分析、特にマトリックス支援レーザ脱離イオン化(MALDI)質量分析を使用して、非消化で非断片化状態の共有結合的に安定化した超分子標的−リガンド複合体の無傷のイオンの存在を分析もしくは他の方法で検出する、又はそのイオンの正体を決定する方法ならびに種々の生物学的用途、たとえば抗体の特性解析、薬物発見及び自動化又はより高スループットの用途を含むタンパク質複合体形成研究におけるこれらの方法の使用。 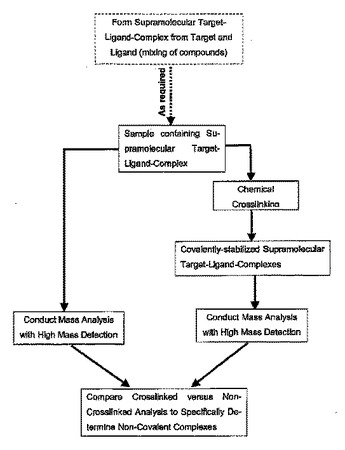 (もっと読む)
(もっと読む)
非対称電界イオンガイド装置
【課題】液滴がアナライザー内に進入するのを効果的に防止するイオンガイド装置を提供する。
【解決手段】異なるガイド電界中心軸を有する複数の区画を含む、質量分析計用電気力学的イオンガイド装置。ガイド電界のうちの少なくとも1つは、四重極成分と二重極成分とを有する非対称ガイド電界であってもよい。イオンガイド装置は、第一の電界の中心軸が入口開口部に面し、第二の電界の中心軸が出口開口部に面するように、ガイドチャンバー内に配設されている。該イオンガイド装置は、入口開口から出口開口まで見通すことの出来ないガイドチャンバーの効果的な利用を可能にし、入口開口からガイドチャンバー内に進入した望ましくない液滴が出口開口を通って出ないようにしている。好適な実施形態では、イオンガイド装置は長手方向に連結されて次第に狭くなる複数の区画を含み、各区画は幾何学的な中心軸の周りに対称的に配列された4枚の平板を含む。 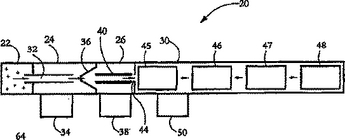 (もっと読む)
(もっと読む)
新規肝がんバイオマーカーおよび該バイオマーカーを用いた肝がんの検出方法
【課題】 正常人と肝がん患者において存在の有無、存在量が異なるタンパク質およびその部分ペプチドを用いて肝がんを検出する方法、ならびに該タンパク質および部分ペプチドからなる肝がん検出のためのバイオマーカーの提供。
【解決手段】 配列番号1で表されるアミノ酸配列からなるフィブリノーゲンα鎖、配列番号3で表されるアミノ酸配列からなるフィブリノペプチドA like、配列番号5で表されるアミノ酸配列からなる補体C4A、配列番号7で表されるアミノ酸配列からなるインターαトリプシンインヒビター、配列番号9で表されるアミノ酸配列からなるゲルソリン、配列番号11で表されるアミノ酸配列からなるアポリポプロテインA1、配列番号13で表されるアミノ酸配列からなるα2マクログロブリン、配列番号15で表されるアミノ酸配列からなるα1アンチトリプシン、配列番号2で表されるアミノ酸配列からなるフィブリノーゲンα鎖の部分ペプチド、配列番号4で表されるアミノ酸配列からなるフィブリノペプチドA likeの部分ペプチド、配列番号6で表されるアミノ酸配列からなる補体C4Aの部分ペプチド、配列番号8で表されるアミノ酸配列からなるインターαトリプシンインヒビターの部分ペプチド、配列番号10で表されるアミノ酸配列からなるゲルソリンの部分ペプチド、配列番号12で表されるアミノ酸配列からなるアポリポプロテインA1の部分ペプチド、配列番号14で表されるアミノ酸配列からなるα2マクログロブリンの部分ペプチド、配列番号16で表されるアミノ酸配列からなるα1アンチトリプシンの部分ペプチド、配列番号17で表されるアミノ酸配列からなるインターαトリプシンインヒビター重鎖H4前駆体の部分ペプチドからなる群から選択される少なくとも1つのタンパク質またはペプチドからなる肝がん検出のための肝がんバイオマーカー。
(もっと読む)
内部標準ペプチドを用いて生体由来試料に含まれる標的タンパク質を定量する方法
【課題】
複数のタンパク質の混合物である生体由来試料に含まれる標的タンパク質を検出・同定し、定量するための、新規タンパク質定量法を提供する。
【解決手段】
標的タンパク質に対するペプチドを合成し、安定同位体で標識した後、内部標準として生体由来試料に既知量を添加する。その後、プロテアーゼにてタンパク質をペプチドへ消化して、液体クロマトグラフィーを用いてペプチドの分離を行い、質量分析計で分析を行なう。既知量の内部標準ペプチドとタンパク質由来ペプチドのシグナル面積を比較することで、定量を行なう。
(もっと読む)
固体支持体上において相互作用した生体分子を分析する方法およびそのための固体支持体
【課題】 多数の試料を迅速に分析する手段を提供し、核酸およびタンパク質等の生体分子の相互作用の分析を迅速に実施する方法を提供する
【解決手段】 生体分子を分析する方法であって、(a)試料中の生体分子をゲル電気泳動で分離し、ゲル中に分離された生体分子を固体支持体上に転写することにより、試料中の生体分子を固体支持体上に固定化すること、(b)固体支持体上に固定化された生体分子にさらなる生体分子を相互作用させること、および(c)固体支持体上に固定化された生体分子および/または該生体分子に相互作用したさらなる生体分子を質量分析することを含む、前記方法。
(もっと読む)
質量分析に関する改良
本発明は反応セルを含む質量分析計およびそのような質量分析計を使用する方法に関する。特に、限定はしないが、本発明は、タンデム質量分析計およびタンデム質量分析に関する。本発明は、イオンを、質量分析計の長軸に沿って順方向に移動し、中間イオン貯蔵部を通過し、その後に反応セルに入るように誘導し、イオンを反応セル内で処理し、処理イオンを、長軸に沿って戻し、中間イオン貯蔵部にもう一度入るように放出し、処理イオンの1つまたは複数のパルスを軸外方向で質量アナライザまで放出する工程を含む、長軸を有する質量計を使用する質量分析法を提供する。  (もっと読む)
(もっと読む)
直交流型イオン移動度分析器
イオンをイオン源(22)から検出器(34)へ導くための流路(16)を形成し、且つ、流路(16)におけるイオン(36)の質量対帯電比を分離するための電場を作る少なくとも2つの電極(12、14)と、電場に対向する流体方向(28)とを含む直交流型イオン移動度分析器(CIMA)(12)。 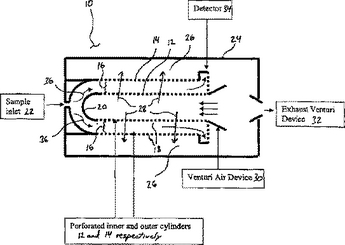 (もっと読む)
(もっと読む)
質量分析計
開示される質量分析計は、エレクトロスプレーイオン化イオン源(11)と電界非対称イオン移動度分光分析デバイス(13)とによって、燃焼室(16)と同位体比質量分析器(19)とのインターフェースがとられる高圧液体クロマトグラフィシステム(10)を備える。検体分子と溶媒分子は、イオン源(11)によってイオン化される。所望の検体イオンは、電界非対称イオン移動度分光分析デバイス(13)によって燃焼室(16)へ実質的に前向きに移送され、他方、望ましくない溶媒イオンは、電界非対称イオン移動度分光分析デバイス(13)によって実質的に減衰される。  (もっと読む)
(もっと読む)
質量分析計に関する改良
本発明は、未反応イオンと反応生成物イオンの両方から質量スペクトルを収集する、反応セルを含む質量分析計に関する。より詳細には(但し、他を除くものではない)、本発明は、前駆物質およびフラグメントイオンから質量スペクトルを収集するタンデム型質量分析法に使用できることが分かった。本発明は、イオンを、質量分析器へ送る前に、フラグメント化またはその他の処理のための反応セルへ送る配置を提示する。あるいは、イオンは、迂回経路に沿って質量分析器へ直接進むことができる。 (もっと読む)
等時性湾曲イオンインタフェースを備えた多重反射型飛行時間質量分析計
本発明は、一般に、多重反射型飛行時間質量分析計(MR TOF MS)に関する。平面MR TOF MS(11)の質量分解能を改善するために、MR TOF分析計(11)との間のイオン移送のために空間等時性で湾曲したインタフェース(21)を使用する。一実施形態は、無電界空間内に周期的レンズ(14)を有する平面MR TOF MS(11)、イオン流をパルスに変換するための線形イオントラップ(17)、及び静電気セクタで作成されたC字形等時性インタフェースを含む。インタフェース(21)は、大きな時間広がりを導入することなくイオンミラー(12)のエッジとフリンジング電界(13)を迂回してのイオンの移動を可能にする。インタフェース(21)は、また、イオンパケットのエネルギーフィルタリングを提供する。イオントラップコンバータ(17)の関連付けられていない往復時間は、イオントラップからのイオン抽出を遅延させることによって短くすることができ、過度のイオンエネルギーは、湾曲インタフェース(21)でフィルタリングされる。 (もっと読む)
241 - 260 / 315
[ Back to top ]