Fターム[2G041DA13]の内容
その他の電気的手段による材料の調査、分析 (22,023) | イオン源 (4,018) | EI、熱電子、フィラメント (257)
Fターム[2G041DA13]に分類される特許
181 - 200 / 257
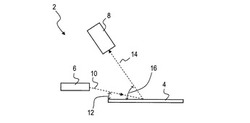
MALDIサンプルプレート撮像ワークステーション
【課題】 サンプルの詳細な画像、特に被分析物の結晶の領域を示す画像をもたらす撮像システムを提供する。
【解決手段】 本発明によれば、イオン源の外部にあるイオン源サンプルプレートの表面全域を画像化するための装置であって、イオン源の外部にあるイオン源サンプルプレートと、サンプルプレートの表面全域の画像を生成するための、サンプルプレートから間隔を空けて配置されている撮像装置と、表面を照射するための、サンプルプレートに近接した照射装置であって、サンプルプレート表面と接触してそのサンプルプレート表面との間に仰角を画定する光ビームを生成する照射装置とを備えている装置が提供される。
(もっと読む)
多重デバイスの並列構成のための質量分析計多重デバイスインターフェース
1つ以上のイオン源を1つ以上の下流側デバイスへインターフェースするために質量分析において使用される多重デバイスインターフェース。該多重デバイスインターフェースは、多重極ロッドセットに印加される電位に依存して、入力ロッドセットまたは出力ロッドセットのどちらかとして構成される3つ以上の多重極ロッドセットを含む。入力ロッドセットとして構成される多重極ロッドセットは、1つ以上のイオン源に連結されることにより、該イオン源から生成されたイオンを受け入れて該イオンを出力多重極ロッドセットとして構成された少なくとも1つの多重極ロッドセットへ伝達する。該出力多重極ロッドセットは、下流側デバイスに連結され、生成されたイオンを該デバイスへ伝達できる。 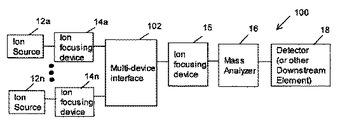 (もっと読む)
(もっと読む)
ガス流を管理するための装置及び方法
【課題】 良好なスペクトル安定性及び装置全体の感度が得られる質量分析システムで使用されるイオン源を提供する。
【解決手段】 本発明のイオン源は、(a)イオンを生成して該イオンをイオン化領域に送るイオン化装置と、(b)前記イオン化装置によって生成されたイオンを収集するための、前記イオン化装置に隣接した収集導管と、(c)前記イオン化装置によって生成されたイオンを脱溶媒和するためにガスを供給する第1のガス源と、(d)イオン化領域に所定の流速でガスを供給する第2のガス源とからなることを特徴とする。
(もっと読む)
同位体比質量分析計および同位体比の決定方法
本発明は、試料中の少なくとも1種の元素の異なる同位体の少なくとも1つの比を決定するための方法に関する。該方法は、試料をイオン化して、少なくとも1種の元素の異なる同位体のイオンであって:多価原子正イオン、水素についての一価正イオンおよび重水素についての一価正イオンからなる群から選択されるものを生成すること、少なくとも1種の元素の異なる同位体の荷電正イオンを、これらの質量対電荷の比に従って分離すること、および前工程で分離された前記少なくとも1種の元素の異なる同位体の少なくとも1つの比を決定することを含む。本発明はまた、上記方法を実施するための装置に関する。 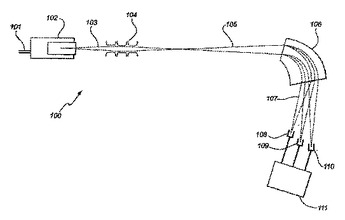 (もっと読む)
(もっと読む)
子宮体癌の検出方法
【課題】未だ見出されていない子宮体癌の特異的腫瘍マーカーとなり得る生体要素を見出し、これを基とする子宮体癌を検出する手段を提供すること。
【解決手段】被験者の血液検体中のタンパク質における分子量1000〜200000Daの範囲の質量分布と発現強度を測定し、当該質量分布と相対発現強度のパターンを、健常人におけるパターンと比較して見出される差異を指標として、当該被験者における子宮体癌を検出する検出方法を提供することにより、上記の課題を解決し得ることを見出した。
(もっと読む)
マイクロ流体システム(MS)
【課題】液体試料の被検体をMS被検体として質量分析計に提示する方法を開示する。
【解決手段】この方法は、(a)(i)液体試料を、マイクロ流体デバイスのマイクロチャンネル構造(I)であって、MS−ポートをも含む構造の試料引入れポート(I)に適用し、(ii)マイクロチャンネル構造(I)において液流により被検体を輸送することによって、被検体をMS被検体に変換させ、そして(iii)MSポートを介して質量分析計にMS被検体を提示する工程を含み、そして(b)慣性力を用いてマイクロチャンネル構造(I)の少なくとも一部内で液流を作り出すことを特徴とする。(a)ディスクの面に垂直な対称軸、(b)引出しポートよりも短い半径距離のところに内部適用領域を含み、MSポートおよび試料引入れポート(I)を含むマイクロチャンネル構造(I)を含むマイクロ流体ディスクを開示する。
(もっと読む)
化合物を質量分析によって検出する方法および装置
ここに記載されているのは、ガス流(2)における化合物を質量分析によって検出する方法である。この方法には、化合物のイオンを形成してガス流(2)における体積ユニットをイオン化することが含まれており、ここでこのイオン化は、ガス流と交わるビーム(9,10)を介して行われ、これらのビームは、電子パルスまたは電子パルス列および光子パルスまたは光子パルス列が交互に切り換わることによって形成される。またこの方法には、電場(13)によってイオンを進路変更して質量分析法を実施することならびに質量分析法によってイオンを検出することが含まれる。本発明の課題は、上記のような方法を提案して、測定範囲を拡げ、分解能を格段に改善することである。この課題は、上記の光子パルスまたは光子パルス列をエキシマランプ(11)によって形成し、電子パルスまたは電子パルス列と、光子パルスまたは光子パルス列との切り換えを50Hz以上の切換替え周波数で行うことによって解決される。 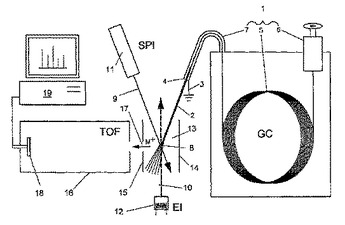 (もっと読む)
(もっと読む)
3次元アトムレベル構造観察装置
【課題】 3次元アトムレベル構造観察装置において、質量の近い元素同志の分析を行うために、小型の構成で分解能の向上を図る装置を提供する。
【解決手段】 3次元構造物体1に対し電界を印加し、電界による3次元構造物体1から離脱した発散状の帯電原子種2に対し、複数のの扇形電場印加機構5を組み合わせてマルチターン飛行時間型質量分析器を構成することによって、発散性の帯電原子種イオンを分析器内を周回させて飛行イオン光路を長くして分解能を向上させる。また、飛行イオン光路中に高速のデフレクタやメカニカルチョッパ型の開閉器などを介して特定のイオン種のみを選択することにより、他の妨害イオンを予め排除してより分解能を高めることも出来る。この構成により質量分解能m/Δm=5,000以上の分解能を実現できる。
(もっと読む)
イオン及び荷電粒子を混合するための方法及び構成
【課題】 荷電粒子を衝突セルに導入するための装置を提供する。
【解決手段】 本発明の装置は、イオンと荷電粒子とを混合するための装置であって、イオン出口端を有する多重極装置と、イオン出口端に接続されている質量分析器と、質量分析器に接続されている荷電粒子源とを備え、荷電粒子源によって生成される荷電粒子が質量分析器を通って、イオン出口端を介して、多重極装置内に入るように構成されていることを特徴とする。
(もっと読む)
マススペクトルを用いた化学的に架橋された細胞サンプルの分類方法
化学的に架橋された分析物を含む細胞のサンプルを分析する方法が提供される。前記分析には質量分析法を使用することが典型的である。 (もっと読む)
代謝物の定量方法
【課題】
本発明の課題は、生体内における代謝物の網羅的な定量方法を見出すことにある。
【解決手段】
代謝的に同位体標識された第一の代謝物群を調製し、サンプルと混合して質量分析装置で測定することにより、サンプル(例えば、組織、生体液、細胞など)中の複数の代謝物を精度よく定量することが可能となった。また、代謝的に同位体標識された第一の代謝物群中の代謝物を定量しておくことにより、代謝物の網羅的な絶対定量が可能となった。
(もっと読む)
質量分析計
入口電極(2)及び出口電極(3)を有するイオンガイド又はイオントラップ(1)が開示される。出口電極(3)の電位は、比較的短期間の間、周期的に降下され、いくつかのイオンがイオンガイド又はイオントラップ(1)から出口電極(3)における開口を介して脱出することを可能にする。出口電極(3)の電位が降下される期間は、漸次増加され、イオンは、イオンガイド又はイオントラップ(1)から質量電荷比に依存して出現する。イオンガイド又はイオントラップ(1)は、質量セパレータ又は低分解能質量分析器として動作され得る。 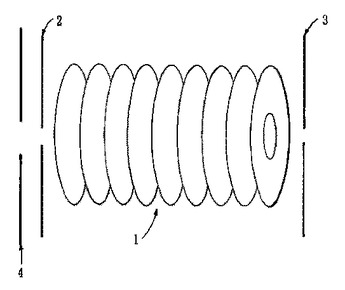 (もっと読む)
(もっと読む)
イオントラップ内にイオンを導入する方法及びイオン蓄積装置
イオンをイオントラップ内に導入する方法及びイオン蓄積装置について記述している。導入手段を使用し、イオントラップに対する導入開口部を通じて第1イオンをイオントラップ内に導入する。導入手段の動作条件を調節し、第1イオンとは異なる極性の第2イオンを同一の導入開口部を通じてイオントラップ内に導入している。 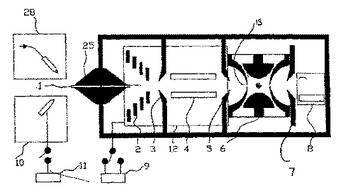 (もっと読む)
(もっと読む)
質量分析装置およびその使用方法
【課題】 真空装置の各種検査を効率的に行うことが可能な質量分析装置1の提供を目的とする。
【解決手段】 質量電荷比ごとの分圧の測定部12に連結されて測定部12を制御する電気系部14に、操作部30および測定結果の表示部16を設けた。その操作部30には、複数種類の質量電荷比ごとの分圧を切り替え表示する表示切替ボタン32を備えている。また表示部16は、質量電荷比が28の窒素ガスの分圧と質量電荷比が32の酸素ガスの分圧との比率を表示しうるようになっている。
(もっと読む)
質量分析計
イオン検出器からの電圧信号が分析される質量分析方法が開示される。各電圧信号の二階微分を取得し、観測された電圧ピークの開始及び終了時間を決定する。次いで、各電圧ピークの強度及び平均時間を決定し、その強度及び時間値を記憶する。次いで、複数回の実験実行から観測された各電圧ピークに関係する強度及び時間値を組み合わせることにより、中間の合成マススペクトルを形成する。次いで、時間及び強度データの種々のペアを積分して平滑な連続マススペクトルを生成する。次いで、連続マススペクトルは、連続マススペクトルの二階微分を決定することによってさらに処理し得る。連続マススペクトルにおいて観測される質量ピークの開始及び終了時間を決定し得る。次いで、連続マススペクトルにおいて観測される各質量ピークの強度及び質量電荷比を決定し得る。次いで、イオン種ごとの強度値及び質量電荷比だけを含む最終の離散マススペクトルを表示又は出力し得る。 (もっと読む)
ナトリウム利尿ペプチドに関連したポリペプチド、並びにこれらの同定および使用法
本発明は、関心対象の所望のポリペプチドに対する抗体と結合するポリペプチドの同定および使用に関する。ナトリウム利尿ペプチドおよびこれらの前駆体、特にBNPを一例として使用し、本発明は、生体試料中、最も好ましくは血液由来試料中に産生される、BNPに対する抗体に結合する多くのナトリウム利尿ペプチド断片を記載する。このような断片の産生は、なかでも組織内へのナトリウム利尿ペプチドの放出を誘発する事象の開始と試料を入手または解析する時間との間の経過時間;試料獲得と試料を解析した時間との間の経過時間;問題の組織試料のタイプ;貯蔵条件;存在するタンパク質分解酵素の量などの関数でありうる持続的なプロセスであることから、正確な予後または診断の結果を提供するために、1つまたは複数のナトリウム利尿ペプチドのためのアッセイ法をデザインするとき、およびこのようなアッセイ法を行うときの両方においてこのような断片を使用してもよい。 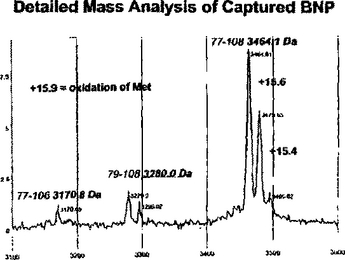 (もっと読む)
(もっと読む)
マススペクトロメータと、それに関係するイオナイザ及び方法
【解決手段】ある実施例では、小型化された構造とそれに関連する方法が、マススペクトロメータ又は分析器として機能し、変更が加えられるとイオンジェネレータとして機能する。小型化された構造は、略平板である平行に離間された一対の電極と出射口を有しており、電極には突出する壁があって、これら電極は協同して、イオン生成チャンバーを与える。加えられた磁場に垂直に向いた電場を制御することで、イオンビームは、質量電荷比に基づいて複数のビームに分離されて、装置の出口から出る。装置がマススペクトロメータ又は分析器として機能している場合、イオンコレクタの衝撃が応答して、関連するプロセッサに情報を送る。イオナイザとしての機能を有することが望まれる場合、イオンの出口に隣接して配置されるイオンコレクタは除かれる。 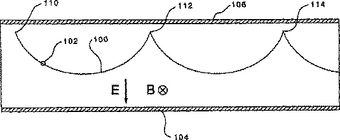 (もっと読む)
(もっと読む)
質量分析方法、及び質量分析計
試料内の要素の質量スペクトルを得る方法を開示する。質量電荷比M1/Z1、M2/Z2、...Mn/Znを有する試料前駆イオンが生成され、解離場所(192)において断片化され、質量電荷比m1/z1、m2/z2、...mn/znのフラグメントイオンを生成する。フラグメントイオンは、静電型又は「オービトラップ」型のイオントラップ(130)内へ誘導され、前駆イオンのM/Z比に従った群としてトラップに入る。各群の質量電荷比は、トラップ内における、イオンの軸方向の運動によって決定される。トラップ内の電場は変形させられる。すると、異なる前駆イオンから生じた、等しいm/z比を有するイオンが分離される。これは、電場の変形によって、軸方向の運動がm/zのみではなく、他の要素にも依存するようになるからである。 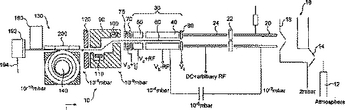 (もっと読む)
(もっと読む)
コレステロール代謝および輸送の測定方法
本発明は、コレステロール逆輸送(RCT)を測定するための生化学的方法に関する。具体的には、RCTの3つの成分(流出成分、血漿成分および排出成分)を、同位体標識コレステロールまたはコレステロール関連分子もしくはコレステロール関連複合体を投与するステップ、および続いて種々のコレステロールまたはコレステロール関連分子もしくはコレステロール関連複合体での同位体の希釈または出現、ならびにステロール最終産物(RCTの一部分である)中への回収を測定するステップにより、in vivoで測定する。生体で初めて、組織から血中へのコレステロール流出速度と血液から体外へのコレステロール排出速度との組み合わせを表す、包括的RCT流(Global RCT flux)のパラメータが作成される。そのような方法は、創薬および薬物開発、アテローム硬化その他の血管疾患および症状の診断および予後診断、疾患治療のための適正な用量の選択、ならびにRCT流を標的とする治療法のための被験体の選択に用いられる。 (もっと読む)
新規肝がんバイオマーカーおよび該バイオマーカーを用いた肝がんの検出方法
【課題】 正常人と肝がん患者において存在の有無、存在量が異なるタンパク質およびその部分ペプチドを用いて肝がんを検出する方法、ならびに該タンパク質および部分ペプチドからなる肝がん検出のためのバイオマーカーの提供。
【解決手段】 配列番号1で表されるアミノ酸配列からなるフィブリノーゲンα鎖、配列番号3で表されるアミノ酸配列からなるフィブリノペプチドA like、配列番号5で表されるアミノ酸配列からなる補体C4A、配列番号7で表されるアミノ酸配列からなるインターαトリプシンインヒビター、配列番号9で表されるアミノ酸配列からなるゲルソリン、配列番号11で表されるアミノ酸配列からなるアポリポプロテインA1、配列番号13で表されるアミノ酸配列からなるα2マクログロブリン、配列番号15で表されるアミノ酸配列からなるα1アンチトリプシン、配列番号2で表されるアミノ酸配列からなるフィブリノーゲンα鎖の部分ペプチド、配列番号4で表されるアミノ酸配列からなるフィブリノペプチドA likeの部分ペプチド、配列番号6で表されるアミノ酸配列からなる補体C4Aの部分ペプチド、配列番号8で表されるアミノ酸配列からなるインターαトリプシンインヒビターの部分ペプチド、配列番号10で表されるアミノ酸配列からなるゲルソリンの部分ペプチド、配列番号12で表されるアミノ酸配列からなるアポリポプロテインA1の部分ペプチド、配列番号14で表されるアミノ酸配列からなるα2マクログロブリンの部分ペプチド、配列番号16で表されるアミノ酸配列からなるα1アンチトリプシンの部分ペプチド、配列番号17で表されるアミノ酸配列からなるインターαトリプシンインヒビター重鎖H4前駆体の部分ペプチドからなる群から選択される少なくとも1つのタンパク質またはペプチドからなる肝がん検出のための肝がんバイオマーカー。
(もっと読む)
181 - 200 / 257
[ Back to top ]