Fターム[2G041FA13]の内容
その他の電気的手段による材料の調査、分析 (22,023) | 検出対象 (2,606) | 非金属 (2,002) | 有機 (1,818) | 高分子 (1,425) | 生体物質 (1,377) | 単に配列を確定するためのもの (98)
Fターム[2G041FA13]に分類される特許
1 - 20 / 98
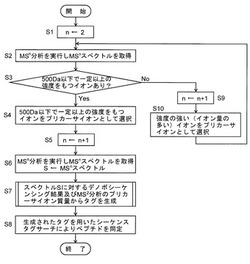
質量分析データ解析方法及び解析装置
【課題】MS/MSイオンサーチやデノボシーケンシングによってペプチドが同定できないような場合でも、高い精度でペプチドの同定を可能とする。
【解決手段】低m/zのプリカーサイオンに対するMSnスペクトルは情報量が少ない反面、デノボシーケンシングにより高い信頼度でアミノ酸配列を推定できる。そこで、意図的にm/zが500以下であるプリカーサイオンに対するMSnスペクトルを取得し(S2-S6)、該スペクトルに対しデノボシーケンシングを実行してプリカーサイオンのm/zからm/z=0までの間のアミノ酸配列を推定する。そして、推定されたアミノ酸配列、MSn分析のプリカーサイオンm/z、及びMS2分析のプリカーサイオンm/zを用いてシーケンスタグを生成する(S7)。このタグの信頼度は高く、シーケンスタグサーチではタグが正確であれば正解ペプチドを見逃しなく検索可能であるから、高い精度でペプチド同定又は候補の絞り込みが行える(S8)。
(もっと読む)
質量分析を用いた修飾タンパク質同定方法及び同定装置
【課題】翻訳後修飾を受けたタンパク質の同定を可能としたシステムにおいて非修飾タンパク質の同定性能の低下を防止するとともに同定時間の短縮化を図る。
【解決手段】公的なアミノ酸配列データベース等の登録情報など、既知のタンパク質のアミノ酸配列情報と翻訳後修飾情報とに基づいて、既知の修飾タンパク質のアミノ酸配列を含む同定用DB5を予め構築する。この際に、修飾されたアミノ酸を通常のアミノ酸と重複しない特定の記号で表記する。検索条件入力部44から同定対象のデータと翻訳後修飾を含む検索条件が指定されると、DB検索部43は指定されたデータを同定用DB5と照合してペプチドの候補を抽出する。修飾タンパク質は既知のものに限られるため検索空間はそれほど拡大しない。それによって、高い同定性能を確保しながら検索時間を短縮することができる。
(もっと読む)
糖ペプチド解析方法及び解析装置
【課題】N末端アミノ酸残基がグルタミンやカルバミドメチル化したシステインである場合、優先的な環化によってNH3やH2Oが脱離するためにm/zずれが生じてペプチド同定が困難になる。本発明はこのようなN-結合型糖ペプチドに対しても高い精度でペプチドを同定することを目的とする。
【解決手段】MS2スペクトルに現れる糖鎖組成を示すピーク列についてデノボシーケンス処理を実施する際に、そのピークの1つとMS2プリカーサとの質量電荷比差からNH3又はH2O脱離によるm/zずれの有無を推定する(S4、S5)。さらに、MS2スペクトル上のN-結合型糖ペプチドに特徴的なトリプレットピークとMS1スペクトル上のトリプレットピークとの質量電荷比差からも同様のm/zずれの有無を推定する(S6、S7)。N末端アミノ酸残基の環化ありと判断されたならば、それをデータベース検索の際の検索条件の1つとすることでペプチドの同定精度を高める。
(もっと読む)
認知機能障害疾患のバイオマーカーおよび該バイオマーカーを用いる認知機能障害疾患の検出方法
【課題】 非認知機能障害被験者と認知機能障害疾患患者において存在量が異なるタンパク質およびその部分ペプチドを用いて軽度認知障害およびアルツハイマー病を含む認知機能障害疾患を検出する方法ならびに該タンパク質および該部分ペプチドからなる軽度認知障害およびアルツハイマー病を含む認知機能障害疾患検出のためのバイオマーカーの提供。
【解決手段】 配列番号1、3、5、7、9,11,13,15,17,19,21,23,25のタンパク質および、これらのタンパク質の部分ペプチドである配列番号2、4、6.8,10,12,14,16,18,20,22,24,26,27で表されるアミノ酸配列から選択される少なくとも1つのタンパク質またはタンパク質から生じるアミノ酸残基5個以上のペプチド断片からなる認知機能障害疾患の診断のためのバイオマーカーならびにこれを用いた診断方法。
(もっと読む)
情報取得方法
【課題】生体組織切片のタンパク質を消化分解した後にTOF−SIMS法で質量分析して、理論消化断片の信号を用いてタンパク質の二次元分布画像を構成する方法では、コントラストの高い画像が得られに難いという課題があった。
【解決手段】試料中のタンパク質又はペプチドを質量分析して、前記質量分析で得られた質量情報に基づいて前記試料中の前記タンパク質又は前記ペプチドの分布状態に関する情報を取得する情報取得方法であって、限定分解された前記タンパク質又はペプチドの親イオンの前記一定領域の強度分布および積算スペクトルのピーク強度に対して、ピアソンの積率相関係数が0・5乃至1.0以下の強度分布を有し、前記一定領域の積算スペクトルのピーク強度比が1.0よりも大きく、m/zが500以上のイオンピークを用いて分布状態に関する質量情報を得る工程と、を有することを特徴とする情報取得方法に関する。
(もっと読む)
C型肝炎に対するペグインターフェロン・リバビリン併用療法の治療効果の予測方法およびそれに用いられる予測キット
【課題】C型肝炎に対するペグインターフェロン・リバビリン併用療法の治療効果の予測方法を提供すること。
【解決手段】C型肝炎の患者の血清中のC3f分解産物の量を指標として、その患者に対するペグインターフェロン・リバビリン併用療法の治療効果を予測する。患者の血清中のC3f分解産物の量を測定し、C3f分解産物が所定の値より多いとき、その患者にはペグインターフェロン・リバビリン併用療法が有効である可能性が高いと判定する。
(もっと読む)
肺癌診断用ポリペプチド、肺癌の検出方法、および治療効果の評価方法
【課題】肺癌の血清および血漿にて測定できる腫瘍マーカーとしては、CEAおよびCYFRAのほかにも、SCC、SLX、NSEおよびProGRPが臨床にて使用されている。しかしながら、NSEおよびProGRPは、小細胞肺癌特異的なものであって、非小細胞癌を検出することはできない。また、CEA、CYFRA、SCCおよびSLXにおいては、非小細胞肺癌を検出するための感度および特異度はいずれも低く、また、初期ステージの肺癌を検出することができず、早期の肺癌診断のための使用には適していない。そのため、非小細胞肺癌診断に適用できる新規バイオマーカー、とりわけ早期の肺癌診断にも使用できる肺癌診断用の新規バイオマーカーを提供する。
【解決手段】特定のアミノ酸配列を有する肺癌診断用のポリペプチドを、質量分析法により検出または測定する
。
(もっと読む)
糖鎖配列解析方法、プログラム、記録媒体、および糖鎖配列解析装置
【課題】 単一種類の単糖から構成された多糖、および、構造が未知または新規である多糖にも適用できて、簡便、短時間かつ高精度に構造解析が可能な糖鎖配列解析方法を提供する。
【解決手段】
多糖の糖鎖配列解析方法であって、
前記多糖を構成する各単糖内の共有結合、および前記各単糖間の共有結合のうち少なくとも一つの共有結合を、イオン化により非還元末端側から順に壊裂させて測定したマススペクトルのフラグメントイオンピークパターンを取得する、フラグメントイオンピークパターン取得工程S2と、
前記フラグメントイオンピークパターンを、あらかじめ準備した多糖のフラグメントイオンピークパターンと対比することにより、前記多糖の糖鎖配列を解析する糖鎖配列解析工程S3とを含むことを特徴とする、糖鎖配列解析方法。
(もっと読む)
タンパク質の同定装置、同定方法並びに同定プログラム及びこれを記録したコンピュータ読み取り可能な記録媒体
【課題】未知の修飾構造を有するタンパク質の構造を決定することのできる新規なタンパク質の同定方法を提供する。
【解決手段】被検タンパク質に対してタンデム質量分析を行う第1の質量分析ステップと、前記第1の質量分析ステップにより得られた親イオン(MS1)のタンデムマス(MS2)のフラグメントに対して更に質量分析を行う第2の質量分析ステップと、前記第2の質量分析ステップにより得られたタンデムマス(MS3)のフラグメントのペプチドイオンの質量がタンパク配列データベースに記憶された既知のタンパク配列の部分配列質量の何れと一致するかを判別することにより前記ペプチドイオンを同定するペプチド同定ステップと、前記タンデムマス(MS2)のフラグメントに修飾ペプチドが含まれるか否かを判別する修飾ペプチド判別ステップと、を有することを特徴とするタンパク質の同定方法である。
(もっと読む)
ペプチドの濃度を決定する方法
ポリペプチドの配列バリアントの決定方法
本発明は、以下の工程を含む、産生されたポリペプチドにおけるアミノ酸配列変異を判定する方法に関する:(a)産生されたポリペプチドの試料を提供する工程、(b)該試料中の該ポリペプチドをプロテアーゼと共にインキュベートする工程、(c)該ポリペプチドのアミノ酸配列断片の逆相クロマトグラフィー接続型高分解能質量分析(FT-ICR/FT-orbitrap)およびMS/MS分析を用いて二次元分析を実施する工程、(d)試料について得られたLC-MSデータセットと参照試料のデータセットを並べて比較し、所定の保持時間でのシグナル強度の差異を探索し、アミノ酸配列変異に関して示差的シグナルを評価することにより、データ評価する工程。データ評価(d)用の参照試料は、十分に特徴決定された標準または分析対象試料の一つのいずれかであり得る。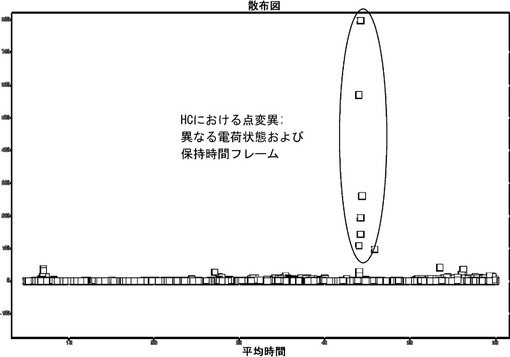
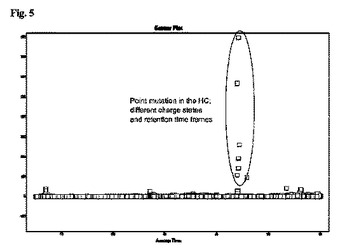 (もっと読む)
(もっと読む)
上皮成長因子受容体(EGFREGFR)タンパク質SRM/MRMアッセイ
本開示は、選択反応モニタリング(SRM)質量分析、または多重反応モニタリング(MRM)質量分析とも名付けられてもいる方法により、ホルマリン中で固定された生物検体中で直接的にEGFRタンパク質を定量するための特に好都合な、上皮成長因子受容体(EGFR)タンパク質由来の特異的ペプチド、および生成されるペプチドのイオン化特性を提供する。このような生物検体は、化学的に保存および固定され、前記生物検体は、ホルマリン固定組織/細胞、ホルマリン固定/パラフィン包埋(FFPE)組織/細胞、FFPE組織ブロックおよびこれらのブロック由来の細胞、ならびにホルマリン固定および/またはパラフィン包埋されている組織培養細胞を含む試薬/固定液を含むホルムアルデヒドで処理した組織および細胞から選択される。タンパク質検体は、前記生物検体からLiquid Tissue(登録商標)試薬およびプロトコルを使って調製され、EGFRタンパク質が、SRM/MRM質量分析法を使って、Liquid Tissue(登録商標)検体中でタンパク質検体中の少なくとも1つ以上の記載ペプチドを定量することにより定量化される。これらのペプチドが修飾または非修飾型で存在する場合は、定量化可能である。EGFRペプチドの修飾型の一例は、ペプチド配列内のチロシン、トレオニン、セリン、および/または他のアミノ酸残基のリン酸化である。 (もっと読む)
インスリン受容体基質1(IRS1)タンパク質SRM/MRMアッセイ
本開示は、選択反応モニタリング(SRM)質量分析、または多重反応モニタリング(MRM)質量分析とも名付けられてもいる方法により、ホルマリン中で固定された生物検体中で直接的にIRS1タンパク質を定量するための特に好都合な、インスリン受容体基質1(IRS1)タンパク質由来の特異的ペプチド、および生成されるペプチドのイオン化特性を提供する。このような生物検体は、化学的に保存および固定され、前記生物検体は、ホルマリン固定組織/細胞、ホルマリン固定/パラフィン包埋(FFPE)組織/細胞、FFPE組織ブロックおよびこれらのブロック由来の細胞、ならびにホルマリン固定および/またはパラフィン包埋されている組織培養細胞を含む試薬/固定液を含むホルムアルデヒドで処理した組織および細胞から選択される。タンパク質検体は、前記生物検体からLiquid Tissue(登録商標)試薬およびプロトコルを使って調製され、IRS1タンパク質が、SRM/MRM質量分析法を使って、Liquid Tissue(登録商標)検体中でタンパク質検体中の少なくとも1つ以上の記載ペプチドを定量することにより定量化される。これらのペプチドが修飾または非修飾型で存在する場合は、定量化可能である。IRS1ペプチドの修飾型の一例は、ペプチド配列内のチロシン、トレオニン、セリン、および/または他のアミノ酸残基のリン酸化である。 (もっと読む)
ペプチド末端の同定方法
【課題】蛋白質のアミノ末端およびカルボキシ末端を、網羅的かつ簡便に決定する方法の提供。
【解決手段】(a)対象ポリペプチド中の1種のアミノ酸残基のアミノ末端側又はカルボキシ末端側の一方で切断したペプチド断片群の取得工程;(b)対象ポリペプチドと同一のポリペプチド中に含まれるアミノ酸残基と同一のアミノ酸残基について、工程(a)で切断した末端と逆側の末端で切断したペプチド断片群の取得工程;(c)工程(a、b)で得た二つのペプチド断片群の質量分析スペクトルの取得工程;(d)工程(c)の質量分析スペクトルから、質量差のあるピークの組を抽出する工程;(e)工程(d)で抽出されたピークの組について、各ピークの質量差、又は、各ピークのフラグメントの質量分析結果から、ピークの組が、対象ポリペプチドのアミノ末端、又は、カルボキシ末端を含むポリペプチドであると判断する工程;により、ポリペプチド末端を同定する。
(もっと読む)
胆道がんの新規バイオマーカー
【課題】胆道がんと関連する新規バイオマーカーの検出に、質量分析を使用する方法を提供する。
【解決手段】被験体における胆道がんと関連する異常量のバイオマーカーを検出する方法であって、a)質量分析を使用して該被験体由来の生物学的試料における約4204m/zのm/z値を有するプロトロンビンの断片の量を定量化すること、及びb)(a)において取得した定量化した値を閾値と比較することを含み、ここで該定量化した値が該閾値を上回る場合異常量の該バイオマーカーが該生物学的試料中に存在する、方法。
(もっと読む)
抗原ペプチドの同定法
【課題】本発明は、抗原ペプチドの同定法を提供することを課題とする。
【解決手段】本発明は、哺乳類生物体由来の限定量の細胞または体液から、それらの配列および同一性を決定するのに十分な量の抗原ペプチドを単離するのに有用な方法を提供する。従って本発明は、診断または治療の目的で利用される新規の疾患関連抗原、例えば腫瘍抗原および自己免疫疾患関連抗原を同定する方法を提供する。本発明の方法を、ワクチンの品質を管理するために利用することもできる。より具体的には、本発明の方法を、生体の最も重要な抗原提示細胞およびワクチン接種用の有用な道具である樹状細胞のペプチド受容体を介して提示された抗原ペプチドの配列を決定するために使用することができる。
(もっと読む)
糖ペプチド構造解析方法及び装置
【課題】目的の糖ペプチド由来のイオンをプリカーサイオンとしたMS/MSスペクトルに基づくデータベース検索により、糖ペプチドを構成するペプチドのアミノ酸配列と糖鎖結合部位とを高い信頼度で推定する。
【解決手段】MSスペクトルから糖ペプチド由来のイオンを見つけてMS/MSスペクトルを取得し(S1〜S3)、該スペクトルから全ての糖鎖が脱離したペプチドに帰属される、及び、糖による単純な修飾を受けたペプチドに帰属されるプロダクトイオンを抽出し、各プロダクトイオン以下のm/zを持つピークのリストをそれぞれ作成する(S4,S5)。S4で判明する修飾条件(糖の種類)を検索条件としピークリストをデータベース検索に供し、一致度の高いペプチドの候補をリスト化する(S6〜S8)。各ピークリストの検索結果を総合的に判定し、アミノ酸配列及び糖鎖結合部位の候補のリストを表示する(S9)。
(もっと読む)
細胞増殖を伴う糖尿病合併症の検査のための方法、組成物およびキット
【課題】増殖性糖尿病網膜症などの細胞増殖を伴う糖尿病合併症の検査方法、ならびに該糖尿病合併症の診断に有用な組成物およびキットを提供する。
【解決手段】被験者由来の生体試料中の配列表の配列番号1〜26で表されるアミノ酸配列を含むポリペプチド、その変異体またはその断片のいずれか1つまたは複数を測定することを含む、増殖性糖尿病網膜症などの細胞増殖を伴う糖尿病合併症を検出する方法、ならびに、増殖性糖尿病網膜症などの細胞増殖を伴う糖尿病合併症を診断および/または検出するための組成物またはキット。
(もっと読む)
質量分析装置を用いた代謝酵素群の一斉タンパク質定量に用いるペプチド
【課題】生体試料中の代謝酵素のタンパク質絶対量を高感度に一斉定量することが可能なアミノ酸配列からなるペプチドやその使用方法を提供すること。
【解決手段】細胞内タンパク質である代謝酵素を高感度に一斉定量することを可能とする質量分析装置で高感度検出可能なペプチドを選択し、アミノ酸配列を同定する。この定量対象ペプチドと、同じアミノ酸配列を有する安定同位体標識ペプチドとを用いて、それぞれの所定濃度段階に対するLC−MS/MSを用いた質量分析を行い、検量線を作成する。試料の被定量代謝酵素タンパク質をトリプシンにより断片化して得られるペプチド断片に、安定同位体標識ペプチドを添加してLC−MS/MSを用いた質量分析を行い、被定量代謝酵素タンパク質ペプチド/安定同位体標識ペプチドのマススペクトル面積比を算出し、該面積比から検量線を用いて定量値を算出する。
(もっと読む)
生体内緊張状態の緩和・誘導抑制効果の評価方法及び評価用キット、並びに、物質のスクリーニング方法
【課題】被験物質が有する生体内緊張状態の緩和効果又は誘導抑制効果を評価する方法等を提供する。
【解決手段】被験物質を投与すると共にストレスを与えた動物から採取した体液における8種のマーカー物質の少なくとも1つの濃度を基準値と比較することにより、前記被験物質が有する生体内緊張状態の緩和効果又は誘導抑制効果を評価する。マーカー物質に対する親和性を有する物質を固定化した担体にマーカー物質を捕捉して、体液中のマーカー物質の濃度を算出する構成が推奨される。該評価方法を用いる物質のスクリーニング方法、該評価方法を簡便に行うことができるキットも提供される。
(もっと読む)
1 - 20 / 98
[ Back to top ]