Fターム[4B050DD07]の内容
Fターム[4B050DD07]に分類される特許
101 - 120 / 202
ニューレグリンの下流タンパク質であるニューキナーゼ
本発明は、ニューレグリンシグナリング経路における下流のプロテインキナーゼであるニューキナーゼに関する。特定の態様において、本発明は、単離されたニューキナーゼをコードする核酸、ニューキナーゼポリペプチド、ニューキナーゼ核酸にハイブリダイズするオリゴヌクレオチド、及びニューキナーゼをコードする配列を含む発現ベクターを提供する。本発明は、ニューキナーゼに関する、単離された宿主細胞、抗体、トランスジェニック非ヒト動物、組成物、及びキットを更に提供する。その他の態様において、本発明は、心臓機能障害に対する素因を同定する方法、ニューキナーゼの存在を検出する方法、ニューキナーゼ核酸、ニューキナーゼ活性に影響を及ぼす薬剤をスクリーニングする方法、及びニューキナーゼ活性を調整する方法を更に提供する。 (もっと読む)
PI3K相互作用分子の同定のための方法およびPI3Kの精製のための方法
本発明は、(a) PI3Kを含むタンパク質調製物を提供する段階、(b) タンパク質調製物と、固体支持体上に固定化されたフェニルチアゾールリガンド1とを、フェニルチアゾールリガンド1-PI3K複合体の形成を可能にする条件下で接触させる段階、(c) フェニルチアゾールリガンド1-PI3K複合体を所与の化合物と共にインキュベートする段階、および(d) 化合物が、固定化されたフェニルチアゾールリガンド1からPI3Kを分離させることができるかどうかを決定する段階を含む、PI3K相互作用化合物の同定のための方法に関する。さらに、本発明は、(a) PI3Kを含むタンパク質調製物を提供する段階、(b) タンパク質調製物と、固体支持体上に固定化されたフェニルチアゾールリガンド1および所与の化合物とを、フェニルチアゾールリガンド1-PI3K複合体の形成を可能にする条件下で接触させる段階、ならびに(c) 段階(b)において形成されたフェニルチアゾールリガンド1-PI3K複合体を検出する段階を含む、PI3K相互作用化合物の同定のための方法に関する。さらに、本発明は、(a) PI3Kを含むタンパク質調製物の2つのアリコートを提供する段階、(b) 1つのアリコートと、固体支持体上に固定化されたフェニルチアゾールリガンド1とを、フェニルチアゾールリガンド1-PI3K複合体の形成を可能にする条件下で接触させる段階、(c) もう一方のアリコートと、固体支持体上に固定化されたフェニルチアゾールリガンド1および所与の化合物とを、フェニルチアゾールリガンド1-PI3K複合体の形成を可能にする条件下で接触させる段階、ならびに(d) 段階(b)および(c)において形成されたフェニルチアゾールリガンド1-PI3K複合体の量を決定する段階を含む、PI3K相互作用化合物の同定のための方法に関する。さらに、本発明は、(a) PI3Kを含む少なくとも1つの細胞をそれぞれ含む2つのアリコートを提供する段階、(b) 1つのアリコートを所与の化合物と共にインキュベートする段階、(c) それぞれのアリコートの細胞を収集する段階、(d) タンパク質調製物を得るために細胞を溶解する段階、(e) タンパク質調製物と、固体支持体上に固定化されたフェニルチアゾールリガンド1とを、フェニルチアゾールリガンド1-PI3K複合体の形成を可能にする条件下で接触させる段階、および(f) 段階(e)の各アリコート中に形成されたフェニルチアゾールリガンド1-PI3K複合体の量を決定する段階を含む、PI3K相互作用化合物の同定のための方法に関する。 (もっと読む)
P38キナーゼ阻害剤
式(I)および(II)で示される化合物、ならびにそれらの同定方法、それらの製造方法、それらを含有する医薬組成物、および疾患の治療におけるそれらの使用が開示される。該化合物は、p38キナーゼの阻害によりTNF−αおよびインターロイキン(IL)の生産を阻害する。それらは、炎症および関節炎の治療に有用である。
 (もっと読む)
(もっと読む)
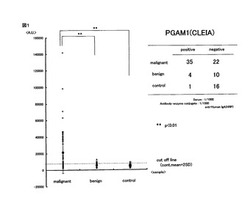
腫瘍マーカ、腫瘍診断キットおよび腫瘍マーカの測定方法
【課題】 感度および特異性の双方が高い腫瘍マーカを提供する。
【解決手段】 本発明の腫瘍マーカは、下記(A)の腫瘍マーカおよび下記(B)の腫瘍マーカの少なくとも一方を含む腫瘍マーカである。
(A)ヒト由来PGAM、抗ヒト由来PGAM抗体、ヒト由来PGAM遺伝子およびヒト由来PGAMmRNAからなる群から選択される少なくとも一つを含む腫瘍マーカ。
(B)ヒト由来TPI、抗ヒト由来TPI抗体、ヒト由来TPI遺伝子およびヒト由来TPImRNAからなる群から選択される少なくとも一つを含む腫瘍マーカ。
例えば、組換えPGAM1を抗原として、被験者の血清中の自己抗体をCLEIA法により測定すれば、図1のグラフに示すように、高感度かつ高特異性で癌を判定できる。
(もっと読む)
分化制御剤及び自己再生制御剤
【課題】 細胞の分化制御や自己再生の制御を行うための新規な薬剤を得る。
【解決手段】 グルクロン酸及びN−アセチルグルコサミンを糖鎖に対して転移する活性を有する酵素(例えばEXT1、EXT2など)をコードする遺伝子の発現を制御する核酸を有効成分とする細胞の分化制御剤及び自己再生制御剤、及びグルクロン酸及びN−アセチルグルコサミンを糖鎖に対して転移する活性を有する酵素(例えばEXT1、EXT2など)をコードする遺伝子の発現を制御する核酸の細胞分化制御剤又は自己再生制御剤としての使用。
(もっと読む)
細胞表面グリカンを修飾するための組成物および方法
グリカン(例えば生存細胞または細胞粒子上に発現するグリカン)を修飾する方法および組成物が本明細書中で提供される。その組成物および方法は、細胞の生存性および細胞の1つまたはそれ以上の表現型の特徴を保存しながら、細胞表面のグリカンの修飾を可能にする。例えば、その方法および組成物を採用して、細胞の1つまたはそれ以上の他の表現型の特徴(例えば多分化能)を保存しながら、細胞の特定の表現型の特徴(糖鎖付加のような)を修飾し得る。  (もっと読む)
(もっと読む)
スクリーニング方法
本発明は、Trabid活性を調節することを含む、Wntシグナル伝達を調節する方法を提供する。好ましくは、Trabid活性を調節することは、Trabid活性を阻害することを含む。本発明はまた、Trabid活性を低減することを含む、TCF転写を低減する方法を提供する。Trabidの調節因子を同定するための方法であって、ユビキチンによりタグ部分にカップリングした検出可能な部分を含む、Trabid基質を用意すること、前記基質の第1及び第2の部分を固定化すること、前記第1の部分に調節因子候補を添加すること、第1及び第2の部分をTrabidと接触させること、インキュベートしてTrabidを作用させること、検出可能な部分からタグを分離することによりユビキチンの切断をアッセイすることを含み、第1の部分から分離された検出可能な部分の量が、第2の部分から分離された検出可能な部分の量と異なるときに、前記候補を、Trabidの調節因子として同定する方法も提供される。本発明は、医薬品としてのTrabid及びTrabid阻害剤の使用を提供する。  (もっと読む)
(もっと読む)
トロンビン変異体
【課題】増強された生理化学的または生物学的活性を有する新規ポリペプチドを提供する。
【解決手段】タンパク質分解活性ポリペプチドであって、天然に存在するトロンビンと少なくとも約80%のアミノ酸相同性を有し、そしてフィブリノゲン凝固活性に対するプロテインC活性化活性の比が前記トロンビンの比の約半分未満または約2倍より大きい比を有するが、ただし、前記ポリペプチドが、前記トロンビン、トロンビンK52Eなど、トロンビン活性化部位内の少なくとも1つのアミノ酸残基が置換あるいは欠失されているトロンビン、またはループF19-E25が組織プラスミノゲンアクチベーター由来の等価なループに置き換えられているトロンビンでない、タンパク質分解活性ポリペプチド。
(もっと読む)
細胞増殖障害の処置
本発明はポリアルキレングリコール化合物、および細胞増殖障害、より具体的にはSykチロシンキナーゼが介在する障害、の処置におけるその使用に関する。 (もっと読む)
遺伝子発現制御用のエピジェネティック調節複合体
部位特異的DNA結合活性を有する第1ドメインとアルギニンメチルトランスフェラーゼ活性を有する第2ドメインとを少なくとも含む、エピジェネティック調節ポリペプチド複合体であって、第2ドメインは、ヒストンH2Aの尾部領域に位置するアルギニン残基をメチル化可能である。複合体は、ヒストンH2AおよびH4の尾部領域におけるR3のメチル化を制御することによって、細胞、特に哺乳類幹細胞における遺伝子発現を調節可能である。複合体の例として、Blimp1のDNA結合活性とPrmt5のアルギニンメチルトランスフェラーゼ活性とを含むポリペプチド複合体が挙げられる。  (もっと読む)
(もっと読む)
α−ガラクトシダーゼA欠損症の治療
【課題】ファブリー病のようなα−ガラクトシダーゼA欠損が疑われる個体を治療するための、ヒトα−gal Aを過剰発現し分泌するように遺伝的に修飾された移植用ヒト細胞、および精製されたヒトα−gal Aの提供。
【解決手段】(1)ヒトα−gal Aを過剰発現し分泌するように遺伝的に修飾されたヒト細胞、または(2)遺伝的に修飾された培養ヒト細胞から得られる精製ヒトα−gal Aのいずれかを用いて治療する、治療用組成物。
(もっと読む)
治療ターゲットとしての新規ユビキチンリガーゼ
【課題】
本発明は、ユビキチンリガーゼの新規の基質ターゲッティングサブユニットをコードするヌクレオチドの発見、同定および特徴づけに関する。
【解決手段】
本発明は、ユビキチンリガーゼの新規の基質ターゲッティングサブユニット、すなわち、FBP1、FBP2、FBP3、FBP4、FBP5、FBP6、FBP7、FBP8、FBP9、FBP10、FBP11、FBP12、FBP13、FBP14、FBP15、FBP16、FBP17、FBP18、FBP19、FBP20、FBP21、FBP22、FBP23、FBP24、およびFBP25をコードするヌクレオチド、トランスジェニックマウス、ノックアウトマウス、宿主細胞発現系、ならびに本発明のヌクレオチドによりコードされるタンパク質を包含する。本発明はさらに、増殖性疾患を治療するためにユビキチンリガーゼおよびそれらの基質をターゲッティングするように設計された治療プロトコルならびに医薬組成物を包含する。
(もっと読む)
SODおよびプロラミン系ペプチドフラグメントを含む医薬組成
【課題】医薬投与用に適合された医薬組成を提供する。この医薬組成は、少なくとも1つのスーパーオキシドジスムターゼ(SOD)および少なくとも1つのプロラミン系ペプチドフラグメントの機能的に活性な組み合わせを含む。
【解決手段】本発明は、少なくとも1つのスーパーオキシドジスムターゼおよび少なくとも1つのプロラミン系ペプチドフラグメントを含む医薬投与用に適合された医薬組成に関する。本発明はまた、特定のスーパーオキシドジスムターゼおよびプロラミン系ペプチドフラグメントに関する。
(もっと読む)
GASC1の阻害
本発明により、試験化合物の、Jumonjiタンパク質のJMJD2サブファミリーのタンパク質に結合し、そして任意にその活性を調節する能力を試験する方法が提供される。前記方法には、試験化合物をJumonjiタンパク質のJMJD2サブファミリーのタンパク質、前記タンパク質の補因子、及び任意で脱メチル化の基質と共にインキュベートすることが含まれる。本発明に係る方法を、多数の化合物のスクリーニングに用いて、特定の癌、特に前立腺癌の治療に臨床的に使用する候補化合物となる化合物群を同定することが可能である。スクリーニングアッセイで活性を示さない他の化合物については、候補化合物としての更なる検討から除外できる。従って、本発明の方法は、製薬産業において有用性を有する。 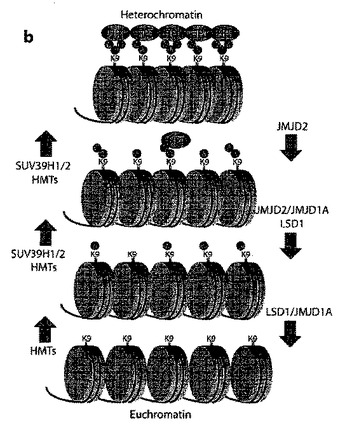 (もっと読む)
(もっと読む)
色素脱失のためのトロポロン−およびヒドロキシベンゾール置換オリゴペプチド
式、R1−NH−C*H((CH2)n−NH3+)−C=O−NH−C*H(CH2R2)−C=O−R3[式中、nは、1、2、3の値をとることができ、R1は、H、ベンジルオキシカルボニル−、tert−ブチルオキシカルボニル−、アセチル、3〜24個の炭素原子を有する直鎖脂肪族アシル基、ビニルオキシカルボニル−(Voc)、アリルオキシカルボニル−(Alloc)、1−イソプロピルアリルオキシカルボニル−(Ipaoc)、−C=O−シクロヘキシル、シンナミルオキシカルボニル−(Coc)、N−(4,4−ジメチル−1−オキソペンチル)、N−(1−オキソ−4−ペンテニル)、N−(4,6−ジメチル−1−オキソ−2,4−ドデカジエニル)、N−(1−オキソ−9,12,15−オクタデカトリエニル)、N−(4−メチル−1−オキソペンチル)、N−(1−オキソ−10−ウンデセニル)、N−(2−メチル−1−オキソプロピル)、9−フルオレニルメトキシカルボニル−(Fmoc)、(ホモ−ベンジルオキシカルボニル)−(ホモ−Z)、P−メトキシベンジルオキシカルボニル−(Moz)、9−アントリルメチル、N−フェニルエチルおよびトリフェニルメチル−(Trt)から選択される基を表し、R2は、p−ヒドロキシフェニル−、4−ヒドロキシヘプタ−1,3,6−トリエン−5−オン−1−イル−、2,4−ジヒドロキシフェニル−、4[(ヒドロキシアミノ)カルボニル]フェニル−、(5−ヒドロキシ−4−オキソ−4H−ピラン−2イル)−、(3−ヒドロキシ−4−オキソピリジン−1−(4H)−イル)−、(2−チオキソ−1,3−オキサゾリジン−5−イル)−、4−[(アミノカルボノチオイル)アミノ]フェニル)−、(2,2’ビピリジン4−イル)−、(5−ブチル−2,4−ジヒドロキシ−フェニル)−、2,4−ジヒドロキシ−5−(1−フェニルエチル)フェニル−、(4−ヒドロキシ−5−チオキソシクロヘプタ−1,3,6−トリエン−1−イル)−から選択される基を表し、R3は、−OH、NH2から選択される基である]の化合物。 (もっと読む)
色素乾皮症遺伝子からのDNA標的配列を切断するメガヌクレアーゼ変異型及びその使用
I-CreIの26位〜40位及び44位〜77位に位置するLAGLIDADG コアドメインの2つの機能的サブドメインのそれぞれに1つずつ、少なくとも2つの置換を有するI-CreI 変異型であって、色素乾皮症遺伝子からのDNA標的配列を切断できる変異型。該変異型及び誘導生成物の、色素乾皮症の予防及び治療のための使用。 (もっと読む)
ヒトIgEに対する抗体酵素およびその利用
【課題】I型アレルギーの原因であるヒトIgEを認識するとともに、IgEを分解してその機能を消失させることができ、I型アレルギーの予防や治療に利用できる抗体酵素を提供する。
【解決手段】ヒトIgEを免疫原としてモノクローナル抗体を作製し、そのモノクローナル抗体の重鎖、軽鎖の可変領域のアミノ酸配列、塩基配列を決定した。続いて、このアミノ酸配列について分子モデリングを行ない、その3次元構造を推定し触媒三つ組残基構造を有しているか否かを確認した。そして、最終的に触媒三つ組残基構造を有するモノクローナル抗体5H5の重鎖および軽鎖の可変領域がヒトIgEの抗体酵素として機能するということを見出した。
(もっと読む)
ヒトTNF−αに対する抗体酵素およびその利用
【課題】リウマチや慢性閉塞性肺炎疾患のようなサイトカインの産生異常により発症する疾患を予防または治療する目的で用いることが可能な抗体酵素を提供することにある。
【解決手段】ヒトTNF−αを抗原として作製された抗体またはその断片は、TNF−αを認識するとともに、当該TNF−αを切断および/または分解することができる抗体酵素である。
(もっと読む)
トランスグルタミナーゼ基質反応性を有するペプチド及びその利用
【課題】トランスグルタミナーゼの基質としての反応性を有するペプチドを提供する。
【解決手段】血液凝固第XIII因子及び/又は組織型トランスグルタミナーゼからなるトランスグルタミナーゼの基質反応性を有し、又は、トランスグルタミナーゼ阻害剤活性を有する特定のアミノ酸配列を有するペプチド。ファージディスプレイ法で提示したペプチドと第1級アミンを含む化合物を利用したトランスグルタミナーゼ阻害剤活性を有する化合物の探索方法。
(もっと読む)
セラミドキナーゼループ
配列番号1の単離ポリヌクレオチド、例えば配列番号1のポリヌクレオチドによりコード化される配列番号2の単離ポリペプチド、かかるポリヌクレオチドを含むベクター、かかるポリヌクレオチドを含む発現系、かかる発現系を含む宿主細胞、診断用試薬としてのかかるポリペプチドまたはポリヌクレオチドの使用、かかるポリペプチドまたはポリヌクレオチドの使用によりセラミドキナーゼのアゴニストまたはアンタゴニストを同定するためのスクリーニングアッセイおよび方法、ならびにかかるスクリーニングおよびそれらの使用により得られたセラミドキナーゼのアゴニストまたはアンタゴニスト。 (もっと読む)
101 - 120 / 202
[ Back to top ]