Fターム[4B065BA01]の内容
微生物、その培養処理 (127,014) | 微生物の創製、選別 (16,082) | 外来遺伝子の導入 (10,800)
Fターム[4B065BA01]の下位に属するFターム
ベクターを使用 (7,491)
エレクトロポーレーション (516)
マイクロインジェクション (82)
リポソームの使用 (260)
Fターム[4B065BA01]に分類される特許
2,121 - 2,140 / 2,451
フラビウイルスワクチン
レプリコンウイルス様粒子が、フラビウイルスワクチンとして使用され得る。本発明は、フラビウイルスワクチンを作製するための物質および方法に関する。このワクチンは、ウイルス様粒子(VLP)を含む。このVLPは、宿主細胞に感染することができ、その宿主細胞内で複製することができ、宿主免疫系によって認識されるウイルスタンパク質を産生することができるが、感染性ウイルス粒子内へはパッケージングされることができない。 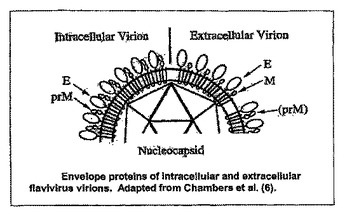 (もっと読む)
(もっと読む)
ブタウロプラキンIIプロモーター及び該プロモーターを利用した有用タンパク質の生産方法
本発明は、ブタウロプラキンII遺伝子のプロモーター、これを含む発現ベクター及びそのベクターを利用した有用タンパク質の生産方法に関する。本発明のプロモーターは高効率で目的タンパク質の膀胱特異的発現を促進する。本発明のプロモーターを利用して目的タンパク質を発現するように形質転換された動物は、尿中に目的タンパク質を高濃度で分泌し、このようにして生産されたタンパク質は既存の同種タンパク質より優れた生理活性を示す。従って、本発明のプロモーター、これを利用した発現ベクター及び形質転換動物は医薬学的に価値のある有用タンパク質の生産分野に有利に使用することができる。 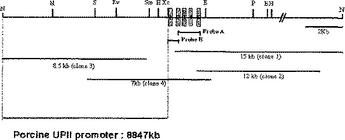 (もっと読む)
(もっと読む)
脂質含量の高い真核微生物及び該微生物を用いた脂質の製造方法
【課題】トリアシルグリセロールなどの脂質を高含量で含む真核微生物変異株を取得するとともに、これを用いて脂質を製造する。
【課題解決手段】
トランスポゾンを挿入させた変異ライブラリーを用いて、真核微生物を変異させ、脂質の蓄積含量の高い変異株をスクリーニングし、その変異株のトランスポゾン挿入位置の同定により変異遺伝子を決定し、それらの遺伝子の破壊株を作成し、これを用いて脂質を製造する。
(もっと読む)
血管形成のsiRNA阻害のための組成物及び方法
血管内皮成長因子(VEGF)遺伝子、並びにVEGFレセプター遺伝子Flt1及びFlk−1/KDRに特異的な小型干渉性RNAを利用するRNA干渉は、これらの遺伝子の発現を阻止する。VEGFの過剰発現により刺激される血管形成を含む病気、例えば糖尿病性網膜症、加齢関連黄斑変性及び多くの種類の癌は、これらの小型の干渉性RNAの投与によって治療することができる。 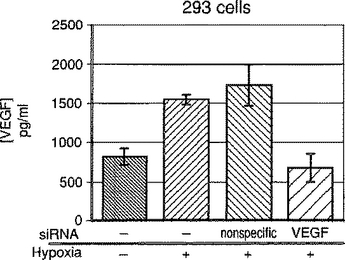 (もっと読む)
(もっと読む)
自家グレリンに対する免疫化
一般に自家グレリンに対する免疫化に基づく新規方法が開示される。免疫化は、好ましくは、自家グレリンのアナログの投与により行なわれる。このアナログは、自家グレリンポリペプチドに対する抗体産生を誘導し得る。免疫原として特に好ましいのは、ただ1つ又は数個の外来性の優性で無差別性のT細胞エピトープの導入により改変されている自家グレリンである。グレリンに対する核酸ワクチン接種及び生ワクチンを用いるワクチン接種並びにこれらワクチン接種に有用な方法及び手段もまた開示される。このような方法及び手段は、アナログ及び薬学的製剤並びに核酸フラグメント、ベクター、形質転換細胞、ポリペプチド及び薬学的製剤の製造方法を含む。 (もっと読む)
腎不全治療薬をスクリーニングする方法
腎不全治療薬を得るためのスクリーニングツール及び簡便なスクリーニング方法、並びに腎不全治療用医薬組成物及びその製造方法を開示する。前記スクリーニングツールはCTGFプロモーターを活性化することができるポリペプチドであるG蛋白質共役型受容体FGK、その機能的等価改変体、又は相同ポリペプチドであるか、あるいは前記ポリペプチドを発現している細胞である。スクリーニング方法は、前記ポリペプチドの阻害を指標とする方法である。 (もっと読む)
血管障害、異常脂質血症および関連疾患の治療用の新規治療標的
本発明は、HDLレベルの調節および/またはそれを必要とする患者における血管障害、異常脂質血症あるいは関連疾患の治療のための組成物と方法を扱う。本発明はまた、ここでの新規治療標的の同定に基づく前記疾患の治療のための治療物質の同定のための方法を含む。本発明はまた、ここで示された治療標的を用いる診断および薬理ゲノミクスの組成物および方法を含む。 (もっと読む)
GlcNAcMan5Man3GlcNAc2グリコフォームを支配的に含む免疫グロブリン
本発明は、特定エフェクター機能を与える、免疫グロブリン糖タンパク質の支配的グリコフォーム構造を有する免疫グロブリン糖タンパク質組成物に関する。加えて、本発明は、特定の富化N−グリカン構造を有する抗体を含み、前記N−グリカン構造がGlcNAcMan5GlcNAc2である医薬組成物に関する。 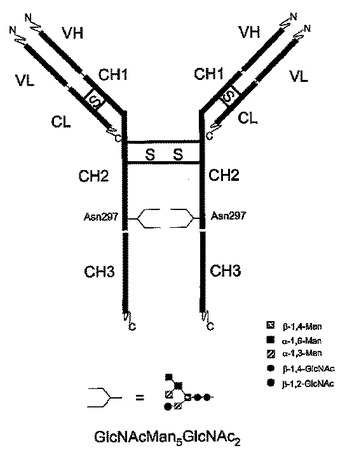 (もっと読む)
(もっと読む)
Gal2GlcNAc2Man3GlcNAc2グリコフォームを支配的に含む免疫グロブリン
本発明は、特定エフェクター機能を与える、免疫グロブリン糖タンパク質の支配的グリコフォーム構造を有する免疫グロブリン糖タンパク質組成物に関する。加えて、本発明は、特定の富化N−グリカン構造を有する抗体を含み、前記N−グリカン構造がフコースを欠くGal2GlcNAc2Man3GlcNAc2である医薬組成物に関する。 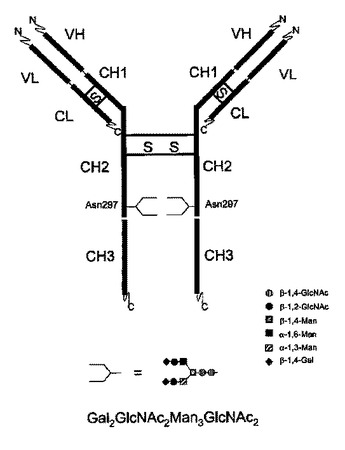 (もっと読む)
(もっと読む)
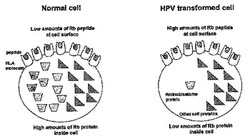
宿主細胞タンパク由来のペプチドを含むHPVワクチン
本発明は宿主細胞タンパク由来のペプチドを含む、ヒトパピローマウィルス (HPV)ワクチンに関し、特に、子宮頸癌、頭頸部癌、皮膚癌のようなHPV感染に関連する癌に対するワクチンに関する。当該ペプチドは、例えばE6、E7のようなHPVタンパクによる分解の標的とされ、HPVに感染された細胞の表面に相対的に多量に存在する宿主細胞タンパクの断片を含む。これらのペプチドは、CTLにより認識され、免疫反応を発現させるので、好ましい腫瘍特異的なマーカーである。本発明は、また、新規なペプチド:ペプチド/HLA複合体のようなペプチド複合体と、腫瘍特異的なワクチンにおけるそれらの使用に関する。 (もっと読む)
ポリリン酸高蓄積細菌の改良およびその利用
【課題】 細菌の菌体内に大量のポリリン酸を蓄積可能な新規な変異株を提供し、当該変異細菌を利用してリン資源のリサイクルを実現する。
【解決手段】 細菌のリン酸輸送に関与するタンパク質をコードするpitA遺伝子の変異はポリリン酸蓄積能を向上させる。また、当該ポリリン酸蓄積能が向上した変異株は水中のリンを効率良く除去できる。さらに、菌体内に蓄積されたポリリン酸は効率良く植物に利用される。
(もっと読む)
絹糸生体材料およびその使用方法
本発明は、絹糸生体材料(例えば、繊維、フィルム、発泡体、およびマット)を生成するための全水性方法および組成物を提供する。この方法では、加工(例えば、電界紡糸)の前に、ポリエチレンオキシド(PEO)(詳細に記録が残されている生体適合性物質)などの少なくとも1種類の生体適合性ポリマーが絹糸タンパク質とブレンドされた。本発明者らは、この段階によって、材料の脆化につながる、可溶化および水溶液からの再加工の間のフィブロインの高次構造変化に関連した問題が避けられることを発見した。さらに、この方法によって、加工された生体材料がインビトロまたはインビボで細胞に暴露された時に問題となることがある有機溶媒の使用が避けられる。 (もっと読む)
Akt−1の発現を抑制するためのアンチセンスオリゴヌクレオチドの使用
Akt-1の発現を抑制し、且ついくつかの癌細胞株において細胞障害性を誘導する新規なアンチセンスオリゴヌクレオチド化合物。 (もっと読む)
IAPタンパク質とのHSP90タンパク質−タンパク質相互作用を阻害する化合物
本明細書において、サバイビン、XIAP、cIAP1、またはcIAP2などのIAPタンパク質とのHsp90相互作用を阻害する化合物、ならびにこのような化合物を同定するおよび用いるための方法を開示している。
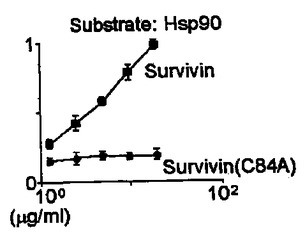 (もっと読む)
(もっと読む)
P−Rex1、RACのためのPTDINS(3,4,5)P3−G−β−γにより制御されたグアニンヌクレオチド交換因子
炎症抑制の標的としての新規のタンパク質が記載される。該タンパク質の製造方法及び抗炎症剤の同定のためのアッセイにおける該タンパク質の使用が記載される。該タンパク質をコードする遺伝子についてのノックアウトマウスの作成方法も記載される。  (もっと読む)
(もっと読む)
Man3GlcNAc2グリコフォームを支配的に含む免疫グロブリン
本発明は、特定エフェクター機能を与える、免疫グロブリン糖タンパク質上の支配的グリコフォーム構造を有する免疫グロブリン糖タンパク質組成物に関する。加えて、本発明は、特定の富化N−グリカン構造を有する抗体を含み、前記N−グリカン構造がMan3GlcNAc2である医薬組成物に関する。 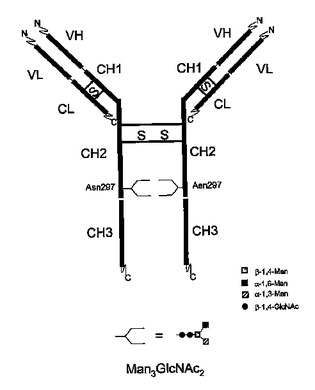 (もっと読む)
(もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
レセプターのシグナル伝達の増強をもたらすNOTCH変異
本発明は、変異された場合にレセプターのシグナル伝達の増強をもたらすNOTCH−1レセプター内の領域の同定に基づく。この変異は、無制御の細胞増殖に関連し、この増殖は、γ−セクレターゼのようなNOTCH−1活性を妨げる因子を用いて阻止され得る。NOTCH−1変異についてのアッセイは、診断的にまたは癌患者に対する処置レジメンの一部として用いられ得る。ヒト腫瘍における新規な変異の同定は、癌の存在を同定するのを助けること、およびNOTCHシグナル伝達のインヒビターに応答する癌細胞を同定し、それによってNOTCHシグナル伝達経路インヒビターによる直接的で合理的な癌処置を可能にすることにおいて有用であるはずである。 (もっと読む)
可溶性RNAポリメラーゼタンパク質およびその使用方法
真核細胞起源でありかつRNAサイレンシング経路に関与するポリメラーゼタンパク質が、検出可能なRNA重合活性を保有する精製された可溶性形態で初めて提供される。このポリメラーゼは、in vitroのRNA合成のための方法およびキットにおいて有用である。本発明のポリメラーゼは、ssRNAテンプレートをコピーして、2つのタイプの反応産物(短いRNAコピーおよび長いRNAコピー)を産生する。これは、ssDNAテンプレートもまたコピーし得る。この重合はRNA合成の開始のためにプライマーを必要としないが、RNA合成はプライマーの存在下でも開始され得る。標準的なヌクレオチドに加えて、本発明のポリメラーゼは、多数の改変されたヌクレオチドをも受容する。このポリメラーゼは、多数の下流の適用(例えば、標識されたRNAプローブの産生または生きた細胞においてRNA干渉効果を誘導するかもしくはin vitro系において適切なトリガーRNA分子の生成)において有用である。 (もっと読む)
遺伝子サイレンシングをモニタリングおよび調節するための方法および手段
標的遺伝子に相同なヌクレオチド配列を含むdsRNA領域のほかに、低下するように設計された追加のdsRNA領域を含む二本鎖RNAを用いて、真核生物における遺伝子発現の低下をモニタリングおよび調節するための方法および手段を提供する。 (もっと読む)
2,121 - 2,140 / 2,451
[ Back to top ]