Fターム[4C069CC14]の内容
ピロール系化合物 (8,574) | 製法 (628) | 化学的方法 (523) | 複素環の形成を伴わないもの (410) | 置換基の形成導入 (324) | ハロゲン化 (14)
Fターム[4C069CC14]に分類される特許
1 - 14 / 14
α−フルオロメチルカルボニル化合物の製造方法
【課題】医農薬の重要な中間体であるα−フルオロメチルカルボニル化合物の実用的な製造方法を提供する。
【解決手段】カルボニル化合物のα位プロトンを塩基で脱プロトン化し、フルオロメタンと反応させることにより、α−フルオロメチルカルボニル化合物が製造できる。各種フルオロメタンは大量規模での入手が比較的安価であり、本発明では塩基以外に付加的な試薬も必要としない。さらに、α位が脱プロトン化できるカルボニル化合物であれば広範な原料基質に適応できる。また、医農薬中間体として特に重要なα−ジフルオロメチル(−β、γ、δまたはε−)アミノ酸の前駆体が好適に製造できる。これらの前駆体は新規化合物である。
(もっと読む)
殺虫性ピロリン誘導体
【課題】殺虫剤として優れた殺虫効果を示す新規なピロリン誘導体を提供すること。
【解決手段】式(I):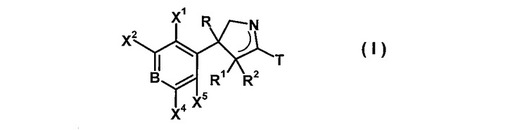
(各置換基は、明細書に記載のとおり)で表わされるピロリン誘導体並びにそれの殺虫剤及び動物寄生虫防除剤としての利用。
(もっと読む)
ヒドロキシル基置換生成物の製造方法
【課題】ヒドロキシル基置換生成物の工業的な製造方法を提供する。
【解決手段】アルコール類を有機塩基と求核剤(X-)の存在下にスルフリルフルオリド(SO2F2)と反応させることにより、ヒドロキシル基置換生成物を製造することができる。本発明は、大量規模での使用において安価な反応剤を用いることができ、さらに操作や精製が簡便に行えて廃棄物の少ない、工業的な製造方法であり、光学活性ヒドロキシル基置換生成物、特に光学活性α−ヒドロキシル基置換エステル類および光学活性4−ヒドロキシル基置換プロリン類の製造にも好適に適応できる。本発明は従来技術の問題点を全て解決し、工業的にも実施可能な製造方法である。
(もっと読む)
複素5員環アルデヒド化合物の製造方法
【課題】毒性の強いハロゲン分子を使用することなくまた高価な原材料を使用することなく高収率で簡便かつ廃棄物の発生量の少ない複素5員環アルデヒド化合物のハロゲン化方法を提供する。
【解決手段】酸化剤とHXで表される化合物により複素5員環アルデヒド化合物の製造方法を提供する。好適に使用できる酸化剤としては例えば、過硫酸またはその塩、過塩素酸又はその塩、次亜塩素酸又はその塩、さらし粉、アルキルヒドロペルオキシド、過酢酸等の有機過酸、アミン−N−オキシド、過ホウ酸塩、過酸化水素、酸素などであり、これらの中でも、生産効率、コスト等の面から、過酸化水素が特に好ましい。HXは塩素原子または臭素原子またはヨウ素原子を表し、塩素原子または臭素原子が好ましく、臭素原子が最も好ましい。HXで表される化合物はいわゆる、塩化水素、臭化水素、ヨウ化水素であり、単独で使用されてもよく、水溶液の状態で使用されてもよい。
(もっと読む)
遷移金属触媒によるクロスカップリングのためのリガンド、およびその使用方法
様々な遷移金属触媒による炭素−ヘテロ原子および炭素−炭素結合形成反応に使用できる、遷移金属のためのリガンドがここに開示されている。開示された方法は、様々な適切な基質、触媒の回転数、反応条件、および効率を含む、遷移金属触媒による反応の多くの特徴における改善を提供する。例えば、そのような改善は、遷移金属触媒によるクロスカップリング反応において実現される。 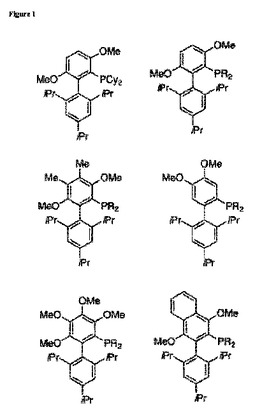 (もっと読む)
(もっと読む)
パーフルオロアルキル基を有する複素環化合物およびその製造方法
【課題】パーフルオロアルキル基を有する複素環化合物の製造方法を開発する。
【解決手段】
パーフルオロアルキル基を有する複素環化合物の製造方法は、
一般式(1)
[式中、Y1は、酸素原子等を示し、Y2、Y3、Y4およびY5は各々独立に、窒素原子、または、炭素数1から4のアルキル基等で置換されていても良い炭素原子を示す。]で表される複素環化合物を、一般式(2) R1aS(=O)R1b [式中、R1aおよびR1bは、炭素数1から12のアルキル基等を示す。]で表されるスルホキシド類、過酸化物、鉄化合物および酸の存在下に、一般式(3) Rf−X [式中、Rfは、炭素数1から6のパーフルオロアルキル基を示し、Xは、ハロゲン原子を示す。]で表されるハロゲン化パーフルオロアルキル類と反応させる。
(もっと読む)
メルカプトチアゾールの製造方法および製造中間体
【課題】医薬品として有用な化合物の、工業的に有利な製造法および中間体の提供。
【解決手段】式(7)で表される化合物(式中、nは、1または2を表し、X1およびX2は、それぞれ独立して、ハロゲン原子を表す。)の製造方法。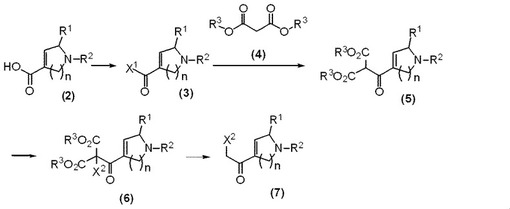 (もっと読む)
(もっと読む)
t−ブトキシカルボニル保護基を有するフッ素化合物の製造方法
【課題】t-ブトキシカルボニル保護基を有するフッ素化合物を工業規模で安定的に高収率で製造する技術の提供。
【解決手段】一般式(1)
(nは1から7の整数であり、環を構成する炭素原子は炭素数1から12のアルキル基、炭素数1から12のアルコキシ基、炭素数1から12のアリールアルキル基、炭素数1から12のアルコキシカルボニル基で置換されていてもよい)で表される化合物を塩基性有機化合物の共存下にフッ素化剤によりフッ素化するか、あるいはルイス塩基性を有する有機化合物を溶媒として用いてフッ素化剤によりフッ素化化合物の製造方法。
(もっと読む)
脱ヒドロキシフッ素化剤
【課題】新規で有用な脱ヒドロキシフッ素化剤を提供する。
【解決手段】スルフリルフルオリド(SO2F2)と、分子内に遊離のヒドロキシル基を有することのない有機塩基と、を含む、新規で有用な脱ヒドロキシフッ素化剤を見出した。本脱ヒドロキシフッ素化剤は、大量規模での使用が好ましくないパーフルオロアルカンスルホニルフルオリドを用いる必要がなく、医農薬および光学材料の重要中間体である、光学活性フルオロ誘導体、具体的には4−フルオロプロリン誘導体、2'−デオキシ−2'−フルオロウリジン誘導体および光学活性α−フルオロカルボン酸エステル誘導体、およびモノフルオロメチル誘導体等を大量規模でも有利に製造できる。
(もっと読む)
4−フルオロプロリン誘導体の製造方法
【課題】医薬の重要中間体である4−フルオロプロリン誘導体の実用的な製造方法を提供する。
【解決手段】4−ヒドロキシプロリン保護体を有機塩基と「有機塩基とフッ化水素からなる塩または錯体」の存在下にトリフルオロメタンスルホン酸無水物と反応させることによりなる。本製造方法の特徴は、フッ素置換で必要となるフッ素源[フッ素アニオン(F-)]の存在下にトリフルオロメタンスルホニル化を行うことにより、目的とする4−フルオロプロリン誘導体が極めて高い収率で得られることにある。また本発明で使用するフッ素源である「有機塩基とフッ化水素からなる塩または錯体」、特に「トリエチルアミンとフッ化水素からなる塩または錯体」は、大規模での入手が容易なだけでなく安価に利用することもできるため、実用的な製造方法という観点からも有利である。
(もっと読む)
アルコール溶媒中での有機フルオロ化合物の調製方法
本発明は、放射性同位元素フッ素18を含んだ有機フルオロ化合物の調製方法に関するもので、より詳細には、放射性同位元素フッ素18を含んだフッ素塩とアルキルハライドまたはアルキルスルホナートとを反応させて有機フルオロ化合物を調製する方法において、下記の化学式1で表わされるアルコールを溶媒に使用することによって、有機フルオロ化合物を高収率で調製する有機フルオロ化合物の調製方法に関するものであり、本発明による合成は、穏和な反応条件下で行うことができ、反応時間を短縮させるだけではなくその収率を顕著に向上させることにより、有機フルオロ化合物の大量生成に好適である。 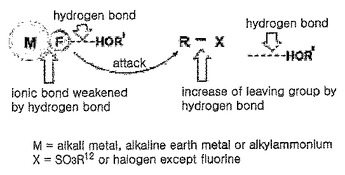 (もっと読む)
(もっと読む)
4−フルオロプロリン誘導体の製造方法
【課題】 医薬の重要中間体である4−フルオロプロリン誘導体の工業的な製造方法を提供する。
【解決手段】 4−ヒドロキシプロリン保護体をトリエチルアミン、ルチジンまたはコリジン等の有機塩基と「トリエチルアミンまたはピリジン等の有機塩基とフッ化水素からなる塩または錯体」の存在下にトリフルオロメタンスルホニルフルオリドと反応させる。本製造方法の第一の特徴は、4−ヒドロキシプロリン保護体の脱ヒドロキシフッ素化反応がパーフルオロアルカンスルホニルフルオリドとしてトリフルオロメタンスルホニルフルオリドを使用することにより良好に進行することにある。また第二の特徴は、該脱ヒドロキシフッ素化反応がトリエチルアミン・三フッ化水素錯体またはジイソプロピルエチルアミン・三フッ化水素錯体以外の「ピリジン等の有機塩基とフッ化水素からなる塩または錯体」のフッ素化剤の存在下においても良好に進行することにある。
(もっと読む)
BACE阻害剤
本発明は、式I:
I
のBACE阻害剤、その使用方法及び調整方法、並びに、その調整のための中間体を提供する。  (もっと読む)
(もっと読む)
cis−4−フルオロ−L−プロリン誘導体の製造法
本発明は、cis−4−フルオロ−L−プロリン誘導体を、安全性が高く、より緩和な条件で好収率及び高純度品を与える工業的に安価に製造する方法であって、下記式[I]
【化1】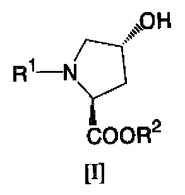
(式中、R1はα−アミノ基の保護基を示し、R2はカルボキシル基の保護基を示す。)で表されるtrans−4−ヒドロキシ−L−プロリン誘導体に、フッ化水素捕捉剤の存在下、N,N−ジエチル−N−(1,1,2,3,3,3−ヘキサフルオロプロピル)アミンを反応させることを特徴とする、cis−4−フルオロ−L−プロリン誘導体の製造方法を提供する。
(もっと読む)
1 - 14 / 14
[ Back to top ]

