Fターム[4H045BA32]の内容
ペプチド又は蛋白質 (143,989) | 化学構造 (26,018) | 環状ペプチド (578) | ペプチド結合以外の結合を含む環があるもの (328) | S−S結合 (124)
Fターム[4H045BA32]に分類される特許
21 - 40 / 124
放射性ヨウ素化方法
本発明は、検査対象の生物学的標的化分子(BTM)を放射性ヨウ素で標識するための新規な方法を提供する。また、本方法を用いて製造される新規な放射性ヨウ素化BTM並びにかかる放射性ヨウ素化BTMを含む放射性医薬組成物も提供される。本発明はまた、本方法で有用な放射性ヨウ素化中間体並びにかかる放射性ヨウ素化BTMを用いるインビボイメージング方法も提供する。 (もっと読む)
非脂質エンベロープウイルスの除去を高めるためのVWFの精製
本発明は、非脂質エンベロープウイルスの除去を高めるための、フォンウィルブランド因子(VWF)を精製するための方法を提供する。例えば、タンパク質含有溶液から非脂質エンベロープウイルスを除去するための方法であって、前記タンパク質の等電点よりも高いpHの前記溶液を、陽イオン交換樹脂に適用することと、前記陽イオン交換樹脂を第1の洗浄緩衝液で洗浄して、溶出液を形成することであって、前記第1の洗浄緩衝液は、前記陽イオン交換樹脂に適用される前記溶液以下であるpHを有することと、を含む、方法が提供される。 (もっと読む)
リナクロチドを含む処方物
本発明は、リナクロチドを含む安定な組成物、ならびに上記組成物の調製および使用のための種々の方法およびプロセスに関する。本発明のリナクロチドを含む薬学的組成物は、安定化量のポリマー、安定化量の立体的に妨害されている一級アミン、安定化量のカチオン、またはこれらの組み合わせもしくは混合物を含む。本発明は、胃腸障害の処置を必要とする被験体に治療上有効な量の上記組成物を投与する工程を包含する、胃腸障害を処置するための方法が提供する。 (もっと読む)
ペプチド含有摂食調節剤
【課題】摂食調節能を有する医薬品、医薬部外品、食品添加物及び機能性食品等に広く利用できるMCHもしくはその酵素分解物を提供すること。
【解決手段】哺乳類のMCHあるいはその酵素分解物として、摂食調節ペプチドを得る。また、得られた物質は生体内生理活性物質であるため、安全面にも優れており、広範な用途に利用できる。
(もっと読む)
安定化された免疫グロブリン定常ドメイン
本発明は、少なくとも1つの定常抗体ドメインを含んでなるマルチドメインモジュラー抗体であって、フレームワーク領域にドメイン内又はドメイン間ジスルフィド架橋を得るために、前記定常ドメインの変異誘発を通してアミノ酸配列に少なくとも1つのCys残基を導入することによって人工ジスルフィド架橋を形成するために変異された抗体、このような抗体に基づくライブラリ、及び製造の方法に関する。 (もっと読む)
造血促進のためのBV8及び/又はEG−VEGFの使用
【課題】造血を亢進するためにBv8及びEG−VEGFポリペプチド及び核酸を使用する方法、Bv8及びEG−VEGF活性のモジュレーターをスクリーニングする方法Bv8及びEG−VEGFポリペプチドないしBv8及びEG−VEGFアンタゴニストを使用する治療方法を提供する。
【解決手段】骨髄細胞及びそのプロジェニーの増殖を誘導する方法であって、該細胞をBv8に接触させることを含んでなる方法。哺乳動物の異常造血関連疾患の治療方法であって、該哺乳動物にBv8アンタゴニスト、EG−VEGFアンタゴニスト、又はそれらの混合を投与することを含んでなる方法。
(もっと読む)
少なくとも2つのα3ドメインを含むHLA−Gの多量体ポリペプチド及び医薬としてのその使用
多量体ポリペプチド及び医薬としてのその使用; HLA-G抗原のα3ペプチドを含む多量体及びこのような多量体の製造方法、HLA-G抗原のα3ペプチドを含む医薬組成物並びに臓器/組織拒絶を含む様々な疾患を治療するためのその使用。前記多量体は、少なくとも2つの単量体を含み、各々の単量体が式X1-X2(式中X1はシステインアミノ酸を含むペプチドリンカーを表し、X2はHLA-Gのα3ドメインを表す)のペプチドP1からなる群において選択される。 (もっと読む)
生物的に生成される環状アフィニティータグ
本発明は、アフィニティータグを対象のタンパク質へと導入する新規の方法に関する。対象のポリペプチドと環状アフィニティータグとを含むタンパク質性物質を供給する酵素的方法であって、(a)前記対象のタンパク質と、一般式がX1-タグ-X2である少なくとも1つのモチーフとを含み;X1およびX2はアミノ酸を表わし、それらの側鎖が、残基X1と残基X2との間にチオエーテル架橋を形成することが可能なランチビオティック酵素により連結されえ;タグは、環化するとその結合パートナーに結合することが可能な短いアミノ酸配列である、少なくとも1つの前駆体タンパク質性物質を供給するステップと; (b)前記前駆体を、X1とX2との間に共有結合を形成することが可能な少なくとも1つの酵素と接触させ、これにより、タグ配列を含む分子内環構造を導入するステップと; (c)結果として得られる環化タンパク質性物質を単離するステップとを含む酵素的方法が提供される。また、この方法により得られるタンパク質性物質、ならびに、例えば、ペプチドライブラリーを調製するためのその使用も提供される。 (もっと読む)
改善された活性を有するコンプスタチン(Compstatin)類似体
【課題】C3タンパク質に結合し、補体活性化を阻害することができるペプチド及びペプチド擬態を有する化合物を提供する。
【解決手段】現在利用可能な化合物と比較して、改良された補体活性化阻害活性を示す、特定の配列を有するペプチド及び、上記ペプチドの部分ペプチド擬態を有する化合物。並びに、前記ペプチドをコードする単離核酸分子。
(もっと読む)
ソマトスタチンベクター
【課題】標的指向性の細胞傷害化合物と、新生物や他の状態の治療へのその療法的使用に関する方法の提供。
【解決手段】生物学的受容体のリガンドのような標的指向部分へ結合した細胞傷害部分を含んでなる、標的指向性の細胞傷害化合物。細胞傷害部分がアントラサイクリン、カンプトテシン、パクリタキセル、ドキソルビシン、又はそれらの誘導体、であり、標的指向部分がソマトスタチン、ボンベシン、若しくはLHRH、あるいはそれらの類似体、又は前記リガンド又は前記類似体の誘導体である。
(もっと読む)
透過性亢進の予防および治療方法
上皮細胞および内皮細胞の透過性亢進を予防および治療するための、7〜17隣接アミノ酸からなり、ヘキサマーTX1EX2X3E(ここで、X1、X2、およびX3はあらゆる天然もしくは非天然のアミノ酸であり得る)を含むペプチドであって、TNFレセプター結合活性を持たず、環化されているペプチドについて記載する。 (もっと読む)
結晶性インスリン複合体
本開示は、結晶性インスリン複合体を提供する。また、本開示は、これらの結晶性インスリン複合体を含むものの製剤、治療法、投与法および製造法を開示する。  (もっと読む)
(もっと読む)
安定な成長ホルモン化合物
本発明は、システイン残基を導入することによりジスルフィド架橋を有し、これによりタンパク質分解に対して耐性となる、安定な成長ホルモン(GH)化合物に関する。 (もっと読む)
抗菌活性を強化したランチビオティック型カルボキシアミド誘導体
【課題】優れた抗菌活性を有するランチビオティック型カルボキシアミド誘導体、その製造方法、及びそれを用いた医薬組成物を提供する。
【解決手段】下記一般式(II)で表され、抗菌性を有するランチビオティック97518の新規なアミド誘導体、その製造方法、及びそれを用いた医薬組成物。
【化1】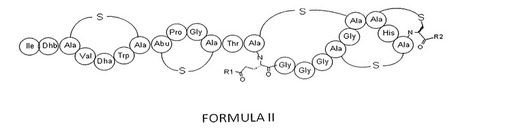
(もっと読む)
ソマトスタチンに由来する新規なオクタペプチド化合物及びその治療的利用
本発明は、一般式(I):H−2−Nal1−シクロ(Cys2−Tyr3−AA4−Lys5−Val6−Cys7)−Thr8−NH2の新規なオクタペプチド化合物に関するものである。これらの生成物は、ソマトスタチンレセプターサブタイプに対する良好な親和性を有するので、それらは、一の(又は、より多くの)ソマトスタチンレセプターが関与する病理的状態又は病気を治療するのに特に有利である。その上、これらの化合物は、それらを、医薬の配合のための種々の溶液において、例えば製薬上許容しうるキャリアーとして構想することを可能にする物理化学的特性を有している。この発明は又、該生成物を含む医薬組成物及びそれらの医薬の製造のための利用にも関係する。 (もっと読む)
C型肝炎ウイルス阻害剤
一般式(I):
を有するC型肝炎ウイルス阻害剤を開示する。HCVを阻害するための、該化合物を含有する組成物および該化合物を用いる方法もまた開示する。 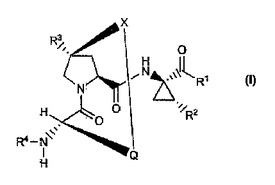 (もっと読む)
(もっと読む)
インスリン化合物の調製方法
本発明は、無作為の非所望副産物を回避する制御された様式で指向反応に相乗的に作用する最適量のトリプシン及びカルボキシペプチダーゼBの組合せ又は同時使用を含むワンステップ酵素反応により、その類似体又は誘導体を含むインスリン化合物を対応する前駆体型から調製することに関する。特に、本発明の酵素的転換反応は、操作工程数の削減、所望最終生成物の高い収率及び純度の点で利点を提供する。 (もっと読む)
エリトロポエチン受容体に結合する化合物およびペプチド
【課題】エリトロポイエチン受容体に結合する新規化合物およびペプチドの提供。
【解決手段】エリトロポエチン受容体(EPO−R) に結合し、そして活性化し、または EPOアゴニストとして働く、アミノ酸配列X3X4X5GPX6TWX7X8 (SEQID NO:) を含み、ここに、各々のアミノ酸は標準的な一文字省略で示され;X3 はC;X4 はR,H,LまたはW;X5 はM,FまたはI;X6 は20の遺伝的にコードされたL−アミノ酸のいずれかから独立して選択され;X7 はD,E,I,LまたはV;およびX8 はCである長さ10〜40アミノ酸残基のペプチド及びそれらの使用方法。
(もっと読む)
デプシペプチドおよびその治療的使用
構造(IX)もしくは(X)の化合物またはその医薬的に許容される塩であって、式中、Xは−C(=O)N(R10)−または−CH(OPr3)−であり;R7、R9およびR10は同一であるかまたは異なっており、水素または天然もしくは非天然アミノ酸由来のアミノ酸側鎖部分を表し;Pr1およびPr2は同一であるかまたは異なっており、水素またはチオール保護基を表し;Pr3は水素またはアルコール保護基であり;R1、R2、R5およびR6は同一であるかまたは異なっており、水素、または天然もしくは非天然アミノ酸のいずれかに由来するアミノ酸側鎖部分を表し、あるいはR1およびR2ならびに/またはR5およびR6は、それらが結合する炭素原子と一緒になってスピロ環部分を形成し、ただし:R1およびR2はそれぞれ水素ではないか、またはR5およびR6はそれぞれ水素ではない。
【化1】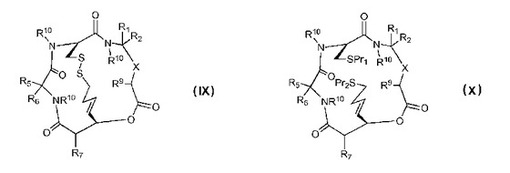
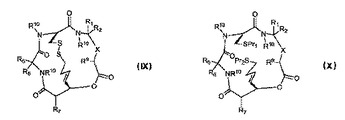 (もっと読む)
(もっと読む)
生物学的に活性なペプチド
(i)WDLYFEIVW(配列番号1);または
(ii)WDLYFEIVW(配列番号1)内に1、2、3または4つのL−アミノ酸置換を含むバリアントアミノ酸配列;または
(iii)部分(i)および(ii)のうちのいずれか1つのペプチドまたはペプチド誘導体のレトロインベルソバリアント
を含むペプチドまたはペプチド誘導体であって、ここで、前記ペプチドまたはペプチド誘導体は、凝血促進活性を有する。
(i)imfwydcyeを含むアミノ酸配列;または
(ii)imfwydcye内に1、2、3、4、5または6つのアミノ酸置換を含むバリアントアミノ酸配列
を含むペプチドまたはペプチド誘導体であって、ここで、前記ペプチドまたはペプチド誘導体は、凝血促進活性を有する。
(もっと読む)
21 - 40 / 124
[ Back to top ]

