ヒトの主要組織適合複合体(MHC)の表現型を有するトランスジェニックマウス、その実験のための使用および応用方法
本発明は、トランスジェニックマウスと、単離されたトランスジェニックマウスの細胞に関するものであり、マウスおよびマウスの細胞は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーンおよび機能的なHLAクラスIIトランスジーンを含むものである。実施態様において、トランスジェニックマウスまたはトランスジェニックマウスの細胞は、H−2クラスI分子およびクラスII分子の両方を欠いており、機能的なHLAクラスIトランスジーンおよび機能的なHLAクラスIIトランスジーンを含んでいる。実施態様において、トランスジェニックマウスまたはトランスジェニックマウスの細胞は、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。本発明はまた、本発明によるトランスジェニックマウスを用いる方法にも関するものである。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本出願は、2003年7月30日に出願された米国特許仮出願第60/490945号明細書(代理人番号第03495.6093号)の利益に基づき、また該利益を特許請求するものであり、該仮出願の開示内容全体は、すべての目的について、本出願の基礎となるものであり、また、参照することによって本出願の一部を構成するものである。
【背景技術】
【0002】
現状では、多くのワクチンが、ヒトのガンの免疫療法のため、そして、マラリア、エイズ、C型肝炎ウイルスおよび重症急性呼吸器症候群(SARS)のような伝染病の治療のために開発されてきている。新たに生起する病原体が出現する早さを考えると、ワクチン戦略および様々なエピトープの防御能について素早く信頼性のある評価をするために用いることのできる動物モデルを改良することが重要である。さらに、インビボ研究は、ワクチンの免疫原性、ワクチンの製剤化、投与経路、組織分布、ならびに一次リンパ器官および二次リンパ器官の関与のような、容易に評価できない、あるいはインビトロで測定することができない、ワクチンの挙動の重大な変動を評価するために既に必要とされている。単純で融通がきくことから、マウスのような小動物は、少なくとも初期のワクチンの開発研究に対して、ヒトではない霊長類のような、より扱いにくく、よりコストの高いモデルシステムに代わる、魅力的な代替物となっている。
【0003】
野生型動物の研究では防御的であることが発見されているワクチンが、いくつかの臨床試験で中程度の有効性を示したことは(McMichael、A.J.&Hanke、T.『Nat Med』9、874−880(2003))、動物のMHC分子とヒトのHLA分子が同一の最適なエピトープを有していないために、ヒトと動物のMHCが免疫反応の結果に対して与える影響が異なるということによって、部分的に説明することができる(Rotzschke、O.et al.『Nature』348、252−254(1990))。従って、いくつかの制限にも関わらず、ヒトHLAを発現するトランスジェニックマウスは、ワクチン候補を試験し、ワクチンが自己免疫疾患を誘発する潜在的なリスクを評価し、ヒトの拘束因子に基づいたより良い治療方法を開発するための前臨床モデルとして、野生型マウスに対する有用な改良となるものである。
【0004】
細胞傷害性T細胞
細胞傷害性T細胞(CTL)は、伝染病の根絶、またある場合にはガンの根絶において重要な役割を果たす(P.Aichele、H.Hengartner、R.M.Zinkernagel and M.Schulz、『J Exp Med』171(1990)、p.1815;L.BenMohamed、H.Gras−Masse、A.Tartar、P.Daubersies、K.Brahimi、M.Bossus、A.Thomas and P.Druhile、『Eur J Immunol』27(1997)、p.1242;D.J.Diamond、J.York、J.Sun、C.L.Wright and S.J.Forman、『Blood』90(1997)、p.1751)。組換えタンパク質ワクチンはCTL反応を確実には誘発しない(Habeshaw JA、Dalgleish AG、Bountiff L、Newell AL、Wilks D、Walker LC、Manca F.1990年11月;11(11):418−25;Miller SB、Tse H、Rosenspire AJ、King SR.『Virology』1992年12月;191(2):973−7)。弱毒化した病原体で構成される他の免疫原性ワクチンは、いくつかの主要な疾病において、最も重要な安全上の懸念から、ヒトに用いることができない。ここ数年、エピトープに基づくアプローチが、予防および免疫療法のための新たなワクチンを開発するための、将来性がある方法として提案されてきている(Melief CJ、Offringa R、Toes RE、Kast WM.『Curr Opin Immunol.』1996年10月、8(5):651−7;Chesnut RW、「Design testing of peptide based cytotoxic T−cell mediated immunotherapeutic to treat infection disease、cancer」、Powell、MF、Newman、MJ(編)『Vaccine Design:The Subunit、Adjuvant Approach』所収、Plenum Press、New−York、1995年、847)。このアプローチはいくつかの利点を有しているのだが、該利点には、自然なプロセシングを受けたエピトープを選択して、免疫系が、高度に保存され免疫的にドミナントな病原体のエピトープに焦点を合わせるようにすること(R.G.van der Most、A.Sette、C.Oseroff、J.Alexander、K.Murali−Krishna、L.L.Lau、S、Southwood、J.Sidney、R.W.Chesnut、M.Matioubian and R.Ahmed、『J Immunol』157(1996)、p.5543)、ならびに、HIV、B型肝炎ウイルス(HBV)およびC型肝炎ウイルス(HCV)の感染において見られるような突然変異によるエスケープを防ぐ、複数のエピトープが関与する反応を誘発することが含まれる。また、該アプローチはサプレッサーT細胞の決定基をなくすことも可能にするものであり、このことにより、TH1の反応が望まれる条件下においてTH2の反応を好適に生じさせること、またその逆も可能となる(Pfeiffer C、Murray J、Madri J、Bottomly K.『Immunol Rev.』1991 Oct;123:65−84;P Chaturvedi、Q Yu、S Southwood、A Sette、and B Singh『Int Immunol』1996、8:745−755)。最後に、該アプローチは、望ましくない自己免疫疾患を誘発する可能性のある、抗原における自己免疫T細胞の決定基を取り除く可能性を提供する。CTLエピトープペプチドを用いる防御性の抗ウイルス免疫または防御性の抗腫瘍免疫は、いくつかの実験モデルで成功を収めている(D.J.Diamond、J.York、J.Sun、C.L.Wright and S.J.Forman、『Blood』90、1997、p.1751;J.E.J.Blaney、E.Nobusawa、M.A.Brehm、R.H.Bonneau、L.M.Mylin、T.M.Fu、Y.Kawaoka and S.S.Tevethia、『J Virol』72(1998)、p.9567)。
【0005】
ヒトのリンパ球の使用に基づくCTLエピトープの決定は、不完全な結果へとつながる環境的、遺伝的な多様性のため、また、CTLクローンの単離における技術的困難性のために、誤りを生じる恐れがある。今までに説明されているHLAクラスIまたはクラスIIのトランスジェニックマウスは、このような動物モデルで新しいCTLおよびヘルパーT細胞のエピトープが同定されたことによって示されているように、これらの限界を克服するための有効なツールであることが証明されている(Hill AV.『Annu Rev Immunol.』1998;16:593−617;Carmon L、El−Shami KM、Paz A、Pascolo S、Tzehoval E、Tirosb B、Koren R、Feldman M、Fridkin M、Lemonnier FA、Eisenbach L.『Int J Cancer』、2000年2月1日;85(3):391−7)。また、これらのマウスは、i)ペプチドのHLA結合親和力と免疫原性との間の良好な相互関係(Lustgarten J、Theobald M、Labadie C、LaFace D、Peterson P、Disis ML、Cheaver MA、Sherman LA.『Hum Immunol.』1997年2月;52(2):109−18;Bakker AB、van der Burg SH、Huijbens RJ、DRijfhout JW、Melief CJ、Adema GJ、Figdor CG.『Int J Cancer』1997年1月27日;70(3):302−9)、ii)抗原プロセシングのレベルでの、マウスのCTL系とヒトのCTL系の間にある顕著な重複(同一のエピトープの生成)、および、iii)HLAトランスジェニックマウスとヒトにおけるCTLレパートリーの、大半の抗原に対する同程度の可動性(Wentworth、P.A.、A.Vifiello、J.Sidney、E.Keogh、P.W.Chesnut、H.Grey、A.Sette.1996.『Eur.J.Immunol.』26:97;Alexander、J.、C.Oserof、J.Sidney、P.Wentworth、E.Keogh、G.Hermanson、F.V.Chisari、R.T.Kubo、H.M.Grey、A.Sette、1997.『J.Immunol.』159:4753)を証明するために用いられている。
【0006】
今までに、合成ペプチドに基づくCTLエピトープワクチンは、多くのヒトの疾病に対する免疫療法として開発されている[18−20]。しかし、いくつかの臨床試験では中程度の有効性が観察されただけである(21)。これは、部分的には、これらのワクチンが十分に強力なCTL反応を誘発することができなかったことによって説明することができる。実際、最近の報告では、最大のCTL反応を得るために、CD4+T細胞の補助が必要であることが示唆されている(A.J.Zajac、K.Murali−Krishna、J.N.Blattman and R.Ahmed、『Curr Opin Immunol』10(1998)、p.444;Firat H、Garcia−Pons F、Tourdot S、Pascolo S、Scardino A、Garcia Z、Michel ML、Jack RW、Jung O、Kosmatopoulos K、Mateo L、Suhrbier A、Lemonnier FA、Langlade−Dernoyen P『Eur J Immunol』29、3112、1999)。
【0007】
CTLはウイルス感染に対する防御免疫の重要な構成要素であるが、CTLをインビボでプライミングする必要性は十分には理解されていない。今では、Th細胞が合成ペプチドでのCTLのプライミングのためには通常不可欠であることが認められている。合成CTLエピトープペプチドに関して、いくつかの研究が、最適なCTL反応を誘発するためにはThリンパ球の刺激が必須であることを指摘している(C.Fayolle、E.Deriaud and C.Leclerc、『J Immunol』147(1991)、p.4069;C.Widmann、P.Romero、J.L.Maryanski、G.Corradin and D.Valmori、『J Immunol Meth』155(1992)、p.95;M.Shirai、C.D.Pendkton、J.Ahlers、T.Takeshita、M.Newman and J.A.Berzofsky、『J Immunol』152(1994)、p.549;J.P.Sauet、H.Gras−Masse、J.G.Guillet and E.Gomard、『Int Immunol』8(1996).p.457)。これらの研究のいくつかは、CD4+ヘルパーT細胞とCD8+T細胞が、それらのコグネイトエピトープを有する一つの抗原提示細胞と同時に相互作用することが、CD8+T細胞の活性化に必要であることを示している(Ridge JP、Di Rosa F、Matzinger P.『Nature』1998年6月4日;3 93(6684):474−8)。
CTLのプライミングにこの三つの細胞の相互作用が関与することは、ウイルスエピトープおよび動物モデルを用いた研究によって、CTLエピトープとTh細胞エピトープが結合していない混合物として投与されるときより、物理的に結合しているときに、CTLのインビボでの誘発が最も効果的であったことから検証された(Shirai M、Pendleton CD、Ahlers J、Takeshita T、Newman M、Berzohky JA.『J Immunol』1994年1月15日;152(2):549−56;Oseroff C、Sette A、Wentworth P、Celis E、Maewal A、Dahlberg C、Fikes J、Kubo RT、Chesnut RW、Grey BX Alexander『J.Vaccine』1998年5月;16(8):823−33)。CTLの抗原ペプチドとTh細胞の抗原ペプチドの、CTL反応を効果的に誘発する能力は、実験モデル(C.Fayolle、E.Deriaud and C.Leclerc、『J Immunol』147(1991)、p.4069;C.Widmann、P.Romero、J.L.Maryanski、G.Corradin and D.Valmori、『J Immunol Meth』155(1992)、p.95)でも、ヒト(A.Vitiello、G.Ishioka、H.M.Grey、R.Rose、P.Famess、R.LaFond、L.Yuan、F.V.Chisari、J.Furze and R.Bartholomeuz、『J Clin Invest』95(1995)、p.341;B.Livingston、C.Crimi、H.Grey、G.Ishioka、F.V.Chisari、J.Fikes、H.M.Grey、R.Chesnut and A.Sette、『J Immunol』159(1997)、p.1383)においても実証されている。さらに、強力なTh反応は、CTL反応の最適な誘発だけではなく、CTLの記憶の維持のためにも重要な役割を果たす(E.A.Walter、P.D.Greenberg、M.J.Gilbert、R.J.Finch、K−S.Watanabe、E.D.Thomas and S.R.Riddell、『N Engl J Med』333(1995)、p.1038;Thomas ED、Blume KG、Forman SJ(編)『Hematopoietic Cell Transplantation』第2版、Malden、MA:Blackwell Science Inc.、1999年所収、Riddell SR、Greenberg PD)。最後に、CD4+「ヘルパー」T細胞が外来抗原に対する細胞性免疫反応と液性免疫反応を協調させることに重要であることも、古くから実証されてきている。
【0008】
近年では、HLA−A*0201クラスI分子とHLA−DR1クラスII分子の両方を発現するトランスジェニック(Tg)マウスが確立された(BenMohamed L、Krishnan R、Longmate J、Auge C、Low L、Primus J、Diamond DJ、『Hum、Immunol』2000年8月;61(8):764−79)。著者らは、HLA−A*0201トランスジーンとHLA−DR1トランスジーンの両方がインビボで機能的であること、MHCクラスI分子とクラスII分子の両方が拘束因子として用いられること、そして、HLA−DR1トランスジーンの生成物がHLA−A*0201拘束性の抗原特異的なCTL反応を助長することを報告している(BenMohamed L、Krishnan R、Longmate J、Auge C、Low L、Primus J、Diamond DJ、『Hum、Immunol』2000年8月;61(8):764−79)。
【0009】
これらHLA−A*0201/DR1のTgマウスがそれらに固有のMHCであるH−2クラスI分子およびクラスII分子を発現したことは注目に値する。内因性のマウスMHCクラスI遺伝子を発現するHLAクラスIトランスジェニックマウスが、優先的に、そしてしばしば独占的にH−2拘束性のCTL反応を示し(C Barra、H Gournier、Z Garcia、PN Marche、E Jouvin−Marche、P Briand、P Fillipi、and FA Lemonnier『J Immunol』1993、150:3681−3689;Epstein H、Hardy F、May JS、Johnson MH、Holmes N『Eur J Immunol.』1989年9月;19(9):1575−83;Le AX;EJ Bernhard、MJ Holterman、S Strub、P Parham、E Lacy、and VH Engelhard『J Immunol』1989、142:1366−1371;Vitiello A、Marchesini D、Furze J、Sherman LA、Chesnut RW『J Exp Med』1991年4月1日;173(4):100715)、内因性のマウスMHCクラスII遺伝子を発現するHLAクラスIIトランスジェニックマウスが、信頼性のあるHLAクラスII拘束性の抗原特異的反応を誘発することができないことから(Nishimura Y、Iwanaga T、Inamitsu T、Yanagawa Y、Yasunami M、Kimura A、Hirokawa K、Sasazuki T『J Immunol』1990年7月1日;145(1)353−60)、これらHLA−A*0201/DR1のTgマウスは、抗原に対するヒトの特異的反応を評価するためには限られた利用性となっている。
【0010】
しかし、HLAクラスIを遺伝子導入されたH−2クラスIノックアウトマウス、または、HLAクラスIIを遺伝子導入されたH−2クラスIIノックアウトマウスにおいては、HLA拘束性のCTL免疫反応だけが生じる(Pascolo S、Bervas N、Ure JM、Smith AG、Lemonnier FA、Perarnau、B『J Exp Med』1997年6月16日;185(12):2043−51;Madsen L、Labrecque N、Engberg J、Dierich A、Svejgaard A、Benoist C、Mathis D、Fugger L『Proc Natl Acad Sci USA』1999年8月31日;96(18):10338−43)。実際、HLA−A2.1を遺伝子導入されたH−2クラスIノックアウト(KO)マウスは、内因性のマウスH−2クラスI分子を発現したままとなっているHLA−A2.1トランスジェニックマウスと比べて、強いHLA−A2.1拘束性反応を実現する能力を示す(Pascolo、S.et al.『J Ex Med』185、2043−2051(1997);Ureta−Vidal、A.、Firat、H.、Perarnau、B.&Lemonnier、F.A.『J Immunol』163、2555−2560(1999);Firat、H.et al.、『Int Immunol』14、925−934(2002);Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003))。本発明者らは、H−2クラスII分子を欠いているかいないかということに応じて、HLA−DR1トランスジェニックマウスで同様の観察を行っている(A.Pajot、未公刊の結果)。さらに、マウスのMHC分子との競合がないときには、HLA−A2.1を遺伝子導入されたH−2クラスI−KOマウスまたはHLA−DR1を遺伝子導入されたH−2クラスII−KOマウスは、HLA拘束性免疫反応だけを生じさせ(Pascolo、S.et al.『J Exp Med』185、2043−2051(1997))(A.Pajot、未公刊の結果)、HLA拘束性のCD8+T細胞反応およびCD4+T細胞反応のモニタリングが容易になる。しかし、病原体に対する防御免疫反応は、ヘルパーT細胞と細胞傷害性CD8+T細胞の間の協調を必要とすることが多く、一頭のマウスにおいてHLAクラスIおよびクラスIIのヒトにおける反応を同時に評価することが不可能な、HLAクラスIのみのトランスジェニックマウスまたはHLAクラスIIのみのトランスジェニックマウスでは研究できない。
【0011】
従って、当該分野では、ヒトCTLエピトープを含む構造からなる、またある場合には、抗ウイルス性および抗腫瘍性のCD8+T細胞活性を維持するための強力なCD4+Th(ヘルパーTリンパ球)エピトープを含む構造からなる、ヒトのワクチン候補の免疫原性を試験するための、適した動物モデル系が必要である(A.J.Zajac、K.Murali−Krishna、J.N.Blattman and R.Ahmed『Curr Opin Immunol』10(1998)、p.444;Firat H、Garcia−Pons F、Tourdot S、Pascolo S、Scardino A、Garcia Z、Michel ML、Jack RW、Jung O、Kosmatopoulos K、Mateo L、Suhrbier A、Lemonnier FA、Langlade−Dernoyen P『Eur J Immunol』29、3112、1999)。また、CTL反応、TH反応(特にTH1反応またはTH2反応)そして場合によっては液性免疫反応の間における相互協調を同時に評価することを可能にする系も必要とされている。
【特許文献1】米国特許第6194389号明細書
【特許文献2】米国特許第6214808号明細書
【非特許文献1】BenMohamed L、Krishnan R、Longmate J、Auge C、Low L、Primus J、Diamond DJ『Hum、Immunol』.2000年8月;61(8):764−79)
【非特許文献2】A.J.Zajac、K.Murali−Krishna、J.N.Blattman and R.Ahmed『Curr Opin Immunol』10(1998)、p.444
【非特許文献3】Firat H、Garcia−Pons F、Tourdot S、Pascolo S、Scardino A、Garcia Z、Michel ML、Jack RW、Jung O、Kosmatopoulos K、Mateo L、Suhrbier A、Lemonnier FA、Langlade−Dernoyen P『Eur J Immunol』29、3112、1999
【発明の開示】
【発明が解決しようとする課題】
【0012】
本発明者らは、H−2クラスI分子およびクラスII分子の両方を欠いている遺伝的背景で、HLA−A2.1分子とHLA−DR1分子の両方を遺伝子導入したマウスを提供することで、この必要性を満たし、さらなる必要性に応えた。具体的には、本発明はマウスを提供するものであるが、該マウスは、(1)変異したH−2クラスI分子およびクラスII分子を含み、(2)遺伝子導入したHLAクラスI分子、または、遺伝子導入したHLAクラスII分子、あるいは、遺伝子導入したHLAクラスI分子と遺伝子導入したHLAクラスII分子の両方を発現するものである。これらのマウスは、ヒトに使用するための、インビボにおける最大の免疫原性を備えたワクチン構造を開発し、最適化することにおいて有用なモデルを提供する。具体的には、このようなマウスによって、動物個体における免疫適応応答の三つの構成要素(抗体、ヘルパーT細胞および細胞溶解)の完全な分析、ならびに、抗原の攻撃に対する、ワクチン投与によって特異的に与えられる防御を評価することが可能になる。
【課題を解決するための手段】
【0013】
本発明のマウスは、H−2クラスI分子とクラスII分子の両方をノックアウトし、遺伝子導入したHLAクラスIの分子および遺伝子導入したHLAクラスIIの分子を発現するもので、完全にヒト化した実験用マウスであり、該マウスは、抗原特異的抗体、抗原特異的なHLA−DR1拘束性のT細胞反応、および抗原特異的なHLA−A2拘束性のT細胞反応の存否を同時に検出するために用いることができる。これらのマウスは、CTL反応、TH反応(特にTH1またはTH2反応)、そして場合によっては液性免疫反応の間でどのように相互協調が起こるのかということを研究するために有用となる。これらのマウスは、基礎的および応用的なワクチン研究のための最適なツールとなる。
【0014】
本発明の第一の実施態様は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーンを含む、トランスジェニックマウスを提供するものである。
【0015】
本発明の第二の実施態様は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーン、および機能的なHLAクラスIIトランスジーンを含む、トランスジェニックマウスを提供するものである。
【0016】
いくつかの実施態様では、HLAクラスIトランスジーンはHLA−A2トランスジーンであり、HLAクラスIIトランスジーンはHLA−DR1トランスジーンである。その他の実施態様では、HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンはシーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0017】
本発明のさらなる実施態様は、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスを提供しており、該実施態様では、トランスジェニックマウスは機能的なHLAクラスIトランスジーンと、機能的なHLAクラスIIトランスジーンを含んでいる。一つの実施態様では、マウスはHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。いくつかの実施態様では、HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンはシーケンスリストに掲載されたHLA−DR1の配列を含んでいる
【0018】
本発明のもう一つの実施態様は、一つの候補抗原または候補抗原群における一つまたは複数のエピトープの存否を同時に識別するための方法を提供しており、該実施態様では、一つまたは複数のエピトープにより、特異的な液性免疫反応、THのHLA−DR1拘束性反応、および/またはCTLのHLA−A2拘束性反応が生じる。該方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーン、および機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、あるいは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスに、候補抗原または候補抗原群を投与すること、マウスにおける、抗原に対する特異的液性免疫反応を分析すること、マウスにおける、抗原に対するTHのHLA−DR1拘束性反応を分析すること、そして、マウスにおける、抗原に対するCTLのHLA−A2拘束性反応を分析することを含んでいる。マウスにおいて抗原に対する特異的液性免疫反応が見られることで、抗原における液性免疫反応を生じさせるエピトープが確認される。マウスにおいて抗原に対するTHのHLA−DR1拘束性反応が見られることで、抗原におけるTHのHLA−DR1拘束性反応を生じさせるエピトープが確認される。マウスにおいて抗原に対するCTLのHLA−A2拘束性反応が見られることで、抗原におけるCTLのHLA−A2拘束性反応を生じさせるエピトープが確認される。
【0019】
いくつかの実施態様では、この方法は、マウスにおける抗原に対するTh1特異的反応を分析することと、マウスにおける抗原に対するTh2特異的反応を分析することを含んでいる。この場合、マウスにおいて抗原に対するTh1特異的反応が見られることで、マウスにおいて抗原に対するTh1特異的反応を生じさせるエピトープが確認され、マウスにおいて抗原に対するTh2特異的反応が見られることで、マウスにおける抗原に対するTh2特異的反応を生じさせるエピトープが確認される。
【0020】
また、本発明は、一つの候補抗原または候補抗原群におけるHLA−DR1拘束性ヘルパーT細胞エピトープの存否を識別する方法も提供するものであり、該方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含んでいるトランスジェニックマウスに、あるいは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、候補抗原または候補抗原群を投与することと、マウスにおいて、抗原に対する、THのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を分析することを含んでいる。マウスにおいて、抗原に対する、THのHLA−DR1拘束性ヘルパーT細胞エピトープ反応が見られることで、抗原における、THのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープが確認される。
【0021】
さらに、本発明は、前段落の方法によって確認されたHLA−DR1拘束性ヘルパーT細胞のエピトープを含む、単離された抗原を提供するものである。いくつかの実施態様では、単離された抗原はさらに、液性免疫反応を生じさせるエピトープおよび/またはCTLのHLA−A2拘束性反応を生じさせるエピトープを含んでいる。別の実施態様では、HLA−DR1拘束性ヘルパーT細胞のエピトープを含む抗原はポリペプチドを含んでいる。その他の実施態様では、HLA−DR1拘束性ヘルパーT細胞のエピトープを含む抗原はポリヌクレオチドを含んでいる。さらなる実施態様では、HLA−DR1拘束性ヘルパーT細胞のエピトープを含む抗原は、DNA、RNA、あるいはDNAとRNAの両方を含んでいる。
【0022】
さらに、本発明は、一つの候補抗原または候補抗原群におけるHLA−A2拘束性細胞傷害性T細胞(CTL)エピトープの存否を識別する方法も提供するものであり、該方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含んでいるトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、候補抗原または候補抗原群を投与することと、マウスにおける抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応を分析することを含んでいる。マウスにおいて抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応が見られることで、抗原または抗原群においてHLA−A2拘束性細胞傷害性T細胞(CTL)反応を生じさせるエピトープが確認される。
【0023】
本発明は、前段落の方法によって確認された、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む、単離された抗原を提供するものである。いくつかの実施態様では、抗原がさらに、液性免疫反応を生じさせるエピトープおよび/またはTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープを含んでいる。別の実施態様では、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原はポリペプチドを含んでいる。その他の実施態様では、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原はポリヌクレオチドを含んでいる。さらなる実施態様では、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原は、DNA、RNA、または、DNAとRNAの両方を含んでいる。
【0024】
また、本発明は二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞の反応の有効性を比較する方法も提供するものである。この方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、あるいは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第一の候補ワクチンを投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンおよび機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第二の候補ワクチンを投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を含んでいる、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、比較すべきさらなる候補ワクチンのそれぞれを投与し、さらなる候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応を測定すること、そして、比較すべき各ワクチンに対するヘルパーT細胞の反応を相互に比較してヘルパーT細胞の反応を誘発する各候補ワクチンの有効性を判定することを含んでいる。いくつかの実施態様では、ヘルパーT細胞の反応はHLA−DR1拘束性反応である。
【0025】
さらに、本発明は、二つまたはそれ以上のワクチンによって誘発された細胞傷害性T細胞反応の有効性を比較する方法を提供するものである。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第一の候補ワクチンを投与し、第一の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第二の候補ワクチンを投与し、第二の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、比較すべきさらなる候補ワクチンのそれぞれを投与し、さらなる候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、そして、比較すべき各ワクチンに対する細胞傷害性T細胞反応を相互に比較して細胞傷害性T細胞反応を誘発する各候補ワクチンの有効性を判定することを含んでいる。いくつかの実施態様では、細胞傷害性T細胞反応はHLA−A2拘束性反応である。
【0026】
さらに、本発明は、二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応の有効性を同時に比較する方法も提供するものである。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第一の候補ワクチンを投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第二の候補ワクチンを投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、比較すべきさらなる候補ワクチンのそれぞれを投与し、さらなる候補ワクチンのそれぞれによってマウスにおいて誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応を測定すること、そして、比較すべき各ワクチンに対するヘルパーT細胞の反応と細胞傷害性T細胞の反応を相互に比較してヘルパーT細胞の反応と細胞傷害性T細胞の反応を誘発する各候補ワクチンの有効性を判定することを含んでいる。いくつかの実施態様では、ヘルパーT細胞の反応はHLA−DR1拘束性反応であり、細胞傷害性T細胞の反応がHLA−A2拘束性反応である。
【0027】
また、本発明は、一つの抗原による免疫付与、あるいは、一つまたは複数の抗原を有するワクチンによる免疫付与に従った、マウスの液性免疫反応、ヘルパーT細胞の反応、そして細胞傷害性T細胞の反応を同時に判定する方法を提案するものでもある。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子とクラスIIの分子の両方を欠いたトランスジェニックマウスに、抗原、もしくは、一つまたは複数の抗原を含むワクチンを投与すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける特異的液性免疫反応を分析すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおけるヘルパーT細胞の反応を分析すること、そして、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける細胞傷害性T細胞の反応を分析することを含んでいる。いくつかの実施態様において、ヘルパーT細胞の反応はTHのHLA−DR1拘束性反応である。いくつかの実施態様において、細胞傷害性T細胞の反応はCTLのHLA−A2拘束性反応である。
【0028】
また、本発明は、事前に選択された基準に基づき、二つまたはそれ以上の候補ワクチンの組成物をヒトに投与するために最適化する方法も提供するものである。本方法は、二つまたはそれ以上の候補ワクチンの組成物による免疫付与に従った、マウスの液性免疫反応、ヘルパーT細胞の反応および細胞傷害性T細胞の反応を同時に判定することを含み、ここで用いる方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスに、抗原、もしくは、一つまたは複数の抗原を含むワクチンを投与すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける特異的液性免疫反応を分析すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおけるヘルパーT細胞の反応を分析すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける細胞傷害性T細胞の反応を分析すること、そして、事前に選択された基準を結果に適用して、最適化されたワクチンを選択することを含む。いくつかの実施態様では、二つまたはそれ以上のワクチン候補は、ワクチンに存在するアジュバントに対する抗原の割合においてのみ異なっている。いくつかの実施態様では、二つまたはそれ以上のワクチン候補は、ワクチンに存在するアジュバントのタイプにおいてのみ異なっている。
【0029】
もう一つの特徴では、本発明は、ワクチンがヒトに投与されたときに、自己免疫疾患を誘発する危険性を有するか否かを判定する方法を提供するものである。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスにワクチンを投与すること、そして、マウスにおける自己免疫反応を分析することを含んでおり、該分析において、マウスにおいて自己免疫反応が見られるということは、ワクチンがヒトに投与されたときに自己免疫疾患を誘発する危険性を有するものであることを示す。
【0030】
また、本発明は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーンを含む、単離されたトランスジェニックマウスの細胞を提供するものでもある。
【0031】
さらに、本発明は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーンおよび機能的なHLAクラスIIトランスジーンを含む、単離されたトランスジェニックマウスの細胞を提供するものでもある。
【0032】
いくつかの実施態様では、HLAクラスIトランスジーンはHLA−A2トランスジーンであり、HLAクラスIIトランスジーンはHLA−DR1トランスジーンである。その他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0033】
さらに、本発明は、H−2クラスI分子およびクラスII分子の両方を欠いている、単離されたトランスジェニックマウスの細胞を提供するものであり、ここでは、トランスジェニックマウスの細胞は、機能的なHLAクラスIトランスジーンと、機能的なHLAクラスIIトランスジーンを含んでいる。いくつかの実施態様では、トランスジェニックマウスの細胞はHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。その他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0034】
本発明は、以下の図面を参照することで、より十全に説明されるものである。
【0035】
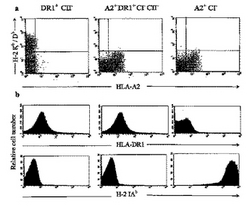
図1は、表示されている遺伝子導入した分子の細胞表面発現のフローサイトメトリー分析を示している。(a)HLA−DR1を遺伝子導入したH−2クラスII−KOマウスに由来する脾細胞(DR1+CII-、左パネル)、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスに由来する脾細胞(A2+DR1+CI-CII-、中央パネル)、および、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスに由来する脾細胞(A2+CI-、右パネル)を、FITC標識W6/32(抗HLA−ABC、横座標)またはビオチン化した28−8−6S(抗H−2Kb/Db、縦座標)m.Abのいずれかによって染色し、後者は、PE標識抗マウスIgGで可視化した。(b)同一のマウス系統に由来するB220+脾臓Bリンパ球を、FITC標識L243(抗HLA−DR1、上パネル)とPE標識AF6−120.1(抗H−2IAβb、下パネル)m.Abで染色した。
【0036】
図2は、表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。(a)HLA−DR1を遺伝子導入したH−2クラスII−KOマウスに由来する脾細胞(DR1+CII-、左パネル)、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスに由来する脾細胞(A2+DR1+CI-CII-、中央パネル)、および、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスに由来する脾細胞(A2+CI-、右パネル)を、PE標識CT−CD4(抗マウスCD4、縦座標)およびFITC標識53−6.7(抗マウスCD8、横座標)m.Abで染色した。数字は、脾細胞全体におけるCD4+T細胞(左上の四角)またはCD8+T細胞(右下の四角)のパーセンテージに対応している。(bおよびc)BVファミリー(1−20)に特異的なフォワードプライマーおよびBCリバースプライマーを用いての、BVセグメントファミリー(1−20)の使用についての、精製した脾臓のCD8+T細胞(b)およびCD4+T細胞(c)のimmunoscope RT−PCR分析である。生産的に再配列したBVセグメントファミリーの典型的なグラフの特徴は、ガウス分布のような分布に、3ヌクレオチドによる長さが異なる一連のピークを有している。この図は、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOの代表のマウスで得られた結果を示している。
【0037】
図3はHBs特異的抗体反応、細胞溶解反応および増殖反応を示している。HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスを、HBsAgをコードするプラスミドDNAを筋肉注射することによって免疫付与し、また免疫付与せず、それから個別に試験した。(a)HBsAg−DNAで免疫付与した代表のマウスの液性免疫反応(上パネル)、細胞溶解反応(中パネル)および増殖反応(下パネル)、ならびに特異性についての対照である。middleとsmallのHBVエンベロープタンパク質の両方を含有するHBsAg粒子に対する抗体(IgG)の力価と、preS2109-134ペプチドに対する抗体の力価を、ELISA検定で判定した。様々なエフェクター/標的(E/T)の割合における細胞溶解活性を、関連ペプチド(HBsAg348-357、HLA−A2.1拘束性◆)または対照ペプチド(HBsAg371-378、H−2Kb拘束性Δ、およびMAGE−3271-279、HLA−A2.1拘束性□)をパルスしたRMAS−HHD標的細胞を用いて評価した。増殖反応は、関連ペプチド(HBsAg180-195、HLA−DR1拘束性)または対照ペプチド(HBsAg126-138、H−2IAb拘束性およびHIV1Gag263-278、HLA−DR1拘束性)のいずれかを用いて検出した。(b)HBsAg−DNAで免疫付与した6匹のマウス(1〜6)の抗体反応(IgG、上パネル)、細胞溶解反応(中パネル)および増殖反応(下パネル)の同様の評価を、6匹の未処理マウス(0)の反応の平均と比較したものである。30/1のE/T割合での細胞溶解活性を、免疫的にドミナントなペプチドであるHBsAg348-357(塗りつぶした棒)、または、サブドミナントなペプチドであるHBsAg335-343(グレーの棒)のいずれかをパルスしたRMAS−HHD標的細胞で評価した。
【0038】
図4は防御分析の結果を示している。HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスは、HBsAgをコードしているプラスミドDNAで二回免疫付与したものと、していないものを用意した。最後の免疫付与から15日後、該マウスを、HBsAgまたはHBxタンパク質のいずれかを発現している107PFUのrVVを腹腔内接種して攻撃した。4日後、マウスを、卵巣におけるウイルス力価について個別に試験した。結果(10を底とする対数で示したrVVのPFU/卵巣)は、rVV−HBsAgで攻撃したHBsAg−DNAで免疫付与したマウス(I、n=10)、rVV−HBsAgで攻撃した未処理マウス(N、n=6)、rVV−HBxで攻撃したHBsAgで免疫付与したマウス(Ix、n=6)、および、rVV−HBxで攻撃した未処理マウス(Nx、n=6)について示されている。
【0039】
図5は、pcmvS2/Sによる免疫付与に従った、HLA−A2+DR1+CI-CII-マウスにおけるACの抗PreS2反応を示している。
【0040】
図6は、pcmvS2−SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−DR1拘束性エピトープに対するCD4+T細胞の増殖反応を示している。
【0041】
図7は、pcmvS2/SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−A2拘束性HBS(348−357)ペプチドに対する、CD8+T細胞の細胞傷害性反応を示している。
【0042】
配列
SEQ ID NO:1は下位の部分を含んでおり、その下位の部分であるヌクレオチド1−1205はHLA−A2プロモーターを含み、ヌクレオチド1206−1265はHLA−A2リーダー配列を含み、ヌクレオチド1266−1565はヒトβ2ミクログロブリンcDNAを含み、ヌクレオチド1566−1610は(Gly4Ser)3リンカーを含み、ヌクレオチド1611−2440は、HLA−A2のエクソン2およびイントロン3の一部を含有するセグメントを含み、そして、ヌクレオチド2441−4547は、イントロン3の一部、エクソン4から8、および、H2Db遺伝子の3’非コード領域の一部を含有するセグメントを含んでいる。
【0043】
SEQ ID NO:2は、DRA*0101遺伝子のヌクレオチド配列である。ヌクレオチド1−15279は5’からHLA−DRアルファ遺伝子に位置するプロモーターであり、ヌクレオチド15280−15425はエクソン1であり、ヌクレオチド15344−15346はATG開始コドンであり、ヌクレオチド17838−18083はエクソン2であり、ヌクレオチド18575−18866はエクソン3であり、ヌクレオチド19146−19311はエクソン4であり、そしてヌクレオチド20008−20340はエクソン5である。
【0044】
SEQ ID NO:3はDRB1*010101遺伝子のヌクレオチド配列である。ヌクレオチド7391−7552はエクソン1であり、ヌクレオチド7453−7455はATG開始コドンであり、ヌクレオチド15809−16079はエクソン2であり、ヌクレオチド19536−19817はエクソン3であり、ヌクレオチド20515−20624はエクソン4であり、ヌクレオチド21097−21121はエクソン5であり、そしてヌクレオチド21750−22085はエクソン6である。
【0045】
本発明の実施には、別のものが指示されていない限り、当該分野の技術に含まれる、細胞生物学、細胞培養、分子生物学、トランスジェニック生物学、微生物学、組換えDNAおよび免疫学の慣用的技術が用いられるものとする。このような技術は先行研究で十分に説明されている。例えば、Sambrook、FritschおよびManiatis編『Molecular Cloning A Laboratory Manual』第二版(Cold Spring Harbor Laboratory Press:1989);『DNA Cloning』第I巻および第II巻(D.N.Glover編、1985);『Oligonucleotide Synthesis』(M.J.Gait編、1984);『Mullis et al.、米国特許第4683195号明細書;『Nucleic Acid Hybridization』(B.D.Hames&S.J.Higgins編、1984);『Transcription And Translation』(B.D.Hames&S.J.Higgins編、1984);『Culture Of Animal Cells』(R.I.Freshney、Alan R.Liss、Inc.、1987);『Immobilized Cells And Enzymes』(IRL Press、1986);B.Perbal『A Practical Guide To Molecular Cloning』(1984);『Methods In ENZYMOLOGY』(J.Abelson and M.Simon編集主幹、Academic Press、Inc.、New York)のシリーズ、とりわけ、第154巻および第155巻(Wu et al.編)ならびに第185巻「Gene Expression Technology」(D.Goeddel編);『Gene Transfer Vectors For Mammalian Cells』(J.H.Miller and M.P.Calos編、1987、Cold Spring Harbor Laboratory);『Immunochemical Methods In Cell And Molecular Biology』(Mayer and Walker編、Academic Press、London、1987);『Handbook Of Experimental Immunology』第I巻〜第IV巻(D.M.Weir and C.C.Blackwell編、1986);そして、『Manipulating the Mouse Embryo』(Cold Spring Harbor Laboratory Press、Cold Spring Harbor、N.Y.、1986)を参照すること。
【0046】
本発明はマウスを提供するものであるが、該マウスは、(1)変異したH−2クラスI分子およびクラスII分子を含み、そして、(2)遺伝子導入したHLAクラスI分子、または、遺伝子導入したHLAクラスII分子、または、遺伝子導入したHLAクラスI分子と遺伝子導入したHLAクラスII分子の両方を発現するものである。本発明によるマウスは、H−2クラスI分子およびクラスII分子の両方をノックアウトしており、遺伝子導入したHLAクラスI分子と遺伝子導入したHLAクラスII分子を発現するもので、完全にヒト化した実験用マウスであり、該実験用マウスは、抗原特異的な抗体、抗原特異的なHLA−DR1拘束性T細胞反応、および抗原特異的なHLA−A2拘束性T細胞反応の存否を同時に検出するために用いることができる。これらのマウスは、CTL反応、TH反応(特にTH1反応またはTH2反応)、および、場合によっては液性免疫反応の間でどのように相互協調が行われているかということを研究するために有用である。これらのマウスは基礎的かつ応用的なワクチン研究のための最適なツールとなるものである。
【0047】
本発明は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーンを含む、トランスジェニックマウスを提供するものである。いくつかの実施態様では、トランスジェニックマウスは破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーン、および機能的なHLAクラスIIトランスジーンを含んでいる。このようなマウスは完全にヒト化された実験用マウスであるということができるのだが、それは、該マウスが、抗原特異的な抗体、抗原特異的なHLA−DR1拘束性T細胞反応および抗原特異的なHLA−A2拘束性T細胞反応の存否を同時に検出するために用いることができるからである。
【0048】
本発明に挙げられている実施例で部分的に示されているように、また、開示内容から当業者には一般的に明らかであるように、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスは、DNAによる免疫付与に従って、HBsAgに特異的な抗体反応、CD4+ヘルパーT細胞反応および細胞溶解性のCD8+T細胞反応を示す能力を有している。これらの反応は、試験した全てのマウス個体で見られたが、ヒトの反応と同じ免疫的にドミナントなエピトープに対して生じ、免疫付与したマウスは、HBsAg組換えワクシニアウイルスに対する特異的な防御を示した。
【0049】
ヘルパーT細胞は、抗体反応の完全な成熟(Katz、D.H.&Benacerraf、B.、『Adv Immunol』15、1−94(1972))、多くのエピトープに対するCTLのプライミング(von Boehmer、H.&Haas、W.、『J Exp Med』150、1134−1142(1979);Keene、J.A.&Forman、J.、『J Exp Med』155、768−782(1982))、および、CTLの長期維持(Matloubian、M.、Concepcion、R.J.&Ahmed、R.、『J Virol』68、8056−8063(1994))には不可欠である。抗体(Lefrancois、L.、『J Virol』51、208−214(1984))とCTL(Zinkernagel、R.M.&Welsh、R.M.、『J Immunol』117、1495−1502(1976))は共に、ウイルス感染に対する防御免疫の重要な構成要素である。実際、強力なHBsAgに特異的な抗体の反応およびCTL反応は、HLA−A2.1とHLA−DR1の両方を遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られるが、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られない。従って、HBsAgに特異的なCD4+T細胞の助けが、効果的なHBsAgに特異的なCTL反応と抗体反応を生じさせるために不可欠である。これらの結果は、HBsAgで免疫付与したマウス(Milich、D.R.、『Semin Liver Dis』11、93−112(1991))、およびHBsAgをワクチン接種したヒト(Celis、E.、Kung、P.C.&Chang、T.W.、『J Immunol』132、1511−1516(1984))を対象とする研究と一貫しており、このことは、抗HBs抗体反応の発生がCD4+T細胞に依存していることを示唆している。
【0050】
HLA−A2.1クラスI分子およびHLA−DR1クラスII分子の両方を発現するトランスジェニックマウスは既に得られている(BenMohamed、L.et al.『Hum Immunol』61、764−779(2000))。著者らは、HLA−A2.1分子およびHLA−DR1分子の両方がインビボで機能的な拘束性の要素であることと、HLA−DR1トランスジーンの産物が、HLA−A2.1拘束性の抗原特異的なCTL反応を強化することを報告している。しかし、これらのマウスにおける免疫反応のヒトへの関連性は、マウスが、通常優先的に、そしてしばしば独占的に抗原に対する反応における拘束要素として用いられる、自身のH−2クラスI分子およびクラスII分子を依然として発現しているため、過小評価されている(Ureta−Vidal、A.、Firat、H.、Perarnau、B.&Lemonnier、F.A.、『J Immunol』163、2555−2560(1990);Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003))(A.Pajot、未公刊の結果)。ここで記載されている本発明は、この限界を、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスを提供することで克服するものである。
【0051】
いくつかの実施態様では、β2m−KOの背景の、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスは、HLA−A2.1の一本鎖を発現し、該一本鎖において、ヒトβ2mがペプチドのアームによってHLA−A2.1の重鎖に共有結合している。該マウスではさらに、H−2IAβb遺伝子の不活性化の結果として、通常のH−2クラスIIのIA分子およびIE分子の細胞表面発現がないのだが、それはなぜなら、H−2のIEαがH−2bハプロタイプの偽遺伝子だからである。ここで挙げられている結果は、このようなマウスがH−2クラスI分子およびクラスII分子の細胞表面発現を失っていることを示している。しかし、ある場合には、結合していないクラスIの重鎖、特にH−2Dbがβ2m−KOマウスの細胞表面に存在し、アロ反応性を誘発する可能性があることが指摘されている。仮にこれが正しいとしても、このようなマウスはペプチドを有していないため、該マウスが抗原特異的な免疫反応に関わることはない(Bix、M.&Raulet、D.、『J Exp Med』176、829−834(1992))。これはAllen et alの報告にも記載されており(Allen、H.、Fraser、J.、Flyer、D.、Calvin、S.&Flavell、R.、『Proc Natl Acad Sci USA』83、7447−7451(1986))、該報告において、Allenらは、細胞内にβ2mが存在しないときにもH−2Dbが細胞表面に発現すること、しかしこのようなDb抗原がDbアロ特異的またはDb拘束性の細胞傷害性Tリンパ球のいずれによっても認識されないことを確認している。さらに、Db抗原はほとんどの天然Dbのモノクローナル抗体には認識されない。
【0052】
それにも関わらず、HLA−DRαのみを遺伝子導入したマウスでは、少なくともHLA−DRβ鎖がないときに、特殊なHLA−DRα/H−2IEβb混成複合体がある程度は細胞表面に発現しうることが報告されている(Lawrance、S.K.et al.、『Cell』58、583−594(1989))。この観察にも関わらず、これらの特殊な分子は、血清学的には、このような混成分子と反応することが知られているmAb(17−3−3S)によっても、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおける細胞表面では検出されなかった(Ozato、K.、Mayer、N.&Sachs、D.H.、『J Immunol』124、533−540(1980))(図1aおよび示していないデータ)。さらに、これらのマウスのHBsAgに特異的なT細胞反応およびHIVの1−Gagに特異的なT細胞反応を研究することで得られた結果はすべて、拘束要素としてHLA−A2.1分子およびHLA−DR1分子のみを用いていることを示した。このことから、特殊なHLA−DRα/H−2IEβb混成体が、通常のHLA−DRα/HLA−DRβ分子と比べて不安定であると思われること、そして、該混成体が、HLA−DRβ鎖がないときにだけ存在しうることが言える。すべてのH−2クラスII領域(H−2IAβb、IAαb、IEβb)が削除されているマウス系統(Madsen、L.et al.、『Proc Natl Acad Sci USA』96、10338−10343(1999))、ならびに、H−2Db遺伝子が削除されているマウス系統が、この可能性を完全に排除するために分析されているところである。第一のマウスから得られた脾細胞の予備分析では、HLA−DR1を遺伝子導入したH−2クラスII−KOマウス(Iaβb゜)で見られるものに類似したCD4+T細胞プールの回復が見られ、これらの新たなマウスのHLA−DR1拘束性CD4+T細胞反応が、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスのHLA−DR1拘束性CD4+T細胞反応と同等であることを示唆している。
【0053】
HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの末梢CD8+Tリンパ球は、親であるHLA−A2.1を遺伝子導入したH−2クラスI−KOマウスと比較して、少なくともBVセグメントの使用の点では量的かつ質的に類似しており、TCRレパートリーが完全に多様化している。野生型マウスと比べて、特にCD8+T細胞プールの部分的な回復は、キメラ(マウス由来のα3ドメイン)HLA−A2.1分子を発現する、一つのHLAを遺伝子導入したマウスで恒常的に見られている(Pascolo、S.et al.、『J Exp Med』185、2043−2051(1997))。共結晶分析により、ヒトのCD8もHLA−A2.1重鎖のα2ドメインと接触を持っていることが実証されたことから、α3ドメインの置換に関係なく、マウスのCD8とHLA−A2.1分子の間では相互作用が不十分なままである(Gao、G.F.et al.、『Nature』387、630−634(1997))。また、不十分な協調は小胞体で起こる可能性もあり、該小胞体では、多くの分子(TAP、タパシン、ERp57)がMHCクラスI分子の生合成を補助する。しかし、この段階では、これらのマウス小胞体分子とヒト小胞体分子の間における唯一の実証されている機能的な差異、つまり、マウスのTAPではなくヒトのTAPが、プラスの電荷を帯びた細胞質ペプチドのCOOH末端を効果的に輸送すること(Momburg、F.、Neefjes、J.J.&Hammerling、G.J.、『Curr Opin Immunol』6、32−37(1994))は、疎水性のC末端を有するペプチドと結合するHLA−A2.1分子にとっては問題にならず、それは、これらのペプチドがマウスおよびヒトのTAPによって効果的に輸送されるからである。HLA−A2.1のみを遺伝子導入したH−2クラスI−KOマウス、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの双方において、CD8+Tリンパ球の数が少なくても、該リンパ球は効果的にHBsAgに対して反応し、そして、重要なこととして、後者のマウスは、ヒトと類似した抗体反応、ヘルパーT細胞反応および細胞溶解反応を示す。
【0054】
Tリンパ球を標的とする、T細胞エピトープをベースとするワクチンの設計を妨げる困難の一つは、HLAクラスI/クラスII分子の多型性である。HLA−A2.1分子およびHLA−DR1分子は、ヒトの個体群におけるかなりの割合の個体が発現している(HLA−A2.1については30%から50%、HLA−DR1については6%から18%)。HLAクラスI分子を機能的にスーパーファミリーにクラスタリングすることは、提示されたペプチド34の集合の顕著な剰余量に基づいているのであるが、HLAクラスIのアイソタイプ変異体または対立遺伝子多型のそれぞれによって生じた反応の個別分析は、それらが提示する最適なエピトープを識別するために、依然として行う必要がある。これは、免疫反応をモニターするための四量体(HLAクラスIまたはHLAクラスII)のような、新たな試薬を開発するために特に重要である。同様の理由のために、たとえペプチドのHLAクラスII分子に対する結合がクラスI分子に対する結合より拘束性が低くても、HLA−A2.1を他のHLAクラスII分子とともに共発現するマウス系統を得ることは有益となるものである。ここでの開示に基づき、さらなる、HLAクラスI/クラスIIを遺伝子導入したH−2クラスI/クラスII−KOマウスを、これらの目的あるいは他の目的のために構成することができる。
【0055】
HLAを遺伝子導入したH−2−KOマウスによって、ヒトへ置き換えることのできる可能性に優れた抗原ペプチドの免疫原性を詳細に分析し、最適化することが可能になるのに対し(Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003);Loirat、D.、Lemonnier、F.A.&Michel、M.L.、『J Immunol』165、4748−4755(2000);Scardino、A.et al.、『Eur J Immunol』31、3261−3270(2001))、これは、ワクチンアジュバントの製剤化の研究に対してはあまり明白ではない。このことは、二つの種の間にある、抗原攻撃に対する反応の初期に動員される様々なエフェクターの違いに起因する可能性がある。固有の免疫に関する基本的な知識を高めることは、将来的には、マウスの免疫系をより完全にヒト化させることをもたらしうるものである。
【0056】
最後に、ここでの開示によって、最適化し、ヒト化したトランスジェニックマウスのモデルが説明されるのだが、該マウスのH−2クラスI遺伝子(マウスβ2m)およびクラスII遺伝子(H−2IAβb)は削除され、等価のヒト遺伝子のHHD(HLA−A*0201)、HLA−DRA*0101およびHLA−DRB1*0101で置き換えられている。HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおける細胞性免疫は、ヒトのHLA分子によって完全に拘束され、マウスのMHC分子によって拘束された免疫反応は全くない。マウスMHCの免疫反応とヒト(トランスジェニック)HLAの免疫反応の間に競合がないことによって、これらのマウスを、ヒトのワクチンにおける、HLA拘束性CD4+ヘルパーT細胞とHLA拘束性CD8+細胞溶解性T細胞の間の協調を要求するエピトープを明らかにするために用いることが可能になる。
【0057】
「HLA」はヒトのMHC複合体であり、「H−2」はマウスのMHC複合体である。ヒトの複合体は三つのクラスIα鎖遺伝子である、HLA−A、HLA−BおよびHLA−C、ならびに、MHCクラスIIα鎖遺伝子とβ鎖遺伝子の三つのペアである、HLA−DR、−DPおよび−DQを含んでいる。多くのハプロタイプにおいて、HLA−DRクラスターは余分のβ鎖遺伝子を含んでおり、該遺伝子の産物はDRα鎖と対をなすことができ、従って、遺伝子の三つのセットは、四つのタイプのMHCクラスII分子を生み出すことになる。マウスにおいて、三つのクラスIα鎖遺伝子は、H−2−L、H−2−DおよびH−2−Kである。マウスのMHCクラスII遺伝子はH−2−AおよびH−2−Eである。
【0058】
当該分野において、多型性HLA抗原および異なったHLA対立遺伝子の両方の結果として、様々な個体のHLA遺伝子の間に遺伝的多様性が存在していることが知られている。従って、ここで開示されている本発明の実施態様は、一つの多型性HLA抗原を他の一つで置き換えること、あるいは、一つのHLA対立遺伝子を他の一つで置き換えることができる。HLA多型および対立遺伝子の例は、たとえば、http://www.anthonynolan.org.uk/HIG/data.htmlとhttp://www.ebi.ac.uk/imgt/hla、Dominique Charon編『Genetic diversity of HLA:Functional and Medical Implication』、EDK Medical and Scientific International Publisher、および、Steven G.E.Marsh、Peter Parham and Linda Barber『The HLA FactsBook』、AP Academic Press、2000で見ることができる。
【0059】
「破壊された」遺伝子とは、相同組換えまたは当該分野で知られたその他のアプローチを用いて変異した遺伝子である。破壊された遺伝子は、遺伝子の低形質対立遺伝子(hypomorphic allele)または遺伝子の無効対立遺伝子(null allele)のどちらかとすることができる。当業者は、用いる対立遺伝子のタイプをあらゆる特別な背景に対して選択することが可能であることを理解できるものである。本発明の多くの実施態様では、無効対立遺伝子が選択されている。
【0060】
「相同組換え」とは、細胞の、事前に選択した所望の遺伝子配列を変異させることで、トランスジェニック動物を作成するための、一般的なアプローチである(Mansour、S.L.et al.、『Nature』336:348−352(1988);Capecchi、M.R.、『Trends Genet.』5:70−76(1989);Capecchi、M.R.、『Science』244:1288−1292(1989);Capecchi、M.R.et al.、Capecchi、M.R.編『Current Communications in Molecular Biology』所収、Cold Spring Harbor Press、Cold Spring Harbor、N.Y.(1989)、pp.45−52;Frohman、M.A.et al.、『Cell』56:145−147(1989))。
【0061】
こうして、マウス中のどのような遺伝子も任意に改変することが可能になる(Capecchi、M.R.、『Trends Genet.』5:70−76(1989);Frohman、M.A.et al.、『Cell』56:145−147(1989))。遺伝子ターゲッティングでは、選択した遺伝子座のクローニングしたDNA配列の中に所望の変異を導入するために、標準的な組換えDNA技術を使用する。それから、その変異を、相同組換えを通して、多能性の胚性幹細胞(ES細胞)のゲノムへと導入する。改変した幹細胞をマウスの胚盤胞にマイクロインジェクトし、発生中のマウスの胚に組み込み、最終的にキメラマウスに成長させる。ある場合には、キメラマウスの生殖系列細胞は、遺伝的に改変したES細胞から派生することがあり、変異した遺伝子型は生殖を通して伝達することができる。
【0062】
遺伝子ターゲッティングは、nptII遺伝子がβ2ミクログロブリン遺伝子座に挿入されているキメラマウスおよびトランスジェニックマウスを作成するために用いられている(Koller、B.H.et al.、『Proc.Natl.Acad.Sci.(U.S.A.)』86:8932−8935(1989);Zijlstra、M.et al.、『Nature』342:435−438(1989);Zijlstra、M.et al.、『Nature』344:742−746(1989);DeChiaba et al.、『Nature』345:78−80(1990))。同様の実験により、nptII遺伝子の挿入によって破壊されているc−abl遺伝子を有しているキメラマウスおよびトランスジェニックマウスの作成が可能になっている(Schwartzberg、P.L.et al.、『Science』246:799−803(1989))。該技術は、en−2遺伝子がnptII遺伝子の挿入によって破壊されているキメラマウスを作成するために用いられている(Joyner、A.L.et al.、『Nature』338:153−155(1989))。
【0063】
「遺伝子ターゲッティング」法を用いるためには、対象となる遺伝子はその前にクローニングされている必要があり、また、イントロン−エクソンの境界が決定されている必要がある。該方法により、マーカー遺伝子(例えばnptII遺伝子)が、対象となる特定の遺伝子の翻訳された領域に挿入される。従って、遺伝子ターゲッティング法を用いると、対象となる遺伝子はかなり破壊される。
【0064】
意義深いことに、細胞の遺伝子を改変するために遺伝子ターゲッティングを用いると、その遺伝子配列においてかなりの改変が生じる。遺伝子ターゲッティングの有効性は可変領域の数に左右され、構造ごとに異なる。
【0065】
本発明のキメラマウスまたはトランスジェニックマウスの細胞は、ES細胞またはその同等物のような多能性前駆細胞とすることができる、一つまたは複数のDNA分子を細胞に導入することによって調製される(Capecchi、M.R.編『Current Communications in Molecular Biology』、Cold Spring Harbor Press、Cold Spring Harbor、N.Y.(1989)所収、Robertson、E.J.、pp.39−44)。「前駆」という用語は、多能性細胞が、目的の(トランスフェクトされた)多能性細胞に対する前駆体であることだけを意味し、該多能性細胞は本発明の教示内容に従って調製される。多能性細胞(前駆的またはトランスフェクトされているもの)は、キメラマウスまたはトランスジェニックマウスを作成するために、当該分野で知られた方法(Evans、M.J.et al.、『Nature』292:154−156(1981))により、インビボで培養することができる。
【0066】
どのようなES細胞でも本発明に従って用いることができる。しかし、ES細胞の初代分離株を用いることが好ましい。このような分離株は、Capecchi、M.R.編『Current Communications in Molecular Biology』、Cold Spring Harbor Press、Cold Spring Harbor、N.Y.(1989)所収、Robertson、E.J.pp.39−44によって開示されているCCE細胞株のような胚から直接、または、CCE細胞株からのES細胞のクローン単離(Schwartzberg、P.A.et al.、『Science』246:799−803(1989)、この文献は参照することにより本発明の一部を構成するものである)により、得ることができる。このようなクローン単離は、E.J.Robertsonの方法(E.J.Robertson編『Teratocarcinomas and Embryonic Stem Cells: A Practical Approach』、IRL Press、Oxford、1987に記載)に従って行うことができるのだが、該文献および該方法は参照することにより本発明の一部を構成するものである。このようなクローン増殖の目的は、マウスへの分化に対して大きな有効性を有しているES細胞を得ることである。クローン選択されたES細胞は、トランスジェニックマウスの作成において、始原細胞株であるCCEよりもおよそ10倍効果的である。本発明の組換え法のためには、クローン選択による利点はない。
【0067】
胚からクローン単離によって得たES細胞株の例は、ES細胞株、AB1(hprt+)またはAB2.1(hprt-)である。ES細胞は、E.J.Robertson(E.J.Robertson編『Teratocarcinomas and Embryonic Stem Cells:A Practical Approach』、IRL Press、Oxford、1987所収、pp.71−112)によって説明されているように、好ましくは間質細胞(STO細胞(特にSNC4のSTO細胞)および/または胚の初代培養線維芽細胞など)上で培養されるのだが、該文献は、参照することにより本発明の一部を構成するものである。キメラマウスの作成および分析のための方法は、Bradley、A.(E.J.Robertson編『Teratocarcinomas and Embryonic Stem Cells:A Practical Approach』、IRL Press、Oxford、1987所収、pp.113−151)によって開示されており、該文献は参照することにより、本発明の一部を構成するものである。間質細胞(および/または線維芽細胞)は、異常なES細胞の過剰なクローン増殖をなくすことに役立つ。もっとも好適には、細胞は、白血球阻害因子(「lif」)(Gough、N.M.et al.、『Reprod.Fertil.Dev.』1:281−288(1989);Yamamori、Y.et al.、『Science』246:1412−1416(1989)、該文献の両者は参照することで本発明の一部を構成するものである)の存在の下で培養される。lifをコードする遺伝子がクローニングされているので(Gough、N.M.et al.、『Reprod.Fertil.Dev.』1:281−288(1989))、この遺伝子を有する間質細胞を、当該分野で知られた方法によって形質転換し、そして、ES細胞を、lifを培地に分泌する、形質転換された間質細胞上で培養することが特に好ましい。
【0068】
本発明で用いられているように、「トランスジーン」という用語は、部分的または全体的に異種な、つまりそれを導入するトランスジェニック動物またはトランスジェニック細胞が有さない核酸配列、あるいは、それを導入するトランスジェニック動物またはトランスジェニック細胞の内因性遺伝子に対して相同ではあるが、それを挿入する細胞のゲノムを改変するような方法で動物のゲノムに挿入されるように作られている、または挿入されている核酸配列を指すものである(たとえば、該核酸配列は、天然の遺伝子の位置とは異なる位置に挿入され、そうでなければ、その挿入はノックアウトを生じさせる)。トランスジーンは、一つまたは複数の転写制御配列と、イントロンのような、選択した核酸の最適な発現に必要となる可能性がある他のあらゆる核酸に、機能可能となるように結合させることができる。本発明の典型例となるトランスジーンは、たとえばH−2ポリペプチドをコードしている。他の典型例となるトランスジーンは、一つまたは複数のHLA遺伝子を、HLA遺伝子のゲノム配列との相同組換えによって破壊するようになっている。
【0069】
「機能的なトランスジーン」とは、mRNA転写産物を生成するものであり、該転写産物は、トランスジーンを含むマウスの少なくとも一つの細胞において、適切にプロセシングされたタンパク質を生成する。当業者には、既知の転写制御エレメントおよび転写後のプロセシングを指示する配列の様々な組み合わせによる一連の選択肢があり、この中から宿主マウスがトランスジーンの発現を指示するということが理解されるものである。本発明の多くの実施態様では、H−2遺伝子制御エレメントの制御下でHLAトランスジーンが発現することが好ましい。
【0070】
いくつかの実施態様では、HLAクラスIトランスジーンはHLA−A2トランスジーンであり、HLAクラスIIトランスジーンはHLA−DR1トランスジーンである。HLA−A2トランスジーンの一例は、シーケンスリストに掲載されたHLA−A2の配列を含むものである。HLA−DR1トランスジーンの一例は、シーケンスリストに掲載されたHLA−DR1の配列を含むものである。
【0071】
一つの実施態様において、本発明はH−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスを提供しており、該実施態様では、トランスジェニックマウスは機能的なHLAクラスIトランスジーンと、機能的なHLAクラスIIトランスジーンを含んでいる。いくつかの実施態様では、マウスはHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0072】
また、本発明は単離されたトランスジェニックマウスの細胞も提供するものである。ある場合には、細胞は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIまたはクラスIIのトランスジーンを含んでいる。その他の場合には、細胞は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーン、および機能的なHLAクラスIIトランスジーンを含んでいる。HLAクラスIトランスジーンはHLA−A2トランスジーンあってよく、HLAクラスIIトランスジーンはHLA−DR1トランスジーンであってよい。ある場合には、HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0073】
一つの実施態様では、本発明は、H−2クラスI分子とクラスII分子の両方を欠いた、単離されたトランスジェニックマウスの細胞を提供しており、該実施態様において、トランスジェニックマウスは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる。単離されたトランスジェニックマウスの細胞は、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有することができる。HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含むことができ、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含むことができる。
【0074】
本発明の単離されたトランスジェニックマウスの細胞は、本発明のいかなるマウスの遺伝子型を有することもできる。しかし、本発明の単離されたトランスジェニックマウスの細胞の遺伝子型の集合と、本発明のマウスの遺伝子型の集合は、必ずしも完全には重なっていない。
【0075】
本発明の単離されたマウスの細胞は、マウスまたはマウスの胚から得ることができる。一つの実施態様では、マウスまたはマウスの胚は、得るべき細胞と同一の遺伝子型を有している。もう一つの実施態様では、マウスまたはマウスの胚は、得るべき細胞とは異なった遺伝子型を有している。細胞をマウスまたはマウスの胚から得た後、細胞の遺伝子を、例えば相同組換えによって破壊することができる。さらに、機能的な遺伝子を、例えばトランスフェクションによって、細胞のゲノムの中に導入することができる。当業者であれば、当該分野で知られたいかなる適切な方法でも、細胞のゲノムを修飾するために適用することができ、それにより、所望の遺伝子型を有する、単離されたマウスの細胞が得られるということが理解されるものである。
【0076】
本発明のもう一つの目的は、H−2クラスI分子とクラスII分子の両方を欠いた、単離されたトランスジェニックマウスの細胞であり、該目的において、トランスジェニックマウスの細胞は機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる。いくつかの実施態様では、トランスジェニックマウスの細胞はHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。その他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0077】
T細胞は、獲得した免疫の多くの側面で中心的な役割を果たし、多様な制御的機能および防御機能を遂行する。いくつかのT細胞は、感染した細胞またはガン化した細胞に出会うと、それらを異種のものと認識し、キラー細胞として作用することで対応し、細胞性免疫反応の一部として宿主自身の細胞を殺す。他のT細胞は、ヘルパーT細胞と呼ばれるものだが、抗体を産生するためにB細胞を刺激することで、あるいは、液性免疫反応または細胞性免疫反応のある側面を抑制することで、認識された異種抗原に反応する。
【0078】
ヘルパーT細胞(Th)は、サイトカインの生成を介して多くの免疫反応をとりまとめる。一般的にはCD4細胞表面マーカーを有するものとして識別されるが、これらの細胞は、機能的には、該細胞が生成するサイトカインのプロフィールと、免疫系のその他の細胞に対するそれらの影響に応じて、Th1またはTh2という亜集団に分けられる。
【0079】
Th1細胞は、T細胞抗原レセプターと称される認識システムを通して、侵入しようとする病原体、またはガンである宿主細胞を検出する。細胞性免疫と呼ばれる、Th1が関与するプロセスは、一般的にはB細胞以外の細胞の活性化を伴い、IFN−γの生成を特徴とすることが多い。それにも関わらず、Th1系がそもそも液性抗体の生成からは独立していても、Th1サイトカインは、IgG2aアイソタイプへの免疫グロブリンのクラススイッチを促進する。
【0080】
異種抗原を検出するとすぐに、ほとんどの成熟したTh1細胞は、IL−2、IL−3、IFN−γ、TNF−β、GM−CSF、高濃度のTNF−α、高濃度のMIP−1α、高濃度のMIP−1β、およびRANTESの放出を命令する。これらのサイトカインは、遅延型過敏性および一般的な細胞性免疫を促進する。たとえばIL−2は、T細胞の成長因子であり、該成長因子は、最初に検出された特定の抗原に感受性のある、さらなるT細胞のクローンの生成を促進するものである。感作T細胞は、抗原を含む細胞または病原体に付着し、攻撃する。
【0081】
対照的に、成熟したTh2細胞は、IL−3、IL−4、IL−5、IL−6、IL−9、IL−10、IL−13、GM−CSF、および、低濃度のTNF−αの分泌を促進する傾向がある。さらに、Th2反応は、B細胞を活性化させること、抗体の産生と分泌を刺激すること、そして、IgA、IgG1およびIgEアイソタイプへのクラススイッチを誘発することによって液性免疫を促進する。
【0082】
本発明で用いられるとき、「抗原」は、1)少なくとも一つのHTLエピトープ、または、2)少なくとも一つのCTLエピトープ、または、3)少なくとも一つのB細胞エピトープ、または、4)少なくとも一つのHTLエピトープと少なくとも一つのCTLエピトープ、または、5)少なくとも一つのHTLエピトープと少なくとも一つのB細胞エピトープ、または、6)少なくとも一つのCTLエピトープと少なくとも一つのB細胞エピトープ、または、7)少なくとも一つのHTLエピトープと少なくとも一つのCTLエピトープと少なくとも一つのB細胞エピトープを含んでいる。「候補抗原」とは、抗原として機能するかどうかを判定するために研究中の分子である。
【0083】
「液性免疫反応」とは、抗体が介在する特異的免疫である。
【0084】
「エピトープ」とは、免疫系によって認識される抗原上の部位である。抗体エピトープは、抗体によって認識される抗原上の部位である。T細胞エピトープは、MHC分子に結合している抗原上の部位である。THエピトープはMHCクラスII分子に結合している抗原上の部位である。CTLエピトープは、MHCクラスI分子に結合している抗原上の部位である。
【0085】
抗原は、ポリペプチド配列またはポリヌクレオチド配列を含むことができ、該配列は、RNA、DNAまたはその両方からなることができる。一つの実施態様では、抗原は、一つまたは複数の抗原性ポリペプチドを機能的にコードしている少なくとも一つのポリヌクレオチド配列を含む。この文脈で用いられるとき、「含む」という語は、少なくとも一つの抗原性ポリペプチドが、少なくとも一つの抗原性ポリペプチドをコードしている外因性ポリヌクレオチドに作用する、宿主細胞の転写装置および/または翻訳装置によってもたらされることを意味しており、それは例えば米国特許第6194389号明細書および米国特許第6214808号明細書に記載されている。
【0086】
本発明の抗原はどのような抗原性分子であってもよい。抗原性分子には、タンパク質、リポタンパク質、および糖タンパク質が含まれ、それらには、アルブミン、破傷風トキソイド、ジフテリアトキソイド、百日咳トキソイド、細菌の外膜タンパク質(髄膜炎菌の外膜タンパク質を含む)、RSV−Fタンパク質、マラリア由来のペプチド、B−ラクトグロブリンB、アプロチニン、オボアルブミン、リゾチームなどの、ウイルス性、細菌性、寄生虫性、動物性および真菌性タンパク質、ならびに、癌胎児性抗原(CEA)、CA15−3、CA125、CA19−9、前立腺特異抗原(PSA)および米国特許第5478556号明細書のTAA複合体のような腫瘍関連抗原が含まれ、該明細書は参照することでその全体が本発明の一部を構成するものである。抗原性分子にはまた、天然の多糖類および合成多糖類を含む炭水化物、ならびにその他のポリマーが含まれ、それらには、フィコール、デキストラン、カルボキシメチルセルロース、アガロース、ポリアクリルアミドおよびその他のアクリル系樹脂、乳酸グリコール酸共重合体、ポリビニルアルコール、部分的に加水分解されたポリ酢酸ビニル、ポリビニルピロリジン、B群連鎖球菌の莢膜多糖および肺炎球菌の莢膜多糖(タイプIIIを含む)、緑膿菌の細胞外ムコ多糖および莢膜多糖(フィッシャーのタイプIを含む)、ならびにヘモフィルスインフルエンザの多糖(PRPを含む)が含まれる。抗原性分子にはまた、TNP、糖類、オリゴ糖類、多糖類、ペプチド、毒素、薬物、化学物質およびアレルゲンのような、ハプテンおよび低分子量の分子を含むその他の成分が含まれる。そして、抗原性分子にはまた、細菌、リケッチア、菌類、ウイルス、寄生虫に由来するハプテンおよび抗原が含まれ、それらには、ジフテリア菌、百日咳菌、破傷風菌、ヘモフィルスインフルエンザウイルス、肺炎球菌、大腸菌、クレブシエラ菌、黄色ブドウ球菌、表皮ブドウ球菌、髄膜炎菌、ポリオウイルス、ムンプスウイルス、麻疹ウイルス、風疹ウイルス、呼吸器合胞体ウイルス、狂犬病ウイルス、エボラウイルス、炭疽菌、リステリア菌、A型肝炎ウイルス、B型肝炎ウイルス、C型肝炎ウイルス、ヒト免疫不全ウイルスIおよびII、単純ヘルペスウイルス1型および2型、CMV、EBV、水痘帯状疱疹ウイルス、マラリア原虫、結核菌、カンジダアルビカンス、その他のカンジダ菌、ニューモシスティスカリニ、マイコプラズマ、A型およびB型インフルエンザウイルス、アデノウイルス、A群連鎖球菌、B群連鎖球菌、緑膿菌、ライノウイルス、リーシュマニア、パラインフルエンザウイルス1型、2型および3型、コロナウイルス、サルモネラ菌、赤痢菌、ロタウイルス、トキソプラズマ、エンテロウイルス、ならびに、クラミジアトラコマチスおよびクラミジアニューモニエが含まれる。
【0087】
本発明で用いられるとき、薬学的組成物またはワクチンは、少なくとも一つの免疫性の組成物を含み、該免疫性組成物は、薬学的に許容されうる担体または賦形剤に溶解すること、懸濁すること、または結合することができる。薬学的に許容されうるどのような担体でも、組成物の投与のために用いることができる。適切な薬学的な担体は、A.Gennaro編『Remington’s Pharmaceutical Sciences』第18版、1990、Mack Pub.、Easton、Pa.に記載されており、該文献は参照することによりその全体が本発明の一部を構成するものである。担体は、水、ポリエチレングリコール、ジメチルスルホキシド(DMSO)、ならびに石油、動物油、植物油、ピーナッツオイル、大豆油、鉱油、ごま油などを含む油類のような、減菌した液体とすることができる。担体は、霧、スプレー、パウダー、ワックス、クリーム、座薬、インプラント、軟膏、膏薬、パッチ、湿布、フィルム、または化粧品の形状とすることができる。
【0088】
薬学的組成物またはワクチンの適切な製剤法は、選択する投与経路に左右される。たとえば、急速静注法または持続注入による静脈投与では、組成物は好ましくは水溶性であり、生理食塩水が好まれる担体である。経皮、経鼻、経口、胃内、膣内、直腸内、またはその他の経粘膜的投与のためには、浸透させるべき障壁に適した浸透剤を製剤に含めることができ、該浸透剤は当該分野では知られたものである。経口投与のためには、活性成分は、錠剤、ピル、糖衣錠、カプセル、液体、ゲル、シロップ、スラリー、懸濁液などに含有させることに適した担体と結合させることができる。また、時間依存の送達システムも本発明の組成物の投与に適用可能である。典型的なシステムは、乳酸グリコール酸共重合体、共重合したシュウ酸塩、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸およびポリ無水物のようなポリマーをベースとするシステムを含む。これらのポリマーおよび類似のポリマーは当該分野で知られた方法に従ってマイクロカプセルに製剤化することができるのだが、該方法はたとえば、米国特許第5075109号明細書で教示されており、該文献は参照することでその全体が本発明の一部を構成するものである。本発明の開示された免疫賦活化合物の投与に適した代替の送達システムは、米国特許第6194389号明細書、第6024983号明細書、第5817637号明細書、第6228621号明細書、第5804212号明細書、第5709879号明細書、第5703055号明細書、第5643605号明細書、第5643574号明細書、第5580563号明細書、第5239660号明細書、第5204253号明細書、第4748043号明細書、第4667014号明細書、第4452775号明細書、第3854480号明細書および第3832252号明細書(該文献のそれぞれは参照することでその全体が本発明の一部を構成するものである)で開示されているものを含んでいる。
【0089】
また、デキストロース溶液およびグリセロール溶液も液体担体として、とりわけ注入可能な溶液または噴霧溶液のために用いることができる。噴霧による投与のためには、当業者に理解されているように、加圧されたスプレーまたは噴霧器による場合のように、適切な推進剤を加えることができる。また、免疫学的組成物は、可溶化剤、乳化剤、安定剤、分散剤、香料、アジュバント、担体、リドカインやキシロカインなどのような局所麻酔剤、抗体、および、既知のまたは可能性が想定されている、抗ウイルス性、抗菌類性、抗寄生虫性、または抗腫瘍性の化合物でも製剤することができる。
【0090】
「アジュバント」とは、標的抗原に対する免疫反応を促進するか強める組成物である。当業者であれば、本発明をここでの開示に照らして実施するにあたり、使用するための適切なアジュバントを選択することができる。
【0091】
本発明は、一つまたは複数の本発明の抗原を含む組成物を投与することで、免疫賦活を必要としている患者を治療する方法を含むものである。本発明で用いられるとき、治療は、あらゆる疾病、病気、異常、または症状に関連する、矯正方法、回復方法、改善方法および予防方法を含んでいる。さらに、治療は、実験動物内またはエクスビボにおいて免疫反応を生じさせること、または抑制することを含んでいる。
【0092】
従って、治療は、本発明のあらゆる免疫賦活性組成物の免疫賦活的な量を、当業者に馴染みのある、あらゆる方法によって投与することを含んでおり、該方法は、一般的には経口経路、経皮経路、静脈注射、筋肉注射および皮下注射を含み、これ以外にも、腹腔内投与、体腔内投与、関節内投与、脳室内投与、髄腔内投与、局所投与、扁桃投与、粘膜投与、経皮投与、膣内投与および強制経口投与を含む。
【0093】
技術を有する実施者によって認識されているように、適切な投与方法を選択することは治療の有効性に寄与する可能性があり、そして、局所投与が、ある場合の適用には好まれる可能性がある。局所投与の許容される経路には、皮下、皮内、腹腔内、硝子体内、吸入または洗浄、経口、経鼻、および、所定の組織、器官、関節、腫瘍、または細胞集団へ向けられた注入が含まれる。例えば、粘膜のリンパ節あるいはパイエル板に粘膜を塗布または注入することは、かなりのIgAへのクラススイッチを伴う液性免疫反応を促進する可能性がある。あるいは、病変部位、病巣、または感染した体の部位を標的とする注入は、充実性腫瘍、局所感染、あるいはその他の免疫賦活を必要とする部位の治療に適用することができる。
【0094】
また、免疫系細胞(例えば、T細胞、B細胞、NK細胞、またはオリゴデンドロサイト)は、宿主から採取し、インビトロで処理することができる。処理された細胞をさらに、培養し、患者に(または異種宿主に)再導入することで、患者または宿主に免疫賦活をもたらすことができる。例えば、骨髄細胞は、患者から吸引し、HDRで処理することで、全体的な免疫または特異的な免疫を賦活することができる。そして、高線量放射線処理または同等の処理を、患者に残っている免疫細胞を破壊するために用いることができる。再移植すると、賦活された自己細胞は、患者において通常の免疫機能を回復するようになる。あるいは、ガンに冒されている患者から単離したNK細胞および/またはT細胞を、患者のガンに特異的な一つまたは複数の抗原にインビトロで曝すことができる。患者に再移植すると、抗原で賦活された細胞は、ガン細胞に抗する活発な細胞性免疫反応を展開するようになる。
【0095】
免疫賦活的な(有効な)量とは、患者における免疫反応を賦活することのできるワクチンの量を指し、病原の攻撃、アレルギー、あるいは免疫異常または免疫学的な病気を予防し、改善し、または治療するために十分な量である。免疫賦活的な量は、ワクチンによる事前の処理を受けていない患者に抗原が投与されたときに得られる反応と比べて、抗原の少なくとも一つのエピトープに対する液性免疫反応または細胞性免疫反応を測定できる程に高める量である。従って、例えば、免疫賦活的な量は、対象となる抗原エピトープに対する抗体の産生を促進すること、あるいは、病原性またはアレルギー性の攻撃に対する検出可能な防御効果を賦活すること、あるいは、対象となる抗原エピトープに対する防御的なCTL反応を促進することができる、抗原含有組成物の量を指す。
【0096】
免疫賦活的な量の本発明の抗原含有組成物による治療は、少なくとも一つの免疫系細胞またはそれらから派生した細胞株を含む宿主での免疫反応において、直接的、間接的、または統計的に観察可能もしくは測定可能な、あらゆる増加またはその他の所望の変化を引き起こすことを含んでおり、前記宿主には特に、エクスビボで組織を培養した宿主が含まれる。宿主の細胞は、ヒトまたは動物の末梢血、リンパ節などから派生させることができる。エクスビボで組織培養した宿主は、好ましくは、新鮮分離したT細胞、B細胞、マクロファージ、オリゴデンドロサイト、NK細胞、および単球を含み、これらのそれぞれは標準的な技術を用いて単離または精製することができる。観察可能あるいは測定可能な反応には、B細胞またはT細胞の増殖または活性化、抗体の分泌の増加、アイソタイプスイッチ、サイトカインの放出の増加、特に一つまたは複数のIL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−9、IL−10、IL−12、IL−13、GM−CSF、IFN−γ、TNF−α、TNF−β、GM−CSF、MIP−1α、MIP−1βまたはRANTESの放出の増加、特異抗原に対する抗体力価または親和性の増加、病原感染に関連する罹患率または死亡率の低下、ウイルス潜伏の促進、誘発、維持または強化、悪性および非悪性腫瘍の成長、転移、影響の抑制または緩和、そして、疾病または疾病の影響からの予防的防御をもたらすことが含まれる。
【0097】
免疫反応の抑制が望まれる場合、例えば自己免疫疾患またはアレルギーの治療では、効果的な量にはまた、治療すべき病気または病変に関連する反応を測定可能または観察可能に減少させるために十分な量が含まれる。
【0098】
投与すべき抗原含有組成物の量および投与頻度は経験的に決定することができ、治療する患者の年齢とサイズ、扱う病気または疾病を考慮に入れることになる。適切な容量は、接種材料につき0.01μgから100μgの範囲に収まるが、より多い、またはより少ない量が指示されることもある。二次的な追加免疫による免疫付与は、一週間から数ヶ月の間隔の後に行うことができる。
【0099】
以下の実施例は本発明のいくつかの実施態様を示している。当業者であれば、本発明の趣旨または範囲を変えることなく行うことができる、数々の変更および変形例が認識されるものである。これらの変更および変形例は、本発明の範囲に含まれていると考えられる。実施例はいかなる場合も本発明を限定するものではない。
【発明を実施するための最良の形態】
【0100】
以下の実験技術および試薬は、本発明のいくつかの非限定的な実施態様を示すために用いた。
【0101】
トランスジェニックマウス
【0102】
HLA−DR1を遺伝子導入したH−2クラスII−KOマウス(IAβb゜)を、リールのパスツール研究所において(Institut Pasteur of Lille)、HLA−DR1を遺伝子導入したマウス(Altmann、D.M.et al.、『J Exp Med』181、867−875(1995))とH−2クラスII−KOマウス(IAβb゜)(Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003))を交配して得た。キメラ一本鎖(HHD分子:HLA−A2.1のα1−α2ドメイン、H−2Dbのα3から細胞内ドメインまでが、そのN末端において、15のアミノ酸のペプチドリンカーによって、ヒトβ2mのC末端と結合している)を発現する、HLA−A2.1を遺伝子導入したマウスを作成した(Pascolo、S.et al.、『J Exp Med』185、2043−2051(1997))。HLA−A2.1(HHD)を遺伝子導入したH−2クラスI−KOマウスとHLA−DR1を遺伝子導入したH−2クラスII−KOマウス(IAβb゜)を異系交配し、後代を、HLA−A2.1+/-/HLA−DR1+/-の二つを遺伝子導入したH−2クラスI(β2m0)/クラスII(IAβ0)−KOマウスが得られるまで選別し、ここに記載された実験に使用した。HLA−A2.1+/-のみを遺伝子導入したH−2クラスI(β2m0)/クラスII(IAβ0)−KOマウスを防御分析における対照として使用した。マウスは、パリのパスツール研究所(Institut Pasteur、Paris)の動物施設で飼育し、全ての手順は、動物保護についてのフランスおよびヨーロッパの規制、および公衆衛生局の勧告を遵守するために、パスツール研究所の所轄局による調査を受けている。
【0103】
遺伝子型決定
【0104】
HLA−DRB1*0101、HLA−DRA*0101およびHLA−A*0201トランスジーンをPCRで検出した。100mMのNaCl、50mMのpH7.2であるTris−HCI、100mMのEDTA、1%のSDSおよび0.5mg/mlのプロテイナーゼKの中で、56℃で一晩インキュベートし、その後、250μlの飽和NaCl溶液を添加し、イソプロパノール沈殿を行った後、DNAの末尾部分を抽出した。標本を70%のエタノール中で洗浄し(×3)、150μlの、10mMのTris−HCI、1mMのpH8であるEDTAで再懸濁した。PCR条件は以下の通りである。1.5mMのMgCl2、1.25UのTaqポリメラーゼ、緩衝液は、製造業者(InVitrogen社、カリフォルニア州カールスバッド)によって提供されたものであり、1サイクル(7分、94℃)、40サイクル(30秒、94℃;30秒、60℃;1分、72℃)、1サイクル(4分、72℃)を行い、フォワードプライマーおよびリバースプライマーとして、HHDについては、5’CAT TGA GAC AGA GCG CTT GGC ACA GAA GCA G3’および5’GGA TGA CGT GAG TAA ACC TGA ATC TTT GGA GTA CGC 3’を用い、HLA−DRB1*0101については、5’TTC TTC AAC GGG ACG GAG CGG GTG 3’および5’CTG CAC TGT GAA GCT CTC ACC AAC 3’を用い、HLA−DRA*0101については、5’CTC CAA GCC CTC TCC CAG AG3’および5’ATG TGC CTT ACA GAG GCC CC 3’を用いた。
【0105】
FACS分析
【0106】
細胞の蛍光定量を、赤血球を除去した、Lympholite−M(Tebu−bio社、Le Perray en Yvelines、フランス)で精製した脾細胞について、FITCと結合したW6/32(抗HLA−ABC、Sigma社、ミズーリ州セントルイス)とビオチン化した抗28−8−6S(抗H−2Kb/Db、BD Biosciences社、カリフォルニア州サンディエゴ)m.Abを用いて行った。CD4+およびCD8+のTリンパ球を、PE標識CT−CD4抗マウスCD4(CALTAG社、カリフォルニア州南サンフランシスコ)とFITC標識53−6.7抗マウスCD8−m.Ab(BD Biosciences社)を用いて染色した。MHCクラスII分子の発現の分析を、MSカラム(Miltenyi Biotec社、ベルギッシュ・グラートバッハ、ドイツ)でポジティブセレクトしたB220+Bリンパ球について行った。2.4G2m.AbでFcレセプターが飽和した後、HLA−DR1およびH−2IAbの発現を、FITC標識L243(抗HLA−DR)およびPE標識AF6−120.1(抗H−2IAβb)m.Ab(BD Biosciences社)を用いて分析した。パラホルムアルデヒドで固定した細胞を、FACSCalibur(Becton Dickinson社、マサチューセッツ州ベッドフォード)で分析した。
【0107】
Immunoscope分析
【0108】
未処理マウスに由来するCD4+およびCD8+のT細胞を、Auto−Macs(Miltenyi Biotec社)でポジティブセレクトし、RNAを、RNA Easy Kit(Qiagen社、ヒルデン、ドイツ)を用いて調製し、cDNA合成に使用した。cDNAを、BVセグメントファミリーのそれぞれに特異的なフォワードプライマーと、二つのBCセグメントに共通のリバースプライマーを用いてPCR増幅した。PCR産物を、FAMをタグ付けした内部BCプライマーを用いて、ランオフで伸長した。ランオフした産物を、373A DNAシーケンサー(Perkin Elmer Applied Biosystem社、カリフォルニア州フォスターシティ)で分離する(7h、35W)ために、6%アクリルアミド/8M尿素ゲルにロードした。データを、Immunoscopeソフト(Pannetier、C.et al.、『Proc Natl Acad Sci USA』90、4319−4323(1993))を用いて分析した。
【0109】
ペプチド
【0110】
HLA−A2結合ペプチドのHBsAg348-357GLSPTVWLSVおよびHBsAg335-343WLSLLVPFV、H−2Kb結合ペプチドのHBsAg371-378ILSPFLPL、HLA−DR1結合ペプチドのHBsAg180-195QAGFFLLTRILTIPQS、H−2IAb結合ペプチドのHBsAg126-138RGLYFPAGGSSSG、ならびにpreS2ペプチドのHBsAg109-134MQWNSTTFHQTLQDPRVRGLYFPAGGは、Neosystem社(ストラスブール、フランス)によって合成されたものであり、PBS−10%のDMSOに1mg/mlの濃度で溶解した。ペプチドのアミノ酸配列のナンバリングは、HBVのaywサブタイプのpreS1領域の最初のメチオニンから開始している。
【0111】
HBVのS2−Sタンパク質をコードするDNAによる免疫付与
【0112】
ヒトCMV前初期遺伝子プロモーターの制御下で発現するHBVの表面抗原preS2およびSをコードしている、pCMV−S2.Sプラスミドベクター(Michel、M.L.et al.、『Proc Natl Acad Sci USA』92、5307−5311(1995))を、エンドトキシンフリーの条件の下、Plasmid Giga Kit(Qiagen社)のカラムで精製した。先行文献で説明されているように(Davis、H.L.、Michel、M.L.&Whalen、R.G.、『Hum Mol Genet』2、1847−1851(1993))、麻酔したマウスの再生前脛骨筋に注入した(各側に50μg)。
【0113】
T細胞増殖分析
最後の免疫付与から12日後、文献で説明されているように(Loirat、D.、Lemonnier、F.A.&Michel、M.L.、『J Immunol』165、4748−4755(2000))、赤血球を除去した、Ficollで精製した脾細胞(5×106細胞/25cm2培養フラスコ(Techno Plastic Products(TPP)、Trasadingen、スイス))を、ペプチドをパルスし(20μg/ml)、γ線を放射(180Gy)した、LPS幼若化細胞(5×106細胞/培養フラスコ)と、10%のFCS、10mMのHEPES、1mMのピルビン酸ナトリウム、5×10-5Mの2−メルカプトエタノール、100I×U/mlのペニシリンおよび100μgのストレプトマイシンを加えたRPMI培地で、共培養した。7日目、増殖分析のために、細胞を、ペプチドをパルスし、放射線照射したLPS幼弱化細胞(2×105細胞/ウェル)と、72時間、3%のFCSを加えたRPMI完全培地で平面培養した(平底の96ウェルマイクロプレート(TPP)に5×105細胞/ウェル)。細胞に、TOMTECコレクターを用いるfiltermates(Perkin Elmer Applied Biosystem社)で回収する前の16時間、ウェルあたり1μCiの(3H)−チミジンをパルスし、取り込まれた放射活性をマイクロβカウンター(Perkin Elmer Applied Biosystem社)で測定した。結果は、賦活指数(SI)=特異的ペプチドでのcpm/関連のないペプチドでのcpmで示した。
【0114】
CTL活性の測定
【0115】
増殖分析として、細胞毒性分析を、同一の免疫脾細胞群で行った。応答細胞(5×106細胞/25cm2培養フラスコ、TPP)と、刺激するための、ペプチドをパルスし(20μg/ml)、γ線を放射した(180Gy)LPS幼若化抗原細胞(5×106細胞/培養フラスコ)を、7日間にわたって、同様の添加RPMI培地の中で共培養した。細胞溶解活性を、10μg/mlの実験対象のペプチドまたは対照ペプチドをパルスしたRMA−S−HHD標的細胞について、標準的な4h51Crアッセイで試験した。%で示された特異的溶解は二段階で計算したのだが、該計算は、[実験対象の自然放出]/[最大の自然放出]×100から、対照ペプチドで見られる非特異的溶解を差し引いたものである。
【0116】
インビボでの抗体産生の測定
【0117】
DNAの注入前後の様々な時間に、マウスから、ヘパリン処理したガラスピペットを用いて、血液を球後穿刺によって採取し、遠心分離によって回収した血清を、抗HBsおよび抗preS2について、特異的ELISAによって分析した。HBVのsmallSタンパク質(1μg/ml)またはpreS2(120−145)合成ペプチド(1μg/ml)を含有する、精製した組換え粒子を、固相として用いた。10%のFCSを加えたPBST(0.1%のTween20を含有するPBS)でブロックした後、連続希釈を行った。よく洗浄した後、ホースラディッシュペルオキシダーゼ(Amersham社、Little Chalfont、イギリス)で標識した抗マウスIg(全IgG)で、結合抗体を検出した。抗体力価を、連続終末点希釈法によって測定した。マウスの血清は個別に試験し、力価は、少なくとも三つの測定値の平均とした。1/100未満まで血清を希釈した場合はネガティブであるとした。
【0118】
抗体力価測定
【0119】
免疫付与したマウスに由来する血清を個別に、ELISA(Michel、M.L.et al.、『Proc Natl Acad Sci USA』92、5307−5311(1995))によって、精製したHBVのmiddleタンパク質とsmallタンパク質またはpreS2合成HBs109-134ペプチドのいずれかについて分析した。0.1%のTween20と10%のFCSを加えた1×PBSでブロックし、洗浄(×3)した後、結合抗体を、ホースラディッシュペルオキシダーゼで標識した抗マウスIgG(Amersham社、Little Chalfont、イギリス)で検出した。抗体力価(少なくとも3回の測定の平均)は連続終末点希釈法によって測定した。1/100未満の力価はネガティブであるとした。
【0120】
ワクチン攻撃とプラークアッセイ
【0121】
DNAを注入したマウスは、HbsAgタンパク質(Smith、G.L.、Mackett、M.&Moss、B.、『Nature』302、490−495(1983))またはHBxタンパク質(Schek、N.、Bartenschlager、R.、Kuhn、C.&Schaller、H.、『Oncogene』6、1735−1744(1991))のいずれかを発現している、107PFUの組換えワクシニアウイルス(Western Reserve株)で、最後の注入から12日後に腹腔内を攻撃したのだが、HBsAgタンパク質を発現しているワクシニアウイルスとHBxタンパク質を発現しているワクシニアウイルスはそれぞれ、B.Moss博士とH.Schaller博士の好意によって提供されたものである。4日後、卵巣を、rVV力価について、BHK21細胞(Buller、R.M.&Wallace、G.D.、『Lab Anim Sci』35、473−476(1985))に対するプラークアッセイによって分析した。
【実施例1】
【0122】
MHC分子の細胞表面発現
HLA−A2.1、H−2Kb/Db、HLA−DR1およびH−2IAb分子の細胞表面発現を、フローサイトメトリー法によって、脾細胞で評価した。図1aに示されているように、類似したレベルのHLA−A2.1の発現が、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスで見られたのに対し、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスでは、HLA−A2.1は見られず、H−2Kb/Dbのみが発現した。HLA−DR1およびH−2IAbの細胞表面発現を、B220+に富んだB細胞で測定した。図1bに示されているように、類似したレベルのHLA−DR1の発現が、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスで見られたのに対し、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスでは全く発現が検出されなかった。しかし、遺伝子導入した分子(特にHLA−DR1)の細胞表面発現は、内因性のH−2クラスI分子およびクラスII分子の発現より低かった。
【実施例2】
【0123】
末梢CD4+T細胞およびCD8+T細胞
CD4+およびCD8+の脾臓T細胞の数を、図2aに示されているように、免疫染色分析およびフローサイトメトリー分析によって測定した。
【0124】
CD4+T細胞は、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスの両方において、脾細胞群の13%〜14%であった。対照的に、H−2クラスII−KOマウスでは、細胞の2%〜3%だけがCD4+であり(データは示されていない)、MHCクラスII分子を欠くマウスについての初期報告(Cosgrove、D.et al.、『Cell』66、1051−1066(1991))に一致する。期待された通り、遺伝子導入したHLA−A2.1分子の発現は、末梢CD8+T細胞群の割合を増加させ、β2ミクログロブリン(β2m)をKOした、MHCクラスIを欠いたマウスでは、0.6%〜1%であった(Pascolo、S.et al.、『J Exp Med』185、2043−2051(1997))のに対し、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスの両方においては、全脾細胞の2%〜3%に達した。
【0125】
実施例1および実施例2で示された結果は、
(1)HLA−A2+HLA−DR1+β2m゜IAβ゜マウスでは、HLA−A2分子の発現、H−2−Kb分子の非発現、CD8+末梢Tリンパ球の数、およびCD8+Tレパートリーの多様性が、概ねHLA−A2+β2m゜マウスに匹敵していること、
(2)HLA−A2+HLA−DR1+β2m゜IAβ゜マウスでは、HLA−DR1分子の発現、H−2−IAb分子の非発現、CD4+Tリンパ球の数、およびCD4+レパートリーの多様性が、概ねHLA−DR1+IAβ゜マウスに匹敵していること、そして、
(3)HLA−A2+HLA−DR1+β2m゜IAβ゜マウスが、HLA−A2+β2m゜マウスおよびHLA−DR1+IAβ゜マウスで見られる特徴的な利点の全てを有していること、
を示している。
【実施例3】
【0126】
TCRのBVセグメントの使用
一つのMHCクラスI分子と一つのMHCクラスII分子の存在により、TCRレパートリーの数と多様性を減少させることができるので、過去に記載されているように(Cochet、M.et al.、『Eur J Immunol』22、2639−2647(1992))、様々なBVファミリーの発現とCDR3の長さの多様性を、RT−PCRをベースとするimmunoscope技術によって、精製した脾細胞のCD4+またはCD8+のT細胞について研究した。ガウス分布に似た分布での大きなピークが、ほとんどのBVファミリー(分析した20のうち15)について、T細胞のCD8+群(図2b)およびCD4+群(図2c)の両方で見られた。抹消Tリンパ球で見られたこのようなグラフの特徴は、機能的に再配列したBVセグメントに典型的であり、一つ目のピークから次のピークまでに、CDR3亜領域の3ヌクレオチド長の変化を有する(Cochet、M.et al.、『Eur J Immunol』22、2639−2647(1992))。
【0127】
BV5.3および17で見られるような、展開(または大きく変化したグラフの特徴)がないことは、予想されていたことであるが、それは、これらの二つのBVセグメントがC57BL/6マウスにおいて偽遺伝子だからである(Wade、T.、Bill、J.、Marrack、P.C.、Palmer、E.&Kappler、J.W.、『J Immunol』141、2165−2167(1988);Chou、H.S.et al.、『Proc Natl Acad Sci USA』84、1992−1996(1987))。しかし、BV5.1、5.2および11のセグメントについて見られたグラフの変化は、対応するBV発現T細胞亜群が小さいことに起因している(該T細胞亜群はC57BL/6マウスでは5%より少なく、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスではおよそ2%である)(データは示していない)。これらの事例以外では、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおけるCD4+およびCD8+のT細胞の両方が、それぞれ、非トランスジェニックC57BL/6マウスのパターンと類似した、TCRのBV鎖の使用とCDR3の多様性のパターンを示している。
【実施例4】
【0128】
機能的解析
AgHBs(B型肝炎ウイルスのエンベロープタンパク質)で免疫付与したHLA−A2+HLA−DR1+β2m゜IAβ゜マウスを分析した。図5は、HBsS2抗体の産生によって示される特異的液性免疫反応を示している。図6は、HBs348-357に対する、特異的なDR1拘束性CD4+T細胞の増殖反応を示している。そして図7は、HBs348-357またはHBs335-343に対する、特異的なHLA−A2拘束性CD8+細胞溶解性T細胞の反応を示している。
【0129】
これらの結果は、HLA−A2+HLA−DR1+β2m゜IAβ゜マウスによって、免疫付与した個体において、特異的液性免疫反応、CD4+Tヘルパー細胞のAg特異的HLA−DR1拘束性反応、そして、Ag特異的HLA−A2拘束性CD8+T細胞の細胞溶解反応を同時に分析することが可能になることを示している。
【0130】
これらのマウスから得られた追加データを以下の表1〜表3に示した。
【0131】
【表1】

【0132】
【表2】

【0133】
【表3】

【実施例5】
【0134】
HBsAg−DNAワクチンに対する免疫反応
HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの免疫学的潜在能力を評価するため、そして、それらの液性免疫反応、CD4+T細胞反応およびCD8+T細胞反応をヒトのものと比較するために、マウスを、HBsAg−DNAプラスミドで免疫付与した。このプラスミドは二つのB型肝炎ウイルスエンベロープタンパク質(middleであるpreS2/SおよびsmallであるS)をコードしており、該タンパク質は、B型肝炎表面抗原を有する粒子で自己組織化している。B型肝炎に対して現状で用いられているワクチンは、これらの二つのタンパク質を含んでいる。
【0135】
代表的なマウスについて図3aで示されているように、HBsAg特異的抗体は、HBsAg−DNAワクチンの注射後12日目に最初に検出し(図3a、上パネル)、これらの抗体の力価は、24日目まで増加した(二回目のDNA免疫付与の12日後、データは示していない)。この抗体の早期反応は、middleのHBVエンベロープタンパク質が有するpreS2−B細胞エピトープ(HBs109-134)とHBsAg粒子に対して特異的であり、HBsAg−DNAで免疫付与したマウス(Michel、M.L.et al.、『Proc Natl Acad Sci USA』92、5307−5311(1995))と、HBsAgをワクチン投与されたヒト(Moulia−Pelat、J.P.et al.、『Vaccine』12、499−502(1994))で報告された類似の反応に一致している。
【0136】
HBsAgに対するCD8+CTL反応を試験し、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの末梢におけるCD8+T細胞が、遺伝子導入したヒトのクラスI分子によって機能的に拘束されるかどうか判定した。HBVに感染したHLA−A2.1+のヒトでは、免疫的にドミナントなHLA−A2.1拘束性HBsAg特異的CTL反応が、HBsAg348-357ペプチド(Maini、M.K. et al.、『Gastroenterology』117、1386−1396(1999))およびHBsAg335-343ペプチド(Nayersina、R.et al.、『J Immunol』150、4659−4671(1993))に対して生じた(すなわち、複数のエピトープ反応が見られた)。C57BL/6マウスでは、H−2Kb拘束性HBsAg特異的CTL反応が、HBsAg371-378ペプチド(Schirmbeck、R.、Wild、J.&Reimann、J.、『Eur J Immunol』28、4149−4161(1998))に対して生じた。ヒト化したマウスがヒトのように反応することができるかどうかを評価するために、ここに記載したように、脾臓T細胞を7日間にわたって、関連ペプチド(HBsAg348-357、HLA−A2.1拘束性)または対照ペプチド(HBsAg371-378、H−2Kb拘束性、MAGE−3271-279、HLA−A2.1拘束性)のいずれかで再賦活した。図3a(中パネル)は、HBsAg−DNAによる免疫付与が強いHBsAg348-357特異的CTL反応を生じさせるが、HBsAg371-378ペプチドまたはMAGE−3271-279ペプチドのいずれに対する反応も生じさせなかったことを示している。
【0137】
このHLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの末梢におけるCD4+T細胞が、遺伝子導入したヒトのクラスII分子によって機能的に拘束されるかどうかを判定するため、HBsAgタンパク質に対するCD4+T細胞反応を試験した。HBsAgをワクチン投与した、または、HBVに感染したHLA−DR1+のヒトでは、免疫的にドミナントなHLA−DR1拘束性HBsAg特異的CD4+T細胞反応が、HBsAg180-195ペプチド(Mm、W.P.et al.、『Hum Immunol』46、93−99(1996))に対して生じる。C57BL/6マウスでは、H−2IAb拘束性HBsAg特異的CD4+T細胞反応が、HBsAg126-138ペプチド(Milich、D.R.、『Semin Liver Dis』11、93−112(1991))に対して生じた。ヒト化したマウスをヒトおよび野生型マウスと比較するために、脾臓のT細胞を、関連ペプチド(HBsAg180-195、HLA−DR1拘束性)または対照ペプチド(HBsAg126-138、H−2IAb拘束性、HIV1Gag263-278、HLA−DR1拘束性)のいずれかでインビトロで再賦活した。図3a(下パネル)は、期待されたように、HLA−DR1拘束性HBsAg180-195ペプチドに対する強い増殖反応を示す一方、H−2IAb拘束性ペプチドは反応の賦活においては効果的ではなかった。同様に、HIV1Gag263-278ペプチドによっても反応は誘発されなかった。さらに、HBsAg180-195ペプチドによってさらにインビトロで再現したところ、特異的増殖指数が数倍増加した(データは示していない)。
【0138】
第一の、HBsAg−DNAで免疫付与した、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−マウスにおける、HBsAg特異的抗体反応、T細胞の増殖反応および細胞溶解性反応の発生と特異性については実証したが、同じ三つの反応について、さらに6頭のHBsAg−DNAで免疫付与したマウスと、対照である6頭の未処理のHLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスも、個別に試験した。図3bに示されているように、三つの反応は、試験した6頭の免疫付与したマウスでは同時に実証されたが、対照用の未処理マウスでは実証されなかった。興味深いことに、2頭の免疫付与したマウスは、HBsAg348-357およびHBsAg335-343のHLA−A2.1拘束性ペプチドの両方に対するCTL反応を示す能力があった(図3b、中パネル)。
【実施例6】
【0139】
防御分析
上記の実施例は、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおける、HBsAg特異的液性免疫性の、CD4+およびCD8+T細胞反応の誘発を実証しており、また、該反応が、自然感染した、または、HBsAgをワクチン投与したヒトの反応と同一の、免疫的にドミナントなエピトープに対して生じることを示している。本実施例では、これらの反応がワクチン投与したマウスで防御を示すかどうかを試験した。マウスはHBVに対して寛容ではないため、HBsAgを遺伝子組換えしたワクシニアウイルス(rVV−HBsAg)をこれらの実験に用いた。マウスは、100μgのHBsAg−DNAで二回、筋肉内に免疫付与した。最後の免疫付与から12日後、マウスは、107PFUのrVV−HBsAgで、腹腔内を攻撃した。4日後、ウイルス力価を、既知の方法に従って測定し、rVVのPFU/卵巣で記録した(Buller、R.M.&Wallace、G.D.、『Lab Anim Sci』35、473−476(1985))。
【0140】
結果を図4に示した。HBsAg−DNAで免疫付与していない未処理マウスは、攻撃後にrVV−HBsAgが複製されていることを示した。対照的に、HBsAg−DNAで免疫付与したマウスにおけるウイルス力価は、4桁以上小さい値であった。これらの結果は、HBsAg−DNAでのワクチン投与が、rVV−HBsAgによる感染を制御する防御性のHBsAg特異的免疫反応を誘発することを強く示唆している。
【0141】
HBsAg−DNAのワクチン投与によって与えられる防御の特異性は、HBsAg−DNAで免疫付与したマウスを他のHBx遺伝子組換えVV(B型肝炎のxタンパク質をコードしている)で攻撃することで実証された。免疫付与していない対照と比べ、HBsAg−DNAで免疫付与したマウスでは、rVV−HBxの複製の減少は見られなかった。
【実施例7】
【0142】
HLA−DR1拘束性のCD4+T細胞は、抗体、ならびにウイルス感染に対するCTL反応および防御にとって重要である。
HLA−DR1拘束性ヘルパーTリンパ球がヒト化したマウスにおける抗体反応とCTL反応に寄与するかどうかを評価するために、免疫反応とウイルス感染効率を、一つ(HLA−A2.1)を遺伝子導入した、および二重(HLA−A2.1/HLA−DR1)に遺伝子導入した、H−2クラスI/クラスII−KOマウスにおいて比較した。表4に示されているように、強力なHBsAg348-357特異的CTL反応は、HLA−A2.1/HLA−DR1を二重に遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られたが、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られなかった。さらに、抗HBs抗体は、HBsAg−DNAをワクチン投与した、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスでは検出することができなかった。結果的に、HBsAg−DNAで免疫付与した、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスは、rVV−HBsAgの感染に対して防御されなかった。
【0143】
【表4】

【0144】
本出願を通して引用されたすべての参考文献、特許文献および公開された特許出願の全内容は、参照することによってそれらの全体が本発明の一部を構成するものである。
【図面の簡単な説明】
【0145】
【図1a】表示されたトランスジェニック分子の細胞表面発現のフローサイトメトリー分析を示している。
【図1b】表示されたトランスジェニック分子の細胞表面発現のフローサイトメトリー分析を示している。
【図2a】表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。
【図2b】表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。
【図2c】表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。
【図3a】HBs特異的抗体反応、細胞溶解反応および増殖反応を示している。
【図3b】HBs特異的抗体反応、細胞溶解反応および増殖反応を示している。
【図4】防御検定の結果を示している。
【図5】pcmvS2/Sによる免疫付与に従った、HLA−A2+DR1+CI-CII-マウスにおけるACの抗PreS2反応を示している。
【図6】pcmvS2−SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−DR1拘束性エピトープに対するCD4+T細胞の増殖反応を示している。
【図7】pcmvS2/SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−A2拘束性HBS(348−357)ペプチドに対する、CD8+T細胞の細胞傷害性反応を示している。
【図1】

【図2】

【図3】

【技術分野】
【0001】
関連出願の相互参照
本出願は、2003年7月30日に出願された米国特許仮出願第60/490945号明細書(代理人番号第03495.6093号)の利益に基づき、また該利益を特許請求するものであり、該仮出願の開示内容全体は、すべての目的について、本出願の基礎となるものであり、また、参照することによって本出願の一部を構成するものである。
【背景技術】
【0002】
現状では、多くのワクチンが、ヒトのガンの免疫療法のため、そして、マラリア、エイズ、C型肝炎ウイルスおよび重症急性呼吸器症候群(SARS)のような伝染病の治療のために開発されてきている。新たに生起する病原体が出現する早さを考えると、ワクチン戦略および様々なエピトープの防御能について素早く信頼性のある評価をするために用いることのできる動物モデルを改良することが重要である。さらに、インビボ研究は、ワクチンの免疫原性、ワクチンの製剤化、投与経路、組織分布、ならびに一次リンパ器官および二次リンパ器官の関与のような、容易に評価できない、あるいはインビトロで測定することができない、ワクチンの挙動の重大な変動を評価するために既に必要とされている。単純で融通がきくことから、マウスのような小動物は、少なくとも初期のワクチンの開発研究に対して、ヒトではない霊長類のような、より扱いにくく、よりコストの高いモデルシステムに代わる、魅力的な代替物となっている。
【0003】
野生型動物の研究では防御的であることが発見されているワクチンが、いくつかの臨床試験で中程度の有効性を示したことは(McMichael、A.J.&Hanke、T.『Nat Med』9、874−880(2003))、動物のMHC分子とヒトのHLA分子が同一の最適なエピトープを有していないために、ヒトと動物のMHCが免疫反応の結果に対して与える影響が異なるということによって、部分的に説明することができる(Rotzschke、O.et al.『Nature』348、252−254(1990))。従って、いくつかの制限にも関わらず、ヒトHLAを発現するトランスジェニックマウスは、ワクチン候補を試験し、ワクチンが自己免疫疾患を誘発する潜在的なリスクを評価し、ヒトの拘束因子に基づいたより良い治療方法を開発するための前臨床モデルとして、野生型マウスに対する有用な改良となるものである。
【0004】
細胞傷害性T細胞
細胞傷害性T細胞(CTL)は、伝染病の根絶、またある場合にはガンの根絶において重要な役割を果たす(P.Aichele、H.Hengartner、R.M.Zinkernagel and M.Schulz、『J Exp Med』171(1990)、p.1815;L.BenMohamed、H.Gras−Masse、A.Tartar、P.Daubersies、K.Brahimi、M.Bossus、A.Thomas and P.Druhile、『Eur J Immunol』27(1997)、p.1242;D.J.Diamond、J.York、J.Sun、C.L.Wright and S.J.Forman、『Blood』90(1997)、p.1751)。組換えタンパク質ワクチンはCTL反応を確実には誘発しない(Habeshaw JA、Dalgleish AG、Bountiff L、Newell AL、Wilks D、Walker LC、Manca F.1990年11月;11(11):418−25;Miller SB、Tse H、Rosenspire AJ、King SR.『Virology』1992年12月;191(2):973−7)。弱毒化した病原体で構成される他の免疫原性ワクチンは、いくつかの主要な疾病において、最も重要な安全上の懸念から、ヒトに用いることができない。ここ数年、エピトープに基づくアプローチが、予防および免疫療法のための新たなワクチンを開発するための、将来性がある方法として提案されてきている(Melief CJ、Offringa R、Toes RE、Kast WM.『Curr Opin Immunol.』1996年10月、8(5):651−7;Chesnut RW、「Design testing of peptide based cytotoxic T−cell mediated immunotherapeutic to treat infection disease、cancer」、Powell、MF、Newman、MJ(編)『Vaccine Design:The Subunit、Adjuvant Approach』所収、Plenum Press、New−York、1995年、847)。このアプローチはいくつかの利点を有しているのだが、該利点には、自然なプロセシングを受けたエピトープを選択して、免疫系が、高度に保存され免疫的にドミナントな病原体のエピトープに焦点を合わせるようにすること(R.G.van der Most、A.Sette、C.Oseroff、J.Alexander、K.Murali−Krishna、L.L.Lau、S、Southwood、J.Sidney、R.W.Chesnut、M.Matioubian and R.Ahmed、『J Immunol』157(1996)、p.5543)、ならびに、HIV、B型肝炎ウイルス(HBV)およびC型肝炎ウイルス(HCV)の感染において見られるような突然変異によるエスケープを防ぐ、複数のエピトープが関与する反応を誘発することが含まれる。また、該アプローチはサプレッサーT細胞の決定基をなくすことも可能にするものであり、このことにより、TH1の反応が望まれる条件下においてTH2の反応を好適に生じさせること、またその逆も可能となる(Pfeiffer C、Murray J、Madri J、Bottomly K.『Immunol Rev.』1991 Oct;123:65−84;P Chaturvedi、Q Yu、S Southwood、A Sette、and B Singh『Int Immunol』1996、8:745−755)。最後に、該アプローチは、望ましくない自己免疫疾患を誘発する可能性のある、抗原における自己免疫T細胞の決定基を取り除く可能性を提供する。CTLエピトープペプチドを用いる防御性の抗ウイルス免疫または防御性の抗腫瘍免疫は、いくつかの実験モデルで成功を収めている(D.J.Diamond、J.York、J.Sun、C.L.Wright and S.J.Forman、『Blood』90、1997、p.1751;J.E.J.Blaney、E.Nobusawa、M.A.Brehm、R.H.Bonneau、L.M.Mylin、T.M.Fu、Y.Kawaoka and S.S.Tevethia、『J Virol』72(1998)、p.9567)。
【0005】
ヒトのリンパ球の使用に基づくCTLエピトープの決定は、不完全な結果へとつながる環境的、遺伝的な多様性のため、また、CTLクローンの単離における技術的困難性のために、誤りを生じる恐れがある。今までに説明されているHLAクラスIまたはクラスIIのトランスジェニックマウスは、このような動物モデルで新しいCTLおよびヘルパーT細胞のエピトープが同定されたことによって示されているように、これらの限界を克服するための有効なツールであることが証明されている(Hill AV.『Annu Rev Immunol.』1998;16:593−617;Carmon L、El−Shami KM、Paz A、Pascolo S、Tzehoval E、Tirosb B、Koren R、Feldman M、Fridkin M、Lemonnier FA、Eisenbach L.『Int J Cancer』、2000年2月1日;85(3):391−7)。また、これらのマウスは、i)ペプチドのHLA結合親和力と免疫原性との間の良好な相互関係(Lustgarten J、Theobald M、Labadie C、LaFace D、Peterson P、Disis ML、Cheaver MA、Sherman LA.『Hum Immunol.』1997年2月;52(2):109−18;Bakker AB、van der Burg SH、Huijbens RJ、DRijfhout JW、Melief CJ、Adema GJ、Figdor CG.『Int J Cancer』1997年1月27日;70(3):302−9)、ii)抗原プロセシングのレベルでの、マウスのCTL系とヒトのCTL系の間にある顕著な重複(同一のエピトープの生成)、および、iii)HLAトランスジェニックマウスとヒトにおけるCTLレパートリーの、大半の抗原に対する同程度の可動性(Wentworth、P.A.、A.Vifiello、J.Sidney、E.Keogh、P.W.Chesnut、H.Grey、A.Sette.1996.『Eur.J.Immunol.』26:97;Alexander、J.、C.Oserof、J.Sidney、P.Wentworth、E.Keogh、G.Hermanson、F.V.Chisari、R.T.Kubo、H.M.Grey、A.Sette、1997.『J.Immunol.』159:4753)を証明するために用いられている。
【0006】
今までに、合成ペプチドに基づくCTLエピトープワクチンは、多くのヒトの疾病に対する免疫療法として開発されている[18−20]。しかし、いくつかの臨床試験では中程度の有効性が観察されただけである(21)。これは、部分的には、これらのワクチンが十分に強力なCTL反応を誘発することができなかったことによって説明することができる。実際、最近の報告では、最大のCTL反応を得るために、CD4+T細胞の補助が必要であることが示唆されている(A.J.Zajac、K.Murali−Krishna、J.N.Blattman and R.Ahmed、『Curr Opin Immunol』10(1998)、p.444;Firat H、Garcia−Pons F、Tourdot S、Pascolo S、Scardino A、Garcia Z、Michel ML、Jack RW、Jung O、Kosmatopoulos K、Mateo L、Suhrbier A、Lemonnier FA、Langlade−Dernoyen P『Eur J Immunol』29、3112、1999)。
【0007】
CTLはウイルス感染に対する防御免疫の重要な構成要素であるが、CTLをインビボでプライミングする必要性は十分には理解されていない。今では、Th細胞が合成ペプチドでのCTLのプライミングのためには通常不可欠であることが認められている。合成CTLエピトープペプチドに関して、いくつかの研究が、最適なCTL反応を誘発するためにはThリンパ球の刺激が必須であることを指摘している(C.Fayolle、E.Deriaud and C.Leclerc、『J Immunol』147(1991)、p.4069;C.Widmann、P.Romero、J.L.Maryanski、G.Corradin and D.Valmori、『J Immunol Meth』155(1992)、p.95;M.Shirai、C.D.Pendkton、J.Ahlers、T.Takeshita、M.Newman and J.A.Berzofsky、『J Immunol』152(1994)、p.549;J.P.Sauet、H.Gras−Masse、J.G.Guillet and E.Gomard、『Int Immunol』8(1996).p.457)。これらの研究のいくつかは、CD4+ヘルパーT細胞とCD8+T細胞が、それらのコグネイトエピトープを有する一つの抗原提示細胞と同時に相互作用することが、CD8+T細胞の活性化に必要であることを示している(Ridge JP、Di Rosa F、Matzinger P.『Nature』1998年6月4日;3 93(6684):474−8)。
CTLのプライミングにこの三つの細胞の相互作用が関与することは、ウイルスエピトープおよび動物モデルを用いた研究によって、CTLエピトープとTh細胞エピトープが結合していない混合物として投与されるときより、物理的に結合しているときに、CTLのインビボでの誘発が最も効果的であったことから検証された(Shirai M、Pendleton CD、Ahlers J、Takeshita T、Newman M、Berzohky JA.『J Immunol』1994年1月15日;152(2):549−56;Oseroff C、Sette A、Wentworth P、Celis E、Maewal A、Dahlberg C、Fikes J、Kubo RT、Chesnut RW、Grey BX Alexander『J.Vaccine』1998年5月;16(8):823−33)。CTLの抗原ペプチドとTh細胞の抗原ペプチドの、CTL反応を効果的に誘発する能力は、実験モデル(C.Fayolle、E.Deriaud and C.Leclerc、『J Immunol』147(1991)、p.4069;C.Widmann、P.Romero、J.L.Maryanski、G.Corradin and D.Valmori、『J Immunol Meth』155(1992)、p.95)でも、ヒト(A.Vitiello、G.Ishioka、H.M.Grey、R.Rose、P.Famess、R.LaFond、L.Yuan、F.V.Chisari、J.Furze and R.Bartholomeuz、『J Clin Invest』95(1995)、p.341;B.Livingston、C.Crimi、H.Grey、G.Ishioka、F.V.Chisari、J.Fikes、H.M.Grey、R.Chesnut and A.Sette、『J Immunol』159(1997)、p.1383)においても実証されている。さらに、強力なTh反応は、CTL反応の最適な誘発だけではなく、CTLの記憶の維持のためにも重要な役割を果たす(E.A.Walter、P.D.Greenberg、M.J.Gilbert、R.J.Finch、K−S.Watanabe、E.D.Thomas and S.R.Riddell、『N Engl J Med』333(1995)、p.1038;Thomas ED、Blume KG、Forman SJ(編)『Hematopoietic Cell Transplantation』第2版、Malden、MA:Blackwell Science Inc.、1999年所収、Riddell SR、Greenberg PD)。最後に、CD4+「ヘルパー」T細胞が外来抗原に対する細胞性免疫反応と液性免疫反応を協調させることに重要であることも、古くから実証されてきている。
【0008】
近年では、HLA−A*0201クラスI分子とHLA−DR1クラスII分子の両方を発現するトランスジェニック(Tg)マウスが確立された(BenMohamed L、Krishnan R、Longmate J、Auge C、Low L、Primus J、Diamond DJ、『Hum、Immunol』2000年8月;61(8):764−79)。著者らは、HLA−A*0201トランスジーンとHLA−DR1トランスジーンの両方がインビボで機能的であること、MHCクラスI分子とクラスII分子の両方が拘束因子として用いられること、そして、HLA−DR1トランスジーンの生成物がHLA−A*0201拘束性の抗原特異的なCTL反応を助長することを報告している(BenMohamed L、Krishnan R、Longmate J、Auge C、Low L、Primus J、Diamond DJ、『Hum、Immunol』2000年8月;61(8):764−79)。
【0009】
これらHLA−A*0201/DR1のTgマウスがそれらに固有のMHCであるH−2クラスI分子およびクラスII分子を発現したことは注目に値する。内因性のマウスMHCクラスI遺伝子を発現するHLAクラスIトランスジェニックマウスが、優先的に、そしてしばしば独占的にH−2拘束性のCTL反応を示し(C Barra、H Gournier、Z Garcia、PN Marche、E Jouvin−Marche、P Briand、P Fillipi、and FA Lemonnier『J Immunol』1993、150:3681−3689;Epstein H、Hardy F、May JS、Johnson MH、Holmes N『Eur J Immunol.』1989年9月;19(9):1575−83;Le AX;EJ Bernhard、MJ Holterman、S Strub、P Parham、E Lacy、and VH Engelhard『J Immunol』1989、142:1366−1371;Vitiello A、Marchesini D、Furze J、Sherman LA、Chesnut RW『J Exp Med』1991年4月1日;173(4):100715)、内因性のマウスMHCクラスII遺伝子を発現するHLAクラスIIトランスジェニックマウスが、信頼性のあるHLAクラスII拘束性の抗原特異的反応を誘発することができないことから(Nishimura Y、Iwanaga T、Inamitsu T、Yanagawa Y、Yasunami M、Kimura A、Hirokawa K、Sasazuki T『J Immunol』1990年7月1日;145(1)353−60)、これらHLA−A*0201/DR1のTgマウスは、抗原に対するヒトの特異的反応を評価するためには限られた利用性となっている。
【0010】
しかし、HLAクラスIを遺伝子導入されたH−2クラスIノックアウトマウス、または、HLAクラスIIを遺伝子導入されたH−2クラスIIノックアウトマウスにおいては、HLA拘束性のCTL免疫反応だけが生じる(Pascolo S、Bervas N、Ure JM、Smith AG、Lemonnier FA、Perarnau、B『J Exp Med』1997年6月16日;185(12):2043−51;Madsen L、Labrecque N、Engberg J、Dierich A、Svejgaard A、Benoist C、Mathis D、Fugger L『Proc Natl Acad Sci USA』1999年8月31日;96(18):10338−43)。実際、HLA−A2.1を遺伝子導入されたH−2クラスIノックアウト(KO)マウスは、内因性のマウスH−2クラスI分子を発現したままとなっているHLA−A2.1トランスジェニックマウスと比べて、強いHLA−A2.1拘束性反応を実現する能力を示す(Pascolo、S.et al.『J Ex Med』185、2043−2051(1997);Ureta−Vidal、A.、Firat、H.、Perarnau、B.&Lemonnier、F.A.『J Immunol』163、2555−2560(1999);Firat、H.et al.、『Int Immunol』14、925−934(2002);Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003))。本発明者らは、H−2クラスII分子を欠いているかいないかということに応じて、HLA−DR1トランスジェニックマウスで同様の観察を行っている(A.Pajot、未公刊の結果)。さらに、マウスのMHC分子との競合がないときには、HLA−A2.1を遺伝子導入されたH−2クラスI−KOマウスまたはHLA−DR1を遺伝子導入されたH−2クラスII−KOマウスは、HLA拘束性免疫反応だけを生じさせ(Pascolo、S.et al.『J Exp Med』185、2043−2051(1997))(A.Pajot、未公刊の結果)、HLA拘束性のCD8+T細胞反応およびCD4+T細胞反応のモニタリングが容易になる。しかし、病原体に対する防御免疫反応は、ヘルパーT細胞と細胞傷害性CD8+T細胞の間の協調を必要とすることが多く、一頭のマウスにおいてHLAクラスIおよびクラスIIのヒトにおける反応を同時に評価することが不可能な、HLAクラスIのみのトランスジェニックマウスまたはHLAクラスIIのみのトランスジェニックマウスでは研究できない。
【0011】
従って、当該分野では、ヒトCTLエピトープを含む構造からなる、またある場合には、抗ウイルス性および抗腫瘍性のCD8+T細胞活性を維持するための強力なCD4+Th(ヘルパーTリンパ球)エピトープを含む構造からなる、ヒトのワクチン候補の免疫原性を試験するための、適した動物モデル系が必要である(A.J.Zajac、K.Murali−Krishna、J.N.Blattman and R.Ahmed『Curr Opin Immunol』10(1998)、p.444;Firat H、Garcia−Pons F、Tourdot S、Pascolo S、Scardino A、Garcia Z、Michel ML、Jack RW、Jung O、Kosmatopoulos K、Mateo L、Suhrbier A、Lemonnier FA、Langlade−Dernoyen P『Eur J Immunol』29、3112、1999)。また、CTL反応、TH反応(特にTH1反応またはTH2反応)そして場合によっては液性免疫反応の間における相互協調を同時に評価することを可能にする系も必要とされている。
【特許文献1】米国特許第6194389号明細書
【特許文献2】米国特許第6214808号明細書
【非特許文献1】BenMohamed L、Krishnan R、Longmate J、Auge C、Low L、Primus J、Diamond DJ『Hum、Immunol』.2000年8月;61(8):764−79)
【非特許文献2】A.J.Zajac、K.Murali−Krishna、J.N.Blattman and R.Ahmed『Curr Opin Immunol』10(1998)、p.444
【非特許文献3】Firat H、Garcia−Pons F、Tourdot S、Pascolo S、Scardino A、Garcia Z、Michel ML、Jack RW、Jung O、Kosmatopoulos K、Mateo L、Suhrbier A、Lemonnier FA、Langlade−Dernoyen P『Eur J Immunol』29、3112、1999
【発明の開示】
【発明が解決しようとする課題】
【0012】
本発明者らは、H−2クラスI分子およびクラスII分子の両方を欠いている遺伝的背景で、HLA−A2.1分子とHLA−DR1分子の両方を遺伝子導入したマウスを提供することで、この必要性を満たし、さらなる必要性に応えた。具体的には、本発明はマウスを提供するものであるが、該マウスは、(1)変異したH−2クラスI分子およびクラスII分子を含み、(2)遺伝子導入したHLAクラスI分子、または、遺伝子導入したHLAクラスII分子、あるいは、遺伝子導入したHLAクラスI分子と遺伝子導入したHLAクラスII分子の両方を発現するものである。これらのマウスは、ヒトに使用するための、インビボにおける最大の免疫原性を備えたワクチン構造を開発し、最適化することにおいて有用なモデルを提供する。具体的には、このようなマウスによって、動物個体における免疫適応応答の三つの構成要素(抗体、ヘルパーT細胞および細胞溶解)の完全な分析、ならびに、抗原の攻撃に対する、ワクチン投与によって特異的に与えられる防御を評価することが可能になる。
【課題を解決するための手段】
【0013】
本発明のマウスは、H−2クラスI分子とクラスII分子の両方をノックアウトし、遺伝子導入したHLAクラスIの分子および遺伝子導入したHLAクラスIIの分子を発現するもので、完全にヒト化した実験用マウスであり、該マウスは、抗原特異的抗体、抗原特異的なHLA−DR1拘束性のT細胞反応、および抗原特異的なHLA−A2拘束性のT細胞反応の存否を同時に検出するために用いることができる。これらのマウスは、CTL反応、TH反応(特にTH1またはTH2反応)、そして場合によっては液性免疫反応の間でどのように相互協調が起こるのかということを研究するために有用となる。これらのマウスは、基礎的および応用的なワクチン研究のための最適なツールとなる。
【0014】
本発明の第一の実施態様は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーンを含む、トランスジェニックマウスを提供するものである。
【0015】
本発明の第二の実施態様は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーン、および機能的なHLAクラスIIトランスジーンを含む、トランスジェニックマウスを提供するものである。
【0016】
いくつかの実施態様では、HLAクラスIトランスジーンはHLA−A2トランスジーンであり、HLAクラスIIトランスジーンはHLA−DR1トランスジーンである。その他の実施態様では、HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンはシーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0017】
本発明のさらなる実施態様は、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスを提供しており、該実施態様では、トランスジェニックマウスは機能的なHLAクラスIトランスジーンと、機能的なHLAクラスIIトランスジーンを含んでいる。一つの実施態様では、マウスはHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。いくつかの実施態様では、HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンはシーケンスリストに掲載されたHLA−DR1の配列を含んでいる
【0018】
本発明のもう一つの実施態様は、一つの候補抗原または候補抗原群における一つまたは複数のエピトープの存否を同時に識別するための方法を提供しており、該実施態様では、一つまたは複数のエピトープにより、特異的な液性免疫反応、THのHLA−DR1拘束性反応、および/またはCTLのHLA−A2拘束性反応が生じる。該方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーン、および機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、あるいは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスに、候補抗原または候補抗原群を投与すること、マウスにおける、抗原に対する特異的液性免疫反応を分析すること、マウスにおける、抗原に対するTHのHLA−DR1拘束性反応を分析すること、そして、マウスにおける、抗原に対するCTLのHLA−A2拘束性反応を分析することを含んでいる。マウスにおいて抗原に対する特異的液性免疫反応が見られることで、抗原における液性免疫反応を生じさせるエピトープが確認される。マウスにおいて抗原に対するTHのHLA−DR1拘束性反応が見られることで、抗原におけるTHのHLA−DR1拘束性反応を生じさせるエピトープが確認される。マウスにおいて抗原に対するCTLのHLA−A2拘束性反応が見られることで、抗原におけるCTLのHLA−A2拘束性反応を生じさせるエピトープが確認される。
【0019】
いくつかの実施態様では、この方法は、マウスにおける抗原に対するTh1特異的反応を分析することと、マウスにおける抗原に対するTh2特異的反応を分析することを含んでいる。この場合、マウスにおいて抗原に対するTh1特異的反応が見られることで、マウスにおいて抗原に対するTh1特異的反応を生じさせるエピトープが確認され、マウスにおいて抗原に対するTh2特異的反応が見られることで、マウスにおける抗原に対するTh2特異的反応を生じさせるエピトープが確認される。
【0020】
また、本発明は、一つの候補抗原または候補抗原群におけるHLA−DR1拘束性ヘルパーT細胞エピトープの存否を識別する方法も提供するものであり、該方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含んでいるトランスジェニックマウスに、あるいは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、候補抗原または候補抗原群を投与することと、マウスにおいて、抗原に対する、THのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を分析することを含んでいる。マウスにおいて、抗原に対する、THのHLA−DR1拘束性ヘルパーT細胞エピトープ反応が見られることで、抗原における、THのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープが確認される。
【0021】
さらに、本発明は、前段落の方法によって確認されたHLA−DR1拘束性ヘルパーT細胞のエピトープを含む、単離された抗原を提供するものである。いくつかの実施態様では、単離された抗原はさらに、液性免疫反応を生じさせるエピトープおよび/またはCTLのHLA−A2拘束性反応を生じさせるエピトープを含んでいる。別の実施態様では、HLA−DR1拘束性ヘルパーT細胞のエピトープを含む抗原はポリペプチドを含んでいる。その他の実施態様では、HLA−DR1拘束性ヘルパーT細胞のエピトープを含む抗原はポリヌクレオチドを含んでいる。さらなる実施態様では、HLA−DR1拘束性ヘルパーT細胞のエピトープを含む抗原は、DNA、RNA、あるいはDNAとRNAの両方を含んでいる。
【0022】
さらに、本発明は、一つの候補抗原または候補抗原群におけるHLA−A2拘束性細胞傷害性T細胞(CTL)エピトープの存否を識別する方法も提供するものであり、該方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含んでいるトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、候補抗原または候補抗原群を投与することと、マウスにおける抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応を分析することを含んでいる。マウスにおいて抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応が見られることで、抗原または抗原群においてHLA−A2拘束性細胞傷害性T細胞(CTL)反応を生じさせるエピトープが確認される。
【0023】
本発明は、前段落の方法によって確認された、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む、単離された抗原を提供するものである。いくつかの実施態様では、抗原がさらに、液性免疫反応を生じさせるエピトープおよび/またはTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープを含んでいる。別の実施態様では、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原はポリペプチドを含んでいる。その他の実施態様では、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原はポリヌクレオチドを含んでいる。さらなる実施態様では、HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原は、DNA、RNA、または、DNAとRNAの両方を含んでいる。
【0024】
また、本発明は二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞の反応の有効性を比較する方法も提供するものである。この方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、あるいは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第一の候補ワクチンを投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンおよび機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第二の候補ワクチンを投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を含んでいる、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、比較すべきさらなる候補ワクチンのそれぞれを投与し、さらなる候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応を測定すること、そして、比較すべき各ワクチンに対するヘルパーT細胞の反応を相互に比較してヘルパーT細胞の反応を誘発する各候補ワクチンの有効性を判定することを含んでいる。いくつかの実施態様では、ヘルパーT細胞の反応はHLA−DR1拘束性反応である。
【0025】
さらに、本発明は、二つまたはそれ以上のワクチンによって誘発された細胞傷害性T細胞反応の有効性を比較する方法を提供するものである。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第一の候補ワクチンを投与し、第一の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第二の候補ワクチンを投与し、第二の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、比較すべきさらなる候補ワクチンのそれぞれを投与し、さらなる候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、そして、比較すべき各ワクチンに対する細胞傷害性T細胞反応を相互に比較して細胞傷害性T細胞反応を誘発する各候補ワクチンの有効性を判定することを含んでいる。いくつかの実施態様では、細胞傷害性T細胞反応はHLA−A2拘束性反応である。
【0026】
さらに、本発明は、二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応の有効性を同時に比較する方法も提供するものである。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第一の候補ワクチンを投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、第二の候補ワクチンを投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応を測定すること、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子およびクラスII分子の両方を欠いたトランスジェニックマウスに、比較すべきさらなる候補ワクチンのそれぞれを投与し、さらなる候補ワクチンのそれぞれによってマウスにおいて誘発されたヘルパーT細胞の反応と細胞傷害性T細胞の反応を測定すること、そして、比較すべき各ワクチンに対するヘルパーT細胞の反応と細胞傷害性T細胞の反応を相互に比較してヘルパーT細胞の反応と細胞傷害性T細胞の反応を誘発する各候補ワクチンの有効性を判定することを含んでいる。いくつかの実施態様では、ヘルパーT細胞の反応はHLA−DR1拘束性反応であり、細胞傷害性T細胞の反応がHLA−A2拘束性反応である。
【0027】
また、本発明は、一つの抗原による免疫付与、あるいは、一つまたは複数の抗原を有するワクチンによる免疫付与に従った、マウスの液性免疫反応、ヘルパーT細胞の反応、そして細胞傷害性T細胞の反応を同時に判定する方法を提案するものでもある。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子とクラスIIの分子の両方を欠いたトランスジェニックマウスに、抗原、もしくは、一つまたは複数の抗原を含むワクチンを投与すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける特異的液性免疫反応を分析すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおけるヘルパーT細胞の反応を分析すること、そして、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける細胞傷害性T細胞の反応を分析することを含んでいる。いくつかの実施態様において、ヘルパーT細胞の反応はTHのHLA−DR1拘束性反応である。いくつかの実施態様において、細胞傷害性T細胞の反応はCTLのHLA−A2拘束性反応である。
【0028】
また、本発明は、事前に選択された基準に基づき、二つまたはそれ以上の候補ワクチンの組成物をヒトに投与するために最適化する方法も提供するものである。本方法は、二つまたはそれ以上の候補ワクチンの組成物による免疫付与に従った、マウスの液性免疫反応、ヘルパーT細胞の反応および細胞傷害性T細胞の反応を同時に判定することを含み、ここで用いる方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスに、抗原、もしくは、一つまたは複数の抗原を含むワクチンを投与すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける特異的液性免疫反応を分析すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおけるヘルパーT細胞の反応を分析すること、抗原、もしくは、一つまたは複数の抗原を含むワクチンに対する、マウスにおける細胞傷害性T細胞の反応を分析すること、そして、事前に選択された基準を結果に適用して、最適化されたワクチンを選択することを含む。いくつかの実施態様では、二つまたはそれ以上のワクチン候補は、ワクチンに存在するアジュバントに対する抗原の割合においてのみ異なっている。いくつかの実施態様では、二つまたはそれ以上のワクチン候補は、ワクチンに存在するアジュバントのタイプにおいてのみ異なっている。
【0029】
もう一つの特徴では、本発明は、ワクチンがヒトに投与されたときに、自己免疫疾患を誘発する危険性を有するか否かを判定する方法を提供するものである。本方法は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLA−A2トランスジーンおよび機能的なHLA−DR1トランスジーンを含むトランスジェニックマウスに、または、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含み、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、H−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスにワクチンを投与すること、そして、マウスにおける自己免疫反応を分析することを含んでおり、該分析において、マウスにおいて自己免疫反応が見られるということは、ワクチンがヒトに投与されたときに自己免疫疾患を誘発する危険性を有するものであることを示す。
【0030】
また、本発明は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーンを含む、単離されたトランスジェニックマウスの細胞を提供するものでもある。
【0031】
さらに、本発明は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーンおよび機能的なHLAクラスIIトランスジーンを含む、単離されたトランスジェニックマウスの細胞を提供するものでもある。
【0032】
いくつかの実施態様では、HLAクラスIトランスジーンはHLA−A2トランスジーンであり、HLAクラスIIトランスジーンはHLA−DR1トランスジーンである。その他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0033】
さらに、本発明は、H−2クラスI分子およびクラスII分子の両方を欠いている、単離されたトランスジェニックマウスの細胞を提供するものであり、ここでは、トランスジェニックマウスの細胞は、機能的なHLAクラスIトランスジーンと、機能的なHLAクラスIIトランスジーンを含んでいる。いくつかの実施態様では、トランスジェニックマウスの細胞はHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。その他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0034】
本発明は、以下の図面を参照することで、より十全に説明されるものである。
【0035】
図1は、表示されている遺伝子導入した分子の細胞表面発現のフローサイトメトリー分析を示している。(a)HLA−DR1を遺伝子導入したH−2クラスII−KOマウスに由来する脾細胞(DR1+CII-、左パネル)、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスに由来する脾細胞(A2+DR1+CI-CII-、中央パネル)、および、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスに由来する脾細胞(A2+CI-、右パネル)を、FITC標識W6/32(抗HLA−ABC、横座標)またはビオチン化した28−8−6S(抗H−2Kb/Db、縦座標)m.Abのいずれかによって染色し、後者は、PE標識抗マウスIgGで可視化した。(b)同一のマウス系統に由来するB220+脾臓Bリンパ球を、FITC標識L243(抗HLA−DR1、上パネル)とPE標識AF6−120.1(抗H−2IAβb、下パネル)m.Abで染色した。
【0036】
図2は、表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。(a)HLA−DR1を遺伝子導入したH−2クラスII−KOマウスに由来する脾細胞(DR1+CII-、左パネル)、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスに由来する脾細胞(A2+DR1+CI-CII-、中央パネル)、および、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスに由来する脾細胞(A2+CI-、右パネル)を、PE標識CT−CD4(抗マウスCD4、縦座標)およびFITC標識53−6.7(抗マウスCD8、横座標)m.Abで染色した。数字は、脾細胞全体におけるCD4+T細胞(左上の四角)またはCD8+T細胞(右下の四角)のパーセンテージに対応している。(bおよびc)BVファミリー(1−20)に特異的なフォワードプライマーおよびBCリバースプライマーを用いての、BVセグメントファミリー(1−20)の使用についての、精製した脾臓のCD8+T細胞(b)およびCD4+T細胞(c)のimmunoscope RT−PCR分析である。生産的に再配列したBVセグメントファミリーの典型的なグラフの特徴は、ガウス分布のような分布に、3ヌクレオチドによる長さが異なる一連のピークを有している。この図は、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOの代表のマウスで得られた結果を示している。
【0037】
図3はHBs特異的抗体反応、細胞溶解反応および増殖反応を示している。HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスを、HBsAgをコードするプラスミドDNAを筋肉注射することによって免疫付与し、また免疫付与せず、それから個別に試験した。(a)HBsAg−DNAで免疫付与した代表のマウスの液性免疫反応(上パネル)、細胞溶解反応(中パネル)および増殖反応(下パネル)、ならびに特異性についての対照である。middleとsmallのHBVエンベロープタンパク質の両方を含有するHBsAg粒子に対する抗体(IgG)の力価と、preS2109-134ペプチドに対する抗体の力価を、ELISA検定で判定した。様々なエフェクター/標的(E/T)の割合における細胞溶解活性を、関連ペプチド(HBsAg348-357、HLA−A2.1拘束性◆)または対照ペプチド(HBsAg371-378、H−2Kb拘束性Δ、およびMAGE−3271-279、HLA−A2.1拘束性□)をパルスしたRMAS−HHD標的細胞を用いて評価した。増殖反応は、関連ペプチド(HBsAg180-195、HLA−DR1拘束性)または対照ペプチド(HBsAg126-138、H−2IAb拘束性およびHIV1Gag263-278、HLA−DR1拘束性)のいずれかを用いて検出した。(b)HBsAg−DNAで免疫付与した6匹のマウス(1〜6)の抗体反応(IgG、上パネル)、細胞溶解反応(中パネル)および増殖反応(下パネル)の同様の評価を、6匹の未処理マウス(0)の反応の平均と比較したものである。30/1のE/T割合での細胞溶解活性を、免疫的にドミナントなペプチドであるHBsAg348-357(塗りつぶした棒)、または、サブドミナントなペプチドであるHBsAg335-343(グレーの棒)のいずれかをパルスしたRMAS−HHD標的細胞で評価した。
【0038】
図4は防御分析の結果を示している。HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスは、HBsAgをコードしているプラスミドDNAで二回免疫付与したものと、していないものを用意した。最後の免疫付与から15日後、該マウスを、HBsAgまたはHBxタンパク質のいずれかを発現している107PFUのrVVを腹腔内接種して攻撃した。4日後、マウスを、卵巣におけるウイルス力価について個別に試験した。結果(10を底とする対数で示したrVVのPFU/卵巣)は、rVV−HBsAgで攻撃したHBsAg−DNAで免疫付与したマウス(I、n=10)、rVV−HBsAgで攻撃した未処理マウス(N、n=6)、rVV−HBxで攻撃したHBsAgで免疫付与したマウス(Ix、n=6)、および、rVV−HBxで攻撃した未処理マウス(Nx、n=6)について示されている。
【0039】
図5は、pcmvS2/Sによる免疫付与に従った、HLA−A2+DR1+CI-CII-マウスにおけるACの抗PreS2反応を示している。
【0040】
図6は、pcmvS2−SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−DR1拘束性エピトープに対するCD4+T細胞の増殖反応を示している。
【0041】
図7は、pcmvS2/SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−A2拘束性HBS(348−357)ペプチドに対する、CD8+T細胞の細胞傷害性反応を示している。
【0042】
配列
SEQ ID NO:1は下位の部分を含んでおり、その下位の部分であるヌクレオチド1−1205はHLA−A2プロモーターを含み、ヌクレオチド1206−1265はHLA−A2リーダー配列を含み、ヌクレオチド1266−1565はヒトβ2ミクログロブリンcDNAを含み、ヌクレオチド1566−1610は(Gly4Ser)3リンカーを含み、ヌクレオチド1611−2440は、HLA−A2のエクソン2およびイントロン3の一部を含有するセグメントを含み、そして、ヌクレオチド2441−4547は、イントロン3の一部、エクソン4から8、および、H2Db遺伝子の3’非コード領域の一部を含有するセグメントを含んでいる。
【0043】
SEQ ID NO:2は、DRA*0101遺伝子のヌクレオチド配列である。ヌクレオチド1−15279は5’からHLA−DRアルファ遺伝子に位置するプロモーターであり、ヌクレオチド15280−15425はエクソン1であり、ヌクレオチド15344−15346はATG開始コドンであり、ヌクレオチド17838−18083はエクソン2であり、ヌクレオチド18575−18866はエクソン3であり、ヌクレオチド19146−19311はエクソン4であり、そしてヌクレオチド20008−20340はエクソン5である。
【0044】
SEQ ID NO:3はDRB1*010101遺伝子のヌクレオチド配列である。ヌクレオチド7391−7552はエクソン1であり、ヌクレオチド7453−7455はATG開始コドンであり、ヌクレオチド15809−16079はエクソン2であり、ヌクレオチド19536−19817はエクソン3であり、ヌクレオチド20515−20624はエクソン4であり、ヌクレオチド21097−21121はエクソン5であり、そしてヌクレオチド21750−22085はエクソン6である。
【0045】
本発明の実施には、別のものが指示されていない限り、当該分野の技術に含まれる、細胞生物学、細胞培養、分子生物学、トランスジェニック生物学、微生物学、組換えDNAおよび免疫学の慣用的技術が用いられるものとする。このような技術は先行研究で十分に説明されている。例えば、Sambrook、FritschおよびManiatis編『Molecular Cloning A Laboratory Manual』第二版(Cold Spring Harbor Laboratory Press:1989);『DNA Cloning』第I巻および第II巻(D.N.Glover編、1985);『Oligonucleotide Synthesis』(M.J.Gait編、1984);『Mullis et al.、米国特許第4683195号明細書;『Nucleic Acid Hybridization』(B.D.Hames&S.J.Higgins編、1984);『Transcription And Translation』(B.D.Hames&S.J.Higgins編、1984);『Culture Of Animal Cells』(R.I.Freshney、Alan R.Liss、Inc.、1987);『Immobilized Cells And Enzymes』(IRL Press、1986);B.Perbal『A Practical Guide To Molecular Cloning』(1984);『Methods In ENZYMOLOGY』(J.Abelson and M.Simon編集主幹、Academic Press、Inc.、New York)のシリーズ、とりわけ、第154巻および第155巻(Wu et al.編)ならびに第185巻「Gene Expression Technology」(D.Goeddel編);『Gene Transfer Vectors For Mammalian Cells』(J.H.Miller and M.P.Calos編、1987、Cold Spring Harbor Laboratory);『Immunochemical Methods In Cell And Molecular Biology』(Mayer and Walker編、Academic Press、London、1987);『Handbook Of Experimental Immunology』第I巻〜第IV巻(D.M.Weir and C.C.Blackwell編、1986);そして、『Manipulating the Mouse Embryo』(Cold Spring Harbor Laboratory Press、Cold Spring Harbor、N.Y.、1986)を参照すること。
【0046】
本発明はマウスを提供するものであるが、該マウスは、(1)変異したH−2クラスI分子およびクラスII分子を含み、そして、(2)遺伝子導入したHLAクラスI分子、または、遺伝子導入したHLAクラスII分子、または、遺伝子導入したHLAクラスI分子と遺伝子導入したHLAクラスII分子の両方を発現するものである。本発明によるマウスは、H−2クラスI分子およびクラスII分子の両方をノックアウトしており、遺伝子導入したHLAクラスI分子と遺伝子導入したHLAクラスII分子を発現するもので、完全にヒト化した実験用マウスであり、該実験用マウスは、抗原特異的な抗体、抗原特異的なHLA−DR1拘束性T細胞反応、および抗原特異的なHLA−A2拘束性T細胞反応の存否を同時に検出するために用いることができる。これらのマウスは、CTL反応、TH反応(特にTH1反応またはTH2反応)、および、場合によっては液性免疫反応の間でどのように相互協調が行われているかということを研究するために有用である。これらのマウスは基礎的かつ応用的なワクチン研究のための最適なツールとなるものである。
【0047】
本発明は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーンを含む、トランスジェニックマウスを提供するものである。いくつかの実施態様では、トランスジェニックマウスは破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーン、および機能的なHLAクラスIIトランスジーンを含んでいる。このようなマウスは完全にヒト化された実験用マウスであるということができるのだが、それは、該マウスが、抗原特異的な抗体、抗原特異的なHLA−DR1拘束性T細胞反応および抗原特異的なHLA−A2拘束性T細胞反応の存否を同時に検出するために用いることができるからである。
【0048】
本発明に挙げられている実施例で部分的に示されているように、また、開示内容から当業者には一般的に明らかであるように、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスは、DNAによる免疫付与に従って、HBsAgに特異的な抗体反応、CD4+ヘルパーT細胞反応および細胞溶解性のCD8+T細胞反応を示す能力を有している。これらの反応は、試験した全てのマウス個体で見られたが、ヒトの反応と同じ免疫的にドミナントなエピトープに対して生じ、免疫付与したマウスは、HBsAg組換えワクシニアウイルスに対する特異的な防御を示した。
【0049】
ヘルパーT細胞は、抗体反応の完全な成熟(Katz、D.H.&Benacerraf、B.、『Adv Immunol』15、1−94(1972))、多くのエピトープに対するCTLのプライミング(von Boehmer、H.&Haas、W.、『J Exp Med』150、1134−1142(1979);Keene、J.A.&Forman、J.、『J Exp Med』155、768−782(1982))、および、CTLの長期維持(Matloubian、M.、Concepcion、R.J.&Ahmed、R.、『J Virol』68、8056−8063(1994))には不可欠である。抗体(Lefrancois、L.、『J Virol』51、208−214(1984))とCTL(Zinkernagel、R.M.&Welsh、R.M.、『J Immunol』117、1495−1502(1976))は共に、ウイルス感染に対する防御免疫の重要な構成要素である。実際、強力なHBsAgに特異的な抗体の反応およびCTL反応は、HLA−A2.1とHLA−DR1の両方を遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られるが、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られない。従って、HBsAgに特異的なCD4+T細胞の助けが、効果的なHBsAgに特異的なCTL反応と抗体反応を生じさせるために不可欠である。これらの結果は、HBsAgで免疫付与したマウス(Milich、D.R.、『Semin Liver Dis』11、93−112(1991))、およびHBsAgをワクチン接種したヒト(Celis、E.、Kung、P.C.&Chang、T.W.、『J Immunol』132、1511−1516(1984))を対象とする研究と一貫しており、このことは、抗HBs抗体反応の発生がCD4+T細胞に依存していることを示唆している。
【0050】
HLA−A2.1クラスI分子およびHLA−DR1クラスII分子の両方を発現するトランスジェニックマウスは既に得られている(BenMohamed、L.et al.『Hum Immunol』61、764−779(2000))。著者らは、HLA−A2.1分子およびHLA−DR1分子の両方がインビボで機能的な拘束性の要素であることと、HLA−DR1トランスジーンの産物が、HLA−A2.1拘束性の抗原特異的なCTL反応を強化することを報告している。しかし、これらのマウスにおける免疫反応のヒトへの関連性は、マウスが、通常優先的に、そしてしばしば独占的に抗原に対する反応における拘束要素として用いられる、自身のH−2クラスI分子およびクラスII分子を依然として発現しているため、過小評価されている(Ureta−Vidal、A.、Firat、H.、Perarnau、B.&Lemonnier、F.A.、『J Immunol』163、2555−2560(1990);Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003))(A.Pajot、未公刊の結果)。ここで記載されている本発明は、この限界を、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスを提供することで克服するものである。
【0051】
いくつかの実施態様では、β2m−KOの背景の、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスは、HLA−A2.1の一本鎖を発現し、該一本鎖において、ヒトβ2mがペプチドのアームによってHLA−A2.1の重鎖に共有結合している。該マウスではさらに、H−2IAβb遺伝子の不活性化の結果として、通常のH−2クラスIIのIA分子およびIE分子の細胞表面発現がないのだが、それはなぜなら、H−2のIEαがH−2bハプロタイプの偽遺伝子だからである。ここで挙げられている結果は、このようなマウスがH−2クラスI分子およびクラスII分子の細胞表面発現を失っていることを示している。しかし、ある場合には、結合していないクラスIの重鎖、特にH−2Dbがβ2m−KOマウスの細胞表面に存在し、アロ反応性を誘発する可能性があることが指摘されている。仮にこれが正しいとしても、このようなマウスはペプチドを有していないため、該マウスが抗原特異的な免疫反応に関わることはない(Bix、M.&Raulet、D.、『J Exp Med』176、829−834(1992))。これはAllen et alの報告にも記載されており(Allen、H.、Fraser、J.、Flyer、D.、Calvin、S.&Flavell、R.、『Proc Natl Acad Sci USA』83、7447−7451(1986))、該報告において、Allenらは、細胞内にβ2mが存在しないときにもH−2Dbが細胞表面に発現すること、しかしこのようなDb抗原がDbアロ特異的またはDb拘束性の細胞傷害性Tリンパ球のいずれによっても認識されないことを確認している。さらに、Db抗原はほとんどの天然Dbのモノクローナル抗体には認識されない。
【0052】
それにも関わらず、HLA−DRαのみを遺伝子導入したマウスでは、少なくともHLA−DRβ鎖がないときに、特殊なHLA−DRα/H−2IEβb混成複合体がある程度は細胞表面に発現しうることが報告されている(Lawrance、S.K.et al.、『Cell』58、583−594(1989))。この観察にも関わらず、これらの特殊な分子は、血清学的には、このような混成分子と反応することが知られているmAb(17−3−3S)によっても、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおける細胞表面では検出されなかった(Ozato、K.、Mayer、N.&Sachs、D.H.、『J Immunol』124、533−540(1980))(図1aおよび示していないデータ)。さらに、これらのマウスのHBsAgに特異的なT細胞反応およびHIVの1−Gagに特異的なT細胞反応を研究することで得られた結果はすべて、拘束要素としてHLA−A2.1分子およびHLA−DR1分子のみを用いていることを示した。このことから、特殊なHLA−DRα/H−2IEβb混成体が、通常のHLA−DRα/HLA−DRβ分子と比べて不安定であると思われること、そして、該混成体が、HLA−DRβ鎖がないときにだけ存在しうることが言える。すべてのH−2クラスII領域(H−2IAβb、IAαb、IEβb)が削除されているマウス系統(Madsen、L.et al.、『Proc Natl Acad Sci USA』96、10338−10343(1999))、ならびに、H−2Db遺伝子が削除されているマウス系統が、この可能性を完全に排除するために分析されているところである。第一のマウスから得られた脾細胞の予備分析では、HLA−DR1を遺伝子導入したH−2クラスII−KOマウス(Iaβb゜)で見られるものに類似したCD4+T細胞プールの回復が見られ、これらの新たなマウスのHLA−DR1拘束性CD4+T細胞反応が、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスのHLA−DR1拘束性CD4+T細胞反応と同等であることを示唆している。
【0053】
HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの末梢CD8+Tリンパ球は、親であるHLA−A2.1を遺伝子導入したH−2クラスI−KOマウスと比較して、少なくともBVセグメントの使用の点では量的かつ質的に類似しており、TCRレパートリーが完全に多様化している。野生型マウスと比べて、特にCD8+T細胞プールの部分的な回復は、キメラ(マウス由来のα3ドメイン)HLA−A2.1分子を発現する、一つのHLAを遺伝子導入したマウスで恒常的に見られている(Pascolo、S.et al.、『J Exp Med』185、2043−2051(1997))。共結晶分析により、ヒトのCD8もHLA−A2.1重鎖のα2ドメインと接触を持っていることが実証されたことから、α3ドメインの置換に関係なく、マウスのCD8とHLA−A2.1分子の間では相互作用が不十分なままである(Gao、G.F.et al.、『Nature』387、630−634(1997))。また、不十分な協調は小胞体で起こる可能性もあり、該小胞体では、多くの分子(TAP、タパシン、ERp57)がMHCクラスI分子の生合成を補助する。しかし、この段階では、これらのマウス小胞体分子とヒト小胞体分子の間における唯一の実証されている機能的な差異、つまり、マウスのTAPではなくヒトのTAPが、プラスの電荷を帯びた細胞質ペプチドのCOOH末端を効果的に輸送すること(Momburg、F.、Neefjes、J.J.&Hammerling、G.J.、『Curr Opin Immunol』6、32−37(1994))は、疎水性のC末端を有するペプチドと結合するHLA−A2.1分子にとっては問題にならず、それは、これらのペプチドがマウスおよびヒトのTAPによって効果的に輸送されるからである。HLA−A2.1のみを遺伝子導入したH−2クラスI−KOマウス、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの双方において、CD8+Tリンパ球の数が少なくても、該リンパ球は効果的にHBsAgに対して反応し、そして、重要なこととして、後者のマウスは、ヒトと類似した抗体反応、ヘルパーT細胞反応および細胞溶解反応を示す。
【0054】
Tリンパ球を標的とする、T細胞エピトープをベースとするワクチンの設計を妨げる困難の一つは、HLAクラスI/クラスII分子の多型性である。HLA−A2.1分子およびHLA−DR1分子は、ヒトの個体群におけるかなりの割合の個体が発現している(HLA−A2.1については30%から50%、HLA−DR1については6%から18%)。HLAクラスI分子を機能的にスーパーファミリーにクラスタリングすることは、提示されたペプチド34の集合の顕著な剰余量に基づいているのであるが、HLAクラスIのアイソタイプ変異体または対立遺伝子多型のそれぞれによって生じた反応の個別分析は、それらが提示する最適なエピトープを識別するために、依然として行う必要がある。これは、免疫反応をモニターするための四量体(HLAクラスIまたはHLAクラスII)のような、新たな試薬を開発するために特に重要である。同様の理由のために、たとえペプチドのHLAクラスII分子に対する結合がクラスI分子に対する結合より拘束性が低くても、HLA−A2.1を他のHLAクラスII分子とともに共発現するマウス系統を得ることは有益となるものである。ここでの開示に基づき、さらなる、HLAクラスI/クラスIIを遺伝子導入したH−2クラスI/クラスII−KOマウスを、これらの目的あるいは他の目的のために構成することができる。
【0055】
HLAを遺伝子導入したH−2−KOマウスによって、ヒトへ置き換えることのできる可能性に優れた抗原ペプチドの免疫原性を詳細に分析し、最適化することが可能になるのに対し(Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003);Loirat、D.、Lemonnier、F.A.&Michel、M.L.、『J Immunol』165、4748−4755(2000);Scardino、A.et al.、『Eur J Immunol』31、3261−3270(2001))、これは、ワクチンアジュバントの製剤化の研究に対してはあまり明白ではない。このことは、二つの種の間にある、抗原攻撃に対する反応の初期に動員される様々なエフェクターの違いに起因する可能性がある。固有の免疫に関する基本的な知識を高めることは、将来的には、マウスの免疫系をより完全にヒト化させることをもたらしうるものである。
【0056】
最後に、ここでの開示によって、最適化し、ヒト化したトランスジェニックマウスのモデルが説明されるのだが、該マウスのH−2クラスI遺伝子(マウスβ2m)およびクラスII遺伝子(H−2IAβb)は削除され、等価のヒト遺伝子のHHD(HLA−A*0201)、HLA−DRA*0101およびHLA−DRB1*0101で置き換えられている。HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおける細胞性免疫は、ヒトのHLA分子によって完全に拘束され、マウスのMHC分子によって拘束された免疫反応は全くない。マウスMHCの免疫反応とヒト(トランスジェニック)HLAの免疫反応の間に競合がないことによって、これらのマウスを、ヒトのワクチンにおける、HLA拘束性CD4+ヘルパーT細胞とHLA拘束性CD8+細胞溶解性T細胞の間の協調を要求するエピトープを明らかにするために用いることが可能になる。
【0057】
「HLA」はヒトのMHC複合体であり、「H−2」はマウスのMHC複合体である。ヒトの複合体は三つのクラスIα鎖遺伝子である、HLA−A、HLA−BおよびHLA−C、ならびに、MHCクラスIIα鎖遺伝子とβ鎖遺伝子の三つのペアである、HLA−DR、−DPおよび−DQを含んでいる。多くのハプロタイプにおいて、HLA−DRクラスターは余分のβ鎖遺伝子を含んでおり、該遺伝子の産物はDRα鎖と対をなすことができ、従って、遺伝子の三つのセットは、四つのタイプのMHCクラスII分子を生み出すことになる。マウスにおいて、三つのクラスIα鎖遺伝子は、H−2−L、H−2−DおよびH−2−Kである。マウスのMHCクラスII遺伝子はH−2−AおよびH−2−Eである。
【0058】
当該分野において、多型性HLA抗原および異なったHLA対立遺伝子の両方の結果として、様々な個体のHLA遺伝子の間に遺伝的多様性が存在していることが知られている。従って、ここで開示されている本発明の実施態様は、一つの多型性HLA抗原を他の一つで置き換えること、あるいは、一つのHLA対立遺伝子を他の一つで置き換えることができる。HLA多型および対立遺伝子の例は、たとえば、http://www.anthonynolan.org.uk/HIG/data.htmlとhttp://www.ebi.ac.uk/imgt/hla、Dominique Charon編『Genetic diversity of HLA:Functional and Medical Implication』、EDK Medical and Scientific International Publisher、および、Steven G.E.Marsh、Peter Parham and Linda Barber『The HLA FactsBook』、AP Academic Press、2000で見ることができる。
【0059】
「破壊された」遺伝子とは、相同組換えまたは当該分野で知られたその他のアプローチを用いて変異した遺伝子である。破壊された遺伝子は、遺伝子の低形質対立遺伝子(hypomorphic allele)または遺伝子の無効対立遺伝子(null allele)のどちらかとすることができる。当業者は、用いる対立遺伝子のタイプをあらゆる特別な背景に対して選択することが可能であることを理解できるものである。本発明の多くの実施態様では、無効対立遺伝子が選択されている。
【0060】
「相同組換え」とは、細胞の、事前に選択した所望の遺伝子配列を変異させることで、トランスジェニック動物を作成するための、一般的なアプローチである(Mansour、S.L.et al.、『Nature』336:348−352(1988);Capecchi、M.R.、『Trends Genet.』5:70−76(1989);Capecchi、M.R.、『Science』244:1288−1292(1989);Capecchi、M.R.et al.、Capecchi、M.R.編『Current Communications in Molecular Biology』所収、Cold Spring Harbor Press、Cold Spring Harbor、N.Y.(1989)、pp.45−52;Frohman、M.A.et al.、『Cell』56:145−147(1989))。
【0061】
こうして、マウス中のどのような遺伝子も任意に改変することが可能になる(Capecchi、M.R.、『Trends Genet.』5:70−76(1989);Frohman、M.A.et al.、『Cell』56:145−147(1989))。遺伝子ターゲッティングでは、選択した遺伝子座のクローニングしたDNA配列の中に所望の変異を導入するために、標準的な組換えDNA技術を使用する。それから、その変異を、相同組換えを通して、多能性の胚性幹細胞(ES細胞)のゲノムへと導入する。改変した幹細胞をマウスの胚盤胞にマイクロインジェクトし、発生中のマウスの胚に組み込み、最終的にキメラマウスに成長させる。ある場合には、キメラマウスの生殖系列細胞は、遺伝的に改変したES細胞から派生することがあり、変異した遺伝子型は生殖を通して伝達することができる。
【0062】
遺伝子ターゲッティングは、nptII遺伝子がβ2ミクログロブリン遺伝子座に挿入されているキメラマウスおよびトランスジェニックマウスを作成するために用いられている(Koller、B.H.et al.、『Proc.Natl.Acad.Sci.(U.S.A.)』86:8932−8935(1989);Zijlstra、M.et al.、『Nature』342:435−438(1989);Zijlstra、M.et al.、『Nature』344:742−746(1989);DeChiaba et al.、『Nature』345:78−80(1990))。同様の実験により、nptII遺伝子の挿入によって破壊されているc−abl遺伝子を有しているキメラマウスおよびトランスジェニックマウスの作成が可能になっている(Schwartzberg、P.L.et al.、『Science』246:799−803(1989))。該技術は、en−2遺伝子がnptII遺伝子の挿入によって破壊されているキメラマウスを作成するために用いられている(Joyner、A.L.et al.、『Nature』338:153−155(1989))。
【0063】
「遺伝子ターゲッティング」法を用いるためには、対象となる遺伝子はその前にクローニングされている必要があり、また、イントロン−エクソンの境界が決定されている必要がある。該方法により、マーカー遺伝子(例えばnptII遺伝子)が、対象となる特定の遺伝子の翻訳された領域に挿入される。従って、遺伝子ターゲッティング法を用いると、対象となる遺伝子はかなり破壊される。
【0064】
意義深いことに、細胞の遺伝子を改変するために遺伝子ターゲッティングを用いると、その遺伝子配列においてかなりの改変が生じる。遺伝子ターゲッティングの有効性は可変領域の数に左右され、構造ごとに異なる。
【0065】
本発明のキメラマウスまたはトランスジェニックマウスの細胞は、ES細胞またはその同等物のような多能性前駆細胞とすることができる、一つまたは複数のDNA分子を細胞に導入することによって調製される(Capecchi、M.R.編『Current Communications in Molecular Biology』、Cold Spring Harbor Press、Cold Spring Harbor、N.Y.(1989)所収、Robertson、E.J.、pp.39−44)。「前駆」という用語は、多能性細胞が、目的の(トランスフェクトされた)多能性細胞に対する前駆体であることだけを意味し、該多能性細胞は本発明の教示内容に従って調製される。多能性細胞(前駆的またはトランスフェクトされているもの)は、キメラマウスまたはトランスジェニックマウスを作成するために、当該分野で知られた方法(Evans、M.J.et al.、『Nature』292:154−156(1981))により、インビボで培養することができる。
【0066】
どのようなES細胞でも本発明に従って用いることができる。しかし、ES細胞の初代分離株を用いることが好ましい。このような分離株は、Capecchi、M.R.編『Current Communications in Molecular Biology』、Cold Spring Harbor Press、Cold Spring Harbor、N.Y.(1989)所収、Robertson、E.J.pp.39−44によって開示されているCCE細胞株のような胚から直接、または、CCE細胞株からのES細胞のクローン単離(Schwartzberg、P.A.et al.、『Science』246:799−803(1989)、この文献は参照することにより本発明の一部を構成するものである)により、得ることができる。このようなクローン単離は、E.J.Robertsonの方法(E.J.Robertson編『Teratocarcinomas and Embryonic Stem Cells: A Practical Approach』、IRL Press、Oxford、1987に記載)に従って行うことができるのだが、該文献および該方法は参照することにより本発明の一部を構成するものである。このようなクローン増殖の目的は、マウスへの分化に対して大きな有効性を有しているES細胞を得ることである。クローン選択されたES細胞は、トランスジェニックマウスの作成において、始原細胞株であるCCEよりもおよそ10倍効果的である。本発明の組換え法のためには、クローン選択による利点はない。
【0067】
胚からクローン単離によって得たES細胞株の例は、ES細胞株、AB1(hprt+)またはAB2.1(hprt-)である。ES細胞は、E.J.Robertson(E.J.Robertson編『Teratocarcinomas and Embryonic Stem Cells:A Practical Approach』、IRL Press、Oxford、1987所収、pp.71−112)によって説明されているように、好ましくは間質細胞(STO細胞(特にSNC4のSTO細胞)および/または胚の初代培養線維芽細胞など)上で培養されるのだが、該文献は、参照することにより本発明の一部を構成するものである。キメラマウスの作成および分析のための方法は、Bradley、A.(E.J.Robertson編『Teratocarcinomas and Embryonic Stem Cells:A Practical Approach』、IRL Press、Oxford、1987所収、pp.113−151)によって開示されており、該文献は参照することにより、本発明の一部を構成するものである。間質細胞(および/または線維芽細胞)は、異常なES細胞の過剰なクローン増殖をなくすことに役立つ。もっとも好適には、細胞は、白血球阻害因子(「lif」)(Gough、N.M.et al.、『Reprod.Fertil.Dev.』1:281−288(1989);Yamamori、Y.et al.、『Science』246:1412−1416(1989)、該文献の両者は参照することで本発明の一部を構成するものである)の存在の下で培養される。lifをコードする遺伝子がクローニングされているので(Gough、N.M.et al.、『Reprod.Fertil.Dev.』1:281−288(1989))、この遺伝子を有する間質細胞を、当該分野で知られた方法によって形質転換し、そして、ES細胞を、lifを培地に分泌する、形質転換された間質細胞上で培養することが特に好ましい。
【0068】
本発明で用いられているように、「トランスジーン」という用語は、部分的または全体的に異種な、つまりそれを導入するトランスジェニック動物またはトランスジェニック細胞が有さない核酸配列、あるいは、それを導入するトランスジェニック動物またはトランスジェニック細胞の内因性遺伝子に対して相同ではあるが、それを挿入する細胞のゲノムを改変するような方法で動物のゲノムに挿入されるように作られている、または挿入されている核酸配列を指すものである(たとえば、該核酸配列は、天然の遺伝子の位置とは異なる位置に挿入され、そうでなければ、その挿入はノックアウトを生じさせる)。トランスジーンは、一つまたは複数の転写制御配列と、イントロンのような、選択した核酸の最適な発現に必要となる可能性がある他のあらゆる核酸に、機能可能となるように結合させることができる。本発明の典型例となるトランスジーンは、たとえばH−2ポリペプチドをコードしている。他の典型例となるトランスジーンは、一つまたは複数のHLA遺伝子を、HLA遺伝子のゲノム配列との相同組換えによって破壊するようになっている。
【0069】
「機能的なトランスジーン」とは、mRNA転写産物を生成するものであり、該転写産物は、トランスジーンを含むマウスの少なくとも一つの細胞において、適切にプロセシングされたタンパク質を生成する。当業者には、既知の転写制御エレメントおよび転写後のプロセシングを指示する配列の様々な組み合わせによる一連の選択肢があり、この中から宿主マウスがトランスジーンの発現を指示するということが理解されるものである。本発明の多くの実施態様では、H−2遺伝子制御エレメントの制御下でHLAトランスジーンが発現することが好ましい。
【0070】
いくつかの実施態様では、HLAクラスIトランスジーンはHLA−A2トランスジーンであり、HLAクラスIIトランスジーンはHLA−DR1トランスジーンである。HLA−A2トランスジーンの一例は、シーケンスリストに掲載されたHLA−A2の配列を含むものである。HLA−DR1トランスジーンの一例は、シーケンスリストに掲載されたHLA−DR1の配列を含むものである。
【0071】
一つの実施態様において、本発明はH−2クラスI分子とクラスII分子の両方を欠いたトランスジェニックマウスを提供しており、該実施態様では、トランスジェニックマウスは機能的なHLAクラスIトランスジーンと、機能的なHLAクラスIIトランスジーンを含んでいる。いくつかの実施態様では、マウスはHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0072】
また、本発明は単離されたトランスジェニックマウスの細胞も提供するものである。ある場合には、細胞は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、および、機能的なHLAクラスIまたはクラスIIのトランスジーンを含んでいる。その他の場合には、細胞は、破壊されたH−2クラスI遺伝子、破壊されたH−2クラスII遺伝子、機能的なHLAクラスIトランスジーン、および機能的なHLAクラスIIトランスジーンを含んでいる。HLAクラスIトランスジーンはHLA−A2トランスジーンあってよく、HLAクラスIIトランスジーンはHLA−DR1トランスジーンであってよい。ある場合には、HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0073】
一つの実施態様では、本発明は、H−2クラスI分子とクラスII分子の両方を欠いた、単離されたトランスジェニックマウスの細胞を提供しており、該実施態様において、トランスジェニックマウスは、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる。単離されたトランスジェニックマウスの細胞は、HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有することができる。HLA−A2トランスジーンはシーケンスリストに掲載されたHLA−A2の配列を含むことができ、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含むことができる。
【0074】
本発明の単離されたトランスジェニックマウスの細胞は、本発明のいかなるマウスの遺伝子型を有することもできる。しかし、本発明の単離されたトランスジェニックマウスの細胞の遺伝子型の集合と、本発明のマウスの遺伝子型の集合は、必ずしも完全には重なっていない。
【0075】
本発明の単離されたマウスの細胞は、マウスまたはマウスの胚から得ることができる。一つの実施態様では、マウスまたはマウスの胚は、得るべき細胞と同一の遺伝子型を有している。もう一つの実施態様では、マウスまたはマウスの胚は、得るべき細胞とは異なった遺伝子型を有している。細胞をマウスまたはマウスの胚から得た後、細胞の遺伝子を、例えば相同組換えによって破壊することができる。さらに、機能的な遺伝子を、例えばトランスフェクションによって、細胞のゲノムの中に導入することができる。当業者であれば、当該分野で知られたいかなる適切な方法でも、細胞のゲノムを修飾するために適用することができ、それにより、所望の遺伝子型を有する、単離されたマウスの細胞が得られるということが理解されるものである。
【0076】
本発明のもう一つの目的は、H−2クラスI分子とクラスII分子の両方を欠いた、単離されたトランスジェニックマウスの細胞であり、該目的において、トランスジェニックマウスの細胞は機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる。いくつかの実施態様では、トランスジェニックマウスの細胞はHLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有している。その他の実施態様では、HLA−A2トランスジーンは、シーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンは、シーケンスリストに掲載されたHLA−DR1の配列を含んでいる。
【0077】
T細胞は、獲得した免疫の多くの側面で中心的な役割を果たし、多様な制御的機能および防御機能を遂行する。いくつかのT細胞は、感染した細胞またはガン化した細胞に出会うと、それらを異種のものと認識し、キラー細胞として作用することで対応し、細胞性免疫反応の一部として宿主自身の細胞を殺す。他のT細胞は、ヘルパーT細胞と呼ばれるものだが、抗体を産生するためにB細胞を刺激することで、あるいは、液性免疫反応または細胞性免疫反応のある側面を抑制することで、認識された異種抗原に反応する。
【0078】
ヘルパーT細胞(Th)は、サイトカインの生成を介して多くの免疫反応をとりまとめる。一般的にはCD4細胞表面マーカーを有するものとして識別されるが、これらの細胞は、機能的には、該細胞が生成するサイトカインのプロフィールと、免疫系のその他の細胞に対するそれらの影響に応じて、Th1またはTh2という亜集団に分けられる。
【0079】
Th1細胞は、T細胞抗原レセプターと称される認識システムを通して、侵入しようとする病原体、またはガンである宿主細胞を検出する。細胞性免疫と呼ばれる、Th1が関与するプロセスは、一般的にはB細胞以外の細胞の活性化を伴い、IFN−γの生成を特徴とすることが多い。それにも関わらず、Th1系がそもそも液性抗体の生成からは独立していても、Th1サイトカインは、IgG2aアイソタイプへの免疫グロブリンのクラススイッチを促進する。
【0080】
異種抗原を検出するとすぐに、ほとんどの成熟したTh1細胞は、IL−2、IL−3、IFN−γ、TNF−β、GM−CSF、高濃度のTNF−α、高濃度のMIP−1α、高濃度のMIP−1β、およびRANTESの放出を命令する。これらのサイトカインは、遅延型過敏性および一般的な細胞性免疫を促進する。たとえばIL−2は、T細胞の成長因子であり、該成長因子は、最初に検出された特定の抗原に感受性のある、さらなるT細胞のクローンの生成を促進するものである。感作T細胞は、抗原を含む細胞または病原体に付着し、攻撃する。
【0081】
対照的に、成熟したTh2細胞は、IL−3、IL−4、IL−5、IL−6、IL−9、IL−10、IL−13、GM−CSF、および、低濃度のTNF−αの分泌を促進する傾向がある。さらに、Th2反応は、B細胞を活性化させること、抗体の産生と分泌を刺激すること、そして、IgA、IgG1およびIgEアイソタイプへのクラススイッチを誘発することによって液性免疫を促進する。
【0082】
本発明で用いられるとき、「抗原」は、1)少なくとも一つのHTLエピトープ、または、2)少なくとも一つのCTLエピトープ、または、3)少なくとも一つのB細胞エピトープ、または、4)少なくとも一つのHTLエピトープと少なくとも一つのCTLエピトープ、または、5)少なくとも一つのHTLエピトープと少なくとも一つのB細胞エピトープ、または、6)少なくとも一つのCTLエピトープと少なくとも一つのB細胞エピトープ、または、7)少なくとも一つのHTLエピトープと少なくとも一つのCTLエピトープと少なくとも一つのB細胞エピトープを含んでいる。「候補抗原」とは、抗原として機能するかどうかを判定するために研究中の分子である。
【0083】
「液性免疫反応」とは、抗体が介在する特異的免疫である。
【0084】
「エピトープ」とは、免疫系によって認識される抗原上の部位である。抗体エピトープは、抗体によって認識される抗原上の部位である。T細胞エピトープは、MHC分子に結合している抗原上の部位である。THエピトープはMHCクラスII分子に結合している抗原上の部位である。CTLエピトープは、MHCクラスI分子に結合している抗原上の部位である。
【0085】
抗原は、ポリペプチド配列またはポリヌクレオチド配列を含むことができ、該配列は、RNA、DNAまたはその両方からなることができる。一つの実施態様では、抗原は、一つまたは複数の抗原性ポリペプチドを機能的にコードしている少なくとも一つのポリヌクレオチド配列を含む。この文脈で用いられるとき、「含む」という語は、少なくとも一つの抗原性ポリペプチドが、少なくとも一つの抗原性ポリペプチドをコードしている外因性ポリヌクレオチドに作用する、宿主細胞の転写装置および/または翻訳装置によってもたらされることを意味しており、それは例えば米国特許第6194389号明細書および米国特許第6214808号明細書に記載されている。
【0086】
本発明の抗原はどのような抗原性分子であってもよい。抗原性分子には、タンパク質、リポタンパク質、および糖タンパク質が含まれ、それらには、アルブミン、破傷風トキソイド、ジフテリアトキソイド、百日咳トキソイド、細菌の外膜タンパク質(髄膜炎菌の外膜タンパク質を含む)、RSV−Fタンパク質、マラリア由来のペプチド、B−ラクトグロブリンB、アプロチニン、オボアルブミン、リゾチームなどの、ウイルス性、細菌性、寄生虫性、動物性および真菌性タンパク質、ならびに、癌胎児性抗原(CEA)、CA15−3、CA125、CA19−9、前立腺特異抗原(PSA)および米国特許第5478556号明細書のTAA複合体のような腫瘍関連抗原が含まれ、該明細書は参照することでその全体が本発明の一部を構成するものである。抗原性分子にはまた、天然の多糖類および合成多糖類を含む炭水化物、ならびにその他のポリマーが含まれ、それらには、フィコール、デキストラン、カルボキシメチルセルロース、アガロース、ポリアクリルアミドおよびその他のアクリル系樹脂、乳酸グリコール酸共重合体、ポリビニルアルコール、部分的に加水分解されたポリ酢酸ビニル、ポリビニルピロリジン、B群連鎖球菌の莢膜多糖および肺炎球菌の莢膜多糖(タイプIIIを含む)、緑膿菌の細胞外ムコ多糖および莢膜多糖(フィッシャーのタイプIを含む)、ならびにヘモフィルスインフルエンザの多糖(PRPを含む)が含まれる。抗原性分子にはまた、TNP、糖類、オリゴ糖類、多糖類、ペプチド、毒素、薬物、化学物質およびアレルゲンのような、ハプテンおよび低分子量の分子を含むその他の成分が含まれる。そして、抗原性分子にはまた、細菌、リケッチア、菌類、ウイルス、寄生虫に由来するハプテンおよび抗原が含まれ、それらには、ジフテリア菌、百日咳菌、破傷風菌、ヘモフィルスインフルエンザウイルス、肺炎球菌、大腸菌、クレブシエラ菌、黄色ブドウ球菌、表皮ブドウ球菌、髄膜炎菌、ポリオウイルス、ムンプスウイルス、麻疹ウイルス、風疹ウイルス、呼吸器合胞体ウイルス、狂犬病ウイルス、エボラウイルス、炭疽菌、リステリア菌、A型肝炎ウイルス、B型肝炎ウイルス、C型肝炎ウイルス、ヒト免疫不全ウイルスIおよびII、単純ヘルペスウイルス1型および2型、CMV、EBV、水痘帯状疱疹ウイルス、マラリア原虫、結核菌、カンジダアルビカンス、その他のカンジダ菌、ニューモシスティスカリニ、マイコプラズマ、A型およびB型インフルエンザウイルス、アデノウイルス、A群連鎖球菌、B群連鎖球菌、緑膿菌、ライノウイルス、リーシュマニア、パラインフルエンザウイルス1型、2型および3型、コロナウイルス、サルモネラ菌、赤痢菌、ロタウイルス、トキソプラズマ、エンテロウイルス、ならびに、クラミジアトラコマチスおよびクラミジアニューモニエが含まれる。
【0087】
本発明で用いられるとき、薬学的組成物またはワクチンは、少なくとも一つの免疫性の組成物を含み、該免疫性組成物は、薬学的に許容されうる担体または賦形剤に溶解すること、懸濁すること、または結合することができる。薬学的に許容されうるどのような担体でも、組成物の投与のために用いることができる。適切な薬学的な担体は、A.Gennaro編『Remington’s Pharmaceutical Sciences』第18版、1990、Mack Pub.、Easton、Pa.に記載されており、該文献は参照することによりその全体が本発明の一部を構成するものである。担体は、水、ポリエチレングリコール、ジメチルスルホキシド(DMSO)、ならびに石油、動物油、植物油、ピーナッツオイル、大豆油、鉱油、ごま油などを含む油類のような、減菌した液体とすることができる。担体は、霧、スプレー、パウダー、ワックス、クリーム、座薬、インプラント、軟膏、膏薬、パッチ、湿布、フィルム、または化粧品の形状とすることができる。
【0088】
薬学的組成物またはワクチンの適切な製剤法は、選択する投与経路に左右される。たとえば、急速静注法または持続注入による静脈投与では、組成物は好ましくは水溶性であり、生理食塩水が好まれる担体である。経皮、経鼻、経口、胃内、膣内、直腸内、またはその他の経粘膜的投与のためには、浸透させるべき障壁に適した浸透剤を製剤に含めることができ、該浸透剤は当該分野では知られたものである。経口投与のためには、活性成分は、錠剤、ピル、糖衣錠、カプセル、液体、ゲル、シロップ、スラリー、懸濁液などに含有させることに適した担体と結合させることができる。また、時間依存の送達システムも本発明の組成物の投与に適用可能である。典型的なシステムは、乳酸グリコール酸共重合体、共重合したシュウ酸塩、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸およびポリ無水物のようなポリマーをベースとするシステムを含む。これらのポリマーおよび類似のポリマーは当該分野で知られた方法に従ってマイクロカプセルに製剤化することができるのだが、該方法はたとえば、米国特許第5075109号明細書で教示されており、該文献は参照することでその全体が本発明の一部を構成するものである。本発明の開示された免疫賦活化合物の投与に適した代替の送達システムは、米国特許第6194389号明細書、第6024983号明細書、第5817637号明細書、第6228621号明細書、第5804212号明細書、第5709879号明細書、第5703055号明細書、第5643605号明細書、第5643574号明細書、第5580563号明細書、第5239660号明細書、第5204253号明細書、第4748043号明細書、第4667014号明細書、第4452775号明細書、第3854480号明細書および第3832252号明細書(該文献のそれぞれは参照することでその全体が本発明の一部を構成するものである)で開示されているものを含んでいる。
【0089】
また、デキストロース溶液およびグリセロール溶液も液体担体として、とりわけ注入可能な溶液または噴霧溶液のために用いることができる。噴霧による投与のためには、当業者に理解されているように、加圧されたスプレーまたは噴霧器による場合のように、適切な推進剤を加えることができる。また、免疫学的組成物は、可溶化剤、乳化剤、安定剤、分散剤、香料、アジュバント、担体、リドカインやキシロカインなどのような局所麻酔剤、抗体、および、既知のまたは可能性が想定されている、抗ウイルス性、抗菌類性、抗寄生虫性、または抗腫瘍性の化合物でも製剤することができる。
【0090】
「アジュバント」とは、標的抗原に対する免疫反応を促進するか強める組成物である。当業者であれば、本発明をここでの開示に照らして実施するにあたり、使用するための適切なアジュバントを選択することができる。
【0091】
本発明は、一つまたは複数の本発明の抗原を含む組成物を投与することで、免疫賦活を必要としている患者を治療する方法を含むものである。本発明で用いられるとき、治療は、あらゆる疾病、病気、異常、または症状に関連する、矯正方法、回復方法、改善方法および予防方法を含んでいる。さらに、治療は、実験動物内またはエクスビボにおいて免疫反応を生じさせること、または抑制することを含んでいる。
【0092】
従って、治療は、本発明のあらゆる免疫賦活性組成物の免疫賦活的な量を、当業者に馴染みのある、あらゆる方法によって投与することを含んでおり、該方法は、一般的には経口経路、経皮経路、静脈注射、筋肉注射および皮下注射を含み、これ以外にも、腹腔内投与、体腔内投与、関節内投与、脳室内投与、髄腔内投与、局所投与、扁桃投与、粘膜投与、経皮投与、膣内投与および強制経口投与を含む。
【0093】
技術を有する実施者によって認識されているように、適切な投与方法を選択することは治療の有効性に寄与する可能性があり、そして、局所投与が、ある場合の適用には好まれる可能性がある。局所投与の許容される経路には、皮下、皮内、腹腔内、硝子体内、吸入または洗浄、経口、経鼻、および、所定の組織、器官、関節、腫瘍、または細胞集団へ向けられた注入が含まれる。例えば、粘膜のリンパ節あるいはパイエル板に粘膜を塗布または注入することは、かなりのIgAへのクラススイッチを伴う液性免疫反応を促進する可能性がある。あるいは、病変部位、病巣、または感染した体の部位を標的とする注入は、充実性腫瘍、局所感染、あるいはその他の免疫賦活を必要とする部位の治療に適用することができる。
【0094】
また、免疫系細胞(例えば、T細胞、B細胞、NK細胞、またはオリゴデンドロサイト)は、宿主から採取し、インビトロで処理することができる。処理された細胞をさらに、培養し、患者に(または異種宿主に)再導入することで、患者または宿主に免疫賦活をもたらすことができる。例えば、骨髄細胞は、患者から吸引し、HDRで処理することで、全体的な免疫または特異的な免疫を賦活することができる。そして、高線量放射線処理または同等の処理を、患者に残っている免疫細胞を破壊するために用いることができる。再移植すると、賦活された自己細胞は、患者において通常の免疫機能を回復するようになる。あるいは、ガンに冒されている患者から単離したNK細胞および/またはT細胞を、患者のガンに特異的な一つまたは複数の抗原にインビトロで曝すことができる。患者に再移植すると、抗原で賦活された細胞は、ガン細胞に抗する活発な細胞性免疫反応を展開するようになる。
【0095】
免疫賦活的な(有効な)量とは、患者における免疫反応を賦活することのできるワクチンの量を指し、病原の攻撃、アレルギー、あるいは免疫異常または免疫学的な病気を予防し、改善し、または治療するために十分な量である。免疫賦活的な量は、ワクチンによる事前の処理を受けていない患者に抗原が投与されたときに得られる反応と比べて、抗原の少なくとも一つのエピトープに対する液性免疫反応または細胞性免疫反応を測定できる程に高める量である。従って、例えば、免疫賦活的な量は、対象となる抗原エピトープに対する抗体の産生を促進すること、あるいは、病原性またはアレルギー性の攻撃に対する検出可能な防御効果を賦活すること、あるいは、対象となる抗原エピトープに対する防御的なCTL反応を促進することができる、抗原含有組成物の量を指す。
【0096】
免疫賦活的な量の本発明の抗原含有組成物による治療は、少なくとも一つの免疫系細胞またはそれらから派生した細胞株を含む宿主での免疫反応において、直接的、間接的、または統計的に観察可能もしくは測定可能な、あらゆる増加またはその他の所望の変化を引き起こすことを含んでおり、前記宿主には特に、エクスビボで組織を培養した宿主が含まれる。宿主の細胞は、ヒトまたは動物の末梢血、リンパ節などから派生させることができる。エクスビボで組織培養した宿主は、好ましくは、新鮮分離したT細胞、B細胞、マクロファージ、オリゴデンドロサイト、NK細胞、および単球を含み、これらのそれぞれは標準的な技術を用いて単離または精製することができる。観察可能あるいは測定可能な反応には、B細胞またはT細胞の増殖または活性化、抗体の分泌の増加、アイソタイプスイッチ、サイトカインの放出の増加、特に一つまたは複数のIL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−9、IL−10、IL−12、IL−13、GM−CSF、IFN−γ、TNF−α、TNF−β、GM−CSF、MIP−1α、MIP−1βまたはRANTESの放出の増加、特異抗原に対する抗体力価または親和性の増加、病原感染に関連する罹患率または死亡率の低下、ウイルス潜伏の促進、誘発、維持または強化、悪性および非悪性腫瘍の成長、転移、影響の抑制または緩和、そして、疾病または疾病の影響からの予防的防御をもたらすことが含まれる。
【0097】
免疫反応の抑制が望まれる場合、例えば自己免疫疾患またはアレルギーの治療では、効果的な量にはまた、治療すべき病気または病変に関連する反応を測定可能または観察可能に減少させるために十分な量が含まれる。
【0098】
投与すべき抗原含有組成物の量および投与頻度は経験的に決定することができ、治療する患者の年齢とサイズ、扱う病気または疾病を考慮に入れることになる。適切な容量は、接種材料につき0.01μgから100μgの範囲に収まるが、より多い、またはより少ない量が指示されることもある。二次的な追加免疫による免疫付与は、一週間から数ヶ月の間隔の後に行うことができる。
【0099】
以下の実施例は本発明のいくつかの実施態様を示している。当業者であれば、本発明の趣旨または範囲を変えることなく行うことができる、数々の変更および変形例が認識されるものである。これらの変更および変形例は、本発明の範囲に含まれていると考えられる。実施例はいかなる場合も本発明を限定するものではない。
【発明を実施するための最良の形態】
【0100】
以下の実験技術および試薬は、本発明のいくつかの非限定的な実施態様を示すために用いた。
【0101】
トランスジェニックマウス
【0102】
HLA−DR1を遺伝子導入したH−2クラスII−KOマウス(IAβb゜)を、リールのパスツール研究所において(Institut Pasteur of Lille)、HLA−DR1を遺伝子導入したマウス(Altmann、D.M.et al.、『J Exp Med』181、867−875(1995))とH−2クラスII−KOマウス(IAβb゜)(Rohrlich、P.S.et al.、『Int Immunol』15、765−772(2003))を交配して得た。キメラ一本鎖(HHD分子:HLA−A2.1のα1−α2ドメイン、H−2Dbのα3から細胞内ドメインまでが、そのN末端において、15のアミノ酸のペプチドリンカーによって、ヒトβ2mのC末端と結合している)を発現する、HLA−A2.1を遺伝子導入したマウスを作成した(Pascolo、S.et al.、『J Exp Med』185、2043−2051(1997))。HLA−A2.1(HHD)を遺伝子導入したH−2クラスI−KOマウスとHLA−DR1を遺伝子導入したH−2クラスII−KOマウス(IAβb゜)を異系交配し、後代を、HLA−A2.1+/-/HLA−DR1+/-の二つを遺伝子導入したH−2クラスI(β2m0)/クラスII(IAβ0)−KOマウスが得られるまで選別し、ここに記載された実験に使用した。HLA−A2.1+/-のみを遺伝子導入したH−2クラスI(β2m0)/クラスII(IAβ0)−KOマウスを防御分析における対照として使用した。マウスは、パリのパスツール研究所(Institut Pasteur、Paris)の動物施設で飼育し、全ての手順は、動物保護についてのフランスおよびヨーロッパの規制、および公衆衛生局の勧告を遵守するために、パスツール研究所の所轄局による調査を受けている。
【0103】
遺伝子型決定
【0104】
HLA−DRB1*0101、HLA−DRA*0101およびHLA−A*0201トランスジーンをPCRで検出した。100mMのNaCl、50mMのpH7.2であるTris−HCI、100mMのEDTA、1%のSDSおよび0.5mg/mlのプロテイナーゼKの中で、56℃で一晩インキュベートし、その後、250μlの飽和NaCl溶液を添加し、イソプロパノール沈殿を行った後、DNAの末尾部分を抽出した。標本を70%のエタノール中で洗浄し(×3)、150μlの、10mMのTris−HCI、1mMのpH8であるEDTAで再懸濁した。PCR条件は以下の通りである。1.5mMのMgCl2、1.25UのTaqポリメラーゼ、緩衝液は、製造業者(InVitrogen社、カリフォルニア州カールスバッド)によって提供されたものであり、1サイクル(7分、94℃)、40サイクル(30秒、94℃;30秒、60℃;1分、72℃)、1サイクル(4分、72℃)を行い、フォワードプライマーおよびリバースプライマーとして、HHDについては、5’CAT TGA GAC AGA GCG CTT GGC ACA GAA GCA G3’および5’GGA TGA CGT GAG TAA ACC TGA ATC TTT GGA GTA CGC 3’を用い、HLA−DRB1*0101については、5’TTC TTC AAC GGG ACG GAG CGG GTG 3’および5’CTG CAC TGT GAA GCT CTC ACC AAC 3’を用い、HLA−DRA*0101については、5’CTC CAA GCC CTC TCC CAG AG3’および5’ATG TGC CTT ACA GAG GCC CC 3’を用いた。
【0105】
FACS分析
【0106】
細胞の蛍光定量を、赤血球を除去した、Lympholite−M(Tebu−bio社、Le Perray en Yvelines、フランス)で精製した脾細胞について、FITCと結合したW6/32(抗HLA−ABC、Sigma社、ミズーリ州セントルイス)とビオチン化した抗28−8−6S(抗H−2Kb/Db、BD Biosciences社、カリフォルニア州サンディエゴ)m.Abを用いて行った。CD4+およびCD8+のTリンパ球を、PE標識CT−CD4抗マウスCD4(CALTAG社、カリフォルニア州南サンフランシスコ)とFITC標識53−6.7抗マウスCD8−m.Ab(BD Biosciences社)を用いて染色した。MHCクラスII分子の発現の分析を、MSカラム(Miltenyi Biotec社、ベルギッシュ・グラートバッハ、ドイツ)でポジティブセレクトしたB220+Bリンパ球について行った。2.4G2m.AbでFcレセプターが飽和した後、HLA−DR1およびH−2IAbの発現を、FITC標識L243(抗HLA−DR)およびPE標識AF6−120.1(抗H−2IAβb)m.Ab(BD Biosciences社)を用いて分析した。パラホルムアルデヒドで固定した細胞を、FACSCalibur(Becton Dickinson社、マサチューセッツ州ベッドフォード)で分析した。
【0107】
Immunoscope分析
【0108】
未処理マウスに由来するCD4+およびCD8+のT細胞を、Auto−Macs(Miltenyi Biotec社)でポジティブセレクトし、RNAを、RNA Easy Kit(Qiagen社、ヒルデン、ドイツ)を用いて調製し、cDNA合成に使用した。cDNAを、BVセグメントファミリーのそれぞれに特異的なフォワードプライマーと、二つのBCセグメントに共通のリバースプライマーを用いてPCR増幅した。PCR産物を、FAMをタグ付けした内部BCプライマーを用いて、ランオフで伸長した。ランオフした産物を、373A DNAシーケンサー(Perkin Elmer Applied Biosystem社、カリフォルニア州フォスターシティ)で分離する(7h、35W)ために、6%アクリルアミド/8M尿素ゲルにロードした。データを、Immunoscopeソフト(Pannetier、C.et al.、『Proc Natl Acad Sci USA』90、4319−4323(1993))を用いて分析した。
【0109】
ペプチド
【0110】
HLA−A2結合ペプチドのHBsAg348-357GLSPTVWLSVおよびHBsAg335-343WLSLLVPFV、H−2Kb結合ペプチドのHBsAg371-378ILSPFLPL、HLA−DR1結合ペプチドのHBsAg180-195QAGFFLLTRILTIPQS、H−2IAb結合ペプチドのHBsAg126-138RGLYFPAGGSSSG、ならびにpreS2ペプチドのHBsAg109-134MQWNSTTFHQTLQDPRVRGLYFPAGGは、Neosystem社(ストラスブール、フランス)によって合成されたものであり、PBS−10%のDMSOに1mg/mlの濃度で溶解した。ペプチドのアミノ酸配列のナンバリングは、HBVのaywサブタイプのpreS1領域の最初のメチオニンから開始している。
【0111】
HBVのS2−Sタンパク質をコードするDNAによる免疫付与
【0112】
ヒトCMV前初期遺伝子プロモーターの制御下で発現するHBVの表面抗原preS2およびSをコードしている、pCMV−S2.Sプラスミドベクター(Michel、M.L.et al.、『Proc Natl Acad Sci USA』92、5307−5311(1995))を、エンドトキシンフリーの条件の下、Plasmid Giga Kit(Qiagen社)のカラムで精製した。先行文献で説明されているように(Davis、H.L.、Michel、M.L.&Whalen、R.G.、『Hum Mol Genet』2、1847−1851(1993))、麻酔したマウスの再生前脛骨筋に注入した(各側に50μg)。
【0113】
T細胞増殖分析
最後の免疫付与から12日後、文献で説明されているように(Loirat、D.、Lemonnier、F.A.&Michel、M.L.、『J Immunol』165、4748−4755(2000))、赤血球を除去した、Ficollで精製した脾細胞(5×106細胞/25cm2培養フラスコ(Techno Plastic Products(TPP)、Trasadingen、スイス))を、ペプチドをパルスし(20μg/ml)、γ線を放射(180Gy)した、LPS幼若化細胞(5×106細胞/培養フラスコ)と、10%のFCS、10mMのHEPES、1mMのピルビン酸ナトリウム、5×10-5Mの2−メルカプトエタノール、100I×U/mlのペニシリンおよび100μgのストレプトマイシンを加えたRPMI培地で、共培養した。7日目、増殖分析のために、細胞を、ペプチドをパルスし、放射線照射したLPS幼弱化細胞(2×105細胞/ウェル)と、72時間、3%のFCSを加えたRPMI完全培地で平面培養した(平底の96ウェルマイクロプレート(TPP)に5×105細胞/ウェル)。細胞に、TOMTECコレクターを用いるfiltermates(Perkin Elmer Applied Biosystem社)で回収する前の16時間、ウェルあたり1μCiの(3H)−チミジンをパルスし、取り込まれた放射活性をマイクロβカウンター(Perkin Elmer Applied Biosystem社)で測定した。結果は、賦活指数(SI)=特異的ペプチドでのcpm/関連のないペプチドでのcpmで示した。
【0114】
CTL活性の測定
【0115】
増殖分析として、細胞毒性分析を、同一の免疫脾細胞群で行った。応答細胞(5×106細胞/25cm2培養フラスコ、TPP)と、刺激するための、ペプチドをパルスし(20μg/ml)、γ線を放射した(180Gy)LPS幼若化抗原細胞(5×106細胞/培養フラスコ)を、7日間にわたって、同様の添加RPMI培地の中で共培養した。細胞溶解活性を、10μg/mlの実験対象のペプチドまたは対照ペプチドをパルスしたRMA−S−HHD標的細胞について、標準的な4h51Crアッセイで試験した。%で示された特異的溶解は二段階で計算したのだが、該計算は、[実験対象の自然放出]/[最大の自然放出]×100から、対照ペプチドで見られる非特異的溶解を差し引いたものである。
【0116】
インビボでの抗体産生の測定
【0117】
DNAの注入前後の様々な時間に、マウスから、ヘパリン処理したガラスピペットを用いて、血液を球後穿刺によって採取し、遠心分離によって回収した血清を、抗HBsおよび抗preS2について、特異的ELISAによって分析した。HBVのsmallSタンパク質(1μg/ml)またはpreS2(120−145)合成ペプチド(1μg/ml)を含有する、精製した組換え粒子を、固相として用いた。10%のFCSを加えたPBST(0.1%のTween20を含有するPBS)でブロックした後、連続希釈を行った。よく洗浄した後、ホースラディッシュペルオキシダーゼ(Amersham社、Little Chalfont、イギリス)で標識した抗マウスIg(全IgG)で、結合抗体を検出した。抗体力価を、連続終末点希釈法によって測定した。マウスの血清は個別に試験し、力価は、少なくとも三つの測定値の平均とした。1/100未満まで血清を希釈した場合はネガティブであるとした。
【0118】
抗体力価測定
【0119】
免疫付与したマウスに由来する血清を個別に、ELISA(Michel、M.L.et al.、『Proc Natl Acad Sci USA』92、5307−5311(1995))によって、精製したHBVのmiddleタンパク質とsmallタンパク質またはpreS2合成HBs109-134ペプチドのいずれかについて分析した。0.1%のTween20と10%のFCSを加えた1×PBSでブロックし、洗浄(×3)した後、結合抗体を、ホースラディッシュペルオキシダーゼで標識した抗マウスIgG(Amersham社、Little Chalfont、イギリス)で検出した。抗体力価(少なくとも3回の測定の平均)は連続終末点希釈法によって測定した。1/100未満の力価はネガティブであるとした。
【0120】
ワクチン攻撃とプラークアッセイ
【0121】
DNAを注入したマウスは、HbsAgタンパク質(Smith、G.L.、Mackett、M.&Moss、B.、『Nature』302、490−495(1983))またはHBxタンパク質(Schek、N.、Bartenschlager、R.、Kuhn、C.&Schaller、H.、『Oncogene』6、1735−1744(1991))のいずれかを発現している、107PFUの組換えワクシニアウイルス(Western Reserve株)で、最後の注入から12日後に腹腔内を攻撃したのだが、HBsAgタンパク質を発現しているワクシニアウイルスとHBxタンパク質を発現しているワクシニアウイルスはそれぞれ、B.Moss博士とH.Schaller博士の好意によって提供されたものである。4日後、卵巣を、rVV力価について、BHK21細胞(Buller、R.M.&Wallace、G.D.、『Lab Anim Sci』35、473−476(1985))に対するプラークアッセイによって分析した。
【実施例1】
【0122】
MHC分子の細胞表面発現
HLA−A2.1、H−2Kb/Db、HLA−DR1およびH−2IAb分子の細胞表面発現を、フローサイトメトリー法によって、脾細胞で評価した。図1aに示されているように、類似したレベルのHLA−A2.1の発現が、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスで見られたのに対し、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスでは、HLA−A2.1は見られず、H−2Kb/Dbのみが発現した。HLA−DR1およびH−2IAbの細胞表面発現を、B220+に富んだB細胞で測定した。図1bに示されているように、類似したレベルのHLA−DR1の発現が、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスで見られたのに対し、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスでは全く発現が検出されなかった。しかし、遺伝子導入した分子(特にHLA−DR1)の細胞表面発現は、内因性のH−2クラスI分子およびクラスII分子の発現より低かった。
【実施例2】
【0123】
末梢CD4+T細胞およびCD8+T細胞
CD4+およびCD8+の脾臓T細胞の数を、図2aに示されているように、免疫染色分析およびフローサイトメトリー分析によって測定した。
【0124】
CD4+T細胞は、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスの両方において、脾細胞群の13%〜14%であった。対照的に、H−2クラスII−KOマウスでは、細胞の2%〜3%だけがCD4+であり(データは示されていない)、MHCクラスII分子を欠くマウスについての初期報告(Cosgrove、D.et al.、『Cell』66、1051−1066(1991))に一致する。期待された通り、遺伝子導入したHLA−A2.1分子の発現は、末梢CD8+T細胞群の割合を増加させ、β2ミクログロブリン(β2m)をKOした、MHCクラスIを欠いたマウスでは、0.6%〜1%であった(Pascolo、S.et al.、『J Exp Med』185、2043−2051(1997))のに対し、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスと、HLA−A2.1を遺伝子導入したH−2クラスI−KOマウスの両方においては、全脾細胞の2%〜3%に達した。
【0125】
実施例1および実施例2で示された結果は、
(1)HLA−A2+HLA−DR1+β2m゜IAβ゜マウスでは、HLA−A2分子の発現、H−2−Kb分子の非発現、CD8+末梢Tリンパ球の数、およびCD8+Tレパートリーの多様性が、概ねHLA−A2+β2m゜マウスに匹敵していること、
(2)HLA−A2+HLA−DR1+β2m゜IAβ゜マウスでは、HLA−DR1分子の発現、H−2−IAb分子の非発現、CD4+Tリンパ球の数、およびCD4+レパートリーの多様性が、概ねHLA−DR1+IAβ゜マウスに匹敵していること、そして、
(3)HLA−A2+HLA−DR1+β2m゜IAβ゜マウスが、HLA−A2+β2m゜マウスおよびHLA−DR1+IAβ゜マウスで見られる特徴的な利点の全てを有していること、
を示している。
【実施例3】
【0126】
TCRのBVセグメントの使用
一つのMHCクラスI分子と一つのMHCクラスII分子の存在により、TCRレパートリーの数と多様性を減少させることができるので、過去に記載されているように(Cochet、M.et al.、『Eur J Immunol』22、2639−2647(1992))、様々なBVファミリーの発現とCDR3の長さの多様性を、RT−PCRをベースとするimmunoscope技術によって、精製した脾細胞のCD4+またはCD8+のT細胞について研究した。ガウス分布に似た分布での大きなピークが、ほとんどのBVファミリー(分析した20のうち15)について、T細胞のCD8+群(図2b)およびCD4+群(図2c)の両方で見られた。抹消Tリンパ球で見られたこのようなグラフの特徴は、機能的に再配列したBVセグメントに典型的であり、一つ目のピークから次のピークまでに、CDR3亜領域の3ヌクレオチド長の変化を有する(Cochet、M.et al.、『Eur J Immunol』22、2639−2647(1992))。
【0127】
BV5.3および17で見られるような、展開(または大きく変化したグラフの特徴)がないことは、予想されていたことであるが、それは、これらの二つのBVセグメントがC57BL/6マウスにおいて偽遺伝子だからである(Wade、T.、Bill、J.、Marrack、P.C.、Palmer、E.&Kappler、J.W.、『J Immunol』141、2165−2167(1988);Chou、H.S.et al.、『Proc Natl Acad Sci USA』84、1992−1996(1987))。しかし、BV5.1、5.2および11のセグメントについて見られたグラフの変化は、対応するBV発現T細胞亜群が小さいことに起因している(該T細胞亜群はC57BL/6マウスでは5%より少なく、HLA−DR1を遺伝子導入したH−2クラスII−KOマウスではおよそ2%である)(データは示していない)。これらの事例以外では、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおけるCD4+およびCD8+のT細胞の両方が、それぞれ、非トランスジェニックC57BL/6マウスのパターンと類似した、TCRのBV鎖の使用とCDR3の多様性のパターンを示している。
【実施例4】
【0128】
機能的解析
AgHBs(B型肝炎ウイルスのエンベロープタンパク質)で免疫付与したHLA−A2+HLA−DR1+β2m゜IAβ゜マウスを分析した。図5は、HBsS2抗体の産生によって示される特異的液性免疫反応を示している。図6は、HBs348-357に対する、特異的なDR1拘束性CD4+T細胞の増殖反応を示している。そして図7は、HBs348-357またはHBs335-343に対する、特異的なHLA−A2拘束性CD8+細胞溶解性T細胞の反応を示している。
【0129】
これらの結果は、HLA−A2+HLA−DR1+β2m゜IAβ゜マウスによって、免疫付与した個体において、特異的液性免疫反応、CD4+Tヘルパー細胞のAg特異的HLA−DR1拘束性反応、そして、Ag特異的HLA−A2拘束性CD8+T細胞の細胞溶解反応を同時に分析することが可能になることを示している。
【0130】
これらのマウスから得られた追加データを以下の表1〜表3に示した。
【0131】
【表1】

【0132】
【表2】

【0133】
【表3】

【実施例5】
【0134】
HBsAg−DNAワクチンに対する免疫反応
HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの免疫学的潜在能力を評価するため、そして、それらの液性免疫反応、CD4+T細胞反応およびCD8+T細胞反応をヒトのものと比較するために、マウスを、HBsAg−DNAプラスミドで免疫付与した。このプラスミドは二つのB型肝炎ウイルスエンベロープタンパク質(middleであるpreS2/SおよびsmallであるS)をコードしており、該タンパク質は、B型肝炎表面抗原を有する粒子で自己組織化している。B型肝炎に対して現状で用いられているワクチンは、これらの二つのタンパク質を含んでいる。
【0135】
代表的なマウスについて図3aで示されているように、HBsAg特異的抗体は、HBsAg−DNAワクチンの注射後12日目に最初に検出し(図3a、上パネル)、これらの抗体の力価は、24日目まで増加した(二回目のDNA免疫付与の12日後、データは示していない)。この抗体の早期反応は、middleのHBVエンベロープタンパク質が有するpreS2−B細胞エピトープ(HBs109-134)とHBsAg粒子に対して特異的であり、HBsAg−DNAで免疫付与したマウス(Michel、M.L.et al.、『Proc Natl Acad Sci USA』92、5307−5311(1995))と、HBsAgをワクチン投与されたヒト(Moulia−Pelat、J.P.et al.、『Vaccine』12、499−502(1994))で報告された類似の反応に一致している。
【0136】
HBsAgに対するCD8+CTL反応を試験し、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの末梢におけるCD8+T細胞が、遺伝子導入したヒトのクラスI分子によって機能的に拘束されるかどうか判定した。HBVに感染したHLA−A2.1+のヒトでは、免疫的にドミナントなHLA−A2.1拘束性HBsAg特異的CTL反応が、HBsAg348-357ペプチド(Maini、M.K. et al.、『Gastroenterology』117、1386−1396(1999))およびHBsAg335-343ペプチド(Nayersina、R.et al.、『J Immunol』150、4659−4671(1993))に対して生じた(すなわち、複数のエピトープ反応が見られた)。C57BL/6マウスでは、H−2Kb拘束性HBsAg特異的CTL反応が、HBsAg371-378ペプチド(Schirmbeck、R.、Wild、J.&Reimann、J.、『Eur J Immunol』28、4149−4161(1998))に対して生じた。ヒト化したマウスがヒトのように反応することができるかどうかを評価するために、ここに記載したように、脾臓T細胞を7日間にわたって、関連ペプチド(HBsAg348-357、HLA−A2.1拘束性)または対照ペプチド(HBsAg371-378、H−2Kb拘束性、MAGE−3271-279、HLA−A2.1拘束性)のいずれかで再賦活した。図3a(中パネル)は、HBsAg−DNAによる免疫付与が強いHBsAg348-357特異的CTL反応を生じさせるが、HBsAg371-378ペプチドまたはMAGE−3271-279ペプチドのいずれに対する反応も生じさせなかったことを示している。
【0137】
このHLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスの末梢におけるCD4+T細胞が、遺伝子導入したヒトのクラスII分子によって機能的に拘束されるかどうかを判定するため、HBsAgタンパク質に対するCD4+T細胞反応を試験した。HBsAgをワクチン投与した、または、HBVに感染したHLA−DR1+のヒトでは、免疫的にドミナントなHLA−DR1拘束性HBsAg特異的CD4+T細胞反応が、HBsAg180-195ペプチド(Mm、W.P.et al.、『Hum Immunol』46、93−99(1996))に対して生じる。C57BL/6マウスでは、H−2IAb拘束性HBsAg特異的CD4+T細胞反応が、HBsAg126-138ペプチド(Milich、D.R.、『Semin Liver Dis』11、93−112(1991))に対して生じた。ヒト化したマウスをヒトおよび野生型マウスと比較するために、脾臓のT細胞を、関連ペプチド(HBsAg180-195、HLA−DR1拘束性)または対照ペプチド(HBsAg126-138、H−2IAb拘束性、HIV1Gag263-278、HLA−DR1拘束性)のいずれかでインビトロで再賦活した。図3a(下パネル)は、期待されたように、HLA−DR1拘束性HBsAg180-195ペプチドに対する強い増殖反応を示す一方、H−2IAb拘束性ペプチドは反応の賦活においては効果的ではなかった。同様に、HIV1Gag263-278ペプチドによっても反応は誘発されなかった。さらに、HBsAg180-195ペプチドによってさらにインビトロで再現したところ、特異的増殖指数が数倍増加した(データは示していない)。
【0138】
第一の、HBsAg−DNAで免疫付与した、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−マウスにおける、HBsAg特異的抗体反応、T細胞の増殖反応および細胞溶解性反応の発生と特異性については実証したが、同じ三つの反応について、さらに6頭のHBsAg−DNAで免疫付与したマウスと、対照である6頭の未処理のHLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスも、個別に試験した。図3bに示されているように、三つの反応は、試験した6頭の免疫付与したマウスでは同時に実証されたが、対照用の未処理マウスでは実証されなかった。興味深いことに、2頭の免疫付与したマウスは、HBsAg348-357およびHBsAg335-343のHLA−A2.1拘束性ペプチドの両方に対するCTL反応を示す能力があった(図3b、中パネル)。
【実施例6】
【0139】
防御分析
上記の実施例は、HLA−A2.1/HLA−DR1を遺伝子導入したH−2クラスI/クラスII−KOマウスにおける、HBsAg特異的液性免疫性の、CD4+およびCD8+T細胞反応の誘発を実証しており、また、該反応が、自然感染した、または、HBsAgをワクチン投与したヒトの反応と同一の、免疫的にドミナントなエピトープに対して生じることを示している。本実施例では、これらの反応がワクチン投与したマウスで防御を示すかどうかを試験した。マウスはHBVに対して寛容ではないため、HBsAgを遺伝子組換えしたワクシニアウイルス(rVV−HBsAg)をこれらの実験に用いた。マウスは、100μgのHBsAg−DNAで二回、筋肉内に免疫付与した。最後の免疫付与から12日後、マウスは、107PFUのrVV−HBsAgで、腹腔内を攻撃した。4日後、ウイルス力価を、既知の方法に従って測定し、rVVのPFU/卵巣で記録した(Buller、R.M.&Wallace、G.D.、『Lab Anim Sci』35、473−476(1985))。
【0140】
結果を図4に示した。HBsAg−DNAで免疫付与していない未処理マウスは、攻撃後にrVV−HBsAgが複製されていることを示した。対照的に、HBsAg−DNAで免疫付与したマウスにおけるウイルス力価は、4桁以上小さい値であった。これらの結果は、HBsAg−DNAでのワクチン投与が、rVV−HBsAgによる感染を制御する防御性のHBsAg特異的免疫反応を誘発することを強く示唆している。
【0141】
HBsAg−DNAのワクチン投与によって与えられる防御の特異性は、HBsAg−DNAで免疫付与したマウスを他のHBx遺伝子組換えVV(B型肝炎のxタンパク質をコードしている)で攻撃することで実証された。免疫付与していない対照と比べ、HBsAg−DNAで免疫付与したマウスでは、rVV−HBxの複製の減少は見られなかった。
【実施例7】
【0142】
HLA−DR1拘束性のCD4+T細胞は、抗体、ならびにウイルス感染に対するCTL反応および防御にとって重要である。
HLA−DR1拘束性ヘルパーTリンパ球がヒト化したマウスにおける抗体反応とCTL反応に寄与するかどうかを評価するために、免疫反応とウイルス感染効率を、一つ(HLA−A2.1)を遺伝子導入した、および二重(HLA−A2.1/HLA−DR1)に遺伝子導入した、H−2クラスI/クラスII−KOマウスにおいて比較した。表4に示されているように、強力なHBsAg348-357特異的CTL反応は、HLA−A2.1/HLA−DR1を二重に遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られたが、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスでは見られなかった。さらに、抗HBs抗体は、HBsAg−DNAをワクチン投与した、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスでは検出することができなかった。結果的に、HBsAg−DNAで免疫付与した、HLA−A2.1のみを遺伝子導入したH−2クラスI/クラスII−KOマウスは、rVV−HBsAgの感染に対して防御されなかった。
【0143】
【表4】

【0144】
本出願を通して引用されたすべての参考文献、特許文献および公開された特許出願の全内容は、参照することによってそれらの全体が本発明の一部を構成するものである。
【図面の簡単な説明】
【0145】
【図1a】表示されたトランスジェニック分子の細胞表面発現のフローサイトメトリー分析を示している。
【図1b】表示されたトランスジェニック分子の細胞表面発現のフローサイトメトリー分析を示している。
【図2a】表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。
【図2b】表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。
【図2c】表示された遺伝子型のマウスにおける、CD8+およびCD4+の脾臓T細胞の数およびBVセグメントの使用(immunoscope分析に基づく)を示している。
【図3a】HBs特異的抗体反応、細胞溶解反応および増殖反応を示している。
【図3b】HBs特異的抗体反応、細胞溶解反応および増殖反応を示している。
【図4】防御検定の結果を示している。
【図5】pcmvS2/Sによる免疫付与に従った、HLA−A2+DR1+CI-CII-マウスにおけるACの抗PreS2反応を示している。
【図6】pcmvS2−SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−DR1拘束性エピトープに対するCD4+T細胞の増殖反応を示している。
【図7】pcmvS2/SによるHLA−A2+DR1+CI-CII-マウスの免疫付与に従った、HLA−A2拘束性HBS(348−357)ペプチドに対する、CD8+T細胞の細胞傷害性反応を示している。
【図1】

【図2】

【図3】

【特許請求の範囲】
【請求項1】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、および
c)機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーン、
を含むトランスジェニックマウス。
【請求項2】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、
c)機能的なHLAクラスIトランスジーン、および、
d)機能的なHLAクラスIIトランスジーン、
を含むトランスジェニックマウス。
【請求項3】
HLAクラスIトランスジーンがHLA−A2トランスジーンであり、HLAクラスIIトランスジーンがHLA−DR1トランスジーンである、請求項2に記載のトランスジェニックマウス。
【請求項4】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項3に記載のトランスジェニックマウス。
【請求項5】
機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる、H−2クラスI分子とH−2クラスII分子の両方を欠いたトランスジェニックマウス。
【請求項6】
HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、請求項5に記載のトランスジェニックマウス。
【請求項7】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項6に記載のトランスジェニックマウス。
【請求項8】
候補抗原または候補抗原群における、特異的液性免疫反応、THのHLA−DR1拘束性反応、および/またはCTLのHLA−A2拘束性反応を生じさせる、一つまたは複数のエピトープの存否を同時に識別する方法であり、該方法が、
a)候補抗原または候補抗原群を請求項3または請求項6のマウスに投与すること、
b)マウスにおける、抗原に対する特異的液性免疫反応を分析すること、
c)マウスにおける、抗原に対するTHのHLA−DR1拘束性反応を分析すること、および、
d)マウスにおける、抗原に対するCTLのHLA−A2拘束性反応を分析することを含み、
該分析において、
−マウスにおいて抗原に対する特異的液性免疫反応が見られることによって、抗原における液性免疫反応を生じさせるエピトープが確認され、
−マウスにおいて抗原に対するTHのHLA−DR1拘束性反応が見られることによって、抗原におけるTHのHLA−DR1拘束性反応を生じさせるエピトープが確認され、
−マウスおいて抗原に対するCTLのHLA−A2拘束性反応が見られることによって、抗原におけるCTLのHLA−A2拘束性反応を生じさせるエピトープが確認される方法。
【請求項9】
さらにマウスにおける抗原に対するTh1特異的反応を分析することと、マウスにおける抗原に対するTh2特異的反応を分析することを含み、該分析において、
−マウスにおいて抗原に対するTh1特異的反応が見られることによって、マウスにおける抗原に対するTh1特異的反応を生じさせるエピトープが確認され、
−マウスにおいて抗原に対するTh2特異的反応が見られることによって、マウスにおける抗原に対するTh2特異的反応を生じさせるエピトープが確認される、請求項8に記載の方法。
【請求項10】
候補抗原または候補抗原群においてHLA−DR1拘束性ヘルパーT細胞エピトープの存否を識別する方法であり、該方法が、
a)候補抗原または候補抗原群を請求項3または請求項6のマウスに投与すること、そして、
b)マウスにおける、抗原に対するTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を分析することを含み、
該分析において、マウスにおいて抗原に対するTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応が見られることによって、抗原におけるTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープが確認される方法。
【請求項11】
請求項10に記載の方法で確認されるHLA−DR1拘束性ヘルパーT細胞エピトープを含む、単離された抗原。
【請求項12】
さらに、抗原が、液性免疫反応を生じさせるエピトープおよび/またはCTLのHLA−A2拘束性反応を生じさせるエピトープを含む、請求項11に記載の単離された抗原。
【請求項13】
HLA−DR1拘束性ヘルパーT細胞エピトープを含む抗原がポリペプチドを含んでいる、請求項11に記載の単離された抗原。
【請求項14】
HLA−DR1拘束性ヘルパーT細胞エピトープを含む抗原がポリヌクレオチドを含んでいる、請求項11に記載の単離された抗原。
【請求項15】
HLA−DR1拘束性ヘルパーT細胞エピトープを含む抗原が、DNA、RNA、またはDNAとRNAの両方を含んでいる、請求項14に記載の単離された抗原。
【請求項16】
候補抗原または候補抗原群におけるHLA−A2拘束性細胞傷害性T細胞(CTL)エピトープの存否を識別する方法であり、該方法が、
a)候補抗原または候補抗原群を請求項3または請求項6のマウスに投与すること、そして、
b)マウスにおける抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応を分析することを含む方法であり、
該分析において、マウスにおいて抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応が見られることによって、抗原または抗原群におけるHLA−A2拘束性細胞傷害性T細胞(CTL)反応を生じさせるエピトープが確認される方法。
【請求項17】
請求項16に記載の方法で確認されるHLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む、単離された抗原。
【請求項18】
さらに、抗原が、液性免疫反応を生じさせるエピトープおよび/またはTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープを含んでいる、請求項17に記載の単離された抗原。
【請求項19】
HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原がポリペプチドを含んでいる、請求項17に記載の単離された抗原。
【請求項20】
HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原がポリヌクレオチドを含んでいる、請求項17に記載の単離された抗原。
【請求項21】
HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原が、DNA、RNA、またはDNAとRNAの両方を含んでいる、請求項20に記載の単離された抗原。
【請求項22】
二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞反応の有効性を比較する方法であり、該方法が、
a)第一の候補ワクチンを請求項3または請求項6のマウスに投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応を測定すること、
b)第二の候補ワクチンを請求項3または請求項6のマウスに投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応を測定すること、
c)比較すべきさらなる候補ワクチンのそれぞれを請求項3または請求項6のマウスに投与し、比較すべきそれぞれのさらなる候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応を測定すること、そして、
d)比較すべき各候補ワクチンに対するヘルパーT細胞反応を互いに比較することで、ヘルパーT細胞反応を誘発する各候補ワクチンの有効性を判定することを含む方法。
【請求項23】
ヘルパーT細胞反応がHLA−DR1拘束性反応である、請求項22に記載の方法。
【請求項24】
二つまたは複数のワクチンによって誘発された細胞傷害性T細胞反応の有効性を比較する方法であり、該方法が、
a)第一の候補ワクチンを請求項3または請求項6のマウスに投与し、第一の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、
b)第二の候補ワクチンを請求項3または請求項6のマウスに投与し、第二の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、
c)比較すべきさらなる候補ワクチンのそれぞれを請求項3または請求項6のマウスに投与し、比較すべきさらなる候補ワクチンのそれぞれによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、そして、
d)比較すべき各ワクチンに対する細胞傷害性T細胞反応を互いに比較することで、細胞傷害性T細胞反応を誘発する各候補ワクチンの有効性を判定することを含む方法。
【請求項25】
細胞傷害性T細胞反応がHLA−A2拘束性反応である、請求項24に記載の方法。
【請求項26】
二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応の有効性を同時に比較する方法であり、該方法が、
a)第一の候補ワクチンを請求項3または請求項6のマウスに投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応を測定すること、
b)第二の候補ワクチンを請求項3または請求項6のマウスに投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応を測定すること、
c)比較すべきさらなる候補ワクチンのそれぞれを請求項3または請求項6のマウスに投与し、比較すべきさらなる候補ワクチンのそれぞれによってマウスにおいて誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応を測定すること、そして、
d)比較すべき各ワクチンに対するヘルパーT細胞反応と細胞傷害性T細胞反応を互いに比較することで、ヘルパーT細胞反応と細胞傷害性T細胞反応を誘発する各候補ワクチンの有効性を判定することを含む方法。
【請求項27】
ヘルパーT細胞反応がHLA−DR1拘束性反応であり、細胞傷害性T細胞反応がHLA−A2拘束性反応である、請求項26に記載の方法。
【請求項28】
抗原、または、一つもしくは複数の抗原を含むワクチンによる免疫付与の後に、マウスの液性免疫反応、ヘルパーT細胞反応および細胞傷害性T細胞反応を同時に判定する方法であり、該方法が、
a)抗原、または、一つもしくは複数の抗原を含むワクチンを、請求項3または請求項6のマウスに投与すること、
b)抗原、または、一つもしくは複数の抗原を含むワクチンに対する、マウスにおける特異的液性免疫反応を分析すること、
c)抗原、または、一つもしくは複数の抗原を含むワクチンに対する、マウスにおけるヘルパーT細胞反応を分析すること、そして、
d)抗原、または、一つもしくは複数の抗原を含むワクチンに対する、マウスにおける細胞傷害性T細胞反応を分析することを含む方法。
【請求項29】
ヘルパーT細胞反応がTHのHLA−DR1拘束性反応である、請求項28に記載の方法。
【請求項30】
細胞傷害性T細胞反応がCTLのHLA−A2拘束性反応である、請求項28に記載の方法。
【請求項31】
事前に選択された基準に基づき、二つまたはそれ以上の候補ワクチンの組成物をヒトへ投与するために最適化する方法であり、該方法が、
−請求項28に従って、二つまたはそれ以上の候補ワクチンの組成物で免疫付与した後、マウスの液性免疫反応、ヘルパーT細胞反応および細胞傷害性T細胞反応を同時に判定すること、そして、
−事前に選択された基準を結果に適用することで、最適化されたワクチンを選択することを含む方法。
【請求項32】
二つまたはそれ以上の候補ワクチンが、ワクチン中に存在するアジュバントに対する抗原の割合においてのみ異なっている、請求項31に記載の方法。
【請求項33】
二つまたはそれ以上の候補ワクチンが、ワクチン中に存在するアジュバントのタイプにおいてのみ異なっている、請求項31に記載の方法。
【請求項34】
ヒトに投与されるとき、ワクチンが自己免疫疾患を誘発する危険性を有するか否かを判定する方法であり、該方法が、
a)ワクチンを請求項3または請求項6のマウスに投与すること、そして、
b)マウスにおける自己免疫反応を分析することを含んでおり、該分析において、
マウスにおいて自己免疫反応が見られることによって、ワクチンがヒトに投与されたときに自己免疫疾患を誘発する危険性を有することが示される方法。
【請求項35】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、および、
c)機能的なHLAクラスIまたはクラスIIのトランスジーン、
を含む、単離されたトランスジェニックマウスの細胞。
【請求項36】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、
c)機能的なHLAクラスIトランスジーン、および、
d)機能的なHLAクラスIIトランスジーン、
を含む、単離されたトランスジェニックマウスの細胞。
【請求項37】
HLAクラスIトランスジーンがHLA−A2トランスジーンであり、HLAクラスIIトランスジーンがHLA−DR1トランスジーンである、請求項36に記載のトランスジェニックマウスの細胞。
【請求項38】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項37に記載のトランスジェニックマウスの細胞。
【請求項39】
H−2クラスI分子およびH−2クラスII分子の両方を欠き、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる、単離されたトランスジェニックマウスの細胞。
【請求項40】
HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、請求項39に記載のトランスジェニックマウスの細胞。
【請求項41】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項40に記載のトランスジェニックマウスの細胞。
【請求項1】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、および
c)機能的なHLAクラスIトランスジーンまたはクラスIIトランスジーン、
を含むトランスジェニックマウス。
【請求項2】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、
c)機能的なHLAクラスIトランスジーン、および、
d)機能的なHLAクラスIIトランスジーン、
を含むトランスジェニックマウス。
【請求項3】
HLAクラスIトランスジーンがHLA−A2トランスジーンであり、HLAクラスIIトランスジーンがHLA−DR1トランスジーンである、請求項2に記載のトランスジェニックマウス。
【請求項4】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項3に記載のトランスジェニックマウス。
【請求項5】
機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる、H−2クラスI分子とH−2クラスII分子の両方を欠いたトランスジェニックマウス。
【請求項6】
HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、請求項5に記載のトランスジェニックマウス。
【請求項7】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項6に記載のトランスジェニックマウス。
【請求項8】
候補抗原または候補抗原群における、特異的液性免疫反応、THのHLA−DR1拘束性反応、および/またはCTLのHLA−A2拘束性反応を生じさせる、一つまたは複数のエピトープの存否を同時に識別する方法であり、該方法が、
a)候補抗原または候補抗原群を請求項3または請求項6のマウスに投与すること、
b)マウスにおける、抗原に対する特異的液性免疫反応を分析すること、
c)マウスにおける、抗原に対するTHのHLA−DR1拘束性反応を分析すること、および、
d)マウスにおける、抗原に対するCTLのHLA−A2拘束性反応を分析することを含み、
該分析において、
−マウスにおいて抗原に対する特異的液性免疫反応が見られることによって、抗原における液性免疫反応を生じさせるエピトープが確認され、
−マウスにおいて抗原に対するTHのHLA−DR1拘束性反応が見られることによって、抗原におけるTHのHLA−DR1拘束性反応を生じさせるエピトープが確認され、
−マウスおいて抗原に対するCTLのHLA−A2拘束性反応が見られることによって、抗原におけるCTLのHLA−A2拘束性反応を生じさせるエピトープが確認される方法。
【請求項9】
さらにマウスにおける抗原に対するTh1特異的反応を分析することと、マウスにおける抗原に対するTh2特異的反応を分析することを含み、該分析において、
−マウスにおいて抗原に対するTh1特異的反応が見られることによって、マウスにおける抗原に対するTh1特異的反応を生じさせるエピトープが確認され、
−マウスにおいて抗原に対するTh2特異的反応が見られることによって、マウスにおける抗原に対するTh2特異的反応を生じさせるエピトープが確認される、請求項8に記載の方法。
【請求項10】
候補抗原または候補抗原群においてHLA−DR1拘束性ヘルパーT細胞エピトープの存否を識別する方法であり、該方法が、
a)候補抗原または候補抗原群を請求項3または請求項6のマウスに投与すること、そして、
b)マウスにおける、抗原に対するTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を分析することを含み、
該分析において、マウスにおいて抗原に対するTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応が見られることによって、抗原におけるTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープが確認される方法。
【請求項11】
請求項10に記載の方法で確認されるHLA−DR1拘束性ヘルパーT細胞エピトープを含む、単離された抗原。
【請求項12】
さらに、抗原が、液性免疫反応を生じさせるエピトープおよび/またはCTLのHLA−A2拘束性反応を生じさせるエピトープを含む、請求項11に記載の単離された抗原。
【請求項13】
HLA−DR1拘束性ヘルパーT細胞エピトープを含む抗原がポリペプチドを含んでいる、請求項11に記載の単離された抗原。
【請求項14】
HLA−DR1拘束性ヘルパーT細胞エピトープを含む抗原がポリヌクレオチドを含んでいる、請求項11に記載の単離された抗原。
【請求項15】
HLA−DR1拘束性ヘルパーT細胞エピトープを含む抗原が、DNA、RNA、またはDNAとRNAの両方を含んでいる、請求項14に記載の単離された抗原。
【請求項16】
候補抗原または候補抗原群におけるHLA−A2拘束性細胞傷害性T細胞(CTL)エピトープの存否を識別する方法であり、該方法が、
a)候補抗原または候補抗原群を請求項3または請求項6のマウスに投与すること、そして、
b)マウスにおける抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応を分析することを含む方法であり、
該分析において、マウスにおいて抗原または抗原群に対するHLA−A2拘束性細胞傷害性T細胞(CTL)反応が見られることによって、抗原または抗原群におけるHLA−A2拘束性細胞傷害性T細胞(CTL)反応を生じさせるエピトープが確認される方法。
【請求項17】
請求項16に記載の方法で確認されるHLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む、単離された抗原。
【請求項18】
さらに、抗原が、液性免疫反応を生じさせるエピトープおよび/またはTHのHLA−DR1拘束性ヘルパーT細胞エピトープ反応を生じさせるエピトープを含んでいる、請求項17に記載の単離された抗原。
【請求項19】
HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原がポリペプチドを含んでいる、請求項17に記載の単離された抗原。
【請求項20】
HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原がポリヌクレオチドを含んでいる、請求項17に記載の単離された抗原。
【請求項21】
HLA−A2拘束性細胞傷害性T細胞(CTL)エピトープを含む抗原が、DNA、RNA、またはDNAとRNAの両方を含んでいる、請求項20に記載の単離された抗原。
【請求項22】
二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞反応の有効性を比較する方法であり、該方法が、
a)第一の候補ワクチンを請求項3または請求項6のマウスに投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応を測定すること、
b)第二の候補ワクチンを請求項3または請求項6のマウスに投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応を測定すること、
c)比較すべきさらなる候補ワクチンのそれぞれを請求項3または請求項6のマウスに投与し、比較すべきそれぞれのさらなる候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応を測定すること、そして、
d)比較すべき各候補ワクチンに対するヘルパーT細胞反応を互いに比較することで、ヘルパーT細胞反応を誘発する各候補ワクチンの有効性を判定することを含む方法。
【請求項23】
ヘルパーT細胞反応がHLA−DR1拘束性反応である、請求項22に記載の方法。
【請求項24】
二つまたは複数のワクチンによって誘発された細胞傷害性T細胞反応の有効性を比較する方法であり、該方法が、
a)第一の候補ワクチンを請求項3または請求項6のマウスに投与し、第一の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、
b)第二の候補ワクチンを請求項3または請求項6のマウスに投与し、第二の候補ワクチンによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、
c)比較すべきさらなる候補ワクチンのそれぞれを請求項3または請求項6のマウスに投与し、比較すべきさらなる候補ワクチンのそれぞれによってマウスにおいて誘発された細胞傷害性T細胞反応を測定すること、そして、
d)比較すべき各ワクチンに対する細胞傷害性T細胞反応を互いに比較することで、細胞傷害性T細胞反応を誘発する各候補ワクチンの有効性を判定することを含む方法。
【請求項25】
細胞傷害性T細胞反応がHLA−A2拘束性反応である、請求項24に記載の方法。
【請求項26】
二つまたはそれ以上のワクチンによって誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応の有効性を同時に比較する方法であり、該方法が、
a)第一の候補ワクチンを請求項3または請求項6のマウスに投与し、第一の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応を測定すること、
b)第二の候補ワクチンを請求項3または請求項6のマウスに投与し、第二の候補ワクチンによってマウスにおいて誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応を測定すること、
c)比較すべきさらなる候補ワクチンのそれぞれを請求項3または請求項6のマウスに投与し、比較すべきさらなる候補ワクチンのそれぞれによってマウスにおいて誘発されたヘルパーT細胞反応と細胞傷害性T細胞反応を測定すること、そして、
d)比較すべき各ワクチンに対するヘルパーT細胞反応と細胞傷害性T細胞反応を互いに比較することで、ヘルパーT細胞反応と細胞傷害性T細胞反応を誘発する各候補ワクチンの有効性を判定することを含む方法。
【請求項27】
ヘルパーT細胞反応がHLA−DR1拘束性反応であり、細胞傷害性T細胞反応がHLA−A2拘束性反応である、請求項26に記載の方法。
【請求項28】
抗原、または、一つもしくは複数の抗原を含むワクチンによる免疫付与の後に、マウスの液性免疫反応、ヘルパーT細胞反応および細胞傷害性T細胞反応を同時に判定する方法であり、該方法が、
a)抗原、または、一つもしくは複数の抗原を含むワクチンを、請求項3または請求項6のマウスに投与すること、
b)抗原、または、一つもしくは複数の抗原を含むワクチンに対する、マウスにおける特異的液性免疫反応を分析すること、
c)抗原、または、一つもしくは複数の抗原を含むワクチンに対する、マウスにおけるヘルパーT細胞反応を分析すること、そして、
d)抗原、または、一つもしくは複数の抗原を含むワクチンに対する、マウスにおける細胞傷害性T細胞反応を分析することを含む方法。
【請求項29】
ヘルパーT細胞反応がTHのHLA−DR1拘束性反応である、請求項28に記載の方法。
【請求項30】
細胞傷害性T細胞反応がCTLのHLA−A2拘束性反応である、請求項28に記載の方法。
【請求項31】
事前に選択された基準に基づき、二つまたはそれ以上の候補ワクチンの組成物をヒトへ投与するために最適化する方法であり、該方法が、
−請求項28に従って、二つまたはそれ以上の候補ワクチンの組成物で免疫付与した後、マウスの液性免疫反応、ヘルパーT細胞反応および細胞傷害性T細胞反応を同時に判定すること、そして、
−事前に選択された基準を結果に適用することで、最適化されたワクチンを選択することを含む方法。
【請求項32】
二つまたはそれ以上の候補ワクチンが、ワクチン中に存在するアジュバントに対する抗原の割合においてのみ異なっている、請求項31に記載の方法。
【請求項33】
二つまたはそれ以上の候補ワクチンが、ワクチン中に存在するアジュバントのタイプにおいてのみ異なっている、請求項31に記載の方法。
【請求項34】
ヒトに投与されるとき、ワクチンが自己免疫疾患を誘発する危険性を有するか否かを判定する方法であり、該方法が、
a)ワクチンを請求項3または請求項6のマウスに投与すること、そして、
b)マウスにおける自己免疫反応を分析することを含んでおり、該分析において、
マウスにおいて自己免疫反応が見られることによって、ワクチンがヒトに投与されたときに自己免疫疾患を誘発する危険性を有することが示される方法。
【請求項35】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、および、
c)機能的なHLAクラスIまたはクラスIIのトランスジーン、
を含む、単離されたトランスジェニックマウスの細胞。
【請求項36】
a)破壊されたH−2クラスI遺伝子、
b)破壊されたH−2クラスII遺伝子、
c)機能的なHLAクラスIトランスジーン、および、
d)機能的なHLAクラスIIトランスジーン、
を含む、単離されたトランスジェニックマウスの細胞。
【請求項37】
HLAクラスIトランスジーンがHLA−A2トランスジーンであり、HLAクラスIIトランスジーンがHLA−DR1トランスジーンである、請求項36に記載のトランスジェニックマウスの細胞。
【請求項38】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項37に記載のトランスジェニックマウスの細胞。
【請求項39】
H−2クラスI分子およびH−2クラスII分子の両方を欠き、機能的なHLAクラスIトランスジーンと機能的なHLAクラスIIトランスジーンを含んでいる、単離されたトランスジェニックマウスの細胞。
【請求項40】
HLA−A2+HLA−DR1+β2m゜IAβ゜という遺伝子型を有する、請求項39に記載のトランスジェニックマウスの細胞。
【請求項41】
HLA−A2トランスジーンがシーケンスリストに掲載されたHLA−A2の配列を含み、HLA−DR1トランスジーンがシーケンスリストに掲載されたHLA−DR1の配列を含んでいる、請求項40に記載のトランスジェニックマウスの細胞。
【図4】


【図5】


【図6】


【図7】




【図5】


【図6】


【図7】


【公表番号】特表2006−528000(P2006−528000A)
【公表日】平成18年12月14日(2006.12.14)
【国際特許分類】
【出願番号】特願2006−521684(P2006−521684)
【出願日】平成16年7月5日(2004.7.5)
【国際出願番号】PCT/IB2004/002374
【国際公開番号】WO2005/004592
【国際公開日】平成17年1月20日(2005.1.20)
【出願人】(500355190)
【Fターム(参考)】
【公表日】平成18年12月14日(2006.12.14)
【国際特許分類】
【出願日】平成16年7月5日(2004.7.5)
【国際出願番号】PCT/IB2004/002374
【国際公開番号】WO2005/004592
【国際公開日】平成17年1月20日(2005.1.20)
【出願人】(500355190)

【Fターム(参考)】
[ Back to top ]

