モノクローナル抗体、並びに、ハイブリドーマ
【課題】ヒト由来エンドセリン受容体タイプB(hETBR)に対する新規のモノクローナル抗体を提供する。
【解決手段】ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応するモノクローナル抗体が提供される。エンドセリン受容体タイプBとナチュラルリガンドとの結合を阻害することができるもの、エンドセリン受容体タイプBが有するナチュラルリガンド特異的なシグナル伝達を阻害することができるものであることが好ましい。当該モノクローナル抗体を産生するハイブリドーマとして、受託番号がFERM P−21961であるハイブリドーマも提供される。
【解決手段】ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応するモノクローナル抗体が提供される。エンドセリン受容体タイプBとナチュラルリガンドとの結合を阻害することができるもの、エンドセリン受容体タイプBが有するナチュラルリガンド特異的なシグナル伝達を阻害することができるものであることが好ましい。当該モノクローナル抗体を産生するハイブリドーマとして、受託番号がFERM P−21961であるハイブリドーマも提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はモノクローナル抗体、並びに、ハイブリドーマに関し、さらに詳細には、ヒト由来エンドセリン受容体タイプBに対する新規のモノクローナル抗体、並びに、当該モノクローナル抗体を産生するハイブリドーマに関する。
【背景技術】
【0002】
細胞表面上の膜受容体タンパク質は、細胞外の情報を細胞内へ伝達する極めて重要な働きをしている。そのため、膜受容体タンパク質に結合する物質はアゴニスト型医薬品やアンタゴニスト型医薬として候補物質となる。膜受容体タンパク質の中でも特にGタンパク質共役型受容体(G protein-coupled receptor;GPCR)は、現在市販されている低分子医薬品の約半数がこの受容体を標的としているため、医薬品開発において極めて注目を集めている。また、GPCRの約半数が、生体内で機能しているナチュラルリガンドが同定されていないオーファンGPCRであり、ナチュラルリガンドやその類縁化合物が新規医薬品の候補物質として期待されていることから、オーファンGPCRに対するリガンドのスクリーニングが熾烈を極めている。
【0003】
GPCRは、細胞膜を7回貫通し、そのN末端を細胞外に、C末端を細胞内に向けて存在している。すなわち、GPCRの細胞外ドメインは、N末端ドメイン、細胞外第1ループ、細胞外第2ループ、および細胞外第3ループから構成されている。同様に、GPCRの細胞内ドメインは、細胞内第1ループ、細胞内第2ループ、細胞内第3ループ、およびC末端ドメインから構成されている。
【0004】
エンドセリン(endothelin;ET)は21個のアミノ酸残基からなるペプチドであり、強力な血管収縮作用を有することが知られている。エンドセリンにはET−1、ET−2、ET−3の3種類のアイソフォームが見出されている。一方、エンドセリンに特異的に結合する受容体がエンドセリン受容体(endothelin receptor)である。エンドセリン受容体にはエンドセリン受容体タイプA(ETAR)とエンドセリン受容体タイプB(ETBR)の2種類が見出されており、ETARはET−1とET−2に対する強い結合性を示し、ETBRは3種類のETに対して同程度の結合性を示す。
【0005】
エンドセリン受容体はGPCRの一種であり、細胞膜を7回貫通する構造を有している。ヒト由来エンドセリン受容体タイプB(以下、「hETBR」と略記することがある。)の1次構造はすでに解明されており、そのN末端ドメイン、各細胞外ドメイン、各細胞内ドメイン、およびC末端ドメインに相当する部位も特定されている。
【0006】
エンドセリン受容体のアンタゴニストは、エンドセリンが関与する種々の疾病の治療薬となる可能性があり、新規アンタゴニストの探索が盛んに行われている(例えば、非特許文献1,2)。例えば、当該アンタゴニストは血管弛緩を抑える作用を有することが予想され、昇圧剤となる可能性がある。また、さまざまな癌の増殖・浸潤を抑える抗癌剤となる可能性がある。一方で、受容体に対する抗体をアンタゴニストとして応用することも一般に試みられており(アンタゴニスト抗体)、エンドセリン受容体タイプBに対する抗体が昇圧剤や抗癌剤となる可能性もある。
【0007】
現在、ヒト由来エンドセリン受容体タイプBに対する抗体としては、ポリクローナル抗体がすでに取得され、一部は市販もされている。一方、モノクローナル抗体に関しては、hETBRの1次構造のみを特異的に認識するものが取得されている(非特許文献3)。しかし、ポリクローナル抗体とモノクローナル抗体のいずれにおいても、hETBRの細胞外ドメインを特異的に認識するもの、例えば細胞外ドメインの立体構造を特異的に認識するものは取得されていない。したがって、hETBRとナチュラルリガンド(ET−1、ET−2、ET−3等)との結合やシグナル伝達を阻害することができる抗体も取得されていない。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】エンドクライン−リレイテッド・キャンサー(Endocrine-Related Cancer),2007年,第14巻,p.233−244
【非特許文献2】ジャーナル・オブ・トランスレイショナル・メディスン(Journal of translational Medicine),2004年,第2巻,16号,1−9
【非特許文献3】プロス・ワン(PloS ONE),2010年,第5巻,第6号,e11241,
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、新たな医薬品開発等に有用なヒト由来エンドセリン受容体タイプBに対する新規のモノクローナル抗体、並びに、当該モノクローナル抗体を産生するハイブリドーマを提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、分子シャペロンの一種であるシャペロニンをコードする遺伝子とヒト由来エンドセリン受容体タイプBをコードする遺伝子との融合遺伝子を用いて、マウスに遺伝子免疫を施し、ヒト由来エンドセリン受容体タイプBに対する免疫応答を誘導した。そして、当該マウスの脾臓細胞とミエローマとを融合させてハイブリドーマの集団を作製し、hETBRの細胞外ドメインを特異的に認識するモノクローナル抗体を産生するハイブリドーマを検索した。その結果、1種のクローンを選抜することに成功した。そして、当該ハイブリドーマから所望のモノクローナル抗体を取得することに成功し、本発明を完成した。本発明の要旨は以下のとおりである。
【0011】
請求項1に記載の発明は、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応するモノクローナル抗体である。
【0012】
本発明はヒト由来エンドセリン受容体タイプB(hETBR)に対するモノクローナル抗体(以下、「抗hETBRモノクローナル抗体」と略記することがある。)に係るものである。本発明のモノクローナル抗体は、hETBRの細胞外ドメインに対して特異的に反応する。換言すれば、hETBRの1次構造のみを認識するものではなく、hETBRの細胞内ドメインのみに反応するものでもない。本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の治療薬開発に有用である。また、本発明のモノクローナル抗体は、エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の診断や、エンドセリン受容体タイプBの免疫測定法の構築にも有用である。
【0013】
請求項2に記載の発明は、前記細胞外ドメインの立体構造を認識するものである請求項1に記載のモノクローナル抗体である。
【0014】
本発明のモノクローナル抗体は、細胞外ドメインの立体構造を認識するものである。換言すれば、細胞外ドメインの1次構造のみを認識するものではない。かかる構成により、hETBRのアンタゴニスト抗体として特に好適なモノクローナル抗体が提供される。なお、立体構造を保持した細胞外ドメインは、天然(native)のhETBR(活性型hETBR)の細胞外ドメインが該当し、例えば、生きた細胞の表面上に存在する。
【0015】
請求項1又は2に記載のモノクローナル抗体において、前記細胞外ドメインは、N末端ドメイン、細胞外第1ループ、細胞外第2ループ、又は細胞外第3ループである構成が好ましい(請求項3)。
【0016】
請求項1〜3のいずれかに記載のモノクローナル抗体において、以下の性質を有する構成が好ましい(請求項4)。
(a)ヒト由来エンドセリン受容体タイプBに反応し、ヒト由来エンドセリン受容体タイプAには実質的に反応しない
(b)ヒト由来エンドセリン受容体タイプBに反応し、マウス由来エンドセリン受容体タイプBとラット由来エンドセリン受容体タイプBのいずれにも実質的に反応しない。
【0017】
請求項1〜4のいずれかに記載のモノクローナル抗体において、サブクラスがマウスIgG2aであり、軽鎖がκ鎖である構成が好ましい(請求項5)。
【0018】
請求項6に記載の発明は、エンドセリン受容体タイプBとナチュラルリガンドとの結合を阻害することができる請求項1〜5のいずれかに記載のモノクローナル抗体である。
【0019】
また請求項7に記載の発明は、エンドセリン受容体タイプBが有するナチュラルリガンド特異的なシグナル伝達を阻害することができる請求項1〜6のいずれかに記載のモノクローナル抗体である。
【0020】
かかる構成により、ヒト由来エンドセリン受容体タイプBに対するアンタゴニストとして使用可能なモノクローナル抗体が提供される。
【0021】
請求項8に記載の発明は、受託番号がFERM P−21961であるハイブリドーマにより産生される、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体である。
【0022】
また請求項9に記載の発明は、請求項8に記載のモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体である。
【0023】
本発明のモノクローナル抗体は、hETBRの細胞外ドメインに対して特異的に反応する。換言すれば、hETBRの1次構造のみを認識するものではなく、hETBRの細胞内ドメインのみに反応するものでもない。本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の治療薬開発に有用である。また、本発明のモノクローナル抗体は、エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の診断や、エンドセリン受容体タイプBの免疫測定法の構築にも有用である。
【0024】
請求項10に記載の発明は、受託番号がFERM P−21961であるハイブリドーマである。
【0025】
本発明のハイブリドーマを用いることにより、上記した本発明のモノクローナル抗体を生産することができる。例えば、その培養物から本発明のモノクローナル抗体を取得することができる。
【発明の効果】
【0026】
本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の治療薬開発に有用である。また、エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の診断や、エンドセリン受容体タイプBの免疫測定法の構築にも有用である。
【0027】
本発明のハイブリドーマによれば、その培養物から本発明のモノクローナル抗体を取得することができる。
【図面の簡単な説明】
【0028】
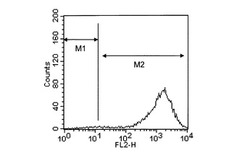
【図1】hETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【図2】hETAR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【図3】対照の細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【図4】hB07抗体溶液と共にインキュベートしたhETBR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真である。
【図5】hB07抗体溶液と共にインキュベートしたhETAR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真である。
【図6】細胞内Ca2+濃度と各添加物の濃度との関係を表すグラフである。
【図7】(a)はマウス由来ETBR(mETBR)遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラム、(b)はラット由来ETBR(rETBR)遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【発明を実施するための形態】
【0029】
まず、ヒト由来エンドセリン受容体タイプB(hETBR)の構造について説明する。
前述したように、hETBRはGタンパク質共役型受容体(GPCR)の一種であり、細胞膜を7回貫通し、そのN末端を細胞外に、C末端を細胞内に向けて存在している。hETBRをコードする遺伝子(cDNA)はすでに単離されており、hETBRのアミノ酸配列も知られている。配列番号3にhETBR遺伝子の塩基配列と該塩基配列に対応するアミノ酸配列を、配列番号4にアミノ酸配列のみを示す。
【0030】
hETBRの疎水性モデルにより一般的に考えられている構造によれば、hETBRの各ドメインは、配列番号4に示すアミノ酸配列における以下の部分に相当する。左側がアミノ酸番号、右側が各ドメインである。なお、異種動物間で細胞外ドメイン(N末端ドメイン、細胞外第1ループ、細胞外第2ループ、細胞外第3ループ)のアミノ酸配列を比較すると、N末端ドメインの相同性は低く、各ループの相同性は高いことがわかっている。
【0031】
1〜 27:膜移行シグナルペプチド配列(発現後に切断・除去される)
28〜 99:N末端ドメイン
123〜137:細胞内第1ループ
161〜172:細胞外第1ループ
196〜220:細胞内第2ループ
244〜276:細胞外第2ループ
300〜324:細胞内第3ループ
348〜357:細胞外第3ループ
381〜442:C末端ドメイン
【0032】
本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応する。本発明のモノクローナル抗体を製造する方法としては、公知の方法をそのまま採用することができ、例えばケーラーとミルシュタインの細胞融合法を基礎として製造することができる。概説すれば、hETBRに対する免疫応答が誘導されたマウス等の動物の脾臓細胞とミエローマとを融合してハイブリドーマの集団を作製し、該ハイブリドーマの集団から所望のモノクローナル抗体を産生するものを選抜する。そして、選抜したハイブリドーマを培養し、その培養物から所望のモノクローナル抗体を単離・精製することができる。
【0033】
hETBRに対する免疫応答を誘導する方法としては、動物にhETBR(タンパク質)を接種する一般的なタンパク免疫の手法によってもよいが、動物にhETBR遺伝子を投与する遺伝子免疫の手法が好ましく用いられる。
【0034】
すなわち、hETBRは膜タンパク質であるので、全長のhETBRを免疫原として使用することは一般に難しい。そこで、タンパク免疫をもってhETBRの細胞外ドメインに対する免疫応答を誘導したい場合には、細胞外ドメインのペプチドを免疫原として用いることとなる。しかし、細胞外ドメインは異種生物間で相同性が高く、構造が複雑なため、当該ペプチドを免疫原に用いても十分な免疫応答を誘導することができないことがある。結局、タンパク免疫によって細胞外ドメインに対する免疫応答を十分に誘導することは難しい。
【0035】
一方、遺伝子免疫によれば、hETBRの全長をコードする遺伝子を用いることにより、全長のhETBRを免疫原に用いたのと同様の状況を作り出すことができる。さらに、発現したhETBRが動物体内で天然(native)の状態(活性型の状態)で存在できるので、hETBRの立体構造に特異的な免疫応答を誘導することが可能となる。また遺伝子免疫の手法によれば、hETBR遺伝子さえ入手できれば行うことができ、精製されたhETBRを準備する必要がない。
【0036】
ただしこの場合でも、hETBRにおいては異種動物間の相同性が比較的高いことには変わりがないため、細胞外ドメインに対する免疫応答を十分に誘導することは難しい。従来、hETBRに対する抗体に関して、ウェスタンブロッティング用抗体のような1次構造のみを認識するものしか取得されていないのは、これが原因の1つと考えられる。そこで、動物に接種する遺伝子として、シャペロニンをコードする遺伝子とhETBRをコードする遺伝子との融合遺伝子を用いる。当該融合遺伝子を免疫原として用いることにより、hETBR遺伝子を単独で用いる場合よりも細胞外ドメインに対する免疫応答をより強く誘導することができる。当該融合遺伝子を用いた遺伝子免疫の方法については、国際公開第2006/041157号パンフレットにその詳細が記載されている。
【0037】
シャペロニンは分子シャペロンの一種であり、バクテリア、古細菌、真核生物等の全ての生物に存在している。特に、バクテリアの細胞質、真核細胞のミトコンドリア、葉緑体に多量に存在している。シャペロニンは、タンパク質の折り畳みを促進する活性やタンパク質の変性を阻止する活性を有する。シャペロニンは、分子量約6万のシャペロニンサブユニット(HSP60ともいう)7〜9個からなるリング状構造体が2個重なった、総分子量80万〜100万程度のシリンダー状の巨大な複合タンパク質である。シャペロニンはそのリング状構造体の内部に空洞を有しており、その空洞内に折り畳み途中のタンパク質や変性したタンパク質を一時的に収納して複合体を形成する。そして、空洞内で収納したタンパク質を正しく折り畳み、続いて空洞から正しく折り畳まれたタンパク質を放出することが知られている。
【0038】
シャペロニンは、バクテリアや真核生物のオルガネラにみられるグループI型と、真核生物や古細菌にみられるグループII型に分類される。本発明のモノクローナル抗体を製造する際に行う遺伝子免疫において、前記した融合遺伝子を用いる場合には、グループI型とグループII型のいずれのシャペロニン遺伝子を採用してもよい。グループI型シャペロニンの代表例としては、大腸菌由来のGroELが挙げられる。グループII型シャペロニンの代表例としては、古細菌由来のTCPが挙げられる。GroELサブユニットをコードする遺伝子の塩基配列を配列番号8に示す。
【0039】
ここで「シャペロニンをコードする遺伝子(シャペロニン遺伝子)」には、シャペロニンサブユニットをコードする遺伝子(シャペロニンサブユニット遺伝子)に加え、複数のシャペロニンサブユニットがタンデムに連結された「シャペロニンサブユニット連結体」をコードする遺伝子を含む。シャペロニンサブユニット連結体をコードする遺伝子は、複数のシャペロニンサブユニット遺伝子がタンデムに連結された遺伝子と同じである。なお、シャペロニンサブユニット連結体は、天然のシャペロニンと同様のリング状構造体を形成することができる。
【0040】
前記融合遺伝子の作製方法としては、例えば、hETBR遺伝子とシャペロニン遺伝子とをライゲーション反応によって連結すればよい。なお、融合遺伝子を動物に投与する際には、融合遺伝子が発現ベクターに組み込まれ、プロモーターの制御下にある状態で投与することが好ましい。発現ベクターの例としては、pCI、pSI、pAdVantage、pTriEX、pKA1、pCDM8、pSが挙げられる。また、発現ベクター上のプロモーターの例としては、CMVプロモーター、AMLプロモーター、SV40プロモーター、SRαプロモーター、EF−1αプロモーター等が挙げられる。さらに、発現ベクターには、プロモーター活性を増強するエンハンサーを含めてもよい。またさらに、発現ベクターには、CpGモチーフを含めてもよい。
【0041】
融合遺伝子を動物に投与する方法としては、例えば、皮下注射、筋肉注射、静脈注射等が挙げられる。またパーティクルガンによる投与も適用可能である。また投与量としては、用いる発現ベクターやプロモーターの種類等に応じて適宜決定すればよいが、1回当たりおおむね1〜3mg/kg体重で、これはマウスの場合は25〜100μg/回になる。また投与の回数は、1回でもよいが、一定間隔をおいて複数回行う方がより高い免疫応答を誘導することができる。
【0042】
なお、タンパク免疫によって動物に免疫応答を誘導する場合には、一般的に行われている方法をそのまま採用することができる。例えば、精製したhETBRを用意し、アジュバントとの混合液を調製する。この混合液をマウス等に皮下注射し、hETBRに対する免疫応答を誘導する。必要に応じて、間隔をあけて複数回投与し、追加免疫してもよい。
【0043】
免疫される動物としては特に限定はないが、好ましくは、マウスが用いられる。これにより、マウス由来のモノクローナル抗体を得ることができる。
【0044】
ハイブリドーマの作製は、ケーラーとミルシュタインの方法によって行うことができる。すなわち、上記した手順で遺伝子免疫あるいはタンパク免疫され、hETBRに対する免疫応答が誘導された動物から脾臓を摘出し、脾臓細胞を採取する。そして、脾臓細胞とミエローマとを細胞融合し、ハイブリドーマの集団を作製する。ハイブリドーマの選抜は、例えば、HAT選択培地を用いて行うことができる。また、ハイブリドーマのクローニングは、例えば、限界希釈法により行うことができる。このようにして、hETBRの細胞外ドメインに反応する抗hETBRモノクローナル抗体を産生するハイブリドーマを選抜ならびにクローニングすればよい。
【0045】
本発明のモノクローナル抗体を産生するハイブリドーマの1つは「hB07」と命名され、独立行政法人 産業技術総合研究所 特許生物寄託センター(IPOD)に寄託されている。寄託の詳細は以下のとおりである。
【0046】
表示:hB07
受託番号:FERM P−21961
受領日:2010年5月11日
【0047】
選抜ならびにクローニングされたハイブリドーマを培養することにより、前記の性質を有する抗hETBRモノクローナル抗体を製造することができる。ハイブリドーマの培養は、動物の腹腔内で行ってもよく、ディッシュ等を用いてインビトロで行ってもよい。動物の腹腔内でハイブリドーマを培養する場合には、腹水を採取し、その腹水からモノクローナル抗体を単離・精製することができる。インビトロで培養する場合には、その培養液からモノクローナル抗体を単離・精製することができる。
【0048】
モノクローナル抗体の精製については、各種クロマトグラフィー、塩析、透析、膜分離等の公知の手法を組み合わせて行うことができる。モノクローナル抗体のサブクラスがIgGである場合には、プロテインAを用いたアフィニティクロマトグラフィーによって簡便に精製することもできる。
【0049】
hB07(受託番号がFERM P−21961であるハイブリドーマ)により産生される抗hETBRモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体、換言すれば、hB07により産生される抗hETBRモノクローナル抗体と「機能的に同等」であるモノクローナル抗体も、本発明に含まれる。このようなモノクローナル抗体を得る方法としては、例えば、hB07により産生される抗hETBRモノクローナル抗体のエピトープを、hETBRの部分ペプチド等を用いたエピトープマッピング法により解析する。そして、同定されたエピトープを含む合成ペプチドを抗原として用い、前記抗hETBRモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体を得ることができる。なお、2つの抗体についてエピトープが同一か否かを調べる方法としては、競合実験による方法が挙げられる。例えば、hB07により産生される抗hETBRモノクローナル抗体を第一抗体とする。そして、当該第一抗体とhETBRとの結合が、試験対象である第二抗体によって競合阻害を受ける場合には、当該第二抗体は、前記第一抗体と同じエピトープに結合するものであるといえる。
【0050】
本発明のモノクローナル抗体は、種々の用途に使用できる。例えば、hETBRに対するアンタゴニストとして、医薬品開発に応用することができる。すなわち、hETBRが有するナチュラルリガンド特異的なシグナル伝達を阻害することにより、血管弛緩を抑える昇圧剤に応用することができる。また、さまざまな癌の増殖・浸潤を抑える抗癌剤となる可能性がある。また、本発明のモノクローナル抗体の相補性決定領域(CDR)の構造を特定し、キメラ化あるいはヒト化すれば、より安全性が高い医薬品とすることができる。また本発明のモノクローナル抗体は、低分子医薬のスクリーニング用試薬、心筋症・高血圧症・癌検査試薬、組織切片・細胞等を用いたETBR局在検証用研究試薬、組換えETBR発現細胞調製用検査試薬、ETBRの結晶構造解析用研究試薬、等の用途にも使用できる。
【0051】
以下、実施例をもって本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0052】
(1)ヒト由来エンドセリン受容体タイプB遺伝子の単離
ヒト胎盤cDNAライブラリー(タカラバイオ社)を鋳型とし、配列番号1及び2に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、配列番号3に示す塩基配列を有するヒト由来エンドセリン受容体タイプB(hETBR)遺伝子を含むDNA断片(以下、「DNA断片A」と称する。)を増幅した。DNA断片Aには、プライマーに由来して、5'末端にNheIサイト、3'末端にSalIサイトが導入された。また、同様にして配列番号1及び5に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、配列番号3に示す塩基配列を有するhETBR遺伝子を含むDNA断片(以下、「DNA断片B」と称する。)を増幅した。DNA断片Bには、プライマーに由来して、5'末端にNheIサイト、3'末端に2個の停止コドン(TAATAG)をコードする配列及びSalIサイトが導入された。
【0053】
(2)GroELサブユニット遺伝子の単離
大腸菌HMS174(DE3)株(ノバジェン社)からゲノムDNAを抽出・精製した。次に、精製したゲノムDNAを鋳型とし、配列番号6及び7に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、配列番号8に示す塩基配列を有するGroELサブユニット遺伝子を含むDNA断片(以下、「DNA断片C」と称する。)を増幅した。DNA断片Cには、プライマーに由来して、5'末端にSalIサイト、3'末端に2個の停止コドン(TAATAG)をコードする配列及びNotIサイトが導入された。
【0054】
(3)hETBRとGroELサブユニットとの融合タンパク質を発現する遺伝子免疫用ベクターの構築
哺乳動物発現ベクターpCI Mammalian Expression Vector(プロメガ社)を制限酵素NheIとSalIで消化し、バクテリア由来アルカリフォスファターゼ(BAP)にて末端を脱リン酸化処理した後、上記(1)で調製したDNA断片Aを挿入した。さらに、この発現ベクターをSalIおよびNotIで消化し、BAPにて末端を脱リン酸化処理した後、上記(2)で調製したDNA断片Cを挿入し、ベクターpCI−hETBR・GroELを構築した。すなわち、ベクターpCI−hETBR・GroELは、hETBRをコードする遺伝子とGroELサブユニットをコードする遺伝子との融合遺伝子を有している。一方、同様にして、哺乳動物発現ベクターpCI Mammalian Expression Vectorを制限酵素NheIとSalIで消化し、BAPにて末端を脱リン酸化処理した後、上記(1)で調製したDNA断片Bを挿入し、ベクターpCI−hETBRを構築した。すなわち、ベクターpCI−hETBRはhETBR遺伝子のみを有している。
【0055】
(4)hETBR安定発現細胞及びhETAR安定発現細胞の作製
(3)で構築したpCI−hETBR・GroELを鋳型とし、配列番号1及び5に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、hETBR遺伝子を含むDNA断片を得た。このDNA断片をpCIneo(プロメガ社)のNheI−XhoIサイトに導入し、pCIneo−hETBRを構築した。
一方、ヒト肺cDNAライブラリー(タカラバイオ社)を鋳型とし、配列番号9及び10に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、ヒト由来エンドセリン受容体タイプA(hETAR)遺伝子(配列番号11)を含むDNA断片を得た。このDNA断片をpCIneoのNheI−XhoIサイトに導入し、pCIneo−hETARを構築した。
【0056】
リポフェクタミン(Lipofectamin)溶液37.5μLと、OPTI−MEMI培地625μLと、20μgのpCIneo−hETBRを含むOPTI−MEMI培地625μLとを混和した。この混和液を用いて、pCIneo−hETBRを2×105個のCHO−K1細胞(大日本製薬社)に導入した。同様の手順で、pCIneo−hETARをCHO−K1細胞に導入した。対照として、pCIneoのみをCHO−K1細胞に導入した。
遺伝子が導入された各CHO−K1細胞を、Ham'sF12K+10%FBS培地(ICN社)にて30時間培養した。さらに、各細胞を剥離、懸濁し、100mmディッシュに5×105個を播き、抗生物質G418(プロメガ社)を0.8mg/mLの濃度で含有するHam'sF12K+10%FBS培地で2週間薬剤処理を行なった。薬剤処理後、限界希釈法により、抗生物質耐性細胞をクローニングした。クローニングした各CHO−K1細胞を、さらに、2×104個/100μLの初期細胞濃度にて、96穴マイクロタイタープレートを用いて一昼夜培養した。培養終了後、10-6〜10-12Mの濃度範囲内のET−1(ペプチド研究所)によって各細胞を刺激したところ、細胞内のCa2+濃度が一過的に上昇した。Ca2+濃度は、Ca2+シグナル解析装置(FLIPR;Molecular Devices社)及び細胞内Ca2+染色キット(Ca3kit;Molecular Devices社)を用いて測定した。このことから、活性型hETARと活性型hETBRのいずれもが、CHO−K1細胞膜上に正常に安定発現していることがわかった。
【0057】
(5)遺伝子免疫
生理食塩水にベクターpCI−hETBR・GroELを250μg/mLの濃度になるよう溶解し、免疫用組成物を調製した。この免疫用組成物を、8週齢のマウスBALB/c(雌)の両足大腿筋に各0.12mLずつ注射を行い、免疫した(0日目)。これにより、pCI−hETBR・GroELを両足に各30μgずつ、すなわち、1匹につき1回あたり60μg投与した。その後、7日目、21日目、及び28日目にも同様して繰り返し免疫した。そして、0、7、14、21、28、35、42日目に採血を行い、血清を調製した。
【0058】
(6)フローサイトメトリーによる活性型hETBRに対する血清中抗体結合性評価
pCIneo−hETBRが導入され安定発現を確認したCHO−K1細胞(以下、「hETBR遺伝子導入細胞」と称する。)、pCIneo−hETARが導入され安定発現を確認したCHO−K1細胞(以下、「hETAR遺伝子導入細胞」と称する。)、及び、pCIneoが導入されたCHO−K1細胞(対照の細胞)をPBSで洗浄した。免疫後35日目の血清を500倍希釈し、各細胞と一緒にインキュベートした。さらに、各細胞をPBSで洗浄し、2次抗体としてフィコエリスリン標識抗マウスIgG抗体(ベックマンコールター社)を添加した後、フローサイトメーターFACScalibur(ベクトンディッキンソン社)を用いて、各細胞と血清中の抗hETBR抗体との相互作用を解析した。
【0059】
その結果、hETBR遺伝子導入細胞を用いた場合は、遺伝子免疫前の血清ではフィコエリスリンがほとんど検出されなかったが、遺伝子免疫後の血清では検出された。これは、免疫後の血清中の抗hETBR抗体がhETBR遺伝子導入細胞に結合することを示していた。一方、hETAR遺伝子導入細胞を用いた場合は、遺伝子免疫後の血清でもフィコエリスリンが検出されなかった。これは、免疫後の血清中の抗hETBR抗体がhETAR遺伝子導入細胞に結合しないことを示していた。なお、対照の細胞を用いた場合も、遺伝子免疫後の血清でもフィコエリスリンが検出されなかった。これは、免疫後の血清中の抗hETBR抗体が対照の細胞に結合しないことを示していた。
以上のことから、ベクターpCI−hETBR・GroELによる遺伝子免疫によって、マウス血清中に活性型hETBRの細胞外ドメインを特異的に認識する抗体の産生を誘導することができた。
【0060】
(7)抗hETBRモノクローナル抗体の作製
上記(5)と同様の手順で遺伝子免疫したマウス6匹に対して追加免疫を行った。追加免疫の3日後に脾臓を摘出し、脾細胞を調製した。PEG法により、1×108個の脾細胞と、1×107個のBALB/Cマウス由来のHAT選択性のミエローマSP2/0細胞とを融合した(細胞融合)。融合した細胞(ハイブリドーマ)の集団をRPMI培地に懸濁し、96穴マイクロプレート14枚の各穴に播種した。この段階で、約990種のハイブリドーマが得られた。
【0061】
細胞融合の翌日から2週間、3日に1度の頻度で、上記マイクロプレート内の培地をHAT Media Supplement(50×)(Sigma社、品番:H0262)を添加したRPMI培地に置き換えた。
【0062】
上記(6)と同様のフローサイトメトリーによって抗体結合評価を行い、hETBR遺伝子導入細胞と各穴のハイブリドーマ培養上清中の抗体との結合性を調べた。その結果、4穴において抗体との結合性が確認された。
【0063】
抗体との結合性が確認された4種のハイブリドーマについて、限界希釈法によるクローニングを行った。すなわち、4種のハイブリドーマについて96穴マイクロプレートに細胞1個以下/穴になるように播種し、培養した。2週間後、同様のフローサイトメトリーを行い、クローニングされた培養上清中の抗体(抗hETBRモノクローナル抗体)の結合性を確認した。その結果、抗hETBRモノクローナル抗体を産生する4種のハイブリドーマがクローニングされた。
【0064】
各ハイブリドーマについてRPMI培地100mL内でフラスコ培養を2週間行った。各培養上清を、プロテインGカラム(アマシャムバイオサイエンス社)に供して精製・濃縮し、精製された4種の抗hETBRモノクローナル抗体を各々約2mg得た。
【0065】
各々の抗hETBRモノクローナル抗体について、以下に示す試験を行った。それらの結果から、所望の性質を有する抗hETBRモノクローナル抗体を1種選抜した(クローン番号hB07)。このハイブリドーマについて、独立行政法人 産業技術総合研究所 特許生物寄託センター(IPOD)に寄託した(受託番号:FERM P−21961;受領日:2010年5月11日)。
【0066】
以下、受託番号FERM P−21961のハイブリドーマから精製された抗hETBRモノクローナル抗体(以下、「hB07抗体」と称する。)について、以下の評価を行った。
【0067】
(8)フローサイトメトリーによるhETBRに対する結合性評価
10μg/mL濃度のhB07抗体のPBS溶液(以下、「hB07抗体溶液」と称する。)を調製した。一方、hETBR遺伝子導入細胞、hETAR遺伝子導入細胞、および対照の細胞をそれぞれPBSで洗浄した後、hB07抗体溶液を各細胞と共にインキュベートした。さらに、各細胞をPBSで洗浄し、2次抗体としてフィコエリスリン標識抗マウスIgG抗体(ベックマンコールター社)を添加した後、フローサイトメーターFACScalibur(ベクトンディッキンソン社)を用いて、各細胞とhB07抗体との相互作用を解析した。結果を図1〜3に示す。図1はhETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図2はhETAR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図3は対照の細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図1〜3において、縦軸は細胞数、横軸はフィコエリスリン(PE)由来の蛍光強度を表す。また、2つのエリア(M1、M2)のうち、M2(右領域)に属する細胞がhB07抗体と結合した細胞を表す。
【0068】
その結果、hETBR遺伝子導入細胞を用いた場合は、M2のエリアに多くの細胞が検出された(図1)。これは、hB07抗体がhETBR遺伝子導入細胞に結合することを示していた。一方、hETAR遺伝子導入細胞を用いた場合(図2)と対照の細胞を用いた場合(図3)は、M2のエリアにはほとんど細胞が検出されなかった。これは、hB07抗体がhETAR遺伝子導入細胞と対照の細胞のいずれにも結合しないことを示していた。以上のことから、hB07抗体が活性型hETBRの細胞外ドメインを特異的に認識するものであることが示された。
【0069】
(9)免疫学的細胞染色よるhETBRに対する結合性評価
hETBR遺伝子導入細胞ならびにhETAR遺伝子導入細胞を、カバーガラスを入れた6穴プレートに播種し、培養した。細胞が接着増殖したことを確認した後、カバーガラスを4%パラホルムアルデヒド/PBS溶液に浸漬して細胞を固定化し、サポニンにより細胞膜透過処理を行った。その後、カバーガラスをhB07抗体溶液と共にインキュベートした。さらに、カバーガラスをPBSで洗浄し、2次抗体としてフィコエリスリン標識抗マウスIgG抗体(ベックマンコールター社)を添加した後、蛍光顕微鏡(オリンパス社)を用いて観察し、各細胞とhB07抗体との相互作用を解析した。結果を図4及び図5に示す。図4はhB07抗体溶液と共にインキュベートしたhETBR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真であり、図5はhB07抗体溶液と共にインキュベートしたhETAR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真である。図4,5において、蛍光が検出された箇所が、細胞上でhB07抗体が結合した箇所である。図4,5中に示したスケールバーは100μmを示す。
【0070】
図4に示すように、細胞膜上に発現しているhETBR遺伝子導入細胞を用いた場合には蛍光が検出され、細胞膜上にhB07抗体が結合していた。一方、hETAR遺伝子導入細胞を用いた場合には、蛍光は検出されず、細胞膜上にhB07抗体が結合していなかった。以上より、免疫学的細胞染色によっても、hB07抗体が細胞上に発現したhETBR(すなわち、hETBRの細胞外ドメイン)に特異的に結合することが示された。
【0071】
(10)細胞内Ca2+シグナル伝達阻害活性評価
hETBR遺伝子導入細胞を、2×104個/100μLの初期細胞濃度にて、96穴マイクロタイタープレートを用いて一昼夜培養した。培養終了後、各穴に10-6〜10-12Mの濃度範囲内のhB07抗体を添加した。また対照として、マウスIgG(ピアス社、陰性対照)を同様に10-6〜10-12Mの濃度範囲内で添加したものも調製した。1時間後、1×10-8MのエンドセリンET−1(ペプチド研究所)によって各細胞を刺激した際の細胞内Ca2+濃度の一過的上昇の抗体濃度依存的減少度を測定した。Ca2+濃度の測定は、Ca2+シグナル解析装置(FLIPR;Molecular Devices社)及び細胞内Ca染色キット(Ca3kit;Molecular Devices社)を用いて行った。結果を図6に示す。図6は細胞内Ca2+濃度と各添加物(hB07抗体又はマウスIgG)の濃度との関係を表すグラフである。図6に示すように、hB07抗体を添加した場合には、ET−1誘導細胞内Ca2+濃度の低下がみられた。これは、hB07抗体がエンドセリンET−1とhETBRとの結合を競合的に阻害した結果、細胞内へのシグナル伝達が阻害されたことを示していた。50%阻害濃度(IC50)を算出すると、hB07抗体では1.708×10-7Mであった。
以上より、hB07抗体が、hETBRが有するナチュラルリガンド特異的なシグナル伝達を阻害できることが示された。
【0072】
(11)アイソタイプ解析
マウスモノクローナル抗体アイソタイピングキット(GEヘルスケア社)を用いて、hB07抗体のアイソタイプを決定した。検出はホースラディッシュペルオキシダーゼ標識マウスIgG抗体を用いたサンドイッチELISAによった。その結果、hB07抗体のアイソタイプはIgG2a、軽鎖はκ鎖であった。
【0073】
(12)異種ETBRに対する結合性評価
上記(1)〜(6)と同様にして、「マウス由来ETBR(mETBR)遺伝子導入細胞」と「ラット由来ETBR(rETBR)遺伝子導入細胞」を作製した。これらの細胞を用い、上記(8)と同様のフローサイトメトリーにて、hB07抗体のmETBRとrETBRに対する結合性を評価した。結果を図7に示す。図7(a)はmETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラム、図7(b)はrETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図7(a),(b)において、縦軸は細胞数、横軸はフィコエリスリン(PE)由来の蛍光強度を表す。また、2つのエリア(M1、M2)のうち、M2(右領域)に属する細胞がhB07抗体と結合した細胞を表す。すなわち、いずれの細胞を用いた場合でも、M2のエリアにはほとんど細胞が検出されなかった。これは、hB07抗体がmETBR遺伝子導入細胞とrETBR遺伝子導入細胞のいずれにも結合しないことを示していた。以上より、hB07抗体はhETBRに対して特異的に反応するが、mETBRとrETBRのいずれにも実質的に反応しないことが示された。
【技術分野】
【0001】
本発明はモノクローナル抗体、並びに、ハイブリドーマに関し、さらに詳細には、ヒト由来エンドセリン受容体タイプBに対する新規のモノクローナル抗体、並びに、当該モノクローナル抗体を産生するハイブリドーマに関する。
【背景技術】
【0002】
細胞表面上の膜受容体タンパク質は、細胞外の情報を細胞内へ伝達する極めて重要な働きをしている。そのため、膜受容体タンパク質に結合する物質はアゴニスト型医薬品やアンタゴニスト型医薬として候補物質となる。膜受容体タンパク質の中でも特にGタンパク質共役型受容体(G protein-coupled receptor;GPCR)は、現在市販されている低分子医薬品の約半数がこの受容体を標的としているため、医薬品開発において極めて注目を集めている。また、GPCRの約半数が、生体内で機能しているナチュラルリガンドが同定されていないオーファンGPCRであり、ナチュラルリガンドやその類縁化合物が新規医薬品の候補物質として期待されていることから、オーファンGPCRに対するリガンドのスクリーニングが熾烈を極めている。
【0003】
GPCRは、細胞膜を7回貫通し、そのN末端を細胞外に、C末端を細胞内に向けて存在している。すなわち、GPCRの細胞外ドメインは、N末端ドメイン、細胞外第1ループ、細胞外第2ループ、および細胞外第3ループから構成されている。同様に、GPCRの細胞内ドメインは、細胞内第1ループ、細胞内第2ループ、細胞内第3ループ、およびC末端ドメインから構成されている。
【0004】
エンドセリン(endothelin;ET)は21個のアミノ酸残基からなるペプチドであり、強力な血管収縮作用を有することが知られている。エンドセリンにはET−1、ET−2、ET−3の3種類のアイソフォームが見出されている。一方、エンドセリンに特異的に結合する受容体がエンドセリン受容体(endothelin receptor)である。エンドセリン受容体にはエンドセリン受容体タイプA(ETAR)とエンドセリン受容体タイプB(ETBR)の2種類が見出されており、ETARはET−1とET−2に対する強い結合性を示し、ETBRは3種類のETに対して同程度の結合性を示す。
【0005】
エンドセリン受容体はGPCRの一種であり、細胞膜を7回貫通する構造を有している。ヒト由来エンドセリン受容体タイプB(以下、「hETBR」と略記することがある。)の1次構造はすでに解明されており、そのN末端ドメイン、各細胞外ドメイン、各細胞内ドメイン、およびC末端ドメインに相当する部位も特定されている。
【0006】
エンドセリン受容体のアンタゴニストは、エンドセリンが関与する種々の疾病の治療薬となる可能性があり、新規アンタゴニストの探索が盛んに行われている(例えば、非特許文献1,2)。例えば、当該アンタゴニストは血管弛緩を抑える作用を有することが予想され、昇圧剤となる可能性がある。また、さまざまな癌の増殖・浸潤を抑える抗癌剤となる可能性がある。一方で、受容体に対する抗体をアンタゴニストとして応用することも一般に試みられており(アンタゴニスト抗体)、エンドセリン受容体タイプBに対する抗体が昇圧剤や抗癌剤となる可能性もある。
【0007】
現在、ヒト由来エンドセリン受容体タイプBに対する抗体としては、ポリクローナル抗体がすでに取得され、一部は市販もされている。一方、モノクローナル抗体に関しては、hETBRの1次構造のみを特異的に認識するものが取得されている(非特許文献3)。しかし、ポリクローナル抗体とモノクローナル抗体のいずれにおいても、hETBRの細胞外ドメインを特異的に認識するもの、例えば細胞外ドメインの立体構造を特異的に認識するものは取得されていない。したがって、hETBRとナチュラルリガンド(ET−1、ET−2、ET−3等)との結合やシグナル伝達を阻害することができる抗体も取得されていない。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】エンドクライン−リレイテッド・キャンサー(Endocrine-Related Cancer),2007年,第14巻,p.233−244
【非特許文献2】ジャーナル・オブ・トランスレイショナル・メディスン(Journal of translational Medicine),2004年,第2巻,16号,1−9
【非特許文献3】プロス・ワン(PloS ONE),2010年,第5巻,第6号,e11241,
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、新たな医薬品開発等に有用なヒト由来エンドセリン受容体タイプBに対する新規のモノクローナル抗体、並びに、当該モノクローナル抗体を産生するハイブリドーマを提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは、分子シャペロンの一種であるシャペロニンをコードする遺伝子とヒト由来エンドセリン受容体タイプBをコードする遺伝子との融合遺伝子を用いて、マウスに遺伝子免疫を施し、ヒト由来エンドセリン受容体タイプBに対する免疫応答を誘導した。そして、当該マウスの脾臓細胞とミエローマとを融合させてハイブリドーマの集団を作製し、hETBRの細胞外ドメインを特異的に認識するモノクローナル抗体を産生するハイブリドーマを検索した。その結果、1種のクローンを選抜することに成功した。そして、当該ハイブリドーマから所望のモノクローナル抗体を取得することに成功し、本発明を完成した。本発明の要旨は以下のとおりである。
【0011】
請求項1に記載の発明は、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応するモノクローナル抗体である。
【0012】
本発明はヒト由来エンドセリン受容体タイプB(hETBR)に対するモノクローナル抗体(以下、「抗hETBRモノクローナル抗体」と略記することがある。)に係るものである。本発明のモノクローナル抗体は、hETBRの細胞外ドメインに対して特異的に反応する。換言すれば、hETBRの1次構造のみを認識するものではなく、hETBRの細胞内ドメインのみに反応するものでもない。本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の治療薬開発に有用である。また、本発明のモノクローナル抗体は、エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の診断や、エンドセリン受容体タイプBの免疫測定法の構築にも有用である。
【0013】
請求項2に記載の発明は、前記細胞外ドメインの立体構造を認識するものである請求項1に記載のモノクローナル抗体である。
【0014】
本発明のモノクローナル抗体は、細胞外ドメインの立体構造を認識するものである。換言すれば、細胞外ドメインの1次構造のみを認識するものではない。かかる構成により、hETBRのアンタゴニスト抗体として特に好適なモノクローナル抗体が提供される。なお、立体構造を保持した細胞外ドメインは、天然(native)のhETBR(活性型hETBR)の細胞外ドメインが該当し、例えば、生きた細胞の表面上に存在する。
【0015】
請求項1又は2に記載のモノクローナル抗体において、前記細胞外ドメインは、N末端ドメイン、細胞外第1ループ、細胞外第2ループ、又は細胞外第3ループである構成が好ましい(請求項3)。
【0016】
請求項1〜3のいずれかに記載のモノクローナル抗体において、以下の性質を有する構成が好ましい(請求項4)。
(a)ヒト由来エンドセリン受容体タイプBに反応し、ヒト由来エンドセリン受容体タイプAには実質的に反応しない
(b)ヒト由来エンドセリン受容体タイプBに反応し、マウス由来エンドセリン受容体タイプBとラット由来エンドセリン受容体タイプBのいずれにも実質的に反応しない。
【0017】
請求項1〜4のいずれかに記載のモノクローナル抗体において、サブクラスがマウスIgG2aであり、軽鎖がκ鎖である構成が好ましい(請求項5)。
【0018】
請求項6に記載の発明は、エンドセリン受容体タイプBとナチュラルリガンドとの結合を阻害することができる請求項1〜5のいずれかに記載のモノクローナル抗体である。
【0019】
また請求項7に記載の発明は、エンドセリン受容体タイプBが有するナチュラルリガンド特異的なシグナル伝達を阻害することができる請求項1〜6のいずれかに記載のモノクローナル抗体である。
【0020】
かかる構成により、ヒト由来エンドセリン受容体タイプBに対するアンタゴニストとして使用可能なモノクローナル抗体が提供される。
【0021】
請求項8に記載の発明は、受託番号がFERM P−21961であるハイブリドーマにより産生される、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体である。
【0022】
また請求項9に記載の発明は、請求項8に記載のモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体である。
【0023】
本発明のモノクローナル抗体は、hETBRの細胞外ドメインに対して特異的に反応する。換言すれば、hETBRの1次構造のみを認識するものではなく、hETBRの細胞内ドメインのみに反応するものでもない。本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の治療薬開発に有用である。また、本発明のモノクローナル抗体は、エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の診断や、エンドセリン受容体タイプBの免疫測定法の構築にも有用である。
【0024】
請求項10に記載の発明は、受託番号がFERM P−21961であるハイブリドーマである。
【0025】
本発明のハイブリドーマを用いることにより、上記した本発明のモノクローナル抗体を生産することができる。例えば、その培養物から本発明のモノクローナル抗体を取得することができる。
【発明の効果】
【0026】
本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の治療薬開発に有用である。また、エンドセリン受容体タイプBの細胞外ドメインに関係する疾病の診断や、エンドセリン受容体タイプBの免疫測定法の構築にも有用である。
【0027】
本発明のハイブリドーマによれば、その培養物から本発明のモノクローナル抗体を取得することができる。
【図面の簡単な説明】
【0028】
【図1】hETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【図2】hETAR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【図3】対照の細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【図4】hB07抗体溶液と共にインキュベートしたhETBR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真である。
【図5】hB07抗体溶液と共にインキュベートしたhETAR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真である。
【図6】細胞内Ca2+濃度と各添加物の濃度との関係を表すグラフである。
【図7】(a)はマウス由来ETBR(mETBR)遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラム、(b)はラット由来ETBR(rETBR)遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。
【発明を実施するための形態】
【0029】
まず、ヒト由来エンドセリン受容体タイプB(hETBR)の構造について説明する。
前述したように、hETBRはGタンパク質共役型受容体(GPCR)の一種であり、細胞膜を7回貫通し、そのN末端を細胞外に、C末端を細胞内に向けて存在している。hETBRをコードする遺伝子(cDNA)はすでに単離されており、hETBRのアミノ酸配列も知られている。配列番号3にhETBR遺伝子の塩基配列と該塩基配列に対応するアミノ酸配列を、配列番号4にアミノ酸配列のみを示す。
【0030】
hETBRの疎水性モデルにより一般的に考えられている構造によれば、hETBRの各ドメインは、配列番号4に示すアミノ酸配列における以下の部分に相当する。左側がアミノ酸番号、右側が各ドメインである。なお、異種動物間で細胞外ドメイン(N末端ドメイン、細胞外第1ループ、細胞外第2ループ、細胞外第3ループ)のアミノ酸配列を比較すると、N末端ドメインの相同性は低く、各ループの相同性は高いことがわかっている。
【0031】
1〜 27:膜移行シグナルペプチド配列(発現後に切断・除去される)
28〜 99:N末端ドメイン
123〜137:細胞内第1ループ
161〜172:細胞外第1ループ
196〜220:細胞内第2ループ
244〜276:細胞外第2ループ
300〜324:細胞内第3ループ
348〜357:細胞外第3ループ
381〜442:C末端ドメイン
【0032】
本発明のモノクローナル抗体は、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応する。本発明のモノクローナル抗体を製造する方法としては、公知の方法をそのまま採用することができ、例えばケーラーとミルシュタインの細胞融合法を基礎として製造することができる。概説すれば、hETBRに対する免疫応答が誘導されたマウス等の動物の脾臓細胞とミエローマとを融合してハイブリドーマの集団を作製し、該ハイブリドーマの集団から所望のモノクローナル抗体を産生するものを選抜する。そして、選抜したハイブリドーマを培養し、その培養物から所望のモノクローナル抗体を単離・精製することができる。
【0033】
hETBRに対する免疫応答を誘導する方法としては、動物にhETBR(タンパク質)を接種する一般的なタンパク免疫の手法によってもよいが、動物にhETBR遺伝子を投与する遺伝子免疫の手法が好ましく用いられる。
【0034】
すなわち、hETBRは膜タンパク質であるので、全長のhETBRを免疫原として使用することは一般に難しい。そこで、タンパク免疫をもってhETBRの細胞外ドメインに対する免疫応答を誘導したい場合には、細胞外ドメインのペプチドを免疫原として用いることとなる。しかし、細胞外ドメインは異種生物間で相同性が高く、構造が複雑なため、当該ペプチドを免疫原に用いても十分な免疫応答を誘導することができないことがある。結局、タンパク免疫によって細胞外ドメインに対する免疫応答を十分に誘導することは難しい。
【0035】
一方、遺伝子免疫によれば、hETBRの全長をコードする遺伝子を用いることにより、全長のhETBRを免疫原に用いたのと同様の状況を作り出すことができる。さらに、発現したhETBRが動物体内で天然(native)の状態(活性型の状態)で存在できるので、hETBRの立体構造に特異的な免疫応答を誘導することが可能となる。また遺伝子免疫の手法によれば、hETBR遺伝子さえ入手できれば行うことができ、精製されたhETBRを準備する必要がない。
【0036】
ただしこの場合でも、hETBRにおいては異種動物間の相同性が比較的高いことには変わりがないため、細胞外ドメインに対する免疫応答を十分に誘導することは難しい。従来、hETBRに対する抗体に関して、ウェスタンブロッティング用抗体のような1次構造のみを認識するものしか取得されていないのは、これが原因の1つと考えられる。そこで、動物に接種する遺伝子として、シャペロニンをコードする遺伝子とhETBRをコードする遺伝子との融合遺伝子を用いる。当該融合遺伝子を免疫原として用いることにより、hETBR遺伝子を単独で用いる場合よりも細胞外ドメインに対する免疫応答をより強く誘導することができる。当該融合遺伝子を用いた遺伝子免疫の方法については、国際公開第2006/041157号パンフレットにその詳細が記載されている。
【0037】
シャペロニンは分子シャペロンの一種であり、バクテリア、古細菌、真核生物等の全ての生物に存在している。特に、バクテリアの細胞質、真核細胞のミトコンドリア、葉緑体に多量に存在している。シャペロニンは、タンパク質の折り畳みを促進する活性やタンパク質の変性を阻止する活性を有する。シャペロニンは、分子量約6万のシャペロニンサブユニット(HSP60ともいう)7〜9個からなるリング状構造体が2個重なった、総分子量80万〜100万程度のシリンダー状の巨大な複合タンパク質である。シャペロニンはそのリング状構造体の内部に空洞を有しており、その空洞内に折り畳み途中のタンパク質や変性したタンパク質を一時的に収納して複合体を形成する。そして、空洞内で収納したタンパク質を正しく折り畳み、続いて空洞から正しく折り畳まれたタンパク質を放出することが知られている。
【0038】
シャペロニンは、バクテリアや真核生物のオルガネラにみられるグループI型と、真核生物や古細菌にみられるグループII型に分類される。本発明のモノクローナル抗体を製造する際に行う遺伝子免疫において、前記した融合遺伝子を用いる場合には、グループI型とグループII型のいずれのシャペロニン遺伝子を採用してもよい。グループI型シャペロニンの代表例としては、大腸菌由来のGroELが挙げられる。グループII型シャペロニンの代表例としては、古細菌由来のTCPが挙げられる。GroELサブユニットをコードする遺伝子の塩基配列を配列番号8に示す。
【0039】
ここで「シャペロニンをコードする遺伝子(シャペロニン遺伝子)」には、シャペロニンサブユニットをコードする遺伝子(シャペロニンサブユニット遺伝子)に加え、複数のシャペロニンサブユニットがタンデムに連結された「シャペロニンサブユニット連結体」をコードする遺伝子を含む。シャペロニンサブユニット連結体をコードする遺伝子は、複数のシャペロニンサブユニット遺伝子がタンデムに連結された遺伝子と同じである。なお、シャペロニンサブユニット連結体は、天然のシャペロニンと同様のリング状構造体を形成することができる。
【0040】
前記融合遺伝子の作製方法としては、例えば、hETBR遺伝子とシャペロニン遺伝子とをライゲーション反応によって連結すればよい。なお、融合遺伝子を動物に投与する際には、融合遺伝子が発現ベクターに組み込まれ、プロモーターの制御下にある状態で投与することが好ましい。発現ベクターの例としては、pCI、pSI、pAdVantage、pTriEX、pKA1、pCDM8、pSが挙げられる。また、発現ベクター上のプロモーターの例としては、CMVプロモーター、AMLプロモーター、SV40プロモーター、SRαプロモーター、EF−1αプロモーター等が挙げられる。さらに、発現ベクターには、プロモーター活性を増強するエンハンサーを含めてもよい。またさらに、発現ベクターには、CpGモチーフを含めてもよい。
【0041】
融合遺伝子を動物に投与する方法としては、例えば、皮下注射、筋肉注射、静脈注射等が挙げられる。またパーティクルガンによる投与も適用可能である。また投与量としては、用いる発現ベクターやプロモーターの種類等に応じて適宜決定すればよいが、1回当たりおおむね1〜3mg/kg体重で、これはマウスの場合は25〜100μg/回になる。また投与の回数は、1回でもよいが、一定間隔をおいて複数回行う方がより高い免疫応答を誘導することができる。
【0042】
なお、タンパク免疫によって動物に免疫応答を誘導する場合には、一般的に行われている方法をそのまま採用することができる。例えば、精製したhETBRを用意し、アジュバントとの混合液を調製する。この混合液をマウス等に皮下注射し、hETBRに対する免疫応答を誘導する。必要に応じて、間隔をあけて複数回投与し、追加免疫してもよい。
【0043】
免疫される動物としては特に限定はないが、好ましくは、マウスが用いられる。これにより、マウス由来のモノクローナル抗体を得ることができる。
【0044】
ハイブリドーマの作製は、ケーラーとミルシュタインの方法によって行うことができる。すなわち、上記した手順で遺伝子免疫あるいはタンパク免疫され、hETBRに対する免疫応答が誘導された動物から脾臓を摘出し、脾臓細胞を採取する。そして、脾臓細胞とミエローマとを細胞融合し、ハイブリドーマの集団を作製する。ハイブリドーマの選抜は、例えば、HAT選択培地を用いて行うことができる。また、ハイブリドーマのクローニングは、例えば、限界希釈法により行うことができる。このようにして、hETBRの細胞外ドメインに反応する抗hETBRモノクローナル抗体を産生するハイブリドーマを選抜ならびにクローニングすればよい。
【0045】
本発明のモノクローナル抗体を産生するハイブリドーマの1つは「hB07」と命名され、独立行政法人 産業技術総合研究所 特許生物寄託センター(IPOD)に寄託されている。寄託の詳細は以下のとおりである。
【0046】
表示:hB07
受託番号:FERM P−21961
受領日:2010年5月11日
【0047】
選抜ならびにクローニングされたハイブリドーマを培養することにより、前記の性質を有する抗hETBRモノクローナル抗体を製造することができる。ハイブリドーマの培養は、動物の腹腔内で行ってもよく、ディッシュ等を用いてインビトロで行ってもよい。動物の腹腔内でハイブリドーマを培養する場合には、腹水を採取し、その腹水からモノクローナル抗体を単離・精製することができる。インビトロで培養する場合には、その培養液からモノクローナル抗体を単離・精製することができる。
【0048】
モノクローナル抗体の精製については、各種クロマトグラフィー、塩析、透析、膜分離等の公知の手法を組み合わせて行うことができる。モノクローナル抗体のサブクラスがIgGである場合には、プロテインAを用いたアフィニティクロマトグラフィーによって簡便に精製することもできる。
【0049】
hB07(受託番号がFERM P−21961であるハイブリドーマ)により産生される抗hETBRモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体、換言すれば、hB07により産生される抗hETBRモノクローナル抗体と「機能的に同等」であるモノクローナル抗体も、本発明に含まれる。このようなモノクローナル抗体を得る方法としては、例えば、hB07により産生される抗hETBRモノクローナル抗体のエピトープを、hETBRの部分ペプチド等を用いたエピトープマッピング法により解析する。そして、同定されたエピトープを含む合成ペプチドを抗原として用い、前記抗hETBRモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体を得ることができる。なお、2つの抗体についてエピトープが同一か否かを調べる方法としては、競合実験による方法が挙げられる。例えば、hB07により産生される抗hETBRモノクローナル抗体を第一抗体とする。そして、当該第一抗体とhETBRとの結合が、試験対象である第二抗体によって競合阻害を受ける場合には、当該第二抗体は、前記第一抗体と同じエピトープに結合するものであるといえる。
【0050】
本発明のモノクローナル抗体は、種々の用途に使用できる。例えば、hETBRに対するアンタゴニストとして、医薬品開発に応用することができる。すなわち、hETBRが有するナチュラルリガンド特異的なシグナル伝達を阻害することにより、血管弛緩を抑える昇圧剤に応用することができる。また、さまざまな癌の増殖・浸潤を抑える抗癌剤となる可能性がある。また、本発明のモノクローナル抗体の相補性決定領域(CDR)の構造を特定し、キメラ化あるいはヒト化すれば、より安全性が高い医薬品とすることができる。また本発明のモノクローナル抗体は、低分子医薬のスクリーニング用試薬、心筋症・高血圧症・癌検査試薬、組織切片・細胞等を用いたETBR局在検証用研究試薬、組換えETBR発現細胞調製用検査試薬、ETBRの結晶構造解析用研究試薬、等の用途にも使用できる。
【0051】
以下、実施例をもって本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0052】
(1)ヒト由来エンドセリン受容体タイプB遺伝子の単離
ヒト胎盤cDNAライブラリー(タカラバイオ社)を鋳型とし、配列番号1及び2に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、配列番号3に示す塩基配列を有するヒト由来エンドセリン受容体タイプB(hETBR)遺伝子を含むDNA断片(以下、「DNA断片A」と称する。)を増幅した。DNA断片Aには、プライマーに由来して、5'末端にNheIサイト、3'末端にSalIサイトが導入された。また、同様にして配列番号1及び5に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、配列番号3に示す塩基配列を有するhETBR遺伝子を含むDNA断片(以下、「DNA断片B」と称する。)を増幅した。DNA断片Bには、プライマーに由来して、5'末端にNheIサイト、3'末端に2個の停止コドン(TAATAG)をコードする配列及びSalIサイトが導入された。
【0053】
(2)GroELサブユニット遺伝子の単離
大腸菌HMS174(DE3)株(ノバジェン社)からゲノムDNAを抽出・精製した。次に、精製したゲノムDNAを鋳型とし、配列番号6及び7に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、配列番号8に示す塩基配列を有するGroELサブユニット遺伝子を含むDNA断片(以下、「DNA断片C」と称する。)を増幅した。DNA断片Cには、プライマーに由来して、5'末端にSalIサイト、3'末端に2個の停止コドン(TAATAG)をコードする配列及びNotIサイトが導入された。
【0054】
(3)hETBRとGroELサブユニットとの融合タンパク質を発現する遺伝子免疫用ベクターの構築
哺乳動物発現ベクターpCI Mammalian Expression Vector(プロメガ社)を制限酵素NheIとSalIで消化し、バクテリア由来アルカリフォスファターゼ(BAP)にて末端を脱リン酸化処理した後、上記(1)で調製したDNA断片Aを挿入した。さらに、この発現ベクターをSalIおよびNotIで消化し、BAPにて末端を脱リン酸化処理した後、上記(2)で調製したDNA断片Cを挿入し、ベクターpCI−hETBR・GroELを構築した。すなわち、ベクターpCI−hETBR・GroELは、hETBRをコードする遺伝子とGroELサブユニットをコードする遺伝子との融合遺伝子を有している。一方、同様にして、哺乳動物発現ベクターpCI Mammalian Expression Vectorを制限酵素NheIとSalIで消化し、BAPにて末端を脱リン酸化処理した後、上記(1)で調製したDNA断片Bを挿入し、ベクターpCI−hETBRを構築した。すなわち、ベクターpCI−hETBRはhETBR遺伝子のみを有している。
【0055】
(4)hETBR安定発現細胞及びhETAR安定発現細胞の作製
(3)で構築したpCI−hETBR・GroELを鋳型とし、配列番号1及び5に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、hETBR遺伝子を含むDNA断片を得た。このDNA断片をpCIneo(プロメガ社)のNheI−XhoIサイトに導入し、pCIneo−hETBRを構築した。
一方、ヒト肺cDNAライブラリー(タカラバイオ社)を鋳型とし、配列番号9及び10に示す塩基配列を有するオリゴヌクレオチドをプライマー対としてPCRを行い、ヒト由来エンドセリン受容体タイプA(hETAR)遺伝子(配列番号11)を含むDNA断片を得た。このDNA断片をpCIneoのNheI−XhoIサイトに導入し、pCIneo−hETARを構築した。
【0056】
リポフェクタミン(Lipofectamin)溶液37.5μLと、OPTI−MEMI培地625μLと、20μgのpCIneo−hETBRを含むOPTI−MEMI培地625μLとを混和した。この混和液を用いて、pCIneo−hETBRを2×105個のCHO−K1細胞(大日本製薬社)に導入した。同様の手順で、pCIneo−hETARをCHO−K1細胞に導入した。対照として、pCIneoのみをCHO−K1細胞に導入した。
遺伝子が導入された各CHO−K1細胞を、Ham'sF12K+10%FBS培地(ICN社)にて30時間培養した。さらに、各細胞を剥離、懸濁し、100mmディッシュに5×105個を播き、抗生物質G418(プロメガ社)を0.8mg/mLの濃度で含有するHam'sF12K+10%FBS培地で2週間薬剤処理を行なった。薬剤処理後、限界希釈法により、抗生物質耐性細胞をクローニングした。クローニングした各CHO−K1細胞を、さらに、2×104個/100μLの初期細胞濃度にて、96穴マイクロタイタープレートを用いて一昼夜培養した。培養終了後、10-6〜10-12Mの濃度範囲内のET−1(ペプチド研究所)によって各細胞を刺激したところ、細胞内のCa2+濃度が一過的に上昇した。Ca2+濃度は、Ca2+シグナル解析装置(FLIPR;Molecular Devices社)及び細胞内Ca2+染色キット(Ca3kit;Molecular Devices社)を用いて測定した。このことから、活性型hETARと活性型hETBRのいずれもが、CHO−K1細胞膜上に正常に安定発現していることがわかった。
【0057】
(5)遺伝子免疫
生理食塩水にベクターpCI−hETBR・GroELを250μg/mLの濃度になるよう溶解し、免疫用組成物を調製した。この免疫用組成物を、8週齢のマウスBALB/c(雌)の両足大腿筋に各0.12mLずつ注射を行い、免疫した(0日目)。これにより、pCI−hETBR・GroELを両足に各30μgずつ、すなわち、1匹につき1回あたり60μg投与した。その後、7日目、21日目、及び28日目にも同様して繰り返し免疫した。そして、0、7、14、21、28、35、42日目に採血を行い、血清を調製した。
【0058】
(6)フローサイトメトリーによる活性型hETBRに対する血清中抗体結合性評価
pCIneo−hETBRが導入され安定発現を確認したCHO−K1細胞(以下、「hETBR遺伝子導入細胞」と称する。)、pCIneo−hETARが導入され安定発現を確認したCHO−K1細胞(以下、「hETAR遺伝子導入細胞」と称する。)、及び、pCIneoが導入されたCHO−K1細胞(対照の細胞)をPBSで洗浄した。免疫後35日目の血清を500倍希釈し、各細胞と一緒にインキュベートした。さらに、各細胞をPBSで洗浄し、2次抗体としてフィコエリスリン標識抗マウスIgG抗体(ベックマンコールター社)を添加した後、フローサイトメーターFACScalibur(ベクトンディッキンソン社)を用いて、各細胞と血清中の抗hETBR抗体との相互作用を解析した。
【0059】
その結果、hETBR遺伝子導入細胞を用いた場合は、遺伝子免疫前の血清ではフィコエリスリンがほとんど検出されなかったが、遺伝子免疫後の血清では検出された。これは、免疫後の血清中の抗hETBR抗体がhETBR遺伝子導入細胞に結合することを示していた。一方、hETAR遺伝子導入細胞を用いた場合は、遺伝子免疫後の血清でもフィコエリスリンが検出されなかった。これは、免疫後の血清中の抗hETBR抗体がhETAR遺伝子導入細胞に結合しないことを示していた。なお、対照の細胞を用いた場合も、遺伝子免疫後の血清でもフィコエリスリンが検出されなかった。これは、免疫後の血清中の抗hETBR抗体が対照の細胞に結合しないことを示していた。
以上のことから、ベクターpCI−hETBR・GroELによる遺伝子免疫によって、マウス血清中に活性型hETBRの細胞外ドメインを特異的に認識する抗体の産生を誘導することができた。
【0060】
(7)抗hETBRモノクローナル抗体の作製
上記(5)と同様の手順で遺伝子免疫したマウス6匹に対して追加免疫を行った。追加免疫の3日後に脾臓を摘出し、脾細胞を調製した。PEG法により、1×108個の脾細胞と、1×107個のBALB/Cマウス由来のHAT選択性のミエローマSP2/0細胞とを融合した(細胞融合)。融合した細胞(ハイブリドーマ)の集団をRPMI培地に懸濁し、96穴マイクロプレート14枚の各穴に播種した。この段階で、約990種のハイブリドーマが得られた。
【0061】
細胞融合の翌日から2週間、3日に1度の頻度で、上記マイクロプレート内の培地をHAT Media Supplement(50×)(Sigma社、品番:H0262)を添加したRPMI培地に置き換えた。
【0062】
上記(6)と同様のフローサイトメトリーによって抗体結合評価を行い、hETBR遺伝子導入細胞と各穴のハイブリドーマ培養上清中の抗体との結合性を調べた。その結果、4穴において抗体との結合性が確認された。
【0063】
抗体との結合性が確認された4種のハイブリドーマについて、限界希釈法によるクローニングを行った。すなわち、4種のハイブリドーマについて96穴マイクロプレートに細胞1個以下/穴になるように播種し、培養した。2週間後、同様のフローサイトメトリーを行い、クローニングされた培養上清中の抗体(抗hETBRモノクローナル抗体)の結合性を確認した。その結果、抗hETBRモノクローナル抗体を産生する4種のハイブリドーマがクローニングされた。
【0064】
各ハイブリドーマについてRPMI培地100mL内でフラスコ培養を2週間行った。各培養上清を、プロテインGカラム(アマシャムバイオサイエンス社)に供して精製・濃縮し、精製された4種の抗hETBRモノクローナル抗体を各々約2mg得た。
【0065】
各々の抗hETBRモノクローナル抗体について、以下に示す試験を行った。それらの結果から、所望の性質を有する抗hETBRモノクローナル抗体を1種選抜した(クローン番号hB07)。このハイブリドーマについて、独立行政法人 産業技術総合研究所 特許生物寄託センター(IPOD)に寄託した(受託番号:FERM P−21961;受領日:2010年5月11日)。
【0066】
以下、受託番号FERM P−21961のハイブリドーマから精製された抗hETBRモノクローナル抗体(以下、「hB07抗体」と称する。)について、以下の評価を行った。
【0067】
(8)フローサイトメトリーによるhETBRに対する結合性評価
10μg/mL濃度のhB07抗体のPBS溶液(以下、「hB07抗体溶液」と称する。)を調製した。一方、hETBR遺伝子導入細胞、hETAR遺伝子導入細胞、および対照の細胞をそれぞれPBSで洗浄した後、hB07抗体溶液を各細胞と共にインキュベートした。さらに、各細胞をPBSで洗浄し、2次抗体としてフィコエリスリン標識抗マウスIgG抗体(ベックマンコールター社)を添加した後、フローサイトメーターFACScalibur(ベクトンディッキンソン社)を用いて、各細胞とhB07抗体との相互作用を解析した。結果を図1〜3に示す。図1はhETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図2はhETAR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図3は対照の細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図1〜3において、縦軸は細胞数、横軸はフィコエリスリン(PE)由来の蛍光強度を表す。また、2つのエリア(M1、M2)のうち、M2(右領域)に属する細胞がhB07抗体と結合した細胞を表す。
【0068】
その結果、hETBR遺伝子導入細胞を用いた場合は、M2のエリアに多くの細胞が検出された(図1)。これは、hB07抗体がhETBR遺伝子導入細胞に結合することを示していた。一方、hETAR遺伝子導入細胞を用いた場合(図2)と対照の細胞を用いた場合(図3)は、M2のエリアにはほとんど細胞が検出されなかった。これは、hB07抗体がhETAR遺伝子導入細胞と対照の細胞のいずれにも結合しないことを示していた。以上のことから、hB07抗体が活性型hETBRの細胞外ドメインを特異的に認識するものであることが示された。
【0069】
(9)免疫学的細胞染色よるhETBRに対する結合性評価
hETBR遺伝子導入細胞ならびにhETAR遺伝子導入細胞を、カバーガラスを入れた6穴プレートに播種し、培養した。細胞が接着増殖したことを確認した後、カバーガラスを4%パラホルムアルデヒド/PBS溶液に浸漬して細胞を固定化し、サポニンにより細胞膜透過処理を行った。その後、カバーガラスをhB07抗体溶液と共にインキュベートした。さらに、カバーガラスをPBSで洗浄し、2次抗体としてフィコエリスリン標識抗マウスIgG抗体(ベックマンコールター社)を添加した後、蛍光顕微鏡(オリンパス社)を用いて観察し、各細胞とhB07抗体との相互作用を解析した。結果を図4及び図5に示す。図4はhB07抗体溶液と共にインキュベートしたhETBR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真であり、図5はhB07抗体溶液と共にインキュベートしたhETAR遺伝子導入細胞を蛍光顕微鏡で観察した結果を表す写真である。図4,5において、蛍光が検出された箇所が、細胞上でhB07抗体が結合した箇所である。図4,5中に示したスケールバーは100μmを示す。
【0070】
図4に示すように、細胞膜上に発現しているhETBR遺伝子導入細胞を用いた場合には蛍光が検出され、細胞膜上にhB07抗体が結合していた。一方、hETAR遺伝子導入細胞を用いた場合には、蛍光は検出されず、細胞膜上にhB07抗体が結合していなかった。以上より、免疫学的細胞染色によっても、hB07抗体が細胞上に発現したhETBR(すなわち、hETBRの細胞外ドメイン)に特異的に結合することが示された。
【0071】
(10)細胞内Ca2+シグナル伝達阻害活性評価
hETBR遺伝子導入細胞を、2×104個/100μLの初期細胞濃度にて、96穴マイクロタイタープレートを用いて一昼夜培養した。培養終了後、各穴に10-6〜10-12Mの濃度範囲内のhB07抗体を添加した。また対照として、マウスIgG(ピアス社、陰性対照)を同様に10-6〜10-12Mの濃度範囲内で添加したものも調製した。1時間後、1×10-8MのエンドセリンET−1(ペプチド研究所)によって各細胞を刺激した際の細胞内Ca2+濃度の一過的上昇の抗体濃度依存的減少度を測定した。Ca2+濃度の測定は、Ca2+シグナル解析装置(FLIPR;Molecular Devices社)及び細胞内Ca染色キット(Ca3kit;Molecular Devices社)を用いて行った。結果を図6に示す。図6は細胞内Ca2+濃度と各添加物(hB07抗体又はマウスIgG)の濃度との関係を表すグラフである。図6に示すように、hB07抗体を添加した場合には、ET−1誘導細胞内Ca2+濃度の低下がみられた。これは、hB07抗体がエンドセリンET−1とhETBRとの結合を競合的に阻害した結果、細胞内へのシグナル伝達が阻害されたことを示していた。50%阻害濃度(IC50)を算出すると、hB07抗体では1.708×10-7Mであった。
以上より、hB07抗体が、hETBRが有するナチュラルリガンド特異的なシグナル伝達を阻害できることが示された。
【0072】
(11)アイソタイプ解析
マウスモノクローナル抗体アイソタイピングキット(GEヘルスケア社)を用いて、hB07抗体のアイソタイプを決定した。検出はホースラディッシュペルオキシダーゼ標識マウスIgG抗体を用いたサンドイッチELISAによった。その結果、hB07抗体のアイソタイプはIgG2a、軽鎖はκ鎖であった。
【0073】
(12)異種ETBRに対する結合性評価
上記(1)〜(6)と同様にして、「マウス由来ETBR(mETBR)遺伝子導入細胞」と「ラット由来ETBR(rETBR)遺伝子導入細胞」を作製した。これらの細胞を用い、上記(8)と同様のフローサイトメトリーにて、hB07抗体のmETBRとrETBRに対する結合性を評価した。結果を図7に示す。図7(a)はmETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラム、図7(b)はrETBR遺伝子導入細胞とhB07抗体との相互作用の解析結果を表すヒストグラムである。図7(a),(b)において、縦軸は細胞数、横軸はフィコエリスリン(PE)由来の蛍光強度を表す。また、2つのエリア(M1、M2)のうち、M2(右領域)に属する細胞がhB07抗体と結合した細胞を表す。すなわち、いずれの細胞を用いた場合でも、M2のエリアにはほとんど細胞が検出されなかった。これは、hB07抗体がmETBR遺伝子導入細胞とrETBR遺伝子導入細胞のいずれにも結合しないことを示していた。以上より、hB07抗体はhETBRに対して特異的に反応するが、mETBRとrETBRのいずれにも実質的に反応しないことが示された。
【特許請求の範囲】
【請求項1】
ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応するモノクローナル抗体。
【請求項2】
前記細胞外ドメインの立体構造を認識するものである請求項1に記載のモノクローナル抗体。
【請求項3】
前記細胞外ドメインは、N末端ドメイン、細胞外第1ループ、細胞外第2ループ、又は細胞外第3ループである請求項1又は2に記載のモノクローナル抗体。
【請求項4】
以下の性質(a)及び(b)を有する請求項1〜3のいずれかに記載のモノクローナル抗体。
(a)ヒト由来エンドセリン受容体タイプBに反応し、ヒト由来エンドセリン受容体タイプAには実質的に反応しない
(b)ヒト由来エンドセリン受容体タイプBに反応し、マウス由来エンドセリン受容体タイプBとラット由来エンドセリン受容体タイプBのいずれにも実質的に反応しない。
【請求項5】
サブクラスがマウスIgG2aであり、軽鎖がκ鎖である請求項1〜4のいずれかに記載のモノクローナル抗体。
【請求項6】
エンドセリン受容体タイプBとナチュラルリガンドとの結合を阻害することができる請求項1〜5のいずれかに記載のモノクローナル抗体。
【請求項7】
エンドセリン受容体タイプBが有するナチュラルリガンド特異的なシグナル伝達を阻害することができる請求項1〜6のいずれかに記載のモノクローナル抗体。
【請求項8】
受託番号がFERM P−21961であるハイブリドーマにより産生される、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体。
【請求項9】
請求項8に記載のモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体。
【請求項10】
受託番号がFERM P−21961であるハイブリドーマ。
【請求項1】
ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体であって、ヒト由来エンドセリン受容体タイプBの細胞外ドメインに対して特異的に反応するモノクローナル抗体。
【請求項2】
前記細胞外ドメインの立体構造を認識するものである請求項1に記載のモノクローナル抗体。
【請求項3】
前記細胞外ドメインは、N末端ドメイン、細胞外第1ループ、細胞外第2ループ、又は細胞外第3ループである請求項1又は2に記載のモノクローナル抗体。
【請求項4】
以下の性質(a)及び(b)を有する請求項1〜3のいずれかに記載のモノクローナル抗体。
(a)ヒト由来エンドセリン受容体タイプBに反応し、ヒト由来エンドセリン受容体タイプAには実質的に反応しない
(b)ヒト由来エンドセリン受容体タイプBに反応し、マウス由来エンドセリン受容体タイプBとラット由来エンドセリン受容体タイプBのいずれにも実質的に反応しない。
【請求項5】
サブクラスがマウスIgG2aであり、軽鎖がκ鎖である請求項1〜4のいずれかに記載のモノクローナル抗体。
【請求項6】
エンドセリン受容体タイプBとナチュラルリガンドとの結合を阻害することができる請求項1〜5のいずれかに記載のモノクローナル抗体。
【請求項7】
エンドセリン受容体タイプBが有するナチュラルリガンド特異的なシグナル伝達を阻害することができる請求項1〜6のいずれかに記載のモノクローナル抗体。
【請求項8】
受託番号がFERM P−21961であるハイブリドーマにより産生される、ヒト由来エンドセリン受容体タイプBに対するモノクローナル抗体。
【請求項9】
請求項8に記載のモノクローナル抗体と同一のエピトープに結合するモノクローナル抗体。
【請求項10】
受託番号がFERM P−21961であるハイブリドーマ。
【図1】


【図2】


【図3】


【図6】


【図7】


【図4】


【図5】




【図2】


【図3】


【図6】


【図7】


【図4】


【図5】


【公開番号】特開2012−111706(P2012−111706A)
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願番号】特願2010−261283(P2010−261283)
【出願日】平成22年11月24日(2010.11.24)
【出願人】(000002174)積水化学工業株式会社 (5,781)
【Fターム(参考)】
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願日】平成22年11月24日(2010.11.24)
【出願人】(000002174)積水化学工業株式会社 (5,781)
【Fターム(参考)】
[ Back to top ]

