自閉症の治療用の組成物及び方法
炭水化物酵素の欠損により生じる症状を緩和するために有用に使われる場合がある組成
物が、例えば自閉症のようなそのような欠損により特徴づけられる疾患の治療のための方
法とともに提供される。前記組成物はA.nigerから単離されたトランスグルコシダ
ーゼを含むことが好ましい。
物が、例えば自閉症のようなそのような欠損により特徴づけられる疾患の治療のための方
法とともに提供される。前記組成物はA.nigerから単離されたトランスグルコシダ
ーゼを含むことが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は自閉症と、1種類又は2種類以上の消化酵素の欠損により特徴付けられる他の
疾患との治療用の方法及び組成物に関する。具体的には本発明は、消化を助ける栄養補助
剤の投与による、かかる疾患の治療に関する。
【背景技術】
【0002】
(自閉症スペクトラム障害又はASDとも呼ばれる)自閉症は、人間(individu
al)の機能をひどく損なう疾患である。自閉症は、自己陶酔と、外界に対してコミュニ
ケーション又は応答する能力の低下と、生活習慣(ritual)及び強迫的現象と、精
神遅滞とにより特徴づけられる。自閉症の人間はてんかんのような発作性疾患の発症リス
クも増大する。自閉症は、3歳までに診断が下されることが一般的であり、発生率は女子
より男子において約2倍ないし5倍高く、その発生率は増加しているようである。自閉症
の真の原因は知られていないが、二卵性双生児よりも一卵性双生児において一致率が高い
事実により示されるように1又は2以上の遺伝的要因を含むようにみえ、食事、有毒化学
薬品及び感染のような免疫及び環境要因も含むかもしれない。
【0003】
ヒト腸管は、食物由来の二糖を遊離の単糖に切断する7種類の酵素を含み、該7種類の
酵素は、
・菌類及び酵母由来の糖トレハロースに作用するトレハラーゼ(EC3.2.1.28)
と、
・ラクトースに作用するラクターゼ(EC3.2.1.23)と、
・グルコシルセラミダーゼ(EC3.2.1.45及び46)と、
・フロリジンヒドロラーゼ(EC3.2.1.62)と、
・グリコアミラーゼ複合体(EC3.2.1.20、グリコアミラーゼ1及びグリコアミ
ラーゼ2か、熱安定性マルターゼ1及び熱安定性マルターゼ2かとしても知られる)と、
・スクラーゼ(EC3.2.1.48、熱不安定性マルターゼとも呼ばれる)及びイソマ
ルターゼ(EC3.2.1.10)とであり、
前記ラクターゼ、グルコシルセラミダーゼ及びフロリジンヒドロラーゼは全てベータ−
グルコシダーゼ複合体に含まれ、前記スクラーゼ及びイソマルターゼは両方ともスクラー
ゼ−イソマルターゼ複合体に含まれる。
【0004】
1990年代後半より前に自閉症は、炭水化物ではなくタンパク質だけの不完全消化が
特徴であるかもしれないと信じられていた。1990年代前半に、自閉症の子供の尿の分
析は、ペプチド、特にエキゾルフィン(exorphins)であるカゾモルフィン及び
グルテオモルフィン(gluteomorphin)のようなペプチドの濃度レベルが健
常者に比較して有意に増加することを証明した(非特許文献1)。グルテオモルフィンは
小麦製品の主要なタンパク質であるグルテンの消化及び代謝の際に形成されるが、カゾモ
ルフィンは乳製品中の主要なタンパク質であるカゼインの消化及び代謝の際に形成される
。これらのエキゾルフィンは、身体にアヘン型の効果を有することが示され、統合失調症
及び注意欠陥障害を含むさまざまなヒトの疾病に関与している。具体的にはオピオイドペ
プチドはT細胞を刺激し、ペプチド特異的T細胞応答と異常なレベルのサイトカイン産生
とを誘発する場合があり、前記応答及び産生は次々に、炎症と、自己免疫反応と、神経免
疫コミュニケーションの障害とを引き起こす場合がある。厳密な小麦及び乳製品を含まな
い食事に従うことにより食事からグルテン及びカゼインを除去することは、自閉症の子供
の症状を大幅に改善することが示されている。しかし食事からのグルテン及びカゼインの
完全な除去は実現するのが困難であるため、自閉症の人間におけるタンパク質の消化を向
上させる栄養補助剤に大きな関心がある。(例えば特許文献1及び2を参照せよ。)
【非特許文献1】Reichelt et al.J.Applied Nutr.,42:1−11(1990)
【特許文献1】米国特許第6,251,391号明細書
【特許文献2】米国特許第6,783,757号明細書
【0005】
1999年にHorvathらは、自閉症患者における炭水化物の消化不良の発見を発
表した(非特許文献2)。36人の自閉症の子供の臨床研究で、58%の子供が正常以下
の炭水化物消化酵素活性を有することが分かった。Horvathらは、ジサッカリダー
ゼ及び/又はグリコアミラーゼが機能していないことを結論した。112人の自閉症患者
でのその後の研究でHorvath及びPermanは、半分以上の患者が消化不良に矛
盾しない症状を有することを発見し、再び炭水化物の消化不良の証拠を提供した(非特許
文献3)。特に彼らは、前記患者の58%でラクターゼ、マルターゼ、スクラーゼ、パラ
チナーゼ及びグルコアミラーゼの欠損を特定した。(イソマルターゼとしても知られる)
パラチナーゼは、多くのエキゾルフィンペプチドを消化するのに関与するペプチダーゼで
あるジペプチジルペプチダーゼ4(DPP4)として腸粘膜内の同じ腺窩で発現されるの
で(非特許文献4及び5)、特に興味のある酵素である。
【非特許文献2】J.Pediatrics,135:559−563、1999
【非特許文献3】Horavth and Perman Curr Opin.In Pediatrics 14:583−587(2002)
【非特許文献4】Gorvel et al.,Gastroenterology 101:618−625(1991)
【非特許文献5】Misumi and Ikahara,in Handbook of Proteolytic Enzymes,ed.Barrett,Rawlings and Woessner,Acadmic Press,p.387−382(1998)
【発明の開示】
【発明が解決しようとする課題】
【0006】
最近マサチューセッツジェネラルチルドレンズホスピタルのKushak及びBuie
は100人以上の自閉症の人間の腸生検の知見を報告したが、該報告の中で彼らは前記自
閉症の人間の60−65%のラクターゼ活性が弱く25−45%のイソマルターゼ/パラ
チナーゼ活性が弱いことを発見し、多くの自閉症の人間ではこれらの酵素が欠損している
ことを示した。しかし食品用イソマルターゼは大量には市販されていないので、消化補助
剤としての使用のために容易には入手できない。したがって、自閉症患者のようにイソマ
ルターゼと他の消化酵素との欠損罹患者にとって有益な、容易に入手できる栄養補助剤に
対する需要がある。
【課題を解決するための手段】
【0007】
発明の概要
本発明は、炭水化物消化酵素の欠損により特徴付けられる疾患の治療方法といっしょに
、炭水化物消化酵素の欠損により生じる症状を緩和するために有効に用いられる場合があ
る組成物を提供する。本発明の組成物を使用して治療される場合がある疾患は、(自閉症
スペクトラム障害又はASDとも呼ばれる)自閉症、炎症性腸疾患、クローン病、過敏性
腸症候群及び潰瘍性大腸炎を含むがこれらに限定されない。
【0008】
下で詳述されるように発明者は、(パラチナーゼとしても知られる)酵素イソマルター
ゼの欠損を補うためにトランスグルコシダーゼ(特にAspergillus nige
r由来のトランスグルコシダーゼ)が有効に用いられる場合があり、それにより自閉症を
治療するために用いられる場合があることを断定した。したがって本発明の組成物は、ト
ランスグルコシダーゼ、好ましくは、A. nigerから単離されたトランスグルコシ
ダーゼを含む。本発明の組成物に有効に用いられる場合があるトランスグルコシダーゼの
他の供給源は、カビ、細菌及び酵母を含む。本発明の組成物は、他の炭水化物消化酵素の
欠損により特徴付けられる疾患の治療に有効と信じられている1種類又は2種類以上の付
加的な成分を含む場合もある。好ましくはかかる成分は、グルコアミラーゼ、ラクターゼ
、インベルターゼ、アミラーゼ、マルターゼ及びモルトジアスターゼからなる群から選択
される。
【0009】
一部の実施態様では本発明の組成物は、食品中に普通に存在するタンパク質、脂質、及
び/又は、他の非炭水化物物質の不完全消化により特徴づけられる疾患の治療に有益と信
じられている1種類又は2種類以上の成分を付加的に含む。好ましくはそのような成分は
、ペプチダーゼと、プロテアーゼと、(ブロメライン及びパパインのような)システイン
プロテアーゼと、フィターゼと、α−ガラクトシダーゼと、セルラーゼと、キシラナーゼ
と、リパーゼと、それらの組合せとからなる群から選択される。
【0010】
他の局面では本発明は、自閉症、炎症性腸疾患、クローン病、過敏性腸症候群及び潰瘍
性大腸炎からなる群から選択される疾患の治療方法を提供し、該方法は1種類又は2種類
以上の本発明の組成物を投与するステップを含む。好ましくは前記組成物はタブレット又
はカプセルの形に設定され、食事といっしょに摂取される。
【0011】
本発明のこれらの局面とその他の局面とは、以下の詳細な説明と、添付図面とを参照す
ることにより明らかになるだろう。本明細書で開示される全ての参考文献は、各々が個々
に取り込まれたかのように、引用によりその全体が本明細書に取り込まれる。
【0012】
図面の簡単な説明
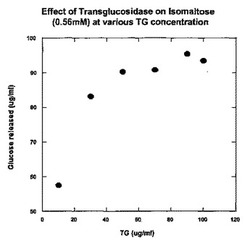
図1は、イソマルトースからのグルコースの放出に及ぼすA. nigerトランスグ
ルコシダーゼの濃度増加の影響を示すグラフである。
【0013】
図2は、固定濃度のトランスグルコシダーゼにより経時的にパラチノースから遊離した
グルコースの量を示すグラフである。
【0014】
図3は、固定濃度のトランスグルコシダーゼによりさまざまな濃度のパラチノースから
遊離したグルコースの量を示すグラフである。
【0015】
発明の詳細な説明
以上のに本発明は、自閉症患者で特定される炭水化物消化酵素の欠損を克服するために
処方される組成物を提供する。好ましい実施態様では前記組成物は、ラクターゼ、マルタ
ーゼ、スクラーゼ、アミラーゼ及びグルコアミラーゼからなる群から選択される1種類又
は2種類以上の酵素の欠損を克服すると信じられている成分といっしょに、酵素イソマル
ターゼの欠損を克服すると信じられている成分を含む。
【0016】
マルトースは、1→4グリコシド結合により別のグルコース分子と結合した1分子のグ
ルコースからなる二糖である。消化の間にこの結合は、2分子のグルコースを作り出すた
めに、(α−グルコシダーゼとしても知られる、EC3.1.1.20)酵素マルターゼ
により切断される。イソマルトースは、1→6グリコシド結合により別のグルコース分子
と結合した1分子のグルコースからなる二糖である。この1→6グリコシド結合は消化の
間に、2分子のグルコースを与えるために、酵素イソマルターゼ(EC3.2.1.10
、デキストリン−6−α−D−グルカノヒドロラーゼ)により切断される。マルターゼは
イソマルターゼの代用になることはできない。(イソマルチュロースと呼ばれることもあ
る)パラチノースは、1→6グリコシド結合により1分子のフルクトース(フルクトフラ
ノース)と結合した1分子のグルコースからなる二糖である。イソマルターゼは、1分子
のグルコースと1分子のフルクトースを作り出すために、この1→6結合も切断する。
【0017】
トランスグルコシダーゼ(EC2.4.1.24)は、菌類の植物Aspergill
us nigerの培養液から抽出されるアルファ−グルコシダーゼである。前記酵素は
、穀物加工及び醸造で使用され、イソマルターゼ活性を有することが知られている食品用
酵素である(McCleary et al.Carbohydrate Resear
ch 185:147−162(1989))。しかしパラチノース消化における明確な
活性は過去に実証されておらず、栄養補助剤としてのその使用の前に、以下に実施例1で
詳述されるとおりテストすることにより、望ましくない逆反応を促進するトランスグルコ
シダーゼの活性が排除されなければならなかった。
【0018】
(β−ガラクトシダーゼとしても知られる、EC3.2.1.23)ラクターゼは、ラ
クトース(乳糖)をその構成糖であるフルクトースとガラクトースとに切断するジサッカ
リダーゼである。本発明の組成物にラクターゼを含めることは、ラクトース不耐性の人々
による前記組成物の利用を可能にし、かつ、利用できるガラクトースの量を増加させる。
【0019】
(EC3.2.1.26、酵母から得られる)インベルターゼは、グルコース及びフル
クトースを作り出すためにスクロースに作用する、並びに、β−D−フルクトフラノシド
としてフルクトースを含む他の複合体糖を加水分解する、ジサッカリダーゼである。ヒト
スクラーゼの実際の食品用類縁体は市販されていないため、インベルターゼは、酵素スク
ラーゼの代わりに消化補助剤中で使用される。
【0020】
(野菜パンクレアチンから得られる)アミラーゼ及び(EC3.2.1.3、A. n
igerから単離される)グルコアミラーゼはデンプンを切断し、より小さい多糖類、二
糖類又はグルコース自身にする酵素である。モルトジアスターゼはそれの、アミロース及
び他の多糖類を加水分解する能力により特徴づけられる。この酵素は、特に穀物から生産
される食品のように炭水化物の豊富な食品を消化するために、アミラーゼ及びグルコアミ
ラーゼと相乗的に働く。
【0021】
炭水化物消化酵素の欠損を克服する成分を含むことに加えて本発明の組成物は、タンパ
ク質及び/又は脂質の消化において重要な酵素のような、他の消化酵素の欠損を克服する
成分も含む場合がある。一部の実施態様ではそのような組成物は、ペプチダーゼと、プロ
テアーゼと、ブロメラインのようなシステインプロテアーゼと、フィターゼと、α−ガラ
クトシダーゼと、セルラーゼと、リパーゼと、キシラナーゼとからなる群から選択される
少なくとも1種類の成分を含む。
【0022】
1つの実施態様では、エンドペプチダーゼ及びエキソペプチダーゼ活性の両方を示すペ
プチダーゼ濃縮成分が含まれる。代替的な実施態様では、本発明の組成物に含まれる前記
ペプチダーゼ濃縮物は、ジペプチジルペプチダーゼIV(DPPIV;EC3.4.14
.5)活性を擬態するので、より強いエキゾルフィン消化を提供する。(例えば米国特許
公報第6,783,757号明細書を参照せよ。)
【0023】
本発明の組成物は、少なくとも1種類の、高い酸安定性及び/又はアルカリ安定性を有
し、かつ、胃中で大きなタンパク質をより小さいペプチドに加水分解する機能を発揮する
プロテアーゼを含むことが好ましい。かかるプロテアーゼは例えばキウィのような植物か
ら単離されることが好ましい。本発明の組成物に含まれる場合がある酸安定性プロテアー
ゼ成分の一例は、National Enzyme Company(Forsyth,
MO)から入手できるProtease3.0である。本発明の組成物で有効に利用され
る場合があるプロテアーゼ成分の別の例は、高い基質特異性でエキソ−ペプチダーゼ及び
エンド−ペプチダーゼ活性の両方を示す、酸性、中性及びアルカリ性プロテアーゼの混合
物であるProtease6.0であるが、前記プロテアーゼ成分もNational
Enzyme Companyから入手できる。
【0024】
タンパク質消化をさらに助けるために本発明の組成物は、システインプロテアーゼを含
むことが好ましい。ブロメライン及びパパインは、前記組成物で有効に利用される場合が
あるシステインプロテアーゼの例である。ブロメラインはパパインよりも広範な特異性及
び機能性を有すると信じられているので、ブロメラインはパパインよりも好ましい。ブロ
メラインは、自閉症者に特徴的な「腸管浸漏症候群(leaky gut)」を有意に低
減する場合がある、有効な抗炎症薬であることも証明されている。
【0025】
フィターゼは、とうもろこしと、米と、小麦と、大豆その他の豆類とのような植物に存
在するフィチン酸を消化する能力のために添加されることが好ましい。フィチン酸は、亜
鉛、カルシウム、マグネシウム、銅、マンガン及び鉄のようなミネラルの吸収に悪影響を
及ぼす場合がある。したがってフィターゼを含めることは、これらのミネラルの生体利用
性の向上をもたらす。
【0026】
α−ガラクトシダーゼは、野菜及びマメ科植物中によく見られるメリビオース、ラフィ
ノース及びスタキオースのアルファ−1−6結合を加水分解する能力によって特徴づけら
れる。これらの糖は、ヒトは容易に消化できず、相当な消化の不快感を引き起こす場合が
ある。したがってこの酵素を含めることは、消化の不快感を低減し、ヒトには通常利用さ
れない栄養源を提供する。
【0027】
キシラナーゼは、植物繊維の不消化成分であるキシランを加水分解する。ヒトは植物繊
維を消化するために必要な内在性の酵素を欠くので、キシラナーゼを含めることは、付加
的な栄養源を提供する。同様に本発明の組成物は、好ましくは、植物性食品中に存在する
セルロースの消化を向上するためにセルラーゼを含む。
【0028】
本発明の組成物に含まれる成分は、容易に商業的に入手できる。それらは、乾燥した形
態で提供され、その後、経口送達に適した剤形を提供するために混合され被包されること
が好ましい。得られたカプセル剤又は錠剤は、好ましくは食品とともに摂取される。当業
者は、本発明の組成物から逸脱することなしに他の送達方法が利用される場合があること
を認識するだろう。本発明の組成物に含まれる成分の特定の濃度は変更可能であるが、市
販の栄養補助剤に現在用いられる成分の特定の濃度にほぼ対応する。例えば微結晶性セル
ロース、ステアリン酸マグネシウム、二酸化ケイ素、米糠及び鉱物油のような付加的な不
活性成分が含まれる場合があるがこれらに限定されない。
【発明を実施するための最良の形態】
【0029】
(剤形Iと呼ばれる)第1の好適な実施態様では、各々のカプセル剤は以下の有効成分
を含む。
【0030】
【表1】

【0031】
ここでAGUはアミログルコシダーゼ単位であり、DPは糖化力(Diastatic
Power)であり、SUはSumner単位であり、DUはデキストリン化単位(D
extrinizing Units)であり、ALUは(LAUとしても知られる)ラ
クターゼ単位である。
【0032】
(剤形IIと呼ばれる)第2の好適な実施態様では、各々のカプセル剤は以下の有効成
分を含む。
【0033】
【表2】

【0034】
(* National Enzyme Co.(Forsyth,MO)から入手で
きるリパーゼ、プロテアーゼ及びアミラーゼの、専有のブレンド製品である。)
【0035】
ここでHUTはヘモグロビン単位チロシン(Hemoglobin Units Ty
rosine)であり、SAPUは分光学的酸プロテアーゼ単位であり、FCCPUは食
品化学コーデックス・パパイン単位であり、GalUは(AGSUとしても知られる)ガ
ラクトシダーゼ単位であり、CUはセルラーゼ単位であり、XUはキシラナーゼ単位であ
る。
【0036】
これらの剤形の各々についての好適な投与量は、食事といっしょに摂取されるカプセル
(剤形IIの場合では50又は100mgのトランスグルコシダーゼ)1ないし2個であ
るが、前記患者の食事及び/又は体重のサイズで投与量は変わる。幼児に対しては、食事
ごとにカプセル半分が摂取される場合がある。
【0037】
以下の実施例は限定の目的でなく例示の目的で提供される。
【実施例1】
【0038】
in vitroでのトランスグルコシダーゼ活性の測定
A. nigerトランスグルコシダーゼがイソマルターゼ活性をある程度有すること
は周知である。しかしトランスグルコシダーゼが例えば自閉症の人間でのイソマルターゼ
の欠損の治療に適するためには、トランスグルコシダーゼは以下の機能的特性を有さなけ
ればならない。
(a)1分子のイソマルトースを2分子のグルコースに切断することができなければな
らない。
(b)1分子のパラチノースを1分子のグルコースと1分子のフルクトースとにに切断
することができなければならない。
(c)グルコースのみか、グルコース及びフルクトースかが存在する場合に(a)又は
(b)のどちらかの逆反応を活性化してはならない。
(d)マルトースをイソマルトースに変換してはならない。
【0039】
これらの特性をテストするため、さまざまな量のA. nigerトランスグルコシダ
ーゼ(TG)が、イソマルトースのグルコースへの変換が確かに起こることを確認し、前
記変換のためにどのくらいの濃度のトランスグルコシダーゼが必要とされるか測定するた
めに、体温に近い温度の反応液中でイソマルトースと反応させられた。本検討の結果は図
1に示される。これらの結果は、TGは40μg/mL以上の濃度を要求し、確かにイソ
マルトースをグルコースに変換することを示す。70μg/mLを超える濃度は、付加的
な利益をほとんど提供しないことが分かった。ほとんど100%のイソマルトースのグル
コースへの変換率が観察された。これらの結果は、40−70μg/mLの間のTGの濃
度がこの変換にとって最適であることを示す。
【0040】
パラチノースをグルコース及びフルクトースに変換するTGの能力が、100μg/m
LのTGを含む反応液からのグルコースの解離を測定することにより試験された。パラチ
ノースの変換のためには、イソマルトースの変換のためよりも多くのTGを必要とするこ
とが知られている。図2は、100μg/mLの濃度のTGによる(グルコースへの変換
の百分率として測定される)パラチノースからのグルコースの経時的な解離を示す。図3
は、さまざまな濃度のTGでの反応90分後における、パラチノースのグルコースへの変
換の百分率を示す。180分で達成されるのはちょうど50%を超える変換率であり、イ
ソマルトースのグルコースへの変換よりは緩慢だったが、TGがパラチノースをグルコー
ス及びフルクトースに変換することが分かった。
【0041】
TGによりグルコースをイソマルトースに戻す変換をテストする実験では、試験液から
のグルコースの消失は認められず、イソマルトース、マルトースその他のいずれかの多糖
の形成はないことを示した。TGによるマルトースのイソマルトースへの変換をテストす
る検討では、テストされた(120μg/mLまでの)TGの濃度でマルトースのイソマ
ルトースへの変換は検出できなかった。
【0042】
以上のテストに基づいて、A. nigerトランスグルコシダーゼ(EC2.4.1
.24)は、定性的にはイソマルターゼ(EC3.2.1.10)の代用酵素の資格があ
ることが断定された。パラチノースは果物及び野菜の非常に微量な二糖成分なので、パラ
チノースの濃度とともにパラチノースの変換率がどの程度変化するかを決定するためにさ
らなるテストが実施された。一定のTG濃度及びインキュベーション時間に対してはパラ
チノース濃度が小さいほどグルコース及びフルクトースへの変換率は高くなり、変換率が
濃度依存的であることが断定された。
【0043】
これらの研究は、A. nigerトランスグルコシダーゼがin vitroテスト
により測定されたとおり、イソマルトースについての消化酵素として満足な活性を有する
ことを示す。A. nigerのTGはパラチノースに対する活性が小さいが、パラチノ
ースは炭水化物食品中の非常に微量な糖であるので、たとえ変換速度はより緩慢であると
しても、TGでの食事補充は満足である場合がある。
【実施例2】
【0044】
トランスグルコシダーゼを含む組成物のin vivoでの活性
自閉症の治療における本発明の組成物の有効性を評価するために、過去に自閉症と診断
された人間が、上述の剤形I又は剤形IIのどちらかか、剤形I及び剤形IIの両方かの
カプセル剤を与えられ、毎回の食事とともに1−2個のカプセル剤を摂取することを指示
された。患者、及び/又は、彼らの医師は、いずれかの望ましくない副作用か、アレルギ
ー反応又は発疹のような感受性型反応かに関する情報といっしょに、胃腸の不快感と、食
品への全体的な耐性と、自己刺激行動(stimming)と、多動性(hyperac
tivity)と、心的状態(mood)と、注意と、睡眠と、アイコンタクトと、話し
方と、社交性(socialization)と、強迫(compulsions)との
変化に関する情報を提供することを要求された。
【0045】
結果は、副作用がほとんどなく、患者からは利点についての勇気付けられる報告を受け
て、前記剤形が患者によく耐容されることを示した。
【0046】
本明細書では例示の目的で本発明の具体的な実施態様が記載されたが、以上の内容から
、本発明の精神及び範囲から逸脱することなしにさまざまな修正がされる場合があると認
識されるだろう。
【図面の簡単な説明】
【0047】
【図1】イソマルトースからのグルコースの放出に及ぼすA. nigerトランスグルコシダーゼの濃度増加の影響を示すグラフ。
【図2】固定濃度のトランスグルコシダーゼにより経時的にパラチノースから解離したグルコースの量を示すグラフ。
【図3】固定濃度のトランスグルコシダーゼによりさまざまな濃度のパラチノースから解離したグルコースの量を示すグラフ。
【技術分野】
【0001】
本発明は自閉症と、1種類又は2種類以上の消化酵素の欠損により特徴付けられる他の
疾患との治療用の方法及び組成物に関する。具体的には本発明は、消化を助ける栄養補助
剤の投与による、かかる疾患の治療に関する。
【背景技術】
【0002】
(自閉症スペクトラム障害又はASDとも呼ばれる)自閉症は、人間(individu
al)の機能をひどく損なう疾患である。自閉症は、自己陶酔と、外界に対してコミュニ
ケーション又は応答する能力の低下と、生活習慣(ritual)及び強迫的現象と、精
神遅滞とにより特徴づけられる。自閉症の人間はてんかんのような発作性疾患の発症リス
クも増大する。自閉症は、3歳までに診断が下されることが一般的であり、発生率は女子
より男子において約2倍ないし5倍高く、その発生率は増加しているようである。自閉症
の真の原因は知られていないが、二卵性双生児よりも一卵性双生児において一致率が高い
事実により示されるように1又は2以上の遺伝的要因を含むようにみえ、食事、有毒化学
薬品及び感染のような免疫及び環境要因も含むかもしれない。
【0003】
ヒト腸管は、食物由来の二糖を遊離の単糖に切断する7種類の酵素を含み、該7種類の
酵素は、
・菌類及び酵母由来の糖トレハロースに作用するトレハラーゼ(EC3.2.1.28)
と、
・ラクトースに作用するラクターゼ(EC3.2.1.23)と、
・グルコシルセラミダーゼ(EC3.2.1.45及び46)と、
・フロリジンヒドロラーゼ(EC3.2.1.62)と、
・グリコアミラーゼ複合体(EC3.2.1.20、グリコアミラーゼ1及びグリコアミ
ラーゼ2か、熱安定性マルターゼ1及び熱安定性マルターゼ2かとしても知られる)と、
・スクラーゼ(EC3.2.1.48、熱不安定性マルターゼとも呼ばれる)及びイソマ
ルターゼ(EC3.2.1.10)とであり、
前記ラクターゼ、グルコシルセラミダーゼ及びフロリジンヒドロラーゼは全てベータ−
グルコシダーゼ複合体に含まれ、前記スクラーゼ及びイソマルターゼは両方ともスクラー
ゼ−イソマルターゼ複合体に含まれる。
【0004】
1990年代後半より前に自閉症は、炭水化物ではなくタンパク質だけの不完全消化が
特徴であるかもしれないと信じられていた。1990年代前半に、自閉症の子供の尿の分
析は、ペプチド、特にエキゾルフィン(exorphins)であるカゾモルフィン及び
グルテオモルフィン(gluteomorphin)のようなペプチドの濃度レベルが健
常者に比較して有意に増加することを証明した(非特許文献1)。グルテオモルフィンは
小麦製品の主要なタンパク質であるグルテンの消化及び代謝の際に形成されるが、カゾモ
ルフィンは乳製品中の主要なタンパク質であるカゼインの消化及び代謝の際に形成される
。これらのエキゾルフィンは、身体にアヘン型の効果を有することが示され、統合失調症
及び注意欠陥障害を含むさまざまなヒトの疾病に関与している。具体的にはオピオイドペ
プチドはT細胞を刺激し、ペプチド特異的T細胞応答と異常なレベルのサイトカイン産生
とを誘発する場合があり、前記応答及び産生は次々に、炎症と、自己免疫反応と、神経免
疫コミュニケーションの障害とを引き起こす場合がある。厳密な小麦及び乳製品を含まな
い食事に従うことにより食事からグルテン及びカゼインを除去することは、自閉症の子供
の症状を大幅に改善することが示されている。しかし食事からのグルテン及びカゼインの
完全な除去は実現するのが困難であるため、自閉症の人間におけるタンパク質の消化を向
上させる栄養補助剤に大きな関心がある。(例えば特許文献1及び2を参照せよ。)
【非特許文献1】Reichelt et al.J.Applied Nutr.,42:1−11(1990)
【特許文献1】米国特許第6,251,391号明細書
【特許文献2】米国特許第6,783,757号明細書
【0005】
1999年にHorvathらは、自閉症患者における炭水化物の消化不良の発見を発
表した(非特許文献2)。36人の自閉症の子供の臨床研究で、58%の子供が正常以下
の炭水化物消化酵素活性を有することが分かった。Horvathらは、ジサッカリダー
ゼ及び/又はグリコアミラーゼが機能していないことを結論した。112人の自閉症患者
でのその後の研究でHorvath及びPermanは、半分以上の患者が消化不良に矛
盾しない症状を有することを発見し、再び炭水化物の消化不良の証拠を提供した(非特許
文献3)。特に彼らは、前記患者の58%でラクターゼ、マルターゼ、スクラーゼ、パラ
チナーゼ及びグルコアミラーゼの欠損を特定した。(イソマルターゼとしても知られる)
パラチナーゼは、多くのエキゾルフィンペプチドを消化するのに関与するペプチダーゼで
あるジペプチジルペプチダーゼ4(DPP4)として腸粘膜内の同じ腺窩で発現されるの
で(非特許文献4及び5)、特に興味のある酵素である。
【非特許文献2】J.Pediatrics,135:559−563、1999
【非特許文献3】Horavth and Perman Curr Opin.In Pediatrics 14:583−587(2002)
【非特許文献4】Gorvel et al.,Gastroenterology 101:618−625(1991)
【非特許文献5】Misumi and Ikahara,in Handbook of Proteolytic Enzymes,ed.Barrett,Rawlings and Woessner,Acadmic Press,p.387−382(1998)
【発明の開示】
【発明が解決しようとする課題】
【0006】
最近マサチューセッツジェネラルチルドレンズホスピタルのKushak及びBuie
は100人以上の自閉症の人間の腸生検の知見を報告したが、該報告の中で彼らは前記自
閉症の人間の60−65%のラクターゼ活性が弱く25−45%のイソマルターゼ/パラ
チナーゼ活性が弱いことを発見し、多くの自閉症の人間ではこれらの酵素が欠損している
ことを示した。しかし食品用イソマルターゼは大量には市販されていないので、消化補助
剤としての使用のために容易には入手できない。したがって、自閉症患者のようにイソマ
ルターゼと他の消化酵素との欠損罹患者にとって有益な、容易に入手できる栄養補助剤に
対する需要がある。
【課題を解決するための手段】
【0007】
発明の概要
本発明は、炭水化物消化酵素の欠損により特徴付けられる疾患の治療方法といっしょに
、炭水化物消化酵素の欠損により生じる症状を緩和するために有効に用いられる場合があ
る組成物を提供する。本発明の組成物を使用して治療される場合がある疾患は、(自閉症
スペクトラム障害又はASDとも呼ばれる)自閉症、炎症性腸疾患、クローン病、過敏性
腸症候群及び潰瘍性大腸炎を含むがこれらに限定されない。
【0008】
下で詳述されるように発明者は、(パラチナーゼとしても知られる)酵素イソマルター
ゼの欠損を補うためにトランスグルコシダーゼ(特にAspergillus nige
r由来のトランスグルコシダーゼ)が有効に用いられる場合があり、それにより自閉症を
治療するために用いられる場合があることを断定した。したがって本発明の組成物は、ト
ランスグルコシダーゼ、好ましくは、A. nigerから単離されたトランスグルコシ
ダーゼを含む。本発明の組成物に有効に用いられる場合があるトランスグルコシダーゼの
他の供給源は、カビ、細菌及び酵母を含む。本発明の組成物は、他の炭水化物消化酵素の
欠損により特徴付けられる疾患の治療に有効と信じられている1種類又は2種類以上の付
加的な成分を含む場合もある。好ましくはかかる成分は、グルコアミラーゼ、ラクターゼ
、インベルターゼ、アミラーゼ、マルターゼ及びモルトジアスターゼからなる群から選択
される。
【0009】
一部の実施態様では本発明の組成物は、食品中に普通に存在するタンパク質、脂質、及
び/又は、他の非炭水化物物質の不完全消化により特徴づけられる疾患の治療に有益と信
じられている1種類又は2種類以上の成分を付加的に含む。好ましくはそのような成分は
、ペプチダーゼと、プロテアーゼと、(ブロメライン及びパパインのような)システイン
プロテアーゼと、フィターゼと、α−ガラクトシダーゼと、セルラーゼと、キシラナーゼ
と、リパーゼと、それらの組合せとからなる群から選択される。
【0010】
他の局面では本発明は、自閉症、炎症性腸疾患、クローン病、過敏性腸症候群及び潰瘍
性大腸炎からなる群から選択される疾患の治療方法を提供し、該方法は1種類又は2種類
以上の本発明の組成物を投与するステップを含む。好ましくは前記組成物はタブレット又
はカプセルの形に設定され、食事といっしょに摂取される。
【0011】
本発明のこれらの局面とその他の局面とは、以下の詳細な説明と、添付図面とを参照す
ることにより明らかになるだろう。本明細書で開示される全ての参考文献は、各々が個々
に取り込まれたかのように、引用によりその全体が本明細書に取り込まれる。
【0012】
図面の簡単な説明
図1は、イソマルトースからのグルコースの放出に及ぼすA. nigerトランスグ
ルコシダーゼの濃度増加の影響を示すグラフである。
【0013】
図2は、固定濃度のトランスグルコシダーゼにより経時的にパラチノースから遊離した
グルコースの量を示すグラフである。
【0014】
図3は、固定濃度のトランスグルコシダーゼによりさまざまな濃度のパラチノースから
遊離したグルコースの量を示すグラフである。
【0015】
発明の詳細な説明
以上のに本発明は、自閉症患者で特定される炭水化物消化酵素の欠損を克服するために
処方される組成物を提供する。好ましい実施態様では前記組成物は、ラクターゼ、マルタ
ーゼ、スクラーゼ、アミラーゼ及びグルコアミラーゼからなる群から選択される1種類又
は2種類以上の酵素の欠損を克服すると信じられている成分といっしょに、酵素イソマル
ターゼの欠損を克服すると信じられている成分を含む。
【0016】
マルトースは、1→4グリコシド結合により別のグルコース分子と結合した1分子のグ
ルコースからなる二糖である。消化の間にこの結合は、2分子のグルコースを作り出すた
めに、(α−グルコシダーゼとしても知られる、EC3.1.1.20)酵素マルターゼ
により切断される。イソマルトースは、1→6グリコシド結合により別のグルコース分子
と結合した1分子のグルコースからなる二糖である。この1→6グリコシド結合は消化の
間に、2分子のグルコースを与えるために、酵素イソマルターゼ(EC3.2.1.10
、デキストリン−6−α−D−グルカノヒドロラーゼ)により切断される。マルターゼは
イソマルターゼの代用になることはできない。(イソマルチュロースと呼ばれることもあ
る)パラチノースは、1→6グリコシド結合により1分子のフルクトース(フルクトフラ
ノース)と結合した1分子のグルコースからなる二糖である。イソマルターゼは、1分子
のグルコースと1分子のフルクトースを作り出すために、この1→6結合も切断する。
【0017】
トランスグルコシダーゼ(EC2.4.1.24)は、菌類の植物Aspergill
us nigerの培養液から抽出されるアルファ−グルコシダーゼである。前記酵素は
、穀物加工及び醸造で使用され、イソマルターゼ活性を有することが知られている食品用
酵素である(McCleary et al.Carbohydrate Resear
ch 185:147−162(1989))。しかしパラチノース消化における明確な
活性は過去に実証されておらず、栄養補助剤としてのその使用の前に、以下に実施例1で
詳述されるとおりテストすることにより、望ましくない逆反応を促進するトランスグルコ
シダーゼの活性が排除されなければならなかった。
【0018】
(β−ガラクトシダーゼとしても知られる、EC3.2.1.23)ラクターゼは、ラ
クトース(乳糖)をその構成糖であるフルクトースとガラクトースとに切断するジサッカ
リダーゼである。本発明の組成物にラクターゼを含めることは、ラクトース不耐性の人々
による前記組成物の利用を可能にし、かつ、利用できるガラクトースの量を増加させる。
【0019】
(EC3.2.1.26、酵母から得られる)インベルターゼは、グルコース及びフル
クトースを作り出すためにスクロースに作用する、並びに、β−D−フルクトフラノシド
としてフルクトースを含む他の複合体糖を加水分解する、ジサッカリダーゼである。ヒト
スクラーゼの実際の食品用類縁体は市販されていないため、インベルターゼは、酵素スク
ラーゼの代わりに消化補助剤中で使用される。
【0020】
(野菜パンクレアチンから得られる)アミラーゼ及び(EC3.2.1.3、A. n
igerから単離される)グルコアミラーゼはデンプンを切断し、より小さい多糖類、二
糖類又はグルコース自身にする酵素である。モルトジアスターゼはそれの、アミロース及
び他の多糖類を加水分解する能力により特徴づけられる。この酵素は、特に穀物から生産
される食品のように炭水化物の豊富な食品を消化するために、アミラーゼ及びグルコアミ
ラーゼと相乗的に働く。
【0021】
炭水化物消化酵素の欠損を克服する成分を含むことに加えて本発明の組成物は、タンパ
ク質及び/又は脂質の消化において重要な酵素のような、他の消化酵素の欠損を克服する
成分も含む場合がある。一部の実施態様ではそのような組成物は、ペプチダーゼと、プロ
テアーゼと、ブロメラインのようなシステインプロテアーゼと、フィターゼと、α−ガラ
クトシダーゼと、セルラーゼと、リパーゼと、キシラナーゼとからなる群から選択される
少なくとも1種類の成分を含む。
【0022】
1つの実施態様では、エンドペプチダーゼ及びエキソペプチダーゼ活性の両方を示すペ
プチダーゼ濃縮成分が含まれる。代替的な実施態様では、本発明の組成物に含まれる前記
ペプチダーゼ濃縮物は、ジペプチジルペプチダーゼIV(DPPIV;EC3.4.14
.5)活性を擬態するので、より強いエキゾルフィン消化を提供する。(例えば米国特許
公報第6,783,757号明細書を参照せよ。)
【0023】
本発明の組成物は、少なくとも1種類の、高い酸安定性及び/又はアルカリ安定性を有
し、かつ、胃中で大きなタンパク質をより小さいペプチドに加水分解する機能を発揮する
プロテアーゼを含むことが好ましい。かかるプロテアーゼは例えばキウィのような植物か
ら単離されることが好ましい。本発明の組成物に含まれる場合がある酸安定性プロテアー
ゼ成分の一例は、National Enzyme Company(Forsyth,
MO)から入手できるProtease3.0である。本発明の組成物で有効に利用され
る場合があるプロテアーゼ成分の別の例は、高い基質特異性でエキソ−ペプチダーゼ及び
エンド−ペプチダーゼ活性の両方を示す、酸性、中性及びアルカリ性プロテアーゼの混合
物であるProtease6.0であるが、前記プロテアーゼ成分もNational
Enzyme Companyから入手できる。
【0024】
タンパク質消化をさらに助けるために本発明の組成物は、システインプロテアーゼを含
むことが好ましい。ブロメライン及びパパインは、前記組成物で有効に利用される場合が
あるシステインプロテアーゼの例である。ブロメラインはパパインよりも広範な特異性及
び機能性を有すると信じられているので、ブロメラインはパパインよりも好ましい。ブロ
メラインは、自閉症者に特徴的な「腸管浸漏症候群(leaky gut)」を有意に低
減する場合がある、有効な抗炎症薬であることも証明されている。
【0025】
フィターゼは、とうもろこしと、米と、小麦と、大豆その他の豆類とのような植物に存
在するフィチン酸を消化する能力のために添加されることが好ましい。フィチン酸は、亜
鉛、カルシウム、マグネシウム、銅、マンガン及び鉄のようなミネラルの吸収に悪影響を
及ぼす場合がある。したがってフィターゼを含めることは、これらのミネラルの生体利用
性の向上をもたらす。
【0026】
α−ガラクトシダーゼは、野菜及びマメ科植物中によく見られるメリビオース、ラフィ
ノース及びスタキオースのアルファ−1−6結合を加水分解する能力によって特徴づけら
れる。これらの糖は、ヒトは容易に消化できず、相当な消化の不快感を引き起こす場合が
ある。したがってこの酵素を含めることは、消化の不快感を低減し、ヒトには通常利用さ
れない栄養源を提供する。
【0027】
キシラナーゼは、植物繊維の不消化成分であるキシランを加水分解する。ヒトは植物繊
維を消化するために必要な内在性の酵素を欠くので、キシラナーゼを含めることは、付加
的な栄養源を提供する。同様に本発明の組成物は、好ましくは、植物性食品中に存在する
セルロースの消化を向上するためにセルラーゼを含む。
【0028】
本発明の組成物に含まれる成分は、容易に商業的に入手できる。それらは、乾燥した形
態で提供され、その後、経口送達に適した剤形を提供するために混合され被包されること
が好ましい。得られたカプセル剤又は錠剤は、好ましくは食品とともに摂取される。当業
者は、本発明の組成物から逸脱することなしに他の送達方法が利用される場合があること
を認識するだろう。本発明の組成物に含まれる成分の特定の濃度は変更可能であるが、市
販の栄養補助剤に現在用いられる成分の特定の濃度にほぼ対応する。例えば微結晶性セル
ロース、ステアリン酸マグネシウム、二酸化ケイ素、米糠及び鉱物油のような付加的な不
活性成分が含まれる場合があるがこれらに限定されない。
【発明を実施するための最良の形態】
【0029】
(剤形Iと呼ばれる)第1の好適な実施態様では、各々のカプセル剤は以下の有効成分
を含む。
【0030】
【表1】

【0031】
ここでAGUはアミログルコシダーゼ単位であり、DPは糖化力(Diastatic
Power)であり、SUはSumner単位であり、DUはデキストリン化単位(D
extrinizing Units)であり、ALUは(LAUとしても知られる)ラ
クターゼ単位である。
【0032】
(剤形IIと呼ばれる)第2の好適な実施態様では、各々のカプセル剤は以下の有効成
分を含む。
【0033】
【表2】

【0034】
(* National Enzyme Co.(Forsyth,MO)から入手で
きるリパーゼ、プロテアーゼ及びアミラーゼの、専有のブレンド製品である。)
【0035】
ここでHUTはヘモグロビン単位チロシン(Hemoglobin Units Ty
rosine)であり、SAPUは分光学的酸プロテアーゼ単位であり、FCCPUは食
品化学コーデックス・パパイン単位であり、GalUは(AGSUとしても知られる)ガ
ラクトシダーゼ単位であり、CUはセルラーゼ単位であり、XUはキシラナーゼ単位であ
る。
【0036】
これらの剤形の各々についての好適な投与量は、食事といっしょに摂取されるカプセル
(剤形IIの場合では50又は100mgのトランスグルコシダーゼ)1ないし2個であ
るが、前記患者の食事及び/又は体重のサイズで投与量は変わる。幼児に対しては、食事
ごとにカプセル半分が摂取される場合がある。
【0037】
以下の実施例は限定の目的でなく例示の目的で提供される。
【実施例1】
【0038】
in vitroでのトランスグルコシダーゼ活性の測定
A. nigerトランスグルコシダーゼがイソマルターゼ活性をある程度有すること
は周知である。しかしトランスグルコシダーゼが例えば自閉症の人間でのイソマルターゼ
の欠損の治療に適するためには、トランスグルコシダーゼは以下の機能的特性を有さなけ
ればならない。
(a)1分子のイソマルトースを2分子のグルコースに切断することができなければな
らない。
(b)1分子のパラチノースを1分子のグルコースと1分子のフルクトースとにに切断
することができなければならない。
(c)グルコースのみか、グルコース及びフルクトースかが存在する場合に(a)又は
(b)のどちらかの逆反応を活性化してはならない。
(d)マルトースをイソマルトースに変換してはならない。
【0039】
これらの特性をテストするため、さまざまな量のA. nigerトランスグルコシダ
ーゼ(TG)が、イソマルトースのグルコースへの変換が確かに起こることを確認し、前
記変換のためにどのくらいの濃度のトランスグルコシダーゼが必要とされるか測定するた
めに、体温に近い温度の反応液中でイソマルトースと反応させられた。本検討の結果は図
1に示される。これらの結果は、TGは40μg/mL以上の濃度を要求し、確かにイソ
マルトースをグルコースに変換することを示す。70μg/mLを超える濃度は、付加的
な利益をほとんど提供しないことが分かった。ほとんど100%のイソマルトースのグル
コースへの変換率が観察された。これらの結果は、40−70μg/mLの間のTGの濃
度がこの変換にとって最適であることを示す。
【0040】
パラチノースをグルコース及びフルクトースに変換するTGの能力が、100μg/m
LのTGを含む反応液からのグルコースの解離を測定することにより試験された。パラチ
ノースの変換のためには、イソマルトースの変換のためよりも多くのTGを必要とするこ
とが知られている。図2は、100μg/mLの濃度のTGによる(グルコースへの変換
の百分率として測定される)パラチノースからのグルコースの経時的な解離を示す。図3
は、さまざまな濃度のTGでの反応90分後における、パラチノースのグルコースへの変
換の百分率を示す。180分で達成されるのはちょうど50%を超える変換率であり、イ
ソマルトースのグルコースへの変換よりは緩慢だったが、TGがパラチノースをグルコー
ス及びフルクトースに変換することが分かった。
【0041】
TGによりグルコースをイソマルトースに戻す変換をテストする実験では、試験液から
のグルコースの消失は認められず、イソマルトース、マルトースその他のいずれかの多糖
の形成はないことを示した。TGによるマルトースのイソマルトースへの変換をテストす
る検討では、テストされた(120μg/mLまでの)TGの濃度でマルトースのイソマ
ルトースへの変換は検出できなかった。
【0042】
以上のテストに基づいて、A. nigerトランスグルコシダーゼ(EC2.4.1
.24)は、定性的にはイソマルターゼ(EC3.2.1.10)の代用酵素の資格があ
ることが断定された。パラチノースは果物及び野菜の非常に微量な二糖成分なので、パラ
チノースの濃度とともにパラチノースの変換率がどの程度変化するかを決定するためにさ
らなるテストが実施された。一定のTG濃度及びインキュベーション時間に対してはパラ
チノース濃度が小さいほどグルコース及びフルクトースへの変換率は高くなり、変換率が
濃度依存的であることが断定された。
【0043】
これらの研究は、A. nigerトランスグルコシダーゼがin vitroテスト
により測定されたとおり、イソマルトースについての消化酵素として満足な活性を有する
ことを示す。A. nigerのTGはパラチノースに対する活性が小さいが、パラチノ
ースは炭水化物食品中の非常に微量な糖であるので、たとえ変換速度はより緩慢であると
しても、TGでの食事補充は満足である場合がある。
【実施例2】
【0044】
トランスグルコシダーゼを含む組成物のin vivoでの活性
自閉症の治療における本発明の組成物の有効性を評価するために、過去に自閉症と診断
された人間が、上述の剤形I又は剤形IIのどちらかか、剤形I及び剤形IIの両方かの
カプセル剤を与えられ、毎回の食事とともに1−2個のカプセル剤を摂取することを指示
された。患者、及び/又は、彼らの医師は、いずれかの望ましくない副作用か、アレルギ
ー反応又は発疹のような感受性型反応かに関する情報といっしょに、胃腸の不快感と、食
品への全体的な耐性と、自己刺激行動(stimming)と、多動性(hyperac
tivity)と、心的状態(mood)と、注意と、睡眠と、アイコンタクトと、話し
方と、社交性(socialization)と、強迫(compulsions)との
変化に関する情報を提供することを要求された。
【0045】
結果は、副作用がほとんどなく、患者からは利点についての勇気付けられる報告を受け
て、前記剤形が患者によく耐容されることを示した。
【0046】
本明細書では例示の目的で本発明の具体的な実施態様が記載されたが、以上の内容から
、本発明の精神及び範囲から逸脱することなしにさまざまな修正がされる場合があると認
識されるだろう。
【図面の簡単な説明】
【0047】
【図1】イソマルトースからのグルコースの放出に及ぼすA. nigerトランスグルコシダーゼの濃度増加の影響を示すグラフ。
【図2】固定濃度のトランスグルコシダーゼにより経時的にパラチノースから解離したグルコースの量を示すグラフ。
【図3】固定濃度のトランスグルコシダーゼによりさまざまな濃度のパラチノースから解離したグルコースの量を示すグラフ。
【特許請求の範囲】
【請求項1】
少なくとも1種類の付加的な炭水化物消化酵素と、トランスグルコシダーゼとを含む、
組成物。
【請求項2】
前記トランスグルコシダーゼはAspergillus niger由来である、請求
項1に記載の組成物。
【請求項3】
前記組成物は人間のイソマルターゼ又はパラチナーゼの欠損を補うのに有効な請求項1
に記載の組成物。
【請求項4】
前記少なくとも1種類の付加的な炭水化物消化酵素は、グルコアミラーゼ、マルターゼ
、モルトジアスターゼ、ラクターゼ、インベルターゼ及びアミラーゼからなる群から選択
される、請求項1に記載の組成物。
【請求項5】
少なくとも1種類の非炭水化物消化酵素を含む、請求項1に記載の組成物。
【請求項6】
前記非炭水化物消化酵素は、ペプチダーゼ、プロテアーゼ、システインプロテアーゼ、
フィターゼ、α−ガラクトシダーゼ、セルラーゼ、リパーゼ及びキシラナーゼからなる群
から選択される、請求項5に記載の組成物。
【請求項7】
前記ペプチダーゼはジペプチジルペプチダーゼIVである、請求項6に記載の組成物。
【請求項8】
前記システインプロテアーゼはブロメライン及びパパインからなる群から選択される、
請求項6に記載の組成物。
【請求項9】
グルコアミラーゼ、マルターゼ、モルトジアスターゼ、ラクターゼ、インベルターゼ及
びアミラーゼからなる群から選択される少なくとも1種類の酵素と、トランスグルコシダ
ーゼとを含む、組成物。
【請求項10】
前記組成物は、トランスグルコシダーゼ、グルコアミラーゼ、モルトジアスターゼ、ラ
クターゼ、インベルターゼ及びアミラーゼを含む、請求項9に記載の組成物。
【請求項11】
(a)トランスグルコシダーゼと、
(b)グルコアミラーゼ、マルターゼ、モルトジアスターゼ、ラクターゼ、インベルター
ゼ及びアミラーゼからなる群から選択される少なくとも1種類の成分と、
(c)ペプチダーゼ、プロテアーゼ、システインプロテアーゼ、フィターゼ、α−ガラク
トシダーゼ、セルラーゼ、リパーゼ及びキシラナーゼからなる群から選択される少なくと
も1種類の成分とを含む、組成物。
【請求項12】
前記組成物は、トランスグルコシダーゼ、アミラーゼ、モルトジアスターゼ、ラクター
ゼ、インベルターゼ、アミラーゼ、ペプチダーゼ、プロテアーゼ、システインプロテアー
ゼ、α−ガラクトシダーゼ、セルラーゼ及びキシラナーゼを含む、請求項11に記載の組
成物。
【請求項13】
トランスグルコシダーゼを含む組成物を患者に投与するステップを含む、患者における
イソマルターゼの欠損により特徴付けられる疾患の治療方法。
【請求項14】
前記トランスグルコシダーゼはAspergillus niger由来である、請求
項13に記載の治療方法。
【請求項15】
前記イソマルターゼの欠損により特徴付けられる疾患は、自閉症、炎症性腸疾患、クロ
ーン病、過敏性腸症候群及び潰瘍性大腸炎からなる群から選択される、請求項13に記載
の治療方法。
【請求項16】
前記組成物は少なくとも1種類の付加的な炭水化物消化酵素を含む、請求項13に記載
の治療方法。
【請求項17】
前記少なくとも1種類の付加的な炭水化物消化酵素は、グルコアミラーゼ、マルターゼ
、モルトジアスターゼ、ラクターゼ、インベルターゼ及びアミラーゼからなる群から選択
される、請求項16に記載の治療方法。
【請求項18】
前記組成物は少なくとも1種類の非炭水化物消化酵素をさらに含む、請求項13に記載
の治療方法。
【請求項19】
前記非炭水化物消化酵素は、ペプチダーゼ、プロテアーゼ、システインプロテアーゼ、
フィターゼ、α−ガラクトシダーゼ、セルラーゼ、リパーゼ及びキシラナーゼからなる群
から選択される、請求項18に記載の治療方法。
【請求項20】
前記ペプチダーゼはジペプチジルペプチダーゼIVである、請求項19に記載の治療方
法。
【請求項1】
少なくとも1種類の付加的な炭水化物消化酵素と、トランスグルコシダーゼとを含む、
組成物。
【請求項2】
前記トランスグルコシダーゼはAspergillus niger由来である、請求
項1に記載の組成物。
【請求項3】
前記組成物は人間のイソマルターゼ又はパラチナーゼの欠損を補うのに有効な請求項1
に記載の組成物。
【請求項4】
前記少なくとも1種類の付加的な炭水化物消化酵素は、グルコアミラーゼ、マルターゼ
、モルトジアスターゼ、ラクターゼ、インベルターゼ及びアミラーゼからなる群から選択
される、請求項1に記載の組成物。
【請求項5】
少なくとも1種類の非炭水化物消化酵素を含む、請求項1に記載の組成物。
【請求項6】
前記非炭水化物消化酵素は、ペプチダーゼ、プロテアーゼ、システインプロテアーゼ、
フィターゼ、α−ガラクトシダーゼ、セルラーゼ、リパーゼ及びキシラナーゼからなる群
から選択される、請求項5に記載の組成物。
【請求項7】
前記ペプチダーゼはジペプチジルペプチダーゼIVである、請求項6に記載の組成物。
【請求項8】
前記システインプロテアーゼはブロメライン及びパパインからなる群から選択される、
請求項6に記載の組成物。
【請求項9】
グルコアミラーゼ、マルターゼ、モルトジアスターゼ、ラクターゼ、インベルターゼ及
びアミラーゼからなる群から選択される少なくとも1種類の酵素と、トランスグルコシダ
ーゼとを含む、組成物。
【請求項10】
前記組成物は、トランスグルコシダーゼ、グルコアミラーゼ、モルトジアスターゼ、ラ
クターゼ、インベルターゼ及びアミラーゼを含む、請求項9に記載の組成物。
【請求項11】
(a)トランスグルコシダーゼと、
(b)グルコアミラーゼ、マルターゼ、モルトジアスターゼ、ラクターゼ、インベルター
ゼ及びアミラーゼからなる群から選択される少なくとも1種類の成分と、
(c)ペプチダーゼ、プロテアーゼ、システインプロテアーゼ、フィターゼ、α−ガラク
トシダーゼ、セルラーゼ、リパーゼ及びキシラナーゼからなる群から選択される少なくと
も1種類の成分とを含む、組成物。
【請求項12】
前記組成物は、トランスグルコシダーゼ、アミラーゼ、モルトジアスターゼ、ラクター
ゼ、インベルターゼ、アミラーゼ、ペプチダーゼ、プロテアーゼ、システインプロテアー
ゼ、α−ガラクトシダーゼ、セルラーゼ及びキシラナーゼを含む、請求項11に記載の組
成物。
【請求項13】
トランスグルコシダーゼを含む組成物を患者に投与するステップを含む、患者における
イソマルターゼの欠損により特徴付けられる疾患の治療方法。
【請求項14】
前記トランスグルコシダーゼはAspergillus niger由来である、請求
項13に記載の治療方法。
【請求項15】
前記イソマルターゼの欠損により特徴付けられる疾患は、自閉症、炎症性腸疾患、クロ
ーン病、過敏性腸症候群及び潰瘍性大腸炎からなる群から選択される、請求項13に記載
の治療方法。
【請求項16】
前記組成物は少なくとも1種類の付加的な炭水化物消化酵素を含む、請求項13に記載
の治療方法。
【請求項17】
前記少なくとも1種類の付加的な炭水化物消化酵素は、グルコアミラーゼ、マルターゼ
、モルトジアスターゼ、ラクターゼ、インベルターゼ及びアミラーゼからなる群から選択
される、請求項16に記載の治療方法。
【請求項18】
前記組成物は少なくとも1種類の非炭水化物消化酵素をさらに含む、請求項13に記載
の治療方法。
【請求項19】
前記非炭水化物消化酵素は、ペプチダーゼ、プロテアーゼ、システインプロテアーゼ、
フィターゼ、α−ガラクトシダーゼ、セルラーゼ、リパーゼ及びキシラナーゼからなる群
から選択される、請求項18に記載の治療方法。
【請求項20】
前記ペプチダーゼはジペプチジルペプチダーゼIVである、請求項19に記載の治療方
法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2008−521906(P2008−521906A)
【公表日】平成20年6月26日(2008.6.26)
【国際特許分類】
【出願番号】特願2007−544439(P2007−544439)
【出願日】平成17年11月30日(2005.11.30)
【国際出願番号】PCT/US2005/043175
【国際公開番号】WO2006/060414
【国際公開日】平成18年6月8日(2006.6.8)
【出願人】(507181660)カークマン グループ インコーポレイテッド (1)
【出願人】(507181671)ナショナル エンザイム カンパニー インコーポレイテッド (1)
【Fターム(参考)】
【公表日】平成20年6月26日(2008.6.26)
【国際特許分類】
【出願日】平成17年11月30日(2005.11.30)
【国際出願番号】PCT/US2005/043175
【国際公開番号】WO2006/060414
【国際公開日】平成18年6月8日(2006.6.8)
【出願人】(507181660)カークマン グループ インコーポレイテッド (1)
【出願人】(507181671)ナショナル エンザイム カンパニー インコーポレイテッド (1)
【Fターム(参考)】
[ Back to top ]

