アシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キット
【課題】 試料中のアシアロGM1や抗アシアロGM1抗体を高感度、高精度かつ短時間で測定することができ、しかも、アシアロGM1や抗アシアロGM1抗体を検査する検査実施機関によって検査結果が異なることを減少させ、診断基準を統一することができる、アシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットを提供する。
【解決手段】 アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも、第1抗体としての抗アシアロGM1抗体が固定されている基板、第2抗体としての結合性物質Aで修飾された修飾化抗アシアロGM1抗体、前記結合性物質Aと対応して結合する結合性物質Bで修飾された標識物質および前記標識物質と反応して発色する基質を包含することを特徴とする。
【解決手段】 アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも、第1抗体としての抗アシアロGM1抗体が固定されている基板、第2抗体としての結合性物質Aで修飾された修飾化抗アシアロGM1抗体、前記結合性物質Aと対応して結合する結合性物質Bで修飾された標識物質および前記標識物質と反応して発色する基質を包含することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本願発明は、アシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットに関するものである。
【背景技術】
【0002】
アシアロGM1(アシアロガングリオシド)は、ガングリオシド(シアル酸を構成糖とするスフィンゴ糖脂質の総称)よりシアル酸残基がはずれたもので、糖脂質の一種である。
このアシアロGM1は、各種疾患の検査にマーカーとして利用されている。たとえば、急性に発症する神経炎の一種であるギラン・バレー症候群や自己免疫性神経疾患等の検査に利用したり、また、腸管障害の検査に利用することも提案されている(特許文献1参照)。たとえば、この特許文献1記載の検査においては、マウスの糞便中のアシアロGM1とフコシルアシアロGM1の含量を、抗アシアロGM1抗体と抗フコシルアシアロGM1抗体を利用した薄層クロマトグラフィ免疫染色法で測定することで、腸管障害を検査している。
【0003】
しかしながら、特許文献1記載のような薄層クロマトグラフィを用いた検査では、抽出操作や薄層クロマトグラフィプレート上での展開操作も必要であり、長時間を要するという問題があった。
【0004】
一方、目的の被測定物質を試料中から、高い検出感度で、しかも簡便な測定操作で検出および測定できる、抗原抗体反応を利用した免疫学的測定方法(ELISA法)が知られているが、このELISA法をアシアロGM1の検出に適用した場合、検査実施機関ごとに使用している試薬類やそのグレードの違いや、検出用抗体である抗アシアロGM1抗体の由来やグレード等(たとえば、IgGやIgM等といったサブクラスの違い、ポリクローナルやモノクローナル等といったクローン、つまり抗原認識部位の違い等)が統一されていないため、交差反応等の影響により検査データに誤差が生じ、検査実施機関によって診断結果が異なる、つまり診断基準が統一できないという問題があった。
【特許文献1】特開平6-265542号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
そこで、本願発明は、以上のとおりの背景から、従来のアシアロGM1の免疫学的測定技術の問題点を解決すべく、試料中のアシアロGM1や抗アシアロGM1抗体を高感度、高精度かつ短時間で測定することができ、しかも、アシアロGM1や抗アシアロGM1抗体を検査する検査実施機関によって検査結果が異なることを減少させ、診断基準を統一することができる、新しいアシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットを提供することを課題としている。
【課題を解決するための手段】
【0006】
本願発明は、前記の課題を解決するものとして、第1には、アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての結合性物質Aで修飾された修飾化抗アシアロGM1抗体;
<3>前記結合性物質Aと対応して結合する結合性物質Bで修飾された標識物質;および
<4>前記標識物質と反応して発色する基質;
を具備することを特徴とし、第2には、結合性物質Aおよび結合性物質Bは、それぞれビオチンまたはストレプトアビジンであることを特徴とする。
【0007】
また、本願発明は、第3には、上記第1または第2の発明を用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として結合性物質Aで修飾された修飾化抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体の結合性物質Aに、結合性物質Bで修飾された標識物質を接触させる工程;
<4>前記標識物質と反応して発色する基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とする。
【0008】
第4には、アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての抗アシアロGM1抗体;
<3>第2抗体と結合する、標識物質で修飾された標識抗体;および
<4>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とする。
【0009】
第5には、上記第4の発明を用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体に、第2抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<4>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とする。
【0010】
さらに、本願発明は、第6には、抗アシアロGM1抗体を特異的に認識し結合する標識抗体を用いた抗アシアロGM1抗体の免疫学的測定キットであって、少なくとも
<1>アシアロGM1が固定されている基板;
<2>抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体;および
<3>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とする。
【0011】
そして、第7には、上記第6の発明を用いた抗アシアロGM1抗体の免疫学的測定方法であって、少なくとも以下の工程
<1>アシアロGM1が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<3>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<4>基質の発色量を測定する工程;
を含むことを特徴とする。
【発明の効果】
【0012】
本願第1から第5の発明によれば、アシアロGM1を、高感度かつ高精度に測定でき、測定に要する時間を短縮でき、しかも、アシアロGM1を検査する検査実施機関によって検査結果が異なることを減少させることができる。
【0013】
また、第6および第7の発明によれば、抗アシアロGM1抗体を、高感度かつ高精度に測定でき、測定に要する時間を短縮でき、しかも、抗アシアロGM1抗体を検査する検査実施機関によって検査結果が異なることを減少させることができる。
【発明を実施するための最良の形態】
【0014】
本願発明は、上記のとおりの特徴をもつものであるが、以下にその実施の形態について詳しく説明する。
【0015】
本願発明は、自己免疫性神経疾患の検査マーカーである、生体成分(特に血中)に含まれるアシアロGM1(アシアロガングリオシド)または抗アシアロGM1抗体を測定の対象とした、免疫学的測定キットである。
【0016】
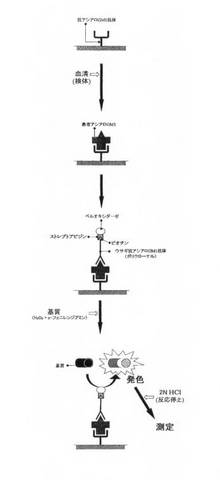
すなわち、図1に例示したように、本願発明は、第1に、このアシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも、
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としてのビオチン等の結合性物質Aで修飾された修飾化抗アシアロGM1抗体;
<3>前記結合性物質Aと対応して結合するストレプトアビジン等の結合性物質Bで修飾された酵素や蛍光タンパク質等の標識物質;および
<4>前記標識物質と反応して発色する基質;
を具備することを特徴としている。さらに、必要に応じて、発色を停止させるため、塩酸や硫酸等の発色停止剤を具備してもよい。
【0017】
このアシアロGM1の免疫学的測定キットを用いた測定方法について説明すると、まず、試験管や培養シャーレ、測定プレート等の基板(担体)上に、第1抗体として抗アシアロGM1抗体を固定した、第1抗体固相化基板を用意する。このとき、第1抗体としての抗アシアロGM1抗体は、ポリクローナル抗体でもよいし、モノクローナル抗体でもよい。なお、アシアロGM1との特異的な結合反応を高めるには、モノクローナル抗体であることが好ましい。
【0018】
第1工程として、前記第1抗体固相化基板に、たとえば、ヒトやサル、マウス、ラット、ヒツジ、ウマ等の生体から公知の方法で被測定試料(たとえば、血液)を採取し、必要に応じて前処理を行って希釈調整した被測定試料を接触させることで、第1抗体固相化基板の第1抗体と被測定試料中に含まれるアシアロGM1とを結合させる。もちろん、被測定試料の由来は、上記生体由来である天然の試料に限定されるものではない。
【0019】
つづいて、第2工程として、リン酸緩衝液(PBS)やトリス緩衝液(TBS)等の洗浄液で、第2工程における余分な成分(たとえば、未結合のアシアロGM1等)を洗浄した後、前記被測定試料に、第2抗体として結合性物質Aで修飾された修飾化抗アシアロGM1抗体を接触させることで、被測定試料中に含まれるアシアロGM1に、第2抗体がさらに結合し、アシアロGM1は、第1抗体と第2抗体との間に挟まれた状態(サンドイッチ)となる。このとき、第2抗体は、ポリクローナル抗体でもモノクローナル抗体であってもよい。なお、洗浄液には、必要に応じて、界面活性剤としてTween-20(登録商標)やTriton-X(登録商標)等や、ブロッキング剤としてスキムミルクやウシ血清アルブミン(BSA)等を含有させてもよい。
【0020】
第3の工程として、第2工程と同様に洗浄液で、余分な成分(たとえば、未結合の第2抗体等)を洗浄した後、前記第2抗体の結合性物質Aに、結合性物質Bで修飾された標識物質を接触させる。この結合性物質Aおよび結合性物質Bの両物質による結合は特異的で強いことや、その取り扱いの容易性から、この結合性物質Aおよび結合性物質Bは、それぞれ、たとえば、ビオチンまたはストレプトアビジン等の生体結合性物質であることが好ましい。つまり、結合性物質Aがビオチンの場合は、結合性物質Bはストレプトアビジンとし、一方、結合性物質Aがストレプトアビジンの場合は、結合性物質Bはビオチンとする。また、標識物質は、たとえば、西洋わさび由来ペルオキシターゼ等の酵素や、緑色蛍光タンパク質や赤色蛍光タンパク質等の蛍光タンパク質、放射線物質、また、サマリウム、ユウロピウム、テルビウム等のランタノイド等が使用できる。
【0021】
第4の工程として、第2工程および第3工程と同様に洗浄液で、余分な成分(たとえば、未結合の標識物質等)を洗浄した後、前記標識物質と反応して発色する基質を接触させ、基質を発色させる。このとき、基質は、標識物質に合わせたものを適宜に採択する。たとえば、標識物質がペルオキシターゼの場合、基質としてo-フェニレンジアミンを使用することで、基質を発色させることができる。
【0022】
そして、第5の工程として、上記第1の工程から第4の工程によって、基質の発色を、吸光度測定器、分光光度計や蛍光測定器、マルチラベルカウンター等で測定する。
【0023】
なお、第4の工程の発色操作の後に、必要に応じて、発色停止剤を添加し、基質の発色反応を停止してもよい。この発色停止剤は、標識物質と基質の発色反応系に合わせて適宜に選択する。たとえば、標識物質がペルオキシターゼで、基質がo-フェニレンジアミンである発色反応系の場合には、塩酸を利用して発色を停止させることができる。
【0024】
また、本願発明は、図2に例示したように、第2に、上記アシアロGM1の測定において、
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての抗アシアロGM1抗体;
<3>第2抗体と結合する、標識物質で修飾された標識抗体;および
<4>標識抗体の標識物質と反応して発色する基質;
を特徴とした測定キットでもよい。
【0025】
この場合、基本的な工程および使用できる抗体の由来、標識物質の種類等は、上記第1の測定方法とほぼ同様であるが、第2抗体である抗アシアロGM1抗体(モノクロ−ナル抗体でもよいし、ポリクローナル抗体でもよい)を認識して結合する、標識物質で修飾された標識抗体を用いるため、第2抗体には標識物質による修飾は施されていない。また、この第2の測定キットおよびこの測定キットを用いた測定方法においても、必要に応じて、上記のような発色を停止させる発色停止操作を行ってもよい。
【0026】
このような本願発明の測定においては、対象となる被測定物質を含む試料とともに、基準となる既知濃度の標準物質(本願発明において、アシアロGM1)を同時測定することで、試料中のアシアロGM1を正確に定量することができる。この測定結果は、抗アシアロGM1抗体の特異性や活性、また、標準物質でアシアロGM1の純度に左右されるが、特に本願発明のアシアロGM1は精製度の高い方法で調製している。たとえば、ウシ脳やラット脳から抽出したり、また、免疫したウサギより採血し、血清を分離採取したものを硫酸アンモニウムにて塩析後、リン酸緩衝液(PBS)に透析してγグロブリン分画を取得したりする。
【0027】
このような本願発明によって、ギラン・バレー症候群や自己免疫性神経疾患等の検査および診断ために、その検査マーカーである血中等のアシアロGM1を、高感度かつ高精度に測定でき、測定に要する時間を短縮できる。しかも、抗体等を含めた測定試薬を「測定キット」として統一することで、アシアロGM1を検査する検査実施機関によって検査結果が異なることを減少させることができ、医療機関における診断結果の正確性および信頼性を向上させることができる。
【0028】
そして、第3に、本願発明は、図3に例示したように、抗アシアロGM1抗体を特異的に認識し、結合する標識抗体を用いた抗アシアロGM1抗体の免疫学的測定キットでもある。具体的には、少なくとも
<1>アシアロGM1が固定されている基板;
<2>抗アシアロGM1抗体(IgGタイプ、IgMタイプを問わない)と結合する、標識物質で修飾された標識抗体;および
<3>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴としている。このとき、試料中の抗アシアロGM1抗体のタイプとしては、上記のとおり、IgGタイプおよびIgMタイプを問わないため、標識抗体は、たとえば、抗ヒトIgG抗体でもよいし、抗ヒトIgM抗体でもよい。また、発色停止剤を具備してもよい。
【0029】
そして、この抗アシアロGM1抗体の免疫学的測定キットを用いた抗アシアロGM1抗体の免疫学的測定方法としては、少なくとも以下の工程
<1>前記アシアロGM1固相化基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<3>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<4>基質の発色量を測定する工程;
を含むことを特徴としており、基本的な工程は上記第1および第2のアシアロGM1測定キットを用いた測定方法とほぼ同様であり、測定対象を、たとえば、血中の「抗アシアロGM1抗体」としている点で異なる。
【0030】
この抗アシアロGM1抗体の免疫学的測定方法においても、必要に応じて発色操作の後に塩酸や硫酸等の発色停止剤を添加してもよい。
【0031】
本願発明における、抗アシアロGM1抗体は、市販のものでもよいし、公知である種々の抗体作製方法によって作製することもできる。たとえば、抗原感作させたラットやマウス、ウサギ、ヒツジ、ヤギ等の動物の血清免疫グロブリンの画分から、抗原アフィニティーカラム等を利用して精製したり(ポリクローナル抗体)、抗体産生細胞と骨髄腫細胞株とを融合させて融合細胞を作製する細胞融合法を利用して抗体を作製したり(モノクローナル抗体)、さらに遺伝子組換え技術によっても抗体を作製することができる(モノクローナル抗体)。
【0032】
一般に、ポリクローナル抗体と比べ、モノクローナル抗体には以下の問題がある。すなわち、(1)モノクローナル抗体は、結合性の弱い抗体しか得ることができない場合があり、検出感度が低下する可能性があった。また、(2)モノクローナル抗体には交差反応を示すものもあるため、この場合は、結合性の強い抗体であっても正確性を欠くことが予想できる。さらに、(3)モノクローナル抗体作製には多くの時間とコストを要すること、および、免疫原となるアシアロGM1は、正常マウスにとって自己成分であることから、通常の方法による抗アシアロGM1モノクローナル抗体の大量生産は困難であった。このような問題を解消するため、本願発明における抗アシアロGM1抗体はポリクローナル抗体であることが好ましい。
【0033】
また、抗体を標識物質で修飾するには、たとえば、その扱い易さや結合強度から、ビオチンやストレプトアビジン等のような生体結合性物質を利用することが考慮できる。
【0034】
以下に実施例を説明し、さらに詳しく本願発明のアシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットについて説明する。もちろん、以下の例によって発明が限定されることはない。
【実施例】
【0035】
実施例1:アシアロGM1の免疫学的定量測定
図1に沿って、アシアロGM1の免疫学的測定キット(ELISAキット)について説明する。
【0036】
(1)抗アシアロGM1ポリクローナル抗体が固定化されている96穴マイクロプレートを基板(担体)として利用した。なお、基板への抗アシアロGM1ポリクローナル抗体の固定化には、炭酸緩衝液(pH 9.6)にて希釈して、たとえば、96穴マイクロプレートを基板(担体)とした場合には、各穴に100μLずつ添加し、4℃にて一晩静置してインキュベーションすることで、固定化させた。
【0037】
(2)各穴に、300μLの0.05%Tween20含有PBS(pH 7.4)(以下、PBS−Tとする)を添加して、洗浄することを3回繰り返して行った。洗浄後、余分なPBS−Tを、可能な限り除去した。
【0038】
(3)非特異的な吸着を防止するため、1%(W/V)のウシ血清アルブミン含有のリン酸緩衝液(以下、PBS−BSAとする)を、全穴に200μLずつ添加し、プレートにシールし、室温(20〜25℃)にて1時間、反応させブロッキングを行った。その後、PBS−BSAを捨て、可能な限り除去した。
【0039】
(4)試料として、患者血清を100μLずつ添加した。また、患者血清中のアシアロGM1濃度を算出するために、精製アシアロGM1(和光純薬製:凍結乾燥品をあらかじめエタノール1mLにて溶解し、使用まで−20℃にて保存)を、1%(W/V)BSAおよび0.05%(v/v)Tween20含有PBS(以下、Diluting Bufferとする)にて、0.2、1、5、25、125(ng/mL)に希釈し、それぞれを各穴に100μLずつ添加した。なお、対照として、100μLのDiluting Bufferのみを添加した穴も準備した。そして、プレートにシールして、室温で2時間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0040】
(5)次に、再度PBS―Tで3回洗浄した後、1%ウシ血清アルブミン溶液で希釈した、2次抗体であるビオチン標識抗アシアロGM1ポリクローナル抗体を、上記Diluting Bufferにて0.25μg/mLに希釈し、プレートに100μLずつ分注し、プレートにシールをして室温(20〜25℃)で2時間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0041】
(6)各穴を、またPBS‐Tで5回洗浄した後、1%ウシ血清アルブミン溶液で希釈したストレプトアビジン‐西洋ワサビ由来ペルオキシダーゼ(和光純薬製)を、上記Diluting Bufferにて10,000倍希釈し、プレートの各穴に100μLずつ分注し、室温(20〜25℃)で30分間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0042】
(7)各穴をPBS‐Tで8回洗浄した後、基質液として、1%のH2O2と1μg/mLのo−フェニレンジアミン溶液との混合液(和光純薬製)を調製し、これを各穴に100μLずつ添加し、プレートにシールを貼付して37℃で30分間反応させた。
【0043】
(8)その後、反応停止液として、2N塩酸(HCl)を各穴に100μLずつ添加し静かに攪拌し、反応を停止させ、波長490nmの吸光度をプレートリーダー(マルチラベルカウンター、ARVO1420)にて測定した。その結果、顕著な発色を検出することができた。つまり、血中のアシアロGM1を検出することができた。なお、精製アシアロGM1を添加していない箇所の測定結果を、ブランクとした。
【0044】
(9)結果、濃度既知の精製アシアロGM1の吸光度を縦軸に、濃度を横軸にとり、検量線を求めた(図4)。吸光度は、試料中のアシアロGM1および標準物質である精製アシアロGM1と結合したビオチン標識抗アシアロGM1抗体量と比例するので、各試料中のアシアロGM1の濃度は、試料の吸光度と検量線との交点より求められ、定量することができた。
実施例2:抗アシアロGM1抗体の免疫学的定量測定
図3に沿って、抗アシアロGM1抗体の免疫学的測定キット(ELISAキット)について説明する。
【0045】
(1)アシアロGM1が固定化されている96穴マイクロプレートを基板(担体)として利用した。なお、基板へのアシアロGM1(和光純薬製;凍結乾燥品をエタノール1mLにて溶解したもので、使用まで−20℃にて保存)の固定化には、エタノールにて1μg/mLに希釈して、たとえば、96穴マイクロプレートを基板(担体)の各穴に100μlずつ添加し、室温(20〜25℃)にて4時間静置し、各穴を乾燥することで、固定化させた。
【0046】
(2)各穴に、300μLの0.05%Tween20含有PBS(pH 7.4)(以下、PBS−Tとする)を添加して、洗浄することを3回繰り返して行った。洗浄後、余分なPBS−Tを、可能な限り除去した。
【0047】
(3)非特異的な吸着を防止するため、1%(W/V)のウシ血清アルブミン含有のリン酸緩衝液(以下、PBS−BSAとする)を、全穴に200μLずつ添加し、プレートにシールし、室温(20〜25℃)にて1時間、反応させブロッキングを行った。その後、PBS−BSAを捨て、可能な限り除去した。
【0048】
(4)定量用として抗アシアロGM1ポリクローナル抗体(和光純薬製)を、1%(W/V)BSAおよび0.05%(v/v)Tween20含有PBS(以下、Diluting Bufferとする)にて100倍〜6400倍まで倍々に希釈したもの、および試料としての患者血清をDiluting Bufferにて100倍希釈したものそれぞれを、プレートの各穴に100μLずつ添加した。また、陰性対照(ネガティブコントロール)として、100μLのDiluting Bufferのみを添加した穴も準備した。そして、プレートにシールして、4℃にて一晩反応させた。反応後、反応液を捨て、可能な限り除去した。
【0049】
(5)再度、PBS-Tで3回洗浄した。その後、上記Diluting Bufferで0.25μg/mLに希釈したビオチン標識抗ヒトIgG抗体またはビオチン標識抗ヒトIgM抗体(いずれも、和光純薬製)を、試料を加えた各穴に100μLずつ分注した。また、抗アシアロGM1抗体を加えた穴には、上記Diluting Bufferで0.25μg/mLに希釈した、2次抗体としてのビオチン標識抗ウサギIgG抗体(和光純薬製)を100μL加えた。そして、プレートにシールをして、室温(20〜25℃)で2時間反応させた。なお、陰性対照(ネガティブコントロール)として、100μLのDiluting Bufferのみを添加した穴も準備した。反応後、反応液を捨て、可能な限り除去した。
【0050】
(6)各穴をPBS−Tで6回洗浄した後、上記Diluting Bufferで、10000倍に希釈したストレプトアビジン‐西洋ワサビ由来ペルオキシダーゼ(和光純薬製)を、各穴に100μlずつ分注し、プレートにシールをして、室温(20〜25℃)で30分間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0051】
(7)そして、各穴をPBS−Tで8回洗浄した後、基質液として、1%のH2O2と1μg/mLのo−フェニレンジアミン溶液との混合液(和光純薬製)を調製し、これを各穴に100μLずつ添加し、プレートにシールを貼付して37℃で30分間反応させた。
【0052】
(8)その後、反応停止液として、2N塩酸(HCl)を各穴に100μLずつ添加して静かに攪拌し、発色を停止させ、波長490nmの吸光度をプレートリーダー(マルチラベルカウンター、ARVO1420)にて測定した。結果、顕著な発色を検出することができた。つまり、血中の抗アシアロGM1抗体を検出することができた。なお、精製アシアロGM1を添加していない箇所を、ブランクとした。
【0053】
(9)以上の方法により測定した抗アシアロGM1抗体の吸光度を縦軸に、抗体の希釈倍数を横軸にとり標準曲線を求めた(図5)。標準曲線は、シグモイド曲線となり、抗体の最高吸光度の半値(50%値)を示す時の希釈倍数を標準曲線より求めた。このときの抗体の結合活性を1unitと規定した。試料の吸光度と標準曲線との交点より、試料中の抗アシアロGM1抗体活性(unit)を求めた。そして、試料を100倍希釈して測定したため、求めた抗アシアロGM1抗体活性を100倍して、補正し、血清中の抗アシアロGM1抗体活性とした。
【図面の簡単な説明】
【0054】
【図1】本願発明にかかるアシアロGM1の免疫学的測定方法の工程を例示した模式図である。
【図2】本願発明にかかるアシアロGM1の免疫学的測定方法における、別の実施形態での工程を例示した模式図である。
【図3】本願発明にかかる抗アシアロGM1抗体の免疫学的測定方法の工程を例示した模式図である。
【図4】本願発明における標準物質である精製アシアロGM1の検量線を示した図である。
【図5】本願発明における抗アシアロGM1抗体の標準曲線を示した図である。
【技術分野】
【0001】
本願発明は、アシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットに関するものである。
【背景技術】
【0002】
アシアロGM1(アシアロガングリオシド)は、ガングリオシド(シアル酸を構成糖とするスフィンゴ糖脂質の総称)よりシアル酸残基がはずれたもので、糖脂質の一種である。
このアシアロGM1は、各種疾患の検査にマーカーとして利用されている。たとえば、急性に発症する神経炎の一種であるギラン・バレー症候群や自己免疫性神経疾患等の検査に利用したり、また、腸管障害の検査に利用することも提案されている(特許文献1参照)。たとえば、この特許文献1記載の検査においては、マウスの糞便中のアシアロGM1とフコシルアシアロGM1の含量を、抗アシアロGM1抗体と抗フコシルアシアロGM1抗体を利用した薄層クロマトグラフィ免疫染色法で測定することで、腸管障害を検査している。
【0003】
しかしながら、特許文献1記載のような薄層クロマトグラフィを用いた検査では、抽出操作や薄層クロマトグラフィプレート上での展開操作も必要であり、長時間を要するという問題があった。
【0004】
一方、目的の被測定物質を試料中から、高い検出感度で、しかも簡便な測定操作で検出および測定できる、抗原抗体反応を利用した免疫学的測定方法(ELISA法)が知られているが、このELISA法をアシアロGM1の検出に適用した場合、検査実施機関ごとに使用している試薬類やそのグレードの違いや、検出用抗体である抗アシアロGM1抗体の由来やグレード等(たとえば、IgGやIgM等といったサブクラスの違い、ポリクローナルやモノクローナル等といったクローン、つまり抗原認識部位の違い等)が統一されていないため、交差反応等の影響により検査データに誤差が生じ、検査実施機関によって診断結果が異なる、つまり診断基準が統一できないという問題があった。
【特許文献1】特開平6-265542号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
そこで、本願発明は、以上のとおりの背景から、従来のアシアロGM1の免疫学的測定技術の問題点を解決すべく、試料中のアシアロGM1や抗アシアロGM1抗体を高感度、高精度かつ短時間で測定することができ、しかも、アシアロGM1や抗アシアロGM1抗体を検査する検査実施機関によって検査結果が異なることを減少させ、診断基準を統一することができる、新しいアシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットを提供することを課題としている。
【課題を解決するための手段】
【0006】
本願発明は、前記の課題を解決するものとして、第1には、アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての結合性物質Aで修飾された修飾化抗アシアロGM1抗体;
<3>前記結合性物質Aと対応して結合する結合性物質Bで修飾された標識物質;および
<4>前記標識物質と反応して発色する基質;
を具備することを特徴とし、第2には、結合性物質Aおよび結合性物質Bは、それぞれビオチンまたはストレプトアビジンであることを特徴とする。
【0007】
また、本願発明は、第3には、上記第1または第2の発明を用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として結合性物質Aで修飾された修飾化抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体の結合性物質Aに、結合性物質Bで修飾された標識物質を接触させる工程;
<4>前記標識物質と反応して発色する基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とする。
【0008】
第4には、アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての抗アシアロGM1抗体;
<3>第2抗体と結合する、標識物質で修飾された標識抗体;および
<4>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とする。
【0009】
第5には、上記第4の発明を用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体に、第2抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<4>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とする。
【0010】
さらに、本願発明は、第6には、抗アシアロGM1抗体を特異的に認識し結合する標識抗体を用いた抗アシアロGM1抗体の免疫学的測定キットであって、少なくとも
<1>アシアロGM1が固定されている基板;
<2>抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体;および
<3>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とする。
【0011】
そして、第7には、上記第6の発明を用いた抗アシアロGM1抗体の免疫学的測定方法であって、少なくとも以下の工程
<1>アシアロGM1が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<3>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<4>基質の発色量を測定する工程;
を含むことを特徴とする。
【発明の効果】
【0012】
本願第1から第5の発明によれば、アシアロGM1を、高感度かつ高精度に測定でき、測定に要する時間を短縮でき、しかも、アシアロGM1を検査する検査実施機関によって検査結果が異なることを減少させることができる。
【0013】
また、第6および第7の発明によれば、抗アシアロGM1抗体を、高感度かつ高精度に測定でき、測定に要する時間を短縮でき、しかも、抗アシアロGM1抗体を検査する検査実施機関によって検査結果が異なることを減少させることができる。
【発明を実施するための最良の形態】
【0014】
本願発明は、上記のとおりの特徴をもつものであるが、以下にその実施の形態について詳しく説明する。
【0015】
本願発明は、自己免疫性神経疾患の検査マーカーである、生体成分(特に血中)に含まれるアシアロGM1(アシアロガングリオシド)または抗アシアロGM1抗体を測定の対象とした、免疫学的測定キットである。
【0016】
すなわち、図1に例示したように、本願発明は、第1に、このアシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも、
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としてのビオチン等の結合性物質Aで修飾された修飾化抗アシアロGM1抗体;
<3>前記結合性物質Aと対応して結合するストレプトアビジン等の結合性物質Bで修飾された酵素や蛍光タンパク質等の標識物質;および
<4>前記標識物質と反応して発色する基質;
を具備することを特徴としている。さらに、必要に応じて、発色を停止させるため、塩酸や硫酸等の発色停止剤を具備してもよい。
【0017】
このアシアロGM1の免疫学的測定キットを用いた測定方法について説明すると、まず、試験管や培養シャーレ、測定プレート等の基板(担体)上に、第1抗体として抗アシアロGM1抗体を固定した、第1抗体固相化基板を用意する。このとき、第1抗体としての抗アシアロGM1抗体は、ポリクローナル抗体でもよいし、モノクローナル抗体でもよい。なお、アシアロGM1との特異的な結合反応を高めるには、モノクローナル抗体であることが好ましい。
【0018】
第1工程として、前記第1抗体固相化基板に、たとえば、ヒトやサル、マウス、ラット、ヒツジ、ウマ等の生体から公知の方法で被測定試料(たとえば、血液)を採取し、必要に応じて前処理を行って希釈調整した被測定試料を接触させることで、第1抗体固相化基板の第1抗体と被測定試料中に含まれるアシアロGM1とを結合させる。もちろん、被測定試料の由来は、上記生体由来である天然の試料に限定されるものではない。
【0019】
つづいて、第2工程として、リン酸緩衝液(PBS)やトリス緩衝液(TBS)等の洗浄液で、第2工程における余分な成分(たとえば、未結合のアシアロGM1等)を洗浄した後、前記被測定試料に、第2抗体として結合性物質Aで修飾された修飾化抗アシアロGM1抗体を接触させることで、被測定試料中に含まれるアシアロGM1に、第2抗体がさらに結合し、アシアロGM1は、第1抗体と第2抗体との間に挟まれた状態(サンドイッチ)となる。このとき、第2抗体は、ポリクローナル抗体でもモノクローナル抗体であってもよい。なお、洗浄液には、必要に応じて、界面活性剤としてTween-20(登録商標)やTriton-X(登録商標)等や、ブロッキング剤としてスキムミルクやウシ血清アルブミン(BSA)等を含有させてもよい。
【0020】
第3の工程として、第2工程と同様に洗浄液で、余分な成分(たとえば、未結合の第2抗体等)を洗浄した後、前記第2抗体の結合性物質Aに、結合性物質Bで修飾された標識物質を接触させる。この結合性物質Aおよび結合性物質Bの両物質による結合は特異的で強いことや、その取り扱いの容易性から、この結合性物質Aおよび結合性物質Bは、それぞれ、たとえば、ビオチンまたはストレプトアビジン等の生体結合性物質であることが好ましい。つまり、結合性物質Aがビオチンの場合は、結合性物質Bはストレプトアビジンとし、一方、結合性物質Aがストレプトアビジンの場合は、結合性物質Bはビオチンとする。また、標識物質は、たとえば、西洋わさび由来ペルオキシターゼ等の酵素や、緑色蛍光タンパク質や赤色蛍光タンパク質等の蛍光タンパク質、放射線物質、また、サマリウム、ユウロピウム、テルビウム等のランタノイド等が使用できる。
【0021】
第4の工程として、第2工程および第3工程と同様に洗浄液で、余分な成分(たとえば、未結合の標識物質等)を洗浄した後、前記標識物質と反応して発色する基質を接触させ、基質を発色させる。このとき、基質は、標識物質に合わせたものを適宜に採択する。たとえば、標識物質がペルオキシターゼの場合、基質としてo-フェニレンジアミンを使用することで、基質を発色させることができる。
【0022】
そして、第5の工程として、上記第1の工程から第4の工程によって、基質の発色を、吸光度測定器、分光光度計や蛍光測定器、マルチラベルカウンター等で測定する。
【0023】
なお、第4の工程の発色操作の後に、必要に応じて、発色停止剤を添加し、基質の発色反応を停止してもよい。この発色停止剤は、標識物質と基質の発色反応系に合わせて適宜に選択する。たとえば、標識物質がペルオキシターゼで、基質がo-フェニレンジアミンである発色反応系の場合には、塩酸を利用して発色を停止させることができる。
【0024】
また、本願発明は、図2に例示したように、第2に、上記アシアロGM1の測定において、
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての抗アシアロGM1抗体;
<3>第2抗体と結合する、標識物質で修飾された標識抗体;および
<4>標識抗体の標識物質と反応して発色する基質;
を特徴とした測定キットでもよい。
【0025】
この場合、基本的な工程および使用できる抗体の由来、標識物質の種類等は、上記第1の測定方法とほぼ同様であるが、第2抗体である抗アシアロGM1抗体(モノクロ−ナル抗体でもよいし、ポリクローナル抗体でもよい)を認識して結合する、標識物質で修飾された標識抗体を用いるため、第2抗体には標識物質による修飾は施されていない。また、この第2の測定キットおよびこの測定キットを用いた測定方法においても、必要に応じて、上記のような発色を停止させる発色停止操作を行ってもよい。
【0026】
このような本願発明の測定においては、対象となる被測定物質を含む試料とともに、基準となる既知濃度の標準物質(本願発明において、アシアロGM1)を同時測定することで、試料中のアシアロGM1を正確に定量することができる。この測定結果は、抗アシアロGM1抗体の特異性や活性、また、標準物質でアシアロGM1の純度に左右されるが、特に本願発明のアシアロGM1は精製度の高い方法で調製している。たとえば、ウシ脳やラット脳から抽出したり、また、免疫したウサギより採血し、血清を分離採取したものを硫酸アンモニウムにて塩析後、リン酸緩衝液(PBS)に透析してγグロブリン分画を取得したりする。
【0027】
このような本願発明によって、ギラン・バレー症候群や自己免疫性神経疾患等の検査および診断ために、その検査マーカーである血中等のアシアロGM1を、高感度かつ高精度に測定でき、測定に要する時間を短縮できる。しかも、抗体等を含めた測定試薬を「測定キット」として統一することで、アシアロGM1を検査する検査実施機関によって検査結果が異なることを減少させることができ、医療機関における診断結果の正確性および信頼性を向上させることができる。
【0028】
そして、第3に、本願発明は、図3に例示したように、抗アシアロGM1抗体を特異的に認識し、結合する標識抗体を用いた抗アシアロGM1抗体の免疫学的測定キットでもある。具体的には、少なくとも
<1>アシアロGM1が固定されている基板;
<2>抗アシアロGM1抗体(IgGタイプ、IgMタイプを問わない)と結合する、標識物質で修飾された標識抗体;および
<3>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴としている。このとき、試料中の抗アシアロGM1抗体のタイプとしては、上記のとおり、IgGタイプおよびIgMタイプを問わないため、標識抗体は、たとえば、抗ヒトIgG抗体でもよいし、抗ヒトIgM抗体でもよい。また、発色停止剤を具備してもよい。
【0029】
そして、この抗アシアロGM1抗体の免疫学的測定キットを用いた抗アシアロGM1抗体の免疫学的測定方法としては、少なくとも以下の工程
<1>前記アシアロGM1固相化基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<3>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<4>基質の発色量を測定する工程;
を含むことを特徴としており、基本的な工程は上記第1および第2のアシアロGM1測定キットを用いた測定方法とほぼ同様であり、測定対象を、たとえば、血中の「抗アシアロGM1抗体」としている点で異なる。
【0030】
この抗アシアロGM1抗体の免疫学的測定方法においても、必要に応じて発色操作の後に塩酸や硫酸等の発色停止剤を添加してもよい。
【0031】
本願発明における、抗アシアロGM1抗体は、市販のものでもよいし、公知である種々の抗体作製方法によって作製することもできる。たとえば、抗原感作させたラットやマウス、ウサギ、ヒツジ、ヤギ等の動物の血清免疫グロブリンの画分から、抗原アフィニティーカラム等を利用して精製したり(ポリクローナル抗体)、抗体産生細胞と骨髄腫細胞株とを融合させて融合細胞を作製する細胞融合法を利用して抗体を作製したり(モノクローナル抗体)、さらに遺伝子組換え技術によっても抗体を作製することができる(モノクローナル抗体)。
【0032】
一般に、ポリクローナル抗体と比べ、モノクローナル抗体には以下の問題がある。すなわち、(1)モノクローナル抗体は、結合性の弱い抗体しか得ることができない場合があり、検出感度が低下する可能性があった。また、(2)モノクローナル抗体には交差反応を示すものもあるため、この場合は、結合性の強い抗体であっても正確性を欠くことが予想できる。さらに、(3)モノクローナル抗体作製には多くの時間とコストを要すること、および、免疫原となるアシアロGM1は、正常マウスにとって自己成分であることから、通常の方法による抗アシアロGM1モノクローナル抗体の大量生産は困難であった。このような問題を解消するため、本願発明における抗アシアロGM1抗体はポリクローナル抗体であることが好ましい。
【0033】
また、抗体を標識物質で修飾するには、たとえば、その扱い易さや結合強度から、ビオチンやストレプトアビジン等のような生体結合性物質を利用することが考慮できる。
【0034】
以下に実施例を説明し、さらに詳しく本願発明のアシアロGM1の免疫学的測定キット並びに抗アシアロGM1抗体の免疫学的測定キットについて説明する。もちろん、以下の例によって発明が限定されることはない。
【実施例】
【0035】
実施例1:アシアロGM1の免疫学的定量測定
図1に沿って、アシアロGM1の免疫学的測定キット(ELISAキット)について説明する。
【0036】
(1)抗アシアロGM1ポリクローナル抗体が固定化されている96穴マイクロプレートを基板(担体)として利用した。なお、基板への抗アシアロGM1ポリクローナル抗体の固定化には、炭酸緩衝液(pH 9.6)にて希釈して、たとえば、96穴マイクロプレートを基板(担体)とした場合には、各穴に100μLずつ添加し、4℃にて一晩静置してインキュベーションすることで、固定化させた。
【0037】
(2)各穴に、300μLの0.05%Tween20含有PBS(pH 7.4)(以下、PBS−Tとする)を添加して、洗浄することを3回繰り返して行った。洗浄後、余分なPBS−Tを、可能な限り除去した。
【0038】
(3)非特異的な吸着を防止するため、1%(W/V)のウシ血清アルブミン含有のリン酸緩衝液(以下、PBS−BSAとする)を、全穴に200μLずつ添加し、プレートにシールし、室温(20〜25℃)にて1時間、反応させブロッキングを行った。その後、PBS−BSAを捨て、可能な限り除去した。
【0039】
(4)試料として、患者血清を100μLずつ添加した。また、患者血清中のアシアロGM1濃度を算出するために、精製アシアロGM1(和光純薬製:凍結乾燥品をあらかじめエタノール1mLにて溶解し、使用まで−20℃にて保存)を、1%(W/V)BSAおよび0.05%(v/v)Tween20含有PBS(以下、Diluting Bufferとする)にて、0.2、1、5、25、125(ng/mL)に希釈し、それぞれを各穴に100μLずつ添加した。なお、対照として、100μLのDiluting Bufferのみを添加した穴も準備した。そして、プレートにシールして、室温で2時間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0040】
(5)次に、再度PBS―Tで3回洗浄した後、1%ウシ血清アルブミン溶液で希釈した、2次抗体であるビオチン標識抗アシアロGM1ポリクローナル抗体を、上記Diluting Bufferにて0.25μg/mLに希釈し、プレートに100μLずつ分注し、プレートにシールをして室温(20〜25℃)で2時間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0041】
(6)各穴を、またPBS‐Tで5回洗浄した後、1%ウシ血清アルブミン溶液で希釈したストレプトアビジン‐西洋ワサビ由来ペルオキシダーゼ(和光純薬製)を、上記Diluting Bufferにて10,000倍希釈し、プレートの各穴に100μLずつ分注し、室温(20〜25℃)で30分間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0042】
(7)各穴をPBS‐Tで8回洗浄した後、基質液として、1%のH2O2と1μg/mLのo−フェニレンジアミン溶液との混合液(和光純薬製)を調製し、これを各穴に100μLずつ添加し、プレートにシールを貼付して37℃で30分間反応させた。
【0043】
(8)その後、反応停止液として、2N塩酸(HCl)を各穴に100μLずつ添加し静かに攪拌し、反応を停止させ、波長490nmの吸光度をプレートリーダー(マルチラベルカウンター、ARVO1420)にて測定した。その結果、顕著な発色を検出することができた。つまり、血中のアシアロGM1を検出することができた。なお、精製アシアロGM1を添加していない箇所の測定結果を、ブランクとした。
【0044】
(9)結果、濃度既知の精製アシアロGM1の吸光度を縦軸に、濃度を横軸にとり、検量線を求めた(図4)。吸光度は、試料中のアシアロGM1および標準物質である精製アシアロGM1と結合したビオチン標識抗アシアロGM1抗体量と比例するので、各試料中のアシアロGM1の濃度は、試料の吸光度と検量線との交点より求められ、定量することができた。
実施例2:抗アシアロGM1抗体の免疫学的定量測定
図3に沿って、抗アシアロGM1抗体の免疫学的測定キット(ELISAキット)について説明する。
【0045】
(1)アシアロGM1が固定化されている96穴マイクロプレートを基板(担体)として利用した。なお、基板へのアシアロGM1(和光純薬製;凍結乾燥品をエタノール1mLにて溶解したもので、使用まで−20℃にて保存)の固定化には、エタノールにて1μg/mLに希釈して、たとえば、96穴マイクロプレートを基板(担体)の各穴に100μlずつ添加し、室温(20〜25℃)にて4時間静置し、各穴を乾燥することで、固定化させた。
【0046】
(2)各穴に、300μLの0.05%Tween20含有PBS(pH 7.4)(以下、PBS−Tとする)を添加して、洗浄することを3回繰り返して行った。洗浄後、余分なPBS−Tを、可能な限り除去した。
【0047】
(3)非特異的な吸着を防止するため、1%(W/V)のウシ血清アルブミン含有のリン酸緩衝液(以下、PBS−BSAとする)を、全穴に200μLずつ添加し、プレートにシールし、室温(20〜25℃)にて1時間、反応させブロッキングを行った。その後、PBS−BSAを捨て、可能な限り除去した。
【0048】
(4)定量用として抗アシアロGM1ポリクローナル抗体(和光純薬製)を、1%(W/V)BSAおよび0.05%(v/v)Tween20含有PBS(以下、Diluting Bufferとする)にて100倍〜6400倍まで倍々に希釈したもの、および試料としての患者血清をDiluting Bufferにて100倍希釈したものそれぞれを、プレートの各穴に100μLずつ添加した。また、陰性対照(ネガティブコントロール)として、100μLのDiluting Bufferのみを添加した穴も準備した。そして、プレートにシールして、4℃にて一晩反応させた。反応後、反応液を捨て、可能な限り除去した。
【0049】
(5)再度、PBS-Tで3回洗浄した。その後、上記Diluting Bufferで0.25μg/mLに希釈したビオチン標識抗ヒトIgG抗体またはビオチン標識抗ヒトIgM抗体(いずれも、和光純薬製)を、試料を加えた各穴に100μLずつ分注した。また、抗アシアロGM1抗体を加えた穴には、上記Diluting Bufferで0.25μg/mLに希釈した、2次抗体としてのビオチン標識抗ウサギIgG抗体(和光純薬製)を100μL加えた。そして、プレートにシールをして、室温(20〜25℃)で2時間反応させた。なお、陰性対照(ネガティブコントロール)として、100μLのDiluting Bufferのみを添加した穴も準備した。反応後、反応液を捨て、可能な限り除去した。
【0050】
(6)各穴をPBS−Tで6回洗浄した後、上記Diluting Bufferで、10000倍に希釈したストレプトアビジン‐西洋ワサビ由来ペルオキシダーゼ(和光純薬製)を、各穴に100μlずつ分注し、プレートにシールをして、室温(20〜25℃)で30分間反応させた。反応後、反応液を捨て、可能な限り除去した。
【0051】
(7)そして、各穴をPBS−Tで8回洗浄した後、基質液として、1%のH2O2と1μg/mLのo−フェニレンジアミン溶液との混合液(和光純薬製)を調製し、これを各穴に100μLずつ添加し、プレートにシールを貼付して37℃で30分間反応させた。
【0052】
(8)その後、反応停止液として、2N塩酸(HCl)を各穴に100μLずつ添加して静かに攪拌し、発色を停止させ、波長490nmの吸光度をプレートリーダー(マルチラベルカウンター、ARVO1420)にて測定した。結果、顕著な発色を検出することができた。つまり、血中の抗アシアロGM1抗体を検出することができた。なお、精製アシアロGM1を添加していない箇所を、ブランクとした。
【0053】
(9)以上の方法により測定した抗アシアロGM1抗体の吸光度を縦軸に、抗体の希釈倍数を横軸にとり標準曲線を求めた(図5)。標準曲線は、シグモイド曲線となり、抗体の最高吸光度の半値(50%値)を示す時の希釈倍数を標準曲線より求めた。このときの抗体の結合活性を1unitと規定した。試料の吸光度と標準曲線との交点より、試料中の抗アシアロGM1抗体活性(unit)を求めた。そして、試料を100倍希釈して測定したため、求めた抗アシアロGM1抗体活性を100倍して、補正し、血清中の抗アシアロGM1抗体活性とした。
【図面の簡単な説明】
【0054】
【図1】本願発明にかかるアシアロGM1の免疫学的測定方法の工程を例示した模式図である。
【図2】本願発明にかかるアシアロGM1の免疫学的測定方法における、別の実施形態での工程を例示した模式図である。
【図3】本願発明にかかる抗アシアロGM1抗体の免疫学的測定方法の工程を例示した模式図である。
【図4】本願発明における標準物質である精製アシアロGM1の検量線を示した図である。
【図5】本願発明における抗アシアロGM1抗体の標準曲線を示した図である。
【特許請求の範囲】
【請求項1】
アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての結合性物質Aで修飾された修飾化抗アシアロGM1抗体;
<3>前記結合性物質Aと対応して結合する結合性物質Bで修飾された標識物質;および
<4>前記標識物質と反応して発色する基質;
を具備することを特徴とするアシアロGM1の免疫学的測定キット。
【請求項2】
結合性物質Aおよび結合性物質Bは、それぞれビオチンまたはストレプトアビジンである請求項1に記載のアシアロGM1の免疫学的測定キット。
【請求項3】
請求項1または2に記載のアシアロGM1の免疫学的測定キットを用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として結合性物質Aで修飾された修飾化抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体の結合性物質Aに、結合性物質Bで修飾された標識物質を接触させる工程;
<4>前記標識物質と反応して発色する基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とするアシアロGM1の免疫学的測定方法。
【請求項4】
アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての抗アシアロGM1抗体;
<3>第2抗体と結合する、標識物質で修飾された標識抗体;および
<4>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とするアシアロGM1の免疫学的測定キット。
【請求項5】
請求項4に記載のアシアロGM1の免疫学的測定キットを用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体に、第2抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<4>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とするアシアロGM1の免疫学的測定方法。
【請求項6】
抗アシアロGM1抗体を特異的に認識し結合する標識抗体を用いた抗アシアロGM1抗体の免疫学的測定キットであって、少なくとも
<1>アシアロGM1が固定されている基板;
<2>抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体;および
<3>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とする抗アシアロGM1抗体の免疫学的測定キット。
【請求項7】
請求項6に記載の抗アシアロGM1抗体の免疫学的測定キットを用いた抗アシアロGM1抗体の免疫学的測定方法であって、少なくとも以下の工程
<1>アシアロGM1が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<3>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<4>基質の発色量を測定する工程;
を含むことを特徴とする抗アシアロGM1抗体の免疫学的測定方法。
【請求項1】
アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての結合性物質Aで修飾された修飾化抗アシアロGM1抗体;
<3>前記結合性物質Aと対応して結合する結合性物質Bで修飾された標識物質;および
<4>前記標識物質と反応して発色する基質;
を具備することを特徴とするアシアロGM1の免疫学的測定キット。
【請求項2】
結合性物質Aおよび結合性物質Bは、それぞれビオチンまたはストレプトアビジンである請求項1に記載のアシアロGM1の免疫学的測定キット。
【請求項3】
請求項1または2に記載のアシアロGM1の免疫学的測定キットを用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として結合性物質Aで修飾された修飾化抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体の結合性物質Aに、結合性物質Bで修飾された標識物質を接触させる工程;
<4>前記標識物質と反応して発色する基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とするアシアロGM1の免疫学的測定方法。
【請求項4】
アシアロGM1を特異的に認識し結合する抗アシアロGM1抗体を用いたアシアロGM1の免疫学的測定キットであって、少なくとも
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板;
<2>第2抗体としての抗アシアロGM1抗体;
<3>第2抗体と結合する、標識物質で修飾された標識抗体;および
<4>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とするアシアロGM1の免疫学的測定キット。
【請求項5】
請求項4に記載のアシアロGM1の免疫学的測定キットを用いたアシアロGM1の免疫学的測定方法であって、少なくとも以下の工程
<1>第1抗体としての抗アシアロGM1抗体が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、第2抗体として抗アシアロGM1抗体を接触させる工程;
<3>前記第2抗体に、第2抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<4>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<5>基質の発色量を測定する工程;
を含むことを特徴とするアシアロGM1の免疫学的測定方法。
【請求項6】
抗アシアロGM1抗体を特異的に認識し結合する標識抗体を用いた抗アシアロGM1抗体の免疫学的測定キットであって、少なくとも
<1>アシアロGM1が固定されている基板;
<2>抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体;および
<3>標識抗体の標識物質と反応して発色する基質;
を具備することを特徴とする抗アシアロGM1抗体の免疫学的測定キット。
【請求項7】
請求項6に記載の抗アシアロGM1抗体の免疫学的測定キットを用いた抗アシアロGM1抗体の免疫学的測定方法であって、少なくとも以下の工程
<1>アシアロGM1が固定されている基板に、被測定試料を接触させる工程;
<2>前記被測定試料に、抗アシアロGM1抗体と結合する、標識物質で修飾された標識抗体を接触させる工程;
<3>前記標識抗体の標識物質に基質を接触させ、基質を発色させる工程;および
<4>基質の発色量を測定する工程;
を含むことを特徴とする抗アシアロGM1抗体の免疫学的測定方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2006−284330(P2006−284330A)
【公開日】平成18年10月19日(2006.10.19)
【国際特許分類】
【出願番号】特願2005−103682(P2005−103682)
【出願日】平成17年3月31日(2005.3.31)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
【公開日】平成18年10月19日(2006.10.19)
【国際特許分類】
【出願日】平成17年3月31日(2005.3.31)
【出願人】(504145364)国立大学法人群馬大学 (352)
【Fターム(参考)】
[ Back to top ]

