ナトリウム利尿ペプチド類を含有する安定化した組成物
ナトリウム利尿ペプチドと有効に安定化させる量の(i)アルキルもしくはアリールスルホニルフルオリドプロテアーゼインヒビター; または(ii) ベンズアミジンを含んでなる、これらのペプチド類の安定化した組成物。
【発明の詳細な説明】
【技術分野】
【0001】
発明の背景
本発明は、一般的にはナトリウム利尿ペプチド類、特にB型ナトリウム利尿ペプチド(BNP)の安定な組成物、そして対照物質として使用するため、例えばうっ血性心不全(CHF)の患者の診断および病期判断のために使用されるこの生化学的マーカーについてのBNP試験操作の性能を監査するための該組成物に関する。本発明はまた、こうした組成物の調製にも関する。
【背景技術】
【0002】
心不全とは、心疾患がもたらす複合臨床症候であって、心室収縮もしくは拡張機能、またはその両方が損なわれる。これは、心臓が酸素および身体の代謝必要物を供給するために十分な量の血液を送り出すことができないことによる結果である。うっ血性心不全とは、心臓が身体の要求に適応させるために十分な酸素に富む血液を供給できない、臨床的症状である。この心機能の低下の結果として、体液が肺および末梢血管腔内に蓄積されることがある。CHFのもっとも一般的な原因は虚血性心疾患である。CHFのその他の原因は高血圧、心筋炎および心臓弁膜症である。
【0003】
ナトリウム利尿ペプチド類はホルモンの1種であって、血圧、電解質バランスおよび血流量を調節する。心房性ナトリウム利尿ペプチド(ANP)は心臓の心房起源の28-アミノ酸ホルモンである。B型ナトリウム利尿ペプチド(当初は「脳性ナトリウム利尿ペプチド」と称された)は、心室から分泌される32-アミノ酸ホルモンである。筋細胞内では、BNPはプレプロBNP(134-アミノ酸ペプチド)から誘導され、これが切断されてプロBNP(108-アミノ酸ペプチド)と別の26-アミノ酸ペプチドになる。その他のナトリウム利尿ペプチド類はC型ナトリウム利尿ペプチド(CNP)およびマンバ(Dendroaspis)ナトリウム利尿ペプチド(DNP)である。ANPおよびBNPは心臓ナトリウム利尿系に属し、心筋細胞起源のもので、広範囲の生物学的特性を共有している。CNPは内皮細胞起源であり、脳および脳脊髄液中に見られる。しかし心臓中にはあるとしてもごくわずかである。DNPはグリーンマンバの毒液から単離されたが、ANP、BNPおよびCNPと構造的に類似性がある。うっ血性心不全の患者では、DNP様免疫反応性の上昇が見られた。
【0004】
天然および合成ナトリウム利尿ペプチド類の両方、ならびにそれらの誘導体は、周知であり、合成ナトリウム利尿ペプチド類の調製方法も同様によく知られている。
【0005】
CHF患者では、プロBNPの断片[BNPおよびN末端BNP(NTプロBNP)]の血漿濃度が上昇し、患者の臨床的悪性度および左心室駆出分画率、そして罹患率および死亡率を正確に予測することが示された。近年、うっ血性心不全の診断および重症度分類のために、このCHF病の悪性度の指標が使用されるようになった。New York Heart AssociationのCHF分類によれば、BNPの平均濃度はステージIからIVに順次増大する。多施設臨床試験で、ステージI、II、II、およびIVのうっ血性心不全について、それぞれ71 pg/ml、204 pg/ml、349 pg/ml、および1022 pg/mlの平均BNP濃度が観察された。ステージIVのCHFはこの疾病の最重症度を表し、どんな肉体運動も不快感を伴わずにはできなくなる結果をもたらす心臓病として定義される。この疾病のこのステージの患者は休息中でも心臓病の症候または冠不全症候群を示すことがある。さらに、これらの患者の不快度は、何らかの肉体運動を行うと増大するようになる。
【0006】
多様な技法を使用するBNPの診断試験が文献中に記載されており、臨床研究業界に紹介されている。BNPの測定に関する市販の定量試験法のいくつかとして、Abbott AxSYM(登録商標)、Bayer ADVIA Centaur(登録商標)、およびBiosite Triage(登録商標)BNPアッセイがある。Abbott AxSYMアッセイはMicroparticle Enzyme Immunoassay(微粒子酵素イムノアッセイ)(MEIA)技法を利用するが、これはヒトBNP抗原に結合する抗BNPモノクローナル抗体でコーティングした微粒子を使用するものである。微粒子上のこれらの抗原-抗体複合体はその後別のモノクローナル抗BNPアルカリホスファターゼコンジュゲートで処理される。その最終の複合体はその後、1蛍光基質からの1リン酸基の除去を触媒して、蛍光産物を生成させる。次にこの産物の蛍光強度を光学アセンブリによって測定して、BNPの濃度を決定する。Biosite Triage BNPアッセイは免疫蛍光アッセイの1種である。このアッセイでは、マウス組み換えポリクローナル抗体を蛍光標識に結合させ、ジスルフィド結合が介在するBNPの環状構造に対するマウスモノクローナル抗体を固相に結合させる。このアッセイでは、血漿を蛍光抗体コンジュゲートと反応させる。一定のインキュベーション時間後、BNPと蛍光抗体コンジュゲートの複合体を検出用レーンの1つに捕捉させる。検体のBNP濃度は検出用レーンに結合した蛍光に比例するので、次にこれを手動蛍光分析機で定量的に測定する。Bayer ADVIA Centaurアッセイは化学発光技法を使用する2部位サンドイッチ免疫アッセイである。このアッセイで使用する第1抗体は、アクリジウムエステルで標識した、BNP上の環状構造に特異的なモノクローナルマウス抗ヒトBNPである。第2抗体(固相)は、BNPのC末端部分に特異的なビオチン化モノクローナルマウス抗ヒト抗体であって、これがストレプトアビジン磁性粒子に連結されている。Abbott AxSYM、Biosite Triage、およびBayer ADVIA Centaur BNPアッセイの検出限界はそれぞれ15、5、および2 pg/mLである。
【0007】
臨床診断試験では、高品質対照物質を定期的に使用して、臨床試験方法および操作の的確性および精度を監査する。高品質対照物質は予想されるすべての分析変数に対して、現実の患者サンプルと同程度の感度がなければならない。さらに、高品質対照物質は安定であって、その対象分析物の濃度はそのアッセイでの医学的判定ポイントに対抗するものでなければならない。高品質対照物質のその他の望ましい特色は低コスト、ロット毎の再現性、および製造の容易性である。
【0008】
いくつかのBNP対照物質が現在市場で入手可能であり、これらとして装置製造会社、AbbottおよびBayerからのものが含まれる。Abbott社のBNP対照物質(REF 8G82-10)はウシタンパク質安定剤ならびに防腐剤、アジ化ナトリウムおよびProClin 300を含む酢酸塩バッファー中のBNPで組成される3レベルの液状対照物質である。この一般的なタイプのアッセイのいくつかが米国公開特許出願、2005/0014287(Frieseら)および2005/0014289 (Parsonsら)に記載されている。Bayer BNP対照物質(REF 02817045)は、アジ化ナトリウムを含む緩衝化したカゼイン酸ナトリウム中の合成ヒトBNPを含む3レベルの凍結乾燥対照物質である。
【0009】
BNP対照物質は、このペプチドが血清または血漿中で低安定性であるので、典型的にはヒト血清または血漿の代わりに人工的で緩衝化したマトリックスを使用して製造される。BNPのin vivoでの半減期(t1/2)は約23分である。これらの人工マトリックス中でも、BNPの安定性はあまり長期ではない。例えば、Bayer BNP対照物質(緩衝化カゼイン酸ナトリウム)中のBNPは再構成して2-8℃で貯蔵したとき、5日間しか安定でない。
【0010】
BNPは特異的細胞受容体およびエンドペプチダーゼによって循環系から排除される。BNPの低安定性の主要な理由は、血漿または血清中の天然のプロテアーゼの存在によるものと見られる。安定なBNP対照物質を製造する目的で、このペプチドを酸化的および酵素的分解から保護するために、例えば以下のようないくつかの手法を使用することができる。
【0011】
1) プロテアーゼの触媒部位について基質として不適合性とするための、BNPの誘導体化。
【0012】
2) 封じ込め(caging)効果を提供することによってBNPを保護するための、高分子量分子の使用。
【0013】
3) 血清または血漿中に存在する天然のプロテアーゼを不活性化するための加熱の使用。
【0014】
4) プロテアーゼ上の触媒部位についてBNPと競合させるための非特異的基質の使用。
【0015】
5) 還元剤(群)の使用。
【0016】
6) プロテアーゼの触媒活性を排除または最少化するための強力で特異的なインヒビター(群)の使用(これに使用されてきた特異的インヒビターとして、金属プロテアーゼの可逆的インヒビターであるEDTA、および多数のセリンプロテアーゼ類のインヒビターであるアプロチニンが含まれる)。
【発明の開示】
【発明が解決しようとする課題】
【0017】
上記の手法の大部分は非効果的、高価であり、かつ/または専用で特別注文の装置および容器を必要とすることが明らかであって、タンパク質の変性、濁度の増大、およびイムノアッセイで使用する分析用シグナルの障害の結果になることもある。液状ヒト血清中のBNPを安定化する試みにおいて、プロテアーゼ群を同定し、特異的プロテアーゼを少数のプロテアーゼインヒビターおよび適切な還元剤の使用によって無力化することは、上記のその他の手法よりも多くの利点を持つことは明らかである。
【0018】
したがって、BNPおよびその他のナトリウム利尿ペプチドのアッセイで使用するための、血清を基剤とする安定な高品質対照物質の需要がある。また、何らかの好適な用途、例えば、ナトリウム利尿ペプチド類の性質および/または挙動の研究の実施の際の、一般的なこれらのペプチドの安定組成物の需要もある。本発明はこれらの需要を満足させ、高品質対照物質の以下のようなその他の基本的な必要条件: 基剤マトリックスとしてヒトまたはその他の哺乳動物の血清または血漿の使用による、分析用変数に対する患者サンプルと同様の応答性、アッセイの線形動力学範囲に対抗し得る対象数値を持つこと、ならびに長期使用のための開封容器および密閉容器での許容し得る安定性の具備、にも合致する。
【課題を解決するための手段】
【0019】
発明の概要
一般的に、本発明は内在性または外来性ナトリウム利尿ペプチド類(天然、合成、もしくは組み換え)を含有または含んでなる安定組成物を含む。さらに特定すると、本発明はヒトを含む哺乳動物の血漿または血清、特にヒト血漿または血清、さらに特別の場合、処理したヒト血漿をも含んでなる組成物を含む。さらにより特定すると、本発明はナトリウム利尿ペプチド類および1種以上の場合によって置換されたアルキルもしくはアリールスルホニルフルオリドプロテアーゼインヒビター、またはベンズアミジンを含有または含んでなる安定組成物を含む。こうした組成物は例えば、BNPまたはその他のナトリウム利尿ペプチド類を使用する各種の臨床試験方法の性能を監査するための標準物質を調製するために使用することができる。この組成物はまた、ナトリウム利尿ペプチド類の性質または挙動の研究を実施するなどの、安定化したナトリウム利尿ペプチド組成物のその他の用途のためにも調製することができる。
【0020】
本発明のその他の態様中、本発明はこうした対照用組成物を含む、ナトリウム利尿ペプチドをアッセイするためのキットを含む。さらに別の態様中、本発明はこうした安定組成物を調製するための方法を含む。
【発明を実施するための最良の形態】
【0021】
発明の詳細な説明
上記のように、本発明は一般的に、内在性または外来性ナトリウム利尿ペプチド類(天然、合成、もしくは組み換え)を含有または含んでなる安定組成物を含む。さらに特定すると、本発明はヒトまたはその他の哺乳動物の血漿または血清、特に処理したヒト血漿をも含んでなる組成物を含む。さらにより特定すると、本発明はナトリウム利尿ペプチド類および本明細書に記載する1種以上の特異的プロテアーゼインヒビターを含有または含んでなる安定組成物を含む。こうした組成物は例えば、BNPまたはその他のナトリウム利尿ペプチド類を使用する各種の臨床試験方法の性能を監査するための標準物質を調製するために使用することができる。この組成物はまた、安定化させたナトリウム利尿ペプチド組成物のその他の用途のためにも調製することができる。
【0022】
本発明の別の態様中、本発明はこうした組成物を調製するための方法を含む。
【0023】
本明細書で使用する用語「ナトリウム利尿ペプチド」および「ナトリウム利尿ペプチド類」として、一般的にこうしたペプチド類、特にANP、BNP、CNPおよびDNP、さらにこうしたペプチドの前駆体、プロ-およびプレプロ-ペプチドなど、例えば上記のプロBNPおよびプレプロBNPが含まれる。この用語には外来性もしくは内在性にかかわらず、天然に存在するもの、または合成のもの、または組み換えDNA技術によって調製されたもののいずれの物質も含まれる。
【0024】
本発明によって、一定の、場合によって置換されたアルキルおよびアリールスルホニルフルオリドならびにベンズアミジンが本発明の組成物中に使用するために好適なプロテアーゼインヒビターであることが決定された。フェニルメチルスルホニルフルオリド(PMSF)および4-アミジノフェニルメタンスルホニルフルオリド(APMSF)はセリンプロテアーゼ活性を阻害するために使用されてきている。これらの化合物は触媒部位でセリン残基と共有結合反応をする。
【0025】
本発明の組成物、キットおよび方法での使用に好適なアルキルおよびアリールスルホニルフルオリドは、(標識カゼインまたはその他の好適なペプチド基質などの基質を使用したときに)トリプシン、キモトリプシン、エラスターゼ、プラスミン、トロンビンまたはカリクレインのタンパク質分解活性を阻害するものである。
【0026】
本明細書で使用する用語「アルキル」は、完全に飽和し、示された炭素原子の数(すなわちC1-C10は1〜10炭素原子)を持つ、直鎖もしくは分枝鎖、または非芳香族環式の炭化水素ラジカル、あるいはそれらの組み合わせを意味する。非環式アルキル基の例として限定するわけではないが、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、t-ブチル、イソブチル、sec-ブチル、例えばn-ペンチル、n-ヘキシル、n-ヘプチル、n-オクチルの相同体および異性体、などの基が含まれる。環式アルキル基の例として、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどが含まれる。本発明での使用のためには、アルキル基はどんな所望のサイズのものでもよい。好ましくはそれらは8個まで、より好ましくは4個までの炭素原子を含むものとなる。
【0027】
本発明で使用する化合物のアルキル基は非置換でも、1もしくは多置換のものでもよい。許容される置換基として、対象となる化合物のプロテアーゼ阻害活性を有意に妨害しない限り、こうした部分分子に普通に見られるものが含まれる。典型的な置換基として、以下が含まれる: ハロ、ヒドロキシ、アミノ、アミド、ニトロ、シアノ、アルコキシ、オキソ、ならびに場合によって置換されたアルキルをさらに含有する置換基、アルキルアミノ、ハロアルキルアミノ、ハロアルコキシなど。
【0028】
置換アルキルまたはシクロアルキル基としてアリールアルキル基、すなわち1種以上のアリール基で置換されたアルキル(シクロアルキルを含む)基も含まれる。例えばベンジル、フェネチル、トリフェニルメチル、シクロヘキシルメチル、シクロプロピルメチルなどである。これらには、置換基として1個のアリール基を持つ、比較的小さいシクロアルキル基、フェニルシクロプロピルなど、も含まれる。アリールアルキル基中の芳香族環または環群はその他の脂肪族基と同様にさらに置換されていてもよく、例えばクロロフェニル、メチルベンジルその他である。置換アルキル基として、1種以上の飽和または不飽和ヘテロ環式基によって置換されたアルキル基も含まれる。例えばピリジルメチル、ピリジルメチル、ピペリジニルメチル、ピロリジニルメチル、モルホリニルメチル、キノリルメチル、その他である。こうした基は1種以上のハロゲン、ヒドロキシル基、低級アルキル基、または低級アルコキシ基(こうした基の組み合わせを含む)で置換されていてもよい。
【0029】
本明細書で使用する「アリール」とは、典型的な置換または非置換のこのクラスの非脂肪族ヒドロカルビル基、すなわちポリ不飽和の、典型的には芳香族の炭化水素置換基を称し、これは単環でも、または互いに縮合するか共有結合した(3環までの)多環でもよく、フェニル、ナフチルなどである。このクラスの部分分子にはインダニルその他などの縮合環部分分子も含まれる。芳香族部分の置換基は脂肪族基についてのものと同様である。本明細書で使用する「アリール」には類似のヘテロ環基(ときには「ヘテロ芳香族」基と称される)、すなわち環内に炭素原子とそのほかに1種以上のヘテロ原子、典型的には酸素、窒素、硫黄および/またはリン、を含有するポリ不飽和環式部分分子も含まれ、ピリジニル、ピラジニル、ピラゾリル、チエニル、フリル、チアゾリル、イミダゾリル、ピロリル、その他と、ベンゾオキサゾリル、ベンゾチアゾリル、その他などの縮合環部分分子がある。これらは場合によって以下のような1種以上の置換基で置換されていてもよい: ハロゲン、ヒドロキシ、アミノ、場合によって置換された低級アルキル、場合によって置換されたアシル、場合によって置換された低級アルコキシ、アルキレンオキシ、アルキレンジオキシ、場合によって置換されたアリールアセトアミド、など。
【0030】
用語「アシル」とは、有機酸からヒドロキシ基の除去によって誘導される基を称する。アシル基の例として、アセチル、プロピオニル、ドデカノイル、テトラデカノイル、イソブチリルなどが含まれる。したがって、本明細書で使用する用語「アシル」は、別に-C(O)-アルキル(ここでアルキルは上記定義の通り)として定義される基を含むことを意味している。
【0031】
本発明で使用するためのアルキルおよびアリールスルホニルフルオリドの適合性は上記のように、プロテアーゼインヒビターとしてのそれらの活性、すなわち、ヒト血清または血漿中の天然に存在するプロテアーゼの、ナトリウム利尿ペプチド類を切断することによって、これらのマトリックス中でのこれらのペプチドの分解および低安定性をもたらす能力を排除または最少化する効力、に基づくものである。プロテアーゼインヒビターとしての活性が未知の候補化合物を、比較的単純なアッセイを使用して、本発明での使用についてスクリーニングすることができる。それは、この可能性があるインヒビターを酵素(群)/プロテアーゼ(群)とともに一定の温度で一定期間インキュベートするものである。阻害効果を判定するため、発色性基質またはBNPをこのプロテアーゼ-インヒビター混合物に添加し、利用可能な分離および分析方法(クロマトグラフィー、比色分析、イムノアッセイ、その他)を使用して、切断または分解の程度を判定することができる。同様のアッセイを使用して、好適なプロテアーゼインヒビターであることがわかった所定のスルホニルフルオリドについて、阻害最少濃度を決定することができる。
【0032】
スルホニルフルオリドクラスの特に強力で不可逆的なプロテアーゼインヒビター、したがって本発明での使用の対象となるインヒビターの1つは、(2-アミノエチル)-ベンゼンスルホニルフルオリド(AEBSF、化学式: C8H10NO2SF.HCl、分子量: 239.7)である。これは無視できるほどの毒性と、広範囲の阻害活性を示し、また弱塩基性(pH 8-9)条件下で極めて徐々にしか酸化されない。その上、触媒部位でのセリン残基との共有結合後、加水分解による活性プロテアーゼへの復活は観察されない。AEBSFのその他の利点は、水および水性媒体中での良好な溶解性とその選択性である。例えば、トロンビン活性に対する阻害活性は血清アルブミンの存在中で遅滞しない。したがって、AEBSFは血清または血漿などのマトリックス中での使用に十分適合する。
【0033】
本発明の組成物および方法中での使用に好適なスルホニルフルオリドとして以下が含まれる: メタンスルホニルフルオリド、フェニルメタンスルホニルフルオリド(PMSF)、4-アミジノフェニルメタンスルホニルフルオリド(APMSF)、3-アセチルベンゼンスルホニルフルオリド、2-アミノベンゼンスルホニルフルオリド、および3-(3-クロロフェノキシアセトアミド)ベンゼンスルホニルフルオリド。ペプチドアミノベンゼンスルホニルフルオリド、すなわち、ペプチド鎖でさらに置換されたベンゼンスルホニルフルオリド、例えば2-[Ac-Ala-Ala-NHN(CH3)CONH]C6H4SO2Fも、本発明の組成物および方法での使用に好適である。実際、これらのインヒビターは、酵素との何らかの二次結合による相互作用の提供が可能な延長させた側鎖を加えることによって、スルホニルフルオリドの反応性を増大させ、それにともなってその後の反応速度を増大させるものと見られる。
【0034】
ベンズアミジン(化学式: C6H5C(NH)NH2.HCl、分子量: 156.6)はトロンビン、プラスミン、およびトリプシンなどのセリンプロテアーゼ類の強力なインヒビターの1つであり、これも本発明の安定組成物に含ませるのに十分好適である。
【0035】
一般的に、ナトリウム利尿ペプチドに十分な安定性を与えるため、スルホニルフルオリドまたはベンズアミジンプロテアーゼインヒビターを適切な量で使用する。例えば、本発明の組成物は、約1 pg/mL〜約6000 pg/mL、好ましくは約20 pg/mL〜約2000 pg/mLのナトリウム利尿ペプチドと、約0.01 mM〜約100 mM、好ましくは約0.1 mM〜約10 mMのスルホニルフルオリドまたはベンズアミジンプロテアーゼインヒビターを含有することとなる。インヒビターのこれらの濃度を、本明細書中では「効果的に安定化させる量」と称する。
【0036】
この組成物は一般的に、ナトリウム利尿ペプチドとプロテアーゼインヒビターおよびその他の成分を混合することによって作製する。これらの成分は好適などんな順番でも添加または混合してよいが、一般的には、最初にプロテアーゼインヒビターを含有する組成物を調製し、次にナトリウム利尿ペプチドを添加することによって、組成物を作製する。
【0037】
標準対照物質を製造するために、処理したヒトもしくは哺乳動物血漿に、適切なタイプおよび濃度のプロテアーゼインヒビターおよび抗微生物剤を添加する。次にこの液に、BNPおよびその他の対象とする心危険因子評価マーカーを、各マーカーについての臨床判断点未満、その付近およびそれ以上、添加する。次にこの液を滅菌ろ過し、無菌充填し、凍結または冷蔵する。これらのステップについては以下の節に記載することとする。
【0038】
本発明の組成物にはヒトまたはその他の哺乳動物の血液、血清、血漿その他を含有させることができ、そしてヒト、同様にその他の哺乳動物、例えばペット、愛玩動物、動物施設の哺乳動物、およびその他の家畜、から取得する体液の試験用に使用することができる。
【0039】
以下の実施例で、BNPを含有する対照物質の調製に適用される本発明について説明する。
【実施例】
【0040】
正常ヒト血清を使用する基礎マトリックスの調製:
一定単位の正常ヒト血漿を集め、先行技術で既知の操作にしたがって繊維素を除去した。生成した血清基礎マトリックスを濃縮するか、または正常生理食塩水で希釈することによって、この基礎マトリックスの総タンパク質濃度を6.0 g/dLに調整した。次に基礎マトリックスのpHを6.2に調整した。脱繊維素血漿を次に既知の操作法にしたがって脂質除去して、コレステロールおよびトリグリセリド濃度を< 20 mg/dLに低下させた。これは基礎マトリックスの光学的透明度を改善するための技法として実施した。生成した基礎マトリックスの総タンパク質濃度およびpHをそれぞれ6.4 g/dLおよび6.2に調整した。次に酵素インヒビター類、ベンズアミジンおよびAEBSFを基礎マトリックスに、それぞれ最終濃度9.5 mMおよび0.125 mMで添加した。再度、pHを6.2に調整し、その後基礎マトリックス中の内在性BNPを、市販のアッセイ(Bayer ADVIA Centaur BNPアッセイ)を使用して測定した。典型的な基礎マトリックス調製物中の内在性BNPの濃度は20 pg/mL未満であった。
【0041】
製品の調製:
BNPならびにその他の臨床心危険因子評価マーカー、トロポニンI、トロポニンT、ミオグロビン、ホモシステイン、CRP、CK-MB、およびNTプロBNPなど、の原液を、天然、合成または組み換え物質を使用して調製した。基礎マトリックスに適切な容量の添加用原液を添加して、アッセイの臨床判断点未満、その付近およびそれ以上の上記の被験体についての試験操作の性能を監査するための3レベルの対照物質を調製した。添加用原液の添加後に被験体濃度を測定して、原液の再添加または希釈によって被験体濃度を調整して、対照物質の3レベルおよび臨床上の利用性を確実にした。次に3種の溶液を0.2μmフィルターによって無菌ろ過し、その後あらかじめ滅菌した小ガラス容器に重点して密封し、-20℃で保存した。
【0042】
製品の性能:
表1に示すのは対照物質の典型的な試験用ロットについての再現性データである。BNPアッセイによって試験をしたとき、対照物質についての変動係数(CV)は典型的な患者サンプルから取得したものに匹敵し、予想される試験および分析のすべての分散幅に対して実際の患者サンプルと同様に感受性があることになるので、本発明の対照物質は高品質対照物質の最も重要な特性の1つに合致することを意味している。これは予測されたことである。なぜならば、業界でのその他の対照物質とは異なって、本発明の対照物質は人工的な基礎マトリックスを使用せず、代わりにヒト血清基礎マトリックスを使用するからである。Bayer ADVIA Centaur BNPアッセイについて本製品を当てはめると、ヒト検体で試験した場合、29.4〜1736 pg/mLの範囲のBNP濃度で4.7〜2.9%の%CVが観察されるはずである。Abbott AxSYMについて本製品を当てはめると、95〜1587 pg/mLの範囲のBNP濃度を試験した場合、この分析機では6.3〜4.7%の%CVが提示される。さらに、その結果は、うっ血性心不全の各種のステージに対応するアッセイの診断/医学的判断点未満、付近およびそれ以上のBNP目標レベルを容易に達成できることを証明している。
【表1】

製品保存期限を予測するため、加速させた安定化モデルを使用して、本製品の密閉容器安定性について評価した。この目的のため、推奨される保存温度、-20℃よりも迅速に被験体の分断/分解を観察できるように、上昇させた温度で事前に決定した時間、製品容器を保存し、各インキュベーション時間の終点でBNPの復活をアッセイした。これらの研究の結果、本製品は-20℃で開封しないで保存した場合、少なくとも3年間安定であることが予測された。この予測された保存期限の主張は、-20℃で進行中の実際の密封容器安定性試験によって支持されることであろう。
【0043】
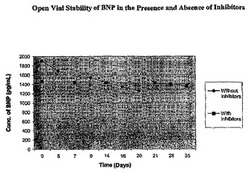
本製品の開封容器安定性も、実務医の実際の使用条件を想定することによって評価した。これは、容器を2-8℃で保存し、35日間にわたって全就業日に冷蔵庫からこれらを取り出し、容器を室温で15分間平衡化させ、容器を開封し、その内容物を実験室環境に曝露し、この容器を密封し、これらを2-8℃の推奨保存温度にもどすことによって、実施した。この開封容器安定性試験期間中、BNPの復活について、容器のサンプルをアッセイした。図1に示すのは、プロテアーゼインヒビターを含ませるか含ませないで調製した試験用ロットでのBNPについての開封容器安定性の結果である。この図は、プロテアーゼインヒビターの安定化効果を明確に証明している。図2に示すのは、3レベルの対照物質のすべてについての時間の関数としての開封容器安定性のプロットを示している。この研究の結果は、本製品が開封して2-8℃で保存する場合、少なくとも35日間安定であるものと見られることを意味している。2-8℃で最初の35日間に、平均で5%のBNP濃度の低下が観察された。
【0044】
本明細書に記載した実施例および実施形態は説明のみを目的とするものであって、これらを参考に多様な改変または変更が当業者には示唆され、それらは本出願および添付する特許請求の範囲の精神および視野の中に含まれるものと解釈すべきである。
【0045】
本明細書中に引用したすべての刊行物、特許、および特許出願は、すべての目的についてその全体を参照として本明細書中に組み入れるものとする。
【図面の簡単な説明】
【0046】
【図1】プロテアーゼインヒビターの存在または不在中でのBNPの開封容器中の安定性を示す。
【図2】3レベルのBNP対照物質の開封容器中の安定性を示す。
【技術分野】
【0001】
発明の背景
本発明は、一般的にはナトリウム利尿ペプチド類、特にB型ナトリウム利尿ペプチド(BNP)の安定な組成物、そして対照物質として使用するため、例えばうっ血性心不全(CHF)の患者の診断および病期判断のために使用されるこの生化学的マーカーについてのBNP試験操作の性能を監査するための該組成物に関する。本発明はまた、こうした組成物の調製にも関する。
【背景技術】
【0002】
心不全とは、心疾患がもたらす複合臨床症候であって、心室収縮もしくは拡張機能、またはその両方が損なわれる。これは、心臓が酸素および身体の代謝必要物を供給するために十分な量の血液を送り出すことができないことによる結果である。うっ血性心不全とは、心臓が身体の要求に適応させるために十分な酸素に富む血液を供給できない、臨床的症状である。この心機能の低下の結果として、体液が肺および末梢血管腔内に蓄積されることがある。CHFのもっとも一般的な原因は虚血性心疾患である。CHFのその他の原因は高血圧、心筋炎および心臓弁膜症である。
【0003】
ナトリウム利尿ペプチド類はホルモンの1種であって、血圧、電解質バランスおよび血流量を調節する。心房性ナトリウム利尿ペプチド(ANP)は心臓の心房起源の28-アミノ酸ホルモンである。B型ナトリウム利尿ペプチド(当初は「脳性ナトリウム利尿ペプチド」と称された)は、心室から分泌される32-アミノ酸ホルモンである。筋細胞内では、BNPはプレプロBNP(134-アミノ酸ペプチド)から誘導され、これが切断されてプロBNP(108-アミノ酸ペプチド)と別の26-アミノ酸ペプチドになる。その他のナトリウム利尿ペプチド類はC型ナトリウム利尿ペプチド(CNP)およびマンバ(Dendroaspis)ナトリウム利尿ペプチド(DNP)である。ANPおよびBNPは心臓ナトリウム利尿系に属し、心筋細胞起源のもので、広範囲の生物学的特性を共有している。CNPは内皮細胞起源であり、脳および脳脊髄液中に見られる。しかし心臓中にはあるとしてもごくわずかである。DNPはグリーンマンバの毒液から単離されたが、ANP、BNPおよびCNPと構造的に類似性がある。うっ血性心不全の患者では、DNP様免疫反応性の上昇が見られた。
【0004】
天然および合成ナトリウム利尿ペプチド類の両方、ならびにそれらの誘導体は、周知であり、合成ナトリウム利尿ペプチド類の調製方法も同様によく知られている。
【0005】
CHF患者では、プロBNPの断片[BNPおよびN末端BNP(NTプロBNP)]の血漿濃度が上昇し、患者の臨床的悪性度および左心室駆出分画率、そして罹患率および死亡率を正確に予測することが示された。近年、うっ血性心不全の診断および重症度分類のために、このCHF病の悪性度の指標が使用されるようになった。New York Heart AssociationのCHF分類によれば、BNPの平均濃度はステージIからIVに順次増大する。多施設臨床試験で、ステージI、II、II、およびIVのうっ血性心不全について、それぞれ71 pg/ml、204 pg/ml、349 pg/ml、および1022 pg/mlの平均BNP濃度が観察された。ステージIVのCHFはこの疾病の最重症度を表し、どんな肉体運動も不快感を伴わずにはできなくなる結果をもたらす心臓病として定義される。この疾病のこのステージの患者は休息中でも心臓病の症候または冠不全症候群を示すことがある。さらに、これらの患者の不快度は、何らかの肉体運動を行うと増大するようになる。
【0006】
多様な技法を使用するBNPの診断試験が文献中に記載されており、臨床研究業界に紹介されている。BNPの測定に関する市販の定量試験法のいくつかとして、Abbott AxSYM(登録商標)、Bayer ADVIA Centaur(登録商標)、およびBiosite Triage(登録商標)BNPアッセイがある。Abbott AxSYMアッセイはMicroparticle Enzyme Immunoassay(微粒子酵素イムノアッセイ)(MEIA)技法を利用するが、これはヒトBNP抗原に結合する抗BNPモノクローナル抗体でコーティングした微粒子を使用するものである。微粒子上のこれらの抗原-抗体複合体はその後別のモノクローナル抗BNPアルカリホスファターゼコンジュゲートで処理される。その最終の複合体はその後、1蛍光基質からの1リン酸基の除去を触媒して、蛍光産物を生成させる。次にこの産物の蛍光強度を光学アセンブリによって測定して、BNPの濃度を決定する。Biosite Triage BNPアッセイは免疫蛍光アッセイの1種である。このアッセイでは、マウス組み換えポリクローナル抗体を蛍光標識に結合させ、ジスルフィド結合が介在するBNPの環状構造に対するマウスモノクローナル抗体を固相に結合させる。このアッセイでは、血漿を蛍光抗体コンジュゲートと反応させる。一定のインキュベーション時間後、BNPと蛍光抗体コンジュゲートの複合体を検出用レーンの1つに捕捉させる。検体のBNP濃度は検出用レーンに結合した蛍光に比例するので、次にこれを手動蛍光分析機で定量的に測定する。Bayer ADVIA Centaurアッセイは化学発光技法を使用する2部位サンドイッチ免疫アッセイである。このアッセイで使用する第1抗体は、アクリジウムエステルで標識した、BNP上の環状構造に特異的なモノクローナルマウス抗ヒトBNPである。第2抗体(固相)は、BNPのC末端部分に特異的なビオチン化モノクローナルマウス抗ヒト抗体であって、これがストレプトアビジン磁性粒子に連結されている。Abbott AxSYM、Biosite Triage、およびBayer ADVIA Centaur BNPアッセイの検出限界はそれぞれ15、5、および2 pg/mLである。
【0007】
臨床診断試験では、高品質対照物質を定期的に使用して、臨床試験方法および操作の的確性および精度を監査する。高品質対照物質は予想されるすべての分析変数に対して、現実の患者サンプルと同程度の感度がなければならない。さらに、高品質対照物質は安定であって、その対象分析物の濃度はそのアッセイでの医学的判定ポイントに対抗するものでなければならない。高品質対照物質のその他の望ましい特色は低コスト、ロット毎の再現性、および製造の容易性である。
【0008】
いくつかのBNP対照物質が現在市場で入手可能であり、これらとして装置製造会社、AbbottおよびBayerからのものが含まれる。Abbott社のBNP対照物質(REF 8G82-10)はウシタンパク質安定剤ならびに防腐剤、アジ化ナトリウムおよびProClin 300を含む酢酸塩バッファー中のBNPで組成される3レベルの液状対照物質である。この一般的なタイプのアッセイのいくつかが米国公開特許出願、2005/0014287(Frieseら)および2005/0014289 (Parsonsら)に記載されている。Bayer BNP対照物質(REF 02817045)は、アジ化ナトリウムを含む緩衝化したカゼイン酸ナトリウム中の合成ヒトBNPを含む3レベルの凍結乾燥対照物質である。
【0009】
BNP対照物質は、このペプチドが血清または血漿中で低安定性であるので、典型的にはヒト血清または血漿の代わりに人工的で緩衝化したマトリックスを使用して製造される。BNPのin vivoでの半減期(t1/2)は約23分である。これらの人工マトリックス中でも、BNPの安定性はあまり長期ではない。例えば、Bayer BNP対照物質(緩衝化カゼイン酸ナトリウム)中のBNPは再構成して2-8℃で貯蔵したとき、5日間しか安定でない。
【0010】
BNPは特異的細胞受容体およびエンドペプチダーゼによって循環系から排除される。BNPの低安定性の主要な理由は、血漿または血清中の天然のプロテアーゼの存在によるものと見られる。安定なBNP対照物質を製造する目的で、このペプチドを酸化的および酵素的分解から保護するために、例えば以下のようないくつかの手法を使用することができる。
【0011】
1) プロテアーゼの触媒部位について基質として不適合性とするための、BNPの誘導体化。
【0012】
2) 封じ込め(caging)効果を提供することによってBNPを保護するための、高分子量分子の使用。
【0013】
3) 血清または血漿中に存在する天然のプロテアーゼを不活性化するための加熱の使用。
【0014】
4) プロテアーゼ上の触媒部位についてBNPと競合させるための非特異的基質の使用。
【0015】
5) 還元剤(群)の使用。
【0016】
6) プロテアーゼの触媒活性を排除または最少化するための強力で特異的なインヒビター(群)の使用(これに使用されてきた特異的インヒビターとして、金属プロテアーゼの可逆的インヒビターであるEDTA、および多数のセリンプロテアーゼ類のインヒビターであるアプロチニンが含まれる)。
【発明の開示】
【発明が解決しようとする課題】
【0017】
上記の手法の大部分は非効果的、高価であり、かつ/または専用で特別注文の装置および容器を必要とすることが明らかであって、タンパク質の変性、濁度の増大、およびイムノアッセイで使用する分析用シグナルの障害の結果になることもある。液状ヒト血清中のBNPを安定化する試みにおいて、プロテアーゼ群を同定し、特異的プロテアーゼを少数のプロテアーゼインヒビターおよび適切な還元剤の使用によって無力化することは、上記のその他の手法よりも多くの利点を持つことは明らかである。
【0018】
したがって、BNPおよびその他のナトリウム利尿ペプチドのアッセイで使用するための、血清を基剤とする安定な高品質対照物質の需要がある。また、何らかの好適な用途、例えば、ナトリウム利尿ペプチド類の性質および/または挙動の研究の実施の際の、一般的なこれらのペプチドの安定組成物の需要もある。本発明はこれらの需要を満足させ、高品質対照物質の以下のようなその他の基本的な必要条件: 基剤マトリックスとしてヒトまたはその他の哺乳動物の血清または血漿の使用による、分析用変数に対する患者サンプルと同様の応答性、アッセイの線形動力学範囲に対抗し得る対象数値を持つこと、ならびに長期使用のための開封容器および密閉容器での許容し得る安定性の具備、にも合致する。
【課題を解決するための手段】
【0019】
発明の概要
一般的に、本発明は内在性または外来性ナトリウム利尿ペプチド類(天然、合成、もしくは組み換え)を含有または含んでなる安定組成物を含む。さらに特定すると、本発明はヒトを含む哺乳動物の血漿または血清、特にヒト血漿または血清、さらに特別の場合、処理したヒト血漿をも含んでなる組成物を含む。さらにより特定すると、本発明はナトリウム利尿ペプチド類および1種以上の場合によって置換されたアルキルもしくはアリールスルホニルフルオリドプロテアーゼインヒビター、またはベンズアミジンを含有または含んでなる安定組成物を含む。こうした組成物は例えば、BNPまたはその他のナトリウム利尿ペプチド類を使用する各種の臨床試験方法の性能を監査するための標準物質を調製するために使用することができる。この組成物はまた、ナトリウム利尿ペプチド類の性質または挙動の研究を実施するなどの、安定化したナトリウム利尿ペプチド組成物のその他の用途のためにも調製することができる。
【0020】
本発明のその他の態様中、本発明はこうした対照用組成物を含む、ナトリウム利尿ペプチドをアッセイするためのキットを含む。さらに別の態様中、本発明はこうした安定組成物を調製するための方法を含む。
【発明を実施するための最良の形態】
【0021】
発明の詳細な説明
上記のように、本発明は一般的に、内在性または外来性ナトリウム利尿ペプチド類(天然、合成、もしくは組み換え)を含有または含んでなる安定組成物を含む。さらに特定すると、本発明はヒトまたはその他の哺乳動物の血漿または血清、特に処理したヒト血漿をも含んでなる組成物を含む。さらにより特定すると、本発明はナトリウム利尿ペプチド類および本明細書に記載する1種以上の特異的プロテアーゼインヒビターを含有または含んでなる安定組成物を含む。こうした組成物は例えば、BNPまたはその他のナトリウム利尿ペプチド類を使用する各種の臨床試験方法の性能を監査するための標準物質を調製するために使用することができる。この組成物はまた、安定化させたナトリウム利尿ペプチド組成物のその他の用途のためにも調製することができる。
【0022】
本発明の別の態様中、本発明はこうした組成物を調製するための方法を含む。
【0023】
本明細書で使用する用語「ナトリウム利尿ペプチド」および「ナトリウム利尿ペプチド類」として、一般的にこうしたペプチド類、特にANP、BNP、CNPおよびDNP、さらにこうしたペプチドの前駆体、プロ-およびプレプロ-ペプチドなど、例えば上記のプロBNPおよびプレプロBNPが含まれる。この用語には外来性もしくは内在性にかかわらず、天然に存在するもの、または合成のもの、または組み換えDNA技術によって調製されたもののいずれの物質も含まれる。
【0024】
本発明によって、一定の、場合によって置換されたアルキルおよびアリールスルホニルフルオリドならびにベンズアミジンが本発明の組成物中に使用するために好適なプロテアーゼインヒビターであることが決定された。フェニルメチルスルホニルフルオリド(PMSF)および4-アミジノフェニルメタンスルホニルフルオリド(APMSF)はセリンプロテアーゼ活性を阻害するために使用されてきている。これらの化合物は触媒部位でセリン残基と共有結合反応をする。
【0025】
本発明の組成物、キットおよび方法での使用に好適なアルキルおよびアリールスルホニルフルオリドは、(標識カゼインまたはその他の好適なペプチド基質などの基質を使用したときに)トリプシン、キモトリプシン、エラスターゼ、プラスミン、トロンビンまたはカリクレインのタンパク質分解活性を阻害するものである。
【0026】
本明細書で使用する用語「アルキル」は、完全に飽和し、示された炭素原子の数(すなわちC1-C10は1〜10炭素原子)を持つ、直鎖もしくは分枝鎖、または非芳香族環式の炭化水素ラジカル、あるいはそれらの組み合わせを意味する。非環式アルキル基の例として限定するわけではないが、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、t-ブチル、イソブチル、sec-ブチル、例えばn-ペンチル、n-ヘキシル、n-ヘプチル、n-オクチルの相同体および異性体、などの基が含まれる。環式アルキル基の例として、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどが含まれる。本発明での使用のためには、アルキル基はどんな所望のサイズのものでもよい。好ましくはそれらは8個まで、より好ましくは4個までの炭素原子を含むものとなる。
【0027】
本発明で使用する化合物のアルキル基は非置換でも、1もしくは多置換のものでもよい。許容される置換基として、対象となる化合物のプロテアーゼ阻害活性を有意に妨害しない限り、こうした部分分子に普通に見られるものが含まれる。典型的な置換基として、以下が含まれる: ハロ、ヒドロキシ、アミノ、アミド、ニトロ、シアノ、アルコキシ、オキソ、ならびに場合によって置換されたアルキルをさらに含有する置換基、アルキルアミノ、ハロアルキルアミノ、ハロアルコキシなど。
【0028】
置換アルキルまたはシクロアルキル基としてアリールアルキル基、すなわち1種以上のアリール基で置換されたアルキル(シクロアルキルを含む)基も含まれる。例えばベンジル、フェネチル、トリフェニルメチル、シクロヘキシルメチル、シクロプロピルメチルなどである。これらには、置換基として1個のアリール基を持つ、比較的小さいシクロアルキル基、フェニルシクロプロピルなど、も含まれる。アリールアルキル基中の芳香族環または環群はその他の脂肪族基と同様にさらに置換されていてもよく、例えばクロロフェニル、メチルベンジルその他である。置換アルキル基として、1種以上の飽和または不飽和ヘテロ環式基によって置換されたアルキル基も含まれる。例えばピリジルメチル、ピリジルメチル、ピペリジニルメチル、ピロリジニルメチル、モルホリニルメチル、キノリルメチル、その他である。こうした基は1種以上のハロゲン、ヒドロキシル基、低級アルキル基、または低級アルコキシ基(こうした基の組み合わせを含む)で置換されていてもよい。
【0029】
本明細書で使用する「アリール」とは、典型的な置換または非置換のこのクラスの非脂肪族ヒドロカルビル基、すなわちポリ不飽和の、典型的には芳香族の炭化水素置換基を称し、これは単環でも、または互いに縮合するか共有結合した(3環までの)多環でもよく、フェニル、ナフチルなどである。このクラスの部分分子にはインダニルその他などの縮合環部分分子も含まれる。芳香族部分の置換基は脂肪族基についてのものと同様である。本明細書で使用する「アリール」には類似のヘテロ環基(ときには「ヘテロ芳香族」基と称される)、すなわち環内に炭素原子とそのほかに1種以上のヘテロ原子、典型的には酸素、窒素、硫黄および/またはリン、を含有するポリ不飽和環式部分分子も含まれ、ピリジニル、ピラジニル、ピラゾリル、チエニル、フリル、チアゾリル、イミダゾリル、ピロリル、その他と、ベンゾオキサゾリル、ベンゾチアゾリル、その他などの縮合環部分分子がある。これらは場合によって以下のような1種以上の置換基で置換されていてもよい: ハロゲン、ヒドロキシ、アミノ、場合によって置換された低級アルキル、場合によって置換されたアシル、場合によって置換された低級アルコキシ、アルキレンオキシ、アルキレンジオキシ、場合によって置換されたアリールアセトアミド、など。
【0030】
用語「アシル」とは、有機酸からヒドロキシ基の除去によって誘導される基を称する。アシル基の例として、アセチル、プロピオニル、ドデカノイル、テトラデカノイル、イソブチリルなどが含まれる。したがって、本明細書で使用する用語「アシル」は、別に-C(O)-アルキル(ここでアルキルは上記定義の通り)として定義される基を含むことを意味している。
【0031】
本発明で使用するためのアルキルおよびアリールスルホニルフルオリドの適合性は上記のように、プロテアーゼインヒビターとしてのそれらの活性、すなわち、ヒト血清または血漿中の天然に存在するプロテアーゼの、ナトリウム利尿ペプチド類を切断することによって、これらのマトリックス中でのこれらのペプチドの分解および低安定性をもたらす能力を排除または最少化する効力、に基づくものである。プロテアーゼインヒビターとしての活性が未知の候補化合物を、比較的単純なアッセイを使用して、本発明での使用についてスクリーニングすることができる。それは、この可能性があるインヒビターを酵素(群)/プロテアーゼ(群)とともに一定の温度で一定期間インキュベートするものである。阻害効果を判定するため、発色性基質またはBNPをこのプロテアーゼ-インヒビター混合物に添加し、利用可能な分離および分析方法(クロマトグラフィー、比色分析、イムノアッセイ、その他)を使用して、切断または分解の程度を判定することができる。同様のアッセイを使用して、好適なプロテアーゼインヒビターであることがわかった所定のスルホニルフルオリドについて、阻害最少濃度を決定することができる。
【0032】
スルホニルフルオリドクラスの特に強力で不可逆的なプロテアーゼインヒビター、したがって本発明での使用の対象となるインヒビターの1つは、(2-アミノエチル)-ベンゼンスルホニルフルオリド(AEBSF、化学式: C8H10NO2SF.HCl、分子量: 239.7)である。これは無視できるほどの毒性と、広範囲の阻害活性を示し、また弱塩基性(pH 8-9)条件下で極めて徐々にしか酸化されない。その上、触媒部位でのセリン残基との共有結合後、加水分解による活性プロテアーゼへの復活は観察されない。AEBSFのその他の利点は、水および水性媒体中での良好な溶解性とその選択性である。例えば、トロンビン活性に対する阻害活性は血清アルブミンの存在中で遅滞しない。したがって、AEBSFは血清または血漿などのマトリックス中での使用に十分適合する。
【0033】
本発明の組成物および方法中での使用に好適なスルホニルフルオリドとして以下が含まれる: メタンスルホニルフルオリド、フェニルメタンスルホニルフルオリド(PMSF)、4-アミジノフェニルメタンスルホニルフルオリド(APMSF)、3-アセチルベンゼンスルホニルフルオリド、2-アミノベンゼンスルホニルフルオリド、および3-(3-クロロフェノキシアセトアミド)ベンゼンスルホニルフルオリド。ペプチドアミノベンゼンスルホニルフルオリド、すなわち、ペプチド鎖でさらに置換されたベンゼンスルホニルフルオリド、例えば2-[Ac-Ala-Ala-NHN(CH3)CONH]C6H4SO2Fも、本発明の組成物および方法での使用に好適である。実際、これらのインヒビターは、酵素との何らかの二次結合による相互作用の提供が可能な延長させた側鎖を加えることによって、スルホニルフルオリドの反応性を増大させ、それにともなってその後の反応速度を増大させるものと見られる。
【0034】
ベンズアミジン(化学式: C6H5C(NH)NH2.HCl、分子量: 156.6)はトロンビン、プラスミン、およびトリプシンなどのセリンプロテアーゼ類の強力なインヒビターの1つであり、これも本発明の安定組成物に含ませるのに十分好適である。
【0035】
一般的に、ナトリウム利尿ペプチドに十分な安定性を与えるため、スルホニルフルオリドまたはベンズアミジンプロテアーゼインヒビターを適切な量で使用する。例えば、本発明の組成物は、約1 pg/mL〜約6000 pg/mL、好ましくは約20 pg/mL〜約2000 pg/mLのナトリウム利尿ペプチドと、約0.01 mM〜約100 mM、好ましくは約0.1 mM〜約10 mMのスルホニルフルオリドまたはベンズアミジンプロテアーゼインヒビターを含有することとなる。インヒビターのこれらの濃度を、本明細書中では「効果的に安定化させる量」と称する。
【0036】
この組成物は一般的に、ナトリウム利尿ペプチドとプロテアーゼインヒビターおよびその他の成分を混合することによって作製する。これらの成分は好適などんな順番でも添加または混合してよいが、一般的には、最初にプロテアーゼインヒビターを含有する組成物を調製し、次にナトリウム利尿ペプチドを添加することによって、組成物を作製する。
【0037】
標準対照物質を製造するために、処理したヒトもしくは哺乳動物血漿に、適切なタイプおよび濃度のプロテアーゼインヒビターおよび抗微生物剤を添加する。次にこの液に、BNPおよびその他の対象とする心危険因子評価マーカーを、各マーカーについての臨床判断点未満、その付近およびそれ以上、添加する。次にこの液を滅菌ろ過し、無菌充填し、凍結または冷蔵する。これらのステップについては以下の節に記載することとする。
【0038】
本発明の組成物にはヒトまたはその他の哺乳動物の血液、血清、血漿その他を含有させることができ、そしてヒト、同様にその他の哺乳動物、例えばペット、愛玩動物、動物施設の哺乳動物、およびその他の家畜、から取得する体液の試験用に使用することができる。
【0039】
以下の実施例で、BNPを含有する対照物質の調製に適用される本発明について説明する。
【実施例】
【0040】
正常ヒト血清を使用する基礎マトリックスの調製:
一定単位の正常ヒト血漿を集め、先行技術で既知の操作にしたがって繊維素を除去した。生成した血清基礎マトリックスを濃縮するか、または正常生理食塩水で希釈することによって、この基礎マトリックスの総タンパク質濃度を6.0 g/dLに調整した。次に基礎マトリックスのpHを6.2に調整した。脱繊維素血漿を次に既知の操作法にしたがって脂質除去して、コレステロールおよびトリグリセリド濃度を< 20 mg/dLに低下させた。これは基礎マトリックスの光学的透明度を改善するための技法として実施した。生成した基礎マトリックスの総タンパク質濃度およびpHをそれぞれ6.4 g/dLおよび6.2に調整した。次に酵素インヒビター類、ベンズアミジンおよびAEBSFを基礎マトリックスに、それぞれ最終濃度9.5 mMおよび0.125 mMで添加した。再度、pHを6.2に調整し、その後基礎マトリックス中の内在性BNPを、市販のアッセイ(Bayer ADVIA Centaur BNPアッセイ)を使用して測定した。典型的な基礎マトリックス調製物中の内在性BNPの濃度は20 pg/mL未満であった。
【0041】
製品の調製:
BNPならびにその他の臨床心危険因子評価マーカー、トロポニンI、トロポニンT、ミオグロビン、ホモシステイン、CRP、CK-MB、およびNTプロBNPなど、の原液を、天然、合成または組み換え物質を使用して調製した。基礎マトリックスに適切な容量の添加用原液を添加して、アッセイの臨床判断点未満、その付近およびそれ以上の上記の被験体についての試験操作の性能を監査するための3レベルの対照物質を調製した。添加用原液の添加後に被験体濃度を測定して、原液の再添加または希釈によって被験体濃度を調整して、対照物質の3レベルおよび臨床上の利用性を確実にした。次に3種の溶液を0.2μmフィルターによって無菌ろ過し、その後あらかじめ滅菌した小ガラス容器に重点して密封し、-20℃で保存した。
【0042】
製品の性能:
表1に示すのは対照物質の典型的な試験用ロットについての再現性データである。BNPアッセイによって試験をしたとき、対照物質についての変動係数(CV)は典型的な患者サンプルから取得したものに匹敵し、予想される試験および分析のすべての分散幅に対して実際の患者サンプルと同様に感受性があることになるので、本発明の対照物質は高品質対照物質の最も重要な特性の1つに合致することを意味している。これは予測されたことである。なぜならば、業界でのその他の対照物質とは異なって、本発明の対照物質は人工的な基礎マトリックスを使用せず、代わりにヒト血清基礎マトリックスを使用するからである。Bayer ADVIA Centaur BNPアッセイについて本製品を当てはめると、ヒト検体で試験した場合、29.4〜1736 pg/mLの範囲のBNP濃度で4.7〜2.9%の%CVが観察されるはずである。Abbott AxSYMについて本製品を当てはめると、95〜1587 pg/mLの範囲のBNP濃度を試験した場合、この分析機では6.3〜4.7%の%CVが提示される。さらに、その結果は、うっ血性心不全の各種のステージに対応するアッセイの診断/医学的判断点未満、付近およびそれ以上のBNP目標レベルを容易に達成できることを証明している。
【表1】

製品保存期限を予測するため、加速させた安定化モデルを使用して、本製品の密閉容器安定性について評価した。この目的のため、推奨される保存温度、-20℃よりも迅速に被験体の分断/分解を観察できるように、上昇させた温度で事前に決定した時間、製品容器を保存し、各インキュベーション時間の終点でBNPの復活をアッセイした。これらの研究の結果、本製品は-20℃で開封しないで保存した場合、少なくとも3年間安定であることが予測された。この予測された保存期限の主張は、-20℃で進行中の実際の密封容器安定性試験によって支持されることであろう。
【0043】
本製品の開封容器安定性も、実務医の実際の使用条件を想定することによって評価した。これは、容器を2-8℃で保存し、35日間にわたって全就業日に冷蔵庫からこれらを取り出し、容器を室温で15分間平衡化させ、容器を開封し、その内容物を実験室環境に曝露し、この容器を密封し、これらを2-8℃の推奨保存温度にもどすことによって、実施した。この開封容器安定性試験期間中、BNPの復活について、容器のサンプルをアッセイした。図1に示すのは、プロテアーゼインヒビターを含ませるか含ませないで調製した試験用ロットでのBNPについての開封容器安定性の結果である。この図は、プロテアーゼインヒビターの安定化効果を明確に証明している。図2に示すのは、3レベルの対照物質のすべてについての時間の関数としての開封容器安定性のプロットを示している。この研究の結果は、本製品が開封して2-8℃で保存する場合、少なくとも35日間安定であるものと見られることを意味している。2-8℃で最初の35日間に、平均で5%のBNP濃度の低下が観察された。
【0044】
本明細書に記載した実施例および実施形態は説明のみを目的とするものであって、これらを参考に多様な改変または変更が当業者には示唆され、それらは本出願および添付する特許請求の範囲の精神および視野の中に含まれるものと解釈すべきである。
【0045】
本明細書中に引用したすべての刊行物、特許、および特許出願は、すべての目的についてその全体を参照として本明細書中に組み入れるものとする。
【図面の簡単な説明】
【0046】
【図1】プロテアーゼインヒビターの存在または不在中でのBNPの開封容器中の安定性を示す。
【図2】3レベルのBNP対照物質の開封容器中の安定性を示す。
【特許請求の範囲】
【請求項1】
(a) ナトリウム利尿ペプチドと、(b) 有効に安定化させる量の(i)プロテアーゼ阻害性の、場合によって置換されたアルキルもしくはアリールスルホニルフルオリド; または(ii) ベンズアミジンとを含んでなる、安定化した液状ナトリウム利尿ペプチド組成物。
【請求項2】
安定化した液状ペプチド組成物がサンプル中のナトリウム利尿ペプチドの濃度を判定する方法中で対照として使用するための標準物質である、請求項1に記載の組成物。
【請求項3】
ナトリウム利尿ペプチドが天然に存在するペプチドである、請求項1に記載の組成物。
【請求項4】
ナトリウム利尿ペプチドが天然に存在するペプチドである、請求項2に記載の組成物。
【請求項5】
ナトリウム利尿ペプチドが合成ペプチドである、請求項1に記載の組成物。
【請求項6】
ナトリウム利尿ペプチドが合成ペプチドである、請求項2に記載の組成物。
【請求項7】
ナトリウム利尿ペプチドが組み換えペプチドである、請求項1に記載の組成物。
【請求項8】
ナトリウム利尿ペプチドが組み換えペプチドである、請求項2に記載の組成物。
【請求項9】
ナトリウム利尿ペプチドがBNPである、請求項1に記載の組成物。
【請求項10】
ナトリウム利尿ペプチドがBNPである、請求項2に記載の組成物。
【請求項11】
さらに1種以上の抗微生物剤を含む、請求項2に記載の組成物。
【請求項12】
体液を含む、請求項2に記載の組成物。
【請求項13】
体液がヒトもしくは哺乳動物の血液またはヒトもしくは哺乳動物の血液成分を含む、請求項12に記載の組成物。
【請求項14】
体液がヒトもしくは哺乳動物の血清または血漿を含む、請求項13に記載の組成物。
【請求項15】
1種以上の抗微生物剤が硫酸ネオマイシン、クロラムフェニコール、およびアンフォテリシンから選択される、請求項11に記載の組成物。
【請求項16】
有効に安定化させる量のベンズアミジンを含む、請求項1に記載の組成物。
【請求項17】
有効に安定化させる量のベンズアミジンを含む、請求項2に記載の組成物。
【請求項18】
有効に安定化させる量のスルホニルフルオリドを含む、請求項1に記載の組成物。
【請求項19】
有効に安定化させる量のスルホニルフルオリドを含む、請求項2に記載の組成物。
【請求項20】
スルホニルフルオリドが場合によって置換されたアルキルスルホニルフルオリドである、請求項18に記載の組成物。
【請求項21】
スルホニルフルオリドが場合によって置換されたアリールスルホニルフルオリドである、請求項18に記載の組成物。
【請求項22】
スルホニルフルオリドが場合によって置換されたアルキルスルホニルフルオリドである、請求項19に記載の組成物。
【請求項23】
スルホニルフルオリドが場合によって置換されたアリールスルホニルフルオリドである、請求項19に記載の組成物。
【請求項24】
スルホニルフルオリドが(2-アミノエチル)-ベンゼンスルホニルフルオリド、フェニルメタンスルホニルフルオリド、4-アミジノフェニル-メタンスルホニルフルオリド、3-アセチルベンゼンスルホニルフルオリド、2-アミノベンゼンスルホニルフルオリド、3-(3-クロロフェノキシアセトアミド)ベンゼンスルホニルフルオリド、およびペプチドアミノベンゼンスルホニルフルオリドから選択される、請求項18に記載の組成物。
【請求項25】
スルホニルフルオリドが(2-アミノエチル)-ベンゼンスルホニルフルオリド、フェニルメタンスルホニルフルオリド、4-アミジノフェニル-メタンスルホニルフルオリド、3-アセチルベンゼンスルホニルフルオリド、2-アミノベンゼンスルホニルフルオリド、3-(3-クロロフェノキシアセトアミド)ベンゼンスルホニルフルオリド、およびペプチドアミノベンゼンスルホニルフルオリドから選択される、請求項19に記載の組成物。
【請求項26】
さらに1群の心危険因子評価マーカーを含む、請求項2に記載の組成物。
【請求項27】
心危険因子評価マーカーがトロポニンI、トロポニンT、ミオグロビン、CK-MB、総CK、ホモシステイン、プロBNP、NTプロBNP、およびhsCRPである、請求項26に記載の組成物。
【請求項28】
請求項2に記載の組成物を含む、ナトリウム利尿ペプチドに関するアッセイを実施するためのキット。
【請求項29】
ナトリウム利尿ペプチドと、有効に安定化させる量の(i)場合によって置換されたアルキルもしくはアリールスルホニルフルオリド; または(ii) ベンズアミジンとを混合することを含んでなる、安定化した液状ナトリウム利尿ペプチド組成物の調製方法。
【請求項1】
(a) ナトリウム利尿ペプチドと、(b) 有効に安定化させる量の(i)プロテアーゼ阻害性の、場合によって置換されたアルキルもしくはアリールスルホニルフルオリド; または(ii) ベンズアミジンとを含んでなる、安定化した液状ナトリウム利尿ペプチド組成物。
【請求項2】
安定化した液状ペプチド組成物がサンプル中のナトリウム利尿ペプチドの濃度を判定する方法中で対照として使用するための標準物質である、請求項1に記載の組成物。
【請求項3】
ナトリウム利尿ペプチドが天然に存在するペプチドである、請求項1に記載の組成物。
【請求項4】
ナトリウム利尿ペプチドが天然に存在するペプチドである、請求項2に記載の組成物。
【請求項5】
ナトリウム利尿ペプチドが合成ペプチドである、請求項1に記載の組成物。
【請求項6】
ナトリウム利尿ペプチドが合成ペプチドである、請求項2に記載の組成物。
【請求項7】
ナトリウム利尿ペプチドが組み換えペプチドである、請求項1に記載の組成物。
【請求項8】
ナトリウム利尿ペプチドが組み換えペプチドである、請求項2に記載の組成物。
【請求項9】
ナトリウム利尿ペプチドがBNPである、請求項1に記載の組成物。
【請求項10】
ナトリウム利尿ペプチドがBNPである、請求項2に記載の組成物。
【請求項11】
さらに1種以上の抗微生物剤を含む、請求項2に記載の組成物。
【請求項12】
体液を含む、請求項2に記載の組成物。
【請求項13】
体液がヒトもしくは哺乳動物の血液またはヒトもしくは哺乳動物の血液成分を含む、請求項12に記載の組成物。
【請求項14】
体液がヒトもしくは哺乳動物の血清または血漿を含む、請求項13に記載の組成物。
【請求項15】
1種以上の抗微生物剤が硫酸ネオマイシン、クロラムフェニコール、およびアンフォテリシンから選択される、請求項11に記載の組成物。
【請求項16】
有効に安定化させる量のベンズアミジンを含む、請求項1に記載の組成物。
【請求項17】
有効に安定化させる量のベンズアミジンを含む、請求項2に記載の組成物。
【請求項18】
有効に安定化させる量のスルホニルフルオリドを含む、請求項1に記載の組成物。
【請求項19】
有効に安定化させる量のスルホニルフルオリドを含む、請求項2に記載の組成物。
【請求項20】
スルホニルフルオリドが場合によって置換されたアルキルスルホニルフルオリドである、請求項18に記載の組成物。
【請求項21】
スルホニルフルオリドが場合によって置換されたアリールスルホニルフルオリドである、請求項18に記載の組成物。
【請求項22】
スルホニルフルオリドが場合によって置換されたアルキルスルホニルフルオリドである、請求項19に記載の組成物。
【請求項23】
スルホニルフルオリドが場合によって置換されたアリールスルホニルフルオリドである、請求項19に記載の組成物。
【請求項24】
スルホニルフルオリドが(2-アミノエチル)-ベンゼンスルホニルフルオリド、フェニルメタンスルホニルフルオリド、4-アミジノフェニル-メタンスルホニルフルオリド、3-アセチルベンゼンスルホニルフルオリド、2-アミノベンゼンスルホニルフルオリド、3-(3-クロロフェノキシアセトアミド)ベンゼンスルホニルフルオリド、およびペプチドアミノベンゼンスルホニルフルオリドから選択される、請求項18に記載の組成物。
【請求項25】
スルホニルフルオリドが(2-アミノエチル)-ベンゼンスルホニルフルオリド、フェニルメタンスルホニルフルオリド、4-アミジノフェニル-メタンスルホニルフルオリド、3-アセチルベンゼンスルホニルフルオリド、2-アミノベンゼンスルホニルフルオリド、3-(3-クロロフェノキシアセトアミド)ベンゼンスルホニルフルオリド、およびペプチドアミノベンゼンスルホニルフルオリドから選択される、請求項19に記載の組成物。
【請求項26】
さらに1群の心危険因子評価マーカーを含む、請求項2に記載の組成物。
【請求項27】
心危険因子評価マーカーがトロポニンI、トロポニンT、ミオグロビン、CK-MB、総CK、ホモシステイン、プロBNP、NTプロBNP、およびhsCRPである、請求項26に記載の組成物。
【請求項28】
請求項2に記載の組成物を含む、ナトリウム利尿ペプチドに関するアッセイを実施するためのキット。
【請求項29】
ナトリウム利尿ペプチドと、有効に安定化させる量の(i)場合によって置換されたアルキルもしくはアリールスルホニルフルオリド; または(ii) ベンズアミジンとを混合することを含んでなる、安定化した液状ナトリウム利尿ペプチド組成物の調製方法。
【図1】


【図2】




【図2】


【公表番号】特表2008−534440(P2008−534440A)
【公表日】平成20年8月28日(2008.8.28)
【国際特許分類】
【出願番号】特願2007−555119(P2007−555119)
【出願日】平成18年1月24日(2006.1.24)
【国際出願番号】PCT/US2006/002888
【国際公開番号】WO2006/088624
【国際公開日】平成18年8月24日(2006.8.24)
【出願人】(504121623)バイオ−ラッド・ラボラトリーズ・インコーポレーテッド (5)
【Fターム(参考)】
【公表日】平成20年8月28日(2008.8.28)
【国際特許分類】
【出願日】平成18年1月24日(2006.1.24)
【国際出願番号】PCT/US2006/002888
【国際公開番号】WO2006/088624
【国際公開日】平成18年8月24日(2006.8.24)
【出願人】(504121623)バイオ−ラッド・ラボラトリーズ・インコーポレーテッド (5)
【Fターム(参考)】
[ Back to top ]

