抗赤血球アロ抗体の多重検出
試料中の抗体を検出する方法が開示され、この場合、抗体が赤血球又は赤血球ゴーストによって発現した抗原を標的にしている。(アッセイに基づいた従来の凝集反応におけるような)特定の抗原−抗体対の間の結合事象を検出するというよりはむしろ、ここでの方法は、血液型抗原に対する臨床上重要なアロ免疫抗体の多重検出を考慮している。特に、本方法は蛍光コード化した赤血球又は赤血球ゴーストを生成するステップと、蛍光サンドイッチ型イムノアッセイを用いて、血清/血漿中の抗体の存在を検出するためにそれらを使用するステップを含んでいる。このアッセイは、画像技術に基づいたフローサイトメトリ法又は蛍光顕微鏡を用いて読み取ることができる。
【発明の詳細な説明】
【技術分野】
【0001】
マイナーな血液型抗原(例えば、Jk、Rh、Kell、Kidd及びDuffy)は、感作宿主に投与された場合、自己抗体及び/又はアロ抗体を誘起し、自己免疫性溶血性貧血、溶血性貧血、新生児溶血性疾患、及び溶血性輸血反応を引き起こす。感作は過去の輸血又は抗体陽性の胎児の妊娠から生じる。これらのアロ抗体は通常、別々の凝集反応アッセイで経時的に、既知の表現型の赤血球(RBC)パネルに対して、レシピエントの血清を検査することによって検出し同定される(例えば、抗Jka抗体は、患者の血清がJka+RBCと反応し、Jka−RBCと反応しないかどうかを判定することによって同定されうる)。様々な抗原表現型のRBCの複数の試料を選択することによって、臨床上重要なアロ抗体の存在又は不存在を検出することが可能である。
【背景技術】
【0002】
凝集反応アッセイは従来、溶液中、すなわち試験管内で行われている。特に反応が弱い場合、試験管の凝集反応用のデータ解釈は、熟練した、経験のある技術者を必要とする。しかしながら近年、ゲルフォーマットや被膜固相フォーマットのような新しい技法が、開発されてきた。ゲル技法はデキストラン−アクリルアミドゲルを通した赤血球凝集反応が制御されるという原理に基づいている[Judd WJ,Steiner EA,Knafl PC,Masters C.The gel test:use in the identification of unexpected antibodies to blood group antigens.Immunohematology 1998;14:59−62]。マイクロチューブは、ゲル、バッファ及び試薬の混合物で充填される。ゲルの頂部で、患者の血清と様々な既知の赤血球との混合物が添加され、制御された条件下でのゲルを通した遠心分離がその後に続く。陰性反応では、細胞はゲルを通過し、マイクロチューブの底部で小球状になる。逆に陽性反応では、最も強い反応(最大の凝集反応塊)が最小ないし観察不能な移動を示し、ほとんどの赤血球が、ゲル微小カラムの頂部で、あるいはその近くで捕捉され、ゲル中の様々な準位で捕捉される。Immucor社により開発された固相システムは、ヒト赤血球固定化用のマイクロウェルを提供し、対応する赤血球抗原に対するIgG赤血球抗体の検出用固相アッセイに用いられる[Plapp FV,Sinor LT,Rachel JM,et al A solid phase antibody screen.Am J Clin Pathol 1984;82:179]。ウェルは、マイクロウェル表面への、ユーザが選択した赤血球の固定化を可能にする化学カップリング剤で被膜される。被膜したウェルは、抗体抗原反応を促進する条件下で、血清、血漿又はその他の試薬を含む血液製剤と共にインキュベートされる。インキュベーションに続いて、未結合の残留免疫グロブリンが、ウェルと抗IgG被膜された、添加した指示赤血球からすすがれる。遠心分離は、指示赤血球を固定化赤血球層に結合した抗体と接触させる。陽性試験の場合、IgG−抗IgGは、指示赤血球と感作される固定化細胞との間の形態を複雑にする。架橋抗体の結果として、指示細胞は、第2の固定化層として固定化細胞と接着する。検出可能な抗体抗原相互作用がない場合(陰性試験)、指示赤血球は固定化細胞へ結合せず、すし詰め状態のボタンのように、ウェルの底で小球状になる。
【0003】
細胞膜は、真核細胞内部と外部環境との間の界面を形成する。従って、この膜に埋め込まれたタンパク質の機能は多様であり、細胞外信号の細胞−細胞及び細胞−細胞外マトリクス認識、感知、及び伝達と、細胞内外への溶質及び水分子の輸送とを含んでいる。細胞表面のタンパク質集合の不均一性は、抽出された膜タンパク質又は未精製の細胞可溶化物を用いたインビトロアッセイの開発の困難性につながっている。赤血球膜は、二重膜と、埋め込まれたタンパク質と糖タンパク質とのアレイと、細胞骨格タンパク質ネットワークの複合体層とからなる複雑な構成である[Steck,T.L.The organization of proteins in the human red blood cell membrane.J.Cell Biol.vol.62(1974)1−19;Byers,T.L.and Branton,D.Visualization of the protein associations in the erythrocyte membrane skeleton.Proc.Natl.Acad.Sci.USA vol.82(1985)6153−6157;Seeman,P.,Cheng,D.,and Iles,G.H.Structure of membrane holes in osmotic and saponin hemolysis J.Cell.Biol.vol.56(1973)519−527]。
【0004】
プローブとしてコード化したインタクト細胞を用いることは、細胞表面レセプタに結合するリガンドを選別するための魅力的な代替方法を提供し、高スループット技術を受入可能な小型化され、多重化されたプラットフォームの開発を与える。
【0005】
赤血球内溶質の封入は、薬剤輸送及びターゲティングの手段として広く研究されてきた[Ihler G.M.,Glew,R.H.and Schnure,F.W.Enzyme loading of erythrocytes.PNAS vol.70(1973)2663−2666;DeLoach,J.R.,Harris,R.L.and Hiler,G.M.An erythrocyte encapsulator dialyzer used in preparing large quantities of erythrocyte ghosts and encapsulation of pesticide in erythrocyte ghosts.Analytical Biochemistry vol.102(1980)220−227;Baker,R.F.Entry of ferritin into human red cells during hypotonic haemolysis.Nature vol.215(1967)424−425;Marsden,N.V.B.,and Ostling,S.G.Accumulation of dextran in human red cells after haemolysis.Nature vol.184(1959)723−724]。このアプローチにおいて、軽度の浸透圧溶血が、赤血球の膜有孔性の変化を誘発し、タンパク質及び小さな溶質とほぼ同一サイズのプローブが、赤血球内部に分配することを可能にする。溶血後のイオン強度(等浸透圧条件の復元)を適宜操作することによってこの孔は再封入でき、赤血球に分配された溶質を永久に捕捉する(赤血球ゴーストとしても知られている)。再封入されたゴーストを洗浄することによって、外部媒質から過剰な溶質を除去する。このアプローチを用いて、蛍光性赤血球ゴーストを与えるための蛍光標識されたデキストランを負荷することは、文献に報告されている[Doberstein,S.K.et al.Fluorescent erythrocyte ghosts asstandards for quantitative flow cytometry.Cytometry vol.20(1995)14−18]。
【0006】
しなしながら、アッセイでの最封入されたゴーストの使用は、細胞表面タンパク質とその配向性が、ゴーストの調製と溶質負荷処理によって影響を及ぼされないことを必要とする。特に低イオン強度バッファの使用、又はバッファ中にマグネシウムイオンがないことは、分子構成の脱凝集反応と、膜のインサイドアウトのフォールディングを導き、本目的のために使用不可能な生成物を与える。
【0007】
細胞を蛍光コード化する代替的な方法は、膜透過性の脂溶性染料の使用[Tanaka,Y.and Schroit,A.J.Insertion of fluorescent phosphatidylserine in the plasma membrane of red blood cells.J.Biol.Chem.vol.258(1983)11335−11343;Tokumasu,F.and Dvorak,J.Development and application of quantum dots for immunochemistry of human erythrocytes.Journal of Microscopy,vol.211(2003)256−261]と細胞表面に対する反応性染料の不可逆性共有結合[Donald,M.M.et al.RBCs labeled at two biotin densities permit simultaneous and repeated measurements of circulating RBC volume.Transfusion,vol 44(2004)431−437;Suzuki,T.and Dale,G.L.Biotinylated erythrocytes:In−vivo survival and in vitro recovery.Blood,vol.70(1987)791−795]を含んでいる。あるとしてもわずかなデータしか、リガンド−レセプタ相互作用上の共有結合の効果については存在しない[Cowley,H.,et al.Biotinylation modifies red cell antigens.Transfusion,vol.39(1999)163−168]。更に、いくつかの染料が多数の異なる色を生成するのに用いられる場合にコード化反応が厳密に制御されないのであれば、多数の別個のコードは表面コード化アプローチを用いて構成することには難しく、異なるスペクトルフィンガプリントを有する多数の染料ライブラリが用いられる。従って、反応を精密にモニタリングせずに、数個の染料の色を用いることができるコード化方法が所望されている。
【0008】
試料中の抗体がゴーストに結合したことを示すべく、コード化したゴースト細胞と第2の抗体を用いた多重アッセイフォーマットにおいて、例えば、フローサイトメトリを用いて、ゴースト細胞アレイの解読がなされる[Wagner,F.F.and Flegel,W.A.Principles and applications of red blood cell flow cytometry.Transfusion Medicine and Hemotherapy vol.25(1998);Roback,J.D.,Barclay,S.and Hillyer,C.D.An automatable platform for accurate Immunohematology testing by flow cytometry.Transfusion Vol.43(2003)918;Roback,J.D.,Barclay,S.and Hillyer,C.D.Improved method for fluoresce cytometric immunohematology testing.Transfusion vol.44(2004)187;Sharon,R.and Fibach,E.Quantitative flow cytometric Analysis of ABO Red Cell Antigens.Cytometry vol.12(1991)545−549;Arndt,P.A.and Garratty,G.Flow cytofluorometric analysis in red blood cell immunology.Transfusion Medicine and Hemotherapy vol.31(2004)]。高スループットに付随する利点を用いてインサイツでの解読を可能にする、その他の解読方法が所望されている。
【発明の開示】
【発明が解決しようとする課題】
【0009】
RBCアロ抗体の検出及び評価方法が開示され、既知の抗原が存在すれば、蛍光コード化した赤血球又は赤血球ゴーストを生成し、血液/血清/血漿試料中の抗体の存在を検出するためにそれらの赤血球又は赤血球ゴーストを用い、好ましくは蛍光サンドイッチ型のイムノアッセイを用いることに基づいている。蛍光RBC又はRBCゴーストの多重集合がまず生成され、特定の表現型を表わす各々の集合が、蛍光サイン又はコードとユニークに連結する。陽性反応の場合においては、試料中のアロ抗体が、抗原−抗体複合体を形成するコード化細胞上の同族の抗原に結合する。未結合の免疫グロブリンを除去するための洗浄後に、(コード化染料より、異なるスベクトルサインを有する)蛍光第2試薬が導入され、細胞上に捕捉されたアロ抗体に結合する。蛍光第2試薬によって生成されたこのアッセイ信号は、コード化蛍光を有する結合と相関することによって、特定の細胞/ゴーストと相関し、従って、細胞及び同族のアロ抗体上に存在する抗原を同定することができる。コード化した細胞の解読は、蛍光顕微鏡検査法及び2次元画像分析法を用いてインサイツで為すことができ、解読画像がアッセイ画像と比較され相関される(特許された米国特許出願第09/448,240号参照)。
【課題を解決するための手段】
【0010】
以下の例は、コード化したゴースト細胞を用いてアッセイを行うと同時に、コード化したゴースト細胞の調製処理を概説している。この処理は、反応の厳密なモニタリングを要求することなく、数個の染料を用いたコード化を可能にし、結果として生ずるゴーストは、蛍光型イムノアッセイで用いられる場合、試料中の抗体を検出するために正確な配向性で抗原を示す。アッセイ結果のインサイツ解読例も含まれている。
【発明を実施するための最良の形態】
【0011】
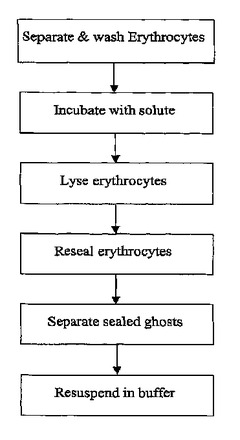
コード化したゴースト細胞を調整する際に、好ましいバッファ条件(pHがほぼ中性、の濃度0.1乃至2mMのバッファと、イオン強度がほぼ等浸透圧のマグネシウムイオン)は、細胞表面タンパク質の反応性と元の配向性を保護するのを手助けし、それらのタンパク質が接近できないように転化されることを防いでいる。例示的な方法は、以下の例1で示されている。
【実施例】
【0012】
例1:赤血球の分離と標識されたゴーストの調製
赤血球洗浄保管バッファ:
500mlの蒸留水に溶解された
塩化ナトリウム =4.383g
一ナトリウムリン酸塩 =0.345g
塩化マグネシウム六水和物 =0.203g
フェニルメチルスルホン酸クロリド=0.0435g
赤血球溶血バッファ:
500mlの蒸留水に溶解された
一ナトリウムリン酸塩 =0.69g
塩化マグネシウム六水和物 =0.203g
フェニルメチルスルホン酸クロリド=0.0435g
赤血球封入溶液:
50mlの蒸留水に溶解された
塩化ナトリウム=6g
手順:
i) 1mlの保管バッファを、2mlの遠心管に入れる
ii) 刺した指の鮮血を1滴加え(〜25uL)、緩やかに逆位にして混ぜ合わせる
iii) 〜600乃至1000gで2分間遠心分離し、上澄みを除去する。1.5mlの保管バッファを加え、緩やかにRBCペレットを再懸濁し、遠心分離を繰り返す。上澄みを捨て、2回繰り返す。
iv) 保管バッファ中の蛍光溶質(又は溶質混合物)を所望の濃度に調整し、200mlの溶液を赤血球ペレットに加える。RTで5分間インキュベートする。
v) 1.5mlのRBC溶血バッファを(iv)中の溶液に加え、逆位によって素早く混合し、RTで30秒間インキュベートする
vi) 250ulのRBC封入溶液を(v)に加え、逆位で混合する
vii) 〜16,000乃至20,000gで3分間遠心分離し、上澄みを捨てる。1.5mlの保管バッファ中でゴーストペレットを再懸濁し、遠心分離−再分散サイクルを3回繰り返す。
viii)0.13g/Lのアジ化ナトリウムを伴う1mlの最終保管バッファ中でペレットを再懸濁し、使用するまで2乃至4℃で保管する。1月以上の間保管すると、ゴーストは安定する。
図1(a)は処理のフローチャートを示す。図1(b)はサイズ分布を示し、図1(c)は上述の処理を用いてコード化したゴースト細胞の蛍光画像を示す。
【0013】
例2:コード化したゴースト細胞のライブラリの生成
分子量3000(標識密度1mol/mol)のTAMRA標識デキストランは、Molecular Probe社から取得し、分子量4000(標識密度0.05mol/mol−0.5mol/mol)のFITC標識デキストランは、Sigma−Aldrich社から取得した。5つの濃度の異なる保存液10mg/ml、2mg/ml、0.4mg/ml、0.08mg/ml及び0.016mg/mlが、それぞれ保管バッファを用いて調製された。コード化したゴーストの10個の異なる集合は、例1に述べた処方箋を用いて調製した。ゴーストは、その蛍光性についてフローサイトメトリを用いて評価された。TAMRA及びFITCデキストランの別個の1:1(v/v)混合物を用いて、2つのコード化した染料を所有するコード化したゴーストを生成した。
【0014】
例3:磁気反応性のコード化されたゴースト細胞のライブラリ生成
コード化したゴースト細胞は、当該技術分野で既知の磁気細胞表面標識法によって与えられうる。いくつかの会社が対象の細胞を磁気標識して分離するキットを販売している(www.miltenyibiotec.com、www.immunicon.com、www.dvnalbiotech.com)。磁力標識された全血液細胞は、商業上の製品(www.diagast.com)としても利用可能である。図2に概説したように、特定の所望のアプローチは、試料からの抗体の結合の後に続いて加えられる、抗ヒトIgGで被膜された磁性ナノビーズを用いた標識を利用している。
【0015】
例4:コード化されたゴーストを解読する方法
上に概説した方法は、明るい、光安定性の、容易に多重化される、蛍光コード化したゴーストを生成している。従って、好結果の解読ストラテジは、フローサイトメトリのような従来の連続照合技術を含め、赤血球を評価するのに従来使用されてきた混合したものの内部から単一の細胞集合の識別を果たすことができるいずれのプラットフォームも含んでいる。代替的に、2次元画像分析法と連結した蛍光顕微鏡検査法[名称READTM 、米国特許第6,797,524号参照;“Array Cytometry”米国特許第6,387,707号参照、双方が引用として取り込まれる]は、解読に用いることができる。機能化した基質上に配置すること[Albrecht,D.R.et al.Photo−and electropatterning of hydrogel−encapsulated living cell arrays.Lab Chip vol.5(2005)111−118;Soen,Y.et al.Detection and characterization of cellular immune responses using peptide−MHC raicroarrays.PLOS Biology vol.1(2003)429−438;Kato,K. et al.Immobilized culture of nonadherent cells on an oleyl poly(ethylene glycol)ether−modifyed surface.Biotechniques vol.35(2003)1014−1021]、及び画像ファイバ上への捕捉[Biran,I. And Walt,D.R.Optical imaging fiber−based single live cell arrays:A high−density cell assay platform.Analytical Chemistry vol.74(2002)3046−3054]のような事前形成を可能にする方法を含む、細胞の2次元アレイについての多様な方法が報告されている。更に、磁気細胞の選択[Tibbe,A.G.J.et al.Cell analysis system based on immunomagnetic cell selection and alignment followed by immunofluorescent analysis using compact disk technologies.Cytometry vol.43(2001)31−37]、マイクロ流体チャネル[Shelby,J.P.et al.A microfluidic model for single−cell capillary obstruction by Plasmodium falciparum−infected erythrocytes.Proc.Nat.Acad.Sci.vol.100(2003)14618−14622]、交流電気泳動[米国特許第6,387,707号;Minerick,A.R.Manipulating and characterization of red blood cells with alternating current field in microdevices.Electrophoresis vol.24(2003)3703−3717]のような、動的又はリアルタイムアレイ組立法がある。
【0016】
例5:全赤血球を用いたイムノアッセイ
図3は、全血液又はRBCゴーストを用いてイムノアッセイを行うための処理フローを示している。この例において、洗浄した全RBC(表現型Fy(a+,b−),(K−,k+))は、モノクローナルマウス抗Fyとモノクローナルマウス抗K(双方がニューヨーク血液センタのMarion Reed博士からの研究室から贈り物である)と別個に反応させた。双方の場合において、Cy5標識ヤギ抗マウスポリクローナル抗体(Jackson Immunoresearch社、ペンシルベニア州ウェストグローブ)は、第2の蛍光検出抗体として用いられた。予想通り、特異的な信号は抗Fyaの場合に見られ、抗K抗体の場合には見られなかった(結果は示さず)。
【0017】
例6:コード化したゴーストを用いたイムノアッセイ
イムノアッセイは例5に概説したように、洗浄された全RBC(表現型(M+,N−))と、モノクローナルラット抗M及び抗N抗体(米国Biological社、マサチューセッツ州スワンプスコット)とから調製されるゴースト細胞を用いて行われた。抗Mを伴う反応は、予期される蛍光信号を生成したが、予想通り、抗Nはバックグラウンドにわたり、どんな検出可能な信号も生成しなかった。図7は抗M抗体を用いたイムノアッセイ完成後のRBCゴーストの画像を示す。
【0018】
例7:全赤血球とアロ血清を用いたイムノアッセイ
一連のイムノアッセイは、表現型試薬RBC(0.8%サージスクリーン、Ortho Clinical Diagnostics社、ニュージャージー州)及び試薬血清(Ortho Clinical Diagnostics社、ニュージャージー州)を用いて実行された。全ケースで、PE標識ヤギ抗ヒト抗体(Jackson Immunoresearch社、ペンシルベニア州ウェストグローブ)(1:100希釈)が、第2の検出抗体として用いられた。抗体陰性AB血液型血清は、負のコントロールとして用いられた。結果は以下の表1に示した。蛍光イムノアッセイと報告された表現型(抗グラム)との結果は一致している。
【表1】

【0019】
用語、表現及び例示はここでは具体例であり制限はされないこと、及び本発明の範囲は請求項によってのみ制限され、請求される主題の総ての等価物を含んでいることは、理解すべきである。
【図面の簡単な説明】
【0020】
【図1】図1は、赤血球分離及びゴースト細胞調製用のフローチャートである。
【図2】図2は、結合後に続く例示的な手順用のフローチャートであり、第2の抗体を展示する磁性ビーズを用いて解読用アレイ内の反応性ゴーストを捕捉している。
【図3】図3は、ゴーストを用いた血清中で反応性抗体を、かつ、サンドウィッチアッセイフォーマット中で第2の検出抗体を検出する手順のフローチャートである。
【技術分野】
【0001】
マイナーな血液型抗原(例えば、Jk、Rh、Kell、Kidd及びDuffy)は、感作宿主に投与された場合、自己抗体及び/又はアロ抗体を誘起し、自己免疫性溶血性貧血、溶血性貧血、新生児溶血性疾患、及び溶血性輸血反応を引き起こす。感作は過去の輸血又は抗体陽性の胎児の妊娠から生じる。これらのアロ抗体は通常、別々の凝集反応アッセイで経時的に、既知の表現型の赤血球(RBC)パネルに対して、レシピエントの血清を検査することによって検出し同定される(例えば、抗Jka抗体は、患者の血清がJka+RBCと反応し、Jka−RBCと反応しないかどうかを判定することによって同定されうる)。様々な抗原表現型のRBCの複数の試料を選択することによって、臨床上重要なアロ抗体の存在又は不存在を検出することが可能である。
【背景技術】
【0002】
凝集反応アッセイは従来、溶液中、すなわち試験管内で行われている。特に反応が弱い場合、試験管の凝集反応用のデータ解釈は、熟練した、経験のある技術者を必要とする。しかしながら近年、ゲルフォーマットや被膜固相フォーマットのような新しい技法が、開発されてきた。ゲル技法はデキストラン−アクリルアミドゲルを通した赤血球凝集反応が制御されるという原理に基づいている[Judd WJ,Steiner EA,Knafl PC,Masters C.The gel test:use in the identification of unexpected antibodies to blood group antigens.Immunohematology 1998;14:59−62]。マイクロチューブは、ゲル、バッファ及び試薬の混合物で充填される。ゲルの頂部で、患者の血清と様々な既知の赤血球との混合物が添加され、制御された条件下でのゲルを通した遠心分離がその後に続く。陰性反応では、細胞はゲルを通過し、マイクロチューブの底部で小球状になる。逆に陽性反応では、最も強い反応(最大の凝集反応塊)が最小ないし観察不能な移動を示し、ほとんどの赤血球が、ゲル微小カラムの頂部で、あるいはその近くで捕捉され、ゲル中の様々な準位で捕捉される。Immucor社により開発された固相システムは、ヒト赤血球固定化用のマイクロウェルを提供し、対応する赤血球抗原に対するIgG赤血球抗体の検出用固相アッセイに用いられる[Plapp FV,Sinor LT,Rachel JM,et al A solid phase antibody screen.Am J Clin Pathol 1984;82:179]。ウェルは、マイクロウェル表面への、ユーザが選択した赤血球の固定化を可能にする化学カップリング剤で被膜される。被膜したウェルは、抗体抗原反応を促進する条件下で、血清、血漿又はその他の試薬を含む血液製剤と共にインキュベートされる。インキュベーションに続いて、未結合の残留免疫グロブリンが、ウェルと抗IgG被膜された、添加した指示赤血球からすすがれる。遠心分離は、指示赤血球を固定化赤血球層に結合した抗体と接触させる。陽性試験の場合、IgG−抗IgGは、指示赤血球と感作される固定化細胞との間の形態を複雑にする。架橋抗体の結果として、指示細胞は、第2の固定化層として固定化細胞と接着する。検出可能な抗体抗原相互作用がない場合(陰性試験)、指示赤血球は固定化細胞へ結合せず、すし詰め状態のボタンのように、ウェルの底で小球状になる。
【0003】
細胞膜は、真核細胞内部と外部環境との間の界面を形成する。従って、この膜に埋め込まれたタンパク質の機能は多様であり、細胞外信号の細胞−細胞及び細胞−細胞外マトリクス認識、感知、及び伝達と、細胞内外への溶質及び水分子の輸送とを含んでいる。細胞表面のタンパク質集合の不均一性は、抽出された膜タンパク質又は未精製の細胞可溶化物を用いたインビトロアッセイの開発の困難性につながっている。赤血球膜は、二重膜と、埋め込まれたタンパク質と糖タンパク質とのアレイと、細胞骨格タンパク質ネットワークの複合体層とからなる複雑な構成である[Steck,T.L.The organization of proteins in the human red blood cell membrane.J.Cell Biol.vol.62(1974)1−19;Byers,T.L.and Branton,D.Visualization of the protein associations in the erythrocyte membrane skeleton.Proc.Natl.Acad.Sci.USA vol.82(1985)6153−6157;Seeman,P.,Cheng,D.,and Iles,G.H.Structure of membrane holes in osmotic and saponin hemolysis J.Cell.Biol.vol.56(1973)519−527]。
【0004】
プローブとしてコード化したインタクト細胞を用いることは、細胞表面レセプタに結合するリガンドを選別するための魅力的な代替方法を提供し、高スループット技術を受入可能な小型化され、多重化されたプラットフォームの開発を与える。
【0005】
赤血球内溶質の封入は、薬剤輸送及びターゲティングの手段として広く研究されてきた[Ihler G.M.,Glew,R.H.and Schnure,F.W.Enzyme loading of erythrocytes.PNAS vol.70(1973)2663−2666;DeLoach,J.R.,Harris,R.L.and Hiler,G.M.An erythrocyte encapsulator dialyzer used in preparing large quantities of erythrocyte ghosts and encapsulation of pesticide in erythrocyte ghosts.Analytical Biochemistry vol.102(1980)220−227;Baker,R.F.Entry of ferritin into human red cells during hypotonic haemolysis.Nature vol.215(1967)424−425;Marsden,N.V.B.,and Ostling,S.G.Accumulation of dextran in human red cells after haemolysis.Nature vol.184(1959)723−724]。このアプローチにおいて、軽度の浸透圧溶血が、赤血球の膜有孔性の変化を誘発し、タンパク質及び小さな溶質とほぼ同一サイズのプローブが、赤血球内部に分配することを可能にする。溶血後のイオン強度(等浸透圧条件の復元)を適宜操作することによってこの孔は再封入でき、赤血球に分配された溶質を永久に捕捉する(赤血球ゴーストとしても知られている)。再封入されたゴーストを洗浄することによって、外部媒質から過剰な溶質を除去する。このアプローチを用いて、蛍光性赤血球ゴーストを与えるための蛍光標識されたデキストランを負荷することは、文献に報告されている[Doberstein,S.K.et al.Fluorescent erythrocyte ghosts asstandards for quantitative flow cytometry.Cytometry vol.20(1995)14−18]。
【0006】
しなしながら、アッセイでの最封入されたゴーストの使用は、細胞表面タンパク質とその配向性が、ゴーストの調製と溶質負荷処理によって影響を及ぼされないことを必要とする。特に低イオン強度バッファの使用、又はバッファ中にマグネシウムイオンがないことは、分子構成の脱凝集反応と、膜のインサイドアウトのフォールディングを導き、本目的のために使用不可能な生成物を与える。
【0007】
細胞を蛍光コード化する代替的な方法は、膜透過性の脂溶性染料の使用[Tanaka,Y.and Schroit,A.J.Insertion of fluorescent phosphatidylserine in the plasma membrane of red blood cells.J.Biol.Chem.vol.258(1983)11335−11343;Tokumasu,F.and Dvorak,J.Development and application of quantum dots for immunochemistry of human erythrocytes.Journal of Microscopy,vol.211(2003)256−261]と細胞表面に対する反応性染料の不可逆性共有結合[Donald,M.M.et al.RBCs labeled at two biotin densities permit simultaneous and repeated measurements of circulating RBC volume.Transfusion,vol 44(2004)431−437;Suzuki,T.and Dale,G.L.Biotinylated erythrocytes:In−vivo survival and in vitro recovery.Blood,vol.70(1987)791−795]を含んでいる。あるとしてもわずかなデータしか、リガンド−レセプタ相互作用上の共有結合の効果については存在しない[Cowley,H.,et al.Biotinylation modifies red cell antigens.Transfusion,vol.39(1999)163−168]。更に、いくつかの染料が多数の異なる色を生成するのに用いられる場合にコード化反応が厳密に制御されないのであれば、多数の別個のコードは表面コード化アプローチを用いて構成することには難しく、異なるスペクトルフィンガプリントを有する多数の染料ライブラリが用いられる。従って、反応を精密にモニタリングせずに、数個の染料の色を用いることができるコード化方法が所望されている。
【0008】
試料中の抗体がゴーストに結合したことを示すべく、コード化したゴースト細胞と第2の抗体を用いた多重アッセイフォーマットにおいて、例えば、フローサイトメトリを用いて、ゴースト細胞アレイの解読がなされる[Wagner,F.F.and Flegel,W.A.Principles and applications of red blood cell flow cytometry.Transfusion Medicine and Hemotherapy vol.25(1998);Roback,J.D.,Barclay,S.and Hillyer,C.D.An automatable platform for accurate Immunohematology testing by flow cytometry.Transfusion Vol.43(2003)918;Roback,J.D.,Barclay,S.and Hillyer,C.D.Improved method for fluoresce cytometric immunohematology testing.Transfusion vol.44(2004)187;Sharon,R.and Fibach,E.Quantitative flow cytometric Analysis of ABO Red Cell Antigens.Cytometry vol.12(1991)545−549;Arndt,P.A.and Garratty,G.Flow cytofluorometric analysis in red blood cell immunology.Transfusion Medicine and Hemotherapy vol.31(2004)]。高スループットに付随する利点を用いてインサイツでの解読を可能にする、その他の解読方法が所望されている。
【発明の開示】
【発明が解決しようとする課題】
【0009】
RBCアロ抗体の検出及び評価方法が開示され、既知の抗原が存在すれば、蛍光コード化した赤血球又は赤血球ゴーストを生成し、血液/血清/血漿試料中の抗体の存在を検出するためにそれらの赤血球又は赤血球ゴーストを用い、好ましくは蛍光サンドイッチ型のイムノアッセイを用いることに基づいている。蛍光RBC又はRBCゴーストの多重集合がまず生成され、特定の表現型を表わす各々の集合が、蛍光サイン又はコードとユニークに連結する。陽性反応の場合においては、試料中のアロ抗体が、抗原−抗体複合体を形成するコード化細胞上の同族の抗原に結合する。未結合の免疫グロブリンを除去するための洗浄後に、(コード化染料より、異なるスベクトルサインを有する)蛍光第2試薬が導入され、細胞上に捕捉されたアロ抗体に結合する。蛍光第2試薬によって生成されたこのアッセイ信号は、コード化蛍光を有する結合と相関することによって、特定の細胞/ゴーストと相関し、従って、細胞及び同族のアロ抗体上に存在する抗原を同定することができる。コード化した細胞の解読は、蛍光顕微鏡検査法及び2次元画像分析法を用いてインサイツで為すことができ、解読画像がアッセイ画像と比較され相関される(特許された米国特許出願第09/448,240号参照)。
【課題を解決するための手段】
【0010】
以下の例は、コード化したゴースト細胞を用いてアッセイを行うと同時に、コード化したゴースト細胞の調製処理を概説している。この処理は、反応の厳密なモニタリングを要求することなく、数個の染料を用いたコード化を可能にし、結果として生ずるゴーストは、蛍光型イムノアッセイで用いられる場合、試料中の抗体を検出するために正確な配向性で抗原を示す。アッセイ結果のインサイツ解読例も含まれている。
【発明を実施するための最良の形態】
【0011】
コード化したゴースト細胞を調整する際に、好ましいバッファ条件(pHがほぼ中性、の濃度0.1乃至2mMのバッファと、イオン強度がほぼ等浸透圧のマグネシウムイオン)は、細胞表面タンパク質の反応性と元の配向性を保護するのを手助けし、それらのタンパク質が接近できないように転化されることを防いでいる。例示的な方法は、以下の例1で示されている。
【実施例】
【0012】
例1:赤血球の分離と標識されたゴーストの調製
赤血球洗浄保管バッファ:
500mlの蒸留水に溶解された
塩化ナトリウム =4.383g
一ナトリウムリン酸塩 =0.345g
塩化マグネシウム六水和物 =0.203g
フェニルメチルスルホン酸クロリド=0.0435g
赤血球溶血バッファ:
500mlの蒸留水に溶解された
一ナトリウムリン酸塩 =0.69g
塩化マグネシウム六水和物 =0.203g
フェニルメチルスルホン酸クロリド=0.0435g
赤血球封入溶液:
50mlの蒸留水に溶解された
塩化ナトリウム=6g
手順:
i) 1mlの保管バッファを、2mlの遠心管に入れる
ii) 刺した指の鮮血を1滴加え(〜25uL)、緩やかに逆位にして混ぜ合わせる
iii) 〜600乃至1000gで2分間遠心分離し、上澄みを除去する。1.5mlの保管バッファを加え、緩やかにRBCペレットを再懸濁し、遠心分離を繰り返す。上澄みを捨て、2回繰り返す。
iv) 保管バッファ中の蛍光溶質(又は溶質混合物)を所望の濃度に調整し、200mlの溶液を赤血球ペレットに加える。RTで5分間インキュベートする。
v) 1.5mlのRBC溶血バッファを(iv)中の溶液に加え、逆位によって素早く混合し、RTで30秒間インキュベートする
vi) 250ulのRBC封入溶液を(v)に加え、逆位で混合する
vii) 〜16,000乃至20,000gで3分間遠心分離し、上澄みを捨てる。1.5mlの保管バッファ中でゴーストペレットを再懸濁し、遠心分離−再分散サイクルを3回繰り返す。
viii)0.13g/Lのアジ化ナトリウムを伴う1mlの最終保管バッファ中でペレットを再懸濁し、使用するまで2乃至4℃で保管する。1月以上の間保管すると、ゴーストは安定する。
図1(a)は処理のフローチャートを示す。図1(b)はサイズ分布を示し、図1(c)は上述の処理を用いてコード化したゴースト細胞の蛍光画像を示す。
【0013】
例2:コード化したゴースト細胞のライブラリの生成
分子量3000(標識密度1mol/mol)のTAMRA標識デキストランは、Molecular Probe社から取得し、分子量4000(標識密度0.05mol/mol−0.5mol/mol)のFITC標識デキストランは、Sigma−Aldrich社から取得した。5つの濃度の異なる保存液10mg/ml、2mg/ml、0.4mg/ml、0.08mg/ml及び0.016mg/mlが、それぞれ保管バッファを用いて調製された。コード化したゴーストの10個の異なる集合は、例1に述べた処方箋を用いて調製した。ゴーストは、その蛍光性についてフローサイトメトリを用いて評価された。TAMRA及びFITCデキストランの別個の1:1(v/v)混合物を用いて、2つのコード化した染料を所有するコード化したゴーストを生成した。
【0014】
例3:磁気反応性のコード化されたゴースト細胞のライブラリ生成
コード化したゴースト細胞は、当該技術分野で既知の磁気細胞表面標識法によって与えられうる。いくつかの会社が対象の細胞を磁気標識して分離するキットを販売している(www.miltenyibiotec.com、www.immunicon.com、www.dvnalbiotech.com)。磁力標識された全血液細胞は、商業上の製品(www.diagast.com)としても利用可能である。図2に概説したように、特定の所望のアプローチは、試料からの抗体の結合の後に続いて加えられる、抗ヒトIgGで被膜された磁性ナノビーズを用いた標識を利用している。
【0015】
例4:コード化されたゴーストを解読する方法
上に概説した方法は、明るい、光安定性の、容易に多重化される、蛍光コード化したゴーストを生成している。従って、好結果の解読ストラテジは、フローサイトメトリのような従来の連続照合技術を含め、赤血球を評価するのに従来使用されてきた混合したものの内部から単一の細胞集合の識別を果たすことができるいずれのプラットフォームも含んでいる。代替的に、2次元画像分析法と連結した蛍光顕微鏡検査法[名称READTM 、米国特許第6,797,524号参照;“Array Cytometry”米国特許第6,387,707号参照、双方が引用として取り込まれる]は、解読に用いることができる。機能化した基質上に配置すること[Albrecht,D.R.et al.Photo−and electropatterning of hydrogel−encapsulated living cell arrays.Lab Chip vol.5(2005)111−118;Soen,Y.et al.Detection and characterization of cellular immune responses using peptide−MHC raicroarrays.PLOS Biology vol.1(2003)429−438;Kato,K. et al.Immobilized culture of nonadherent cells on an oleyl poly(ethylene glycol)ether−modifyed surface.Biotechniques vol.35(2003)1014−1021]、及び画像ファイバ上への捕捉[Biran,I. And Walt,D.R.Optical imaging fiber−based single live cell arrays:A high−density cell assay platform.Analytical Chemistry vol.74(2002)3046−3054]のような事前形成を可能にする方法を含む、細胞の2次元アレイについての多様な方法が報告されている。更に、磁気細胞の選択[Tibbe,A.G.J.et al.Cell analysis system based on immunomagnetic cell selection and alignment followed by immunofluorescent analysis using compact disk technologies.Cytometry vol.43(2001)31−37]、マイクロ流体チャネル[Shelby,J.P.et al.A microfluidic model for single−cell capillary obstruction by Plasmodium falciparum−infected erythrocytes.Proc.Nat.Acad.Sci.vol.100(2003)14618−14622]、交流電気泳動[米国特許第6,387,707号;Minerick,A.R.Manipulating and characterization of red blood cells with alternating current field in microdevices.Electrophoresis vol.24(2003)3703−3717]のような、動的又はリアルタイムアレイ組立法がある。
【0016】
例5:全赤血球を用いたイムノアッセイ
図3は、全血液又はRBCゴーストを用いてイムノアッセイを行うための処理フローを示している。この例において、洗浄した全RBC(表現型Fy(a+,b−),(K−,k+))は、モノクローナルマウス抗Fyとモノクローナルマウス抗K(双方がニューヨーク血液センタのMarion Reed博士からの研究室から贈り物である)と別個に反応させた。双方の場合において、Cy5標識ヤギ抗マウスポリクローナル抗体(Jackson Immunoresearch社、ペンシルベニア州ウェストグローブ)は、第2の蛍光検出抗体として用いられた。予想通り、特異的な信号は抗Fyaの場合に見られ、抗K抗体の場合には見られなかった(結果は示さず)。
【0017】
例6:コード化したゴーストを用いたイムノアッセイ
イムノアッセイは例5に概説したように、洗浄された全RBC(表現型(M+,N−))と、モノクローナルラット抗M及び抗N抗体(米国Biological社、マサチューセッツ州スワンプスコット)とから調製されるゴースト細胞を用いて行われた。抗Mを伴う反応は、予期される蛍光信号を生成したが、予想通り、抗Nはバックグラウンドにわたり、どんな検出可能な信号も生成しなかった。図7は抗M抗体を用いたイムノアッセイ完成後のRBCゴーストの画像を示す。
【0018】
例7:全赤血球とアロ血清を用いたイムノアッセイ
一連のイムノアッセイは、表現型試薬RBC(0.8%サージスクリーン、Ortho Clinical Diagnostics社、ニュージャージー州)及び試薬血清(Ortho Clinical Diagnostics社、ニュージャージー州)を用いて実行された。全ケースで、PE標識ヤギ抗ヒト抗体(Jackson Immunoresearch社、ペンシルベニア州ウェストグローブ)(1:100希釈)が、第2の検出抗体として用いられた。抗体陰性AB血液型血清は、負のコントロールとして用いられた。結果は以下の表1に示した。蛍光イムノアッセイと報告された表現型(抗グラム)との結果は一致している。
【表1】

【0019】
用語、表現及び例示はここでは具体例であり制限はされないこと、及び本発明の範囲は請求項によってのみ制限され、請求される主題の総ての等価物を含んでいることは、理解すべきである。
【図面の簡単な説明】
【0020】
【図1】図1は、赤血球分離及びゴースト細胞調製用のフローチャートである。
【図2】図2は、結合後に続く例示的な手順用のフローチャートであり、第2の抗体を展示する磁性ビーズを用いて解読用アレイ内の反応性ゴーストを捕捉している。
【図3】図3は、ゴーストを用いた血清中で反応性抗体を、かつ、サンドウィッチアッセイフォーマット中で第2の検出抗体を検出する手順のフローチャートである。
【特許請求の範囲】
【請求項1】
試料中のアロ抗体を検出する方法において:
別々にコード化された赤血球又は赤血球ゴーストセットを生成するステップであって、別々にコード化された細胞又はゴーストが、前記セット中のその他の細胞又はゴーストによって発現されない細胞膜表面上の少なくとも1の抗原を発現するステップと;
前記細胞膜表面上の前記抗原に対し、試料中に存在する抗体の結合を可能にする条件下で、前記セットを血清、血液又は血漿の試料へ曝露するステップと;
この結合した抗体を標的として標識された第2の抗体を用いて結合を検出するステップと;
を具えることを特徴とする方法。
【請求項2】
結合の後に過剰な未結合の試料を洗い落とすステップを更に具えることを特徴とする請求項1に記載の方法。
【請求項3】
前記コード化が蛍光染料を伴うことを特徴とする請求項1に記載の方法。
【請求項4】
前記第2の抗体が蛍光染料で標識されることを特徴とする請求項1に記載の方法。
【請求項5】
前記第2の抗体がモノクローナルであることを特徴とする請求項1に記載の方法。
【請求項6】
前記検出ステップが、フローサイトメトリを用いて実行されるか、又は、前記コード化された細胞又はゴーストのアレイを画像化し、前記結合した第2の抗体を画像化し、前記結合した第2の抗体をこのアレイ画像と相関させて、前記セット内のどの細胞又はゴーストが前記試料中の抗体と反応したかを決定することによって実行されることを特徴とする請求項1に記載の方法。
【請求項7】
コード化したゴースト細胞を調製する方法が:
全血液から赤血球を分離するステップと;
染料溶液を用いて前記赤血球をインキュベートして、前記赤血球の表面上の抗原をコード化するステップと;
溶血溶液を用いて赤血球を溶血させるステップと;
再封入溶液を用いてこの溶血させた赤血球を再封入するステップと;
前記再封入溶液からこの再封入された赤血球ゴーストを分離するステップと;
を具えることを特徴とする方法。
【請求項8】
分離が遠心分離によって行われることを特徴とする請求項7に記載の方法。
【請求項9】
前記溶血溶液が、500mlの蒸留水に溶解させた0.69gの一ナトリウムリン酸塩と、0.203gの塩化マグネシウム六水和物と、0.0435gのフェニルメチルスルホン酸クロリドとを具えることを特徴とする請求項7に記載の方法。
【請求項10】
前記再封入溶液が、50mlの蒸留水に溶解させた6gの塩化ナトリウムを具えることを特徴とする請求項7に記載の方法。
【請求項11】
前記染料溶液が、pHがほぼ中性で、イオン強度がほぼ等浸透圧で、濃度0.1乃至2mMのマグネシウムイオンとを有するバッファであることを特徴とする請求項7に記載の方法。
【請求項12】
この染料が蛍光性であることを特徴とする請求項7に記載の方法。
【請求項13】
500mlの蒸留水に溶解させた、4.383gの塩化ナトリウムと、0.345gの一ナトリウムリン酸塩と、0.203gの塩化マグネシウム六水和物と、0.0435gのフェニルメチルスルホン酸クロリドとを具える溶液中で、このゴーストを保存するステップを更に具えることを特徴とする請求項7に記載の方法。
【請求項14】
請求項7乃至13のいずれかの方法により調製されるコード化したゴースト細胞。
【請求項1】
試料中のアロ抗体を検出する方法において:
別々にコード化された赤血球又は赤血球ゴーストセットを生成するステップであって、別々にコード化された細胞又はゴーストが、前記セット中のその他の細胞又はゴーストによって発現されない細胞膜表面上の少なくとも1の抗原を発現するステップと;
前記細胞膜表面上の前記抗原に対し、試料中に存在する抗体の結合を可能にする条件下で、前記セットを血清、血液又は血漿の試料へ曝露するステップと;
この結合した抗体を標的として標識された第2の抗体を用いて結合を検出するステップと;
を具えることを特徴とする方法。
【請求項2】
結合の後に過剰な未結合の試料を洗い落とすステップを更に具えることを特徴とする請求項1に記載の方法。
【請求項3】
前記コード化が蛍光染料を伴うことを特徴とする請求項1に記載の方法。
【請求項4】
前記第2の抗体が蛍光染料で標識されることを特徴とする請求項1に記載の方法。
【請求項5】
前記第2の抗体がモノクローナルであることを特徴とする請求項1に記載の方法。
【請求項6】
前記検出ステップが、フローサイトメトリを用いて実行されるか、又は、前記コード化された細胞又はゴーストのアレイを画像化し、前記結合した第2の抗体を画像化し、前記結合した第2の抗体をこのアレイ画像と相関させて、前記セット内のどの細胞又はゴーストが前記試料中の抗体と反応したかを決定することによって実行されることを特徴とする請求項1に記載の方法。
【請求項7】
コード化したゴースト細胞を調製する方法が:
全血液から赤血球を分離するステップと;
染料溶液を用いて前記赤血球をインキュベートして、前記赤血球の表面上の抗原をコード化するステップと;
溶血溶液を用いて赤血球を溶血させるステップと;
再封入溶液を用いてこの溶血させた赤血球を再封入するステップと;
前記再封入溶液からこの再封入された赤血球ゴーストを分離するステップと;
を具えることを特徴とする方法。
【請求項8】
分離が遠心分離によって行われることを特徴とする請求項7に記載の方法。
【請求項9】
前記溶血溶液が、500mlの蒸留水に溶解させた0.69gの一ナトリウムリン酸塩と、0.203gの塩化マグネシウム六水和物と、0.0435gのフェニルメチルスルホン酸クロリドとを具えることを特徴とする請求項7に記載の方法。
【請求項10】
前記再封入溶液が、50mlの蒸留水に溶解させた6gの塩化ナトリウムを具えることを特徴とする請求項7に記載の方法。
【請求項11】
前記染料溶液が、pHがほぼ中性で、イオン強度がほぼ等浸透圧で、濃度0.1乃至2mMのマグネシウムイオンとを有するバッファであることを特徴とする請求項7に記載の方法。
【請求項12】
この染料が蛍光性であることを特徴とする請求項7に記載の方法。
【請求項13】
500mlの蒸留水に溶解させた、4.383gの塩化ナトリウムと、0.345gの一ナトリウムリン酸塩と、0.203gの塩化マグネシウム六水和物と、0.0435gのフェニルメチルスルホン酸クロリドとを具える溶液中で、このゴーストを保存するステップを更に具えることを特徴とする請求項7に記載の方法。
【請求項14】
請求項7乃至13のいずれかの方法により調製されるコード化したゴースト細胞。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2009−529655(P2009−529655A)
【公表日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願番号】特願2008−549566(P2008−549566)
【出願日】平成19年1月4日(2007.1.4)
【国際出願番号】PCT/US2007/000234
【国際公開番号】WO2007/081778
【国際公開日】平成19年7月19日(2007.7.19)
【出願人】(503369358)バイオアレイ ソリューションズ リミテッド (14)
【Fターム(参考)】
【公表日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願日】平成19年1月4日(2007.1.4)
【国際出願番号】PCT/US2007/000234
【国際公開番号】WO2007/081778
【国際公開日】平成19年7月19日(2007.7.19)
【出願人】(503369358)バイオアレイ ソリューションズ リミテッド (14)
【Fターム(参考)】
[ Back to top ]

