細胞内発光イメージングのために最適化されたルシフェラーゼ遺伝子
【課題】細胞内情報を可視化する。
【解決手段】pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体であって、米国産Photinus pyralisホタルルシフェラーゼをコードする遺伝子構築体と比較して哺乳類細胞内の発光量が15倍以上高く、pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体が、哺乳類細胞における翻訳を効率化するために遺伝子配列を改変したものであり、改変前のpH非感受性ヒカリコメツキムシ・ルシフェラーゼ遺伝子が特定の配列で示されるものであり、前記遺伝子配列の改変が、下記のa)〜c):a)余分な転写因子が結合しないように、cDNAの配列を変えること、b)cDNA配列における昆虫のコドンユーセージを哺乳類細胞用に変えること、c)cDNAの制限酵素部位をなくすように変えることの少なくとも1種を含む、遺伝子構築体。
【解決手段】pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体であって、米国産Photinus pyralisホタルルシフェラーゼをコードする遺伝子構築体と比較して哺乳類細胞内の発光量が15倍以上高く、pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体が、哺乳類細胞における翻訳を効率化するために遺伝子配列を改変したものであり、改変前のpH非感受性ヒカリコメツキムシ・ルシフェラーゼ遺伝子が特定の配列で示されるものであり、前記遺伝子配列の改変が、下記のa)〜c):a)余分な転写因子が結合しないように、cDNAの配列を変えること、b)cDNA配列における昆虫のコドンユーセージを哺乳類細胞用に変えること、c)cDNAの制限酵素部位をなくすように変えることの少なくとも1種を含む、遺伝子構築体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、細胞内イメージングを目的とした細胞内での発光量が増幅されたルシフェラーゼの遺伝子構築体、その組み合わせ、該遺伝子構築体で形質転換された形質転換細胞、細胞内における2種の蛋白質の相互作用を評価する方法に関する。
【0002】
さらに本発明は、細胞内発現活性の高いルシフェラーゼ遺伝子構築体を用いた生細胞における感度の高い転写活性測定方法に関する。さらに詳しくは、プレートフォーマットによる多検体解析方法に関する。
【背景技術】
【0003】
生命科学の分野では、細胞内カルシウム量の変動、細胞内タンパクのリン酸化、エネルギーであるATPの分布或いは遺伝子の転写活性の測定など、細胞内に起きるさまざまな現象を解析することが大変重要であり、解析する手段として各種分子プローブが作成され、イメージングが行われている。とりわけ細胞内イメージングツールとして各種蛍光タンパクが用いられている。蛍光タンパクは細胞内での発現とほぼ同時期に、補因子を必要とせず、蛍光活性を持つ。細胞内で蛍光活性を指標として蛋白質の局在等に関するモニター蛋白質として利用されているが、励起光を必要とし不均一な蛍光収率等のため定量化は難しく、また、細胞に励起光を当てるため細胞が損傷され、長時間の観察には適していない。
【0004】
レポーター遺伝子を用いた転写活性測定は、プロモーター、エンハンサー、サイレンサーなどの遺伝子発現制御配列やそれに結合する転写因子の解析の他、特定のプロモーターに連結されたレポーター遺伝子の発現量を指標に、細胞内シグナル伝達経路の活性化状態、あるいは受容体−リガンドの解析などの様々な細胞内分子メカニズムの解析に用いられるツールである。この手法はまた、ドラッグ・ディスカバリーにおいて大規模スクリーニングのツールとして、また化学物質の毒性評価の指標として使用されている。
【0005】
ここで用いられるレポーターとしては、クロラムフェニコールアセチルトランスフェラーゼ(CAT)やβ−ガラクトシダーゼ、緑色蛍光タンパク質(GFP)などの多くの酵素が用いられてきたが、ホタルルシフェラーゼの発光を利用したシステムは感度が高く、他のレポーター酵素アッセイに比べ簡便なことから、現在広く用いられている。GFPも基質を必要とせず、励起光を照射することによって容易に検出することが可能であるが、定量化には適していない。また、励起光を照射するため、細胞へのダメージが大きく、長時間、連続的にモニターする目的には適さない。
【0006】
ホタルルシフェラーゼは発光性甲虫由来のルシフェラーゼであり、Photinus、Photuris及びLuciola属のホタルからcDNAが単離されている。特にPhotinus pylalis由来のものは、長年に渡って仔細な研究がなされている。ホタルを含む甲虫由来のルシフェラーゼは、多複素環式有機酸D-(-)-2-(6’-ヒドロキシ-2’-ベンゾチアゾリル)-Δ2-チアゾリン-4-カルボン酸(以後、ルシフェリンと表記する)を基質とし、Mgイオン存在下でATPとルシフェリンが反応してルシフェニルアデニレートを形成し、酸素と結合し、励起状態のオキシルシフェリンが生じる。このオキシルシフェリンが基底状態に戻るときに光を発する。
【0007】
ホタルルシフェラーゼはレポーター遺伝子として、細胞に与える外来因子の影響の評価、細胞内情報伝達の伝播、或は個々のタンパク群の発現解析等に用いられている。ホタルルシフェラーゼ遺伝子に転写活性領域を挿入、細胞内に遺伝子構築体を導入、レポーター遺伝子を導入した培養細胞を一定時間、薬剤等で処理した後、細胞を集め、発光基質を加えることで、細胞内で合成されたルシフェラーゼ量を測定、転写活性を評価するシステムが挙げられる。ルシフェラーゼの発光量から転写活性を評価することから定量性に優れており、既に多くの会社から本システム関連製品が開発、市販化されている。
【0008】
ホタルルシフェラーゼを用いたイメージングとして、例えば、細胞内カルシウム量を発光タンパク質イクオリンで、ATP量をホタルルシフェラーゼで測定し、細胞内におけるエネルギー物質ATPの変動の可視化に成功している(非特許文献1)。また、ホタルルシフェラーゼスプリットアッセイによりタンパク間分子間力の可視化に成功した例もある(非特許文献2)。ルシフェラーゼによるイメージングは蛍光タンパクのように1分子レベルの解析や細胞内のごく小さいエリアのイメージングには不向きであるが、細胞内のオルガネラレベルで起きている現象の解析、特に長時間に渡る測定においては蛍光タンパクでは計測できない細胞情報を得ることが可能である。よってホタルルシフェラーゼイメージングは医薬の評価、スクリーニングに有効な方法である。
【0009】
しかしながら、ホタルルシフェラーゼを用いたイメージングの例は少ない。これは蛍光タンパクに比べてルシフェラーゼの哺乳類細胞内での安定性が低く、タンパク質としての寿命が短いため、また、転写効率が低いため、実用に適さなかったためであり、さらに、細胞の画像解析装置は蛍光に対応したものが多く、発光を効率よく計測するシステムでないためである。とりわけ生細胞内におけるホタルルシフェラーゼの発光活性が低いため、発光シグナルを容易に得ることができないためである。
【0010】
ホタルルシフェラーゼのうちイメージングその他に最も多く用いられている酵素がアメリカ産ホタル(Photinus pyralis)ルシフェラーゼであるが、最近、in vitroで半減期が2−25倍程度、熱安定性を向上させた変異体において、細胞内での発光シグナルの向上が見られ、細胞内のイメージングに適したルシフェラーゼであると報告された(非特許文献3)。しかしながら、ホタルルシフェラーゼでは細胞内のpHに連動して発光色を変える欠点があり、発光色の多様性に目を向けたマルチ遺伝子発現のような用途には不向きである(マルチ遺伝子転写活性測定システム:近江谷克裕、中島芳浩;特許文献1)。
【0011】
甲虫由来のルシフェラーゼ遺伝子を導入されたトランスジェニック動物や細胞において発現されたルシフェラーゼは、動物個体内にルシフェリンを投与したり、細胞培養液中にルシフェリンを添加し細胞内に浸透させ、ルシフェラーゼ−ルシフェリン反応を行い、その発光によって検出することが可能である。
【0012】
しかし、多くの場合、細胞内で発現するルシフェラーゼの検出は、界面活性剤を含む試薬で細胞を溶解し、このルシフェラーゼを含む溶解液を発光基質と混合させてルシフェリンの発光を測定することにより行われている。この方法では、前記細胞培養液にルシフェリンを添加して検出する方法に比べ、細胞を溶解し、さらに発光試薬と反応させるため煩雑となる。また、一度細胞を溶解してしまうと、その後の細胞内現象を見ることはできないが、細胞を溶解しない前記方法では必要に応じて培養時間を延長し、細胞内現象を継続して観察できるというメリットがある。そのデメリットにも関わらず、細胞を溶解して検出する方法が現在主流であるのは、ホタルルシフェラーゼレポーターが生細胞内ではルシフェリンと十分に反応せず、シグナルが弱く、感度が低いことが主要な原因のひとつである。この問題は、転写活性の弱いプロモーターの解析、あるいはレポーター遺伝子の一過的導入解析を遺伝子導入効率の低い細胞で実施しようとする場合に顕著となる。また、多検体を同時に測定しようとするとサンプル量が減少し、感度の低い検出系では測定が難しい。そのため、細胞を生かしたまま、効率よく転写活性をモニターできるレポーターアッセイ方法が必要とされていた。
【0013】
外来因子が生体に与える影響を評価することは、薬剤を評価し新薬を開発する上で、或いは化学物質の毒性を評価する上でも大変に重要である。従来、マウスなどの生物個体を用いた計測・評価から、細胞組織・集団を用いた計測・評価が、さらに一つの細胞レベルで細胞間、細胞内の情報変化より外来因子を評価することが行われつつある。よって外来因子を評価する上で、細胞間、細胞内を評価するための分子プローブが重要となっている。蛍光タンパクは細胞内イメージングプローブとして短時間の解析には向いているが、長時間の解析には不向きである。ルシフェラーゼは長時間の解析には向いているが、イメージングツールとしては確立されていない。
【0014】
細胞内、細胞間イメージングツールとしてルシフェラーゼを確立するためには、哺乳類細胞内におけるルシフェラーゼの高い安定性と比較的長いタンパク質の寿命が望まれる。また、各種タグタンパクドメインを融合させたタンパクにおいても高い発光活性を有することが望まれる。従来、哺乳類細胞の転写活性測定に用いられてきたアメリカ産ホタル、日本産ホタルでは、充分な発光量と安定性が見られなかった。特にアメリカ産ホタルルシフェラーゼ、日本産ホタルルシフェラーゼは細胞内のpH環境等で発光スペクトルが変化するため、安定な測定が難しい。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】WO2004/99421
【非特許文献】
【0016】
【非特許文献1】Sala-Newby GB et al.: Imaging bioluminescent indicators shows Ca2+ and ATP permeability thresholds in live cells attacked by complement. Immunology. 1998 Apr;93(4):601-9.
【非特許文献2】Ozawa T et al.: Split luciferase as an optical probe for detecting protein-protein interactions in mammalian cells based on protein splicing.Anal Chem. 2001 Jun 1;73(11):2516-21.
【非特許文献3】BaggettB et al.: Thermostability of firefly luciferases affects efficiency of detection by in vivo bioluminescence. Mol Imaging. 2004 Oct;3(4):324-32.
【発明の概要】
【発明が解決しようとする課題】
【0017】
本発明は、細胞内のpHに非感受性であり、かつ、細胞のダメージがほとんどあるいは全くなく、個々の細胞内についての長時間のイメージングを可能にする遺伝子構築体および形質転換細胞、特に形質転換ヒト細胞を提供することを目的とする。
【0018】
また、本発明は、ルシフェラーゼを分割して融合タンパク質として細胞内に導入し、ルシフェラーゼの各部分と融合した各蛋白質の相互作用をイメージングする方法、イメージング可能な形質転換細胞およびこのような融合タンパクをコードする遺伝子構築体の組合せを提供することを目的とする。
【0019】
さらに本発明は、生細胞を用いた感度の高い転写活性測定方法を提供することを目的とする。さらに詳しくは、転写活性の弱いプロモーターの解析、一過的遺伝子導入において遺伝子導入効率の低い細胞、1条件あたりのサンプル量が少なくプレートフォーマットにおいて有効な生細胞を用いた転写活性測定方法を提供する。
【課題を解決するための手段】
【0020】
本発明者は、上記課題に鑑み検討を重ねた結果、ブラジル産ヒカリコメツキムシ由来ルシフェラーゼが哺乳類細胞内で高い安定性および長寿命特性を有し、特に哺乳類細胞内での発光イメージングを可能にすることを見出した。
【0021】
また、本発明者は、哺乳類細胞などの生細胞において高い活性を示すヒカリコメツキ由来ルシフェラーゼを転写活性測定に適用し、転写活性の弱いプロモーターや遺伝子導入効率の低い細胞において従来のホタルルシフェラーゼを用いたアッセイに比べ感度よく安定した計測が可能であることを見出し、本発明を完成するに到った。
【0022】
本発明は、以下の遺伝子構築体、形質転換細胞、細胞内での異種蛋白質の相互作用を解析する方法、転写活性測定方法を提供するものである。
1. pH非感受性ルシフェラーゼをコードする遺伝子構築体であって、ホタル由来ルシフェラーゼ遺伝子構築体と比較して細胞内の発現活性が高い遺伝子構築体。
2. 前記細胞が哺乳類細胞である、項1に記載の遺伝子構築体。
3. 前記遺伝子構築体が、哺乳類細胞中での翻訳を効率化されたルシフェラーゼ遺伝子からなる項2に記載の遺伝子構築体。
4. 前記遺伝子構築体がヒカリコメツキムシ由来のルシフェラーゼをコードする項1〜3のいずれかに記載の遺伝子構築体。
5. ヒカリコメツキ由来ルシフェラーゼがPyrophorus属、Pyrearinus属由来ルシフェラーゼまたはその変異体からなる群より選択される、項4に記載の遺伝子構築体。
6. ヒカリコメツキ由来ルシフェラーゼをコードする遺伝子が配列番号:2の塩基配列を有する、項4または5に記載の遺伝子構築体。
7. pH非感受性ルシフェラーゼが不安定化されたルシフェラーゼである、項1〜6のいずれかに記載の遺伝子構築体。
8. 遺伝子構築体がpH非感受性ルシフェラーゼまたはその部分配列と少なくとも1つの異種タンパク質またはタグ配列からなる融合タンパク質をコードすることを特徴とする項1〜7のいずれかに記載の遺伝子構築体。
9. 異種タンパク質またはタグ配列がタンパク質不安定化シグナルである、項8に記載の遺伝子構築体。
10. タンパク質不安定化シグナルがPEST配列を有する、項9に記載の遺伝子構築体。
11. PEST配列がマウスオルニチンデカルボキシラーゼの3’末端またはその変異体である、項10に記載の遺伝子構築体。
12. 異種タンパク質またはタグ配列が細胞内局在化シグナルである項8に記載の遺伝子構築体。
13. pH非感受性の前記ルシフェラーゼのN末端部分と少なくとも1つの第一異種タンパク質からなる融合タンパク質をコードする項8に記載の遺伝子構築体。
14. pH非感受性の前記ルシフェラーゼのC末端部分と少なくとも1つの第二異種タンパク質からなる融合タンパク質をコードする項8に記載の遺伝子構築体。
15. 項13の遺伝子構築体と項14の遺伝子構築体との組合せ。
16. 項13および14の融合タンパク質をコードする遺伝子構築体を同一の細胞に導入し、前記融合タンパク質を発現させ、第一異種タンパク質と第二異種タンパク質の相互作用を評価する方法。
17. 項13および14に記載の遺伝子構築体からの発現産物を混合し、第一異種タンパク質と第二異種タンパク質の相互作用を評価する方法。
18. 項1〜14の遺伝子構築体または項15に記載の遺伝子構築体の組合せを用いて形質転換された形質転換細胞。
19. 前記細胞が哺乳類細胞である項18に記載の形質転換細胞。
20. 前記細胞がヒト細胞である、項18または19に記載の形質転換細胞。
21. 配列番号2に記載のヒカリコメツキルシフェラーゼ遺伝子改変体。
22. 細胞内のオルガネラのイメージングのための項18〜20のいずれかに記載の形質転換細胞の使用。
23. 試験対象となる転写制御配列制御下でpH非感受性ルシフェラーゼを発現する試験細胞を所望の条件下で培養し、該発現ルシフェラーゼによる発光を生細胞において測定することを含み、ホタル由来ルシフェラーゼと比較してpH非感受性ルシフェラーゼの細胞内の発現活性が高いことを特徴とする転写活性測定方法。
24. pH非感受性ルシフェラーゼがヒカリコメツキ由来ルシフェラーゼである、項23に記載の方法。
25. pH非感受性ルシフェラーゼがPyrophorus属、Pyrearinus属のヒカリコメツキ由来ルシフェラーゼまたはその変異体からなる群より選択される、項23または24に記載の方法。
26. 転写制御配列制御下のpH非感受性ルシフェラーゼ遺伝子が、配列番号:2に示される塩基配列を有する、項23〜25のいずれかに記載の方法。
27. pH非感受性ルシフェラーゼが不安定化されている、項23〜26のいずれかに記載の方法。
28. 細胞が哺乳類細胞、酵母、大腸菌および植物細胞からなる群より選択される、項23〜27のいずれかに記載の方法。
29. 被験転写制御配列が転写活性が低い配列である、項23〜28のいずれかに記載の方法。
30. 細胞が遺伝子導入効率の低い細胞である、項23〜29のいずれかに記載の方法。
31. 0.01〜10mM D-luciferinを細胞培養液に添加する、項23〜30のいずれかに記載の方法。
32. 96、384または1536ウェルプレートフォーマットで実施する、項23〜31のいずれかに記載の方法。
33. ルシフェラーゼの発現差により化合物の細胞への影響を評価する、項23〜32のいずれかに記載の方法。
【発明の効果】
【0023】
本発明によれば、ルシフェラーゼの細胞内での発現量を大幅に向上させることができ、個々の細胞内での長期間の発光イメージングを行うことが可能になった。ルシフェラーゼを用いる系は、励起光にさらされた短時間の細胞イメージングから光細胞ダメージを考慮しなくて良く、長時間にわたる細胞イメージングが可能になり、各種病態の治療及び新薬開発への利用も可能となる。
【0024】
本発明の方法により、特に、転写活性の弱いプロモーター解析や遺伝子導入効率の低い細胞におけるプロモーター解析において、従来のホタルルシフェラーゼを用いたアッセイに比べ感度よく、安定した計測が可能となった。さらに、本発明の方法によりシグナル強度が向上したことによって、サンプル量が少ないプレートフォーマットによる多検体処理が困難であった試験においてもプレートフォーマットで生細胞解析が可能となり、創薬スクリーニング、化学物質の毒性評価などにおける生細胞分析適用範囲を拡大できる。
【図面の簡単な説明】
【0025】
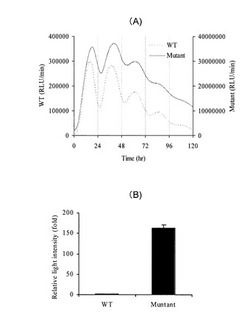
【図1】(A) Real-time monitoring;ヒカリコメツキルシフェラーゼ野性型(PtGR;WT)及び変異型(PtGRm;Mutant)におけるBmalIプロモーター活性を例としたリアルタイム発光活性の測定、(B)Transient assay;ヒカリコメツキルシフェラーゼ野性型(PtGR;WT)及び変異型(PtGRm;Mutant)のBmalIプロモーター転写活性測定の結果例
【図2】(A)アメリカ産ホタルルシフェラーゼ(Firefly) 及び(B)ヒカリコメツキルシフェラーゼ変異型(PtGRm)におけるBmalIプロモーター活性を例としたリアルタイム発光活性の測定、(C)ヒカリコメツキルシフェラーゼ変異型(dPTGRm)及びアメリカ産ホタルルシフェラーゼ(dLuc(+))におけるBmalIプロモーター活性測定の結果例
【図3】ヒカリコメツキルシフェラーゼ変異型(PtGRm-PEST)及びアメリカ産ホタルルシフェラーゼ(Luc(+)-PEST)の細胞内の半減期
【図4】(A)アメリカ産ホタルルシフェラーゼ(Firefly)及び(B)ヒカリコメツキルシフェラーゼ変異型(PtGRm)を発現した哺乳類細胞の発光イメージング
【図5】ヒカリコメツキルシフェラーゼ変異型(PtGRm)に細胞内局在ペプチド配列を挿入した変異体の構造とその発光活性。図5において:核局在化シグナル DPKKKRKVDPKKKRKVDPKKKRKV;小胞体局在化シグナル MGWSCIILFLVATATGAHS---SEKDEL;膜局在化シグナル MLCCMRRTKQVEKNDEDQKI。
【図6】細胞内の各オルガネラにおける発光イメージングと蛍光イメージングの比較を示す。図6において、(A) 発光イメージング; (B) 抗FLAG抗体; (C) GFP; (D) 重ね合せ; (E) ペルオキシソーム; (F) 核; (G) 細胞質; (H) 蛍光イメージング。
【図7】4分間隔で撮影した発光イメージングの結果を示す。
【図8】実施例で用いたAP1応答配列、NFκB応答配列を含むプラスミドの構築フローを示す図である。
【図9】HeLa S3細胞におけるAP1応答エレメントに連結されたルシフェラーゼの各条件での発現を比較したデータを示す図である。(A) 測定値; (B) 誘導比
【図10】Jurkat細胞におけるNFκB応答エレメントに連結されたルシフェラーゼの各条件での発現を比較したデータを示す図である。(A) 測定値; (B) 誘導比
【図11】Jurkat細胞におけるAP1応答エレメントに連結されたルシフェラーゼの各条件での発現を比較したデータを示す図である。(A) 測定値; (B) 誘導比
【図12】発光測定値及びpH8.0における測定値をそれぞれのルシフェラーゼにおいて100として、各pHの相対活性をプロットしたグラフを示す。(A) Signal intensity; (B) PtGRm, Fluc pH依存性
【発明を実施するための形態】
【0026】
本発明の遺伝子構築体は、細胞(特に哺乳類細胞)内で発現した場合に、従来使用されているホタル(Photinus Pyralis)由来ルシフェラーゼ遺伝子構築体と比較して発現効率が向上しており、個々の細胞のイメージングが可能になる(例えば図5参照)。
【0027】
従来のホタルルシフェラーゼを導入した形質転換細胞では、発光シグナルが十分ではなく、非特許文献3に記載されたホタルルシフェラーゼ変異体においても発光シグナルが依然として少なく、発光イメージングには不十分である。
【0028】
一方、本発明の遺伝子構築体を用いて形質転換された細胞は、ホタル(Photinus Pyralis)由来ルシフェラーゼ遺伝子構築体で形質転換された細胞と比較して、2倍以上、好ましくは4倍以上、より好ましくは10倍以上、さらに好ましくは25倍以上、特に100倍以上の発光量を有する。
【0029】
本発明の1つの好ましい実施形態において、本発明の遺伝子構築体は、ルシフェラーゼ遺伝子を導入するためのマルチクローニングサイト、ルシフェラーゼ遺伝子、該遺伝子発現を調節するためのプロモーター及び/又はエンハンサー(転写制御配列)、ポリアデニル化配列、選択可能なマーカー遺伝子、複製起点などを含む発現ベクターであり得る。プロモーター、エンハンサーなどの転写制御配列は、本発明のルシフェラーゼにより転写活性が測定される対象である。
【0030】
本発明の遺伝子構築体でコードされるルシフェラーゼは、pH非感受性、すなわち発光波長がpHに依存して実質的に変化しないものである。このような特性を有するルシフェラーゼであれば特に限定されないが、ヒカリコメツキ由来のルシフェラーゼが本発明の遺伝子構築体により好ましくコードされる。ヒカリコメツキ由来のルシフェラーゼ遺伝子としては、配列番号1の遺伝子が例示される。ヒカリコメツキ由来のルシフェラーゼは、発光波長がpH非感受性だけでなく、細胞(特に哺乳類細胞)内における安定性が他のルシフェラーゼと比較して有意に高く(すなわち細胞内の分解が遅く)、この点でも好ましい。
【0031】
ホタルルシフェラーゼはpHに依存して発光波長が変化するため、pHが常に変化している細胞内環境での正確なイメージングが困難である。
【0032】
さらに、ヒカリコメツキ由来ルシフェラーゼ、ホタルルシフェラーゼはいずれもpH8に最大発光域が存在するが、細胞質はpH7.2と至適pHに比べやや低い。従来から一般に行われている細胞内で発現したホタルルシフェラーゼの検出は、細胞を溶解しpH8付近の緩衝液中で反応を行うのに対し、生細胞内ではpHが低いため反応効率が悪い。一方、ヒカリコメツキ由来のルシフェラーゼはホタルルシフェラーゼに比べ低pH側でも高い反応効率を保持しており、生細胞のアッセイに適している。本発明のヒカリコメツキ由来のルシフェラーゼは、細胞内のpHが6.5以上であれば十分な測定が可能であり、好ましい細胞内pHは7以上、より好ましくは7.0〜8.5、特に7.4〜8.0である。
【0033】
ヒカリコメツキ由来ルシフェラーゼは細胞内における安定性が高いという点は、発現活性の低い転写制御配列の解析、細胞内における局在解析、ルシフェラーゼを局在させたオルガネラのモニタリング、ルシフェラーゼに融合した異種タンパク質の機能や存在量の解析などに有効である。しかしながら、この安定性は転写活性の増減をモニターするような解析においては変動をモニターしづらくする場合がある。この場合、細胞内における分解を促進させることが好ましいが、細胞内寿命を短縮化したヒカリコメツキ由来ルシフェラーゼは低pHでもホタルルシフェラーゼよりも高い発光反応の効率は保持されており、短寿命かつ高シグナル強度のルシフェラーゼとして有用である。一方で、概して、多くの組織や細胞において一定量発現し、細胞の維持・増殖に関わるハウスキーピング遺伝子のような遺伝子群は細胞内転写産物量が高いのに対し、細胞の機能調節を担うような遺伝子の多くは発現が低い場合が多い。このような低発現量の遺伝子の一つであるサイトカインのうち、IL6などは炎症を伴う多くの腫瘍で発現が亢進しており、ガンの進展に関与している可能性が示唆されており、多発性骨髄腫や形質細胞白血病などでは抗IL6抗体の優れた治療効果が報告されている。あるいは、サイトカイン・ケモカインであるIL−8、ICAM-1のなど気道上皮細胞における発現量は、非喫煙者・健常喫煙者・慢性閉塞性肺疾患の順に亢進する。このような遺伝子の発現制御領域を用いて、これら疾患に関連した亢進作用を抑制するような化合物をスクリーニングすることは疾患のメカニズムの解明・ドラッグディスカバリーの面で非常に有用である。より検出能の高いルシフェラーゼを用いることで、従来のホタルルシフェラーゼでは転写効率が低く、十分に検出ないし定量を行えなかった遺伝子の転写制御配列に関する細胞アッセイを行うことが可能である。ここで言及される転写制御配列としては、転写開始に必要なプロモーターと言われる配列領域に加え、さらにエンハンサーやサイレンサーと呼ばれる転写の促進または抑制に関わる配列領域を含む。エンハンサーやサイレンサーの調節を解析するためのひとつの手段としては、例えば、被験配列の当該部位と考えられる部位の塩基配列を遺伝子工学的に他の塩基配列に置換したり、当該領域を除去することによって、その遺伝子発現の調節が維持されるかを評価する。あるいは一定発現することが知られるプロモーター配列に、エンハンサーあるいはサイレンサーと考えられる配列を連結し、ルシフェラーゼの発現促進あるいは抑制が認められるかを評価する方法もある。
【0034】
本発明で使用するルシフェラーゼ遺伝子は、天然のルシフェラーゼ遺伝子自体を使用してもよいが、遺伝子構築体が導入される細胞における翻訳を効率化するために遺伝子配列を改変するのが好ましい。具体的には、a) 余分な転写因子が結合しないように、cDNAの配列を変えること、b)cDNAの配列を、昆虫のコドンユーセージ(コドンの使用頻度の偏り)を所望の細胞用(例えば哺乳類用)に変え、さらにc)使用上、制限酵素部位が多いことで応用が限定されることからそのcDNAを変えることなどが挙げられ、これらを適宜組み合わせて翻訳効率を向上させることで、ルシフェラーゼの発現量を増大し、発光イメージングが容易に行える程度にまで発光量を高めることができる。例えば、配列番号2のヒカリコメツキルシフェラーゼ遺伝子改変体は、改変前の配列番号1の遺伝子と比較して150倍程度の発光量を有する。配列番号1の開始コドン、2番目のコドンとメチオニンが連続しているのに対し、配列番号2ではメチオニンを一つ削除しているが十分な発光の増強が認められたことから、このメチオニンは1つでも2つでもいずれであってもよい。本発明のpH非感受性ルシフェラーゼをコードする遺伝子には、配列番号2のDNAとストリンジェントな条件下にハイブリダイズし、かつPhotinus Pyralis由来ルシフェラーゼ遺伝子よりも細胞(特に哺乳類細胞)内の発現活性が高い変異型遺伝子も包含される。
【0035】
本発明で使用される、Photinus Pyralis由来ルシフェラーゼ遺伝子と比較して哺乳類細胞内の発現活性が高い遺伝子としては、ヒカリコメツキ由来ブラジル産Pyrearinus属(例えばPyrearinus termitilluminans)のルシフェラーゼが特に好ましい。また、ブラジル産Pyrophorus属(例えばPyrophorus punctatissimus)ルシフェラーゼなども好ましい。
【0036】
特に、Pyrearinus termitilluminans由来のルシフェラーゼはpHによる発光スペクトルの変動がなく、最大発光波長538 nmを有し、ルシフェラーゼによる発光検出の際に一般に用いられる光電子増倍管(PMT) やcharged-coupled device (CCD)カメラの量子効率の最大域と一致するため、感度よく検出することが可能である。
【0037】
なお、本発明で使用されるルシフェラーゼは、天然に存在するルシフェラーゼだけでなく、1又は2以上のアミノ酸を置換、付加、欠失又は挿入し、かつ、Photinus Pyralis由来ルシフェラーゼ遺伝子よりも細胞(特に哺乳類細胞)内の発現活性が高い変異型ルシフェラーゼを包含する。また、N末端またはC末端に第2のタンパク質が結合した融合タンパク質であってもよい。
【0038】
「ストリンジェントな条件」とは,特異的なハイブリダイゼーションのみが起き,非特異的なハイブリダイゼーションが起きないような条件をいう。このような条件は,通常,「1xSSC,0.1%SDS,37℃」程度であり,好ましくは「0.5xSSC,0.1%SDS,42℃」程度であり,更に好ましくは「0.2xSSC,0.1%SDS,65℃」程度である。ハイブリダイゼーションによって得られるDNAは配列番号2記載の塩基配列により表わされるDNAと通常高い相同性を有する。高い相同性とは,80%以上の相同性,好ましくは85%以上の相同性,更に好ましくは90%以上、特に95%以上、あるいは98%以上の相同性を指す。
【0039】
本発明において、哺乳類としては、ヒト、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌが挙げられ、好ましくはヒトである。
【0040】
pH非感受性とは、細胞(特に哺乳類細胞)内でpHが変化しても、ルシフェラーゼの最大発光波長の変動が3nm以下、好ましくは2nm以下、さらに好ましくは1nm以下、特に好ましくは0.5nm以下であることを意味する。最大発光波長の変化量がこの範囲内であれば、複数の発光タンパク質の発現量をフィルター等で分離して定量する場合、相互の発光タンパク質の比率がほとんど変化しないため好ましい。
【0041】
本発明の遺伝子構築体で細胞(例えば哺乳類細胞)を形質転換した場合、該形質転換細胞は十分に高い発光量を得ることができる。異種タンパクないしタグを結合させると発光量が低下するため、何も結合させない場合であっても発光量が不十分である従来の遺伝子構築体では異種タンパクないしタグを結合させることは困難であった。一方、本発明では異種タンパクないしタグを結合させるルシフェラーゼによる発光量が非常に高いため、異種タンパクないしタグを結合させた状態で個々の細胞のイメージングを行うことができる。
【0042】
本発明のルシフェラーゼと融合される異種タンパクとしては、任意の異種タンパクが挙げられ、タグとしてはPEST 配列又はユビキチン又はこれらの生物学的に活性な断片又はこれらの変異体若しくは誘導体をコードするヌクレオチド配列によりコードされる蛋白質不安定化シグナル、さらに核局在化シグナル、膜局在化シグナル、細胞質局在化シグナル、ミトコンドリア局在化シグナル、ER局在化シグナルなどの細胞内局在化シグナルが挙げられる。
【0043】
ルシフェラーゼの不安定化は、ルシフェラーゼ蛋白質を不安定化するPEST配列等を使用してもよく、ポリAシグナルを欠如させたり、c-fos、c-jun 、c-myc 、GM-CSF、 IL-3 、TNF-α、IL-2、IL-6、IL-8、IL-10、ウロキナーゼ、bcl-2、Cox-2、PAI-2等の種々の遺伝子由来の配列をルシフェラーゼ遺伝子に連結してルシフェラーゼのmRNAを不安定化してもよい。
【0044】
ルシフェラーゼ蛋白質又はそのmRNAを不安定化することで、ある刺激に対するルシフェラーゼの発現量の変化をより正確に(タイムラグなく)観察することができる。これは、哺乳類細胞中での発現効率がホタルよりも高い本発明の遺伝子構築体により初めて実現されるものである。
【0045】
タグとして使用されるPEST配列は、オルニチンデカルボキシラーゼの3‘末端又はその変異体が好ましく、オルニチンデカルボキシラーゼの3‘末端又はその変異体は哺乳類由来のものが好ましく、一般的によく使用されるのはマウス由来のものである(配列番号7, 8)。なお、PESTは、プロリン(P)、グルタミン酸(E)、セリン(S)及びスレオニン(T)の豊富なアミノ酸配列を指し、PEST 配列を含むタンパク質は半減期が短いことが知られている。
【0046】
本発明の1つの実施形態では、ルシフェラーゼスプリットアッセイであって、ルシフェラーゼを例えばN末端部分とC末端部分の2つに分け、各々をコードするDNAを異種タンパクと連結し、これらの遺伝子構築体を1つの細胞で共発現させる。ここで、ルシフェラーゼのN末端部分とルシフェラーゼのC末端部分は別々に発現されるが、これらが近接した位置に来ると、発光するように設計することができる。
【0047】
第1遺伝子構築体:(ルシフェラーゼのN末端部分)−(第1異種タンパク)
第2遺伝子構築体:(第2異種タンパク) −(ルシフェラーゼのC末端部分)
これらの遺伝子構築体を1つの細胞内で共発現させると、2つの異種タンパクの相互作用によりN末端・C末端が近接位にあることを発光シグナルにより確認することが可能になる。
【0048】
ルシフェラーゼスプリットアッセイについては、前記記載の非特許文献2に報告されるようにホタルルシフェラーゼを用いて成功した例はあるが、ヒカリコメツキルシフェラーゼは、ホタルルシフェラーゼに比べ発現活性が高く、かつpH非感受性であるため、より好適なプローブとして使用できる。
【0049】
例えば、ヒカリコメツキルシフェラーゼにおいて、N末端部分とC末端部分は以下のように設計できる。ヒカリコメツキルシフェラーゼの構造は明らかにされていないが、ヒカリコメツキルシフェラーゼと同じ甲虫ルシフェラーゼであるホタルルシフェラーゼは活性中心を挟んで、β−バレルと2つのβ−シートからなる大きなN末端部分とC−末端部分との2つのドメインからなることが知られている(Conti, E. et al.; Crystal structure of firefly luciferase throws light on a superfamily of adenylate-forming enzymes. Structure. 1996 March;4(3):287-98)。ホタルルシフェラーゼのスプリットアッセイではこれらの2つの部位を連結する柔軟な部位で分割することが知られており、その一つの例がホタルルシフェラーゼの437アミノ酸と438アミノ酸の間で分割し、N末端部分、C末端部分とするものである(非特許文献2)。ヒカリコメツキルシフェラーゼとホタルルシフェラーゼのホモロジー検索により、N末端部分とC末端部分の連結付近は比較的高いホモロジーがあり、ヒカリコメツキルシフェラーゼのN末端部分とC末端部分の連結部分はアミノ酸配列で432位から436位と推定され、この領域で分割されることが好ましい。特に好ましくは433位と434位の間で分割するもので、遺伝子構築体としては配列番号2の1299位までをルシフェラーゼのN末端部分、配列番号2の1300位以後をC末端部分として用いた構築体である。
【0050】
また、2つの蛋白質の相互作用を検出する対象となる第1異種タンパクと第2異種タンパクの組み合わせとしては、以下のものが挙げられる。
【0051】
【表1】

【0052】
本発明において、前記ルシフェラーゼ遺伝子上流に転写活性(プロモーター活性)を有するか、有する可能性のある被験配列を連結した遺伝子構築体を細胞へ導入するか、相同性組換えなどによって、ある遺伝子転写制御配列下に前記ルシフェラーゼ遺伝子が組み込まれた細胞を用いて、被験制御配列の転写制御下で発現されるルシフェラーゼを指標に、前記配列の転写制御をモニターする。例えば哺乳類細胞において転写活性を測定するために、ルシフェラーゼ遺伝子が安定発現可能になるように、開始コドンの上流には翻訳を効率化するためのKozak配列を、ルシフェラーゼ遺伝子下流にはポリアデニル化シグナルを配置することができる。さらに好ましくは、ルシフェラーゼ遺伝子の上流に配置される被験転写制御配列上流に転写終結シグナルを配置することによって、被験配列以外の配列による発現への影響をできるだけ排除することが好ましい。
【0053】
さらに、転写活性のダイナミックな増減変動を解析するためには、ルシフェラーゼの細胞内寿命があまりに長いと基底状態のシグナルが高くなり、転写の活性化がモニターしづらい。このような場合、ルシフェラーゼの細胞内寿命を短縮化することによって、より明瞭な転写活性の変動解析を行うことが可能になる。ルシフェラーゼを短寿命化する方法としては、タンパク質分解促進シグナル配列、例えばユビキチン化シグナル配列やPEST配列などの蛋白質不安定化シグナル配列をルシフェラーゼに融合する方法が挙げられる。
【0054】
前記ルシフェラーゼ遺伝子上流に転写活性(プロモーター活性)を有するか、有する可能性のある被験配列を連結した遺伝子構築体を細胞へ導入する方法としては、リン酸カルシウム法、DEAE-デキストラン法、カチオニックリポソーム法などの化学的手法、アデノウイルスベクター、ワクシニアウイルスベクターやレトロウイルスベクター、HVJリポソームなどの生物学的手法、エレクトロポレーション、DNA直接注射、遺伝子銃などの物理的手法など、いずれの方法であってもよい。化学的手法やエレクトロポレーション法が一般に手軽で用いられるが、遺伝子導入効率は細胞によって大きく変わる。本発明は、遺伝子導入効率の高い細胞は勿論であるが、遺伝子導入効率の低い細胞を用いての生細胞転写活性測定試験に好ましく適用される。遺伝子導入効率の低い細胞での一過的な遺伝子導入による転写活性測定試験では、従来のホタルルシフェラーゼを用いた場合、シグナル強度が低く、生細胞での解析を十分に行えない。本発明における一過的な遺伝子導入とは、対象となる細胞にルシフェラーゼ遺伝子構築物、例えばプラスミド状のもの、を前記方法で遺伝子導入し、導入された細胞・導入されなかった細胞を分離する(安定的に染色体に組み込まれた細胞を選択する)工程を実施することなく、細胞試験に用いることを指す。また、遺伝子導入効率の低い細胞としては、浮遊細胞や正常細胞、初代細胞が挙げられる。特に、ヒト初代細胞は、ドラッグディスカバリーのプロセスにおいてさまざまな治療分野におけるin vitroシステムとして用いられ、生物学的に生物個体に非常に近い細胞アッセイモデルとして、かつオートメーションやハイスループット解析になじみ易いスクリーニングツールとして重要視されている。ヒト初代細胞の例としては、ヒト皮膚微小内管内皮細胞(HMVEC)、ヒト表皮角化細胞(HEK)、ヒト表皮メラニン細胞(HEM)、ヒト皮膚繊維芽細胞(HDF)、ヒト骨格筋細胞(HSkMC)、ヒト臍帯静脈内皮細胞(HUVEC)、ヒト臍帯動脈内皮細胞(HUAEC)、ヒト胎盤上皮細胞(HPIEpC)、ヒト臍帯静脈平滑筋細胞(HUVSMC)、ヒト臍帯動脈平滑筋細胞(HUASMC)、ヒト冠動脈内皮細胞(HCAEC)、ヒト肺動脈内皮細胞(HPAEC)、ヒト大動脈内皮細胞(HAOEC),ヒト心繊維芽細胞(HCF)、ヒト内胸動脈内皮細胞(HITAEC)、ヒト鎖骨化動脈内皮細胞(HScAEC)、ヒト冠動脈平滑筋細胞(HCASMC)、ヒト肺動脈平滑筋細胞(HPASMC)、ヒト大動脈平滑筋細胞(HAOSMC)、ヒト内胸動脈平滑筋細胞(HITASMC)、ヒト鎖骨化動脈平滑筋細胞(HScASMC)、ヒト軟骨細胞(HC)、ヒト骨芽細胞(HOb)、ヒト滑膜細胞(HFLS、HFLS−OA、HFLS−RA)、ヒト気管支上皮細胞(HBEpC)、ヒト胚繊維芽細胞(HLF)、ヒト頭髪毛乳頭細胞(HFDPC)、ヒト前駆脂肪細胞(HPA)、ヒト乳腺上皮細胞(HMEpC)などが挙げられるが、これに限られるものではない。
【0055】
本発明は、さらに1条件あたりのサンプルが少ないプレートフォーマットの解析への生細胞転写活性測定試験に好ましく適用される。ドラッグディスカバリー、化合物の毒性評価のために、多種の化合物を広範な濃度で細胞に暴露し、細胞への作用を評価する必要がある。そのため、少量検体をプレートフォーマットで測定できることが必要である。少量検体ではサンプルから発せられる総発光量が少なくなる一方、同時に多検体を測定するため、1検体あたりの読取り時間が短縮化される。しかしながら、本発明のプレートフォーマットの測定においては、従来の方法に比べシグナル強度が高いため、高感度・高精度な解析を行うことが可能である。さらに、本発明の方法は生細胞にルシフェリンを添加(投与)するだけであるため、蛍光検出における励起光照射のような細胞へのダメージの大きなステップがないため、適宜培養時間を延長し、細胞への作用を長時間にわたってトレースすることが可能である。
【実施例】
【0056】
以下、本発明を実施例に基づきより詳細に説明する。
【0057】
実施例1
野生型(配列番号1)および改良型(配列番号2)ヒカリコメツキルシフェラーゼcDNAと、マウスオルニチンデカルボキシラーゼのPEST配列(配列番号7)を連結した短寿命型ルシフェラーゼを作製した。これらを時計遺伝子マウスBmal1プロモーター(GenBank Accession No. AB064982)下流に挿入したベクターを作製した。続いて各ベクター1μgを、35mm培養ディッシュに播種した培養繊維芽細胞NIH3T3にリポフェクション法(リポフェクトアミンプラス、インビトロジェン社)により導入し、24時間37℃で培養後、100 nMのデキサメタゾンを含むDMEM培地で2時間処理した。更に200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換後、遺伝子発現連続測定装置(アトー(株)社AB2500)にて、1分間の発光を15分間隔で5日間発光量をリアルタイムに測定した(図1(a))。野生型および改良型ルシフェラーゼともに、Bmal1プロモーターに依存した約24時間周期の変動をモニター可能であるが、改良型ルシフェラーゼの発光強度は野生型のそれよりも約100倍高いことが明らかとなった。
【0058】
前述のレポーターベクター200 ngを、24ウェルプレートに播種した培養繊維芽細胞NIH3T3にリポフェクション法により導入し、37℃で24時間培養後、300μLの細胞溶解剤(ピッカジーン デュアルシーパンジー用培養細胞溶解剤、東洋インキ)で細胞を破砕した。細胞抽出液50μLに発光基質液50μL(ピッカジーン発光試薬II)を加え、ルミノメーター(アトー(株)社 AB2250)で20秒間発光を測定した(図1(b))。改良型ルシフェラーゼの発光強度は野生型のそれよりも約150倍程度高いことが明らかとなった。
【0059】
実施例2
米国産Photinus pyralisホタルルシフェラーゼcDNA(Luc(+)、プロメガ社製)および改良型ヒカリコメツキルシフェラーゼcDNA(配列番号2)に、マウスオルニチンデカルボキシラーゼのPEST配列(配列番号7)を連結した短寿命型ルシフェラーゼを作製した。これらを時計遺伝子マウスBmal1プロモーター(GenBank Accession No. AB064982)下流に挿入したベクターを作製した。続いて各ベクター1μgを、35mm培養ディッシュに播種した培養繊維芽細胞rat1にリポフェクション法(リポフェクトアミンプラス)により導入し、24時間37℃で培養後、100 nMのデキサメタゾンを含むDMEM培地で2時間処理した。更に200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換後、遺伝子発現連続測定装置(アトー(株)社AB2500)にて、1分間の発光を15分間隔で5日間測定した(図2)。米国産Photinus pyralisホタルルシフェラーゼ(図2(a))と改良型ヒカリコメツキルシフェラーゼ(図2(b))を比較すると、発光の変動パターンは同じであり、改良型ヒカリコメツキルシフェラーゼがリアルタイム解析に用いられてきたアメリカ産ルシフェラーゼと同等の能力を持つ、一方、24時間以内の発光量を積算した結果(図2(c))、発光量が15倍以上高いことが明らかになった。
【0060】
実施例3
前述の短寿命型ホタルルシフェラーゼcDNAおよび短寿命・改良型ヒカリコメツキルシフェラーゼcDNAを、SV40プロモーターの下流に挿入した発現ベクターを作製した。200 ngの発現ベクターを、24ウェルプレートに播種した培養繊維芽細胞NIH3T3にリポフェクション法により導入し、37℃で48時間培養した。続いて100μMの蛋白質合成阻害剤シクロヘキシミドを含む培養液に置換し、30分間培養後、1時間毎に細胞内の発光活性を測定した。発光活性の測定は、実施例1と同様の方法で行った(図3)。短寿命化米国産Photinus pyralisホタルルシフェラーゼでは、半減期が1時間であったが、短寿命型改良型ヒカリコメツキルシフェラーゼでは半減期が4時間と4倍長寿命化された。
【0061】
実施例4
米国産Photinus pyralisホタルルシフェラーゼcDNA(Luc(+)、プロメガ社製)および改良型ヒカリコメツキルシフェラーゼcDNA(配列番号2)のN末端にFLAGタグ配列(MDYDDDDK;配列番号15)を連結、これらをCMVプロモーターの下流に挿入した発現ベクター2μgを培養繊維芽細胞NIH3T3にリポフェクション法により導入し、37℃で24時間培養した。その後、200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換し、−60℃に冷却したCCDカメラ(アトー(株)社セルグラフ)で3分間発光を測定した。米国産Photinus pyralisホタルルシフェラーゼ(図4(a))およびヒカリコメツキルシフェラーゼ(図4(b))を比較すると、ヒカリコメツキルシフェラーゼを生産する哺乳類細胞が明らか強いシグナルを発することがわかる。細胞を拡大すると核では発光は見られず、PEST配列によって細胞内の細胞質内にルシフェラーゼが局在し発光することがわかる。
【0062】
実施例5
CMVプロモーター下流に挿入された改良型ヒカリコメツキルシフェラーゼcDNA(配列番号2)は哺乳類細胞のペルオキシゾームに局在することを確認した。このC末端のアミノ酸配列SKLを除去したものを細胞質局在化改良型ヒカリコメツキルシフェラーゼとし、次に細胞質局在化改良型ヒカリコメツキルシフェラーゼのC末端に核局在化シグナルDPKKKRKVDPKKKRKVDPKKKRKV(配列番号3)を配したものを核局在化改良型ヒカリコメツキルシフェラーゼとした。また、細胞質局在化改良型ヒカリコメツキルシフェラーゼのN末端MGWSCIILFLVATATGAHS(小胞体局在化シグナル、Vh chain targeting signal;配列番号4)をC末端にSEKDEL(小胞体保留シグナル;配列番号6)を配したものを小胞体局在化改良型ヒカリコメツキルシフェラーゼとした。さらに細胞質局在化改良型ヒカリコメツキルシフェラーゼのN末端にMLCCMRRTKQVEKNDEDQKI(膜局在化シグナル, Neuromodulin N-terminus;配列番号5)を配したものを膜局在化改良型ヒカリコメツキルシフェラーゼとした。
【0063】
オルガネラ局在シグナルを融合したヒカリコメツキcDNAは全てCMVプロモーターの下流に挿入、この発現ベクター0.2μgを培養繊維芽細胞NIH3T3にリポフェクトアミンプラスにより導入した。37℃で24時間培養後、300μLのPBSで細胞を破砕し、細胞抽出液50μLに発光基質液50μL(ピッカジーン発光試薬II)を加え、実施例1と同様の方法で発光活性を測定した。局在化シグナルによって発光活性は変化したが、全て配列番号2の改良型ヒカリコメツキルシフェラーゼに対しておよそ20%以上の発光活性を有しており、細胞内の各所に局在しながらも発光活性を有することがわかる(図5)。
【0064】
実施例6
実施例5で作製したペルオキシソーム局在化、核局在化および細胞質局在化改良型ヒカリコメツキルシフェラーゼcDNAのN末端にFLAGタグ配列(MDYDDDDK;配列番号15)を融合し、各々をCMVプロモーターの下流に挿入した発現ベクターpCMV-FLAG-PtGRm-POX(ペルオキシソーム局在化)、pCMV-FLAG-PtGRm-Nuc(核局在化)およびpCMV-FLAG-PtGRm-Cyto(細胞質局在化)を作製した。一方、EGFP(Clontech社)cDNAのC末端にSKL配列を融合し、これをCMVプロモーターの下流に挿入した発現ベクターpCMV-EGFP-POX(ペルオキシソーム局在化EGFP)を作製した。続いて35mm培養ディッシュに播種した培養繊維芽細胞NIH3T3に、pCMV-FLAG-PtGRm-POX 2μgとpCMV-EGFP-POX 0.2μg、pCMV-FLAG-PtGRm-Nuc 2μgとpAcGFP-Nuc(核局在化GFP、Clontech社)0.2μg、pCMV-FLAG-PtGRm-Cyto 2μgの組合わせで各発現ベクターをリポフェクション法(リポフェクトアミンプラス、Invitrogen社)により導入し、37℃で24時間培養した。発光イメージングは、200μMのD-ルシフェリンと10%牛血清を含むDMEM培地に交換後、冷却CCDカメラを搭載した発光イメージング装置(アトー(株)社 セルグラフ)を用い、40倍の対物レンズにて3分間発光を撮影した。改良型ヒカリコメツキルシフェラーゼの細胞内局在は、抗FLAG抗体(Sigma社)を用いた免疫染色により、またコトランスフェクションしたGFPの細胞内局在はGFP蛍光を共焦点顕微鏡(BioRad社)により観察した(図6)。抗FLAG抗体を用いた免疫染色あるいは局在化GFPによる蛍光イメージングにより、ペルオキシソーム局在化、核局在化および細胞質局在化改良型ヒカリコメツキルシフェラーゼがそれぞれのオルガネラに局在化することが確認された。一方、高倍率の対物レンズを用いた発光イメージングにより、3分間の露光で各オルガネラから発する顕著な発光シグナルが得られ、細胞内の各所での局在のイメージングが可能であることが明らかとなった。
【0065】
実施例7
細胞質局在化改良型ヒカリコメツキルシフェラーゼcDNAのN末端にマウスimportin a1 cDNA(GenBank No.D55720)を融合し、これをCMVプロモーターの下流に挿入した発現ベクターを作製した。続いてベクター2μgを、35mm培養ディッシュに播種した培養繊維芽細胞NIH3T3にリポフェクション法(リポフェクトアミンプラス)により導入し、37℃で3時間培養後、200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換した。発光イメージングは発光イメージング装置(アトー(株)社 セルグラフ)を用い、40倍の対物レンズにて3分間露光、4分間隔で撮影した(図7)。発光イメージングにより、importin a1が約30分間隔で核内と細胞質の輸送を繰り返すことが確認され、タンパク質の細胞内局在の変化を連続してイメージング可能なことがわかる。
【0066】
実施例8 AP1応答配列、NFκB応答配列を含むプラスミドの構築
pSLG-HSVtk control(東洋紡績)を鋳型として、オリゴヌクレオチド1、2(シグマ アルドリッチ ジャパン社)(配列番号9、10)、PCR酵素KOD -plus-(東洋紡績)を用いて、Herpes simplex virus thymidine kinase (HSVtk) 由来のプロモーター配列を増幅した。オリゴヌクレオチドの5’末端には、制限酵素Spe I、EcoR Vの認識配列が付加されている。 このPCR産物、pELuc-test(東洋紡績、配列番号2のPtGRm遺伝子搭載ベクター)をそれぞれ制限酵素Spe I、EcoR V(東洋紡績)で分解し、Ligation high(東洋紡績)を用いてライゲーション反応を行い、HSVtkプロモーターをpELuc-testのPtGRm遺伝子上流に挿入した(pPtGRm-HSVtk)。続いて、オリゴヌクレオチド3(シグマ アルドリッチ ジャパン社)(配列番号11)とそれに相補的なオリゴヌクレオチド4(シグマ アルドリッチ ジャパン社)(配列番号12)、オリゴヌクレオチド5(シグマ アルドリッチ ジャパン社)(配列番号13)とそれに相補的なオリゴヌクレオチド6(シグマ アルドリッチ ジャパン社)(配列番号14)をそれぞれアニーリングし、NFκB応答配列カセット、AP1応答配列カセットを作成した。
【0067】
それぞれのカセットは、一方に制限酵素Xho I、他方に制限酵素Bgl IIの切断面と相補鎖を形成するように構築されている。pPtGRm-HSVtkを制限酵素Xho I、Bgl II(東洋紡績)で分解し、HSVtkプロモーターの上流に前記カセットをそれぞれ挿入した(NFκB-PtGRm、AP1-PtGRm;図8)。つづいて、NFκB-PtGRm、AP1-PtGRmを制限酵素Xho I、Nco I(東洋紡績)で分解して、NFκB応答配列+HSVtkプロモーター+Kozak配列、AP1応答配列+HSVtkプロモーター+Kozak配列領域を切り出し、一方でpGL3-Basic(プロメガ社、ホタルルシフェラーゼLuc(+)搭載ベクター) を制限酵素Xho I、Nco Iで処理して、ホタルルシフェラーゼ遺伝子上流にNFκB応答配列+HSVtkプロモーター+Kozak配列、AP1応答配列+HSVtkプロモーター+Kozak配列を挿入した(NFκB-Luc(+)、pGL3-AP1-Luc(+))。
【0068】
前記AP1は、アクチベータータンパク質複合体(activator protein complex-1)の略でc-Junとc-Fosなどから構成される一連の転写因子複合体で、例えば、ホルボールエステル(TPA)によって誘導される多くの遺伝子(コラゲナーゼ、メタロチオネインIIA、ストロメライシンなど)のプロモーター領域に保存されたAP1応答配列モチーフ(TGACTCA)に結合して遺伝子の発現を促進することが知られている。NFκBは、TNFαや炎症性刺激に関係する転写因子として知られている。
【0069】
実施例9 HeLa S3細胞におけるAP1応答配列の解析
HeLa S3細胞を96ウェル白色不透明プレートに1ウェル当たり3×104cells (100μl)ずつ播種し、10% FCSを含むダルベッコ変法イーグル培地DMEM(日水製薬)中で培養した。翌日、プラスミドpEluc-AP1、pGL3-AP1をそれぞれ1ウェル当たり0.2μg(DMEM(FCS無添加)25μlで希釈)をLipofectamine 2000 transfection reagent(インビトロジェン社)0.5μl(DMEM 25μlで希釈)と混合し、DMEM+0.1% FCS 100μlで置換された細胞に添加し、24時間インキュベートすることによって遺伝子導入を行った。翌日、未添加、0.01μM TPA(Sigma)、0.1μM TPA、1μM TPAまたは10 ng/ml EGFを含むDMEM+0.1% FCS(さらに0.2mM D-luciferinを含む)に置換し、5時間インキュベートした。その後、プレートリーダー1420 ARVOMX(パーキンエルマー)を用いて、発光を測定した。結果を図9に示す。測定値グラフは読取り値を、誘導比グラフは読取り値をもとに、各コンストラクトについて無添加条件を1として各種濃度の薬剤添加条件の発現誘導比をプロットしている。本発明のルシフェラーゼにおいても各刺激に対し従来のルシフェラーゼと同様の変動が認められる一方で、およそ15倍の発光強度が認められた。
【0070】
実施例10 Jurkat細胞におけるNFκB応答配列の解析
Jurkat細胞を1×106cells (4 ml)になるように、0.1% FCSを含むRPMI1640培地(日水製薬)に懸濁し、1 mlずつに24ウェルプレートの4ウェルに分注した。プラスミドpEluc-NFκB、pGL3-NFκB、pEluc-AP1、pGL3-AP1をそれぞれ2μg(RPMI1640(FCS無添加)200μlで希釈)をLA2000(RPMI 1640(FCS無添加)200μlで希釈)と混合し、Jurkat細胞と混合し、24時間インキュベートすることによって遺伝子導入を行った。翌日、遺伝子導入されたJurkat細胞を50μlずつ白色透明プレートに分注した。つづいて、pEluc-NFκBまたはpGL3-NFκB、pEluc-AP1またはpGL3-AP1を導入されたJurkat細胞には、添加物なし、または種々濃度のTNFα(PEPROTECH)を含むRPMI+0.1% FCS(さらに0.4mM D-luciferinを含む)50μlを添加し、5時間インキュベートした。TNFαは最終濃度で0.01ng/ml、0.1ng/ml、1ng/ml、10ng/mlとなるように添加している。その後、プレートリーダー1420 ARVOMX(パーキンエルマー)を用いて、発光を測定した。
【0071】
NFκB応答配列を含むコンストラクトを用いてTNFα刺激に対する変動を調べた結果を図10に示す。測定値グラフは読取り値を、誘導比グラフは読取り値をもとに、各コンストラクトについて無添加条件を1として各種濃度の薬剤添加条件の発現誘導比をプロットしている。本発明のヒカリコメツキムシルシフェラーゼを用いた転写活性測定法においても各刺激に対し従来のルシフェラーゼを用いた転写活性測定法と同等以上の変動が認められる一方で、およそ30〜60倍の発光強度が認められた。
【0072】
AP1応答配列を含むコンストラクトを用いてTNFα刺激に対する変動を調べた結果を図11に示す。測定値グラフは読取り値を、誘導比グラフは読取り値をもとに、各コンストラクトについて無添加条件を1として各種濃度の薬剤添加条件の発現誘導比をプロットしている。本発明のヒカリコメツキムシルシフェラーゼを用いた転写活性測定法においてはホタルルシフェラーゼ測定法に比べ、およそ20〜30倍のシグナル強度が認められた。本発明の方法においても各刺激に対し従来のルシフェラーゼと同様、有意な変動が認められなかった一方で、ホタルルシフェラーゼ法ではバラツキの幅が大きく、遺伝子導入効率が低く、転写活性の低い被験配列の解析ではより精度の高い解析が可能であることが確認された。
【0073】
実施例11 ヒカリコメツキ由来ルシフェラーゼ
ヒカリコメツキ由来ルシフェラーゼ酵素標品は、ベクターpELuc-test(東洋紡)のルシフェラーゼ遺伝子PtGRmを大腸菌発現用ベクターに挿入し大腸菌で発現させ、組換え体として取得した。ホタルルシフェラーゼ酵素標品は、QuantiLum Recombinat Luciferase(Promega社、図中はfLucと記載)を用いた。それぞれの酵素標品について、15mM MgSO4、6mM EDTA、4mM CoenzymeA、1.2mM D-luciferin,6mM DTT、0.2% Nonidet P40、2mM ATP及び2μg/ml酵素標品の発光試薬を調製した。0.02mM, 0.2mM, 1mM ATP溶液100μlと100mM Hepes-NaOH pH6.6〜8.8 100μlを混合し発光を計測した。
【0074】
図12に発光測定値及びpH8.0における測定値をそれぞれのルシフェラーゼにおいて100として、各pHの相対活性をプロットしたグラフを示す。この結果、ヒカリコメツキ由来ルシフェラーゼの方がpHによる変動が小さいことが明らかとなった。
【産業上の利用可能性】
【0075】
本発明は、細胞内をイメージングする発光量を増強したルシフェラーゼを提供する.本酵素を使用することで、細胞内のATP分布やオルガネラ局在等を可視化できる。これらは病態の治療,検査及び新薬開発に利用が可能である。
【0076】
本発明は、生細胞における転写活性測定方法を提供する。本発明の方法を使用することによって、特に、従来の方法では解析が困難であった、転写活性の弱いプロモーター系や、浮遊細胞や初代細胞などの遺伝子の一過的導入の効率が細胞系おいて、生細胞アッセイが可能になる。さらに、サンプル量の少ないプレートファオーマットでの解析も適用範囲を拡大できることから、遺伝子転写を指標としたシグナル伝達系などの解析、さらには化合物スクリーニングの系として利用することができ、創薬・医療などの産業界に寄与することが大である。
【技術分野】
【0001】
本発明は、細胞内イメージングを目的とした細胞内での発光量が増幅されたルシフェラーゼの遺伝子構築体、その組み合わせ、該遺伝子構築体で形質転換された形質転換細胞、細胞内における2種の蛋白質の相互作用を評価する方法に関する。
【0002】
さらに本発明は、細胞内発現活性の高いルシフェラーゼ遺伝子構築体を用いた生細胞における感度の高い転写活性測定方法に関する。さらに詳しくは、プレートフォーマットによる多検体解析方法に関する。
【背景技術】
【0003】
生命科学の分野では、細胞内カルシウム量の変動、細胞内タンパクのリン酸化、エネルギーであるATPの分布或いは遺伝子の転写活性の測定など、細胞内に起きるさまざまな現象を解析することが大変重要であり、解析する手段として各種分子プローブが作成され、イメージングが行われている。とりわけ細胞内イメージングツールとして各種蛍光タンパクが用いられている。蛍光タンパクは細胞内での発現とほぼ同時期に、補因子を必要とせず、蛍光活性を持つ。細胞内で蛍光活性を指標として蛋白質の局在等に関するモニター蛋白質として利用されているが、励起光を必要とし不均一な蛍光収率等のため定量化は難しく、また、細胞に励起光を当てるため細胞が損傷され、長時間の観察には適していない。
【0004】
レポーター遺伝子を用いた転写活性測定は、プロモーター、エンハンサー、サイレンサーなどの遺伝子発現制御配列やそれに結合する転写因子の解析の他、特定のプロモーターに連結されたレポーター遺伝子の発現量を指標に、細胞内シグナル伝達経路の活性化状態、あるいは受容体−リガンドの解析などの様々な細胞内分子メカニズムの解析に用いられるツールである。この手法はまた、ドラッグ・ディスカバリーにおいて大規模スクリーニングのツールとして、また化学物質の毒性評価の指標として使用されている。
【0005】
ここで用いられるレポーターとしては、クロラムフェニコールアセチルトランスフェラーゼ(CAT)やβ−ガラクトシダーゼ、緑色蛍光タンパク質(GFP)などの多くの酵素が用いられてきたが、ホタルルシフェラーゼの発光を利用したシステムは感度が高く、他のレポーター酵素アッセイに比べ簡便なことから、現在広く用いられている。GFPも基質を必要とせず、励起光を照射することによって容易に検出することが可能であるが、定量化には適していない。また、励起光を照射するため、細胞へのダメージが大きく、長時間、連続的にモニターする目的には適さない。
【0006】
ホタルルシフェラーゼは発光性甲虫由来のルシフェラーゼであり、Photinus、Photuris及びLuciola属のホタルからcDNAが単離されている。特にPhotinus pylalis由来のものは、長年に渡って仔細な研究がなされている。ホタルを含む甲虫由来のルシフェラーゼは、多複素環式有機酸D-(-)-2-(6’-ヒドロキシ-2’-ベンゾチアゾリル)-Δ2-チアゾリン-4-カルボン酸(以後、ルシフェリンと表記する)を基質とし、Mgイオン存在下でATPとルシフェリンが反応してルシフェニルアデニレートを形成し、酸素と結合し、励起状態のオキシルシフェリンが生じる。このオキシルシフェリンが基底状態に戻るときに光を発する。
【0007】
ホタルルシフェラーゼはレポーター遺伝子として、細胞に与える外来因子の影響の評価、細胞内情報伝達の伝播、或は個々のタンパク群の発現解析等に用いられている。ホタルルシフェラーゼ遺伝子に転写活性領域を挿入、細胞内に遺伝子構築体を導入、レポーター遺伝子を導入した培養細胞を一定時間、薬剤等で処理した後、細胞を集め、発光基質を加えることで、細胞内で合成されたルシフェラーゼ量を測定、転写活性を評価するシステムが挙げられる。ルシフェラーゼの発光量から転写活性を評価することから定量性に優れており、既に多くの会社から本システム関連製品が開発、市販化されている。
【0008】
ホタルルシフェラーゼを用いたイメージングとして、例えば、細胞内カルシウム量を発光タンパク質イクオリンで、ATP量をホタルルシフェラーゼで測定し、細胞内におけるエネルギー物質ATPの変動の可視化に成功している(非特許文献1)。また、ホタルルシフェラーゼスプリットアッセイによりタンパク間分子間力の可視化に成功した例もある(非特許文献2)。ルシフェラーゼによるイメージングは蛍光タンパクのように1分子レベルの解析や細胞内のごく小さいエリアのイメージングには不向きであるが、細胞内のオルガネラレベルで起きている現象の解析、特に長時間に渡る測定においては蛍光タンパクでは計測できない細胞情報を得ることが可能である。よってホタルルシフェラーゼイメージングは医薬の評価、スクリーニングに有効な方法である。
【0009】
しかしながら、ホタルルシフェラーゼを用いたイメージングの例は少ない。これは蛍光タンパクに比べてルシフェラーゼの哺乳類細胞内での安定性が低く、タンパク質としての寿命が短いため、また、転写効率が低いため、実用に適さなかったためであり、さらに、細胞の画像解析装置は蛍光に対応したものが多く、発光を効率よく計測するシステムでないためである。とりわけ生細胞内におけるホタルルシフェラーゼの発光活性が低いため、発光シグナルを容易に得ることができないためである。
【0010】
ホタルルシフェラーゼのうちイメージングその他に最も多く用いられている酵素がアメリカ産ホタル(Photinus pyralis)ルシフェラーゼであるが、最近、in vitroで半減期が2−25倍程度、熱安定性を向上させた変異体において、細胞内での発光シグナルの向上が見られ、細胞内のイメージングに適したルシフェラーゼであると報告された(非特許文献3)。しかしながら、ホタルルシフェラーゼでは細胞内のpHに連動して発光色を変える欠点があり、発光色の多様性に目を向けたマルチ遺伝子発現のような用途には不向きである(マルチ遺伝子転写活性測定システム:近江谷克裕、中島芳浩;特許文献1)。
【0011】
甲虫由来のルシフェラーゼ遺伝子を導入されたトランスジェニック動物や細胞において発現されたルシフェラーゼは、動物個体内にルシフェリンを投与したり、細胞培養液中にルシフェリンを添加し細胞内に浸透させ、ルシフェラーゼ−ルシフェリン反応を行い、その発光によって検出することが可能である。
【0012】
しかし、多くの場合、細胞内で発現するルシフェラーゼの検出は、界面活性剤を含む試薬で細胞を溶解し、このルシフェラーゼを含む溶解液を発光基質と混合させてルシフェリンの発光を測定することにより行われている。この方法では、前記細胞培養液にルシフェリンを添加して検出する方法に比べ、細胞を溶解し、さらに発光試薬と反応させるため煩雑となる。また、一度細胞を溶解してしまうと、その後の細胞内現象を見ることはできないが、細胞を溶解しない前記方法では必要に応じて培養時間を延長し、細胞内現象を継続して観察できるというメリットがある。そのデメリットにも関わらず、細胞を溶解して検出する方法が現在主流であるのは、ホタルルシフェラーゼレポーターが生細胞内ではルシフェリンと十分に反応せず、シグナルが弱く、感度が低いことが主要な原因のひとつである。この問題は、転写活性の弱いプロモーターの解析、あるいはレポーター遺伝子の一過的導入解析を遺伝子導入効率の低い細胞で実施しようとする場合に顕著となる。また、多検体を同時に測定しようとするとサンプル量が減少し、感度の低い検出系では測定が難しい。そのため、細胞を生かしたまま、効率よく転写活性をモニターできるレポーターアッセイ方法が必要とされていた。
【0013】
外来因子が生体に与える影響を評価することは、薬剤を評価し新薬を開発する上で、或いは化学物質の毒性を評価する上でも大変に重要である。従来、マウスなどの生物個体を用いた計測・評価から、細胞組織・集団を用いた計測・評価が、さらに一つの細胞レベルで細胞間、細胞内の情報変化より外来因子を評価することが行われつつある。よって外来因子を評価する上で、細胞間、細胞内を評価するための分子プローブが重要となっている。蛍光タンパクは細胞内イメージングプローブとして短時間の解析には向いているが、長時間の解析には不向きである。ルシフェラーゼは長時間の解析には向いているが、イメージングツールとしては確立されていない。
【0014】
細胞内、細胞間イメージングツールとしてルシフェラーゼを確立するためには、哺乳類細胞内におけるルシフェラーゼの高い安定性と比較的長いタンパク質の寿命が望まれる。また、各種タグタンパクドメインを融合させたタンパクにおいても高い発光活性を有することが望まれる。従来、哺乳類細胞の転写活性測定に用いられてきたアメリカ産ホタル、日本産ホタルでは、充分な発光量と安定性が見られなかった。特にアメリカ産ホタルルシフェラーゼ、日本産ホタルルシフェラーゼは細胞内のpH環境等で発光スペクトルが変化するため、安定な測定が難しい。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】WO2004/99421
【非特許文献】
【0016】
【非特許文献1】Sala-Newby GB et al.: Imaging bioluminescent indicators shows Ca2+ and ATP permeability thresholds in live cells attacked by complement. Immunology. 1998 Apr;93(4):601-9.
【非特許文献2】Ozawa T et al.: Split luciferase as an optical probe for detecting protein-protein interactions in mammalian cells based on protein splicing.Anal Chem. 2001 Jun 1;73(11):2516-21.
【非特許文献3】BaggettB et al.: Thermostability of firefly luciferases affects efficiency of detection by in vivo bioluminescence. Mol Imaging. 2004 Oct;3(4):324-32.
【発明の概要】
【発明が解決しようとする課題】
【0017】
本発明は、細胞内のpHに非感受性であり、かつ、細胞のダメージがほとんどあるいは全くなく、個々の細胞内についての長時間のイメージングを可能にする遺伝子構築体および形質転換細胞、特に形質転換ヒト細胞を提供することを目的とする。
【0018】
また、本発明は、ルシフェラーゼを分割して融合タンパク質として細胞内に導入し、ルシフェラーゼの各部分と融合した各蛋白質の相互作用をイメージングする方法、イメージング可能な形質転換細胞およびこのような融合タンパクをコードする遺伝子構築体の組合せを提供することを目的とする。
【0019】
さらに本発明は、生細胞を用いた感度の高い転写活性測定方法を提供することを目的とする。さらに詳しくは、転写活性の弱いプロモーターの解析、一過的遺伝子導入において遺伝子導入効率の低い細胞、1条件あたりのサンプル量が少なくプレートフォーマットにおいて有効な生細胞を用いた転写活性測定方法を提供する。
【課題を解決するための手段】
【0020】
本発明者は、上記課題に鑑み検討を重ねた結果、ブラジル産ヒカリコメツキムシ由来ルシフェラーゼが哺乳類細胞内で高い安定性および長寿命特性を有し、特に哺乳類細胞内での発光イメージングを可能にすることを見出した。
【0021】
また、本発明者は、哺乳類細胞などの生細胞において高い活性を示すヒカリコメツキ由来ルシフェラーゼを転写活性測定に適用し、転写活性の弱いプロモーターや遺伝子導入効率の低い細胞において従来のホタルルシフェラーゼを用いたアッセイに比べ感度よく安定した計測が可能であることを見出し、本発明を完成するに到った。
【0022】
本発明は、以下の遺伝子構築体、形質転換細胞、細胞内での異種蛋白質の相互作用を解析する方法、転写活性測定方法を提供するものである。
1. pH非感受性ルシフェラーゼをコードする遺伝子構築体であって、ホタル由来ルシフェラーゼ遺伝子構築体と比較して細胞内の発現活性が高い遺伝子構築体。
2. 前記細胞が哺乳類細胞である、項1に記載の遺伝子構築体。
3. 前記遺伝子構築体が、哺乳類細胞中での翻訳を効率化されたルシフェラーゼ遺伝子からなる項2に記載の遺伝子構築体。
4. 前記遺伝子構築体がヒカリコメツキムシ由来のルシフェラーゼをコードする項1〜3のいずれかに記載の遺伝子構築体。
5. ヒカリコメツキ由来ルシフェラーゼがPyrophorus属、Pyrearinus属由来ルシフェラーゼまたはその変異体からなる群より選択される、項4に記載の遺伝子構築体。
6. ヒカリコメツキ由来ルシフェラーゼをコードする遺伝子が配列番号:2の塩基配列を有する、項4または5に記載の遺伝子構築体。
7. pH非感受性ルシフェラーゼが不安定化されたルシフェラーゼである、項1〜6のいずれかに記載の遺伝子構築体。
8. 遺伝子構築体がpH非感受性ルシフェラーゼまたはその部分配列と少なくとも1つの異種タンパク質またはタグ配列からなる融合タンパク質をコードすることを特徴とする項1〜7のいずれかに記載の遺伝子構築体。
9. 異種タンパク質またはタグ配列がタンパク質不安定化シグナルである、項8に記載の遺伝子構築体。
10. タンパク質不安定化シグナルがPEST配列を有する、項9に記載の遺伝子構築体。
11. PEST配列がマウスオルニチンデカルボキシラーゼの3’末端またはその変異体である、項10に記載の遺伝子構築体。
12. 異種タンパク質またはタグ配列が細胞内局在化シグナルである項8に記載の遺伝子構築体。
13. pH非感受性の前記ルシフェラーゼのN末端部分と少なくとも1つの第一異種タンパク質からなる融合タンパク質をコードする項8に記載の遺伝子構築体。
14. pH非感受性の前記ルシフェラーゼのC末端部分と少なくとも1つの第二異種タンパク質からなる融合タンパク質をコードする項8に記載の遺伝子構築体。
15. 項13の遺伝子構築体と項14の遺伝子構築体との組合せ。
16. 項13および14の融合タンパク質をコードする遺伝子構築体を同一の細胞に導入し、前記融合タンパク質を発現させ、第一異種タンパク質と第二異種タンパク質の相互作用を評価する方法。
17. 項13および14に記載の遺伝子構築体からの発現産物を混合し、第一異種タンパク質と第二異種タンパク質の相互作用を評価する方法。
18. 項1〜14の遺伝子構築体または項15に記載の遺伝子構築体の組合せを用いて形質転換された形質転換細胞。
19. 前記細胞が哺乳類細胞である項18に記載の形質転換細胞。
20. 前記細胞がヒト細胞である、項18または19に記載の形質転換細胞。
21. 配列番号2に記載のヒカリコメツキルシフェラーゼ遺伝子改変体。
22. 細胞内のオルガネラのイメージングのための項18〜20のいずれかに記載の形質転換細胞の使用。
23. 試験対象となる転写制御配列制御下でpH非感受性ルシフェラーゼを発現する試験細胞を所望の条件下で培養し、該発現ルシフェラーゼによる発光を生細胞において測定することを含み、ホタル由来ルシフェラーゼと比較してpH非感受性ルシフェラーゼの細胞内の発現活性が高いことを特徴とする転写活性測定方法。
24. pH非感受性ルシフェラーゼがヒカリコメツキ由来ルシフェラーゼである、項23に記載の方法。
25. pH非感受性ルシフェラーゼがPyrophorus属、Pyrearinus属のヒカリコメツキ由来ルシフェラーゼまたはその変異体からなる群より選択される、項23または24に記載の方法。
26. 転写制御配列制御下のpH非感受性ルシフェラーゼ遺伝子が、配列番号:2に示される塩基配列を有する、項23〜25のいずれかに記載の方法。
27. pH非感受性ルシフェラーゼが不安定化されている、項23〜26のいずれかに記載の方法。
28. 細胞が哺乳類細胞、酵母、大腸菌および植物細胞からなる群より選択される、項23〜27のいずれかに記載の方法。
29. 被験転写制御配列が転写活性が低い配列である、項23〜28のいずれかに記載の方法。
30. 細胞が遺伝子導入効率の低い細胞である、項23〜29のいずれかに記載の方法。
31. 0.01〜10mM D-luciferinを細胞培養液に添加する、項23〜30のいずれかに記載の方法。
32. 96、384または1536ウェルプレートフォーマットで実施する、項23〜31のいずれかに記載の方法。
33. ルシフェラーゼの発現差により化合物の細胞への影響を評価する、項23〜32のいずれかに記載の方法。
【発明の効果】
【0023】
本発明によれば、ルシフェラーゼの細胞内での発現量を大幅に向上させることができ、個々の細胞内での長期間の発光イメージングを行うことが可能になった。ルシフェラーゼを用いる系は、励起光にさらされた短時間の細胞イメージングから光細胞ダメージを考慮しなくて良く、長時間にわたる細胞イメージングが可能になり、各種病態の治療及び新薬開発への利用も可能となる。
【0024】
本発明の方法により、特に、転写活性の弱いプロモーター解析や遺伝子導入効率の低い細胞におけるプロモーター解析において、従来のホタルルシフェラーゼを用いたアッセイに比べ感度よく、安定した計測が可能となった。さらに、本発明の方法によりシグナル強度が向上したことによって、サンプル量が少ないプレートフォーマットによる多検体処理が困難であった試験においてもプレートフォーマットで生細胞解析が可能となり、創薬スクリーニング、化学物質の毒性評価などにおける生細胞分析適用範囲を拡大できる。
【図面の簡単な説明】
【0025】
【図1】(A) Real-time monitoring;ヒカリコメツキルシフェラーゼ野性型(PtGR;WT)及び変異型(PtGRm;Mutant)におけるBmalIプロモーター活性を例としたリアルタイム発光活性の測定、(B)Transient assay;ヒカリコメツキルシフェラーゼ野性型(PtGR;WT)及び変異型(PtGRm;Mutant)のBmalIプロモーター転写活性測定の結果例
【図2】(A)アメリカ産ホタルルシフェラーゼ(Firefly) 及び(B)ヒカリコメツキルシフェラーゼ変異型(PtGRm)におけるBmalIプロモーター活性を例としたリアルタイム発光活性の測定、(C)ヒカリコメツキルシフェラーゼ変異型(dPTGRm)及びアメリカ産ホタルルシフェラーゼ(dLuc(+))におけるBmalIプロモーター活性測定の結果例
【図3】ヒカリコメツキルシフェラーゼ変異型(PtGRm-PEST)及びアメリカ産ホタルルシフェラーゼ(Luc(+)-PEST)の細胞内の半減期
【図4】(A)アメリカ産ホタルルシフェラーゼ(Firefly)及び(B)ヒカリコメツキルシフェラーゼ変異型(PtGRm)を発現した哺乳類細胞の発光イメージング
【図5】ヒカリコメツキルシフェラーゼ変異型(PtGRm)に細胞内局在ペプチド配列を挿入した変異体の構造とその発光活性。図5において:核局在化シグナル DPKKKRKVDPKKKRKVDPKKKRKV;小胞体局在化シグナル MGWSCIILFLVATATGAHS---SEKDEL;膜局在化シグナル MLCCMRRTKQVEKNDEDQKI。
【図6】細胞内の各オルガネラにおける発光イメージングと蛍光イメージングの比較を示す。図6において、(A) 発光イメージング; (B) 抗FLAG抗体; (C) GFP; (D) 重ね合せ; (E) ペルオキシソーム; (F) 核; (G) 細胞質; (H) 蛍光イメージング。
【図7】4分間隔で撮影した発光イメージングの結果を示す。
【図8】実施例で用いたAP1応答配列、NFκB応答配列を含むプラスミドの構築フローを示す図である。
【図9】HeLa S3細胞におけるAP1応答エレメントに連結されたルシフェラーゼの各条件での発現を比較したデータを示す図である。(A) 測定値; (B) 誘導比
【図10】Jurkat細胞におけるNFκB応答エレメントに連結されたルシフェラーゼの各条件での発現を比較したデータを示す図である。(A) 測定値; (B) 誘導比
【図11】Jurkat細胞におけるAP1応答エレメントに連結されたルシフェラーゼの各条件での発現を比較したデータを示す図である。(A) 測定値; (B) 誘導比
【図12】発光測定値及びpH8.0における測定値をそれぞれのルシフェラーゼにおいて100として、各pHの相対活性をプロットしたグラフを示す。(A) Signal intensity; (B) PtGRm, Fluc pH依存性
【発明を実施するための形態】
【0026】
本発明の遺伝子構築体は、細胞(特に哺乳類細胞)内で発現した場合に、従来使用されているホタル(Photinus Pyralis)由来ルシフェラーゼ遺伝子構築体と比較して発現効率が向上しており、個々の細胞のイメージングが可能になる(例えば図5参照)。
【0027】
従来のホタルルシフェラーゼを導入した形質転換細胞では、発光シグナルが十分ではなく、非特許文献3に記載されたホタルルシフェラーゼ変異体においても発光シグナルが依然として少なく、発光イメージングには不十分である。
【0028】
一方、本発明の遺伝子構築体を用いて形質転換された細胞は、ホタル(Photinus Pyralis)由来ルシフェラーゼ遺伝子構築体で形質転換された細胞と比較して、2倍以上、好ましくは4倍以上、より好ましくは10倍以上、さらに好ましくは25倍以上、特に100倍以上の発光量を有する。
【0029】
本発明の1つの好ましい実施形態において、本発明の遺伝子構築体は、ルシフェラーゼ遺伝子を導入するためのマルチクローニングサイト、ルシフェラーゼ遺伝子、該遺伝子発現を調節するためのプロモーター及び/又はエンハンサー(転写制御配列)、ポリアデニル化配列、選択可能なマーカー遺伝子、複製起点などを含む発現ベクターであり得る。プロモーター、エンハンサーなどの転写制御配列は、本発明のルシフェラーゼにより転写活性が測定される対象である。
【0030】
本発明の遺伝子構築体でコードされるルシフェラーゼは、pH非感受性、すなわち発光波長がpHに依存して実質的に変化しないものである。このような特性を有するルシフェラーゼであれば特に限定されないが、ヒカリコメツキ由来のルシフェラーゼが本発明の遺伝子構築体により好ましくコードされる。ヒカリコメツキ由来のルシフェラーゼ遺伝子としては、配列番号1の遺伝子が例示される。ヒカリコメツキ由来のルシフェラーゼは、発光波長がpH非感受性だけでなく、細胞(特に哺乳類細胞)内における安定性が他のルシフェラーゼと比較して有意に高く(すなわち細胞内の分解が遅く)、この点でも好ましい。
【0031】
ホタルルシフェラーゼはpHに依存して発光波長が変化するため、pHが常に変化している細胞内環境での正確なイメージングが困難である。
【0032】
さらに、ヒカリコメツキ由来ルシフェラーゼ、ホタルルシフェラーゼはいずれもpH8に最大発光域が存在するが、細胞質はpH7.2と至適pHに比べやや低い。従来から一般に行われている細胞内で発現したホタルルシフェラーゼの検出は、細胞を溶解しpH8付近の緩衝液中で反応を行うのに対し、生細胞内ではpHが低いため反応効率が悪い。一方、ヒカリコメツキ由来のルシフェラーゼはホタルルシフェラーゼに比べ低pH側でも高い反応効率を保持しており、生細胞のアッセイに適している。本発明のヒカリコメツキ由来のルシフェラーゼは、細胞内のpHが6.5以上であれば十分な測定が可能であり、好ましい細胞内pHは7以上、より好ましくは7.0〜8.5、特に7.4〜8.0である。
【0033】
ヒカリコメツキ由来ルシフェラーゼは細胞内における安定性が高いという点は、発現活性の低い転写制御配列の解析、細胞内における局在解析、ルシフェラーゼを局在させたオルガネラのモニタリング、ルシフェラーゼに融合した異種タンパク質の機能や存在量の解析などに有効である。しかしながら、この安定性は転写活性の増減をモニターするような解析においては変動をモニターしづらくする場合がある。この場合、細胞内における分解を促進させることが好ましいが、細胞内寿命を短縮化したヒカリコメツキ由来ルシフェラーゼは低pHでもホタルルシフェラーゼよりも高い発光反応の効率は保持されており、短寿命かつ高シグナル強度のルシフェラーゼとして有用である。一方で、概して、多くの組織や細胞において一定量発現し、細胞の維持・増殖に関わるハウスキーピング遺伝子のような遺伝子群は細胞内転写産物量が高いのに対し、細胞の機能調節を担うような遺伝子の多くは発現が低い場合が多い。このような低発現量の遺伝子の一つであるサイトカインのうち、IL6などは炎症を伴う多くの腫瘍で発現が亢進しており、ガンの進展に関与している可能性が示唆されており、多発性骨髄腫や形質細胞白血病などでは抗IL6抗体の優れた治療効果が報告されている。あるいは、サイトカイン・ケモカインであるIL−8、ICAM-1のなど気道上皮細胞における発現量は、非喫煙者・健常喫煙者・慢性閉塞性肺疾患の順に亢進する。このような遺伝子の発現制御領域を用いて、これら疾患に関連した亢進作用を抑制するような化合物をスクリーニングすることは疾患のメカニズムの解明・ドラッグディスカバリーの面で非常に有用である。より検出能の高いルシフェラーゼを用いることで、従来のホタルルシフェラーゼでは転写効率が低く、十分に検出ないし定量を行えなかった遺伝子の転写制御配列に関する細胞アッセイを行うことが可能である。ここで言及される転写制御配列としては、転写開始に必要なプロモーターと言われる配列領域に加え、さらにエンハンサーやサイレンサーと呼ばれる転写の促進または抑制に関わる配列領域を含む。エンハンサーやサイレンサーの調節を解析するためのひとつの手段としては、例えば、被験配列の当該部位と考えられる部位の塩基配列を遺伝子工学的に他の塩基配列に置換したり、当該領域を除去することによって、その遺伝子発現の調節が維持されるかを評価する。あるいは一定発現することが知られるプロモーター配列に、エンハンサーあるいはサイレンサーと考えられる配列を連結し、ルシフェラーゼの発現促進あるいは抑制が認められるかを評価する方法もある。
【0034】
本発明で使用するルシフェラーゼ遺伝子は、天然のルシフェラーゼ遺伝子自体を使用してもよいが、遺伝子構築体が導入される細胞における翻訳を効率化するために遺伝子配列を改変するのが好ましい。具体的には、a) 余分な転写因子が結合しないように、cDNAの配列を変えること、b)cDNAの配列を、昆虫のコドンユーセージ(コドンの使用頻度の偏り)を所望の細胞用(例えば哺乳類用)に変え、さらにc)使用上、制限酵素部位が多いことで応用が限定されることからそのcDNAを変えることなどが挙げられ、これらを適宜組み合わせて翻訳効率を向上させることで、ルシフェラーゼの発現量を増大し、発光イメージングが容易に行える程度にまで発光量を高めることができる。例えば、配列番号2のヒカリコメツキルシフェラーゼ遺伝子改変体は、改変前の配列番号1の遺伝子と比較して150倍程度の発光量を有する。配列番号1の開始コドン、2番目のコドンとメチオニンが連続しているのに対し、配列番号2ではメチオニンを一つ削除しているが十分な発光の増強が認められたことから、このメチオニンは1つでも2つでもいずれであってもよい。本発明のpH非感受性ルシフェラーゼをコードする遺伝子には、配列番号2のDNAとストリンジェントな条件下にハイブリダイズし、かつPhotinus Pyralis由来ルシフェラーゼ遺伝子よりも細胞(特に哺乳類細胞)内の発現活性が高い変異型遺伝子も包含される。
【0035】
本発明で使用される、Photinus Pyralis由来ルシフェラーゼ遺伝子と比較して哺乳類細胞内の発現活性が高い遺伝子としては、ヒカリコメツキ由来ブラジル産Pyrearinus属(例えばPyrearinus termitilluminans)のルシフェラーゼが特に好ましい。また、ブラジル産Pyrophorus属(例えばPyrophorus punctatissimus)ルシフェラーゼなども好ましい。
【0036】
特に、Pyrearinus termitilluminans由来のルシフェラーゼはpHによる発光スペクトルの変動がなく、最大発光波長538 nmを有し、ルシフェラーゼによる発光検出の際に一般に用いられる光電子増倍管(PMT) やcharged-coupled device (CCD)カメラの量子効率の最大域と一致するため、感度よく検出することが可能である。
【0037】
なお、本発明で使用されるルシフェラーゼは、天然に存在するルシフェラーゼだけでなく、1又は2以上のアミノ酸を置換、付加、欠失又は挿入し、かつ、Photinus Pyralis由来ルシフェラーゼ遺伝子よりも細胞(特に哺乳類細胞)内の発現活性が高い変異型ルシフェラーゼを包含する。また、N末端またはC末端に第2のタンパク質が結合した融合タンパク質であってもよい。
【0038】
「ストリンジェントな条件」とは,特異的なハイブリダイゼーションのみが起き,非特異的なハイブリダイゼーションが起きないような条件をいう。このような条件は,通常,「1xSSC,0.1%SDS,37℃」程度であり,好ましくは「0.5xSSC,0.1%SDS,42℃」程度であり,更に好ましくは「0.2xSSC,0.1%SDS,65℃」程度である。ハイブリダイゼーションによって得られるDNAは配列番号2記載の塩基配列により表わされるDNAと通常高い相同性を有する。高い相同性とは,80%以上の相同性,好ましくは85%以上の相同性,更に好ましくは90%以上、特に95%以上、あるいは98%以上の相同性を指す。
【0039】
本発明において、哺乳類としては、ヒト、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌが挙げられ、好ましくはヒトである。
【0040】
pH非感受性とは、細胞(特に哺乳類細胞)内でpHが変化しても、ルシフェラーゼの最大発光波長の変動が3nm以下、好ましくは2nm以下、さらに好ましくは1nm以下、特に好ましくは0.5nm以下であることを意味する。最大発光波長の変化量がこの範囲内であれば、複数の発光タンパク質の発現量をフィルター等で分離して定量する場合、相互の発光タンパク質の比率がほとんど変化しないため好ましい。
【0041】
本発明の遺伝子構築体で細胞(例えば哺乳類細胞)を形質転換した場合、該形質転換細胞は十分に高い発光量を得ることができる。異種タンパクないしタグを結合させると発光量が低下するため、何も結合させない場合であっても発光量が不十分である従来の遺伝子構築体では異種タンパクないしタグを結合させることは困難であった。一方、本発明では異種タンパクないしタグを結合させるルシフェラーゼによる発光量が非常に高いため、異種タンパクないしタグを結合させた状態で個々の細胞のイメージングを行うことができる。
【0042】
本発明のルシフェラーゼと融合される異種タンパクとしては、任意の異種タンパクが挙げられ、タグとしてはPEST 配列又はユビキチン又はこれらの生物学的に活性な断片又はこれらの変異体若しくは誘導体をコードするヌクレオチド配列によりコードされる蛋白質不安定化シグナル、さらに核局在化シグナル、膜局在化シグナル、細胞質局在化シグナル、ミトコンドリア局在化シグナル、ER局在化シグナルなどの細胞内局在化シグナルが挙げられる。
【0043】
ルシフェラーゼの不安定化は、ルシフェラーゼ蛋白質を不安定化するPEST配列等を使用してもよく、ポリAシグナルを欠如させたり、c-fos、c-jun 、c-myc 、GM-CSF、 IL-3 、TNF-α、IL-2、IL-6、IL-8、IL-10、ウロキナーゼ、bcl-2、Cox-2、PAI-2等の種々の遺伝子由来の配列をルシフェラーゼ遺伝子に連結してルシフェラーゼのmRNAを不安定化してもよい。
【0044】
ルシフェラーゼ蛋白質又はそのmRNAを不安定化することで、ある刺激に対するルシフェラーゼの発現量の変化をより正確に(タイムラグなく)観察することができる。これは、哺乳類細胞中での発現効率がホタルよりも高い本発明の遺伝子構築体により初めて実現されるものである。
【0045】
タグとして使用されるPEST配列は、オルニチンデカルボキシラーゼの3‘末端又はその変異体が好ましく、オルニチンデカルボキシラーゼの3‘末端又はその変異体は哺乳類由来のものが好ましく、一般的によく使用されるのはマウス由来のものである(配列番号7, 8)。なお、PESTは、プロリン(P)、グルタミン酸(E)、セリン(S)及びスレオニン(T)の豊富なアミノ酸配列を指し、PEST 配列を含むタンパク質は半減期が短いことが知られている。
【0046】
本発明の1つの実施形態では、ルシフェラーゼスプリットアッセイであって、ルシフェラーゼを例えばN末端部分とC末端部分の2つに分け、各々をコードするDNAを異種タンパクと連結し、これらの遺伝子構築体を1つの細胞で共発現させる。ここで、ルシフェラーゼのN末端部分とルシフェラーゼのC末端部分は別々に発現されるが、これらが近接した位置に来ると、発光するように設計することができる。
【0047】
第1遺伝子構築体:(ルシフェラーゼのN末端部分)−(第1異種タンパク)
第2遺伝子構築体:(第2異種タンパク) −(ルシフェラーゼのC末端部分)
これらの遺伝子構築体を1つの細胞内で共発現させると、2つの異種タンパクの相互作用によりN末端・C末端が近接位にあることを発光シグナルにより確認することが可能になる。
【0048】
ルシフェラーゼスプリットアッセイについては、前記記載の非特許文献2に報告されるようにホタルルシフェラーゼを用いて成功した例はあるが、ヒカリコメツキルシフェラーゼは、ホタルルシフェラーゼに比べ発現活性が高く、かつpH非感受性であるため、より好適なプローブとして使用できる。
【0049】
例えば、ヒカリコメツキルシフェラーゼにおいて、N末端部分とC末端部分は以下のように設計できる。ヒカリコメツキルシフェラーゼの構造は明らかにされていないが、ヒカリコメツキルシフェラーゼと同じ甲虫ルシフェラーゼであるホタルルシフェラーゼは活性中心を挟んで、β−バレルと2つのβ−シートからなる大きなN末端部分とC−末端部分との2つのドメインからなることが知られている(Conti, E. et al.; Crystal structure of firefly luciferase throws light on a superfamily of adenylate-forming enzymes. Structure. 1996 March;4(3):287-98)。ホタルルシフェラーゼのスプリットアッセイではこれらの2つの部位を連結する柔軟な部位で分割することが知られており、その一つの例がホタルルシフェラーゼの437アミノ酸と438アミノ酸の間で分割し、N末端部分、C末端部分とするものである(非特許文献2)。ヒカリコメツキルシフェラーゼとホタルルシフェラーゼのホモロジー検索により、N末端部分とC末端部分の連結付近は比較的高いホモロジーがあり、ヒカリコメツキルシフェラーゼのN末端部分とC末端部分の連結部分はアミノ酸配列で432位から436位と推定され、この領域で分割されることが好ましい。特に好ましくは433位と434位の間で分割するもので、遺伝子構築体としては配列番号2の1299位までをルシフェラーゼのN末端部分、配列番号2の1300位以後をC末端部分として用いた構築体である。
【0050】
また、2つの蛋白質の相互作用を検出する対象となる第1異種タンパクと第2異種タンパクの組み合わせとしては、以下のものが挙げられる。
【0051】
【表1】

【0052】
本発明において、前記ルシフェラーゼ遺伝子上流に転写活性(プロモーター活性)を有するか、有する可能性のある被験配列を連結した遺伝子構築体を細胞へ導入するか、相同性組換えなどによって、ある遺伝子転写制御配列下に前記ルシフェラーゼ遺伝子が組み込まれた細胞を用いて、被験制御配列の転写制御下で発現されるルシフェラーゼを指標に、前記配列の転写制御をモニターする。例えば哺乳類細胞において転写活性を測定するために、ルシフェラーゼ遺伝子が安定発現可能になるように、開始コドンの上流には翻訳を効率化するためのKozak配列を、ルシフェラーゼ遺伝子下流にはポリアデニル化シグナルを配置することができる。さらに好ましくは、ルシフェラーゼ遺伝子の上流に配置される被験転写制御配列上流に転写終結シグナルを配置することによって、被験配列以外の配列による発現への影響をできるだけ排除することが好ましい。
【0053】
さらに、転写活性のダイナミックな増減変動を解析するためには、ルシフェラーゼの細胞内寿命があまりに長いと基底状態のシグナルが高くなり、転写の活性化がモニターしづらい。このような場合、ルシフェラーゼの細胞内寿命を短縮化することによって、より明瞭な転写活性の変動解析を行うことが可能になる。ルシフェラーゼを短寿命化する方法としては、タンパク質分解促進シグナル配列、例えばユビキチン化シグナル配列やPEST配列などの蛋白質不安定化シグナル配列をルシフェラーゼに融合する方法が挙げられる。
【0054】
前記ルシフェラーゼ遺伝子上流に転写活性(プロモーター活性)を有するか、有する可能性のある被験配列を連結した遺伝子構築体を細胞へ導入する方法としては、リン酸カルシウム法、DEAE-デキストラン法、カチオニックリポソーム法などの化学的手法、アデノウイルスベクター、ワクシニアウイルスベクターやレトロウイルスベクター、HVJリポソームなどの生物学的手法、エレクトロポレーション、DNA直接注射、遺伝子銃などの物理的手法など、いずれの方法であってもよい。化学的手法やエレクトロポレーション法が一般に手軽で用いられるが、遺伝子導入効率は細胞によって大きく変わる。本発明は、遺伝子導入効率の高い細胞は勿論であるが、遺伝子導入効率の低い細胞を用いての生細胞転写活性測定試験に好ましく適用される。遺伝子導入効率の低い細胞での一過的な遺伝子導入による転写活性測定試験では、従来のホタルルシフェラーゼを用いた場合、シグナル強度が低く、生細胞での解析を十分に行えない。本発明における一過的な遺伝子導入とは、対象となる細胞にルシフェラーゼ遺伝子構築物、例えばプラスミド状のもの、を前記方法で遺伝子導入し、導入された細胞・導入されなかった細胞を分離する(安定的に染色体に組み込まれた細胞を選択する)工程を実施することなく、細胞試験に用いることを指す。また、遺伝子導入効率の低い細胞としては、浮遊細胞や正常細胞、初代細胞が挙げられる。特に、ヒト初代細胞は、ドラッグディスカバリーのプロセスにおいてさまざまな治療分野におけるin vitroシステムとして用いられ、生物学的に生物個体に非常に近い細胞アッセイモデルとして、かつオートメーションやハイスループット解析になじみ易いスクリーニングツールとして重要視されている。ヒト初代細胞の例としては、ヒト皮膚微小内管内皮細胞(HMVEC)、ヒト表皮角化細胞(HEK)、ヒト表皮メラニン細胞(HEM)、ヒト皮膚繊維芽細胞(HDF)、ヒト骨格筋細胞(HSkMC)、ヒト臍帯静脈内皮細胞(HUVEC)、ヒト臍帯動脈内皮細胞(HUAEC)、ヒト胎盤上皮細胞(HPIEpC)、ヒト臍帯静脈平滑筋細胞(HUVSMC)、ヒト臍帯動脈平滑筋細胞(HUASMC)、ヒト冠動脈内皮細胞(HCAEC)、ヒト肺動脈内皮細胞(HPAEC)、ヒト大動脈内皮細胞(HAOEC),ヒト心繊維芽細胞(HCF)、ヒト内胸動脈内皮細胞(HITAEC)、ヒト鎖骨化動脈内皮細胞(HScAEC)、ヒト冠動脈平滑筋細胞(HCASMC)、ヒト肺動脈平滑筋細胞(HPASMC)、ヒト大動脈平滑筋細胞(HAOSMC)、ヒト内胸動脈平滑筋細胞(HITASMC)、ヒト鎖骨化動脈平滑筋細胞(HScASMC)、ヒト軟骨細胞(HC)、ヒト骨芽細胞(HOb)、ヒト滑膜細胞(HFLS、HFLS−OA、HFLS−RA)、ヒト気管支上皮細胞(HBEpC)、ヒト胚繊維芽細胞(HLF)、ヒト頭髪毛乳頭細胞(HFDPC)、ヒト前駆脂肪細胞(HPA)、ヒト乳腺上皮細胞(HMEpC)などが挙げられるが、これに限られるものではない。
【0055】
本発明は、さらに1条件あたりのサンプルが少ないプレートフォーマットの解析への生細胞転写活性測定試験に好ましく適用される。ドラッグディスカバリー、化合物の毒性評価のために、多種の化合物を広範な濃度で細胞に暴露し、細胞への作用を評価する必要がある。そのため、少量検体をプレートフォーマットで測定できることが必要である。少量検体ではサンプルから発せられる総発光量が少なくなる一方、同時に多検体を測定するため、1検体あたりの読取り時間が短縮化される。しかしながら、本発明のプレートフォーマットの測定においては、従来の方法に比べシグナル強度が高いため、高感度・高精度な解析を行うことが可能である。さらに、本発明の方法は生細胞にルシフェリンを添加(投与)するだけであるため、蛍光検出における励起光照射のような細胞へのダメージの大きなステップがないため、適宜培養時間を延長し、細胞への作用を長時間にわたってトレースすることが可能である。
【実施例】
【0056】
以下、本発明を実施例に基づきより詳細に説明する。
【0057】
実施例1
野生型(配列番号1)および改良型(配列番号2)ヒカリコメツキルシフェラーゼcDNAと、マウスオルニチンデカルボキシラーゼのPEST配列(配列番号7)を連結した短寿命型ルシフェラーゼを作製した。これらを時計遺伝子マウスBmal1プロモーター(GenBank Accession No. AB064982)下流に挿入したベクターを作製した。続いて各ベクター1μgを、35mm培養ディッシュに播種した培養繊維芽細胞NIH3T3にリポフェクション法(リポフェクトアミンプラス、インビトロジェン社)により導入し、24時間37℃で培養後、100 nMのデキサメタゾンを含むDMEM培地で2時間処理した。更に200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換後、遺伝子発現連続測定装置(アトー(株)社AB2500)にて、1分間の発光を15分間隔で5日間発光量をリアルタイムに測定した(図1(a))。野生型および改良型ルシフェラーゼともに、Bmal1プロモーターに依存した約24時間周期の変動をモニター可能であるが、改良型ルシフェラーゼの発光強度は野生型のそれよりも約100倍高いことが明らかとなった。
【0058】
前述のレポーターベクター200 ngを、24ウェルプレートに播種した培養繊維芽細胞NIH3T3にリポフェクション法により導入し、37℃で24時間培養後、300μLの細胞溶解剤(ピッカジーン デュアルシーパンジー用培養細胞溶解剤、東洋インキ)で細胞を破砕した。細胞抽出液50μLに発光基質液50μL(ピッカジーン発光試薬II)を加え、ルミノメーター(アトー(株)社 AB2250)で20秒間発光を測定した(図1(b))。改良型ルシフェラーゼの発光強度は野生型のそれよりも約150倍程度高いことが明らかとなった。
【0059】
実施例2
米国産Photinus pyralisホタルルシフェラーゼcDNA(Luc(+)、プロメガ社製)および改良型ヒカリコメツキルシフェラーゼcDNA(配列番号2)に、マウスオルニチンデカルボキシラーゼのPEST配列(配列番号7)を連結した短寿命型ルシフェラーゼを作製した。これらを時計遺伝子マウスBmal1プロモーター(GenBank Accession No. AB064982)下流に挿入したベクターを作製した。続いて各ベクター1μgを、35mm培養ディッシュに播種した培養繊維芽細胞rat1にリポフェクション法(リポフェクトアミンプラス)により導入し、24時間37℃で培養後、100 nMのデキサメタゾンを含むDMEM培地で2時間処理した。更に200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換後、遺伝子発現連続測定装置(アトー(株)社AB2500)にて、1分間の発光を15分間隔で5日間測定した(図2)。米国産Photinus pyralisホタルルシフェラーゼ(図2(a))と改良型ヒカリコメツキルシフェラーゼ(図2(b))を比較すると、発光の変動パターンは同じであり、改良型ヒカリコメツキルシフェラーゼがリアルタイム解析に用いられてきたアメリカ産ルシフェラーゼと同等の能力を持つ、一方、24時間以内の発光量を積算した結果(図2(c))、発光量が15倍以上高いことが明らかになった。
【0060】
実施例3
前述の短寿命型ホタルルシフェラーゼcDNAおよび短寿命・改良型ヒカリコメツキルシフェラーゼcDNAを、SV40プロモーターの下流に挿入した発現ベクターを作製した。200 ngの発現ベクターを、24ウェルプレートに播種した培養繊維芽細胞NIH3T3にリポフェクション法により導入し、37℃で48時間培養した。続いて100μMの蛋白質合成阻害剤シクロヘキシミドを含む培養液に置換し、30分間培養後、1時間毎に細胞内の発光活性を測定した。発光活性の測定は、実施例1と同様の方法で行った(図3)。短寿命化米国産Photinus pyralisホタルルシフェラーゼでは、半減期が1時間であったが、短寿命型改良型ヒカリコメツキルシフェラーゼでは半減期が4時間と4倍長寿命化された。
【0061】
実施例4
米国産Photinus pyralisホタルルシフェラーゼcDNA(Luc(+)、プロメガ社製)および改良型ヒカリコメツキルシフェラーゼcDNA(配列番号2)のN末端にFLAGタグ配列(MDYDDDDK;配列番号15)を連結、これらをCMVプロモーターの下流に挿入した発現ベクター2μgを培養繊維芽細胞NIH3T3にリポフェクション法により導入し、37℃で24時間培養した。その後、200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換し、−60℃に冷却したCCDカメラ(アトー(株)社セルグラフ)で3分間発光を測定した。米国産Photinus pyralisホタルルシフェラーゼ(図4(a))およびヒカリコメツキルシフェラーゼ(図4(b))を比較すると、ヒカリコメツキルシフェラーゼを生産する哺乳類細胞が明らか強いシグナルを発することがわかる。細胞を拡大すると核では発光は見られず、PEST配列によって細胞内の細胞質内にルシフェラーゼが局在し発光することがわかる。
【0062】
実施例5
CMVプロモーター下流に挿入された改良型ヒカリコメツキルシフェラーゼcDNA(配列番号2)は哺乳類細胞のペルオキシゾームに局在することを確認した。このC末端のアミノ酸配列SKLを除去したものを細胞質局在化改良型ヒカリコメツキルシフェラーゼとし、次に細胞質局在化改良型ヒカリコメツキルシフェラーゼのC末端に核局在化シグナルDPKKKRKVDPKKKRKVDPKKKRKV(配列番号3)を配したものを核局在化改良型ヒカリコメツキルシフェラーゼとした。また、細胞質局在化改良型ヒカリコメツキルシフェラーゼのN末端MGWSCIILFLVATATGAHS(小胞体局在化シグナル、Vh chain targeting signal;配列番号4)をC末端にSEKDEL(小胞体保留シグナル;配列番号6)を配したものを小胞体局在化改良型ヒカリコメツキルシフェラーゼとした。さらに細胞質局在化改良型ヒカリコメツキルシフェラーゼのN末端にMLCCMRRTKQVEKNDEDQKI(膜局在化シグナル, Neuromodulin N-terminus;配列番号5)を配したものを膜局在化改良型ヒカリコメツキルシフェラーゼとした。
【0063】
オルガネラ局在シグナルを融合したヒカリコメツキcDNAは全てCMVプロモーターの下流に挿入、この発現ベクター0.2μgを培養繊維芽細胞NIH3T3にリポフェクトアミンプラスにより導入した。37℃で24時間培養後、300μLのPBSで細胞を破砕し、細胞抽出液50μLに発光基質液50μL(ピッカジーン発光試薬II)を加え、実施例1と同様の方法で発光活性を測定した。局在化シグナルによって発光活性は変化したが、全て配列番号2の改良型ヒカリコメツキルシフェラーゼに対しておよそ20%以上の発光活性を有しており、細胞内の各所に局在しながらも発光活性を有することがわかる(図5)。
【0064】
実施例6
実施例5で作製したペルオキシソーム局在化、核局在化および細胞質局在化改良型ヒカリコメツキルシフェラーゼcDNAのN末端にFLAGタグ配列(MDYDDDDK;配列番号15)を融合し、各々をCMVプロモーターの下流に挿入した発現ベクターpCMV-FLAG-PtGRm-POX(ペルオキシソーム局在化)、pCMV-FLAG-PtGRm-Nuc(核局在化)およびpCMV-FLAG-PtGRm-Cyto(細胞質局在化)を作製した。一方、EGFP(Clontech社)cDNAのC末端にSKL配列を融合し、これをCMVプロモーターの下流に挿入した発現ベクターpCMV-EGFP-POX(ペルオキシソーム局在化EGFP)を作製した。続いて35mm培養ディッシュに播種した培養繊維芽細胞NIH3T3に、pCMV-FLAG-PtGRm-POX 2μgとpCMV-EGFP-POX 0.2μg、pCMV-FLAG-PtGRm-Nuc 2μgとpAcGFP-Nuc(核局在化GFP、Clontech社)0.2μg、pCMV-FLAG-PtGRm-Cyto 2μgの組合わせで各発現ベクターをリポフェクション法(リポフェクトアミンプラス、Invitrogen社)により導入し、37℃で24時間培養した。発光イメージングは、200μMのD-ルシフェリンと10%牛血清を含むDMEM培地に交換後、冷却CCDカメラを搭載した発光イメージング装置(アトー(株)社 セルグラフ)を用い、40倍の対物レンズにて3分間発光を撮影した。改良型ヒカリコメツキルシフェラーゼの細胞内局在は、抗FLAG抗体(Sigma社)を用いた免疫染色により、またコトランスフェクションしたGFPの細胞内局在はGFP蛍光を共焦点顕微鏡(BioRad社)により観察した(図6)。抗FLAG抗体を用いた免疫染色あるいは局在化GFPによる蛍光イメージングにより、ペルオキシソーム局在化、核局在化および細胞質局在化改良型ヒカリコメツキルシフェラーゼがそれぞれのオルガネラに局在化することが確認された。一方、高倍率の対物レンズを用いた発光イメージングにより、3分間の露光で各オルガネラから発する顕著な発光シグナルが得られ、細胞内の各所での局在のイメージングが可能であることが明らかとなった。
【0065】
実施例7
細胞質局在化改良型ヒカリコメツキルシフェラーゼcDNAのN末端にマウスimportin a1 cDNA(GenBank No.D55720)を融合し、これをCMVプロモーターの下流に挿入した発現ベクターを作製した。続いてベクター2μgを、35mm培養ディッシュに播種した培養繊維芽細胞NIH3T3にリポフェクション法(リポフェクトアミンプラス)により導入し、37℃で3時間培養後、200μMのD-ルシフェリンと10%(w/v)の牛血清を含むDMEM培地に交換した。発光イメージングは発光イメージング装置(アトー(株)社 セルグラフ)を用い、40倍の対物レンズにて3分間露光、4分間隔で撮影した(図7)。発光イメージングにより、importin a1が約30分間隔で核内と細胞質の輸送を繰り返すことが確認され、タンパク質の細胞内局在の変化を連続してイメージング可能なことがわかる。
【0066】
実施例8 AP1応答配列、NFκB応答配列を含むプラスミドの構築
pSLG-HSVtk control(東洋紡績)を鋳型として、オリゴヌクレオチド1、2(シグマ アルドリッチ ジャパン社)(配列番号9、10)、PCR酵素KOD -plus-(東洋紡績)を用いて、Herpes simplex virus thymidine kinase (HSVtk) 由来のプロモーター配列を増幅した。オリゴヌクレオチドの5’末端には、制限酵素Spe I、EcoR Vの認識配列が付加されている。 このPCR産物、pELuc-test(東洋紡績、配列番号2のPtGRm遺伝子搭載ベクター)をそれぞれ制限酵素Spe I、EcoR V(東洋紡績)で分解し、Ligation high(東洋紡績)を用いてライゲーション反応を行い、HSVtkプロモーターをpELuc-testのPtGRm遺伝子上流に挿入した(pPtGRm-HSVtk)。続いて、オリゴヌクレオチド3(シグマ アルドリッチ ジャパン社)(配列番号11)とそれに相補的なオリゴヌクレオチド4(シグマ アルドリッチ ジャパン社)(配列番号12)、オリゴヌクレオチド5(シグマ アルドリッチ ジャパン社)(配列番号13)とそれに相補的なオリゴヌクレオチド6(シグマ アルドリッチ ジャパン社)(配列番号14)をそれぞれアニーリングし、NFκB応答配列カセット、AP1応答配列カセットを作成した。
【0067】
それぞれのカセットは、一方に制限酵素Xho I、他方に制限酵素Bgl IIの切断面と相補鎖を形成するように構築されている。pPtGRm-HSVtkを制限酵素Xho I、Bgl II(東洋紡績)で分解し、HSVtkプロモーターの上流に前記カセットをそれぞれ挿入した(NFκB-PtGRm、AP1-PtGRm;図8)。つづいて、NFκB-PtGRm、AP1-PtGRmを制限酵素Xho I、Nco I(東洋紡績)で分解して、NFκB応答配列+HSVtkプロモーター+Kozak配列、AP1応答配列+HSVtkプロモーター+Kozak配列領域を切り出し、一方でpGL3-Basic(プロメガ社、ホタルルシフェラーゼLuc(+)搭載ベクター) を制限酵素Xho I、Nco Iで処理して、ホタルルシフェラーゼ遺伝子上流にNFκB応答配列+HSVtkプロモーター+Kozak配列、AP1応答配列+HSVtkプロモーター+Kozak配列を挿入した(NFκB-Luc(+)、pGL3-AP1-Luc(+))。
【0068】
前記AP1は、アクチベータータンパク質複合体(activator protein complex-1)の略でc-Junとc-Fosなどから構成される一連の転写因子複合体で、例えば、ホルボールエステル(TPA)によって誘導される多くの遺伝子(コラゲナーゼ、メタロチオネインIIA、ストロメライシンなど)のプロモーター領域に保存されたAP1応答配列モチーフ(TGACTCA)に結合して遺伝子の発現を促進することが知られている。NFκBは、TNFαや炎症性刺激に関係する転写因子として知られている。
【0069】
実施例9 HeLa S3細胞におけるAP1応答配列の解析
HeLa S3細胞を96ウェル白色不透明プレートに1ウェル当たり3×104cells (100μl)ずつ播種し、10% FCSを含むダルベッコ変法イーグル培地DMEM(日水製薬)中で培養した。翌日、プラスミドpEluc-AP1、pGL3-AP1をそれぞれ1ウェル当たり0.2μg(DMEM(FCS無添加)25μlで希釈)をLipofectamine 2000 transfection reagent(インビトロジェン社)0.5μl(DMEM 25μlで希釈)と混合し、DMEM+0.1% FCS 100μlで置換された細胞に添加し、24時間インキュベートすることによって遺伝子導入を行った。翌日、未添加、0.01μM TPA(Sigma)、0.1μM TPA、1μM TPAまたは10 ng/ml EGFを含むDMEM+0.1% FCS(さらに0.2mM D-luciferinを含む)に置換し、5時間インキュベートした。その後、プレートリーダー1420 ARVOMX(パーキンエルマー)を用いて、発光を測定した。結果を図9に示す。測定値グラフは読取り値を、誘導比グラフは読取り値をもとに、各コンストラクトについて無添加条件を1として各種濃度の薬剤添加条件の発現誘導比をプロットしている。本発明のルシフェラーゼにおいても各刺激に対し従来のルシフェラーゼと同様の変動が認められる一方で、およそ15倍の発光強度が認められた。
【0070】
実施例10 Jurkat細胞におけるNFκB応答配列の解析
Jurkat細胞を1×106cells (4 ml)になるように、0.1% FCSを含むRPMI1640培地(日水製薬)に懸濁し、1 mlずつに24ウェルプレートの4ウェルに分注した。プラスミドpEluc-NFκB、pGL3-NFκB、pEluc-AP1、pGL3-AP1をそれぞれ2μg(RPMI1640(FCS無添加)200μlで希釈)をLA2000(RPMI 1640(FCS無添加)200μlで希釈)と混合し、Jurkat細胞と混合し、24時間インキュベートすることによって遺伝子導入を行った。翌日、遺伝子導入されたJurkat細胞を50μlずつ白色透明プレートに分注した。つづいて、pEluc-NFκBまたはpGL3-NFκB、pEluc-AP1またはpGL3-AP1を導入されたJurkat細胞には、添加物なし、または種々濃度のTNFα(PEPROTECH)を含むRPMI+0.1% FCS(さらに0.4mM D-luciferinを含む)50μlを添加し、5時間インキュベートした。TNFαは最終濃度で0.01ng/ml、0.1ng/ml、1ng/ml、10ng/mlとなるように添加している。その後、プレートリーダー1420 ARVOMX(パーキンエルマー)を用いて、発光を測定した。
【0071】
NFκB応答配列を含むコンストラクトを用いてTNFα刺激に対する変動を調べた結果を図10に示す。測定値グラフは読取り値を、誘導比グラフは読取り値をもとに、各コンストラクトについて無添加条件を1として各種濃度の薬剤添加条件の発現誘導比をプロットしている。本発明のヒカリコメツキムシルシフェラーゼを用いた転写活性測定法においても各刺激に対し従来のルシフェラーゼを用いた転写活性測定法と同等以上の変動が認められる一方で、およそ30〜60倍の発光強度が認められた。
【0072】
AP1応答配列を含むコンストラクトを用いてTNFα刺激に対する変動を調べた結果を図11に示す。測定値グラフは読取り値を、誘導比グラフは読取り値をもとに、各コンストラクトについて無添加条件を1として各種濃度の薬剤添加条件の発現誘導比をプロットしている。本発明のヒカリコメツキムシルシフェラーゼを用いた転写活性測定法においてはホタルルシフェラーゼ測定法に比べ、およそ20〜30倍のシグナル強度が認められた。本発明の方法においても各刺激に対し従来のルシフェラーゼと同様、有意な変動が認められなかった一方で、ホタルルシフェラーゼ法ではバラツキの幅が大きく、遺伝子導入効率が低く、転写活性の低い被験配列の解析ではより精度の高い解析が可能であることが確認された。
【0073】
実施例11 ヒカリコメツキ由来ルシフェラーゼ
ヒカリコメツキ由来ルシフェラーゼ酵素標品は、ベクターpELuc-test(東洋紡)のルシフェラーゼ遺伝子PtGRmを大腸菌発現用ベクターに挿入し大腸菌で発現させ、組換え体として取得した。ホタルルシフェラーゼ酵素標品は、QuantiLum Recombinat Luciferase(Promega社、図中はfLucと記載)を用いた。それぞれの酵素標品について、15mM MgSO4、6mM EDTA、4mM CoenzymeA、1.2mM D-luciferin,6mM DTT、0.2% Nonidet P40、2mM ATP及び2μg/ml酵素標品の発光試薬を調製した。0.02mM, 0.2mM, 1mM ATP溶液100μlと100mM Hepes-NaOH pH6.6〜8.8 100μlを混合し発光を計測した。
【0074】
図12に発光測定値及びpH8.0における測定値をそれぞれのルシフェラーゼにおいて100として、各pHの相対活性をプロットしたグラフを示す。この結果、ヒカリコメツキ由来ルシフェラーゼの方がpHによる変動が小さいことが明らかとなった。
【産業上の利用可能性】
【0075】
本発明は、細胞内をイメージングする発光量を増強したルシフェラーゼを提供する.本酵素を使用することで、細胞内のATP分布やオルガネラ局在等を可視化できる。これらは病態の治療,検査及び新薬開発に利用が可能である。
【0076】
本発明は、生細胞における転写活性測定方法を提供する。本発明の方法を使用することによって、特に、従来の方法では解析が困難であった、転写活性の弱いプロモーター系や、浮遊細胞や初代細胞などの遺伝子の一過的導入の効率が細胞系おいて、生細胞アッセイが可能になる。さらに、サンプル量の少ないプレートファオーマットでの解析も適用範囲を拡大できることから、遺伝子転写を指標としたシグナル伝達系などの解析、さらには化合物スクリーニングの系として利用することができ、創薬・医療などの産業界に寄与することが大である。
【特許請求の範囲】
【請求項1】
pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体であって、米国産Photinus pyralisホタルルシフェラーゼをコードする遺伝子構築体と比較して哺乳類細胞内の発光量が15倍以上高く、pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体が、哺乳類細胞における翻訳を効率化するために遺伝子配列を改変したものであり、改変前のpH非感受性ヒカリコメツキムシ・ルシフェラーゼ遺伝子が配列番号1で示されるものであり、前記遺伝子配列の改変が、下記のa)〜c):
a) 余分な転写因子が結合しないように、cDNAの配列を変えること、
b)cDNA配列における昆虫のコドンユーセージを哺乳類細胞用に変えること、
c)cDNAの制限酵素部位をなくすように変えること
の少なくとも1種を含む、遺伝子構築体。
【請求項2】
野生型のpH非感受性ヒカリコメツキムシ・ルシフェラーゼの遺伝子構築体と比較して哺乳類細胞における発光量が100倍以上高い、請求項1に記載の遺伝子構築体。
【請求項3】
ヒカリコメツキムシ・ルシフェラーゼがPyrophorus属、Pyrearinus属由来ルシフェラーゼからなる群より選択される、請求項1又は2に記載の遺伝子構築体。
【請求項4】
遺伝子構築体がpH非感受性ルシフェラーゼまたはそのN末端ドメイン配列もしくはC末端ドメイン配列と少なくとも1つの異種タンパク質またはタグ配列からなる融合タンパク質をコードすることを特徴とする請求項1〜3のいずれかに記載の遺伝子構築体。
【請求項5】
異種タンパク質またはタグ配列が細胞内局在化シグナルである請求項4に記載の遺伝子構築体。
【請求項6】
pH非感受性の前記ルシフェラーゼのN末端ドメイン部分と少なくとも1つの第一異種タンパク質からなる融合タンパク質をコードする請求項4に記載の遺伝子構築体。
【請求項7】
pH非感受性の前記ルシフェラーゼのC末端ドメイン部分と少なくとも1つの第二異種タンパク質からなる融合タンパク質をコードする請求項4に記載の遺伝子構築体。
【請求項8】
請求項6の遺伝子構築体と請求項7の遺伝子構築体との組合せ。
【請求項9】
請求項1〜7のいずれかに記載の遺伝子構築体または請求項8に記載の遺伝子構築体の組合せを用いて形質転換された形質転換哺乳類細胞。
【請求項10】
前記哺乳類細胞がヒト細胞である、請求項9に記載の形質転換哺乳類細胞。
【請求項1】
pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体であって、米国産Photinus pyralisホタルルシフェラーゼをコードする遺伝子構築体と比較して哺乳類細胞内の発光量が15倍以上高く、pH非感受性ヒカリコメツキムシ・ルシフェラーゼをコードする遺伝子構築体が、哺乳類細胞における翻訳を効率化するために遺伝子配列を改変したものであり、改変前のpH非感受性ヒカリコメツキムシ・ルシフェラーゼ遺伝子が配列番号1で示されるものであり、前記遺伝子配列の改変が、下記のa)〜c):
a) 余分な転写因子が結合しないように、cDNAの配列を変えること、
b)cDNA配列における昆虫のコドンユーセージを哺乳類細胞用に変えること、
c)cDNAの制限酵素部位をなくすように変えること
の少なくとも1種を含む、遺伝子構築体。
【請求項2】
野生型のpH非感受性ヒカリコメツキムシ・ルシフェラーゼの遺伝子構築体と比較して哺乳類細胞における発光量が100倍以上高い、請求項1に記載の遺伝子構築体。
【請求項3】
ヒカリコメツキムシ・ルシフェラーゼがPyrophorus属、Pyrearinus属由来ルシフェラーゼからなる群より選択される、請求項1又は2に記載の遺伝子構築体。
【請求項4】
遺伝子構築体がpH非感受性ルシフェラーゼまたはそのN末端ドメイン配列もしくはC末端ドメイン配列と少なくとも1つの異種タンパク質またはタグ配列からなる融合タンパク質をコードすることを特徴とする請求項1〜3のいずれかに記載の遺伝子構築体。
【請求項5】
異種タンパク質またはタグ配列が細胞内局在化シグナルである請求項4に記載の遺伝子構築体。
【請求項6】
pH非感受性の前記ルシフェラーゼのN末端ドメイン部分と少なくとも1つの第一異種タンパク質からなる融合タンパク質をコードする請求項4に記載の遺伝子構築体。
【請求項7】
pH非感受性の前記ルシフェラーゼのC末端ドメイン部分と少なくとも1つの第二異種タンパク質からなる融合タンパク質をコードする請求項4に記載の遺伝子構築体。
【請求項8】
請求項6の遺伝子構築体と請求項7の遺伝子構築体との組合せ。
【請求項9】
請求項1〜7のいずれかに記載の遺伝子構築体または請求項8に記載の遺伝子構築体の組合せを用いて形質転換された形質転換哺乳類細胞。
【請求項10】
前記哺乳類細胞がヒト細胞である、請求項9に記載の形質転換哺乳類細胞。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−161329(P2012−161329A)
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願番号】特願2012−94893(P2012−94893)
【出願日】平成24年4月18日(2012.4.18)
【分割の表示】特願2006−306536(P2006−306536)の分割
【原出願日】平成18年11月13日(2006.11.13)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【Fターム(参考)】
【公開日】平成24年8月30日(2012.8.30)
【国際特許分類】
【出願日】平成24年4月18日(2012.4.18)
【分割の表示】特願2006−306536(P2006−306536)の分割
【原出願日】平成18年11月13日(2006.11.13)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【Fターム(参考)】
[ Back to top ]

