エレクトロニック・バイオサイエンシーズ・エルエルシーにより出願された特許
1 - 5 / 5
電解検知システムにおけるポリマーの制御される転位
遮断シグナルを測定する電解検知システム1が、DNA18’等の流体チャネル16、16’を通じる分子18の制御される転位を可能にする。DC電源23が供給する実質的に一定の電界が流体チャネル16、16’にわたって印加され、システム1内の分子18の転位を誘発する。AC電源22、22’が供給する振動電気パラメータ(例えば電流又は電圧)も遮断シグナルを測定する手段として流体チャネル16、16’にわたって印加される。実質的に一定の電界を変更して、分子18のより詳細な制御を提供し、任意選択的に分子18の選択された部分をチャネル16、16’に複数回通して多数のシグナル測定値を提供できる。温度制御ステージ14がこのシステムを冷却し、分子転位のさらなる制御を提供する。変性又は非変性タンパク質孔38を流体チャネル16、16’内で利用できる。本システムにより長いDNA181鎖を増幅を用いずに迅速にシークエンシング可能になる。  (もっと読む)
(もっと読む)
電解質系内の時変イオン電流を検知するための方法及び装置
バリア構造5(11、12’、111)で分離された第1の流体チャンバ(4、4’、104)及び第2の流体チャンバ(8、8’’、108)を有する電解質系(2、2’、2‘’)内で時変イオン電流を検知するための装置及び方法であって、バリア構造(11、12’、111)は、厚壁(12.112)と、オリフィス(22、22’、122)を有する基板(14、114)とを含み、第1(4、41’、104)の流体チャンバ及び第2(8、8’、108)の流体チャンバが、オリフィス(22、22’、122)を介して連通する、装置及び方法が提供される。電位が、第1(4、4’、104)の流体チャンバ及び第2(8、8’、108)の流体チャンバの各流体チャンバ内の電極(18、19、118、119)の間に印加され、それによって、電流がオリフィス(22、22’、122)を通じて電極間で駆動される。システムの総静電容量は10pF未満である。 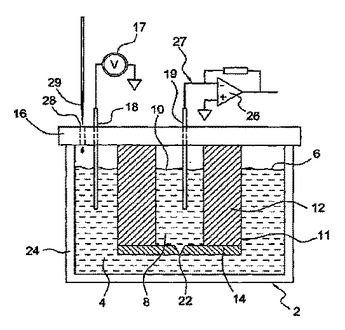 (もっと読む)
(もっと読む)
検体の生体指紋を生成するための集積化感知アレイ
電子感知素子(20、21、22)の集積アレイ(37)は、検体の生体指紋を出力する。システム(10)は、好ましくは、一続きの3層(35、75、100)からなるが、そのように5配列する必要はない。上層(100)は、流体体積又は検体槽(40)を定め、中層(35)は、感知素子(20、21、22)を含み、第3層(75)は、電子的読出し素子を含む。検体槽(40)は、電解質及び検出すべき検体を含む。感知素子(20、21、22)は、最小の応答時間で、最大10の検出感度となるように最適化される。それぞれの感知素子(20、21、22)の応答は、専用感知電極(30、31、32)により読み出される。それぞれの電極(30、31、32)の周りに制御リング70がある。制御リング(70)の電位は、注目する検体を感知素子(20、21、22)に引き付けるように設定される。  (もっと読む)
(もっと読む)
細胞又はニューロンの電位を非侵襲的に検出するための回路及び方法
細胞によって放射された電位を非侵襲的に測定するためのシステム及び方法。これを実行するため、信号を受け取るためにプローブが、細胞から10ミクロン以内に配置される。更に細胞の環境の基準電位が、決定される。センサは、この信号を記録し、基準電位をこの細胞の信号と比較して、この細胞の電位を測定する。  (もっと読む)
(もっと読む)
イオン・チャネルを通過する時変電流を検出するための方法及び装置
容量性検出システム(2、2’、2”)は、イオン・チャネル又はタンパク質細孔などのチャネル(50)を通過する時変イオン電流を測定するために使用される。そのような容量性システム(2、2’、2”)は、電極腐食の問題を被らず、イオン濃度の増加を制御する方法と共に使用されるとき、ナノメートルの規模の寸法を有するチャネル(50)のまわりで測定ボリューム(10、20)の使用を可能にする。 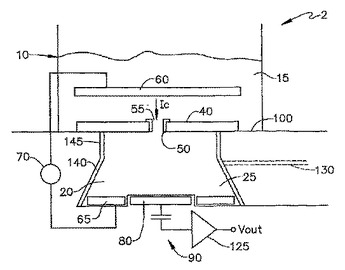 (もっと読む)
(もっと読む)
1 - 5 / 5
[ Back to top ]

