アトピー性皮膚炎の治療用軟膏製剤
【課題】タクロリムス水和物を含有し、長期保存後もタクロリムス残存率が高く、保存安定性に優れ、プロトピック軟膏と実質的に同等の皮膚吸収性を有するアトピー性皮膚炎の治療用軟膏製剤を提供すること。
【解決手段】タクロリムス水和物とトリアセチンとを含有し、タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書を添付していることを特徴とする、アトピー性皮膚炎の治療用軟膏製剤。
【解決手段】タクロリムス水和物とトリアセチンとを含有し、タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書を添付していることを特徴とする、アトピー性皮膚炎の治療用軟膏製剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アトピー性皮膚炎の治療用軟膏製剤に関する。
【背景技術】
【0002】
従来、タクロリムス水和物を有効成分として含有するアトピー性皮膚炎治療剤として、プロトピック軟膏が知られている。プロトピック軟膏では、溶剤として炭酸プロピレンが用いられている(特許文献1、非特許文献1)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第2526752号
【非特許文献1】2008年8月改訂(第10版)アステラス製薬株式会社発行「プロトピック軟膏0.1%」添付文書
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明の課題は、タクロリムス水和物を含有し、長期保存後もタクロリムス残存率が高く、保存安定性に優れ、プロトピック軟膏と実質的に同等の皮膚吸収性を有するアトピー性皮膚炎の治療用軟膏製剤を提供することである。
【課題を解決するための手段】
【0005】
本発明者らは、上記課題を解決するために、医薬分野で使用されうる極めて多数の溶剤、溶解補助剤、安定化剤、界面活性剤等の医薬製剤のための添加剤と、タクロリムス水和物との組み合わせを含む軟膏剤を試製し、その薬剤性状を詳しく検討した結果、驚くべきことに、タクロリムス水和物とトリアセチンとを含有することを特徴とする軟膏剤が上記本発明の課題を解決することを見出し、さらに鋭意検討を重ねて、本発明を完成するに至った。
【0006】
すなわち、本発明は、
(1) タクロリムス水和物とトリアセチンとを含有し、タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書を添付していることを特徴とする、アトピー性皮膚炎の治療用軟膏製剤、
(2) タクロリムス水和物を軟膏基剤全体に対してタクロリムスとして約0.01〜1%(w/w)を含有することを特徴とする(1)記載の製剤、
(3) トリアセチンを軟膏基剤全体に対して約1〜10%(w/w)を含有することを特徴とする(1)又は(2)記載の製剤、に関する。
【発明の効果】
【0007】
本発明によれば、長期保存後もタクロリムス残存率が高く、保存安定性に優れ、プロトピック軟膏と実質的に同等の皮膚吸収性を有するアトピー性皮膚炎の治療用軟膏製剤が提供される。
【図面の簡単な説明】
【0008】
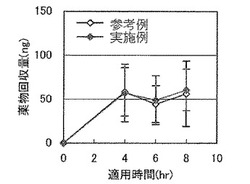
【図1】実施例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間とタクロリムス回収量との関係を表す図である。
【図2】比較例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間とタクロリムス回収量との関係を表す図である。
【発明を実施するための形態】
【0009】
以下、本発明を詳細に説明する。
本発明の軟膏製剤のアトピー性皮膚炎の治療のための有効成分は、タクロリムス水和物である。タクロリムス水和物は、本願出願日前公知の化合物である。本発明において使用されるタクロリムス水和物は、公知の製造方法に従って製造されてよい。例えば、特許第2526752号参照。
本発明に使用されるトリアセチンは、グリセリルトリアセタートとも称され、医薬製剤における可塑剤、基剤、コーティング剤などとして市販されているので、本発明においては、そのような市販されているトリアセチンを使用してもよいし、公知方法に従って製造されたものであってもよい。
タクロリムス水和物の本発明の軟膏製剤全体に対する使用量は、通常はタクロリムスとして約0.01〜1%(w/w)程度であり、好ましくは大人用軟膏としては、約0.1%(w/w)であり、小児用軟膏としては、約0.03%(w/w)である。
トリアセチンの本発明の軟膏製剤全体に対する使用量は、通常は約1〜10%(w/w)程度であり、好ましくは約2〜8%(w/w)である。
【0010】
本発明の軟膏は、所望によりタクロリムス水和物及びトリアセチン以外の成分を含んでいてもよい。そのようなタクロリムス水和物及びトリアセチン以外の成分として、例えば、湿潤剤、増粘剤、乳化剤、着色剤、芳香剤、抗酸化剤、安定剤、抗炎症剤、殺菌剤、防腐剤、油性物質などを含んでいてもよい。
湿潤剤としては、例えば、尿素、グリセリン、プロピレングリコール、ソルビトール、酵素などが挙げられる。
増粘剤としては、ポリビニルアルコール、ポリビニルピロリドン、ヒプロメロース、ヒドロキシプロピルセルロース、カルボキシビニルポリマー、キサンタンガムなどが挙げられる。
乳化剤としては、例えば、ベントナイト、ケイ酸アルミニウムマグネシウムなどが挙げられる。
着色剤としては、例えば、カラメル、タルク、医薬品等に使用することができるタール色素などが挙げられる。
【0011】
芳香剤としては、例えば、カンフル、サリチル酸メチルなどが挙げられる。
抗酸化剤としては、例えば、アスコルビン酸、ジブチルヒドロキシトルエン、トコフェロール酢酸エステルなどが挙げられる。
安定剤としては、例えば、サリチル酸エチレングリコール、エデト酸ナトリウムなどが挙げられる。
抗炎症剤としては、例えば、デキサメタゾン、デキサメタゾン硫酸ナトリウム、ハイドロコーチゾンなどが挙げられる。
殺菌剤としては、例えば、ヨウ素剤、エタノールなどが挙げられる。
防腐剤としては、例えば、ソルビン酸、パラベン類などが挙げられる。
油性物質としては、炭化水素類(流動パラフィン、ワセリン、スクワラン、パラフィンなど)、動・植物油(サラシミツロウ、カルナウバロウ、ラノリンなど)、高級脂肪酸(パルミチン酸、ステアリン酸、オレイン酸など)、脂肪族高級アルコール(セタノール、ステアリルアルコールなど)などが挙げられる。
【0012】
本発明の軟膏は、上記の成分を公知手段に従って混合することによって製造される。混合するための手段としては、どのようなものでもよいが、例えば、ホモミキサーなどの高速撹拌機が便宜に使用される。
本発明の軟膏をアトピー患者に対して、1日1〜2回適量を患部に塗布する。なお、1回あたりの塗布量は5gまでとするのが好ましい。
タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書が添付されている軟膏製剤であることが、本発明に欠くことができない必須の構成要件である。そのような文書は、例えば、医薬品の添付文書、現品説明書、使用説明書、インタビューフォームなど、どのような文書でもよいし、そのようなことを記載した包装箱、軟膏容器などでもよい。包装箱としては、例えば、紙箱が挙げられる。紙箱は、ナイロン、ポリエチレンなどでラミネート加工されていてもよい。軟膏容器としては、例えば、軟膏ツボ、押し出し式のチューブ、クリームジャーなどが挙げられる。軟膏容器の材質としては、例えば、プラスチック(ポリエチレン、ポリプロピレンなど)、金属(アルミニウム、ステンレス)、ガラスなどが挙げられる。更に、金属については、その表面がエポキシ樹脂などによりラミネート加工されていてもよい。
【実施例】
【0013】
[薬剤の調製]
下記表1の処方に従って、実施例、及び比較例1〜6の薬剤を調製した。以下において含有量を示す%は、特に断りのない限り質量%を示す。
【0014】
【表1】

【0015】
タクロリムス水和物(New Drug Research & Development Co.,Ltd製)を各溶剤(トリアセチン、N−メチル−2−ピロリドン、マクロゴール400、ベンジルアルコール、トリイソオクタン酸グリセリン、トリ(カプリル・カプリン酸)グリセリン、又はプロピレングリコール脂肪酸エステル)に60〜70℃で加温溶解して主薬溶解相(I液)とした。白色ワセリン、流動パラフィン、パラフィン、及びサラシミツロウを70〜80℃で加温溶解後、60℃まで冷却して基剤相成分(II液)とした。パドル200rpmで撹拌しながら、I液をII液に加え、乳化試験機ET−3A型(日光ケミカルズ株式会社製)にて60℃で10分間混合した後、35℃以下になるまで200rpmで撹拌冷却して薬剤を得た。
【0016】
[安定性試験]
上記実施例、及び比較例1〜6の薬剤を試料として用いて、安定性試験を行った。また、参考例として、プロトピック軟膏0.1%(アステラス製薬株式会社製)を用いた。プロトピック軟膏0.1%は、タクロリムスを100g中0.102g含有し、さらに白色ワセリン、流動パラフィン、パラフィン、サラシミツロウ、及び炭酸プロピレンを含有する。
100gのポリエチレン製容器内に40℃/75%RH(相対湿度)、又は50℃条件下で上記薬剤を1カ月保存したときのタクロリムス残存量を高速液体クロマトグラフ(HPLC)により測定した。なお、参考例のプロトピック軟膏0.1%は、5gアルミニウムチューブ中で保存した。
【0017】
試料5gにテトラヒドロフラン90mLを加え、50℃で5分間加温した。振とう後、溶液が白濁するまで室温放置して、15分間超音波処理した。内標準溶液(ベンゾ[a]アントラセン5mgをテトラヒドロフランに溶解し、100mLとしたもの)10mLを添加し、さらに振とうした。20℃、3000rpmで5分間遠心分離を行った後、上澄み液中のタクロリムス含量をHPLCにより以下の条件で測定した。
測定装置:株式会社島津製作所製、Waters Corporation製
カラム:CAPCELLPAK MGII(4.6mmφ×250mm、5μm、資生堂社製)
カラム温度:50℃
測定波長:215nm
注入量:10μL
移動相:アセトニトリル/0.01%トリフルオロ酢酸溶液混液(3:2)
流量:約1mL/min
測定回数:3回
保存前のタクロリムス含量に対する1ヶ月保存後のタクロリムス含量の残存率を求めた。結果を下記表2及び表3に示す。
【0018】
【表2】

【0019】
【表3】

溶剤としてトリアセチンを用いた実施例の薬剤では、40℃/75%RH条件下で保存後の安定性は、参考例のプロトピック軟膏とほぼ同等であった。また、50℃保存後の安定性は、比較例1〜6に比べて非常に良好であった。
【0020】
[皮内薬物動態試験]
上記実施例、比較例1〜6、及び参考例の薬剤について、薬物動態試験を実施した。
適用時間:2、4、6、8時間
被験者:18人(20代男性1人、30代男性5人、40代男性4人、50代男性5人、60代男性3人)
被験者の背部に試料製剤10mgを塗布し、各適用時間後、コットンで薬剤を拭き取って粘着テープを貼付した。貼付箇所を加圧後、粘着テープを剥離した。合計22枚の粘着テープについて、貼付及び剥離を繰り返した。最初の2枚を破棄し、続く20枚をサンプリングした。20枚の粘着テープを10mLのアセトニトリルに浸漬し、10分間超音波処理した。更に10分間振とう後、3000rpmで5分間遠心分離を行い、0.45μmのフィルターでろ過して試料溶液を得た。液体クロマトグラフ-タンデム質量分析(LC−MS/MS)により以下の条件でタクロリムス回収量を測定した。
【0021】
測定装置:HPLC(株式会社島津製作所製)、MS/MS(Thermo Fisher Scientific Incorporated製)
カラム:Inertsil ODS-3(3μm、2.1mmφ×50mm(GLサイエンス社製)
温度:50℃
移動相:0.1%酢酸水溶液/アセトニトリル混液(1:1)
流量:0.6mL/min
注入量:20μL
イオン化法:positive ESI
結果を図1及び図2に示す。図1は、本発明の実施例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間(経過時間)とタクロリムス回収量(ng)との関係を表す。これにより、本発明の製剤がプロトピック軟膏と実質的に同等の皮膚吸収性を有することがわかる。
図2は、比較例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間(経過時間)とタクロリムス回収量(ng)との関係を表す。比較例の製剤とタクロリムス軟膏とでは皮膚吸収性において有意差が見られた。
【技術分野】
【0001】
本発明は、アトピー性皮膚炎の治療用軟膏製剤に関する。
【背景技術】
【0002】
従来、タクロリムス水和物を有効成分として含有するアトピー性皮膚炎治療剤として、プロトピック軟膏が知られている。プロトピック軟膏では、溶剤として炭酸プロピレンが用いられている(特許文献1、非特許文献1)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特許第2526752号
【非特許文献1】2008年8月改訂(第10版)アステラス製薬株式会社発行「プロトピック軟膏0.1%」添付文書
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明の課題は、タクロリムス水和物を含有し、長期保存後もタクロリムス残存率が高く、保存安定性に優れ、プロトピック軟膏と実質的に同等の皮膚吸収性を有するアトピー性皮膚炎の治療用軟膏製剤を提供することである。
【課題を解決するための手段】
【0005】
本発明者らは、上記課題を解決するために、医薬分野で使用されうる極めて多数の溶剤、溶解補助剤、安定化剤、界面活性剤等の医薬製剤のための添加剤と、タクロリムス水和物との組み合わせを含む軟膏剤を試製し、その薬剤性状を詳しく検討した結果、驚くべきことに、タクロリムス水和物とトリアセチンとを含有することを特徴とする軟膏剤が上記本発明の課題を解決することを見出し、さらに鋭意検討を重ねて、本発明を完成するに至った。
【0006】
すなわち、本発明は、
(1) タクロリムス水和物とトリアセチンとを含有し、タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書を添付していることを特徴とする、アトピー性皮膚炎の治療用軟膏製剤、
(2) タクロリムス水和物を軟膏基剤全体に対してタクロリムスとして約0.01〜1%(w/w)を含有することを特徴とする(1)記載の製剤、
(3) トリアセチンを軟膏基剤全体に対して約1〜10%(w/w)を含有することを特徴とする(1)又は(2)記載の製剤、に関する。
【発明の効果】
【0007】
本発明によれば、長期保存後もタクロリムス残存率が高く、保存安定性に優れ、プロトピック軟膏と実質的に同等の皮膚吸収性を有するアトピー性皮膚炎の治療用軟膏製剤が提供される。
【図面の簡単な説明】
【0008】
【図1】実施例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間とタクロリムス回収量との関係を表す図である。
【図2】比較例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間とタクロリムス回収量との関係を表す図である。
【発明を実施するための形態】
【0009】
以下、本発明を詳細に説明する。
本発明の軟膏製剤のアトピー性皮膚炎の治療のための有効成分は、タクロリムス水和物である。タクロリムス水和物は、本願出願日前公知の化合物である。本発明において使用されるタクロリムス水和物は、公知の製造方法に従って製造されてよい。例えば、特許第2526752号参照。
本発明に使用されるトリアセチンは、グリセリルトリアセタートとも称され、医薬製剤における可塑剤、基剤、コーティング剤などとして市販されているので、本発明においては、そのような市販されているトリアセチンを使用してもよいし、公知方法に従って製造されたものであってもよい。
タクロリムス水和物の本発明の軟膏製剤全体に対する使用量は、通常はタクロリムスとして約0.01〜1%(w/w)程度であり、好ましくは大人用軟膏としては、約0.1%(w/w)であり、小児用軟膏としては、約0.03%(w/w)である。
トリアセチンの本発明の軟膏製剤全体に対する使用量は、通常は約1〜10%(w/w)程度であり、好ましくは約2〜8%(w/w)である。
【0010】
本発明の軟膏は、所望によりタクロリムス水和物及びトリアセチン以外の成分を含んでいてもよい。そのようなタクロリムス水和物及びトリアセチン以外の成分として、例えば、湿潤剤、増粘剤、乳化剤、着色剤、芳香剤、抗酸化剤、安定剤、抗炎症剤、殺菌剤、防腐剤、油性物質などを含んでいてもよい。
湿潤剤としては、例えば、尿素、グリセリン、プロピレングリコール、ソルビトール、酵素などが挙げられる。
増粘剤としては、ポリビニルアルコール、ポリビニルピロリドン、ヒプロメロース、ヒドロキシプロピルセルロース、カルボキシビニルポリマー、キサンタンガムなどが挙げられる。
乳化剤としては、例えば、ベントナイト、ケイ酸アルミニウムマグネシウムなどが挙げられる。
着色剤としては、例えば、カラメル、タルク、医薬品等に使用することができるタール色素などが挙げられる。
【0011】
芳香剤としては、例えば、カンフル、サリチル酸メチルなどが挙げられる。
抗酸化剤としては、例えば、アスコルビン酸、ジブチルヒドロキシトルエン、トコフェロール酢酸エステルなどが挙げられる。
安定剤としては、例えば、サリチル酸エチレングリコール、エデト酸ナトリウムなどが挙げられる。
抗炎症剤としては、例えば、デキサメタゾン、デキサメタゾン硫酸ナトリウム、ハイドロコーチゾンなどが挙げられる。
殺菌剤としては、例えば、ヨウ素剤、エタノールなどが挙げられる。
防腐剤としては、例えば、ソルビン酸、パラベン類などが挙げられる。
油性物質としては、炭化水素類(流動パラフィン、ワセリン、スクワラン、パラフィンなど)、動・植物油(サラシミツロウ、カルナウバロウ、ラノリンなど)、高級脂肪酸(パルミチン酸、ステアリン酸、オレイン酸など)、脂肪族高級アルコール(セタノール、ステアリルアルコールなど)などが挙げられる。
【0012】
本発明の軟膏は、上記の成分を公知手段に従って混合することによって製造される。混合するための手段としては、どのようなものでもよいが、例えば、ホモミキサーなどの高速撹拌機が便宜に使用される。
本発明の軟膏をアトピー患者に対して、1日1〜2回適量を患部に塗布する。なお、1回あたりの塗布量は5gまでとするのが好ましい。
タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書が添付されている軟膏製剤であることが、本発明に欠くことができない必須の構成要件である。そのような文書は、例えば、医薬品の添付文書、現品説明書、使用説明書、インタビューフォームなど、どのような文書でもよいし、そのようなことを記載した包装箱、軟膏容器などでもよい。包装箱としては、例えば、紙箱が挙げられる。紙箱は、ナイロン、ポリエチレンなどでラミネート加工されていてもよい。軟膏容器としては、例えば、軟膏ツボ、押し出し式のチューブ、クリームジャーなどが挙げられる。軟膏容器の材質としては、例えば、プラスチック(ポリエチレン、ポリプロピレンなど)、金属(アルミニウム、ステンレス)、ガラスなどが挙げられる。更に、金属については、その表面がエポキシ樹脂などによりラミネート加工されていてもよい。
【実施例】
【0013】
[薬剤の調製]
下記表1の処方に従って、実施例、及び比較例1〜6の薬剤を調製した。以下において含有量を示す%は、特に断りのない限り質量%を示す。
【0014】
【表1】

【0015】
タクロリムス水和物(New Drug Research & Development Co.,Ltd製)を各溶剤(トリアセチン、N−メチル−2−ピロリドン、マクロゴール400、ベンジルアルコール、トリイソオクタン酸グリセリン、トリ(カプリル・カプリン酸)グリセリン、又はプロピレングリコール脂肪酸エステル)に60〜70℃で加温溶解して主薬溶解相(I液)とした。白色ワセリン、流動パラフィン、パラフィン、及びサラシミツロウを70〜80℃で加温溶解後、60℃まで冷却して基剤相成分(II液)とした。パドル200rpmで撹拌しながら、I液をII液に加え、乳化試験機ET−3A型(日光ケミカルズ株式会社製)にて60℃で10分間混合した後、35℃以下になるまで200rpmで撹拌冷却して薬剤を得た。
【0016】
[安定性試験]
上記実施例、及び比較例1〜6の薬剤を試料として用いて、安定性試験を行った。また、参考例として、プロトピック軟膏0.1%(アステラス製薬株式会社製)を用いた。プロトピック軟膏0.1%は、タクロリムスを100g中0.102g含有し、さらに白色ワセリン、流動パラフィン、パラフィン、サラシミツロウ、及び炭酸プロピレンを含有する。
100gのポリエチレン製容器内に40℃/75%RH(相対湿度)、又は50℃条件下で上記薬剤を1カ月保存したときのタクロリムス残存量を高速液体クロマトグラフ(HPLC)により測定した。なお、参考例のプロトピック軟膏0.1%は、5gアルミニウムチューブ中で保存した。
【0017】
試料5gにテトラヒドロフラン90mLを加え、50℃で5分間加温した。振とう後、溶液が白濁するまで室温放置して、15分間超音波処理した。内標準溶液(ベンゾ[a]アントラセン5mgをテトラヒドロフランに溶解し、100mLとしたもの)10mLを添加し、さらに振とうした。20℃、3000rpmで5分間遠心分離を行った後、上澄み液中のタクロリムス含量をHPLCにより以下の条件で測定した。
測定装置:株式会社島津製作所製、Waters Corporation製
カラム:CAPCELLPAK MGII(4.6mmφ×250mm、5μm、資生堂社製)
カラム温度:50℃
測定波長:215nm
注入量:10μL
移動相:アセトニトリル/0.01%トリフルオロ酢酸溶液混液(3:2)
流量:約1mL/min
測定回数:3回
保存前のタクロリムス含量に対する1ヶ月保存後のタクロリムス含量の残存率を求めた。結果を下記表2及び表3に示す。
【0018】
【表2】

【0019】
【表3】

溶剤としてトリアセチンを用いた実施例の薬剤では、40℃/75%RH条件下で保存後の安定性は、参考例のプロトピック軟膏とほぼ同等であった。また、50℃保存後の安定性は、比較例1〜6に比べて非常に良好であった。
【0020】
[皮内薬物動態試験]
上記実施例、比較例1〜6、及び参考例の薬剤について、薬物動態試験を実施した。
適用時間:2、4、6、8時間
被験者:18人(20代男性1人、30代男性5人、40代男性4人、50代男性5人、60代男性3人)
被験者の背部に試料製剤10mgを塗布し、各適用時間後、コットンで薬剤を拭き取って粘着テープを貼付した。貼付箇所を加圧後、粘着テープを剥離した。合計22枚の粘着テープについて、貼付及び剥離を繰り返した。最初の2枚を破棄し、続く20枚をサンプリングした。20枚の粘着テープを10mLのアセトニトリルに浸漬し、10分間超音波処理した。更に10分間振とう後、3000rpmで5分間遠心分離を行い、0.45μmのフィルターでろ過して試料溶液を得た。液体クロマトグラフ-タンデム質量分析(LC−MS/MS)により以下の条件でタクロリムス回収量を測定した。
【0021】
測定装置:HPLC(株式会社島津製作所製)、MS/MS(Thermo Fisher Scientific Incorporated製)
カラム:Inertsil ODS-3(3μm、2.1mmφ×50mm(GLサイエンス社製)
温度:50℃
移動相:0.1%酢酸水溶液/アセトニトリル混液(1:1)
流量:0.6mL/min
注入量:20μL
イオン化法:positive ESI
結果を図1及び図2に示す。図1は、本発明の実施例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間(経過時間)とタクロリムス回収量(ng)との関係を表す。これにより、本発明の製剤がプロトピック軟膏と実質的に同等の皮膚吸収性を有することがわかる。
図2は、比較例の製剤、及びプロトピック軟膏(参考例)の人体皮膚塗布後の適用時間(経過時間)とタクロリムス回収量(ng)との関係を表す。比較例の製剤とタクロリムス軟膏とでは皮膚吸収性において有意差が見られた。
【特許請求の範囲】
【請求項1】
タクロリムス水和物とトリアセチンとを含有し、タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書を添付していることを特徴とする、アトピー性皮膚炎の治療用軟膏製剤。
【請求項2】
タクロリムス水和物を軟膏基剤全体に対してタクロリムスとして約0.01〜1%(w/w)を含有することを特徴とする請求項1記載の製剤。
【請求項3】
トリアセチンを軟膏基剤全体に対して約1〜10%(w/w)を含有することを特徴とする請求項1又は2記載の製剤。
【請求項1】
タクロリムス水和物とトリアセチンとを含有し、タクロリムスの人体経皮吸収がプロトピック軟膏と実質的に同等であることが記載された文書を添付していることを特徴とする、アトピー性皮膚炎の治療用軟膏製剤。
【請求項2】
タクロリムス水和物を軟膏基剤全体に対してタクロリムスとして約0.01〜1%(w/w)を含有することを特徴とする請求項1記載の製剤。
【請求項3】
トリアセチンを軟膏基剤全体に対して約1〜10%(w/w)を含有することを特徴とする請求項1又は2記載の製剤。
【図1】


【図2】




【図2】


【公開番号】特開2010−202546(P2010−202546A)
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願番号】特願2009−48382(P2009−48382)
【出願日】平成21年3月2日(2009.3.2)
【出願人】(592235075)大正薬品工業株式会社 (11)
【出願人】(000158219)岩城製薬株式会社 (4)
【Fターム(参考)】
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願日】平成21年3月2日(2009.3.2)
【出願人】(592235075)大正薬品工業株式会社 (11)
【出願人】(000158219)岩城製薬株式会社 (4)
【Fターム(参考)】
[ Back to top ]

