コロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法
【課題】目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することを可能とするコロニーピッキング方法を提供する。
【解決手段】本発明に係るコロニーピッキング方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程S10と、前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程S20とを含むことを特徴とする。
【解決手段】本発明に係るコロニーピッキング方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程S10と、前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程S20とを含むことを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、目的とする分化形質を保持するモノクローナルな融合細胞を作製するためのコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法に関する。
【背景技術】
【0002】
従来、抗体産生や生理活性物質産生といった、目的とする分化形質を保持するモノクローナルな融合細胞は、以下のような作製方法によって作製されている。
例えば、モノクローナル抗体を産生するハイブリドーマ(雑種細胞;hybridoma)のクローンを作製する場合を例にとって説明すると、
(A)目的とする抗原を接種して免疫された動物の脾臓細胞に含まれるB細胞と、ミエローマ細胞株などの腫瘍細胞とを、ポリエチレングリコールなどの細胞融合誘起物質を用いて細胞融合させ、ハイブリドーマを複数作製する工程、
(B)複数作製した前記ハイブリドーマを96ウェル(穴)プレート(例えば、100〜200μL/ウェル)の各ウェルに入れられたHAT(ヒポキサンチン、アミノプリテン及びチミジン)を含む培地などの選択培地で選択培養して、各ハイブリドーマに由来するコロニーを複数有するコロニー群を1つ以上得る工程、
(C)1つ以上得られたコロニー群の中から、目的とする抗原と結合する抗体を産生するハイブリドーマのコロニーを有するコロニー群を、FACS法(fluorescence activated cell sorting)などのフローサイトメトリー法やELISA法(enzyme-linked immunosorbent assay)などによってスクリーニング(一般的に1次スクリーニング(1st screening)と呼ばれている)する工程、
(D)1次スクリーニングで得られた陽性ウェルに含まれるハイブリドーマのコロニー群を24ウェルプレートにスケールアップ(例えば、1mL/ウェル)して培養する工程、
(E)24ウェルプレートで培養したハイブリドーマのコロニー群をFACS法などのフローサイトメトリー法やELISA法などによる再度のスクリーニング(一般的に2次スクリーニング(2nd screening)と呼ばれている)を行う工程、
(F)2次スクリーニングで得られた陽性ウェルからハイブリドーマのコロニーを採取し、限界希釈法などによってクローニングを行う工程、
(G)クローニングしたコロニーが単一細胞由来のものであるか否かのスクリーニングを行なう工程、
を順次行うことでモノクローナル抗体を産生するモノクローナルなハイブリドーマなどの融合細胞を作製している(例えば、非特許文献1参照)。
【発明の概要】
【発明が解決しようとする課題】
【0003】
しかしながら、従来から行われている作製方法では、例えば、前記(C)の工程や(E)の工程におけるスクリーニングによって得られた陽性ウェルが、例えば、目的としない分化形質を保持するハイブリドーマ(融合細胞)や目的とする分化形質を保持しないハイブリドーマなどの不必要なハイブリドーマを多数含んでいるため、継代を続けるうちに目的とする分化形質を保持するハイブリドーマが前記不必要なハイブリドーマとの生存競争に敗れてしまい、目的とする分化形質を保持するハイブリドーマが消失してしまうことがあった。また、染色体が脱落することによって目的とする分化形質を保持するハイブリドーマが消失してしまうこともあった。さらに、1セット7〜14日間を要する融合細胞の培養、スクリーニング及びクローニングの一連の作業を、シングルセルクローンを得るまでに複数回繰り返さなければならず、労力や時間的及び金銭的な負担が大きかった。
【0004】
これらに加え、従来から行われている作製方法では、前記(C)の工程や(E)の工程のスクリーニングにおいて、目的とする分化形質を保持するハイブリドーマ(融合細胞)のクローンの検体数が非常に多くなることがあり、目的とする分化形質を保持するハイブリドーマのシングルセルクローンを得るまでに、長いときでは半年近くもかかる場合があるなど、労力や時間的及び金銭的な負担が大きかった。
【0005】
本発明は、前記問題点に鑑みてなされたものであり、目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することを可能とするコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法を提供することを課題とする。
【課題を解決するための手段】
【0006】
前記課題を解決した本発明に係るコロニーピッキング方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程とを含むことを特徴としている。
【0007】
本発明に係るコロニーピッキング装置は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング装置であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞を、前記融合細胞の大きさの1〜40倍の大きさの内径を有する先端部を備えた細管体によってピッキングするピッキング手段と、前記細管体でピッキングした融合細胞を個別の培地にまき込むまき込み手段とを含むことを特徴としている。
【0008】
本発明に係る融合細胞クローン作製方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを作製するための融合細胞クローン作製方法であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程と、個別の培地にまき込んだ融合細胞を培養する培養工程とを含むことを特徴としている。
【発明の効果】
【0009】
本発明に係るコロニーピッキング方法によれば、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングし、当該ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込むため、継代を続けるうちに目的としない分化形質を保持する融合細胞などとの生存競争に敗れたり、染色体が脱落したりして、目的とする分化形質を保持する融合細胞が消失してしまうことを防ぐことができる。また、目的とする分化形質を保持する融合細胞のクローンの検体数が非常に多くなることを防ぐことができるため、労力や時間的及び金銭的な負担を少なくすることができる。
【0010】
本発明に係るコロニーピッキング装置によれば、ピッキング手段とまき込み手段とを備えているため、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞を、前記融合細胞の大きさの1〜40倍の大きさの内径を有する先端部を備えた細管体によってピッキングし、当該細管体でピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込むことができる。そのため、継代を続けるうちに目的としない分化形質を保持する融合細胞などとの生存競争に敗れたり、染色体が脱落したりして、目的とする分化形質を保持する融合細胞が消失してしまうことを防ぐことができる。また、目的とする分化形質を保持する融合細胞のクローンの検体数が非常に多くなることを防ぐことができるため、労力や時間的及び金銭的な負担を少なくすることができる。
【0011】
本発明に係る融合細胞クローン作製方法によれば、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングし、当該ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込み、培養する。つまり、陽性ウェル内の融合細胞のコロニーをスケールアップする操作を行わないで個別に培養するため、例えば増殖速度が遅いことなどにより、継代を続けるうちに目的としない分化形質を保持する融合細胞などとの生存競争に敗れたり、染色体が脱落したりして、目的とする分化形質を保持する融合細胞が消失してしまうことを防ぐことができる。そのため、目的とする分化形質を保持する融合細胞を確実に得ることができる。また、目的とする分化形質を保持する融合細胞のクローンの検体数が非常に多くなることを防ぐことができるため、労力や時間的及び金銭的な負担を少なくすることができる。
【図面の簡単な説明】
【0012】
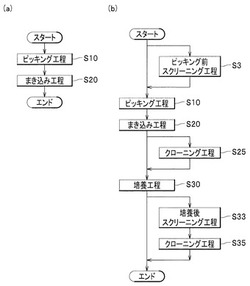
【図1】(a)は、本発明に係るコロニーピッキング方法の工程の内容を示すフローチャートであり、(b)は、本発明に係る融合細胞クローン作製方法の工程内用を示すフローチャートである。
【図2】(a)は、本発明に係るコロニーピッキング装置の具体的な構成例を説明する斜視図であり、(b)は、(a)のAの部分を拡大した拡大図である。
【図3】(a)及び(b)は、容器位置入換手段の構成例を説明する説明図である。
【図4】(a)及び(b)は、ピッキングした融合細胞を個別の培地に移す様子を説明する概念図である。
【発明を実施するための形態】
【0013】
以下、適宜図面を参照して、本発明に係るコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法について詳細に説明する。
なお、本発明は、目的とする分化形質を保持するモノクローナルな融合細胞を作製するためのコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法に係るものであるが、融合細胞を得るまでに必要な操作や融合細胞の取り扱い方法、融合細胞のクローニング方法などについて、発明を実施するための最良の形態及び実施例に特に説明がない場合には、例えば、非特許文献1や常用される標準的なプロトコール集に記載の方法、あるいはそれらを修飾したり、改変したりした方法を用いることができる。また、市販の試薬キットや測定装置を用いる場合には、特に説明が無い場合、それらに添付のプロトコールを用いることができる。また、当業者であれば本明細書の記載及び例えば、非特許文献1や標準的なプロトコール集などの記載から容易に本発明を再現することができる。
【0014】
まず、本発明に係るコロニーピッキング方法について説明する。
図1(a)に示すように、本発明に係るコロニーピッキング方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、ピッキング工程S10と、まき込み工程S20とを含んでなる。
なお、ピッキング工程S10を行う前の免疫、細胞融合、選択培地による選択培養、及び1次スクリーニングの各工程は、通常行われる手法により行うことができる。
【0015】
免疫は、例えば、ファージディスプレイ法によって抗原を提示させたファージを作製し、提示させた抗原を常法により単離し、これをマウスなどの被免疫動物に免疫することによって行うことができる。また、常法により精製した抗原をマウスなどの被免疫動物に免疫することによっても行うことができる。なお、免疫の際には、完全フロイントアジュバントや不完全フロイントアジュバントなどを用いることもできる。
【0016】
細胞融合は、例えば、目的とする分化形質を保持した生体細胞と、腫瘍細胞とを細胞融合させることにより行うことができる。なお、目的とする分化形質を保持した生体細胞は、目的とする分化形質を保持している細胞であればどのようなものでも用いることができる。例えば、目的とする分化形質が、特定の抗原に反応するモノクローナル抗体を産生する抗体産生である場合は、動物に対して目的とする抗原を接種して免疫した動物の脾臓の細胞(B細胞)を用いることができる。また例えば、目的とする分化形質が、リンホカインなどの生理活性物質を産生する生理活性物質産生である場合は、動物の胸腺の細胞(T細胞)を用いることができる。なお、動物に対する目的とする抗原の接種と、免疫した動物から脾臓の細胞の取得とは、常法により行うことができる。
【0017】
前記した細胞を得るための動物としては、マウス、ラット、ラビット、若しくはゴートなど、及び必要に応じて作製したこれらのノックアウト又は/及びトランスジェニック動物を用いることができる。例えば、マウスを用いる場合は、BALB/c系統のマウスを用いるのが好適である。これは、融合細胞を作製する際の腫瘍細胞として広く用いられているミエローマ細胞株がBALB/c系統のマウスを起源とするものが多いので、BALB/c系統のマウスから得られた分化形質を保持した生体細胞との相性がよいというメリットや、得られた融合細胞をBALB/c系統のマウスの腹腔内で増殖させることができるため、特別な処理なしで腹水から高濃度のモノクローナル抗体などを産生させることができるというメリットや入手が容易であるというメリットがあるためである。同様の観点から、例えば、ラットを用いる場合は、low系統のものを用いるのが好ましい。なお、前記した細胞を得るための動物は前記したものに限定されないことはいうまでもなく、前記した動物以外の動物や前記した系統以外の系統のものを用いることもできる。
【0018】
また、融合細胞を作製するために用いられる腫瘍細胞としては、in vivoでの増殖が盛んな腫瘍細胞であればどのような腫瘍細胞でも用いることができるが、融合細胞のスクリーニング効率の関係から、特定の組成を有するか又は有しない選択培地では生存できないものであって、免疫グロブリンを産生する能力が低い腫瘍細胞を用いるのが好ましい。かかる腫瘍細胞としては、例えば、チミジンキナーゼ(TK)或いはヒポキサンチングアニンホスホリボシルトランスフェラーゼ(HGPRT)を欠損させて、2つある核酸合成経路のうちサルベージ経路で核酸を生合成することができず、de novo経路でのみ核酸を生合成することができるマウスミエローマ細胞株NS−1などを好適に用いることができる。なお、本発明で用いることのできる腫瘍細胞としてはこれに限定されないことはいうまでもない。例えば、目的とする分化形質が特定の抗原に反応するラビットのモノクローナル抗体を産生する抗体産生である場合は、ラビットミエローマ細胞なども用いることができる。
【0019】
そして、分化形質を保持する生体細胞と腫瘍細胞の融合は、例えば、平均分子量1000〜6000程度、濃度30〜50%程度のポリエチレングリコールを用いたポリエチレングリコール法や、センダイウイルスによる細胞融合法又は電気パルスによる電気融合法といった任意の細胞融合手法により行うことができる。
【0020】
ここで、細胞融合を作製する際に用いることのできる培地としては、作製する融合細胞によって異なるが、例えば、マウスを用いて作製する融合細胞である場合は、HATを含むRPMI1640培地、HT(ヒポキサンチン及びチミジン)を含むRPMI1640培地、10%FCS(ウシ胎児血清)又は20%FBS(ウシ胎児血清)を含むか又は含まないRPMI1640培地を用いることができる。また、これらの培地に適宜の細胞増殖因子を加えたものを用いてもよい。融合細胞は、例えば、5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらい(直径約100〜1400μm程度)まで培養する。この間、培地は静置してもよく、また必要に応じて揺動装置等により揺動してもよい。
【0021】
前記した操作によって得られる融合細胞の中には、目的とする分化形質を保持しない融合細胞が相当数含まれている。そこで、目的とする分化形質を保持する融合細胞を効率よく検出するために選択培地による選択培養を行う。
【0022】
選択培地による選択培養は、特定の組成を有する選択培地を用いることによって行うことができる。特定の組成を有する選択培地は、融合細胞作製時と同様にHATを含む培地などを好適に用いることができる。例えば、腫瘍細胞として前記したde novo経路でのみ核酸を生合成することができるミエローマ細胞株を用いた場合、de novo経路による核酸の生合成の阻害剤であるアミノプリテンを含んでいるのでde novo経路による核酸の生合成を行うことができず、また、前記したようにTK或いはHGPRTが欠損しているのでサルベージ経路による核酸の生合成を行うことができない。そのため、分化形質を保持する生体細胞と融合しなかった腫瘍細胞はHATを含む培地中で生育することができない。一方、腫瘍細胞と融合しなかった分化形質を保持する生体細胞は、正常細胞であるのでしばらくの間はHATを含む培地中で生育することができるものの、長期間生存することはできず、やがて死滅してしまう。このように、特定の組成を有する選択培地を用いることによって、分化形質を保持する生体細胞と腫瘍細胞が融合した融合細胞を選択的に生育(選択培養)させてこれを適切かつ容易に得ることが可能となる。なお、本発明で用いることのできる選択培地はこれに限定されるものではなく、融合細胞の選択培養を行うことのできる培地であればどのような培地でも用いることができる。
【0023】
選択培地による選択培養は、例えば、1ウェル当たりに適度な量の選択培地を添加した96ウェルプレートを用いて培養するとよいが、これに限定されるものではない。例えば、6、12、24、48ウェルを有する培養用容器で培養してもよい。
かかる選択培地による選択培養は、融合細胞作製時と同様の条件、例えば、5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらいまで培養することにより行うことができる。なお、培養期間中、必要に応じて選択培地の半量や全量を交換してもよく、適度なスピードでウェルプレートを揺動してもよい。このようにすると、作製した融合細胞に由来するコロニーを複数有するコロニー群が、96ウェルプレートの各ウェル内に形成される。
【0024】
1次スクリーニングは、選択培地で選択培養されて得られた融合細胞に由来するコロニー群から、目的とする分化形質を保持する融合細胞のコロニーを有するコロニー群を選定するものである。
この1次スクリーニングは、従来から行われているハイブリドーマの作製方法において1次スクリーニング(1st screening)と呼ばれるものに相当し、例えば、流体を利用した細胞測定方法であるフローサイトメトリー法、特に、蛍光抗体で染色した対象となる融合細胞を液流にのせて流し、レーザー光の焦点を通過させて各細胞が発する蛍光を測定し、特定の細胞のみを生きたまま無菌的に分取することが可能なFACS法(fluorescence activated cell sorting)によって行うことができる。FACS法による場合、液滴荷電方式やセルキャプチャー方式などにより行うことができる。また、1次スクリーニングは、前記した手法に限定されず、例えば、ELISA法(enzyme-linked immunosorbent assay)などによっても行うこともできる。
【0025】
このような1次スクリーニングを行うと、例えば96ウェルプレートのうちの目的とする分化形質を保持する融合細胞のコロニーを有するコロニー群を含むウェルを陽性ウェルとして検出することができる。
【0026】
そして、本発明におけるピッキング工程S10は、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングする工程である。
【0027】
ここで、一般的なハイブリドーマなどの融合細胞のクローンを作製する方法について説明すると、1次スクリーニングで陽性であったウェル内の融合細胞を全て24ウェルプレートなどの、より大きい系で培養を行った後に2次スクリーニングとクローニングを行う。その理由は、作製された融合細胞のコロニーは、この段階ではその大きさが直径およそ140μm程度と非常に小さいため取り扱いに困難を極めることと、作製された融合細胞のクローンが消失してしまう可能性もあるため、なるべく早く、作製された融合細胞のクローンを凍結保存できる量まで増やしたいためである。
【0028】
これに対し、本発明では、例えば、96ウェルプレートでの選択培養を行った直後から、選択培養を行って得られた融合細胞のコロニーに含まれる融合細胞のみを個別にピッキングし、当該ピッキングした融合細胞のみを他の融合細胞と隔離して培養、つまり、個別に培養できるように用意した隔離した培地、つまり、個別の培地に移して培養を行う。従って、本発明では、この段階からシングルセルクローンを得るためのクローニング作業を行うので、作製された目的とする分化形質を保持する融合細胞のクローンが目的としない分化形質を保持する融合細胞などとの生存競争に敗れて消失してしまう可能性を殆どなくすことができる。その結果、この後に行い得るスクリーニング工程で、目的とする分化形質を保持する融合細胞のコロニーを含む陽性ウェルの検出数が従来の方法と比較して高くなるだけでなく、この段階からシングルセルクローンを得るためのクローニング作業を行っているので、この後に行い得るクローニングの負担を軽減することができる。スクリーニング工程については、後記の融合細胞クローン作製方法において説明する。
前記したように、1次スクリーニング直後の96ウェルプレートのウェル内に形成されるコロニーの大きさは非常に小さいので、作製された融合細胞のコロニーを個別にピッキングするのは極めて困難であるが、本願では後記するコロニーピッキング装置を用いることによって容易に行うことができる。当該コロニーピッキング装置については後に詳述することとする。
【0029】
なお、このピッキング工程S10では、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングすることができればよく、必ずしも一度のピッキング作業で1つのコロニーから融合細胞を得なければいけないということではない。例えば、2つのコロニーが非常に近接しているか、又は重なっていることから一度のピッキング作業で2つ以上のコロニーの融合細胞をピッキングしてしまう可能性もある。このような場合は、個別の培地にまき込む前に、ピッキングした融合細胞を一旦他の培地にまいて個々に分散させた後、個別の培地にまき込むようにしてもよい。
【0030】
次に行うまき込み工程S20は、ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込む工程である。かかる培地は、まき込んだ融合細胞が増殖することができればよい。従って、前記した融合細胞作製時に使用した培地と同様のものであってもよいし、異なるものであってもよい。例えば、HATを含む培地、HTを含む培地、10%FCS(ウシ胎児血清)を含むか又は含まないRPMI1640培地を用いることができる。また、これらの培地に適宜の細胞増殖因子を加えたものを用いてもよい。培地にまき込んだ融合細胞は、前記した融合細胞作製時と同様、例えば、5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらいまで培養する。この間、培地は静置してもよく、また必要に応じて揺動装置等により揺動してもよい。
【0031】
まき込み工程S20でコロニーをピッキングして移す先の培地は、例えば、96ウェルプレートの各ウェルに添加された新たな培地であればよい。この新たな培地は、前記と同様、HATを含む培地などを用いることができる。なお、より容量の大きい6、12、24、48ウェルを有する培養用容器の各ウェルに添加された培地や、シャーレなどの個別の培養用容器に添加された培地であってもよい。
【0032】
次に、本発明に係る融合細胞クローン作製方法について説明する。
本発明に係る融合細胞クローン作製方法は、前記した本発明に係るコロニーピッキング方法を工程の一部に含むものであり、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを作製するための方法である。
本発明に係る融合細胞クローン作製方法は、ピッキング工程S10と、まき込み工程S20と、培養工程S30とを含む。なお、ピッキング工程S10とまき込み工程S20は、コロニーピッキング方法のピッキング工程S10及びまき込み工程S20と全く同様であるので詳細な説明を省略する。
【0033】
培養工程S30は、個別の培地にまき込んだ融合細胞を培養する工程である。既に説明しているとおり、ピッキング工程S10でクローニング作業を兼ねた操作を行っているので、この培養工程S30によって培養された融合細胞の株は、シングルセルクローンである可能性が非常に高い。
【0034】
なお、ピッキング工程S10の前に、陽性であったウェル内に含まれる融合細胞のコロニーの中から陽性を示す融合細胞のコロニーを検出するピッキング前スクリーニング工程S3を行うとよい。ピッキング前スクリーニング工程S3は所謂2次スクリーニングに相当するものである。このようにすると、陽性を示す融合細胞のコロニーを絞り込むことができるので、ピッキング工程S10でピッキングする回数を減らすことができる。ピッキング前スクリーニング工程S3は、FACS法などのフローサイトメトリー法やELISA法などによって行うことができる。
【0035】
また、まき込み工程S20の後に、融合細胞をクローニングするクローニング工程S25を行うのが好ましい。前記したように、ピッキング工程S10でクローニング作業を兼ねる操作をしているが、培養して得られた融合細胞の細胞株がシングルセルクローンからなる細胞株である保証はないので、目的とする分化形質を保持したシングルセルクローンからなる細胞株を確実に樹立できたという確証を得るために当該クローニング工程S25を行うとよい。クローニング工程S25は、シングルセルクローンを得ることができればどのような手法を用いてもよく、例えば、限界希釈法により行うことができる。
【0036】
さらに、培養工程S30の後に、培養した融合細胞の陽性反応を確認する培養後スクリーニング工程S33を行うのが好ましい。培養後スクリーニング工程S33は、この前にピッキング前スクリーニング工程S3を行っていれば、所謂3次スクリーニングに相当し、ピッキング前スクリーニング工程S3を行っていなければ所謂2次スクリーニングに相当するものである。このようにすると、培養後スクリーニング工程S33で陽性を示した融合細胞が目的とする分化形質を保持することを確認できるとともに、当該融合細胞を選択的に得ることができるので、後記するクローニング工程S35で当該融合細胞のクローニングを容易に行うことができる。培養後スクリーニング工程S33は、FACS法などのフローサイトメトリー法やELISA法などによって行うことができる。
【0037】
そして、培養後スクリーニング工程S33の後に、当該培養後スクリーニングの結果が陽性であった融合細胞をクローニングするクローニング工程S35を行うのがさらに好ましい。このようにすれば、目的とする分化形質を保持した融合細胞のシングルセルクローンからなるコロニー(細胞株)をより確実に得ることができる。
【0038】
次に、本発明に係るコロニーピッキング装置について説明する。
本発明に係るコロニーピッキング装置1は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング装置であって、前記した本発明に係るコロニーピッキング方法のピッキング工程S10と、まき込み工程S20とを実施するための装置であり、ピッキング手段と、まき込み手段とを有している。
【0039】
ピッキング手段は、ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするものであり、実質的に前記したピッキング工程S10と同様の作用を奏する。
また、まき込み手段は、ピッキングした融合細胞を個別に培養できるように個別の培地にまき込むものであり、実質的に前記したまき込み工程S20と同様の作用を奏する。
【0040】
本発明に係るコロニーピッキング装置1の具体例を図2の(a)に示す。図2の(a)に示すように、コロニーピッキング装置1は、顕微鏡2と、載置台3と、細管体4と、圧力制御装置5とを主に備えて構成されている。
【0041】
顕微鏡2は、融合細胞のコロニーを拡大して観察するためのものである。また、顕微鏡2を用いることによって細管体4による操作を確実に行うことができる。かかる顕微鏡2は、コロニーや融合細胞を拡大して観察することができるものであればどのようなものでも用いることができる。その倍率は少なくとも400倍程度を有していればよい。このような顕微鏡2としては、例えば、光学顕微鏡などを使用することができる。
【0042】
載置台3は、顕微鏡2の下に設けられた、融合細胞のコロニーが入った培養用容器や、ピッキングした融合細胞を個別に培養するために新しく用意した個別の培地を入れた96ウェルプレートなどの培養用容器を固定して載置するものである。これらの培養用容器を固定する手段は、これらが固定されればよく、どのような手段で固定されても構わない。
【0043】
細管体4は、図2の(a)及び(b)に示すように、融合細胞をピッキングするための先端部41を有している。この先端部41は、先端部41の内径が小さいほど、融合細胞を個別にピッキングすることができるようになるため好適である。先端部41の内径は、ピッキングしようとする融合細胞の大きさ(直径約10〜18μm程度)の1〜40倍程度、より好ましくは1〜20倍程度、さらに好ましくは1.5〜15倍程度、さらにより好ましくは1.5〜10倍程度とするとよい。つまり、先端部41の内径は、例えば、10〜400μm程度とするとよい。なお、先端部41の内径がこの範囲内であっても400μmのように大きく形成されている場合は1つのコロニー内から複数の融合細胞をピッキングするおそれがあるが、このような場合であっても1つのコロニーからピッキングしたものであれば同一の融合細胞に由来する増殖細胞である可能性が高く、また、後の工程でスクリーニングとクローニングを行うことでシングルセルクローンを得ることができるので問題とはならない。
【0044】
先端部41の内径が10μm程度未満であると、ピッキングする際に融合細胞を傷つけてしまうおそれがある。他方、細管体4の先端部41の内径が400μm程度を超えると融合細胞をピッキングする際に複数のコロニーの融合細胞をピッキングし易くなるためクローニング作業を兼ねることができないおそれが高くなり好ましくない。
また、先端部41の肉厚が小さいほどウェルの壁部近傍にできたコロニーから融合細胞をピッキングし易くなるので好ましい。従って、先端部41の肉厚は、例えば、50〜400μm程度とするとよい。
このような細管体4は、ガラス管やプラスチック管を熱して引き伸ばすことで作製することができる。
【0045】
また、細管体4は、少なくとも先端部41が載置台3に対して垂直に設けられているので、図2の(b)に示すように、96ウェルプレートのように小さなウェルであってもその壁部などに接触しないように操作することが可能である。また、このようにすることで、非常に小さなコロニーであっても融合細胞を正確にピッキングすることができる。
さらに、細管体4は、載置台3に対して少なくとも上下方向に可動する可動部42を備えた保持具43に保持されているので、手動又は電動によって可動部42を動かして細管体4を下方向に移動させれば融合細胞のコロニーを正確にピッキングすることが可能となり、また、可動部42を動かして細管体4を上方向に移動させればピッキングした融合細胞を他の培地に移すことができるようになる。
【0046】
圧力制御装置5は、細管体4の基端部44と接続手段51を介して接続され、細管体4内を陰圧及び陽圧に制御する。圧力の制御は融合細胞のコロニーから1個若しくは複数個の融合細胞を吸い上げて他の培地に吐出することができる程度の圧力を有すればよい。なお、圧力制御装置5による圧力の制御が精密にできなかったり、圧力の制御速度があまりに急激であったりすると、目的としない他のコロニーの融合細胞をピッキングする可能性が高くなるので好ましくない。
かかる圧力制御装置5は、接続手段51を介して接続された細管体4内の圧力を制御することができるものであればどのようなものを用いてもよい。例えば、ペリスタポンプなどを好適に用いることができる。接続手段51は、シリコン製などの中空のチューブ等であって、当該接続手段51内の圧力を精密に制御可能とするためなるべく内径が小さいものを用いるとよい。
【0047】
また、本発明に係るコロニーピッキング装置1は、前記した保持具43が、載置台3と水平な方向において細管体4を前後左右方向に可動する可動部42aを有していると細管体4の可動域が広がり、ピッキング作業やまき込み作業が行い易くなるためより好ましい。ここで、可動部42aを有する保持具43は融合細胞のピッキング作業中やまき込み作業中に細管体4の先端部41がぶれたりしないものであるのが好ましい。このような保持具43としては、例えば、株式会社成茂科学器械研究所製のマニピュレーターを1つ或いは必要に応じて複数組み合わせて作製し、使用することを挙げることができる。
【0048】
なお、載置台3が、96ウェルプレートなどの培養用容器を前後左右方向に可動する容器可動機構(図示せず)や、載置台3の規定位置に対して載置台3を前後左右方向に可動させる載置台可動機構(図示せず)などを備えていてもよい。また、載置台3は、通常時は水平に保たれる載置台3を若干斜めに傾かせる載置台斜傾機構(図示せず)を備えていてもよい。これらの機構を備えていると細管体4の可動域を広げるのと同様に、ピッキング作業やまき込み作業を行い易くすることができる。特に、載置台斜傾機構を備えていると、培養用容器を若干斜めに傾かせることができる結果、ウェルの壁部の際にあるコロニーから融合細胞をピッキングすることが可能となる。容器可動機構や載置台可動機構は、培養用容器又は載置台3の位置を前後左右方向に移動させることのできる適宜の手段、例えば、ユーザーの手元に配置された操作ツマミと、これと連動した手動又は電動によるラック・アンド・ピニオンなどの手段により具現することができる。また、載置台斜傾機構は、電動式、油圧式又は空気圧式のアクチュエーターを載置台3が斜めに傾くように任意の位置で1箇所又は複数箇所設けることにより具現することができる。
【0049】
また、本発明に係るコロニーピッキング装置1は、個別にピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込むために、図3(a)及び(b)に示すように、融合細胞の培養に用いられたコロニー群を有する培養用容器の位置P1と、前記個別の培地が添加された培養用容器の位置P2とを交換する容器位置入換手段6を前記載置台3上に備えていてもよい。このような容器位置入換手段6としては例えば、載置台3に、当該載置台3の面内方向において円回転する回転盤61(図3(a)参照)や、当該載置台3の面内方向において水平移動する水平移動盤62(図3(b)参照)を挙げることができ、この回転盤61上又は水平移動盤62上の所定の位置P1,P2に融合細胞の培養に用いられた、コロニー群を有する培養用容器と、前記個別の培地が添加された培養用容器とを固定できるようにするとよい。
【0050】
なお、回転盤61は、図3(a)に示すように、載置台3の面内方向において円回転することにより、培養用容器の位置P1と位置P2を相互に入れ換えることができる。また、水平移動盤62は、図3(b)に示すように、載置台3の面内方向において水平に移動することで、同図中実線で示す培養用容器の位置P1と位置P2を、同図中破線で示す位置P1と位置P2に相互に入れ換えることができる。
これらの容器位置入換手段6を備えていれば、コロニー群を有する培養用容器の位置P1と、前記個別の培地が添加された培養用容器の位置P2とを入れ換えるだけで、細管体4でピッキングした融合細胞を個別の培地に確実且つ容易にまき込むことができる。
【0051】
次に、本発明に係るコロニーピッキング装置1の使用態様について説明する。
まず、常法により細胞融合され、選択培地で選択培養され、1次スクリーニングが行われて、その結果が陽性であったウェルを有する96ウェルプレートなどの培養用容器を載置台3上に載置し、固定する。
【0052】
そして、顕微鏡2で陽性であったウェル内のコロニー群を観察しつつ、図2の(b)に示すように、保持具43で保持された細管体4の先端部41を慎重にウェル内に挿入し、当該先端部41をコロニー群の中から任意に選択した1つのコロニーに接触させる。例えば、図4の(a)及び(b)に示すように“B5”“C2”“C13”などとナンバリングしたコロニー群の中から融合細胞のコロニーを1つ選び先端部41を接触させる。そして、圧力制御装置5で接続手段51と接続された細管体4内を陰圧にして、選んだ1つのコロニーから1個若しくは複数個の融合細胞を吸い上げてピッキングする。そして、可動部42、並びに、必要に応じて、可動部42a、前記した容器可動機構、前記した載置台可動機構、前記した載置台斜傾機構及び容器位置入換手段6などによって、前記個別の培地が添加された培養用容器のウェル内の培地上に前記先端部41を移動させた後、これを下方に慎重に降下させて当該先端部41と当該個別の培地とを接触させる。そして、圧力制御装置5で接続手段51と接続された細管体4内を陽圧にし、ピッキングした融合細胞を培地上に吐出することで融合細胞を培地にまき込むことができる。
その後は、培地にまき込んだ融合細胞を所定の条件で培養し、常法により2次スクリーニングやクローニング等を行うことで、シングルセルクローンからなる細胞株を得ることができる(図1(b)参照)。
【0053】
このように、本発明に係るコロニーピッキング装置1は、載置台3に対して少なくとも上下方向に可動する可動部42を備えた保持具43に保持された細管体4と、この細管体4と接続された圧力制御装置5とを有することによって、融合細胞をピッキングするピッキング手段(ピッキング工程S10)を具現し、融合細胞をピッキングした細管体4と、これを他の培養用容器に用意した個別の培地上に移動させる可動部42、並びに、必要に応じて可動部42a、容器可動機構、載置台可動機構、載置台斜傾機構及び容器位置入換手段6等と、細管体4と接続された圧力制御装置5とを有することによって、ピッキングした融合細胞を前記した他の培養用容器に用意した個別の培地上にまき込むまき込み手段(まき込み工程S20)を具現している。なお、ピッキング手段及びまき込み手段を具現する手段はこれに限定されるものではなく、他の構成例によっても具現可能であることはいうまでもない。
【実施例】
【0054】
次に、本発明の効果を奏する実施例について、本発明の効果を奏しない比較例と対比して説明する。
(比較例)
比較例では、非特許文献2に記載の手法に従って、生体内で発現量が少なく、融合細胞の増殖速度が遅いタンパク質αのモノクローナル抗体を産生する融合細胞(ハイブリドーマ)のクローニングを試みた。
【0055】
つまり、この比較例では、gp64トランスジェニックマウスと掛け合わせた、タンパク質αのノックアウトマウス(タンパク質αKOマウス)に、当該タンパク質αの全長DNAを導入し、タンパク質αを表面に提示させたバキュロウイルス(BV)を常法により精製し、2〜4週間おきに3回免疫した。なお、免疫は腹腔内投与により行い、その投与量は1匹あたりブラッドフォード値で0.1mgとした。
【0056】
抗血清を免疫ごとにFACS評価し、抗血清評価で差があったマウスを用いて常法により細胞融合を行い、融合細胞(ハイブリドーマ)を得、FACS法により1次スクリーニングを行ったところ、複数枚の96ウェルプレートから約500個の陽性ウェルを得ることができた。96ウェルプレート内の培地は、20%FBSを添加したRPMI1640培地を用い、5%CO2、37℃の条件で培養した。
【0057】
陽性であったウェル内の培地を24ウェルプレートのウェルに移してスケールアップし、FACS法により2次スクリーニングを行ったところ、Geo Meanが1次スクリーニング時よりも1/5〜1/10程度に低下した。つまり、陽性であったウェル内に含まれる、抗タンパク質α抗体を産生する融合細胞が、抗タンパク質α抗体を産生しない融合細胞との生存競争に敗れてしまったために抗タンパク質α抗体を産生するシングルセルクローンを得ることができなかった。
【0058】
(実施例1)
実施例1では、融合細胞の作製と1次スクリーニングの操作までを比較例と同じ条件で行った。なお、96ウェルプレート内の培地は、比較例と同じものを用い、比較例と同じ条件で培養した。1次スクリーニングの結果、比較例とほぼ同じ数(480個)の陽性ウェルを得ることができた。
【0059】
そして、実施例1では、図2に示すコロニーピッキング装置1を用いて1次スクリーニングで陽性であったウェル内に含まれる融合細胞のコロニーから1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングし、ピッキングした融合細胞を個別に培養できるように用意した個別の培地(96ウェルプレートを使用)にまき込んだ。かかる作業を細胞融合で得ることのできた陽性ウェル内に含まれる全てのコロニーに対して行った。なお、個別の培地として使用した培地は、比較例と同じものを用いた。
【0060】
ここで、実施例1で用いたコロニーピッキング装置1は、株式会社成茂科学器械研究所製のマニピュレーターを複数組み合わせて作製したものであり、発明を実施するための形態の項目で説明したような構成を有している。すなわち、当該コロニーピッキング装置1は、顕微鏡2と、載置台3と、細管体4と、圧力制御装置5とを主に備えて構成されている(図2及び本明細書の該当する箇所を参照のこと。ここでのコロニーピッキング装置1の構成についての詳細な説明は省略する)。
【0061】
そして、個別の培地にまき込んだ融合細胞を5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらいまで培養した。なお、培養日数は、成長の早いコロニー群で3〜5日ほどであり、成長の遅いコロニー群では7〜10日ほどであった。個別の培地にまき込んで培養した融合細胞についてCell ELISA法を行って2次スクリーニングしたところ、71個の陽性ウェルを得ることができた。さらに、得られた陽性ウェル71個についてFACS法によって3次スクリーニングし、限界希釈法によりクローニングしたところ、5個のウェルについて陽性ウェル(陽性クローン)を得ることができた。
【0062】
実施例1では、融合細胞を作製した後、最終的な5個の陽性ウェルを得るまで合計2週間程を要した。これは、1次スクリーニングを行った後、24ウェルプレートでスケールアップを行ってから2次スクリーニング及びクローニングを行う一般的な従来法(通常、3〜4週間程度を要する)に比べておよそ2/3〜1/2以下の日数しか要しなかった。また、使用したウェルプレートも96ウェルプレートのみであった。
従って、実施例1によれば、目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つ従来法に比べてかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することができた。
【0063】
(実施例2)
実施例2では、免疫を実施例1と異なる条件で行った以外は、全く同じ条件で実験を行った。実施例1における免疫は、抗原として、タンパク質αの全長DNAを導入し、タンパク質αを表面に提示させたBVを常法により精製し、腹腔内投与する(投与量は、1匹あたりブラッドフォード値で0.1mg)とともに、精製したタンパク質α(投与量は、1匹あたりブラッドフォード値で0.005mg)を完全フロイントアジュバントとともに腫瘍近傍皮下投与することによって免疫した。
【0064】
1次スクリーニングの結果、実施例1とほぼ同じ数(480個)の陽性ウェルを得ることができた。陽性ウェル内に含まれる融合細胞のコロニーから1つのコロニーを選択して当該コロニーに含まれる融合細胞を実施例1と同様にコロニーピッキング装置1でピッキングし、ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまきこんで培養した。培養日数は、実施例1と同様に、成長の早いコロニー群で3〜5日ほどであり、成長の遅いコロニー群では7〜10日ほどであった。培養した融合細胞についてCell ELISA法を行って2次スクリーニングしたところ、53個の陽性ウェルを得ることができた。さらに、得られた陽性ウェル53個についてFACS法によって3次スクリーニングし、限界希釈法によりクローニングしたところ、5個のウェルについて陽性ウェル(陽性クローン)を得ることができた。
【0065】
実施例2によっても実施例1と同じように、融合細胞を作製した後、最終的な5個の陽性ウェルを得るまで合計2週間程を要した。つまり、実施例2も、目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つ従来法に比べてかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することができた。
【先行技術文献】
【非特許文献】
【0066】
【非特許文献1】Kremer, L., Marquez, G., Methods Mol. Biol., “Generation of monoclonal antibodies against chemokine receptors”, 239, 2004, p.243-260.
【非特許文献2】Ryoichi Saitoh et al., Journal of Immunological Methods, ”Viral envelope protein gp64 transgenic mouse facilitates the generation of monoclonal antibodies against exogenous membrane proteins displayed on baculovirus”, 322, 2007, p.104-117.
【符号の説明】
【0067】
S10 ピッキング工程
S20 まき込み工程
S3 ピッキング前スクリーニング工程
S25 クローニング工程
S30 培養工程
S33 培養後スクリーニング工程
S35 クローニング工程
1 コロニーピッキング装置
2 顕微鏡
3 載置台
4 細管体
41 先端部
42,42a 可動部
43 保持具
44 基端部
5 圧力制御装置
51 接続手段
6 容器位置入換手段
61 回転盤
62 水平移動盤
【技術分野】
【0001】
本発明は、目的とする分化形質を保持するモノクローナルな融合細胞を作製するためのコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法に関する。
【背景技術】
【0002】
従来、抗体産生や生理活性物質産生といった、目的とする分化形質を保持するモノクローナルな融合細胞は、以下のような作製方法によって作製されている。
例えば、モノクローナル抗体を産生するハイブリドーマ(雑種細胞;hybridoma)のクローンを作製する場合を例にとって説明すると、
(A)目的とする抗原を接種して免疫された動物の脾臓細胞に含まれるB細胞と、ミエローマ細胞株などの腫瘍細胞とを、ポリエチレングリコールなどの細胞融合誘起物質を用いて細胞融合させ、ハイブリドーマを複数作製する工程、
(B)複数作製した前記ハイブリドーマを96ウェル(穴)プレート(例えば、100〜200μL/ウェル)の各ウェルに入れられたHAT(ヒポキサンチン、アミノプリテン及びチミジン)を含む培地などの選択培地で選択培養して、各ハイブリドーマに由来するコロニーを複数有するコロニー群を1つ以上得る工程、
(C)1つ以上得られたコロニー群の中から、目的とする抗原と結合する抗体を産生するハイブリドーマのコロニーを有するコロニー群を、FACS法(fluorescence activated cell sorting)などのフローサイトメトリー法やELISA法(enzyme-linked immunosorbent assay)などによってスクリーニング(一般的に1次スクリーニング(1st screening)と呼ばれている)する工程、
(D)1次スクリーニングで得られた陽性ウェルに含まれるハイブリドーマのコロニー群を24ウェルプレートにスケールアップ(例えば、1mL/ウェル)して培養する工程、
(E)24ウェルプレートで培養したハイブリドーマのコロニー群をFACS法などのフローサイトメトリー法やELISA法などによる再度のスクリーニング(一般的に2次スクリーニング(2nd screening)と呼ばれている)を行う工程、
(F)2次スクリーニングで得られた陽性ウェルからハイブリドーマのコロニーを採取し、限界希釈法などによってクローニングを行う工程、
(G)クローニングしたコロニーが単一細胞由来のものであるか否かのスクリーニングを行なう工程、
を順次行うことでモノクローナル抗体を産生するモノクローナルなハイブリドーマなどの融合細胞を作製している(例えば、非特許文献1参照)。
【発明の概要】
【発明が解決しようとする課題】
【0003】
しかしながら、従来から行われている作製方法では、例えば、前記(C)の工程や(E)の工程におけるスクリーニングによって得られた陽性ウェルが、例えば、目的としない分化形質を保持するハイブリドーマ(融合細胞)や目的とする分化形質を保持しないハイブリドーマなどの不必要なハイブリドーマを多数含んでいるため、継代を続けるうちに目的とする分化形質を保持するハイブリドーマが前記不必要なハイブリドーマとの生存競争に敗れてしまい、目的とする分化形質を保持するハイブリドーマが消失してしまうことがあった。また、染色体が脱落することによって目的とする分化形質を保持するハイブリドーマが消失してしまうこともあった。さらに、1セット7〜14日間を要する融合細胞の培養、スクリーニング及びクローニングの一連の作業を、シングルセルクローンを得るまでに複数回繰り返さなければならず、労力や時間的及び金銭的な負担が大きかった。
【0004】
これらに加え、従来から行われている作製方法では、前記(C)の工程や(E)の工程のスクリーニングにおいて、目的とする分化形質を保持するハイブリドーマ(融合細胞)のクローンの検体数が非常に多くなることがあり、目的とする分化形質を保持するハイブリドーマのシングルセルクローンを得るまでに、長いときでは半年近くもかかる場合があるなど、労力や時間的及び金銭的な負担が大きかった。
【0005】
本発明は、前記問題点に鑑みてなされたものであり、目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することを可能とするコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法を提供することを課題とする。
【課題を解決するための手段】
【0006】
前記課題を解決した本発明に係るコロニーピッキング方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程とを含むことを特徴としている。
【0007】
本発明に係るコロニーピッキング装置は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング装置であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞を、前記融合細胞の大きさの1〜40倍の大きさの内径を有する先端部を備えた細管体によってピッキングするピッキング手段と、前記細管体でピッキングした融合細胞を個別の培地にまき込むまき込み手段とを含むことを特徴としている。
【0008】
本発明に係る融合細胞クローン作製方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを作製するための融合細胞クローン作製方法であって、前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程と、個別の培地にまき込んだ融合細胞を培養する培養工程とを含むことを特徴としている。
【発明の効果】
【0009】
本発明に係るコロニーピッキング方法によれば、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングし、当該ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込むため、継代を続けるうちに目的としない分化形質を保持する融合細胞などとの生存競争に敗れたり、染色体が脱落したりして、目的とする分化形質を保持する融合細胞が消失してしまうことを防ぐことができる。また、目的とする分化形質を保持する融合細胞のクローンの検体数が非常に多くなることを防ぐことができるため、労力や時間的及び金銭的な負担を少なくすることができる。
【0010】
本発明に係るコロニーピッキング装置によれば、ピッキング手段とまき込み手段とを備えているため、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞を、前記融合細胞の大きさの1〜40倍の大きさの内径を有する先端部を備えた細管体によってピッキングし、当該細管体でピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込むことができる。そのため、継代を続けるうちに目的としない分化形質を保持する融合細胞などとの生存競争に敗れたり、染色体が脱落したりして、目的とする分化形質を保持する融合細胞が消失してしまうことを防ぐことができる。また、目的とする分化形質を保持する融合細胞のクローンの検体数が非常に多くなることを防ぐことができるため、労力や時間的及び金銭的な負担を少なくすることができる。
【0011】
本発明に係る融合細胞クローン作製方法によれば、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングし、当該ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込み、培養する。つまり、陽性ウェル内の融合細胞のコロニーをスケールアップする操作を行わないで個別に培養するため、例えば増殖速度が遅いことなどにより、継代を続けるうちに目的としない分化形質を保持する融合細胞などとの生存競争に敗れたり、染色体が脱落したりして、目的とする分化形質を保持する融合細胞が消失してしまうことを防ぐことができる。そのため、目的とする分化形質を保持する融合細胞を確実に得ることができる。また、目的とする分化形質を保持する融合細胞のクローンの検体数が非常に多くなることを防ぐことができるため、労力や時間的及び金銭的な負担を少なくすることができる。
【図面の簡単な説明】
【0012】
【図1】(a)は、本発明に係るコロニーピッキング方法の工程の内容を示すフローチャートであり、(b)は、本発明に係る融合細胞クローン作製方法の工程内用を示すフローチャートである。
【図2】(a)は、本発明に係るコロニーピッキング装置の具体的な構成例を説明する斜視図であり、(b)は、(a)のAの部分を拡大した拡大図である。
【図3】(a)及び(b)は、容器位置入換手段の構成例を説明する説明図である。
【図4】(a)及び(b)は、ピッキングした融合細胞を個別の培地に移す様子を説明する概念図である。
【発明を実施するための形態】
【0013】
以下、適宜図面を参照して、本発明に係るコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法について詳細に説明する。
なお、本発明は、目的とする分化形質を保持するモノクローナルな融合細胞を作製するためのコロニーピッキング方法、コロニーピッキング装置、及び融合細胞クローン作製方法に係るものであるが、融合細胞を得るまでに必要な操作や融合細胞の取り扱い方法、融合細胞のクローニング方法などについて、発明を実施するための最良の形態及び実施例に特に説明がない場合には、例えば、非特許文献1や常用される標準的なプロトコール集に記載の方法、あるいはそれらを修飾したり、改変したりした方法を用いることができる。また、市販の試薬キットや測定装置を用いる場合には、特に説明が無い場合、それらに添付のプロトコールを用いることができる。また、当業者であれば本明細書の記載及び例えば、非特許文献1や標準的なプロトコール集などの記載から容易に本発明を再現することができる。
【0014】
まず、本発明に係るコロニーピッキング方法について説明する。
図1(a)に示すように、本発明に係るコロニーピッキング方法は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、ピッキング工程S10と、まき込み工程S20とを含んでなる。
なお、ピッキング工程S10を行う前の免疫、細胞融合、選択培地による選択培養、及び1次スクリーニングの各工程は、通常行われる手法により行うことができる。
【0015】
免疫は、例えば、ファージディスプレイ法によって抗原を提示させたファージを作製し、提示させた抗原を常法により単離し、これをマウスなどの被免疫動物に免疫することによって行うことができる。また、常法により精製した抗原をマウスなどの被免疫動物に免疫することによっても行うことができる。なお、免疫の際には、完全フロイントアジュバントや不完全フロイントアジュバントなどを用いることもできる。
【0016】
細胞融合は、例えば、目的とする分化形質を保持した生体細胞と、腫瘍細胞とを細胞融合させることにより行うことができる。なお、目的とする分化形質を保持した生体細胞は、目的とする分化形質を保持している細胞であればどのようなものでも用いることができる。例えば、目的とする分化形質が、特定の抗原に反応するモノクローナル抗体を産生する抗体産生である場合は、動物に対して目的とする抗原を接種して免疫した動物の脾臓の細胞(B細胞)を用いることができる。また例えば、目的とする分化形質が、リンホカインなどの生理活性物質を産生する生理活性物質産生である場合は、動物の胸腺の細胞(T細胞)を用いることができる。なお、動物に対する目的とする抗原の接種と、免疫した動物から脾臓の細胞の取得とは、常法により行うことができる。
【0017】
前記した細胞を得るための動物としては、マウス、ラット、ラビット、若しくはゴートなど、及び必要に応じて作製したこれらのノックアウト又は/及びトランスジェニック動物を用いることができる。例えば、マウスを用いる場合は、BALB/c系統のマウスを用いるのが好適である。これは、融合細胞を作製する際の腫瘍細胞として広く用いられているミエローマ細胞株がBALB/c系統のマウスを起源とするものが多いので、BALB/c系統のマウスから得られた分化形質を保持した生体細胞との相性がよいというメリットや、得られた融合細胞をBALB/c系統のマウスの腹腔内で増殖させることができるため、特別な処理なしで腹水から高濃度のモノクローナル抗体などを産生させることができるというメリットや入手が容易であるというメリットがあるためである。同様の観点から、例えば、ラットを用いる場合は、low系統のものを用いるのが好ましい。なお、前記した細胞を得るための動物は前記したものに限定されないことはいうまでもなく、前記した動物以外の動物や前記した系統以外の系統のものを用いることもできる。
【0018】
また、融合細胞を作製するために用いられる腫瘍細胞としては、in vivoでの増殖が盛んな腫瘍細胞であればどのような腫瘍細胞でも用いることができるが、融合細胞のスクリーニング効率の関係から、特定の組成を有するか又は有しない選択培地では生存できないものであって、免疫グロブリンを産生する能力が低い腫瘍細胞を用いるのが好ましい。かかる腫瘍細胞としては、例えば、チミジンキナーゼ(TK)或いはヒポキサンチングアニンホスホリボシルトランスフェラーゼ(HGPRT)を欠損させて、2つある核酸合成経路のうちサルベージ経路で核酸を生合成することができず、de novo経路でのみ核酸を生合成することができるマウスミエローマ細胞株NS−1などを好適に用いることができる。なお、本発明で用いることのできる腫瘍細胞としてはこれに限定されないことはいうまでもない。例えば、目的とする分化形質が特定の抗原に反応するラビットのモノクローナル抗体を産生する抗体産生である場合は、ラビットミエローマ細胞なども用いることができる。
【0019】
そして、分化形質を保持する生体細胞と腫瘍細胞の融合は、例えば、平均分子量1000〜6000程度、濃度30〜50%程度のポリエチレングリコールを用いたポリエチレングリコール法や、センダイウイルスによる細胞融合法又は電気パルスによる電気融合法といった任意の細胞融合手法により行うことができる。
【0020】
ここで、細胞融合を作製する際に用いることのできる培地としては、作製する融合細胞によって異なるが、例えば、マウスを用いて作製する融合細胞である場合は、HATを含むRPMI1640培地、HT(ヒポキサンチン及びチミジン)を含むRPMI1640培地、10%FCS(ウシ胎児血清)又は20%FBS(ウシ胎児血清)を含むか又は含まないRPMI1640培地を用いることができる。また、これらの培地に適宜の細胞増殖因子を加えたものを用いてもよい。融合細胞は、例えば、5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらい(直径約100〜1400μm程度)まで培養する。この間、培地は静置してもよく、また必要に応じて揺動装置等により揺動してもよい。
【0021】
前記した操作によって得られる融合細胞の中には、目的とする分化形質を保持しない融合細胞が相当数含まれている。そこで、目的とする分化形質を保持する融合細胞を効率よく検出するために選択培地による選択培養を行う。
【0022】
選択培地による選択培養は、特定の組成を有する選択培地を用いることによって行うことができる。特定の組成を有する選択培地は、融合細胞作製時と同様にHATを含む培地などを好適に用いることができる。例えば、腫瘍細胞として前記したde novo経路でのみ核酸を生合成することができるミエローマ細胞株を用いた場合、de novo経路による核酸の生合成の阻害剤であるアミノプリテンを含んでいるのでde novo経路による核酸の生合成を行うことができず、また、前記したようにTK或いはHGPRTが欠損しているのでサルベージ経路による核酸の生合成を行うことができない。そのため、分化形質を保持する生体細胞と融合しなかった腫瘍細胞はHATを含む培地中で生育することができない。一方、腫瘍細胞と融合しなかった分化形質を保持する生体細胞は、正常細胞であるのでしばらくの間はHATを含む培地中で生育することができるものの、長期間生存することはできず、やがて死滅してしまう。このように、特定の組成を有する選択培地を用いることによって、分化形質を保持する生体細胞と腫瘍細胞が融合した融合細胞を選択的に生育(選択培養)させてこれを適切かつ容易に得ることが可能となる。なお、本発明で用いることのできる選択培地はこれに限定されるものではなく、融合細胞の選択培養を行うことのできる培地であればどのような培地でも用いることができる。
【0023】
選択培地による選択培養は、例えば、1ウェル当たりに適度な量の選択培地を添加した96ウェルプレートを用いて培養するとよいが、これに限定されるものではない。例えば、6、12、24、48ウェルを有する培養用容器で培養してもよい。
かかる選択培地による選択培養は、融合細胞作製時と同様の条件、例えば、5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらいまで培養することにより行うことができる。なお、培養期間中、必要に応じて選択培地の半量や全量を交換してもよく、適度なスピードでウェルプレートを揺動してもよい。このようにすると、作製した融合細胞に由来するコロニーを複数有するコロニー群が、96ウェルプレートの各ウェル内に形成される。
【0024】
1次スクリーニングは、選択培地で選択培養されて得られた融合細胞に由来するコロニー群から、目的とする分化形質を保持する融合細胞のコロニーを有するコロニー群を選定するものである。
この1次スクリーニングは、従来から行われているハイブリドーマの作製方法において1次スクリーニング(1st screening)と呼ばれるものに相当し、例えば、流体を利用した細胞測定方法であるフローサイトメトリー法、特に、蛍光抗体で染色した対象となる融合細胞を液流にのせて流し、レーザー光の焦点を通過させて各細胞が発する蛍光を測定し、特定の細胞のみを生きたまま無菌的に分取することが可能なFACS法(fluorescence activated cell sorting)によって行うことができる。FACS法による場合、液滴荷電方式やセルキャプチャー方式などにより行うことができる。また、1次スクリーニングは、前記した手法に限定されず、例えば、ELISA法(enzyme-linked immunosorbent assay)などによっても行うこともできる。
【0025】
このような1次スクリーニングを行うと、例えば96ウェルプレートのうちの目的とする分化形質を保持する融合細胞のコロニーを有するコロニー群を含むウェルを陽性ウェルとして検出することができる。
【0026】
そして、本発明におけるピッキング工程S10は、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングする工程である。
【0027】
ここで、一般的なハイブリドーマなどの融合細胞のクローンを作製する方法について説明すると、1次スクリーニングで陽性であったウェル内の融合細胞を全て24ウェルプレートなどの、より大きい系で培養を行った後に2次スクリーニングとクローニングを行う。その理由は、作製された融合細胞のコロニーは、この段階ではその大きさが直径およそ140μm程度と非常に小さいため取り扱いに困難を極めることと、作製された融合細胞のクローンが消失してしまう可能性もあるため、なるべく早く、作製された融合細胞のクローンを凍結保存できる量まで増やしたいためである。
【0028】
これに対し、本発明では、例えば、96ウェルプレートでの選択培養を行った直後から、選択培養を行って得られた融合細胞のコロニーに含まれる融合細胞のみを個別にピッキングし、当該ピッキングした融合細胞のみを他の融合細胞と隔離して培養、つまり、個別に培養できるように用意した隔離した培地、つまり、個別の培地に移して培養を行う。従って、本発明では、この段階からシングルセルクローンを得るためのクローニング作業を行うので、作製された目的とする分化形質を保持する融合細胞のクローンが目的としない分化形質を保持する融合細胞などとの生存競争に敗れて消失してしまう可能性を殆どなくすことができる。その結果、この後に行い得るスクリーニング工程で、目的とする分化形質を保持する融合細胞のコロニーを含む陽性ウェルの検出数が従来の方法と比較して高くなるだけでなく、この段階からシングルセルクローンを得るためのクローニング作業を行っているので、この後に行い得るクローニングの負担を軽減することができる。スクリーニング工程については、後記の融合細胞クローン作製方法において説明する。
前記したように、1次スクリーニング直後の96ウェルプレートのウェル内に形成されるコロニーの大きさは非常に小さいので、作製された融合細胞のコロニーを個別にピッキングするのは極めて困難であるが、本願では後記するコロニーピッキング装置を用いることによって容易に行うことができる。当該コロニーピッキング装置については後に詳述することとする。
【0029】
なお、このピッキング工程S10では、1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングすることができればよく、必ずしも一度のピッキング作業で1つのコロニーから融合細胞を得なければいけないということではない。例えば、2つのコロニーが非常に近接しているか、又は重なっていることから一度のピッキング作業で2つ以上のコロニーの融合細胞をピッキングしてしまう可能性もある。このような場合は、個別の培地にまき込む前に、ピッキングした融合細胞を一旦他の培地にまいて個々に分散させた後、個別の培地にまき込むようにしてもよい。
【0030】
次に行うまき込み工程S20は、ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込む工程である。かかる培地は、まき込んだ融合細胞が増殖することができればよい。従って、前記した融合細胞作製時に使用した培地と同様のものであってもよいし、異なるものであってもよい。例えば、HATを含む培地、HTを含む培地、10%FCS(ウシ胎児血清)を含むか又は含まないRPMI1640培地を用いることができる。また、これらの培地に適宜の細胞増殖因子を加えたものを用いてもよい。培地にまき込んだ融合細胞は、前記した融合細胞作製時と同様、例えば、5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらいまで培養する。この間、培地は静置してもよく、また必要に応じて揺動装置等により揺動してもよい。
【0031】
まき込み工程S20でコロニーをピッキングして移す先の培地は、例えば、96ウェルプレートの各ウェルに添加された新たな培地であればよい。この新たな培地は、前記と同様、HATを含む培地などを用いることができる。なお、より容量の大きい6、12、24、48ウェルを有する培養用容器の各ウェルに添加された培地や、シャーレなどの個別の培養用容器に添加された培地であってもよい。
【0032】
次に、本発明に係る融合細胞クローン作製方法について説明する。
本発明に係る融合細胞クローン作製方法は、前記した本発明に係るコロニーピッキング方法を工程の一部に含むものであり、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを作製するための方法である。
本発明に係る融合細胞クローン作製方法は、ピッキング工程S10と、まき込み工程S20と、培養工程S30とを含む。なお、ピッキング工程S10とまき込み工程S20は、コロニーピッキング方法のピッキング工程S10及びまき込み工程S20と全く同様であるので詳細な説明を省略する。
【0033】
培養工程S30は、個別の培地にまき込んだ融合細胞を培養する工程である。既に説明しているとおり、ピッキング工程S10でクローニング作業を兼ねた操作を行っているので、この培養工程S30によって培養された融合細胞の株は、シングルセルクローンである可能性が非常に高い。
【0034】
なお、ピッキング工程S10の前に、陽性であったウェル内に含まれる融合細胞のコロニーの中から陽性を示す融合細胞のコロニーを検出するピッキング前スクリーニング工程S3を行うとよい。ピッキング前スクリーニング工程S3は所謂2次スクリーニングに相当するものである。このようにすると、陽性を示す融合細胞のコロニーを絞り込むことができるので、ピッキング工程S10でピッキングする回数を減らすことができる。ピッキング前スクリーニング工程S3は、FACS法などのフローサイトメトリー法やELISA法などによって行うことができる。
【0035】
また、まき込み工程S20の後に、融合細胞をクローニングするクローニング工程S25を行うのが好ましい。前記したように、ピッキング工程S10でクローニング作業を兼ねる操作をしているが、培養して得られた融合細胞の細胞株がシングルセルクローンからなる細胞株である保証はないので、目的とする分化形質を保持したシングルセルクローンからなる細胞株を確実に樹立できたという確証を得るために当該クローニング工程S25を行うとよい。クローニング工程S25は、シングルセルクローンを得ることができればどのような手法を用いてもよく、例えば、限界希釈法により行うことができる。
【0036】
さらに、培養工程S30の後に、培養した融合細胞の陽性反応を確認する培養後スクリーニング工程S33を行うのが好ましい。培養後スクリーニング工程S33は、この前にピッキング前スクリーニング工程S3を行っていれば、所謂3次スクリーニングに相当し、ピッキング前スクリーニング工程S3を行っていなければ所謂2次スクリーニングに相当するものである。このようにすると、培養後スクリーニング工程S33で陽性を示した融合細胞が目的とする分化形質を保持することを確認できるとともに、当該融合細胞を選択的に得ることができるので、後記するクローニング工程S35で当該融合細胞のクローニングを容易に行うことができる。培養後スクリーニング工程S33は、FACS法などのフローサイトメトリー法やELISA法などによって行うことができる。
【0037】
そして、培養後スクリーニング工程S33の後に、当該培養後スクリーニングの結果が陽性であった融合細胞をクローニングするクローニング工程S35を行うのがさらに好ましい。このようにすれば、目的とする分化形質を保持した融合細胞のシングルセルクローンからなるコロニー(細胞株)をより確実に得ることができる。
【0038】
次に、本発明に係るコロニーピッキング装置について説明する。
本発明に係るコロニーピッキング装置1は、細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング装置であって、前記した本発明に係るコロニーピッキング方法のピッキング工程S10と、まき込み工程S20とを実施するための装置であり、ピッキング手段と、まき込み手段とを有している。
【0039】
ピッキング手段は、ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするものであり、実質的に前記したピッキング工程S10と同様の作用を奏する。
また、まき込み手段は、ピッキングした融合細胞を個別に培養できるように個別の培地にまき込むものであり、実質的に前記したまき込み工程S20と同様の作用を奏する。
【0040】
本発明に係るコロニーピッキング装置1の具体例を図2の(a)に示す。図2の(a)に示すように、コロニーピッキング装置1は、顕微鏡2と、載置台3と、細管体4と、圧力制御装置5とを主に備えて構成されている。
【0041】
顕微鏡2は、融合細胞のコロニーを拡大して観察するためのものである。また、顕微鏡2を用いることによって細管体4による操作を確実に行うことができる。かかる顕微鏡2は、コロニーや融合細胞を拡大して観察することができるものであればどのようなものでも用いることができる。その倍率は少なくとも400倍程度を有していればよい。このような顕微鏡2としては、例えば、光学顕微鏡などを使用することができる。
【0042】
載置台3は、顕微鏡2の下に設けられた、融合細胞のコロニーが入った培養用容器や、ピッキングした融合細胞を個別に培養するために新しく用意した個別の培地を入れた96ウェルプレートなどの培養用容器を固定して載置するものである。これらの培養用容器を固定する手段は、これらが固定されればよく、どのような手段で固定されても構わない。
【0043】
細管体4は、図2の(a)及び(b)に示すように、融合細胞をピッキングするための先端部41を有している。この先端部41は、先端部41の内径が小さいほど、融合細胞を個別にピッキングすることができるようになるため好適である。先端部41の内径は、ピッキングしようとする融合細胞の大きさ(直径約10〜18μm程度)の1〜40倍程度、より好ましくは1〜20倍程度、さらに好ましくは1.5〜15倍程度、さらにより好ましくは1.5〜10倍程度とするとよい。つまり、先端部41の内径は、例えば、10〜400μm程度とするとよい。なお、先端部41の内径がこの範囲内であっても400μmのように大きく形成されている場合は1つのコロニー内から複数の融合細胞をピッキングするおそれがあるが、このような場合であっても1つのコロニーからピッキングしたものであれば同一の融合細胞に由来する増殖細胞である可能性が高く、また、後の工程でスクリーニングとクローニングを行うことでシングルセルクローンを得ることができるので問題とはならない。
【0044】
先端部41の内径が10μm程度未満であると、ピッキングする際に融合細胞を傷つけてしまうおそれがある。他方、細管体4の先端部41の内径が400μm程度を超えると融合細胞をピッキングする際に複数のコロニーの融合細胞をピッキングし易くなるためクローニング作業を兼ねることができないおそれが高くなり好ましくない。
また、先端部41の肉厚が小さいほどウェルの壁部近傍にできたコロニーから融合細胞をピッキングし易くなるので好ましい。従って、先端部41の肉厚は、例えば、50〜400μm程度とするとよい。
このような細管体4は、ガラス管やプラスチック管を熱して引き伸ばすことで作製することができる。
【0045】
また、細管体4は、少なくとも先端部41が載置台3に対して垂直に設けられているので、図2の(b)に示すように、96ウェルプレートのように小さなウェルであってもその壁部などに接触しないように操作することが可能である。また、このようにすることで、非常に小さなコロニーであっても融合細胞を正確にピッキングすることができる。
さらに、細管体4は、載置台3に対して少なくとも上下方向に可動する可動部42を備えた保持具43に保持されているので、手動又は電動によって可動部42を動かして細管体4を下方向に移動させれば融合細胞のコロニーを正確にピッキングすることが可能となり、また、可動部42を動かして細管体4を上方向に移動させればピッキングした融合細胞を他の培地に移すことができるようになる。
【0046】
圧力制御装置5は、細管体4の基端部44と接続手段51を介して接続され、細管体4内を陰圧及び陽圧に制御する。圧力の制御は融合細胞のコロニーから1個若しくは複数個の融合細胞を吸い上げて他の培地に吐出することができる程度の圧力を有すればよい。なお、圧力制御装置5による圧力の制御が精密にできなかったり、圧力の制御速度があまりに急激であったりすると、目的としない他のコロニーの融合細胞をピッキングする可能性が高くなるので好ましくない。
かかる圧力制御装置5は、接続手段51を介して接続された細管体4内の圧力を制御することができるものであればどのようなものを用いてもよい。例えば、ペリスタポンプなどを好適に用いることができる。接続手段51は、シリコン製などの中空のチューブ等であって、当該接続手段51内の圧力を精密に制御可能とするためなるべく内径が小さいものを用いるとよい。
【0047】
また、本発明に係るコロニーピッキング装置1は、前記した保持具43が、載置台3と水平な方向において細管体4を前後左右方向に可動する可動部42aを有していると細管体4の可動域が広がり、ピッキング作業やまき込み作業が行い易くなるためより好ましい。ここで、可動部42aを有する保持具43は融合細胞のピッキング作業中やまき込み作業中に細管体4の先端部41がぶれたりしないものであるのが好ましい。このような保持具43としては、例えば、株式会社成茂科学器械研究所製のマニピュレーターを1つ或いは必要に応じて複数組み合わせて作製し、使用することを挙げることができる。
【0048】
なお、載置台3が、96ウェルプレートなどの培養用容器を前後左右方向に可動する容器可動機構(図示せず)や、載置台3の規定位置に対して載置台3を前後左右方向に可動させる載置台可動機構(図示せず)などを備えていてもよい。また、載置台3は、通常時は水平に保たれる載置台3を若干斜めに傾かせる載置台斜傾機構(図示せず)を備えていてもよい。これらの機構を備えていると細管体4の可動域を広げるのと同様に、ピッキング作業やまき込み作業を行い易くすることができる。特に、載置台斜傾機構を備えていると、培養用容器を若干斜めに傾かせることができる結果、ウェルの壁部の際にあるコロニーから融合細胞をピッキングすることが可能となる。容器可動機構や載置台可動機構は、培養用容器又は載置台3の位置を前後左右方向に移動させることのできる適宜の手段、例えば、ユーザーの手元に配置された操作ツマミと、これと連動した手動又は電動によるラック・アンド・ピニオンなどの手段により具現することができる。また、載置台斜傾機構は、電動式、油圧式又は空気圧式のアクチュエーターを載置台3が斜めに傾くように任意の位置で1箇所又は複数箇所設けることにより具現することができる。
【0049】
また、本発明に係るコロニーピッキング装置1は、個別にピッキングした融合細胞を個別に培養できるように用意した個別の培地にまき込むために、図3(a)及び(b)に示すように、融合細胞の培養に用いられたコロニー群を有する培養用容器の位置P1と、前記個別の培地が添加された培養用容器の位置P2とを交換する容器位置入換手段6を前記載置台3上に備えていてもよい。このような容器位置入換手段6としては例えば、載置台3に、当該載置台3の面内方向において円回転する回転盤61(図3(a)参照)や、当該載置台3の面内方向において水平移動する水平移動盤62(図3(b)参照)を挙げることができ、この回転盤61上又は水平移動盤62上の所定の位置P1,P2に融合細胞の培養に用いられた、コロニー群を有する培養用容器と、前記個別の培地が添加された培養用容器とを固定できるようにするとよい。
【0050】
なお、回転盤61は、図3(a)に示すように、載置台3の面内方向において円回転することにより、培養用容器の位置P1と位置P2を相互に入れ換えることができる。また、水平移動盤62は、図3(b)に示すように、載置台3の面内方向において水平に移動することで、同図中実線で示す培養用容器の位置P1と位置P2を、同図中破線で示す位置P1と位置P2に相互に入れ換えることができる。
これらの容器位置入換手段6を備えていれば、コロニー群を有する培養用容器の位置P1と、前記個別の培地が添加された培養用容器の位置P2とを入れ換えるだけで、細管体4でピッキングした融合細胞を個別の培地に確実且つ容易にまき込むことができる。
【0051】
次に、本発明に係るコロニーピッキング装置1の使用態様について説明する。
まず、常法により細胞融合され、選択培地で選択培養され、1次スクリーニングが行われて、その結果が陽性であったウェルを有する96ウェルプレートなどの培養用容器を載置台3上に載置し、固定する。
【0052】
そして、顕微鏡2で陽性であったウェル内のコロニー群を観察しつつ、図2の(b)に示すように、保持具43で保持された細管体4の先端部41を慎重にウェル内に挿入し、当該先端部41をコロニー群の中から任意に選択した1つのコロニーに接触させる。例えば、図4の(a)及び(b)に示すように“B5”“C2”“C13”などとナンバリングしたコロニー群の中から融合細胞のコロニーを1つ選び先端部41を接触させる。そして、圧力制御装置5で接続手段51と接続された細管体4内を陰圧にして、選んだ1つのコロニーから1個若しくは複数個の融合細胞を吸い上げてピッキングする。そして、可動部42、並びに、必要に応じて、可動部42a、前記した容器可動機構、前記した載置台可動機構、前記した載置台斜傾機構及び容器位置入換手段6などによって、前記個別の培地が添加された培養用容器のウェル内の培地上に前記先端部41を移動させた後、これを下方に慎重に降下させて当該先端部41と当該個別の培地とを接触させる。そして、圧力制御装置5で接続手段51と接続された細管体4内を陽圧にし、ピッキングした融合細胞を培地上に吐出することで融合細胞を培地にまき込むことができる。
その後は、培地にまき込んだ融合細胞を所定の条件で培養し、常法により2次スクリーニングやクローニング等を行うことで、シングルセルクローンからなる細胞株を得ることができる(図1(b)参照)。
【0053】
このように、本発明に係るコロニーピッキング装置1は、載置台3に対して少なくとも上下方向に可動する可動部42を備えた保持具43に保持された細管体4と、この細管体4と接続された圧力制御装置5とを有することによって、融合細胞をピッキングするピッキング手段(ピッキング工程S10)を具現し、融合細胞をピッキングした細管体4と、これを他の培養用容器に用意した個別の培地上に移動させる可動部42、並びに、必要に応じて可動部42a、容器可動機構、載置台可動機構、載置台斜傾機構及び容器位置入換手段6等と、細管体4と接続された圧力制御装置5とを有することによって、ピッキングした融合細胞を前記した他の培養用容器に用意した個別の培地上にまき込むまき込み手段(まき込み工程S20)を具現している。なお、ピッキング手段及びまき込み手段を具現する手段はこれに限定されるものではなく、他の構成例によっても具現可能であることはいうまでもない。
【実施例】
【0054】
次に、本発明の効果を奏する実施例について、本発明の効果を奏しない比較例と対比して説明する。
(比較例)
比較例では、非特許文献2に記載の手法に従って、生体内で発現量が少なく、融合細胞の増殖速度が遅いタンパク質αのモノクローナル抗体を産生する融合細胞(ハイブリドーマ)のクローニングを試みた。
【0055】
つまり、この比較例では、gp64トランスジェニックマウスと掛け合わせた、タンパク質αのノックアウトマウス(タンパク質αKOマウス)に、当該タンパク質αの全長DNAを導入し、タンパク質αを表面に提示させたバキュロウイルス(BV)を常法により精製し、2〜4週間おきに3回免疫した。なお、免疫は腹腔内投与により行い、その投与量は1匹あたりブラッドフォード値で0.1mgとした。
【0056】
抗血清を免疫ごとにFACS評価し、抗血清評価で差があったマウスを用いて常法により細胞融合を行い、融合細胞(ハイブリドーマ)を得、FACS法により1次スクリーニングを行ったところ、複数枚の96ウェルプレートから約500個の陽性ウェルを得ることができた。96ウェルプレート内の培地は、20%FBSを添加したRPMI1640培地を用い、5%CO2、37℃の条件で培養した。
【0057】
陽性であったウェル内の培地を24ウェルプレートのウェルに移してスケールアップし、FACS法により2次スクリーニングを行ったところ、Geo Meanが1次スクリーニング時よりも1/5〜1/10程度に低下した。つまり、陽性であったウェル内に含まれる、抗タンパク質α抗体を産生する融合細胞が、抗タンパク質α抗体を産生しない融合細胞との生存競争に敗れてしまったために抗タンパク質α抗体を産生するシングルセルクローンを得ることができなかった。
【0058】
(実施例1)
実施例1では、融合細胞の作製と1次スクリーニングの操作までを比較例と同じ条件で行った。なお、96ウェルプレート内の培地は、比較例と同じものを用い、比較例と同じ条件で培養した。1次スクリーニングの結果、比較例とほぼ同じ数(480個)の陽性ウェルを得ることができた。
【0059】
そして、実施例1では、図2に示すコロニーピッキング装置1を用いて1次スクリーニングで陽性であったウェル内に含まれる融合細胞のコロニーから1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングし、ピッキングした融合細胞を個別に培養できるように用意した個別の培地(96ウェルプレートを使用)にまき込んだ。かかる作業を細胞融合で得ることのできた陽性ウェル内に含まれる全てのコロニーに対して行った。なお、個別の培地として使用した培地は、比較例と同じものを用いた。
【0060】
ここで、実施例1で用いたコロニーピッキング装置1は、株式会社成茂科学器械研究所製のマニピュレーターを複数組み合わせて作製したものであり、発明を実施するための形態の項目で説明したような構成を有している。すなわち、当該コロニーピッキング装置1は、顕微鏡2と、載置台3と、細管体4と、圧力制御装置5とを主に備えて構成されている(図2及び本明細書の該当する箇所を参照のこと。ここでのコロニーピッキング装置1の構成についての詳細な説明は省略する)。
【0061】
そして、個別の培地にまき込んだ融合細胞を5%CO2濃度下、37℃でウェル内のコロニーの区別がつくくらいまで培養した。なお、培養日数は、成長の早いコロニー群で3〜5日ほどであり、成長の遅いコロニー群では7〜10日ほどであった。個別の培地にまき込んで培養した融合細胞についてCell ELISA法を行って2次スクリーニングしたところ、71個の陽性ウェルを得ることができた。さらに、得られた陽性ウェル71個についてFACS法によって3次スクリーニングし、限界希釈法によりクローニングしたところ、5個のウェルについて陽性ウェル(陽性クローン)を得ることができた。
【0062】
実施例1では、融合細胞を作製した後、最終的な5個の陽性ウェルを得るまで合計2週間程を要した。これは、1次スクリーニングを行った後、24ウェルプレートでスケールアップを行ってから2次スクリーニング及びクローニングを行う一般的な従来法(通常、3〜4週間程度を要する)に比べておよそ2/3〜1/2以下の日数しか要しなかった。また、使用したウェルプレートも96ウェルプレートのみであった。
従って、実施例1によれば、目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つ従来法に比べてかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することができた。
【0063】
(実施例2)
実施例2では、免疫を実施例1と異なる条件で行った以外は、全く同じ条件で実験を行った。実施例1における免疫は、抗原として、タンパク質αの全長DNAを導入し、タンパク質αを表面に提示させたBVを常法により精製し、腹腔内投与する(投与量は、1匹あたりブラッドフォード値で0.1mg)とともに、精製したタンパク質α(投与量は、1匹あたりブラッドフォード値で0.005mg)を完全フロイントアジュバントとともに腫瘍近傍皮下投与することによって免疫した。
【0064】
1次スクリーニングの結果、実施例1とほぼ同じ数(480個)の陽性ウェルを得ることができた。陽性ウェル内に含まれる融合細胞のコロニーから1つのコロニーを選択して当該コロニーに含まれる融合細胞を実施例1と同様にコロニーピッキング装置1でピッキングし、ピッキングした融合細胞を個別に培養できるように用意した個別の培地にまきこんで培養した。培養日数は、実施例1と同様に、成長の早いコロニー群で3〜5日ほどであり、成長の遅いコロニー群では7〜10日ほどであった。培養した融合細胞についてCell ELISA法を行って2次スクリーニングしたところ、53個の陽性ウェルを得ることができた。さらに、得られた陽性ウェル53個についてFACS法によって3次スクリーニングし、限界希釈法によりクローニングしたところ、5個のウェルについて陽性ウェル(陽性クローン)を得ることができた。
【0065】
実施例2によっても実施例1と同じように、融合細胞を作製した後、最終的な5個の陽性ウェルを得るまで合計2週間程を要した。つまり、実施例2も、目的とする分化形質を保持する融合細胞を従来よりも確実に得ることができ、且つ従来法に比べてかかる融合細胞を作製するための労力や時間的及び金銭的な負担を軽減することができた。
【先行技術文献】
【非特許文献】
【0066】
【非特許文献1】Kremer, L., Marquez, G., Methods Mol. Biol., “Generation of monoclonal antibodies against chemokine receptors”, 239, 2004, p.243-260.
【非特許文献2】Ryoichi Saitoh et al., Journal of Immunological Methods, ”Viral envelope protein gp64 transgenic mouse facilitates the generation of monoclonal antibodies against exogenous membrane proteins displayed on baculovirus”, 322, 2007, p.104-117.
【符号の説明】
【0067】
S10 ピッキング工程
S20 まき込み工程
S3 ピッキング前スクリーニング工程
S25 クローニング工程
S30 培養工程
S33 培養後スクリーニング工程
S35 クローニング工程
1 コロニーピッキング装置
2 顕微鏡
3 載置台
4 細管体
41 先端部
42,42a 可動部
43 保持具
44 基端部
5 圧力制御装置
51 接続手段
6 容器位置入換手段
61 回転盤
62 水平移動盤
【特許請求の範囲】
【請求項1】
細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、
前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、
前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程と、
を含むことを特徴とするコロニーピッキング方法。
【請求項2】
細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング装置であって、
前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞を、前記融合細胞の大きさの1〜40倍の大きさの内径を有する先端部を備えた細管体によってピッキングするピッキング手段と、
前記細管体でピッキングした融合細胞を個別の培地にまき込むまき込み手段と、
を含むことを特徴とするコロニーピッキング装置。
【請求項3】
細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを作製するための融合細胞クローン作製方法であって、
前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、
前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程と、
個別の培地にまき込んだ融合細胞を培養する培養工程と、
を含むことを特徴とする融合細胞クローン作製方法。
【請求項4】
前記ピッキング工程の前に、前記陽性であったウェル内に含まれる融合細胞のコロニーの中から陽性を示す融合細胞のコロニーを検出するピッキング前スクリーニング工程を行うことを特徴とする請求項3に記載の融合細胞クローン作製方法。
【請求項5】
前記まき込み工程の後に、前記融合細胞をクローニングするクローニング工程を行うことを特徴とする請求項3又は請求項4に記載の融合細胞クローン作製方法。
【請求項6】
前記培養工程の後に、培養した融合細胞の陽性反応を確認する培養後スクリーニング工程を行うことを特徴とする請求項3又は請求項4に記載の融合細胞クローン作製方法。
【請求項7】
前記培養後スクリーニング工程の後に、当該培養後スクリーニングの結果が陽性であった融合細胞をクローニングするクローニング工程を行うことを特徴とする請求項6に記載の融合細胞クローン作製方法。
【請求項1】
細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング方法であって、
前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、
前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程と、
を含むことを特徴とするコロニーピッキング方法。
【請求項2】
細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを得るために行われるコロニーピッキング装置であって、
前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞を、前記融合細胞の大きさの1〜40倍の大きさの内径を有する先端部を備えた細管体によってピッキングするピッキング手段と、
前記細管体でピッキングした融合細胞を個別の培地にまき込むまき込み手段と、
を含むことを特徴とするコロニーピッキング装置。
【請求項3】
細胞融合され、選択培地で選択培養された後に行う1次スクリーニングの結果が陽性であったウェル内に含まれる融合細胞のコロニーから融合細胞のクローンを作製するための融合細胞クローン作製方法であって、
前記ウェル内に含まれる融合細胞のコロニーの中から1つのコロニーを選択して当該コロニーに含まれる融合細胞をピッキングするピッキング工程と、
前記ピッキングした融合細胞を個別の培地にまき込むまき込み工程と、
個別の培地にまき込んだ融合細胞を培養する培養工程と、
を含むことを特徴とする融合細胞クローン作製方法。
【請求項4】
前記ピッキング工程の前に、前記陽性であったウェル内に含まれる融合細胞のコロニーの中から陽性を示す融合細胞のコロニーを検出するピッキング前スクリーニング工程を行うことを特徴とする請求項3に記載の融合細胞クローン作製方法。
【請求項5】
前記まき込み工程の後に、前記融合細胞をクローニングするクローニング工程を行うことを特徴とする請求項3又は請求項4に記載の融合細胞クローン作製方法。
【請求項6】
前記培養工程の後に、培養した融合細胞の陽性反応を確認する培養後スクリーニング工程を行うことを特徴とする請求項3又は請求項4に記載の融合細胞クローン作製方法。
【請求項7】
前記培養後スクリーニング工程の後に、当該培養後スクリーニングの結果が陽性であった融合細胞をクローニングするクローニング工程を行うことを特徴とする請求項6に記載の融合細胞クローン作製方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−50259(P2011−50259A)
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願番号】特願2009−199634(P2009−199634)
【出願日】平成21年8月31日(2009.8.31)
【出願人】(509244709)
【出願人】(509245131)
【出願人】(509245142)
【出願人】(591044050)株式会社成茂科学器械研究所 (1)
【Fターム(参考)】
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願日】平成21年8月31日(2009.8.31)
【出願人】(509244709)

【出願人】(509245131)

【出願人】(509245142)

【出願人】(591044050)株式会社成茂科学器械研究所 (1)
【Fターム(参考)】
[ Back to top ]

