バイオセンサ、その製造方法、その使用方法
【課題】検出感度を低下させることなく、迅速かつ高精度に基質量を定量する。
【解決手段】バイオセンサ1は、絶縁性基板101と、絶縁性基板101に設けられている作用極102、対極103および参照極105からなる電極と、電極と接するように設けられ、酸化還元酵素および電子受容体を含む反応層104と、を備える。電子受容体は、酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含む。
【解決手段】バイオセンサ1は、絶縁性基板101と、絶縁性基板101に設けられている作用極102、対極103および参照極105からなる電極と、電極と接するように設けられ、酸化還元酵素および電子受容体を含む反応層104と、を備える。電子受容体は、酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオセンサ、その製造方法よびその使用方法に関する。
【背景技術】
【0002】
従来のバイオセンサとしては、例えば特許文献1に記載されたものがある。このバイオセンサは、フェロセン電解質由来のフェリシウムイオンを電子受容体として用いる。フェリシウムイオンは、グルコースの酸化反応から生じた電子と直接反応して、フェロセンに還元される。そのため、あらかじめ電極上で電子受容体を酸化体に変換させる必要がない。したがって、検出感度を低下させることなく、酵素反応を短時間で進行させることができる。
【0003】
フェリシウムイオンを電子受容体として用いることにより、生体試料や食品などの試料中のグルコースを迅速に定量することができる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平9−304329号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
【0006】
第一に、フェロセンの酸化電流を得るためには、印加電圧を高くしなければならないという問題があった。
【0007】
特許文献1記載のバイオセンサでは、フェロセンの酸化電流の大きさを応答電流値として測定する。これにより得られた応答電流値の大きさは、試料中に存在するグルコース濃度に比例する。したがって、応答電流値を測定することにより試料中のグルコースを定量することができる。
【0008】
ところが、フェロセンの酸化には、高い印加電圧が必要とされる。そうすると、試料中に含まれる干渉物質、たとえば尿酸、ビリルビン、アスコルビン酸、アセトアミノフェンなど)の影響を受けやすいこととなる。その結果として、測定精度が低下することとなる。
【0009】
第二に、フェリシウムイオンは高価な試薬であり、使い捨てのバイオセンサではコストがかかりすぎてしまうという問題があった。
【0010】
以上のことから、安価で酸化電流を得るための印加電圧のより低い電子受容体が望まれていた。
【0011】
本発明は上記事情に鑑みてなされたものであり、検出感度を低下させることなく、迅速かつ高精度にグルコース等の基質量を定量することができるバイオセンサを提供するものである。
【課題を解決するための手段】
【0012】
本発明によれば、基板と、
前記基板に設けられている電極と、
前記電極と接するように設けられ、酸化還元酵素および電子受容体を含む反応層と、
を備え、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサ
が提供される。
【0013】
また、本発明によれば、基板を準備する工程と、
前記基板に電極を設ける工程と、
酸化還元酵素および電子受容体を含む反応層を前記電極に接するように設ける工程と、
を含み、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサの製造方法
が提供される。
【0014】
また、本発明によれば、上記のバイオセンサの使用方法であって、
酸化還元酵素および電子受容体を含む反応層に試料を添加するステップと、
添加された前記試料中の基質と前記酸化還元酵素とを反応させるステップと、
反応した前記酸化還元酵素と前記電子受容体とを反応させるステップと、
反応した前記電子受容体に電位を印加するステップと、
前記電位を印加された前記電子受容体から発生する電流を測定するステップと、
を含むバイオセンサの使用方法
が提供される。
【0015】
この発明によれば、電子受容体として酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を用いる。これにより、酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体は、基質と反応して還元された酸化還元酵素と直接反応することができる。したがって、電極に電圧を印加することで検出される電流値は、酸化還元酵素と電子受容体との反応によって生成された還元体の応答電流のみが検出されることとなり、還元型の電子受容体を仕込んだときよりもベース電流を低くすることができる。よって、検出感度を低下させることなく、試料中の基質量を迅速に精度よく測定することが可能となる。
【0016】
また、酸化電流を得るための印加電圧は、フェロシアンよりもテトラチアフルバレンまたはテトラチアフルバレン誘導体の方が低い。そのため、酸化還元酵素との反応により酸化型から還元型に変換した電子受容体を再酸化するための印加電圧を低くすることができ、干渉物質の影響を受けにくくすることができる。したがって、検出感度を低下させることなく、迅速かつ高精度に試料中の基質量を測定することが可能となる。
【0017】
さらに、テトラチアフルバレン等の酸化体は、テトラチアフルバレン等を過酸化物等の酸化剤と作用させて容易に調製することができる。したがって、フェリシウムイオンよりもコストの点で有利である。そのため、本発明の構成は、ディスポーザブル式のバイオセンサに適している。
【0018】
また、本発明は、電子受容体がシクロデキストリンで包接されている構成を採用することができる。これにより、電子受容体の親水性を向上させることができる。したがって、電子受容体を容易に電極に塗布することが可能となる。
【0019】
また、本発明は、反応層に界面活性剤が含まれている構成を採用することができる。これにより、酸化型テトラチアフルバレンが酸化還元酵素と反応することで得られたテトラチアフルバレンの水に対する溶解性を向上させることができる。また、酸化型テトラチアフルバレン誘導体が酸化還元酵素と反応することで得られた還元体のテトラチアフルバレン誘導体も同様に、水に対する溶解性を向上させることができる。
【0020】
また、本発明は、反応層が、酸化還元酵素を含む酵素層と、電子受容体を含むメディエーター層と、を含み、酵素層はメディエーター層に接しており、電極の表面にメディエーター層が設けられている構成を採用することができる。こうすることにより、基質と反応した酵素が、酵素層とメディエーター層との界面で酸化型の電子受容体に即座に作用することができる。したがって酵素および電子受容体間の電子の送受を効率よく行うことができ、より迅速に試料中の基質量を測定することができる。
【0021】
また、本発明は、反応層に含有される酸化型のテトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体が反応層の全体にわたって分布している構成を採用することができる。これにより、基質と反応した酵素が、酸化型の電子受容体に即座に作用することができる。したがって酵素および電子受容体間の電子の送受を効率よく行うことができ、より迅速に試料中の基質量を測定することができる。
【0022】
また、本発明は、メディエーター層に含まれる酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体がメディエーター層の全体にわたって分布している構成を採用することができる。これにより、基質と反応した酵素が、酵素層とメディエーター層との界面で酸化型の電子受容体に即座に作用することができる。そして、還元型となった電子受容体は濃度勾配差を利用して迅速に電極の表面に向かって移動することができる。したがってより迅速に試料中の基質量を測定することができる。
【0023】
また、本発明は、酸化還元酵素がグルコース酸化酵素またはグルコース還元酵素である構成を採用することができる。具体的には、グルコースデヒドロゲナーゼまたはグルコースオキシゲナーゼを用いることができる。これにより、本発明は、グルコースセンサとして利用することが可能となる。
【0024】
さらに本発明の構成は、電子受容体が二電子酸化体である構成を採用することができる。これにより、試料中の基質と反応した酵素はより迅速に電子受容体と反応することができる。したがって、試料中に含まれる基質濃度をさらに迅速に測定することができる。
【発明の効果】
【0025】
本発明によれば、検出感度を低下させることなく、迅速かつ高精度にグルコース等の基質量を測定することができる。
【図面の簡単な説明】
【0026】
【図1】実施の形態に係るバイオセンサを模式的に示した断面図である。
【図2】実施の形態に係るバイオセンサを模式的に示した平面図である。
【図3】変形例に係るバイオセンサを模式的に示した断面図である。
【図4】実施例に係る酸化型の電子受容体の紫外可視近赤外光吸収スペクトルの結果である。
【図5】実施例に係る酸化型の電子受容体の紫外可視近赤外光吸収スペクトルの結果である。
【図6】実施例に係る酸化型の電子受容体の紫外可視近赤外光吸収スペクトルの結果である。
【図7】実施例に係る酸化型の電子受容体を精製する方法を説明する図である。
【図8】実施例に係る酸化型の電子受容体を精製した後の紫外可視近赤外光吸収スペクトルの結果である。
【図9】実施例に係るバイオセンサを用いた測定結果を示す図である。
【図10】実施例に係るバイオセンサを用いた測定結果を示す図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施の形態について、図面を用いて説明する。尚、すべての図面において、同様な構成要素には同様の符号を付し、適宜説明を省略する。
【0028】
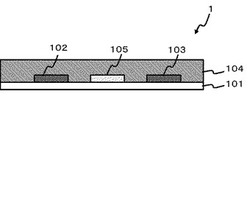
図2は、本実施の形態のバイオセンサ1を示す模式的な平面図である。図1は、図2のA−A'断面図である。バイオセンサ1は、絶縁性基板101と、絶縁性基板101に設けられている電極106と、電極106と接するように設けられ、酸化還元酵素および電子受容体を含む反応層104と、を備える。また、バイオセンサ1は、電子受容体として、酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を反応層104に含有する。「テトラチアフルバレン」(tetrathiafulvalene(TTF))またはテトラチアフルバレン誘導体」は、総称して、以下、「TTF化合物」ともいう。反応層104に含有される酸化型TTF化合物は反応層104の全体にわたって分布している。
【0029】
絶縁性基板101には、セラミック、プラスチック、シリコン、アルミナガラス板または高分子材料を使用することができる。好ましくは、ポリエチレンテレフタレート、ポリビニルクロライド及びポリカーボネードなどの合成樹脂板を用いることができる。
【0030】
電極106として、作用極102および対極103からなる二極系電極を採用することができる。作用極102、対極103は、導電性材料を用いて形成させることができる。導電性材料とは、炭素、またはパラジウム、銀、白金、金、銅、ニッケル、それらの合金等の金属材料である。また、電極106として、図1および図2で示すような、作用極102、対極103および参照極105からなる三極系電極を採用することもできる。三極系電極を採用することで、安定に応答電流を得ることができ、測定精度を安定化させることができる。参照極105も、作用極102及び対極103と同様に、導電性材料を用いて形成させることができる。電極は1種の導電性材料により形成させてもよいし、2種以上の導電性材料により形成させてもよい。これにより、安定した応答電流が得られ、精度がさらに安定化する。作用極102、対極103および参照極105は、スクリーン印刷、スパッタ法、または蒸着法により絶縁性基板101に塗布することにより形成させることができる。電極106には、表面が絶縁膜30で覆われている絶縁領域と、反応層104で覆われている測定領域と、電圧を印加するための印加領域と、が設けられている。印加領域では、電極106の表面が露出している。
【0031】
反応層104は、少なくとも1種の酸化還元酵素および少なくとも1種の電子受容体を含有する。
【0032】
電子受容体としては、少なくとも一種の酸化型TTF化合物を用いるが、二種以上の酸化型TTF化合物を用いてもよい。酸化型TTF化合物(酸化型TTFおよび酸化型TTF誘導体)とは、TTF化合物の1電子酸化体または2電子酸化体をいう。TTF化合物が1電子放出することで1電子酸化体となり、TTF化合物から2電子放出されることで2電子酸化体となる。TTF誘導体として、たとえば、4−エトキシカルボニル−4',5,5'−トリメチルテトラチアフルバレン(Me3TTF−CO2Et)、8−メルカプトオクチルテトラチアフルバレンカルボキシレートなどを例示することができる。
【0033】
酸化型TTF化合物は、TTF化合物を適当な溶媒に溶解し、酸化剤と作用させることで調整することができる。溶媒は、TTF化合物、および、その酸化体が溶解する溶媒であればどのようなものであっても用いることができるが、たとえば、アセトニトリルを例示することができる。酸化剤には、過酸化物を例示することができる。過酸化物として、たとえば、過塩素酸鉄(III)を用いることができる。
【0034】
反応式1にTTFの酸化還元反応を示す。化合物1がTTFであり、TTFが1電子放出することによりTTFの1電子酸化体であるテトラチアフルバレン・カチオンラジカル(TTF・+)(化合物2)となる。さらに化合物2から1電子放出されることにより、TTFの2電子酸化体であるテトラチアフルバレン・カチオンラジカル(TTF・2+)(化合物3)となる。換言すると、化合物2および化合物3が酸化型TTFである。それぞれの反応は可逆反応であり、化合物2及び化合物3は、還元剤と作用させることにより化合物1に還元することができる。還元剤としてたとえば、アスコルビン酸、ジチオスレイトール(DTT)などを用いることができる。
【0035】
(反応式1)

【0036】
反応層104中の酸化型TTF化合物の含有量は、特に限定されず、必要に応じて適切な量を選択することができるが、好ましくは、TTF化合物の1電子酸化体を0.05〜10mMを含む。
【0037】
酸化還元酵素は、測定対象となる様々な基質と反応して酸化される。酸化された酵素が、TTF化合物の酸化体と酸化還元反応をすることで、基質量を定量することができる。
【0038】
たとえば、酸化還元酵素には、グルコースオキシダーゼ(GOD)、グルコースデヒドロゲナーゼを用いることができる。また、乳酸オキシダーゼ、乳酸デヒドロゲナーゼ、コレステロールオキシダーゼ(ChOD)、およびこれらの組合せを用いることができる。
【0039】
バイオセンサ1をグルコースセンサとする場合、酸化還元酵素として、グルコースオキシダーゼ(GOD)またはグルコースデヒドロゲナーゼを用いることができる。
【0040】
酸化還元酵素として、GODを用いる場合の測定メカニズムは反応式2に基づく。
【0041】
(反応式2)
グルコース + GOD(酸化体) → グルコン酸 + GOD(還元体)
GOD(還元体) + 酸化型TTF化合物 → GOD(酸化体)+TTF化合物(還元体)
【0042】
反応式2で示すように、測定試料中のグルコースは、GODの触媒反応によりGODを還元させることで、グルコースがグルコン酸に酸化される。そしてGODは電子を酸化型TTF化合物に伝達して元の状態に戻り、酸化型TTF化合物が還元されてTTF化合物(還元体)となる。TTF化合物が電気化学的に酸化されることで、酸化型TTF化合物になるが、このとき、得られる酸化電流を応答電流値として測定する。この応答電流値は、測定試料中に存在するグルコース濃度に比例する。
【0043】
反応層104中の酸化還元酵素の含有量は、特に限定されず、必要に応じて適切な量を選択することができる。たとえば、グルコースオキシダーゼを用いる場合、その含有量は、0.1〜40ユニット/μLが好ましい。ここで、「1ユニット」とは、1μmolの基質を1分間で酸化させるために必要な、酸化還元酵素の量をいう。
【0044】
バイオセンサ1は、酸化型TTF化合物がシクロデキストリンで包接されている構成を採用することができる。これにより親水性が向上するため、電極に塗布しやすくなる。
【0045】
シクロデキストリンとしては、特に制限されないが、例えば、α−シクロデキストリン、β−シクロデキストリンやγ−シクロデキストリン等を使用することができる。また、化学修飾されたシクロデキストリンであってもよく、例えば、ヒドロキシシクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン(hp−β−CD)、ジメチル−β−シクロデキストリン、カルボキシメチル−β−シクロデキストリン等の化学修飾体があげられ、中でも、ヒドロキシプロピル−β−シクロデキストリンが好ましい。これらは一種類でもよいし、二種類以上を併用してもよい。
【0046】
酸化型TTF化合物は1モルあたり、例えば、40重量%以下のシクロデキストリンによって包接されていることが好ましく、より好ましくは0.1〜20重量%であり、特に好ましくは1〜10重量%である。シクロデキストリンの濃度が高すぎると粘性が高くなるという点で問題があり、低すぎると可溶化が難しくなるという点で問題がある。
【0047】
酸化型TTF化合物は、シクロデキストリンを用いた公知の包接方法により包接することができる。例えば、シクロデキストリンを水性溶媒に溶解したシクロデキストリン溶液と、酸化型TTF化合物を懸濁した酸化体懸濁液と、を準備し、両者を混合させることで当該酸化型TTF化合物を包接させることができる。
【0048】
シクロデキストリン溶液に対する酸化型TTF化合物の割合は、酸化型TTF化合物を溶解できれば特に制限されないが、たとえば、40重量%以下のシクロデキストリンの溶液に当該酸化型TTF化合物を5mMとなるように溶解させることができる。シクロデキストリンの溶液は、1〜10重量%であるとより好ましい。
【0049】
水性溶媒としては、たとえば、水、緩衝液等が使用できる。緩衝液としては、TES(N−Tris(hydroxymethyl)methyl−2−aminoethanesulfonic acid)緩衝液、HEPES(2−[4−(2−Hydroxyethyl)−1−piperazinyl]ethanesulfonic acid)緩衝液などを用いることができる。緩衝液は、塩化ナトリウムを含んでいてもよい。
【0050】
溶媒のpHは4〜8とすると好ましい。pHが大きすぎたり小さすぎたりすると酵素が失活してしまうため好ましくない。
【0051】
また、反応層104は、界面活性剤を含むことができる。
【0052】
電子受容体として酸化型TTF化合物を使用することで、反応式2で示すように、酸化還元酵素の還元体と酸化型TTF化合物とが反応し、酸化還元酵素が酸化されるとともに酸化型TTF化合物からTTF化合物(還元体)が生成される。TTF化合物は、水に対する溶解度が低い。そのため、測定試料中に含まれる水によって生成した還元体が反応層上に析出することがある。そこで、反応層104に界面活性剤を含ませることにより、生成したTTF化合物(還元体)の水に対する溶解性を向上させることができる。
【0053】
界面活性剤としては、たとえば、レシチン、オクチルチオグルコシド、コール酸ナトリウム、ドデシル−β−マルトシド、デオキシコール酸ナトリウム、タウロデオキシコール酸ナトリウム、Tritron−X(登録商標)、Lubrol PX(登録商標)、DK−エステル(登録商標)、BIGCHAP(登録商標)、DeoxCHAP(登録商標)、ラウリル硫酸ナトリウム(sodium dodecyl sulfate、SDS)、およびTween20(ポリオキシエチレンソルビタンモノラウラート)を用いることができる。Tritron−X(登録商標)、SDS、およびTween20を用いると特に好ましい。
【0054】
測定試料には、血液、尿、唾液等の体液等や、果汁等の食品を例示することができる。
【0055】
つづいて、バイオセンサ1の製造方法の一例について説明する。
【0056】
まず、基板を準備し、基板にスクリーン印刷、スパッタ法、または蒸着法等、公知の方法により、作用極102を形成させる。ついで、基板上に絶縁性ペーストをスクリーン印刷して絶縁膜30を形成し、絶縁性基板101を得る。絶縁層30は作用極102の外周を覆うように形成させる。そして、作用極102に並列するように、対極103および参照極105を設ける。
【0057】
その後、酸化還元酵素および電子受容体を含む反応層104を絶縁性基板101上に設ける。具体的には、反応層104は、以下のようにして絶縁性基板101上に形成させることができる。
【0058】
酸化型TTF化合物、シクロデキストリン、界面活性剤及び酸化還元酵素を水性溶媒に混合調整し、絶縁性基板101の表面に塗布した後、乾燥させてバイオセンサ1を完成する。乾燥は、酸化還元酵素が失活しない温度であり、かつ、至適温度以下で行うと好ましい。
【0059】
つづいて、バイオセンサ1を用いて試料液中に含まれる基質濃度を測定する方法について説明する。
【0060】
まず、測定試料を反応層104に添加する。測定試料の添加により反応層104が溶解し、試料中の基質と酸化還元酵素との反応、および、この反応に続く酸化還元酵素と電子受容体との反応が進行する。これら反応を進行させるため、バイオセンサ1を所定時間放置した後、対極103に対して作用極102にアノード方向にパルス電圧(0〜+0.3V)を印加する。応答電流が発生し、応答電流値が公知の方法で測定される。あらかじめ既知の濃度の基質を用いて作成した基質濃度と応答電流値との検量線を用いて、得られた応答電流値から基質濃度を求める。
【0061】
つづいて、バイオセンサ1の作用および効果について図1、2を用いて説明する。
【0062】
バイオセンサ1によれば、電子受容体として酸化型TTF化合物を用いる。これにより、酸化型TTF化合物は、基質と反応して還元された酸化還元酵素と直接反応することができる。したがって、酸化還元酵素との反応によって生成されたTTF化合物の酸化電流のみが応答電流値として検出されることとなり、還元型の電子受容体を仕込んだときによりもベース電流を低くすることができる。よって、検出感度を低下させることなく、試料中の基質量を迅速に精度よく測定することが可能となる。
【0063】
従来、TTF化合物は電子受容体として用いられていた。しかしながら、酸化還元酵素は、酸化型TTF化合物としか反応しない。そのため、TTF化合物をそのまま反応層に仕込むと、TTF化合物をいったん酸化型TTF化合物に変換する必要があった。その結果、酸化反応時に発生する電流により、ベース電流が高くなるという問題があった。つまり、ベース電流が高くなることで、基質に対する応答電流が相対的に小さくなり、結果として検出感度が低下するという問題があった。
【0064】
また、使用時に酸化型TTF化合物を生成させると、酸化反応にばらつきがあり、バイオセンサの性能を低下させる原因にもなっていた。また、どの程度TTF化合物が酸化されているのか予測することができず、どの程度電子受容体を仕込んでおけばよいかを見通しを立てることができなかった。
【0065】
ところが、バイオセンサ1では、あらかじめ酸化型TTF化合物を仕込んでおく。これにより、仕込みに必要な電子受容体の量を予測して、バイオセンサを設計することができる。これにより、個々のバイオセンサの性能を均一にすることができ、各チップ間でのばらつきを少なくすることができる。したがって、使い捨てのバイオチップであっても、安定した測定結果を得ることができる。また、所望の性能を有するバイオセンサを用意することも可能となる。
【0066】
また、TTF化合物を再び酸化型TTF化合物に酸化するための印加電圧は、0〜+0.3Vであって、フェロシアンを酸化するための印加電圧(+0.4〜+0.7V)よりも低い。したがって、TTF化合物は、試料中に含まれる干渉物質の影響を受けにくく、高精度に試料中の基質濃度を定量することが可能となる。
【0067】
さらに、酸化型TTF化合物は、TTF化合物を過酸化物と作用させて容易に調製することができる。したがって、フェリシウムイオンよりもコストの点で有利である。そのため、バイオセンサ1は、ディスポーザブル式のバイオセンサとして利用することが可能である。
【0068】
また、バイオセンサ1は、反応層104に含有される酸化型TTF化合物としてTTF化合物の2電子酸化体を採用することができる。2電子酸化体を用いることにより酵素反応により生じた電子とより迅速に反応することができる。したがって、試料中に含まれるグルコース等の基質濃度をさらに迅速に測定することができる。
【0069】
また、バイオセンサ1は、反応層104に含有される酸化型TTF化合物が反応層104の全体にわたって分布している構成を採用することができる。これにより、反応層104の全体にわたって、基質と作用した酸化還元酵素と迅速に反応することができる。したがって、試料中の基質濃度をさらに迅速に測定することができる。
【0070】
さらに、バイオセンサ1は、電子受容体がシクロデキストリンで包接されている構成を採用することもできる。これにより、電子受容体の親水性を向上させることができる。したがって、電子受容体を電極に容易に塗布することが可能となる。
【0071】
以上のように、バイオセンサ1によれば、検出感度を低下させることなく、迅速かつ高精度にグルコース等の基質を定量することができる。
【0072】
以上、図面を参照して本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0073】
たとえば、図3で示すバイオセンサ2の構成を採用することもできる。バイオセンサ2は、反応層204が、酸化還元酵素を含む酵素層204bと、電子受容体を含むメディエーター層204aと、を備える。酵素層204bはメディエーター層204aに接しており、電極106の表面にメディエーター層204aが設けられている。バイオセンサ2とバイオセンサ1とは、反応層104のかわりに反応層204を備える点で異なっている。メディエーター層204aに含まれる酸化型TTF化合物がメディエーター層204aの全体にわたって分布している。
【0074】
酸化還元酵素および電子受容体は反応層内を拡散するため、メディエーター層204aが酸化還元酵素を含むこともあるし、酵素層204bが電子受容体を含むこともある。しかしながら、メディエーター層204aは酵素層204bよりも高濃度かつ均一に酸化型TTF化合物を含んでいる。また、酵素層204bはメディエーター層204aよりも高濃度かつ均一に酸化還元酵素を含んでいる。
【0075】
バイオセンサ2は、酸化型TTF化合物がシクロデキストリン、ナフィオン(登録商標)や有機溶媒で包接されている構成を採用することができる。バイオセンサ1と同様に、シクロデキストリンで包摂させると特に好ましい。これにより親水性が向上するため、電極に塗布しやすくなる。
【0076】
また、バイオセンサ2は、メディエーター層204aと酵素層204bとの間に、界面活性剤を含む界面活性層を形成してもよい。界面活性剤としては、バイオセンサ1で用いられる界面活性剤と同様のものを採用することができる。
【0077】
バイオセンサ2ではたとえば、以下のようにして絶縁性基板101上に反応層204を形成させることができる。
【0078】
酸化型TTF化合物を溶媒に溶解し、得られた酸化型TTF化合物溶液を絶縁性基板101の表面に塗布して乾燥する。その後、作用極102、対極103、参照極105のそれぞれに酸化型TTF化合物溶液を塗布し、再び乾燥させる。乾燥後、形成されたメディエーター層204aの表面に、繰り返し、酸化型TTF化合物溶液を塗布することで、均等にメディエーター層204aを形成させることができる。塗布後、デシケーターに入れる等してメディエーター層204aを念入りに乾燥させる。
【0079】
ここで、酸化型TTF化合物を溶解させる溶媒は、酸化型TTF化合物を溶解し、かつ、揮発しやすいものを用いると好ましい。たとえば、水、揮発性有機溶媒を用いることができ、アセトニトリルを使用するとより好ましい。
【0080】
その後、界面活性剤の溶液を塗布し、さらにデシケーターに入れる等して乾燥させる。これにより、界面活性剤の層を形成させることができる。界面活性剤の存在により、メディエーター層204aと酵素層204bとの界面に発生した還元型TTF化合物の析出を防止することができる。
【0081】
ついで、酸化還元酵素の溶液を塗布し、酵素層204bを形成させる。酸化還元酵素としてGODまたはグルコースデヒドロゲナーゼとすることにより、バイオセンサ2をグルコースセンサとすることができる。最後に、低温下で乾燥させてバイオセンサ2を完成させる。なお、乾燥時の温度は、酸化還元酵素が失活しない温度であり、かつ、至適温度以下とすると好ましい。
【実施例】
【0082】
以下、本発明のバイオチップの実施例について説明するが、本発明はこれに限定されるものではない。
【0083】
(酸化型TTFの調整方法、および、その測定方法)
1.アセトニトリル中でのTTFの酸化
テトラチアフルバレン(TTF)を1mMとなるようアセトニトリルで調整した(以下、「TTF溶液1」という)。過塩素酸鉄(III)(Fe(ClO4)3)を500mMとなるようアセトニトリルで調整した(以下、「過塩素酸鉄(III)溶液1」という)。過塩素酸鉄(III)溶液1に、さらにアセトニトリルを加え、過塩素酸鉄(III)の濃度が0、0.5、1、2.5、5、10、25、50mMの各濃度になるように希釈した(以下、「過塩素酸鉄(III)希釈液1」という)。ついで、TTF溶液1と過塩素酸鉄(III)溶液1とを混合し、TTFが0.1mM、過塩素酸鉄(III)が0、0.5、1、2.5、5、10、25、50mMの各濃度になるようアセトニトリルで希釈した(以下、「混合液1」という)。混合液1を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。
【0084】
結果を図4に示す。図4(a)は、過塩素酸鉄(III)希釈液1の濃度別の吸収スペクトルを示す。図4(b)は、混合液1の過塩素酸鉄(III)濃度別吸収スペクトルを示す。
【0085】
ここで、TTFの1電子酸化体(化合物2)には450nmおよび600nmのそれぞれに吸収があり、TTFの2電子酸化体(化合物3)には375nmに吸収があることが報告されている。(M.Asakawa,P.R.Ashton,V.Balzani,et.al,Angew.Chem.Int.Ed.,1998,37,No.3,333−337)。また、TTFは、300nm付近nmに吸収があることが知られている(S.Hnig,G.Kiesslich,H.Quast,D.Scheutzow,Liebigs Ann.Chem.,1973,310−323)。そこで、図4(b)をみると、435nm、580nm、360nmにそれぞれ吸収が認められる。また、過塩素酸鉄(III)の濃度が増加により、435nm、580nmの吸収が強くなり、過塩素酸鉄(III)50mMでは、360nmの吸収も認められる。一方、300nm付近の吸収は、過塩素酸鉄(III)濃度の増加により、減少している。
【0086】
以上のことから、混合液1中でTTFが過塩素酸鉄(III)により酸化されていることがわかった。よって、アセトニトリル中でTTFの酸化は可能であった。
【0087】
2.90%アセトニトリル+10%超純水中でのTTFの酸化
TTF溶液1と過塩素酸鉄(III)溶液1とを混合し、TTFが0.1mM、過塩素酸鉄(III)が0、0.5、1、2.5、5、10、25、50mMの各濃度になるよう、アセトニトリル、および、超純水(最終濃度10%)で調整した(以下、「混合液2」という)。混合液2を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。ついで、アスコルビン酸(AsA)による再還元も行った。超純水で5mMとなるようAsAを調製した(以下、「AsA溶液1」という)。AsA溶液は、さらに0、0.01、0.05、0.1、0.2、0.5mMの各濃度になるように調整した(以下、「AsA希釈液」という。TTF溶液1と過塩素酸鉄(III)溶液1とAsA溶液とを混合し、TTFが0.1mM、過塩素酸鉄(III)濃度が50mM、AsA濃度が0、0.01、0.05、0.1、0.2、0.5mMの各濃度となるようアセトニトリル、および、超純水(最終濃度10%)で調整した(以下、「混合液3」という)。また、過塩素酸鉄(III)溶液1およびAsA溶液1を混合し、Fe(ClO4)3が50mM、AsAが0.1、0.2、0.5mMの各濃度となるようアセトニトリル及び、超純水(最終濃度10%)で調整した(以下、「混合液4」という)。また、TTF溶液1とAsA溶液1とを混合し、TTFが0.1mM、AsAが0、0.5、1、2.5、5、10、25、50mMの各濃度になるよう、アセトニトリル及び、超純水(最終濃度10%)で調整した(以下、「混合液5」という)。混合液3〜5を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。
【0088】
結果を図5に示す。図5(a)は、混合液2の過塩素酸鉄(III)濃度別吸収スペクトルを示す。図5(b)は、AsA希釈液の濃度別溶液の吸収スペクトルを示す。図5(c)は、混合液4のAsA濃度別吸収スペクトルを示す。図5(d)は、混合液5のAsA濃度別吸収スペクトルを示す。図5(e)は、混合液3のAsA濃度別吸収スペクトルを示す。
【0089】
図5(a)で示すように、過塩素酸鉄(III)濃度の増加により435nm、580nmにおける吸収がそれぞれ増加した。また、過塩素酸鉄(III)濃度が25mM、50mMでは、それぞれ、360nmに吸収が認められた。一方、過塩素酸鉄(III)濃度の増加により300nm付近の吸収は減少した。また、図5(e)で示すように、AsA濃度の増加により435nm、580nmにおける吸収が減少した。一方、300nm付近の吸収が増加した。
【0090】
以上の結果から、過塩素酸鉄(III)によって酸化されたTTFの1電子酸化体は、AsAによってTTFに還元され、可逆的に酸化還元することがわかった。
【0091】
3.超純水系でのTTFの酸化
10%ヒドロキシプロピル−β−シクロデキストリン(hp−β−CD)を含む超純水にてTTFを1mM(以下、「TTF溶液2」という)、Fe(ClO4)3を500mM(以下、「過塩素酸鉄(III)溶液2」という)に調整した。過塩素酸鉄(III)溶液2は、さらに0、1、2.5、5、10、25、50、100mMの各濃度になるように調整した(以下、「過塩素酸鉄(III)希釈液2」という。TTF溶液2と過塩素酸鉄(III)溶液2とを混合し、10%hp−β−CD含有超純水でTTFが0.1mM、過塩素酸鉄(III)が0、0.5、1、2.5、5、10、25、50、100mMの各濃度になるよう調整した(以下、「混合液6」という)。混合液6を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。ついで、アスコルビン酸による再還元を行った。10%hp−β−CD含有超純水でAsA溶液を調製した。(以下、「AsA溶液2」という)TTF溶液2、過塩素酸鉄(III)溶液2、及び、AsA溶液2を混合し、TTFが0.1mM、過塩素酸鉄(III)が10mM、AsAが各濃度となるよう10%hp−β−CD含有超純水で調整した(以下、「混合液7」という)。ついで、過塩素酸鉄(III)溶液2とAsA溶液2とを混合し、過塩素酸鉄(III)溶液2が10mM、AsAが0、0.01、0.02、0.05mMの各濃度になるようアセトニトリルで希釈した(以下、「混合液8」という)。混合液6〜8を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。
【0092】
結果を図6に示す。図6(a)は、過塩素酸鉄(III)希釈液2の濃度別吸収スペクトルを示す。図6(b)は、混合液6の過塩素酸鉄(III)濃度別吸収スペクトルを示す。図6(c)は、AsA溶液2の濃度別吸収スペクトルを示す。図6(d)は、混合液8のAsA濃度別吸収スペクトルを示す。図6(e)は、混合液7のAsA濃度別吸収スペクトルを示す。
【0093】
図6(b)で示すように、過塩素酸鉄(III)濃度の増加により435nm、580nm、360nmにおける吸収が増加している。一方、Fe(ClO4)3濃度の増加により300nm付近における吸収は減少している。また、図6(e)で示すように、AsA濃度の増加により435nm、580nmにおける吸収が減少している。一方、AsA濃度の増加により300nm付近における吸収は増加している。したがって、水系でもTTFを過塩素酸鉄(III)により可逆的に酸化することが可能であった。また、過塩素酸鉄(III)によって酸化されたTTFの1電子酸化体(化合物2)は、AsAによってTTF(化合物1)に還元され、可逆的に酸化還元することがわかった。
【0094】
(酸化型TTFの精製方法)
図7は、固相抽出法を用いて酸化型TTFの精製方法を説明する図である。固相担体は、C18(300mg)を用い、アセトニトリル(2mL)を通液した(図7(a))ついで、超純水(3mL)を通液した(図7(b))。その後、40%アセトニトリルに溶解させたTTF(10mM)、および、過塩素酸鉄(III)(1M)の混液を300μLを添加した(図7(c))。通液後、超純水(2〜3mL)で洗浄し、抽出液を500μLずつ分取した(図7(d))。最後に、アセトニトリル(1−1.5mL)で溶出し、溶出液を500μLずつ分取した(図7(e))。分取した各フラクションを分光光度計にてスペクトル測定した。また、アセトニトリルにより抽出した各フラクションを合わせて濃縮後乾燥し、残渣を得た。使用したTTFが100%酸化型TTFになったものとして、得られた残渣中の酸化型TTFの量を換算し、残渣にアセトニトリルを適量加えて酸化型TTFのアセトニトリル溶液を所望の濃度に調整した。各濃度に調整されたアセトニトリル溶液を435nmにて吸光度測定し、酸化型TTFの換算濃度と吸光度との相関を調べた。
【0095】
結果を図8に示す。図8(a)は、図7(d)で示すステップにおいて、超純水により抽出した各フラクションの吸収スペクトルを示す。図8(b)は、図7(e)で示すステップにおいて、アセトニトリルにより抽出した各フラクションの吸収スペクトルを示す。図8(c)は、435nmの吸光度と酸化型TTFの換算濃度との関係を示したグラフである。
【0096】
図8(a)から、超純水では酸化型TTFは溶出されにくいことがわかった。また、図8(b)から、アセトニトリルで酸化型TTFを溶出できることがわかった。また、固相抽出してもTTFは酸化された状態で存在することがわかった。さらに、435nmの吸光度と換算した酸化型TTF濃度との関係は十分な直線性が得られた。これを検量線として用い、TTFの一電子酸化体の濃度の指標とした。
【0097】
(バイオセンサの作製方法)
1.メディエーター・酵素混合系
バイオセンサ1の構成と同様の構成を有するグルコースセンサA1、A2を以下の方法により作製した。まず、カーボン作用極、銀/塩化銀参照極、カーボン対極が設けられたPET(Polyethylene Terephthalate)基板を用意した。ついで、TTFまたはTTF1電子酸化体を超純水に溶解し、hp−β−CD(5%)、tritonX−100(1%)、GOD(10U/μL)をそれぞれ添加した。その後、各溶液をそれぞれ5μLチップ上に塗布することにより反応層を形成し、24時間以上冷蔵庫にて乾燥させた。TTF含有溶液を塗布したものをグルコースセンサA1とし、TTF1電子酸化体含有溶液を塗布したものをグルコースセンサA2とした。
【0098】
なお、TTF1電子酸化体の溶液は、以下の方法により、所定の濃度に調整した。図7(e)で示すステップで得られたアセトニトリルの溶出液の吸光度を測定する。図8(c)で示す検量線を用い、吸光度の測定値から濃度に変換する。溶出液の容量を正確に量りとり、溶出液を乾燥させる。これにより、所定量の1電子酸化体の粉末を得る。この粉末を溶媒に溶解し、所定濃度に調整する。
【0099】
2.メディエーター、酵素二層系
バイオセンサ2の構成と同様の構成を有するグルコースセンサB1、B2を以下の方法により作製した。まず、カーボン作用極、銀/塩化銀参照極、カーボン対極が設けられたPET基板を用意した。ついで、TTFまたはTTF1電子酸化体それぞれの4mMアセトニトリル溶液を1μLずつ5回に分けて5μLチップ上に塗布した。具体的には、1μL塗布し、乾燥後に再度1μLを電極系上に塗布し、これを5回繰り返した。デシケーター内で乾燥後、5%tritonX−100の水溶液1μLを塗布した。その後、デシケーター内で乾燥し、脱塩した20U/μLのGOD溶液を2.5μL塗布し、24時間以上冷蔵庫にて乾燥させた。TTF含有溶液を塗布したものをグルコースセンサB1とし、TTF1電子酸化体含有溶液を塗布したものをグルコースセンサB2とした。
【0100】
(電気化学測定)
標準サンプルとして、150mM NaClを含む0.1M TES緩衝液(pH 7.5)で調製したグルコース溶液を用意した。また、ボランティアによって採取されたヒト尿、およびこのヒト尿にグルコースを添加したもの尿サンプルとして用意した。サンプル5μLを反応層に添加し、サンプル添加後10秒後に、対極に対して作用極にアノード方向に電圧(0.3mV/vs)を印加し、応答電流の測定を開始した。開始後1分の電流値を測定値とした。測定に用いたグルコースセンサA1、A2、B1、B2は測定ごとに交換した。
【0101】
図9にグルコースセンサA1、A2の結果を示す。図9(a)は、標準サンプルの結果を示す図である。図9(b)は、図9(a)の拡大図である。図9(c)は、尿サンプルの結果を示す図である。図9(d)は、図9(c)の拡大図である。○はグルコースセンサA1、△はグルコースセンサA2の結果を示す。各グラフの横軸はグルコース濃度(mM)を示し、縦軸は電流値(μA)を示す。図9で示すように、TTF1電子酸化体を超純水で調製したチップは、ベース電流が低下した。
【0102】
図10にグルコースセンサB1、B2の結果を示す。図10(a)は、標準サンプルの結果を示す図である。図10(b)は、図10(a)の拡大図である。図10(c)は、尿サンプルの結果を示す図である。図10(d)は、図10(c)の拡大図である。○はグルコースセンサB1、□はグルコースセンサB2の結果を示す。各グラフの横軸はグルコース濃度(mM)を示し、縦軸は電流値(μA)を示す。グルコースセンサB2は、標準サンプルを用いた場合、4〜10mMの範囲で、良好な直線性が得られた。したがって、グルコースセンサB2は、低濃度グルコースを定量的に測定できることが示唆された。
【符号の説明】
【0103】
1 バイオセンサ
2 バイオセンサ
101 絶縁性基板
102 作用極
103 対極
104 反応層
105 参照極
106 電極
204 反応層
204a メディエーター層
204b 酵素層
【技術分野】
【0001】
本発明は、バイオセンサ、その製造方法よびその使用方法に関する。
【背景技術】
【0002】
従来のバイオセンサとしては、例えば特許文献1に記載されたものがある。このバイオセンサは、フェロセン電解質由来のフェリシウムイオンを電子受容体として用いる。フェリシウムイオンは、グルコースの酸化反応から生じた電子と直接反応して、フェロセンに還元される。そのため、あらかじめ電極上で電子受容体を酸化体に変換させる必要がない。したがって、検出感度を低下させることなく、酵素反応を短時間で進行させることができる。
【0003】
フェリシウムイオンを電子受容体として用いることにより、生体試料や食品などの試料中のグルコースを迅速に定量することができる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平9−304329号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
【0006】
第一に、フェロセンの酸化電流を得るためには、印加電圧を高くしなければならないという問題があった。
【0007】
特許文献1記載のバイオセンサでは、フェロセンの酸化電流の大きさを応答電流値として測定する。これにより得られた応答電流値の大きさは、試料中に存在するグルコース濃度に比例する。したがって、応答電流値を測定することにより試料中のグルコースを定量することができる。
【0008】
ところが、フェロセンの酸化には、高い印加電圧が必要とされる。そうすると、試料中に含まれる干渉物質、たとえば尿酸、ビリルビン、アスコルビン酸、アセトアミノフェンなど)の影響を受けやすいこととなる。その結果として、測定精度が低下することとなる。
【0009】
第二に、フェリシウムイオンは高価な試薬であり、使い捨てのバイオセンサではコストがかかりすぎてしまうという問題があった。
【0010】
以上のことから、安価で酸化電流を得るための印加電圧のより低い電子受容体が望まれていた。
【0011】
本発明は上記事情に鑑みてなされたものであり、検出感度を低下させることなく、迅速かつ高精度にグルコース等の基質量を定量することができるバイオセンサを提供するものである。
【課題を解決するための手段】
【0012】
本発明によれば、基板と、
前記基板に設けられている電極と、
前記電極と接するように設けられ、酸化還元酵素および電子受容体を含む反応層と、
を備え、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサ
が提供される。
【0013】
また、本発明によれば、基板を準備する工程と、
前記基板に電極を設ける工程と、
酸化還元酵素および電子受容体を含む反応層を前記電極に接するように設ける工程と、
を含み、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサの製造方法
が提供される。
【0014】
また、本発明によれば、上記のバイオセンサの使用方法であって、
酸化還元酵素および電子受容体を含む反応層に試料を添加するステップと、
添加された前記試料中の基質と前記酸化還元酵素とを反応させるステップと、
反応した前記酸化還元酵素と前記電子受容体とを反応させるステップと、
反応した前記電子受容体に電位を印加するステップと、
前記電位を印加された前記電子受容体から発生する電流を測定するステップと、
を含むバイオセンサの使用方法
が提供される。
【0015】
この発明によれば、電子受容体として酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を用いる。これにより、酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体は、基質と反応して還元された酸化還元酵素と直接反応することができる。したがって、電極に電圧を印加することで検出される電流値は、酸化還元酵素と電子受容体との反応によって生成された還元体の応答電流のみが検出されることとなり、還元型の電子受容体を仕込んだときよりもベース電流を低くすることができる。よって、検出感度を低下させることなく、試料中の基質量を迅速に精度よく測定することが可能となる。
【0016】
また、酸化電流を得るための印加電圧は、フェロシアンよりもテトラチアフルバレンまたはテトラチアフルバレン誘導体の方が低い。そのため、酸化還元酵素との反応により酸化型から還元型に変換した電子受容体を再酸化するための印加電圧を低くすることができ、干渉物質の影響を受けにくくすることができる。したがって、検出感度を低下させることなく、迅速かつ高精度に試料中の基質量を測定することが可能となる。
【0017】
さらに、テトラチアフルバレン等の酸化体は、テトラチアフルバレン等を過酸化物等の酸化剤と作用させて容易に調製することができる。したがって、フェリシウムイオンよりもコストの点で有利である。そのため、本発明の構成は、ディスポーザブル式のバイオセンサに適している。
【0018】
また、本発明は、電子受容体がシクロデキストリンで包接されている構成を採用することができる。これにより、電子受容体の親水性を向上させることができる。したがって、電子受容体を容易に電極に塗布することが可能となる。
【0019】
また、本発明は、反応層に界面活性剤が含まれている構成を採用することができる。これにより、酸化型テトラチアフルバレンが酸化還元酵素と反応することで得られたテトラチアフルバレンの水に対する溶解性を向上させることができる。また、酸化型テトラチアフルバレン誘導体が酸化還元酵素と反応することで得られた還元体のテトラチアフルバレン誘導体も同様に、水に対する溶解性を向上させることができる。
【0020】
また、本発明は、反応層が、酸化還元酵素を含む酵素層と、電子受容体を含むメディエーター層と、を含み、酵素層はメディエーター層に接しており、電極の表面にメディエーター層が設けられている構成を採用することができる。こうすることにより、基質と反応した酵素が、酵素層とメディエーター層との界面で酸化型の電子受容体に即座に作用することができる。したがって酵素および電子受容体間の電子の送受を効率よく行うことができ、より迅速に試料中の基質量を測定することができる。
【0021】
また、本発明は、反応層に含有される酸化型のテトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体が反応層の全体にわたって分布している構成を採用することができる。これにより、基質と反応した酵素が、酸化型の電子受容体に即座に作用することができる。したがって酵素および電子受容体間の電子の送受を効率よく行うことができ、より迅速に試料中の基質量を測定することができる。
【0022】
また、本発明は、メディエーター層に含まれる酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体がメディエーター層の全体にわたって分布している構成を採用することができる。これにより、基質と反応した酵素が、酵素層とメディエーター層との界面で酸化型の電子受容体に即座に作用することができる。そして、還元型となった電子受容体は濃度勾配差を利用して迅速に電極の表面に向かって移動することができる。したがってより迅速に試料中の基質量を測定することができる。
【0023】
また、本発明は、酸化還元酵素がグルコース酸化酵素またはグルコース還元酵素である構成を採用することができる。具体的には、グルコースデヒドロゲナーゼまたはグルコースオキシゲナーゼを用いることができる。これにより、本発明は、グルコースセンサとして利用することが可能となる。
【0024】
さらに本発明の構成は、電子受容体が二電子酸化体である構成を採用することができる。これにより、試料中の基質と反応した酵素はより迅速に電子受容体と反応することができる。したがって、試料中に含まれる基質濃度をさらに迅速に測定することができる。
【発明の効果】
【0025】
本発明によれば、検出感度を低下させることなく、迅速かつ高精度にグルコース等の基質量を測定することができる。
【図面の簡単な説明】
【0026】
【図1】実施の形態に係るバイオセンサを模式的に示した断面図である。
【図2】実施の形態に係るバイオセンサを模式的に示した平面図である。
【図3】変形例に係るバイオセンサを模式的に示した断面図である。
【図4】実施例に係る酸化型の電子受容体の紫外可視近赤外光吸収スペクトルの結果である。
【図5】実施例に係る酸化型の電子受容体の紫外可視近赤外光吸収スペクトルの結果である。
【図6】実施例に係る酸化型の電子受容体の紫外可視近赤外光吸収スペクトルの結果である。
【図7】実施例に係る酸化型の電子受容体を精製する方法を説明する図である。
【図8】実施例に係る酸化型の電子受容体を精製した後の紫外可視近赤外光吸収スペクトルの結果である。
【図9】実施例に係るバイオセンサを用いた測定結果を示す図である。
【図10】実施例に係るバイオセンサを用いた測定結果を示す図である。
【発明を実施するための形態】
【0027】
以下、本発明の実施の形態について、図面を用いて説明する。尚、すべての図面において、同様な構成要素には同様の符号を付し、適宜説明を省略する。
【0028】
図2は、本実施の形態のバイオセンサ1を示す模式的な平面図である。図1は、図2のA−A'断面図である。バイオセンサ1は、絶縁性基板101と、絶縁性基板101に設けられている電極106と、電極106と接するように設けられ、酸化還元酵素および電子受容体を含む反応層104と、を備える。また、バイオセンサ1は、電子受容体として、酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を反応層104に含有する。「テトラチアフルバレン」(tetrathiafulvalene(TTF))またはテトラチアフルバレン誘導体」は、総称して、以下、「TTF化合物」ともいう。反応層104に含有される酸化型TTF化合物は反応層104の全体にわたって分布している。
【0029】
絶縁性基板101には、セラミック、プラスチック、シリコン、アルミナガラス板または高分子材料を使用することができる。好ましくは、ポリエチレンテレフタレート、ポリビニルクロライド及びポリカーボネードなどの合成樹脂板を用いることができる。
【0030】
電極106として、作用極102および対極103からなる二極系電極を採用することができる。作用極102、対極103は、導電性材料を用いて形成させることができる。導電性材料とは、炭素、またはパラジウム、銀、白金、金、銅、ニッケル、それらの合金等の金属材料である。また、電極106として、図1および図2で示すような、作用極102、対極103および参照極105からなる三極系電極を採用することもできる。三極系電極を採用することで、安定に応答電流を得ることができ、測定精度を安定化させることができる。参照極105も、作用極102及び対極103と同様に、導電性材料を用いて形成させることができる。電極は1種の導電性材料により形成させてもよいし、2種以上の導電性材料により形成させてもよい。これにより、安定した応答電流が得られ、精度がさらに安定化する。作用極102、対極103および参照極105は、スクリーン印刷、スパッタ法、または蒸着法により絶縁性基板101に塗布することにより形成させることができる。電極106には、表面が絶縁膜30で覆われている絶縁領域と、反応層104で覆われている測定領域と、電圧を印加するための印加領域と、が設けられている。印加領域では、電極106の表面が露出している。
【0031】
反応層104は、少なくとも1種の酸化還元酵素および少なくとも1種の電子受容体を含有する。
【0032】
電子受容体としては、少なくとも一種の酸化型TTF化合物を用いるが、二種以上の酸化型TTF化合物を用いてもよい。酸化型TTF化合物(酸化型TTFおよび酸化型TTF誘導体)とは、TTF化合物の1電子酸化体または2電子酸化体をいう。TTF化合物が1電子放出することで1電子酸化体となり、TTF化合物から2電子放出されることで2電子酸化体となる。TTF誘導体として、たとえば、4−エトキシカルボニル−4',5,5'−トリメチルテトラチアフルバレン(Me3TTF−CO2Et)、8−メルカプトオクチルテトラチアフルバレンカルボキシレートなどを例示することができる。
【0033】
酸化型TTF化合物は、TTF化合物を適当な溶媒に溶解し、酸化剤と作用させることで調整することができる。溶媒は、TTF化合物、および、その酸化体が溶解する溶媒であればどのようなものであっても用いることができるが、たとえば、アセトニトリルを例示することができる。酸化剤には、過酸化物を例示することができる。過酸化物として、たとえば、過塩素酸鉄(III)を用いることができる。
【0034】
反応式1にTTFの酸化還元反応を示す。化合物1がTTFであり、TTFが1電子放出することによりTTFの1電子酸化体であるテトラチアフルバレン・カチオンラジカル(TTF・+)(化合物2)となる。さらに化合物2から1電子放出されることにより、TTFの2電子酸化体であるテトラチアフルバレン・カチオンラジカル(TTF・2+)(化合物3)となる。換言すると、化合物2および化合物3が酸化型TTFである。それぞれの反応は可逆反応であり、化合物2及び化合物3は、還元剤と作用させることにより化合物1に還元することができる。還元剤としてたとえば、アスコルビン酸、ジチオスレイトール(DTT)などを用いることができる。
【0035】
(反応式1)

【0036】
反応層104中の酸化型TTF化合物の含有量は、特に限定されず、必要に応じて適切な量を選択することができるが、好ましくは、TTF化合物の1電子酸化体を0.05〜10mMを含む。
【0037】
酸化還元酵素は、測定対象となる様々な基質と反応して酸化される。酸化された酵素が、TTF化合物の酸化体と酸化還元反応をすることで、基質量を定量することができる。
【0038】
たとえば、酸化還元酵素には、グルコースオキシダーゼ(GOD)、グルコースデヒドロゲナーゼを用いることができる。また、乳酸オキシダーゼ、乳酸デヒドロゲナーゼ、コレステロールオキシダーゼ(ChOD)、およびこれらの組合せを用いることができる。
【0039】
バイオセンサ1をグルコースセンサとする場合、酸化還元酵素として、グルコースオキシダーゼ(GOD)またはグルコースデヒドロゲナーゼを用いることができる。
【0040】
酸化還元酵素として、GODを用いる場合の測定メカニズムは反応式2に基づく。
【0041】
(反応式2)
グルコース + GOD(酸化体) → グルコン酸 + GOD(還元体)
GOD(還元体) + 酸化型TTF化合物 → GOD(酸化体)+TTF化合物(還元体)
【0042】
反応式2で示すように、測定試料中のグルコースは、GODの触媒反応によりGODを還元させることで、グルコースがグルコン酸に酸化される。そしてGODは電子を酸化型TTF化合物に伝達して元の状態に戻り、酸化型TTF化合物が還元されてTTF化合物(還元体)となる。TTF化合物が電気化学的に酸化されることで、酸化型TTF化合物になるが、このとき、得られる酸化電流を応答電流値として測定する。この応答電流値は、測定試料中に存在するグルコース濃度に比例する。
【0043】
反応層104中の酸化還元酵素の含有量は、特に限定されず、必要に応じて適切な量を選択することができる。たとえば、グルコースオキシダーゼを用いる場合、その含有量は、0.1〜40ユニット/μLが好ましい。ここで、「1ユニット」とは、1μmolの基質を1分間で酸化させるために必要な、酸化還元酵素の量をいう。
【0044】
バイオセンサ1は、酸化型TTF化合物がシクロデキストリンで包接されている構成を採用することができる。これにより親水性が向上するため、電極に塗布しやすくなる。
【0045】
シクロデキストリンとしては、特に制限されないが、例えば、α−シクロデキストリン、β−シクロデキストリンやγ−シクロデキストリン等を使用することができる。また、化学修飾されたシクロデキストリンであってもよく、例えば、ヒドロキシシクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン(hp−β−CD)、ジメチル−β−シクロデキストリン、カルボキシメチル−β−シクロデキストリン等の化学修飾体があげられ、中でも、ヒドロキシプロピル−β−シクロデキストリンが好ましい。これらは一種類でもよいし、二種類以上を併用してもよい。
【0046】
酸化型TTF化合物は1モルあたり、例えば、40重量%以下のシクロデキストリンによって包接されていることが好ましく、より好ましくは0.1〜20重量%であり、特に好ましくは1〜10重量%である。シクロデキストリンの濃度が高すぎると粘性が高くなるという点で問題があり、低すぎると可溶化が難しくなるという点で問題がある。
【0047】
酸化型TTF化合物は、シクロデキストリンを用いた公知の包接方法により包接することができる。例えば、シクロデキストリンを水性溶媒に溶解したシクロデキストリン溶液と、酸化型TTF化合物を懸濁した酸化体懸濁液と、を準備し、両者を混合させることで当該酸化型TTF化合物を包接させることができる。
【0048】
シクロデキストリン溶液に対する酸化型TTF化合物の割合は、酸化型TTF化合物を溶解できれば特に制限されないが、たとえば、40重量%以下のシクロデキストリンの溶液に当該酸化型TTF化合物を5mMとなるように溶解させることができる。シクロデキストリンの溶液は、1〜10重量%であるとより好ましい。
【0049】
水性溶媒としては、たとえば、水、緩衝液等が使用できる。緩衝液としては、TES(N−Tris(hydroxymethyl)methyl−2−aminoethanesulfonic acid)緩衝液、HEPES(2−[4−(2−Hydroxyethyl)−1−piperazinyl]ethanesulfonic acid)緩衝液などを用いることができる。緩衝液は、塩化ナトリウムを含んでいてもよい。
【0050】
溶媒のpHは4〜8とすると好ましい。pHが大きすぎたり小さすぎたりすると酵素が失活してしまうため好ましくない。
【0051】
また、反応層104は、界面活性剤を含むことができる。
【0052】
電子受容体として酸化型TTF化合物を使用することで、反応式2で示すように、酸化還元酵素の還元体と酸化型TTF化合物とが反応し、酸化還元酵素が酸化されるとともに酸化型TTF化合物からTTF化合物(還元体)が生成される。TTF化合物は、水に対する溶解度が低い。そのため、測定試料中に含まれる水によって生成した還元体が反応層上に析出することがある。そこで、反応層104に界面活性剤を含ませることにより、生成したTTF化合物(還元体)の水に対する溶解性を向上させることができる。
【0053】
界面活性剤としては、たとえば、レシチン、オクチルチオグルコシド、コール酸ナトリウム、ドデシル−β−マルトシド、デオキシコール酸ナトリウム、タウロデオキシコール酸ナトリウム、Tritron−X(登録商標)、Lubrol PX(登録商標)、DK−エステル(登録商標)、BIGCHAP(登録商標)、DeoxCHAP(登録商標)、ラウリル硫酸ナトリウム(sodium dodecyl sulfate、SDS)、およびTween20(ポリオキシエチレンソルビタンモノラウラート)を用いることができる。Tritron−X(登録商標)、SDS、およびTween20を用いると特に好ましい。
【0054】
測定試料には、血液、尿、唾液等の体液等や、果汁等の食品を例示することができる。
【0055】
つづいて、バイオセンサ1の製造方法の一例について説明する。
【0056】
まず、基板を準備し、基板にスクリーン印刷、スパッタ法、または蒸着法等、公知の方法により、作用極102を形成させる。ついで、基板上に絶縁性ペーストをスクリーン印刷して絶縁膜30を形成し、絶縁性基板101を得る。絶縁層30は作用極102の外周を覆うように形成させる。そして、作用極102に並列するように、対極103および参照極105を設ける。
【0057】
その後、酸化還元酵素および電子受容体を含む反応層104を絶縁性基板101上に設ける。具体的には、反応層104は、以下のようにして絶縁性基板101上に形成させることができる。
【0058】
酸化型TTF化合物、シクロデキストリン、界面活性剤及び酸化還元酵素を水性溶媒に混合調整し、絶縁性基板101の表面に塗布した後、乾燥させてバイオセンサ1を完成する。乾燥は、酸化還元酵素が失活しない温度であり、かつ、至適温度以下で行うと好ましい。
【0059】
つづいて、バイオセンサ1を用いて試料液中に含まれる基質濃度を測定する方法について説明する。
【0060】
まず、測定試料を反応層104に添加する。測定試料の添加により反応層104が溶解し、試料中の基質と酸化還元酵素との反応、および、この反応に続く酸化還元酵素と電子受容体との反応が進行する。これら反応を進行させるため、バイオセンサ1を所定時間放置した後、対極103に対して作用極102にアノード方向にパルス電圧(0〜+0.3V)を印加する。応答電流が発生し、応答電流値が公知の方法で測定される。あらかじめ既知の濃度の基質を用いて作成した基質濃度と応答電流値との検量線を用いて、得られた応答電流値から基質濃度を求める。
【0061】
つづいて、バイオセンサ1の作用および効果について図1、2を用いて説明する。
【0062】
バイオセンサ1によれば、電子受容体として酸化型TTF化合物を用いる。これにより、酸化型TTF化合物は、基質と反応して還元された酸化還元酵素と直接反応することができる。したがって、酸化還元酵素との反応によって生成されたTTF化合物の酸化電流のみが応答電流値として検出されることとなり、還元型の電子受容体を仕込んだときによりもベース電流を低くすることができる。よって、検出感度を低下させることなく、試料中の基質量を迅速に精度よく測定することが可能となる。
【0063】
従来、TTF化合物は電子受容体として用いられていた。しかしながら、酸化還元酵素は、酸化型TTF化合物としか反応しない。そのため、TTF化合物をそのまま反応層に仕込むと、TTF化合物をいったん酸化型TTF化合物に変換する必要があった。その結果、酸化反応時に発生する電流により、ベース電流が高くなるという問題があった。つまり、ベース電流が高くなることで、基質に対する応答電流が相対的に小さくなり、結果として検出感度が低下するという問題があった。
【0064】
また、使用時に酸化型TTF化合物を生成させると、酸化反応にばらつきがあり、バイオセンサの性能を低下させる原因にもなっていた。また、どの程度TTF化合物が酸化されているのか予測することができず、どの程度電子受容体を仕込んでおけばよいかを見通しを立てることができなかった。
【0065】
ところが、バイオセンサ1では、あらかじめ酸化型TTF化合物を仕込んでおく。これにより、仕込みに必要な電子受容体の量を予測して、バイオセンサを設計することができる。これにより、個々のバイオセンサの性能を均一にすることができ、各チップ間でのばらつきを少なくすることができる。したがって、使い捨てのバイオチップであっても、安定した測定結果を得ることができる。また、所望の性能を有するバイオセンサを用意することも可能となる。
【0066】
また、TTF化合物を再び酸化型TTF化合物に酸化するための印加電圧は、0〜+0.3Vであって、フェロシアンを酸化するための印加電圧(+0.4〜+0.7V)よりも低い。したがって、TTF化合物は、試料中に含まれる干渉物質の影響を受けにくく、高精度に試料中の基質濃度を定量することが可能となる。
【0067】
さらに、酸化型TTF化合物は、TTF化合物を過酸化物と作用させて容易に調製することができる。したがって、フェリシウムイオンよりもコストの点で有利である。そのため、バイオセンサ1は、ディスポーザブル式のバイオセンサとして利用することが可能である。
【0068】
また、バイオセンサ1は、反応層104に含有される酸化型TTF化合物としてTTF化合物の2電子酸化体を採用することができる。2電子酸化体を用いることにより酵素反応により生じた電子とより迅速に反応することができる。したがって、試料中に含まれるグルコース等の基質濃度をさらに迅速に測定することができる。
【0069】
また、バイオセンサ1は、反応層104に含有される酸化型TTF化合物が反応層104の全体にわたって分布している構成を採用することができる。これにより、反応層104の全体にわたって、基質と作用した酸化還元酵素と迅速に反応することができる。したがって、試料中の基質濃度をさらに迅速に測定することができる。
【0070】
さらに、バイオセンサ1は、電子受容体がシクロデキストリンで包接されている構成を採用することもできる。これにより、電子受容体の親水性を向上させることができる。したがって、電子受容体を電極に容易に塗布することが可能となる。
【0071】
以上のように、バイオセンサ1によれば、検出感度を低下させることなく、迅速かつ高精度にグルコース等の基質を定量することができる。
【0072】
以上、図面を参照して本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【0073】
たとえば、図3で示すバイオセンサ2の構成を採用することもできる。バイオセンサ2は、反応層204が、酸化還元酵素を含む酵素層204bと、電子受容体を含むメディエーター層204aと、を備える。酵素層204bはメディエーター層204aに接しており、電極106の表面にメディエーター層204aが設けられている。バイオセンサ2とバイオセンサ1とは、反応層104のかわりに反応層204を備える点で異なっている。メディエーター層204aに含まれる酸化型TTF化合物がメディエーター層204aの全体にわたって分布している。
【0074】
酸化還元酵素および電子受容体は反応層内を拡散するため、メディエーター層204aが酸化還元酵素を含むこともあるし、酵素層204bが電子受容体を含むこともある。しかしながら、メディエーター層204aは酵素層204bよりも高濃度かつ均一に酸化型TTF化合物を含んでいる。また、酵素層204bはメディエーター層204aよりも高濃度かつ均一に酸化還元酵素を含んでいる。
【0075】
バイオセンサ2は、酸化型TTF化合物がシクロデキストリン、ナフィオン(登録商標)や有機溶媒で包接されている構成を採用することができる。バイオセンサ1と同様に、シクロデキストリンで包摂させると特に好ましい。これにより親水性が向上するため、電極に塗布しやすくなる。
【0076】
また、バイオセンサ2は、メディエーター層204aと酵素層204bとの間に、界面活性剤を含む界面活性層を形成してもよい。界面活性剤としては、バイオセンサ1で用いられる界面活性剤と同様のものを採用することができる。
【0077】
バイオセンサ2ではたとえば、以下のようにして絶縁性基板101上に反応層204を形成させることができる。
【0078】
酸化型TTF化合物を溶媒に溶解し、得られた酸化型TTF化合物溶液を絶縁性基板101の表面に塗布して乾燥する。その後、作用極102、対極103、参照極105のそれぞれに酸化型TTF化合物溶液を塗布し、再び乾燥させる。乾燥後、形成されたメディエーター層204aの表面に、繰り返し、酸化型TTF化合物溶液を塗布することで、均等にメディエーター層204aを形成させることができる。塗布後、デシケーターに入れる等してメディエーター層204aを念入りに乾燥させる。
【0079】
ここで、酸化型TTF化合物を溶解させる溶媒は、酸化型TTF化合物を溶解し、かつ、揮発しやすいものを用いると好ましい。たとえば、水、揮発性有機溶媒を用いることができ、アセトニトリルを使用するとより好ましい。
【0080】
その後、界面活性剤の溶液を塗布し、さらにデシケーターに入れる等して乾燥させる。これにより、界面活性剤の層を形成させることができる。界面活性剤の存在により、メディエーター層204aと酵素層204bとの界面に発生した還元型TTF化合物の析出を防止することができる。
【0081】
ついで、酸化還元酵素の溶液を塗布し、酵素層204bを形成させる。酸化還元酵素としてGODまたはグルコースデヒドロゲナーゼとすることにより、バイオセンサ2をグルコースセンサとすることができる。最後に、低温下で乾燥させてバイオセンサ2を完成させる。なお、乾燥時の温度は、酸化還元酵素が失活しない温度であり、かつ、至適温度以下とすると好ましい。
【実施例】
【0082】
以下、本発明のバイオチップの実施例について説明するが、本発明はこれに限定されるものではない。
【0083】
(酸化型TTFの調整方法、および、その測定方法)
1.アセトニトリル中でのTTFの酸化
テトラチアフルバレン(TTF)を1mMとなるようアセトニトリルで調整した(以下、「TTF溶液1」という)。過塩素酸鉄(III)(Fe(ClO4)3)を500mMとなるようアセトニトリルで調整した(以下、「過塩素酸鉄(III)溶液1」という)。過塩素酸鉄(III)溶液1に、さらにアセトニトリルを加え、過塩素酸鉄(III)の濃度が0、0.5、1、2.5、5、10、25、50mMの各濃度になるように希釈した(以下、「過塩素酸鉄(III)希釈液1」という)。ついで、TTF溶液1と過塩素酸鉄(III)溶液1とを混合し、TTFが0.1mM、過塩素酸鉄(III)が0、0.5、1、2.5、5、10、25、50mMの各濃度になるようアセトニトリルで希釈した(以下、「混合液1」という)。混合液1を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。
【0084】
結果を図4に示す。図4(a)は、過塩素酸鉄(III)希釈液1の濃度別の吸収スペクトルを示す。図4(b)は、混合液1の過塩素酸鉄(III)濃度別吸収スペクトルを示す。
【0085】
ここで、TTFの1電子酸化体(化合物2)には450nmおよび600nmのそれぞれに吸収があり、TTFの2電子酸化体(化合物3)には375nmに吸収があることが報告されている。(M.Asakawa,P.R.Ashton,V.Balzani,et.al,Angew.Chem.Int.Ed.,1998,37,No.3,333−337)。また、TTFは、300nm付近nmに吸収があることが知られている(S.Hnig,G.Kiesslich,H.Quast,D.Scheutzow,Liebigs Ann.Chem.,1973,310−323)。そこで、図4(b)をみると、435nm、580nm、360nmにそれぞれ吸収が認められる。また、過塩素酸鉄(III)の濃度が増加により、435nm、580nmの吸収が強くなり、過塩素酸鉄(III)50mMでは、360nmの吸収も認められる。一方、300nm付近の吸収は、過塩素酸鉄(III)濃度の増加により、減少している。
【0086】
以上のことから、混合液1中でTTFが過塩素酸鉄(III)により酸化されていることがわかった。よって、アセトニトリル中でTTFの酸化は可能であった。
【0087】
2.90%アセトニトリル+10%超純水中でのTTFの酸化
TTF溶液1と過塩素酸鉄(III)溶液1とを混合し、TTFが0.1mM、過塩素酸鉄(III)が0、0.5、1、2.5、5、10、25、50mMの各濃度になるよう、アセトニトリル、および、超純水(最終濃度10%)で調整した(以下、「混合液2」という)。混合液2を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。ついで、アスコルビン酸(AsA)による再還元も行った。超純水で5mMとなるようAsAを調製した(以下、「AsA溶液1」という)。AsA溶液は、さらに0、0.01、0.05、0.1、0.2、0.5mMの各濃度になるように調整した(以下、「AsA希釈液」という。TTF溶液1と過塩素酸鉄(III)溶液1とAsA溶液とを混合し、TTFが0.1mM、過塩素酸鉄(III)濃度が50mM、AsA濃度が0、0.01、0.05、0.1、0.2、0.5mMの各濃度となるようアセトニトリル、および、超純水(最終濃度10%)で調整した(以下、「混合液3」という)。また、過塩素酸鉄(III)溶液1およびAsA溶液1を混合し、Fe(ClO4)3が50mM、AsAが0.1、0.2、0.5mMの各濃度となるようアセトニトリル及び、超純水(最終濃度10%)で調整した(以下、「混合液4」という)。また、TTF溶液1とAsA溶液1とを混合し、TTFが0.1mM、AsAが0、0.5、1、2.5、5、10、25、50mMの各濃度になるよう、アセトニトリル及び、超純水(最終濃度10%)で調整した(以下、「混合液5」という)。混合液3〜5を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。
【0088】
結果を図5に示す。図5(a)は、混合液2の過塩素酸鉄(III)濃度別吸収スペクトルを示す。図5(b)は、AsA希釈液の濃度別溶液の吸収スペクトルを示す。図5(c)は、混合液4のAsA濃度別吸収スペクトルを示す。図5(d)は、混合液5のAsA濃度別吸収スペクトルを示す。図5(e)は、混合液3のAsA濃度別吸収スペクトルを示す。
【0089】
図5(a)で示すように、過塩素酸鉄(III)濃度の増加により435nm、580nmにおける吸収がそれぞれ増加した。また、過塩素酸鉄(III)濃度が25mM、50mMでは、それぞれ、360nmに吸収が認められた。一方、過塩素酸鉄(III)濃度の増加により300nm付近の吸収は減少した。また、図5(e)で示すように、AsA濃度の増加により435nm、580nmにおける吸収が減少した。一方、300nm付近の吸収が増加した。
【0090】
以上の結果から、過塩素酸鉄(III)によって酸化されたTTFの1電子酸化体は、AsAによってTTFに還元され、可逆的に酸化還元することがわかった。
【0091】
3.超純水系でのTTFの酸化
10%ヒドロキシプロピル−β−シクロデキストリン(hp−β−CD)を含む超純水にてTTFを1mM(以下、「TTF溶液2」という)、Fe(ClO4)3を500mM(以下、「過塩素酸鉄(III)溶液2」という)に調整した。過塩素酸鉄(III)溶液2は、さらに0、1、2.5、5、10、25、50、100mMの各濃度になるように調整した(以下、「過塩素酸鉄(III)希釈液2」という。TTF溶液2と過塩素酸鉄(III)溶液2とを混合し、10%hp−β−CD含有超純水でTTFが0.1mM、過塩素酸鉄(III)が0、0.5、1、2.5、5、10、25、50、100mMの各濃度になるよう調整した(以下、「混合液6」という)。混合液6を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。ついで、アスコルビン酸による再還元を行った。10%hp−β−CD含有超純水でAsA溶液を調製した。(以下、「AsA溶液2」という)TTF溶液2、過塩素酸鉄(III)溶液2、及び、AsA溶液2を混合し、TTFが0.1mM、過塩素酸鉄(III)が10mM、AsAが各濃度となるよう10%hp−β−CD含有超純水で調整した(以下、「混合液7」という)。ついで、過塩素酸鉄(III)溶液2とAsA溶液2とを混合し、過塩素酸鉄(III)溶液2が10mM、AsAが0、0.01、0.02、0.05mMの各濃度になるようアセトニトリルで希釈した(以下、「混合液8」という)。混合液6〜8を超純水で10倍に希釈し、分光光度計にてスペクトル測定した。
【0092】
結果を図6に示す。図6(a)は、過塩素酸鉄(III)希釈液2の濃度別吸収スペクトルを示す。図6(b)は、混合液6の過塩素酸鉄(III)濃度別吸収スペクトルを示す。図6(c)は、AsA溶液2の濃度別吸収スペクトルを示す。図6(d)は、混合液8のAsA濃度別吸収スペクトルを示す。図6(e)は、混合液7のAsA濃度別吸収スペクトルを示す。
【0093】
図6(b)で示すように、過塩素酸鉄(III)濃度の増加により435nm、580nm、360nmにおける吸収が増加している。一方、Fe(ClO4)3濃度の増加により300nm付近における吸収は減少している。また、図6(e)で示すように、AsA濃度の増加により435nm、580nmにおける吸収が減少している。一方、AsA濃度の増加により300nm付近における吸収は増加している。したがって、水系でもTTFを過塩素酸鉄(III)により可逆的に酸化することが可能であった。また、過塩素酸鉄(III)によって酸化されたTTFの1電子酸化体(化合物2)は、AsAによってTTF(化合物1)に還元され、可逆的に酸化還元することがわかった。
【0094】
(酸化型TTFの精製方法)
図7は、固相抽出法を用いて酸化型TTFの精製方法を説明する図である。固相担体は、C18(300mg)を用い、アセトニトリル(2mL)を通液した(図7(a))ついで、超純水(3mL)を通液した(図7(b))。その後、40%アセトニトリルに溶解させたTTF(10mM)、および、過塩素酸鉄(III)(1M)の混液を300μLを添加した(図7(c))。通液後、超純水(2〜3mL)で洗浄し、抽出液を500μLずつ分取した(図7(d))。最後に、アセトニトリル(1−1.5mL)で溶出し、溶出液を500μLずつ分取した(図7(e))。分取した各フラクションを分光光度計にてスペクトル測定した。また、アセトニトリルにより抽出した各フラクションを合わせて濃縮後乾燥し、残渣を得た。使用したTTFが100%酸化型TTFになったものとして、得られた残渣中の酸化型TTFの量を換算し、残渣にアセトニトリルを適量加えて酸化型TTFのアセトニトリル溶液を所望の濃度に調整した。各濃度に調整されたアセトニトリル溶液を435nmにて吸光度測定し、酸化型TTFの換算濃度と吸光度との相関を調べた。
【0095】
結果を図8に示す。図8(a)は、図7(d)で示すステップにおいて、超純水により抽出した各フラクションの吸収スペクトルを示す。図8(b)は、図7(e)で示すステップにおいて、アセトニトリルにより抽出した各フラクションの吸収スペクトルを示す。図8(c)は、435nmの吸光度と酸化型TTFの換算濃度との関係を示したグラフである。
【0096】
図8(a)から、超純水では酸化型TTFは溶出されにくいことがわかった。また、図8(b)から、アセトニトリルで酸化型TTFを溶出できることがわかった。また、固相抽出してもTTFは酸化された状態で存在することがわかった。さらに、435nmの吸光度と換算した酸化型TTF濃度との関係は十分な直線性が得られた。これを検量線として用い、TTFの一電子酸化体の濃度の指標とした。
【0097】
(バイオセンサの作製方法)
1.メディエーター・酵素混合系
バイオセンサ1の構成と同様の構成を有するグルコースセンサA1、A2を以下の方法により作製した。まず、カーボン作用極、銀/塩化銀参照極、カーボン対極が設けられたPET(Polyethylene Terephthalate)基板を用意した。ついで、TTFまたはTTF1電子酸化体を超純水に溶解し、hp−β−CD(5%)、tritonX−100(1%)、GOD(10U/μL)をそれぞれ添加した。その後、各溶液をそれぞれ5μLチップ上に塗布することにより反応層を形成し、24時間以上冷蔵庫にて乾燥させた。TTF含有溶液を塗布したものをグルコースセンサA1とし、TTF1電子酸化体含有溶液を塗布したものをグルコースセンサA2とした。
【0098】
なお、TTF1電子酸化体の溶液は、以下の方法により、所定の濃度に調整した。図7(e)で示すステップで得られたアセトニトリルの溶出液の吸光度を測定する。図8(c)で示す検量線を用い、吸光度の測定値から濃度に変換する。溶出液の容量を正確に量りとり、溶出液を乾燥させる。これにより、所定量の1電子酸化体の粉末を得る。この粉末を溶媒に溶解し、所定濃度に調整する。
【0099】
2.メディエーター、酵素二層系
バイオセンサ2の構成と同様の構成を有するグルコースセンサB1、B2を以下の方法により作製した。まず、カーボン作用極、銀/塩化銀参照極、カーボン対極が設けられたPET基板を用意した。ついで、TTFまたはTTF1電子酸化体それぞれの4mMアセトニトリル溶液を1μLずつ5回に分けて5μLチップ上に塗布した。具体的には、1μL塗布し、乾燥後に再度1μLを電極系上に塗布し、これを5回繰り返した。デシケーター内で乾燥後、5%tritonX−100の水溶液1μLを塗布した。その後、デシケーター内で乾燥し、脱塩した20U/μLのGOD溶液を2.5μL塗布し、24時間以上冷蔵庫にて乾燥させた。TTF含有溶液を塗布したものをグルコースセンサB1とし、TTF1電子酸化体含有溶液を塗布したものをグルコースセンサB2とした。
【0100】
(電気化学測定)
標準サンプルとして、150mM NaClを含む0.1M TES緩衝液(pH 7.5)で調製したグルコース溶液を用意した。また、ボランティアによって採取されたヒト尿、およびこのヒト尿にグルコースを添加したもの尿サンプルとして用意した。サンプル5μLを反応層に添加し、サンプル添加後10秒後に、対極に対して作用極にアノード方向に電圧(0.3mV/vs)を印加し、応答電流の測定を開始した。開始後1分の電流値を測定値とした。測定に用いたグルコースセンサA1、A2、B1、B2は測定ごとに交換した。
【0101】
図9にグルコースセンサA1、A2の結果を示す。図9(a)は、標準サンプルの結果を示す図である。図9(b)は、図9(a)の拡大図である。図9(c)は、尿サンプルの結果を示す図である。図9(d)は、図9(c)の拡大図である。○はグルコースセンサA1、△はグルコースセンサA2の結果を示す。各グラフの横軸はグルコース濃度(mM)を示し、縦軸は電流値(μA)を示す。図9で示すように、TTF1電子酸化体を超純水で調製したチップは、ベース電流が低下した。
【0102】
図10にグルコースセンサB1、B2の結果を示す。図10(a)は、標準サンプルの結果を示す図である。図10(b)は、図10(a)の拡大図である。図10(c)は、尿サンプルの結果を示す図である。図10(d)は、図10(c)の拡大図である。○はグルコースセンサB1、□はグルコースセンサB2の結果を示す。各グラフの横軸はグルコース濃度(mM)を示し、縦軸は電流値(μA)を示す。グルコースセンサB2は、標準サンプルを用いた場合、4〜10mMの範囲で、良好な直線性が得られた。したがって、グルコースセンサB2は、低濃度グルコースを定量的に測定できることが示唆された。
【符号の説明】
【0103】
1 バイオセンサ
2 バイオセンサ
101 絶縁性基板
102 作用極
103 対極
104 反応層
105 参照極
106 電極
204 反応層
204a メディエーター層
204b 酵素層
【特許請求の範囲】
【請求項1】
基板と、
前記基板に設けられている電極と、
前記電極と接するように設けられ、酸化還元酵素および電子受容体を含む反応層と、
を備え、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサ。
【請求項2】
前記酸化還元酵素がグルコース酸化酵素またはグルコース還元酵素であることを特徴とする請求項1に記載のバイオセンサ。
【請求項3】
前記反応層に含有される前記酸化型テトラチアフルバレンまたは前記酸化型テトラチアフルバレン誘導体が前記反応層の全体にわたって分布していることを特徴とする請求項1または2に記載のバイオセンサ。
【請求項4】
前記反応層は、前記酸化還元酵素を含む酵素層と、前記電子受容体を含むメディエーター層と、を含み、
前記酵素層は前記メディエーター層に接しており、
前記電極の表面に前記メディエーター層が設けられていることを特徴とする請求項1または2に記載のバイオセンサ。
【請求項5】
前記メディエータ層に含まれる前記酸化型テトラチアフルバレンまたは前記酸化型テトラチアフルバレン誘導体が前記メディエーター層の全体にわたって分布していることを特徴とする請求項4に記載のバイオセンサ。
【請求項6】
前記電子受容体がシクロデキストリンで包接されていることを特徴とする請求項1乃至5に記載のバイオセンサ。
【請求項7】
前記反応層に界面活性剤が含まれていることを特徴とする請求項1乃至6に記載のバイオセンサ。
【請求項8】
前記電子受容体が二電子酸化体であることを特徴とする請求項1乃至7いずれかに記載のバイオセンサ。
【請求項9】
基板を準備する工程と、
前記基板に電極を設ける工程と、
酸化還元酵素および電子受容体を含む反応層を前記電極に接するように設ける工程と、
を含み、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサの製造方法。
【請求項10】
請求項1乃至8いずれかに記載のバイオセンサの使用方法であって、
酸化還元酵素および電子受容体を含む反応層に試料を添加するステップと、
添加された前記試料中の基質と前記酸化還元酵素とを反応させるステップと、
反応した前記酸化還元酵素と前記電子受容体とを反応させるステップと、
反応した前記電子受容体に電位を印加するステップと、
前記電位を印加された前記電子受容体から発生する電流を測定するステップと、
を含むバイオセンサの使用方法。
【請求項1】
基板と、
前記基板に設けられている電極と、
前記電極と接するように設けられ、酸化還元酵素および電子受容体を含む反応層と、
を備え、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサ。
【請求項2】
前記酸化還元酵素がグルコース酸化酵素またはグルコース還元酵素であることを特徴とする請求項1に記載のバイオセンサ。
【請求項3】
前記反応層に含有される前記酸化型テトラチアフルバレンまたは前記酸化型テトラチアフルバレン誘導体が前記反応層の全体にわたって分布していることを特徴とする請求項1または2に記載のバイオセンサ。
【請求項4】
前記反応層は、前記酸化還元酵素を含む酵素層と、前記電子受容体を含むメディエーター層と、を含み、
前記酵素層は前記メディエーター層に接しており、
前記電極の表面に前記メディエーター層が設けられていることを特徴とする請求項1または2に記載のバイオセンサ。
【請求項5】
前記メディエータ層に含まれる前記酸化型テトラチアフルバレンまたは前記酸化型テトラチアフルバレン誘導体が前記メディエーター層の全体にわたって分布していることを特徴とする請求項4に記載のバイオセンサ。
【請求項6】
前記電子受容体がシクロデキストリンで包接されていることを特徴とする請求項1乃至5に記載のバイオセンサ。
【請求項7】
前記反応層に界面活性剤が含まれていることを特徴とする請求項1乃至6に記載のバイオセンサ。
【請求項8】
前記電子受容体が二電子酸化体であることを特徴とする請求項1乃至7いずれかに記載のバイオセンサ。
【請求項9】
基板を準備する工程と、
前記基板に電極を設ける工程と、
酸化還元酵素および電子受容体を含む反応層を前記電極に接するように設ける工程と、
を含み、
前記電子受容体が酸化型テトラチアフルバレンまたは酸化型テトラチアフルバレン誘導体を含むことを特徴とするバイオセンサの製造方法。
【請求項10】
請求項1乃至8いずれかに記載のバイオセンサの使用方法であって、
酸化還元酵素および電子受容体を含む反応層に試料を添加するステップと、
添加された前記試料中の基質と前記酸化還元酵素とを反応させるステップと、
反応した前記酸化還元酵素と前記電子受容体とを反応させるステップと、
反応した前記電子受容体に電位を印加するステップと、
前記電位を印加された前記電子受容体から発生する電流を測定するステップと、
を含むバイオセンサの使用方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−68643(P2013−68643A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2013−10765(P2013−10765)
【出願日】平成25年1月24日(2013.1.24)
【分割の表示】特願2008−220414(P2008−220414)の分割
【原出願日】平成20年8月28日(2008.8.28)
【出願人】(000133179)株式会社タニタ (303)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成25年1月24日(2013.1.24)
【分割の表示】特願2008−220414(P2008−220414)の分割
【原出願日】平成20年8月28日(2008.8.28)
【出願人】(000133179)株式会社タニタ (303)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
[ Back to top ]

