プロバイオティクス菌株GM−263(ADR−1)が糖尿病による腎線維化の治療に用いられる組成物及びその用途
【課題】糖尿病による腎線維化を有効に治療すること。
【解決手段】糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の組成物とその用途を提供し、有効含有量であるラクトバチルス・ロイテリGM−263(ADR−1)(受託番号はCCTCC M 209263)を用いて、糖尿病による腎線維化を治療する組成物を製造し、これにより、糖化ヘモグロビンと血糖濃度を低下させ、体重と腎重を正常な範囲に回復させて、更にJAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質の発現を抑制することによって、糖尿病による腎線維化を有効に治療する。
【解決手段】糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の組成物とその用途を提供し、有効含有量であるラクトバチルス・ロイテリGM−263(ADR−1)(受託番号はCCTCC M 209263)を用いて、糖尿病による腎線維化を治療する組成物を製造し、これにより、糖化ヘモグロビンと血糖濃度を低下させ、体重と腎重を正常な範囲に回復させて、更にJAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質の発現を抑制することによって、糖尿病による腎線維化を有効に治療する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はプロバイオティクス菌株の用途に関し、特に、プロバイオティクス菌株GM−263(ADR−1)が糖尿病による腎線維化の治療に用いられる組成物及びその用途に関する。
【背景技術】
【0002】
高血糖が糖尿病性腎症(diabetic nephropathy;DN)を誘発する主な原因であり、透析を受けている患者において、糖尿病による糖尿病性腎症(diabetic nephropathy;DN)患者が40%を占め、それに糖尿病性腎症が末期腎不全(end−stage renal disease;ESRD)を誘発する主な原因でもある。糖尿病性腎症は、通常、糖尿病発症後の15〜20年から臨床反応が発生し、高い割合で末期腎不全に発展してしまう。同時に、例えば、高血圧症、高血脂症、高尿酸症、心血管疾患などの他の疾病が伴う可能性もある。
【0003】
糖尿病性腎症は、おおよそ過剰濾過(hyperfiltration)期、静止期(silent phase)、微量アルブミン尿(microalbuminuria)期、タンパク尿(proteinuria)期及び末期腎不全である五つの時期に分けられる。一般的に、糖尿病性腎症の治療は血糖制御、血圧制御、飲食制御、薬物制御を多く採用し、それによって、血糖、血圧、タンパク質の摂食量を制御する。
【0004】
数多くの研究において、腸内菌叢が体の健康に影響を与えることが提示されている。菌叢のバランスを維持する方法としては、プロバイオティクス(probiotics又はprobiotic bacteria)を摂取する方法がある。プロバイオティクスは、一般的に人体内からの、腸内健康に有益な生菌を指し、外部から補充され、体に有益になる可能性がある微生物をも指しており、例えば、乳酸菌(lactic acid bacteria;LAB)と一部の酵母菌が挙げられ、その内、乳酸菌は、乳糖又はその他の糖類を乳酸に転換する微生物の総称である。乳酸菌はグラム陽性菌に属し、常に食品工業における発酵に用いられる。
【0005】
近年、流行病学に関する研究から、乳酸菌は、アレルギーに関する疾病及び胃腸病、例えば炎症性腸疾患(inflammatory bowel disease;IBD)などを改善できることが知られてきた。そして、更に乳酸菌が免疫反応を刺激することができ、無害のアレルゲン(innocent allergens)に対しての免疫寛容(tolerance)を発達させる。その他の研究において、乳酸菌が人間や家畜の抗生剤に関する下痢(antibiotic−associated diarrhea)、旅行者下痢(travellers’ diarrhea)、小児下痢(pediatric diarrhea)、炎症性腸疾患(IBD)、過敏性腸症候群(irritable bowel syndrome)、アトピー性疾患(atopic disease)などを有効に改善できることも示されている。
【0006】
しかし、前記研究において、プロバイオティクス菌株が糖尿病による腎線維化に応用できるかどうかについて殆ど検討せず、プロバイオティクス菌株の関与可能な制御機構も提示していない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記事情に鑑みて、糖尿病による腎線維化の治療におけるプロバイオティクス菌株の新用途を提供し、プロバイオティクス菌株をその他に応用するよう開発する必要がある。
【課題を解決するための手段】
【0008】
そこで、本発明の一態様において、プロバイオティクス菌株GM−263(ADR−1)を含み、その含有量が糖化ヘモグロビン(HbA1c)と血糖濃度を有効に低下させることができ、体重と腎重を正常な範囲に回復させて、更に糖尿病による腎線維化を治療する、糖尿病による腎線維化の治療用組成物が提供される。
【0009】
本発明の他の一態様において、プロバイオティクス菌株GM−263(ADR−1)の用途が提供され、このプロバイオティクス菌株GM−263(ADR−1)は、ヤヌスキナーゼ2(Janus kinase 2;p−JAK2)/シグナル伝達性転写因子1(signal transducer and activator of transcription 1;p−STAT1)のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質の発現を抑制することによって、糖尿病による腎線維化を有効に治療することができる。
【0010】
本発明の前記態様によれば、糖尿病による腎線維化の治療に用いられる組成物が提供される。一実施例において、この組成物は、プロバイオティクス菌株GM−263(ADR−1)を含み、このプロバイオティクス菌株GM−263(ADR−1)は、例えばラクトバチルス・ロイテリ(Lactobacillus reuteri) GM−263(ADR−1)(中国典型培養物保蔵センターに寄託されており、受託番号はCCTCC M 209263)であってもよい。
【0011】
本発明の一実施例によれば、前記プロバイオティクス菌株GM−263(ADR−1)が生菌又は不活化菌である。
【0012】
本発明の一実施例によれば、前記プロバイオティクス菌株GM−263(ADR−1)は、JAK2/STAT1のリン酸化を特異的に抑制し、腎線維化に関するタンパク質の発現を特異的に抑制することに用いられる。腎線維化に関するタンパク質としては、例えばプラスミノーゲン・アクチベーター・インヒビタ−1(plasminogen activator inhibitor;PAI−1)、サイクリン依存性キナーゼ阻害因子(cyclin−dependent kinase inhibitor;CDKI)P21Waf1/Cip1、平滑筋α−アクチン(smooth muscle α−actin;α−SMA)又はフィブロネクチン(fibronectin)が挙げられる。
【0013】
本発明の一実施例によれば、前記組成物は、医薬組成物、補助飲食品、食品又はその組成分である。
【0014】
本発明の他の一態様によれば、プロバイオティクス菌株GM−263(ADR−1)の用途が提供され、前記プロバイオティクス菌株GM−263(ADR−1)は、JAK2とSTAT1のリン酸化を特異的に抑制し、PAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンのタンパク質発現を抑制することができる。
【0015】
本発明の、糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の用途を応用する場合、前記プロバイオティクス菌株GM−263(ADR−1)を用いて、糖化ヘモグロビンと血糖濃度を低下させ、体重と腎重を正常な範囲に回復させて、更にJAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(例えばPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン等)の発現を抑制することによって、糖尿病による腎線維化を有効に治療する。それに従い、プロバイオティクス菌株GM−263(ADR−1)をその他に応用するようも開発する。
【発明の効果】
【0016】
前述によれば、本発明は、プロバイオティクス菌株GM−263(ADR−1)が糖尿病による腎線維化の治療に用いられる組成物及びその用途を提供し、プロバイオティクス菌株GM−263(ADR−1)を用いて組成物を製造し、このプロバイオティクス菌株GM−263(ADR−1)の含有量が糖尿病による腎線維化を有効に治療することができる。
【図面の簡単な説明】
【0017】
下記の図面の詳細な説明は、本発明の前記又はその他の目的、特徴、利点及び実施例をより分りやすくするためのものである。
【0018】
【図1】AとBは本発明の一実施例による各ラットの糖化ヘモグロビン(glycated hemoglobin)濃度(図1A)と血糖濃度(図1B)を示す棒グラフである。
【図2】AとBは本発明の一実施例による各ラットの体重(図2A)と左腎の重量(図2B)を示す棒グラフである。
【図3】本発明の一実施例による各ラットの腎臓皮質組織のウェスタンブロッティング解析図である。
【図4】Aは図5のβ−アクチンの発現量によって標準化された図3のリン酸化JAK2を示す棒グラフであり、Bは図5のβ−アクチンの発現量によって標準化された図3のリン酸化STAT1を示す棒グラフである。
【図5】本発明の他の実施例による各ラットの腎臓皮質組織を示すウェスタンブロッティング解析図である。
【図6】Aはβ−アクチンの発現量によって標準化された図5のPAI−1発現量を示す棒グラフであり、Bはβ−アクチンの発現量によって標準化された図5のP21Waf1/Cip1発現量を示す棒グラフであり、Cはβ−アクチンの発現量によって標準化された図5のα−SMA発現量を示す棒グラフであり、Dはβ−アクチンの発現量によって標準化された図5のフィブロネクチン発現量を示す棒グラフである。
【発明を実施するための形態】
【0019】
ここで、本発明の「プロバイオティクス菌株GM−263(ADR−1)」とは、ラクトバチルス・ロイテリ(Lactobacillus reuteri)GM−263(ADR−1)であり、中国典型培養物保存センター(China Center for Type Culture Collection;CCTCC;中国湖北省武漢市武昌珞珈山)に寄託され、その受託番号はCCTCC M 209263である(なお、寄託時の微生物名は、ラクトバチルス・ロイテリGMNL−263とされている)。
【0020】
前記プロバイオティクス菌株GM−263(ADR−1)は、従来の方法、例えば、健康な大人の消化管から候補菌株を選別し、従来の菌種同定方法、例えば、16S rDNA配列解析及び菌種の生理生化学特性を同定する市販品により、プロバイオティクス菌株がラクトバチルス・ロイテリGM−263(ADR−1)であると同定することができるが、ここで詳しく述べない。
【0021】
簡単に言えば、前記同定されたプロバイオティクス菌株GM−263(ADR−1)はMRSブロス培地(broth medium;DIFCO(登録商標)0881、最終pH 6.5±0.2)を用いて、37℃の温度で、嫌気又は好気で培養される。他の一例において、前記MRSブロス培地を用いる菌液を寒天培地に画線接種(streak plating)することができる。
【0022】
一実施例において、生体内の(in vivo)動物実験によって、本発明のプロバイオティクス菌株GM−263(ADR−1)は、確かに糖化ヘモグロビン(glycated hemoglobin)と血糖(blood sugar)濃度を低下させ、体重と腎重を正常な範囲に回復させ、更にJAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(PAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン等)の発現を特異的に抑制することによって、糖尿病による腎線維化を有効に治療できることが証明されている。
【0023】
ここで特に説明すべきことは、本発明の「動物実験」には、例えばストレプトゾトシン(streptozotocin;STZ)のような薬物を用いることによって、糖尿病を人為的に誘発した実験動物を含み、これにより糖尿病による腎線維化に対するプロバイオティクス菌株GM−263(ADR−1)の治療効果を評価することができる。
【0024】
ここで補充するのは、一実施例において、前記プロバイオティクス菌株GM−263(ADR−1)(例えば、ラクトバチルス・ロイテリGM−263(ADR−1);受託番号はCCTCC M 209263)は、糖尿病による腎線維化の治療用組成物を製造することに用いられる場合、生(live)菌又は不活化(inactive)菌であってもよい。一例において、前記プロバイオティクス菌株GM−263(ADR−1)は、医薬組成物、補助飲食品、食品又はその組成分であってもよい。他の一例において、前記プロバイオティクス菌株GM−263(ADR−1)は凍結乾燥の形にしてもよく、また、このプロバイオティクス菌株GM−263(ADR−1)はその他の成分を更に含んでもよく、例えばグルコース、マルトデキストリン(maltodextrin)、乳児用調製粉乳、フラクトオリゴ糖(fructooligosaccharides)、ステアリン酸マグネシウム(magnesium stearate)、ヨーグルト香料(yogurt spices)、その他の分離しにくい成分、又は前記の任意の組み合わせを更に含んでもよい。
【0025】
また、その他の実施例において、前記プロバイオティクス菌株GM−263(ADR−1)(例えば、ラクトバチルス・ロイテリGM−263(ADR−1);受託番号はCCTCC M 209263)は更にその他の混合菌株を選択的に含んで、糖尿病による腎線維化の治療用組成物を製造することに用いることもできる。一例において、前記その他の混合菌株は、アシドフィルス菌(Lactobacillus acidophilus)、ラクトバチルス・プランタルム(Lactobacillus plantarum)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、発酵乳酸桿菌(Lactobacillus fermentum)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)、サーモフィルス菌(Streptococcus thermophilus)、ラクトバチルス・クレモリス(Lactobacillus cremoris)、ラクトバチルス・パラカゼイ・サブスピーシーズ・パラカゼイ(Lactobacillus paracasei subsp. paracasei)、ラクトバチルス・ラムノーサス・GG(Lactobacillus rhamnosus GG)又は前記の任意の組み合わせを含むが、これらに限られない。
【実施例】
【0026】
以下、実施例を用いて本発明の応用を説明したが、それは本発明を限定するものではなく、当業者であれば、本発明の精神と範囲から逸脱しない限り、種々の変更及び修正することができる。
【0027】
実 施 例 1:
動物評価モデルの作製
1.プロバイオティクス菌株GM−263(ADR−1)の同定と調製
この実施例では、プロバイオティクス菌株GM−263(ADR−1)(受託番号はCCTCC M 209263)を用いて、動物実験を行い、糖尿病による腎線維化を治療するプロバイオティクス菌株GM−263(ADR−1)の効果を評価した。
【0028】
このプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)は、健康な大人の胃腸管から選別された分離株の種別を同定するために、16S rDNA配列解析及び菌種の生理生化学特性を同定する市販品(例えば、API同定システム)を用いた。前記16S rDNA配列解析及びAPI同定システムに関する技術は、当業者に熟知されているので、ここで詳しく述べない。
【0029】
プロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)の16S rDNAの一部の配列解析の結果は、配列番号1に示されたヌクレオチド(nucleotide)配列のようであり、この16S rDNA配列解析は、財団法人食品工業発展研究所に委託して行った。配列番号1に示された16S rDNAには、560個のヌクレオチドがあり、配列を対比したところ、ラクトバチルス・ロイテリ(Lactobacillus reuteri)と99%の類似度(similarity)を有することが示された。
【0030】
次に、例えばAPI(登録商標) 50 CHL同定システム(API(登録商標) 50 CHL system;bioMerieux Inc., France)又は機能が相当する他の商品のような、菌種の生理生化学特性を同定する市販品によって、ラクトバチルス・ロイテリ(Lactobacillus reuteri;ATCC 23272)のような標準菌株と比べることで、プロバイオティクス菌株の「種(species)」別を同定した。
【0031】
表1は、API(登録商標) 50CHL同定システムによってこのプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)を分析した結果を示す。
【0032】
【表1−1】

【表1−2】

【0033】
前記16S rDNA配列解析と表1の結果によれば、このプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)の配列類似度と生理代謝活性は、いずれもラクトバチルス・ロイテリ(Lactobacillus reuteri;ATCC 23272)に近い。よって、このプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)はラクトバチルス・ロイテリ(Lactobacillus reuteri)であることが判明した。
【0034】
前記同定されたラクトバチルス・ロイテリGM−263(ADR−1)は、MRSブロス培地(broth medium;DIFCO(登録商標)0881、最終pH 6.5±0.2)を用いて、37℃の温度で、嫌気又は好気で培養される。又は、前記MRSブロス培地を用いる菌液を寒天培地に画線接種(streak plating)することができる。動物実験に供するために、このラクトバチルスロイテリを大量に培養してもよい。
【0035】
動物実験を行う場合に、ラクトバチルスロイテリGM−263(ADR−1)(受託番号CCTCC M 209263)の菌量は、1gあたり約1×106から約1×1011まで、または1×108までのコロニー形成単位(colony−forming unit;CFU)(CFU/g)であってもよい。このラクトバチルスロイテリGM−263(ADR−1)(受託番号CCTCC M 209263)は、凍結乾燥の形にしてもよく、また、その他の成分を含んでもよく、例えば賦形剤、グルコース、マルトデキストリン、脱脂粉乳、乳児用調製粉乳、フラクトオリゴ糖、ステアリン酸マグネシウム、ヨーグルト香料、その他の分離しにくい成分、又は前記の任意の組み合わせを含んでもよい。一例として、このラクトバチルスロイテリGM−263(ADR−1)(受託番号CCTCC M 209263)は凍結乾燥の形である場合に、前記賦形剤は、脱脂粉乳、トレハロース(trehalose)、フラクトオリゴ糖を含んでもよく、その割合(w/v)については、例えば、約2:1:1であってもよい。
【0036】
2.アレルゲン感作動物実験モデルの作製
この実施例では、12週齢の雄のラット(品系:Sprague−Dawley(S.D.) Rat;供給源:台湾台北楽斯科生物科技股▲ふん▼有限公司)で糖尿病動物実験モデルを作製した。まず、実験ラットに18時間禁食させてから、ストレプトゾトシン(10mMのクエン酸ナトリウムに溶解した, pH 4.5;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)を50mg/kg体重で腹腔内注射(intraperitoneal injection)した。二日間を経て、糖尿病の誘発に成功したかどうかを確認するために、グルコースオキシダーゼ(glucose oxidase)法によって血糖を測定し、血糖濃度が16mmol/L以上のラットを選んだ。この糖尿病になったラットの血糖濃度を毎日監視した。
【0037】
健康ラットと糖尿病ラットを5群に分け、それぞれは、健康ラット対照群(6匹;20.60%の脂肪、56.57%の炭水化物及び22.83%のタンパク質を含む標準飼料を給与した。以下、健康対照群と略称する)、糖尿病ラット対照群(6匹;標準飼料を給与し、以下、糖尿病ラットと略称する)、インシュリンを投与した糖尿病ラット対照群(6匹;標準飼料を給与し、インシュリン注射量が4−5U/キログラム/日である。、以下、糖尿病ラット+インシュリンと略称する)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した健康ラット対照群(6匹;標準飼料を給与し、各ラットに対する毎日の飼育菌量が約1×109コロニー形成単位(colony−forming unit;CFU)であった。以下はGM−263と略称する)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット(6匹;標準飼料を給与し、各ラットに対する毎日の飼育菌量が約1×109 CFUであった。以下、糖尿病ラット+GM−263と略称する)であった。
【0038】
各群のラットは、摂食量には顕著な差異がなく、毎日約25.6±0.77g(p=0.1747)であった。実験材料の全ては0.5mLのリン酸塩緩衝生理食塩水(phosphate−buffered saline;PBS)に調合され、毎日二回投与した。
【0039】
ストレプトゾトシンを注射してから28日後、全てのラットを屠殺して、各ラット毎の体重と左腎の重量を記録し、その後、特定タンパク含有量分析を行うために、解剖して腎臓の皮質を取り出した。
【0040】
ラットの飼育温度は25±1℃、相対湿度は65±5%であり、12時間毎の明暗サイクルに維持し、標準実験室レベルの飼料(Labdiet(登録商標) Laboratory Rodent Diet #5001, PMI Nutrition International Inc., U.S.A)で飼育し、飼育期間中に飼料及び水を自由摂取させた。ラットの飼育条件は、全て台湾の衛生研究院より公表されている実験動物管理ガイドにより行った。
【0041】
実 施 例 2:
生理に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
1.糖尿病ラットの糖化ヘモグロビンと血糖濃度に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
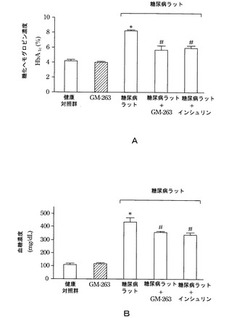
図1Aと図1Bは、本発明の一実施例によるラットの糖化ヘモグロビン(glycated hemoglobin)濃度(図1A)及び血糖濃度(図1B)を示す棒グラフである。図1Aの縦軸は糖化ヘモグロビン濃度(HbA1c)の百分率(%)を示し、図1Bの縦軸は血糖濃度(mg/dl)を示す。図1Aと図1Bの横軸は、それぞれ健康ラット対照群(健康対照群と略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した健康ラット対照群(GM−263と略称)、糖尿病ラット対照群(糖尿病ラットと略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット(糖尿病ラット+GM−263と略称)、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリンと略称)を示す。図面記号*は、健康対照群と比べて、p<0.05であることを示し、図面記号#は、糖尿病ラットと比べて、p<0.05であることを示す。
【0042】
図1Aと図1Bの結果から分かるように、ストレプトゾトシンを注射してから28日後、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与したGM−263群の糖化ヘモグロビン濃度と血糖濃度は、健康対照群に近いが、糖尿病ラットの糖化ヘモグロビン濃度(>7.5%)と血糖濃度(>350mg/dl)は、健康対照群やGM−263群より著しく高い。しかしながら、ラクトバチルス・ロイテリGM−263を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、その糖化ヘモグロビン濃度と血糖濃度の値が、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)に近いことから、糖尿病ラットに実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かに糖化ヘモグロビンと血糖濃度を低下できることを示した。
【0043】
2.糖尿病ラットの体重と腎重に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
図2Aと図2Bは、本発明の一実施例によるラットの体重(図2A)と左腎の重量(図2B)を示す棒グラフである。図2Aの縦軸は体重(g)を示し、図2Bの縦軸は左腎の重量(g)を示す。図2Aと図2Bの横軸は、それぞれ健康ラット対照群(健康対照群と略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した健康ラット対照群(GM−263と略称)、糖尿病ラット対照群(糖尿病ラットと略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット(糖尿病ラット+GM−263と略称)、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリンと略称)を示す。図面記号*は、健康対照群と比べて、p<0.05であることを示し、図面記号#は、糖尿病ラットと比べて、p<0.05であることを示す。
【0044】
図2Aと図2Bの結果から分かるように、ストレプトゾトシンを注射してから28日後、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与したGM−263群の体重と左腎の重量は、健康対照群に近いが、糖尿病ラットの体重は、健康対照群やGM−263群より著しく低く、糖尿病ラットの左腎の重量は、健康対照群やGM−263群より著しく高かった。上記の内、腎重の変化は腎線維化を評価する指標の一つである。
【0045】
しかしながら、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、その体重(図2A)が再び上昇する傾向があり、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)に近かった。なお、図2Bに示すように、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、その左腎の重量(図2B)が糖尿病ラットより著しく低く、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)に近いことから、糖尿病ラットに実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かに糖尿病による腎線維化の状況を改善できることを示した。
【0046】
実 施 例 3:
遺伝子制御と細胞内タンパク質の発現に対するプロバイオティクス菌株GM−26
3(ADR−1)の影響の評価
1.腎臓組織の抽出
実施例1で取り出された腎臓皮質を、この組織約50mgに対し、0.1%のドデシル硫酸ナトリウム(sodium dodecyl sulfate;SDS)溶解バッファー(SDS lysis buffer)1mLの割合で加え、氷上に4℃で保持した後、組織ホモジナイザーで砕き、約10分間静置反応させ、腎臓皮質組織を十分に均質化(homogenize)して、腎臓皮質細胞内のタンパク質をさらに溶出した。
【0047】
前記SDS溶解バッファーは、50mMの塩化トリスヒドロキシメチルアミノメタン(tris(hydroxymethyl)aminomethane chloride;Tris−Cl, pH 8.0;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)溶液、150mMの塩化ナトリウム、0.02%のアジ化ナトリウム(sodium azide;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、1%の界面活性剤NP−40(NONIDET p−40 ethyl phenyl polyethylene glycol;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、0.05%のオルトバナジン酸ナトリウム(sodium orthovanadate ; Na3VO4;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、100μg/mLのフェニルメチルスルホニルフッ化物(phenylmethylsulfonyl fluoride;PMSF;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、1μg/mLのアプロチニン(aprotinin;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、プロテイナーゼ・インヒビター・カクテル(proteinase inhibitor cocktail;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)を含んでもよい。
【0048】
その後、得られたホモジネート(homogenate)を約12000rpmの回転速度で、4℃において、約20分間遠心した。そして、上澄みを回収して、Bradford法によりタンパク質の濃度を測量した後、−70℃に保存し、その後、評価を行った。
【0049】
2.ウェスタンブロッティング(Western blotting)
前記のように得られたホモジネートに対して、10%のドデシル硫酸ナトリウム・ポリアクリルアミドゲル電気泳動分析(sodium dodecyl sulfate−polyacrylamide gel electrophoresis;SDS−PAGE;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)を行った。100Vの電圧で、タンパク質電気泳動緩衝液(125mM Tris−base; 1.25 M Glycine; 1% SDS)において、電気泳動を約3時間行った。その後、192mMのグリシン(glycine)と20%(v/v)のメタノールを含む25mMのTris−HCl溶液(pH 8.3)により、15分間平衡化した。前記SDS−PAGEの調製と関連設備は、当業者が既に熟知しているので、ここで詳しく述べない。
【0050】
前記SDS−PAGEの電気泳動ゲルは、ウェスタンブロッティング分析(Western blotting assay)を続けて行ってもよい。この実施例において、ウェスタンブロッティングキットによって(例えばBio−Rad Scientific Instruments Transfer Unit)、100Vで、タンパク質電気泳動緩衝液(125mM Tris−base; 1.25 M Glycine; 1% SDS)により、電気泳動を約3時間行い、前記電気泳動ゲルのタンパク質を転写膜に転写した。転写膜としては、例えばProtranTMニトロセルロースメンブレーン(nitrocellulose membrane、孔径0.45μM;Schieicher & Schuell, Kneene, NH, U.S.A.)であってもよい。
【0051】
その後、Blocking溶液(例えば、5%の脱脂粉乳をTBS緩衝液(10mM Tris−Base、100mM NaCl、0.1% Tween−20、pH 7.4)に溶解する)で、室温で約1時間反応後、一次抗体(primary antibody)(抗体結合溶液で希釈し、抗体結合溶液の組成は後述する)を入れ、4℃で一晩反応させた。そして、TBS緩衝液で三回洗浄した。各回の洗浄時間は10分間であった。続いて、TBS緩衝液により4000倍に希釈した二次抗体(secondary antibody)をいれて、37℃で1時間反応させてから、TBS緩衝液で三回洗浄した。各回の洗浄時間は10分間であった。その後、例えば増強化学発光(Enhanced ChemiLuminescence;ECL)反応キット(Amersham Corp., Arlington Heights, IL, U.S.A.)などの冷光呈色剤を転写膜に入れて、冷光法によりLAS−3000のルミノ・イメージアナライザ(例えばFujifilm LAS−3000 chemiluminescence detection system, Tokyo, Japan)に現像させ、結果を分析した。
【0052】
前記一次抗体は、例えば、JAK2、STAT1、PAI−1、P21Waf1/Cip1、α−SMA(上記製品がSanta Cruz Biotechnology, Inc., Santa Cruz, CA, U.S.A.より)、フィブロネクチン(Chemicon, Temecula, CA, U.S.A.)、リン酸化JAK2、リン酸化STAT1(上記製品がUpstate Biotechnology, Inc., Santa Cruz, CA, U.S.A.より)、β−アクチン(β−actin;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A)に対するモノクロナール抗体であってもよい。
【0053】
前記二次抗体は、例えば、ストレプトアビジン−ペルオキシダーゼ(streptavidin−peroxidase)を結合したヤギ抗マウスIgG (goat anti−mouse IgG−HRP)、又はストレプトアビジン−ペルオキシダーゼを結合したヤギ抗ウサギIgG (goat anti−rabbit IgG−HRP) (上記製品がAmersham Corp., Arlington Heights, IL, U.S.A.より)であってもよい。
【0054】
前記抗体結合溶液は、例えば、TBS緩衝液(10mM Tris−Base, 100mM NaCl, 0.1% Tween−20, pH 7.4を含む)を含んでもよい。
【0055】
ウェスタンブロッティングのバンド強度は、デンシトメトリー分析(densitometric analysis)法により定量される。その結果は、目標タンパクとβ−アクチンとのバンド強度の割合で表す。それに、ここでいう毎群のサンプルは、少なくとも三回繰り返したものであり、得られた数値は、「平均値±標準偏差(mean±SD)」で示す。統計分析は、One−way ANOVAにより分析し、Tukey−Kramer型多重比較検定法(Tukey−type multiple comparison test)によってスチューデント化残差(studentized)で各群の差異顕著性を比較した。各群の差異がp<0.05の場合、顕著性差異があると考えられる。
【0056】
3.糖尿病ラットの腎臓皮質のJAK2とSTAT1のリン酸化に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
過去の研究によれば、糖尿病動物の高血糖により腎線維化を誘発した過程において、JAK/STATsシグナル伝導経路(signal transduction pathway)は、重要な遺伝子制御の役割を担っている。そこで、この実施例は、更に糖尿病ラットの腎臓皮質のJAK2とSTAT1のリン酸化に対するプロバイオティクス菌株GM−263(ADR−1)の影響を評価した。
【0057】
図3は、本発明の一実施例による糖尿病ラットの腎臓皮質組織を示すウェスタンブロッティング解析図である。その内、レーン1−2は健康対照群を示し、レーン3−4は糖尿病ラット群を示し、レーン5−6はラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット群(糖尿病ラット+GM−263)を示し、レーン7−8はインシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)を示す。図3は、糖尿病ラットの腎臓皮質組織内のJAK2(約120kDa)、STAT1(約90kDa)、リン酸化JAK2(約120kDa)、STAT1(約90kDa)の発現を分析するものである。また、図5のβ−アクチンは、前記蛋白の発現量を標準化するものである。
【0058】
図4Aは、β−アクチンの発現量によって標準化された図3のリン酸化JAK2を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたリン酸化JAK2の相対量(即ち、JAK2リン酸化/β−アクチンの相対発現量、任意単位(arbitary units))を示す。また、健康対照群のJAK2リン酸化/β−アクチンの相対発現量を1.0とする。
【0059】
図4Bは、β−アクチンの発現量によって標準化された図3のリン酸化STAT1を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたリン酸化STAT1の相対量(即ち、リン酸化STAT1/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のSTAT1リン酸化/β−アクチンの相対発現量を1.0とする。図4Aと図4Bの図面記号*は、健康対照群と比べて、p<0.05であることを示し、図面記号#は、糖尿病ラットと比べて、p<0.05であることを示す。
【0060】
図3、図4A、図4Bの結果からわかるように、ストレプトゾトシンを注射してから28日後、糖尿病ラットのJAK2(図3の上からの二列のレーン3−4)とSTAT1(図3の下からの二列のレーン3−4)のリン酸化の相対量は、いずれも健康対照群(図3のレーン1−2)より著しく高いことから、糖尿病ラットの腎臓皮質のJAK2とSTAT1は高度に活性化されている状態になることが示された。
【0061】
しかしながら、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、そのJAK2とSTAT1のリン酸化の相対量(図3のレーン5−6)が著しく低下して、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)(図3のレーン7−8)に近いことから、実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かにJAK2とSTAT1のリン酸化を特異的に抑制できることを示した。
【0062】
4.糖尿病ラットの腎臓皮質の細胞内タンパク質の発現に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
図5は、本発明の他の実施例による糖尿病ラットの腎臓皮質組織を示すウェスタンブロッティング解析図であり、レーン1−2は健康対照群を示し、レーン3−4は糖尿病ラット群を示し、レーン5−6はラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット群(糖尿病ラット+GM−263)を示し、レーン7−8はインシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)を示す。図5は、糖尿病ラットの腎臓皮質組織内のPAI−1(約50kDa)、P21Waf1/Cip1(約20kDa)、α−SMA(約42kDa)、フィブロネクチン(約200kDa)の発現量を分析するものである。また、β−アクチンは、前記タンパクの発現量を標準化するものである。
【0063】
図6Aは、β−アクチンの発現量によって標準化された図5のPAI−1発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたPAI−1の相対発現量(即ち、PAI−1/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のPAI−1/β−アクチンの相対発現量を1.0とする。
【0064】
図6Bは、β−アクチンの発現量によって標準化された図5のP21Waf1/Cip1発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたP21Waf1/Cip1の相対発現量(即ち、P21Waf1/Cip1/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のP21Waf1/Cip1/β−アクチンの相対発現量を1.0とする。
【0065】
図6Cは、β−アクチンの発現量によって標準化された図5のα−SMA発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたα−SMAの相対発現量(即ちα−SMA/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のα−SMA/β−アクチンの相対発現量を1.0とする。
【0066】
図6Dは、β−アクチンの発現量によって標準化された図5のフィブロネクチン発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたフィブロネクチンの相対発現量(即ち、フィブロネクチン/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のフィブロネクチン/β−アクチンの相対発現量を1.0とする。
【0067】
図5、図6A乃至図6Dの結果からわかるように、ストレプトゾトシンを注射してから28日後、糖尿病ラットのPAI−1(図5の上から一列目のレーン3−4)、P21Waf1/Cip1(図5の上から二列目のレーン3−4)、α−SMA(図5の上から三列目のレーン3−4)、フィブロネクチン(図5の最後の列のレーン3−4)のリン酸化の相対量は、健康対照群(図5のレーン1−2)より著しく高いことから、糖尿病ラットの腎臓皮質のPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンは高度に発現されている状態になり、糖尿病ラットの腎線維化を引き起こしたことを示した。
【0068】
しかし、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、そのPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンの相対量(図5のレーン5−6)が著しく低下し、それにP21Waf1/Cip1とα−SMAの低下程度が、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)(図5のレーン7−8)よりも低いことから、実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かにPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンの発現量を特異的に抑制できることを示した。
【0069】
以上をまとめていえば、本発明のプロバイオティクス菌株GM−263(ADR−1)(ラクトバチルスロイテリGM−263(ADR−1))(受託番号はCCTCC M 209263)は、糖尿病による腎線維化の治療に応用できることが証明されており、また、本発明は、乳酸菌の関与可能な制御機構、即ち、JAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(PAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン)の発現を抑制する制御機構を提示し、それによって、糖尿病による腎線維化を有効に治療でき、それに従い、プロバイオティクス菌株をその他に応用するよう開発する。
【0070】
ここで補充するのは、本発明は、特定の菌株、特定の分析方式、特定の動物モデル、特定の反応条件、特定の使用方法、特定の材料又は特定の設備等を例として、本発明の、糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の用途を説明するが、当業者が理解するように、本発明はこれらに限られず、本発明の精神と範囲から逸脱しない限り、本発明のプロバイオティクス菌株GM−263(ADR−1)がその他のプロバイオティクス菌株、その他の分析方式、その他の動物モデル、その他の反応条件、その他の使用方式、その他の同等レベルの材料又はその他の設備等によって行ってもよい。また、本発明のプロバイオティクス菌株GM−263(ADR−1)を、例えば医薬組成物、補助飲食品、食品又はその組成分などの、糖尿病による腎線維化を治療する組成物の製造に用いる場合、プロバイオティクス菌株GM−263(ADR−1)は、生菌又は不活化菌であってもよく、また、凍結乾燥の形であってもよい。なお、本発明のプロバイオティクス菌株GM−263(ADR−1)は、更にその他の成分を含んでもよく、例えばグルコース、マルトデキストリン、乳児用調製粉乳、フラクトオリゴ糖、ステアリン酸マグネシウム、ヨーグルト香料、その他の分離しにくい成分、又は前記の任意の組み合わせを更に含んでもよい。
【0071】
本発明の前記実施例から分かるように、本発明の、糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の用途は、その利点がプロバイオティクス菌株GM−263(ADR−1)を用いて、糖化ヘモグロビンと血糖濃度を低下させ、体重と腎重を正常な範囲に回復させて、更に、JAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(例えばPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン等)の発現を抑制することによって、糖尿病による腎線維化を有効に治療し、それに従い、プロバイオティクス菌株GM−263(ADR−1)をその他に応用するよう開発する。
【0072】
本発明を複数の実施例によって以上のように開示したが、これは本発明を限定するものではなく、当業者であれば、本発明の精神及び範囲から逸脱しない限り、各種の変更及び修飾することができる。本発明は、特許請求の範囲の記載によって限定される。
【技術分野】
【0001】
本発明はプロバイオティクス菌株の用途に関し、特に、プロバイオティクス菌株GM−263(ADR−1)が糖尿病による腎線維化の治療に用いられる組成物及びその用途に関する。
【背景技術】
【0002】
高血糖が糖尿病性腎症(diabetic nephropathy;DN)を誘発する主な原因であり、透析を受けている患者において、糖尿病による糖尿病性腎症(diabetic nephropathy;DN)患者が40%を占め、それに糖尿病性腎症が末期腎不全(end−stage renal disease;ESRD)を誘発する主な原因でもある。糖尿病性腎症は、通常、糖尿病発症後の15〜20年から臨床反応が発生し、高い割合で末期腎不全に発展してしまう。同時に、例えば、高血圧症、高血脂症、高尿酸症、心血管疾患などの他の疾病が伴う可能性もある。
【0003】
糖尿病性腎症は、おおよそ過剰濾過(hyperfiltration)期、静止期(silent phase)、微量アルブミン尿(microalbuminuria)期、タンパク尿(proteinuria)期及び末期腎不全である五つの時期に分けられる。一般的に、糖尿病性腎症の治療は血糖制御、血圧制御、飲食制御、薬物制御を多く採用し、それによって、血糖、血圧、タンパク質の摂食量を制御する。
【0004】
数多くの研究において、腸内菌叢が体の健康に影響を与えることが提示されている。菌叢のバランスを維持する方法としては、プロバイオティクス(probiotics又はprobiotic bacteria)を摂取する方法がある。プロバイオティクスは、一般的に人体内からの、腸内健康に有益な生菌を指し、外部から補充され、体に有益になる可能性がある微生物をも指しており、例えば、乳酸菌(lactic acid bacteria;LAB)と一部の酵母菌が挙げられ、その内、乳酸菌は、乳糖又はその他の糖類を乳酸に転換する微生物の総称である。乳酸菌はグラム陽性菌に属し、常に食品工業における発酵に用いられる。
【0005】
近年、流行病学に関する研究から、乳酸菌は、アレルギーに関する疾病及び胃腸病、例えば炎症性腸疾患(inflammatory bowel disease;IBD)などを改善できることが知られてきた。そして、更に乳酸菌が免疫反応を刺激することができ、無害のアレルゲン(innocent allergens)に対しての免疫寛容(tolerance)を発達させる。その他の研究において、乳酸菌が人間や家畜の抗生剤に関する下痢(antibiotic−associated diarrhea)、旅行者下痢(travellers’ diarrhea)、小児下痢(pediatric diarrhea)、炎症性腸疾患(IBD)、過敏性腸症候群(irritable bowel syndrome)、アトピー性疾患(atopic disease)などを有効に改善できることも示されている。
【0006】
しかし、前記研究において、プロバイオティクス菌株が糖尿病による腎線維化に応用できるかどうかについて殆ど検討せず、プロバイオティクス菌株の関与可能な制御機構も提示していない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記事情に鑑みて、糖尿病による腎線維化の治療におけるプロバイオティクス菌株の新用途を提供し、プロバイオティクス菌株をその他に応用するよう開発する必要がある。
【課題を解決するための手段】
【0008】
そこで、本発明の一態様において、プロバイオティクス菌株GM−263(ADR−1)を含み、その含有量が糖化ヘモグロビン(HbA1c)と血糖濃度を有効に低下させることができ、体重と腎重を正常な範囲に回復させて、更に糖尿病による腎線維化を治療する、糖尿病による腎線維化の治療用組成物が提供される。
【0009】
本発明の他の一態様において、プロバイオティクス菌株GM−263(ADR−1)の用途が提供され、このプロバイオティクス菌株GM−263(ADR−1)は、ヤヌスキナーゼ2(Janus kinase 2;p−JAK2)/シグナル伝達性転写因子1(signal transducer and activator of transcription 1;p−STAT1)のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質の発現を抑制することによって、糖尿病による腎線維化を有効に治療することができる。
【0010】
本発明の前記態様によれば、糖尿病による腎線維化の治療に用いられる組成物が提供される。一実施例において、この組成物は、プロバイオティクス菌株GM−263(ADR−1)を含み、このプロバイオティクス菌株GM−263(ADR−1)は、例えばラクトバチルス・ロイテリ(Lactobacillus reuteri) GM−263(ADR−1)(中国典型培養物保蔵センターに寄託されており、受託番号はCCTCC M 209263)であってもよい。
【0011】
本発明の一実施例によれば、前記プロバイオティクス菌株GM−263(ADR−1)が生菌又は不活化菌である。
【0012】
本発明の一実施例によれば、前記プロバイオティクス菌株GM−263(ADR−1)は、JAK2/STAT1のリン酸化を特異的に抑制し、腎線維化に関するタンパク質の発現を特異的に抑制することに用いられる。腎線維化に関するタンパク質としては、例えばプラスミノーゲン・アクチベーター・インヒビタ−1(plasminogen activator inhibitor;PAI−1)、サイクリン依存性キナーゼ阻害因子(cyclin−dependent kinase inhibitor;CDKI)P21Waf1/Cip1、平滑筋α−アクチン(smooth muscle α−actin;α−SMA)又はフィブロネクチン(fibronectin)が挙げられる。
【0013】
本発明の一実施例によれば、前記組成物は、医薬組成物、補助飲食品、食品又はその組成分である。
【0014】
本発明の他の一態様によれば、プロバイオティクス菌株GM−263(ADR−1)の用途が提供され、前記プロバイオティクス菌株GM−263(ADR−1)は、JAK2とSTAT1のリン酸化を特異的に抑制し、PAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンのタンパク質発現を抑制することができる。
【0015】
本発明の、糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の用途を応用する場合、前記プロバイオティクス菌株GM−263(ADR−1)を用いて、糖化ヘモグロビンと血糖濃度を低下させ、体重と腎重を正常な範囲に回復させて、更にJAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(例えばPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン等)の発現を抑制することによって、糖尿病による腎線維化を有効に治療する。それに従い、プロバイオティクス菌株GM−263(ADR−1)をその他に応用するようも開発する。
【発明の効果】
【0016】
前述によれば、本発明は、プロバイオティクス菌株GM−263(ADR−1)が糖尿病による腎線維化の治療に用いられる組成物及びその用途を提供し、プロバイオティクス菌株GM−263(ADR−1)を用いて組成物を製造し、このプロバイオティクス菌株GM−263(ADR−1)の含有量が糖尿病による腎線維化を有効に治療することができる。
【図面の簡単な説明】
【0017】
下記の図面の詳細な説明は、本発明の前記又はその他の目的、特徴、利点及び実施例をより分りやすくするためのものである。
【0018】
【図1】AとBは本発明の一実施例による各ラットの糖化ヘモグロビン(glycated hemoglobin)濃度(図1A)と血糖濃度(図1B)を示す棒グラフである。
【図2】AとBは本発明の一実施例による各ラットの体重(図2A)と左腎の重量(図2B)を示す棒グラフである。
【図3】本発明の一実施例による各ラットの腎臓皮質組織のウェスタンブロッティング解析図である。
【図4】Aは図5のβ−アクチンの発現量によって標準化された図3のリン酸化JAK2を示す棒グラフであり、Bは図5のβ−アクチンの発現量によって標準化された図3のリン酸化STAT1を示す棒グラフである。
【図5】本発明の他の実施例による各ラットの腎臓皮質組織を示すウェスタンブロッティング解析図である。
【図6】Aはβ−アクチンの発現量によって標準化された図5のPAI−1発現量を示す棒グラフであり、Bはβ−アクチンの発現量によって標準化された図5のP21Waf1/Cip1発現量を示す棒グラフであり、Cはβ−アクチンの発現量によって標準化された図5のα−SMA発現量を示す棒グラフであり、Dはβ−アクチンの発現量によって標準化された図5のフィブロネクチン発現量を示す棒グラフである。
【発明を実施するための形態】
【0019】
ここで、本発明の「プロバイオティクス菌株GM−263(ADR−1)」とは、ラクトバチルス・ロイテリ(Lactobacillus reuteri)GM−263(ADR−1)であり、中国典型培養物保存センター(China Center for Type Culture Collection;CCTCC;中国湖北省武漢市武昌珞珈山)に寄託され、その受託番号はCCTCC M 209263である(なお、寄託時の微生物名は、ラクトバチルス・ロイテリGMNL−263とされている)。
【0020】
前記プロバイオティクス菌株GM−263(ADR−1)は、従来の方法、例えば、健康な大人の消化管から候補菌株を選別し、従来の菌種同定方法、例えば、16S rDNA配列解析及び菌種の生理生化学特性を同定する市販品により、プロバイオティクス菌株がラクトバチルス・ロイテリGM−263(ADR−1)であると同定することができるが、ここで詳しく述べない。
【0021】
簡単に言えば、前記同定されたプロバイオティクス菌株GM−263(ADR−1)はMRSブロス培地(broth medium;DIFCO(登録商標)0881、最終pH 6.5±0.2)を用いて、37℃の温度で、嫌気又は好気で培養される。他の一例において、前記MRSブロス培地を用いる菌液を寒天培地に画線接種(streak plating)することができる。
【0022】
一実施例において、生体内の(in vivo)動物実験によって、本発明のプロバイオティクス菌株GM−263(ADR−1)は、確かに糖化ヘモグロビン(glycated hemoglobin)と血糖(blood sugar)濃度を低下させ、体重と腎重を正常な範囲に回復させ、更にJAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(PAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン等)の発現を特異的に抑制することによって、糖尿病による腎線維化を有効に治療できることが証明されている。
【0023】
ここで特に説明すべきことは、本発明の「動物実験」には、例えばストレプトゾトシン(streptozotocin;STZ)のような薬物を用いることによって、糖尿病を人為的に誘発した実験動物を含み、これにより糖尿病による腎線維化に対するプロバイオティクス菌株GM−263(ADR−1)の治療効果を評価することができる。
【0024】
ここで補充するのは、一実施例において、前記プロバイオティクス菌株GM−263(ADR−1)(例えば、ラクトバチルス・ロイテリGM−263(ADR−1);受託番号はCCTCC M 209263)は、糖尿病による腎線維化の治療用組成物を製造することに用いられる場合、生(live)菌又は不活化(inactive)菌であってもよい。一例において、前記プロバイオティクス菌株GM−263(ADR−1)は、医薬組成物、補助飲食品、食品又はその組成分であってもよい。他の一例において、前記プロバイオティクス菌株GM−263(ADR−1)は凍結乾燥の形にしてもよく、また、このプロバイオティクス菌株GM−263(ADR−1)はその他の成分を更に含んでもよく、例えばグルコース、マルトデキストリン(maltodextrin)、乳児用調製粉乳、フラクトオリゴ糖(fructooligosaccharides)、ステアリン酸マグネシウム(magnesium stearate)、ヨーグルト香料(yogurt spices)、その他の分離しにくい成分、又は前記の任意の組み合わせを更に含んでもよい。
【0025】
また、その他の実施例において、前記プロバイオティクス菌株GM−263(ADR−1)(例えば、ラクトバチルス・ロイテリGM−263(ADR−1);受託番号はCCTCC M 209263)は更にその他の混合菌株を選択的に含んで、糖尿病による腎線維化の治療用組成物を製造することに用いることもできる。一例において、前記その他の混合菌株は、アシドフィルス菌(Lactobacillus acidophilus)、ラクトバチルス・プランタルム(Lactobacillus plantarum)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、発酵乳酸桿菌(Lactobacillus fermentum)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)、サーモフィルス菌(Streptococcus thermophilus)、ラクトバチルス・クレモリス(Lactobacillus cremoris)、ラクトバチルス・パラカゼイ・サブスピーシーズ・パラカゼイ(Lactobacillus paracasei subsp. paracasei)、ラクトバチルス・ラムノーサス・GG(Lactobacillus rhamnosus GG)又は前記の任意の組み合わせを含むが、これらに限られない。
【実施例】
【0026】
以下、実施例を用いて本発明の応用を説明したが、それは本発明を限定するものではなく、当業者であれば、本発明の精神と範囲から逸脱しない限り、種々の変更及び修正することができる。
【0027】
実 施 例 1:
動物評価モデルの作製
1.プロバイオティクス菌株GM−263(ADR−1)の同定と調製
この実施例では、プロバイオティクス菌株GM−263(ADR−1)(受託番号はCCTCC M 209263)を用いて、動物実験を行い、糖尿病による腎線維化を治療するプロバイオティクス菌株GM−263(ADR−1)の効果を評価した。
【0028】
このプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)は、健康な大人の胃腸管から選別された分離株の種別を同定するために、16S rDNA配列解析及び菌種の生理生化学特性を同定する市販品(例えば、API同定システム)を用いた。前記16S rDNA配列解析及びAPI同定システムに関する技術は、当業者に熟知されているので、ここで詳しく述べない。
【0029】
プロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)の16S rDNAの一部の配列解析の結果は、配列番号1に示されたヌクレオチド(nucleotide)配列のようであり、この16S rDNA配列解析は、財団法人食品工業発展研究所に委託して行った。配列番号1に示された16S rDNAには、560個のヌクレオチドがあり、配列を対比したところ、ラクトバチルス・ロイテリ(Lactobacillus reuteri)と99%の類似度(similarity)を有することが示された。
【0030】
次に、例えばAPI(登録商標) 50 CHL同定システム(API(登録商標) 50 CHL system;bioMerieux Inc., France)又は機能が相当する他の商品のような、菌種の生理生化学特性を同定する市販品によって、ラクトバチルス・ロイテリ(Lactobacillus reuteri;ATCC 23272)のような標準菌株と比べることで、プロバイオティクス菌株の「種(species)」別を同定した。
【0031】
表1は、API(登録商標) 50CHL同定システムによってこのプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)を分析した結果を示す。
【0032】
【表1−1】

【表1−2】

【0033】
前記16S rDNA配列解析と表1の結果によれば、このプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)の配列類似度と生理代謝活性は、いずれもラクトバチルス・ロイテリ(Lactobacillus reuteri;ATCC 23272)に近い。よって、このプロバイオティクス菌株GM−263(ADR−1;CCTCC M 209263)はラクトバチルス・ロイテリ(Lactobacillus reuteri)であることが判明した。
【0034】
前記同定されたラクトバチルス・ロイテリGM−263(ADR−1)は、MRSブロス培地(broth medium;DIFCO(登録商標)0881、最終pH 6.5±0.2)を用いて、37℃の温度で、嫌気又は好気で培養される。又は、前記MRSブロス培地を用いる菌液を寒天培地に画線接種(streak plating)することができる。動物実験に供するために、このラクトバチルスロイテリを大量に培養してもよい。
【0035】
動物実験を行う場合に、ラクトバチルスロイテリGM−263(ADR−1)(受託番号CCTCC M 209263)の菌量は、1gあたり約1×106から約1×1011まで、または1×108までのコロニー形成単位(colony−forming unit;CFU)(CFU/g)であってもよい。このラクトバチルスロイテリGM−263(ADR−1)(受託番号CCTCC M 209263)は、凍結乾燥の形にしてもよく、また、その他の成分を含んでもよく、例えば賦形剤、グルコース、マルトデキストリン、脱脂粉乳、乳児用調製粉乳、フラクトオリゴ糖、ステアリン酸マグネシウム、ヨーグルト香料、その他の分離しにくい成分、又は前記の任意の組み合わせを含んでもよい。一例として、このラクトバチルスロイテリGM−263(ADR−1)(受託番号CCTCC M 209263)は凍結乾燥の形である場合に、前記賦形剤は、脱脂粉乳、トレハロース(trehalose)、フラクトオリゴ糖を含んでもよく、その割合(w/v)については、例えば、約2:1:1であってもよい。
【0036】
2.アレルゲン感作動物実験モデルの作製
この実施例では、12週齢の雄のラット(品系:Sprague−Dawley(S.D.) Rat;供給源:台湾台北楽斯科生物科技股▲ふん▼有限公司)で糖尿病動物実験モデルを作製した。まず、実験ラットに18時間禁食させてから、ストレプトゾトシン(10mMのクエン酸ナトリウムに溶解した, pH 4.5;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)を50mg/kg体重で腹腔内注射(intraperitoneal injection)した。二日間を経て、糖尿病の誘発に成功したかどうかを確認するために、グルコースオキシダーゼ(glucose oxidase)法によって血糖を測定し、血糖濃度が16mmol/L以上のラットを選んだ。この糖尿病になったラットの血糖濃度を毎日監視した。
【0037】
健康ラットと糖尿病ラットを5群に分け、それぞれは、健康ラット対照群(6匹;20.60%の脂肪、56.57%の炭水化物及び22.83%のタンパク質を含む標準飼料を給与した。以下、健康対照群と略称する)、糖尿病ラット対照群(6匹;標準飼料を給与し、以下、糖尿病ラットと略称する)、インシュリンを投与した糖尿病ラット対照群(6匹;標準飼料を給与し、インシュリン注射量が4−5U/キログラム/日である。、以下、糖尿病ラット+インシュリンと略称する)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した健康ラット対照群(6匹;標準飼料を給与し、各ラットに対する毎日の飼育菌量が約1×109コロニー形成単位(colony−forming unit;CFU)であった。以下はGM−263と略称する)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット(6匹;標準飼料を給与し、各ラットに対する毎日の飼育菌量が約1×109 CFUであった。以下、糖尿病ラット+GM−263と略称する)であった。
【0038】
各群のラットは、摂食量には顕著な差異がなく、毎日約25.6±0.77g(p=0.1747)であった。実験材料の全ては0.5mLのリン酸塩緩衝生理食塩水(phosphate−buffered saline;PBS)に調合され、毎日二回投与した。
【0039】
ストレプトゾトシンを注射してから28日後、全てのラットを屠殺して、各ラット毎の体重と左腎の重量を記録し、その後、特定タンパク含有量分析を行うために、解剖して腎臓の皮質を取り出した。
【0040】
ラットの飼育温度は25±1℃、相対湿度は65±5%であり、12時間毎の明暗サイクルに維持し、標準実験室レベルの飼料(Labdiet(登録商標) Laboratory Rodent Diet #5001, PMI Nutrition International Inc., U.S.A)で飼育し、飼育期間中に飼料及び水を自由摂取させた。ラットの飼育条件は、全て台湾の衛生研究院より公表されている実験動物管理ガイドにより行った。
【0041】
実 施 例 2:
生理に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
1.糖尿病ラットの糖化ヘモグロビンと血糖濃度に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
図1Aと図1Bは、本発明の一実施例によるラットの糖化ヘモグロビン(glycated hemoglobin)濃度(図1A)及び血糖濃度(図1B)を示す棒グラフである。図1Aの縦軸は糖化ヘモグロビン濃度(HbA1c)の百分率(%)を示し、図1Bの縦軸は血糖濃度(mg/dl)を示す。図1Aと図1Bの横軸は、それぞれ健康ラット対照群(健康対照群と略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した健康ラット対照群(GM−263と略称)、糖尿病ラット対照群(糖尿病ラットと略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット(糖尿病ラット+GM−263と略称)、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリンと略称)を示す。図面記号*は、健康対照群と比べて、p<0.05であることを示し、図面記号#は、糖尿病ラットと比べて、p<0.05であることを示す。
【0042】
図1Aと図1Bの結果から分かるように、ストレプトゾトシンを注射してから28日後、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与したGM−263群の糖化ヘモグロビン濃度と血糖濃度は、健康対照群に近いが、糖尿病ラットの糖化ヘモグロビン濃度(>7.5%)と血糖濃度(>350mg/dl)は、健康対照群やGM−263群より著しく高い。しかしながら、ラクトバチルス・ロイテリGM−263を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、その糖化ヘモグロビン濃度と血糖濃度の値が、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)に近いことから、糖尿病ラットに実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かに糖化ヘモグロビンと血糖濃度を低下できることを示した。
【0043】
2.糖尿病ラットの体重と腎重に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
図2Aと図2Bは、本発明の一実施例によるラットの体重(図2A)と左腎の重量(図2B)を示す棒グラフである。図2Aの縦軸は体重(g)を示し、図2Bの縦軸は左腎の重量(g)を示す。図2Aと図2Bの横軸は、それぞれ健康ラット対照群(健康対照群と略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した健康ラット対照群(GM−263と略称)、糖尿病ラット対照群(糖尿病ラットと略称)、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット(糖尿病ラット+GM−263と略称)、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリンと略称)を示す。図面記号*は、健康対照群と比べて、p<0.05であることを示し、図面記号#は、糖尿病ラットと比べて、p<0.05であることを示す。
【0044】
図2Aと図2Bの結果から分かるように、ストレプトゾトシンを注射してから28日後、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与したGM−263群の体重と左腎の重量は、健康対照群に近いが、糖尿病ラットの体重は、健康対照群やGM−263群より著しく低く、糖尿病ラットの左腎の重量は、健康対照群やGM−263群より著しく高かった。上記の内、腎重の変化は腎線維化を評価する指標の一つである。
【0045】
しかしながら、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、その体重(図2A)が再び上昇する傾向があり、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)に近かった。なお、図2Bに示すように、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、その左腎の重量(図2B)が糖尿病ラットより著しく低く、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)に近いことから、糖尿病ラットに実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かに糖尿病による腎線維化の状況を改善できることを示した。
【0046】
実 施 例 3:
遺伝子制御と細胞内タンパク質の発現に対するプロバイオティクス菌株GM−26
3(ADR−1)の影響の評価
1.腎臓組織の抽出
実施例1で取り出された腎臓皮質を、この組織約50mgに対し、0.1%のドデシル硫酸ナトリウム(sodium dodecyl sulfate;SDS)溶解バッファー(SDS lysis buffer)1mLの割合で加え、氷上に4℃で保持した後、組織ホモジナイザーで砕き、約10分間静置反応させ、腎臓皮質組織を十分に均質化(homogenize)して、腎臓皮質細胞内のタンパク質をさらに溶出した。
【0047】
前記SDS溶解バッファーは、50mMの塩化トリスヒドロキシメチルアミノメタン(tris(hydroxymethyl)aminomethane chloride;Tris−Cl, pH 8.0;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)溶液、150mMの塩化ナトリウム、0.02%のアジ化ナトリウム(sodium azide;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、1%の界面活性剤NP−40(NONIDET p−40 ethyl phenyl polyethylene glycol;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、0.05%のオルトバナジン酸ナトリウム(sodium orthovanadate ; Na3VO4;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、100μg/mLのフェニルメチルスルホニルフッ化物(phenylmethylsulfonyl fluoride;PMSF;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、1μg/mLのアプロチニン(aprotinin;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)、プロテイナーゼ・インヒビター・カクテル(proteinase inhibitor cocktail;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)を含んでもよい。
【0048】
その後、得られたホモジネート(homogenate)を約12000rpmの回転速度で、4℃において、約20分間遠心した。そして、上澄みを回収して、Bradford法によりタンパク質の濃度を測量した後、−70℃に保存し、その後、評価を行った。
【0049】
2.ウェスタンブロッティング(Western blotting)
前記のように得られたホモジネートに対して、10%のドデシル硫酸ナトリウム・ポリアクリルアミドゲル電気泳動分析(sodium dodecyl sulfate−polyacrylamide gel electrophoresis;SDS−PAGE;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A.)を行った。100Vの電圧で、タンパク質電気泳動緩衝液(125mM Tris−base; 1.25 M Glycine; 1% SDS)において、電気泳動を約3時間行った。その後、192mMのグリシン(glycine)と20%(v/v)のメタノールを含む25mMのTris−HCl溶液(pH 8.3)により、15分間平衡化した。前記SDS−PAGEの調製と関連設備は、当業者が既に熟知しているので、ここで詳しく述べない。
【0050】
前記SDS−PAGEの電気泳動ゲルは、ウェスタンブロッティング分析(Western blotting assay)を続けて行ってもよい。この実施例において、ウェスタンブロッティングキットによって(例えばBio−Rad Scientific Instruments Transfer Unit)、100Vで、タンパク質電気泳動緩衝液(125mM Tris−base; 1.25 M Glycine; 1% SDS)により、電気泳動を約3時間行い、前記電気泳動ゲルのタンパク質を転写膜に転写した。転写膜としては、例えばProtranTMニトロセルロースメンブレーン(nitrocellulose membrane、孔径0.45μM;Schieicher & Schuell, Kneene, NH, U.S.A.)であってもよい。
【0051】
その後、Blocking溶液(例えば、5%の脱脂粉乳をTBS緩衝液(10mM Tris−Base、100mM NaCl、0.1% Tween−20、pH 7.4)に溶解する)で、室温で約1時間反応後、一次抗体(primary antibody)(抗体結合溶液で希釈し、抗体結合溶液の組成は後述する)を入れ、4℃で一晩反応させた。そして、TBS緩衝液で三回洗浄した。各回の洗浄時間は10分間であった。続いて、TBS緩衝液により4000倍に希釈した二次抗体(secondary antibody)をいれて、37℃で1時間反応させてから、TBS緩衝液で三回洗浄した。各回の洗浄時間は10分間であった。その後、例えば増強化学発光(Enhanced ChemiLuminescence;ECL)反応キット(Amersham Corp., Arlington Heights, IL, U.S.A.)などの冷光呈色剤を転写膜に入れて、冷光法によりLAS−3000のルミノ・イメージアナライザ(例えばFujifilm LAS−3000 chemiluminescence detection system, Tokyo, Japan)に現像させ、結果を分析した。
【0052】
前記一次抗体は、例えば、JAK2、STAT1、PAI−1、P21Waf1/Cip1、α−SMA(上記製品がSanta Cruz Biotechnology, Inc., Santa Cruz, CA, U.S.A.より)、フィブロネクチン(Chemicon, Temecula, CA, U.S.A.)、リン酸化JAK2、リン酸化STAT1(上記製品がUpstate Biotechnology, Inc., Santa Cruz, CA, U.S.A.より)、β−アクチン(β−actin;Sigma−Aldrich Chemical, St. Louis, MO, U.S.A)に対するモノクロナール抗体であってもよい。
【0053】
前記二次抗体は、例えば、ストレプトアビジン−ペルオキシダーゼ(streptavidin−peroxidase)を結合したヤギ抗マウスIgG (goat anti−mouse IgG−HRP)、又はストレプトアビジン−ペルオキシダーゼを結合したヤギ抗ウサギIgG (goat anti−rabbit IgG−HRP) (上記製品がAmersham Corp., Arlington Heights, IL, U.S.A.より)であってもよい。
【0054】
前記抗体結合溶液は、例えば、TBS緩衝液(10mM Tris−Base, 100mM NaCl, 0.1% Tween−20, pH 7.4を含む)を含んでもよい。
【0055】
ウェスタンブロッティングのバンド強度は、デンシトメトリー分析(densitometric analysis)法により定量される。その結果は、目標タンパクとβ−アクチンとのバンド強度の割合で表す。それに、ここでいう毎群のサンプルは、少なくとも三回繰り返したものであり、得られた数値は、「平均値±標準偏差(mean±SD)」で示す。統計分析は、One−way ANOVAにより分析し、Tukey−Kramer型多重比較検定法(Tukey−type multiple comparison test)によってスチューデント化残差(studentized)で各群の差異顕著性を比較した。各群の差異がp<0.05の場合、顕著性差異があると考えられる。
【0056】
3.糖尿病ラットの腎臓皮質のJAK2とSTAT1のリン酸化に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
過去の研究によれば、糖尿病動物の高血糖により腎線維化を誘発した過程において、JAK/STATsシグナル伝導経路(signal transduction pathway)は、重要な遺伝子制御の役割を担っている。そこで、この実施例は、更に糖尿病ラットの腎臓皮質のJAK2とSTAT1のリン酸化に対するプロバイオティクス菌株GM−263(ADR−1)の影響を評価した。
【0057】
図3は、本発明の一実施例による糖尿病ラットの腎臓皮質組織を示すウェスタンブロッティング解析図である。その内、レーン1−2は健康対照群を示し、レーン3−4は糖尿病ラット群を示し、レーン5−6はラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット群(糖尿病ラット+GM−263)を示し、レーン7−8はインシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)を示す。図3は、糖尿病ラットの腎臓皮質組織内のJAK2(約120kDa)、STAT1(約90kDa)、リン酸化JAK2(約120kDa)、STAT1(約90kDa)の発現を分析するものである。また、図5のβ−アクチンは、前記蛋白の発現量を標準化するものである。
【0058】
図4Aは、β−アクチンの発現量によって標準化された図3のリン酸化JAK2を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたリン酸化JAK2の相対量(即ち、JAK2リン酸化/β−アクチンの相対発現量、任意単位(arbitary units))を示す。また、健康対照群のJAK2リン酸化/β−アクチンの相対発現量を1.0とする。
【0059】
図4Bは、β−アクチンの発現量によって標準化された図3のリン酸化STAT1を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたリン酸化STAT1の相対量(即ち、リン酸化STAT1/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のSTAT1リン酸化/β−アクチンの相対発現量を1.0とする。図4Aと図4Bの図面記号*は、健康対照群と比べて、p<0.05であることを示し、図面記号#は、糖尿病ラットと比べて、p<0.05であることを示す。
【0060】
図3、図4A、図4Bの結果からわかるように、ストレプトゾトシンを注射してから28日後、糖尿病ラットのJAK2(図3の上からの二列のレーン3−4)とSTAT1(図3の下からの二列のレーン3−4)のリン酸化の相対量は、いずれも健康対照群(図3のレーン1−2)より著しく高いことから、糖尿病ラットの腎臓皮質のJAK2とSTAT1は高度に活性化されている状態になることが示された。
【0061】
しかしながら、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、そのJAK2とSTAT1のリン酸化の相対量(図3のレーン5−6)が著しく低下して、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)(図3のレーン7−8)に近いことから、実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かにJAK2とSTAT1のリン酸化を特異的に抑制できることを示した。
【0062】
4.糖尿病ラットの腎臓皮質の細胞内タンパク質の発現に対するプロバイオティクス菌株GM−263(ADR−1)の影響の評価
図5は、本発明の他の実施例による糖尿病ラットの腎臓皮質組織を示すウェスタンブロッティング解析図であり、レーン1−2は健康対照群を示し、レーン3−4は糖尿病ラット群を示し、レーン5−6はラクトバチルス・ロイテリGM−263(ADR−1)を経口投与した糖尿病ラット群(糖尿病ラット+GM−263)を示し、レーン7−8はインシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)を示す。図5は、糖尿病ラットの腎臓皮質組織内のPAI−1(約50kDa)、P21Waf1/Cip1(約20kDa)、α−SMA(約42kDa)、フィブロネクチン(約200kDa)の発現量を分析するものである。また、β−アクチンは、前記タンパクの発現量を標準化するものである。
【0063】
図6Aは、β−アクチンの発現量によって標準化された図5のPAI−1発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたPAI−1の相対発現量(即ち、PAI−1/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のPAI−1/β−アクチンの相対発現量を1.0とする。
【0064】
図6Bは、β−アクチンの発現量によって標準化された図5のP21Waf1/Cip1発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたP21Waf1/Cip1の相対発現量(即ち、P21Waf1/Cip1/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のP21Waf1/Cip1/β−アクチンの相対発現量を1.0とする。
【0065】
図6Cは、β−アクチンの発現量によって標準化された図5のα−SMA発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたα−SMAの相対発現量(即ちα−SMA/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のα−SMA/β−アクチンの相対発現量を1.0とする。
【0066】
図6Dは、β−アクチンの発現量によって標準化された図5のフィブロネクチン発現量を示す棒グラフであり、縦軸はβ−アクチンの発現量によって標準化されたフィブロネクチンの相対発現量(即ち、フィブロネクチン/β−アクチンの相対発現量、任意単位)を示す。また、健康対照群のフィブロネクチン/β−アクチンの相対発現量を1.0とする。
【0067】
図5、図6A乃至図6Dの結果からわかるように、ストレプトゾトシンを注射してから28日後、糖尿病ラットのPAI−1(図5の上から一列目のレーン3−4)、P21Waf1/Cip1(図5の上から二列目のレーン3−4)、α−SMA(図5の上から三列目のレーン3−4)、フィブロネクチン(図5の最後の列のレーン3−4)のリン酸化の相対量は、健康対照群(図5のレーン1−2)より著しく高いことから、糖尿病ラットの腎臓皮質のPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンは高度に発現されている状態になり、糖尿病ラットの腎線維化を引き起こしたことを示した。
【0068】
しかし、ラクトバチルス・ロイテリGM−263(ADR−1)を経口投与された糖尿病ラット(糖尿病ラット+GM−263)は、そのPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンの相対量(図5のレーン5−6)が著しく低下し、それにP21Waf1/Cip1とα−SMAの低下程度が、インシュリンを投与した糖尿病ラット対照群(糖尿病ラット+インシュリン)(図5のレーン7−8)よりも低いことから、実施例1のプロバイオティクス菌株GM−263(ADR−1)を経口投与することによって、確かにPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチンの発現量を特異的に抑制できることを示した。
【0069】
以上をまとめていえば、本発明のプロバイオティクス菌株GM−263(ADR−1)(ラクトバチルスロイテリGM−263(ADR−1))(受託番号はCCTCC M 209263)は、糖尿病による腎線維化の治療に応用できることが証明されており、また、本発明は、乳酸菌の関与可能な制御機構、即ち、JAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(PAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン)の発現を抑制する制御機構を提示し、それによって、糖尿病による腎線維化を有効に治療でき、それに従い、プロバイオティクス菌株をその他に応用するよう開発する。
【0070】
ここで補充するのは、本発明は、特定の菌株、特定の分析方式、特定の動物モデル、特定の反応条件、特定の使用方法、特定の材料又は特定の設備等を例として、本発明の、糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の用途を説明するが、当業者が理解するように、本発明はこれらに限られず、本発明の精神と範囲から逸脱しない限り、本発明のプロバイオティクス菌株GM−263(ADR−1)がその他のプロバイオティクス菌株、その他の分析方式、その他の動物モデル、その他の反応条件、その他の使用方式、その他の同等レベルの材料又はその他の設備等によって行ってもよい。また、本発明のプロバイオティクス菌株GM−263(ADR−1)を、例えば医薬組成物、補助飲食品、食品又はその組成分などの、糖尿病による腎線維化を治療する組成物の製造に用いる場合、プロバイオティクス菌株GM−263(ADR−1)は、生菌又は不活化菌であってもよく、また、凍結乾燥の形であってもよい。なお、本発明のプロバイオティクス菌株GM−263(ADR−1)は、更にその他の成分を含んでもよく、例えばグルコース、マルトデキストリン、乳児用調製粉乳、フラクトオリゴ糖、ステアリン酸マグネシウム、ヨーグルト香料、その他の分離しにくい成分、又は前記の任意の組み合わせを更に含んでもよい。
【0071】
本発明の前記実施例から分かるように、本発明の、糖尿病による腎線維化の治療におけるプロバイオティクス菌株GM−263(ADR−1)の用途は、その利点がプロバイオティクス菌株GM−263(ADR−1)を用いて、糖化ヘモグロビンと血糖濃度を低下させ、体重と腎重を正常な範囲に回復させて、更に、JAK2/STAT1のシグナル伝導経路を特異的に抑制し、腎線維化に関するタンパク質(例えばPAI−1、P21Waf1/Cip1、α−SMA、フィブロネクチン等)の発現を抑制することによって、糖尿病による腎線維化を有効に治療し、それに従い、プロバイオティクス菌株GM−263(ADR−1)をその他に応用するよう開発する。
【0072】
本発明を複数の実施例によって以上のように開示したが、これは本発明を限定するものではなく、当業者であれば、本発明の精神及び範囲から逸脱しない限り、各種の変更及び修飾することができる。本発明は、特許請求の範囲の記載によって限定される。
【特許請求の範囲】
【請求項1】
プロバイオティクス菌株GM−263(ADR−1)を含み、前記プロバイオティクス菌株GM−263(ADR−1)がラクトバチルス・ロイテリ(Lactobacillus reuteri)GM−263(ADR−1)(受託番号はCCTCC M 209263)であり、前記プロバイオティクス菌株GM−263(ADR−1)の含有量が糖尿病による腎線維化を有効に治療する量である、糖尿病による腎線維化の治療用組成物。
【請求項2】
前記プロバイオティクス菌株GM−263(ADR−1)が、生菌又は不活化菌である請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項3】
前記プロバイオティクス菌株GM−263(ADR−1)が、ヤヌスキナーゼ2(Janus kinase 2;JAK2)とシグナル伝達性転写因子1(signal transducer and activator of transcription 1;STAT1)のリン酸化を特異的に抑制することに用いられる請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項4】
前記プロバイオティクス菌株GM−263(ADR−1)が、プラスミノーゲンアクチベーターインヒビタ−1(plasminogen activator inhibitor;PAI−1)、サイクリン依存性キナーゼ阻害因子(cyclin−dependent kinase inhibitor;CDKI)P21Waf1/Cip1、平滑筋α−アクチン(smooth muscle α−actin;α−SMA)又はフィブロネクチン(fibronectin)のタンパク質発現を特異的に抑制することに用いられる請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項5】
前記組成物が、医薬組成物、補助飲食品、食品又はその組成分である請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項6】
更に少なくとも一つの他の菌株を含み、前記その他の菌株が、アシドフィルス菌(Lactobacillus acidophilus)、ラクトバチルス・プランタルム(Lactobacillus plantarum)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、発酵乳酸桿菌(Lactobacillus fermentum)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)、サーモフィルス菌(Streptococcus thermophilus)、ラクトバチルス・クレモリス(Lactobacillus cremoris)、ラクトバチルス・パラカゼイ・サブスピーシーズ・パラカゼイ(Lactobacillus paracasei subsp. paracasei)、ラクトバチルス・ラムノーサス・GG(Lactobacillus rhamnosus GG)及び前記の任意の組み合わせからなる群より選ばれた請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項7】
プロバイオティクス菌株GM−263(ADR−1)が、ラクトバチルス・ロイテリGM−263(ADR−1)(受託番号はCCTCC M 209263)であり、JAK2とSTAT1のリン酸化を特異的に抑制するプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項8】
前記プロバイオティクス菌株GM−263(ADR−1)が、PAI−1、P21Waf1/Cip1、α−SMA又はフィブロネクチンのタンパク質発現を特異的に抑制することに用いられる請求項7に記載のプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項9】
前記プロバイオティクス菌株GM−263(ADR−1)が生菌又は不活化菌である請求項7に記載のプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項10】
前記プロバイオティクス菌株GM−263(ADR−1)が、少なくとも一つの他の菌株と混合され、前記少なくとも一つの他の菌株が、アシドフィルス菌(Lactobacillus acidophilus)、ラクトバチルス・プランタルム(Lactobacillus plantarum)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、発酵乳酸桿菌(Lactobacillus fermentum)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)、サーモフィルス菌(Streptococcus thermophilus)、ラクトバチルス・クレモリス(Lactobacillus cremoris)、ラクトバチルス・パラカゼイ・サブスピーシーズ・パラカゼイ(Lactobacillus paracasei subsp. paracasei)、ラクトバチルス・ラムノーサス・GG(Lactobacillus rhamnosus GG)及び前記の任意の組み合わせからなる群より選ばれた請求項7に記載のプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項1】
プロバイオティクス菌株GM−263(ADR−1)を含み、前記プロバイオティクス菌株GM−263(ADR−1)がラクトバチルス・ロイテリ(Lactobacillus reuteri)GM−263(ADR−1)(受託番号はCCTCC M 209263)であり、前記プロバイオティクス菌株GM−263(ADR−1)の含有量が糖尿病による腎線維化を有効に治療する量である、糖尿病による腎線維化の治療用組成物。
【請求項2】
前記プロバイオティクス菌株GM−263(ADR−1)が、生菌又は不活化菌である請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項3】
前記プロバイオティクス菌株GM−263(ADR−1)が、ヤヌスキナーゼ2(Janus kinase 2;JAK2)とシグナル伝達性転写因子1(signal transducer and activator of transcription 1;STAT1)のリン酸化を特異的に抑制することに用いられる請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項4】
前記プロバイオティクス菌株GM−263(ADR−1)が、プラスミノーゲンアクチベーターインヒビタ−1(plasminogen activator inhibitor;PAI−1)、サイクリン依存性キナーゼ阻害因子(cyclin−dependent kinase inhibitor;CDKI)P21Waf1/Cip1、平滑筋α−アクチン(smooth muscle α−actin;α−SMA)又はフィブロネクチン(fibronectin)のタンパク質発現を特異的に抑制することに用いられる請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項5】
前記組成物が、医薬組成物、補助飲食品、食品又はその組成分である請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項6】
更に少なくとも一つの他の菌株を含み、前記その他の菌株が、アシドフィルス菌(Lactobacillus acidophilus)、ラクトバチルス・プランタルム(Lactobacillus plantarum)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、発酵乳酸桿菌(Lactobacillus fermentum)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)、サーモフィルス菌(Streptococcus thermophilus)、ラクトバチルス・クレモリス(Lactobacillus cremoris)、ラクトバチルス・パラカゼイ・サブスピーシーズ・パラカゼイ(Lactobacillus paracasei subsp. paracasei)、ラクトバチルス・ラムノーサス・GG(Lactobacillus rhamnosus GG)及び前記の任意の組み合わせからなる群より選ばれた請求項1に記載の糖尿病による腎線維化の治療用組成物。
【請求項7】
プロバイオティクス菌株GM−263(ADR−1)が、ラクトバチルス・ロイテリGM−263(ADR−1)(受託番号はCCTCC M 209263)であり、JAK2とSTAT1のリン酸化を特異的に抑制するプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項8】
前記プロバイオティクス菌株GM−263(ADR−1)が、PAI−1、P21Waf1/Cip1、α−SMA又はフィブロネクチンのタンパク質発現を特異的に抑制することに用いられる請求項7に記載のプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項9】
前記プロバイオティクス菌株GM−263(ADR−1)が生菌又は不活化菌である請求項7に記載のプロバイオティクス菌株GM−263(ADR−1)の用途。
【請求項10】
前記プロバイオティクス菌株GM−263(ADR−1)が、少なくとも一つの他の菌株と混合され、前記少なくとも一つの他の菌株が、アシドフィルス菌(Lactobacillus acidophilus)、ラクトバチルス・プランタルム(Lactobacillus plantarum)、ビフィドバクテリウム・ロンガム(Bifidobacterium longum)、発酵乳酸桿菌(Lactobacillus fermentum)、ラクトバチルス・ブルガリカス(Lactobacillus bulgaricus)、サーモフィルス菌(Streptococcus thermophilus)、ラクトバチルス・クレモリス(Lactobacillus cremoris)、ラクトバチルス・パラカゼイ・サブスピーシーズ・パラカゼイ(Lactobacillus paracasei subsp. paracasei)、ラクトバチルス・ラムノーサス・GG(Lactobacillus rhamnosus GG)及び前記の任意の組み合わせからなる群より選ばれた請求項7に記載のプロバイオティクス菌株GM−263(ADR−1)の用途。
【図1】


【図2】


【図4】


【図6】


【図3】


【図5】




【図2】


【図4】


【図6】


【図3】


【図5】


【公開番号】特開2012−149026(P2012−149026A)
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願番号】特願2011−19444(P2011−19444)
【出願日】平成23年2月1日(2011.2.1)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔掲載アドレス〕 http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6VSD−50PJJDJ−1&_user=10&_coverDate=12%2F31%2F2010&_rdoc=15&_fmt=high&_orig=browse&_origin=browse&_zone=rslt_list_item&_srch=doc−info(%23toc%236260%232010%23998899993%232650735%23FLA%23display%23Volume)&_cdi=6260&_sort=d&_docanchor=&_ct=18&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=ba233347b3d7cabad23451f558ea38f9&searchtype=a 〔掲載日〕 平成22年8月5日
【出願人】(511028375)景岳生物科技股▲ふん▼有限公司 (2)
【Fターム(参考)】
【公開日】平成24年8月9日(2012.8.9)
【国際特許分類】
【出願日】平成23年2月1日(2011.2.1)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 〔掲載アドレス〕 http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6VSD−50PJJDJ−1&_user=10&_coverDate=12%2F31%2F2010&_rdoc=15&_fmt=high&_orig=browse&_origin=browse&_zone=rslt_list_item&_srch=doc−info(%23toc%236260%232010%23998899993%232650735%23FLA%23display%23Volume)&_cdi=6260&_sort=d&_docanchor=&_ct=18&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=ba233347b3d7cabad23451f558ea38f9&searchtype=a 〔掲載日〕 平成22年8月5日
【出願人】(511028375)景岳生物科技股▲ふん▼有限公司 (2)
【Fターム(参考)】
[ Back to top ]

