汚れ判定方法
【課題】屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供する。
【解決手段】屋内の汚れがカビか否かを現場で判定する方法であって、汚れからサンプルを採取するサンプル採取ステップと、サンプル中の補酵素の存在量を定量する定量ステップと、補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップとを含む方法。
【解決手段】屋内の汚れがカビか否かを現場で判定する方法であって、汚れからサンプルを採取するサンプル採取ステップと、サンプル中の補酵素の存在量を定量する定量ステップと、補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップとを含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、建築物の屋内の汚れ判定方法に関する。より詳細には、屋内の汚れがカビか否かを現場で判定する方法に関する。
【背景技術】
【0002】
建築物の屋内の汚れが微生物、特にカビであった場合、直ちに対策を施さなければ汚染が拡大し、除去が困難になる場合がある。また、汚れが微生物を原因とするものであるか否かにより、汚れを除去する対策が異なる。このため、汚れが微生物によるものか否かを判定する必要がある。
【0003】
一般的に、検査対象から採取したサンプル中の微生物について調査する場合、サンプルを培地に接種し、数日間の培養が行われる。例えば、特許文献1には、耐熱性を有するメンブレンフィルターを介して空気を吸引することにより空気中に浮遊する微生物を該メンブレンフィルター上に捕捉し、該メンブレンフィルター上に捕捉した微生物を培地上で培養した後、培養された微生物中のATPをバイオルミネッセンス反応により検出する微生物の迅速測定方法が開示されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−161143号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、サンプルを培地に接種して培養する工程は、最低5日間程度の日数を要する。このため、サンプルを採取してから判定結果が出るまで最短でも1週間程度必要である。このため、従来の方法で建築物の屋内の汚れがカビか否かを判定した場合、判定に時間がかかり、汚れがカビによるものであった場合には対応が遅れ、汚れの除去が困難になる場合があった。
【0006】
また、培養において、培地の選択が適切でなかった場合には、サンプル中に微生物が存在していたにもかかわらずコロニーとして検出することができず、本来検出されるべき微生物が検出されず、誤判定してしまう場合があった。
【0007】
そこで本発明は、屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明は、屋内の汚れがカビか否かを現場で判定する方法であって、汚れからサンプルを採取するサンプル採取ステップと、サンプル中の補酵素の存在量を定量する定量ステップと、補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップとを含む方法を提供する。
【0009】
上記本発明の方法によれば、屋内の汚れがカビか否かの判定を、現場において短時間で行うことができる。このため、汚れの除去に適切な対策をその場で判断することができる。また、本発明の方法は、微生物を培養する工程を含まないため、培地の選択が不適切であることにより誤判定することがなく、正しい判定結果を得ることができる。
【0010】
上記補酵素は、ニコチンアミドアデニンジヌクレオチド(NAD)、ニコチンアミドアデニンジヌクレオチドリン酸(NADP)、還元型ニコチンアミドアデニンジヌクレオチド(NADH)及び還元型ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)からなる群より選択される1種以上の化合物であることが好ましい。また、上記判定ステップにおいて、上記選択された化合物の合計の単位面積当たりの存在量が、所定値A1未満の場合には、汚れはカビではないと判定し、所定値A2以上の場合には、汚れはカビであると判定し、所定値A1以上A2未満の場合には、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定することが好ましい。
【0011】
補酵素として、NAD、NADP、NADH又はNADPHを測定対象とすることにより、迅速に定量することができる。また、上記判定ステップにおいて、上記選択された化合物の合計の単位面積当たりの存在量に基づいて判定することにより、汚れがカビか否かを迅速に判定することができる。さらに、NAD、NADP、NADH又はNADPHの存在量に基づいて、汚れがカビであるか否かを判定することが困難な場合であっても、顕微鏡観察を行うことにより、現場でカビか否かを判定することができる。
【0012】
上記補酵素は、アデノシン三リン酸(ATP)であってもよい。また、上記判定ステップにおいて、ATPの単位面積当たりの存在量が、所定値B1未満の場合には、汚れはカビではないと判定し、所定値B2以上の場合には、汚れはカビであると判定し、所定値B1以上B2未満の場合には、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定することが好ましい。
【0013】
補酵素としてATPを測定対象とすることにより、迅速に定量することができる。また、上記判定ステップにおいて、ATPの単位面積当たりの存在量に応じて汚れがカビであるか否かを判定することにより、汚れがカビか否かを迅速に判定することができる。さらに、ATPの存在量に基づいて、汚れがカビであるか判定することが困難な場合であっても、顕微鏡観察を行うことにより、現場でカビか否かを判定することができる。
【発明の効果】
【0014】
本発明により、屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供することができる。
【図面の簡単な説明】
【0015】
【図1】テンプレートの一実施形態を示す概略図である。
【図2】テンプレート貼付用伸縮ポールの一実施形態を示す概略図である。
【図3】サンプル採取用伸縮ポールの一実施形態を示す概略図である。
【図4】試験紙の一実施形態を示す概略図である。
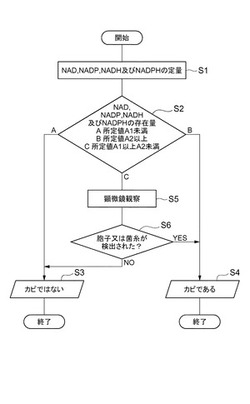
【図5】NAD法の一実施形態を示すフローチャートである。
【図6】ATP法の一実施形態を示すフローチャートである。
【図7】実験例2の結果を示すグラフである。A:ルシパックII、B:ルシフェール250プラス、C:ルシフェール250プラス及びルシフェールATP消去試薬セット、D:ルシフェールHSセットからATP消去試薬を省いたもの、E:ルシフェールHSセット。
【図8】実験例3の結果を示すグラフである。
【図9】実験例6の結果を示すグラフである。
【発明を実施するための形態】
【0016】
以下、場合により図面を参照しながら、好適な実施形態を説明する。なお、図面の説明において同一要素には同一符号を付し、重複する説明を省略する。また、図面は理解を容易にするため一部を誇張して描いており、寸法比率は説明のものとは必ずしも一致しない。
【0017】
屋内の汚れがカビか否かを現場で判定する方法は、汚れからサンプルを採取するサンプル採取ステップと、サンプル中の補酵素を定量する定量ステップと、補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップとを含む。
【0018】
まず、サンプル採取ステップについて説明する。一実施形態において、屋内の壁、天井、床等の汚れからサンプルを採取する。サンプルは一定の面積から採取することが好ましい。これにより、後述する定量ステップで得られる補酵素の存在量を、単位面積当たりの値として基準値と比較することが容易になる。
【0019】
一定の面積からサンプルを採取するためには、ふきとり検査枠又はテンプレートと呼ばれるサンプル回収用の枠を使用することが好ましい。テンプレートとは、中央部が切り取られた紙製の枠であり、検査対象表面に押し付けてサンプル採取範囲を特定し、枠で特定された領域からサンプルを採取するものであり、一般に市販されている。市販のテンプレートは100cm2の開口部を有しており、これを検査対象の表面に押しつけながらサンプル採取範囲を特定し、特定された領域内を脱脂綿等で拭き取ることにより、サンプルを採取することが一般的である。しかしながら、発明者らが検討した結果、通常の100cm2のテンプレートでは、本実施形態の判定方法には広すぎることが明らかとなった。後述する判定ステップにおける判断を、より正確に行うためには、テンプレートの開口部は1〜25cm2であることが好ましく、1〜9cm2であることがより好ましく、4cm2が特に好ましい。
【0020】
図1はテンプレートの一実施形態を示す概略図である。図1に示すように、テンプレート100は、サンプル採取範囲を特定する開口部20、テンプレート回収のための穴30を備えており、折り目40に沿って折り曲げられている。穴30の周囲は補強されている。穴30は、サンプル採取後に、検査対象表面からテンプレートを回収するときに用いる。手の届かない場所にテンプレートを貼付した場合であっても、例えば、伸縮ポールの先端に取りつけたフックを穴30に引っかけて引きはがすことにより、テンプレートを測定対象の表面から回収することが容易になる。テンプレート100の面10は全面が粘着層である。開口部20は、1〜25cm2の面積を有する。
【0021】
市販のテンプレートは粘着層を有していないため、片手で押さえつけながらサンプルを採取する必要がある。このため、手の届く範囲でしかサンプルの採取ができなかった。また、天井面等の手の届かないところでは脚立などの使用が必要であった。これに対し、上記実施形態のテンプレートを使用することにより、テンプレートを片手で押さえつける必要がなくなるため、手の届かない場所からもサンプル採取を行うことが容易となる。手の届かない場所でサンプル採取を行うために、以下に説明する伸縮ポール等を用いてテンプレートを検査対象表面に貼付することができる。
【0022】
図2は、テンプレート貼付用伸縮ポールの一実施形態を示す概略図である。テンプレート貼付用伸縮ポール200は、伸縮ポール210、伸縮ポール210の先端に固定バンド215により固定された治具220を備えている。治具220の面230にテンプレートをセットし、これを検査対象の表面に押しつけてテンプレートを貼付する。これにより、手の届かない場所であっても容易にテンプレートを貼付することができる。
【0023】
一実施形態において、サンプル採取には、滅菌された綿棒を用いることができる。サンプルを効率よく採取するために、サンプル採取時には、綿棒を滅菌水で湿らせることが好ましい。滅菌水の代わりにリン酸緩衝食塩水などの滅菌された適切な液体を用いてもよい。正確な判定を行うために、綿棒を用いてテンプレートで特定された範囲をまんべんなくなぞり、検査対象表面のサンプルを採取する。手の届かない範囲からサンプルを採取する場合には、伸縮ポールの先端に綿棒を取り付けた、サンプル採取用伸縮ポールを使用する。図3は、サンプル採取用伸縮ポールの一実施形態を示す概略図である。サンプル採取用伸縮ポール300は、伸縮ポール210、伸縮ポール210の先端に固定バンド215により固定された治具310を備えている。治具310に綿棒320を接続し、テンプレートで特定された範囲からサンプルを採取する。
【0024】
一実施形態において、サンプル採取パッドを用いてサンプルを採取することができる。図4は、サンプル採取パッドを備える試験紙の一実施形態を示す概略図である。試験紙400は、支持体410の表面に接着されたサンプル採取パッド420を備える。サンプル採取パッド420の面430は、1〜5cm2の面積を有する。検査対象の表面に、サンプル採取パッド420を一定の回数押しつけることによりサンプルを採取する。サンプル採取パッド420は、サンプル採取位置が重ならないように、毎回異なる位置に押しつけることが好ましい。これにより、テンプレートを使用しなくても一定の面積からサンプルを採取することができる。サンプルを効率よく採取するために、サンプル採取時には、サンプル採取パッド420を滅菌水で湿らせることが好ましい。滅菌水の代わりにリン酸緩衝食塩水などの滅菌された適切な液体を用いてもよい。例えば、1.68cm2の面積を有するサンプル採取パッドを使用する場合、サンプル採取のために検査対象表面に押しつける回数は、1〜30回であることが好ましく、5〜20回であることがより好ましい。
【0025】
次に、定量ステップについて説明する。定量ステップにおいて、上記のサンプル採取ステップで採取したサンプル中の補酵素の存在量を定量する。
【0026】
一実施形態において、補酵素は、NAD、NADP、NADH及びNADPHからなる群より選択される1種以上の化合物である。以下、補酵素がNAD、NADP、NADH又はNADPHである判定方法を「NAD法」という場合がある。
【0027】
NAD又はNADPに、β−D−グルコース及びグルコース−1−デヒドロゲナーゼを反応させると、D−グルコノラクトン、NADH及びNADPHが生成される。続いて、上記の反応により生成されたNADH及びNADPH、並びにサンプル中に存在していたNADH及びNADPHに、テトラゾリウム塩及びジアフォラーゼを作用させると、テトラゾリウム塩がホルマザン塩に変換される。このホルマザン塩の発色に基づいて、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量を定量することができる。したがって、本実施形態において、サンプルに、β−D−グルコース、グルコース−1−デヒドロゲナーゼ、テトラゾリウム塩及びジアフォラーゼを反応させることにより、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量に対応したホルマザン塩の発色が得られる。なお、この場合において、グルコース−1−デヒドロゲナーゼは、NADとNADPとの双方を基質とするものである。また、ジアフォラーゼは、NADHとNADPHの双方を基質とするものである。
【0028】
本実施形態において、サンプルは、上記のサンプル採取パッドを用いて採取する。続いて、サンプルを採取したパッドにβ−D−グルコース、グルコース−1−デヒドロゲナーゼ、テトラゾリウム塩及びジアフォラーゼの溶液を滴下することにより、上記の反応を行い、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量に応じたホルマザン塩の発色を得、発色強度に基づいてNAD、NADP、NADH及びNADPHの合計の存在量を定量する。サンプル中にNAD、NADP、NADH又はNADPHが存在しない場合にはホルマザン塩の発色は得られない。定量は色差計を用いて行ってもよいが、予め段階希釈した既知濃度のNAD、NADP、NADH又はNADPHを用いて上記の反応により発色させて検量線を得ておき、目視によって定量することもできる。本実施形態によるNAD、NADP、NADH及びNADPHの合計の存在量の定量は、現場で簡便に短時間で行うことができる。
【0029】
上記実施形態において、グルコース−1−デヒドロゲナーゼは、NADのみを基質とするものであってもよい。また、ジアフォラーゼは、NADHのみを基質とするものであってもよい。この場合、補酵素として、サンプル中のNAD及びNADHの合計の存在量が定量される。
【0030】
また、上記実施形態において、グルコース−1−デヒドロゲナーゼは、NADPのみを基質とするものであってもよい。また、ジアフォラーゼは、NADPHのみを基質とするものであってもよい。この場合、補酵素として、サンプル中のNADP及びNADPHの合計の存在量が定量される。
【0031】
上記のNAD、NADP、NADH及びNADPHの合計の存在量の定量は、例えば、HY−RiSE(商品名、メルク社)を用いて実施することができる。
【0032】
一実施形態において、補酵素はATPである。以下、補酵素がATPである判定方法を「ATP法」という場合がある。発光基質であるルシフェリンは、ATP及びマグネシウムイオンの存在下で、ルシフェラーゼによってオキシルシフェリンに変換されて発光する。この発光量はATP量に比例する。
【0033】
本実施形態において、サンプルは、上記のテンプレート及び滅菌された綿棒を用いて採取する。続いて、サンプルを採取した綿棒を、ルシフェリン、マグネシウムイオン及びルシフェラーゼを含む反応液に浸して撹拌する。この結果、サンプル中のATPの存在量に応じた発光が得られる。サンプル中にATPが存在しない場合には発光は得られない。発光量はルミノメーターを用いて測定することができる。ルミノメーターは現場に持ち込み可能なものであり、小型のポータブルタイプのものが好ましく、例えばルミテスターC−110(商品名、キッコーマン株式会社)が好適に用いられる。予め段階希釈した既知濃度のATPを用いて上記の反応を行い発光させて、検量線を得ておくことが好ましい。検量線を用いて、発光量からサンプル中のATPの存在量を求めることができる。本実施形態によるATPの定量は、現場で簡便に短時間で行うことができる。
【0034】
上記のATPの定量は、例えば、ATP定量用キットである、ルシパックII(商品名、キッコーマン株式会社)を用いて実施することができる。
【0035】
NADやATPは、微生物の代謝物である。したがって、上記実施形態によりサンプルからNADやATPが検出された場合、検査対象表面に微生物が存在していると判断することができる。この微生物はカビに限られない。しかしながら、屋内において、カビ以外の微生物が大量に発生して汚れを形成することは非常に稀である。そのため、ほとんどの場合において、上記実施形態によりサンプルからNADやATPが検出された場合、検査対象表面にカビが存在していると判断することができる。
【0036】
次に、判定ステップについて説明する。判定ステップでは、上記定量ステップで定量したサンプル中の補酵素の存在量に基づいて、屋内の汚れがカビか否かを現場で判定する。
【0037】
NAD法の場合、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量が、検査対象表面の単位面積当たり、所定値A1未満の場合には、汚れはカビではないと判定し、所定値A2以上の場合には、汚れはカビであると判定する。一方、所定値A1以上A2未満の場合には、確定的に判定することが困難な場合がある。このため、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定する。顕微鏡は現場に持ち込み可能な、小型のポータブルタイプのものであることが好ましい。顕微鏡で観察した結果、胞子や菌糸の存在が認められた場合には、カビであると判定できる。
【0038】
一実施形態において、所定値A1、A2は次の通りである。NAD定量キットとして、HY−RiSE(商品名、メルク社)を使用し、検査対象表面に20回押しつけることによりサンプルを回収して発色させた場合、発色量を目視で判定し、発色の度合いに応じて次のように0〜3段階に分類する。ほとんど発色が見られないものを第0段階と分類する。周辺部が薄い紫色であり、わずかに変色しているものを第1段階と分類する。中央部が黒ずんだ紫色に変色し、周辺部も紫色に変色しているものを第2段階と分類する。中央部がはっきりとした濃い紫色に変色し、周辺も紫色に変色しているものを第3段階と分類する。数値として表現する場合には、第0段階を0、第1段階を1、第2段階を2、第3段階を3と表現する。本実施形態において、所定値A1は1(第1段階)であり、所定値A2は3(第3段階)である。
【0039】
ATP法の場合、サンプル中のATPの存在量が、検査対象表面の単位面積当たり、所定値B1未満の場合には、汚れはカビではないと判定し、所定値B2以上の場合には、汚れはカビであると判定する。一方、サンプル中のATPの存在量が、所定値B1以上B2未満の場合には、確定的に判定することが困難な場合がある。このため、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定する。顕微鏡で観察した結果、胞子や菌糸の存在が認められた場合には、カビであると判定できる。
【0040】
一実施形態において、所定値B1、B2は次の通りである。後述する実験例1の通りに校正された、ルミテスターC−110(商品名、キッコーマン株式会社)を使用する。検査対象表面4cm2から回収したサンプルを、ATP定量キットであるルシパックII(商品名、キッコーマン株式会社)を使用して発光させ、ルミテスターC−110(商品名、キッコーマン株式会社)で発光量を測定する。本実施形態において、所定値B1は100であり、所定値B2は10000である。
【0041】
顕微鏡としては、例えば小型の倒立型顕微鏡(DSM−1型、ダイコーサイエンス株式会社)を使用できる。顕微鏡の接眼レンズの代わりに、パソコンに接続されたデジタルカメラシステムを接続し、顕微鏡画像をノートパソコンのディスプレイ等の携帯型のモニタ上に表示させることが好ましい。デジタルカメラシステムとしては、例えばMoticam2000(商品名、株式会社島津理化)が使用できる。これにより、複数の人間で顕微鏡画像を確認することができる。顕微鏡の倍率は20〜1200倍が好ましい。
【0042】
顕微鏡でサンプルを観察する場合、NAD法又はATP法で使用したサンプルの一部をスライドガラスに滴下して観察してもよく、検査対象表面から新たに顕微鏡観察用のサンプルを採取してもよい。新たにサンプル採取する場合、検査対象表面が剥離しにくい素材である場合には、検査対象表面にセロハンテープを貼付及び剥離することによりセロハンテープの粘着面にサンプルを付着させてもよい。この場合、サンプルが付着したセロハンテープをスライドガラスに貼付して顕微鏡観察することができる。また、検査対象表面が剥離しやすい素材からなり、セロハンテープでサンプル採取すると表面を破損してしまう恐れがある場合には、滅菌水等で湿らせた綿棒で検査対象表面をなぞってサンプル採取し、スライドガラス上に塗布して顕微鏡観察することができる。
【0043】
上記の定量ステップにおいて、サンプル中にNADやATP等の補酵素の存在が検出された場合には、サンプル中に生きたカビが存在すると判断できる。一方、顕微鏡による観察では、観察された胞子や菌糸の形態から、カビの生死の判断も可能である。
【0044】
本方法により検出可能なカビとしては、例えば、アスペルギルス属、アルテルナリア属、ケトミウム属、クラドスポリウム属、ユーロチウム属、ペニシリウム属、フサリウム属、リゾプス属、トリコデルマ属に属するものが例示できる。
【0045】
図5は、NAD法の一実施形態を示すフローチャートである。本実施形態において、まず、検査対象表面からサンプルを採取し、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量を定量する(ステップS1)。定量した結果、NAD、NADP、NADH及びNADPHの合計の存在量が、検査対象表面の単位面積当たり所定値A1未満の場合には(ステップS2のA)、汚れはカビではないと判定し(ステップS3)、所定値A2以上の場合には(ステップS2のB)、汚れはカビであると判定する(ステップS4)。一方、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量が、検査対象表面の単位面積当たり所定値A1以上A2未満の場合には(ステップS2のC)、顕微鏡観察を行う(ステップS5)。顕微鏡観察の結果、サンプル中に胞子や菌糸の存在が確認された場合には(ステップS6のYES)、汚れはカビであると判定し(ステップS4)、胞子や菌糸の存在が確認されなかった場合には(ステップS6のNO)、汚れはカビではないと判定する(ステップS3)。
【0046】
図6は、ATP法の一実施形態を示すフローチャートである。本実施形態において、検査対象表面からサンプルを採取し、サンプル中のATPの存在量を定量する(ステップS1)。定量した結果、ATPの存在量が、検査対象表面の単位面積当たり所定値B1未満の場合には(ステップS2のA)、汚れはカビではないと判定し(ステップS3)、所定値B2以上の場合には(ステップS2のB)、汚れはカビであると判定する(ステップS4)。一方、サンプル中のATPの存在量が、検査対象表面の単位面積当たり所定値B1以上B2未満の場合には(ステップS2のC)、顕微鏡観察を行う(ステップS5)。顕微鏡観察の結果、サンプル中に胞子や菌糸の存在が確認された場合には(ステップS6のYES)、汚れはカビであると判定し(ステップS4)、胞子や菌糸の存在が確認されなかった場合には(ステップS6のNO)、汚れはカビではないと判定する(ステップS3)。
【実施例】
【0047】
以下、本発明の実施例を示して、本発明を更に具体的に説明するが、本発明はこれらの実施例に限定されるものではなく、本発明の技術的思想を逸脱しない範囲での種々の変更が可能である。
【0048】
(実験例1)
(検量線の作成)
ルミテスターC−110(商品名、キッコーマン株式会社)を用いて、ATPの発光量の検量線を作成した。まず、ATPの濃度が、0、2×10−12、2×10−11、2×10−10、2×10−9、2×10−8、2×10−7(M)である標準溶液を調製した。続いて、ATP定量キットであるルシフェール250プラス(商品名、キッコーマン株式会社)を用いて、取扱説明書にしたがってこれらの標準溶液を発光させた。続いて、ルミテスターC−110(商品名、キッコーマン株式会社)を用いて各溶液の発光量(相対値)を測定した。測定結果を表1に示す。
【0049】
【表1】

【0050】
(実験例2)
(サンプル中のATPに基づいた発光量の測定)
複数の市販のATP定量用キットを使用して、既知濃度に懸濁したアスペルギルス・ニガーの胞子をサンプルに用い、サンプル中のATPに基づいた発光量を測定した。まず、アスペルギルス・ニガーの胞子を滅菌水で懸濁し、1×104〜1×107個/mlの範囲内で数段階に段階希釈した溶液を調製し、カビのサンプルとした。
【0051】
続いて、複数のATP定量用キットを使用して、各サンプル中のATPの存在量に応じた発光を得、発光量を測定した。キットには、ルシパックII、ルシフェール250プラス、ルシフェール250プラス及びルシフェールATP消去試薬セット、ルシフェールHSセットからATP消去試薬を省いたもの、ルシフェールHSセット(いずれも商品名、キッコーマン株式会社)を使用し、操作は取扱説明書にしたがって行った。実験例1で使用したルミテスターC−110(商品名、キッコーマン株式会社)を用いて発光量を測定した。
【0052】
図7は、ATPの存在量に基づいた発光量をプロットしたグラフである。発光量として、ルミテスターC−110(商品名、キッコーマン株式会社)で測定された値を使用した。グラフ中A〜Eは、それぞれ次のキットを用いた結果である。A:ルシパックII、B:ルシフェール250プラス、C:ルシフェール250プラス及びルシフェールATP消去試薬セット、D:ルシフェールHSセットからATP消去試薬を省いたもの、E:ルシフェールHSセット。
【0053】
(実験例3)
(サンプル中のNADに基づいた発色)
市販のNAD定量用キットを使用して、既知濃度に懸濁したアスペルギルス・ニガーの胞子をサンプルに用い、サンプル中のNADの存在量に基づいたホルマザン塩の発色を得た。まず、アスペルギルス・ニガーの胞子を滅菌水で懸濁し、1×104個/mlから1×107個/mlの濃度となるように段階希釈して、カビのサンプルとした。
【0054】
続いて、NAD定量用キットを使用して、各サンプル中のNADの存在量に応じた発色を得た。NAD定量キットとして、HY−RiSE(商品名、メルク社)を使用した。発色量を目視で判定し、発色の度合いに応じて次のように0〜3段階に分類した。ほとんど発色が見られないものを第0段階と分類した。周辺部が薄い紫色であり、わずかに変色しているものを第1段階と分類した。中央部が黒ずんだ紫色に変色し、周辺部も紫色に変色しているものを第2段階と分類した。中央部がはっきりとした濃い紫色に変色し、周辺も紫色に変色しているものを第3段階と分類した。
【0055】
図8は、各サンプル中のNADの存在量に基づいた発色量をプロットしたグラフである。発色量は、発色の度合いに応じた分類で、第0段階のものを0、第1段階のものを1、第2段階のものを2、第3段階のものを3と表記した。
【0056】
(実験例4)
(ATP法による判定)
まず、屋内の汚れからサンプルを採取した。2×2cmの開口部を有するテンプレートを壁面に貼付した。テンプレートとして、全面粘着型付せん(商品名SSZ−33RY、住友スリーエム株式会社)の一部を2×2cmサイズに切り抜いたものを使用した。続いて、ATP定量キットであるルシパックII(商品名、キッコーマン株式会社)の綿棒を滅菌水で濡らし、この綿棒を用いてテンプレートで特定された領域をまんべんなくなぞり、サンプルを採取した。
【0057】
続いて、サンプルが付着した綿棒をルシパックIIの本体に戻し、取扱説明書にしたがって本体を数回振り下ろし、ルシパックIIの試薬を測定チューブに落とした。次に、溶け残った試薬をよく振り混ぜて溶解し、測定チューブを本体から取り外し、実験例1で使用したルミテスターC−110(商品名、キッコーマン株式会社)を用いて発光量を測定した。上記のATPの存在量の定量を、様々な屋内の汚れについて行った。
【0058】
(顕微鏡観察による判定)
ATP法で測定した検査対象表面とほぼ同一の領域からサンプルを採取し、顕微鏡で観察した。まず、2×2cmの開口部を有するテンプレートを壁面に貼付した。テンプレートとして、全面粘着型付せん(商品名SSZ−33RY、住友スリーエム株式会社)の一部を2×2cmサイズに切り抜いたものを使用した。続いて、滅菌し、リン酸緩衝食塩水で湿らせた綿棒を用いて、テンプレートで特定された領域をまんべんなくなぞり、サンプルを採取した。綿棒として、ふきふきチェックII(商品名、栄研化学株式会社)を使用した。続いて、サンプルが付着した綿棒をスライドガラス上に塗りつけ、顕微鏡で観察した。顕微鏡としては、小型倒立型顕微鏡(DSM−1型、ダイコーサイエンス株式会社)に、デジタルカメラシステム(Moticam2000、商品名、株式会社島津理化)を接続したものを使用した。顕微鏡画像をノートパソコンのディスプレイ上に表示させた。胞子や菌糸が認められた場合には屋内の汚れはカビであると判定した。
【0059】
検査対象表面において、ルミテスターC−110(商品名、キッコーマン株式会社)で測定した場合の発光量の計測値が、100未満のサンプルにおいては、顕微鏡観察しても胞子や菌糸の存在が確認されなかった。また、発光量の計測値が10000以上のサンプルにおいては、顕微鏡観察によっても胞子や菌糸の存在が確認された。一方、発光量の計測値が100以上10000未満のサンプルにおいては、胞子や菌糸の存在が認められる場合と認められない場合があった。表2に、ATPの存在量に基づいた発光量の計測値及び顕微鏡観察による判定の結果を示す。表中の数値は、該当したサンプル数を意味する。
【0060】
【表2】

【0061】
上記のATP法による判定及び顕微鏡観察による判定は、検査対象の汚れが存在する現場において短時間で行うことができた。
【0062】
(実験例5)
(NAD法による判定)
NAD定量キットとして、HY−RiSE(商品名、メルク社)を使用した。取扱説明書にしたがって、HY−RiSEの試験紙のパッド部分を湿潤液で湿らせ、検査対象である屋内の汚れに20回押しつけてサンプルを採取した。パッド部分の面積は1.68cm2であった。続いて、サンプルが付着したパッド部分に基質液及び酵素液を滴下し、30分間暗所で放置した。続いて、ホルマザン塩の発色量に基づいて、実験例3と同様に、目視によりサンプル中のNAD、NADP、NADH及びNADPHの合計の存在量を0〜3段階に分類することにより定量した。上記の定量を、様々な屋内の汚れについて行った。
【0063】
(顕微鏡観察による判定)
実験例3と同様にして、NAD法で測定した検査対象表面とほぼ同一の領域からサンプルを採取し、顕微鏡で観察した。胞子や菌糸が認められた場合には屋内の汚れはカビであると判定した。検査対象表面において、NAD、NADP、NADH及びNADPHの合計の存在量が、第1段階未満のサンプルにおいては、顕微鏡観察しても胞子や菌糸の存在が確認されなかった。また、NAD、NADP、NADH及びNADPHの合計の存在量が第3段階以上のサンプルにおいては、顕微鏡観察によっても胞子や菌糸の存在が確認された。一方、NAD、NADP、NADH及びNADPHの合計の存在量が、第1段階以上第3段階未満のサンプルにおいては、胞子や菌糸の存在が認められる場合と認められない場合があった。表3に、NAD、NADP、NADH及びNADPHの合計の存在量に基づいた発色量及び顕微鏡観察による判定の結果を示す。表中の数値は、該当したサンプル数を意味する。
【0064】
【表3】

【0065】
上記のNAD法による判定及び顕微鏡観察による判定は、検査対象の汚れが存在する現場において短時間で行うことができた。
【0066】
(実験例6)
(NAD法とATP法との比較)
実験例3及び4でカビか否かを判定した屋内の汚れの各サンプルにおいて、定量されたNAD、NADP、NADH及びNADPHの合計の存在量とATPの存在量との関係を検討した。図9は、各サンプルにおける、NAD、NADP、NADH及びNADPHの合計の存在量と、ATPの存在量とをプロットしたグラフである。両者の結果には良好な相関が認められた。
【産業上の利用可能性】
【0067】
本発明により、屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供することができる。
【符号の説明】
【0068】
10,230,430…面、20…開口部、30…穴、40…折り目、100…テンプレート、200…テンプレート貼付用伸縮ポール、210…伸縮ポール、215…固定バンド、220,310…治具、300…サンプル採取用伸縮ポール、320…綿棒、400…試験紙、410…支持体、420…サンプル採取パッド。
【技術分野】
【0001】
本発明は、建築物の屋内の汚れ判定方法に関する。より詳細には、屋内の汚れがカビか否かを現場で判定する方法に関する。
【背景技術】
【0002】
建築物の屋内の汚れが微生物、特にカビであった場合、直ちに対策を施さなければ汚染が拡大し、除去が困難になる場合がある。また、汚れが微生物を原因とするものであるか否かにより、汚れを除去する対策が異なる。このため、汚れが微生物によるものか否かを判定する必要がある。
【0003】
一般的に、検査対象から採取したサンプル中の微生物について調査する場合、サンプルを培地に接種し、数日間の培養が行われる。例えば、特許文献1には、耐熱性を有するメンブレンフィルターを介して空気を吸引することにより空気中に浮遊する微生物を該メンブレンフィルター上に捕捉し、該メンブレンフィルター上に捕捉した微生物を培地上で培養した後、培養された微生物中のATPをバイオルミネッセンス反応により検出する微生物の迅速測定方法が開示されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−161143号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、サンプルを培地に接種して培養する工程は、最低5日間程度の日数を要する。このため、サンプルを採取してから判定結果が出るまで最短でも1週間程度必要である。このため、従来の方法で建築物の屋内の汚れがカビか否かを判定した場合、判定に時間がかかり、汚れがカビによるものであった場合には対応が遅れ、汚れの除去が困難になる場合があった。
【0006】
また、培養において、培地の選択が適切でなかった場合には、サンプル中に微生物が存在していたにもかかわらずコロニーとして検出することができず、本来検出されるべき微生物が検出されず、誤判定してしまう場合があった。
【0007】
そこで本発明は、屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明は、屋内の汚れがカビか否かを現場で判定する方法であって、汚れからサンプルを採取するサンプル採取ステップと、サンプル中の補酵素の存在量を定量する定量ステップと、補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップとを含む方法を提供する。
【0009】
上記本発明の方法によれば、屋内の汚れがカビか否かの判定を、現場において短時間で行うことができる。このため、汚れの除去に適切な対策をその場で判断することができる。また、本発明の方法は、微生物を培養する工程を含まないため、培地の選択が不適切であることにより誤判定することがなく、正しい判定結果を得ることができる。
【0010】
上記補酵素は、ニコチンアミドアデニンジヌクレオチド(NAD)、ニコチンアミドアデニンジヌクレオチドリン酸(NADP)、還元型ニコチンアミドアデニンジヌクレオチド(NADH)及び還元型ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)からなる群より選択される1種以上の化合物であることが好ましい。また、上記判定ステップにおいて、上記選択された化合物の合計の単位面積当たりの存在量が、所定値A1未満の場合には、汚れはカビではないと判定し、所定値A2以上の場合には、汚れはカビであると判定し、所定値A1以上A2未満の場合には、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定することが好ましい。
【0011】
補酵素として、NAD、NADP、NADH又はNADPHを測定対象とすることにより、迅速に定量することができる。また、上記判定ステップにおいて、上記選択された化合物の合計の単位面積当たりの存在量に基づいて判定することにより、汚れがカビか否かを迅速に判定することができる。さらに、NAD、NADP、NADH又はNADPHの存在量に基づいて、汚れがカビであるか否かを判定することが困難な場合であっても、顕微鏡観察を行うことにより、現場でカビか否かを判定することができる。
【0012】
上記補酵素は、アデノシン三リン酸(ATP)であってもよい。また、上記判定ステップにおいて、ATPの単位面積当たりの存在量が、所定値B1未満の場合には、汚れはカビではないと判定し、所定値B2以上の場合には、汚れはカビであると判定し、所定値B1以上B2未満の場合には、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定することが好ましい。
【0013】
補酵素としてATPを測定対象とすることにより、迅速に定量することができる。また、上記判定ステップにおいて、ATPの単位面積当たりの存在量に応じて汚れがカビであるか否かを判定することにより、汚れがカビか否かを迅速に判定することができる。さらに、ATPの存在量に基づいて、汚れがカビであるか判定することが困難な場合であっても、顕微鏡観察を行うことにより、現場でカビか否かを判定することができる。
【発明の効果】
【0014】
本発明により、屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供することができる。
【図面の簡単な説明】
【0015】
【図1】テンプレートの一実施形態を示す概略図である。
【図2】テンプレート貼付用伸縮ポールの一実施形態を示す概略図である。
【図3】サンプル採取用伸縮ポールの一実施形態を示す概略図である。
【図4】試験紙の一実施形態を示す概略図である。
【図5】NAD法の一実施形態を示すフローチャートである。
【図6】ATP法の一実施形態を示すフローチャートである。
【図7】実験例2の結果を示すグラフである。A:ルシパックII、B:ルシフェール250プラス、C:ルシフェール250プラス及びルシフェールATP消去試薬セット、D:ルシフェールHSセットからATP消去試薬を省いたもの、E:ルシフェールHSセット。
【図8】実験例3の結果を示すグラフである。
【図9】実験例6の結果を示すグラフである。
【発明を実施するための形態】
【0016】
以下、場合により図面を参照しながら、好適な実施形態を説明する。なお、図面の説明において同一要素には同一符号を付し、重複する説明を省略する。また、図面は理解を容易にするため一部を誇張して描いており、寸法比率は説明のものとは必ずしも一致しない。
【0017】
屋内の汚れがカビか否かを現場で判定する方法は、汚れからサンプルを採取するサンプル採取ステップと、サンプル中の補酵素を定量する定量ステップと、補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップとを含む。
【0018】
まず、サンプル採取ステップについて説明する。一実施形態において、屋内の壁、天井、床等の汚れからサンプルを採取する。サンプルは一定の面積から採取することが好ましい。これにより、後述する定量ステップで得られる補酵素の存在量を、単位面積当たりの値として基準値と比較することが容易になる。
【0019】
一定の面積からサンプルを採取するためには、ふきとり検査枠又はテンプレートと呼ばれるサンプル回収用の枠を使用することが好ましい。テンプレートとは、中央部が切り取られた紙製の枠であり、検査対象表面に押し付けてサンプル採取範囲を特定し、枠で特定された領域からサンプルを採取するものであり、一般に市販されている。市販のテンプレートは100cm2の開口部を有しており、これを検査対象の表面に押しつけながらサンプル採取範囲を特定し、特定された領域内を脱脂綿等で拭き取ることにより、サンプルを採取することが一般的である。しかしながら、発明者らが検討した結果、通常の100cm2のテンプレートでは、本実施形態の判定方法には広すぎることが明らかとなった。後述する判定ステップにおける判断を、より正確に行うためには、テンプレートの開口部は1〜25cm2であることが好ましく、1〜9cm2であることがより好ましく、4cm2が特に好ましい。
【0020】
図1はテンプレートの一実施形態を示す概略図である。図1に示すように、テンプレート100は、サンプル採取範囲を特定する開口部20、テンプレート回収のための穴30を備えており、折り目40に沿って折り曲げられている。穴30の周囲は補強されている。穴30は、サンプル採取後に、検査対象表面からテンプレートを回収するときに用いる。手の届かない場所にテンプレートを貼付した場合であっても、例えば、伸縮ポールの先端に取りつけたフックを穴30に引っかけて引きはがすことにより、テンプレートを測定対象の表面から回収することが容易になる。テンプレート100の面10は全面が粘着層である。開口部20は、1〜25cm2の面積を有する。
【0021】
市販のテンプレートは粘着層を有していないため、片手で押さえつけながらサンプルを採取する必要がある。このため、手の届く範囲でしかサンプルの採取ができなかった。また、天井面等の手の届かないところでは脚立などの使用が必要であった。これに対し、上記実施形態のテンプレートを使用することにより、テンプレートを片手で押さえつける必要がなくなるため、手の届かない場所からもサンプル採取を行うことが容易となる。手の届かない場所でサンプル採取を行うために、以下に説明する伸縮ポール等を用いてテンプレートを検査対象表面に貼付することができる。
【0022】
図2は、テンプレート貼付用伸縮ポールの一実施形態を示す概略図である。テンプレート貼付用伸縮ポール200は、伸縮ポール210、伸縮ポール210の先端に固定バンド215により固定された治具220を備えている。治具220の面230にテンプレートをセットし、これを検査対象の表面に押しつけてテンプレートを貼付する。これにより、手の届かない場所であっても容易にテンプレートを貼付することができる。
【0023】
一実施形態において、サンプル採取には、滅菌された綿棒を用いることができる。サンプルを効率よく採取するために、サンプル採取時には、綿棒を滅菌水で湿らせることが好ましい。滅菌水の代わりにリン酸緩衝食塩水などの滅菌された適切な液体を用いてもよい。正確な判定を行うために、綿棒を用いてテンプレートで特定された範囲をまんべんなくなぞり、検査対象表面のサンプルを採取する。手の届かない範囲からサンプルを採取する場合には、伸縮ポールの先端に綿棒を取り付けた、サンプル採取用伸縮ポールを使用する。図3は、サンプル採取用伸縮ポールの一実施形態を示す概略図である。サンプル採取用伸縮ポール300は、伸縮ポール210、伸縮ポール210の先端に固定バンド215により固定された治具310を備えている。治具310に綿棒320を接続し、テンプレートで特定された範囲からサンプルを採取する。
【0024】
一実施形態において、サンプル採取パッドを用いてサンプルを採取することができる。図4は、サンプル採取パッドを備える試験紙の一実施形態を示す概略図である。試験紙400は、支持体410の表面に接着されたサンプル採取パッド420を備える。サンプル採取パッド420の面430は、1〜5cm2の面積を有する。検査対象の表面に、サンプル採取パッド420を一定の回数押しつけることによりサンプルを採取する。サンプル採取パッド420は、サンプル採取位置が重ならないように、毎回異なる位置に押しつけることが好ましい。これにより、テンプレートを使用しなくても一定の面積からサンプルを採取することができる。サンプルを効率よく採取するために、サンプル採取時には、サンプル採取パッド420を滅菌水で湿らせることが好ましい。滅菌水の代わりにリン酸緩衝食塩水などの滅菌された適切な液体を用いてもよい。例えば、1.68cm2の面積を有するサンプル採取パッドを使用する場合、サンプル採取のために検査対象表面に押しつける回数は、1〜30回であることが好ましく、5〜20回であることがより好ましい。
【0025】
次に、定量ステップについて説明する。定量ステップにおいて、上記のサンプル採取ステップで採取したサンプル中の補酵素の存在量を定量する。
【0026】
一実施形態において、補酵素は、NAD、NADP、NADH及びNADPHからなる群より選択される1種以上の化合物である。以下、補酵素がNAD、NADP、NADH又はNADPHである判定方法を「NAD法」という場合がある。
【0027】
NAD又はNADPに、β−D−グルコース及びグルコース−1−デヒドロゲナーゼを反応させると、D−グルコノラクトン、NADH及びNADPHが生成される。続いて、上記の反応により生成されたNADH及びNADPH、並びにサンプル中に存在していたNADH及びNADPHに、テトラゾリウム塩及びジアフォラーゼを作用させると、テトラゾリウム塩がホルマザン塩に変換される。このホルマザン塩の発色に基づいて、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量を定量することができる。したがって、本実施形態において、サンプルに、β−D−グルコース、グルコース−1−デヒドロゲナーゼ、テトラゾリウム塩及びジアフォラーゼを反応させることにより、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量に対応したホルマザン塩の発色が得られる。なお、この場合において、グルコース−1−デヒドロゲナーゼは、NADとNADPとの双方を基質とするものである。また、ジアフォラーゼは、NADHとNADPHの双方を基質とするものである。
【0028】
本実施形態において、サンプルは、上記のサンプル採取パッドを用いて採取する。続いて、サンプルを採取したパッドにβ−D−グルコース、グルコース−1−デヒドロゲナーゼ、テトラゾリウム塩及びジアフォラーゼの溶液を滴下することにより、上記の反応を行い、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量に応じたホルマザン塩の発色を得、発色強度に基づいてNAD、NADP、NADH及びNADPHの合計の存在量を定量する。サンプル中にNAD、NADP、NADH又はNADPHが存在しない場合にはホルマザン塩の発色は得られない。定量は色差計を用いて行ってもよいが、予め段階希釈した既知濃度のNAD、NADP、NADH又はNADPHを用いて上記の反応により発色させて検量線を得ておき、目視によって定量することもできる。本実施形態によるNAD、NADP、NADH及びNADPHの合計の存在量の定量は、現場で簡便に短時間で行うことができる。
【0029】
上記実施形態において、グルコース−1−デヒドロゲナーゼは、NADのみを基質とするものであってもよい。また、ジアフォラーゼは、NADHのみを基質とするものであってもよい。この場合、補酵素として、サンプル中のNAD及びNADHの合計の存在量が定量される。
【0030】
また、上記実施形態において、グルコース−1−デヒドロゲナーゼは、NADPのみを基質とするものであってもよい。また、ジアフォラーゼは、NADPHのみを基質とするものであってもよい。この場合、補酵素として、サンプル中のNADP及びNADPHの合計の存在量が定量される。
【0031】
上記のNAD、NADP、NADH及びNADPHの合計の存在量の定量は、例えば、HY−RiSE(商品名、メルク社)を用いて実施することができる。
【0032】
一実施形態において、補酵素はATPである。以下、補酵素がATPである判定方法を「ATP法」という場合がある。発光基質であるルシフェリンは、ATP及びマグネシウムイオンの存在下で、ルシフェラーゼによってオキシルシフェリンに変換されて発光する。この発光量はATP量に比例する。
【0033】
本実施形態において、サンプルは、上記のテンプレート及び滅菌された綿棒を用いて採取する。続いて、サンプルを採取した綿棒を、ルシフェリン、マグネシウムイオン及びルシフェラーゼを含む反応液に浸して撹拌する。この結果、サンプル中のATPの存在量に応じた発光が得られる。サンプル中にATPが存在しない場合には発光は得られない。発光量はルミノメーターを用いて測定することができる。ルミノメーターは現場に持ち込み可能なものであり、小型のポータブルタイプのものが好ましく、例えばルミテスターC−110(商品名、キッコーマン株式会社)が好適に用いられる。予め段階希釈した既知濃度のATPを用いて上記の反応を行い発光させて、検量線を得ておくことが好ましい。検量線を用いて、発光量からサンプル中のATPの存在量を求めることができる。本実施形態によるATPの定量は、現場で簡便に短時間で行うことができる。
【0034】
上記のATPの定量は、例えば、ATP定量用キットである、ルシパックII(商品名、キッコーマン株式会社)を用いて実施することができる。
【0035】
NADやATPは、微生物の代謝物である。したがって、上記実施形態によりサンプルからNADやATPが検出された場合、検査対象表面に微生物が存在していると判断することができる。この微生物はカビに限られない。しかしながら、屋内において、カビ以外の微生物が大量に発生して汚れを形成することは非常に稀である。そのため、ほとんどの場合において、上記実施形態によりサンプルからNADやATPが検出された場合、検査対象表面にカビが存在していると判断することができる。
【0036】
次に、判定ステップについて説明する。判定ステップでは、上記定量ステップで定量したサンプル中の補酵素の存在量に基づいて、屋内の汚れがカビか否かを現場で判定する。
【0037】
NAD法の場合、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量が、検査対象表面の単位面積当たり、所定値A1未満の場合には、汚れはカビではないと判定し、所定値A2以上の場合には、汚れはカビであると判定する。一方、所定値A1以上A2未満の場合には、確定的に判定することが困難な場合がある。このため、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定する。顕微鏡は現場に持ち込み可能な、小型のポータブルタイプのものであることが好ましい。顕微鏡で観察した結果、胞子や菌糸の存在が認められた場合には、カビであると判定できる。
【0038】
一実施形態において、所定値A1、A2は次の通りである。NAD定量キットとして、HY−RiSE(商品名、メルク社)を使用し、検査対象表面に20回押しつけることによりサンプルを回収して発色させた場合、発色量を目視で判定し、発色の度合いに応じて次のように0〜3段階に分類する。ほとんど発色が見られないものを第0段階と分類する。周辺部が薄い紫色であり、わずかに変色しているものを第1段階と分類する。中央部が黒ずんだ紫色に変色し、周辺部も紫色に変色しているものを第2段階と分類する。中央部がはっきりとした濃い紫色に変色し、周辺も紫色に変色しているものを第3段階と分類する。数値として表現する場合には、第0段階を0、第1段階を1、第2段階を2、第3段階を3と表現する。本実施形態において、所定値A1は1(第1段階)であり、所定値A2は3(第3段階)である。
【0039】
ATP法の場合、サンプル中のATPの存在量が、検査対象表面の単位面積当たり、所定値B1未満の場合には、汚れはカビではないと判定し、所定値B2以上の場合には、汚れはカビであると判定する。一方、サンプル中のATPの存在量が、所定値B1以上B2未満の場合には、確定的に判定することが困難な場合がある。このため、サンプルの顕微鏡観察により、汚れがカビであるか否かを判定する。顕微鏡で観察した結果、胞子や菌糸の存在が認められた場合には、カビであると判定できる。
【0040】
一実施形態において、所定値B1、B2は次の通りである。後述する実験例1の通りに校正された、ルミテスターC−110(商品名、キッコーマン株式会社)を使用する。検査対象表面4cm2から回収したサンプルを、ATP定量キットであるルシパックII(商品名、キッコーマン株式会社)を使用して発光させ、ルミテスターC−110(商品名、キッコーマン株式会社)で発光量を測定する。本実施形態において、所定値B1は100であり、所定値B2は10000である。
【0041】
顕微鏡としては、例えば小型の倒立型顕微鏡(DSM−1型、ダイコーサイエンス株式会社)を使用できる。顕微鏡の接眼レンズの代わりに、パソコンに接続されたデジタルカメラシステムを接続し、顕微鏡画像をノートパソコンのディスプレイ等の携帯型のモニタ上に表示させることが好ましい。デジタルカメラシステムとしては、例えばMoticam2000(商品名、株式会社島津理化)が使用できる。これにより、複数の人間で顕微鏡画像を確認することができる。顕微鏡の倍率は20〜1200倍が好ましい。
【0042】
顕微鏡でサンプルを観察する場合、NAD法又はATP法で使用したサンプルの一部をスライドガラスに滴下して観察してもよく、検査対象表面から新たに顕微鏡観察用のサンプルを採取してもよい。新たにサンプル採取する場合、検査対象表面が剥離しにくい素材である場合には、検査対象表面にセロハンテープを貼付及び剥離することによりセロハンテープの粘着面にサンプルを付着させてもよい。この場合、サンプルが付着したセロハンテープをスライドガラスに貼付して顕微鏡観察することができる。また、検査対象表面が剥離しやすい素材からなり、セロハンテープでサンプル採取すると表面を破損してしまう恐れがある場合には、滅菌水等で湿らせた綿棒で検査対象表面をなぞってサンプル採取し、スライドガラス上に塗布して顕微鏡観察することができる。
【0043】
上記の定量ステップにおいて、サンプル中にNADやATP等の補酵素の存在が検出された場合には、サンプル中に生きたカビが存在すると判断できる。一方、顕微鏡による観察では、観察された胞子や菌糸の形態から、カビの生死の判断も可能である。
【0044】
本方法により検出可能なカビとしては、例えば、アスペルギルス属、アルテルナリア属、ケトミウム属、クラドスポリウム属、ユーロチウム属、ペニシリウム属、フサリウム属、リゾプス属、トリコデルマ属に属するものが例示できる。
【0045】
図5は、NAD法の一実施形態を示すフローチャートである。本実施形態において、まず、検査対象表面からサンプルを採取し、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量を定量する(ステップS1)。定量した結果、NAD、NADP、NADH及びNADPHの合計の存在量が、検査対象表面の単位面積当たり所定値A1未満の場合には(ステップS2のA)、汚れはカビではないと判定し(ステップS3)、所定値A2以上の場合には(ステップS2のB)、汚れはカビであると判定する(ステップS4)。一方、サンプル中のNAD、NADP、NADH及びNADPHの合計の存在量が、検査対象表面の単位面積当たり所定値A1以上A2未満の場合には(ステップS2のC)、顕微鏡観察を行う(ステップS5)。顕微鏡観察の結果、サンプル中に胞子や菌糸の存在が確認された場合には(ステップS6のYES)、汚れはカビであると判定し(ステップS4)、胞子や菌糸の存在が確認されなかった場合には(ステップS6のNO)、汚れはカビではないと判定する(ステップS3)。
【0046】
図6は、ATP法の一実施形態を示すフローチャートである。本実施形態において、検査対象表面からサンプルを採取し、サンプル中のATPの存在量を定量する(ステップS1)。定量した結果、ATPの存在量が、検査対象表面の単位面積当たり所定値B1未満の場合には(ステップS2のA)、汚れはカビではないと判定し(ステップS3)、所定値B2以上の場合には(ステップS2のB)、汚れはカビであると判定する(ステップS4)。一方、サンプル中のATPの存在量が、検査対象表面の単位面積当たり所定値B1以上B2未満の場合には(ステップS2のC)、顕微鏡観察を行う(ステップS5)。顕微鏡観察の結果、サンプル中に胞子や菌糸の存在が確認された場合には(ステップS6のYES)、汚れはカビであると判定し(ステップS4)、胞子や菌糸の存在が確認されなかった場合には(ステップS6のNO)、汚れはカビではないと判定する(ステップS3)。
【実施例】
【0047】
以下、本発明の実施例を示して、本発明を更に具体的に説明するが、本発明はこれらの実施例に限定されるものではなく、本発明の技術的思想を逸脱しない範囲での種々の変更が可能である。
【0048】
(実験例1)
(検量線の作成)
ルミテスターC−110(商品名、キッコーマン株式会社)を用いて、ATPの発光量の検量線を作成した。まず、ATPの濃度が、0、2×10−12、2×10−11、2×10−10、2×10−9、2×10−8、2×10−7(M)である標準溶液を調製した。続いて、ATP定量キットであるルシフェール250プラス(商品名、キッコーマン株式会社)を用いて、取扱説明書にしたがってこれらの標準溶液を発光させた。続いて、ルミテスターC−110(商品名、キッコーマン株式会社)を用いて各溶液の発光量(相対値)を測定した。測定結果を表1に示す。
【0049】
【表1】

【0050】
(実験例2)
(サンプル中のATPに基づいた発光量の測定)
複数の市販のATP定量用キットを使用して、既知濃度に懸濁したアスペルギルス・ニガーの胞子をサンプルに用い、サンプル中のATPに基づいた発光量を測定した。まず、アスペルギルス・ニガーの胞子を滅菌水で懸濁し、1×104〜1×107個/mlの範囲内で数段階に段階希釈した溶液を調製し、カビのサンプルとした。
【0051】
続いて、複数のATP定量用キットを使用して、各サンプル中のATPの存在量に応じた発光を得、発光量を測定した。キットには、ルシパックII、ルシフェール250プラス、ルシフェール250プラス及びルシフェールATP消去試薬セット、ルシフェールHSセットからATP消去試薬を省いたもの、ルシフェールHSセット(いずれも商品名、キッコーマン株式会社)を使用し、操作は取扱説明書にしたがって行った。実験例1で使用したルミテスターC−110(商品名、キッコーマン株式会社)を用いて発光量を測定した。
【0052】
図7は、ATPの存在量に基づいた発光量をプロットしたグラフである。発光量として、ルミテスターC−110(商品名、キッコーマン株式会社)で測定された値を使用した。グラフ中A〜Eは、それぞれ次のキットを用いた結果である。A:ルシパックII、B:ルシフェール250プラス、C:ルシフェール250プラス及びルシフェールATP消去試薬セット、D:ルシフェールHSセットからATP消去試薬を省いたもの、E:ルシフェールHSセット。
【0053】
(実験例3)
(サンプル中のNADに基づいた発色)
市販のNAD定量用キットを使用して、既知濃度に懸濁したアスペルギルス・ニガーの胞子をサンプルに用い、サンプル中のNADの存在量に基づいたホルマザン塩の発色を得た。まず、アスペルギルス・ニガーの胞子を滅菌水で懸濁し、1×104個/mlから1×107個/mlの濃度となるように段階希釈して、カビのサンプルとした。
【0054】
続いて、NAD定量用キットを使用して、各サンプル中のNADの存在量に応じた発色を得た。NAD定量キットとして、HY−RiSE(商品名、メルク社)を使用した。発色量を目視で判定し、発色の度合いに応じて次のように0〜3段階に分類した。ほとんど発色が見られないものを第0段階と分類した。周辺部が薄い紫色であり、わずかに変色しているものを第1段階と分類した。中央部が黒ずんだ紫色に変色し、周辺部も紫色に変色しているものを第2段階と分類した。中央部がはっきりとした濃い紫色に変色し、周辺も紫色に変色しているものを第3段階と分類した。
【0055】
図8は、各サンプル中のNADの存在量に基づいた発色量をプロットしたグラフである。発色量は、発色の度合いに応じた分類で、第0段階のものを0、第1段階のものを1、第2段階のものを2、第3段階のものを3と表記した。
【0056】
(実験例4)
(ATP法による判定)
まず、屋内の汚れからサンプルを採取した。2×2cmの開口部を有するテンプレートを壁面に貼付した。テンプレートとして、全面粘着型付せん(商品名SSZ−33RY、住友スリーエム株式会社)の一部を2×2cmサイズに切り抜いたものを使用した。続いて、ATP定量キットであるルシパックII(商品名、キッコーマン株式会社)の綿棒を滅菌水で濡らし、この綿棒を用いてテンプレートで特定された領域をまんべんなくなぞり、サンプルを採取した。
【0057】
続いて、サンプルが付着した綿棒をルシパックIIの本体に戻し、取扱説明書にしたがって本体を数回振り下ろし、ルシパックIIの試薬を測定チューブに落とした。次に、溶け残った試薬をよく振り混ぜて溶解し、測定チューブを本体から取り外し、実験例1で使用したルミテスターC−110(商品名、キッコーマン株式会社)を用いて発光量を測定した。上記のATPの存在量の定量を、様々な屋内の汚れについて行った。
【0058】
(顕微鏡観察による判定)
ATP法で測定した検査対象表面とほぼ同一の領域からサンプルを採取し、顕微鏡で観察した。まず、2×2cmの開口部を有するテンプレートを壁面に貼付した。テンプレートとして、全面粘着型付せん(商品名SSZ−33RY、住友スリーエム株式会社)の一部を2×2cmサイズに切り抜いたものを使用した。続いて、滅菌し、リン酸緩衝食塩水で湿らせた綿棒を用いて、テンプレートで特定された領域をまんべんなくなぞり、サンプルを採取した。綿棒として、ふきふきチェックII(商品名、栄研化学株式会社)を使用した。続いて、サンプルが付着した綿棒をスライドガラス上に塗りつけ、顕微鏡で観察した。顕微鏡としては、小型倒立型顕微鏡(DSM−1型、ダイコーサイエンス株式会社)に、デジタルカメラシステム(Moticam2000、商品名、株式会社島津理化)を接続したものを使用した。顕微鏡画像をノートパソコンのディスプレイ上に表示させた。胞子や菌糸が認められた場合には屋内の汚れはカビであると判定した。
【0059】
検査対象表面において、ルミテスターC−110(商品名、キッコーマン株式会社)で測定した場合の発光量の計測値が、100未満のサンプルにおいては、顕微鏡観察しても胞子や菌糸の存在が確認されなかった。また、発光量の計測値が10000以上のサンプルにおいては、顕微鏡観察によっても胞子や菌糸の存在が確認された。一方、発光量の計測値が100以上10000未満のサンプルにおいては、胞子や菌糸の存在が認められる場合と認められない場合があった。表2に、ATPの存在量に基づいた発光量の計測値及び顕微鏡観察による判定の結果を示す。表中の数値は、該当したサンプル数を意味する。
【0060】
【表2】

【0061】
上記のATP法による判定及び顕微鏡観察による判定は、検査対象の汚れが存在する現場において短時間で行うことができた。
【0062】
(実験例5)
(NAD法による判定)
NAD定量キットとして、HY−RiSE(商品名、メルク社)を使用した。取扱説明書にしたがって、HY−RiSEの試験紙のパッド部分を湿潤液で湿らせ、検査対象である屋内の汚れに20回押しつけてサンプルを採取した。パッド部分の面積は1.68cm2であった。続いて、サンプルが付着したパッド部分に基質液及び酵素液を滴下し、30分間暗所で放置した。続いて、ホルマザン塩の発色量に基づいて、実験例3と同様に、目視によりサンプル中のNAD、NADP、NADH及びNADPHの合計の存在量を0〜3段階に分類することにより定量した。上記の定量を、様々な屋内の汚れについて行った。
【0063】
(顕微鏡観察による判定)
実験例3と同様にして、NAD法で測定した検査対象表面とほぼ同一の領域からサンプルを採取し、顕微鏡で観察した。胞子や菌糸が認められた場合には屋内の汚れはカビであると判定した。検査対象表面において、NAD、NADP、NADH及びNADPHの合計の存在量が、第1段階未満のサンプルにおいては、顕微鏡観察しても胞子や菌糸の存在が確認されなかった。また、NAD、NADP、NADH及びNADPHの合計の存在量が第3段階以上のサンプルにおいては、顕微鏡観察によっても胞子や菌糸の存在が確認された。一方、NAD、NADP、NADH及びNADPHの合計の存在量が、第1段階以上第3段階未満のサンプルにおいては、胞子や菌糸の存在が認められる場合と認められない場合があった。表3に、NAD、NADP、NADH及びNADPHの合計の存在量に基づいた発色量及び顕微鏡観察による判定の結果を示す。表中の数値は、該当したサンプル数を意味する。
【0064】
【表3】

【0065】
上記のNAD法による判定及び顕微鏡観察による判定は、検査対象の汚れが存在する現場において短時間で行うことができた。
【0066】
(実験例6)
(NAD法とATP法との比較)
実験例3及び4でカビか否かを判定した屋内の汚れの各サンプルにおいて、定量されたNAD、NADP、NADH及びNADPHの合計の存在量とATPの存在量との関係を検討した。図9は、各サンプルにおける、NAD、NADP、NADH及びNADPHの合計の存在量と、ATPの存在量とをプロットしたグラフである。両者の結果には良好な相関が認められた。
【産業上の利用可能性】
【0067】
本発明により、屋内の汚れがカビか否かを、現場で迅速に正しく判定する方法を提供することができる。
【符号の説明】
【0068】
10,230,430…面、20…開口部、30…穴、40…折り目、100…テンプレート、200…テンプレート貼付用伸縮ポール、210…伸縮ポール、215…固定バンド、220,310…治具、300…サンプル採取用伸縮ポール、320…綿棒、400…試験紙、410…支持体、420…サンプル採取パッド。
【特許請求の範囲】
【請求項1】
屋内の汚れがカビか否かを現場で判定する方法であって、
汚れからサンプルを採取するサンプル採取ステップと、
サンプル中の補酵素の存在量を定量する定量ステップと、
補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップと
を含む方法。
【請求項2】
前記補酵素は、ニコチンアミドアデニンジヌクレオチド、ニコチンアミドアデニンジヌクレオチドリン酸、還元型ニコチンアミドアデニンジヌクレオチド及び還元型ニコチンアミドアデニンジヌクレオチドリン酸からなる群より選択される1種以上の化合物であり、
前記判定ステップにおいて、前記補酵素の単位面積当たりの存在量が、
所定値A1未満の場合には、前記汚れはカビではないと判定し、
所定値A2以上の場合には、前記汚れはカビであると判定し、
所定値A1以上A2未満の場合には、前記サンプルの顕微鏡観察により前記汚れがカビであるか否かを判定する、請求項1に記載の方法。
【請求項3】
前記補酵素はアデノシン三リン酸であり、
前記判定ステップにおいて、アデノシン三リン酸の単位面積当たりの存在量が、
所定値B1未満の場合には、前記汚れはカビではないと判定し、
所定値B2以上の場合には、前記汚れはカビであると判定し、
所定値B1以上B2未満の場合には、前記サンプルの顕微鏡観察により前記汚れがカビであるか否かを判定する、請求項1に記載の方法。
【請求項1】
屋内の汚れがカビか否かを現場で判定する方法であって、
汚れからサンプルを採取するサンプル採取ステップと、
サンプル中の補酵素の存在量を定量する定量ステップと、
補酵素の存在量に基づいて汚れがカビか否かを判定する判定ステップと
を含む方法。
【請求項2】
前記補酵素は、ニコチンアミドアデニンジヌクレオチド、ニコチンアミドアデニンジヌクレオチドリン酸、還元型ニコチンアミドアデニンジヌクレオチド及び還元型ニコチンアミドアデニンジヌクレオチドリン酸からなる群より選択される1種以上の化合物であり、
前記判定ステップにおいて、前記補酵素の単位面積当たりの存在量が、
所定値A1未満の場合には、前記汚れはカビではないと判定し、
所定値A2以上の場合には、前記汚れはカビであると判定し、
所定値A1以上A2未満の場合には、前記サンプルの顕微鏡観察により前記汚れがカビであるか否かを判定する、請求項1に記載の方法。
【請求項3】
前記補酵素はアデノシン三リン酸であり、
前記判定ステップにおいて、アデノシン三リン酸の単位面積当たりの存在量が、
所定値B1未満の場合には、前記汚れはカビではないと判定し、
所定値B2以上の場合には、前記汚れはカビであると判定し、
所定値B1以上B2未満の場合には、前記サンプルの顕微鏡観察により前記汚れがカビであるか否かを判定する、請求項1に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−231765(P2012−231765A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−104120(P2011−104120)
【出願日】平成23年5月9日(2011.5.9)
【出願人】(000001373)鹿島建設株式会社 (1,387)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年5月9日(2011.5.9)
【出願人】(000001373)鹿島建設株式会社 (1,387)
【Fターム(参考)】
[ Back to top ]

