粘膜免疫賦活剤
【課題】ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供する。また、ミツバチ産品を利用したM細胞分化誘導剤、抗原取込促進剤についても提供する。
【解決手段】本発明に係る粘膜免疫賦活剤では、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することとした。また、本発明に係るM細胞分化誘導剤では、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとした。さらに、本発明に係る抗原取込促進剤では、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとした。
【解決手段】本発明に係る粘膜免疫賦活剤では、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することとした。また、本発明に係るM細胞分化誘導剤では、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとした。さらに、本発明に係る抗原取込促進剤では、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとした。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ミツバチ産品を利用した粘膜免疫賦活剤に関する。
【背景技術】
【0002】
従来より、感染症を予防する手段の一つとして、種々のワクチンが使用されている。これらのワクチンの大半は注射によるものであり、少なからずとも接種対象に侵襲を加えるものである。
【0003】
そこで、接種対象に侵襲を加えないワクチンとして、粘膜面にて抗原感作を行う粘膜ワクチンが知られている。しかし、粘膜ワクチンはpoliovirus(例えば、非特許文献1参照。)、Salmonella typhi、V. cholerae(例えば、非特許文献2参照。)、rotavirus(例えば、非特許文献3参照。)に対する経口ワクチンやinfluenza virusに対する経鼻ワクチン(例えば、非特許文献4参照。)などがアメリカなどで承認を受けているのみであり、注射によるワクチンに比して未だ一般的とは言い難い。
【0004】
粘膜ワクチンの開発が遅れている理由としては粘膜ワクチンの投与の問題と粘膜に分泌された抗体の定量が難しく正確に測定できず、粘膜のT細胞の回収と機能解析が困難であるなどの粘膜免疫応答の測定が複雑であることがあげられる。しかしながら粘膜感染症であるHIV-1を含め、粘膜からのウイルスの感染を阻害するような粘膜免疫を誘導するワクチンの開発が今後ますます要求されることが予想されている。
【0005】
ところで、粘膜面に抗体を誘導するためには、前述のように粘膜面での抗原感作が必要であり(例えば、非特許文献5参照。)、その粘膜面での抗原の取り込みに中心的な役割を果たす存在はM(microfold)細胞である(例えば、非特許文献6参照。)。
【0006】
M細胞は、他の上皮細胞とは異なり管腔側から抗原を取り込むために変則的で短い微絨毛を持ち、基底膜側にポケット状構造をとる(例えば、非特許文献7参照。)。さらに他の上皮細胞と比較して頂端膜側において糖衣を欠乏しアルカリフォスファターゼやイソスクロースマルターゼのような消化酵素の発現が減少しており(例えば、非特許文献8、9参照。)、管腔に曝露されやすくなり巨大な分子や微生物のM細胞への接近を容易にしている。
【0007】
例えば、マウスのM細胞では、reovirus 、rotavirusやpoliovirusといったウイルスやS,typhimurium、S.typhi、Y.enterocolitica、V. choleraeなどの微生物やUlex europaeus agglutinin-1(UEA-1)などのレクチン、ラテックスビーズなど様々な抗原を取り込むことが知られている。
【0008】
これらは、マウスM細胞に特異的に発現した受容体を介して取り込まれると考えられ、マウスM細胞に特異的に発現するといわれている分子としてはIntegrinβ1(例えば、非特許文献10参照。)やα-L-フコース(例えば、非特許文献11参照。)などがあげられ、実際に、Y.enterocoliticaのM細胞による取り込みにIntegrinβ1が関与しており(例えば、非特許文献12参照。)、UEA-1はα(1,2)-フコースを標的としている(例えば、非特許文献13参照。)。また、reovirus由来のσ1タンパク質はM細胞上のα(2,3)結合型のシアル酸を含んだ糖鎖構造に特異的に結合するといわれている(例えば、非特許文献14参照。)。
【0009】
これらのタンパク質を用いた粘膜ワクチンは強力な抗原特異的IgGと粘膜IgA応答に加えCTLの誘導に成功している(例えば、非特許文献15-18参照。)。さらに近年、FAEにのみ存在すると考えられていたM細胞が絨毛にも存在することが発見され(例えば、非特許文献19参照。)、FAEのM細胞と絨毛M細胞の両方を標的とすることでより効果的に粘膜免疫を誘導することができると考えられる。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Modlin, J. F. Poliomyelitis in the United States: the final chapter? Jama 292, 1749-51 (2004).
【非特許文献2】Levine, M. M. Immunization against bacterial diseases of the intestine. J Pediatr Gastroenterol Nutr 31, 336-55 (2000).
【非特許文献3】Kapikian, A. Z., Hoshino, Y., Chanock, R. M. & Perez-Schael, I. Efficacy of a quadrivalent rhesus rotavirus-based human rotavirus vaccine aimed at preventing severe rotavirus diarrhea in infants and young children. J Infect Dis 174 Suppl 1, S65-72 (1996)..
【非特許文献4】Belshe, R. B. et al. The efficacy of live attenuated, cold-adapted, trivalent, intranasal influenzavirus vaccine in children. N Engl J Med 338, 1405-12 (1998).
【非特許文献5】Lamm, M. E. Interaction of antigens and antibodies at mucosal surfaces. Annu Rev Microbiol 51, 311-40 (1997).
【非特許文献6】Owen, R. L. Sequential uptake of horseradish peroxidase by lymphoid follicle epithelium of Peyer's patches in the normal unobstructed mouse intestine: an ultrastructural study. Gastroenterology 72, 440-51 (1977).
【非特許文献7】Brayden, D. J., Jepson, M. A. & Baird, A. W. Keynote review: intestinal Peyer's patch M cells and oral vaccine targeting. Drug Discov Today 10, 1145-57 (2005).
【非特許文献8】El Bahi, S. et al. Lymphoepithelial interactions trigger specific regulation of gene expression in the M cell-containing follicle-associated epithelium of Peyer's patches. J Immunol 168, 3713-20 (2002).
【非特許文献9】Brown, D., Cremaschi, D., James, P. S., Rossetti, C. & Smith, M. W. Brush-border membrane alkaline phosphatase activity in mouse Peyer's patch follicle-associated enterocytes. J Physiol 427, 81-8 (1990).
【非特許文献10】Clark, M. A., Hirst, B. H. & Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect Immun 66, 1237-43 (1998).
【非特許文献11】Clark, M. A., Jepson, M. A., Simmons, N. L., Booth, T. A. & Hirst, B. H. Differential expression of lectin-binding sites defines mouse intestinal M-cells. J Histochem Cytochem 41, 1679-87 (1993).
【非特許文献12】Isberg, R. R. & Leong, J. M. Multiple beta 1 chain integrins are receptors for invasin, a protein that promotes bacterial penetration into mammalian cells. Cell 60, 861-71 (1990).
【非特許文献13】Sharma, R., Schumacher, U. & Adam, E. Lectin histochemistry reveals the appearance of M-cells in Peyer's patches of SCID mice after syngeneic normal bone marrow transplantation. J Histochem Cytochem 46, 143-8 (1998).
【非特許文献14】Helander, A. et al. The viral sigma1 protein and glycoconjugates containing alpha2-3-linked sialic acid are involved in type 1 reovirus adherence to M cell apical surfaces. J Virol 77, 7964-77 (2003).
【非特許文献15】Manocha, M. et al. Enhanced mucosal and systemic immune response with intranasal immunization of mice with HIV peptides entrapped in PLG microparticles in combination with Ulex Europaeus-I lectin as M cell target. Vaccine 23, 5599-617 (2005).
【非特許文献16】Wang, X. et al. Transgene vaccination using Ulex europaeus agglutinin I (UEA-1) for targeted mucosal immunization against HIV-1 envelope. Vaccine 23, 3836-42 (2005).
【非特許文献17】Wu, Y. et al. M cell-targeted DNA vaccination. Proc Natl Acad Sci U S A 98, 9318-23 (2001).
【非特許文献18】Wang, X., Hone, D. M., Haddad, A., Shata, M. T. & Pascual, D. W. M cell DNA vaccination for CTL immunity to HIV. J Immunol 171, 4717-25 (2003).
【非特許文献19】Jang, M. H. et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proc Natl Acad Sci U S A 101, 6110-5 (2004).
【発明の概要】
【発明が解決しようとする課題】
【0011】
しかしながら、前述のUEA-1などのレクチンは一般的にタンパク質であるため腸内で分解されやすく毒性があることが問題となっており、さらにM細胞は腸の上皮細胞のわずか0.00001%を構成しているのみであり、より効果的な粘膜ワクチンを作製するためには、ワクチン抗原をM細胞に効率よく送達させるために、分解されにくく毒性もないデリバリー分子の開発やM細胞を誘導する因子を用いて抗原の腸管腔からの取り込み効率を意図的にコントロールすることが必要不可欠である。
【0012】
このような状況において本発明者らは、M細胞の配備数と機能をコントロールできれば、免疫誘導と寛容の区別をコンロトールしながら効率的な粘膜免疫を誘導できる可能性があると考えた。
【0013】
また、生体に経口投与を行うことも想定し、毒性がなく、ヒトの食文化に古来より密接な関係を有する物品を中心に、粘膜免疫を誘導可能な物質のスクリーニングを行うべきであるとの考えに至った。
【0014】
特に本発明者らは、長年に亘り免疫に関連する研究分野に携わっており、M細胞を識別することにより腸管免疫を賦活可能な新規の物質として、TGDK-CH2-CH2-NH-Rの式で示される化合物を見出し、既に特許出願も行っている(国際公開WO2007/052641号)。
【0015】
そこで、これまでの研究の成果に基づき、上述のTGDK(tetragalloyl-D-lysine dendrimer)を構成しているgalloyl基と類似したポリフェノールを含有するミツバチ産品に着目し、粘膜免疫を誘導可能な物質の検討を行った。
【0016】
本発明は、かかる見地より完成されたものであって、ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供することを目的としている。
【0017】
また、併せて、ミツバチ産品を利用したM細胞分化誘導剤、抗原取込促進剤、M細胞分化誘導方法及びM細胞の抗原取込促進方法についても提供する。
【課題を解決するための手段】
【0018】
上記従来の課題を解決するために、請求項1に係る粘膜免疫賦活剤では、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することとした。
【0019】
また、請求項2に係るM細胞分化誘導剤では、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとした。
【0020】
また、請求項3に係る抗原取込促進剤では、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとした。
【0021】
また、請求項4に係るM細胞分化誘導方法では、請求項2に記載のM細胞分化誘導剤を腸管上皮細胞に接触させて、前記腸管上皮細胞の少なくとも一部をM細胞に分化させることとした。
【0022】
また、請求項5に係るM細胞の抗原取込促進方法では、請求項3に記載の抗原取込促進剤をM細胞に接触させて、M細胞の抗原取り込みを促進させることとした。
【発明の効果】
【0023】
請求項1に係る発明によれば、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することとしたため、ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供することができる。
【0024】
また、請求項2に係る発明によれば、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとしたため、腸管上皮細胞のM細胞分化を効率的に行うことができ、ミツバチ産品を利用したM細胞分化誘導剤を提供することができる。
【0025】
また、請求項3に係る発明によれば、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとしたため、ミツバチ産品を利用した抗原取込促進剤を提供することができる。
【0026】
また、請求項4に係る発明によれば、請求項2に記載のM細胞分化誘導剤を腸管上皮細胞に接触させて、前記腸管上皮細胞の少なくとも一部をM細胞に分化させることとしたため、ミツバチ産品を利用しつつ、腸管上皮細胞のM細胞分化を効率的に行うことができる。
【0027】
また、請求項5に係る発明によれば、請求項3に記載の抗原取込促進剤をM細胞に接触させて、M細胞の抗原取り込みを促進させることとしたため、ミツバチ産品を利用したM細胞の抗原取込促進方法を提供することができる。
【図面の簡単な説明】
【0028】
【図1】ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した試薬を示す説明図である。
【図2】ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した試薬の組成を示す説明図である。
【図3】ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した器具、装置類を示す説明図である。
【図4】ミツバチ産品由来のサンプルによるM細胞分化誘導実験の実験方法及び結果を示した説明図である。
【図5】ミツバチ産品由来のサンプルのM細胞内トランスサイトーシスへの影響の実験方法及び結果を示した説明図である。
【発明を実施するための形態】
【0029】
以下、本発明の実施形態について、具体的に説明する。
【0030】
本発明の目的の一つは、ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供することにある。
【0031】
具体的には、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することにより、本実施形態に係る粘膜免疫賦活剤を実現することができる。
【0032】
ここで、ミツバチ産品とは、養蜂において生産される産物のことであり、主に、蜂蜜、ローヤルゼリー、プロポリス、花粉荷を挙げることができる。特に、本発明に関連するローヤルゼリー、プロポリス、花粉荷は、具体的には下記の通りである。
【0033】
ローヤルゼリーは、働き蜂の唾液腺で生合成され、顎の外分泌腺から分泌される酸味のある乳白色クリーム状の物質である。また、プロポリスは、主に樹木の新芽や蕾、樹皮から採集したガム質、樹液、植物色素、香油等に、働き蜂の分泌物、蜂ろうなどを混合して作られた暗緑色や褐色から暗褐色を呈した粘着性のある樹脂状の固形物質である。また、花粉荷は、働き蜂が植物より採取した花粉と、働き蜂の分泌物とが混合された混合物である。
【0034】
粘膜免疫賦活剤を実現するにあたり、ローヤルゼリー、プロポリス、花粉荷は、いずれか1つを含有することとしても良く、また、複数を同時に混合するようにしても良い。
【0035】
また、本実施形態に係るM細胞分化誘導剤は、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとしている。後に実験結果に基づいて述べるが、ローヤルゼリーやプロポリスは、M細胞の分化誘導能を有することが本発明者らの実験により示唆されており、これらを含有するM細胞分化誘導剤は、顕著なM細胞の分化誘導を示す。
【0036】
特に、M細胞は、粘膜面での抗原の取り込みに中心的な役割を果たす細胞であり、このM細胞が粘膜面にて増えることは、換言すれば、粘膜免疫を賦活することであると言える。
【0037】
また、本実施形態に係る抗原取込促進剤は、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとしている。このM細胞の抗原取り込みについても後に実験結果に基づいて説明するが、ローヤルゼリーや花粉荷は、M細胞の抗原取り込みを促進することが本発明者らの実験により示唆されており、これらを含有する抗原取込促進剤は、顕著な抗原取込能の上昇を示す。
【0038】
また、この抗原取込促進剤についても、前述のM細胞分化誘導剤と同様に、粘膜免疫を賦活することであるとも言える。
【0039】
このように、本実施形態に係る粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤によれば、ローヤルゼリーやプロポリスによってM細胞の分化を促進し、また、ローヤルゼリーや花粉荷によってM細胞の抗原取込み能そのものを増大させることとなり、粘膜免疫を賦活させることができる。
【0040】
また、これらの粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤は、生体に対して使用しても良く、また、in vitroの実験等に用いられる薬剤として使用しても良い。
【0041】
すなわち、本発明に係るM細胞分化誘導方法は、前述のM細胞分化誘導剤を腸管上皮細胞に接触させることで実現することができ、また、本発明に係るM細胞の抗原取込促進方法は、前述の抗原取込促進剤をM細胞に接触させることで実現することができる。なお、これらのM細胞分化誘導剤や抗原取込促進剤を接触させる手段としては、特に限定されるものではない。例えば、ヒトや動物などでは経口投与して接触させることができ、また、in vitroの実験等で使用する場合には、適宜溶媒に溶解して用いることもできる。
【0042】
また、有効成分がミツバチ産品であることから、人体に対して安全であり、ヒトに対して経口投与しても良い。この場合、粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤は、医薬品としても良いが、普段の食生活から手軽に摂取できる健康食品としても、日々の健康増進の一環として有用である。
【0043】
以下、本実施形態に係る粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤、M細胞分化誘導方法、M細胞の抗原取込促進方法について、ミツバチ産品のM細胞誘導能とトランスサイトーシスへの影響を評価するための実験方法及び結果を示しながら、さらに具体的に説明する。
【0044】
〔実験材料〕
ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した実験材料は、図1-図3に示すとおりである。なお、試薬はすべて特級、培養用またはそれに準ずるものを用いている。また、培養試薬は無菌的に調製し保存した。
【0045】
また、ミツバチ産品の検体溶液を下記の(1)-(5)の通り調製した。
(1)花粉荷上清(1 % , 5 % , 10 %)
花粉荷1 gをEMEM培地5 mlで溶解し1.5 mlエッペンドルフチューブに分注後、遠心をおこない、上清のみを用いた。
(2)0.45 μm≧花粉荷溶液(1 % , 5 % , 10 %)
花粉荷溶液を0.45 μmフィルターでろ過した溶液を用いた。
(3)0.80 μm≧花粉荷溶液(1 % , 5 % , 10 %)
花粉荷溶液を0.80 μmフィルターでろ過した溶液を用いた。
(4)Propolis溶液(1 % , 0.5 % , 0.1 %)
Propolis原液の溶媒であるethanolをspeed backにより気化させ、propolis結晶をDMSOで555.6 μg/μlとなるように溶解したものを用いた。
(5)Loyal jelly溶液 (1 % , 0.5 % , 0.1 %)
8.5 μgのLoyal jelly dry powderを100 μlのDMSOで溶解したものを用いた。
【0046】
また、以下の実験では、ヒト腸管上皮細胞由来のCaco-2を用いた。ヒト腸管上皮細胞由来のCaco-2は付着系細胞であり、2 % FCSを含むEMEM培地に2 mMのL-glutamine、0.1 mMの非必須アミノ酸を加えたものを用いた。細胞は、37 ℃、5 % CO2存在下でtissue culture flask内で対数増殖の範囲内 (2.0×105-1.0×106 cells/ml)で継代培養を行った。なお、細胞濃度はtrypan blue染色法により、生細胞数と死細胞数とをカウントして求めた。
【0047】
〔ミツバチ産品由来のサンプルによるM細胞分化誘導実験〕
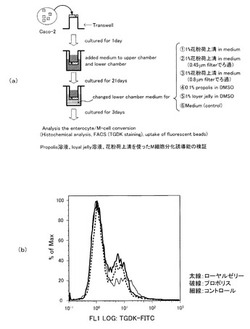
図4(a)に示すように、Caco-2細胞(4.25×106 cells/1 ml)をtranswellの膜上に播種後、16時間培養する。16時間後transwell insertを6 well plateに挿入して、upper compartmentに1.5 ml、lower compartmentに2.6 mlの培養液をそれぞれ加える。72時間毎に、それぞれの培養液を交換して21-28日間培養を続ける。その後、抵抗値が600 Ω・cm2を超えることでCaco-2細胞の単層形成を確認する。単層形成後、lower compartmentにはミツバチ産品由来の各sample solutionを2.6 mlずつ加え、72時間インキュベートする。72時間後、各細胞を回収し(4.25 x 106 cells) に10 μMのFITC-TGDK in PBS(-)もしくは抗GP2抗体を加え4 ℃で30 分間インキュベートし,cold washing buffer (500 μl)で2回洗浄した(first antibodyが抗GP-2抗体の場合、second antibodyにTRITC-conjugated Donkey anti-Rabbit IgGを加え4 ℃で30 分間インキュベートする)。得られた細胞をPBS(-) 500 μlで懸濁し,42 μm の網目のメッシュでろ過後,flow cytometor で解析した。その結果を図4(b)に示す。
【0048】
図4(b)に示すように、に示すように、コントロールと比較してpropolis溶液そしてloyal jelly溶液で処理した培養細胞に対してFITC-TGDKの結合をみたところ、TGDKが結合している細胞数が増加していることが示唆された。これらのことから、propolis溶液そしてloyal jelly溶液がM細胞分化誘導能を持つことが示唆された。すなわち、本実施形態に係るローヤルゼリー及び/又はプロポリスを有効成分として含有するM細胞分化誘導剤は、M細胞分化誘導能を有すると言える。
【0049】
〔ミツバチ産品由来のサンプルのM細胞内トランスサイトーシスへの影響〕
図5(a)に示すように、に示すように、ミツバチ産品由来の各sample solutionで3日間培養したM細胞のupper compartmentに100 μlの2% FCS培養液、lower compartmentに600 μlのfluorescent beads soln.を加え、upper compartmentから経時的(0 , 30 , 60 , 120 , 180 min)に培養液を回収した(回収するたびにupper compartmentに回収した量の培養液を加える)。その後、遠心にかけ、沈殿を30 μlの二次水で懸濁しFIA PLATE(BLACK , 384 wells)に25 μlずつapplyし、Microplate readerで蛍光を測定した。その結果を図5(b)に示す。
【0050】
図5(b)に示すように、4 ℃条件下で蛍光強度が上がらないことから、fluorescent beadsが拡散によりupper compartmentに移行していないと考えられる。60 min以降(37 ℃条件)では、特に花粉荷上清培養細胞そしてloyal jelly soln.培養細胞においてトランスサイトーシスを促進していることが示唆された。すなわち、本実施形態に係るローヤルゼリー及び/又は花粉荷を有効成分として含有する抗原取込促進剤は、M細胞の抗原取り込みを促進すると言える。
【0051】
次に、本実施形態に係る粘膜免疫賦活剤、M細胞分化誘導剤、抗原取込促進剤の具体的な調製方法について説明する。
【0052】
〔粘膜免疫賦活剤の調製例〕
乳糖を主成分とする賦形剤に、ミツバチ産品をそれぞれ添加して打錠することにより、以下の(1)〜(6)に示すミツバチ産品を含有する粘膜免疫賦活剤を調製した。
【0053】
(1)99gの賦形剤に、ローヤルゼリー1gを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリーを含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリーを含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤や、抗原取込促進剤としても利用することができる。
【0054】
(2)999gの賦形剤に、プロポリス1gを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてプロポリスを含有する粘膜免疫賦活剤を得た。なお、このプロポリスを含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤としても利用することができる。
【0055】
(3)99gの賦形剤に、花粉荷1gを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品として花粉荷を含有する粘膜免疫賦活剤を得た。なお、この花粉荷を含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、抗原取込促進剤としても利用することができる。
【0056】
(4)989gの賦形剤に、ローヤルゼリー10gと、プロポリス1gとを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリー及びプロポリスを含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリー及びプロポリスを含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤としても利用することができる。
【0057】
(5)989gの賦形剤に、ローヤルゼリー1gと、花粉荷10gとを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリー及び花粉荷を含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリー及び花粉荷を含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、抗原取込促進剤としても利用することができる。
【0058】
(6)979gの賦形剤に、ローヤルゼリー10gと、プロポリス1gと、花粉荷10gとを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリー、プロポリス及び花粉荷を含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリー、プロポリス及び花粉荷を含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤や、抗原取込促進剤としても利用することができる。
【0059】
上記(1)-(6)のように調製した粘膜免疫賦活剤、M細胞分化誘導剤や抗原取込促進剤は、ヒトや動物に対して経口投与しても良く、また、適宜溶媒に溶解して、試験試薬として用いるようにしても良い。
【0060】
上述してきたように、本実施形態に係る粘膜免疫賦活剤は、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有するため、粘膜免疫を有効に誘導することができる。
【0061】
また、本実施形態に係るM細胞分化誘導剤は、ローヤルゼリー及び/又はプロポリスを有効成分として含有するため、腸管上皮細胞に対して、M細胞分化誘導を行うことができる。また、これに伴い、粘膜免疫を有効に誘導することができる。
【0062】
また、本実施形態に係る抗原取込促進剤は、ローヤルゼリー及び/又は花粉荷を有効成分として含有することとしたため、M細胞の抗原取り込みを促進することができる。また、これに伴い、粘膜免疫を有効に誘導することができる。
【0063】
最後に、上述した各実施の形態の説明は本発明の一例であり、本発明は上述の実施の形態に限定されることはない。このため、上述した各実施の形態以外であっても、本発明に係る技術的思想を逸脱しない範囲であれば、設計等に応じて種々の変更が可能であることは勿論である。
【技術分野】
【0001】
本発明は、ミツバチ産品を利用した粘膜免疫賦活剤に関する。
【背景技術】
【0002】
従来より、感染症を予防する手段の一つとして、種々のワクチンが使用されている。これらのワクチンの大半は注射によるものであり、少なからずとも接種対象に侵襲を加えるものである。
【0003】
そこで、接種対象に侵襲を加えないワクチンとして、粘膜面にて抗原感作を行う粘膜ワクチンが知られている。しかし、粘膜ワクチンはpoliovirus(例えば、非特許文献1参照。)、Salmonella typhi、V. cholerae(例えば、非特許文献2参照。)、rotavirus(例えば、非特許文献3参照。)に対する経口ワクチンやinfluenza virusに対する経鼻ワクチン(例えば、非特許文献4参照。)などがアメリカなどで承認を受けているのみであり、注射によるワクチンに比して未だ一般的とは言い難い。
【0004】
粘膜ワクチンの開発が遅れている理由としては粘膜ワクチンの投与の問題と粘膜に分泌された抗体の定量が難しく正確に測定できず、粘膜のT細胞の回収と機能解析が困難であるなどの粘膜免疫応答の測定が複雑であることがあげられる。しかしながら粘膜感染症であるHIV-1を含め、粘膜からのウイルスの感染を阻害するような粘膜免疫を誘導するワクチンの開発が今後ますます要求されることが予想されている。
【0005】
ところで、粘膜面に抗体を誘導するためには、前述のように粘膜面での抗原感作が必要であり(例えば、非特許文献5参照。)、その粘膜面での抗原の取り込みに中心的な役割を果たす存在はM(microfold)細胞である(例えば、非特許文献6参照。)。
【0006】
M細胞は、他の上皮細胞とは異なり管腔側から抗原を取り込むために変則的で短い微絨毛を持ち、基底膜側にポケット状構造をとる(例えば、非特許文献7参照。)。さらに他の上皮細胞と比較して頂端膜側において糖衣を欠乏しアルカリフォスファターゼやイソスクロースマルターゼのような消化酵素の発現が減少しており(例えば、非特許文献8、9参照。)、管腔に曝露されやすくなり巨大な分子や微生物のM細胞への接近を容易にしている。
【0007】
例えば、マウスのM細胞では、reovirus 、rotavirusやpoliovirusといったウイルスやS,typhimurium、S.typhi、Y.enterocolitica、V. choleraeなどの微生物やUlex europaeus agglutinin-1(UEA-1)などのレクチン、ラテックスビーズなど様々な抗原を取り込むことが知られている。
【0008】
これらは、マウスM細胞に特異的に発現した受容体を介して取り込まれると考えられ、マウスM細胞に特異的に発現するといわれている分子としてはIntegrinβ1(例えば、非特許文献10参照。)やα-L-フコース(例えば、非特許文献11参照。)などがあげられ、実際に、Y.enterocoliticaのM細胞による取り込みにIntegrinβ1が関与しており(例えば、非特許文献12参照。)、UEA-1はα(1,2)-フコースを標的としている(例えば、非特許文献13参照。)。また、reovirus由来のσ1タンパク質はM細胞上のα(2,3)結合型のシアル酸を含んだ糖鎖構造に特異的に結合するといわれている(例えば、非特許文献14参照。)。
【0009】
これらのタンパク質を用いた粘膜ワクチンは強力な抗原特異的IgGと粘膜IgA応答に加えCTLの誘導に成功している(例えば、非特許文献15-18参照。)。さらに近年、FAEにのみ存在すると考えられていたM細胞が絨毛にも存在することが発見され(例えば、非特許文献19参照。)、FAEのM細胞と絨毛M細胞の両方を標的とすることでより効果的に粘膜免疫を誘導することができると考えられる。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Modlin, J. F. Poliomyelitis in the United States: the final chapter? Jama 292, 1749-51 (2004).
【非特許文献2】Levine, M. M. Immunization against bacterial diseases of the intestine. J Pediatr Gastroenterol Nutr 31, 336-55 (2000).
【非特許文献3】Kapikian, A. Z., Hoshino, Y., Chanock, R. M. & Perez-Schael, I. Efficacy of a quadrivalent rhesus rotavirus-based human rotavirus vaccine aimed at preventing severe rotavirus diarrhea in infants and young children. J Infect Dis 174 Suppl 1, S65-72 (1996)..
【非特許文献4】Belshe, R. B. et al. The efficacy of live attenuated, cold-adapted, trivalent, intranasal influenzavirus vaccine in children. N Engl J Med 338, 1405-12 (1998).
【非特許文献5】Lamm, M. E. Interaction of antigens and antibodies at mucosal surfaces. Annu Rev Microbiol 51, 311-40 (1997).
【非特許文献6】Owen, R. L. Sequential uptake of horseradish peroxidase by lymphoid follicle epithelium of Peyer's patches in the normal unobstructed mouse intestine: an ultrastructural study. Gastroenterology 72, 440-51 (1977).
【非特許文献7】Brayden, D. J., Jepson, M. A. & Baird, A. W. Keynote review: intestinal Peyer's patch M cells and oral vaccine targeting. Drug Discov Today 10, 1145-57 (2005).
【非特許文献8】El Bahi, S. et al. Lymphoepithelial interactions trigger specific regulation of gene expression in the M cell-containing follicle-associated epithelium of Peyer's patches. J Immunol 168, 3713-20 (2002).
【非特許文献9】Brown, D., Cremaschi, D., James, P. S., Rossetti, C. & Smith, M. W. Brush-border membrane alkaline phosphatase activity in mouse Peyer's patch follicle-associated enterocytes. J Physiol 427, 81-8 (1990).
【非特許文献10】Clark, M. A., Hirst, B. H. & Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect Immun 66, 1237-43 (1998).
【非特許文献11】Clark, M. A., Jepson, M. A., Simmons, N. L., Booth, T. A. & Hirst, B. H. Differential expression of lectin-binding sites defines mouse intestinal M-cells. J Histochem Cytochem 41, 1679-87 (1993).
【非特許文献12】Isberg, R. R. & Leong, J. M. Multiple beta 1 chain integrins are receptors for invasin, a protein that promotes bacterial penetration into mammalian cells. Cell 60, 861-71 (1990).
【非特許文献13】Sharma, R., Schumacher, U. & Adam, E. Lectin histochemistry reveals the appearance of M-cells in Peyer's patches of SCID mice after syngeneic normal bone marrow transplantation. J Histochem Cytochem 46, 143-8 (1998).
【非特許文献14】Helander, A. et al. The viral sigma1 protein and glycoconjugates containing alpha2-3-linked sialic acid are involved in type 1 reovirus adherence to M cell apical surfaces. J Virol 77, 7964-77 (2003).
【非特許文献15】Manocha, M. et al. Enhanced mucosal and systemic immune response with intranasal immunization of mice with HIV peptides entrapped in PLG microparticles in combination with Ulex Europaeus-I lectin as M cell target. Vaccine 23, 5599-617 (2005).
【非特許文献16】Wang, X. et al. Transgene vaccination using Ulex europaeus agglutinin I (UEA-1) for targeted mucosal immunization against HIV-1 envelope. Vaccine 23, 3836-42 (2005).
【非特許文献17】Wu, Y. et al. M cell-targeted DNA vaccination. Proc Natl Acad Sci U S A 98, 9318-23 (2001).
【非特許文献18】Wang, X., Hone, D. M., Haddad, A., Shata, M. T. & Pascual, D. W. M cell DNA vaccination for CTL immunity to HIV. J Immunol 171, 4717-25 (2003).
【非特許文献19】Jang, M. H. et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proc Natl Acad Sci U S A 101, 6110-5 (2004).
【発明の概要】
【発明が解決しようとする課題】
【0011】
しかしながら、前述のUEA-1などのレクチンは一般的にタンパク質であるため腸内で分解されやすく毒性があることが問題となっており、さらにM細胞は腸の上皮細胞のわずか0.00001%を構成しているのみであり、より効果的な粘膜ワクチンを作製するためには、ワクチン抗原をM細胞に効率よく送達させるために、分解されにくく毒性もないデリバリー分子の開発やM細胞を誘導する因子を用いて抗原の腸管腔からの取り込み効率を意図的にコントロールすることが必要不可欠である。
【0012】
このような状況において本発明者らは、M細胞の配備数と機能をコントロールできれば、免疫誘導と寛容の区別をコンロトールしながら効率的な粘膜免疫を誘導できる可能性があると考えた。
【0013】
また、生体に経口投与を行うことも想定し、毒性がなく、ヒトの食文化に古来より密接な関係を有する物品を中心に、粘膜免疫を誘導可能な物質のスクリーニングを行うべきであるとの考えに至った。
【0014】
特に本発明者らは、長年に亘り免疫に関連する研究分野に携わっており、M細胞を識別することにより腸管免疫を賦活可能な新規の物質として、TGDK-CH2-CH2-NH-Rの式で示される化合物を見出し、既に特許出願も行っている(国際公開WO2007/052641号)。
【0015】
そこで、これまでの研究の成果に基づき、上述のTGDK(tetragalloyl-D-lysine dendrimer)を構成しているgalloyl基と類似したポリフェノールを含有するミツバチ産品に着目し、粘膜免疫を誘導可能な物質の検討を行った。
【0016】
本発明は、かかる見地より完成されたものであって、ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供することを目的としている。
【0017】
また、併せて、ミツバチ産品を利用したM細胞分化誘導剤、抗原取込促進剤、M細胞分化誘導方法及びM細胞の抗原取込促進方法についても提供する。
【課題を解決するための手段】
【0018】
上記従来の課題を解決するために、請求項1に係る粘膜免疫賦活剤では、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することとした。
【0019】
また、請求項2に係るM細胞分化誘導剤では、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとした。
【0020】
また、請求項3に係る抗原取込促進剤では、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとした。
【0021】
また、請求項4に係るM細胞分化誘導方法では、請求項2に記載のM細胞分化誘導剤を腸管上皮細胞に接触させて、前記腸管上皮細胞の少なくとも一部をM細胞に分化させることとした。
【0022】
また、請求項5に係るM細胞の抗原取込促進方法では、請求項3に記載の抗原取込促進剤をM細胞に接触させて、M細胞の抗原取り込みを促進させることとした。
【発明の効果】
【0023】
請求項1に係る発明によれば、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することとしたため、ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供することができる。
【0024】
また、請求項2に係る発明によれば、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとしたため、腸管上皮細胞のM細胞分化を効率的に行うことができ、ミツバチ産品を利用したM細胞分化誘導剤を提供することができる。
【0025】
また、請求項3に係る発明によれば、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとしたため、ミツバチ産品を利用した抗原取込促進剤を提供することができる。
【0026】
また、請求項4に係る発明によれば、請求項2に記載のM細胞分化誘導剤を腸管上皮細胞に接触させて、前記腸管上皮細胞の少なくとも一部をM細胞に分化させることとしたため、ミツバチ産品を利用しつつ、腸管上皮細胞のM細胞分化を効率的に行うことができる。
【0027】
また、請求項5に係る発明によれば、請求項3に記載の抗原取込促進剤をM細胞に接触させて、M細胞の抗原取り込みを促進させることとしたため、ミツバチ産品を利用したM細胞の抗原取込促進方法を提供することができる。
【図面の簡単な説明】
【0028】
【図1】ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した試薬を示す説明図である。
【図2】ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した試薬の組成を示す説明図である。
【図3】ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した器具、装置類を示す説明図である。
【図4】ミツバチ産品由来のサンプルによるM細胞分化誘導実験の実験方法及び結果を示した説明図である。
【図5】ミツバチ産品由来のサンプルのM細胞内トランスサイトーシスへの影響の実験方法及び結果を示した説明図である。
【発明を実施するための形態】
【0029】
以下、本発明の実施形態について、具体的に説明する。
【0030】
本発明の目的の一つは、ミツバチ産品を利用した新たな粘膜免疫賦活剤を提供することにある。
【0031】
具体的には、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有することにより、本実施形態に係る粘膜免疫賦活剤を実現することができる。
【0032】
ここで、ミツバチ産品とは、養蜂において生産される産物のことであり、主に、蜂蜜、ローヤルゼリー、プロポリス、花粉荷を挙げることができる。特に、本発明に関連するローヤルゼリー、プロポリス、花粉荷は、具体的には下記の通りである。
【0033】
ローヤルゼリーは、働き蜂の唾液腺で生合成され、顎の外分泌腺から分泌される酸味のある乳白色クリーム状の物質である。また、プロポリスは、主に樹木の新芽や蕾、樹皮から採集したガム質、樹液、植物色素、香油等に、働き蜂の分泌物、蜂ろうなどを混合して作られた暗緑色や褐色から暗褐色を呈した粘着性のある樹脂状の固形物質である。また、花粉荷は、働き蜂が植物より採取した花粉と、働き蜂の分泌物とが混合された混合物である。
【0034】
粘膜免疫賦活剤を実現するにあたり、ローヤルゼリー、プロポリス、花粉荷は、いずれか1つを含有することとしても良く、また、複数を同時に混合するようにしても良い。
【0035】
また、本実施形態に係るM細胞分化誘導剤は、ローヤルゼリー及び/又はプロポリスを有効成分として含有することとしている。後に実験結果に基づいて述べるが、ローヤルゼリーやプロポリスは、M細胞の分化誘導能を有することが本発明者らの実験により示唆されており、これらを含有するM細胞分化誘導剤は、顕著なM細胞の分化誘導を示す。
【0036】
特に、M細胞は、粘膜面での抗原の取り込みに中心的な役割を果たす細胞であり、このM細胞が粘膜面にて増えることは、換言すれば、粘膜免疫を賦活することであると言える。
【0037】
また、本実施形態に係る抗原取込促進剤は、ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進することとしている。このM細胞の抗原取り込みについても後に実験結果に基づいて説明するが、ローヤルゼリーや花粉荷は、M細胞の抗原取り込みを促進することが本発明者らの実験により示唆されており、これらを含有する抗原取込促進剤は、顕著な抗原取込能の上昇を示す。
【0038】
また、この抗原取込促進剤についても、前述のM細胞分化誘導剤と同様に、粘膜免疫を賦活することであるとも言える。
【0039】
このように、本実施形態に係る粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤によれば、ローヤルゼリーやプロポリスによってM細胞の分化を促進し、また、ローヤルゼリーや花粉荷によってM細胞の抗原取込み能そのものを増大させることとなり、粘膜免疫を賦活させることができる。
【0040】
また、これらの粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤は、生体に対して使用しても良く、また、in vitroの実験等に用いられる薬剤として使用しても良い。
【0041】
すなわち、本発明に係るM細胞分化誘導方法は、前述のM細胞分化誘導剤を腸管上皮細胞に接触させることで実現することができ、また、本発明に係るM細胞の抗原取込促進方法は、前述の抗原取込促進剤をM細胞に接触させることで実現することができる。なお、これらのM細胞分化誘導剤や抗原取込促進剤を接触させる手段としては、特に限定されるものではない。例えば、ヒトや動物などでは経口投与して接触させることができ、また、in vitroの実験等で使用する場合には、適宜溶媒に溶解して用いることもできる。
【0042】
また、有効成分がミツバチ産品であることから、人体に対して安全であり、ヒトに対して経口投与しても良い。この場合、粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤は、医薬品としても良いが、普段の食生活から手軽に摂取できる健康食品としても、日々の健康増進の一環として有用である。
【0043】
以下、本実施形態に係る粘膜免疫賦活剤や、M細胞分化誘導剤、抗原取込促進剤、M細胞分化誘導方法、M細胞の抗原取込促進方法について、ミツバチ産品のM細胞誘導能とトランスサイトーシスへの影響を評価するための実験方法及び結果を示しながら、さらに具体的に説明する。
【0044】
〔実験材料〕
ミツバチ産品のM細胞誘導能検証実験、及び、トランスサイトーシスへの影響確認実験を行うにあたり使用した実験材料は、図1-図3に示すとおりである。なお、試薬はすべて特級、培養用またはそれに準ずるものを用いている。また、培養試薬は無菌的に調製し保存した。
【0045】
また、ミツバチ産品の検体溶液を下記の(1)-(5)の通り調製した。
(1)花粉荷上清(1 % , 5 % , 10 %)
花粉荷1 gをEMEM培地5 mlで溶解し1.5 mlエッペンドルフチューブに分注後、遠心をおこない、上清のみを用いた。
(2)0.45 μm≧花粉荷溶液(1 % , 5 % , 10 %)
花粉荷溶液を0.45 μmフィルターでろ過した溶液を用いた。
(3)0.80 μm≧花粉荷溶液(1 % , 5 % , 10 %)
花粉荷溶液を0.80 μmフィルターでろ過した溶液を用いた。
(4)Propolis溶液(1 % , 0.5 % , 0.1 %)
Propolis原液の溶媒であるethanolをspeed backにより気化させ、propolis結晶をDMSOで555.6 μg/μlとなるように溶解したものを用いた。
(5)Loyal jelly溶液 (1 % , 0.5 % , 0.1 %)
8.5 μgのLoyal jelly dry powderを100 μlのDMSOで溶解したものを用いた。
【0046】
また、以下の実験では、ヒト腸管上皮細胞由来のCaco-2を用いた。ヒト腸管上皮細胞由来のCaco-2は付着系細胞であり、2 % FCSを含むEMEM培地に2 mMのL-glutamine、0.1 mMの非必須アミノ酸を加えたものを用いた。細胞は、37 ℃、5 % CO2存在下でtissue culture flask内で対数増殖の範囲内 (2.0×105-1.0×106 cells/ml)で継代培養を行った。なお、細胞濃度はtrypan blue染色法により、生細胞数と死細胞数とをカウントして求めた。
【0047】
〔ミツバチ産品由来のサンプルによるM細胞分化誘導実験〕
図4(a)に示すように、Caco-2細胞(4.25×106 cells/1 ml)をtranswellの膜上に播種後、16時間培養する。16時間後transwell insertを6 well plateに挿入して、upper compartmentに1.5 ml、lower compartmentに2.6 mlの培養液をそれぞれ加える。72時間毎に、それぞれの培養液を交換して21-28日間培養を続ける。その後、抵抗値が600 Ω・cm2を超えることでCaco-2細胞の単層形成を確認する。単層形成後、lower compartmentにはミツバチ産品由来の各sample solutionを2.6 mlずつ加え、72時間インキュベートする。72時間後、各細胞を回収し(4.25 x 106 cells) に10 μMのFITC-TGDK in PBS(-)もしくは抗GP2抗体を加え4 ℃で30 分間インキュベートし,cold washing buffer (500 μl)で2回洗浄した(first antibodyが抗GP-2抗体の場合、second antibodyにTRITC-conjugated Donkey anti-Rabbit IgGを加え4 ℃で30 分間インキュベートする)。得られた細胞をPBS(-) 500 μlで懸濁し,42 μm の網目のメッシュでろ過後,flow cytometor で解析した。その結果を図4(b)に示す。
【0048】
図4(b)に示すように、に示すように、コントロールと比較してpropolis溶液そしてloyal jelly溶液で処理した培養細胞に対してFITC-TGDKの結合をみたところ、TGDKが結合している細胞数が増加していることが示唆された。これらのことから、propolis溶液そしてloyal jelly溶液がM細胞分化誘導能を持つことが示唆された。すなわち、本実施形態に係るローヤルゼリー及び/又はプロポリスを有効成分として含有するM細胞分化誘導剤は、M細胞分化誘導能を有すると言える。
【0049】
〔ミツバチ産品由来のサンプルのM細胞内トランスサイトーシスへの影響〕
図5(a)に示すように、に示すように、ミツバチ産品由来の各sample solutionで3日間培養したM細胞のupper compartmentに100 μlの2% FCS培養液、lower compartmentに600 μlのfluorescent beads soln.を加え、upper compartmentから経時的(0 , 30 , 60 , 120 , 180 min)に培養液を回収した(回収するたびにupper compartmentに回収した量の培養液を加える)。その後、遠心にかけ、沈殿を30 μlの二次水で懸濁しFIA PLATE(BLACK , 384 wells)に25 μlずつapplyし、Microplate readerで蛍光を測定した。その結果を図5(b)に示す。
【0050】
図5(b)に示すように、4 ℃条件下で蛍光強度が上がらないことから、fluorescent beadsが拡散によりupper compartmentに移行していないと考えられる。60 min以降(37 ℃条件)では、特に花粉荷上清培養細胞そしてloyal jelly soln.培養細胞においてトランスサイトーシスを促進していることが示唆された。すなわち、本実施形態に係るローヤルゼリー及び/又は花粉荷を有効成分として含有する抗原取込促進剤は、M細胞の抗原取り込みを促進すると言える。
【0051】
次に、本実施形態に係る粘膜免疫賦活剤、M細胞分化誘導剤、抗原取込促進剤の具体的な調製方法について説明する。
【0052】
〔粘膜免疫賦活剤の調製例〕
乳糖を主成分とする賦形剤に、ミツバチ産品をそれぞれ添加して打錠することにより、以下の(1)〜(6)に示すミツバチ産品を含有する粘膜免疫賦活剤を調製した。
【0053】
(1)99gの賦形剤に、ローヤルゼリー1gを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリーを含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリーを含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤や、抗原取込促進剤としても利用することができる。
【0054】
(2)999gの賦形剤に、プロポリス1gを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてプロポリスを含有する粘膜免疫賦活剤を得た。なお、このプロポリスを含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤としても利用することができる。
【0055】
(3)99gの賦形剤に、花粉荷1gを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品として花粉荷を含有する粘膜免疫賦活剤を得た。なお、この花粉荷を含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、抗原取込促進剤としても利用することができる。
【0056】
(4)989gの賦形剤に、ローヤルゼリー10gと、プロポリス1gとを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリー及びプロポリスを含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリー及びプロポリスを含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤としても利用することができる。
【0057】
(5)989gの賦形剤に、ローヤルゼリー1gと、花粉荷10gとを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリー及び花粉荷を含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリー及び花粉荷を含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、抗原取込促進剤としても利用することができる。
【0058】
(6)979gの賦形剤に、ローヤルゼリー10gと、プロポリス1gと、花粉荷10gとを添加して混合し、この混合物を打錠機に供することにより、ミツバチ産品としてローヤルゼリー、プロポリス及び花粉荷を含有する粘膜免疫賦活剤を得た。なお、このローヤルゼリー、プロポリス及び花粉荷を含有する粘膜免疫賦活剤は、前述の試験結果からもわかるように、M細胞分化誘導剤や、抗原取込促進剤としても利用することができる。
【0059】
上記(1)-(6)のように調製した粘膜免疫賦活剤、M細胞分化誘導剤や抗原取込促進剤は、ヒトや動物に対して経口投与しても良く、また、適宜溶媒に溶解して、試験試薬として用いるようにしても良い。
【0060】
上述してきたように、本実施形態に係る粘膜免疫賦活剤は、ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有するため、粘膜免疫を有効に誘導することができる。
【0061】
また、本実施形態に係るM細胞分化誘導剤は、ローヤルゼリー及び/又はプロポリスを有効成分として含有するため、腸管上皮細胞に対して、M細胞分化誘導を行うことができる。また、これに伴い、粘膜免疫を有効に誘導することができる。
【0062】
また、本実施形態に係る抗原取込促進剤は、ローヤルゼリー及び/又は花粉荷を有効成分として含有することとしたため、M細胞の抗原取り込みを促進することができる。また、これに伴い、粘膜免疫を有効に誘導することができる。
【0063】
最後に、上述した各実施の形態の説明は本発明の一例であり、本発明は上述の実施の形態に限定されることはない。このため、上述した各実施の形態以外であっても、本発明に係る技術的思想を逸脱しない範囲であれば、設計等に応じて種々の変更が可能であることは勿論である。
【特許請求の範囲】
【請求項1】
ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有する粘膜免疫賦活剤。
【請求項2】
ローヤルゼリー及び/又はプロポリスを有効成分として含有するM細胞分化誘導剤。
【請求項3】
ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進する抗原取込促進剤。
【請求項4】
請求項2に記載のM細胞分化誘導剤を腸管上皮細胞に接触させて、前記腸管上皮細胞の少なくとも一部をM細胞に分化させるM細胞分化誘導方法。
【請求項5】
請求項3に記載の抗原取込促進剤をM細胞に接触させて、M細胞の抗原取り込みを促進させる、M細胞の抗原取込促進方法。
【請求項1】
ローヤルゼリー、プロポリス、花粉荷から選ばれる少なくともいずれか1つのミツバチ産品を有効成分として含有する粘膜免疫賦活剤。
【請求項2】
ローヤルゼリー及び/又はプロポリスを有効成分として含有するM細胞分化誘導剤。
【請求項3】
ローヤルゼリー及び/又は花粉荷を有効成分として含有し、M細胞の抗原取り込みを促進する抗原取込促進剤。
【請求項4】
請求項2に記載のM細胞分化誘導剤を腸管上皮細胞に接触させて、前記腸管上皮細胞の少なくとも一部をM細胞に分化させるM細胞分化誘導方法。
【請求項5】
請求項3に記載の抗原取込促進剤をM細胞に接触させて、M細胞の抗原取り込みを促進させる、M細胞の抗原取込促進方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−84525(P2011−84525A)
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願番号】特願2009−239219(P2009−239219)
【出願日】平成21年10月16日(2009.10.16)
【出願人】(504159235)国立大学法人 熊本大学 (314)
【Fターム(参考)】
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願日】平成21年10月16日(2009.10.16)
【出願人】(504159235)国立大学法人 熊本大学 (314)
【Fターム(参考)】
[ Back to top ]

