融合蛋白質
【課題】 自己抗体を特異的に抑制することができ、自己抗体性自己免疫疾患を効果的に予防または治療することができる融合蛋白質を提供する。
【解決手段】 自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とからなることを特徴とする融合蛋白質。この融合蛋白質は、蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることによって製造される。
【解決手段】 自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とからなることを特徴とする融合蛋白質。この融合蛋白質は、蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることによって製造される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、自己抗体を中和しかつ自己抗体の産生を阻害することによって、重症筋無力症などの自己抗体性自己免疫疾患を効果的に予防・治療することができる融合蛋白質に関する。
【背景技術】
【0002】
免疫系は、本来、細菌やウイルスなどの自己と異なる異物を認識し排除するための役割を持つが、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことがある。自己免疫疾患は、このような状態によって生ずる疾患の総称であり、この中でも自己抗体(自分自身の細胞や組織を抗原として認識する抗体)が自己抗原(自分自身の細胞や組織)と反応することで生ずる疾患を自己抗体性自己免疫疾患と称している。自己抗体性自己免疫疾患としては、例えば、重症筋無力症、自己免疫性溶血性貧血、特発性血小板減少性紫斑病、自己免疫性好中球減少症、抗TSH抗体が原因の甲状腺機能亢進症、自己抗体性急性脳炎、橋本脳症、非ヘルペス性辺縁系脳炎等が挙げられる。
【0003】
自己抗体性自己免疫疾患の治療方法としては、ステロイド剤や免疫抑制剤の投与が従来より行われているが、これらの薬剤はいずれも、自己抗体を特異的に抑制するものではなく、免疫反応を一般的に抑制するものであるため、特異性がなく、十分効果的な治療方法とは言えない。
【0004】
自己免疫疾患の代表例の一つである重症筋無力症についても、それを根幹から治療するための既存の治療薬はなく、上述のステロイド剤や免疫抑制剤の他、コリンエステラーゼ阻害薬が主として使用されているに過ぎない(非特許文献1)。特に、コリンエステラーゼ阻害薬の使用については、その用量設定が難しいという問題がある。また、血漿交換療法も用いられているが、1回の治療に100万円以上の多額の費用が発生する。一方、包括医療制度により重症筋無力症の治療費として補助される金額は60万円程であり、医療現場での負担も大きい。しかも、血漿交換療法は、効果が1ヶ月程度しか持続しないという問題がある。また、胸腺摘出術も用いられ、一定の効果を上げているものの、摘出術に対する患者の不安感や、費用面の問題があり、さらには、免疫機構が未発達な小児や免疫不全患者などには適用できないという問題がある。
【0005】
近年、重症筋無力症の治療方法として、ガンマグロブリン製剤の有効性が確認され、一部の製薬メーカーにおいては臨床試験も行っている(非特許文献2)。しかし、ガンマグロブリン製剤は、ヒト血漿由来の生物学的製剤であるため、未知のウイルスなどによる感染リスク等が考えられる。また、ガンマグロブリン製剤の投与量は大量であり、たとえ実現されたとしても、患者や医療現場における費用的・時間的負担は相当大きいものと予想される。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】日本臨床 66巻6号 第1155頁〜第1157頁 重症筋無力症 治験研究動向
【非特許文献2】神経治療 Vol.25 No.6 第689頁〜第692頁 免疫グロブリン大量療法
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、かかる従来技術の現状に鑑み創案されたものであり、その目的は、自己抗体を特異的に抑制することができ、自己抗体性自己免疫疾患を効果的に予防または治療することができる融合蛋白質およびその製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者は、自己抗体性自己免疫疾患の治療方法として、まず、自己抗体のみに反応する抗体を組換え蛋白質において作製し、この抗体を患者に投与し、患者の体内の自己抗体をこの抗体と結合させて分解することを想起した。しかしながら、自己抗体性自己免疫疾患の自己抗体は特定の一つの抗体ではなく、種々の抗体群から成り立っているため、これらの種々の抗体群の全てに対して反応するイディオタイプ抗体の作製は、極めて困難であり、この方法は実現可能性が低いと考えられた。
【0009】
そこで、本発明者は、自己抗体性自己免疫疾患の治療方法として、自己抗体に反応する抗体を使用するのではなく、自己抗体によって認識される自己抗原を組換え蛋白質において作製し、この人工自己抗原を囮(デコイ)として患者に投与して、患者の体内の自己抗体をこの人工自己抗原と結合させることによって、自己抗体を中和し、自己抗体が患者自身の自己抗原とは反応しないようにすることができることを見出した。そして更に、この人工自己抗原を抗体重鎖定常領域と融合させておくことによって自己抗体の産生も特異的に阻害することができることを見出し、本発明の完成に至った。
【0010】
即ち、本発明によれば、自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とからなることを特徴とする融合蛋白質が提供される。
【0011】
また、本発明によれば、蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることを特徴とする上記融合蛋白質の製造方法、および上記融合蛋白質を有効成分として含有することを特徴とする自己抗体性自己免疫疾患の予防・治療用組成物が提供される。
【発明の効果】
【0012】
本発明の融合蛋白質は、自己抗体性自己免疫疾患の患者の体内に存在する自己抗体を中和し、かつ自己抗体の産生を阻害することによって、自己抗体を特異的に抑制することができる。従って、本発明の融合蛋白質を使用すれば、重症筋無力症を始めとする種々の自己抗体性自己免疫疾患を効果的に予防・治療することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、実施例で作成した融合蛋白質(α1−Fc)を発現させるためのベクターpcDNA3.1−AChR−Fcの模式図である。
【図2】図2は、精製した融合蛋白質(α1−Fc)の非還元状態および還元状態におけるSDS−PAGE後の銀染色像(左側)、およびウェスタンブロッティング像(右側)を示す。
【図3】図3は、ハイブリドーマMab35への融合蛋白質α1−Fcの結合を示す。融合蛋白質α1−Fc添加濃度(μg/mL)は、Aが無添加、Bが0.1、Cが0.36、Dが1、Eが3.6、Fが10、Gが36およびHが100である。
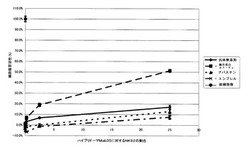
【図4】図4は、ハイブリドーマMab35に対する融合蛋白質α1−FcのADCC活性を示す。横軸にターゲット細胞であるハイブリドーマMab35に対するエフェクター細胞であるNK92の割合を、縦軸に細胞障害活性(%)をそれぞれ示す。◆は抗体無添加時の細胞傷害活性を示し、■は融合蛋白質α1−Fcの添加時の細胞傷害活性を示し、▲はアバスチンの添加時の細胞傷害活性を示し、×はエンブレルの添加時の細胞障害活性を示す。●は総細胞数を示す。
【発明を実施するための形態】
【0014】
本発明の融合蛋白質は、自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とが融合されたものである。蛋白質(X)は、自己抗体に対する自己抗原、またはその一部に相当し、患者の自己抗原の代わりに自己抗体と結合する囮(デコイ)としての役割を有する。即ち、本発明の融合蛋白質が自己抗体性自己免疫疾患の患者に投与されると、患者の体内の自己抗体は、融合蛋白質のうち蛋白質(X)の部分を自己抗原として認識してこの部分に結合する。結合した自己抗体は、患者の体内に本来存在する自己抗原ともはや結合することができないので、この方法によって自己抗体を中和することができ、自己抗体と患者の自己抗原との結合による自己免疫疾患の症状の発生を抑制することができる。自己抗体は、特定の一つの抗体ではなく種々の抗体群から成り立っているが、いずれの抗体も自己抗原を認識する機能を有する点では共通する。従って、自己抗原の囮となる本発明の融合蛋白質を使用すれば、種々の抗体群に対して個別の融合蛋白質を作成しなくても、一つの融合蛋白質で種々の抗体群を中和することができる。
【0015】
本発明の融合蛋白質は、自己抗原の囮となる蛋白質(X)に加えて、抗体重鎖定常領域のフラグメントを含む蛋白質(A)も含む。この蛋白質(A)は、抗体依存性細胞傷害活性(ADCC活性)を発揮する役割を有する。自己抗体は、血中のB細胞で産生されるが、このB細胞の表面には、自己抗体と同じ抗原結合部位を持つ細胞表面提示型の抗体がB細胞受容体として存在している。従って、本発明の融合蛋白質が患者に投与されると、そのうちのいくつかは患者の体内の自己抗体と上述のように結合するが、いくつかは、自己抗体を産生するB細胞の表面の抗体(B細胞受容体)に結合する。B細胞受容体に本発明の融合蛋白質が結合すると、NK細胞などのエフェクター細胞がそのFc受容体を介して融合蛋白質中の蛋白質(A)の部分に結合し、抗体依存性細胞傷害活性(ADCC活性)を発揮し、融合蛋白質に結合したB細胞を攻撃して死滅させる。このように、本発明によれば、体内に存在する自己抗体を中和して自己抗体の自己抗原への結合を防止するのみならず、自己抗体の産生源である特定B細胞をも選択的に死滅させることができる。従って、本発明の融合蛋白質は、自己抗体の産生阻害、および産生された自己抗体の中和という二つの方法で、自己抗体性自己免疫疾患を予防または治療することができる。
なお、本発明の融合蛋白質と同様に囮(デコイ)を使用する考え方として、ガーショニ、ジョナサン・エムによる特表平2−502538号には分子状デコイアントが開示されている。この分子状デコイアントは、好ましくない作用を示す異物に対する天然の受容体の最小部分断片に相当し、外来性抗原とデコイアントの競合作用により、外来性抗原の生体受容体への結合を抑制しようとするものである。特表平2−502538号では、上記異物は、ウイルス、バクテリア、毒素などの外来性抗原であるとされており、自己抗体については何ら記載されていない。また、特表平2−502538号の分子状デコイアントは、単独で使用されており、抗体重鎖定常領域と結合されていない。
また、B細胞を死滅させる考え方として、アナンド・アイヤーらによる特表2008−515926号には、B細胞表面抗原に対する抗体に細胞毒性物質を付加した複合体を自己免疫疾患の患者に投与することによってB細胞を死滅させることが開示されている。この複合体は、B細胞を死滅させることはできるが、産生された自己抗体を中和することはできず、自己抗体に対しては別途、抗サイトカイン剤を投与する必要があるとされている。
【0016】
本発明の融合蛋白質中の蛋白質(X)は、予防または治療対象の自己抗体性自己免疫疾患の原因となる自己抗体に対する自己抗原またはその一部に相当し、予防または治療対象の自己免疫疾患に応じて決まる。例えば、重症筋無力症の予防・治療の場合、重症筋無力症は、神経伝達物質であるアセチルコリンの筋肉側における受け皿であるニコチン性アセチルコリン受容体(自己抗原)に抗ニコチン性アセチルコリン受容体抗体(自己抗体)が結合してアセチルコリンによる神経・筋伝達を阻害することによって生じる疾患であるので、蛋白質(X)は、自己抗原のニコチン性アセチルコリン受容体であることができる。同様に、自己免疫性溶血性貧血の予防・治療の場合、蛋白質(X)は、赤血球表面マーカーであることができ、特発性血小板減少性紫斑病の予防・治療の場合、蛋白質(X)は、血小板表面マーカーであることができ、自己免疫性好中球減少症の予防・治療の場合、蛋白質(X)は、好中球表面マーカーであることができ、抗TSH抗体が原因の甲状腺機能亢進症の予防・治療の場合、蛋白質(X)は、TSHであることができ、原発性甲状腺機能低下症(橋本病)の予防・治療の場合、蛋白質(X)は、甲状腺表面マーカーであることができ、自己抗体性脳炎・脳症の予防・治療の場合、蛋白質(X)は、NMDA受容体、AMPA受容体などであることができる。
【0017】
蛋白質(X)は、これらの受容体やマーカー全体である必要はなく、自己抗体の認識部位を含んでさえいればその一部であってもよい。例えば、重症筋無力症の場合、上述のニコチン性アセチルコリン受容体は、いくつかのサブユニットからなる多量体蛋白質であり、自己抗体の認識部位は、その中でもα1サブユニットのアイソフォーム1(骨格筋でのみ発現されるアイソフォームであり、配列番号4で示される)、アイソフォーム2(骨格筋、脳、心臓、腎臓、肺臓で発現されるアイソフォームであり、配列番号5で示される)のN末端細胞外領域に存在する。従って、重症筋無力症の場合、蛋白質(X)は、ニコチン性アセチルコリン受容体α1(nAChRα1)サブユニットまたはその一部であることができ、より具体的にはnAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2、またはそれらの一部であることができ、さらに具体的にはnAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2のN末端細胞外領域のアミノ酸配列からなることができる。
【0018】
これらのアミノ酸配列には、その相同性が損なわれない範囲で、1個または数個(例えば1〜20個、好ましくは1〜10個、さらに好ましくは1〜7個)のアミノ酸が欠失、付加、および/または置換されていてもよい。その範囲としては、例えば、70%以上、好ましくは80%以上、さらに好ましくは90%以上の配列の同一性を有するものが挙げられる。アミノ酸配列の相同性は、相同性計算アルゴリズムNCBI BLAST(National Center for Biotechnology Information Basic Local Alignment Search Tool)を用いて、以下の条件(期待値=10;ギャップを許す;マトリクス=BLOSUM62;フィルタリング=OFF)で計算することができる。具体的には、このような欠失、付加、および/または置換が導入されたアミノ酸配列は、例えばサイトダイレクテドミュータジェネシスキット(タカラバイオ製)や、QuickChange Site−Directed Mutagenesis Kit(STRATAGENE製)等の市販キットを用いて対応するDNA配列を置換することにより容易に得ることができる。
【0019】
本発明の融合蛋白質中の蛋白質(A)は、抗体重鎖定常領域のフラグメントを含む蛋白質であり、例えば抗体重鎖のヒンジ領域以下(Fc領域)、抗体重鎖CH1領域またはそれらの一部であることができる。抗体重鎖のヒンジ領域以下(Fc領域)としては、具体的には、配列番号1または配列番号2のアミノ酸配列を挙げることができる。配列番号1,2はいずれもヒトのFc領域の配列であり、配列番号1は、アジア人に多いタイプ、配列番号2は、欧米人に多いタイプである。
【0020】
本発明の融合蛋白質の具体例としては、例えば配列番号3のアミノ酸配列からなる蛋白質が挙げられる。この融合蛋白質は、蛋白質(X)がnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域のアミノ酸配列(配列番号4の第1位〜第210位のアミノ酸からなるアミノ酸配列)であり、蛋白質(A)が配列番号1のアミノ酸配列である場合に相当する。このアミノ酸配列も、上述の通り、その相同性が損なわれない範囲で、1個または数個(例えば1〜20個、好ましくは1〜10個、さらに好ましくは1〜7個)のアミノ酸が欠失、付加、または/および置換されていてもよい。
【0021】
本発明の融合蛋白質は、従来公知の遺伝子工学的手法によって製造することができ、例えば、蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを必要によりそれぞれ増幅しておき、これらのDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることによって製造することができる。DNAの増幅は、例えばPCR法によって行うことができ、増幅したDNAの結合は、例えばOverlap extension PCR法によって行うことができる。発現ベクターは、発現効率を向上させるためのCMVやSV40等のプロモーターや、発現された融合蛋白質の回収を容易にするための抗体重鎖シグナル配列、膜蛋白質シグナル配列、抗体κ鎖シグナル配列などの分泌シグナル配列を備えていることが好ましい。宿主細胞としては、例えば酵母、動物細胞、昆虫細胞、植物細胞などを使用することができ、その中でも動物細胞、特にCHO細胞、HEK293細胞などが好ましい。発現させた融合蛋白質は、常法により回収し、Protein Aカラム等を用いて精製すればよい。
【0022】
次に、本発明の融合蛋白質を有効成分として含有することを特徴とする自己抗体性自己免疫疾患の予防・治療用組成物について説明する。かかる組成物の具体的な製剤形態としては、注射剤、坐剤等を挙げることができる。注射剤の場合は、上述のようにして得られた本発明の融合蛋白質に糖類、ポリオール、アルブミン、界面活性剤等の安定化剤、塩類等の等張化剤等を添加し、凍結乾燥して保存しておき、使用時に注射用水に溶解して投与すればよい。凍結乾燥品中の本発明の融合蛋白質の含有量は特に限定されないが、例えば0.01〜200mg/g、好ましくは0.1〜100mg/gである。また、溶解された注射剤中の本発明の融合蛋白質の含有量は特に限定されないが、例えば0.01〜200mg/mL、好ましくは0.1〜100mg/mLである。注射剤の場合の投与方法としては、静脈内投与、筋肉内投与、皮下投与等が挙げられる。坐剤の場合は、例えば、本発明の融合蛋白質を通常の坐剤用基剤に混合して製剤化し、直腸より投与すればよい。坐剤中の本発明の融合蛋白質の含有量は特に限定されないが、例えば0.1〜300mg/mL、好ましくは0.5〜100mg/mLである。本発明の組成物の投与量は、目的とする治療効果、投与方法、治療期間、年齢、体重等により異なるが、通常成人一日当たり10μg/kg〜50mg/kgである。
【0023】
本発明の組成物が自己抗体性自己免疫疾患の患者に投与されると、組成物中の本発明の融合蛋白質が体液流に乗って体内に分配される。そして、融合蛋白質が自己抗体と出会うと、自己抗体は融合蛋白質の蛋白質(X)の部分(自己抗体によって認識される部位)に結合するので、この自己抗体はもはや患者自身の自己抗原とは反応できなくなる。また、本発明の融合蛋白質が、自己抗体を産生するB細胞に出会うと、融合蛋白質はこのB細胞の表面の抗体(B細胞受容体)に結合される。この結合が生じると、融合蛋白質の蛋白質(A)の部分(抗体重鎖定常領域のフラグメント)にNK細胞などのエフェクター細胞が結合し、抗体依存性細胞傷害活性(ADCC活性)を発揮し、融合蛋白質に結合されたB細胞を攻撃して死滅させる。このように、本発明によれば、自己抗体を中和して自己抗体の自己抗原への結合を防止するのみならず、自己抗体の産生源である特定B細胞をも選択的に死滅させることができる。従って、本発明の融合蛋白質、およびかかる融合蛋白質を含む組成物は、例えば重症筋無力症等の自己抗体性自己免疫疾患の予防・治療薬として効果を発揮すると期待できる。
【実施例】
【0024】
以下に、実施例により本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではない。
【0025】
(1)融合蛋白質の製造
ヒト末梢血リンパ球(PBL)のcDNAを鋳型とし、配列番号8および配列番号9のDNA配列をプライマーとし、東洋紡績(株)の遺伝子増幅キット「KOD−plus−Ver.2」(カタログ番号:KOD−211)を用いて、ヒト抗体重鎖シグナル配列(分泌シグナル配列)の遺伝子を増幅した。
【0026】
増幅した遺伝子について、インビトロジェン社のクローニングキット「Zero Blunt TOPO PCR Cloning Kit for Sequence」(カタログ番号:K2895−20)を用いてクローニングを行い、遺伝子配列の解析を行った。その後、インビトロジェン社の発現ベクター「pcDNA3.1(+)ベクター」(カタログ番号:V790−20)をNEB社の制限酵素NheI(カタログ番号:R0131)、EcoRI(カタログ番号:R0101)で処理し、増幅した抗体重鎖シグナル配列(分泌シグナル配列)を発現ベクターに挿入した。
【0027】
次に、Open Biosystems社から取り寄せたヒトnAChRα1サブユニットのcDNA(カタログ番号:MHS1011−61598)を鋳型とし、配列番号10および配列番号11のDNA配列をプライマーとし、東洋紡績(株)の「KOD−plus−Ver.2」を用いて、ヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域の遺伝子を増幅した。増幅された遺伝子は、配列番号4のアミノ酸配列の第1位〜第210位に相当する。このアミノ酸配列を配列番号6に示す。
【0028】
一方、ヒト末梢血リンパ球(PBL)のcDNAを鋳型とし、配列番号12および配列番号13のDNA配列をプライマーとし、PCRによって、ヒト抗体重鎖Fc領域の遺伝子を増幅した。増幅した遺伝子について、インビトロジェン社の「Zero Blunt TOPO Cloning Kit For Sequence」を用いてクローニングを行い、遺伝子配列の解析を行った。その結果、配列番号1および配列番号2のアミノ酸配列をコードする二種類のヒト抗体重鎖Fc領域の遺伝子が得られたことが判明した。
【0029】
このようにして得られたヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域の遺伝子およびヒト抗体重鎖Fc領域の遺伝子を混ぜ合わせ、配列番号10および配列番号13のDNA配列をプライマーとし、Overlap extension PCR法によって遺伝子を増幅し、ヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域とヒト抗体重鎖Fc領域とを一本鎖でコードする遺伝子配列を作製した。作製された遺伝子配列に相当するアミノ酸配列を配列番号3および7に示す。配列番号3は、ヒト抗体重鎖Fc領域が配列番号1のアミノ酸であるものに相当し、配列番号7は、ヒト抗体重鎖Fc領域が配列番号2のアミノ酸であるものに相当する。
【0030】
作製した遺伝子配列についてインビトロジェン社の「Zero Blunt TOPO Cloning Kit for Sequence」を用いてクローニングを行い、遺伝子配列の解析を行った。その後、予め分泌シグナル配列を挿入しておいたpcDNA3.1ベクターをNEB社の制限酵素PpuMI(カタログ番号:R0506)、PmeI(カタログ番号:R0560)で処理して、作製した遺伝子配列を挿入し、ヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域とヒト抗体重鎖Fc領域とからなる融合蛋白質(α1−Fc)を発現させるためのベクターを得た。得られたベクターの模式図を図1に示す。
【0031】
次に、インビトロジェン社の発現系「Free Style MAX 293 Expression System」(カタログ番号:K9000−10)を用いて、得られたベクターをHEK293細胞に導入して融合蛋白質α1−Fcを発現させ、GEヘルスケア社の精製カラム「HiTrap Protein A HP Column」(カタログ番号:17−0402−01)を用いて精製し、融合蛋白質α1−Fcを得た。
【0032】
融合蛋白質の発現確認は、SDS−PAGE後、銀染色並びにウェスタンブロッティングにより行った。ウェスタンブロッティングにはHRP標識抗ヒトIgG抗体を用いた。その結果を図2に示す。図2中の矢印で示されるバンドが、融合蛋白質α1−Fcに相当する。
【0033】
(2)融合蛋白質の自己抗体に対する反応性の確認
ラットnAChRに対する自己抗体である抗nAChR自己抗体mAb35を産生するハイブリドーマMab35(ATCC番号:TIB−175)を培養し、その培養上清からGEヘルスケア社の精製カラム「HiTrap Protein G HP column」(カタログ番号:17−0404−01)を用いて抗nAChR自己抗体mAb35を精製した。この抗体は、ラットのみならず、マウスおよびヒトに対しても交差反応性を示す抗体であることがTzartosらによって報告されている(J.Neuroimmunol,1987;15,185−94))。
【0034】
次に、精製した抗nAChR自己抗体を様々な濃度でELISAプレートに固相化し、ブロッキングを行った。その後、(1)で作製した融合蛋白質α1−Fcを反応させ、フナコシ社のELISA定量キット「IgG(Fc),Human,ELISA Quantitation Kit」(カタログ番号:E80−104)に付属のHRP標識抗ヒトFc抗体で処理し、フナコシ社の基質溶液「TMB Solution」(カタログ番号:N301)を基質として反応させて、1%硫酸で反応を停止させた。その後、波長450nmでの吸光度を測定した。
【0035】
その結果を以下の表1に示す。表1から明らかなように、自己抗体の濃度が増大するにつれて吸光度が増大しており、自己抗体の濃度に依存して融合蛋白質が自己抗体と反応していることが確認された。
【0036】

【0037】
(3)ハイブリドーマMab35への融合蛋白質α1−Fcの結合の確認
自己抗体は生体内ではB細胞で産生され、自己抗体を産生するB細胞の細胞表面には、自己抗体と同じ抗体が細胞膜上にB細胞受容体として提示されている。(2)で使用したハイブリドーマMab35は抗nAChR自己抗体を産生するため、ハイブリドーマMab35においてもB細胞と同様に細胞表面上に自己抗体を提示していると考えられる。そこで、融合蛋白質α1−FcがハイブリドーマMab35へ結合するかどうかを確認した。
【0038】
HBSS/BSAで洗浄した1×105個のハイブリドーマMab35に、(1)で作製した融合蛋白質α1−Fcを様々な濃度で添加した。次にJackson Immuno Research LABORATORIES社のPE標識抗ヒトIgG抗体(カタログ番号:109−116−170)を添加し、HBSS/BSAで洗浄し、融合蛋白質とハイブリドーマとの結合をフローサイトメーターで測定した。
【0039】
その結果を図3に示す。図3から、融合蛋白質α1−Fcが濃度依存的にハイブリドーマMab35と結合していることが明らかである。この結果は、重症筋無力症患者の体内で、融合蛋白質α1−Fcが抗nAChR自己抗体産生B細胞と結合する可能性を示している。
【0040】
(4)ハイブリドーマMab35に対する融合蛋白質α1−FcのADCC活性の確認
1×106個のハイブリドーマMab35をHBSS/BSAで洗浄した後、同仁社の蛍光色素「Calcein−AM」(カタログ番号:C326)を10μMとなるように添加したHBSS/BSAで37℃で30分間インキュベーションを行い、ハイブリドーマ細胞内にCalcein−AMを取り込ませた。次に、これらのハイブリドーマ細胞を96穴プレートに10000個/ウェルとなるように分注し、(1)で作製した融合蛋白質α1−Fcまたはコントロール抗体(アバスチンまたはエンブレル)と、エフェクター細胞のNK92細胞(ATCC番号:CRL−2407)を様々な濃度で添加し、37℃で4時間インキュベーションを行った。インキュベーション後、×300gで5分間遠心分離して細胞を沈殿させ、上清の蛍光を測定した(Ex=485nm、Em=540nm)。
【0041】
その結果を図4に示す。図4から明らかなように、NK92細胞のみを添加した群(抗体等無添加)においても極く弱い濃度依存的な細胞障害活性(natural killing)が認められたものの、融合蛋白質α1−Fc投与群においては、最大で50%の強い細胞障害活性がNK92細胞数依存的に認められた。一方、コントロール抗体群においては強い細胞障害活性は認められなかった。
【0042】
以上の結果から、融合蛋白質α1−FcはハイブリドーマMab35と結合し、融合蛋白質α1−Fc中の蛋白質(A)の部分(Fcγ受容体)を介してエフェクター細胞のNK92による細胞障害活性(ADCC活性)を発揮することが明らかである。この結果は、重症筋無力症患者の体内で、融合蛋白質α1−Fcが抗nAChR自己抗体産生B細胞と結合し、ADCC活性によって、自己抗体産生B細胞を攻撃して死滅させる可能性を示している。
【産業上の利用可能性】
【0043】
本発明の融合蛋白質は、自己抗体の産生阻害、および産生された自己抗体の中和という二つの方法で、自己抗体性自己免疫疾患を予防または治療することができる。従って、本発明の融合蛋白質は、重症筋無力症を始めとする種々の自己抗体性自己免疫疾患を効果的に予防または治療するために広く利用できる。
【配列表フリーテキスト】
【0044】
配列番号8〜13は、プライマーの配列である。
【技術分野】
【0001】
本発明は、自己抗体を中和しかつ自己抗体の産生を阻害することによって、重症筋無力症などの自己抗体性自己免疫疾患を効果的に予防・治療することができる融合蛋白質に関する。
【背景技術】
【0002】
免疫系は、本来、細菌やウイルスなどの自己と異なる異物を認識し排除するための役割を持つが、自分自身の正常な細胞や組織に対してまで過剰に反応し攻撃を加えてしまうことがある。自己免疫疾患は、このような状態によって生ずる疾患の総称であり、この中でも自己抗体(自分自身の細胞や組織を抗原として認識する抗体)が自己抗原(自分自身の細胞や組織)と反応することで生ずる疾患を自己抗体性自己免疫疾患と称している。自己抗体性自己免疫疾患としては、例えば、重症筋無力症、自己免疫性溶血性貧血、特発性血小板減少性紫斑病、自己免疫性好中球減少症、抗TSH抗体が原因の甲状腺機能亢進症、自己抗体性急性脳炎、橋本脳症、非ヘルペス性辺縁系脳炎等が挙げられる。
【0003】
自己抗体性自己免疫疾患の治療方法としては、ステロイド剤や免疫抑制剤の投与が従来より行われているが、これらの薬剤はいずれも、自己抗体を特異的に抑制するものではなく、免疫反応を一般的に抑制するものであるため、特異性がなく、十分効果的な治療方法とは言えない。
【0004】
自己免疫疾患の代表例の一つである重症筋無力症についても、それを根幹から治療するための既存の治療薬はなく、上述のステロイド剤や免疫抑制剤の他、コリンエステラーゼ阻害薬が主として使用されているに過ぎない(非特許文献1)。特に、コリンエステラーゼ阻害薬の使用については、その用量設定が難しいという問題がある。また、血漿交換療法も用いられているが、1回の治療に100万円以上の多額の費用が発生する。一方、包括医療制度により重症筋無力症の治療費として補助される金額は60万円程であり、医療現場での負担も大きい。しかも、血漿交換療法は、効果が1ヶ月程度しか持続しないという問題がある。また、胸腺摘出術も用いられ、一定の効果を上げているものの、摘出術に対する患者の不安感や、費用面の問題があり、さらには、免疫機構が未発達な小児や免疫不全患者などには適用できないという問題がある。
【0005】
近年、重症筋無力症の治療方法として、ガンマグロブリン製剤の有効性が確認され、一部の製薬メーカーにおいては臨床試験も行っている(非特許文献2)。しかし、ガンマグロブリン製剤は、ヒト血漿由来の生物学的製剤であるため、未知のウイルスなどによる感染リスク等が考えられる。また、ガンマグロブリン製剤の投与量は大量であり、たとえ実現されたとしても、患者や医療現場における費用的・時間的負担は相当大きいものと予想される。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】日本臨床 66巻6号 第1155頁〜第1157頁 重症筋無力症 治験研究動向
【非特許文献2】神経治療 Vol.25 No.6 第689頁〜第692頁 免疫グロブリン大量療法
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、かかる従来技術の現状に鑑み創案されたものであり、その目的は、自己抗体を特異的に抑制することができ、自己抗体性自己免疫疾患を効果的に予防または治療することができる融合蛋白質およびその製造方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者は、自己抗体性自己免疫疾患の治療方法として、まず、自己抗体のみに反応する抗体を組換え蛋白質において作製し、この抗体を患者に投与し、患者の体内の自己抗体をこの抗体と結合させて分解することを想起した。しかしながら、自己抗体性自己免疫疾患の自己抗体は特定の一つの抗体ではなく、種々の抗体群から成り立っているため、これらの種々の抗体群の全てに対して反応するイディオタイプ抗体の作製は、極めて困難であり、この方法は実現可能性が低いと考えられた。
【0009】
そこで、本発明者は、自己抗体性自己免疫疾患の治療方法として、自己抗体に反応する抗体を使用するのではなく、自己抗体によって認識される自己抗原を組換え蛋白質において作製し、この人工自己抗原を囮(デコイ)として患者に投与して、患者の体内の自己抗体をこの人工自己抗原と結合させることによって、自己抗体を中和し、自己抗体が患者自身の自己抗原とは反応しないようにすることができることを見出した。そして更に、この人工自己抗原を抗体重鎖定常領域と融合させておくことによって自己抗体の産生も特異的に阻害することができることを見出し、本発明の完成に至った。
【0010】
即ち、本発明によれば、自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とからなることを特徴とする融合蛋白質が提供される。
【0011】
また、本発明によれば、蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることを特徴とする上記融合蛋白質の製造方法、および上記融合蛋白質を有効成分として含有することを特徴とする自己抗体性自己免疫疾患の予防・治療用組成物が提供される。
【発明の効果】
【0012】
本発明の融合蛋白質は、自己抗体性自己免疫疾患の患者の体内に存在する自己抗体を中和し、かつ自己抗体の産生を阻害することによって、自己抗体を特異的に抑制することができる。従って、本発明の融合蛋白質を使用すれば、重症筋無力症を始めとする種々の自己抗体性自己免疫疾患を効果的に予防・治療することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、実施例で作成した融合蛋白質(α1−Fc)を発現させるためのベクターpcDNA3.1−AChR−Fcの模式図である。
【図2】図2は、精製した融合蛋白質(α1−Fc)の非還元状態および還元状態におけるSDS−PAGE後の銀染色像(左側)、およびウェスタンブロッティング像(右側)を示す。
【図3】図3は、ハイブリドーマMab35への融合蛋白質α1−Fcの結合を示す。融合蛋白質α1−Fc添加濃度(μg/mL)は、Aが無添加、Bが0.1、Cが0.36、Dが1、Eが3.6、Fが10、Gが36およびHが100である。
【図4】図4は、ハイブリドーマMab35に対する融合蛋白質α1−FcのADCC活性を示す。横軸にターゲット細胞であるハイブリドーマMab35に対するエフェクター細胞であるNK92の割合を、縦軸に細胞障害活性(%)をそれぞれ示す。◆は抗体無添加時の細胞傷害活性を示し、■は融合蛋白質α1−Fcの添加時の細胞傷害活性を示し、▲はアバスチンの添加時の細胞傷害活性を示し、×はエンブレルの添加時の細胞障害活性を示す。●は総細胞数を示す。
【発明を実施するための形態】
【0014】
本発明の融合蛋白質は、自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とが融合されたものである。蛋白質(X)は、自己抗体に対する自己抗原、またはその一部に相当し、患者の自己抗原の代わりに自己抗体と結合する囮(デコイ)としての役割を有する。即ち、本発明の融合蛋白質が自己抗体性自己免疫疾患の患者に投与されると、患者の体内の自己抗体は、融合蛋白質のうち蛋白質(X)の部分を自己抗原として認識してこの部分に結合する。結合した自己抗体は、患者の体内に本来存在する自己抗原ともはや結合することができないので、この方法によって自己抗体を中和することができ、自己抗体と患者の自己抗原との結合による自己免疫疾患の症状の発生を抑制することができる。自己抗体は、特定の一つの抗体ではなく種々の抗体群から成り立っているが、いずれの抗体も自己抗原を認識する機能を有する点では共通する。従って、自己抗原の囮となる本発明の融合蛋白質を使用すれば、種々の抗体群に対して個別の融合蛋白質を作成しなくても、一つの融合蛋白質で種々の抗体群を中和することができる。
【0015】
本発明の融合蛋白質は、自己抗原の囮となる蛋白質(X)に加えて、抗体重鎖定常領域のフラグメントを含む蛋白質(A)も含む。この蛋白質(A)は、抗体依存性細胞傷害活性(ADCC活性)を発揮する役割を有する。自己抗体は、血中のB細胞で産生されるが、このB細胞の表面には、自己抗体と同じ抗原結合部位を持つ細胞表面提示型の抗体がB細胞受容体として存在している。従って、本発明の融合蛋白質が患者に投与されると、そのうちのいくつかは患者の体内の自己抗体と上述のように結合するが、いくつかは、自己抗体を産生するB細胞の表面の抗体(B細胞受容体)に結合する。B細胞受容体に本発明の融合蛋白質が結合すると、NK細胞などのエフェクター細胞がそのFc受容体を介して融合蛋白質中の蛋白質(A)の部分に結合し、抗体依存性細胞傷害活性(ADCC活性)を発揮し、融合蛋白質に結合したB細胞を攻撃して死滅させる。このように、本発明によれば、体内に存在する自己抗体を中和して自己抗体の自己抗原への結合を防止するのみならず、自己抗体の産生源である特定B細胞をも選択的に死滅させることができる。従って、本発明の融合蛋白質は、自己抗体の産生阻害、および産生された自己抗体の中和という二つの方法で、自己抗体性自己免疫疾患を予防または治療することができる。
なお、本発明の融合蛋白質と同様に囮(デコイ)を使用する考え方として、ガーショニ、ジョナサン・エムによる特表平2−502538号には分子状デコイアントが開示されている。この分子状デコイアントは、好ましくない作用を示す異物に対する天然の受容体の最小部分断片に相当し、外来性抗原とデコイアントの競合作用により、外来性抗原の生体受容体への結合を抑制しようとするものである。特表平2−502538号では、上記異物は、ウイルス、バクテリア、毒素などの外来性抗原であるとされており、自己抗体については何ら記載されていない。また、特表平2−502538号の分子状デコイアントは、単独で使用されており、抗体重鎖定常領域と結合されていない。
また、B細胞を死滅させる考え方として、アナンド・アイヤーらによる特表2008−515926号には、B細胞表面抗原に対する抗体に細胞毒性物質を付加した複合体を自己免疫疾患の患者に投与することによってB細胞を死滅させることが開示されている。この複合体は、B細胞を死滅させることはできるが、産生された自己抗体を中和することはできず、自己抗体に対しては別途、抗サイトカイン剤を投与する必要があるとされている。
【0016】
本発明の融合蛋白質中の蛋白質(X)は、予防または治療対象の自己抗体性自己免疫疾患の原因となる自己抗体に対する自己抗原またはその一部に相当し、予防または治療対象の自己免疫疾患に応じて決まる。例えば、重症筋無力症の予防・治療の場合、重症筋無力症は、神経伝達物質であるアセチルコリンの筋肉側における受け皿であるニコチン性アセチルコリン受容体(自己抗原)に抗ニコチン性アセチルコリン受容体抗体(自己抗体)が結合してアセチルコリンによる神経・筋伝達を阻害することによって生じる疾患であるので、蛋白質(X)は、自己抗原のニコチン性アセチルコリン受容体であることができる。同様に、自己免疫性溶血性貧血の予防・治療の場合、蛋白質(X)は、赤血球表面マーカーであることができ、特発性血小板減少性紫斑病の予防・治療の場合、蛋白質(X)は、血小板表面マーカーであることができ、自己免疫性好中球減少症の予防・治療の場合、蛋白質(X)は、好中球表面マーカーであることができ、抗TSH抗体が原因の甲状腺機能亢進症の予防・治療の場合、蛋白質(X)は、TSHであることができ、原発性甲状腺機能低下症(橋本病)の予防・治療の場合、蛋白質(X)は、甲状腺表面マーカーであることができ、自己抗体性脳炎・脳症の予防・治療の場合、蛋白質(X)は、NMDA受容体、AMPA受容体などであることができる。
【0017】
蛋白質(X)は、これらの受容体やマーカー全体である必要はなく、自己抗体の認識部位を含んでさえいればその一部であってもよい。例えば、重症筋無力症の場合、上述のニコチン性アセチルコリン受容体は、いくつかのサブユニットからなる多量体蛋白質であり、自己抗体の認識部位は、その中でもα1サブユニットのアイソフォーム1(骨格筋でのみ発現されるアイソフォームであり、配列番号4で示される)、アイソフォーム2(骨格筋、脳、心臓、腎臓、肺臓で発現されるアイソフォームであり、配列番号5で示される)のN末端細胞外領域に存在する。従って、重症筋無力症の場合、蛋白質(X)は、ニコチン性アセチルコリン受容体α1(nAChRα1)サブユニットまたはその一部であることができ、より具体的にはnAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2、またはそれらの一部であることができ、さらに具体的にはnAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2のN末端細胞外領域のアミノ酸配列からなることができる。
【0018】
これらのアミノ酸配列には、その相同性が損なわれない範囲で、1個または数個(例えば1〜20個、好ましくは1〜10個、さらに好ましくは1〜7個)のアミノ酸が欠失、付加、および/または置換されていてもよい。その範囲としては、例えば、70%以上、好ましくは80%以上、さらに好ましくは90%以上の配列の同一性を有するものが挙げられる。アミノ酸配列の相同性は、相同性計算アルゴリズムNCBI BLAST(National Center for Biotechnology Information Basic Local Alignment Search Tool)を用いて、以下の条件(期待値=10;ギャップを許す;マトリクス=BLOSUM62;フィルタリング=OFF)で計算することができる。具体的には、このような欠失、付加、および/または置換が導入されたアミノ酸配列は、例えばサイトダイレクテドミュータジェネシスキット(タカラバイオ製)や、QuickChange Site−Directed Mutagenesis Kit(STRATAGENE製)等の市販キットを用いて対応するDNA配列を置換することにより容易に得ることができる。
【0019】
本発明の融合蛋白質中の蛋白質(A)は、抗体重鎖定常領域のフラグメントを含む蛋白質であり、例えば抗体重鎖のヒンジ領域以下(Fc領域)、抗体重鎖CH1領域またはそれらの一部であることができる。抗体重鎖のヒンジ領域以下(Fc領域)としては、具体的には、配列番号1または配列番号2のアミノ酸配列を挙げることができる。配列番号1,2はいずれもヒトのFc領域の配列であり、配列番号1は、アジア人に多いタイプ、配列番号2は、欧米人に多いタイプである。
【0020】
本発明の融合蛋白質の具体例としては、例えば配列番号3のアミノ酸配列からなる蛋白質が挙げられる。この融合蛋白質は、蛋白質(X)がnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域のアミノ酸配列(配列番号4の第1位〜第210位のアミノ酸からなるアミノ酸配列)であり、蛋白質(A)が配列番号1のアミノ酸配列である場合に相当する。このアミノ酸配列も、上述の通り、その相同性が損なわれない範囲で、1個または数個(例えば1〜20個、好ましくは1〜10個、さらに好ましくは1〜7個)のアミノ酸が欠失、付加、または/および置換されていてもよい。
【0021】
本発明の融合蛋白質は、従来公知の遺伝子工学的手法によって製造することができ、例えば、蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを必要によりそれぞれ増幅しておき、これらのDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることによって製造することができる。DNAの増幅は、例えばPCR法によって行うことができ、増幅したDNAの結合は、例えばOverlap extension PCR法によって行うことができる。発現ベクターは、発現効率を向上させるためのCMVやSV40等のプロモーターや、発現された融合蛋白質の回収を容易にするための抗体重鎖シグナル配列、膜蛋白質シグナル配列、抗体κ鎖シグナル配列などの分泌シグナル配列を備えていることが好ましい。宿主細胞としては、例えば酵母、動物細胞、昆虫細胞、植物細胞などを使用することができ、その中でも動物細胞、特にCHO細胞、HEK293細胞などが好ましい。発現させた融合蛋白質は、常法により回収し、Protein Aカラム等を用いて精製すればよい。
【0022】
次に、本発明の融合蛋白質を有効成分として含有することを特徴とする自己抗体性自己免疫疾患の予防・治療用組成物について説明する。かかる組成物の具体的な製剤形態としては、注射剤、坐剤等を挙げることができる。注射剤の場合は、上述のようにして得られた本発明の融合蛋白質に糖類、ポリオール、アルブミン、界面活性剤等の安定化剤、塩類等の等張化剤等を添加し、凍結乾燥して保存しておき、使用時に注射用水に溶解して投与すればよい。凍結乾燥品中の本発明の融合蛋白質の含有量は特に限定されないが、例えば0.01〜200mg/g、好ましくは0.1〜100mg/gである。また、溶解された注射剤中の本発明の融合蛋白質の含有量は特に限定されないが、例えば0.01〜200mg/mL、好ましくは0.1〜100mg/mLである。注射剤の場合の投与方法としては、静脈内投与、筋肉内投与、皮下投与等が挙げられる。坐剤の場合は、例えば、本発明の融合蛋白質を通常の坐剤用基剤に混合して製剤化し、直腸より投与すればよい。坐剤中の本発明の融合蛋白質の含有量は特に限定されないが、例えば0.1〜300mg/mL、好ましくは0.5〜100mg/mLである。本発明の組成物の投与量は、目的とする治療効果、投与方法、治療期間、年齢、体重等により異なるが、通常成人一日当たり10μg/kg〜50mg/kgである。
【0023】
本発明の組成物が自己抗体性自己免疫疾患の患者に投与されると、組成物中の本発明の融合蛋白質が体液流に乗って体内に分配される。そして、融合蛋白質が自己抗体と出会うと、自己抗体は融合蛋白質の蛋白質(X)の部分(自己抗体によって認識される部位)に結合するので、この自己抗体はもはや患者自身の自己抗原とは反応できなくなる。また、本発明の融合蛋白質が、自己抗体を産生するB細胞に出会うと、融合蛋白質はこのB細胞の表面の抗体(B細胞受容体)に結合される。この結合が生じると、融合蛋白質の蛋白質(A)の部分(抗体重鎖定常領域のフラグメント)にNK細胞などのエフェクター細胞が結合し、抗体依存性細胞傷害活性(ADCC活性)を発揮し、融合蛋白質に結合されたB細胞を攻撃して死滅させる。このように、本発明によれば、自己抗体を中和して自己抗体の自己抗原への結合を防止するのみならず、自己抗体の産生源である特定B細胞をも選択的に死滅させることができる。従って、本発明の融合蛋白質、およびかかる融合蛋白質を含む組成物は、例えば重症筋無力症等の自己抗体性自己免疫疾患の予防・治療薬として効果を発揮すると期待できる。
【実施例】
【0024】
以下に、実施例により本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではない。
【0025】
(1)融合蛋白質の製造
ヒト末梢血リンパ球(PBL)のcDNAを鋳型とし、配列番号8および配列番号9のDNA配列をプライマーとし、東洋紡績(株)の遺伝子増幅キット「KOD−plus−Ver.2」(カタログ番号:KOD−211)を用いて、ヒト抗体重鎖シグナル配列(分泌シグナル配列)の遺伝子を増幅した。
【0026】
増幅した遺伝子について、インビトロジェン社のクローニングキット「Zero Blunt TOPO PCR Cloning Kit for Sequence」(カタログ番号:K2895−20)を用いてクローニングを行い、遺伝子配列の解析を行った。その後、インビトロジェン社の発現ベクター「pcDNA3.1(+)ベクター」(カタログ番号:V790−20)をNEB社の制限酵素NheI(カタログ番号:R0131)、EcoRI(カタログ番号:R0101)で処理し、増幅した抗体重鎖シグナル配列(分泌シグナル配列)を発現ベクターに挿入した。
【0027】
次に、Open Biosystems社から取り寄せたヒトnAChRα1サブユニットのcDNA(カタログ番号:MHS1011−61598)を鋳型とし、配列番号10および配列番号11のDNA配列をプライマーとし、東洋紡績(株)の「KOD−plus−Ver.2」を用いて、ヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域の遺伝子を増幅した。増幅された遺伝子は、配列番号4のアミノ酸配列の第1位〜第210位に相当する。このアミノ酸配列を配列番号6に示す。
【0028】
一方、ヒト末梢血リンパ球(PBL)のcDNAを鋳型とし、配列番号12および配列番号13のDNA配列をプライマーとし、PCRによって、ヒト抗体重鎖Fc領域の遺伝子を増幅した。増幅した遺伝子について、インビトロジェン社の「Zero Blunt TOPO Cloning Kit For Sequence」を用いてクローニングを行い、遺伝子配列の解析を行った。その結果、配列番号1および配列番号2のアミノ酸配列をコードする二種類のヒト抗体重鎖Fc領域の遺伝子が得られたことが判明した。
【0029】
このようにして得られたヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域の遺伝子およびヒト抗体重鎖Fc領域の遺伝子を混ぜ合わせ、配列番号10および配列番号13のDNA配列をプライマーとし、Overlap extension PCR法によって遺伝子を増幅し、ヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域とヒト抗体重鎖Fc領域とを一本鎖でコードする遺伝子配列を作製した。作製された遺伝子配列に相当するアミノ酸配列を配列番号3および7に示す。配列番号3は、ヒト抗体重鎖Fc領域が配列番号1のアミノ酸であるものに相当し、配列番号7は、ヒト抗体重鎖Fc領域が配列番号2のアミノ酸であるものに相当する。
【0030】
作製した遺伝子配列についてインビトロジェン社の「Zero Blunt TOPO Cloning Kit for Sequence」を用いてクローニングを行い、遺伝子配列の解析を行った。その後、予め分泌シグナル配列を挿入しておいたpcDNA3.1ベクターをNEB社の制限酵素PpuMI(カタログ番号:R0506)、PmeI(カタログ番号:R0560)で処理して、作製した遺伝子配列を挿入し、ヒトnAChRα1サブユニットのアイソフォーム1のN末端細胞外領域とヒト抗体重鎖Fc領域とからなる融合蛋白質(α1−Fc)を発現させるためのベクターを得た。得られたベクターの模式図を図1に示す。
【0031】
次に、インビトロジェン社の発現系「Free Style MAX 293 Expression System」(カタログ番号:K9000−10)を用いて、得られたベクターをHEK293細胞に導入して融合蛋白質α1−Fcを発現させ、GEヘルスケア社の精製カラム「HiTrap Protein A HP Column」(カタログ番号:17−0402−01)を用いて精製し、融合蛋白質α1−Fcを得た。
【0032】
融合蛋白質の発現確認は、SDS−PAGE後、銀染色並びにウェスタンブロッティングにより行った。ウェスタンブロッティングにはHRP標識抗ヒトIgG抗体を用いた。その結果を図2に示す。図2中の矢印で示されるバンドが、融合蛋白質α1−Fcに相当する。
【0033】
(2)融合蛋白質の自己抗体に対する反応性の確認
ラットnAChRに対する自己抗体である抗nAChR自己抗体mAb35を産生するハイブリドーマMab35(ATCC番号:TIB−175)を培養し、その培養上清からGEヘルスケア社の精製カラム「HiTrap Protein G HP column」(カタログ番号:17−0404−01)を用いて抗nAChR自己抗体mAb35を精製した。この抗体は、ラットのみならず、マウスおよびヒトに対しても交差反応性を示す抗体であることがTzartosらによって報告されている(J.Neuroimmunol,1987;15,185−94))。
【0034】
次に、精製した抗nAChR自己抗体を様々な濃度でELISAプレートに固相化し、ブロッキングを行った。その後、(1)で作製した融合蛋白質α1−Fcを反応させ、フナコシ社のELISA定量キット「IgG(Fc),Human,ELISA Quantitation Kit」(カタログ番号:E80−104)に付属のHRP標識抗ヒトFc抗体で処理し、フナコシ社の基質溶液「TMB Solution」(カタログ番号:N301)を基質として反応させて、1%硫酸で反応を停止させた。その後、波長450nmでの吸光度を測定した。
【0035】
その結果を以下の表1に示す。表1から明らかなように、自己抗体の濃度が増大するにつれて吸光度が増大しており、自己抗体の濃度に依存して融合蛋白質が自己抗体と反応していることが確認された。
【0036】

【0037】
(3)ハイブリドーマMab35への融合蛋白質α1−Fcの結合の確認
自己抗体は生体内ではB細胞で産生され、自己抗体を産生するB細胞の細胞表面には、自己抗体と同じ抗体が細胞膜上にB細胞受容体として提示されている。(2)で使用したハイブリドーマMab35は抗nAChR自己抗体を産生するため、ハイブリドーマMab35においてもB細胞と同様に細胞表面上に自己抗体を提示していると考えられる。そこで、融合蛋白質α1−FcがハイブリドーマMab35へ結合するかどうかを確認した。
【0038】
HBSS/BSAで洗浄した1×105個のハイブリドーマMab35に、(1)で作製した融合蛋白質α1−Fcを様々な濃度で添加した。次にJackson Immuno Research LABORATORIES社のPE標識抗ヒトIgG抗体(カタログ番号:109−116−170)を添加し、HBSS/BSAで洗浄し、融合蛋白質とハイブリドーマとの結合をフローサイトメーターで測定した。
【0039】
その結果を図3に示す。図3から、融合蛋白質α1−Fcが濃度依存的にハイブリドーマMab35と結合していることが明らかである。この結果は、重症筋無力症患者の体内で、融合蛋白質α1−Fcが抗nAChR自己抗体産生B細胞と結合する可能性を示している。
【0040】
(4)ハイブリドーマMab35に対する融合蛋白質α1−FcのADCC活性の確認
1×106個のハイブリドーマMab35をHBSS/BSAで洗浄した後、同仁社の蛍光色素「Calcein−AM」(カタログ番号:C326)を10μMとなるように添加したHBSS/BSAで37℃で30分間インキュベーションを行い、ハイブリドーマ細胞内にCalcein−AMを取り込ませた。次に、これらのハイブリドーマ細胞を96穴プレートに10000個/ウェルとなるように分注し、(1)で作製した融合蛋白質α1−Fcまたはコントロール抗体(アバスチンまたはエンブレル)と、エフェクター細胞のNK92細胞(ATCC番号:CRL−2407)を様々な濃度で添加し、37℃で4時間インキュベーションを行った。インキュベーション後、×300gで5分間遠心分離して細胞を沈殿させ、上清の蛍光を測定した(Ex=485nm、Em=540nm)。
【0041】
その結果を図4に示す。図4から明らかなように、NK92細胞のみを添加した群(抗体等無添加)においても極く弱い濃度依存的な細胞障害活性(natural killing)が認められたものの、融合蛋白質α1−Fc投与群においては、最大で50%の強い細胞障害活性がNK92細胞数依存的に認められた。一方、コントロール抗体群においては強い細胞障害活性は認められなかった。
【0042】
以上の結果から、融合蛋白質α1−FcはハイブリドーマMab35と結合し、融合蛋白質α1−Fc中の蛋白質(A)の部分(Fcγ受容体)を介してエフェクター細胞のNK92による細胞障害活性(ADCC活性)を発揮することが明らかである。この結果は、重症筋無力症患者の体内で、融合蛋白質α1−Fcが抗nAChR自己抗体産生B細胞と結合し、ADCC活性によって、自己抗体産生B細胞を攻撃して死滅させる可能性を示している。
【産業上の利用可能性】
【0043】
本発明の融合蛋白質は、自己抗体の産生阻害、および産生された自己抗体の中和という二つの方法で、自己抗体性自己免疫疾患を予防または治療することができる。従って、本発明の融合蛋白質は、重症筋無力症を始めとする種々の自己抗体性自己免疫疾患を効果的に予防または治療するために広く利用できる。
【配列表フリーテキスト】
【0044】
配列番号8〜13は、プライマーの配列である。
【特許請求の範囲】
【請求項1】
自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とからなることを特徴とする融合蛋白質。
【請求項2】
蛋白質(A)が、抗体重鎖のヒンジ領域以下、抗体重鎖CH1領域、またはそれらの一部を含むことを特徴とする請求項1に記載の融合蛋白質。
【請求項3】
蛋白質(A)が、配列番号1または配列番号2のアミノ酸配列からなることを特徴とする請求項1または2に記載の融合蛋白質。
【請求項4】
蛋白質(X)が、ニコチン性アセチルコリン受容体α1(nAChRα1)サブユニットまたはその一部であることを特徴とする請求項1〜3のいずれか一項に記載の融合蛋白質。
【請求項5】
蛋白質(X)が、nAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2であるか、またはそれらの一部であることを特徴とする請求項4に記載の融合蛋白質。
【請求項6】
アイソフォーム1が、配列番号4のアミノ酸配列からなることを特徴とする請求項5に記載の融合蛋白質。
【請求項7】
アイソフォーム2が、配列番号5のアミノ酸配列からなることを特徴とする請求項5に記載の融合蛋白質。
【請求項8】
蛋白質(X)が、nAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2のN末端細胞外領域のアミノ酸配列からなるか、またはこのアミノ酸配列において1個もしくは数個のアミノ酸が欠失、付加および/もしくは置換されたアミノ酸配列からなることを特徴とする請求項5に記載の融合蛋白質。
【請求項9】
配列番号3のアミノ酸配列からなるか、または配列番号3のアミノ酸配列において1個もしくは数個のアミノ酸が欠失、付加および/もしくは置換されたアミノ酸配列からなることを特徴とする請求項4に記載の融合蛋白質。
【請求項10】
蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることを特徴とする請求項1〜9のいずれか一項に記載の融合蛋白質の製造方法。
【請求項11】
発現ベクターが、分泌シグナル配列を含むことを特徴とする請求項10に記載の製造方法。
【請求項12】
請求項1〜9のいずれか一項に記載の融合蛋白質を有効成分として含有することを特徴とする自己抗体性自己免疫疾患の予防・治療用組成物。
【請求項13】
組成物が注射剤または坐薬の形態であることを特徴とする請求項12に記載の組成物。
【請求項1】
自己抗体性自己免疫疾患の原因となる自己抗体によって認識される部位を含む蛋白質(X)と抗体重鎖定常領域のフラグメントを含む蛋白質(A)とからなることを特徴とする融合蛋白質。
【請求項2】
蛋白質(A)が、抗体重鎖のヒンジ領域以下、抗体重鎖CH1領域、またはそれらの一部を含むことを特徴とする請求項1に記載の融合蛋白質。
【請求項3】
蛋白質(A)が、配列番号1または配列番号2のアミノ酸配列からなることを特徴とする請求項1または2に記載の融合蛋白質。
【請求項4】
蛋白質(X)が、ニコチン性アセチルコリン受容体α1(nAChRα1)サブユニットまたはその一部であることを特徴とする請求項1〜3のいずれか一項に記載の融合蛋白質。
【請求項5】
蛋白質(X)が、nAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2であるか、またはそれらの一部であることを特徴とする請求項4に記載の融合蛋白質。
【請求項6】
アイソフォーム1が、配列番号4のアミノ酸配列からなることを特徴とする請求項5に記載の融合蛋白質。
【請求項7】
アイソフォーム2が、配列番号5のアミノ酸配列からなることを特徴とする請求項5に記載の融合蛋白質。
【請求項8】
蛋白質(X)が、nAChRα1サブユニットのアイソフォーム1および/またはアイソフォーム2のN末端細胞外領域のアミノ酸配列からなるか、またはこのアミノ酸配列において1個もしくは数個のアミノ酸が欠失、付加および/もしくは置換されたアミノ酸配列からなることを特徴とする請求項5に記載の融合蛋白質。
【請求項9】
配列番号3のアミノ酸配列からなるか、または配列番号3のアミノ酸配列において1個もしくは数個のアミノ酸が欠失、付加および/もしくは置換されたアミノ酸配列からなることを特徴とする請求項4に記載の融合蛋白質。
【請求項10】
蛋白質(X)をコードするDNAおよび蛋白質(A)をコードするDNAを相互に結合し、得られたDNAを発現ベクターに挿入し、このベクターを宿主細胞に導入して融合蛋白質を発現させることを特徴とする請求項1〜9のいずれか一項に記載の融合蛋白質の製造方法。
【請求項11】
発現ベクターが、分泌シグナル配列を含むことを特徴とする請求項10に記載の製造方法。
【請求項12】
請求項1〜9のいずれか一項に記載の融合蛋白質を有効成分として含有することを特徴とする自己抗体性自己免疫疾患の予防・治療用組成物。
【請求項13】
組成物が注射剤または坐薬の形態であることを特徴とする請求項12に記載の組成物。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−32188(P2011−32188A)
【公開日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願番号】特願2009−178120(P2009−178120)
【出願日】平成21年7月30日(2009.7.30)
【特許番号】特許第4495776号(P4495776)
【特許公報発行日】平成22年7月7日(2010.7.7)
【出願人】(000231648)日本製薬株式会社 (17)
【Fターム(参考)】
【公開日】平成23年2月17日(2011.2.17)
【国際特許分類】
【出願日】平成21年7月30日(2009.7.30)
【特許番号】特許第4495776号(P4495776)
【特許公報発行日】平成22年7月7日(2010.7.7)
【出願人】(000231648)日本製薬株式会社 (17)
【Fターム(参考)】
[ Back to top ]

