イネ雑種弱勢原因遺伝子HWC1、HWC2を利用した雑種弱勢の人為的誘導
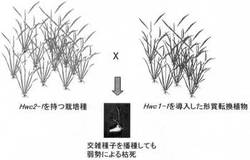
【課題】イネの雑種弱勢原因遺伝子を単離して、当該遺伝子を利用して雑種弱勢または過敏感細胞死を人為的に誘導する技術を提供する。
【解決手段】雑種弱勢原因遺伝子は、第一の遺伝子と第二の遺伝子が一対の遺伝子として組み合わさり、両方が発現した場合に雑種弱勢または過敏感細胞死という表現型を示す。第一の遺伝子は特定のアミノ酸配列をコードするHWC1であり、第二の遺伝子は特定のアミノ酸配列をコードするHWC2からなる。
【解決手段】雑種弱勢原因遺伝子は、第一の遺伝子と第二の遺伝子が一対の遺伝子として組み合わさり、両方が発現した場合に雑種弱勢または過敏感細胞死という表現型を示す。第一の遺伝子は特定のアミノ酸配列をコードするHWC1であり、第二の遺伝子は特定のアミノ酸配列をコードするHWC2からなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、植物の遺伝子とその利用に関する。詳しくは、交雑すると弱勢または過敏感細胞死を誘導する一対の遺伝子、該遺伝子がそれぞれ組み込まれた組換えベクター、該ベクターにより形質転換された細胞および形質転換植物、並びにそれらの利用に関する。
【背景技術】
【0002】
作物を形質転換して農業を行えば、導入された遺伝子が自然生態系に拡散する可能性が生じる。また、除草剤抵抗性遺伝子などが野生の植物に拡散すれば、除草剤で駆除できない雑草を生じさせることになる。2000年には、スターリンク事件が生じ食品として認可のない組換えトウモロコシが食用のトウモロコシに混入し問題となった。これらの問題に対してこれまで、親世代で発現していない遺伝子を次世代で発現させる方法(主として次世代の種子を発芽不能にする技術:特許文献1)、葉緑体のゲノムに遺伝子を導入することにより、花粉から遺伝子が拡散できないようにする方法(Daniell. H. 非特許文献1、2)、閉花受粉の応用(吉田均ら:非特許文献3)などが知られている。それぞれ長所短所があるため、遺伝子の拡散防止を目指す場合には異なる方法を組合わせて行うのが望ましい。そのためには、多様な技術を開発し、用いることができるようにすべきである。
【0003】
雑種弱勢(hybrid weakness)とは、両親は正常に生育し、何ら異常を示さないにもかかわらずその雑種では生育異常が起こり、正常に成長できない現象である。そのため、交雑が起きたときには雑種が生育不良で次世代を生じない。もしこの現象を人工的に制御できれば、遺伝子の拡散防止技術に応用が可能である。
【0004】
イネ(Oryza sativa L.)では、ペルーの品種Jamaicaと多くの日本の栽培品種との間に見られる雑種弱勢が知られている。これは、図1に示すように、Hybrid Weakness C 1(HWC1)のJamaica対立遺伝子であるHwc1-1と、HWC2の対立遺伝子Hwc2-1との優性補足作用によって説明される(雨宮と明峰1963:非特許文献4)。Sato & Morishima (1987)はHwc1-1とHwc2-1の分布を調べ、Hwc2-1の遺伝子型はジャポニカ、特に温帯ジャポニカに高頻度で分布するが、インディカ品種にはまれにしか存在せず、野生イネにはこの遺伝子型を持つ系統が見つかっていないこと、Hwc1-1は多くのイネ品種、野生イネを調べても見つからず、Jamaicaが特異的に保持していることを報告している(非特許文献5)。このことから、Hwc2-1は温帯ジャポニカが他の集団と分岐した後すぐに現れ、何らかの理由で集団内に広がり、定着した対立遺伝子であると推定される。一方、Hwc1-1はJamaicaでしか見つかっていないため、HWC1遺伝子座において比較的新しく現れた対立遺伝子であると考えられる。
【0005】
この組合わせの交雑において、種子は正常に形成される。しかし発芽後に、根が成長しない、葉が細くなり巻く、葉の形成速度が遅い、分げつが少ない、矮性を示すなどの異常が見られる。特に根で顕著な異常が現れ、伸長の抑制、側根形成の遅れ、本来側根の形成が抑制されている先端部での側根形成などが観察される。
【0006】
イネゲノムは、遺伝地図、発現遺伝子地図、物理地図などゲノム塩基配列の精密解読に不可欠な基盤が既に整備され、2004年には全塩基配列が解読された(http://rapdb.dna.affrc.go.jp/rap_history.html, International Rice Genome Sequencing Project. (2005) The map-based sequence of the rice genome. Nature 436: 793-800:非特許文献6)。イネのゲノムは3.72億のDNA塩基配列から構成され、予測された遺伝子の総数は約4万個とされ、それらのゲノム中での分布状況の特徴が明らかにされた。しかし、各遺伝子と機能との関係が明らかになっているものは少数であり、両者の関係を解明することがゲノム塩基配列解読後の課題となっている。
【0007】
本発明者らは、雑種弱勢が生じる機構を解明するために、雑種弱勢原因遺伝子HWC1とHWC2に対応する塩基配列の単離に取り組んできた。これまでに、高密度連鎖解析による両遺伝子の特定が進められている。
【0008】
HWC1は既に特定され、シロイヌナズナのLEUNIGやキンギョソウのSTYLOSAと同祖関係にある遺伝子であることが判明した。HWC1やこれらの同祖遺伝子は、C末端側にWD40の繰り返しモチーフを持ち、N末端側にタンパク質相互作用に機能を持つと考えられているLisH(lissencephaly type 1-like homology)ドメインを持っており、Groucho/TUP1遺伝子族に共通するドメイン構造を持つ。LEUNIGやSTYLOSAは花の発生や葉の形、維管束形成で働いており、植物の正常な発生に必要な遺伝子であると考えられている(Navarro ら:非特許文献7)。そのため、この遺伝子のイネにおける同祖遺伝子が雑種弱勢の原因となり、根の成長に異常を誘起することはこれまでの知見からは予測不可能であった。また、このHWC1の日本晴における対立遺伝子(hwc1-2)はRice Annotation Project Database(RAP-DB)の遺伝子モデルOs01g0607400に該当する。Jamaicaのみが持つHwc1-1対立遺伝子ではエクソン部の塩基配列の一箇所が変異しており、この一塩基変異がアミノ酸の置換をもたらすことにより、Hwc2-1を持つ植物との交雑による弱勢が誘導される可能性が示唆された(波越ら:非特許文献8、沖山ら:非特許文献9)。しかしながら、正確な変異部位の位置は公表されていない。
【0009】
一方、HWC2の候補遺伝子はRice Genome Annotation ProjectにおいてNB-LRR型の病害抵抗性タンパク質をコードすると予想される遺伝子モデルLOC_Os04g53160に該当すると推測された(一谷ら:非特許文献10)。また、抵抗性反応による過敏感細胞死と雑種弱勢現象との類似性が示唆されている(沖山ら:非特許文献11、12)。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第5723765号(特表平10-503377号広報)
【非特許文献】
【0011】
【非特許文献1】Daniell, H. (2002) Nat Biotechnol 20, 581-586
【非特許文献2】Daniell, H. (2007) PNAS 104 no.17, 6879-6880
【非特許文献3】吉田均ら(2007)育種学研究9巻(別冊2号)220頁
【非特許文献4】雨宮と明峰(1963)農林水産省農業技術研究所報告D第10号139-223
【非特許文献5】Sato, Y. I. & Morishima, H., Euphytica 36, 425-431 (1987)
【非特許文献6】Nature 436: 793-800(2005)
【非特許文献7】Navarro ら、Development 131, 3649-3659 (2004)
【非特許文献8】波越ら(2006)育種学研究8巻(別冊2号)93頁
【非特許文献9】沖山ら(2008)育種学研究10巻(別冊1号)13頁
【非特許文献10】一谷ら(2008)育種学研究10巻(別冊2号)62頁
【非特許文献11】沖山ら(2008)育種学研究10巻(別冊2号)248頁
【非特許文献12】沖山ら(2009)育種学研究11巻(別冊1号)79頁
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明者らの研究により、イネの雑種弱勢原因遺伝子の一つがNB-LRR型の病害抵抗性遺伝子であるらしいこと、そして、抵抗性反応が雑種弱勢の原因となっている可能性のあることが示唆された。
【0013】
本発明は、イネの雑種弱勢原因遺伝子を単離して提供するとともに、当該遺伝子と雑種弱勢または過敏感細胞死という生理的現象の発現との因果関係を解明することにより、当該遺伝子を利用してこれらの現象を人為的に誘導する技術を構築することを課題とする。
【課題を解決するための手段】
【0014】
本発明者らは、一対の雑種弱勢原因遺伝子HWC1とHWC2のDNA塩基配列を明らかにした。HWC1はWD40モチーフを持つGroucho/Tup1ファミリーに属する遺伝子であること、HWC2は白葉枯病抵抗性遺伝子Xa1と同様の構造を持つNB-LRR遺伝子であることが明らかとなった。HWC1遺伝子座のJamaica対立遺伝子Hwc1-1にコードされるポリペプチドでは、587番目のコドンに相当する位置におけるアミノ酸残基が別のアミノ酸に置換していることが判明した。したがって、この雑種弱勢は、通常の植物で発生上必須であるHWC1の一アミノ酸残基が別のアミノ酸に置換した結果、病害抵抗性遺伝子ファミリーに属するHWC2遺伝子座の対立遺伝子Hwc2-1の遺伝子産物によって認識され生じた現象であると推測される。つまり、雑種弱勢の原因は抵抗性反応により過敏感細胞死が生じたことであると考えられる。
【0015】
実際に、本発明者らは、これらの塩基配列を持ったDNAを形質転換によって導入して、イネにおいて人為的に雑種弱勢を誘導することができることを確認した。
【0016】
HWC1とHWC2の遺伝子の組合わせは、病原菌の持つ非病原性遺伝子と植物の抵抗性遺伝子との関係にあるため、イネ以外の種でも適用可能である。
【0017】
本発明の概略は以下の通りである。
【0018】
(1)HWC1遺伝子座の対立遺伝子hwc1-2にコードされるHWC1-2ポリペプチドに対するアミノ酸の変異を、HWC1-1ポリペプチドの587位のアミノ酸残基に相当する位置に有するアミノ酸配列からなる変異ポリペプチドまたはその部分配列からなる断片であって、当該変異により、HWC2遺伝子座の対立遺伝子Hwc2-1が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有する前記変異ポリペプチドまたはその断片をコードする塩基配列を含むDNA。
【0019】
(2)前記変異ポリペプチドまたはその断片がアミノ酸配列VAKAHASA-KV(式中、HはHWC1-1ポリペプチドの587位のアミノ酸残基に相当し、-は任意のアミノ酸又は一残基の欠失を表す)を含む、上記(1)のDNA。
【0020】
(3)以下の(a)〜(g)のいずれかのポリペプチドをコードする塩基配列を含む、上記(1)のDNA:
(a)配列番号7で表されるアミノ酸配列において587位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(b)587位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(a)のポリペプチド
(c)配列番号8で表されるアミノ酸配列において588位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(d)588位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(c)のポリペプチド
(e)配列番号3で表されるアミノ酸配列からなるポリペプチド
(f)配列番号3で表されるアミノ酸配列からなるポリペプチドにおいて587位のアミノ酸残基がリシンであるアミノ酸配列からなるポリペプチド
(g)少なくともWDリピートドメインの330個のアミノ酸を有する、HWC1-1ポリペプチドの部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド。
【0021】
(4)以下の(h)または(i)の塩基配列を有する、(1)記載のDNA:
(h)配列番号1で表される塩基配列
(i)配列番号2で表される塩基配列。
【0022】
(5)上記(1)〜(4)のいずれかのDNAを含む、植物形質転換用ベクター。
【0023】
(6)上記(1)の変異ポリペプチドを発現する、外来遺伝子で形質転換された植物。
【0024】
(7)上記(1)〜(4)のいずれかのDNAを形質転換により植物に導入して、Hwc2-1を持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該形質転換された植物に付与する方法。
【0025】
(8)Hwc2-1を持つ植物が、イネ科の植物である、(7)の方法。
【0026】
(9)配列番号3のアミノ酸配列をコードする塩基配列を有するHWC1遺伝子、及び配列番号6のアミノ酸配列をコードする塩基配列を有するHWC2遺伝子からなる一対の雑種弱勢原因遺伝子。
【0027】
(10)HWC1遺伝子座の対立遺伝子Hwc1-1を組み込んだ発現カセットを、HWC2遺伝子座の対立遺伝子Hwc2-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0028】
(11)Hwc1-1が配列番号2の塩基配列またはその一部からなる配列を有する、(9)の方法。
【0029】
(12)HWC2遺伝子座の対立遺伝子Hwc2-1を組み込んだ発現カセットを、HWC1遺伝子座の対立遺伝子Hwc1-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0030】
(13)Hwc2-1が配列番号5の塩基配列またはその一部からなる配列を有する、(12)の方法。
【発明の効果】
【0031】
本発明により、特定の交配組合わせでのみプログラム細胞死が起きる雑種弱勢原因遺伝子遺伝子が提供される。これらの遺伝子は、単独で植物中に存在するときには、植物の成長にとって何らの害のある形質を示さず、また、これまで日本人が長く食用にしてきたイネに由来し、ヒトにとって安全なものである。
【0032】
植物の交雑による遺伝子の圃場や環境への拡散防止に対してこれまで、様々な方法が考案されてきた。最も単純な方法は植物のある発生段階で発現し、植物の成長を阻害し、次世代の植物を作れない遺伝子を持つ形質転換植物である。この方法は、生産物を利用する上での安全性、種子あるいは実を利用する作物では有効でない、種子を自家採種して維持することができないなどの問題がある。また、モンサントによる「親世代で発現していない遺伝子を次世代で発現させる方法に関する特許(主として次世代の種子を発芽不能にする技術)」) US. patent number: 5,723, 765(特許文献1)も知られている。この方法では、弱いながらも毒性のあるリボソーム不活性化タンパク質 (ribosome-inactivation protein)あるいは、通常植物にない量のインドール酢酸を種子内で合成することにより種子の発芽を妨げている。この方法では、テトラサイクリンなどによる薬剤処理も必要で食用として利用する際に安全性確保のための配慮を行う必要がある。また、テトラサイクリンによる遺伝子発現の誘導はむらなく全ての種子で実施する必要があり、1度誘導に失敗すると、次世代以降では全く効果を失うという欠点を持つ。この方法もまた、自家採種による種子の再生産ができない。また、リボヌクレアーゼ(barnase)を種子の形成期に発現させて種子を不発芽にし、barnaseのインヒビターを一過的に誘導したときだけ種子が得られる方法も考案されている。この方法では、種子を得ることが出来るが、種子を得る際に遺伝子の発現を誘導する処理を行わなければならない。これらの方法と比べ本発明では、親系統は通常の植物と同様に種子を採種できる。また、収穫する種子に従来の植物と比較して成分的に変更を引き起こすような生産物が蓄積することがない。植物が本来持つ遺伝子がプログラム細胞死を誘因するするため、毒性のある物質も使用する必要がない。
【0033】
一方生育不良を誘導する方法とは全く異なる方法も知られている。葉緑体のゲノムに遺伝子を導入することにより、花粉から遺伝子が拡散できないようにする方法 (Daniell et al. 2002)、閉花受粉の応用(吉田 2006)などの研究がある。しかし、葉緑体ゲノムに導入する場合、除草剤抵抗性のように常に発現していることが望ましい遺伝子については適しているが、植物の発生過程において特定の時期に、特定の場所で発現させる遺伝子の拡散防止に用いることは困難である。本発明においては、核に導入された遺伝子において雑種弱勢を誘導することができるため、特定の場所や発生段階で発現する遺伝子と共に用いることが出来る。また、閉花受粉を用いる方法は、花が環境条件によって開いてしまうという問題があり、必ず閉花したままで受粉が行われるようにするための研究が行われている。その点、雑種弱勢は、個体による表現型のばらつきは少なく、通常の環境では条件に左右されずに遺伝子の流れを制御することが期待される。
【図面の簡単な説明】
【0034】
【図1】日本型イネとペルー品種Jamaicaの間に見られる雑種弱勢(雨宮・明峰1963)を示す。Aは雑種弱勢の遺伝的なモデルである。Bは播種後1ヶ月の根の写真で、左は正常に成育した日本晴の根、右はJamaicaと日本晴の雑種で雑種弱勢を生じ根の成長が異常になっている。
【図2】Hwc1-1またはHwc2-1を導入した形質転換体との交雑によって生じた雑種弱勢とHwc2-1のトランスポゾン挿入変異による雑種弱勢の打破を示す。A、BはHwc2-1導入植物とJamaicaとの雑種、CはHwc1-1導入植物と台中65号との雑種である。DはHwc2-1にトランスポゾンによる挿入変異が起きた対立遺伝子ではHwc1-1を持つJamaicaとの交雑において雑種弱勢が生じなくなることを示している。 A:Hwc1-1もHwc2-1も持たないSL6-3にHwc2-1を導入した形質転換植物。左は自殖植物。右がHwc1-1を持つJamaicaを交配して得られた種子を播種したもの。 Bar=0.5 mm. B:SL6-3にHwc2-1を導入した形質転換植物とJamaicaとの雑種、播種後1ヶ月。 C:SL6-3 へHwc1-1を導入した植物とHwc2-1を持つ台中65号との雑種。Bar=0.2 mm. D:左がHwc2-1にTos17の挿入変異を持つ系統にJamaicaを交配したもの。右が日本晴とJamaicaの雑種。播種後2週間、Bar=1 cm.
【図3】圃場生態系における遺伝子拡散防止の概念図である。
【図4】gene targetingによる遺伝子導入の概念図である。gene targetingは相同組み換えにより染色体の特定部位の改変ができる。gene targetingには非相同組み換え以外の形質転換を除くためのネガティブ選抜が必要である。
【図5−1】HWC1およびコムギの同祖遺伝子にコードされるポリペプチドのアミノ酸配列整列化データである。上の3つがイネ由来の配列であり、上段から、JamaicaのHwc1-1(配列番号3)、日本晴のhwc1-2(配列番号7)、Kasalathのhwc1-2(配列番号8)に対応する。最下段がコムギの同祖遺伝子AK335189にコードされるポリペプチドのアミノ酸配列(配列番号9)である。
【図5−2】図5−1の続き。
【図6−1】HWC1およびその同祖遺伝子にコードされるポリペプチドのアミノ酸配列を比較した図である。イネやコムギの他、キンギョソウSTYLOSA(配列番号10)やシロイヌナズナLEUNIG(配列番号11)のアミノ酸配列との整列化データも示している。
【図6−2】図6−1の続き。
【図6−3】図6−2の続き。
【図7】HWC1のドメイン構造を示す。LisHやSSDPを持ち、C末端の約300アミノ酸がWD40リピートを構成している。HWC1-1ではWD40ドメインの先頭付近587位にアミノ酸置換(R→H)が生じている。http://blast.ncbi.nlm.nih.gov/Blast.cgiを用いて作図した。
【発明を実施するための形態】
【0035】
本発明者らは、高密度連鎖解析により、イネ雑種弱勢の原因となる遺伝子HWC1とHWC2の単離に成功した。さらに、本発明者らは、14kbpあるHWC1のJamaica対立遺伝子Hwc1-1染色体断片を形質転換により導入すると、Hwc2-1を持つイネと交雑した雑種で弱勢が生じることを確認した。また、交雑によらず、Hwc2-1を持つイネにHwc1-1を形質転換しても弱勢を誘導することができた。一方、8434bpのHwc2-1染色体断片を形質転換によりイネに導入して、Hwc1-1を持つイネと交雑した場合に弱勢が生じることも確認した(図2)。
【0036】
従って、本発明により、イネ由来の雑種弱勢原因遺伝子が提供される。本発明の遺伝子には二種類の遺伝子が包含される。第一の遺伝子と第二の遺伝子は一対の遺伝子として組み合わさり、両方が発現した場合に雑種弱勢または過敏感細胞死という表現型を示す。第一の遺伝子の代表例はJamaicaのHwc1-1であり、第二の遺伝子の代表例は温帯ジャポニカのHwc2-1である。
【0037】
1.用語の説明
「雑種弱勢原因遺伝子」という用語は一代雑種において生育能力が低下する現象を引き起こす原因となる遺伝子を意味する。雑種弱勢原因遺伝子は、通常1対の優性補足遺伝子であることが知られている。
【0038】
単にHWC1とHWC2という場合は、それぞれの遺伝子あるいは遺伝子座を意味する。遺伝子はコード配列の前後の部分(自己の制御配列、イントロンを含む天然のDNAあるいは外来制御配列を含むキメラ遺伝子)を含み、転写されてポリペプチドとして発現し得る概念で、遺伝子座という場合は特に染色体上における遺伝子の位置を示す。
【0039】
Hwc1-1、Hwc2-1は、それぞれの遺伝子座における雑種弱勢の原因となる対立遺伝子を示す。一方、hwc1-2、hwc2-2はそれぞれの遺伝子座における雑種弱勢を引き起こさない対立遺伝子を示す。
【0040】
HWC1-1ポリペプチド、HWC2-1ポリペプチドは、それぞれ、対立遺伝子であるHwc1-1とHwc2-1によりコードされるアミノ酸配列を有するポリペプチドを意味する。HWC1-2ポリペプチド、HWC2-2ポリペプチドも、同様に、hwc1-2とhwc2-2によりコードされるアミノ酸配列を有するポリペプチドをそれぞれ意味する。
【0041】
本明細書において、遺伝子の表記は、最近設定された表記法(McCouch SR. 2008. Gene nomenclature system for rice. Rice 1: 72-84.)に従う。この表記は、ショウジョウバエやシロイヌナズナなどモデル生物ですでに行われている表記法に準じるが、イネでは対立遺伝子は表現型に違いがあることがわかって新しく設定される。よって、雑種弱勢という表現型に関しては、例えば、雑種弱勢原因遺伝子HWC1とHWC2に対応する弱勢を起こさないものはすべて配列に違いがあってもそれぞれhwc1-2とhwc2-2ということになる。遺伝子産物であるポリペプチドとしての表記は全て大文字で記載する。
【0042】
本明細書で「植物」というときは、特に明記した場合を除き、植物体(個体)の他、種子(発芽種子、未熟種子を含む)、器官又はその部分(葉、根、茎、花、雄蕊、雌蘂、それらの片を含む)、植物培養細胞、カルス、プロトプラストを含む。
【0043】
「外来」遺伝子は、形質転換などの遺伝子操作により、新たに導入された遺伝子をいう。特に、他の生物種に由来する場合を指す。
【0044】
「キメラ」遺伝子は、異なる遺伝子の部分を組み合わせて新たに機能を持つように作られた遺伝子を指す。例えばカリフラワーモザイクウイルスの35Sプロモーターとイネのある遺伝子のcDNA、アグロバクテリウムのノパリン合成酵素のポリA付加配列、ターミネーターを連結した遺伝子などを示す。
【0045】
「作動可能に連結された」は、一方の機能が他方の影響を受けるという、一つの核酸配列に対するもう一つの核酸配列の関連を指す。例えば、プロモーターがコード配列の発現に影響を及ぼすことができるとき、すなわち、コード配列がプロモーターの転写調節下にあるとき、このプロモーターはコード配列と作動可能に連結されている。
【0046】
「発現カセット」とは形質転換ベクターに含まれる遺伝子領域であって、植物において発現するのに必要な制御部位を持ち、適当なクローニングサイトに発現させたいDNA配列を連結すればそのDNA領域を含む転写産物が得られるものをいう。
【0047】
本明細書で使用される遺伝子組換え、クローニング、形質転換等の技術は、当該技術分野で周知であり、例えばMolecular Cloning(Sambrook, J. et al., Molecular Cloning :a Laboratory Manual 2nd ed., Cold Spring Harbor Laboratory Press, 10 Skyline Drive Plainview, NY (1989))モデル植物の実験プロトコール(島本功、岡田清孝、田畑哲之監修 秀潤社ISBN4-87962-286-9)に記載されている。
【0048】
2.Hwc1-1の単離
Hwc1-1はこれまでの調査から野生イネやインディカ品種、ジャポニカ品種を含む栽培イネでも見つからず、唯一ペルーの品種Jamaicaだけが例外的に持つことが知られている。これまで、雑種から種子を得ることが困難であったためHwc1-1の遺伝解析や単離は困難であった。本発明者らは、Hwc1-1を持ち、遺伝子型がHwc1-1/Hwc1-1、hwc2-1/hwc2-1であるJamaicaとHwc1-1もHwc2-1も持たないKasalath(hwc1-2/hwc1-2, hwc2-2/hwc2-2)を交配し、F1(Hwc1-1/hwc1-1、hwc2-1/hwc2-1)を得た。次に、このF1から自殖種子を得てHWC1がHwc1-1/Hwc1-1、Hwc1-1/hwc1-2、hwc1-2/hwc1-2のような3つの遺伝子型に分離するF2世代を4747個体育成した。この中から染色体上でHWC1を挟むDNAマーカー RMKG14、RM5間で組み換えを起こした21個体を選抜した。選抜個体をhwc1-2/hwc1-2, Hwc2-1/Hwc2-1の遺伝子型を持つ台中65号と検定交配し、後代の表現型を調査することでHWC1遺伝子座の遺伝子型を決定した。候補領域をさらに絞り込むため、新たにDNAマーカー RMNM37、RMNM38を作成し連鎖解析を行ったところ、HWC1は両マーカーの間に位置することが判明した。2マーカー間の距離は14 kbpであった。RAP-DBに公開されている日本晴のゲノム塩基配列においてはこの領域に存在する遺伝子モデルはOs01g0607400のみであった。一方、Jamaicaから核DNAを単離し、Bacteria Artificial Chromosome (BAC)ライブラリーを作製し、HWC1近傍のDNAマーカーでHWC1領域を含むクローンを選抜した。このクローンのDNA塩基配列をショットガンシーケンス法によって決定し、Rice GAASを用いて遺伝子予測を行った。JamaicaにおけるHWC1領域の遺伝子の並びはRAP-DBの日本晴と一致しており、Os01g0607400の対立遺伝子と考えられるOpen Reading Frame (ORF) も存在した。日本晴のOs01g0607400とそのJamaicaにおける対立遺伝子を比較したところアミノ酸置換を伴う1塩基多型が見出された。連鎖解析の結果と表現型に対応する遺伝子多型が見つかったことから、この遺伝子がHWC1であると推定された。これを証明するために、遺伝子の上流制御配列、転写領域を含む全長14 kbpのJamaica染色体断片を形質転換ベクターpCAMBIA1301に導入しHwc2-1を持つ日本晴、あるいはHwc2-1を持たない日本晴の第4染色体をKasalath染色体に置換した系統(以下SL6-3)へアグロバクテリウム法を用いて形質転換を行った。その結果、Hwc2-1を持つ日本晴では弱勢を示す形質転換体が8個体得られたが、Hwc2-1を持たないSL6-3系統では弱勢を生じる個体は現れなかった。また、このSL6-3に候補遺伝子を導入した形質転換植物から得られたT1植物8系統にHwc2-1を持つ台中65号を検定交配すると雑種弱勢を生じる個体が生じた。
【0049】
かくして、Os01g0607400がHWC1に相当し、この遺伝子のJamaica対立遺伝子がHwc1-1の本体であることが確認された。
【0050】
HWC1の推定アミノ酸配列中には、特徴的な領域としてC末端側にWD40の繰り返しモチーフを持ち、N末端側にLisH(lissencephaly type 1-like homology)ドメインを持っている。これら2つのモチーフはどちらもタンパク質相互作用に関わるモチーフとして知られている。RAP-DBではGene Ontology (GO)においてDNA binding、nucleusの記載があり、タンパク質モチーフとしては、WD40リピートやLisHの他 Single-stranded DNA-binding protein, SSDPが記載されている。図7にHWC1のドメイン構造の模式図を示す。当該WD40リピートモチーフは配列番号7で示される日本晴Os01g0607400の産物として推定されたアミノ酸配列において580位から876位までとなっており、LisHモチーフは10位から36位までである。HWC1-1ではWD40ドメインの先頭付近587位にアミノ酸置換(R→H)が生じている。また、このドメイン構造からHWC1はGroucho/Tup1ファミリーに属する遺伝子であると考えられる。相同性検索とドメイン構造の比較から、キンギョソウのSTYLOSA、シロイヌナズナのLEUNIGがHWC1の同祖遺伝子と考えられる。これらの遺伝子は、花の発生、葉の形、維管束形成などで重要な働きを持つものとして報告がある。しかし、これまで、これらの同祖遺伝子にはプログラム細胞死の誘導、雑種弱勢との関係については報告がなく、GOにもcell deathの記載はない。また、これまでの報告からそのような機能を予測する論理的な根拠はない。
【0051】
本発明者らが単離に成功したHwc1-1の染色体断片は、5'制御領域+プロモーター+エクソン+イントロン+polyA付加配列を含む14068bpからなる、配列番号1に示される塩基配列を有する。配列番号1において11527番目の塩基Aが日本晴を含む通常のイネではGになっており、この一塩基変異がアミノ酸配列の587位においてWDモチーフの単一アミノ酸の変異をもたらす(日本晴:アルギニン、Jamaica:ヒスチジン)。配列番号1の塩基配列は2631塩基対のORFに対応し、配列番号3に示される876個のアミノ酸からなるタンパク質をコードする。配列番号1に示される塩基配列から転写され修飾されて成熟したmRNAを逆転写して得られるcDNAのセンス鎖DNA塩基配列が配列番号2で表される。
【0052】
3.第一の遺伝子
本発明の雑種弱勢原因遺伝子の第一の遺伝子の典型的な例は、配列番号1または2に示される配列を有するDNA、あるいは配列番号3に示されるアミノ酸配列をコードするDNA、あるいはコドンの縮重の範囲内で配列番号3に示されるアミノ酸配列と同じアミノ酸配列をコードするDNAである。しかしながら、本発明の雑種弱勢原因遺伝子の第一の遺伝子はこれらに配列を有するものに限定されない。
【0053】
本発明の雑種弱勢原因遺伝子の第一の遺伝子の必須の特徴は、第二の遺伝子であるHWC2遺伝子座の対立遺伝子Hwc2-1が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有することである。
【0054】
本発明者らの研究により、イネの雑種弱勢原因遺伝子HWC1、HWC2が単離され、イネ雑種弱勢の一つではNB-LRR型遺伝子による過敏感細胞死が原因で生じている可能性が高いことが明らかとなった。シロイヌナズナでもNB-LRR型遺伝子が雑種ネクロシスを引き起こすことが報告されており(Bomblies et al. (2007) PLoS Biol. 5: 1962-1972)、これらの例のように自分自身の持つ遺伝子をエリシターとして認識し、過敏感細胞死を起こす自己免疫不全型の雑種不全は、様々な植物分類群の交雑において見られる可能性が考えられる。つまり、本発明においてHwc1-1の配列が明らかとなったことにより、これまでメカニズムが不明であった雑種弱勢、致死という現象の一つについて、病害抵抗性遺伝子Hwc2-1による抵抗性反応を引き起こす単一アミノ酸変異をHwc1-1が有することによって生じた現象であることが推測できるようになった。
【0055】
図5に、JamaicaのHWC1-1のアミノ酸配列(配列番号3)と、野生型ポリペプチドである日本晴(Nipponbare)のHWC1-2(配列番号7)又はKasalathのHWC1-2(配列番号8)との比較を示す。日本晴由来HWC1-2ポリペプチドの587位又はKasalath由来HWC1-2ポリペプチドの588位のアルギニンが、HWC1-1ポリペプチドの587位に相当するアミノ酸ではヒスチジンに置換されている。Kasalath由来HWC1-2ポリペプチドの588位のアルギニンは、HWC1-1ポリペプチドと整列化したときにHWC1-1ポリペプチドの587位と同じ位置で整列する(図5−2中3列目の網掛部分に注目されたい)。
【0056】
従って、本発明の雑種弱勢原因遺伝子の第一の遺伝子は、一態様において、HWC1-2ポリペプチドに対して特定の部位で一アミノ酸残基の置換を有する変異ポリペプチドをコードする、HWC1の対立遺伝子として定義される。この特徴的な変異の位置は、イネ品種「日本晴」のHWC1-2ポリペプチドあるいはJamaicaのHWC1-1ポリペプチドのいずれにおいても587位のアミノ酸残基として、一義的に表現できる。変異ポリペプチドは、第二の遺伝子であるHwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有することで特徴付けられ、推定配列がデータベース上に公開されている日本晴由来のポリペプチドに代表される野生型ポリペプチドとは異なる新規な機能を有するものである。
【0057】
HWC1は発生に必須の遺伝子であるが、JamaicaのHWC1-1ポリペプチドにおいては、野生型のアルギニンが同族の塩基性アミノ酸ヒスチジンに変化したためにJamaicaに劣悪な変化が生じないのだと思われる。塩基性アミノ酸としては他にリシンがある。よって、本発明の雑種弱勢原因遺伝子の第一の遺伝子は、HWC1-2ポリペプチドに対する前記変異が、HWC1-1ポリペプチドの587位に相当するアミノ酸のヒスチジンまたはリシンへの置換である変異ポリペプチドをコードする遺伝子であってもよい。HWC1-2ポリペプチドのアミノ酸配列としては、例えば、配列番号7に示される日本晴(Nipponbare)由来の配列、または配列番号8に示されるKasalath由来の配列等が挙げられるが、これらに限定されない。
【0058】
HWC1-2ポリペプチドは品種の違いによって配列番号7、配列番号8でみられるようにアミノ酸配列やアミノ酸残基数に多様性があるが、図5のようにHWC1-1ポリペプチドと整列化することでHWC1-1ポリペプチドの587位に相当するアミノ酸を定義することができる。また、イネ科の植物であればHWC1のアミノ酸配列はよく相同性が保たれており、コムギでもイネのHWC1-1ポリペプチドと85%の相同性が見られ、図5のような整列化によってHWC1-1ポリペプチドの587位に相当するアミノ酸は明確に定義することが出来る。さらに、図6のようにシロイヌナズナやキンギョソウなど分類群の離れた種でも整列化によってHWC1-1ポリペプチドの587位に相当するアミノ酸を定義することが可能である(図6−2中6列目の網掛部分)。
【0059】
本発明の雑種弱勢原因遺伝子の第一の遺伝子は、Hwc1-1遺伝子産物である変異ポリペプチドの部分配列あるいは部分配列を用いた融合タンパク質をコードする遺伝子であってもよい。当該部分配列は、少なくとも10個以上、好ましくは50個以上、より好ましくは100個以上、さらにより好ましくは200個以上、最も好ましくは少なくともWD40リピートドメインの330個の連続したアミノ酸残基を有することが望ましい。さらに、本発明の雑種弱勢原因遺伝子の第一の遺伝子は、上述の特徴的なHWC1-1ポリペプチドの変異部分を挟む10残基からなるアミノ酸配列VAKAHASA-KVに示される、ヒスチジンを生じる変異によっても定義することもできる。当該アミノ酸配列の式中、下線部のヒスチジン残基がHWC1-1ポリペプチドの587位に相当し、−は任意のアミノ酸残基(好ましくはT又はS)又は一残基の欠失を表しHWC1-1ポリペプチドの591位に相当する。本発明の雑種弱勢原因遺伝子の第一の遺伝子は、このヒスチジンを生じる変異部分を挟む200アミノ酸程度からなる部分配列をコードする遺伝子と適当なプロモーターなどを連結したキメラ遺伝子であってもよい。
【0060】
本発明の第一の遺伝子は、例えば、化学合成により、または、染色体をクローニングしたベクターから制限酵素等により切り出すことにより、あるいはJamaicaのDNAを鋳型としたPCRにより、入手可能である。
【0061】
4.Hwc2-1の単離
HWC2遺伝子は第4染色体のフェノール反応性遺伝子Phの近傍に座乗している。そこで、本発明者らはHWC2においてもHWC1と同様の方法で、まず日本晴とKasalathの雑種第二代を用いて連鎖解析を行った。しかし、HWC2の近傍染色体領域は日本晴とKasalathの間で組換えが抑制され、連鎖解析による絞り込みが困難であった。そこで、他の交配組み合わせによる雑種集団(12632個体のF2集団と2574個体の3系交配集団)を用いて連鎖解析を行った。最終的には,IR24 X 金南風、J147 X IR24、 アキヒカリ X カサラスの交雑F2に出現した組換え個体によって座乗位置を約6000塩基に絞り込んだ。
【0062】
この領域に座乗する遺伝子は1つで、Rice Genome Annotation ProjectではLOC_Os04g53160として記載されていた。弱勢を引き起こすHwc2-1対立遺伝子を持つ品種についてLOC_Os04g53160のcDNAの塩基配列を解読したところ、Hwc2-1を持つ日本晴、山田錦、Ketang Nangkaは互いに全く同じ塩基配列を示した。一方、hwc2-2をもつ品種では、KasalathやJamaicaなどのようにHWC2領域の染色体構造が日本晴に対して大きく異なっているものもあった。DNAマーカーによる分析により、HWC2領域の染色体構造は13のハプロタイプに分類され、そのうち、ハプロタイプ1から5までは、Hwc2-1と類似した構造を持つと推定された。そのため、ハプロタイプ3から5に属する系統についてcDNAの塩基配列を解読したところ、KatakutaraではHwc2をもつ品種に対して1カ所に集中して4塩基置換が起こっており、2アミノ酸の置換を引き起こすと考えられた。他のhwc2をもつ品種はKatakutaraとやや異なる配列を示したが、Hwc2をもつ品種に対してKatakutaraと共通の1カ所の4塩基置換(日本晴:TACAAGTAAAGGGGAAC、Katakutara:TACATGTACTGGGAAAC、置換部位にアンダーライン)を起こしていた。この4塩基置換の箇所は制限酵素Rsa I認識部位であったので、この部分を挟むようにプライマーを設計してPCR、制限酵素処理を行ったところ、制限酵素による切断あり/なしは生物研ジーンバンクが配布している世界イネコアコレクション、日本在来イネコアコレクションにおいてhwc2-2/Hwc2-1に完全に対応した。
【0063】
以上の結果から、HWC2がLOC_Os04g53160であることが示唆されたため、日本晴のLOC_Os04g53160を含む染色体領域をアグロバクテリウム法により形質転換し、相補性検定を実施した。具体的な方法は以下の通りである。転写開始点上流の制御領域とpolyA付加配列を含んだ8.4kbpの染色体断片をPCRにより増幅し、形質転換用ベクターpCAMBIA1301にクローニングを行った。挿入断片については、配列を確認し、塩基置換などの変異がないことを確認した。この構築されたプラスミドを用いHWC2領域がKasalath染色体に置換されたSL6-3系統へ形質転換を行った。得られた形質転換植物は正常に生育したが、T0世代でHwc1-1を持つJamaicaと交配すると激しい雑種弱勢の表現型が現れた(図2C)。系統によっては、交配によって弱勢を示す雑種と正常な雑種が得られた。この時、雑種弱勢の出現と形質転換した遺伝子の存在は対応しており、正常な雑種では形質転換した遺伝子が検出できなかった。
【0064】
さらに、日本晴LOC_Os04g53160のアミノ酸コード領域にレトロトランスポゾンTos17あるいはTos17のLTR配列が挿入した系統にJamaicaを交配したところ雑種弱勢が現れない個体が見られた。正常な雑種にはLOC_Os04g53160への挿入配列が存在し、弱勢を生じた雑種では挿入が検出されなかった(図2D)。
【0065】
以上のことから、LOC_Os04g53160として記載されていたORFがHWC2であることが確認された。しかし、この推定された遺伝子モデルは完全長cDNAなどの転写産物による裏付けのあるものではなかったので、実際に転写産物があるかどうかをRT-PCRによって確認し、その転写産物について塩基配列を決定したところ、推定された翻訳開始点を含む転写産物が存在し、イントロンの切り出し位置も遺伝子モデルが正しいことが明らかとなった。
【0066】
前述したように、第二の遺伝子であるHWC2は、NB-LRR型の植物病害抵抗性遺伝子の一種である。
【0067】
Hwc2-1対立遺伝子のゲノム配列を配列番号4に、配列番号4に示される塩基配列から転写され修飾されて成熟したmRNAを逆転写して得られるcDNAのセンス鎖DNA塩基配列を配列番号5に、当該塩基配列によりコードされるアミノ酸配列を配列番号6に示す。
【0068】
Hwc2-1対立遺伝子は、主に、温帯型のジャポニカ品種のゲノムDNAまたはcDNAから入手することができる。Hwc2-1を持つ品種の例は、日本晴、愛知旭、名古屋白、信州、雷電、亀治、早生旭、宝、七面鳥糯、水稲農林8号、雄町、水稲農林6号、神力糯、銀坊主、台中65号、神力、水稲農林17号、旭4号、水稲農林22号、森田早生、石白、愛国、水稲農林1号、埼玉糯、上州、団子、陸稲陸羽2号、DIANYU 1、宝満神田稲、細稈、京都旭、双葉、竹成、ヒメノモチ、坊主糯、目黒糯、富国、白稲、REXMONT、JAGUARY、かばしこ、万作、赤毛、関山、冷立稲、金南風、コシヒカリ、アキヒカリである。これらのイネ品種の染色体をクローニングしたベクターから制限酵素等により切り出すことにより、あるいはこれらの品種のDNAを鋳型としたPCRにより、Hwc2-1対立遺伝子を得ることができる。あるいは、本願に開示された塩基配列に基き化学合成によっても、入手可能である。
【0069】
5.ベクター、発現カセット
本発明はまた、本発明の遺伝子を含むベクターまたは発現カセットを提供する。発現カセットは本発明の遺伝子を適当なプロモーターに連結させて含有する、ベクター中の遺伝子領域である。
【0070】
ベクターは宿主中で複製可能なものであれば特に限定されず、例えば、プラスミドDNA、ファージDNA等が挙げられる。プラスミドDNAとしては、大腸菌由来のプラスミド(例えば、pBR322、pBR325、pUC18、pUC119、pTrcHis、pBlueBacHis 等)、枯草菌由来のプラスミド(例えば、pUB110、pTP5 等)、酵母由来のプラスミド(例えば、YEp13、YEp24、YCp50、pYE52 等)、植物細胞宿主用プラスミド(pBI221、pBI121)等が挙げられ、ファージ DNAとしてはλファージ等が挙げられる。本発明において特に有用なベクターは、植物用のクローニングベクターである。植物細胞用のクローニングベクターに本発明の遺伝子を挿入することにより、トランスジェニック植物を作成するための植物形質転換用ベクターを得ることができる。
【0071】
ベクターに本発明の遺伝子を挿入するには、本発明の遺伝子を含む精製されたDNAを適当な制限酵素で切断し、必要に応じて適切なリンカーを連結し、さらに必要であればプロモーター領域を組み換えて、ベクターDNAの制限酵素部位またはマルチクローニングサイトに挿入してベクターに連結する方法等が採用される。
【0072】
本発明の遺伝子は、宿主に応じたプロモーターに作動可能に連結してベクターに導入される必要がある。プロモーター活性によって、その下流に配置された本発明の遺伝子は宿主中で適切に発現される。
【0073】
プロモーターとしては、構成性のプロモーターを使用しても、条件特異的に活性化されて、その下流の遺伝子を発現させるプロモーターを使用することもできる。
【0074】
本発明において好適なものは、植物中で構成的に発現できるプロモーターである。そのようなプロモーターとしては様々なタイプのものが多数公知であり、また絶えず発見されており、例えば、カリフラワーモザイクウイルスの35S RNAプロモーター、rd29A遺伝子プロモーター、rbcSプロモーター等が挙げられるが特に限定されない。例えば、次の文献を参照されたい。C Kuhlemeier, P J Green, and N H Chua (1987) Regulation of Gene Expression in Higher Plants. Annual Review of Plant Physiology 38: 221-257.;Venter M. (2007) Synthetic promoters: genetic control through cis engineering. TRENDS in Plant Science Vol.12 No.3 1360-1385.
本発明のベクターは、プロモーター、本発明の遺伝子のほか、所望によりエンハンサー等のシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー(例えば、ジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子等)、リボソーム結合配列(SD配列)等を含んでいてもよい。
【0075】
6.形質転換
本発明のベクターを、目的遺伝子が発現し得るように宿主中に導入することにより形質転換体を得ることができる。宿主は、本発明の遺伝子を発現できるものであれば特に限定されない。
【0076】
本発明において、好適な宿主は植物細胞(植物培養細胞、プロトプラスト、イネであれば胚盤誘導カルス細胞)である。
【0077】
植物細胞への遺伝子導入法としては、アグロバクテリウムを用いる方法(Horschet al.,Science,227,129(1985)、Hiei et al.,Plant J.,6,271-282(1994))、リーフディスク法(Horsch et al.,Science,227,1229-1231(1985))、エレクトロポレーション法(Fromm et al.,Nature,319,791(1986))、PEG法(Paszkowski et al.,EMBO J.,3,2717(1984))、マイクロインジェクション法(Crossway et al.,Mol.Gen.Genet.,202,179(1986))、微小物衝突法(パーティクルガン法)(McCabe et al.,Bio/Technology,6,923(1988))、ポリエチレングリコール法、リポソーム法、マイクロインジェクション法などが挙げられるが、特に限定されない。これらの導入法の中で好ましくは、ベクターを接合操作等を利用してアグロバクテリウム内に移し、このアグロバクテリウムを植物に感染させることによる。感染させるための方法も、当業者には周知である。例えば、植物体の一部を傷つけ、そこに細菌を感染させる方法、植物体の胚組織(未熟胚を含む。)に細菌を感染させる方法、カルスに感染させる方法、プロトプラストと細菌を共培養する方法、又は葉組織の小片を細菌とともに培養する方法(リーフディスク法)がある。
【0078】
ベクターの選択は、形質転換の方法によって異なる。
【0079】
好適なクローニング用ベクターとしては、例えば、pBI221、pBI121(以上Clontech社製)、及びこれらから派生したベクター等が挙げられる。また、特に単子葉植物の形質転換には、pIG121Hm、pTOK233(以上Hieiら,Plant J.,6,271-282(1994))、pSB424(Komariら, Plant J.,10,165-174(1996))、スーパーバイナリーベクターpSB21及びこれらから派生したベクターなどが例示される。
【0080】
植物形質転換用ベクターは、少なくともプロモーター、翻訳開始コドン、所望の遺伝子、翻訳終始コドン及びターミネーターを含んでいることが好ましい。また、シグナルペプチドをコードするDNA、エンハンサー配列、所望の遺伝子の5’側及び3’側の非翻訳領域、選抜マーカー領域などを適宜含んでいてもよい。マーカー遺伝子の例としては、テトラサイクリン、アンピシリン、又はカナマイシン若しくはネオマイシン、ハイグロマイシン又はスペクチノマイシン等の抗生物質耐性遺伝子等の他、ルシフェラーゼ遺伝子、β−ガラクトシダーゼ、β−グルクロニダーゼ(GUS)、グリーンフルオレッセンスプロテイン(GFP)、β−ラクタマーゼ、クロラムフェニコールアセチルトランスフェラーゼ(CAT)等が挙げられる。
【0081】
得られた形質転換細胞は、適当なマーカーを指標とするか、又は所望の形質を発現しているか否かによって他の細胞から選択することができる。形質転換細胞をさらに従来技術を利用して分化させることにより、目的の形質転換植物体とすることができる。本発明の遺伝子を発現する、外来遺伝子で形質転換された植物も本発明の範囲に含まれる。
【0082】
得られた形質転換体の解析は、当業者に周知の種々の方法を用いて行うことができる。例えば、導入した遺伝子のDNA配列を基にオリゴヌクレオチドプライマーを合成し、これを用いたPCRにより形質転換植物の染色体DNAを解析することができる。また、導入した遺伝子に対応するmRNAや、タンパク質の発現の有無により解析することができる。
【0083】
7.雑種弱勢の誘導
本発明の遺伝子を形質転換によって植物に導入すると人為的に雑種弱勢を誘導することができる。すなわち、両方の遺伝子を持つ植物は生育できないので、例えば、Hwc1-1を導入された形質転換植物はHwc2-1を持つ植物と交配したときに雑種が弱勢を起こすようになり、反対に、Hwc2-1を導入された形質転換植物はHwc1-1を持つ植物と交配したときに雑種が弱勢を起こすようになる。
【0084】
従って、本発明は、第一の遺伝子を形質転換により導入することにより、Hwc2-1を含む持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該植物に付与する方法を含む。この方法は、(a)第一の遺伝子で植物を形質転換する工程と、(b)導入した第一の遺伝子が持つ配列を指標として形質転換植物を選択する工程を含む。Hwc2-1を含む持つ植物の典型的な例は温帯ジャポニカ型のイネである。
【0085】
同様に、本発明は、Hwc2-1を持たない植物にHwc2-1を形質転換により導入して、第一の遺伝子(例えばHwc1-1)を持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該植物に付与する方法を含む。天然でHwc1-1を持つ植物の例はペルーのイネ品種Jamaicaである。当該方法で利用可能な、Hwc2-1を持たない植物の例としては、IR 58、CO 13、凱旋糯、日の出、戦捷、山田化、オッカモドシ、渡舟、唐干、葉冠、ハバタキ、陸稲農林糯1号、ZENITH、Latisal、あそみのり、PULUIK ARANG、BASILANON、LEBED、NEANG PHTONG、RADIN GOI SESAT、Intan Merah、黄玉、黄金丸、金子、TADUKAN、PADI KUNING、RAMBHOG、PINULUPOT 1、DAHONGGU、RATUL、HONG CHEUH ZAI、RYOU SUISAN KOUMAI、SHWE NANG GYI、VANDARAN、KEIBOBA、BADARI DHAN、KASALATH、ARC 5955、Katakutara、TIMA、ARC 11094、IR36、杜稲、TUPA 121-3、CHIN GALAY、ARC 7047、CALOTOC、BINGALA、TUPA 729、SHONI、Bhasamanik、Badshabhog、ARC 7291、URASAN 1、PTB 7、タカチホ、新山田穂2号、PADI ASE BAUDA、GUANGLUAI 4、PTB 10、BEI KHE、嘉平、MA SHO、SHUUSOUSHU、おいらん、MILYANG 23、BLEIYO、PADI PERAK、KHAU TAN CHIEM、NEANG MENH、Intan su se、DAVAO 1、HAKPHAYNHAY、IR24、AZUCENA、NABA、陸稲農林12号、KEMASIN、QINGYU、VARY FUTSI、岡穂、PHULBA、DENG PAO ZHAI、KALO DHAN、SURJAMUKHI、KHAU MAC KHO、MUHA、LOCAL BASMATI、ASU、JENA 035、KHAO NAM JEN、ANJANA DHAN、八束穂、JHONA 2、JINGUOYIN、KHAO NOK、DEEJIAOHUALUO、NEPAL 555、NEPAL 8、平山、陸稲農林21号、JARJAN、ADT 14、Dular、Assam 4、PTB 10、ARC10303、TN1、TKM6、農林11号、胆振早生、シレワ、Java 14、Kele、Ashkata、Bhutmuri、Tetep、南京11号、Culture 340、DV85等のイネ品種が挙げられる。あるいは、Hwc2-1を持たない植物として、染色体置換系統SL6-3系統のように、第四染色体を置換する等の方法によりHwc2-1を持たないように染色体操作された温帯ジャポニカ型のイネの系統も利用可能である。
【0086】
上述の方法においては、交雑により生じた種子が発芽した植物は、生育不良となり次世代の種子を生じない必要がある。従って、本発明の遺伝子が、形質転換された植物においてゲノムDNAに組み込まれ、安定に保持され、雑種植物体で発現することが望ましい。雑種弱勢では第一の遺伝子が発現する部位でプログラム細胞死が生じると考えられるため、確実に植物体を枯死させるには、第一の遺伝子は植物体のうち、根、維管束、葉など生存に必須な器官で発現するかあるいは植物体全体で発現することが望ましい。また、第二の遺伝子(Hwc2-1)は第一の遺伝子が発現する部位で発現するかあるいは、植物体全体で発現することが必要となる。さらに、第一の遺伝子の発現レベルが高ければ高いほど弱勢の症状は強くなる傾向があるので、第一の遺伝子は充分な発現量を必要とする。
【0087】
実施例で解析された植物はイネ(Hwc2-1を持つ品種として「日本晴」、Hwc2-1を持たない品種として染色体置換系統SL6-3系統と「あそみのり」、Hwc1-1を持つ品種としてJamaica)であるが、本発明はイネ以外の植物にも利用可能であると考えられる。このような植物として、農作物ではコムギ、オオムギ、ライムギ、トウモロコシ、サトウキビ、ソルガム、ワタ、ヒマワリ、ピーナッツ、トマト、ジャガイモ、サツマイモ、エンドウ、ダイズ、アズキ、レタス、キャベツ、カリフラワー、ブロッコリー、カブ、ダイコン、ホウレンソウ、タマネギ、ニンジン、ニンニク、ナス、カボチャ、キュウリ、リンゴ、ナシ、メロン、イチゴ、ブドウなどが、観賞用植物としてはシロイヌナズナ、ペチュニア、キク、カーネーション、セントポーリア、ヒャクニチソウなどが挙げられる。中でも、イネ科の穀物(例えば、トウモロコシ、オオムギ、コムギ、ライムギ、サトウキビ、ソルガム)においては好適に利用し得る可能性が十分にあると思われる。
【0088】
8.生態系への応用
上述の雑種弱勢を誘導する方法を利用して、圃場生態系において望ましくない交雑によって遺伝子が拡散することを防ぐことができる。例えば、イネは通常開花し、開花の直前もしくは開花とほぼ同時に自家受粉することが知られているが、この時、風にのって花粉が外部に飛散する。そのため、遺伝子組換えイネにおいて、花粉飛散による非組換えイネへの外来遺伝子飛散が懸念されている(吉田ら2007;非特許文献3)。日本の稲作で用いられている品種はほとんどがHwc2-1を持つため、形質転換体を作成する場合、外来遺伝子と第一の遺伝子のコードするタンパク質の全体あるいは一部を発現する遺伝子(例えばHwc1-1)を一緒に形質転換すれば、形質転換体が周囲に栽培されている品種と交雑しても弱勢が生じて次世代の種子を生じることがない(図3)。
【0089】
本発明で利用可能な外来遺伝子の例としては、除草剤耐性遺伝子、害虫抵抗性遺伝子、耐冷性遺伝子、耐乾燥性遺伝子、物質の生合成に関わる遺伝子(ビタミンAなど)、植物の含有成分を改変する遺伝子(例えば、花粉症アレルゲンタンパク質などの医薬に関する遺伝子)、植物発生プログラムの変更に関わる遺伝子(開花特性(日長感応性、春化要求性)、発芽に関する性質、草丈、草型、花の大きさや形態、実の大きさ、生殖様式(単為結果性、単為生殖性、自家不和合性)、葉序、花序、根や茎の肥大等)等が挙げられる。
【0090】
交雑により生じた種子が発芽した植物は、生育不良となり次世代の種子を生じないため、導入されたこれらの外来遺伝子は、その遺伝子組換え植物のみに留まり、周囲の雑草や他の栽培品種に広がらない。
【0091】
これらの遺伝子とHwc1-1を一緒に形質転換する方法としては、これらの遺伝子とHwc1-1遺伝子を連結した状態で含む形質転換用ベクターを利用する方法が適切である。
【0092】
9.Hwc1-1およびHwc1-2のネガティブマーカーとしての利用
Hwc2-1を持ち、Hwc2-1が発現する細胞でHwc1-1を発現させた場合に過敏感細胞死が生じることを利用して、Hwc1-1をネガティブマーカーとして細胞選抜に利用できる。相同組換えによって染色体の特定の遺伝子の配列を組み換えるジーンターゲティングを行うときにネガティブ細胞選抜が必要であるが、その際に利用可能な技術である。Hwc2-1を持つ染色体を有する植物細胞に、形質転換により標的遺伝子(target gene)とともにHwc1-1を導入すると、Hwc2-1の働きによりHwc1-1を持つ細胞は死滅するが、相同組換えによってHwc1-1が除かれた細胞は生き残るので、ジーンターゲティングが成功した細胞を選抜することができる(図4)。
【0093】
具体的には、ベクターの中にHwc1-1のcDNA配列を発現を誘導するプロモーターとともに挿入し、Hwc2-1を持つ植物に形質転換したときに、形質転換が起きると過敏感細胞死を起こすネガティブ選抜マーカー遺伝子として利用する。
【0094】
従って、以下の方法も本発明の範囲に含まれる。
【0095】
HWC1遺伝子座の対立遺伝子Hwc1-1を組み込んだ発現カセットを、HWC2遺伝子座の対立遺伝子Hwc2-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0096】
一態様において、前記Hwc1-1は配列番号2の塩基配列またはその一部からなる配列を有する。配列番号2の一部からなる配列は、HWC1-1ポリペプチドの変異部分を挟む10残基のアミノ酸配列VAKAHASA-KVを含むポリペプチドをコードすることが望ましい。
同様に、Hwc2-1もHwc1-1を持つ植物においてマーカーとなる。従って、以下の方法も本発明の範囲に含まれる。
【0097】
HWC2遺伝子座の対立遺伝子Hwc2-1を組み込んだ発現カセットを、HWC1遺伝子座の対立遺伝子Hwc1-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0098】
一態様において、前記Hwc2-1は配列番号5の塩基配列またはその一部からなる配列を有する。
【0099】
以下、本発明を実施例によって具体的に説明する。実施例で用いたHwc1-1とHwc2-1は、遺伝子および発現制御領域を含む染色体の断片であり、それぞれ配列番号1と配列番号4に示される塩基配列を有する。なお、これらの実施例は、本発明を説明するためのものであって、本発明の範囲を限定するものではない。
【実施例1】
【0100】
Hwc1-1を持たない植物にHwc1-1を導入し、雑種弱勢を人工的に誘導した例
Jamaicaのバクテリア人工染色体(BAC)を用いたゲノムDNAライブラリーを作製し、Hwc1-1を含むBACクローンをDNAマーカーRMNM37、RMNM38を用いて選抜した。選抜されたBACクローンから遺伝子の上流制御配列、転写領域を含む全長14 kbpのJamaica染色体断片を切り出し、形質転換ベクター pCAMBIA1301(http://www.cambia.org/daisy/cambia/585.html)のSal IとSac Iの間に挿入した。この形質転換ベクターをアグロバクテリウムEHA105とヘルパー大腸菌PRK2013を用いた3者接合法によってアグロバクテリウムへ導入した。このアグロバクテリウムを用い、日本晴の第4染色体をHwc2-1を持たないKasalath染色体に置換した系統(以下SL6-3)へ形質転換を行った。形質転換にはToki ら (2006: Seiichi Toki, Naho Hara1, Kazuko Ono1, Haruko Onodera1, Akemi Tagiri1, Seibi Oka and Hiroshi Tanaka (2006) Early infection of scutellum tissue with Agrobacterium allows high-speed transformation of rice. Plant Journal 47: 969-976.)の方法に従い、イネ種子の胚盤から誘導されるカルスにアグロバクテリウムを共存培養する方法を用いた。形質転換植物は正常に生育し、SL6-3と異なる表現型を示すことはなかった。しかし、SL6-3に候補遺伝子を導入した形質転換植物から得られたT1植物8系統にHwc2-1を持つ台中65号を検定交雑すると、交雑種子から雑種弱勢を生じる個体が生じ(図2C)、PCRによって導入遺伝子の有無を確認すると、弱勢の表現型と導入した遺伝子の有無が一致した。以上より、Hwc1-1を形質転換ベクターに入れてHwc1-1を持たない植物に導入することにより、人工的に雑種弱勢を誘導できることが示された。また、この時用いたベクターpCAMBIA1301はHwc1-1の他、35Sプロモーターに連結したハイグロマイシン抵抗性遺伝子(hptII)やβ-グルクロニダーゼ遺伝子などを含んでいる。そのため、有用な遺伝子とHwc1-1を同時に形質転換して雑種弱勢を誘導するということも本実施例と同様に行うことができると考えられる。
【実施例2】
【0101】
Hwc2-1を持たない植物にHwc2-1を導入し、雑種弱勢を人工的に誘導した例
日本晴のHwc2-1染色体断片8.4kbpをLongPCRにより増幅後、プライマーに付加した制限酵素認識配列をKpn I、SalIで切断、pCAMBIA1301にクローニングし、Hwc2-1を持たないSL6-3系統、あるいは「あそみのり」へHwc1-1の場合と同様の方法で導入した。得られた形質転換植物は正常に生育した。一方、これらのT0世代形質転換植物8個体とHwc1-1を持つJamaicaとを検定交雑し、その後代で表現型を調べると、交雑後代からいずれも強い雑種弱勢を示す個体が出現した(図2A、B)。また、弱勢の起きた個体からはいずれも導入した遺伝子が検出され、弱勢の起きなかった個体からは導入した遺伝子が検出されなかった。このことから、Hwc2-1を形質転換してHwc2-1を持たない植物に導入することによって、Hwc1-1を持つ植物との交雑において雑種弱勢を誘導できることが確認された。この例においても、ベクターはpCAMBIA1301を用いており、Hwc2-1以外に2つの遺伝子を含んでいる状況で行われた。
【実施例3】
【0102】
Hwc2-1を持つ植物にHwc1-1を持つベクターを導入し弱勢を誘導する実験
100粒の日本晴完熟種子を用い、Hwc1-1を組み込んだpCAMBIA1301を持つアグロバクテリウムEHA105によって形質転換を行った。通常pCAMBIA1301のベクターのみでは、1粒から平均1個体以上の形質転換植物が得られるが、カルスの生育が悪く、再分化する個体も少なかった。得られた10個体の植物のうち、PCRを行ってHwc1-1が検出された個体は3個体のみであった。この3個体も激しい弱勢を示し、34℃では生育できるが10cm程度までシュートが成長するとそれ以上に成長することはなかった。
【実施例4】
【0103】
Hwc1-1を持つ植物にHwc2-1を持つベクターを導入し弱勢を誘導する実験
これまでの遺伝学的な解析から、Hwc1-1がホモ接合になるとHwc2-1の存在下で激しい弱勢を示すことが明らかとなっていた。そのため、Hwc1-1を持つ品種にHwc2-1を直接導入すると、形質転換植物が全く得られない可能性が高いと考えられた。そこで、Hwc1-1をヘテロ接合で持つように、Jamaicaと農林11号、JamaicaとあそみのりでF1雑種を作出し、そのF1雑種にHwc2-1を持つpCAMBIA1301ベクターを導入することを試みた。Tokiら(2006)によるカルス誘導中の種子へ感染する方法では36の種子、誘導したカルスに感染する一般的な方法では200以上のカルスを用いて形質転換を試みたが、ごく小さい再分化植物が初期に枯死したものを除くとHwc2-1を導入した植物は得られなかった。一方、Hwc2-1と4塩基の違いを持つ、品種Katakutaraの持つhwc2-2を導入した場合は100個のカルスを用いて形質転換植物が得られ、導入遺伝子を確認した植物のうち12個体については形質転換体であることが確認された。Hwc1-1もHwc2-1も持たない染色体置換系統SL6-3にHwc2-1を導入した実験では通常通り形質転換体が得られ、38個体では導入遺伝子の存在が確認された。このT0植物の一部については実施例2の実験に用いた。これらのHwc2-1を導入された植物では交配を行うと雑種弱勢が誘導された。これらの結果から、Hwc1-1を持つ場合にだけHwc2-1を持つベクターを導入することができないということが示された。
【0104】
結果を表にまとめたものを示す。
【0105】
【表1】

【0106】
実施例2において、交雑によって形質転換したHwc2-1をHwc1-1を持つ植物へ導入した場合、通常の雑種弱勢より激しい表現型が現れた。そのため実施例4で行ったように、交配によらず、直接Hwc1-1を持つ植物にHwc2-1を導入する場合は、形質転換の過程で、程度の強い弱勢が細胞レベルで生じ、植物を得るには至らないものと推察される。
【産業上の利用可能性】
【0107】
本発明により提供された雑種弱勢原因遺伝子は、耕地生態系において遺伝子の流れを制御する技術に利用できる。用いる遺伝子がイネの通常の遺伝子に由来するため、社会的に受け入れられやすいと推察される。
【配列表フリーテキスト】
【0108】
配列番号1 Hwc1-1 ゲノムDNA Jamaica対立遺伝子
配列番号2 Hwc1-1 cDNA
配列番号3 HWC1-1(Jamaica)
配列番号4 Hwc2-1 ゲノムDNA
配列番号5 Hwc2-1 cDNA
配列番号6 HWC2-1
配列番号7 HWC1-2(Nipponbare)
配列番号8 HWC1-2(Kasalath)
配列番号9 コムギ AK335189
配列番号10 STYLOSA
配列番号11 LEUNIG
【技術分野】
【0001】
本発明は、植物の遺伝子とその利用に関する。詳しくは、交雑すると弱勢または過敏感細胞死を誘導する一対の遺伝子、該遺伝子がそれぞれ組み込まれた組換えベクター、該ベクターにより形質転換された細胞および形質転換植物、並びにそれらの利用に関する。
【背景技術】
【0002】
作物を形質転換して農業を行えば、導入された遺伝子が自然生態系に拡散する可能性が生じる。また、除草剤抵抗性遺伝子などが野生の植物に拡散すれば、除草剤で駆除できない雑草を生じさせることになる。2000年には、スターリンク事件が生じ食品として認可のない組換えトウモロコシが食用のトウモロコシに混入し問題となった。これらの問題に対してこれまで、親世代で発現していない遺伝子を次世代で発現させる方法(主として次世代の種子を発芽不能にする技術:特許文献1)、葉緑体のゲノムに遺伝子を導入することにより、花粉から遺伝子が拡散できないようにする方法(Daniell. H. 非特許文献1、2)、閉花受粉の応用(吉田均ら:非特許文献3)などが知られている。それぞれ長所短所があるため、遺伝子の拡散防止を目指す場合には異なる方法を組合わせて行うのが望ましい。そのためには、多様な技術を開発し、用いることができるようにすべきである。
【0003】
雑種弱勢(hybrid weakness)とは、両親は正常に生育し、何ら異常を示さないにもかかわらずその雑種では生育異常が起こり、正常に成長できない現象である。そのため、交雑が起きたときには雑種が生育不良で次世代を生じない。もしこの現象を人工的に制御できれば、遺伝子の拡散防止技術に応用が可能である。
【0004】
イネ(Oryza sativa L.)では、ペルーの品種Jamaicaと多くの日本の栽培品種との間に見られる雑種弱勢が知られている。これは、図1に示すように、Hybrid Weakness C 1(HWC1)のJamaica対立遺伝子であるHwc1-1と、HWC2の対立遺伝子Hwc2-1との優性補足作用によって説明される(雨宮と明峰1963:非特許文献4)。Sato & Morishima (1987)はHwc1-1とHwc2-1の分布を調べ、Hwc2-1の遺伝子型はジャポニカ、特に温帯ジャポニカに高頻度で分布するが、インディカ品種にはまれにしか存在せず、野生イネにはこの遺伝子型を持つ系統が見つかっていないこと、Hwc1-1は多くのイネ品種、野生イネを調べても見つからず、Jamaicaが特異的に保持していることを報告している(非特許文献5)。このことから、Hwc2-1は温帯ジャポニカが他の集団と分岐した後すぐに現れ、何らかの理由で集団内に広がり、定着した対立遺伝子であると推定される。一方、Hwc1-1はJamaicaでしか見つかっていないため、HWC1遺伝子座において比較的新しく現れた対立遺伝子であると考えられる。
【0005】
この組合わせの交雑において、種子は正常に形成される。しかし発芽後に、根が成長しない、葉が細くなり巻く、葉の形成速度が遅い、分げつが少ない、矮性を示すなどの異常が見られる。特に根で顕著な異常が現れ、伸長の抑制、側根形成の遅れ、本来側根の形成が抑制されている先端部での側根形成などが観察される。
【0006】
イネゲノムは、遺伝地図、発現遺伝子地図、物理地図などゲノム塩基配列の精密解読に不可欠な基盤が既に整備され、2004年には全塩基配列が解読された(http://rapdb.dna.affrc.go.jp/rap_history.html, International Rice Genome Sequencing Project. (2005) The map-based sequence of the rice genome. Nature 436: 793-800:非特許文献6)。イネのゲノムは3.72億のDNA塩基配列から構成され、予測された遺伝子の総数は約4万個とされ、それらのゲノム中での分布状況の特徴が明らかにされた。しかし、各遺伝子と機能との関係が明らかになっているものは少数であり、両者の関係を解明することがゲノム塩基配列解読後の課題となっている。
【0007】
本発明者らは、雑種弱勢が生じる機構を解明するために、雑種弱勢原因遺伝子HWC1とHWC2に対応する塩基配列の単離に取り組んできた。これまでに、高密度連鎖解析による両遺伝子の特定が進められている。
【0008】
HWC1は既に特定され、シロイヌナズナのLEUNIGやキンギョソウのSTYLOSAと同祖関係にある遺伝子であることが判明した。HWC1やこれらの同祖遺伝子は、C末端側にWD40の繰り返しモチーフを持ち、N末端側にタンパク質相互作用に機能を持つと考えられているLisH(lissencephaly type 1-like homology)ドメインを持っており、Groucho/TUP1遺伝子族に共通するドメイン構造を持つ。LEUNIGやSTYLOSAは花の発生や葉の形、維管束形成で働いており、植物の正常な発生に必要な遺伝子であると考えられている(Navarro ら:非特許文献7)。そのため、この遺伝子のイネにおける同祖遺伝子が雑種弱勢の原因となり、根の成長に異常を誘起することはこれまでの知見からは予測不可能であった。また、このHWC1の日本晴における対立遺伝子(hwc1-2)はRice Annotation Project Database(RAP-DB)の遺伝子モデルOs01g0607400に該当する。Jamaicaのみが持つHwc1-1対立遺伝子ではエクソン部の塩基配列の一箇所が変異しており、この一塩基変異がアミノ酸の置換をもたらすことにより、Hwc2-1を持つ植物との交雑による弱勢が誘導される可能性が示唆された(波越ら:非特許文献8、沖山ら:非特許文献9)。しかしながら、正確な変異部位の位置は公表されていない。
【0009】
一方、HWC2の候補遺伝子はRice Genome Annotation ProjectにおいてNB-LRR型の病害抵抗性タンパク質をコードすると予想される遺伝子モデルLOC_Os04g53160に該当すると推測された(一谷ら:非特許文献10)。また、抵抗性反応による過敏感細胞死と雑種弱勢現象との類似性が示唆されている(沖山ら:非特許文献11、12)。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】米国特許第5723765号(特表平10-503377号広報)
【非特許文献】
【0011】
【非特許文献1】Daniell, H. (2002) Nat Biotechnol 20, 581-586
【非特許文献2】Daniell, H. (2007) PNAS 104 no.17, 6879-6880
【非特許文献3】吉田均ら(2007)育種学研究9巻(別冊2号)220頁
【非特許文献4】雨宮と明峰(1963)農林水産省農業技術研究所報告D第10号139-223
【非特許文献5】Sato, Y. I. & Morishima, H., Euphytica 36, 425-431 (1987)
【非特許文献6】Nature 436: 793-800(2005)
【非特許文献7】Navarro ら、Development 131, 3649-3659 (2004)
【非特許文献8】波越ら(2006)育種学研究8巻(別冊2号)93頁
【非特許文献9】沖山ら(2008)育種学研究10巻(別冊1号)13頁
【非特許文献10】一谷ら(2008)育種学研究10巻(別冊2号)62頁
【非特許文献11】沖山ら(2008)育種学研究10巻(別冊2号)248頁
【非特許文献12】沖山ら(2009)育種学研究11巻(別冊1号)79頁
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明者らの研究により、イネの雑種弱勢原因遺伝子の一つがNB-LRR型の病害抵抗性遺伝子であるらしいこと、そして、抵抗性反応が雑種弱勢の原因となっている可能性のあることが示唆された。
【0013】
本発明は、イネの雑種弱勢原因遺伝子を単離して提供するとともに、当該遺伝子と雑種弱勢または過敏感細胞死という生理的現象の発現との因果関係を解明することにより、当該遺伝子を利用してこれらの現象を人為的に誘導する技術を構築することを課題とする。
【課題を解決するための手段】
【0014】
本発明者らは、一対の雑種弱勢原因遺伝子HWC1とHWC2のDNA塩基配列を明らかにした。HWC1はWD40モチーフを持つGroucho/Tup1ファミリーに属する遺伝子であること、HWC2は白葉枯病抵抗性遺伝子Xa1と同様の構造を持つNB-LRR遺伝子であることが明らかとなった。HWC1遺伝子座のJamaica対立遺伝子Hwc1-1にコードされるポリペプチドでは、587番目のコドンに相当する位置におけるアミノ酸残基が別のアミノ酸に置換していることが判明した。したがって、この雑種弱勢は、通常の植物で発生上必須であるHWC1の一アミノ酸残基が別のアミノ酸に置換した結果、病害抵抗性遺伝子ファミリーに属するHWC2遺伝子座の対立遺伝子Hwc2-1の遺伝子産物によって認識され生じた現象であると推測される。つまり、雑種弱勢の原因は抵抗性反応により過敏感細胞死が生じたことであると考えられる。
【0015】
実際に、本発明者らは、これらの塩基配列を持ったDNAを形質転換によって導入して、イネにおいて人為的に雑種弱勢を誘導することができることを確認した。
【0016】
HWC1とHWC2の遺伝子の組合わせは、病原菌の持つ非病原性遺伝子と植物の抵抗性遺伝子との関係にあるため、イネ以外の種でも適用可能である。
【0017】
本発明の概略は以下の通りである。
【0018】
(1)HWC1遺伝子座の対立遺伝子hwc1-2にコードされるHWC1-2ポリペプチドに対するアミノ酸の変異を、HWC1-1ポリペプチドの587位のアミノ酸残基に相当する位置に有するアミノ酸配列からなる変異ポリペプチドまたはその部分配列からなる断片であって、当該変異により、HWC2遺伝子座の対立遺伝子Hwc2-1が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有する前記変異ポリペプチドまたはその断片をコードする塩基配列を含むDNA。
【0019】
(2)前記変異ポリペプチドまたはその断片がアミノ酸配列VAKAHASA-KV(式中、HはHWC1-1ポリペプチドの587位のアミノ酸残基に相当し、-は任意のアミノ酸又は一残基の欠失を表す)を含む、上記(1)のDNA。
【0020】
(3)以下の(a)〜(g)のいずれかのポリペプチドをコードする塩基配列を含む、上記(1)のDNA:
(a)配列番号7で表されるアミノ酸配列において587位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(b)587位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(a)のポリペプチド
(c)配列番号8で表されるアミノ酸配列において588位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(d)588位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(c)のポリペプチド
(e)配列番号3で表されるアミノ酸配列からなるポリペプチド
(f)配列番号3で表されるアミノ酸配列からなるポリペプチドにおいて587位のアミノ酸残基がリシンであるアミノ酸配列からなるポリペプチド
(g)少なくともWDリピートドメインの330個のアミノ酸を有する、HWC1-1ポリペプチドの部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド。
【0021】
(4)以下の(h)または(i)の塩基配列を有する、(1)記載のDNA:
(h)配列番号1で表される塩基配列
(i)配列番号2で表される塩基配列。
【0022】
(5)上記(1)〜(4)のいずれかのDNAを含む、植物形質転換用ベクター。
【0023】
(6)上記(1)の変異ポリペプチドを発現する、外来遺伝子で形質転換された植物。
【0024】
(7)上記(1)〜(4)のいずれかのDNAを形質転換により植物に導入して、Hwc2-1を持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該形質転換された植物に付与する方法。
【0025】
(8)Hwc2-1を持つ植物が、イネ科の植物である、(7)の方法。
【0026】
(9)配列番号3のアミノ酸配列をコードする塩基配列を有するHWC1遺伝子、及び配列番号6のアミノ酸配列をコードする塩基配列を有するHWC2遺伝子からなる一対の雑種弱勢原因遺伝子。
【0027】
(10)HWC1遺伝子座の対立遺伝子Hwc1-1を組み込んだ発現カセットを、HWC2遺伝子座の対立遺伝子Hwc2-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0028】
(11)Hwc1-1が配列番号2の塩基配列またはその一部からなる配列を有する、(9)の方法。
【0029】
(12)HWC2遺伝子座の対立遺伝子Hwc2-1を組み込んだ発現カセットを、HWC1遺伝子座の対立遺伝子Hwc1-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0030】
(13)Hwc2-1が配列番号5の塩基配列またはその一部からなる配列を有する、(12)の方法。
【発明の効果】
【0031】
本発明により、特定の交配組合わせでのみプログラム細胞死が起きる雑種弱勢原因遺伝子遺伝子が提供される。これらの遺伝子は、単独で植物中に存在するときには、植物の成長にとって何らの害のある形質を示さず、また、これまで日本人が長く食用にしてきたイネに由来し、ヒトにとって安全なものである。
【0032】
植物の交雑による遺伝子の圃場や環境への拡散防止に対してこれまで、様々な方法が考案されてきた。最も単純な方法は植物のある発生段階で発現し、植物の成長を阻害し、次世代の植物を作れない遺伝子を持つ形質転換植物である。この方法は、生産物を利用する上での安全性、種子あるいは実を利用する作物では有効でない、種子を自家採種して維持することができないなどの問題がある。また、モンサントによる「親世代で発現していない遺伝子を次世代で発現させる方法に関する特許(主として次世代の種子を発芽不能にする技術)」) US. patent number: 5,723, 765(特許文献1)も知られている。この方法では、弱いながらも毒性のあるリボソーム不活性化タンパク質 (ribosome-inactivation protein)あるいは、通常植物にない量のインドール酢酸を種子内で合成することにより種子の発芽を妨げている。この方法では、テトラサイクリンなどによる薬剤処理も必要で食用として利用する際に安全性確保のための配慮を行う必要がある。また、テトラサイクリンによる遺伝子発現の誘導はむらなく全ての種子で実施する必要があり、1度誘導に失敗すると、次世代以降では全く効果を失うという欠点を持つ。この方法もまた、自家採種による種子の再生産ができない。また、リボヌクレアーゼ(barnase)を種子の形成期に発現させて種子を不発芽にし、barnaseのインヒビターを一過的に誘導したときだけ種子が得られる方法も考案されている。この方法では、種子を得ることが出来るが、種子を得る際に遺伝子の発現を誘導する処理を行わなければならない。これらの方法と比べ本発明では、親系統は通常の植物と同様に種子を採種できる。また、収穫する種子に従来の植物と比較して成分的に変更を引き起こすような生産物が蓄積することがない。植物が本来持つ遺伝子がプログラム細胞死を誘因するするため、毒性のある物質も使用する必要がない。
【0033】
一方生育不良を誘導する方法とは全く異なる方法も知られている。葉緑体のゲノムに遺伝子を導入することにより、花粉から遺伝子が拡散できないようにする方法 (Daniell et al. 2002)、閉花受粉の応用(吉田 2006)などの研究がある。しかし、葉緑体ゲノムに導入する場合、除草剤抵抗性のように常に発現していることが望ましい遺伝子については適しているが、植物の発生過程において特定の時期に、特定の場所で発現させる遺伝子の拡散防止に用いることは困難である。本発明においては、核に導入された遺伝子において雑種弱勢を誘導することができるため、特定の場所や発生段階で発現する遺伝子と共に用いることが出来る。また、閉花受粉を用いる方法は、花が環境条件によって開いてしまうという問題があり、必ず閉花したままで受粉が行われるようにするための研究が行われている。その点、雑種弱勢は、個体による表現型のばらつきは少なく、通常の環境では条件に左右されずに遺伝子の流れを制御することが期待される。
【図面の簡単な説明】
【0034】
【図1】日本型イネとペルー品種Jamaicaの間に見られる雑種弱勢(雨宮・明峰1963)を示す。Aは雑種弱勢の遺伝的なモデルである。Bは播種後1ヶ月の根の写真で、左は正常に成育した日本晴の根、右はJamaicaと日本晴の雑種で雑種弱勢を生じ根の成長が異常になっている。
【図2】Hwc1-1またはHwc2-1を導入した形質転換体との交雑によって生じた雑種弱勢とHwc2-1のトランスポゾン挿入変異による雑種弱勢の打破を示す。A、BはHwc2-1導入植物とJamaicaとの雑種、CはHwc1-1導入植物と台中65号との雑種である。DはHwc2-1にトランスポゾンによる挿入変異が起きた対立遺伝子ではHwc1-1を持つJamaicaとの交雑において雑種弱勢が生じなくなることを示している。 A:Hwc1-1もHwc2-1も持たないSL6-3にHwc2-1を導入した形質転換植物。左は自殖植物。右がHwc1-1を持つJamaicaを交配して得られた種子を播種したもの。 Bar=0.5 mm. B:SL6-3にHwc2-1を導入した形質転換植物とJamaicaとの雑種、播種後1ヶ月。 C:SL6-3 へHwc1-1を導入した植物とHwc2-1を持つ台中65号との雑種。Bar=0.2 mm. D:左がHwc2-1にTos17の挿入変異を持つ系統にJamaicaを交配したもの。右が日本晴とJamaicaの雑種。播種後2週間、Bar=1 cm.
【図3】圃場生態系における遺伝子拡散防止の概念図である。
【図4】gene targetingによる遺伝子導入の概念図である。gene targetingは相同組み換えにより染色体の特定部位の改変ができる。gene targetingには非相同組み換え以外の形質転換を除くためのネガティブ選抜が必要である。
【図5−1】HWC1およびコムギの同祖遺伝子にコードされるポリペプチドのアミノ酸配列整列化データである。上の3つがイネ由来の配列であり、上段から、JamaicaのHwc1-1(配列番号3)、日本晴のhwc1-2(配列番号7)、Kasalathのhwc1-2(配列番号8)に対応する。最下段がコムギの同祖遺伝子AK335189にコードされるポリペプチドのアミノ酸配列(配列番号9)である。
【図5−2】図5−1の続き。
【図6−1】HWC1およびその同祖遺伝子にコードされるポリペプチドのアミノ酸配列を比較した図である。イネやコムギの他、キンギョソウSTYLOSA(配列番号10)やシロイヌナズナLEUNIG(配列番号11)のアミノ酸配列との整列化データも示している。
【図6−2】図6−1の続き。
【図6−3】図6−2の続き。
【図7】HWC1のドメイン構造を示す。LisHやSSDPを持ち、C末端の約300アミノ酸がWD40リピートを構成している。HWC1-1ではWD40ドメインの先頭付近587位にアミノ酸置換(R→H)が生じている。http://blast.ncbi.nlm.nih.gov/Blast.cgiを用いて作図した。
【発明を実施するための形態】
【0035】
本発明者らは、高密度連鎖解析により、イネ雑種弱勢の原因となる遺伝子HWC1とHWC2の単離に成功した。さらに、本発明者らは、14kbpあるHWC1のJamaica対立遺伝子Hwc1-1染色体断片を形質転換により導入すると、Hwc2-1を持つイネと交雑した雑種で弱勢が生じることを確認した。また、交雑によらず、Hwc2-1を持つイネにHwc1-1を形質転換しても弱勢を誘導することができた。一方、8434bpのHwc2-1染色体断片を形質転換によりイネに導入して、Hwc1-1を持つイネと交雑した場合に弱勢が生じることも確認した(図2)。
【0036】
従って、本発明により、イネ由来の雑種弱勢原因遺伝子が提供される。本発明の遺伝子には二種類の遺伝子が包含される。第一の遺伝子と第二の遺伝子は一対の遺伝子として組み合わさり、両方が発現した場合に雑種弱勢または過敏感細胞死という表現型を示す。第一の遺伝子の代表例はJamaicaのHwc1-1であり、第二の遺伝子の代表例は温帯ジャポニカのHwc2-1である。
【0037】
1.用語の説明
「雑種弱勢原因遺伝子」という用語は一代雑種において生育能力が低下する現象を引き起こす原因となる遺伝子を意味する。雑種弱勢原因遺伝子は、通常1対の優性補足遺伝子であることが知られている。
【0038】
単にHWC1とHWC2という場合は、それぞれの遺伝子あるいは遺伝子座を意味する。遺伝子はコード配列の前後の部分(自己の制御配列、イントロンを含む天然のDNAあるいは外来制御配列を含むキメラ遺伝子)を含み、転写されてポリペプチドとして発現し得る概念で、遺伝子座という場合は特に染色体上における遺伝子の位置を示す。
【0039】
Hwc1-1、Hwc2-1は、それぞれの遺伝子座における雑種弱勢の原因となる対立遺伝子を示す。一方、hwc1-2、hwc2-2はそれぞれの遺伝子座における雑種弱勢を引き起こさない対立遺伝子を示す。
【0040】
HWC1-1ポリペプチド、HWC2-1ポリペプチドは、それぞれ、対立遺伝子であるHwc1-1とHwc2-1によりコードされるアミノ酸配列を有するポリペプチドを意味する。HWC1-2ポリペプチド、HWC2-2ポリペプチドも、同様に、hwc1-2とhwc2-2によりコードされるアミノ酸配列を有するポリペプチドをそれぞれ意味する。
【0041】
本明細書において、遺伝子の表記は、最近設定された表記法(McCouch SR. 2008. Gene nomenclature system for rice. Rice 1: 72-84.)に従う。この表記は、ショウジョウバエやシロイヌナズナなどモデル生物ですでに行われている表記法に準じるが、イネでは対立遺伝子は表現型に違いがあることがわかって新しく設定される。よって、雑種弱勢という表現型に関しては、例えば、雑種弱勢原因遺伝子HWC1とHWC2に対応する弱勢を起こさないものはすべて配列に違いがあってもそれぞれhwc1-2とhwc2-2ということになる。遺伝子産物であるポリペプチドとしての表記は全て大文字で記載する。
【0042】
本明細書で「植物」というときは、特に明記した場合を除き、植物体(個体)の他、種子(発芽種子、未熟種子を含む)、器官又はその部分(葉、根、茎、花、雄蕊、雌蘂、それらの片を含む)、植物培養細胞、カルス、プロトプラストを含む。
【0043】
「外来」遺伝子は、形質転換などの遺伝子操作により、新たに導入された遺伝子をいう。特に、他の生物種に由来する場合を指す。
【0044】
「キメラ」遺伝子は、異なる遺伝子の部分を組み合わせて新たに機能を持つように作られた遺伝子を指す。例えばカリフラワーモザイクウイルスの35Sプロモーターとイネのある遺伝子のcDNA、アグロバクテリウムのノパリン合成酵素のポリA付加配列、ターミネーターを連結した遺伝子などを示す。
【0045】
「作動可能に連結された」は、一方の機能が他方の影響を受けるという、一つの核酸配列に対するもう一つの核酸配列の関連を指す。例えば、プロモーターがコード配列の発現に影響を及ぼすことができるとき、すなわち、コード配列がプロモーターの転写調節下にあるとき、このプロモーターはコード配列と作動可能に連結されている。
【0046】
「発現カセット」とは形質転換ベクターに含まれる遺伝子領域であって、植物において発現するのに必要な制御部位を持ち、適当なクローニングサイトに発現させたいDNA配列を連結すればそのDNA領域を含む転写産物が得られるものをいう。
【0047】
本明細書で使用される遺伝子組換え、クローニング、形質転換等の技術は、当該技術分野で周知であり、例えばMolecular Cloning(Sambrook, J. et al., Molecular Cloning :a Laboratory Manual 2nd ed., Cold Spring Harbor Laboratory Press, 10 Skyline Drive Plainview, NY (1989))モデル植物の実験プロトコール(島本功、岡田清孝、田畑哲之監修 秀潤社ISBN4-87962-286-9)に記載されている。
【0048】
2.Hwc1-1の単離
Hwc1-1はこれまでの調査から野生イネやインディカ品種、ジャポニカ品種を含む栽培イネでも見つからず、唯一ペルーの品種Jamaicaだけが例外的に持つことが知られている。これまで、雑種から種子を得ることが困難であったためHwc1-1の遺伝解析や単離は困難であった。本発明者らは、Hwc1-1を持ち、遺伝子型がHwc1-1/Hwc1-1、hwc2-1/hwc2-1であるJamaicaとHwc1-1もHwc2-1も持たないKasalath(hwc1-2/hwc1-2, hwc2-2/hwc2-2)を交配し、F1(Hwc1-1/hwc1-1、hwc2-1/hwc2-1)を得た。次に、このF1から自殖種子を得てHWC1がHwc1-1/Hwc1-1、Hwc1-1/hwc1-2、hwc1-2/hwc1-2のような3つの遺伝子型に分離するF2世代を4747個体育成した。この中から染色体上でHWC1を挟むDNAマーカー RMKG14、RM5間で組み換えを起こした21個体を選抜した。選抜個体をhwc1-2/hwc1-2, Hwc2-1/Hwc2-1の遺伝子型を持つ台中65号と検定交配し、後代の表現型を調査することでHWC1遺伝子座の遺伝子型を決定した。候補領域をさらに絞り込むため、新たにDNAマーカー RMNM37、RMNM38を作成し連鎖解析を行ったところ、HWC1は両マーカーの間に位置することが判明した。2マーカー間の距離は14 kbpであった。RAP-DBに公開されている日本晴のゲノム塩基配列においてはこの領域に存在する遺伝子モデルはOs01g0607400のみであった。一方、Jamaicaから核DNAを単離し、Bacteria Artificial Chromosome (BAC)ライブラリーを作製し、HWC1近傍のDNAマーカーでHWC1領域を含むクローンを選抜した。このクローンのDNA塩基配列をショットガンシーケンス法によって決定し、Rice GAASを用いて遺伝子予測を行った。JamaicaにおけるHWC1領域の遺伝子の並びはRAP-DBの日本晴と一致しており、Os01g0607400の対立遺伝子と考えられるOpen Reading Frame (ORF) も存在した。日本晴のOs01g0607400とそのJamaicaにおける対立遺伝子を比較したところアミノ酸置換を伴う1塩基多型が見出された。連鎖解析の結果と表現型に対応する遺伝子多型が見つかったことから、この遺伝子がHWC1であると推定された。これを証明するために、遺伝子の上流制御配列、転写領域を含む全長14 kbpのJamaica染色体断片を形質転換ベクターpCAMBIA1301に導入しHwc2-1を持つ日本晴、あるいはHwc2-1を持たない日本晴の第4染色体をKasalath染色体に置換した系統(以下SL6-3)へアグロバクテリウム法を用いて形質転換を行った。その結果、Hwc2-1を持つ日本晴では弱勢を示す形質転換体が8個体得られたが、Hwc2-1を持たないSL6-3系統では弱勢を生じる個体は現れなかった。また、このSL6-3に候補遺伝子を導入した形質転換植物から得られたT1植物8系統にHwc2-1を持つ台中65号を検定交配すると雑種弱勢を生じる個体が生じた。
【0049】
かくして、Os01g0607400がHWC1に相当し、この遺伝子のJamaica対立遺伝子がHwc1-1の本体であることが確認された。
【0050】
HWC1の推定アミノ酸配列中には、特徴的な領域としてC末端側にWD40の繰り返しモチーフを持ち、N末端側にLisH(lissencephaly type 1-like homology)ドメインを持っている。これら2つのモチーフはどちらもタンパク質相互作用に関わるモチーフとして知られている。RAP-DBではGene Ontology (GO)においてDNA binding、nucleusの記載があり、タンパク質モチーフとしては、WD40リピートやLisHの他 Single-stranded DNA-binding protein, SSDPが記載されている。図7にHWC1のドメイン構造の模式図を示す。当該WD40リピートモチーフは配列番号7で示される日本晴Os01g0607400の産物として推定されたアミノ酸配列において580位から876位までとなっており、LisHモチーフは10位から36位までである。HWC1-1ではWD40ドメインの先頭付近587位にアミノ酸置換(R→H)が生じている。また、このドメイン構造からHWC1はGroucho/Tup1ファミリーに属する遺伝子であると考えられる。相同性検索とドメイン構造の比較から、キンギョソウのSTYLOSA、シロイヌナズナのLEUNIGがHWC1の同祖遺伝子と考えられる。これらの遺伝子は、花の発生、葉の形、維管束形成などで重要な働きを持つものとして報告がある。しかし、これまで、これらの同祖遺伝子にはプログラム細胞死の誘導、雑種弱勢との関係については報告がなく、GOにもcell deathの記載はない。また、これまでの報告からそのような機能を予測する論理的な根拠はない。
【0051】
本発明者らが単離に成功したHwc1-1の染色体断片は、5'制御領域+プロモーター+エクソン+イントロン+polyA付加配列を含む14068bpからなる、配列番号1に示される塩基配列を有する。配列番号1において11527番目の塩基Aが日本晴を含む通常のイネではGになっており、この一塩基変異がアミノ酸配列の587位においてWDモチーフの単一アミノ酸の変異をもたらす(日本晴:アルギニン、Jamaica:ヒスチジン)。配列番号1の塩基配列は2631塩基対のORFに対応し、配列番号3に示される876個のアミノ酸からなるタンパク質をコードする。配列番号1に示される塩基配列から転写され修飾されて成熟したmRNAを逆転写して得られるcDNAのセンス鎖DNA塩基配列が配列番号2で表される。
【0052】
3.第一の遺伝子
本発明の雑種弱勢原因遺伝子の第一の遺伝子の典型的な例は、配列番号1または2に示される配列を有するDNA、あるいは配列番号3に示されるアミノ酸配列をコードするDNA、あるいはコドンの縮重の範囲内で配列番号3に示されるアミノ酸配列と同じアミノ酸配列をコードするDNAである。しかしながら、本発明の雑種弱勢原因遺伝子の第一の遺伝子はこれらに配列を有するものに限定されない。
【0053】
本発明の雑種弱勢原因遺伝子の第一の遺伝子の必須の特徴は、第二の遺伝子であるHWC2遺伝子座の対立遺伝子Hwc2-1が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有することである。
【0054】
本発明者らの研究により、イネの雑種弱勢原因遺伝子HWC1、HWC2が単離され、イネ雑種弱勢の一つではNB-LRR型遺伝子による過敏感細胞死が原因で生じている可能性が高いことが明らかとなった。シロイヌナズナでもNB-LRR型遺伝子が雑種ネクロシスを引き起こすことが報告されており(Bomblies et al. (2007) PLoS Biol. 5: 1962-1972)、これらの例のように自分自身の持つ遺伝子をエリシターとして認識し、過敏感細胞死を起こす自己免疫不全型の雑種不全は、様々な植物分類群の交雑において見られる可能性が考えられる。つまり、本発明においてHwc1-1の配列が明らかとなったことにより、これまでメカニズムが不明であった雑種弱勢、致死という現象の一つについて、病害抵抗性遺伝子Hwc2-1による抵抗性反応を引き起こす単一アミノ酸変異をHwc1-1が有することによって生じた現象であることが推測できるようになった。
【0055】
図5に、JamaicaのHWC1-1のアミノ酸配列(配列番号3)と、野生型ポリペプチドである日本晴(Nipponbare)のHWC1-2(配列番号7)又はKasalathのHWC1-2(配列番号8)との比較を示す。日本晴由来HWC1-2ポリペプチドの587位又はKasalath由来HWC1-2ポリペプチドの588位のアルギニンが、HWC1-1ポリペプチドの587位に相当するアミノ酸ではヒスチジンに置換されている。Kasalath由来HWC1-2ポリペプチドの588位のアルギニンは、HWC1-1ポリペプチドと整列化したときにHWC1-1ポリペプチドの587位と同じ位置で整列する(図5−2中3列目の網掛部分に注目されたい)。
【0056】
従って、本発明の雑種弱勢原因遺伝子の第一の遺伝子は、一態様において、HWC1-2ポリペプチドに対して特定の部位で一アミノ酸残基の置換を有する変異ポリペプチドをコードする、HWC1の対立遺伝子として定義される。この特徴的な変異の位置は、イネ品種「日本晴」のHWC1-2ポリペプチドあるいはJamaicaのHWC1-1ポリペプチドのいずれにおいても587位のアミノ酸残基として、一義的に表現できる。変異ポリペプチドは、第二の遺伝子であるHwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有することで特徴付けられ、推定配列がデータベース上に公開されている日本晴由来のポリペプチドに代表される野生型ポリペプチドとは異なる新規な機能を有するものである。
【0057】
HWC1は発生に必須の遺伝子であるが、JamaicaのHWC1-1ポリペプチドにおいては、野生型のアルギニンが同族の塩基性アミノ酸ヒスチジンに変化したためにJamaicaに劣悪な変化が生じないのだと思われる。塩基性アミノ酸としては他にリシンがある。よって、本発明の雑種弱勢原因遺伝子の第一の遺伝子は、HWC1-2ポリペプチドに対する前記変異が、HWC1-1ポリペプチドの587位に相当するアミノ酸のヒスチジンまたはリシンへの置換である変異ポリペプチドをコードする遺伝子であってもよい。HWC1-2ポリペプチドのアミノ酸配列としては、例えば、配列番号7に示される日本晴(Nipponbare)由来の配列、または配列番号8に示されるKasalath由来の配列等が挙げられるが、これらに限定されない。
【0058】
HWC1-2ポリペプチドは品種の違いによって配列番号7、配列番号8でみられるようにアミノ酸配列やアミノ酸残基数に多様性があるが、図5のようにHWC1-1ポリペプチドと整列化することでHWC1-1ポリペプチドの587位に相当するアミノ酸を定義することができる。また、イネ科の植物であればHWC1のアミノ酸配列はよく相同性が保たれており、コムギでもイネのHWC1-1ポリペプチドと85%の相同性が見られ、図5のような整列化によってHWC1-1ポリペプチドの587位に相当するアミノ酸は明確に定義することが出来る。さらに、図6のようにシロイヌナズナやキンギョソウなど分類群の離れた種でも整列化によってHWC1-1ポリペプチドの587位に相当するアミノ酸を定義することが可能である(図6−2中6列目の網掛部分)。
【0059】
本発明の雑種弱勢原因遺伝子の第一の遺伝子は、Hwc1-1遺伝子産物である変異ポリペプチドの部分配列あるいは部分配列を用いた融合タンパク質をコードする遺伝子であってもよい。当該部分配列は、少なくとも10個以上、好ましくは50個以上、より好ましくは100個以上、さらにより好ましくは200個以上、最も好ましくは少なくともWD40リピートドメインの330個の連続したアミノ酸残基を有することが望ましい。さらに、本発明の雑種弱勢原因遺伝子の第一の遺伝子は、上述の特徴的なHWC1-1ポリペプチドの変異部分を挟む10残基からなるアミノ酸配列VAKAHASA-KVに示される、ヒスチジンを生じる変異によっても定義することもできる。当該アミノ酸配列の式中、下線部のヒスチジン残基がHWC1-1ポリペプチドの587位に相当し、−は任意のアミノ酸残基(好ましくはT又はS)又は一残基の欠失を表しHWC1-1ポリペプチドの591位に相当する。本発明の雑種弱勢原因遺伝子の第一の遺伝子は、このヒスチジンを生じる変異部分を挟む200アミノ酸程度からなる部分配列をコードする遺伝子と適当なプロモーターなどを連結したキメラ遺伝子であってもよい。
【0060】
本発明の第一の遺伝子は、例えば、化学合成により、または、染色体をクローニングしたベクターから制限酵素等により切り出すことにより、あるいはJamaicaのDNAを鋳型としたPCRにより、入手可能である。
【0061】
4.Hwc2-1の単離
HWC2遺伝子は第4染色体のフェノール反応性遺伝子Phの近傍に座乗している。そこで、本発明者らはHWC2においてもHWC1と同様の方法で、まず日本晴とKasalathの雑種第二代を用いて連鎖解析を行った。しかし、HWC2の近傍染色体領域は日本晴とKasalathの間で組換えが抑制され、連鎖解析による絞り込みが困難であった。そこで、他の交配組み合わせによる雑種集団(12632個体のF2集団と2574個体の3系交配集団)を用いて連鎖解析を行った。最終的には,IR24 X 金南風、J147 X IR24、 アキヒカリ X カサラスの交雑F2に出現した組換え個体によって座乗位置を約6000塩基に絞り込んだ。
【0062】
この領域に座乗する遺伝子は1つで、Rice Genome Annotation ProjectではLOC_Os04g53160として記載されていた。弱勢を引き起こすHwc2-1対立遺伝子を持つ品種についてLOC_Os04g53160のcDNAの塩基配列を解読したところ、Hwc2-1を持つ日本晴、山田錦、Ketang Nangkaは互いに全く同じ塩基配列を示した。一方、hwc2-2をもつ品種では、KasalathやJamaicaなどのようにHWC2領域の染色体構造が日本晴に対して大きく異なっているものもあった。DNAマーカーによる分析により、HWC2領域の染色体構造は13のハプロタイプに分類され、そのうち、ハプロタイプ1から5までは、Hwc2-1と類似した構造を持つと推定された。そのため、ハプロタイプ3から5に属する系統についてcDNAの塩基配列を解読したところ、KatakutaraではHwc2をもつ品種に対して1カ所に集中して4塩基置換が起こっており、2アミノ酸の置換を引き起こすと考えられた。他のhwc2をもつ品種はKatakutaraとやや異なる配列を示したが、Hwc2をもつ品種に対してKatakutaraと共通の1カ所の4塩基置換(日本晴:TACAAGTAAAGGGGAAC、Katakutara:TACATGTACTGGGAAAC、置換部位にアンダーライン)を起こしていた。この4塩基置換の箇所は制限酵素Rsa I認識部位であったので、この部分を挟むようにプライマーを設計してPCR、制限酵素処理を行ったところ、制限酵素による切断あり/なしは生物研ジーンバンクが配布している世界イネコアコレクション、日本在来イネコアコレクションにおいてhwc2-2/Hwc2-1に完全に対応した。
【0063】
以上の結果から、HWC2がLOC_Os04g53160であることが示唆されたため、日本晴のLOC_Os04g53160を含む染色体領域をアグロバクテリウム法により形質転換し、相補性検定を実施した。具体的な方法は以下の通りである。転写開始点上流の制御領域とpolyA付加配列を含んだ8.4kbpの染色体断片をPCRにより増幅し、形質転換用ベクターpCAMBIA1301にクローニングを行った。挿入断片については、配列を確認し、塩基置換などの変異がないことを確認した。この構築されたプラスミドを用いHWC2領域がKasalath染色体に置換されたSL6-3系統へ形質転換を行った。得られた形質転換植物は正常に生育したが、T0世代でHwc1-1を持つJamaicaと交配すると激しい雑種弱勢の表現型が現れた(図2C)。系統によっては、交配によって弱勢を示す雑種と正常な雑種が得られた。この時、雑種弱勢の出現と形質転換した遺伝子の存在は対応しており、正常な雑種では形質転換した遺伝子が検出できなかった。
【0064】
さらに、日本晴LOC_Os04g53160のアミノ酸コード領域にレトロトランスポゾンTos17あるいはTos17のLTR配列が挿入した系統にJamaicaを交配したところ雑種弱勢が現れない個体が見られた。正常な雑種にはLOC_Os04g53160への挿入配列が存在し、弱勢を生じた雑種では挿入が検出されなかった(図2D)。
【0065】
以上のことから、LOC_Os04g53160として記載されていたORFがHWC2であることが確認された。しかし、この推定された遺伝子モデルは完全長cDNAなどの転写産物による裏付けのあるものではなかったので、実際に転写産物があるかどうかをRT-PCRによって確認し、その転写産物について塩基配列を決定したところ、推定された翻訳開始点を含む転写産物が存在し、イントロンの切り出し位置も遺伝子モデルが正しいことが明らかとなった。
【0066】
前述したように、第二の遺伝子であるHWC2は、NB-LRR型の植物病害抵抗性遺伝子の一種である。
【0067】
Hwc2-1対立遺伝子のゲノム配列を配列番号4に、配列番号4に示される塩基配列から転写され修飾されて成熟したmRNAを逆転写して得られるcDNAのセンス鎖DNA塩基配列を配列番号5に、当該塩基配列によりコードされるアミノ酸配列を配列番号6に示す。
【0068】
Hwc2-1対立遺伝子は、主に、温帯型のジャポニカ品種のゲノムDNAまたはcDNAから入手することができる。Hwc2-1を持つ品種の例は、日本晴、愛知旭、名古屋白、信州、雷電、亀治、早生旭、宝、七面鳥糯、水稲農林8号、雄町、水稲農林6号、神力糯、銀坊主、台中65号、神力、水稲農林17号、旭4号、水稲農林22号、森田早生、石白、愛国、水稲農林1号、埼玉糯、上州、団子、陸稲陸羽2号、DIANYU 1、宝満神田稲、細稈、京都旭、双葉、竹成、ヒメノモチ、坊主糯、目黒糯、富国、白稲、REXMONT、JAGUARY、かばしこ、万作、赤毛、関山、冷立稲、金南風、コシヒカリ、アキヒカリである。これらのイネ品種の染色体をクローニングしたベクターから制限酵素等により切り出すことにより、あるいはこれらの品種のDNAを鋳型としたPCRにより、Hwc2-1対立遺伝子を得ることができる。あるいは、本願に開示された塩基配列に基き化学合成によっても、入手可能である。
【0069】
5.ベクター、発現カセット
本発明はまた、本発明の遺伝子を含むベクターまたは発現カセットを提供する。発現カセットは本発明の遺伝子を適当なプロモーターに連結させて含有する、ベクター中の遺伝子領域である。
【0070】
ベクターは宿主中で複製可能なものであれば特に限定されず、例えば、プラスミドDNA、ファージDNA等が挙げられる。プラスミドDNAとしては、大腸菌由来のプラスミド(例えば、pBR322、pBR325、pUC18、pUC119、pTrcHis、pBlueBacHis 等)、枯草菌由来のプラスミド(例えば、pUB110、pTP5 等)、酵母由来のプラスミド(例えば、YEp13、YEp24、YCp50、pYE52 等)、植物細胞宿主用プラスミド(pBI221、pBI121)等が挙げられ、ファージ DNAとしてはλファージ等が挙げられる。本発明において特に有用なベクターは、植物用のクローニングベクターである。植物細胞用のクローニングベクターに本発明の遺伝子を挿入することにより、トランスジェニック植物を作成するための植物形質転換用ベクターを得ることができる。
【0071】
ベクターに本発明の遺伝子を挿入するには、本発明の遺伝子を含む精製されたDNAを適当な制限酵素で切断し、必要に応じて適切なリンカーを連結し、さらに必要であればプロモーター領域を組み換えて、ベクターDNAの制限酵素部位またはマルチクローニングサイトに挿入してベクターに連結する方法等が採用される。
【0072】
本発明の遺伝子は、宿主に応じたプロモーターに作動可能に連結してベクターに導入される必要がある。プロモーター活性によって、その下流に配置された本発明の遺伝子は宿主中で適切に発現される。
【0073】
プロモーターとしては、構成性のプロモーターを使用しても、条件特異的に活性化されて、その下流の遺伝子を発現させるプロモーターを使用することもできる。
【0074】
本発明において好適なものは、植物中で構成的に発現できるプロモーターである。そのようなプロモーターとしては様々なタイプのものが多数公知であり、また絶えず発見されており、例えば、カリフラワーモザイクウイルスの35S RNAプロモーター、rd29A遺伝子プロモーター、rbcSプロモーター等が挙げられるが特に限定されない。例えば、次の文献を参照されたい。C Kuhlemeier, P J Green, and N H Chua (1987) Regulation of Gene Expression in Higher Plants. Annual Review of Plant Physiology 38: 221-257.;Venter M. (2007) Synthetic promoters: genetic control through cis engineering. TRENDS in Plant Science Vol.12 No.3 1360-1385.
本発明のベクターは、プロモーター、本発明の遺伝子のほか、所望によりエンハンサー等のシスエレメント、スプライシングシグナル、ポリA付加シグナル、選択マーカー(例えば、ジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子等)、リボソーム結合配列(SD配列)等を含んでいてもよい。
【0075】
6.形質転換
本発明のベクターを、目的遺伝子が発現し得るように宿主中に導入することにより形質転換体を得ることができる。宿主は、本発明の遺伝子を発現できるものであれば特に限定されない。
【0076】
本発明において、好適な宿主は植物細胞(植物培養細胞、プロトプラスト、イネであれば胚盤誘導カルス細胞)である。
【0077】
植物細胞への遺伝子導入法としては、アグロバクテリウムを用いる方法(Horschet al.,Science,227,129(1985)、Hiei et al.,Plant J.,6,271-282(1994))、リーフディスク法(Horsch et al.,Science,227,1229-1231(1985))、エレクトロポレーション法(Fromm et al.,Nature,319,791(1986))、PEG法(Paszkowski et al.,EMBO J.,3,2717(1984))、マイクロインジェクション法(Crossway et al.,Mol.Gen.Genet.,202,179(1986))、微小物衝突法(パーティクルガン法)(McCabe et al.,Bio/Technology,6,923(1988))、ポリエチレングリコール法、リポソーム法、マイクロインジェクション法などが挙げられるが、特に限定されない。これらの導入法の中で好ましくは、ベクターを接合操作等を利用してアグロバクテリウム内に移し、このアグロバクテリウムを植物に感染させることによる。感染させるための方法も、当業者には周知である。例えば、植物体の一部を傷つけ、そこに細菌を感染させる方法、植物体の胚組織(未熟胚を含む。)に細菌を感染させる方法、カルスに感染させる方法、プロトプラストと細菌を共培養する方法、又は葉組織の小片を細菌とともに培養する方法(リーフディスク法)がある。
【0078】
ベクターの選択は、形質転換の方法によって異なる。
【0079】
好適なクローニング用ベクターとしては、例えば、pBI221、pBI121(以上Clontech社製)、及びこれらから派生したベクター等が挙げられる。また、特に単子葉植物の形質転換には、pIG121Hm、pTOK233(以上Hieiら,Plant J.,6,271-282(1994))、pSB424(Komariら, Plant J.,10,165-174(1996))、スーパーバイナリーベクターpSB21及びこれらから派生したベクターなどが例示される。
【0080】
植物形質転換用ベクターは、少なくともプロモーター、翻訳開始コドン、所望の遺伝子、翻訳終始コドン及びターミネーターを含んでいることが好ましい。また、シグナルペプチドをコードするDNA、エンハンサー配列、所望の遺伝子の5’側及び3’側の非翻訳領域、選抜マーカー領域などを適宜含んでいてもよい。マーカー遺伝子の例としては、テトラサイクリン、アンピシリン、又はカナマイシン若しくはネオマイシン、ハイグロマイシン又はスペクチノマイシン等の抗生物質耐性遺伝子等の他、ルシフェラーゼ遺伝子、β−ガラクトシダーゼ、β−グルクロニダーゼ(GUS)、グリーンフルオレッセンスプロテイン(GFP)、β−ラクタマーゼ、クロラムフェニコールアセチルトランスフェラーゼ(CAT)等が挙げられる。
【0081】
得られた形質転換細胞は、適当なマーカーを指標とするか、又は所望の形質を発現しているか否かによって他の細胞から選択することができる。形質転換細胞をさらに従来技術を利用して分化させることにより、目的の形質転換植物体とすることができる。本発明の遺伝子を発現する、外来遺伝子で形質転換された植物も本発明の範囲に含まれる。
【0082】
得られた形質転換体の解析は、当業者に周知の種々の方法を用いて行うことができる。例えば、導入した遺伝子のDNA配列を基にオリゴヌクレオチドプライマーを合成し、これを用いたPCRにより形質転換植物の染色体DNAを解析することができる。また、導入した遺伝子に対応するmRNAや、タンパク質の発現の有無により解析することができる。
【0083】
7.雑種弱勢の誘導
本発明の遺伝子を形質転換によって植物に導入すると人為的に雑種弱勢を誘導することができる。すなわち、両方の遺伝子を持つ植物は生育できないので、例えば、Hwc1-1を導入された形質転換植物はHwc2-1を持つ植物と交配したときに雑種が弱勢を起こすようになり、反対に、Hwc2-1を導入された形質転換植物はHwc1-1を持つ植物と交配したときに雑種が弱勢を起こすようになる。
【0084】
従って、本発明は、第一の遺伝子を形質転換により導入することにより、Hwc2-1を含む持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該植物に付与する方法を含む。この方法は、(a)第一の遺伝子で植物を形質転換する工程と、(b)導入した第一の遺伝子が持つ配列を指標として形質転換植物を選択する工程を含む。Hwc2-1を含む持つ植物の典型的な例は温帯ジャポニカ型のイネである。
【0085】
同様に、本発明は、Hwc2-1を持たない植物にHwc2-1を形質転換により導入して、第一の遺伝子(例えばHwc1-1)を持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該植物に付与する方法を含む。天然でHwc1-1を持つ植物の例はペルーのイネ品種Jamaicaである。当該方法で利用可能な、Hwc2-1を持たない植物の例としては、IR 58、CO 13、凱旋糯、日の出、戦捷、山田化、オッカモドシ、渡舟、唐干、葉冠、ハバタキ、陸稲農林糯1号、ZENITH、Latisal、あそみのり、PULUIK ARANG、BASILANON、LEBED、NEANG PHTONG、RADIN GOI SESAT、Intan Merah、黄玉、黄金丸、金子、TADUKAN、PADI KUNING、RAMBHOG、PINULUPOT 1、DAHONGGU、RATUL、HONG CHEUH ZAI、RYOU SUISAN KOUMAI、SHWE NANG GYI、VANDARAN、KEIBOBA、BADARI DHAN、KASALATH、ARC 5955、Katakutara、TIMA、ARC 11094、IR36、杜稲、TUPA 121-3、CHIN GALAY、ARC 7047、CALOTOC、BINGALA、TUPA 729、SHONI、Bhasamanik、Badshabhog、ARC 7291、URASAN 1、PTB 7、タカチホ、新山田穂2号、PADI ASE BAUDA、GUANGLUAI 4、PTB 10、BEI KHE、嘉平、MA SHO、SHUUSOUSHU、おいらん、MILYANG 23、BLEIYO、PADI PERAK、KHAU TAN CHIEM、NEANG MENH、Intan su se、DAVAO 1、HAKPHAYNHAY、IR24、AZUCENA、NABA、陸稲農林12号、KEMASIN、QINGYU、VARY FUTSI、岡穂、PHULBA、DENG PAO ZHAI、KALO DHAN、SURJAMUKHI、KHAU MAC KHO、MUHA、LOCAL BASMATI、ASU、JENA 035、KHAO NAM JEN、ANJANA DHAN、八束穂、JHONA 2、JINGUOYIN、KHAO NOK、DEEJIAOHUALUO、NEPAL 555、NEPAL 8、平山、陸稲農林21号、JARJAN、ADT 14、Dular、Assam 4、PTB 10、ARC10303、TN1、TKM6、農林11号、胆振早生、シレワ、Java 14、Kele、Ashkata、Bhutmuri、Tetep、南京11号、Culture 340、DV85等のイネ品種が挙げられる。あるいは、Hwc2-1を持たない植物として、染色体置換系統SL6-3系統のように、第四染色体を置換する等の方法によりHwc2-1を持たないように染色体操作された温帯ジャポニカ型のイネの系統も利用可能である。
【0086】
上述の方法においては、交雑により生じた種子が発芽した植物は、生育不良となり次世代の種子を生じない必要がある。従って、本発明の遺伝子が、形質転換された植物においてゲノムDNAに組み込まれ、安定に保持され、雑種植物体で発現することが望ましい。雑種弱勢では第一の遺伝子が発現する部位でプログラム細胞死が生じると考えられるため、確実に植物体を枯死させるには、第一の遺伝子は植物体のうち、根、維管束、葉など生存に必須な器官で発現するかあるいは植物体全体で発現することが望ましい。また、第二の遺伝子(Hwc2-1)は第一の遺伝子が発現する部位で発現するかあるいは、植物体全体で発現することが必要となる。さらに、第一の遺伝子の発現レベルが高ければ高いほど弱勢の症状は強くなる傾向があるので、第一の遺伝子は充分な発現量を必要とする。
【0087】
実施例で解析された植物はイネ(Hwc2-1を持つ品種として「日本晴」、Hwc2-1を持たない品種として染色体置換系統SL6-3系統と「あそみのり」、Hwc1-1を持つ品種としてJamaica)であるが、本発明はイネ以外の植物にも利用可能であると考えられる。このような植物として、農作物ではコムギ、オオムギ、ライムギ、トウモロコシ、サトウキビ、ソルガム、ワタ、ヒマワリ、ピーナッツ、トマト、ジャガイモ、サツマイモ、エンドウ、ダイズ、アズキ、レタス、キャベツ、カリフラワー、ブロッコリー、カブ、ダイコン、ホウレンソウ、タマネギ、ニンジン、ニンニク、ナス、カボチャ、キュウリ、リンゴ、ナシ、メロン、イチゴ、ブドウなどが、観賞用植物としてはシロイヌナズナ、ペチュニア、キク、カーネーション、セントポーリア、ヒャクニチソウなどが挙げられる。中でも、イネ科の穀物(例えば、トウモロコシ、オオムギ、コムギ、ライムギ、サトウキビ、ソルガム)においては好適に利用し得る可能性が十分にあると思われる。
【0088】
8.生態系への応用
上述の雑種弱勢を誘導する方法を利用して、圃場生態系において望ましくない交雑によって遺伝子が拡散することを防ぐことができる。例えば、イネは通常開花し、開花の直前もしくは開花とほぼ同時に自家受粉することが知られているが、この時、風にのって花粉が外部に飛散する。そのため、遺伝子組換えイネにおいて、花粉飛散による非組換えイネへの外来遺伝子飛散が懸念されている(吉田ら2007;非特許文献3)。日本の稲作で用いられている品種はほとんどがHwc2-1を持つため、形質転換体を作成する場合、外来遺伝子と第一の遺伝子のコードするタンパク質の全体あるいは一部を発現する遺伝子(例えばHwc1-1)を一緒に形質転換すれば、形質転換体が周囲に栽培されている品種と交雑しても弱勢が生じて次世代の種子を生じることがない(図3)。
【0089】
本発明で利用可能な外来遺伝子の例としては、除草剤耐性遺伝子、害虫抵抗性遺伝子、耐冷性遺伝子、耐乾燥性遺伝子、物質の生合成に関わる遺伝子(ビタミンAなど)、植物の含有成分を改変する遺伝子(例えば、花粉症アレルゲンタンパク質などの医薬に関する遺伝子)、植物発生プログラムの変更に関わる遺伝子(開花特性(日長感応性、春化要求性)、発芽に関する性質、草丈、草型、花の大きさや形態、実の大きさ、生殖様式(単為結果性、単為生殖性、自家不和合性)、葉序、花序、根や茎の肥大等)等が挙げられる。
【0090】
交雑により生じた種子が発芽した植物は、生育不良となり次世代の種子を生じないため、導入されたこれらの外来遺伝子は、その遺伝子組換え植物のみに留まり、周囲の雑草や他の栽培品種に広がらない。
【0091】
これらの遺伝子とHwc1-1を一緒に形質転換する方法としては、これらの遺伝子とHwc1-1遺伝子を連結した状態で含む形質転換用ベクターを利用する方法が適切である。
【0092】
9.Hwc1-1およびHwc1-2のネガティブマーカーとしての利用
Hwc2-1を持ち、Hwc2-1が発現する細胞でHwc1-1を発現させた場合に過敏感細胞死が生じることを利用して、Hwc1-1をネガティブマーカーとして細胞選抜に利用できる。相同組換えによって染色体の特定の遺伝子の配列を組み換えるジーンターゲティングを行うときにネガティブ細胞選抜が必要であるが、その際に利用可能な技術である。Hwc2-1を持つ染色体を有する植物細胞に、形質転換により標的遺伝子(target gene)とともにHwc1-1を導入すると、Hwc2-1の働きによりHwc1-1を持つ細胞は死滅するが、相同組換えによってHwc1-1が除かれた細胞は生き残るので、ジーンターゲティングが成功した細胞を選抜することができる(図4)。
【0093】
具体的には、ベクターの中にHwc1-1のcDNA配列を発現を誘導するプロモーターとともに挿入し、Hwc2-1を持つ植物に形質転換したときに、形質転換が起きると過敏感細胞死を起こすネガティブ選抜マーカー遺伝子として利用する。
【0094】
従って、以下の方法も本発明の範囲に含まれる。
【0095】
HWC1遺伝子座の対立遺伝子Hwc1-1を組み込んだ発現カセットを、HWC2遺伝子座の対立遺伝子Hwc2-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0096】
一態様において、前記Hwc1-1は配列番号2の塩基配列またはその一部からなる配列を有する。配列番号2の一部からなる配列は、HWC1-1ポリペプチドの変異部分を挟む10残基のアミノ酸配列VAKAHASA-KVを含むポリペプチドをコードすることが望ましい。
同様に、Hwc2-1もHwc1-1を持つ植物においてマーカーとなる。従って、以下の方法も本発明の範囲に含まれる。
【0097】
HWC2遺伝子座の対立遺伝子Hwc2-1を組み込んだ発現カセットを、HWC1遺伝子座の対立遺伝子Hwc1-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【0098】
一態様において、前記Hwc2-1は配列番号5の塩基配列またはその一部からなる配列を有する。
【0099】
以下、本発明を実施例によって具体的に説明する。実施例で用いたHwc1-1とHwc2-1は、遺伝子および発現制御領域を含む染色体の断片であり、それぞれ配列番号1と配列番号4に示される塩基配列を有する。なお、これらの実施例は、本発明を説明するためのものであって、本発明の範囲を限定するものではない。
【実施例1】
【0100】
Hwc1-1を持たない植物にHwc1-1を導入し、雑種弱勢を人工的に誘導した例
Jamaicaのバクテリア人工染色体(BAC)を用いたゲノムDNAライブラリーを作製し、Hwc1-1を含むBACクローンをDNAマーカーRMNM37、RMNM38を用いて選抜した。選抜されたBACクローンから遺伝子の上流制御配列、転写領域を含む全長14 kbpのJamaica染色体断片を切り出し、形質転換ベクター pCAMBIA1301(http://www.cambia.org/daisy/cambia/585.html)のSal IとSac Iの間に挿入した。この形質転換ベクターをアグロバクテリウムEHA105とヘルパー大腸菌PRK2013を用いた3者接合法によってアグロバクテリウムへ導入した。このアグロバクテリウムを用い、日本晴の第4染色体をHwc2-1を持たないKasalath染色体に置換した系統(以下SL6-3)へ形質転換を行った。形質転換にはToki ら (2006: Seiichi Toki, Naho Hara1, Kazuko Ono1, Haruko Onodera1, Akemi Tagiri1, Seibi Oka and Hiroshi Tanaka (2006) Early infection of scutellum tissue with Agrobacterium allows high-speed transformation of rice. Plant Journal 47: 969-976.)の方法に従い、イネ種子の胚盤から誘導されるカルスにアグロバクテリウムを共存培養する方法を用いた。形質転換植物は正常に生育し、SL6-3と異なる表現型を示すことはなかった。しかし、SL6-3に候補遺伝子を導入した形質転換植物から得られたT1植物8系統にHwc2-1を持つ台中65号を検定交雑すると、交雑種子から雑種弱勢を生じる個体が生じ(図2C)、PCRによって導入遺伝子の有無を確認すると、弱勢の表現型と導入した遺伝子の有無が一致した。以上より、Hwc1-1を形質転換ベクターに入れてHwc1-1を持たない植物に導入することにより、人工的に雑種弱勢を誘導できることが示された。また、この時用いたベクターpCAMBIA1301はHwc1-1の他、35Sプロモーターに連結したハイグロマイシン抵抗性遺伝子(hptII)やβ-グルクロニダーゼ遺伝子などを含んでいる。そのため、有用な遺伝子とHwc1-1を同時に形質転換して雑種弱勢を誘導するということも本実施例と同様に行うことができると考えられる。
【実施例2】
【0101】
Hwc2-1を持たない植物にHwc2-1を導入し、雑種弱勢を人工的に誘導した例
日本晴のHwc2-1染色体断片8.4kbpをLongPCRにより増幅後、プライマーに付加した制限酵素認識配列をKpn I、SalIで切断、pCAMBIA1301にクローニングし、Hwc2-1を持たないSL6-3系統、あるいは「あそみのり」へHwc1-1の場合と同様の方法で導入した。得られた形質転換植物は正常に生育した。一方、これらのT0世代形質転換植物8個体とHwc1-1を持つJamaicaとを検定交雑し、その後代で表現型を調べると、交雑後代からいずれも強い雑種弱勢を示す個体が出現した(図2A、B)。また、弱勢の起きた個体からはいずれも導入した遺伝子が検出され、弱勢の起きなかった個体からは導入した遺伝子が検出されなかった。このことから、Hwc2-1を形質転換してHwc2-1を持たない植物に導入することによって、Hwc1-1を持つ植物との交雑において雑種弱勢を誘導できることが確認された。この例においても、ベクターはpCAMBIA1301を用いており、Hwc2-1以外に2つの遺伝子を含んでいる状況で行われた。
【実施例3】
【0102】
Hwc2-1を持つ植物にHwc1-1を持つベクターを導入し弱勢を誘導する実験
100粒の日本晴完熟種子を用い、Hwc1-1を組み込んだpCAMBIA1301を持つアグロバクテリウムEHA105によって形質転換を行った。通常pCAMBIA1301のベクターのみでは、1粒から平均1個体以上の形質転換植物が得られるが、カルスの生育が悪く、再分化する個体も少なかった。得られた10個体の植物のうち、PCRを行ってHwc1-1が検出された個体は3個体のみであった。この3個体も激しい弱勢を示し、34℃では生育できるが10cm程度までシュートが成長するとそれ以上に成長することはなかった。
【実施例4】
【0103】
Hwc1-1を持つ植物にHwc2-1を持つベクターを導入し弱勢を誘導する実験
これまでの遺伝学的な解析から、Hwc1-1がホモ接合になるとHwc2-1の存在下で激しい弱勢を示すことが明らかとなっていた。そのため、Hwc1-1を持つ品種にHwc2-1を直接導入すると、形質転換植物が全く得られない可能性が高いと考えられた。そこで、Hwc1-1をヘテロ接合で持つように、Jamaicaと農林11号、JamaicaとあそみのりでF1雑種を作出し、そのF1雑種にHwc2-1を持つpCAMBIA1301ベクターを導入することを試みた。Tokiら(2006)によるカルス誘導中の種子へ感染する方法では36の種子、誘導したカルスに感染する一般的な方法では200以上のカルスを用いて形質転換を試みたが、ごく小さい再分化植物が初期に枯死したものを除くとHwc2-1を導入した植物は得られなかった。一方、Hwc2-1と4塩基の違いを持つ、品種Katakutaraの持つhwc2-2を導入した場合は100個のカルスを用いて形質転換植物が得られ、導入遺伝子を確認した植物のうち12個体については形質転換体であることが確認された。Hwc1-1もHwc2-1も持たない染色体置換系統SL6-3にHwc2-1を導入した実験では通常通り形質転換体が得られ、38個体では導入遺伝子の存在が確認された。このT0植物の一部については実施例2の実験に用いた。これらのHwc2-1を導入された植物では交配を行うと雑種弱勢が誘導された。これらの結果から、Hwc1-1を持つ場合にだけHwc2-1を持つベクターを導入することができないということが示された。
【0104】
結果を表にまとめたものを示す。
【0105】
【表1】

【0106】
実施例2において、交雑によって形質転換したHwc2-1をHwc1-1を持つ植物へ導入した場合、通常の雑種弱勢より激しい表現型が現れた。そのため実施例4で行ったように、交配によらず、直接Hwc1-1を持つ植物にHwc2-1を導入する場合は、形質転換の過程で、程度の強い弱勢が細胞レベルで生じ、植物を得るには至らないものと推察される。
【産業上の利用可能性】
【0107】
本発明により提供された雑種弱勢原因遺伝子は、耕地生態系において遺伝子の流れを制御する技術に利用できる。用いる遺伝子がイネの通常の遺伝子に由来するため、社会的に受け入れられやすいと推察される。
【配列表フリーテキスト】
【0108】
配列番号1 Hwc1-1 ゲノムDNA Jamaica対立遺伝子
配列番号2 Hwc1-1 cDNA
配列番号3 HWC1-1(Jamaica)
配列番号4 Hwc2-1 ゲノムDNA
配列番号5 Hwc2-1 cDNA
配列番号6 HWC2-1
配列番号7 HWC1-2(Nipponbare)
配列番号8 HWC1-2(Kasalath)
配列番号9 コムギ AK335189
配列番号10 STYLOSA
配列番号11 LEUNIG
【特許請求の範囲】
【請求項1】
HWC1遺伝子座の対立遺伝子hwc1-2にコードされるHWC1-2ポリペプチドに対するアミノ酸の変異を、HWC1-1ポリペプチドの587位のアミノ酸残基に相当する位置に有するアミノ酸配列からなる変異ポリペプチドまたはその部分配列からなる断片であって、当該変異により、HWC2遺伝子座の対立遺伝子Hwc2-1が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有する前記変異ポリペプチドまたはその断片をコードする塩基配列を含むDNA。
【請求項2】
前記変異ポリペプチドまたはその断片がアミノ酸配列VAKAHASA-KV(式中、HはHWC1-1ポリペプチドの587位のアミノ酸残基に相当し、-は任意のアミノ酸又は一残基の欠失を表す)を含む、請求項1に記載のDNA。
【請求項3】
以下の(a)〜(g)のいずれかのポリペプチドをコードする塩基配列を含む、請求項1に記載のDNA:
(a)配列番号7で表されるアミノ酸配列において587位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(b)587位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(a)のポリペプチド
(c)配列番号8で表されるアミノ酸配列において588位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(d)588位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(c)のポリペプチド
(e)配列番号3で表されるアミノ酸配列からなるポリペプチド
(f)配列番号3で表されるアミノ酸配列からなるポリペプチドにおいて587位のアミノ酸残基がリシンであるアミノ酸配列からなるポリペプチド
(g)少なくともWDリピートドメインの330個のアミノ酸を有する、HWC1-1ポリペプチドの部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド。
【請求項4】
以下の(h)または(i)の塩基配列を有する、請求項1に記載のDNA:
(h)配列番号1で表される塩基配列
(i)配列番号2で表される塩基配列。
【請求項5】
請求項1〜4のいずれかに記載のDNAを含む、植物形質転換用ベクター。
【請求項6】
請求項1に記載の変異ポリペプチドを発現する、外来遺伝子で形質転換された植物。
【請求項7】
請求項1〜4のいずれかに記載のDNAを形質転換により植物に導入して、Hwc2-1を持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該形質転換された植物に付与する方法。
【請求項8】
Hwc2-1を持つ植物が、イネ科の植物である、項求項7に記載の方法。
【請求項9】
配列番号3のアミノ酸配列をコードする塩基配列を有するHWC1遺伝子、及び配列番号6のアミノ酸配列をコードする塩基配列を有するHWC2遺伝子からなる一対の雑種弱勢原因遺伝子。
【請求項10】
HWC1遺伝子座の対立遺伝子Hwc1-1を組み込んだ発現カセットを、HWC2遺伝子座の対立遺伝子Hwc2-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【請求項11】
Hwc1-1が配列番号2の塩基配列またはその一部からなる配列を有する、請求項10に記載の方法。
【請求項12】
HWC2遺伝子座の対立遺伝子Hwc2-1を組み込んだ発現カセットを、HWC1遺伝子座の対立遺伝子Hwc1-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【請求項13】
Hwc2-1が配列番号5の塩基配列またはその一部からなる配列を有する、請求項12に記載の方法。
【請求項1】
HWC1遺伝子座の対立遺伝子hwc1-2にコードされるHWC1-2ポリペプチドに対するアミノ酸の変異を、HWC1-1ポリペプチドの587位のアミノ酸残基に相当する位置に有するアミノ酸配列からなる変異ポリペプチドまたはその部分配列からなる断片であって、当該変異により、HWC2遺伝子座の対立遺伝子Hwc2-1が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有する前記変異ポリペプチドまたはその断片をコードする塩基配列を含むDNA。
【請求項2】
前記変異ポリペプチドまたはその断片がアミノ酸配列VAKAHASA-KV(式中、HはHWC1-1ポリペプチドの587位のアミノ酸残基に相当し、-は任意のアミノ酸又は一残基の欠失を表す)を含む、請求項1に記載のDNA。
【請求項3】
以下の(a)〜(g)のいずれかのポリペプチドをコードする塩基配列を含む、請求項1に記載のDNA:
(a)配列番号7で表されるアミノ酸配列において587位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(b)587位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(a)のポリペプチド
(c)配列番号8で表されるアミノ酸配列において588位のアルギニンが別のアミノ酸に置換されたアミノ酸配列またはその部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド
(d)588位のアミノ酸残基がヒスチジンまたはリシンであるアミノ酸配列またはその部分配列からなる、前記(c)のポリペプチド
(e)配列番号3で表されるアミノ酸配列からなるポリペプチド
(f)配列番号3で表されるアミノ酸配列からなるポリペプチドにおいて587位のアミノ酸残基がリシンであるアミノ酸配列からなるポリペプチド
(g)少なくともWDリピートドメインの330個のアミノ酸を有する、HWC1-1ポリペプチドの部分配列からなり、かつHWC2遺伝子座の対立遺伝子Hwc2-1遺伝子が発現する細胞で発現すると過敏感細胞死を引き起こす機能を有するポリペプチド。
【請求項4】
以下の(h)または(i)の塩基配列を有する、請求項1に記載のDNA:
(h)配列番号1で表される塩基配列
(i)配列番号2で表される塩基配列。
【請求項5】
請求項1〜4のいずれかに記載のDNAを含む、植物形質転換用ベクター。
【請求項6】
請求項1に記載の変異ポリペプチドを発現する、外来遺伝子で形質転換された植物。
【請求項7】
請求項1〜4のいずれかに記載のDNAを形質転換により植物に導入して、Hwc2-1を持つ植物と交配したときに雑種が弱勢を起こすようになる性質を当該形質転換された植物に付与する方法。
【請求項8】
Hwc2-1を持つ植物が、イネ科の植物である、項求項7に記載の方法。
【請求項9】
配列番号3のアミノ酸配列をコードする塩基配列を有するHWC1遺伝子、及び配列番号6のアミノ酸配列をコードする塩基配列を有するHWC2遺伝子からなる一対の雑種弱勢原因遺伝子。
【請求項10】
HWC1遺伝子座の対立遺伝子Hwc1-1を組み込んだ発現カセットを、HWC2遺伝子座の対立遺伝子Hwc2-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【請求項11】
Hwc1-1が配列番号2の塩基配列またはその一部からなる配列を有する、請求項10に記載の方法。
【請求項12】
HWC2遺伝子座の対立遺伝子Hwc2-1を組み込んだ発現カセットを、HWC1遺伝子座の対立遺伝子Hwc1-1を有する植物細胞に導入し、当該細胞の細胞死を引き起こす方法。
【請求項13】
Hwc2-1が配列番号5の塩基配列またはその一部からなる配列を有する、請求項12に記載の方法。
【図5−1】


【図6−1】


【図6−3】


【図1】


【図2】


【図3】


【図4】


【図5−2】


【図6−2】


【図7】




【図6−1】


【図6−3】


【図1】


【図2】


【図3】


【図4】


【図5−2】


【図6−2】


【図7】


【公開番号】特開2011−55806(P2011−55806A)
【公開日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願番号】特願2009−212278(P2009−212278)
【出願日】平成21年9月14日(2009.9.14)
【出願人】(504203572)国立大学法人茨城大学 (99)
【出願人】(504258527)国立大学法人 鹿児島大学 (284)
【Fターム(参考)】
【公開日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願日】平成21年9月14日(2009.9.14)
【出願人】(504203572)国立大学法人茨城大学 (99)
【出願人】(504258527)国立大学法人 鹿児島大学 (284)
【Fターム(参考)】
[ Back to top ]

