内分泌撹乱作用の評価方法
【課題】 評価の対象とする物質について、その内分泌撹乱作用を迅速且つ簡便に評価することのできる方法を提供する。
【解決手段】 本発明に係る内分泌撹乱作用の評価方法は、対象物質の内分泌撹乱作用を評価する方法であって、電極が配置された細胞群に対して、対象物質を接触させる工程と、電極が配置された細胞群に対して、ホルモン受容体に対するアゴニストを比較物質として接触させる工程と、前記細胞群について、前記対象物質を接触させる前後と、前記比較物質を接触させる前後と、における電気生理学的応答を、前記電極を介して測定する測定工程と、を含む。
【解決手段】 本発明に係る内分泌撹乱作用の評価方法は、対象物質の内分泌撹乱作用を評価する方法であって、電極が配置された細胞群に対して、対象物質を接触させる工程と、電極が配置された細胞群に対して、ホルモン受容体に対するアゴニストを比較物質として接触させる工程と、前記細胞群について、前記対象物質を接触させる前後と、前記比較物質を接触させる前後と、における電気生理学的応答を、前記電極を介して測定する測定工程と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、内分泌撹乱作用をもつ物質を特定するための方法に関し、特に迅速且つ簡便な内分泌撹乱作用の評価方法に関する。
【背景技術】
【0002】
生体の発生、成長、代謝等を調節するしくみの一つとして、当該生体を構成する細胞のうち特定の細胞が血液中に分泌するホルモン(成長ホルモンや性ホルモン等)による内分泌系が知られている。
【0003】
この内分泌系としては、例えば、卵巣の濾胞細胞が分泌した女性ホルモン(エストロゲン)が血液中を循環し、他の細胞のエストロゲン受容体に結合することによって、当該他の細胞にエストロゲン特有の機能を発現させるしくみ等がある。
【0004】
このような内分泌系について、ホルモン受容体に対する本来のアゴニストであるホルモンとは異なる物質であるにもかかわらず、当該ホルモン受容体に結合して当該ホルモンと同様の作用を引き起こす外因性物質が、いわゆる内分泌撹乱物質として問題となることがある。
【0005】
例えば、いわゆる合成エストロゲンと呼ばれるジエチルスチルベストロール(DES)は、流産の防止の目的で多用された結果、胎児期に暴露された女性の生殖器に遅発性のがん等を発生させることが報告されており、内分泌撹乱物質の一つとして知られている。
【0006】
このような内分泌撹乱物質としては、DESのように既にその内分泌撹乱作用が確認されているものもあるが、未だその内分泌撹乱作用が確認されていない未知の物質も存在すると考えられる。
【0007】
したがって、このような既知或いは未知の物質によるヒトの健康或いは自然界の生態系への悪影響を防止するために、物質の内分泌撹乱作用を正確に評価し、内分泌撹乱物質を特定する必要がある。
【0008】
そこで、従来、内分泌撹乱物質を特定するために、例えば、動物個体の親世代に候補物質を作用させた場合に、当該候補物質がその子世代の発生過程に与える影響を評価する方法や、候補物質が培養細胞の増殖能力に与える影響を評価する方法等が試みられている(非特許文献1等)。
【非特許文献1】Newbold, R. R. et al., Carcinogenesis 19, 1655-1663, 1998
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかしながら、上記従来の評価方法は、ホルモンの作用経路として、細胞の核内に存在するホルモン受容体を介し、比較的長い時間を経た後に観察される長期的な作用を指標としたものであったため、その結果を得るために長時間を要し、多数の候補物質について評価する場合には、利便性の低いものであった。
【0010】
さらに、従来、環境省によって内分泌撹乱物質の候補として挙げられていた67種類の物質について、哺乳類における明確な内分泌撹乱作用が確認されなかったことが報告され、2004年には、毒性が疑われる約千種類の化学物質の中から新たに内分泌撹乱物質を特定し直すことが発表された。
【0011】
このため、内分泌撹乱物質を特定するための方法の一つとして、内分泌撹乱作用の新たな評価方法が求められている。
【0012】
本発明は、上記問題に鑑みて為されたものであって、評価の対象とする物質について、その内分泌撹乱作用を迅速且つ簡便に評価することのできる方法を提供することをその目的の一つとする。
【課題を解決するための手段】
【0013】
上記従来の課題を解決するため、本発明の一実施形態に係る内分泌撹乱作用の評価方法は、対象物質の内分泌撹乱作用を評価する方法であって、電極が配置された細胞群に対して、対象物質を接触させる工程と、電極が配置された細胞群に対して、ホルモン受容体に対するアゴニストを比較物質として接触させる工程と、前記細胞群について、前記対象物質を接触させる前後と、前記比較物質を接触させる前後と、における電気生理学的応答を、前記電極を介して測定する測定工程と、を含むことを特徴とする。
【0014】
また、本発明の他の実施形態に係る内分泌撹乱作用の評価方法は、対象物質の内分泌撹乱作用を評価する方法であって、電極が配置された細胞群に対して、対象物質を接触させる工程と、電極が配置された細胞群に対して、ホルモン受容体に対するアンタゴニストを比較物質として接触させた後、さらに対象物質を接触させる工程と、前記細胞群について、前記対象物質を接触させる前後における電気生理学的応答を、前記電極を介して測定する測定工程と、を含むことを特徴とする。
【0015】
また、前記ホルモン受容体は、ステロイドホルモン受容体である、こととしてもよい。
【0016】
また、前記測定工程においては、前記細胞群の細胞膜電位変化に基づく電気生理学的応答を測定する、こととしてもよい。
【0017】
また、前記細胞群は、神経細胞群である、こととしてもよい。
【0018】
また、前記対象物質を接触させた細胞群及び前記比較物質を接触させた細胞群に対して、当該細胞群の電気生理学的応答に変化を起こさせる刺激物質を接触させる工程をさらに含み、前記測定工程においては、前記細胞群について、前記刺激物質を接触させる前後における電気生理学的応答をさらに測定する、こととしてもよい。
【0019】
また、前記細胞群は、神経細胞群であり、前記刺激物質は、前記神経細胞群に対して長期抑制を起こさせる化学物質である、こととしてもよい。
【0020】
また、前記神経細胞群は、脳組織切片に含まれる神経細胞群である、こととしてもよい。
【0021】
また、前記脳組織切片は、海馬領域に係る脳組織切片である、こととしてもよい。
【0022】
また、前記測定工程においては、前記神経細胞群の興奮性シナプス後電位を測定する、こととしてもよい。
【発明の効果】
【0023】
本発明によれば、評価の対象とする物質について、その内分泌撹乱作用を迅速且つ簡便に評価する方法を提供することができる。
【発明を実施するための最良の形態】
【0024】
以下に、本発明に係る内分泌撹乱作用の評価方法について、図面を参照しつつ説明する。なお、本発明に係る内分泌撹乱作用の評価方法は、以下の実施形態に限られるものではない。
【0025】
まず、本発明の第一の実施形態に係る内分泌撹乱作用の評価方法(以下、本評価方法1と呼ぶ。)について、その概要を説明する。本評価方法1は、生体内の細胞が有するホルモン受容体を介して引き起こされるホルモン作用のうち、本発明者によって見出された、ごく短時間で引き起こされる急性作用に着目したものである。
【0026】
すなわち、本発明者は、鋭意研究を重ねた結果、例えば、いわゆる環境ホルモンとして既に知られている物質(例えば、DES等)を、ホルモン受容体を有する細胞に接触させると、接触後ごく短時間のうちに、当該細胞において、当該ホルモン受容体に対する本来のアゴニストであるホルモンと同様の電気生理学的応答(例えば、細胞膜電位の変化等)を引き起こすことを見出した。なお、この急性のホルモン様作用に係るホルモン受容体は、主に細胞膜上に存在すると考えられている。
【0027】
本評価方法1は、上記本発明者による独自の知見に基づき、内分泌撹乱作用の評価の対象とする物質が、ホルモン受容体を有する細胞群に対して、当該ホルモン受容体に対するアゴニストと同様の電気生理学的応答を引き起こすか否かを評価し、当該ホルモン様の電気生理学的応答を引き起こす対象物質を内分泌撹乱物質の候補として特定するものである。
【0028】
ここで、本評価方法1において電気生理学的応答を測定する細胞群としては、当該細胞群に含まれる細胞のうち少なくとも一部がホルモン受容体(例えば、ステロイドホルモン(ストレスホルモン、男性ホルモン、女性ホルモン等を含む)に対する受容体)を有し、当該ホルモン受容体にアゴニストが結合することによって電気生理学的応答を示すものであれば、由来する動物や組織の種類に関わらず用いることができ、特に脳組織や神経組織由来のものが顕著な電気生理学的応答を示すため好適である。
【0029】
具体的に、この細胞群としては、例えば、ビブラトーム等を用いて生体組織から薄く切り出した組織切片(組織スライス)を用いることができる。この場合、例えば、細胞群として脳組織切片や神経組織切片等を用いることができ、特に、ラットやマウス等の海馬領域に係る脳組織切片を好適に用いることができる。なお、海馬領域に係る脳組織切片を用いる場合には、海馬領域の長軸横断切片が好適である。ここで、長軸横断切片とは、海馬の長軸に対して垂直に切断した切片である。また、この組織切片は、厚さが150〜400μm程度の範囲のものを好ましく用いることができ、特に300μm程度のものを好適に用いることができる。これは、組織切片の厚さが150μm程度より小さい場合には、当該組織切片に含まれる神経細胞のほとんどが、切片の作製時にその細胞体や樹状突起に大きな損傷を受けたものとなるため、健常組織として用いることが困難となり、また、組織切片の厚さが400μm程度より大きい場合には、当該組織切片の外部の溶液中から、当該組織切片の内部の神経細胞への酸素供給が不十分となり、やはり健常組織として用いることが困難となるためである。また、この細胞群としては、消化酵素等を用いた公知の細胞調製方法により生体組織から単離される初代細胞、樹立された株化細胞、遺伝子組替処理を施された細胞等を培養したものを用いることもできる。この場合、例えば、細胞群として脳組織若しくは神経組織から単離した初代神経細胞、株化神経細胞、遺伝子組替神経細胞等を培養した神経細胞群等を好ましく用いることができる。
【0030】
また、本評価方法1においては、この細胞群に対して、その電気生理学的応答を測定するための電極を配置して用いる。この電極としては、当該電極と接触している細胞群について、その細胞膜電位の変化等の電気生理学的応答を測定することができるものであればよく、例えば、細胞に対して穿刺するガラス電極や、複数の電極が基板上に規則的に配置された多電極プローブを用いることができ、特に、複数の細胞について簡便且つ安定的に測定できる点で当該多電極プローブを好適に用いることができる。
【0031】
また、細胞群に対する電極の配置は、例えば、細胞群として組織切片を用いる場合には、複数の電極を、当該組織切片の表面(組織からの切り出し断面)付近に存在する細胞群のうち少なくとも一部に接触するよう配置することにより行うことができる。この場合、例えば、多電極プローブの複数の電極上に組織切片を載置することによって、この電極の配置を行ってもよい。例えば、細胞群としてラットやマウス等の脳海馬組織切片を用いる場合には、海馬アンモン角に存在する錐体細胞及び海馬歯状回に存在する顆粒細胞がそれぞれ電極に接触するよう配置することができる。また、この電極の配置は、例えば、細胞群として培養細胞群を用いる場合には、複数の電極を、当該培養細胞群に含まれる細胞のうち少なくとも一部に接触するよう配置することにより行うことができる。この場合、例えば、多電極プローブの複数の電極上に培養細胞群を接着させることによって、この電極の配置を行ってもよい。
【0032】
次に、本評価方法1の具体的内容について説明する。本評価方法1は、対象物質接触工程と、比較物質接触工程と、測定工程と、を含む。以下、これらの各工程について順次説明する。なお、本評価方法1においては、第一細胞群と第二細胞群との2つの細胞群を用いる場合を例として説明する。すなわち、第一細胞群は対象物質接触工程及び測定工程において、第二細胞群は比較物質接触工程及び測定工程において、それぞれ用いられる。
【0033】
これら第一細胞群と第二細胞群としては、同様のホルモン受容体を有するものが用いられる。例えば、細胞群として一つの脳組織から切り出した脳組織切片を用いる場合には、取得した複数の脳組織切片のうち、1枚を第一細胞群として、他の1枚を第二細胞群として用いることができる。また、細胞群として培養細胞群を用いる場合には、継代数等の培養条件が同一の培養細胞群のうち、一部の細胞群を第一細胞群として、他の一部の細胞群を第二細胞群として用いることができる。なお、以下において、第一細胞群と第二細胞群とを特に区別する必要がない場合には、単に細胞群と呼ぶ。
【0034】
対象物質接触工程においては、電極が配置された第一細胞群に対して、対象物質を接触させる。ここで、対象物質としては、内分泌撹乱作用をもつか否かの評価対象とする物質であれば特に限られず、例えば、既に何らかのホルモン様作用をもつことが報告されている物質、化学構造が既知で当該化学構造から内分泌撹乱作用をもつことが疑われる物質、化学構造や作用が未知の物質等を用いることができる。
【0035】
具体的に、この対象物質接触工程においては、電極が配置された第一細胞群を、対象物質を含む水溶液中に浸漬することによって、当該第一細胞群に対して、当該対象物質を接触させる。すなわち、例えば、まず所定の容器内に対象物質を含まない水溶液を満たし、当該水溶液中に第一細胞群を所定時間浸漬した後に、当該容器内の水溶液を、対象物質を含む水溶液と交換することにより、当該第一細胞群と当該対象物質とを接触させる。この場合、対象物質を添加した水溶液を第一細胞群が入った容器に灌流させてもよい。また、水溶液に添加する対象物質の濃度は任意に調整することができる。
【0036】
なお、ここで用いる水溶液は、第一細胞群の種類(由来組織や細胞の種類)等に応じて、当該第一細胞群の生存状態を維持できるよう、塩類(ナトリウムやカリウム等)や栄養成分(グルコースやアミノ酸類等)の組成や濃度等を任意に調整したものを用いることができる。この水溶液は以下の工程においても用いられる。
【0037】
比較物質接触工程においては、電極が配置された第二細胞群に対して、当該第二細胞群が有するホルモン受容体に対するアゴニストを比較物質として接触させる。ここで、アゴニストとしては、細胞群に含まれる細胞のうち少なくとも一部が有するホルモン受容体に対する本来のアゴニストを好適に用いることができる。具体的に、例えば、エストロゲン受容体等のステロイドホルモン受容体を有する細胞を含む細胞群を用いる場合には、市販されているエストロゲン等のステロイドホルモンを水溶液中に任意の濃度で溶解して用いることができる。このアゴニストとしては、この他にも、コルチコステロン等のストレスステロイド、テストステロンや5−ジヒドロテストステロン等の男性ホルモン、エストラジオールやエストロン等の女性ホルモン等を用いることができる。
【0038】
具体的に、この比較物質接触工程においては、電極が配置された第二細胞群を、アゴニストを含む水溶液中に浸漬することによって、当該第二細胞群に対して、当該アゴニストを接触させる。すなわち、例えば、まず所定の容器内にアゴニストを含まない水溶液を満たし、当該水溶液中に第二細胞群を所定時間浸漬した後に、当該容器内の水溶液を、アゴニストを含む水溶液と交換することにより、当該第二細胞群と当該アゴニストとを接触させる。この場合、アゴニストを添加した水溶液を第二細胞群が入った容器に灌流させてもよい。また、水溶液に添加するアゴニストの濃度は任意に調整することができる。
【0039】
測定工程においては、上記対象物質接触工程において対象物質を接触させる前後における第一細胞群の電気生理学的応答と、上記比較物質接触工程において比較物質を接触させる前後における第二細胞群の電気生理学的応答と、を当該細胞群に配置した電極を介して測定する。
【0040】
具体的に、この測定工程においては、例えば、第一細胞群に対して対象物質を接触させる前後に亘って、また第二細胞群に対してアゴニストを接触させる前後に亘って、当該細胞群に含まれる細胞のうち少なくとも一部に対し、一定の刺激を付加するとともに、当該刺激により引き起こされる電気生理学的応答を測定する。
【0041】
ここで、この測定工程における刺激方法としては、当該刺激によって細胞の電気生理学的応答が引き起こされるものであれば特に限られず、例えば、細胞群として脳組織切片や培養神経細胞を用いる場合には、当該細胞群に含まれる神経細胞に投射するシナプス前線維に対する電気刺激や、ガラスピペットを用いた当該神経細胞に対する神経伝達物質の局所的噴射等が挙げられるが、簡便に安定して実施できるという観点から、電気刺激が好適である。また、例えば、細胞群として筋肉組織を用いる場合には、当該筋肉組織内においてシナプスを形成する神経細胞に対しても同様の刺激方法を用いることができる。また、例えば、細胞群として、ホルモン受容体へのアゴニストへの結合によって性質が変わりうる神経伝達物質受容体と、当該ホルモン受容体の遺伝子を導入した株化細胞を用いる場合には、当該株化細胞と当該神経伝達物質とを接触させる刺激方法を用いることもできる。
【0042】
この刺激方法として電気刺激を用いる場合には、例えば、細胞群に配置した複数の電極のうち、一部の電極から当該電極に接触している細胞に対して所定強度の電気刺激を一定の時間間隔で付加するとともに、他の一部の電極から当該電気刺激により引き起こされる細胞膜電位の変化等を反復的に測定することができる。この場合、具体的に、ガラス電極を用いて集合電位を測定する方法、ガラス電極刺入法により単一細胞から細胞内電位を測定する方法、ガラス電極を用いたパッチクランプ法により単一細胞から細胞内電位を測定する方法、多電極プローブを用いる方法等を用いることができるが、特に多電極プローブの複数の電極に接触している細胞群の集合電位を測定する方法は簡便且つ確実な方法として特に好適に用いることができる。
【0043】
すなわち、多電極プローブを用いた電気刺激方法を用いる場合には、この測定工程において、例えば、細胞群として海馬領域に係る脳組織切片を用い、当該脳組織切片に多電極プローブの複数の電極を配置し、アゴニストとしてエストロゲンを用いて、まず対象物質を含まない水溶液中に浸漬した第一脳組織切片の興奮性シナプス後電位を当該電極を介して測定し、次に当該第一脳組織切片を対象物質を含む水溶液中に浸漬して、その興奮性シナプス後電位をさらに測定する。また、第二脳組織切片については、まずエストロゲンを含まない水溶液中に浸漬した当該第二脳組織切片の興奮性シナプス後電位を測定し、次に当該第二脳組織切片をエストロゲンを含む水溶液中に浸漬して興奮性シナプス後電位をさらに測定する。なお、これら対象物質又はエストロゲンを含む水溶液は、脳組織切片が入った容器に灌流させてもよい。
【0044】
そして、この場合、この測定工程における測定結果として、第一脳組織切片が対象物質と接触する前後における興奮性シナプス後電位の大きさと、第二脳組織切片がエストロゲンと接触する前後における興奮性シナプス後電位の大きさと、が類似していれば、当該対象物質はエストロゲンと同様のホルモン様作用をもつ可能性が高いことが確認される。すなわち、この対象物質は、脳組織切片に対し、当該脳組織切片に含まれる少なくとも一部の細胞が有するエストロゲン受容体を介して内分泌撹乱作用を引き起こす内分泌撹乱物質である可能性が高いことが確認される。一方、第一脳組織切片が対象物質と接触する前後における興奮性シナプス後電位と、第二脳組織切片がエストロゲンと接触する前後における興奮性シナプス後電位と、が類似していれば、当該対象物質は、少なくともエストロゲン受容体を介した内分泌撹乱作用はもたないことが確認される。
【0045】
このように、本評価方法1によれば、対象物質による内分泌撹乱作用を、細胞群の電気生理学的応答として測定することができるため、対象物質について、その内分泌撹乱作用を極めて迅速且つ簡便に評価することができる。
【0046】
また、本評価方法1は、上記対象物質接触工程と、比較物質接触工程と、測定工程と、に加え、対象物質を接触させた細胞群及び比較物質を接触させた細胞群に対して、当該細胞群の電気生理学的応答に変化を起こさせる刺激物質を接触させる刺激物質接触工程をさらに含むこととしてもよい。
【0047】
ここで、この刺激物質としては、ホルモン受容体を介した経路とは異なる経路で、細胞群の電気生理学的応答に対して変化を起こさせ、且つ当該電気生理学的応答の変化の程度を、当該細胞群を予めアゴニストと接触させた場合と、接触させない場合とで変化させるものであれば特に限られず用いることができる。具体的に、例えば、細胞群として神経細胞群を用いた場合には、この刺激物質としては、当該神経細胞群に対して当該刺激物質を接触させる前後で当該神経細胞の興奮性シナプス後電位に一定の変化を起こさせ、且つ当該興奮性シナプス後電位の変化の程度を、当該神経細胞とエストロゲンとを予め接触させた場合と、接触させない場合とで変化させるものを用いることができる。この場合、例えば、この刺激物質として、脳組織切片に含まれる神経細胞群等に対して興奮性シナプス後電位のいわゆる長期抑制を起こさせるN―メチル―D―アスパラギン酸(NMDA)等を用いることができる。なお、この場合、このNMDAの作用濃度(水溶液中に溶解する濃度)は10〜50μMの範囲が好ましく、またその作用時間(神経細胞群をNMDA添加水溶液中に浸漬する時間)は10分以内が好ましく用いられ、特にNMDAの作用濃度30μM、作用時間3分間が好適である。これは、NMDAの作用濃度が10μMより小さい場合には、その刺激作用が不十分であり、また、NMDAの作用濃度が50μMより大きく、又はその作用時間が10分より長い場合には、神経細胞群が死滅することがあるためである。なお、上記の好適な作用濃度及び作用時間の範囲においては、神経細胞を健全な状態に保ちつつ十分な刺激作用が得られることが確認されている。また、この他にも、例えば、細胞群として海馬脳組織切片を用いた場合には、当該海馬脳組織切片に含まれる神経細胞群に対して長期抑制を起こさせるI型代謝型グルタミン酸受容体に対するアゴニストである(RS)−3,5−dihydroxyphenylglycine(DHPG)等を用いることもできる。
【0048】
具体的に、この刺激物質接触工程においては、例えば、まず所定の容器内において、第一細胞群を、対象物質を添加した水溶液中に浸漬し、第二細胞群を、アゴニストを添加した水溶液中に浸漬した後、当該容器内の水溶液を、上記刺激物質を添加した水溶液と交換することにより、当該細胞群と当該刺激物質とを接触させる。なお、この場合、刺激物質を添加した水溶液を細胞群が入った容器に灌流させてもよい。また、水溶液に添加する刺激物質の濃度は任意に調整することができる。
【0049】
また、本評価方法1がこの刺激物質接触工程を含む場合には、測定工程において、対象物質を接触させる前後における第一細胞群の電気生理学的応答と、比較物質を接触させる前後における第二細胞群の電気生理学的応答と、に加えて、さらに刺激物質を接触させる前後における当該細胞群の電気生理学的応答をも測定する。
【0050】
具体的に、この測定工程においては、まず対象物質を含まない水溶液中に浸漬した第一細胞群について電気生理学的応答を測定し、次に当該第一細胞群を対象物質を含む水溶液中に浸漬して電気生理学的応答を測定し、さらに当該第一細胞群を刺激物質を含む水溶液中に浸漬して電気生理学的応答を測定する。また、この測定工程においては、まずアゴニストを含まない水溶液中に浸漬した第二細胞群について電気生理学的応答を測定し、次に当該第二細胞群をアゴニストを含む水溶液中に浸漬して電気生理学的応答を測定し、さらに当該第二細胞群を刺激物質を含む水溶液中に浸漬して電気生理学的応答を測定する。このように、本評価方法1においては、細胞群の電気生理学的応答を、全工程に亘って時間的に連続して測定し続けることとしてもよい。
【0051】
すなわち、例えば、細胞群として脳組織切片を用い、アゴニストとしてエストロゲンを用い、刺激物質としてNMDAを用い、電気生理学的応答として当該脳組織切片の興奮性シナプス後電位を測定する場合には、第一脳組織切片と第二脳組織切片とについて、まず刺激物質、エストロゲン、NMDAのいずれとも接触させずに興奮性シナプス後電位を測定し、続いて第一脳組織切片を対象物質と接触させるとともに、第二脳組織切片をエストロゲンと接触させて、当該第一脳組織切片と第二脳組織切片とにおける興奮性シナプス後電位をそれぞれ測定し、この後さらに、当該第一脳組織切片と第二脳組織切片とをNMDAに接触させて、それぞれの興奮性シナプス後電位をさらに測定する。
【0052】
そして、この測定工程において、対象物質と接触させた後にNMDAと接触させた第一脳組織切片における興奮性シナプス後電位の変化の程度と、エストロゲンと接触させた後にNMDAと接触させた第二脳組織切片における興奮性シナプス後電位の変化の程度と、が同程度であれば、この対象物質はエストロゲン受容体を介して脳組織切片の興奮性シナプス後電位に変化をもたらす作用をもつ内分泌撹乱物質である可能性が高いことが確認される。
【0053】
このように、この刺激物質接触工程を含む本評価方法1においては、刺激物質を含む水溶液中に細胞群を浸漬して、当該細胞群全体に当該刺激物質を接触させるため、例えば、当該刺激物質や対象物質が作用する細胞が、当該細胞群の一部にのみ存在する場合であっても、当該細胞群全体として、当該刺激物質や対象物質による電気生理学的応答の変化を確実に測定することができる。さらに、この場合、刺激物質によって細胞群の電気生理学的応答が顕著に現れることとなるため、対象物質や比較物質が当該電気生理学的応答に与える影響を測定する上での精度を向上させることができる。したがって、このような本評価方法1によれば、対象物質による内分泌撹乱作用を、細胞群全体としての電気生理学的応答として、簡便且つ確実に評価することができる。
【0054】
次に、本発明の第二の実施形態に係る内分泌撹乱作用の評価方法(以下、本評価方法2と呼ぶ。)について説明する。この本評価方法2は、上記本評価方法1と同様、生体内の細胞が有するホルモン受容体を介して引き起こされるホルモン作用のうち、ごく短時間で引き起こされる急性作用に着目したものである。
【0055】
すなわち、本発明者は、鋭意研究を重ねた結果、例えば、いわゆる環境ホルモンとして既知の物質を、ホルモン受容体を有する細胞に接触させると、接触後ごく短時間のうちに、当該細胞において、当該ホルモン受容体に対するアゴニストと同様の電気生理学的応答を引き起こすが、細胞群をホルモン受容体に対するアンタゴニストと接触させた後に、当該環境ホルモンに接触させた場合には、当該アゴニストと同様の電気生理学的応答は引き起こされないこと、すなわち、当該アンタゴニストによってホルモン受容体を介したホルモン様の電気生理学的応答が阻害されること、を見出した。
【0056】
この本評価方法2は、この本発明者による独自の知見に基づき、対象物質が、ホルモン受容体を有する細胞に対して電気生理学的応答を起こすか否かを評価するとともに、当該電気生理学的応答がアンタゴニストによって阻害されるか否かを評価するものである。したがって、本評価方法2によれば、このような、アンタゴニストによって阻害される、ホルモン様の電気生理学的応答を引き起こす対象物質を内分泌撹乱物質である可能性の高い物質として特定することができる。
【0057】
具体的に、この本評価方法2は、電極が配置された細胞群に対して対象物質を接触させる対象物質接触工程と、電極が配置された細胞群に対してホルモン受容体に対するアンタゴニストを比較物質として接触させた後、さらに対象物質を接触させる比較物質接触工程と、当該細胞群について、対象物質を接触させる前後における電気生理学的応答を電極を介して測定する測定工程と、を含む。なお、本評価方法2においても、上記本評価方法1と同様に、第一細胞群と第二細胞群との2つの細胞群を用いる場合を例として説明する。
【0058】
この本評価方法2における対象物質接触工程においては、上記本評価方法1における対象物質接触工程と同様、電極が配置された第一細胞群に対して対象物質を接触させる。また、本評価方法2における比較物質接触工程においては、電極が配置された第二細胞群を、まずホルモン受容体に対するアンタゴニストを含む水溶液中に浸漬して当該第二細胞群に当該アンタゴニストを接触させた後、さらに当該第二細胞群を、対象物質を含む水溶液中に浸漬することによって当該第二細胞群に当該対象物質を接触させる。
【0059】
ここで、このアンタゴニストとしては、細胞群に含まれる細胞のうち少なくとも一部が有するホルモン受容体に対して結合するが、当該ホルモン受容体に対する本来のアゴニストが引き起こすホルモン作用は引き起こさない物質であれば好適に用いることができる。具体的に、例えば、エストロゲン受容体を有する細胞群を用いる場合には、市販されている17α−エストラジオール等のエストロゲンインヒビターを水溶液中に任意の濃度で溶解して用いることができる。
【0060】
また、この本評価方法2における測定工程においては、電極を配置した第一細胞群を、まず対象物質を含まない水溶液中に浸漬してその電気生理学的応答を測定し、次に当該第一細胞群を、対象物質を含む水溶液中に浸漬してその電気生理学的応答をさらに測定する。また、この測定工程においては、電極を配置した第二細胞群を、まずアンタゴニストを含む水溶液中に浸漬してその電気生理学的応答を測定し、次に当該第二細胞群を、対象物質を含む水溶液中に浸漬してその電気生理学的応答をさらに測定する。
【0061】
具体的に、例えば、細胞群として脳組織切片を用い、アンタゴニストとしてエストロゲンインヒビターを用いる場合には、この測定工程において、アンタゴニストと接触させることなく対象物質と接触させた第一脳組織切片における、当該対象物質との接触前後での細胞膜電位の変化が、アンタゴニストと接触させた後に対象物質と接触させた第二脳組織切片において測定されない場合には、当該対象物質はエストロゲン受容体を介して当該細胞膜電位の変化を引き起こす、すなわちエストロゲン受容体を介したホルモン様作用をもつ、内分泌撹乱物質である可能性が高いことが確認される。
【0062】
このように、本評価方法2によれば、対象物質による内分泌撹乱作用を電気生理学的応答として測定することができるため、対象物質について、その内分泌撹乱作用を極めて迅速且つ簡便に評価することができる。
【0063】
また、この本評価方法2は、上記対象物質接触工程と、比較物質接触工程と、測定工程と、に加え、上記本評価方法1と同様の刺激物質接触工程をさらに含むこととしてもよい。この場合、例えば、細胞群として脳組織切片を用い、アンタゴニストとしてエストロゲンインヒビターを用い、刺激物質としてNMDAを用い、電気生理学的応答として当該脳組織切片の興奮性シナプス後電位を測定する場合には、まず、第一脳組織切片について、エストロゲンインヒビターと接触させないときの興奮性シナプス後電位と、第二脳組織切片について、エストロゲンインヒビターと接触させたときの興奮性シナプス後電位と、を測定し、続いてこれら第一脳組織切片と第二脳組織切片とを対象物質と接触させたときの興奮性シナプス後電位を測定し、この後さらに、当該第一脳組織切片と第二脳組織切片とをNMDAに接触させて興奮性シナプス後電位を測定する。
【0064】
そして、測定工程において、対象物質と接触させた後にNMDAと接触させた第一脳組織切片における興奮性シナプス後電位の変化が、エストロゲンインヒビターと接触させた後に対象物質と接触させ、さらにその後にNMDAと接触させた第二脳組織切片において測定されない場合には、この対象物質は、エストロゲン受容体を介したホルモン様の興奮性シナプス後電位に変化をもたらす作用をもつ内分泌撹乱物質である可能性が高いことが確認される。
【0065】
このように、この刺激物質接触工程を含む本評価方法2においては、上記刺激物質接触工程を含む本評価方法1と同様、対象物質による内分泌撹乱作用を、細胞群全体としての電気生理学的応答として、簡便且つ確実に評価することができる。
【0066】
[実施例]
次に、上記本評価方法1について、具体的な実施の一例を説明する。まず、細胞群の準備及び実験条件の設定方法について説明する。細胞群としては、ビブラトーム(DSK ZERO1、堂阪イーエム株式会社製)を用いて成獣ラット脳組織から切り出した、海馬領域の長軸横断組織切片を用いた。この海馬組織切片の厚さは300μmとした。
【0067】
この海馬組織切片の電気生理学的応答の測定には、多電極測定装置MED64 System(メッド64システム、アルファメッド社)を用いた。そして、海馬組織切片に配置する電極としては、この多電極測定装置に付属の多電極プローブMED−P530A(アルファメッド社)を用いた。この多電極プローブの基板上には複数の電極が予め所定間隔(300μm)で規則的に配置されている。
【0068】
ビブラトームによって切り出した1枚の海馬組織切片を、1つの多電極プローブの基板上に設置した1つのチャンバー内に静置するとともに、当該チャンバー内に酸素と二酸化炭素との混合ガス(95%酸素ガス、5%二酸化炭素ガス)で十分に飽和させた人工脳脊髄液中を満たすことにより、当該海馬組織切片を当該人工脳脊髄液中に浸漬し、室温で1時間以上静置した。なお、この人工脳脊髄液としては、124mMのNaCl、1.25mMのNaH2PO4・2H2O、5mMのKCl、2mMのMgSO4・7H2O、2mMのCaCl2、22mMのNaHCO3、10mMのGlutaminを含む水溶液を用いた。
【0069】
そして、この人工脳脊髄液中において、海馬組織切片の表面付近の2つのアンモン角領域と、1つの歯状回と、の3つの領域に含まれる細胞が、多電極プローブ上の複数の電極と、それぞれ接触するように、当該多電極プローブ上に当該海馬組織切片を載置した。すなわち、アンモン角CA1野の錐体細胞と、アンモン角CA3野の錐体細胞と、歯状回の顆粒細胞と、のそれぞれについて、当該神経細胞群に投射するシナプス前線維に対して電気刺激を負荷する刺激電極と、当該神経細胞群において当該電気刺激によって誘発される興奮性シナプス後電位を集合電位として記録する記録電極と、を配置した。
【0070】
刺激電極による海馬組織切片への電気刺激は、アンモン角CA1野に配置した刺激電極、アンモン角CA3野に配置した刺激電極、歯状回に配置した刺激電極、そして再びアンモン角CA1野に配置した刺激電極、という順番で、15秒間隔で反復的に順次電気刺激を負荷することにより行った。そして、この電気刺激によって誘発される興奮性シナプス後電位を約30分間に亘って記録し、当該集合電位が安定したことを確認してから、以下の各工程において当該刺激電極から負荷する電気刺激の強度を設定した。すなわち、まず、海馬組織切片上の各部位(アンモン角CA1野、アンモン角CA3野、歯状回)に対して負荷する電気刺激の大きさを弱い強度から徐々に増加させつつ、集合電位を測定した。そして、測定される集合電位の大きさが飽和した(すなわち一定となった)時点で、当該飽和した集合電位の大きさを最大値(100%)とし、この最大値に対して50%の値になるように、刺激電極から当該海馬組織切片に負荷する電気刺激の強度を設定した。
【0071】
また、本実施例においては、対象物質としてDESを用い、ホルモン受容体に対するアゴニストとしてエストロゲンの一つであるエストラジオールを用い、刺激物質としてはNMDAを用いた。また、以下の工程において、海馬組織切片と、DES、エストラジオール、又はNMDAとの接触は、当該DES、エストラジオール、又はNMDAを含み、混合ガスで十分に飽和させた人工脳脊髄液を流速毎分約2mlでチャンバー内に灌流することにより行った。
【0072】
次に、本実施例における各工程について説明する。本実施例においては、同一の脳組織から取得した第一、第二、第三、第四海馬組織切片の4枚の海馬組織切片を用いた場合について説明する。これらの海馬組織切片のそれぞれに対して、上記多電極プローブの刺激電極と記録電極とを配置した。まず、電極を配置した各海馬組織切片に対して、DES、エストラジオール、NMDAのいずれも含まない人工脳脊髄液を灌流しながら、上記のように設定した電気刺激強度による電気刺激を反復的に負荷し、その興奮性シナプス後電位を20分間に亘って連続的に(経時的に)記録した(以下、この工程を予備工程と呼ぶ)。
【0073】
ここで、本実施例においては、興奮性シナプス後電位の測定結果を次のように評価した。すなわち、興奮性シナプス後電位は、例えば図1に示すように、横軸を時間(分)、縦軸を集合電位(mV)としたグラフとして記録されるが、上記予備工程における20分間の測定結果について、図1に破線の矢印で示す集合電位の波形の高さの絶対値(集合電位の大きさ)の平均値を算出し、当該平均値を100%として、後述の工程において測定される興奮性シナプス後電位の値が当該平均値の何%に相当するかを評価した。
【0074】
この予備工程に続いて、灌流液を、第一海馬組織切片については1nMのDESを含む人工脳脊髄液に、第二海馬組織切片については1nMのエストラジオールを含む人工脳脊髄液に、第三海馬組織切片については上記DESを人工脳脊髄液に溶解する際に溶媒として用いたエタノールを含む人工脳脊髄液に、第四海馬組織切片については上記エストラジオールを人工脳脊髄液に溶解する際に溶媒として用いたエタノールを含む人工脳脊髄液に、それぞれ交換し、電気刺激に対する興奮性シナプス後電位をさらに30分間測定し続けた。
【0075】
そして、この30分間に亘る興奮性シナプス後電位の測定に続いて、灌流液に対してさらにNMDAを添加することにより、各海馬組織切片において長期抑圧を誘発した。すなわち、灌流液を、第一海馬組織切片については30μMのNMDAと1nMのDESとを含む人工脳脊髄液に、第二海馬組織切片については30μMのNMDAと1nMのエストラジオールとを含む人工脳脊髄液に、第三及び第四海馬組織切片については30μMのNMDAとエタノールとを含む人工脳脊髄液に、それぞれ交換し、電気刺激に対する興奮性シナプス後電位をさらに3分間測定した。
【0076】
その後、灌流液を、再びNMDAを含まない水溶液、すなわち、第一海馬組織切片については1nMのDESを含む人工脳脊髄液に、第二海馬組織切片については1nMのエストラジオールを含む人工脳脊髄液に、第三及び第四海馬組織切片については上記エタノールを含む人工脳脊髄液に、それぞれ交換し、電気刺激に対する興奮性シナプス後電位をさらに60分間に亘って記録し続けた。上記各工程における灌流液の交換は、興奮性シナプス後電位を測定しつつ連続的に行った。
【0077】
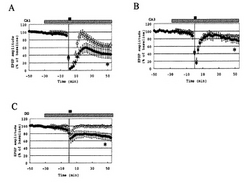
図2及び図3に、本実施例における興奮性シナプス後電位の経時的変化を測定した結果を表す波形を示す。図2は、NMDAにより引き起こされる興奮性シナプス後電位の長期抑制の程度に対して、エストラジオールが与えた効果を示している。この図2において、横軸は時間(分)、縦軸は興奮性シナプス後電位(%)、をそれぞれ示し、グラフ上部に示す黒棒印はNMDAを灌流投与した時間帯を示し、グラフ上部に示す斜線棒印はエストラジオールを灌流投与した時間帯を示す。また、この図2において、黒丸印は第一の海馬組織切片をエストラジオールと接触させた場合の結果を、また白丸印は第三の海馬組織切片を用いた対照実験の結果を、それぞれ示している。図2Aはアンモン角CA1野についての測定結果、図2Bはアンモン角CA3野についての測定結果、図2Cは歯状回についての測定結果、をそれぞれ示している。
【0078】
図2Aに示すように、第三海馬組織切片のアンモン角CA1野を用いた対照実験(白丸印)において、時間0(ゼロ)の時点から3分間NMDA(30μM)を灌流投与(黒棒印時間帯)することで、当該第三海馬組織切片のアンモン角CA1野における興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して70%程度に減少した。
【0079】
一方、図2Aに示すように、NMDA投与前にエストラジオール(1nM)を30分間灌流投与(斜線棒印時間帯)した第一海馬組織切片のアンモン角CA1野(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して40%程度に減少した。
【0080】
また、図2Bに示すように、第三海馬組織切片のアンモン角CA3野を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して80%程度に減少した。
【0081】
一方、図2Bに示すように、NMDA投与前にエストラジオール(1nM)を30分間灌流投与(斜線棒印時間帯)した第一海馬組織切片のアンモン角CA3野(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して55%程度に減少した。
【0082】
また、図2Cに示すように、第三海馬組織切片の海馬歯状回を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して90%程度に減少した。
【0083】
一方、図2Cに示すように、NMDA投与前にエストラジオール(1nM)を30分間灌流投与(斜線棒印時間帯)した第一海馬組織切片の海馬歯状回(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより減少し、NMDA投与前における興奮性シナプス後電位に対して80%程度に減少した。
【0084】
図3は、NMDAにより引き起こされる興奮性シナプス後電位の長期抑制の程度に対して、DESが与えた効果を示している。この図3において、横軸、縦軸、グラフ上部に示す黒棒印及び斜線棒印は、それぞれ図2と同様であり、黒丸印は第二海馬組織切片についての結果を、また白丸印は、第四海馬組織切片を用いた対照実験についての結果を、それぞれ示している。図3Aはアンモン角CA1野についての測定結果、図3Bはアンモン角CA3野についての測定結果、図3Cは歯状回についての測定結果、をそれぞれ示している。
【0085】
図3Aに示すように、第四海馬組織切片のアンモン角CA1野を用いた対照実験(白丸印)において、時間0(ゼロ)の時点から3分間NMDA(30μM)を灌流投与(黒棒印時間帯)することで、当該第四海馬組織切片のアンモン角CA1野における興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して65%程度に減少した。
【0086】
一方、図3Aに示すように、NMDA投与前にDES(1nM)を30分間灌流投与(斜線棒印時間帯)した第二海馬組織切片のアンモン角CA1野(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して40%程度に減少した。
【0087】
また、図3Bに示すように、第四海馬組織切片のアンモン角CA3野を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して85%程度に減少した。
【0088】
一方、図3Bに示すように、NMDA投与前にDES(1nM)を30分間灌流投与(斜線棒印時間帯)した第二海馬組織切片(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより減少し、NMDA投与前における興奮性シナプス後電位に対して75%程度に減少した。
【0089】
また、図3Cに示すように、第四海馬組織切片の海馬歯状回を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して98%程度に減少した。
【0090】
一方、図3Cに示すように、NMDA投与前にDES(1nM)を30分間灌流投与(斜線棒印時間帯)した第二海馬組織切片の海馬歯状回(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して68%程度に減少した。
【図面の簡単な説明】
【0091】
【図1】本発明の一実施形態に係る内分泌撹乱作用の評価方法における興奮性シナプス後電位の測定結果の一例を示すグラフである。
【図2】本発明の一実施形態に係る内分泌撹乱作用の評価方法において、エストラジオールが興奮性シナプス後電位に与える影響を測定した結果の一例を示すグラフである。
【図3】本発明の一実施形態に係る内分泌撹乱作用の評価方法において、DESが興奮性シナプス後電位に与える影響を測定した結果の一例を示すグラフである。
【技術分野】
【0001】
本発明は、内分泌撹乱作用をもつ物質を特定するための方法に関し、特に迅速且つ簡便な内分泌撹乱作用の評価方法に関する。
【背景技術】
【0002】
生体の発生、成長、代謝等を調節するしくみの一つとして、当該生体を構成する細胞のうち特定の細胞が血液中に分泌するホルモン(成長ホルモンや性ホルモン等)による内分泌系が知られている。
【0003】
この内分泌系としては、例えば、卵巣の濾胞細胞が分泌した女性ホルモン(エストロゲン)が血液中を循環し、他の細胞のエストロゲン受容体に結合することによって、当該他の細胞にエストロゲン特有の機能を発現させるしくみ等がある。
【0004】
このような内分泌系について、ホルモン受容体に対する本来のアゴニストであるホルモンとは異なる物質であるにもかかわらず、当該ホルモン受容体に結合して当該ホルモンと同様の作用を引き起こす外因性物質が、いわゆる内分泌撹乱物質として問題となることがある。
【0005】
例えば、いわゆる合成エストロゲンと呼ばれるジエチルスチルベストロール(DES)は、流産の防止の目的で多用された結果、胎児期に暴露された女性の生殖器に遅発性のがん等を発生させることが報告されており、内分泌撹乱物質の一つとして知られている。
【0006】
このような内分泌撹乱物質としては、DESのように既にその内分泌撹乱作用が確認されているものもあるが、未だその内分泌撹乱作用が確認されていない未知の物質も存在すると考えられる。
【0007】
したがって、このような既知或いは未知の物質によるヒトの健康或いは自然界の生態系への悪影響を防止するために、物質の内分泌撹乱作用を正確に評価し、内分泌撹乱物質を特定する必要がある。
【0008】
そこで、従来、内分泌撹乱物質を特定するために、例えば、動物個体の親世代に候補物質を作用させた場合に、当該候補物質がその子世代の発生過程に与える影響を評価する方法や、候補物質が培養細胞の増殖能力に与える影響を評価する方法等が試みられている(非特許文献1等)。
【非特許文献1】Newbold, R. R. et al., Carcinogenesis 19, 1655-1663, 1998
【発明の開示】
【発明が解決しようとする課題】
【0009】
しかしながら、上記従来の評価方法は、ホルモンの作用経路として、細胞の核内に存在するホルモン受容体を介し、比較的長い時間を経た後に観察される長期的な作用を指標としたものであったため、その結果を得るために長時間を要し、多数の候補物質について評価する場合には、利便性の低いものであった。
【0010】
さらに、従来、環境省によって内分泌撹乱物質の候補として挙げられていた67種類の物質について、哺乳類における明確な内分泌撹乱作用が確認されなかったことが報告され、2004年には、毒性が疑われる約千種類の化学物質の中から新たに内分泌撹乱物質を特定し直すことが発表された。
【0011】
このため、内分泌撹乱物質を特定するための方法の一つとして、内分泌撹乱作用の新たな評価方法が求められている。
【0012】
本発明は、上記問題に鑑みて為されたものであって、評価の対象とする物質について、その内分泌撹乱作用を迅速且つ簡便に評価することのできる方法を提供することをその目的の一つとする。
【課題を解決するための手段】
【0013】
上記従来の課題を解決するため、本発明の一実施形態に係る内分泌撹乱作用の評価方法は、対象物質の内分泌撹乱作用を評価する方法であって、電極が配置された細胞群に対して、対象物質を接触させる工程と、電極が配置された細胞群に対して、ホルモン受容体に対するアゴニストを比較物質として接触させる工程と、前記細胞群について、前記対象物質を接触させる前後と、前記比較物質を接触させる前後と、における電気生理学的応答を、前記電極を介して測定する測定工程と、を含むことを特徴とする。
【0014】
また、本発明の他の実施形態に係る内分泌撹乱作用の評価方法は、対象物質の内分泌撹乱作用を評価する方法であって、電極が配置された細胞群に対して、対象物質を接触させる工程と、電極が配置された細胞群に対して、ホルモン受容体に対するアンタゴニストを比較物質として接触させた後、さらに対象物質を接触させる工程と、前記細胞群について、前記対象物質を接触させる前後における電気生理学的応答を、前記電極を介して測定する測定工程と、を含むことを特徴とする。
【0015】
また、前記ホルモン受容体は、ステロイドホルモン受容体である、こととしてもよい。
【0016】
また、前記測定工程においては、前記細胞群の細胞膜電位変化に基づく電気生理学的応答を測定する、こととしてもよい。
【0017】
また、前記細胞群は、神経細胞群である、こととしてもよい。
【0018】
また、前記対象物質を接触させた細胞群及び前記比較物質を接触させた細胞群に対して、当該細胞群の電気生理学的応答に変化を起こさせる刺激物質を接触させる工程をさらに含み、前記測定工程においては、前記細胞群について、前記刺激物質を接触させる前後における電気生理学的応答をさらに測定する、こととしてもよい。
【0019】
また、前記細胞群は、神経細胞群であり、前記刺激物質は、前記神経細胞群に対して長期抑制を起こさせる化学物質である、こととしてもよい。
【0020】
また、前記神経細胞群は、脳組織切片に含まれる神経細胞群である、こととしてもよい。
【0021】
また、前記脳組織切片は、海馬領域に係る脳組織切片である、こととしてもよい。
【0022】
また、前記測定工程においては、前記神経細胞群の興奮性シナプス後電位を測定する、こととしてもよい。
【発明の効果】
【0023】
本発明によれば、評価の対象とする物質について、その内分泌撹乱作用を迅速且つ簡便に評価する方法を提供することができる。
【発明を実施するための最良の形態】
【0024】
以下に、本発明に係る内分泌撹乱作用の評価方法について、図面を参照しつつ説明する。なお、本発明に係る内分泌撹乱作用の評価方法は、以下の実施形態に限られるものではない。
【0025】
まず、本発明の第一の実施形態に係る内分泌撹乱作用の評価方法(以下、本評価方法1と呼ぶ。)について、その概要を説明する。本評価方法1は、生体内の細胞が有するホルモン受容体を介して引き起こされるホルモン作用のうち、本発明者によって見出された、ごく短時間で引き起こされる急性作用に着目したものである。
【0026】
すなわち、本発明者は、鋭意研究を重ねた結果、例えば、いわゆる環境ホルモンとして既に知られている物質(例えば、DES等)を、ホルモン受容体を有する細胞に接触させると、接触後ごく短時間のうちに、当該細胞において、当該ホルモン受容体に対する本来のアゴニストであるホルモンと同様の電気生理学的応答(例えば、細胞膜電位の変化等)を引き起こすことを見出した。なお、この急性のホルモン様作用に係るホルモン受容体は、主に細胞膜上に存在すると考えられている。
【0027】
本評価方法1は、上記本発明者による独自の知見に基づき、内分泌撹乱作用の評価の対象とする物質が、ホルモン受容体を有する細胞群に対して、当該ホルモン受容体に対するアゴニストと同様の電気生理学的応答を引き起こすか否かを評価し、当該ホルモン様の電気生理学的応答を引き起こす対象物質を内分泌撹乱物質の候補として特定するものである。
【0028】
ここで、本評価方法1において電気生理学的応答を測定する細胞群としては、当該細胞群に含まれる細胞のうち少なくとも一部がホルモン受容体(例えば、ステロイドホルモン(ストレスホルモン、男性ホルモン、女性ホルモン等を含む)に対する受容体)を有し、当該ホルモン受容体にアゴニストが結合することによって電気生理学的応答を示すものであれば、由来する動物や組織の種類に関わらず用いることができ、特に脳組織や神経組織由来のものが顕著な電気生理学的応答を示すため好適である。
【0029】
具体的に、この細胞群としては、例えば、ビブラトーム等を用いて生体組織から薄く切り出した組織切片(組織スライス)を用いることができる。この場合、例えば、細胞群として脳組織切片や神経組織切片等を用いることができ、特に、ラットやマウス等の海馬領域に係る脳組織切片を好適に用いることができる。なお、海馬領域に係る脳組織切片を用いる場合には、海馬領域の長軸横断切片が好適である。ここで、長軸横断切片とは、海馬の長軸に対して垂直に切断した切片である。また、この組織切片は、厚さが150〜400μm程度の範囲のものを好ましく用いることができ、特に300μm程度のものを好適に用いることができる。これは、組織切片の厚さが150μm程度より小さい場合には、当該組織切片に含まれる神経細胞のほとんどが、切片の作製時にその細胞体や樹状突起に大きな損傷を受けたものとなるため、健常組織として用いることが困難となり、また、組織切片の厚さが400μm程度より大きい場合には、当該組織切片の外部の溶液中から、当該組織切片の内部の神経細胞への酸素供給が不十分となり、やはり健常組織として用いることが困難となるためである。また、この細胞群としては、消化酵素等を用いた公知の細胞調製方法により生体組織から単離される初代細胞、樹立された株化細胞、遺伝子組替処理を施された細胞等を培養したものを用いることもできる。この場合、例えば、細胞群として脳組織若しくは神経組織から単離した初代神経細胞、株化神経細胞、遺伝子組替神経細胞等を培養した神経細胞群等を好ましく用いることができる。
【0030】
また、本評価方法1においては、この細胞群に対して、その電気生理学的応答を測定するための電極を配置して用いる。この電極としては、当該電極と接触している細胞群について、その細胞膜電位の変化等の電気生理学的応答を測定することができるものであればよく、例えば、細胞に対して穿刺するガラス電極や、複数の電極が基板上に規則的に配置された多電極プローブを用いることができ、特に、複数の細胞について簡便且つ安定的に測定できる点で当該多電極プローブを好適に用いることができる。
【0031】
また、細胞群に対する電極の配置は、例えば、細胞群として組織切片を用いる場合には、複数の電極を、当該組織切片の表面(組織からの切り出し断面)付近に存在する細胞群のうち少なくとも一部に接触するよう配置することにより行うことができる。この場合、例えば、多電極プローブの複数の電極上に組織切片を載置することによって、この電極の配置を行ってもよい。例えば、細胞群としてラットやマウス等の脳海馬組織切片を用いる場合には、海馬アンモン角に存在する錐体細胞及び海馬歯状回に存在する顆粒細胞がそれぞれ電極に接触するよう配置することができる。また、この電極の配置は、例えば、細胞群として培養細胞群を用いる場合には、複数の電極を、当該培養細胞群に含まれる細胞のうち少なくとも一部に接触するよう配置することにより行うことができる。この場合、例えば、多電極プローブの複数の電極上に培養細胞群を接着させることによって、この電極の配置を行ってもよい。
【0032】
次に、本評価方法1の具体的内容について説明する。本評価方法1は、対象物質接触工程と、比較物質接触工程と、測定工程と、を含む。以下、これらの各工程について順次説明する。なお、本評価方法1においては、第一細胞群と第二細胞群との2つの細胞群を用いる場合を例として説明する。すなわち、第一細胞群は対象物質接触工程及び測定工程において、第二細胞群は比較物質接触工程及び測定工程において、それぞれ用いられる。
【0033】
これら第一細胞群と第二細胞群としては、同様のホルモン受容体を有するものが用いられる。例えば、細胞群として一つの脳組織から切り出した脳組織切片を用いる場合には、取得した複数の脳組織切片のうち、1枚を第一細胞群として、他の1枚を第二細胞群として用いることができる。また、細胞群として培養細胞群を用いる場合には、継代数等の培養条件が同一の培養細胞群のうち、一部の細胞群を第一細胞群として、他の一部の細胞群を第二細胞群として用いることができる。なお、以下において、第一細胞群と第二細胞群とを特に区別する必要がない場合には、単に細胞群と呼ぶ。
【0034】
対象物質接触工程においては、電極が配置された第一細胞群に対して、対象物質を接触させる。ここで、対象物質としては、内分泌撹乱作用をもつか否かの評価対象とする物質であれば特に限られず、例えば、既に何らかのホルモン様作用をもつことが報告されている物質、化学構造が既知で当該化学構造から内分泌撹乱作用をもつことが疑われる物質、化学構造や作用が未知の物質等を用いることができる。
【0035】
具体的に、この対象物質接触工程においては、電極が配置された第一細胞群を、対象物質を含む水溶液中に浸漬することによって、当該第一細胞群に対して、当該対象物質を接触させる。すなわち、例えば、まず所定の容器内に対象物質を含まない水溶液を満たし、当該水溶液中に第一細胞群を所定時間浸漬した後に、当該容器内の水溶液を、対象物質を含む水溶液と交換することにより、当該第一細胞群と当該対象物質とを接触させる。この場合、対象物質を添加した水溶液を第一細胞群が入った容器に灌流させてもよい。また、水溶液に添加する対象物質の濃度は任意に調整することができる。
【0036】
なお、ここで用いる水溶液は、第一細胞群の種類(由来組織や細胞の種類)等に応じて、当該第一細胞群の生存状態を維持できるよう、塩類(ナトリウムやカリウム等)や栄養成分(グルコースやアミノ酸類等)の組成や濃度等を任意に調整したものを用いることができる。この水溶液は以下の工程においても用いられる。
【0037】
比較物質接触工程においては、電極が配置された第二細胞群に対して、当該第二細胞群が有するホルモン受容体に対するアゴニストを比較物質として接触させる。ここで、アゴニストとしては、細胞群に含まれる細胞のうち少なくとも一部が有するホルモン受容体に対する本来のアゴニストを好適に用いることができる。具体的に、例えば、エストロゲン受容体等のステロイドホルモン受容体を有する細胞を含む細胞群を用いる場合には、市販されているエストロゲン等のステロイドホルモンを水溶液中に任意の濃度で溶解して用いることができる。このアゴニストとしては、この他にも、コルチコステロン等のストレスステロイド、テストステロンや5−ジヒドロテストステロン等の男性ホルモン、エストラジオールやエストロン等の女性ホルモン等を用いることができる。
【0038】
具体的に、この比較物質接触工程においては、電極が配置された第二細胞群を、アゴニストを含む水溶液中に浸漬することによって、当該第二細胞群に対して、当該アゴニストを接触させる。すなわち、例えば、まず所定の容器内にアゴニストを含まない水溶液を満たし、当該水溶液中に第二細胞群を所定時間浸漬した後に、当該容器内の水溶液を、アゴニストを含む水溶液と交換することにより、当該第二細胞群と当該アゴニストとを接触させる。この場合、アゴニストを添加した水溶液を第二細胞群が入った容器に灌流させてもよい。また、水溶液に添加するアゴニストの濃度は任意に調整することができる。
【0039】
測定工程においては、上記対象物質接触工程において対象物質を接触させる前後における第一細胞群の電気生理学的応答と、上記比較物質接触工程において比較物質を接触させる前後における第二細胞群の電気生理学的応答と、を当該細胞群に配置した電極を介して測定する。
【0040】
具体的に、この測定工程においては、例えば、第一細胞群に対して対象物質を接触させる前後に亘って、また第二細胞群に対してアゴニストを接触させる前後に亘って、当該細胞群に含まれる細胞のうち少なくとも一部に対し、一定の刺激を付加するとともに、当該刺激により引き起こされる電気生理学的応答を測定する。
【0041】
ここで、この測定工程における刺激方法としては、当該刺激によって細胞の電気生理学的応答が引き起こされるものであれば特に限られず、例えば、細胞群として脳組織切片や培養神経細胞を用いる場合には、当該細胞群に含まれる神経細胞に投射するシナプス前線維に対する電気刺激や、ガラスピペットを用いた当該神経細胞に対する神経伝達物質の局所的噴射等が挙げられるが、簡便に安定して実施できるという観点から、電気刺激が好適である。また、例えば、細胞群として筋肉組織を用いる場合には、当該筋肉組織内においてシナプスを形成する神経細胞に対しても同様の刺激方法を用いることができる。また、例えば、細胞群として、ホルモン受容体へのアゴニストへの結合によって性質が変わりうる神経伝達物質受容体と、当該ホルモン受容体の遺伝子を導入した株化細胞を用いる場合には、当該株化細胞と当該神経伝達物質とを接触させる刺激方法を用いることもできる。
【0042】
この刺激方法として電気刺激を用いる場合には、例えば、細胞群に配置した複数の電極のうち、一部の電極から当該電極に接触している細胞に対して所定強度の電気刺激を一定の時間間隔で付加するとともに、他の一部の電極から当該電気刺激により引き起こされる細胞膜電位の変化等を反復的に測定することができる。この場合、具体的に、ガラス電極を用いて集合電位を測定する方法、ガラス電極刺入法により単一細胞から細胞内電位を測定する方法、ガラス電極を用いたパッチクランプ法により単一細胞から細胞内電位を測定する方法、多電極プローブを用いる方法等を用いることができるが、特に多電極プローブの複数の電極に接触している細胞群の集合電位を測定する方法は簡便且つ確実な方法として特に好適に用いることができる。
【0043】
すなわち、多電極プローブを用いた電気刺激方法を用いる場合には、この測定工程において、例えば、細胞群として海馬領域に係る脳組織切片を用い、当該脳組織切片に多電極プローブの複数の電極を配置し、アゴニストとしてエストロゲンを用いて、まず対象物質を含まない水溶液中に浸漬した第一脳組織切片の興奮性シナプス後電位を当該電極を介して測定し、次に当該第一脳組織切片を対象物質を含む水溶液中に浸漬して、その興奮性シナプス後電位をさらに測定する。また、第二脳組織切片については、まずエストロゲンを含まない水溶液中に浸漬した当該第二脳組織切片の興奮性シナプス後電位を測定し、次に当該第二脳組織切片をエストロゲンを含む水溶液中に浸漬して興奮性シナプス後電位をさらに測定する。なお、これら対象物質又はエストロゲンを含む水溶液は、脳組織切片が入った容器に灌流させてもよい。
【0044】
そして、この場合、この測定工程における測定結果として、第一脳組織切片が対象物質と接触する前後における興奮性シナプス後電位の大きさと、第二脳組織切片がエストロゲンと接触する前後における興奮性シナプス後電位の大きさと、が類似していれば、当該対象物質はエストロゲンと同様のホルモン様作用をもつ可能性が高いことが確認される。すなわち、この対象物質は、脳組織切片に対し、当該脳組織切片に含まれる少なくとも一部の細胞が有するエストロゲン受容体を介して内分泌撹乱作用を引き起こす内分泌撹乱物質である可能性が高いことが確認される。一方、第一脳組織切片が対象物質と接触する前後における興奮性シナプス後電位と、第二脳組織切片がエストロゲンと接触する前後における興奮性シナプス後電位と、が類似していれば、当該対象物質は、少なくともエストロゲン受容体を介した内分泌撹乱作用はもたないことが確認される。
【0045】
このように、本評価方法1によれば、対象物質による内分泌撹乱作用を、細胞群の電気生理学的応答として測定することができるため、対象物質について、その内分泌撹乱作用を極めて迅速且つ簡便に評価することができる。
【0046】
また、本評価方法1は、上記対象物質接触工程と、比較物質接触工程と、測定工程と、に加え、対象物質を接触させた細胞群及び比較物質を接触させた細胞群に対して、当該細胞群の電気生理学的応答に変化を起こさせる刺激物質を接触させる刺激物質接触工程をさらに含むこととしてもよい。
【0047】
ここで、この刺激物質としては、ホルモン受容体を介した経路とは異なる経路で、細胞群の電気生理学的応答に対して変化を起こさせ、且つ当該電気生理学的応答の変化の程度を、当該細胞群を予めアゴニストと接触させた場合と、接触させない場合とで変化させるものであれば特に限られず用いることができる。具体的に、例えば、細胞群として神経細胞群を用いた場合には、この刺激物質としては、当該神経細胞群に対して当該刺激物質を接触させる前後で当該神経細胞の興奮性シナプス後電位に一定の変化を起こさせ、且つ当該興奮性シナプス後電位の変化の程度を、当該神経細胞とエストロゲンとを予め接触させた場合と、接触させない場合とで変化させるものを用いることができる。この場合、例えば、この刺激物質として、脳組織切片に含まれる神経細胞群等に対して興奮性シナプス後電位のいわゆる長期抑制を起こさせるN―メチル―D―アスパラギン酸(NMDA)等を用いることができる。なお、この場合、このNMDAの作用濃度(水溶液中に溶解する濃度)は10〜50μMの範囲が好ましく、またその作用時間(神経細胞群をNMDA添加水溶液中に浸漬する時間)は10分以内が好ましく用いられ、特にNMDAの作用濃度30μM、作用時間3分間が好適である。これは、NMDAの作用濃度が10μMより小さい場合には、その刺激作用が不十分であり、また、NMDAの作用濃度が50μMより大きく、又はその作用時間が10分より長い場合には、神経細胞群が死滅することがあるためである。なお、上記の好適な作用濃度及び作用時間の範囲においては、神経細胞を健全な状態に保ちつつ十分な刺激作用が得られることが確認されている。また、この他にも、例えば、細胞群として海馬脳組織切片を用いた場合には、当該海馬脳組織切片に含まれる神経細胞群に対して長期抑制を起こさせるI型代謝型グルタミン酸受容体に対するアゴニストである(RS)−3,5−dihydroxyphenylglycine(DHPG)等を用いることもできる。
【0048】
具体的に、この刺激物質接触工程においては、例えば、まず所定の容器内において、第一細胞群を、対象物質を添加した水溶液中に浸漬し、第二細胞群を、アゴニストを添加した水溶液中に浸漬した後、当該容器内の水溶液を、上記刺激物質を添加した水溶液と交換することにより、当該細胞群と当該刺激物質とを接触させる。なお、この場合、刺激物質を添加した水溶液を細胞群が入った容器に灌流させてもよい。また、水溶液に添加する刺激物質の濃度は任意に調整することができる。
【0049】
また、本評価方法1がこの刺激物質接触工程を含む場合には、測定工程において、対象物質を接触させる前後における第一細胞群の電気生理学的応答と、比較物質を接触させる前後における第二細胞群の電気生理学的応答と、に加えて、さらに刺激物質を接触させる前後における当該細胞群の電気生理学的応答をも測定する。
【0050】
具体的に、この測定工程においては、まず対象物質を含まない水溶液中に浸漬した第一細胞群について電気生理学的応答を測定し、次に当該第一細胞群を対象物質を含む水溶液中に浸漬して電気生理学的応答を測定し、さらに当該第一細胞群を刺激物質を含む水溶液中に浸漬して電気生理学的応答を測定する。また、この測定工程においては、まずアゴニストを含まない水溶液中に浸漬した第二細胞群について電気生理学的応答を測定し、次に当該第二細胞群をアゴニストを含む水溶液中に浸漬して電気生理学的応答を測定し、さらに当該第二細胞群を刺激物質を含む水溶液中に浸漬して電気生理学的応答を測定する。このように、本評価方法1においては、細胞群の電気生理学的応答を、全工程に亘って時間的に連続して測定し続けることとしてもよい。
【0051】
すなわち、例えば、細胞群として脳組織切片を用い、アゴニストとしてエストロゲンを用い、刺激物質としてNMDAを用い、電気生理学的応答として当該脳組織切片の興奮性シナプス後電位を測定する場合には、第一脳組織切片と第二脳組織切片とについて、まず刺激物質、エストロゲン、NMDAのいずれとも接触させずに興奮性シナプス後電位を測定し、続いて第一脳組織切片を対象物質と接触させるとともに、第二脳組織切片をエストロゲンと接触させて、当該第一脳組織切片と第二脳組織切片とにおける興奮性シナプス後電位をそれぞれ測定し、この後さらに、当該第一脳組織切片と第二脳組織切片とをNMDAに接触させて、それぞれの興奮性シナプス後電位をさらに測定する。
【0052】
そして、この測定工程において、対象物質と接触させた後にNMDAと接触させた第一脳組織切片における興奮性シナプス後電位の変化の程度と、エストロゲンと接触させた後にNMDAと接触させた第二脳組織切片における興奮性シナプス後電位の変化の程度と、が同程度であれば、この対象物質はエストロゲン受容体を介して脳組織切片の興奮性シナプス後電位に変化をもたらす作用をもつ内分泌撹乱物質である可能性が高いことが確認される。
【0053】
このように、この刺激物質接触工程を含む本評価方法1においては、刺激物質を含む水溶液中に細胞群を浸漬して、当該細胞群全体に当該刺激物質を接触させるため、例えば、当該刺激物質や対象物質が作用する細胞が、当該細胞群の一部にのみ存在する場合であっても、当該細胞群全体として、当該刺激物質や対象物質による電気生理学的応答の変化を確実に測定することができる。さらに、この場合、刺激物質によって細胞群の電気生理学的応答が顕著に現れることとなるため、対象物質や比較物質が当該電気生理学的応答に与える影響を測定する上での精度を向上させることができる。したがって、このような本評価方法1によれば、対象物質による内分泌撹乱作用を、細胞群全体としての電気生理学的応答として、簡便且つ確実に評価することができる。
【0054】
次に、本発明の第二の実施形態に係る内分泌撹乱作用の評価方法(以下、本評価方法2と呼ぶ。)について説明する。この本評価方法2は、上記本評価方法1と同様、生体内の細胞が有するホルモン受容体を介して引き起こされるホルモン作用のうち、ごく短時間で引き起こされる急性作用に着目したものである。
【0055】
すなわち、本発明者は、鋭意研究を重ねた結果、例えば、いわゆる環境ホルモンとして既知の物質を、ホルモン受容体を有する細胞に接触させると、接触後ごく短時間のうちに、当該細胞において、当該ホルモン受容体に対するアゴニストと同様の電気生理学的応答を引き起こすが、細胞群をホルモン受容体に対するアンタゴニストと接触させた後に、当該環境ホルモンに接触させた場合には、当該アゴニストと同様の電気生理学的応答は引き起こされないこと、すなわち、当該アンタゴニストによってホルモン受容体を介したホルモン様の電気生理学的応答が阻害されること、を見出した。
【0056】
この本評価方法2は、この本発明者による独自の知見に基づき、対象物質が、ホルモン受容体を有する細胞に対して電気生理学的応答を起こすか否かを評価するとともに、当該電気生理学的応答がアンタゴニストによって阻害されるか否かを評価するものである。したがって、本評価方法2によれば、このような、アンタゴニストによって阻害される、ホルモン様の電気生理学的応答を引き起こす対象物質を内分泌撹乱物質である可能性の高い物質として特定することができる。
【0057】
具体的に、この本評価方法2は、電極が配置された細胞群に対して対象物質を接触させる対象物質接触工程と、電極が配置された細胞群に対してホルモン受容体に対するアンタゴニストを比較物質として接触させた後、さらに対象物質を接触させる比較物質接触工程と、当該細胞群について、対象物質を接触させる前後における電気生理学的応答を電極を介して測定する測定工程と、を含む。なお、本評価方法2においても、上記本評価方法1と同様に、第一細胞群と第二細胞群との2つの細胞群を用いる場合を例として説明する。
【0058】
この本評価方法2における対象物質接触工程においては、上記本評価方法1における対象物質接触工程と同様、電極が配置された第一細胞群に対して対象物質を接触させる。また、本評価方法2における比較物質接触工程においては、電極が配置された第二細胞群を、まずホルモン受容体に対するアンタゴニストを含む水溶液中に浸漬して当該第二細胞群に当該アンタゴニストを接触させた後、さらに当該第二細胞群を、対象物質を含む水溶液中に浸漬することによって当該第二細胞群に当該対象物質を接触させる。
【0059】
ここで、このアンタゴニストとしては、細胞群に含まれる細胞のうち少なくとも一部が有するホルモン受容体に対して結合するが、当該ホルモン受容体に対する本来のアゴニストが引き起こすホルモン作用は引き起こさない物質であれば好適に用いることができる。具体的に、例えば、エストロゲン受容体を有する細胞群を用いる場合には、市販されている17α−エストラジオール等のエストロゲンインヒビターを水溶液中に任意の濃度で溶解して用いることができる。
【0060】
また、この本評価方法2における測定工程においては、電極を配置した第一細胞群を、まず対象物質を含まない水溶液中に浸漬してその電気生理学的応答を測定し、次に当該第一細胞群を、対象物質を含む水溶液中に浸漬してその電気生理学的応答をさらに測定する。また、この測定工程においては、電極を配置した第二細胞群を、まずアンタゴニストを含む水溶液中に浸漬してその電気生理学的応答を測定し、次に当該第二細胞群を、対象物質を含む水溶液中に浸漬してその電気生理学的応答をさらに測定する。
【0061】
具体的に、例えば、細胞群として脳組織切片を用い、アンタゴニストとしてエストロゲンインヒビターを用いる場合には、この測定工程において、アンタゴニストと接触させることなく対象物質と接触させた第一脳組織切片における、当該対象物質との接触前後での細胞膜電位の変化が、アンタゴニストと接触させた後に対象物質と接触させた第二脳組織切片において測定されない場合には、当該対象物質はエストロゲン受容体を介して当該細胞膜電位の変化を引き起こす、すなわちエストロゲン受容体を介したホルモン様作用をもつ、内分泌撹乱物質である可能性が高いことが確認される。
【0062】
このように、本評価方法2によれば、対象物質による内分泌撹乱作用を電気生理学的応答として測定することができるため、対象物質について、その内分泌撹乱作用を極めて迅速且つ簡便に評価することができる。
【0063】
また、この本評価方法2は、上記対象物質接触工程と、比較物質接触工程と、測定工程と、に加え、上記本評価方法1と同様の刺激物質接触工程をさらに含むこととしてもよい。この場合、例えば、細胞群として脳組織切片を用い、アンタゴニストとしてエストロゲンインヒビターを用い、刺激物質としてNMDAを用い、電気生理学的応答として当該脳組織切片の興奮性シナプス後電位を測定する場合には、まず、第一脳組織切片について、エストロゲンインヒビターと接触させないときの興奮性シナプス後電位と、第二脳組織切片について、エストロゲンインヒビターと接触させたときの興奮性シナプス後電位と、を測定し、続いてこれら第一脳組織切片と第二脳組織切片とを対象物質と接触させたときの興奮性シナプス後電位を測定し、この後さらに、当該第一脳組織切片と第二脳組織切片とをNMDAに接触させて興奮性シナプス後電位を測定する。
【0064】
そして、測定工程において、対象物質と接触させた後にNMDAと接触させた第一脳組織切片における興奮性シナプス後電位の変化が、エストロゲンインヒビターと接触させた後に対象物質と接触させ、さらにその後にNMDAと接触させた第二脳組織切片において測定されない場合には、この対象物質は、エストロゲン受容体を介したホルモン様の興奮性シナプス後電位に変化をもたらす作用をもつ内分泌撹乱物質である可能性が高いことが確認される。
【0065】
このように、この刺激物質接触工程を含む本評価方法2においては、上記刺激物質接触工程を含む本評価方法1と同様、対象物質による内分泌撹乱作用を、細胞群全体としての電気生理学的応答として、簡便且つ確実に評価することができる。
【0066】
[実施例]
次に、上記本評価方法1について、具体的な実施の一例を説明する。まず、細胞群の準備及び実験条件の設定方法について説明する。細胞群としては、ビブラトーム(DSK ZERO1、堂阪イーエム株式会社製)を用いて成獣ラット脳組織から切り出した、海馬領域の長軸横断組織切片を用いた。この海馬組織切片の厚さは300μmとした。
【0067】
この海馬組織切片の電気生理学的応答の測定には、多電極測定装置MED64 System(メッド64システム、アルファメッド社)を用いた。そして、海馬組織切片に配置する電極としては、この多電極測定装置に付属の多電極プローブMED−P530A(アルファメッド社)を用いた。この多電極プローブの基板上には複数の電極が予め所定間隔(300μm)で規則的に配置されている。
【0068】
ビブラトームによって切り出した1枚の海馬組織切片を、1つの多電極プローブの基板上に設置した1つのチャンバー内に静置するとともに、当該チャンバー内に酸素と二酸化炭素との混合ガス(95%酸素ガス、5%二酸化炭素ガス)で十分に飽和させた人工脳脊髄液中を満たすことにより、当該海馬組織切片を当該人工脳脊髄液中に浸漬し、室温で1時間以上静置した。なお、この人工脳脊髄液としては、124mMのNaCl、1.25mMのNaH2PO4・2H2O、5mMのKCl、2mMのMgSO4・7H2O、2mMのCaCl2、22mMのNaHCO3、10mMのGlutaminを含む水溶液を用いた。
【0069】
そして、この人工脳脊髄液中において、海馬組織切片の表面付近の2つのアンモン角領域と、1つの歯状回と、の3つの領域に含まれる細胞が、多電極プローブ上の複数の電極と、それぞれ接触するように、当該多電極プローブ上に当該海馬組織切片を載置した。すなわち、アンモン角CA1野の錐体細胞と、アンモン角CA3野の錐体細胞と、歯状回の顆粒細胞と、のそれぞれについて、当該神経細胞群に投射するシナプス前線維に対して電気刺激を負荷する刺激電極と、当該神経細胞群において当該電気刺激によって誘発される興奮性シナプス後電位を集合電位として記録する記録電極と、を配置した。
【0070】
刺激電極による海馬組織切片への電気刺激は、アンモン角CA1野に配置した刺激電極、アンモン角CA3野に配置した刺激電極、歯状回に配置した刺激電極、そして再びアンモン角CA1野に配置した刺激電極、という順番で、15秒間隔で反復的に順次電気刺激を負荷することにより行った。そして、この電気刺激によって誘発される興奮性シナプス後電位を約30分間に亘って記録し、当該集合電位が安定したことを確認してから、以下の各工程において当該刺激電極から負荷する電気刺激の強度を設定した。すなわち、まず、海馬組織切片上の各部位(アンモン角CA1野、アンモン角CA3野、歯状回)に対して負荷する電気刺激の大きさを弱い強度から徐々に増加させつつ、集合電位を測定した。そして、測定される集合電位の大きさが飽和した(すなわち一定となった)時点で、当該飽和した集合電位の大きさを最大値(100%)とし、この最大値に対して50%の値になるように、刺激電極から当該海馬組織切片に負荷する電気刺激の強度を設定した。
【0071】
また、本実施例においては、対象物質としてDESを用い、ホルモン受容体に対するアゴニストとしてエストロゲンの一つであるエストラジオールを用い、刺激物質としてはNMDAを用いた。また、以下の工程において、海馬組織切片と、DES、エストラジオール、又はNMDAとの接触は、当該DES、エストラジオール、又はNMDAを含み、混合ガスで十分に飽和させた人工脳脊髄液を流速毎分約2mlでチャンバー内に灌流することにより行った。
【0072】
次に、本実施例における各工程について説明する。本実施例においては、同一の脳組織から取得した第一、第二、第三、第四海馬組織切片の4枚の海馬組織切片を用いた場合について説明する。これらの海馬組織切片のそれぞれに対して、上記多電極プローブの刺激電極と記録電極とを配置した。まず、電極を配置した各海馬組織切片に対して、DES、エストラジオール、NMDAのいずれも含まない人工脳脊髄液を灌流しながら、上記のように設定した電気刺激強度による電気刺激を反復的に負荷し、その興奮性シナプス後電位を20分間に亘って連続的に(経時的に)記録した(以下、この工程を予備工程と呼ぶ)。
【0073】
ここで、本実施例においては、興奮性シナプス後電位の測定結果を次のように評価した。すなわち、興奮性シナプス後電位は、例えば図1に示すように、横軸を時間(分)、縦軸を集合電位(mV)としたグラフとして記録されるが、上記予備工程における20分間の測定結果について、図1に破線の矢印で示す集合電位の波形の高さの絶対値(集合電位の大きさ)の平均値を算出し、当該平均値を100%として、後述の工程において測定される興奮性シナプス後電位の値が当該平均値の何%に相当するかを評価した。
【0074】
この予備工程に続いて、灌流液を、第一海馬組織切片については1nMのDESを含む人工脳脊髄液に、第二海馬組織切片については1nMのエストラジオールを含む人工脳脊髄液に、第三海馬組織切片については上記DESを人工脳脊髄液に溶解する際に溶媒として用いたエタノールを含む人工脳脊髄液に、第四海馬組織切片については上記エストラジオールを人工脳脊髄液に溶解する際に溶媒として用いたエタノールを含む人工脳脊髄液に、それぞれ交換し、電気刺激に対する興奮性シナプス後電位をさらに30分間測定し続けた。
【0075】
そして、この30分間に亘る興奮性シナプス後電位の測定に続いて、灌流液に対してさらにNMDAを添加することにより、各海馬組織切片において長期抑圧を誘発した。すなわち、灌流液を、第一海馬組織切片については30μMのNMDAと1nMのDESとを含む人工脳脊髄液に、第二海馬組織切片については30μMのNMDAと1nMのエストラジオールとを含む人工脳脊髄液に、第三及び第四海馬組織切片については30μMのNMDAとエタノールとを含む人工脳脊髄液に、それぞれ交換し、電気刺激に対する興奮性シナプス後電位をさらに3分間測定した。
【0076】
その後、灌流液を、再びNMDAを含まない水溶液、すなわち、第一海馬組織切片については1nMのDESを含む人工脳脊髄液に、第二海馬組織切片については1nMのエストラジオールを含む人工脳脊髄液に、第三及び第四海馬組織切片については上記エタノールを含む人工脳脊髄液に、それぞれ交換し、電気刺激に対する興奮性シナプス後電位をさらに60分間に亘って記録し続けた。上記各工程における灌流液の交換は、興奮性シナプス後電位を測定しつつ連続的に行った。
【0077】
図2及び図3に、本実施例における興奮性シナプス後電位の経時的変化を測定した結果を表す波形を示す。図2は、NMDAにより引き起こされる興奮性シナプス後電位の長期抑制の程度に対して、エストラジオールが与えた効果を示している。この図2において、横軸は時間(分)、縦軸は興奮性シナプス後電位(%)、をそれぞれ示し、グラフ上部に示す黒棒印はNMDAを灌流投与した時間帯を示し、グラフ上部に示す斜線棒印はエストラジオールを灌流投与した時間帯を示す。また、この図2において、黒丸印は第一の海馬組織切片をエストラジオールと接触させた場合の結果を、また白丸印は第三の海馬組織切片を用いた対照実験の結果を、それぞれ示している。図2Aはアンモン角CA1野についての測定結果、図2Bはアンモン角CA3野についての測定結果、図2Cは歯状回についての測定結果、をそれぞれ示している。
【0078】
図2Aに示すように、第三海馬組織切片のアンモン角CA1野を用いた対照実験(白丸印)において、時間0(ゼロ)の時点から3分間NMDA(30μM)を灌流投与(黒棒印時間帯)することで、当該第三海馬組織切片のアンモン角CA1野における興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して70%程度に減少した。
【0079】
一方、図2Aに示すように、NMDA投与前にエストラジオール(1nM)を30分間灌流投与(斜線棒印時間帯)した第一海馬組織切片のアンモン角CA1野(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して40%程度に減少した。
【0080】
また、図2Bに示すように、第三海馬組織切片のアンモン角CA3野を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して80%程度に減少した。
【0081】
一方、図2Bに示すように、NMDA投与前にエストラジオール(1nM)を30分間灌流投与(斜線棒印時間帯)した第一海馬組織切片のアンモン角CA3野(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して55%程度に減少した。
【0082】
また、図2Cに示すように、第三海馬組織切片の海馬歯状回を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して90%程度に減少した。
【0083】
一方、図2Cに示すように、NMDA投与前にエストラジオール(1nM)を30分間灌流投与(斜線棒印時間帯)した第一海馬組織切片の海馬歯状回(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより減少し、NMDA投与前における興奮性シナプス後電位に対して80%程度に減少した。
【0084】
図3は、NMDAにより引き起こされる興奮性シナプス後電位の長期抑制の程度に対して、DESが与えた効果を示している。この図3において、横軸、縦軸、グラフ上部に示す黒棒印及び斜線棒印は、それぞれ図2と同様であり、黒丸印は第二海馬組織切片についての結果を、また白丸印は、第四海馬組織切片を用いた対照実験についての結果を、それぞれ示している。図3Aはアンモン角CA1野についての測定結果、図3Bはアンモン角CA3野についての測定結果、図3Cは歯状回についての測定結果、をそれぞれ示している。
【0085】
図3Aに示すように、第四海馬組織切片のアンモン角CA1野を用いた対照実験(白丸印)において、時間0(ゼロ)の時点から3分間NMDA(30μM)を灌流投与(黒棒印時間帯)することで、当該第四海馬組織切片のアンモン角CA1野における興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して65%程度に減少した。
【0086】
一方、図3Aに示すように、NMDA投与前にDES(1nM)を30分間灌流投与(斜線棒印時間帯)した第二海馬組織切片のアンモン角CA1野(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して40%程度に減少した。
【0087】
また、図3Bに示すように、第四海馬組織切片のアンモン角CA3野を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して85%程度に減少した。
【0088】
一方、図3Bに示すように、NMDA投与前にDES(1nM)を30分間灌流投与(斜線棒印時間帯)した第二海馬組織切片(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより減少し、NMDA投与前における興奮性シナプス後電位に対して75%程度に減少した。
【0089】
また、図3Cに示すように、第四海馬組織切片の海馬歯状回を用いた対照実験(白丸印)においても、NMDA投与によって興奮性シナプス後電位反応の一過的減少が観察された。さらに、NMDA投与後50分の時点における興奮性シナプス後電位は、NMDA投与前における興奮性シナプス後電位に対して98%程度に減少した。
【0090】
一方、図3Cに示すように、NMDA投与前にDES(1nM)を30分間灌流投与(斜線棒印時間帯)した第二海馬組織切片の海馬歯状回(黒丸印)については、NMDA投与後50分の時点における興奮性シナプス後電位は、対照実験と比べてより大きく減少し、NMDA投与前における興奮性シナプス後電位に対して68%程度に減少した。
【図面の簡単な説明】
【0091】
【図1】本発明の一実施形態に係る内分泌撹乱作用の評価方法における興奮性シナプス後電位の測定結果の一例を示すグラフである。
【図2】本発明の一実施形態に係る内分泌撹乱作用の評価方法において、エストラジオールが興奮性シナプス後電位に与える影響を測定した結果の一例を示すグラフである。
【図3】本発明の一実施形態に係る内分泌撹乱作用の評価方法において、DESが興奮性シナプス後電位に与える影響を測定した結果の一例を示すグラフである。
【特許請求の範囲】
【請求項1】
対象物質の内分泌撹乱作用を評価する方法であって、
電極が配置された細胞群に対して、対象物質を接触させる工程と、
電極が配置された細胞群に対して、ホルモン受容体に対するアゴニストを比較物質として接触させる工程と、
前記細胞群について、前記対象物質を接触させる前後と、前記比較物質を接触させる前後と、における電気生理学的応答を、前記電極を介して測定する測定工程と、
を含むことを特徴とする内分泌撹乱作用の評価方法。
【請求項2】
対象物質の内分泌撹乱作用を評価する方法であって、
電極が配置された細胞群に対して、対象物質を接触させる工程と、
電極が配置された細胞群に対して、ホルモン受容体に対するアンタゴニストを比較物質として接触させた後、さらに対象物質を接触させる工程と、
前記細胞群について、前記対象物質を接触させる前後における電気生理学的応答を、前記電極を介して測定する測定工程と、
を含むことを特徴とする内分泌撹乱作用の評価方法。
【請求項3】
前記ホルモン受容体は、ステロイドホルモン受容体である、
ことを特徴とする請求項1又は2に記載の内分泌撹乱作用の評価方法。
【請求項4】
前記測定工程においては、前記細胞群の細胞膜電位変化に基づく電気生理学的応答を測定する、
ことを特徴とする請求項1乃至3のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項5】
前記細胞群は、神経細胞群である、
ことを特徴とする請求項1乃至4のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項6】
前記対象物質を接触させた細胞群及び前記比較物質を接触させた細胞群に対して、当該細胞群の電気生理学的応答に変化を起こさせる刺激物質を接触させる工程をさらに含み、
前記測定工程においては、前記細胞群について、前記刺激物質を接触させる前後における電気生理学的応答をさらに測定する、
ことを特徴とする請求項1乃至4のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項7】
前記細胞群は、神経細胞群であり、
前記刺激物質は、前記神経細胞群に対して長期抑制を起こさせる化学物質である、
ことを特徴とする請求項6に記載の内分泌撹乱作用の評価方法。
【請求項8】
前記神経細胞群は、脳組織切片に含まれる神経細胞群である、
ことを特徴とする請求項5又は7に記載の内分泌撹乱作用の評価方法。
【請求項9】
前記脳組織切片は、海馬領域に係る脳組織切片である、
ことを特徴とする請求項8に記載の内分泌撹乱作用の評価方法。
【請求項10】
前記測定工程においては、前記神経細胞群の興奮性シナプス後電位を測定する、
ことを特徴とする請求項5、7乃至9のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項1】
対象物質の内分泌撹乱作用を評価する方法であって、
電極が配置された細胞群に対して、対象物質を接触させる工程と、
電極が配置された細胞群に対して、ホルモン受容体に対するアゴニストを比較物質として接触させる工程と、
前記細胞群について、前記対象物質を接触させる前後と、前記比較物質を接触させる前後と、における電気生理学的応答を、前記電極を介して測定する測定工程と、
を含むことを特徴とする内分泌撹乱作用の評価方法。
【請求項2】
対象物質の内分泌撹乱作用を評価する方法であって、
電極が配置された細胞群に対して、対象物質を接触させる工程と、
電極が配置された細胞群に対して、ホルモン受容体に対するアンタゴニストを比較物質として接触させた後、さらに対象物質を接触させる工程と、
前記細胞群について、前記対象物質を接触させる前後における電気生理学的応答を、前記電極を介して測定する測定工程と、
を含むことを特徴とする内分泌撹乱作用の評価方法。
【請求項3】
前記ホルモン受容体は、ステロイドホルモン受容体である、
ことを特徴とする請求項1又は2に記載の内分泌撹乱作用の評価方法。
【請求項4】
前記測定工程においては、前記細胞群の細胞膜電位変化に基づく電気生理学的応答を測定する、
ことを特徴とする請求項1乃至3のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項5】
前記細胞群は、神経細胞群である、
ことを特徴とする請求項1乃至4のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項6】
前記対象物質を接触させた細胞群及び前記比較物質を接触させた細胞群に対して、当該細胞群の電気生理学的応答に変化を起こさせる刺激物質を接触させる工程をさらに含み、
前記測定工程においては、前記細胞群について、前記刺激物質を接触させる前後における電気生理学的応答をさらに測定する、
ことを特徴とする請求項1乃至4のいずれか一項に記載の内分泌撹乱作用の評価方法。
【請求項7】
前記細胞群は、神経細胞群であり、
前記刺激物質は、前記神経細胞群に対して長期抑制を起こさせる化学物質である、
ことを特徴とする請求項6に記載の内分泌撹乱作用の評価方法。
【請求項8】
前記神経細胞群は、脳組織切片に含まれる神経細胞群である、
ことを特徴とする請求項5又は7に記載の内分泌撹乱作用の評価方法。
【請求項9】
前記脳組織切片は、海馬領域に係る脳組織切片である、
ことを特徴とする請求項8に記載の内分泌撹乱作用の評価方法。
【請求項10】
前記測定工程においては、前記神経細胞群の興奮性シナプス後電位を測定する、
ことを特徴とする請求項5、7乃至9のいずれか一項に記載の内分泌撹乱作用の評価方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−119033(P2006−119033A)
【公開日】平成18年5月11日(2006.5.11)
【国際特許分類】
【出願番号】特願2004−308264(P2004−308264)
【出願日】平成16年10月22日(2004.10.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 2004年8月27日 掲載アドレス http://sfn.scholarone.com/itin2004/main.html?new_page_id=126&abstract_id=12186&p_num=757.23&is_tech=0
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成18年5月11日(2006.5.11)
【国際特許分類】
【出願日】平成16年10月22日(2004.10.22)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 掲載年月日 2004年8月27日 掲載アドレス http://sfn.scholarone.com/itin2004/main.html?new_page_id=126&abstract_id=12186&p_num=757.23&is_tech=0
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

