微量光イメージング装置、及び微量光イメージング方法
【課題】高効率な励起光照射が可能な微量光イメージング装置、及び微量光イメージング方法を提供する。
【解決手段】本発明に係る微量光イメージング装置100は、励起光源20と、励起光源20から出射された励起光を、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するスポット励起光照射部23と、微量光イメージング観察ターゲット及びその周辺に励起光を照射するように、スポット励起光照射部23を所望の位置に調整する位置調整手段(22、23)と、を具備する励起光照射ユニット2と、微量光イメージング観察ターゲットから発する微量光を、体外から検出する微量光検出装置(1)と,被験動物を載置、又は搭載する測定ユニット3を備えるものである。
【解決手段】本発明に係る微量光イメージング装置100は、励起光源20と、励起光源20から出射された励起光を、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するスポット励起光照射部23と、微量光イメージング観察ターゲット及びその周辺に励起光を照射するように、スポット励起光照射部23を所望の位置に調整する位置調整手段(22、23)と、を具備する励起光照射ユニット2と、微量光イメージング観察ターゲットから発する微量光を、体外から検出する微量光検出装置(1)と,被験動物を載置、又は搭載する測定ユニット3を備えるものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微量光イメージング装置、及び微量光イメージング方法に関する。
【背景技術】
【0002】
生体内情報を非侵襲的に得る方法として、蛍光イメージング技術が注目を集めている。特許文献1においては、光ファイバー先端を歯に近接させ、光ファイバーから励起光を照射して蛍光を検出することにより歯髄炎を診断する方法が開示されている。また、特許文献2には、光ファイバーを用いて、体内深部臓器に励起光を照射し、蛍光を内視鏡装置を用いて検出、若しくは観察者の眼によって直接観察する方法が記載されている。特許文献3には、内視鏡システムの一つとして、生体組織を励起させる特定波長帯域の光を内視鏡の先端から出射するとともに、この光によって励起された体腔内壁下の生体組織から発光された蛍光による像を撮像装置によって撮像する蛍光内視鏡システムが記載されている。
【0003】
ところで、昨今においては、目的とする臓器や組織などの病巣部に、薬物を効果的かつ集中的に送り込む技術として薬物送達システム(ドラックデリバリーシステム)が注目を集めている。この技術により、投与する薬物量や投与回数を軽減し、高効率な治療の実現を図ることができる。また、次世代型の薬物送達システムとして、病巣部を磁場環境下とし、製剤に含有する磁性微粒子の集積特性を利用して薬物を送達する方法が提案されている(特許文献4、5、非特許文献1)。しかしながら、ドラックデリバリーシステムの生体内機構については、未だ解明されていない点も多く存在する。蛍光イメージング技術により、生体内機構を解明することができれば、飛躍的な医療の進歩が期待できる。また、一般的な製剤においても、蛍光イメージングにより生体内での薬物の挙動を解明できれば、新薬開発に大きく貢献できる。
【0004】
これらを解明するための蛍光イメージング装置として、最近では、体外から励起光を照射し、体内に存在する蛍光物質に励起光を到達させ、その蛍光物質の発光を体外から超高感度カメラを用いて検出するシステムが実用化されている(非特許文献2)。すなわち、動物を置いた接地面(動物下面)から励起光を照射し、動物体壁を透過させてターゲット部位に励起光を到達させ、生じた蛍光をカメラで検出する手法が提案されている。動物を載置する動物載置台は、無数の穴があり、この穴に対応する本数のファイバー先端部が、動物載置台の下面側から上面側に突出し、励起光を照射する構造となっている。なお、非特許文献3においては、後述する。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−215572号公報
【特許文献2】特開2007−68896号公報
【特許文献3】特開2009−106766号公報 第22、23段落
【特許文献4】特開2009−242315号公報
【特許文献5】特許4183047号
【非特許文献】
【0006】
【非特許文献1】Namiki, Y. et al. Nature Nanotechnology, 2009, 4, 598 - 606
【非特許文献2】"超高感度 発光・蛍光 in vivo イメージングシステム"、[online]、住商ファーマインターナショナル株式会社、[平成23年1月18日検索]、インターネット〈URL:http://www.summitpharma.co.jp/japanese/service/products/xenogen/〉
【非特許文献3】Weissleder R. Nat Biotechnol. 2001 Apr;19(4):316-7.
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記非特許文献2の方法は、簡便性の点、生体における負荷の観点において優れている。しかしながら、上記非特許文献2の方法によれば、励起光照射位置の自由度が高いとはいえなかった。また、より高効率な励起光照射方法が提供できれば、生体に対する励起光照射の影響を抑制しつつ、より高度な知見が得られることが期待できる。
【0008】
本発明は、上記問題点に鑑みてなされたものであり、その目的とするところは、高効率な励起光照射が可能な微量光イメージング装置、及び微量光イメージング方法を提供することである。
【課題を解決するための手段】
【0009】
本発明に係る微量光イメージング装置は、励起光源と、前記励起光源から出射された励起光を、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するスポット励起光照射部と、前記微量光イメージング観察ターゲット及びその周辺に前記励起光を照射するように、前記スポット励起光照射部を所望の位置に調整する位置調整手段と、を具備する励起光照射ユニットと、前記微量光イメージング観察ターゲットから発する微量光を、体外から検出する発光検出装置と,被験動物を載置、又は搭載する測定ユニットと、を備えるものである。
【0010】
本発明に係る微量光イメージング装置によれば、励起光照射をスポット状の光とし、かつ、前記スポット励起光照射部を所望の位置に調整する位置調整手段を具備しているので、体内の微量光イメージング観察ターゲット及びその周辺に効率よく励起光照射を行うことができる。このため、励起光の照射強度を低減させることができる。また、照射領域を微量光イメージング観察ターゲット及びその周辺に限定することができるという優れた効果がある。
【0011】
本発明に係る微量光イメージング方法は、スポット励起光照射部を介して、微量光イメージング観察ターゲット及びその周辺に限定して励起光をスポット照射し、前記励起光照射によって発生した光を、体外から検出するものである。
【発明の効果】
【0012】
本発明によれば、高効率な励起光照射が可能な微量光イメージング装置、及び微量光イメージング方法を提供することができるという優れた効果を有する。
【図面の簡単な説明】
【0013】
【図1】第1実施形態に係る微量光イメージング装置の模式的説明図。
【図2】第1実施形態に係る微量光イメージング方法の模式的説明図。
【図3】第2実施形態に係る微量光イメージング装置の光ファイバーの模式的断面図。
【図4】第3実施形態に係る微量光イメージング装置の模式的説明図。
【図5】第4実施形態に係る微量光イメージング装置の模式的説明図。
【図6】第5実施形態に係る微量光イメージング装置の模式的説明図。
【図7】第6実施形態に係る微量光イメージング装置の模式的説明図。
【図8】第7実施形態に係る微量光イメージング装置の模式的説明図。
【図9】第8実施形態に係る微量光イメージング装置の模式的説明図。
【発明を実施するための形態】
【0014】
本発明に係る微量光イメージング装置は、生体内の微量光イメージング観察ターゲット及びその周辺に励起光を照射し、微量光イメージング観察ターゲット及びその周辺への励起光照射によって誘起された放射過程の物理現象の少なくとも1つを体外からイメージングするものである。放射過程の物理現象とは、蛍光を含めた広義の発光のみならず、熱放射(赤外線)を含むものである。本願発明において「微量光イメージング」とは、微量光イメージング観察ターゲット及びその周辺に励起光を照射することによって誘起された物理現象を検出するものであり、例えば、微量光イメージング観察ターゲット及びその周辺の励起状態から基底状態に戻るときに放出する発光、熱放射等の放射過程の物理現象の少なくとも1つをイメージングすることを云う。なお、自らが光を吸収して得たエネルギーを他の物質に渡すことで、反応や発光のプロセスを助ける役割を果たすものでもよく、イメージング検出対象が励起光照射によって直接的に励起された物質でなくてもよい。
【0015】
以下、本発明を適用した実施形態の一例について説明する。なお、本発明の趣旨に合致する限り、他の実施形態も本発明の範疇に属し得ることは言うまでもない。また、以降の図における各部材のサイズや比率は、説明の便宜上のものであり、実際のものとは異なる。
【0016】
[第1実施形態]
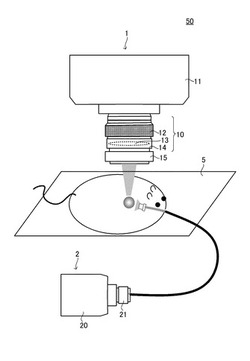
図1に、本発明に係る微量光イメージング装置50の模式的説明図を示す。微量光イメージング装置50は、微量光検出装置である超高感度カメラ1と励起光照射ユニット2と測定ユニット5を有する。測定ユニット5は、被験動物を載置、若しくは搭載するユニットであり、ステージ状としたり、収容可能な筒体としたりすることができる。
【0017】
超高感度カメラ1は、レンズ本体10、カメラ本体11、回動ユニット(リング部)であるフォーカスリング12、調整ユニットであるフォーカスレンズ13、ズームレンズ(不図示)、絞り(不図示)、レンズを収容するレンズ鏡筒14、フィルタリング15等を備えている。第1実施形態に係るレンズ本体10は、カメラ本体11に対して着脱自在に構成されている。なお、レンズ本体10がカメラ本体11と一体的に形成されているものであってもよい。
【0018】
超高感度カメラ1は、生体内から発生する発光・蛍光・赤外線(熱)等の微量光を体外から検出可能なカメラであり、リアルタイムのイメージングが可能なビデオ機能も備えている。従って、リアルタイムの生体内現象の動画撮影が可能である。超高感度カメラ1は、フォーカス用の遠隔調整装置(不図示)を着脱自在に具備していてもよい。
【0019】
超高感度カメラ1は、生体内から発生する蛍光の像を結像する撮影光学系を備えている。また、超高感度カメラ1は、撮影光学系により結像された被写体像を電気信号に変換するEM−CCD、CCD等の撮像素子や、撮像素子により得られた信号から所定形式の映像信号を生成する回路等を具備する。超高感度カメラ1で生成された映像信号は、所定のコネクタに接続されて外部機器に送出され、映像の記録や編集などが可能なように構成されている。また、超高感度カメラ1は、カメラ本体の設定状況等を表示するモニタ(不図示)なども備えている。
【0020】
フォーカスリング12は、フォーカスレンズ13のフォーカスを調整する機能を有し、光軸(図1参照)を中心に回転可能なように支持されている。フォーカスリング12の回動に伴ってフォーカスレンズ13を固設収容したレンズ鏡筒14が光軸方向に往復動するようになっている。これにより、フォーカスレンズ13と被写体(不図示)間の距離が調整される。フォーカスリング12の回転量に基づいてフォーカスレンズ13を光軸方向に往復動させてピントを合わせる。
【0021】
フィルタリング15は、フォーカスレンズ13よりも被写体側に設けられている。フィルタリング15は、名称の如く、特定の波長の光をカットするフィルタリングとして機能するカットオフフィルタが収容されている。
【0022】
励起光照射ユニット2は、励起光源20、高分解能励起フィルタ21、光ファイバー22、スポット励起光照射部23等を備えている。
【0023】
励起光源20は、励起光を光ファイバー22に出射する。励起光源20は、例えば、半導体レーザー、LED、キセノンランプ、ハロゲンランプである。高分解能励起フィルタ21は、励起光源20から光ファイバー22に入射する励起光の波長を、目的に応じて選択する役割を担っている。バンドパスフィルタを組み合わせることにより、目的の励起波長を選択することができるようになっている。減光フィルタ、絞りを装着し、光量を調整可能な機能を付与してもよい。
【0024】
励起光源20から出射した励起光は、高分解能励起フィルタ21を通過することにより、波長領域の異なる複数の帯域に分離される。そして、目的の蛍光物質を励起可能な光を選定し、光ファイバー22を介してスポット励起光照射部23から微量光イメージング観察ターゲット及びその周辺に照射される。スポット励起光照射部23は、光ファイバー22の先端部に設けられている。なお、「光ファイバー22の先端部」とは、励起光照射ユニット2の最先端部に限定されるものではなく、最先端部に別の機能素子などが設けられていてもよい。
【0025】
光ファイバー22は、励起光を伝送する役割を担う。光ファイバー22及び励起光照射部23は、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するように、励起光照射部23を所望の位置に設置するための位置調整手段として機能する。光ファイバー22は、生体内深部に挿入しやすいようにフレキシブル性に優れ、かつ生体内への挿入をよりスムーズに行うために細径のものを用いる。例えば、直径0.3mm〜5mm程度のものを用いる。光ファイバー22は、不要な光漏れを防ぐために、アルミなどの金属材料、若しくは黒色樹脂などで被覆されている。黒色樹脂や金属材料などの筒状のチューブ内部に光ファイバー22を挿入するようにしてもよい。
【0026】
励起波長は、特に限定されるものではないが、体内に存在する目的の標識物質を励起した際に発光する蛍光が、体表を通過して超高感度カメラ1により撮像することができる波長の光とする必要がある。具体的には、発光する蛍光の波長は、生体組織の透過可能な400nm以上とする。より好ましくは生体組織の透過性が高い700nm以上である。近赤外領域なども好適に適用することができる。また、多波長の励起光を照射してもよい。励起波長は、通常は、10nm以上、2500nm以下である。より好ましくは、紫外線による細胞障害防止の観点から380nm以上、赤外線(体温)による影響の排除の観点から1200nm以下である。特に好ましくは、光の吸収・散乱・自家蛍光による影響の排除の観点から700nm以上、900nm以下(生体の窓領域(非特許文献3参照))である。以降の説明においては、微量光として蛍光を例にとり説明する。
【0027】
図2に、第1実施形態に係る微量光イメージング方法を説明するための説明図を示す。まず、微量光イメージングを行いたい対象を標識する。生体内に蛍光発生物質が存在する場合には、蛍光イメージング試薬による標識は不要である。適用可能な発光成分、発光分子、または発光構築物は、用途に応じて種々のものを利用することができる。蛍光イメージング試薬としては、例えば、米国PerkinElmer社製のin vivo・in vitro 近赤外蛍光イメージング試薬であるProSense、ProSense Control、MMPSense(登録商標)、ReninSense(登録商標)、Neutrophil Elastase(登録商標)などを用いることができる。なお、蛍光イメージング試薬は、酵素を使って発光物質を酸化させるなどの化学反応によって光を発する物質も含むものとする。また、微量光イメージングは、蛍光に限定されず、他の発光にも適用可能である。
【0028】
標識個所は、標的組織、標的細胞、標的たんぱく質等が挙げられる。また、蛍光標識した製剤(蛍光標識-製剤)を用意し、経口、点眼、点鼻、舌下、経肛門、経膣、静脈注射、(髄腔・胸腔・腹腔など)体腔内注射、動脈内注射、皮下注射、筋肉注射、腫瘍内局所注射等によって体内に投与して、微量光イメージングを行いたい領域での挙動を追跡してもよい。
【0029】
蛍光標識後、微量光イメージングを行いたい領域に励起光が照射可能な位置まで、スポット励起光照射部23と光ファイバー22を被験動物4の経口(経食道・経気管支)から挿入する。生体内への挿入部は、経口に代えて、経静脈、経動脈、経体腔、経肛門、経膣等でもよい。また、外科的処置によって、発光標識部近傍を開口して光ファイバーを挿入してもよい。
【0030】
光ファイバー22及びスポット励起光照射部23を生体内に挿入後、励起光源20から出射された励起光を、光ファイバー22を介してスポット励起光照射部23から所望の領域に照射する。そして、励起光照射に伴って発する蛍光を、超高感度カメラ1により被験動物4の体外の超感度カメラ1から検出する。
【0031】
なお、被験動物4は、例えば、ヒト、サル、ウシ、ヒツジ、ヤギ、ウマ、ブタ、ウサギ、イヌ、ネコ、マウス、ラット、モルモット等、哺乳動物、および鳥類・は虫類・両生類・魚類、昆虫、節足動物、環形動物など全ての動物を挙げることができるが、これに限定されるものではない。また、励起光を照射する体内臓器としては、実質臓器(例えば、脳、目、甲状腺、乳腺、心臓、肺、肝臓、膵臓、腎臓、副腎、卵巣、精巣等)、管腔臓器(例えば、食道、胃、十二指腸、空腸、回腸、大腸、胆嚢、尿管、膀胱内等)、脳脊髄腔、胸腔、腹腔、筋肉、関節等、特に限定されない。上記各臓器の全体を照射してもよいし、一部を照射してもよい。また、複数の臓器に亘って照射することも可能である。
【0032】
第1実施形態に係る微量光イメージング装置50によれば、生体内における発光物質のダイナミズムを非浸襲的に観察することができる。例えば、微量光の変化を追跡することによって励起光照射領域の薬剤の濃度分布を知ることができる。また、薬剤の生体内の取り込み量や取り込み機構の知見を得ることができる。また、癌に集積する薬物を経時的にモニタリングすることができる。あるいは、再生医療研究などで移植した細胞がどのように増殖していくかを追跡することができる。このため、生体内機構の解明、ドラックデリバリーシステムをはじめとする各種薬剤の薬物動態の知見を得るなどの用途に特に好適に用いることができる。
【0033】
上記特許文献2,3の内視鏡を介して蛍光の画像形成を行う方法によれば、観察範囲が限定されるという問題がある。一方、第1実施形態に係る微量光イメージング装置50によれば、励起光の照射領域を適宜設計可能であり、観察範囲を内視鏡の観察可能領域よりも広く設定することも可能となる。すなわち、内視鏡の観察領域よりも広い領域に、生体内部から励起光を照射し、内視鏡の観察領域よりも広い領域の蛍光物質集積挙動を検出することが可能となる。また、検出領域が内視鏡により検出可能な領域の場合においても、内視鏡の場合には位置ずれが生じる恐れがあるが、本発明によれば位置ずれの問題なく確実に検出できるというメリットがある。
【0034】
また、第1実施形態に係る微量光イメージング装置によれば、励起光照射を体内で行い、かつ、微量光イメージング観察ターゲット及びその周辺に近づけて励起光を照射しているので、体内の微量光イメージング観察ターゲット及びその周辺に効率よく励起光を照射することができる。すなわち、体外照射では、反射・吸収などによる励起光の減衰により、蛍光物質の励起が不十分である問題があるが、第1実施形態によれば、励起光の減衰を大幅に抑制することができる。その結果、体外照射では、励起光が十分到達しないため、検出できなかった体内深部に集積した微量の蛍光物質も検出できるという特長がある。このため、励起光を体外から照射する場合に比して、照射強度を低減させることができる。
【0035】
また、照射領域を微量光イメージング観察ターゲット及びその周辺に限定することができるという優れた効果がある。その結果、生体に投与する蛍光物質量を最小限にすることが可能になり、生体破壊作用のある紫外線などであっても短時間・領域限定的な照射が可能になる。また、生体負荷を軽減することができる。さらに、第1実施形態に係る微量光イメージング装置によれば、高効率な励起光照射によって、シングル/ノイズ(S/N)比を改善することができるという優れた効果がある。
【0036】
[第2実施形態]
次に、第1実施形態とは異なる微量光イメージング装置について説明する。第2実施形態に係る微量光イメージング装置は、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第2実施形態に係る微量光イメージング装置は、異なる波長を伝送可能な複数の光ファイバーを備えている点、1本の光ファイバーよりなる第1実施形態とは相違する。
【0037】
図3に、第2実施形態に係る光ファイバーの模式的な切断部断面図を示す。第2実施形態に係る微量光イメージング装置は、3本の光ファイバー22aを有する。3本の光ファイバー22aは、被覆層24によって一体的になっている。
【0038】
3本の光ファイバー22aは、それぞれ所望のタイミングで、かつ、所望の波長の励起光を照射可能なようになっている。それぞれの光ファイバー22aにおいて、多重波長を照射するようにしてもよい。なお、光ファイバーの本数は一例であって、2本、若しくは4本以上であってもよい。
【0039】
第2実施形態によれば、上記第1実施形態と同様の効果を得ることができる。また、複数の光ファイバーを設けているので、より複雑な励起照射プログラムを設定することが可能となる。これにより、従来では困難であった複数の生体内機構を互いに相関を取りつつ解明していくことが期待できる。しかも、励起光を体内の微量光イメージング観察ターゲット及びその周辺近傍に限定しているので、複数の励起光を照射しても、生体に対するダメージを抑制することができる。
【0040】
[第3実施形態]
第3実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第3実施形態に係る微量光イメージング装置は、励起光照射ユニット2の最先端部に磁石を備えている点において第1実施形態とは相違する。
【0041】
図4に、第3実施形態に係る微量光イメージング装置の模式的説明図を示す。第3実施形態に係る微量光イメージング装置50bは、励起光照射ユニット2bの最先端部に磁気照射部25を有する。
【0042】
磁気照射部25は、磁石、シールド手段、ケーシング等を備える。シールド手段は、磁力遮蔽部材により構成する。これにより、磁石の磁力線に指向性を付与させることが可能となる。なお、磁力発生手段としては、磁石を有していればよく、磁石に指向性を付与する必要がない場合には、シールド手段を具備していなくてもよい。また、ケーシングは、磁石を収容して密封可能な形態であればよい。
【0043】
磁石は、その種類や形状は特に限定されない。例えば、電磁石、超電導磁石、永久磁石を用いることができる。磁気照射装置の小型化や、密封性を容易に確保する観点からは、永久磁石を用いることが好ましい。永久磁石の種類は、特に限定されるものではないが、一例として、フェライト、Ne−Fe−B合金、サマリウム−コバルト合金を挙げることができる。強力な磁力を要する場合には、Ne−Fe−B合金が好ましい。磁石の形状は、ケーシング内に収容して密封可能であれば特にその形状を問わない。
【0044】
シールド手段は、前述したように、磁石の磁界発生方向に指向性を付与するためのシールド機能を有する。第3実施形態に係るシールド手段は、ヨーク(継鉄)により構成した。無論、シールド機能を有する材料であればこれに限定されるものではない。第3実施形態においては、一方向に強い磁力が発生するように、シールド手段であるヨークは、磁石30の側面及び底面を被覆するような凹部形状の円筒体からなる。シールド手段を設けることにより、磁石の上面からの磁力を増強する。
【0045】
ケーシングは、生体適合性があり、かつ生分解性を示さない材料により構成される。これらを満足する材料であれば、特に限定されないが、一例として、生体適合性を有するTi、チタンバナジウム合金(例えば、Tiに6%のアルミニウム、4%のバナジウムを添加したもの)、チタンニオブ合金(例えば、Tiに6%のアルミニウム、7%のニオブを添加したもの)、チタンジルコニウム合金などTi系材料を挙げることができる。また、アルミナ、窒化ケイ素、炭化ケイ素、ジルコニア等のセラミックを挙げることもできる。さらに、金属表面を高温で熱することによってセラミックに変換したオキシニウムや、超高分子量ポリエチレン(分子量150万以上、(より好ましくは450万以上))などを挙げることができる。
【0046】
第3実施形態に係る微量光イメージング装置50bの微量光イメージング方法について説明する。まず、蛍光標識磁性製剤を用意し、蛍光標識磁性製剤を被験動物に静脈注射等により投与する。そして、微量光イメージング観察ターゲット及びその周辺に磁気照射を行う。この際、若しくは所定の時間経過後に、微量光イメージング観察ターゲット及びその周辺に光ファイバーを介して励起光を照射し、微量光を超高感度カメラにより被験動物の体外から検出する。これにより、製剤に含有する磁性微粒子の集積特性を利用して薬物を送達するドラックデリバリーシステムの分野等の集積機構等の知見を得ることが期待できる。この際、癌細胞などに他の蛍光標識をしておくことにより、蛍光標識磁性製剤と癌細胞の経時的な相互関係等の知見を得ることも期待できる。
【0047】
第3実施形態によれば、上記第1実施形態と同様の効果を得ることができる。また、第3実施形態に係る磁気照射部25は、生体適合性を示し、かつ生分解性を示さない材料により構成されているので、生体に挿入する際に悪影響を及ぼさずに、かつ、微量光イメージング装置の使用と連動して使用することができる。無論、磁気照射の機能・励起光照射の機能のみを単独で用いてもよい。さらに、第3実施形態によれば、磁気照射部25を光ファイバー22の先端部に取り付けることにより、装置の小型化を実現することができるというメリットも有する。
【0048】
[第4実施形態]
第4実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第4実施形態に係る微量光イメージング装置は、励起光照射ユニット2の最先端部に蛍光イメージング試薬放出ユニットを備えている点において第1実施形態とは相違する。
【0049】
図5に、第4実施形態に係る微量光イメージング装置の模式的説明図を示す。第4実施形態に係る微量光イメージング装置50cは、励起光照射ユニット2cの最先端部に薬剤放出部26を有する。薬剤放出部26は、例えば、蛍光イメージング試薬放出部である。
【0050】
第4実施形態に係る微量光イメージング装置50cによる微量光イメージングは、まず、微量光イメージング装置50cの光ファイバー22等を生体内に挿入する。次いで、薬剤放出部26から蛍光イメージング試薬を放出させる。放出と同時、若しくは、放出から所定時間経過後に励起光を照射して、蛍光イメージング試薬の経時的挙動を超高感度カメラ1から検出する。
【0051】
第4実施形態によれば、上記第1実施形態と同様の効果を得ることができる。また、第4実施形態に係る薬剤放出部26は、微量光イメージング装置の使用と連動して使用することができる。無論、薬剤放出機能のみを単独で用いてもよい。さらに、薬剤放出部26を光ファイバー22の先端部に取り付けることにより、装置の小型化を実現することができるというメリットもある。なお、第4実施形態においては、薬剤放出部から放出する薬剤を蛍光イメージング試薬とする例について述べたが、予め蛍光イメージング試薬を投与して、非蛍光薬剤等を薬剤放出部から放出したりタンパク質等の生理活性物質などを放出したりしてもよい。
【0052】
[第5実施形態]
第5実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第5実施形態に係る微量光イメージング装置は、励起光照射ユニット2の先端部近傍にセンサを備えている点において第1実施形態とは相違する。
【0053】
図6に、第5実施形態に係る微量光イメージング装置の模式的説明図を示す。第5実施形態に係る微量光イメージング装置50dは、励起光照射ユニット2dの最先端部にセンサ27を有する。センサ27は、光ファイバー22の先端部近傍の外周領域に設けられている。なお、センサ27の位置は、特に限定されるものではなく、第4実施形態のように薬剤放出部26の位置に設けたりしてもよい。
【0054】
センサ27の種類は、特に限定されないが、一例として、磁気センサ、プラズモンセンサ、放射能センサ等を挙げることができる。例えば、センサ27が磁気センサである場合、上記第3実施形態で用いた蛍光標識磁性製剤等の標識磁性粒子を検出し、所望の濃度以上に集積した部位に、励起光を選択的に照射するようにすることができる。また、センサ27がプラズモンセンサである場合、貴金属ナノ粒子等を検出し、所望の濃度以上に集積した部位に、励起光を選択的に照射するようにすることができる。また、センサ27が、放射能センサである場合、アイソトープ含有ナノ粒子を検出し、所望の濃度に集積した部位に、励起光を選択的に照射するようにすることができる。
【0055】
第5実施形態に係る微量光イメージング装置50dの微量光イメージングは、まず、必要に応じて、生体内を蛍光標識する。次いで、微量光イメージング装置50dの光ファイバー22の一部、及びスポット励起光照射部23を生体内に挿入する。その後、センサ27によって対象のセンシングを行う。そして、対象が所望の濃度以上となったときに、励起光を照射して、蛍光イメージング試薬の経時的挙動をバイオ用超高感度カメラ1から検出する。なお、濃度とは独立に励起光照射を行なってもよいし、これらのモードが選択可能なように構成されていてもよい。
【0056】
第5実施形態によれば、上記第1実施形態と同様の効果を得ることができる。しかも、センサ27によって、センシングする対象が所望の量以上が検出されている個所に励起光を照射するモードを搭載することにより、より高効率に励起光を照射することが可能となる。無論、センサ機能のみを単独で用いてもよい。さらに、第5実施形態によれば、センサ27を光ファイバー22の先端部に取り付けることにより、装置の小型化を実現することができるというメリットも有する。
【0057】
[第6実施形態]
第6実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第6実施形態に係る微量光イメージング装置は、円筒状の測定ユニットを備えている点において相違する。
【0058】
図7に、第6実施形態に係る微量光イメージング装置の模式的説明図を示す。第6実施形態に係る微量光イメージング装置50eは、励起光照射ユニット2e、超高感度カメラ1、測定ユニット3等を備えている。
【0059】
微量光イメージング装置50eの励起光照射ユニット2eは、励起光照射部(不図示)、励起光源20、光伝達中継部28、第1光ファイバー31、第2光ファイバー32を有する。第1光ファイバー31と第2光ファイバー32は、光伝達中継部28を介して連結されている。第1光ファイバー31及び励起光照射部(不図示)の一端部が生体内部まで挿入され、生体内に留置可能なようになっている。第1光ファイバー31他端部は、光伝達中継部28に接続されている。また、第2光ファイバー32の一端部が光伝達中継部28に、他端部が励起光源20に接続されている。なお、第1光ファイバー31と第2光ファイバー32が光伝達中継部28を介して連結されている例を示したが、複数の光伝達中継部と3つ以上の光ファイバーを用いてもよい。
【0060】
測定ユニット3は、被験動物4を収容可能な円筒体よりなる。測定ユニット3内において被験動物4の位置が固定可能なように、測定ユニット3には位置固定手段が設けられている。測定ユニット3内に搭載された被験動物4から発せられた蛍光が超高感度カメラ1に検出されるように、測定ユニット3には、開口部が設けられている。すなわち、生体内で発した蛍光は、測定ユニット3の開口部から超高感度カメラ1に検出される。なお、測定ユニット3にこのような開口部等を設けず、測定ユニット3自体を蛍光透過材料から構成してもよい。
【0061】
測定ユニット3は、円筒の中心軸に対して回転するように構成されている。無論、他の軸を中心に回転するモードや、両モードを併用してもよい。測定ユニット3の回転に伴って、第1光ファイバー31が稔れないように、測定ユニット3と第1光ファイバー31の一部が固定されている。これにより、測定ユニット3の回転に伴って、第1光ファイバー31も回転し、第1光ファイバー31が測定ユニット3の回動によって、稔れないようになっている。光伝達中継部28は、第1光ファイバー31の回転を第2光ファイバー32に伝えず、かつ、励起光源20からの励起光を第2光ファイバー32から第1光ファイバー31に伝達する機能を担っている。
【0062】
第6実施形態に係る微量光イメージング装置50eの微量光イメージングは、まず、微量光イメージング装置50eの第1光ファイバー31、スポット励起光照射部(不図示)を生体内に挿入する。次いで、蛍光標識がなされた被験動物4を測定ユニット3内に搭載する。そして、励起光を励起光源20から第2光ファイバー32、光伝送中継部28、第1光ファイバー31、スポット励起光照射部23を介して生体内の所望の位置に照射して、蛍光イメージング試薬の経時的挙動等を超高感度カメラ1から検出する。なお、スポット励起光照射部23が1つである例を説明したが、被験動物の大きさなどに応じて、スポット励起光照射部23を複数有するようにしてもよい。
【0063】
第6実施形態によれば、上記第1実施形態と同様の効果を得ることができる。しかも、測定ユニット3によって、所望の方向から撮像することができるというメリットがある。
【0064】
[第7実施形態]
第7実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第6実施形態と同様である。すなわち、第7実施形態に係る微量光イメージング装置は、被験動物内に光ファイバーを挿入せず、体外から励起光を照射する点において相違する。
【0065】
図8に、第7実施形態に係る微量光イメージング装置の模式的説明図を示す。第7実施形態に係る微量光イメージング装置50fは、励起光照射ユニット2f、超高感度カメラ1、測定ユニット3等を備えている。
【0066】
スポット励起光照射部23は、測定ユニット3の外周近傍に配置されている。光ファイバー22fのスポット励起光照射部23とは反対の端部は、励起光源20に接続されている。スポット励起光照射部23及び光ファイバー22fは、XYZθステージ(不図示)によって、自在に位置制御が可能なようになっている。すなわち、X方向、Y方向、Z方向、θ方向に移動自在に構成されている。励起光照射ユニット2f自体をXYZθステージにより移動自在に構成してもよい。XYZθステージと測定ユニット3は、微量光イメージング観察ターゲット及びその周辺に励起光を照射するように、スポット励起光照射部23を所望の位置とする位置調整手段としての役割も担う。なお、XYZθステージに代えて、スポット励起光照射部23の移動が自在であれば、他の手段を適用してもよい。
【0067】
第7実施形態においては、生体外である測定ユニット3の外周部近傍に設置された光ファイバー22f、スポット励起光照射部23から出射した励起光を生体に照射する。そして、生体内で発した蛍光を体外に設置された超高感度カメラ1から検出する。すなわち、生体内で発した蛍光が測定ユニット3を介して超高感度カメラ1に検出される。なお、測定ユニット3を蛍光透過材料で構成せず、開口部等を設けてもよい。
【0068】
第7実施形態に係る微量光イメージング装置50fの微量光イメージングは、まず、必要に応じて被験動物4に蛍光標識を施し、次いで、被験動物4を測定ユニット3内に搭載して固定する。被験動物4を測定ユニット3内に搭載した後に蛍光標識してもよい。そして、励起光を励起光源20から光ファイバー22f、スポット励起光照射部23、測定ユニット3を介して生体内の所望の位置に照射する。そして、生体内に標識された蛍光を体外に設置された超高感度カメラ1から検出する。
【0069】
第7実施形態によれば、スポット励起光照射部23により、領域限定的な照射が可能になるので生体負荷を軽減することができる。しかも、光ファイバー22fをXYZθ方向に移動自在にし、かつ測定ユニット3により回転可能とすることにより、所望の位置に光ファイバー22fを移動させ、所望の位置に対してピンポイント的に励起光を照射することが可能となる。すなわち、上記非特許文献2のように下面に限定されず、光ファイバー22fの先端を自由に移動し、目的部位に集中的に強力な励起光をスポット照射することが可能である。また、上記非特許文献2の方法に比して照射ユニットの小型化を実現することができるので、装置全体の小型化を図ることが可能であるというメリットもある。
【0070】
なお、反射光を最小限にする観点からは、ファイバー先端を動物になるべく近接させ、光の漏れを防ぐのが有効である。さらにその目的で、励起光と超高感度カメラの光軸の中間に被験動物を位置させることが好ましい。そのため、照射部位、照射方向は限定されないが、被験動物の下側面より励起光を照射し、励起光照射により発する蛍光を被験動物の上側から検出するのが好ましい。また、光ファイバー先端を動物になるべく近接させる観点からは、動物体表にファイバー先端を押し当て圧迫(密着)する方法も有効である。また、圧迫によりファイバー先端を体内深部の照射を目的とする部位に近づけてもよい。
【0071】
[第8実施形態]
第8実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第7実施形態と同様である。すなわち、第8実施形態に係る微量光イメージング装置は、測定ステージ状の測定ユニット5を具備している点において相違する。
【0072】
図9に、第8実施形態に係る微量光イメージング装置の模式的説明図を示す。第8実施形態に係る微量光イメージング装置50gは、励起光照射ユニット2g、超高感度カメラ1、測定ユニット5等を備えている。
【0073】
スポット励起光照射部23は、測定ユニット3の外側の近接位置に先端部が配置されている。光ファイバー22gのスポット励起光照射部23とは反対の端部は、励起光源20に接続されている。スポット励起光照射部23及び光ファイバー22gは、XYZθステージ(不図示)によって、移動自在になっている。なお、XYZθステージに代えて、スポット励起光照射部23と光ファイバー22の移動が自在であれば、他の手段を適用してもよい。
【0074】
測定ユニット5は、被験動物4を搭載し、かつ被験動物4の位置を固定可能なステージである。第8実施形態においては、測定ユニット5は、移動自在なものではなく、定位置に固定されたものである。これにより、測定ユニット5の構造を簡便にすることができる。その結果、例えば、動物保温用のヒーター等の他の機能を容易に組み込むことができる。無論、測定ユニット5の位置を移動自在とし、光ファイバー22gを固定してもよい。また、測定ユニット5と光ファイバー22gの両者を移動自在にしてもよい。
【0075】
生体外である測定ユニット5の外周部近傍に設置されたスポット励起光照射部23から発した励起光を、測定ユニット5を介して被験動物4に照射し、被験動物4の生体内で発した蛍光を体外に設置された超高感度カメラ1から検出する。
【0076】
第8実施形態に係る微量光イメージング装置50gの微量光イメージングは、まず、被験動物に蛍光標識を施し、次いで、被験動物4を測定ユニット5内に搭載する。そして、励起光を励起光源20から光ファイバー22g、スポット励起光照射部23、測定ユニット5を介して被験動物4の生体内の所望の位置に照射する。そして、生体内に標識された蛍光を体外に設置された超高感度カメラ1から検出する。
【0077】
第8実施形態によれば、領域限定的な照射が可能になるので生体負荷を軽減することができる。しかも、光ファイバー22gとスポット励起光照射部23をXYZθ方向に移動自在にすることにより、所望の位置に光ファイバー22gを移動させ、ピンポイント的に励起光を照射することが可能となる。しかも、上記非特許文献2の方法に比して励起光照射ユニットの小型化を実現することができるので、装置全体の小型化を図ることができるというメリットもある。
【0078】
なお、上記実施形態は一例であって、本発明の趣旨を逸脱しない範囲で種々の変形が可能である。また、上記第1実施形態〜第8実施形態は、好適に組み合わせて用いることができる。また、微量光イメージング装置は、他の公知の機能を備えていてもよい。例えば、可視帯域の照明光を出射することによって体腔内を照明するモードを備えていてもよい。また、励起光モードと照明モードとを切り替え可能にしてもよい。また、上記実施形態においては、スポット励起光照射部は、光ファイバーに接続されている例を説明したが、スポット励起光を照射可能であればよく、光ファイバーを用いなくてもよい。また、上記実施形態においては、微量光検出対象が蛍光である例を挙げたが、他の発光、熱(赤外線)等の微量光であってもよい。また、スポット励起光照射部が1つである例を説明したが、被験動物の大きさなどに応じて、スポット励起光照射部を複数有するようにしてもよい。また、生体情報を多角的に得る観点から、CTなどのX線照射装置、MRI等の機能を備えたりしてもよい。また、上記実施形態においては、微量光検出装置として超高感度カメラの例を挙げたが、フォトンカウンター等を用いてもよい。
【産業上の利用可能性】
【0079】
本発明の微量光イメージング装置は、生体内の微量光の挙動を追跡することにより、生体内事象を検出することができる。従って、医学的現象の解明や、薬物動態の解明等に有用である。
【符号の説明】
【0080】
1 超高感度カメラ
2 励起光照射ユニット
3、5 測定ユニット
4 被験動物
10 レンズ本体
11 カメラ本体
12 フォーカスリング
13 フォーカスレンズ
14 レンズ鏡筒
15 フィルタリング
20 励起光源
21 高分解能励起フィルタ
22 光ファイバー
23 スポット励起光照射部
24 被覆部
25 磁気照射部
26 薬剤放出部
27 センサ
28 光伝送中継部
31 第1光ファイバー
32 第2光ファイバー
50 微量光イメージング装置
【技術分野】
【0001】
本発明は、微量光イメージング装置、及び微量光イメージング方法に関する。
【背景技術】
【0002】
生体内情報を非侵襲的に得る方法として、蛍光イメージング技術が注目を集めている。特許文献1においては、光ファイバー先端を歯に近接させ、光ファイバーから励起光を照射して蛍光を検出することにより歯髄炎を診断する方法が開示されている。また、特許文献2には、光ファイバーを用いて、体内深部臓器に励起光を照射し、蛍光を内視鏡装置を用いて検出、若しくは観察者の眼によって直接観察する方法が記載されている。特許文献3には、内視鏡システムの一つとして、生体組織を励起させる特定波長帯域の光を内視鏡の先端から出射するとともに、この光によって励起された体腔内壁下の生体組織から発光された蛍光による像を撮像装置によって撮像する蛍光内視鏡システムが記載されている。
【0003】
ところで、昨今においては、目的とする臓器や組織などの病巣部に、薬物を効果的かつ集中的に送り込む技術として薬物送達システム(ドラックデリバリーシステム)が注目を集めている。この技術により、投与する薬物量や投与回数を軽減し、高効率な治療の実現を図ることができる。また、次世代型の薬物送達システムとして、病巣部を磁場環境下とし、製剤に含有する磁性微粒子の集積特性を利用して薬物を送達する方法が提案されている(特許文献4、5、非特許文献1)。しかしながら、ドラックデリバリーシステムの生体内機構については、未だ解明されていない点も多く存在する。蛍光イメージング技術により、生体内機構を解明することができれば、飛躍的な医療の進歩が期待できる。また、一般的な製剤においても、蛍光イメージングにより生体内での薬物の挙動を解明できれば、新薬開発に大きく貢献できる。
【0004】
これらを解明するための蛍光イメージング装置として、最近では、体外から励起光を照射し、体内に存在する蛍光物質に励起光を到達させ、その蛍光物質の発光を体外から超高感度カメラを用いて検出するシステムが実用化されている(非特許文献2)。すなわち、動物を置いた接地面(動物下面)から励起光を照射し、動物体壁を透過させてターゲット部位に励起光を到達させ、生じた蛍光をカメラで検出する手法が提案されている。動物を載置する動物載置台は、無数の穴があり、この穴に対応する本数のファイバー先端部が、動物載置台の下面側から上面側に突出し、励起光を照射する構造となっている。なお、非特許文献3においては、後述する。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−215572号公報
【特許文献2】特開2007−68896号公報
【特許文献3】特開2009−106766号公報 第22、23段落
【特許文献4】特開2009−242315号公報
【特許文献5】特許4183047号
【非特許文献】
【0006】
【非特許文献1】Namiki, Y. et al. Nature Nanotechnology, 2009, 4, 598 - 606
【非特許文献2】"超高感度 発光・蛍光 in vivo イメージングシステム"、[online]、住商ファーマインターナショナル株式会社、[平成23年1月18日検索]、インターネット〈URL:http://www.summitpharma.co.jp/japanese/service/products/xenogen/〉
【非特許文献3】Weissleder R. Nat Biotechnol. 2001 Apr;19(4):316-7.
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記非特許文献2の方法は、簡便性の点、生体における負荷の観点において優れている。しかしながら、上記非特許文献2の方法によれば、励起光照射位置の自由度が高いとはいえなかった。また、より高効率な励起光照射方法が提供できれば、生体に対する励起光照射の影響を抑制しつつ、より高度な知見が得られることが期待できる。
【0008】
本発明は、上記問題点に鑑みてなされたものであり、その目的とするところは、高効率な励起光照射が可能な微量光イメージング装置、及び微量光イメージング方法を提供することである。
【課題を解決するための手段】
【0009】
本発明に係る微量光イメージング装置は、励起光源と、前記励起光源から出射された励起光を、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するスポット励起光照射部と、前記微量光イメージング観察ターゲット及びその周辺に前記励起光を照射するように、前記スポット励起光照射部を所望の位置に調整する位置調整手段と、を具備する励起光照射ユニットと、前記微量光イメージング観察ターゲットから発する微量光を、体外から検出する発光検出装置と,被験動物を載置、又は搭載する測定ユニットと、を備えるものである。
【0010】
本発明に係る微量光イメージング装置によれば、励起光照射をスポット状の光とし、かつ、前記スポット励起光照射部を所望の位置に調整する位置調整手段を具備しているので、体内の微量光イメージング観察ターゲット及びその周辺に効率よく励起光照射を行うことができる。このため、励起光の照射強度を低減させることができる。また、照射領域を微量光イメージング観察ターゲット及びその周辺に限定することができるという優れた効果がある。
【0011】
本発明に係る微量光イメージング方法は、スポット励起光照射部を介して、微量光イメージング観察ターゲット及びその周辺に限定して励起光をスポット照射し、前記励起光照射によって発生した光を、体外から検出するものである。
【発明の効果】
【0012】
本発明によれば、高効率な励起光照射が可能な微量光イメージング装置、及び微量光イメージング方法を提供することができるという優れた効果を有する。
【図面の簡単な説明】
【0013】
【図1】第1実施形態に係る微量光イメージング装置の模式的説明図。
【図2】第1実施形態に係る微量光イメージング方法の模式的説明図。
【図3】第2実施形態に係る微量光イメージング装置の光ファイバーの模式的断面図。
【図4】第3実施形態に係る微量光イメージング装置の模式的説明図。
【図5】第4実施形態に係る微量光イメージング装置の模式的説明図。
【図6】第5実施形態に係る微量光イメージング装置の模式的説明図。
【図7】第6実施形態に係る微量光イメージング装置の模式的説明図。
【図8】第7実施形態に係る微量光イメージング装置の模式的説明図。
【図9】第8実施形態に係る微量光イメージング装置の模式的説明図。
【発明を実施するための形態】
【0014】
本発明に係る微量光イメージング装置は、生体内の微量光イメージング観察ターゲット及びその周辺に励起光を照射し、微量光イメージング観察ターゲット及びその周辺への励起光照射によって誘起された放射過程の物理現象の少なくとも1つを体外からイメージングするものである。放射過程の物理現象とは、蛍光を含めた広義の発光のみならず、熱放射(赤外線)を含むものである。本願発明において「微量光イメージング」とは、微量光イメージング観察ターゲット及びその周辺に励起光を照射することによって誘起された物理現象を検出するものであり、例えば、微量光イメージング観察ターゲット及びその周辺の励起状態から基底状態に戻るときに放出する発光、熱放射等の放射過程の物理現象の少なくとも1つをイメージングすることを云う。なお、自らが光を吸収して得たエネルギーを他の物質に渡すことで、反応や発光のプロセスを助ける役割を果たすものでもよく、イメージング検出対象が励起光照射によって直接的に励起された物質でなくてもよい。
【0015】
以下、本発明を適用した実施形態の一例について説明する。なお、本発明の趣旨に合致する限り、他の実施形態も本発明の範疇に属し得ることは言うまでもない。また、以降の図における各部材のサイズや比率は、説明の便宜上のものであり、実際のものとは異なる。
【0016】
[第1実施形態]
図1に、本発明に係る微量光イメージング装置50の模式的説明図を示す。微量光イメージング装置50は、微量光検出装置である超高感度カメラ1と励起光照射ユニット2と測定ユニット5を有する。測定ユニット5は、被験動物を載置、若しくは搭載するユニットであり、ステージ状としたり、収容可能な筒体としたりすることができる。
【0017】
超高感度カメラ1は、レンズ本体10、カメラ本体11、回動ユニット(リング部)であるフォーカスリング12、調整ユニットであるフォーカスレンズ13、ズームレンズ(不図示)、絞り(不図示)、レンズを収容するレンズ鏡筒14、フィルタリング15等を備えている。第1実施形態に係るレンズ本体10は、カメラ本体11に対して着脱自在に構成されている。なお、レンズ本体10がカメラ本体11と一体的に形成されているものであってもよい。
【0018】
超高感度カメラ1は、生体内から発生する発光・蛍光・赤外線(熱)等の微量光を体外から検出可能なカメラであり、リアルタイムのイメージングが可能なビデオ機能も備えている。従って、リアルタイムの生体内現象の動画撮影が可能である。超高感度カメラ1は、フォーカス用の遠隔調整装置(不図示)を着脱自在に具備していてもよい。
【0019】
超高感度カメラ1は、生体内から発生する蛍光の像を結像する撮影光学系を備えている。また、超高感度カメラ1は、撮影光学系により結像された被写体像を電気信号に変換するEM−CCD、CCD等の撮像素子や、撮像素子により得られた信号から所定形式の映像信号を生成する回路等を具備する。超高感度カメラ1で生成された映像信号は、所定のコネクタに接続されて外部機器に送出され、映像の記録や編集などが可能なように構成されている。また、超高感度カメラ1は、カメラ本体の設定状況等を表示するモニタ(不図示)なども備えている。
【0020】
フォーカスリング12は、フォーカスレンズ13のフォーカスを調整する機能を有し、光軸(図1参照)を中心に回転可能なように支持されている。フォーカスリング12の回動に伴ってフォーカスレンズ13を固設収容したレンズ鏡筒14が光軸方向に往復動するようになっている。これにより、フォーカスレンズ13と被写体(不図示)間の距離が調整される。フォーカスリング12の回転量に基づいてフォーカスレンズ13を光軸方向に往復動させてピントを合わせる。
【0021】
フィルタリング15は、フォーカスレンズ13よりも被写体側に設けられている。フィルタリング15は、名称の如く、特定の波長の光をカットするフィルタリングとして機能するカットオフフィルタが収容されている。
【0022】
励起光照射ユニット2は、励起光源20、高分解能励起フィルタ21、光ファイバー22、スポット励起光照射部23等を備えている。
【0023】
励起光源20は、励起光を光ファイバー22に出射する。励起光源20は、例えば、半導体レーザー、LED、キセノンランプ、ハロゲンランプである。高分解能励起フィルタ21は、励起光源20から光ファイバー22に入射する励起光の波長を、目的に応じて選択する役割を担っている。バンドパスフィルタを組み合わせることにより、目的の励起波長を選択することができるようになっている。減光フィルタ、絞りを装着し、光量を調整可能な機能を付与してもよい。
【0024】
励起光源20から出射した励起光は、高分解能励起フィルタ21を通過することにより、波長領域の異なる複数の帯域に分離される。そして、目的の蛍光物質を励起可能な光を選定し、光ファイバー22を介してスポット励起光照射部23から微量光イメージング観察ターゲット及びその周辺に照射される。スポット励起光照射部23は、光ファイバー22の先端部に設けられている。なお、「光ファイバー22の先端部」とは、励起光照射ユニット2の最先端部に限定されるものではなく、最先端部に別の機能素子などが設けられていてもよい。
【0025】
光ファイバー22は、励起光を伝送する役割を担う。光ファイバー22及び励起光照射部23は、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するように、励起光照射部23を所望の位置に設置するための位置調整手段として機能する。光ファイバー22は、生体内深部に挿入しやすいようにフレキシブル性に優れ、かつ生体内への挿入をよりスムーズに行うために細径のものを用いる。例えば、直径0.3mm〜5mm程度のものを用いる。光ファイバー22は、不要な光漏れを防ぐために、アルミなどの金属材料、若しくは黒色樹脂などで被覆されている。黒色樹脂や金属材料などの筒状のチューブ内部に光ファイバー22を挿入するようにしてもよい。
【0026】
励起波長は、特に限定されるものではないが、体内に存在する目的の標識物質を励起した際に発光する蛍光が、体表を通過して超高感度カメラ1により撮像することができる波長の光とする必要がある。具体的には、発光する蛍光の波長は、生体組織の透過可能な400nm以上とする。より好ましくは生体組織の透過性が高い700nm以上である。近赤外領域なども好適に適用することができる。また、多波長の励起光を照射してもよい。励起波長は、通常は、10nm以上、2500nm以下である。より好ましくは、紫外線による細胞障害防止の観点から380nm以上、赤外線(体温)による影響の排除の観点から1200nm以下である。特に好ましくは、光の吸収・散乱・自家蛍光による影響の排除の観点から700nm以上、900nm以下(生体の窓領域(非特許文献3参照))である。以降の説明においては、微量光として蛍光を例にとり説明する。
【0027】
図2に、第1実施形態に係る微量光イメージング方法を説明するための説明図を示す。まず、微量光イメージングを行いたい対象を標識する。生体内に蛍光発生物質が存在する場合には、蛍光イメージング試薬による標識は不要である。適用可能な発光成分、発光分子、または発光構築物は、用途に応じて種々のものを利用することができる。蛍光イメージング試薬としては、例えば、米国PerkinElmer社製のin vivo・in vitro 近赤外蛍光イメージング試薬であるProSense、ProSense Control、MMPSense(登録商標)、ReninSense(登録商標)、Neutrophil Elastase(登録商標)などを用いることができる。なお、蛍光イメージング試薬は、酵素を使って発光物質を酸化させるなどの化学反応によって光を発する物質も含むものとする。また、微量光イメージングは、蛍光に限定されず、他の発光にも適用可能である。
【0028】
標識個所は、標的組織、標的細胞、標的たんぱく質等が挙げられる。また、蛍光標識した製剤(蛍光標識-製剤)を用意し、経口、点眼、点鼻、舌下、経肛門、経膣、静脈注射、(髄腔・胸腔・腹腔など)体腔内注射、動脈内注射、皮下注射、筋肉注射、腫瘍内局所注射等によって体内に投与して、微量光イメージングを行いたい領域での挙動を追跡してもよい。
【0029】
蛍光標識後、微量光イメージングを行いたい領域に励起光が照射可能な位置まで、スポット励起光照射部23と光ファイバー22を被験動物4の経口(経食道・経気管支)から挿入する。生体内への挿入部は、経口に代えて、経静脈、経動脈、経体腔、経肛門、経膣等でもよい。また、外科的処置によって、発光標識部近傍を開口して光ファイバーを挿入してもよい。
【0030】
光ファイバー22及びスポット励起光照射部23を生体内に挿入後、励起光源20から出射された励起光を、光ファイバー22を介してスポット励起光照射部23から所望の領域に照射する。そして、励起光照射に伴って発する蛍光を、超高感度カメラ1により被験動物4の体外の超感度カメラ1から検出する。
【0031】
なお、被験動物4は、例えば、ヒト、サル、ウシ、ヒツジ、ヤギ、ウマ、ブタ、ウサギ、イヌ、ネコ、マウス、ラット、モルモット等、哺乳動物、および鳥類・は虫類・両生類・魚類、昆虫、節足動物、環形動物など全ての動物を挙げることができるが、これに限定されるものではない。また、励起光を照射する体内臓器としては、実質臓器(例えば、脳、目、甲状腺、乳腺、心臓、肺、肝臓、膵臓、腎臓、副腎、卵巣、精巣等)、管腔臓器(例えば、食道、胃、十二指腸、空腸、回腸、大腸、胆嚢、尿管、膀胱内等)、脳脊髄腔、胸腔、腹腔、筋肉、関節等、特に限定されない。上記各臓器の全体を照射してもよいし、一部を照射してもよい。また、複数の臓器に亘って照射することも可能である。
【0032】
第1実施形態に係る微量光イメージング装置50によれば、生体内における発光物質のダイナミズムを非浸襲的に観察することができる。例えば、微量光の変化を追跡することによって励起光照射領域の薬剤の濃度分布を知ることができる。また、薬剤の生体内の取り込み量や取り込み機構の知見を得ることができる。また、癌に集積する薬物を経時的にモニタリングすることができる。あるいは、再生医療研究などで移植した細胞がどのように増殖していくかを追跡することができる。このため、生体内機構の解明、ドラックデリバリーシステムをはじめとする各種薬剤の薬物動態の知見を得るなどの用途に特に好適に用いることができる。
【0033】
上記特許文献2,3の内視鏡を介して蛍光の画像形成を行う方法によれば、観察範囲が限定されるという問題がある。一方、第1実施形態に係る微量光イメージング装置50によれば、励起光の照射領域を適宜設計可能であり、観察範囲を内視鏡の観察可能領域よりも広く設定することも可能となる。すなわち、内視鏡の観察領域よりも広い領域に、生体内部から励起光を照射し、内視鏡の観察領域よりも広い領域の蛍光物質集積挙動を検出することが可能となる。また、検出領域が内視鏡により検出可能な領域の場合においても、内視鏡の場合には位置ずれが生じる恐れがあるが、本発明によれば位置ずれの問題なく確実に検出できるというメリットがある。
【0034】
また、第1実施形態に係る微量光イメージング装置によれば、励起光照射を体内で行い、かつ、微量光イメージング観察ターゲット及びその周辺に近づけて励起光を照射しているので、体内の微量光イメージング観察ターゲット及びその周辺に効率よく励起光を照射することができる。すなわち、体外照射では、反射・吸収などによる励起光の減衰により、蛍光物質の励起が不十分である問題があるが、第1実施形態によれば、励起光の減衰を大幅に抑制することができる。その結果、体外照射では、励起光が十分到達しないため、検出できなかった体内深部に集積した微量の蛍光物質も検出できるという特長がある。このため、励起光を体外から照射する場合に比して、照射強度を低減させることができる。
【0035】
また、照射領域を微量光イメージング観察ターゲット及びその周辺に限定することができるという優れた効果がある。その結果、生体に投与する蛍光物質量を最小限にすることが可能になり、生体破壊作用のある紫外線などであっても短時間・領域限定的な照射が可能になる。また、生体負荷を軽減することができる。さらに、第1実施形態に係る微量光イメージング装置によれば、高効率な励起光照射によって、シングル/ノイズ(S/N)比を改善することができるという優れた効果がある。
【0036】
[第2実施形態]
次に、第1実施形態とは異なる微量光イメージング装置について説明する。第2実施形態に係る微量光イメージング装置は、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第2実施形態に係る微量光イメージング装置は、異なる波長を伝送可能な複数の光ファイバーを備えている点、1本の光ファイバーよりなる第1実施形態とは相違する。
【0037】
図3に、第2実施形態に係る光ファイバーの模式的な切断部断面図を示す。第2実施形態に係る微量光イメージング装置は、3本の光ファイバー22aを有する。3本の光ファイバー22aは、被覆層24によって一体的になっている。
【0038】
3本の光ファイバー22aは、それぞれ所望のタイミングで、かつ、所望の波長の励起光を照射可能なようになっている。それぞれの光ファイバー22aにおいて、多重波長を照射するようにしてもよい。なお、光ファイバーの本数は一例であって、2本、若しくは4本以上であってもよい。
【0039】
第2実施形態によれば、上記第1実施形態と同様の効果を得ることができる。また、複数の光ファイバーを設けているので、より複雑な励起照射プログラムを設定することが可能となる。これにより、従来では困難であった複数の生体内機構を互いに相関を取りつつ解明していくことが期待できる。しかも、励起光を体内の微量光イメージング観察ターゲット及びその周辺近傍に限定しているので、複数の励起光を照射しても、生体に対するダメージを抑制することができる。
【0040】
[第3実施形態]
第3実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第3実施形態に係る微量光イメージング装置は、励起光照射ユニット2の最先端部に磁石を備えている点において第1実施形態とは相違する。
【0041】
図4に、第3実施形態に係る微量光イメージング装置の模式的説明図を示す。第3実施形態に係る微量光イメージング装置50bは、励起光照射ユニット2bの最先端部に磁気照射部25を有する。
【0042】
磁気照射部25は、磁石、シールド手段、ケーシング等を備える。シールド手段は、磁力遮蔽部材により構成する。これにより、磁石の磁力線に指向性を付与させることが可能となる。なお、磁力発生手段としては、磁石を有していればよく、磁石に指向性を付与する必要がない場合には、シールド手段を具備していなくてもよい。また、ケーシングは、磁石を収容して密封可能な形態であればよい。
【0043】
磁石は、その種類や形状は特に限定されない。例えば、電磁石、超電導磁石、永久磁石を用いることができる。磁気照射装置の小型化や、密封性を容易に確保する観点からは、永久磁石を用いることが好ましい。永久磁石の種類は、特に限定されるものではないが、一例として、フェライト、Ne−Fe−B合金、サマリウム−コバルト合金を挙げることができる。強力な磁力を要する場合には、Ne−Fe−B合金が好ましい。磁石の形状は、ケーシング内に収容して密封可能であれば特にその形状を問わない。
【0044】
シールド手段は、前述したように、磁石の磁界発生方向に指向性を付与するためのシールド機能を有する。第3実施形態に係るシールド手段は、ヨーク(継鉄)により構成した。無論、シールド機能を有する材料であればこれに限定されるものではない。第3実施形態においては、一方向に強い磁力が発生するように、シールド手段であるヨークは、磁石30の側面及び底面を被覆するような凹部形状の円筒体からなる。シールド手段を設けることにより、磁石の上面からの磁力を増強する。
【0045】
ケーシングは、生体適合性があり、かつ生分解性を示さない材料により構成される。これらを満足する材料であれば、特に限定されないが、一例として、生体適合性を有するTi、チタンバナジウム合金(例えば、Tiに6%のアルミニウム、4%のバナジウムを添加したもの)、チタンニオブ合金(例えば、Tiに6%のアルミニウム、7%のニオブを添加したもの)、チタンジルコニウム合金などTi系材料を挙げることができる。また、アルミナ、窒化ケイ素、炭化ケイ素、ジルコニア等のセラミックを挙げることもできる。さらに、金属表面を高温で熱することによってセラミックに変換したオキシニウムや、超高分子量ポリエチレン(分子量150万以上、(より好ましくは450万以上))などを挙げることができる。
【0046】
第3実施形態に係る微量光イメージング装置50bの微量光イメージング方法について説明する。まず、蛍光標識磁性製剤を用意し、蛍光標識磁性製剤を被験動物に静脈注射等により投与する。そして、微量光イメージング観察ターゲット及びその周辺に磁気照射を行う。この際、若しくは所定の時間経過後に、微量光イメージング観察ターゲット及びその周辺に光ファイバーを介して励起光を照射し、微量光を超高感度カメラにより被験動物の体外から検出する。これにより、製剤に含有する磁性微粒子の集積特性を利用して薬物を送達するドラックデリバリーシステムの分野等の集積機構等の知見を得ることが期待できる。この際、癌細胞などに他の蛍光標識をしておくことにより、蛍光標識磁性製剤と癌細胞の経時的な相互関係等の知見を得ることも期待できる。
【0047】
第3実施形態によれば、上記第1実施形態と同様の効果を得ることができる。また、第3実施形態に係る磁気照射部25は、生体適合性を示し、かつ生分解性を示さない材料により構成されているので、生体に挿入する際に悪影響を及ぼさずに、かつ、微量光イメージング装置の使用と連動して使用することができる。無論、磁気照射の機能・励起光照射の機能のみを単独で用いてもよい。さらに、第3実施形態によれば、磁気照射部25を光ファイバー22の先端部に取り付けることにより、装置の小型化を実現することができるというメリットも有する。
【0048】
[第4実施形態]
第4実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第4実施形態に係る微量光イメージング装置は、励起光照射ユニット2の最先端部に蛍光イメージング試薬放出ユニットを備えている点において第1実施形態とは相違する。
【0049】
図5に、第4実施形態に係る微量光イメージング装置の模式的説明図を示す。第4実施形態に係る微量光イメージング装置50cは、励起光照射ユニット2cの最先端部に薬剤放出部26を有する。薬剤放出部26は、例えば、蛍光イメージング試薬放出部である。
【0050】
第4実施形態に係る微量光イメージング装置50cによる微量光イメージングは、まず、微量光イメージング装置50cの光ファイバー22等を生体内に挿入する。次いで、薬剤放出部26から蛍光イメージング試薬を放出させる。放出と同時、若しくは、放出から所定時間経過後に励起光を照射して、蛍光イメージング試薬の経時的挙動を超高感度カメラ1から検出する。
【0051】
第4実施形態によれば、上記第1実施形態と同様の効果を得ることができる。また、第4実施形態に係る薬剤放出部26は、微量光イメージング装置の使用と連動して使用することができる。無論、薬剤放出機能のみを単独で用いてもよい。さらに、薬剤放出部26を光ファイバー22の先端部に取り付けることにより、装置の小型化を実現することができるというメリットもある。なお、第4実施形態においては、薬剤放出部から放出する薬剤を蛍光イメージング試薬とする例について述べたが、予め蛍光イメージング試薬を投与して、非蛍光薬剤等を薬剤放出部から放出したりタンパク質等の生理活性物質などを放出したりしてもよい。
【0052】
[第5実施形態]
第5実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第5実施形態に係る微量光イメージング装置は、励起光照射ユニット2の先端部近傍にセンサを備えている点において第1実施形態とは相違する。
【0053】
図6に、第5実施形態に係る微量光イメージング装置の模式的説明図を示す。第5実施形態に係る微量光イメージング装置50dは、励起光照射ユニット2dの最先端部にセンサ27を有する。センサ27は、光ファイバー22の先端部近傍の外周領域に設けられている。なお、センサ27の位置は、特に限定されるものではなく、第4実施形態のように薬剤放出部26の位置に設けたりしてもよい。
【0054】
センサ27の種類は、特に限定されないが、一例として、磁気センサ、プラズモンセンサ、放射能センサ等を挙げることができる。例えば、センサ27が磁気センサである場合、上記第3実施形態で用いた蛍光標識磁性製剤等の標識磁性粒子を検出し、所望の濃度以上に集積した部位に、励起光を選択的に照射するようにすることができる。また、センサ27がプラズモンセンサである場合、貴金属ナノ粒子等を検出し、所望の濃度以上に集積した部位に、励起光を選択的に照射するようにすることができる。また、センサ27が、放射能センサである場合、アイソトープ含有ナノ粒子を検出し、所望の濃度に集積した部位に、励起光を選択的に照射するようにすることができる。
【0055】
第5実施形態に係る微量光イメージング装置50dの微量光イメージングは、まず、必要に応じて、生体内を蛍光標識する。次いで、微量光イメージング装置50dの光ファイバー22の一部、及びスポット励起光照射部23を生体内に挿入する。その後、センサ27によって対象のセンシングを行う。そして、対象が所望の濃度以上となったときに、励起光を照射して、蛍光イメージング試薬の経時的挙動をバイオ用超高感度カメラ1から検出する。なお、濃度とは独立に励起光照射を行なってもよいし、これらのモードが選択可能なように構成されていてもよい。
【0056】
第5実施形態によれば、上記第1実施形態と同様の効果を得ることができる。しかも、センサ27によって、センシングする対象が所望の量以上が検出されている個所に励起光を照射するモードを搭載することにより、より高効率に励起光を照射することが可能となる。無論、センサ機能のみを単独で用いてもよい。さらに、第5実施形態によれば、センサ27を光ファイバー22の先端部に取り付けることにより、装置の小型化を実現することができるというメリットも有する。
【0057】
[第6実施形態]
第6実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第1実施形態と同様である。すなわち、第6実施形態に係る微量光イメージング装置は、円筒状の測定ユニットを備えている点において相違する。
【0058】
図7に、第6実施形態に係る微量光イメージング装置の模式的説明図を示す。第6実施形態に係る微量光イメージング装置50eは、励起光照射ユニット2e、超高感度カメラ1、測定ユニット3等を備えている。
【0059】
微量光イメージング装置50eの励起光照射ユニット2eは、励起光照射部(不図示)、励起光源20、光伝達中継部28、第1光ファイバー31、第2光ファイバー32を有する。第1光ファイバー31と第2光ファイバー32は、光伝達中継部28を介して連結されている。第1光ファイバー31及び励起光照射部(不図示)の一端部が生体内部まで挿入され、生体内に留置可能なようになっている。第1光ファイバー31他端部は、光伝達中継部28に接続されている。また、第2光ファイバー32の一端部が光伝達中継部28に、他端部が励起光源20に接続されている。なお、第1光ファイバー31と第2光ファイバー32が光伝達中継部28を介して連結されている例を示したが、複数の光伝達中継部と3つ以上の光ファイバーを用いてもよい。
【0060】
測定ユニット3は、被験動物4を収容可能な円筒体よりなる。測定ユニット3内において被験動物4の位置が固定可能なように、測定ユニット3には位置固定手段が設けられている。測定ユニット3内に搭載された被験動物4から発せられた蛍光が超高感度カメラ1に検出されるように、測定ユニット3には、開口部が設けられている。すなわち、生体内で発した蛍光は、測定ユニット3の開口部から超高感度カメラ1に検出される。なお、測定ユニット3にこのような開口部等を設けず、測定ユニット3自体を蛍光透過材料から構成してもよい。
【0061】
測定ユニット3は、円筒の中心軸に対して回転するように構成されている。無論、他の軸を中心に回転するモードや、両モードを併用してもよい。測定ユニット3の回転に伴って、第1光ファイバー31が稔れないように、測定ユニット3と第1光ファイバー31の一部が固定されている。これにより、測定ユニット3の回転に伴って、第1光ファイバー31も回転し、第1光ファイバー31が測定ユニット3の回動によって、稔れないようになっている。光伝達中継部28は、第1光ファイバー31の回転を第2光ファイバー32に伝えず、かつ、励起光源20からの励起光を第2光ファイバー32から第1光ファイバー31に伝達する機能を担っている。
【0062】
第6実施形態に係る微量光イメージング装置50eの微量光イメージングは、まず、微量光イメージング装置50eの第1光ファイバー31、スポット励起光照射部(不図示)を生体内に挿入する。次いで、蛍光標識がなされた被験動物4を測定ユニット3内に搭載する。そして、励起光を励起光源20から第2光ファイバー32、光伝送中継部28、第1光ファイバー31、スポット励起光照射部23を介して生体内の所望の位置に照射して、蛍光イメージング試薬の経時的挙動等を超高感度カメラ1から検出する。なお、スポット励起光照射部23が1つである例を説明したが、被験動物の大きさなどに応じて、スポット励起光照射部23を複数有するようにしてもよい。
【0063】
第6実施形態によれば、上記第1実施形態と同様の効果を得ることができる。しかも、測定ユニット3によって、所望の方向から撮像することができるというメリットがある。
【0064】
[第7実施形態]
第7実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第6実施形態と同様である。すなわち、第7実施形態に係る微量光イメージング装置は、被験動物内に光ファイバーを挿入せず、体外から励起光を照射する点において相違する。
【0065】
図8に、第7実施形態に係る微量光イメージング装置の模式的説明図を示す。第7実施形態に係る微量光イメージング装置50fは、励起光照射ユニット2f、超高感度カメラ1、測定ユニット3等を備えている。
【0066】
スポット励起光照射部23は、測定ユニット3の外周近傍に配置されている。光ファイバー22fのスポット励起光照射部23とは反対の端部は、励起光源20に接続されている。スポット励起光照射部23及び光ファイバー22fは、XYZθステージ(不図示)によって、自在に位置制御が可能なようになっている。すなわち、X方向、Y方向、Z方向、θ方向に移動自在に構成されている。励起光照射ユニット2f自体をXYZθステージにより移動自在に構成してもよい。XYZθステージと測定ユニット3は、微量光イメージング観察ターゲット及びその周辺に励起光を照射するように、スポット励起光照射部23を所望の位置とする位置調整手段としての役割も担う。なお、XYZθステージに代えて、スポット励起光照射部23の移動が自在であれば、他の手段を適用してもよい。
【0067】
第7実施形態においては、生体外である測定ユニット3の外周部近傍に設置された光ファイバー22f、スポット励起光照射部23から出射した励起光を生体に照射する。そして、生体内で発した蛍光を体外に設置された超高感度カメラ1から検出する。すなわち、生体内で発した蛍光が測定ユニット3を介して超高感度カメラ1に検出される。なお、測定ユニット3を蛍光透過材料で構成せず、開口部等を設けてもよい。
【0068】
第7実施形態に係る微量光イメージング装置50fの微量光イメージングは、まず、必要に応じて被験動物4に蛍光標識を施し、次いで、被験動物4を測定ユニット3内に搭載して固定する。被験動物4を測定ユニット3内に搭載した後に蛍光標識してもよい。そして、励起光を励起光源20から光ファイバー22f、スポット励起光照射部23、測定ユニット3を介して生体内の所望の位置に照射する。そして、生体内に標識された蛍光を体外に設置された超高感度カメラ1から検出する。
【0069】
第7実施形態によれば、スポット励起光照射部23により、領域限定的な照射が可能になるので生体負荷を軽減することができる。しかも、光ファイバー22fをXYZθ方向に移動自在にし、かつ測定ユニット3により回転可能とすることにより、所望の位置に光ファイバー22fを移動させ、所望の位置に対してピンポイント的に励起光を照射することが可能となる。すなわち、上記非特許文献2のように下面に限定されず、光ファイバー22fの先端を自由に移動し、目的部位に集中的に強力な励起光をスポット照射することが可能である。また、上記非特許文献2の方法に比して照射ユニットの小型化を実現することができるので、装置全体の小型化を図ることが可能であるというメリットもある。
【0070】
なお、反射光を最小限にする観点からは、ファイバー先端を動物になるべく近接させ、光の漏れを防ぐのが有効である。さらにその目的で、励起光と超高感度カメラの光軸の中間に被験動物を位置させることが好ましい。そのため、照射部位、照射方向は限定されないが、被験動物の下側面より励起光を照射し、励起光照射により発する蛍光を被験動物の上側から検出するのが好ましい。また、光ファイバー先端を動物になるべく近接させる観点からは、動物体表にファイバー先端を押し当て圧迫(密着)する方法も有効である。また、圧迫によりファイバー先端を体内深部の照射を目的とする部位に近づけてもよい。
【0071】
[第8実施形態]
第8実施形態に係る微量光イメージングは、以下の点を除く基本的な構成は第7実施形態と同様である。すなわち、第8実施形態に係る微量光イメージング装置は、測定ステージ状の測定ユニット5を具備している点において相違する。
【0072】
図9に、第8実施形態に係る微量光イメージング装置の模式的説明図を示す。第8実施形態に係る微量光イメージング装置50gは、励起光照射ユニット2g、超高感度カメラ1、測定ユニット5等を備えている。
【0073】
スポット励起光照射部23は、測定ユニット3の外側の近接位置に先端部が配置されている。光ファイバー22gのスポット励起光照射部23とは反対の端部は、励起光源20に接続されている。スポット励起光照射部23及び光ファイバー22gは、XYZθステージ(不図示)によって、移動自在になっている。なお、XYZθステージに代えて、スポット励起光照射部23と光ファイバー22の移動が自在であれば、他の手段を適用してもよい。
【0074】
測定ユニット5は、被験動物4を搭載し、かつ被験動物4の位置を固定可能なステージである。第8実施形態においては、測定ユニット5は、移動自在なものではなく、定位置に固定されたものである。これにより、測定ユニット5の構造を簡便にすることができる。その結果、例えば、動物保温用のヒーター等の他の機能を容易に組み込むことができる。無論、測定ユニット5の位置を移動自在とし、光ファイバー22gを固定してもよい。また、測定ユニット5と光ファイバー22gの両者を移動自在にしてもよい。
【0075】
生体外である測定ユニット5の外周部近傍に設置されたスポット励起光照射部23から発した励起光を、測定ユニット5を介して被験動物4に照射し、被験動物4の生体内で発した蛍光を体外に設置された超高感度カメラ1から検出する。
【0076】
第8実施形態に係る微量光イメージング装置50gの微量光イメージングは、まず、被験動物に蛍光標識を施し、次いで、被験動物4を測定ユニット5内に搭載する。そして、励起光を励起光源20から光ファイバー22g、スポット励起光照射部23、測定ユニット5を介して被験動物4の生体内の所望の位置に照射する。そして、生体内に標識された蛍光を体外に設置された超高感度カメラ1から検出する。
【0077】
第8実施形態によれば、領域限定的な照射が可能になるので生体負荷を軽減することができる。しかも、光ファイバー22gとスポット励起光照射部23をXYZθ方向に移動自在にすることにより、所望の位置に光ファイバー22gを移動させ、ピンポイント的に励起光を照射することが可能となる。しかも、上記非特許文献2の方法に比して励起光照射ユニットの小型化を実現することができるので、装置全体の小型化を図ることができるというメリットもある。
【0078】
なお、上記実施形態は一例であって、本発明の趣旨を逸脱しない範囲で種々の変形が可能である。また、上記第1実施形態〜第8実施形態は、好適に組み合わせて用いることができる。また、微量光イメージング装置は、他の公知の機能を備えていてもよい。例えば、可視帯域の照明光を出射することによって体腔内を照明するモードを備えていてもよい。また、励起光モードと照明モードとを切り替え可能にしてもよい。また、上記実施形態においては、スポット励起光照射部は、光ファイバーに接続されている例を説明したが、スポット励起光を照射可能であればよく、光ファイバーを用いなくてもよい。また、上記実施形態においては、微量光検出対象が蛍光である例を挙げたが、他の発光、熱(赤外線)等の微量光であってもよい。また、スポット励起光照射部が1つである例を説明したが、被験動物の大きさなどに応じて、スポット励起光照射部を複数有するようにしてもよい。また、生体情報を多角的に得る観点から、CTなどのX線照射装置、MRI等の機能を備えたりしてもよい。また、上記実施形態においては、微量光検出装置として超高感度カメラの例を挙げたが、フォトンカウンター等を用いてもよい。
【産業上の利用可能性】
【0079】
本発明の微量光イメージング装置は、生体内の微量光の挙動を追跡することにより、生体内事象を検出することができる。従って、医学的現象の解明や、薬物動態の解明等に有用である。
【符号の説明】
【0080】
1 超高感度カメラ
2 励起光照射ユニット
3、5 測定ユニット
4 被験動物
10 レンズ本体
11 カメラ本体
12 フォーカスリング
13 フォーカスレンズ
14 レンズ鏡筒
15 フィルタリング
20 励起光源
21 高分解能励起フィルタ
22 光ファイバー
23 スポット励起光照射部
24 被覆部
25 磁気照射部
26 薬剤放出部
27 センサ
28 光伝送中継部
31 第1光ファイバー
32 第2光ファイバー
50 微量光イメージング装置
【特許請求の範囲】
【請求項1】
励起光源と、
前記励起光源から出射された励起光を、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するスポット励起光照射部と、
前記微量光イメージング観察ターゲット及びその周辺に前記励起光を照射するように、前記スポット励起光照射部を所望の位置に調整する位置調整手段と、を具備する励起光照射ユニットと、
前記微量光イメージング観察ターゲットから発する微量光を、体外から検出する発光検出装置と,
被験動物を載置、又は搭載する測定ユニットと、
を備える微量光イメージング装置。
【請求項2】
前記スポット励起光照射部は、光ファイバーに接続されていることを特徴とする請求項1に記載の微量光イメージング装置。
【請求項3】
前記発光検出装置は、超高感度カメラであることを特徴とする請求項1又は2に記載の微量光イメージング装置。
【請求項4】
前記位置調整手段は、前記スポット励起光照射部、若しくは前記測定ユニットの少なくともいずれかが移動自在に構成されたものであることを特徴とする請求項1〜3のいずれか1項に記載の微量光イメージング装置。
【請求項5】
前記スポット励起光照射部は、複数の光ファイバーに接続されていることを特徴とする請求項1〜4のいずれか1項に記載の微量光イメージング装置。
【請求項6】
前記スポット励起光照射部は、
生体内の前記微量光イメージング観察ターゲット近傍に前記スポット励起光照射部、及びこれと接続された光ファイバーを挿入可能な構成と、
前記測定ユニットの外周部近傍に前記スポット励起光照射部を設置する構成の少なくともいずれかを有することを特徴とする請求項1〜5のいずれか1項に記載の微量光イメージング装置。
【請求項7】
前記スポット励起光照射部の近傍に磁気照射部、薬剤放出部、センサの少なくともいずれかが設置されていることを特徴とする請求項1〜6のいずれか1項に記載の微量光イメージング装置。
【請求項8】
前記測定ユニットは、前記励起光照射により生体内で発する微量光を前記微量光検出装置によって検出可能なように、開口部が設けられているか、若しくは発光透過材料によって構成されていることを特徴とする請求項1〜7のいずれか1項に記載の微量光イメージング装置。
【請求項9】
スポット励起光照射部を介して、生体内の微量光イメージング観察ターゲット及びその周辺に限定して励起光をスポット照射し、
前記励起光照射によって発する微量光を、体外から検出する微量光イメージング方法。
【請求項10】
スポット励起光照射部を生体内に挿入することを特徴とする請求項9に記載の微量光イメージング方法。
【請求項11】
スポット励起光照射部は、体外から照射することを特徴とする請求項9に記載の微量光イメージング方法。
【請求項1】
励起光源と、
前記励起光源から出射された励起光を、生体内の微量光イメージング観察ターゲット及びその周辺に限定して照射するスポット励起光照射部と、
前記微量光イメージング観察ターゲット及びその周辺に前記励起光を照射するように、前記スポット励起光照射部を所望の位置に調整する位置調整手段と、を具備する励起光照射ユニットと、
前記微量光イメージング観察ターゲットから発する微量光を、体外から検出する発光検出装置と,
被験動物を載置、又は搭載する測定ユニットと、
を備える微量光イメージング装置。
【請求項2】
前記スポット励起光照射部は、光ファイバーに接続されていることを特徴とする請求項1に記載の微量光イメージング装置。
【請求項3】
前記発光検出装置は、超高感度カメラであることを特徴とする請求項1又は2に記載の微量光イメージング装置。
【請求項4】
前記位置調整手段は、前記スポット励起光照射部、若しくは前記測定ユニットの少なくともいずれかが移動自在に構成されたものであることを特徴とする請求項1〜3のいずれか1項に記載の微量光イメージング装置。
【請求項5】
前記スポット励起光照射部は、複数の光ファイバーに接続されていることを特徴とする請求項1〜4のいずれか1項に記載の微量光イメージング装置。
【請求項6】
前記スポット励起光照射部は、
生体内の前記微量光イメージング観察ターゲット近傍に前記スポット励起光照射部、及びこれと接続された光ファイバーを挿入可能な構成と、
前記測定ユニットの外周部近傍に前記スポット励起光照射部を設置する構成の少なくともいずれかを有することを特徴とする請求項1〜5のいずれか1項に記載の微量光イメージング装置。
【請求項7】
前記スポット励起光照射部の近傍に磁気照射部、薬剤放出部、センサの少なくともいずれかが設置されていることを特徴とする請求項1〜6のいずれか1項に記載の微量光イメージング装置。
【請求項8】
前記測定ユニットは、前記励起光照射により生体内で発する微量光を前記微量光検出装置によって検出可能なように、開口部が設けられているか、若しくは発光透過材料によって構成されていることを特徴とする請求項1〜7のいずれか1項に記載の微量光イメージング装置。
【請求項9】
スポット励起光照射部を介して、生体内の微量光イメージング観察ターゲット及びその周辺に限定して励起光をスポット照射し、
前記励起光照射によって発する微量光を、体外から検出する微量光イメージング方法。
【請求項10】
スポット励起光照射部を生体内に挿入することを特徴とする請求項9に記載の微量光イメージング方法。
【請求項11】
スポット励起光照射部は、体外から照射することを特徴とする請求項9に記載の微量光イメージング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−154896(P2012−154896A)
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−16665(P2011−16665)
【出願日】平成23年1月28日(2011.1.28)
【出願人】(501083643)学校法人慈恵大学 (20)
【Fターム(参考)】
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成23年1月28日(2011.1.28)
【出願人】(501083643)学校法人慈恵大学 (20)
【Fターム(参考)】
[ Back to top ]

