心不全の心筋インスリン抵抗性を再現したexvivo心筋細胞、その作製方法および該心筋細胞を用いたスクリーニング方法
【課題】心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供する。
【解決手段】株化心筋芽細胞を心筋細胞に分化誘導した後、遊離脂肪酸を含有する培養液で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞。また、該ex vivo心筋細胞を用いた、心不全時の心筋細胞の基質代謝・エネルギー代謝評価系による、心不全時の心筋細胞代謝改善薬のスクリーニング方法。
【解決手段】株化心筋芽細胞を心筋細胞に分化誘導した後、遊離脂肪酸を含有する培養液で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞。また、該ex vivo心筋細胞を用いた、心不全時の心筋細胞の基質代謝・エネルギー代謝評価系による、心不全時の心筋細胞代謝改善薬のスクリーニング方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞、その作製方法および該心筋細胞を用いた心筋細胞代謝改善薬のスクリーニング方法に関する。
【背景技術】
【0002】
高齢化が加速する中で心不全の患者数も増加の傾向をたどっている。増え続ける患者数と医療費に対して、入院頻度を減らし外来内服治療によって状態を安定化させるような心不全治療法を確立することが望まれている。
【0003】
心不全とは体内の代謝的需要・静脈環流に対して、心臓がそれに見合う十分なポンプ機能を果たすことができない状態を示す。その原因としては虚血性心疾患(狭心症・心筋梗塞)、心臓弁膜症、心筋症、高血圧性心機能障害、心筋炎、先天性心疾患など様々な疾患があげられる。心不全治療ターゲットは病態生理の解明とともに変遷している。かつては心臓の機械的なポンプ不全(収縮不全)が注目され、機械的なポンプ不全に対する強心剤や利尿剤の投与が中心的な治療であった。しかし、1980年代からは神経体液因子との関連が注目され、アンギオテンシンIIの作用を抑制する目的でアンギオテンシン変換酵素阻害剤が投与され始めた。1990年代からは、慢性心不全に対するβ遮断薬の有効性が示され、アポトーシスや心筋リモデリングとの関連性が注目されている。また、近年では心筋細胞自体のエネルギー代謝に注目した心不全治療薬の開発が急がれている。
【0004】
近年の報告では、心不全状態において心筋細胞がインスリン抵抗性(心不全の心筋インスリン抵抗性ともいう)を示し、かつ基礎代謝が変化する。心不全状態における心筋細胞のこのような変化が、心筋細胞のエネルギー代謝の効率を悪化させ、心不全の病態を悪化させる増悪因子であることが示されている(非特許文献1)。つまり、慢性心不全において心筋細胞のインスリン抵抗性はグルコースの代謝を低下させ、遊離脂肪酸の代謝を亢進させる。その結果、約11〜12%の心筋細胞のエネルギー効率低下を起こし、活性酸素やアポトーシスも誘導することによってさらなる病態の悪化を引き起こす(図1)。ここで、心筋インスリン抵抗性は、一般的な生活習慣病やメタボリックシンドロームから生じる全身性のインスリン抵抗性とは異なり、心筋細胞において特異的に生じるものである。心筋細胞代謝改善に注目した臨床研究も報告されており、一定の効果を示している(非特許文献2、非特許文献3)。しかしながら、心臓に特化した糖代謝改善薬剤が存在せず、従来の全身に作用する経口糖尿病薬を代用しているため、メトホルミン(metoformin)では、アシドーシスが生じ、ロシグリタゾン(rosiglitazone)およびピオグリタゾン(pioglitazone)では水分貯留が生じるなどの理由で心不全患者には禁忌とされている。そのため、心筋細胞の代謝改善、つまりインスリン抵抗性の改善に注目した心不全治療の開発と研究が求められている。
【0005】
また、In vitroにおいて心筋細胞の基質代謝を研究しようとする試みも行われている(非特許文献4)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Houman Ashrafian et al., "Metabolic Mechanisms in Heart Failure", Circulation: Jounal of American Heart Association 2007; 116; 434-448
【非特許文献2】Dean T. Eurich, et al., "Improved Clinical Outcomes Associated With Metformin in Patients With Diabetes and Heart Failure", Diabetes care 2005; 28; 2345-2351
【非特許文献3】George G. Sokos et al., "Glucagon-Like Peptide-1 Infusion Improves Left Ventricular Ejection Fraction and Functional Status in Patients With Chronic Heart Failure", Journal of Cardiac Failure 2006; 12 (9); 694-699
【非特許文献4】Mathias Uhlig et al., "Functional role of Rab11 in GLUT4 trafficking in cardiomyocytes", Molecular and Cellular Endocrinology 2005; 235; 1-9
【発明の概要】
【発明が解決しようとする課題】
【0007】
心不全に関する従来のin vivoの基礎研究では、実験動物に対して冠動脈結紮や高頻度ペースメーカー刺激などを用いて機械的に心不全を発生させたり、遺伝子改変動物を用いたりしていた。高頻度ペーシングでは心不全モデル動物の作製に約2週間を要し、Dahl食塩感受性ラットなどの遺伝子改変動物を用いた場合では心不全が発生するまでに約12週間を要する。このように上記方法では、モデル動物の作製に時間がかかるうえ、作成している間にサンプルが死亡してしまうことがしばしばあった。また実際にモデル動物に薬剤を投与して心筋代謝改善薬の効果を判定しようと試みても、全身反応の二次的効果であるのか心筋細胞に特異的な効果であるのかを判定することは困難であった。
【0008】
また、非特許文献4に記載されているように、in vitroに心筋細胞の基質代謝を研究しようとしても、市販の心筋培養細胞(H9c2細胞;ラット心筋芽細胞)は幼若なため、基礎代謝研究の評価が困難であった。すなわち、H9c2細胞においてはインスリン刺激による糖取り込み経路の発現が未成熟であり、H9c2細胞をインスリンで刺激した場合でも該細胞は糖をほとんど取り込まないため、H9c2細胞は、インスリン抵抗性の評価には不適切だった。
【0009】
本発明は、上記の事情を鑑みてなされたものであり、心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明の第1の観点に係る心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞の作製方法は、
株化心筋芽細胞を心筋細胞に分化誘導する工程と、
該心筋細胞を、遊離脂肪酸を含有する培養液で培養する工程と、
を備えることを特徴とする。
【0011】
前記株化心筋芽細胞はH9c2細胞であることが好ましい。
【0012】
前記遊離脂肪酸はパルミチン酸であることが好ましい。
【0013】
前記遊離脂肪酸を含有する培養液中の該遊離脂肪酸の濃度が50μM〜2mMであることが好ましい。
【0014】
前記心筋細胞は、前記遊離脂肪酸を含有する培養液で、6時間〜2日間培養されることが好ましい。
【0015】
前記分化誘導する工程が、
前記株化心筋芽細胞をコンフルエントに達するまで増殖させる工程と、
該増殖させた心筋芽細胞を0.5%〜2%のウシ胎児血清を含有する培養液で培養して、心筋細胞に分化誘導する工程と、
を備えることが好ましい。
【0016】
前記増殖させた心筋芽細胞を、前記ウシ胎児血清を含有する培養液で、3日〜7日間培養することが好ましい。
【0017】
本発明の第2の観点に係る心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞は、上記の第1の観点に係るex vivo心筋細胞の作製方法で作製されることを特徴とする。
【0018】
本発明の第3の観点に係る心不全時の心筋細胞代謝改善薬のスクリーニング方法は、上記の第2の観点に係るex vivo心筋細胞を用いることを特徴とする。
【発明の効果】
【0019】
本発明に係る心筋細胞の作製方法によれば、株化された心筋芽細胞を分化誘導した後、遊離脂肪酸を含有する培養液で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞を作製することができ、心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供することができる。この細胞を利用することにより、心不全時の心筋細胞代謝改善薬を簡易にスクリーニングすることができる。
【図面の簡単な説明】
【0020】
【図1】心不全における代謝悪循環の様子を示す図である。
【図2A】H9c2細胞および1%FBS含有培養液で分化した心筋細胞におけるマイオゲニンのタンパク質発現量を示す図である。
【図2B】H9c2細胞および1%FBS含有培養液で分化した心筋細胞におけるトロポニンTのタンパク質発現量を示す図である。
【図3A】H9c2細胞および1%HS含有培養液で分化した心筋細胞におけるマイオゲニンのタンパク質発現量を示す図である。
【図3B】H9c2細胞および1%HS+10%FBS含有培養液で分化した心筋細胞におけるマイオゲニンのタンパク質発現量を示す図である。
【図4A】H9c2細胞および分化した心筋細胞におけるインスリンレセプター基質1(IRS−1)のタンパク質発現量を示す図である。
【図4B】H9c2細胞および分化した心筋細胞におけるグルコーストランスポーター4(GLUT4)のタンパク質発現量を示す図である。
【図5】H9c2細胞および分化した心筋細胞における、インスリン刺激の有無によるGLUT4の細胞内局在の変化を示す図である。
【図6】H9c2細胞および分化した心筋細胞における、インスリン刺激の有無による2−デオキシグルコースの取り込み量の変化を示す図である。
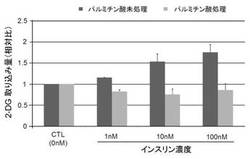
【図7】分化した心筋細胞における、パルミチン酸処理の有無による2−デオキシグルコースの取り込み量の変化を示す図である。
【図8】分化した心筋細胞における、パルミチン酸処理の有無によるIRS−1およびAktのリン酸化の変化を示す図である。
【図9】分化した心筋細胞における、パルミチン酸処理の有無によるIRS−1のセリン部位のリン酸化の変化を示す図である。
【図10】ペルヘキシリン前処理の有無によるIRS−1およびAktのリン酸化の変化を示す図である。
【図11】ペルヘキシリン前処理の有無によるIRS−1のセリン部位のリン酸化の変化を示す図である。
【発明を実施するための形態】
【0021】
本発明は、心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供する。詳細には、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞、その作製方法および該ex vivo心筋細胞を用いた心筋細胞代謝改善薬のスクリーニング方法を提供する。
本発明の発明者らは、株化された心筋芽細胞を、分化誘導(分化用)培養液で培養して心筋細胞に分化させた後に、遊離脂肪酸含有培養液で培養することにより、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞が得られることを見出して本発明を完成させたものである。
【0022】
(1.心筋芽細胞および心筋細胞)
本明細書において「株化心筋芽細胞」、「株化された心筋芽細胞」とは、自己増殖能を有し、心筋細胞に分化するよう方向付けられた細胞であり、心筋細胞に比べて未分化な細胞である。株化心筋芽細胞では、後述する心筋細胞に特異的なタンパク質がほとんど検出されない又はその存在量が分化した心筋細胞に比べて低い状態にある。また、株化心筋芽細胞はインスリン刺激による糖の細胞内取り込みの機能を有さない又は分化した細胞に比べて低い状態にある。
【0023】
本発明で用いる株化心筋芽細胞は、種々の動物、例えば鳥類又は哺乳動物由来の心筋芽細胞から樹立される株化心筋芽細胞であれば特に制限はなく、すでに樹立された心筋芽細胞株の他、動物から単離した心筋芽細胞を公知の方法を用いて株化することによって新たに樹立される細胞株であってもよい。例えば、ラット、ヒト、サル、マウス、ブタ、ウシ又はニワトリ等に由来する株化心筋芽細胞を用いることができる。
【0024】
株化心筋芽細胞としては、好ましくは、ラット心臓由来のH9c2細胞(ATCC番号CRL−1446)が挙げられる。これは米国American Type Culture Collection(ATCC)より入手することができる。また、ラット心房筋由来のHL−1細胞、ヒト心臓由来のAC16細胞、心筋細胞に分化しやすいES細胞であるP19CL6細胞も利用可能である。
【0025】
本明細書において「心筋細胞」とは、株化心筋芽細胞を分化誘導して作製した細胞であり、心筋芽細胞と比較して心室筋の細胞に特異的なタンパク質発現が亢進し、インスリン刺激による糖取り込みの亢進した細胞である。このため、株化心筋芽細胞を分化誘導することによって得られた細胞は、分化する前の株化心筋芽細胞と比べ心筋細胞により近い性質を有している。
【0026】
心筋細胞に特異的なタンパク質およびその検出方法は、適宜選択することができる。心筋細胞に特異的なタンパク質(分化マーカー)としては、マイオゲニン(myogenin)、トロポニンT(Troponin T)、トロポニンIおよびミオシン軽鎖、といった筋原性タンパク質などが挙げられる。特異的なタンパク質の検出方法としては、公知の生化学的または免疫化学的な方法を用いることができる。特に制限されないが、分化マーカーに特異的な標識抗体を用いる方法(染色法、フローサイトメトリー、ELISAなど)、RT−PCR法、ハイブリダイゼーション解析などが挙げられる。分化マーカーに特異的な抗体は市販されており、容易に使用することができる。
【0027】
(2.細胞培養)
上記の株化心筋芽細胞を増殖用培養液で培養する。増殖用培養液は、株化心筋芽細胞を培養するために一般的に用いられている培養液であれば、特に限定されるものではない。例えば、血清を添加したDMEM(Dulbecco’s modified Eagle’s medium)培養液を用いることができる。血清としては、ウシ胎児血清(fetal bovine serum,FBS)、ウマ血清(horse serum,HS)などを用いることができる。好ましくは、FBSを用いる。血清濃度は、約5%〜約15%であることが好ましく、約10%であることがより好ましい。また、株化心筋芽細胞を増殖させることができれば、適当な増殖因子等を含有する無血清培養液を用いることができる。
【0028】
増殖用培養液には、株化心筋芽細胞を培養するために一般的に用いられる抗生物質を添加することができる。例えば、100U/mLのペニシリンおよび/または100μg/mLのストレプトマイシンを添加することができる。また、ファンギゾン(1%fungizone)等の抗真菌剤を添加してもよい。本発明に用いられる増殖用培養液は、さらに他の成分を含むことができる。例えば、1mM〜3mMのグルタミンおよび0.5mM〜2mMのピルビン酸を含むことができる。
【0029】
このような増殖用培養液を用いて、心筋芽細胞をコンフルエント、つまりほぼ100%のconfluenceの状態になるまで単層培養する。培養条件は、心筋芽細胞を培養するための公知の条件を採用することができる。例えば、約5%CO2存在下、約37℃で、3日〜7日間、細胞を培養する。
【0030】
なお、H9c2細胞は、継代回数が10から20の細胞を使用すると、後述する心筋細胞への分化誘導において、安定した分化が誘導でき、通常は分化用培養液に交換して3日間以上の培養によって心筋細胞に近い性質をもつことができる。
【0031】
(3.心筋細胞への分化誘導)
続いて、上述のように増殖培養した細胞を分化用培養液中で培養する。
分化用培養液は、分化心筋芽細胞を心筋細胞に分化させることができる組成であればよく、所定の濃度の血清を含有するDMEM培養液を用いることができる。安定した分化のためには、増殖用培養液よりも低濃度の血清を含有することが好ましい。
具体的には、分化用培養液中の好ましい血清濃度は約0.1%〜約15%である。血清濃度が0.1%より低いと細胞障害性が認められ、15%より高いと分化させることが困難となる。またより安定した分化のためには、約0.5%〜約2%の血清濃度であることがより好ましい。さらに好ましくは約1%である。
分化用培養液に含まれる血清としては、ウシ胎児血清(FBS)、ウマ血清(HS)などを用いることができる。また、これらを組み合わせて用いてもよい。なお、後続するパルミチン酸負荷工程における細胞障害の観点から、FBSを用いることがより好ましい。
本発明における分化用培養液としては、例えば、1%FBS、1%HS、または1%HS+10%FBSを含有するDMEM培養液を用いることができる。
【0032】
分化用培養液には、心筋芽細胞を培養するために一般的に用いられている抗生物質を添加することができる。例えば、100U/mLのペニシリンおよび/または100μg/mLのストレプトマイシンを添加することができる。また、ファンギゾン(1%fungizone)等の抗真菌剤を添加してもよい。本発明に用いられる分化用培養液は、さらに他の成分を含むことができる。例えば、1mM〜3mMのグルタミンおよび0.5mM〜2mMのピルビン酸を含むことができる。
【0033】
このような分化用培養液中で、約5%CO2、約37℃の条件下で、3日間以上、心筋芽細胞を培養する。培養液の種類によっても異なるが、好ましくは約3日〜7日間培養する。なお、3日間より長く培養する場合は、2〜3日毎に新鮮な培養液に交換することが好ましい。これにより、心筋芽細胞は心筋細胞に近い性質を有する細胞に分化誘導される。分化用培養液中での培養期間が3日間より短いと分化が十分でなく、7日間より長いと細胞障害性を示す傾向があり、パルミチン酸負荷工程で細胞障害が認められる可能性が高くなる。
【0034】
(4.糖代謝能の評価)
株化心筋芽細胞を分化誘導することにより得られた心筋細胞では、後述する実施例に示すように、分化前の心筋芽細胞に比べてインスリンレセプター基質1(Insulin Receptor substrate−1:IRS−1)およびグルコーストランスポーター4(GLUT4)の発現が亢進している。IRS−1は、インスリンシグナル経路のタンパク質の一つである。また、GLUT4は、インスリンに応答してグルコースを細胞内に取り込むグルコーストランスポーターである。IRS−1およびGLUT4の発現は、標識抗体を用いる方法(染色法、フローサイトメトリー、ELISAなど)、酵素活性を利用した染色法、RT−PCR法およびハイブリダイズ解析などにより確認することができる。
【0035】
インスリンシグナル伝達においては、細胞外に存在するインスリンがインスリンレセプターと結合することにより、細胞内へのグルコース取り込みを開始させるシグナル伝達が開始される。
まず、インスリンがインスリンレセプターと結合すると、内在するチロシンキナーゼが活性化され、インスリンレセプターは自己リン酸化される。そのリン酸化チロシンにIRS−1が結合し,このIRS−1がリン酸化される。リン酸化されたIRS−1はホスファチジルイノシトール−3−キナーゼ(PI−3キナーゼ)に結合しPI−3キナーゼを活性化する。活性化されたPI−3キナーゼはさらにプロテインキナーゼB(PKB)を細胞膜に引き寄せ、PKBを活性化する。活性化されたPKBはGLUT4を細胞膜表面に移動させる。細胞膜表面に移動したGLUT4を介してグルコースが細胞内に取り込まれる。
このように、インスリン刺激に応じてGLUT4が細胞膜表面に移動し、グルコース取り込み能(糖代謝能)が亢進することを「インスリン応答性」という。
【0036】
本発明に係る分化後の心筋細胞では、後述する実施例に示すように、インスリン刺激によってGLUT4が細胞膜表面に移動し、かつ分化前の心筋芽細胞に比べてグルコースの取り込みが亢進している。一方、未分化の心筋芽細胞では、GLUT4の発現が低く、インスリン刺激によるGLUT4の細胞膜表面への移動は認められない。また、未分化の心筋芽細胞では、インスリン刺激によるグルコース取り込みの亢進は認められない。
このように、株化心筋芽細胞を分化誘導することにより得られる心筋細胞は、インスリンシグナル経路に関するタンパク質の発現が亢進し、インスリン応答性を示す。従って、株化心筋芽細胞を分化誘導することにより得られる心筋細胞は、より心筋細胞に近いグルコース代謝能を有する。
【0037】
インスリン刺激は、インスリン(0.1nM〜1μM)を用いて、心筋芽細胞および分化後の心筋細胞を1分〜30分間インキュベートすることによって行うことができる。負荷するインスリンの濃度は、分化後の心筋細胞がインスリン応答性を示す濃度であればよい。好ましくは0.1nM〜1μM、より好ましくは10nM〜100nM、さらに好ましくは100nMである。インスリン刺激に用いるインスリン含有液は、例えば、HEPES−PBS(リン酸緩衝生理食塩水)またはKreb Ringer phosphate(KRP)バッファー等にインスリンを溶解することによって調整することができるが、これに限定されるものではない。
【0038】
インスリン刺激によるGLUT4の細胞膜表面への移動を評価する方法は、タンパク質の細胞内局在を評価することができる方法であれば、特に限定されない。例えば免疫染色法を用いてGLUT4の細胞内分布を観察することによって評価することができる。具体的には、細胞をカバーガラス上で一晩培養し、PBSで洗浄後、4%パラホルムアルデヒド−PBS溶液で細胞をガラス上に固定する。このガラスをジギトニン(100μg/mL)含有PBSに浸し、PBSで洗浄後、GLUT4に特異的な一次抗体を添加し、インキュベートする。PBSで洗浄後、一次抗体に対する蛍光標識二次抗体を添加し、インキュベートする。PBSで洗浄後、封入剤を滴下したスライドガラス上に、処理したカバーガラスを反転して載せる。このように染色した細胞を、蛍光顕微鏡や共焦点レーザー顕微鏡などを用いて観察することにより、GLUT4が細胞膜表面に移動したかどうかを評価することができる。
【0039】
グルコースの取り込み能は、培養液中に添加したグルコースの減少量を測定する方法、放射能ラベルしたグルコースもしくはグルコース類似化合物(例えば2−デオキシグルコース(2−DG))を用いて細胞内の放射能を測定する方法、または蛍光標識したグルコースもしくはグルコース類似化合物を用いて細胞内の蛍光を検出する方法などによって評価することができるが、これに限定されるものではない。
【0040】
他のインスリン応答性の評価方法として、例えば、インスリン刺激によって分化後の心筋細胞のインスリンシグナル伝達に関わるタンパク質(例えば、IRS−1、プロテインキナーゼB(Akt)等)がリン酸化されていることを確認する方法等がある。
【0041】
(5.インスリン抵抗性の付与)
上述のように分化された心筋細胞を、遊離脂肪酸を含有する培養液で培養することにより、該心筋細胞にインスリン抵抗性を付与することができる。
本明細書において「インスリン抵抗性」とは、インスリン刺激されても、細胞が上述したインスリン応答性を示さなくなることをいう。つまり、インスリン抵抗性を示す心筋細胞では、該心筋細胞を、インスリンを含有する培養液中でインキュベートしても、GLUT4が細胞膜表面へ移動せず、グルコース取り込み量も増加しない。
【0042】
本発明に用いられる遊離脂肪酸は特に限定されないが、オレイン酸、パルミチン酸、ステアリン酸、リノール酸、リノレン酸などを含む。好ましくはパルミチン酸、ステアリン酸である。培養液中の遊離脂肪酸の濃度は、50μM〜2mMであることが好ましい。より好ましくは、100μM〜400μMであり、さらに好ましくは、200μMである。培養液中の遊離脂肪酸の濃度が50μMよりも高い場合、負荷された心筋細胞は十分なインスリン抵抗性を示す。また、培養液中の遊離脂肪酸の濃度が2mMよりも低い場合、心筋細胞に対する細胞障害性が低減され、遊離脂肪酸を負荷していない細胞に比べて細胞数が減少する可能性が低くなるため、インスリン抵抗性の評価に適する。
【0043】
遊離脂肪酸を含む培養液には、上述する増殖用培養液を用いることができるが、これに限定されるものではない。
培養条件は、心筋細胞を培養するための公知の条件を採用することができる。例えば、約5%CO2存在下、約37℃で細胞を培養する。培養時間は、心筋細胞にインスリン抵抗性を付与することができる条件であればよい。培養時間は、負荷する遊離脂肪酸の培養液中の濃度によっても異なるが、好ましくは6時間〜48時間、より好ましくは12時間〜36時間、さらに好ましくは24時間である。6時間より長いと、心筋細胞は十分なインスリン抵抗性を示すようになり、48時間より短いと、心筋細胞に対する細胞障害性が低減され、遊離脂肪酸を負荷していない細胞に比べて細胞数が減少する可能性が低くなる。
【0044】
遊離脂肪酸を含有する培養液は、例えば、次のように調製することができる。
パルミチン酸を、40℃〜50℃に温めた0.1N NaOH溶液に溶解させる。このパルミチン酸溶液を12%BSA含有培養液(Dulbecco’s modified Eagle’s medium with BSA)に加え、パルミチン酸濃度が2mMになるように希釈して保存する。この2mMパルミチン酸−BSA含有培養液と、増殖用培養液を1:10で混合することにより、FFA(free fatty acid)培養液(200μM)を調製することができる。
【0045】
このように調製したFFA培養液中で心筋細胞を培養することによって、該心筋細胞をインスリン含有培養液で培養しても、GLUT4は細胞膜表面へは移動せず、グルコース取り込みも亢進しない。つまり心筋細胞は、インスリン抵抗性を示すようになる。インスリン抵抗性が付与されたことは、上述したGLUT4の細胞内局在を観察する方法および/またはグルコースの取り込み能の評価方法と同様にして確認することができる。また、インスリン抵抗性が付与されたことは、例えば、心筋細胞のインスリンシグナル伝達に関わるタンパク質(例えば、IRS−1、Akt等)のリン酸化抑制を観察する方法、心筋細胞のIRS−1のセリン部位(例えば、Ser636/Ser639)が過剰にリン酸化されていることを観察する方法(インスリン抵抗性の原因の一つとして、IRS−1のセリン部位の過剰なリン酸化が挙げられる)等によっても確認することができる。
【0046】
(6.心不全時の心筋細胞代謝改善薬のスクリーニング)
上述するように作製されたex vivo心筋細胞は、インスリン抵抗性を再現している。そのため、該心筋細胞を利用して、心不全時の心筋細胞の代謝改善薬を簡易にスクリーニングすることができる。
スクリーニングされる代謝改善薬としては、インスリン抵抗性の改善薬(GLP−1受容体作動薬であるリラグルチド、DPP4拮抗剤であるシタグリプチリン酸塩水和物、ビグアナイド薬、グリタゾン類など)、脂肪酸代謝阻害剤(例えばperhexiline、trimetazidine)などが挙げられる。
【0047】
具体的には、まず、上述のように作製したex vivo心筋細胞を、被検化合物である代謝改善候補薬を添加した培養液でインキュベートする。なお、代謝改善候補薬とのインキュベートの条件は、該代謝改善薬の種類や効果・効能に応じて適宜設定することができる。例えば、5%CO2存在下、37℃で、1時間〜24時間インキュベートしてもよい。また、代謝改善候補薬を添加する培養液は、上述した増殖用培養液を用いてもよく、さらにパルミチン酸などの遊離脂肪酸を含有してもよい。
その後、該心筋細胞の糖代謝能を評価し、例えばインスリン抵抗性が低減または消失すれば、添加した被検化合物は、心不全時に認められる心筋細胞のインスリン抵抗性の改善に有効であると判断することができる。
細胞の糖代謝能は、上述した「4.糖代謝能の評価」に記載した方法を用いて評価することができる。糖代謝能は、GLUT4の細胞膜表面への移行の有無を観察することによって評価してもよく、細胞へのグルコースなどの糖取り込み量を測定することによって評価してもよい。また、その両方によって評価してもよい。さらに、細胞の糖代謝能は、例えば、細胞のインスリンシグナル経路に関わるタンパク質(例えば、IRS−1、プロテインキナーゼB(Akt)等)がリン酸化されていることを観察する方法、細胞のIRS−1のセリン部位(例えば、Ser636/Ser639)の過剰なリン酸化のキャンセルを観察する方法等によっても確認することができる。
【0048】
上述したように、株化された心筋芽細胞を分化誘導した後、心不全患者に起こる血中遊離不飽和脂肪酸の上昇を疑似した培養液、すなわち遊離脂肪酸を含有する培養液中で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞を作製することができる。これにより、心不全時の心筋細胞の基質代謝・エネルギー代謝を評価するための実験系を提供することができる。また、本発明に係る心筋細胞を利用することにより、心筋細胞を標的とした様々な薬剤、例えば、インスリン抵抗性改善薬および糖取込亢進薬といった代謝改善薬、を従来の実験動物等を用いた方法と比較して簡易にスクリーニングすることができる。
【0049】
以下、実施例を用いて本発明をより詳細に説明するが、実施例は本発明を限定するものでない。
【実施例】
【0050】
(心筋細胞への分化誘導)
(1.1%FBS)
市販のH9c2細胞(ATCC番号CRL−1446)をシャーレに約20万〜40万/10cmディッシュで播種し、10mLの増殖用培養液(Dulbecco’s modified Eagle’s medium(Invitrogen,カタログ番号10313),10%FBS(Invitorogen,カタログ番号10473),2mMグルタミン(Invitrogen,カタログ番号25030),1mMピルビン酸(Sigma,カタログ番号P2256),100U/mLペニシリン+100μg/mLストレプトマイシン(BioWhittaker,カタログ番号17−603E))中で、5%CO2存在下、37℃で、100%confluenceになるまで培養した。なお、H9c2細胞は、継代回数が10から20の細胞を用いた。
【0051】
H9c2細胞が100%confluenceになった時点で分化用培養液(低血清培養液:Dulbecco’s modified Eagle’s medium,1%FBS,2mMグルタミン,1mMピルビン酸,100U/mLペニシリン+100μg/mLストレプトマイシン)に交換して細胞をさらに3日〜14日間培養して分化を誘導した。なお、2〜3日毎に新鮮な分化用培養液に交換した。
【0052】
分化誘導された細胞が、心筋細胞に近い性質を有していることを確認するために、筋原性タンパク質であるマイオゲニンおよびトロポニンTのタンパク質発現量をウエスタンブロット法により評価した。なお、分化誘導された細胞は、分化用培養液で3,5,7,10および14日間培養した細胞を用いた。ウエスタンブロット法は、常法に従って行った。
【0053】
具体的には、細胞溶解剤(Cell Lysis Buffer)を使って心筋細胞の全タンパク質サンプルを溶解し抽出した。そのサンプルをSDS−ポリアクリルアミドゲルを用いて100Vで約1時間の電気泳動を行った。電気泳動によって分離されたタンパク質を電場によってニトロセルロース膜に移した。室温にて24時間、目的とするタンパク質の一次特異抗体(マイオゲニン抗体(Santa Cruz Biotechnology社,カタログ番号sc52903)、トロポニンT抗体(Santa Cruz Biotechnology社,カタログ番号sc52282))溶解溶液に浸した。ニトロセルロース膜の一次抗体をよく洗い落としてから、一次抗体の動物種に従ったHRP標識二次抗体(Anti mouse IgG HRP抗体(Promega,カタログ番号W402B))の溶解溶液に約1時間浸した。HRPによって発光する発光試薬を用いて目的とするタンパク質を標識し、ルミノメーター検出機(FUJIFILM,LAS3000mini)によって撮像した。
【0054】
図2Aに示すように、未分化なH9c2細胞では、マイオゲニンのバンドはほとんど検出されなかった。一方、分化誘導された細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいてもマイオゲニンのバンドが検出された。分化後の細胞におけるマイオゲニンのバンド強度は、分化前のH9c2細胞に比べて4倍以上であった。
また、図2Bに示すように、トロポニンTについても、未分化なH9c2細胞では、ほとんどバンドが認められないのに対し、分化後の細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいても、トロポニンTのバンドが検出された。分化後の細胞におけるトロポニンTのバンド強度は、分化前のH9c2細胞に比べて3倍以上であった。
このように、H9c2細胞を分化誘導することにより得られた細胞は、筋原性タンパク質の発現が分化前に比べて亢進し、未分化なH9c2細胞と比べ心筋細胞により近い性質を有し、心筋細胞に分化したことが確認された。
【0055】
(2.1%HS)
上記と同様に、100%confluenceの状態になったH9c2細胞を、分化用培養液(Dulbecco’s modified Eagle’s medium,1%HS,2mMグルタミン,1mMピルビン酸,100U/mLペニシリン+100μg/mLストレプトマイシン)に交換して細胞をさらに5日〜14日間培養して分化を誘導した。なお、2〜3日毎に新鮮な分化用培養液に交換した。
【0056】
分化誘導された細胞が、心筋細胞に近い性質を有していることを確認するために、筋原性タンパク質であるマイオゲニンの発現量をウエスタンブロット法により上記と同様に評価した。図3Aに示すように、未分化なH9c2細胞に比べて、5日〜10日間分化誘導された細胞では、マイオゲニンのバンドがより強く検出された。
【0057】
(3.1%HS+10%FBS)
上記と同様に、100%confluenceの状態になったH9c2細胞を、分化用培養液(Dulbecco’s modified Eagle’s medium,1%HS,10%FBS,2mMグルタミン,1mMピルビン酸,100U/mLペニシリン+100μg/mLストレプトマイシン)に交換して細胞をさらに5日〜14日間培養して分化を誘導した。なお、2〜3日毎に新鮮な分化用培養液に交換した。
【0058】
分化誘導された細胞が、心筋細胞に近い性質を有していることを確認するために、筋原性タンパク質であるマイオゲニンの発現量をウエスタンブロット法により上記と同様に評価した。図3Bに示すように、未分化なH9c2細胞に比べて、分化誘導された細胞では、マイオゲニンのバンドがより強く検出された。
【0059】
以上の結果から、分化用培養液に含まれる血清が1%FBS、1%HS、または1%HS+10%FBSの何れの条件においても、H9c2細胞は心筋細胞に分化誘導されて、心筋細胞に特異的なタンパク質を発現することが明らかとなった。そこで、以下の評価では、1%FBSの血清を含有する分化用培養液を用いて分化誘導させた心筋細胞を用いた。
【0060】
(分化後の心筋細胞の糖代謝能の評価)
次に、分化後の心筋細胞の糖代謝能について評価した。
【0061】
分化後の心筋細胞におけるIRS−1およびGLUT4の発現が亢進しているかどうかをウエスタンブロット法により評価した。
具体的には、上記のマイオゲニンおよびトロポニンTの発現量を検出したウエスタンブロット法と同様の方法で行った。なお、一次抗体としては、マイオゲニン抗体およびトロポニンT抗体の代わりにIRS−1抗体(Cell Signaling Technology社,カタログ番号2382S)およびGLUT4抗体(Santa Cruz Biotechnology社,カタログ番号sc1608)を用いた。
【0062】
図4Aに示すように、未分化なH9c2細胞では、IRS−1のバンドはほとんど検出されなかった。一方、分化誘導された心筋細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいてもIRS−1のバンドが検出され、分化後の心筋細胞におけるIRS−1のバンド強度は、分化前のH9c2細胞に比べて約1.2〜1.4倍であった。
【0063】
また、図4Bに示すように、未分化なH9c2細胞では、GLUT4のバンドはほとんど検出されなかった。一方、分化誘導された心筋細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいてもGLUT4のバンドが検出された。分化後の心筋細胞におけるGLUT4のバンド強度は、分化前のH9c2細胞に比べて約2倍であった。
【0064】
このように、H9c2細胞を分化誘導することにより、インスリンシグナル経路に関連するタンパク質の発現が亢進することが確認された。
なお、分化用培養液で10日間以上培養した細胞は、3日〜7日間培養した細胞に比べて、細胞障害性を示す傾向が認められた。そこで、以下の評価では、1%FBSの血清を含有する分化用培養液を用いて約5日間分化誘導させた心筋細胞を用いた。
【0065】
(インスリン応答性)
次に、分化後の心筋細胞のインスリン応答性について評価した。
分化後の心筋細胞および未分化なH9c2細胞を、スライド、カバーガラス、または光学用プラスチック支持体の上で培養し、それぞれ100nMのインスリンを含有するHEPES−PBS溶液(インスリン含有溶液)、およびインスリンを含有しない溶液(インスリン非含有溶液;対照)中で30分間インキュベートした。インキュベーションは、5%CO2存在下、37℃で行った。
【0066】
インスリン含有および非含有溶液でそれぞれインキュベートした心筋細胞におけるGLUT4の細胞内局在を免疫染色法によって観察した。具体的には、分化後の心筋細胞および未分化なH9c2細胞を、それぞれ100nMでインスリンを含有する溶液中、および含有しない溶液(対照)中で30分間インキュベート(5%CO2、37℃)し、30分経過した時点で4℃にしてインスリンの反応を停止させた。その後、細胞固定液(4%パラホルムアルデヒド)に15分間静置して、細胞を固定した。固定した細胞に対しジギトニン(100μg/mL)を用いて透過処理を行った。これにより、細胞膜の透過性を亢進させ、目的とするタンパク質と一次抗体が接触できるようにする。透過処理した細胞に抗GLUT4ポリクローナル抗体(Santa Cruz Biotechnology社,カタログ番号sc−1608、希釈濃度1:500)を溶解させた1%BSA−PBS溶液(BSA:Sigma、PBS:Invitrogen)を加えて室温で1時間静置した。一次抗体を1%BSA−PBS溶液でよく洗い流したあとで、蛍光標識された二次抗体(Alexa Fluor(登録商標)488結合ウサギ抗ヤギ抗体;Molecular Probes社,カタログ番号A11078)を溶解した溶液に浸して室温で30分静置した。できあがったサンプルは蛍光顕微鏡(または共焦点レーザー顕微鏡)によって観察した。
【0067】
図5はインスリン処理した心筋細胞におけるGLUT4の細胞内局在を示す免疫染色写真である。図中、「N」は核を、矢印の「PM」は細胞膜を示す。図5に示すように、未分化なH9c2細胞では、培養液中のインスリンの有無によるGLUT4の細胞内局在の違いは認められなかった。一方、分化後の心筋細胞では、培養液中にインスリンを含まない場合、GLUT4は細胞質全体に広がって局在しているのに対し、インスリン含有溶液で処理した場合、GLUT4は細胞膜上に局在していることが観察された。
【0068】
次に、分化後の心筋細胞を、上記と同様にインスリン含有溶液で培養し、そのグルコース取り込み能について評価した。
分化後の心筋細胞および未分化なH9c2細胞をそれぞれ、0,1,10および100nMのインスリンと、1μCi/mLの三重水素(3H Tritium)で標識された2−デオキシグルコース(日本パーキンエルマー社,カタログ番号NET549A)とを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、心筋細胞中に取り込まれた三重水素の放射活性を、液体シンチレーションカウンターを用いて測定し、細胞に取り込まれた2−デオキシグルコース量を比較した。
【0069】
図6は、それぞれの細胞をインスリン無添加の溶液中でインキュベートした場合(CTL)のグルコース取り込み量を1としたときの、インスリン含有溶液中でインキュベートした場合のグルコース取り込み量を示す。図6に示すように、未分化なH9c2細胞では、いずれのインスリン濃度下においてもグルコースの取り込み能の亢進は認められなかった。一方、分化後の心筋細胞では、溶液中に含まれるインスリン濃度に応じてグルコース取り込み量が亢進していた。
【0070】
このように分化後の心筋細胞では、インスリン刺激によりGLUT4が細胞膜へ移行し、グルコース取り込み能が亢進した。従って、H9c2細胞から分化誘導することによって得られた心筋細胞は、インスリン応答性を獲得していることが明らかとなった。
【0071】
(インスリン抵抗性の付与)
上述のように分化誘導することによって得られた心筋細胞を、パルミチン酸含有培養液を用いて、5%CO2存在下、37℃で、約24時間培養した。対照として、分化後の心筋細胞を、パルミチン酸を含まない増殖用培養液で同様に培養した。
【0072】
パルミチン酸含有培養液は、次のように調製した。まず、約40〜50℃に温めた0.1N NaOH溶液にパルミチン酸を溶解させた。このパルミチン酸溶液を12%BSA含有培養液(Dulbecco’s modified Eagle’s medium with BSA)に加え、パルミチン酸濃度が2mMになるように希釈した。この2mMパルミチン酸−BSA含有培養液と増殖用培養液とを1:10で混合し、200μMのパルミチン酸を含有するパルミチン酸含有培養液とした。
【0073】
このようにパルミチン酸含有培養液で培養した心筋細胞のグルコース取り込み能を評価した。
パルミチン酸含有培養液で培養した心筋細胞、およびパルミチン酸を含まない培養液で培養した心筋細胞をそれぞれKRPバッファーで洗浄し、0,1,10および100nMのインスリンと1μCi/mLの三重水素(3H Tritium)で標識された2−デオキシグルコース(日本パーキンエルマー社,NET549A)とを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、心筋細胞中に取り込まれた三重水素の放射活性を、液体シンチレーションカウンターを用いて測定し、2−デオキシグルコースの取り込みを評価した。
図7に示すように、パルミチン酸を含まない培養液で培養した心筋細胞は、インスリン刺激により、そのグルコース取り込み量が亢進することが確認された。一方、パルミチン酸含有培養液中で培養した心筋細胞は、インスリン刺激によってもそのグルコース取り込み量が亢進しなかった。このように、パルミチン酸含有培養液で培養された心筋細胞は、インスリン抵抗性を示すことが明らかとなった。
【0074】
パルミチン酸含有培養液で培養した心筋細胞へのインスリン抵抗性付与ついてさらに確認するために、細胞のIRS−1およびプロテインキナーゼB(Akt)のリン酸化、ならびにIRS−1のセリン部位のリン酸化について観察した。
【0075】
前述と同様にパルミチン酸含有培養液で培養した心筋細胞、およびパルミチン酸を含まない培養液で培養した心筋細胞をそれぞれKRPバッファーで洗浄し、0nMおよび100nMのインスリンを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、IRS−1およびAktのリン酸化について、ウエスタンブロット法で観察した。
図8に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、インスリン刺激によりIRS−1およびAktのリン酸化のバンドがより強く検出され、IRS−1およびAktの両方がリン酸化されたことが確認された。一方、パルミチン酸含有培養液で培養した心筋細胞においては、インスリン刺激によってもIRS−1およびAktのリン酸化のバンドにほとんど変化は見られず、IRS−1およびAktの両方でリン酸化が抑制されていることが確認された。このように、パルミチン酸含有培養液で培養した心筋細胞では、インスリンシグナリング反応が低下していることが示唆された。
【0076】
前述と同様にパルミチン酸含有培養液で培養した心筋細胞、およびパルミチン酸を含まない培養液で培養した心筋細胞について、IRS−1のセリン部位(Ser636/639)のリン酸化をウエスタンブロット法で観察した。
図9に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、IRS−1のセリン部位のリン酸化のバンドはほとんど検出されず、IRS−1のセリン部位のリン酸化は確認されなかった。一方、パルミチン酸含有培養液で培養した心筋細胞においては、IRS−1のセリン部位のリン酸化のバンドが強く検出され、IRS−1のセリン部位のリン酸化が確認された。このように、パルミチン酸含有培養液で培養した心筋細胞は、インスリン抵抗性を有することが示唆された。
これらのことから、パルミチン酸含有培養液で培養された心筋細胞がインスリン抵抗性を示すことがさらに明らかとなった。
【0077】
(心筋細胞代謝改善薬のスクリーニング)
パルミチン酸含有培養液で培養された心筋細胞が心不全時の心筋細胞代謝改善薬のスクリーニングに有用であるかについて、Perhexiline Maleate(マレイン酸ペルヘキシリン)(シグマ社,P3028)(以下、ペルヘキシリンという)を用いて検証した。ペルヘキシリンは狭心症薬として開発された薬剤であり、ミトコンドリアの脂質取り込みを制御するカルニチンパルミチン酸トランスフェラーゼ(CPT)−1を阻害することにより心筋細胞の代謝を改善させると考えられている。この検証は、細胞のIRS−1およびAktのリン酸化、ならびにIRS−1のセリン部位のリン酸化を観察することで行った。
【0078】
上述のように分化誘導することによって得られた心筋細胞を、0,0.1,1,2および5μMのペルヘキシリンを含有する、前述と同様のパルミチン酸含有培養液を用いて、5%CO2存在下、37℃で、約24時間培養した。対照として、分化後の心筋細胞を、パルミチン酸を含まない増殖用培養液で同様に培養した。それぞれの細胞をKRPバッファーで洗浄し、100nMのインスリンを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、IRS−1およびAktのリン酸化をウエスタンブロット法で観察した。
図10に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、インスリン刺激によるIRS−1およびAktのリン酸化のバンドが検出され、IRS−1およびAktの両方でリン酸化が確認された。一方、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)のIRS−1およびAktのリン酸化のバンドは、パルミチン酸を含まない培養液で培養した心筋細胞のそれに比して、弱く検出され、IRS−1およびAktの両方でリン酸化が抑制されていることが確認された。このように、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)においては、インスリンシグナリング反応が阻害されていることが確認された。さらに、パルミチン酸含有培養液で培養した心筋細胞をペルヘキシリンで前処理すると、ペルヘキシリンの用量依存的にIRS−1およびAktのリン酸化の度合いが強くなった。このように、インスリンシグナリング反応阻害において、ペルヘキシリンによる用量依存的な改善効果が確認された。
【0079】
前述と同様のパルミチン酸含有培養液(0,0.1,1,2および5μMのペルヘキシリンを含有する)を用いて培養した心筋細胞、ならびにパルミチン酸を含まない培養液を用いて培養した心筋細胞について、IRS−1のセリン部位(Ser636/639及びSer307)のリン酸化をウエスタンブロット法で観察した。
図11に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、IRS−1のセリン部位のリン酸化のバンドは検出されず、IRS−1のセリン部位のリン酸化は確認されなかった。一方、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)においては、IRS−1のセリン部位のリン酸化のバンドが検出され、IRS−1のセリン部位のリン酸化が確認された。このように、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)は、インスリン抵抗性を有することが確認された。さらに、パルミチン酸含有培養液で培養した心筋細胞をペルヘキシリンで前処理すると、IRS−1のセリン部位のリン酸化の度合いが弱くなった。このように、ペルヘキシリンによるインスリン抵抗性の改善効果が確認された。
【0080】
これらのことから、パルミチン酸含有培養液で培養された心筋細胞は、心不全時の心筋細胞代謝改善薬のスクリーニングに有用であることが示された。特に、本スクリーニングにおいては、心筋細胞代謝改善薬の濃度を多段階で設定することができるため、至適用量の決定までに至る時間および費用を大幅に削減することが可能である。
【0081】
以上の結果から、株化された心筋芽細胞を分化誘導した後、心不全患者に起こる血中遊離不飽和脂肪酸の上昇を疑似した培養液、すなわち遊離脂肪酸を含有する培養液中で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞を作製できることが明らかとなった。また、このex vivo心筋細胞は、心不全時の心筋細胞代謝改善薬のスクリーニングに有用であることが明らかとなった。
【産業上の利用可能性】
【0082】
以上説明したように、本発明に係るex vivo心筋細胞の作製方法によれば、心不全の心筋インスリン抵抗性を再現した心筋細胞モデルの形成までの時間を短縮することができ、1回の実験で多種設定の評価が可能になる。さらに、樹立された培養細胞系統から作製しているので、標的タンパク質の過剰発現やノックダウンが容易にできる。そのため、本発明に係るex vivo心筋細胞は、医学研究、創薬開発、および代謝改善薬の効果判定などに広く応用され得る。
【技術分野】
【0001】
本発明は、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞、その作製方法および該心筋細胞を用いた心筋細胞代謝改善薬のスクリーニング方法に関する。
【背景技術】
【0002】
高齢化が加速する中で心不全の患者数も増加の傾向をたどっている。増え続ける患者数と医療費に対して、入院頻度を減らし外来内服治療によって状態を安定化させるような心不全治療法を確立することが望まれている。
【0003】
心不全とは体内の代謝的需要・静脈環流に対して、心臓がそれに見合う十分なポンプ機能を果たすことができない状態を示す。その原因としては虚血性心疾患(狭心症・心筋梗塞)、心臓弁膜症、心筋症、高血圧性心機能障害、心筋炎、先天性心疾患など様々な疾患があげられる。心不全治療ターゲットは病態生理の解明とともに変遷している。かつては心臓の機械的なポンプ不全(収縮不全)が注目され、機械的なポンプ不全に対する強心剤や利尿剤の投与が中心的な治療であった。しかし、1980年代からは神経体液因子との関連が注目され、アンギオテンシンIIの作用を抑制する目的でアンギオテンシン変換酵素阻害剤が投与され始めた。1990年代からは、慢性心不全に対するβ遮断薬の有効性が示され、アポトーシスや心筋リモデリングとの関連性が注目されている。また、近年では心筋細胞自体のエネルギー代謝に注目した心不全治療薬の開発が急がれている。
【0004】
近年の報告では、心不全状態において心筋細胞がインスリン抵抗性(心不全の心筋インスリン抵抗性ともいう)を示し、かつ基礎代謝が変化する。心不全状態における心筋細胞のこのような変化が、心筋細胞のエネルギー代謝の効率を悪化させ、心不全の病態を悪化させる増悪因子であることが示されている(非特許文献1)。つまり、慢性心不全において心筋細胞のインスリン抵抗性はグルコースの代謝を低下させ、遊離脂肪酸の代謝を亢進させる。その結果、約11〜12%の心筋細胞のエネルギー効率低下を起こし、活性酸素やアポトーシスも誘導することによってさらなる病態の悪化を引き起こす(図1)。ここで、心筋インスリン抵抗性は、一般的な生活習慣病やメタボリックシンドロームから生じる全身性のインスリン抵抗性とは異なり、心筋細胞において特異的に生じるものである。心筋細胞代謝改善に注目した臨床研究も報告されており、一定の効果を示している(非特許文献2、非特許文献3)。しかしながら、心臓に特化した糖代謝改善薬剤が存在せず、従来の全身に作用する経口糖尿病薬を代用しているため、メトホルミン(metoformin)では、アシドーシスが生じ、ロシグリタゾン(rosiglitazone)およびピオグリタゾン(pioglitazone)では水分貯留が生じるなどの理由で心不全患者には禁忌とされている。そのため、心筋細胞の代謝改善、つまりインスリン抵抗性の改善に注目した心不全治療の開発と研究が求められている。
【0005】
また、In vitroにおいて心筋細胞の基質代謝を研究しようとする試みも行われている(非特許文献4)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Houman Ashrafian et al., "Metabolic Mechanisms in Heart Failure", Circulation: Jounal of American Heart Association 2007; 116; 434-448
【非特許文献2】Dean T. Eurich, et al., "Improved Clinical Outcomes Associated With Metformin in Patients With Diabetes and Heart Failure", Diabetes care 2005; 28; 2345-2351
【非特許文献3】George G. Sokos et al., "Glucagon-Like Peptide-1 Infusion Improves Left Ventricular Ejection Fraction and Functional Status in Patients With Chronic Heart Failure", Journal of Cardiac Failure 2006; 12 (9); 694-699
【非特許文献4】Mathias Uhlig et al., "Functional role of Rab11 in GLUT4 trafficking in cardiomyocytes", Molecular and Cellular Endocrinology 2005; 235; 1-9
【発明の概要】
【発明が解決しようとする課題】
【0007】
心不全に関する従来のin vivoの基礎研究では、実験動物に対して冠動脈結紮や高頻度ペースメーカー刺激などを用いて機械的に心不全を発生させたり、遺伝子改変動物を用いたりしていた。高頻度ペーシングでは心不全モデル動物の作製に約2週間を要し、Dahl食塩感受性ラットなどの遺伝子改変動物を用いた場合では心不全が発生するまでに約12週間を要する。このように上記方法では、モデル動物の作製に時間がかかるうえ、作成している間にサンプルが死亡してしまうことがしばしばあった。また実際にモデル動物に薬剤を投与して心筋代謝改善薬の効果を判定しようと試みても、全身反応の二次的効果であるのか心筋細胞に特異的な効果であるのかを判定することは困難であった。
【0008】
また、非特許文献4に記載されているように、in vitroに心筋細胞の基質代謝を研究しようとしても、市販の心筋培養細胞(H9c2細胞;ラット心筋芽細胞)は幼若なため、基礎代謝研究の評価が困難であった。すなわち、H9c2細胞においてはインスリン刺激による糖取り込み経路の発現が未成熟であり、H9c2細胞をインスリンで刺激した場合でも該細胞は糖をほとんど取り込まないため、H9c2細胞は、インスリン抵抗性の評価には不適切だった。
【0009】
本発明は、上記の事情を鑑みてなされたものであり、心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明の第1の観点に係る心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞の作製方法は、
株化心筋芽細胞を心筋細胞に分化誘導する工程と、
該心筋細胞を、遊離脂肪酸を含有する培養液で培養する工程と、
を備えることを特徴とする。
【0011】
前記株化心筋芽細胞はH9c2細胞であることが好ましい。
【0012】
前記遊離脂肪酸はパルミチン酸であることが好ましい。
【0013】
前記遊離脂肪酸を含有する培養液中の該遊離脂肪酸の濃度が50μM〜2mMであることが好ましい。
【0014】
前記心筋細胞は、前記遊離脂肪酸を含有する培養液で、6時間〜2日間培養されることが好ましい。
【0015】
前記分化誘導する工程が、
前記株化心筋芽細胞をコンフルエントに達するまで増殖させる工程と、
該増殖させた心筋芽細胞を0.5%〜2%のウシ胎児血清を含有する培養液で培養して、心筋細胞に分化誘導する工程と、
を備えることが好ましい。
【0016】
前記増殖させた心筋芽細胞を、前記ウシ胎児血清を含有する培養液で、3日〜7日間培養することが好ましい。
【0017】
本発明の第2の観点に係る心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞は、上記の第1の観点に係るex vivo心筋細胞の作製方法で作製されることを特徴とする。
【0018】
本発明の第3の観点に係る心不全時の心筋細胞代謝改善薬のスクリーニング方法は、上記の第2の観点に係るex vivo心筋細胞を用いることを特徴とする。
【発明の効果】
【0019】
本発明に係る心筋細胞の作製方法によれば、株化された心筋芽細胞を分化誘導した後、遊離脂肪酸を含有する培養液で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞を作製することができ、心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供することができる。この細胞を利用することにより、心不全時の心筋細胞代謝改善薬を簡易にスクリーニングすることができる。
【図面の簡単な説明】
【0020】
【図1】心不全における代謝悪循環の様子を示す図である。
【図2A】H9c2細胞および1%FBS含有培養液で分化した心筋細胞におけるマイオゲニンのタンパク質発現量を示す図である。
【図2B】H9c2細胞および1%FBS含有培養液で分化した心筋細胞におけるトロポニンTのタンパク質発現量を示す図である。
【図3A】H9c2細胞および1%HS含有培養液で分化した心筋細胞におけるマイオゲニンのタンパク質発現量を示す図である。
【図3B】H9c2細胞および1%HS+10%FBS含有培養液で分化した心筋細胞におけるマイオゲニンのタンパク質発現量を示す図である。
【図4A】H9c2細胞および分化した心筋細胞におけるインスリンレセプター基質1(IRS−1)のタンパク質発現量を示す図である。
【図4B】H9c2細胞および分化した心筋細胞におけるグルコーストランスポーター4(GLUT4)のタンパク質発現量を示す図である。
【図5】H9c2細胞および分化した心筋細胞における、インスリン刺激の有無によるGLUT4の細胞内局在の変化を示す図である。
【図6】H9c2細胞および分化した心筋細胞における、インスリン刺激の有無による2−デオキシグルコースの取り込み量の変化を示す図である。
【図7】分化した心筋細胞における、パルミチン酸処理の有無による2−デオキシグルコースの取り込み量の変化を示す図である。
【図8】分化した心筋細胞における、パルミチン酸処理の有無によるIRS−1およびAktのリン酸化の変化を示す図である。
【図9】分化した心筋細胞における、パルミチン酸処理の有無によるIRS−1のセリン部位のリン酸化の変化を示す図である。
【図10】ペルヘキシリン前処理の有無によるIRS−1およびAktのリン酸化の変化を示す図である。
【図11】ペルヘキシリン前処理の有無によるIRS−1のセリン部位のリン酸化の変化を示す図である。
【発明を実施するための形態】
【0021】
本発明は、心不全時の心筋細胞の基質代謝・エネルギー代謝を簡易に評価するための実験系を提供する。詳細には、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞、その作製方法および該ex vivo心筋細胞を用いた心筋細胞代謝改善薬のスクリーニング方法を提供する。
本発明の発明者らは、株化された心筋芽細胞を、分化誘導(分化用)培養液で培養して心筋細胞に分化させた後に、遊離脂肪酸含有培養液で培養することにより、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞が得られることを見出して本発明を完成させたものである。
【0022】
(1.心筋芽細胞および心筋細胞)
本明細書において「株化心筋芽細胞」、「株化された心筋芽細胞」とは、自己増殖能を有し、心筋細胞に分化するよう方向付けられた細胞であり、心筋細胞に比べて未分化な細胞である。株化心筋芽細胞では、後述する心筋細胞に特異的なタンパク質がほとんど検出されない又はその存在量が分化した心筋細胞に比べて低い状態にある。また、株化心筋芽細胞はインスリン刺激による糖の細胞内取り込みの機能を有さない又は分化した細胞に比べて低い状態にある。
【0023】
本発明で用いる株化心筋芽細胞は、種々の動物、例えば鳥類又は哺乳動物由来の心筋芽細胞から樹立される株化心筋芽細胞であれば特に制限はなく、すでに樹立された心筋芽細胞株の他、動物から単離した心筋芽細胞を公知の方法を用いて株化することによって新たに樹立される細胞株であってもよい。例えば、ラット、ヒト、サル、マウス、ブタ、ウシ又はニワトリ等に由来する株化心筋芽細胞を用いることができる。
【0024】
株化心筋芽細胞としては、好ましくは、ラット心臓由来のH9c2細胞(ATCC番号CRL−1446)が挙げられる。これは米国American Type Culture Collection(ATCC)より入手することができる。また、ラット心房筋由来のHL−1細胞、ヒト心臓由来のAC16細胞、心筋細胞に分化しやすいES細胞であるP19CL6細胞も利用可能である。
【0025】
本明細書において「心筋細胞」とは、株化心筋芽細胞を分化誘導して作製した細胞であり、心筋芽細胞と比較して心室筋の細胞に特異的なタンパク質発現が亢進し、インスリン刺激による糖取り込みの亢進した細胞である。このため、株化心筋芽細胞を分化誘導することによって得られた細胞は、分化する前の株化心筋芽細胞と比べ心筋細胞により近い性質を有している。
【0026】
心筋細胞に特異的なタンパク質およびその検出方法は、適宜選択することができる。心筋細胞に特異的なタンパク質(分化マーカー)としては、マイオゲニン(myogenin)、トロポニンT(Troponin T)、トロポニンIおよびミオシン軽鎖、といった筋原性タンパク質などが挙げられる。特異的なタンパク質の検出方法としては、公知の生化学的または免疫化学的な方法を用いることができる。特に制限されないが、分化マーカーに特異的な標識抗体を用いる方法(染色法、フローサイトメトリー、ELISAなど)、RT−PCR法、ハイブリダイゼーション解析などが挙げられる。分化マーカーに特異的な抗体は市販されており、容易に使用することができる。
【0027】
(2.細胞培養)
上記の株化心筋芽細胞を増殖用培養液で培養する。増殖用培養液は、株化心筋芽細胞を培養するために一般的に用いられている培養液であれば、特に限定されるものではない。例えば、血清を添加したDMEM(Dulbecco’s modified Eagle’s medium)培養液を用いることができる。血清としては、ウシ胎児血清(fetal bovine serum,FBS)、ウマ血清(horse serum,HS)などを用いることができる。好ましくは、FBSを用いる。血清濃度は、約5%〜約15%であることが好ましく、約10%であることがより好ましい。また、株化心筋芽細胞を増殖させることができれば、適当な増殖因子等を含有する無血清培養液を用いることができる。
【0028】
増殖用培養液には、株化心筋芽細胞を培養するために一般的に用いられる抗生物質を添加することができる。例えば、100U/mLのペニシリンおよび/または100μg/mLのストレプトマイシンを添加することができる。また、ファンギゾン(1%fungizone)等の抗真菌剤を添加してもよい。本発明に用いられる増殖用培養液は、さらに他の成分を含むことができる。例えば、1mM〜3mMのグルタミンおよび0.5mM〜2mMのピルビン酸を含むことができる。
【0029】
このような増殖用培養液を用いて、心筋芽細胞をコンフルエント、つまりほぼ100%のconfluenceの状態になるまで単層培養する。培養条件は、心筋芽細胞を培養するための公知の条件を採用することができる。例えば、約5%CO2存在下、約37℃で、3日〜7日間、細胞を培養する。
【0030】
なお、H9c2細胞は、継代回数が10から20の細胞を使用すると、後述する心筋細胞への分化誘導において、安定した分化が誘導でき、通常は分化用培養液に交換して3日間以上の培養によって心筋細胞に近い性質をもつことができる。
【0031】
(3.心筋細胞への分化誘導)
続いて、上述のように増殖培養した細胞を分化用培養液中で培養する。
分化用培養液は、分化心筋芽細胞を心筋細胞に分化させることができる組成であればよく、所定の濃度の血清を含有するDMEM培養液を用いることができる。安定した分化のためには、増殖用培養液よりも低濃度の血清を含有することが好ましい。
具体的には、分化用培養液中の好ましい血清濃度は約0.1%〜約15%である。血清濃度が0.1%より低いと細胞障害性が認められ、15%より高いと分化させることが困難となる。またより安定した分化のためには、約0.5%〜約2%の血清濃度であることがより好ましい。さらに好ましくは約1%である。
分化用培養液に含まれる血清としては、ウシ胎児血清(FBS)、ウマ血清(HS)などを用いることができる。また、これらを組み合わせて用いてもよい。なお、後続するパルミチン酸負荷工程における細胞障害の観点から、FBSを用いることがより好ましい。
本発明における分化用培養液としては、例えば、1%FBS、1%HS、または1%HS+10%FBSを含有するDMEM培養液を用いることができる。
【0032】
分化用培養液には、心筋芽細胞を培養するために一般的に用いられている抗生物質を添加することができる。例えば、100U/mLのペニシリンおよび/または100μg/mLのストレプトマイシンを添加することができる。また、ファンギゾン(1%fungizone)等の抗真菌剤を添加してもよい。本発明に用いられる分化用培養液は、さらに他の成分を含むことができる。例えば、1mM〜3mMのグルタミンおよび0.5mM〜2mMのピルビン酸を含むことができる。
【0033】
このような分化用培養液中で、約5%CO2、約37℃の条件下で、3日間以上、心筋芽細胞を培養する。培養液の種類によっても異なるが、好ましくは約3日〜7日間培養する。なお、3日間より長く培養する場合は、2〜3日毎に新鮮な培養液に交換することが好ましい。これにより、心筋芽細胞は心筋細胞に近い性質を有する細胞に分化誘導される。分化用培養液中での培養期間が3日間より短いと分化が十分でなく、7日間より長いと細胞障害性を示す傾向があり、パルミチン酸負荷工程で細胞障害が認められる可能性が高くなる。
【0034】
(4.糖代謝能の評価)
株化心筋芽細胞を分化誘導することにより得られた心筋細胞では、後述する実施例に示すように、分化前の心筋芽細胞に比べてインスリンレセプター基質1(Insulin Receptor substrate−1:IRS−1)およびグルコーストランスポーター4(GLUT4)の発現が亢進している。IRS−1は、インスリンシグナル経路のタンパク質の一つである。また、GLUT4は、インスリンに応答してグルコースを細胞内に取り込むグルコーストランスポーターである。IRS−1およびGLUT4の発現は、標識抗体を用いる方法(染色法、フローサイトメトリー、ELISAなど)、酵素活性を利用した染色法、RT−PCR法およびハイブリダイズ解析などにより確認することができる。
【0035】
インスリンシグナル伝達においては、細胞外に存在するインスリンがインスリンレセプターと結合することにより、細胞内へのグルコース取り込みを開始させるシグナル伝達が開始される。
まず、インスリンがインスリンレセプターと結合すると、内在するチロシンキナーゼが活性化され、インスリンレセプターは自己リン酸化される。そのリン酸化チロシンにIRS−1が結合し,このIRS−1がリン酸化される。リン酸化されたIRS−1はホスファチジルイノシトール−3−キナーゼ(PI−3キナーゼ)に結合しPI−3キナーゼを活性化する。活性化されたPI−3キナーゼはさらにプロテインキナーゼB(PKB)を細胞膜に引き寄せ、PKBを活性化する。活性化されたPKBはGLUT4を細胞膜表面に移動させる。細胞膜表面に移動したGLUT4を介してグルコースが細胞内に取り込まれる。
このように、インスリン刺激に応じてGLUT4が細胞膜表面に移動し、グルコース取り込み能(糖代謝能)が亢進することを「インスリン応答性」という。
【0036】
本発明に係る分化後の心筋細胞では、後述する実施例に示すように、インスリン刺激によってGLUT4が細胞膜表面に移動し、かつ分化前の心筋芽細胞に比べてグルコースの取り込みが亢進している。一方、未分化の心筋芽細胞では、GLUT4の発現が低く、インスリン刺激によるGLUT4の細胞膜表面への移動は認められない。また、未分化の心筋芽細胞では、インスリン刺激によるグルコース取り込みの亢進は認められない。
このように、株化心筋芽細胞を分化誘導することにより得られる心筋細胞は、インスリンシグナル経路に関するタンパク質の発現が亢進し、インスリン応答性を示す。従って、株化心筋芽細胞を分化誘導することにより得られる心筋細胞は、より心筋細胞に近いグルコース代謝能を有する。
【0037】
インスリン刺激は、インスリン(0.1nM〜1μM)を用いて、心筋芽細胞および分化後の心筋細胞を1分〜30分間インキュベートすることによって行うことができる。負荷するインスリンの濃度は、分化後の心筋細胞がインスリン応答性を示す濃度であればよい。好ましくは0.1nM〜1μM、より好ましくは10nM〜100nM、さらに好ましくは100nMである。インスリン刺激に用いるインスリン含有液は、例えば、HEPES−PBS(リン酸緩衝生理食塩水)またはKreb Ringer phosphate(KRP)バッファー等にインスリンを溶解することによって調整することができるが、これに限定されるものではない。
【0038】
インスリン刺激によるGLUT4の細胞膜表面への移動を評価する方法は、タンパク質の細胞内局在を評価することができる方法であれば、特に限定されない。例えば免疫染色法を用いてGLUT4の細胞内分布を観察することによって評価することができる。具体的には、細胞をカバーガラス上で一晩培養し、PBSで洗浄後、4%パラホルムアルデヒド−PBS溶液で細胞をガラス上に固定する。このガラスをジギトニン(100μg/mL)含有PBSに浸し、PBSで洗浄後、GLUT4に特異的な一次抗体を添加し、インキュベートする。PBSで洗浄後、一次抗体に対する蛍光標識二次抗体を添加し、インキュベートする。PBSで洗浄後、封入剤を滴下したスライドガラス上に、処理したカバーガラスを反転して載せる。このように染色した細胞を、蛍光顕微鏡や共焦点レーザー顕微鏡などを用いて観察することにより、GLUT4が細胞膜表面に移動したかどうかを評価することができる。
【0039】
グルコースの取り込み能は、培養液中に添加したグルコースの減少量を測定する方法、放射能ラベルしたグルコースもしくはグルコース類似化合物(例えば2−デオキシグルコース(2−DG))を用いて細胞内の放射能を測定する方法、または蛍光標識したグルコースもしくはグルコース類似化合物を用いて細胞内の蛍光を検出する方法などによって評価することができるが、これに限定されるものではない。
【0040】
他のインスリン応答性の評価方法として、例えば、インスリン刺激によって分化後の心筋細胞のインスリンシグナル伝達に関わるタンパク質(例えば、IRS−1、プロテインキナーゼB(Akt)等)がリン酸化されていることを確認する方法等がある。
【0041】
(5.インスリン抵抗性の付与)
上述のように分化された心筋細胞を、遊離脂肪酸を含有する培養液で培養することにより、該心筋細胞にインスリン抵抗性を付与することができる。
本明細書において「インスリン抵抗性」とは、インスリン刺激されても、細胞が上述したインスリン応答性を示さなくなることをいう。つまり、インスリン抵抗性を示す心筋細胞では、該心筋細胞を、インスリンを含有する培養液中でインキュベートしても、GLUT4が細胞膜表面へ移動せず、グルコース取り込み量も増加しない。
【0042】
本発明に用いられる遊離脂肪酸は特に限定されないが、オレイン酸、パルミチン酸、ステアリン酸、リノール酸、リノレン酸などを含む。好ましくはパルミチン酸、ステアリン酸である。培養液中の遊離脂肪酸の濃度は、50μM〜2mMであることが好ましい。より好ましくは、100μM〜400μMであり、さらに好ましくは、200μMである。培養液中の遊離脂肪酸の濃度が50μMよりも高い場合、負荷された心筋細胞は十分なインスリン抵抗性を示す。また、培養液中の遊離脂肪酸の濃度が2mMよりも低い場合、心筋細胞に対する細胞障害性が低減され、遊離脂肪酸を負荷していない細胞に比べて細胞数が減少する可能性が低くなるため、インスリン抵抗性の評価に適する。
【0043】
遊離脂肪酸を含む培養液には、上述する増殖用培養液を用いることができるが、これに限定されるものではない。
培養条件は、心筋細胞を培養するための公知の条件を採用することができる。例えば、約5%CO2存在下、約37℃で細胞を培養する。培養時間は、心筋細胞にインスリン抵抗性を付与することができる条件であればよい。培養時間は、負荷する遊離脂肪酸の培養液中の濃度によっても異なるが、好ましくは6時間〜48時間、より好ましくは12時間〜36時間、さらに好ましくは24時間である。6時間より長いと、心筋細胞は十分なインスリン抵抗性を示すようになり、48時間より短いと、心筋細胞に対する細胞障害性が低減され、遊離脂肪酸を負荷していない細胞に比べて細胞数が減少する可能性が低くなる。
【0044】
遊離脂肪酸を含有する培養液は、例えば、次のように調製することができる。
パルミチン酸を、40℃〜50℃に温めた0.1N NaOH溶液に溶解させる。このパルミチン酸溶液を12%BSA含有培養液(Dulbecco’s modified Eagle’s medium with BSA)に加え、パルミチン酸濃度が2mMになるように希釈して保存する。この2mMパルミチン酸−BSA含有培養液と、増殖用培養液を1:10で混合することにより、FFA(free fatty acid)培養液(200μM)を調製することができる。
【0045】
このように調製したFFA培養液中で心筋細胞を培養することによって、該心筋細胞をインスリン含有培養液で培養しても、GLUT4は細胞膜表面へは移動せず、グルコース取り込みも亢進しない。つまり心筋細胞は、インスリン抵抗性を示すようになる。インスリン抵抗性が付与されたことは、上述したGLUT4の細胞内局在を観察する方法および/またはグルコースの取り込み能の評価方法と同様にして確認することができる。また、インスリン抵抗性が付与されたことは、例えば、心筋細胞のインスリンシグナル伝達に関わるタンパク質(例えば、IRS−1、Akt等)のリン酸化抑制を観察する方法、心筋細胞のIRS−1のセリン部位(例えば、Ser636/Ser639)が過剰にリン酸化されていることを観察する方法(インスリン抵抗性の原因の一つとして、IRS−1のセリン部位の過剰なリン酸化が挙げられる)等によっても確認することができる。
【0046】
(6.心不全時の心筋細胞代謝改善薬のスクリーニング)
上述するように作製されたex vivo心筋細胞は、インスリン抵抗性を再現している。そのため、該心筋細胞を利用して、心不全時の心筋細胞の代謝改善薬を簡易にスクリーニングすることができる。
スクリーニングされる代謝改善薬としては、インスリン抵抗性の改善薬(GLP−1受容体作動薬であるリラグルチド、DPP4拮抗剤であるシタグリプチリン酸塩水和物、ビグアナイド薬、グリタゾン類など)、脂肪酸代謝阻害剤(例えばperhexiline、trimetazidine)などが挙げられる。
【0047】
具体的には、まず、上述のように作製したex vivo心筋細胞を、被検化合物である代謝改善候補薬を添加した培養液でインキュベートする。なお、代謝改善候補薬とのインキュベートの条件は、該代謝改善薬の種類や効果・効能に応じて適宜設定することができる。例えば、5%CO2存在下、37℃で、1時間〜24時間インキュベートしてもよい。また、代謝改善候補薬を添加する培養液は、上述した増殖用培養液を用いてもよく、さらにパルミチン酸などの遊離脂肪酸を含有してもよい。
その後、該心筋細胞の糖代謝能を評価し、例えばインスリン抵抗性が低減または消失すれば、添加した被検化合物は、心不全時に認められる心筋細胞のインスリン抵抗性の改善に有効であると判断することができる。
細胞の糖代謝能は、上述した「4.糖代謝能の評価」に記載した方法を用いて評価することができる。糖代謝能は、GLUT4の細胞膜表面への移行の有無を観察することによって評価してもよく、細胞へのグルコースなどの糖取り込み量を測定することによって評価してもよい。また、その両方によって評価してもよい。さらに、細胞の糖代謝能は、例えば、細胞のインスリンシグナル経路に関わるタンパク質(例えば、IRS−1、プロテインキナーゼB(Akt)等)がリン酸化されていることを観察する方法、細胞のIRS−1のセリン部位(例えば、Ser636/Ser639)の過剰なリン酸化のキャンセルを観察する方法等によっても確認することができる。
【0048】
上述したように、株化された心筋芽細胞を分化誘導した後、心不全患者に起こる血中遊離不飽和脂肪酸の上昇を疑似した培養液、すなわち遊離脂肪酸を含有する培養液中で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞を作製することができる。これにより、心不全時の心筋細胞の基質代謝・エネルギー代謝を評価するための実験系を提供することができる。また、本発明に係る心筋細胞を利用することにより、心筋細胞を標的とした様々な薬剤、例えば、インスリン抵抗性改善薬および糖取込亢進薬といった代謝改善薬、を従来の実験動物等を用いた方法と比較して簡易にスクリーニングすることができる。
【0049】
以下、実施例を用いて本発明をより詳細に説明するが、実施例は本発明を限定するものでない。
【実施例】
【0050】
(心筋細胞への分化誘導)
(1.1%FBS)
市販のH9c2細胞(ATCC番号CRL−1446)をシャーレに約20万〜40万/10cmディッシュで播種し、10mLの増殖用培養液(Dulbecco’s modified Eagle’s medium(Invitrogen,カタログ番号10313),10%FBS(Invitorogen,カタログ番号10473),2mMグルタミン(Invitrogen,カタログ番号25030),1mMピルビン酸(Sigma,カタログ番号P2256),100U/mLペニシリン+100μg/mLストレプトマイシン(BioWhittaker,カタログ番号17−603E))中で、5%CO2存在下、37℃で、100%confluenceになるまで培養した。なお、H9c2細胞は、継代回数が10から20の細胞を用いた。
【0051】
H9c2細胞が100%confluenceになった時点で分化用培養液(低血清培養液:Dulbecco’s modified Eagle’s medium,1%FBS,2mMグルタミン,1mMピルビン酸,100U/mLペニシリン+100μg/mLストレプトマイシン)に交換して細胞をさらに3日〜14日間培養して分化を誘導した。なお、2〜3日毎に新鮮な分化用培養液に交換した。
【0052】
分化誘導された細胞が、心筋細胞に近い性質を有していることを確認するために、筋原性タンパク質であるマイオゲニンおよびトロポニンTのタンパク質発現量をウエスタンブロット法により評価した。なお、分化誘導された細胞は、分化用培養液で3,5,7,10および14日間培養した細胞を用いた。ウエスタンブロット法は、常法に従って行った。
【0053】
具体的には、細胞溶解剤(Cell Lysis Buffer)を使って心筋細胞の全タンパク質サンプルを溶解し抽出した。そのサンプルをSDS−ポリアクリルアミドゲルを用いて100Vで約1時間の電気泳動を行った。電気泳動によって分離されたタンパク質を電場によってニトロセルロース膜に移した。室温にて24時間、目的とするタンパク質の一次特異抗体(マイオゲニン抗体(Santa Cruz Biotechnology社,カタログ番号sc52903)、トロポニンT抗体(Santa Cruz Biotechnology社,カタログ番号sc52282))溶解溶液に浸した。ニトロセルロース膜の一次抗体をよく洗い落としてから、一次抗体の動物種に従ったHRP標識二次抗体(Anti mouse IgG HRP抗体(Promega,カタログ番号W402B))の溶解溶液に約1時間浸した。HRPによって発光する発光試薬を用いて目的とするタンパク質を標識し、ルミノメーター検出機(FUJIFILM,LAS3000mini)によって撮像した。
【0054】
図2Aに示すように、未分化なH9c2細胞では、マイオゲニンのバンドはほとんど検出されなかった。一方、分化誘導された細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいてもマイオゲニンのバンドが検出された。分化後の細胞におけるマイオゲニンのバンド強度は、分化前のH9c2細胞に比べて4倍以上であった。
また、図2Bに示すように、トロポニンTについても、未分化なH9c2細胞では、ほとんどバンドが認められないのに対し、分化後の細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいても、トロポニンTのバンドが検出された。分化後の細胞におけるトロポニンTのバンド強度は、分化前のH9c2細胞に比べて3倍以上であった。
このように、H9c2細胞を分化誘導することにより得られた細胞は、筋原性タンパク質の発現が分化前に比べて亢進し、未分化なH9c2細胞と比べ心筋細胞により近い性質を有し、心筋細胞に分化したことが確認された。
【0055】
(2.1%HS)
上記と同様に、100%confluenceの状態になったH9c2細胞を、分化用培養液(Dulbecco’s modified Eagle’s medium,1%HS,2mMグルタミン,1mMピルビン酸,100U/mLペニシリン+100μg/mLストレプトマイシン)に交換して細胞をさらに5日〜14日間培養して分化を誘導した。なお、2〜3日毎に新鮮な分化用培養液に交換した。
【0056】
分化誘導された細胞が、心筋細胞に近い性質を有していることを確認するために、筋原性タンパク質であるマイオゲニンの発現量をウエスタンブロット法により上記と同様に評価した。図3Aに示すように、未分化なH9c2細胞に比べて、5日〜10日間分化誘導された細胞では、マイオゲニンのバンドがより強く検出された。
【0057】
(3.1%HS+10%FBS)
上記と同様に、100%confluenceの状態になったH9c2細胞を、分化用培養液(Dulbecco’s modified Eagle’s medium,1%HS,10%FBS,2mMグルタミン,1mMピルビン酸,100U/mLペニシリン+100μg/mLストレプトマイシン)に交換して細胞をさらに5日〜14日間培養して分化を誘導した。なお、2〜3日毎に新鮮な分化用培養液に交換した。
【0058】
分化誘導された細胞が、心筋細胞に近い性質を有していることを確認するために、筋原性タンパク質であるマイオゲニンの発現量をウエスタンブロット法により上記と同様に評価した。図3Bに示すように、未分化なH9c2細胞に比べて、分化誘導された細胞では、マイオゲニンのバンドがより強く検出された。
【0059】
以上の結果から、分化用培養液に含まれる血清が1%FBS、1%HS、または1%HS+10%FBSの何れの条件においても、H9c2細胞は心筋細胞に分化誘導されて、心筋細胞に特異的なタンパク質を発現することが明らかとなった。そこで、以下の評価では、1%FBSの血清を含有する分化用培養液を用いて分化誘導させた心筋細胞を用いた。
【0060】
(分化後の心筋細胞の糖代謝能の評価)
次に、分化後の心筋細胞の糖代謝能について評価した。
【0061】
分化後の心筋細胞におけるIRS−1およびGLUT4の発現が亢進しているかどうかをウエスタンブロット法により評価した。
具体的には、上記のマイオゲニンおよびトロポニンTの発現量を検出したウエスタンブロット法と同様の方法で行った。なお、一次抗体としては、マイオゲニン抗体およびトロポニンT抗体の代わりにIRS−1抗体(Cell Signaling Technology社,カタログ番号2382S)およびGLUT4抗体(Santa Cruz Biotechnology社,カタログ番号sc1608)を用いた。
【0062】
図4Aに示すように、未分化なH9c2細胞では、IRS−1のバンドはほとんど検出されなかった。一方、分化誘導された心筋細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいてもIRS−1のバンドが検出され、分化後の心筋細胞におけるIRS−1のバンド強度は、分化前のH9c2細胞に比べて約1.2〜1.4倍であった。
【0063】
また、図4Bに示すように、未分化なH9c2細胞では、GLUT4のバンドはほとんど検出されなかった。一方、分化誘導された心筋細胞では、分化用培養液で培養して3,5,7,10および14日後のいずれにおいてもGLUT4のバンドが検出された。分化後の心筋細胞におけるGLUT4のバンド強度は、分化前のH9c2細胞に比べて約2倍であった。
【0064】
このように、H9c2細胞を分化誘導することにより、インスリンシグナル経路に関連するタンパク質の発現が亢進することが確認された。
なお、分化用培養液で10日間以上培養した細胞は、3日〜7日間培養した細胞に比べて、細胞障害性を示す傾向が認められた。そこで、以下の評価では、1%FBSの血清を含有する分化用培養液を用いて約5日間分化誘導させた心筋細胞を用いた。
【0065】
(インスリン応答性)
次に、分化後の心筋細胞のインスリン応答性について評価した。
分化後の心筋細胞および未分化なH9c2細胞を、スライド、カバーガラス、または光学用プラスチック支持体の上で培養し、それぞれ100nMのインスリンを含有するHEPES−PBS溶液(インスリン含有溶液)、およびインスリンを含有しない溶液(インスリン非含有溶液;対照)中で30分間インキュベートした。インキュベーションは、5%CO2存在下、37℃で行った。
【0066】
インスリン含有および非含有溶液でそれぞれインキュベートした心筋細胞におけるGLUT4の細胞内局在を免疫染色法によって観察した。具体的には、分化後の心筋細胞および未分化なH9c2細胞を、それぞれ100nMでインスリンを含有する溶液中、および含有しない溶液(対照)中で30分間インキュベート(5%CO2、37℃)し、30分経過した時点で4℃にしてインスリンの反応を停止させた。その後、細胞固定液(4%パラホルムアルデヒド)に15分間静置して、細胞を固定した。固定した細胞に対しジギトニン(100μg/mL)を用いて透過処理を行った。これにより、細胞膜の透過性を亢進させ、目的とするタンパク質と一次抗体が接触できるようにする。透過処理した細胞に抗GLUT4ポリクローナル抗体(Santa Cruz Biotechnology社,カタログ番号sc−1608、希釈濃度1:500)を溶解させた1%BSA−PBS溶液(BSA:Sigma、PBS:Invitrogen)を加えて室温で1時間静置した。一次抗体を1%BSA−PBS溶液でよく洗い流したあとで、蛍光標識された二次抗体(Alexa Fluor(登録商標)488結合ウサギ抗ヤギ抗体;Molecular Probes社,カタログ番号A11078)を溶解した溶液に浸して室温で30分静置した。できあがったサンプルは蛍光顕微鏡(または共焦点レーザー顕微鏡)によって観察した。
【0067】
図5はインスリン処理した心筋細胞におけるGLUT4の細胞内局在を示す免疫染色写真である。図中、「N」は核を、矢印の「PM」は細胞膜を示す。図5に示すように、未分化なH9c2細胞では、培養液中のインスリンの有無によるGLUT4の細胞内局在の違いは認められなかった。一方、分化後の心筋細胞では、培養液中にインスリンを含まない場合、GLUT4は細胞質全体に広がって局在しているのに対し、インスリン含有溶液で処理した場合、GLUT4は細胞膜上に局在していることが観察された。
【0068】
次に、分化後の心筋細胞を、上記と同様にインスリン含有溶液で培養し、そのグルコース取り込み能について評価した。
分化後の心筋細胞および未分化なH9c2細胞をそれぞれ、0,1,10および100nMのインスリンと、1μCi/mLの三重水素(3H Tritium)で標識された2−デオキシグルコース(日本パーキンエルマー社,カタログ番号NET549A)とを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、心筋細胞中に取り込まれた三重水素の放射活性を、液体シンチレーションカウンターを用いて測定し、細胞に取り込まれた2−デオキシグルコース量を比較した。
【0069】
図6は、それぞれの細胞をインスリン無添加の溶液中でインキュベートした場合(CTL)のグルコース取り込み量を1としたときの、インスリン含有溶液中でインキュベートした場合のグルコース取り込み量を示す。図6に示すように、未分化なH9c2細胞では、いずれのインスリン濃度下においてもグルコースの取り込み能の亢進は認められなかった。一方、分化後の心筋細胞では、溶液中に含まれるインスリン濃度に応じてグルコース取り込み量が亢進していた。
【0070】
このように分化後の心筋細胞では、インスリン刺激によりGLUT4が細胞膜へ移行し、グルコース取り込み能が亢進した。従って、H9c2細胞から分化誘導することによって得られた心筋細胞は、インスリン応答性を獲得していることが明らかとなった。
【0071】
(インスリン抵抗性の付与)
上述のように分化誘導することによって得られた心筋細胞を、パルミチン酸含有培養液を用いて、5%CO2存在下、37℃で、約24時間培養した。対照として、分化後の心筋細胞を、パルミチン酸を含まない増殖用培養液で同様に培養した。
【0072】
パルミチン酸含有培養液は、次のように調製した。まず、約40〜50℃に温めた0.1N NaOH溶液にパルミチン酸を溶解させた。このパルミチン酸溶液を12%BSA含有培養液(Dulbecco’s modified Eagle’s medium with BSA)に加え、パルミチン酸濃度が2mMになるように希釈した。この2mMパルミチン酸−BSA含有培養液と増殖用培養液とを1:10で混合し、200μMのパルミチン酸を含有するパルミチン酸含有培養液とした。
【0073】
このようにパルミチン酸含有培養液で培養した心筋細胞のグルコース取り込み能を評価した。
パルミチン酸含有培養液で培養した心筋細胞、およびパルミチン酸を含まない培養液で培養した心筋細胞をそれぞれKRPバッファーで洗浄し、0,1,10および100nMのインスリンと1μCi/mLの三重水素(3H Tritium)で標識された2−デオキシグルコース(日本パーキンエルマー社,NET549A)とを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、心筋細胞中に取り込まれた三重水素の放射活性を、液体シンチレーションカウンターを用いて測定し、2−デオキシグルコースの取り込みを評価した。
図7に示すように、パルミチン酸を含まない培養液で培養した心筋細胞は、インスリン刺激により、そのグルコース取り込み量が亢進することが確認された。一方、パルミチン酸含有培養液中で培養した心筋細胞は、インスリン刺激によってもそのグルコース取り込み量が亢進しなかった。このように、パルミチン酸含有培養液で培養された心筋細胞は、インスリン抵抗性を示すことが明らかとなった。
【0074】
パルミチン酸含有培養液で培養した心筋細胞へのインスリン抵抗性付与ついてさらに確認するために、細胞のIRS−1およびプロテインキナーゼB(Akt)のリン酸化、ならびにIRS−1のセリン部位のリン酸化について観察した。
【0075】
前述と同様にパルミチン酸含有培養液で培養した心筋細胞、およびパルミチン酸を含まない培養液で培養した心筋細胞をそれぞれKRPバッファーで洗浄し、0nMおよび100nMのインスリンを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、IRS−1およびAktのリン酸化について、ウエスタンブロット法で観察した。
図8に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、インスリン刺激によりIRS−1およびAktのリン酸化のバンドがより強く検出され、IRS−1およびAktの両方がリン酸化されたことが確認された。一方、パルミチン酸含有培養液で培養した心筋細胞においては、インスリン刺激によってもIRS−1およびAktのリン酸化のバンドにほとんど変化は見られず、IRS−1およびAktの両方でリン酸化が抑制されていることが確認された。このように、パルミチン酸含有培養液で培養した心筋細胞では、インスリンシグナリング反応が低下していることが示唆された。
【0076】
前述と同様にパルミチン酸含有培養液で培養した心筋細胞、およびパルミチン酸を含まない培養液で培養した心筋細胞について、IRS−1のセリン部位(Ser636/639)のリン酸化をウエスタンブロット法で観察した。
図9に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、IRS−1のセリン部位のリン酸化のバンドはほとんど検出されず、IRS−1のセリン部位のリン酸化は確認されなかった。一方、パルミチン酸含有培養液で培養した心筋細胞においては、IRS−1のセリン部位のリン酸化のバンドが強く検出され、IRS−1のセリン部位のリン酸化が確認された。このように、パルミチン酸含有培養液で培養した心筋細胞は、インスリン抵抗性を有することが示唆された。
これらのことから、パルミチン酸含有培養液で培養された心筋細胞がインスリン抵抗性を示すことがさらに明らかとなった。
【0077】
(心筋細胞代謝改善薬のスクリーニング)
パルミチン酸含有培養液で培養された心筋細胞が心不全時の心筋細胞代謝改善薬のスクリーニングに有用であるかについて、Perhexiline Maleate(マレイン酸ペルヘキシリン)(シグマ社,P3028)(以下、ペルヘキシリンという)を用いて検証した。ペルヘキシリンは狭心症薬として開発された薬剤であり、ミトコンドリアの脂質取り込みを制御するカルニチンパルミチン酸トランスフェラーゼ(CPT)−1を阻害することにより心筋細胞の代謝を改善させると考えられている。この検証は、細胞のIRS−1およびAktのリン酸化、ならびにIRS−1のセリン部位のリン酸化を観察することで行った。
【0078】
上述のように分化誘導することによって得られた心筋細胞を、0,0.1,1,2および5μMのペルヘキシリンを含有する、前述と同様のパルミチン酸含有培養液を用いて、5%CO2存在下、37℃で、約24時間培養した。対照として、分化後の心筋細胞を、パルミチン酸を含まない増殖用培養液で同様に培養した。それぞれの細胞をKRPバッファーで洗浄し、100nMのインスリンを含有するKRPバッファー溶液中で、5%CO2存在下、37℃で15分間インキュベートした。その後、IRS−1およびAktのリン酸化をウエスタンブロット法で観察した。
図10に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、インスリン刺激によるIRS−1およびAktのリン酸化のバンドが検出され、IRS−1およびAktの両方でリン酸化が確認された。一方、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)のIRS−1およびAktのリン酸化のバンドは、パルミチン酸を含まない培養液で培養した心筋細胞のそれに比して、弱く検出され、IRS−1およびAktの両方でリン酸化が抑制されていることが確認された。このように、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)においては、インスリンシグナリング反応が阻害されていることが確認された。さらに、パルミチン酸含有培養液で培養した心筋細胞をペルヘキシリンで前処理すると、ペルヘキシリンの用量依存的にIRS−1およびAktのリン酸化の度合いが強くなった。このように、インスリンシグナリング反応阻害において、ペルヘキシリンによる用量依存的な改善効果が確認された。
【0079】
前述と同様のパルミチン酸含有培養液(0,0.1,1,2および5μMのペルヘキシリンを含有する)を用いて培養した心筋細胞、ならびにパルミチン酸を含まない培養液を用いて培養した心筋細胞について、IRS−1のセリン部位(Ser636/639及びSer307)のリン酸化をウエスタンブロット法で観察した。
図11に示すように、パルミチン酸を含まない培養液で培養した心筋細胞においては、IRS−1のセリン部位のリン酸化のバンドは検出されず、IRS−1のセリン部位のリン酸化は確認されなかった。一方、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)においては、IRS−1のセリン部位のリン酸化のバンドが検出され、IRS−1のセリン部位のリン酸化が確認された。このように、パルミチン酸含有培養液で培養した心筋細胞(ペルヘキシリン濃度0μM)は、インスリン抵抗性を有することが確認された。さらに、パルミチン酸含有培養液で培養した心筋細胞をペルヘキシリンで前処理すると、IRS−1のセリン部位のリン酸化の度合いが弱くなった。このように、ペルヘキシリンによるインスリン抵抗性の改善効果が確認された。
【0080】
これらのことから、パルミチン酸含有培養液で培養された心筋細胞は、心不全時の心筋細胞代謝改善薬のスクリーニングに有用であることが示された。特に、本スクリーニングにおいては、心筋細胞代謝改善薬の濃度を多段階で設定することができるため、至適用量の決定までに至る時間および費用を大幅に削減することが可能である。
【0081】
以上の結果から、株化された心筋芽細胞を分化誘導した後、心不全患者に起こる血中遊離不飽和脂肪酸の上昇を疑似した培養液、すなわち遊離脂肪酸を含有する培養液中で培養することによって、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞を作製できることが明らかとなった。また、このex vivo心筋細胞は、心不全時の心筋細胞代謝改善薬のスクリーニングに有用であることが明らかとなった。
【産業上の利用可能性】
【0082】
以上説明したように、本発明に係るex vivo心筋細胞の作製方法によれば、心不全の心筋インスリン抵抗性を再現した心筋細胞モデルの形成までの時間を短縮することができ、1回の実験で多種設定の評価が可能になる。さらに、樹立された培養細胞系統から作製しているので、標的タンパク質の過剰発現やノックダウンが容易にできる。そのため、本発明に係るex vivo心筋細胞は、医学研究、創薬開発、および代謝改善薬の効果判定などに広く応用され得る。
【特許請求の範囲】
【請求項1】
株化心筋芽細胞を心筋細胞に分化誘導する工程と、
該心筋細胞を、遊離脂肪酸を含有する培養液で培養する工程と、
を備える、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞の作製方法。
【請求項2】
前記株化心筋芽細胞がH9c2細胞である、ことを特徴とする請求項1に記載の作製方法。
【請求項3】
前記遊離脂肪酸がパルミチン酸である、ことを特徴とする請求項1または2に記載の作製方法。
【請求項4】
前記遊離脂肪酸を含有する培養液中の該遊離脂肪酸の濃度が50μM〜2mMである、ことを特徴とする請求項1乃至3のいずれか1項に記載の作製方法。
【請求項5】
前記心筋細胞は、前記遊離脂肪酸を含有する培養液で、6時間〜2日間培養される、ことを特徴とする請求項1乃至4のいずれか1項に記載の作製方法。
【請求項6】
前記分化誘導する工程が、
前記株化心筋芽細胞をコンフルエントに達するまで増殖させる工程と、
該増殖させた心筋芽細胞を0.5%〜2%のウシ胎児血清を含有する培養液で培養して、心筋細胞に分化誘導する工程と、
を備える、ことを特徴とする請求項1乃至5のいずれか1項に記載の作製方法。
【請求項7】
前記増殖させた心筋芽細胞を、前記ウシ胎児血清を含有する培養液で、3日〜7日間培養する、ことを特徴とする請求項6に記載の作製方法。
【請求項8】
請求項1乃至7のいずれか1項に記載の作製方法で作製された、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞。
【請求項9】
請求項8に記載のex vivo心筋細胞を用いることを特徴とする、心不全時の心筋細胞代謝改善薬のスクリーニング方法。
【請求項1】
株化心筋芽細胞を心筋細胞に分化誘導する工程と、
該心筋細胞を、遊離脂肪酸を含有する培養液で培養する工程と、
を備える、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞の作製方法。
【請求項2】
前記株化心筋芽細胞がH9c2細胞である、ことを特徴とする請求項1に記載の作製方法。
【請求項3】
前記遊離脂肪酸がパルミチン酸である、ことを特徴とする請求項1または2に記載の作製方法。
【請求項4】
前記遊離脂肪酸を含有する培養液中の該遊離脂肪酸の濃度が50μM〜2mMである、ことを特徴とする請求項1乃至3のいずれか1項に記載の作製方法。
【請求項5】
前記心筋細胞は、前記遊離脂肪酸を含有する培養液で、6時間〜2日間培養される、ことを特徴とする請求項1乃至4のいずれか1項に記載の作製方法。
【請求項6】
前記分化誘導する工程が、
前記株化心筋芽細胞をコンフルエントに達するまで増殖させる工程と、
該増殖させた心筋芽細胞を0.5%〜2%のウシ胎児血清を含有する培養液で培養して、心筋細胞に分化誘導する工程と、
を備える、ことを特徴とする請求項1乃至5のいずれか1項に記載の作製方法。
【請求項7】
前記増殖させた心筋芽細胞を、前記ウシ胎児血清を含有する培養液で、3日〜7日間培養する、ことを特徴とする請求項6に記載の作製方法。
【請求項8】
請求項1乃至7のいずれか1項に記載の作製方法で作製された、心不全の心筋インスリン抵抗性を再現したex vivo心筋細胞。
【請求項9】
請求項8に記載のex vivo心筋細胞を用いることを特徴とする、心不全時の心筋細胞代謝改善薬のスクリーニング方法。
【図1】


【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2A】


【図2B】


【図3A】


【図3B】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2012−152208(P2012−152208A)
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−155940(P2011−155940)
【出願日】平成23年7月14日(2011.7.14)
【出願人】(504300181)国立大学法人浜松医科大学 (96)
【Fターム(参考)】
【公開日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成23年7月14日(2011.7.14)
【出願人】(504300181)国立大学法人浜松医科大学 (96)
【Fターム(参考)】
[ Back to top ]

