放射性医薬組成物
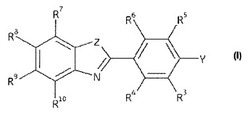
本発明は、放射性医薬品に関し、特に、式Iの化合物と、賦形剤としてポリソルベートとを含む放射性医薬組成物に関する。本発明の放射性医薬組成物は、同種類の化合物を含む従来技術の組成物で遭遇される問題を軽減する。又、本発明により提供されるのは、本発明の放射性医薬組成物の調製方法並びに本放射性医薬組成物の特定の用途である。
【化1】

【化1】

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アミロイド結合化合物を含む放射性医薬組成物及びその調製方法に関する。この放射性医薬組成物は、特に異常アミロイド沈着を伴う疾患状態の診断に用途を見出している。この放射性医薬組成物は、陽電子放射断層撮影(PET)又は単光子放射断層撮影(SPECT)で使用するインビボ造影剤として役立つことができる。
【背景技術】
【0002】
医薬組成物に含まれる共通の賦形剤としては、緩衝剤、凍結乾燥助剤、安定化助剤、可溶化助剤及び静菌剤がある。製剤中に1種以上の適宜的成分を包含すると、医薬品の安定性及び有効期間、並びに開業エンドユーザーによる医薬品の合成し易さを改善することができる。医薬組成物の調製において典型的に使用される可溶化助剤には、エタノール、グリセリン、ポリエチレングリコール、プロピレングリコール、ポリオキシエチレンソルビタンモノオレエート、ソルビタンモノオレエート、ポリソルベート、ポリ(オキシエチレン)、ポリ(オキシプロピレン)−ポリ(オキシエチレン)ブロック共重合体(プルロニックス(Pluronics))及びレシチンが挙げられる。
【0003】
Powellらの総説は、非経口投与向けを意図した医薬組成物の使用における賦形剤の総合的一覧表を提供している[1998 PDA Journal of Pharmaceutical Science and Technology 52(5)pp238〜311]。その中に、0.0005〜12重量/体積%の範囲にある濃度でポリソルベート80を含む、ほぼ40種の医薬組成物が掲げられている。ポリソルベートを含有する、知られている放射性医薬組成物は、111In−オキシキノリン溶液である。この放射性医薬組成物は、特に水中溶解を可能にし、水溶液である場合錯体のガラス及びプラスチック表面への付着を防止するため1ミリリットル当り100μg(0.01重量/体積%に等しい)のポリソルベート80を含有する(欧州特許第0017355号)。
【0004】
静脈内投与に適合するために、放射性医薬組成物は、無菌、非発熱性であり、適切な生体適合性担体媒質中に溶解されなければならない。所望の、無菌、非発熱性放射性医薬組成物をもたらすために、無菌的製造条件下で調製することができる。別法として、非無菌条件下で調製し、続いて例えばガンマ線照射、オートクレーブ処理、乾燥加熱、メンブラン濾過(無菌濾過と呼ばれることがある)又は化学処理(例えばエチレンオキシドによる)を使用し末端除菌を行うことができる。無菌濾過は、その中を通って放射性医薬組成物を通過させる調剤キット(dispensing kit)により達成することができる。このような調剤キットは無菌でなければならないものであり、典型的には0.2μm気孔フィルターを備え、それと共にシリコーンチューブを備え、それにより放射性医薬組成物がフィルターを通過し、バイアル又は注射器などの適切な無菌受け器に入ることを可能にする。このような調剤キット向けの特定の工業標準は存在せず、したがって実際には、種々の調剤キットにおいて様々なフィルタータイプ及びチューブが使用されている。
【0005】
放射性医薬品は、典型的には、非放射性前駆体化合物の、適切な放射性標識との反応によって調製され、前駆体化合物のほんの小部分が放射性標識されて放射性医薬品をもたらす。その結果として、調剤キット表面への付着により、得られた放射性医薬組成物が使用に適さなくなる程度まで、比較的大きい割合の放射性医薬品の損失を招く恐れがある。国際公開第2002/16333号及び同第2004/083195号において記述されるように、チオフラビン誘導体化合物を含む放射性医薬組成物は、アミロイド沈着物により特性付けられる疾患を有する患者の診断において有用であることが知られている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第2007/064773号
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、これらのチオフラビン誘導体化合物を含む、知られている放射性医薬組成物が調剤キットを通過する場合、この放射性医薬品が様々な0.2μm気孔フィルター及びシリコーンチューブの範囲に強く付着することを見出している。したがって、調剤キット構成部分へのチオフラビン誘導体化合物の損失を減らすために、解決策が求められた。
【課題を解決するための手段】
【0008】
本発明は、放射性医薬品に関し、又特に、賦形剤としてのポリソルベートと共にチオフラビン誘導体化合物を含む放射性医薬組成物に関する。本発明の放射性医薬組成物は、同種類の化合物を含む従来技術の組成物で遭遇される問題を克服している。又本発明により提供されるのは、本発明の放射性医薬組成物の調製方法並びに本放射性医薬組成物の特定の用途である。
【発明を実施するための形態】
【0009】
一態様において、本発明は、放射性医薬組成物であって、pH4.0〜10.5において
(i)以下の式Iの化合物と、
(ii)生体適合性担体媒質と、
(iii)0.05〜5.0重量/体積%のポリソルベートと
を含む組成物に関する。
【0010】
【化1】

式中、
ZはS、NR’、O又はC(R’)2であり、各R’は独立にH又はC1〜6アルキルであって、ZがC(R’)2のときは互変異性体の形態の複素環は次式のインドールであり、
【0011】
【化2】

Yは水素、C1〜6アルキル、ハロ、OR’若しくはSR’(R’はH又はC1〜6アルキルである。)であるか、或いはYは−NR1R2であり、
R1〜10は各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、C4〜6シクロアルキル、ヒドロキシル、C1〜6ヒドロキシアルキル、C2〜6ヒドロキシアルケニル、C2〜6ヒドロキシアルキニル、チオール、C1〜6チオアルキル、C2〜6チオアルケニル、C2〜6チオアルキニル、C1〜6チオアルコキシ、ハロ、C1〜6ハロアルキル、C2〜6ハロアルケニル、C2〜6ハロアルキニル、C1〜6ハロアルコキシ、アミノ、C1〜6アミノアルキル、C2〜6アミノアルケニル、C2〜6アミノアルキニル、C1〜6アミノアルコキシ、シアノ、C1〜6シアノアルキル、C2〜6シアノアルケニル、C2〜6シアノアルキニル及びC1〜6シアノアルコキシ、ニトロ、C1〜6ニトロアルキル、C2〜6ニトロアルケニル、C2〜6ニトロアルキニル及びC1〜6ニトロアルコキシからなる群から選択され、
式Iの化合物の1以上の原子はインビボイメージングに適した放射性同位体である。
【0012】
特記しない限り、「アルキル」という用語は、単独又は組合せで、好ましくは炭素原子数1〜10、さらに好ましくは1〜5、最も好ましくは1〜3の直鎖若しくは枝分れ鎖アルキル基を意味する。このような基の具体例としては、特に限定されないが、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソ−アミル、ヘキシル、オクチルが挙げられる。
【0013】
「アルケニル」という用語は、二重結合1つを含む直鎖若しくは枝分れ脂肪族炭化水素基をいう。例は、ビニル(エテニル)、アリル、イソプロペニル、1−プロペニル、2−メチル−1−プロペニル、1−ブテニル、2−ブテニル、3−ブテニル、2−エチル−1−ブテニル、3−メチル−2−ブテニル、1−ペンテニル、2−ペンテニル、3−ペンテニル、4−ペンテニル、4−メチル−3−ペンテニル、1−ヘキセニル、2−ヘキセニル、3−ヘキセニル、4−ヘキセニル及び5−ヘキセニルなどの基である。
【0014】
「アルキニル」という用語は、三重結合1つを含む直鎖若しくは枝分れ脂肪族炭化水素基をいう。例には、エチニル、1−プロピニル、2−プロピニル、1−ブチニル、2−ブチニル、3−ブチニル、1−ペンチニル、2−ペンチニル、3−ペンチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、3−ヘキシニル、4−ヘキシニル及び5−ヘキシニルなどの基が挙げられる。
【0015】
特記しない限り、「アルコキシ」という用語は、単独又は組合せで、アルキルエーテル基を意味し、この中で用語アルキルは上記で定義した通りである。適切なアルキルエーテル基の具体例としては、特に限定されないが、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、イソ−ブトキシ、sec−ブトキシ、tert−ブトキシが挙げられる。
【0016】
特記しない限り、「シクロアルキル」という用語は、単独又は組合せで、飽和若しくは部分飽和単環状、二環状若しくは三環状アルキル基を意味し、この場合、各環部分は、好ましくは環炭素原子数3〜8個、さらに好ましくは環炭素原子数3〜7個、最も好ましくは環炭素原子数4〜6個を含有し、又適宜に、本明細書でアリールの定義に関して定義される通りに適宜置換されるベンゾ縮合環系とすることができる。このようなシクロアルキル基の具体例としては、特に限定されないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、オクタヒドロナフチル、2,3−ジヒドロ−1H−インデニル、アダマンチルが挙げられる。
【0017】
「ヒドロキシル」という用語は−OH基をいう。本明細書で用いる「ヒドロキシアルキル」、「ヒドロキシアルケニル」及び「ヒドロキシアルキニル」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のヒドロキシ基をいう。
【0018】
「ハロ」という用語は、フッ素、塩素、臭素又はヨウ素から選択される置換基を意味する。本明細書で用いる「ハロアルキル」、「ハロアルケニル」、「ハロアルキニル」、「ハロアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のハロ基をいう。好ましいハロ置換基はフルオロ及びヨードである。
【0019】
「チオール」という用語は、−SH基を意味する。本明細書で用いる「チオアルキル」、「チオアルケニル」、「チオアルキニル」、「チオアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のチオール基をいう。
【0020】
本明細書で用いる「シアノ」という用語は、−CN基をいう。本明細書で用いる「シアノアルキル」、「シアノアルケニル」、「シアノアルキニル」、「シアノアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のシアノ基をいう。シアノアルキルの代表的例としては、シアノメチル、2−シアノエチル、及び3−シアノプロピルが挙げられる。
【0021】
「ニトロ」という用語は、−NO2基を意味する。本明細書で用いる「ニトロアルキル」、「ニトロアルケニル」、「ニトロアルキニル」、「ニトロアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のニトロ基をいう。
【0022】
本明細書で用いる「式Iの化合物」という用語は、遊離化合物又は別法として、その医薬として許容できる塩、プロドラッグ(エステルなど)若しくは溶媒和物を意味する。適切な塩、プロドラッグ又は溶媒和物は、国際公開第2004/083195号及び同第02/16333号に記載されている通りである。
【0023】
式Iについて、
ZがS、NR’又はOであり、
Yが−NR1R2であり、
R1〜10が各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ヒドロキシル、C1〜6ヒドロキシアルキル、ハロ、C1〜6ハロアルキル、及びC1〜6ハロアルコキシからなる群から選択されることが好ましい。
【0024】
式Iについて、
ZがSであり、
Yが−NR1R2であり、
R1〜10が各々独立に水素、C1〜3アルキル、C2〜4アルケニル、C2〜4アルキニル、C1〜3アルコキシ、ヒドロキシル、C1〜3ヒドロキシアルキル、ハロ、C1〜3ハロアルキル、及びC1〜3ハロアルコキシからなる群から選択されることが最も好ましい。
【0025】
特に好ましい実施形態において、式Iの化合物は、式Iaの化合物である。
【0026】
【化3】

式中、
R11及びR12は独立に水素、C1〜6アルキル、C1〜6アルコキシ、ニトロ、アミノ、C1〜6アミノアルキル、ハロ又はC1〜6ハロアルキルから選択され、
R13は水素、ヒドロキシ、ニトロ、シアノ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ハロ、C1〜6ハロアルキル、C1〜6ハロアルケニル、−COOR’、−OCH2OR’(R’は、式Iについて定義した通りである。)であり、
Yaは水素、ヒドロキシル、C1〜6アルキル、C1〜6アルコキシ若しくはハロであり又は式Iについて上記で定義した−NR1R2である。
【0027】
式Iaの化合物について、
R11及びR12が独立に水素、C1〜6アルキル又はハロから選択され、
R13がヒドロキシ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ又はハロであり、
Yaがハロ又は式Iについて上記で定義した−NR1R2であることが好ましい。
【0028】
式Iaの化合物について、
R11及びR12が独立に水素又はハロから選択され、
R13がヒドロキシ又はC1〜6アルコキシであり、
Yaが−NR1R2(R1は水素であり、又R2は水素、C1〜6アルキル又はC1〜6ハロアルキルである。)であることが最も好ましい。
【0029】
「インビボイメージングに適した放射性同位体」は、インビボ投与に続いて、非侵襲的方法で外部的に検出することができる放射性同位体である。このような放射性同位体の例には、ガンマ線を放射する放射性ハロゲン及び陽電子を放射する放射性非金属、特に単光子放射断層撮影(SPECT)又は陽電子放射断層撮影(PET)を使用してイメージングするのに適したものが挙げられる。この放射性同位体は、11C、123I、124I、125I、131I、75Br、76Br、77Br及び18Fから、最も適切には11C、123I、及び18Fから選択されるのが適切である。
【0030】
特に好ましい実施形態において、本発明の放射性医薬組成物は、R11〜R13又はYaのうちの1つが、放射性炭素若しくは放射性ハロゲンであり又は放射性炭素若しくは放射性ハロゲンを含む、式Iaの化合物である。放射性炭素が11Cであり、又放射性ハロゲンが、好ましくは123I、124I、125I、131I、75Br、76Br、77Br、17F及び18Fから選択されるのが好ましい。放射性ハロゲンが、123I又は18Fであるのが最も好ましい。式Iaが放射性炭素を含む場合、それがYa内の原子であることが好ましく、Yaが−NR1R2であることが最も好ましい。式Iaが放射性ハロゲンを含む場合、それが、R11若しくはYaの放射性ハロゲンであり又はYaが−NR1R2(R1は水素であり、又R2はC1〜6ハロアルキル若しくはC2〜6ハロアルケニルである。)である場合、Ya内の原子であることが好ましい。
【0031】
特に好ましい式Iaの化合物の非限定的な例は、以下のものである。
【0032】
【化4】

「生体適合性担体媒質」は、放射性医薬品を懸濁若しくは溶解している流体、特に液体であり、生理学的に許容される、すなわち毒性若しくは過度の不快感がなく哺乳動物の身体に投与することができる放射性医薬組成物をもたらす。典型的な、生体適合性担体媒質は、例えば発熱物質を含まない注射用水、等張性生理食塩水及びエタノール水溶液である。本発明の放射性医薬組成物のためにエタノール水溶液が好ましく、本発明の組成物のために5〜10体積/体積%のエタノールが特に適している。この生体適合性担体媒質は、エタノール6〜8体積/体積%、最も好ましくはエタノール6.5〜7.5体積/体積%を含むエタノール水溶液であることが好ましく、7体積/体積%が特に好ましい。
【0033】
本放射性医薬組成物は、pH調節剤、医薬として許容できる安定剤若しくは酸化防止剤(アスコルビン酸、ゲンチジン酸又はパラ−アミノ安息香酸など)、抗菌防腐剤又はフィラーなどの付加成分をさらに適宜含むことができる。
【0034】
「pH調節剤」という用語は、哺乳動物投与のために放射性医薬組成物のpHを許容できる限界(およそpH4.0〜10.5)内に確実に保持するのに役立つ化合物又は化合物の混合物を意味する。適切なこのようなpH調節剤には、トリシン、リン酸若しくはTRIS[すなわちトリス(ヒドロキシメチル)アミノメタン]などの医薬として許容できる緩衝剤、及び炭酸ナトリウム、重炭酸ナトリウム又はこれらの混合物などの医薬として許容できる塩基が挙げられる。pHは、6.0〜8.5、適切には6.0〜8.0の範囲内に、又最も好ましくは5.8〜7.2の範囲内に保持することが好ましく、7.0〜7.2の範囲内のpHが特に好ましい。本発明の放射性医薬組成物のために好ましい緩衝剤は、好ましくは0.005〜0.1M、最も好ましくは0.01M〜0.1M、特に好ましくは0.01〜0.05M、又最も特に好ましくは0.01〜0.02Mのリン酸緩衝液である。
【0035】
「抗菌防腐剤」という用語とは、細菌、酵母又はカビなどの有害な可能性のある微生物の成長を抑制する薬剤を意味する。抗菌防腐剤は、用量に応じていくらかの殺菌性状をも呈することができる。本発明の1種以上の抗菌防腐剤の主な役割は、放射性医薬組成物中のこのような任意の微生物の成長を抑制することである。適切な1種以上の抗菌防腐剤には、パラベン、すなわちメチル、エチル、プロピル若しくはブチルパラベン又はこれらの混合物、ベンジルアルコール、フェノール、クレゾール、セトリミド及びチオメルサルが挙げられる。好ましい1種以上の抗菌防腐剤はパラベンである。
【0036】
「フィラー」という用語とは、製品製造の間材料取扱いを容易にし得る、医薬として許容できる充填剤を意味する。適切なフィラーには、塩化ナトリウムなどの無機塩、及びスクロース、マルトース、マンニトール若しくはトレハロースなどの水溶性糖又は糖アルコールが挙げられる。
【0037】
放射性医薬組成物についての原則として、目標は、医薬として有効な、並びに生理学的に許容される組成物を生成させる、可能な限り最低量の賦形剤を有することである。
【0038】
本発明の放射性医薬組成物は、使用のため、完全な無菌性を維持しながら、皮下針による単回若しくは多回穿刺に適しているシール(例えば圧着された隔壁シール密閉部)を備えた容器で適切に供給される。このような容器は、単回若しくは多回の患者投与量を収容できる。典型的な投与量容器は、単回若しくは多回の患者投与量を収めた小口ビン(体積5〜50cm3、例えば10〜30cm3が適している)を備え、それにより、臨床状況に適合した実行可能な製剤の有効期間内に種々の時間間隔で、患者投与量(複数可)を、こうして臨床等級注射器中に吸引することができる。薬液充填済み注射器は、単回患者投与量を収めるように設計され、したがって臨床使用に適した使い捨て若しくは他の注射器とするのが好ましい。薬液充填済み注射器は、操作者を放射線照射量から保護するため放射性医薬品用シリンジシールドを備えることができる。適切なこのような放射性医薬品用シリンジシールドは、当技術分野で知られ、鉛又はタングステンのいずれかを含むことが好ましい。典型的には、本発明の放射性医薬組成物は、50〜100MBq/ml、適切には70〜85MBq/ml、より適切には80MBq/mlの放射能濃度を有する。単回患者投与量は、典型的には、投与の時点で50〜400MBq、より典型的には80〜370MBqを含み、1〜10ml、好ましくは約5mlの体積を有するであろう。
【0039】
「ポリソルベート」はポリオキシエチレンソルビタンエステルである。ポリソルベートの総合的記述は、“Nonionic Surfactants”,M.J.Schick,Ed.(Dekker,New York,1967)pp247〜299中に見出すことができる。ポリソルベートの例には、ポリソルベート20、ポリソルベート40、ポリソルベート60及びポリソルベート80が挙げられ、Sigma−Aldrich社から商標名Tween(登録商標)のもとに、それぞれTween20、Tween40、Tween60及びTween80として市販されている。「ポリソルベート」に続く番号は、分子のポリオキシエチレンソルビタン部分に結合した脂肪酸のタイプに関連している。モノラウリン酸エステルは20により示され、モノパルミチン酸エステルは40により示され、モノステアリン酸エステルは60により、又モノオレイン酸エステルは80により示される。ポリソルベートの濃度は、フィルタータイプの範囲への式Iの化合物の付着を実質的に無くすのに十分な適切なものとする。調剤の間フィルターへの式Iの化合物の損失は、0〜10%、最も好ましくは0〜5.0%、特に好ましくは0〜1.0%の範囲にあり、又最も特に好ましくは0%であることが好ましい。好ましい実施形態において、放射性医薬品製剤のポリソルベートは、ポリソルベート20又はポリソルベート80から選択され、ポリソルベート80が特に好ましい。この放射性医薬品製剤中に存在するポリソルベートの濃度は、0.25〜2.5重量/体積%の範囲に、最も好ましくは0.5〜1.0重量/体積%の間にあり、又特に好ましくは0.5重量/体積%であることが好ましい。
【0040】
式Iの化合物は、市販の出発材料から又は国際公開第2002/16333号、同第2004/083195号及び同第2007/020400号に記載されている出発材料を使用して、或いは有機化学の標準的方法によって調製できる。
【0041】
放射性炭素又は放射性ハロゲンなどの放射性標識を含む式Iの化合物は、放射性炭素又は放射性ハロゲンの適切な供給源との、前駆体化合物の反応によって便利に調製できる。
【0042】
「前駆体化合物」は、好都合な化学形態の放射性標識との化学反応が特定の部位で起こり、最小の段階数(理想的には単一段階)で行うことができ、又著しい精製の必要がなくて(理想的にはさらなる精製なしで)、所望の式Iの放射性標識化合物をもたらすように設計された、式Iの放射性標識化合物の誘導体を含む。このような前駆体化合物は合成のものであり、良好な化学的純度で便利に得ることができる。この前駆体化合物は、この前駆体化合物のいくつかの官能基のための保護基を適宜含むことができる。
【0043】
「保護基」とは、望ましくない化学反応を阻害若しくは抑制するが、十分に反応性であって、分子の残部が改変されない十分に穏やかな条件下で、問題の官能基から切断できるように設計されている基を意味する。脱保護した後、所望の式Iの放射性標識化合物が得られる。保護基は、当業者に周知であり、アミン基については、Boc(この場合Bocはtert−ブチルオキシカルボニルである。)、Fmoc(この場合Fmocはフルオレニルメトキシカルボニルである。)、トリフルオロアセチル、アリルオキシカルボニル、Dde[すなわち1−(4,4−ジメチル−2,6−ジオキソシクロヘキシリデン)エチル]又はNpys[すなわち3−ニトロ−2−ピリジンスルフェニル]から、又カルボキシル基については、メチルエステル、tert−ブチルエステル又はベンジルエステルから適切に選択される。ヒドロキシル基について、適切な保護基は、メチル、エチル若しくはtert−ブチル、アルコキシメチル若しくはアルコキシエチル、ベンジル、アセチル、ベンゾイル、トリチル(Trt)又は、テトラブチルジメチルシリルなどのトリアルキルシリルである。チオール基について、適切な保護基は、トリチル及び4−メトキシベンジルである。さらなる保護基の使用は、‘Protective Groups in Organic Synthesis’,Theorodora W.Greene and Peter G.M.Wuts,(Third Edition,John Wiley & Sons,1999)中に記述されている。
【0044】
放射性ハロゲン又は放射性炭素で標識した式Iの化合物が、本発明の放射性医薬組成物において好ましい。適切な前駆体化合物により、式Iの、放射性ヨウ素化、放射性フッ素化及び放射性カルボニル化化合物を得る方法を、ここに記述している。
【0045】
放射性ヨウ素化
放射性ヨウ素で式Iの化合物に標識する場合、適切な前駆体化合物は、求電子ヨウ素化若しくは求核ヨウ素化のいずれかを受ける又は標識アルデヒド若しくはケトンとの縮合を受ける誘導体を含むものである。第一の範疇の例は、
(a)トリアルキルスタンナン(例えばトリメチルスタンニル又はトリブチルスタンニル)又はトリアルキルシラン(例えばトリメチルシリル)又は有機ホウ素化合物(例えばホウ素酸エステル又は有機トリフルオロホウ酸塩)などの有機金属誘導体、
(b)ハロゲン交換のための非放射性臭化アルキル又は求核ヨウ素化のためのアルキルトシレート、メシレート若しくはトリフレート、
(c)求電子ヨウ素化に向かって活性化された芳香環(例えばフェノール、フェニルアミン)及び求核ヨウ素化に向かって活性化された芳香環(例えばアリールヨードニウム塩アリールジアゾニウム、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体)
である。
【0046】
放射性ヨウ素化のための前駆体化合物は、ヨウ素化アリール若しくは臭化アリールなどの非放射性ハロゲン原子(放射性ヨウ素交換を可能にするため)、活性化芳香環(例えばフェノール若しくはフェニルアミン)、有機金属置換基(例えば、トリアルキルスズ、トリアルキルシリル又は有機ホウ素化合物)又はトリアゼンなどの有機置換基若しくはヨードニウム塩などの求核置換のための良好な脱離基を含むことが好ましい。放射性ヨウ素化のため、前駆体化合物は、活性化アリール環又は有機金属置換基を含むことが好ましく、有機金属置換基はトリアルキルスズであることが最も好ましい。
【0047】
有機分子中に放射性ヨウ素を導入する前駆体化合物及び方法は、Bolton[J.Lab.Comp.Radiopharm.,45,485〜528(2002)]に記載されている。適切なホウ酸エステル有機ホウ素化合物及びそれらの調製は、Kabalakaら[Nucl.Med.Biol.,29,841〜843(2002)及び30,369〜373(2003)]に記載されている。適切な有機トリフルオロホウ酸塩及びそれらの調製は、Kabalakaら[Nucl.Med.Biol.,31,935〜938(2004)]に記載されている。
【0048】
放射性ヨウ素が結合することができるアリール基の例を以下に挙げる。
【0049】
【化5】

(この場合アルキルは、メチル又はブチルが好ましい。)。これらの基は、芳香環での容易な放射性ヨウ素置換を可能にするいくつかの置換基を含有する。放射性ヨウ素を含有する代替的な置換基は、放射性ハロゲン交換による直接ヨウ素化によって合成することができ、例えば以下の通りである。
【0050】
【化6】

飽和脂肪族系に結合したヨウ素原子は、インビボで代謝し易くしたがって放射性ヨウ素が失われ易いことが知られているので、放射性ヨウ素原子は、ベンゼン環などの芳香環又はビニル基に直接共有結合により結合することが好ましい。
【0051】
放射性ヨウ素の供給源は、ヨウ化物イオン又はヨードニウムイオン(I+)から選択される。化学形態が、放射性合成中に酸化剤により求電子化学種に典型的に変換されるヨウ化物イオンであることが最も好ましい。
【0052】
式Iの化合物の放射性ヨウ素化についてのいくつかの方法に関するさらなる詳細は、国際公開第2002/16333号及び同第2004/083195号に記載されている。
【0053】
放射性フッ素化
フッ素の放射性同位体で式Iの化合物を標識する場合、フッ化アルキルがインビボ代謝に抵抗性があるため、放射性フッ素原子は、フルオロアルキル若しくはフルオロアルコキシ基の一部を形成させることができる。フルオロアルキル化は、フルオロアルキル基との、フェノール、チオール及びアミドなどの反応性基を含有する前駆体化合物の反応によって行うことができる。
【0054】
別法として、放射性フッ素原子は、ベンゼン環などの芳香環への直接共有結合により結合できる。このようなアリール系について、アリールジアゾニウム塩、アリールニトロ化合物又はアリール第四級アンモニウム塩からの、18F−フッ化物求核性置換が、アリール−18F誘導体への適切な経路である。
【0055】
放射性フッ素化は、臭化アルキル、アルキルメシレート又はアルキルトシレートなどの良好な脱離基を有する前駆体化合物中の適切な化学基との、18F−フッ化物の反応を使用した直接標識化により行うことができる。
【0056】
18Fの半減期が僅か109.8分なので、中間体18F部分が、高い比放射能を有し、したがって可能な限り急速な反応過程を用いて生成されることが重要である。
【0057】
式Iの化合物の放射性フッ素化についてのいくつかの方法に関するさらなる詳細は、国際公開第2002/16333号、同第2004/083195号及び同第2007/020400号に記載されている。
【0058】
18F−標識誘導体への合成経路のさらなる詳細は、Bolton,J.Lab.Comp.Radiopharm.,45,485〜528(2002)に記載されている。
【0059】
放射性カルボニル化
式Iの化合物を、11Cにより標識する場合、標識化への1つの取組みは、式Iのメチル化化合物の脱メチル化バージョンである前駆体化合物を、[11C]ヨウ化メチルと反応させることである。所望の式Iの標識化合物の特定の炭化水素鎖のグリニャール試薬を、[11C]CO2と反応させることにより、11Cを組み込むことも可能である。11Cは、芳香環のメチル基として導入することもでき、その場合には、前駆体化合物はトリアルキルスズ基又はB(OH)2基を含むであろう。
【0060】
11Cの半減期が僅か20.4分なので、中間体11C部分が、高い比放射能を有し、したがって可能な限り急速な反応過程を用いて生成されることが重要である。
【0061】
式Iの化合物の放射性カルボニル化についてのいくつかの方法に関するさらなる詳細は、国際公開第2002/16333号及び同第2004/083195号に記載されている。
【0062】
このような11C−標識化技術の完全な総説は、Handbook of Radiopharmaceuticals,Ed.M.J.Welch and C.S.Redvanly(2003,John Wiley and Sons)における、Antoniらの“Aspects on the Synthesis of 11C−Labelled Compounds”中に見出すことができる。
【0063】
式Iの化合物に放射性標識する場合、例えば放射性薬学で使用するキットの一部として前駆体化合物を提供できることが便利である。このようなキットには、適切に適応させた自動合成装置に差し込むことができるカートリッジを収めることができる。このカートリッジには、前駆体のほかに、任意の望ましくない放射性イオンを除去するカラムと、反応混合物を蒸発させ、要求通りに生成物を製剤するように接続された適正な容器とを収めることができる。合成に必要とされる試薬及び溶媒並びに他の消耗品も、放射線濃度、体積、送達時間などについての顧客の要求条件に一致するような形で合成装置を操作させるソフトウエアを納めたコンパクトディスクと一緒に収めることができる。キットの全ての構成部分を使い捨てとして、使用間に汚染される可能性を最小にすること、及び無菌とし且つ品質保証できることが便利である。
【0064】
合成に続いて、式Iの化合物は精製を要する可能性があり、それは標準的方法を使用して、例えば高速液体クロマトグラフィー(HPLC)、イオン交換クロマトグラフィーを使用して、且つ/又は溶媒交換カートリッジを通過させて、行うことができる。
【0065】
高速液体クロマトグラフィー(HPLC)は、放射性医薬品の調製に通常使用され、式Iの化合物の合成に続く粗反応混合物中に存在する任意の化学的不純物を除去するため使用することができる。任意の特定の化合物について、HPLC方法を最適化する必要がある。中性、酸性若しくは塩基性pHにおいて様々な有機溶媒、例えばメタノール、アセトニトリル、エタノール、2−プロパノールの1つと一緒に順相若しくは逆相カラムを使用することができる。中性pH条件で逆相カラムを使用して、式Iの化合物の最も有利な分離を達成することが好ましい。
【0066】
溶媒交換カートリッジを使用した精製は、カラムへの式Iの化合物の充填に続く、式Iの化合物に適した溶媒によるカラムについての溶離を伴い、エタノール及びエタノール水溶液が好ましい溶媒である。適切な溶媒交換カートリッジには、C8、C18又はC30などのSEP−Pak(商標)カートリッジ(Waters社)が挙げられる。
【0067】
さらなる態様において、本発明は、本発明の放射性医薬組成物の調製方法であって、
(i)式Iの化合物、生体適合性担体媒質、及び0.05〜5.0重量/体積%のポリソルベートを混和する段階、及び
(ii)必要に応じて、得られた混合物のpHを4.0〜10.5に調節する段階
を含む方法に関する。
【0068】
段階(ii)に従って、本組成物を滅菌することができる。滅菌は、当技術分野の標準的方法、例えばガンマ線照射、オートクレーブ処理、乾燥加熱、メンブラン濾過(無菌濾過と呼ばれることがある)又は化学処理(例えばエチレンオキシドによる)によって実施できる。無菌濾過は、その中を通って放射性医薬組成物を通過させる調剤キットによって達成することができる。このような調剤キットは無菌でなければならないものであり、典型的には0.2μm気孔フィルターを備え、それと共にシリコーンチューブを備え、それにより放射性医薬組成物がフィルターを通過し、且つバイアル又は注射器などの適切な無菌受け器に入ることを可能にする。
【0069】
したがって、上述の、本発明の放射性医薬組成物の調製方法であって、
(iii)段階(ii)から得られる組成物を、好ましくは無菌濾過によって滅菌する段階
をさらに含む方法をさらに提供する。
【0070】
段階(i)は、上述の溶媒交換カートリッジに、式Iの化合物を充填し、次いで、生体適合性担体媒質中に含まれる溶媒若しくは溶媒の混合物(例えば水及びエタノール)で溶離することによって、便利に行うことができる。溶離液は、ポリソルベート並びに、フィラー(例えば塩化ナトリウム)及びpH調節剤(例えば、リン酸緩衝液などの医薬として許容できる緩衝剤)などの任意の他の賦形剤を充填済みのバイアルなどの収集容器内に集めることができる。好ましい一実施形態において、この収集容器は上述のように充填済みとし、次いで−30℃〜−10℃、適切には−25℃〜−15℃、より適切には−20℃の低温で貯蔵し、次いで使用直前に室温とする。ポリソルベートをこの方法で貯蔵することにより、その有効期間を延ばし、且つより高い放射線濃度(RAC)を有する放射性医薬組成物の製造が可能になることが、見出されている。 段階(i)において、式Iの化合物、生体適合性担体媒質、及びポリソルベート、並びにそのための好ましい実施形態は、それぞれ上記で定義した通りである。上述のように、好ましい生体適合性担体媒質は、エタノール水溶液である。
【0071】
本調製方法の段階(ii)は、段階(i)の間若しくはその後に行うことができる。例えば、上述のように、pH調節剤は、段階(i)の間に充填済み収集容器内に入れることができ、或いは段階(i)を実行する間若しくは実行した後に、収集容器に添加できる。
【0072】
本調製方法の好ましい実施形態において、上述のように、1つ以上の段階が自動化される。
【0073】
実施例1〜4は、無菌濾過の間、調剤キットの構成部分の範囲に化合物Iが付着することを低減する、本発明の組成物及び方法の利点を実証する。
【0074】
なおさらなる態様において、本発明は、被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定に使用するための本発明の放射性医薬組成物に関する。このアミロイド沈着物はアミロイドβの沈着物であり、又この被検体の器官又は体領域は脳であることが好ましい。本発明の放射性医薬組成物は、アミロイド状態を有することが疑われた被検体における1か所以上のアミロイド沈着物をインビボイメージングするためのものである。「アミロイド状態」とは、アルツハイマー病(AD)、家族性AD、ダウン症候群、アミロイド症、真性II型糖尿病、及びアポリポタンパクE4対立遺伝子のためのホモ接合体などのアミロイド沈着によって特徴付けられる障害若しくは状態である。本発明の方法は、ADをインビボイメージングするためのものであることが好ましい。「インビボイメージング」は、被検体への本発明の放射性医薬組成物の投与に続いて、式Iの化合物の検出を可能にする任意の方法をいう。好ましいインビボイメージングの方法は、陽電子放射断層撮影(PET)及び単光子放射断層撮影(SPECT)であり、PETが特に好ましい。「被検体」は哺乳動物、好ましくはヒトである。代替的実施形態において、本発明の方法は、典型的にはアミロイド状態特異性治療に応答する、アミロイド状態の進行又は寛解を監視する手段として、2つ以上のはっきり識別される時点で行うことができる。
【0075】
したがって、被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定方法であって、
(i)本発明の放射性医薬組成物の検出可能な量を被検体に投与し、
(ii)式Iの化合物を被検体内の任意のアミロイド沈着物に結合させ、
(iii)インビボイメージングにより、被検体内の1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定する
段階を含む方法を提供する。
【0076】
上記の段階(ii)及び(iii)は、放射性医薬組成物を予め投与した被検体における1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定するための、本発明の放射性医薬組成物の独立(スタンドアローン)な使用であると理解することもできる。
【0077】
「検出可能な量」は、投与された放射性医薬組成物の量が、被検体内のアミロイドに式Iの化合物が結合したことの検出を可能にするのに十分であることを意味する。注入される放射能は、典型的には50〜400MBq、より典型的には80〜370MBqであり、又1〜10ml、好ましくは約5mlの体積を有するであろう。
【0078】
本発明のこの態様は又、被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定するのに使用するための、本発明の放射性医薬組成物の製造における式Iの化合物の使用をも包含する。
【0079】
実施例の簡単な説明
実施例1は、PEG400、プロピレングリコール又はポリソルベート20を有する[19F]化合物1の製剤を比較するために行った実験を記述する。
【0080】
実施例2は、ポリソルベート20又はポリソルベート80を有する[19F]化合物1の製剤を比較するために行った実験を記述する。
【0081】
実施例3は、2種の異なったフィルタータイプへの、ポリソルベート80を有する[19F]化合物1の製剤の付着を比較するために行った実験を記述する。
【0082】
実施例4は、3種の異なったシリコーンチューブタイプへの、ポリソルベート80を有する[19F]化合物1の製剤の付着を比較するために行った実験を記述する。
【0083】
実施例5は、[18F]化合物1の自動合成、及び本発明の組成物としたその製剤について記述する。
【実施例】
【0084】
実施例1
PEG400、及びプロピレングリコールを有する化合物1製剤の除菌調剤
pH7.4の0.01Mナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び(i)12体積/体積%のプロピレングリコール(PG)又は(ii)10体積/体積%のポリエチレングリコール400(PEG400)のいずれかを含有する溶液を調製した。下記の実験において、高速液体クロマトグラフィー(HPLC)により、調剤キットの種々の構成部分への化合物1の損失百分率を評価した。
【0085】
【表1】

両賦形剤について、注射器及び硬質管内で失われた量は少なかった。主な損失は、フィルター内で見られ、又プロピレングリコールについてはシリコーン管内でも見られた。これらの結果は、12%のPG又は10%のPEG400の存在する状態でも、調剤キット表面への、最も顕著にはフィルターへの化合物1の著しい損失が観察されたことを示している。
【0086】
実施例2
ポリソルベート20及びポリソルベート80を有する化合物1組成物の無菌濾過の比較
pH7.4の0.01Mナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び選択された体積/体積%量のポリソルベート20及びポリソルベート80を含有する溶液を調製した。下記のように、4種の濾過実験を行った。
【0087】
【表2】

各溶液を、その体積がおよそ9.5mlであることが判明している10ml注射器中に吸引した。注射器内における体積を、9mlに減らし整えた。その残りを、濾過前の分析用試料として使用した(未処理標準)。
【0088】
直径25mm、“Supor(登録商標)親水性ポリエーテルスルホン及び疎水性バンドRepelメンブラン”(気孔0.20μm及び2.80cm”)を有するPall社S−200 DLL25 Repel(商標)Stripeフィルター(Pallフィルター)を通して濾過を行った。1回分当り1mlの溶液を、フィルターに圧搾通過させた。最初の1ml部分について、およそ0.4mlしか通過して出なかった(デッド体積およそ0.6ml)。残りの部分は、およそ1.9mlである最後の部分を除いて、1mlであったが、空気も圧搾通過させて溶液の全体積を集めた。部分の体積は、自動ピペットを使用して測定した。
【0089】
Tween溶液は幾分発泡し、そのため溶液は注意深くフィルターを圧搾通過させなければならなかった(9mlを濾過する平均時間はおよそ1分及び20秒であった。)。
【0090】
濾過後の回収率は、次の通りであった。
【0091】
【表3】

濾過後の全体回収率は、0.1%のポリソルベート20及び80について92%であり、5.0%のポリソルベート20及び80について100%であった。これらの結果は、低濃度であっても、化合物Iの製剤中にポリソルベート20又はポリソルベート80のいずれかが存在すると、その結果フィルターへの化合物Iの損失が著しく低減されたことを実証している。
【0092】
実施例3
種々のフィルタータイプでの化合物1組成物の無菌濾過の比較
pH7.4の10mMナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び選択された体積/体積%量のポリソルベート80を含有する溶液を調製した。下記のように、Pallフィルター並びに、Durapore(登録商標)メンブランを有するMillipore社Millex(登録商標)GV33mmフィルターユニット0.22μm(Millexフィルター)を使用し、又種々の体積/体積%量のポリソルベート80を使用して、10種の濾過実験を行った。
【0093】
【表4】

各溶液を、その体積がおよそ9.5mlであることが判明している10ml注射器中に吸引した。注射器内における体積を、9mlに減らし整えた。その残りを、濾過前の分析用試料として使用した(未処理標準)。
【0094】
各溶液は、上記に示したフィルターを、一気に圧搾通過させ、およそ16秒を要した。化合物1の領域に基づいて計算した濾過後の回収率%は、下記の通りであった。
【0095】
【表5】

これらの結果は、0.3体積/体積%以上の濃度のポリソルベート80が存在すると、以前に顕著な損失が観察されたフィルターについてさえも、化合物1の損失を低減させるのに十分であることを明確に実証している。
【0096】
実施例4
種々のシリコーンチューブへの化合物1吸着の比較
pH7.4の10mMナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び選択された体積/体積%量のポリソルベート80を含有する溶液を調製した。下記のように、種々のシリコーンチューブタイプを試験した。
【0097】
【表6】

各実験において、チューブ上への化合物1の損失百分率を計算した。チューブを通る通過前及び通過後にフッ素を試験し、結果は、下記の通りであった。
【0098】
【表7】

これらの結果は、製剤中に1.0体積/体積%以上のポリソルベートを包含すると、各チューブタイプへの化合物1の著しい損失が低減され又は無くなりさえすることを実証している。
【0099】
実施例5
2−[3−[18F]フルオロ−4−(メチルアミノ)フェニル]−6−ヒドロキシ−ベンゾチアゾール(化合物1)の自動合成
FASTlab(商標)(GE Healthcare社)自動合成装置ユニットのための単回使用流体経路に、下記の試薬を充填し、このFASTlabプラットフォーム上に取り付けた。
【0100】
I.80:20アセトニトリル:水中の150mM重炭酸テトラブチルアンモニウム(0.8ml)、
II.最終中間体溶液:ジメチルスルホキシド中の75mM2−[3−ニトロ−4(メチルホルミルアミノ)フェニル]−6−エトキシメトキシ−ベンゾチアゾール(1.37ml)、
III.4M塩酸(4ml)、
IV.エタノール(2×4ml)、
V.水(100ml)。
【0101】
さらに、下記の賦形剤を入れた生成物収集バイアルを、FASTlabプラットフォームに隣接した位置に置いた。
0.67(重量/体積)%のポリソルベート80、1.21(重量/体積)%の塩化ナトリウム、18.82mMリン酸緩衝液(pH7)(合計体積37.2ml)。
【0102】
[18O]−濃縮水中の[18F]フッ化物の溶液を合成装置の出発位置中に充填すると、操作者は、下記の事象のシーケンスを行わせるプログラムを開始した。
【0103】
フッ化物溶液が、QMA(第四級メチルアンモニウム)カートリッジを通過して、フッ化物を捕捉し、又濃縮水を廃液に送った。次いで、フッ化物を回収するためにQMAカートリッジで、350μlの150mM重炭酸テトラブチルアンモニウムにより溶離し、得られた溶液を反応器容器に送った。
【0104】
反応器容器を120℃に加熱し、窒素流を溶液上に通しながら真空下に5分間保持した。次いで同じ加熱及び真空条件下で窒素流を、残った溶液に4分間直接通して、反応器の内容物を乾燥させた。最終中間体溶液(1ml)を、反応器容器に添加し、15分間温度を130℃に上昇させた。この段階により、最終中間体内への[18F]フッ化物の組込みが可能となる。この溶液を95℃まで冷却し、0.25mlの塩酸溶液を添加した。この混合物を5分間125℃に加熱して、ベンゾチアゾール誘導体の脱保護を達成し、2−[3−[18F]フルオロ−4−(メチルアミノ)フェニル]−6−ヒドロキシ−ベンゾチアゾールの粗製溶液を生成した。反応器容器を1mlのエタノール:水(体積で1:1)で希釈し、FASTlabに隣接した位置に置いたC30 HPLCカラム(250×10mm、5μm)上に注入した。カラムでは、5ml/分の0.8%のトリエチルアミン:アセトニトリル(体積で53:47)で溶離した。所望の生成物を、放射線検出により特定し、分流してFASTlab上に戻した。得られた精製2−[3−[18F]フルオロ−4−(メチルアミノ)フェニル]−6−ヒドロキシ−ベンゾチアゾール溶液は、2つのC30固相抽出カートリッジ(エタノール1m及び水15mlで前調質されている)を直接通過させ、それにより生成物をカートリッジ上に保持した。カートリッジを水ですすいで洗浄し、残ったHPLC溶離溶媒を廃液に送った。次いで生成物をエタノール3.5ml続いて水9.3mlによりC30カートリッジから溶出させ、薬液充填済みの生成物収集バイアルに入れて、最終生成物体積50mlをもたらした(0.5(重量/体積)%のポリソルベート80、7(体積/体積)%のエタノール、0.9(重量/体積)%の塩化ナトリウム、14mMリン酸緩衝液(pH7))。
【技術分野】
【0001】
本発明は、アミロイド結合化合物を含む放射性医薬組成物及びその調製方法に関する。この放射性医薬組成物は、特に異常アミロイド沈着を伴う疾患状態の診断に用途を見出している。この放射性医薬組成物は、陽電子放射断層撮影(PET)又は単光子放射断層撮影(SPECT)で使用するインビボ造影剤として役立つことができる。
【背景技術】
【0002】
医薬組成物に含まれる共通の賦形剤としては、緩衝剤、凍結乾燥助剤、安定化助剤、可溶化助剤及び静菌剤がある。製剤中に1種以上の適宜的成分を包含すると、医薬品の安定性及び有効期間、並びに開業エンドユーザーによる医薬品の合成し易さを改善することができる。医薬組成物の調製において典型的に使用される可溶化助剤には、エタノール、グリセリン、ポリエチレングリコール、プロピレングリコール、ポリオキシエチレンソルビタンモノオレエート、ソルビタンモノオレエート、ポリソルベート、ポリ(オキシエチレン)、ポリ(オキシプロピレン)−ポリ(オキシエチレン)ブロック共重合体(プルロニックス(Pluronics))及びレシチンが挙げられる。
【0003】
Powellらの総説は、非経口投与向けを意図した医薬組成物の使用における賦形剤の総合的一覧表を提供している[1998 PDA Journal of Pharmaceutical Science and Technology 52(5)pp238〜311]。その中に、0.0005〜12重量/体積%の範囲にある濃度でポリソルベート80を含む、ほぼ40種の医薬組成物が掲げられている。ポリソルベートを含有する、知られている放射性医薬組成物は、111In−オキシキノリン溶液である。この放射性医薬組成物は、特に水中溶解を可能にし、水溶液である場合錯体のガラス及びプラスチック表面への付着を防止するため1ミリリットル当り100μg(0.01重量/体積%に等しい)のポリソルベート80を含有する(欧州特許第0017355号)。
【0004】
静脈内投与に適合するために、放射性医薬組成物は、無菌、非発熱性であり、適切な生体適合性担体媒質中に溶解されなければならない。所望の、無菌、非発熱性放射性医薬組成物をもたらすために、無菌的製造条件下で調製することができる。別法として、非無菌条件下で調製し、続いて例えばガンマ線照射、オートクレーブ処理、乾燥加熱、メンブラン濾過(無菌濾過と呼ばれることがある)又は化学処理(例えばエチレンオキシドによる)を使用し末端除菌を行うことができる。無菌濾過は、その中を通って放射性医薬組成物を通過させる調剤キット(dispensing kit)により達成することができる。このような調剤キットは無菌でなければならないものであり、典型的には0.2μm気孔フィルターを備え、それと共にシリコーンチューブを備え、それにより放射性医薬組成物がフィルターを通過し、バイアル又は注射器などの適切な無菌受け器に入ることを可能にする。このような調剤キット向けの特定の工業標準は存在せず、したがって実際には、種々の調剤キットにおいて様々なフィルタータイプ及びチューブが使用されている。
【0005】
放射性医薬品は、典型的には、非放射性前駆体化合物の、適切な放射性標識との反応によって調製され、前駆体化合物のほんの小部分が放射性標識されて放射性医薬品をもたらす。その結果として、調剤キット表面への付着により、得られた放射性医薬組成物が使用に適さなくなる程度まで、比較的大きい割合の放射性医薬品の損失を招く恐れがある。国際公開第2002/16333号及び同第2004/083195号において記述されるように、チオフラビン誘導体化合物を含む放射性医薬組成物は、アミロイド沈着物により特性付けられる疾患を有する患者の診断において有用であることが知られている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第2007/064773号
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者らは、これらのチオフラビン誘導体化合物を含む、知られている放射性医薬組成物が調剤キットを通過する場合、この放射性医薬品が様々な0.2μm気孔フィルター及びシリコーンチューブの範囲に強く付着することを見出している。したがって、調剤キット構成部分へのチオフラビン誘導体化合物の損失を減らすために、解決策が求められた。
【課題を解決するための手段】
【0008】
本発明は、放射性医薬品に関し、又特に、賦形剤としてのポリソルベートと共にチオフラビン誘導体化合物を含む放射性医薬組成物に関する。本発明の放射性医薬組成物は、同種類の化合物を含む従来技術の組成物で遭遇される問題を克服している。又本発明により提供されるのは、本発明の放射性医薬組成物の調製方法並びに本放射性医薬組成物の特定の用途である。
【発明を実施するための形態】
【0009】
一態様において、本発明は、放射性医薬組成物であって、pH4.0〜10.5において
(i)以下の式Iの化合物と、
(ii)生体適合性担体媒質と、
(iii)0.05〜5.0重量/体積%のポリソルベートと
を含む組成物に関する。
【0010】
【化1】

式中、
ZはS、NR’、O又はC(R’)2であり、各R’は独立にH又はC1〜6アルキルであって、ZがC(R’)2のときは互変異性体の形態の複素環は次式のインドールであり、
【0011】
【化2】

Yは水素、C1〜6アルキル、ハロ、OR’若しくはSR’(R’はH又はC1〜6アルキルである。)であるか、或いはYは−NR1R2であり、
R1〜10は各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、C4〜6シクロアルキル、ヒドロキシル、C1〜6ヒドロキシアルキル、C2〜6ヒドロキシアルケニル、C2〜6ヒドロキシアルキニル、チオール、C1〜6チオアルキル、C2〜6チオアルケニル、C2〜6チオアルキニル、C1〜6チオアルコキシ、ハロ、C1〜6ハロアルキル、C2〜6ハロアルケニル、C2〜6ハロアルキニル、C1〜6ハロアルコキシ、アミノ、C1〜6アミノアルキル、C2〜6アミノアルケニル、C2〜6アミノアルキニル、C1〜6アミノアルコキシ、シアノ、C1〜6シアノアルキル、C2〜6シアノアルケニル、C2〜6シアノアルキニル及びC1〜6シアノアルコキシ、ニトロ、C1〜6ニトロアルキル、C2〜6ニトロアルケニル、C2〜6ニトロアルキニル及びC1〜6ニトロアルコキシからなる群から選択され、
式Iの化合物の1以上の原子はインビボイメージングに適した放射性同位体である。
【0012】
特記しない限り、「アルキル」という用語は、単独又は組合せで、好ましくは炭素原子数1〜10、さらに好ましくは1〜5、最も好ましくは1〜3の直鎖若しくは枝分れ鎖アルキル基を意味する。このような基の具体例としては、特に限定されないが、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソ−アミル、ヘキシル、オクチルが挙げられる。
【0013】
「アルケニル」という用語は、二重結合1つを含む直鎖若しくは枝分れ脂肪族炭化水素基をいう。例は、ビニル(エテニル)、アリル、イソプロペニル、1−プロペニル、2−メチル−1−プロペニル、1−ブテニル、2−ブテニル、3−ブテニル、2−エチル−1−ブテニル、3−メチル−2−ブテニル、1−ペンテニル、2−ペンテニル、3−ペンテニル、4−ペンテニル、4−メチル−3−ペンテニル、1−ヘキセニル、2−ヘキセニル、3−ヘキセニル、4−ヘキセニル及び5−ヘキセニルなどの基である。
【0014】
「アルキニル」という用語は、三重結合1つを含む直鎖若しくは枝分れ脂肪族炭化水素基をいう。例には、エチニル、1−プロピニル、2−プロピニル、1−ブチニル、2−ブチニル、3−ブチニル、1−ペンチニル、2−ペンチニル、3−ペンチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、3−ヘキシニル、4−ヘキシニル及び5−ヘキシニルなどの基が挙げられる。
【0015】
特記しない限り、「アルコキシ」という用語は、単独又は組合せで、アルキルエーテル基を意味し、この中で用語アルキルは上記で定義した通りである。適切なアルキルエーテル基の具体例としては、特に限定されないが、メトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、イソ−ブトキシ、sec−ブトキシ、tert−ブトキシが挙げられる。
【0016】
特記しない限り、「シクロアルキル」という用語は、単独又は組合せで、飽和若しくは部分飽和単環状、二環状若しくは三環状アルキル基を意味し、この場合、各環部分は、好ましくは環炭素原子数3〜8個、さらに好ましくは環炭素原子数3〜7個、最も好ましくは環炭素原子数4〜6個を含有し、又適宜に、本明細書でアリールの定義に関して定義される通りに適宜置換されるベンゾ縮合環系とすることができる。このようなシクロアルキル基の具体例としては、特に限定されないが、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、オクタヒドロナフチル、2,3−ジヒドロ−1H−インデニル、アダマンチルが挙げられる。
【0017】
「ヒドロキシル」という用語は−OH基をいう。本明細書で用いる「ヒドロキシアルキル」、「ヒドロキシアルケニル」及び「ヒドロキシアルキニル」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のヒドロキシ基をいう。
【0018】
「ハロ」という用語は、フッ素、塩素、臭素又はヨウ素から選択される置換基を意味する。本明細書で用いる「ハロアルキル」、「ハロアルケニル」、「ハロアルキニル」、「ハロアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のハロ基をいう。好ましいハロ置換基はフルオロ及びヨードである。
【0019】
「チオール」という用語は、−SH基を意味する。本明細書で用いる「チオアルキル」、「チオアルケニル」、「チオアルキニル」、「チオアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のチオール基をいう。
【0020】
本明細書で用いる「シアノ」という用語は、−CN基をいう。本明細書で用いる「シアノアルキル」、「シアノアルケニル」、「シアノアルキニル」、「シアノアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のシアノ基をいう。シアノアルキルの代表的例としては、シアノメチル、2−シアノエチル、及び3−シアノプロピルが挙げられる。
【0021】
「ニトロ」という用語は、−NO2基を意味する。本明細書で用いる「ニトロアルキル」、「ニトロアルケニル」、「ニトロアルキニル」、「ニトロアルコキシ」という用語は、それぞれアルキル、アルケニル、アルキニル又はアルコキシを通じて親分子部分に付加される1個以上のニトロ基をいう。
【0022】
本明細書で用いる「式Iの化合物」という用語は、遊離化合物又は別法として、その医薬として許容できる塩、プロドラッグ(エステルなど)若しくは溶媒和物を意味する。適切な塩、プロドラッグ又は溶媒和物は、国際公開第2004/083195号及び同第02/16333号に記載されている通りである。
【0023】
式Iについて、
ZがS、NR’又はOであり、
Yが−NR1R2であり、
R1〜10が各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ヒドロキシル、C1〜6ヒドロキシアルキル、ハロ、C1〜6ハロアルキル、及びC1〜6ハロアルコキシからなる群から選択されることが好ましい。
【0024】
式Iについて、
ZがSであり、
Yが−NR1R2であり、
R1〜10が各々独立に水素、C1〜3アルキル、C2〜4アルケニル、C2〜4アルキニル、C1〜3アルコキシ、ヒドロキシル、C1〜3ヒドロキシアルキル、ハロ、C1〜3ハロアルキル、及びC1〜3ハロアルコキシからなる群から選択されることが最も好ましい。
【0025】
特に好ましい実施形態において、式Iの化合物は、式Iaの化合物である。
【0026】
【化3】

式中、
R11及びR12は独立に水素、C1〜6アルキル、C1〜6アルコキシ、ニトロ、アミノ、C1〜6アミノアルキル、ハロ又はC1〜6ハロアルキルから選択され、
R13は水素、ヒドロキシ、ニトロ、シアノ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ハロ、C1〜6ハロアルキル、C1〜6ハロアルケニル、−COOR’、−OCH2OR’(R’は、式Iについて定義した通りである。)であり、
Yaは水素、ヒドロキシル、C1〜6アルキル、C1〜6アルコキシ若しくはハロであり又は式Iについて上記で定義した−NR1R2である。
【0027】
式Iaの化合物について、
R11及びR12が独立に水素、C1〜6アルキル又はハロから選択され、
R13がヒドロキシ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ又はハロであり、
Yaがハロ又は式Iについて上記で定義した−NR1R2であることが好ましい。
【0028】
式Iaの化合物について、
R11及びR12が独立に水素又はハロから選択され、
R13がヒドロキシ又はC1〜6アルコキシであり、
Yaが−NR1R2(R1は水素であり、又R2は水素、C1〜6アルキル又はC1〜6ハロアルキルである。)であることが最も好ましい。
【0029】
「インビボイメージングに適した放射性同位体」は、インビボ投与に続いて、非侵襲的方法で外部的に検出することができる放射性同位体である。このような放射性同位体の例には、ガンマ線を放射する放射性ハロゲン及び陽電子を放射する放射性非金属、特に単光子放射断層撮影(SPECT)又は陽電子放射断層撮影(PET)を使用してイメージングするのに適したものが挙げられる。この放射性同位体は、11C、123I、124I、125I、131I、75Br、76Br、77Br及び18Fから、最も適切には11C、123I、及び18Fから選択されるのが適切である。
【0030】
特に好ましい実施形態において、本発明の放射性医薬組成物は、R11〜R13又はYaのうちの1つが、放射性炭素若しくは放射性ハロゲンであり又は放射性炭素若しくは放射性ハロゲンを含む、式Iaの化合物である。放射性炭素が11Cであり、又放射性ハロゲンが、好ましくは123I、124I、125I、131I、75Br、76Br、77Br、17F及び18Fから選択されるのが好ましい。放射性ハロゲンが、123I又は18Fであるのが最も好ましい。式Iaが放射性炭素を含む場合、それがYa内の原子であることが好ましく、Yaが−NR1R2であることが最も好ましい。式Iaが放射性ハロゲンを含む場合、それが、R11若しくはYaの放射性ハロゲンであり又はYaが−NR1R2(R1は水素であり、又R2はC1〜6ハロアルキル若しくはC2〜6ハロアルケニルである。)である場合、Ya内の原子であることが好ましい。
【0031】
特に好ましい式Iaの化合物の非限定的な例は、以下のものである。
【0032】
【化4】

「生体適合性担体媒質」は、放射性医薬品を懸濁若しくは溶解している流体、特に液体であり、生理学的に許容される、すなわち毒性若しくは過度の不快感がなく哺乳動物の身体に投与することができる放射性医薬組成物をもたらす。典型的な、生体適合性担体媒質は、例えば発熱物質を含まない注射用水、等張性生理食塩水及びエタノール水溶液である。本発明の放射性医薬組成物のためにエタノール水溶液が好ましく、本発明の組成物のために5〜10体積/体積%のエタノールが特に適している。この生体適合性担体媒質は、エタノール6〜8体積/体積%、最も好ましくはエタノール6.5〜7.5体積/体積%を含むエタノール水溶液であることが好ましく、7体積/体積%が特に好ましい。
【0033】
本放射性医薬組成物は、pH調節剤、医薬として許容できる安定剤若しくは酸化防止剤(アスコルビン酸、ゲンチジン酸又はパラ−アミノ安息香酸など)、抗菌防腐剤又はフィラーなどの付加成分をさらに適宜含むことができる。
【0034】
「pH調節剤」という用語は、哺乳動物投与のために放射性医薬組成物のpHを許容できる限界(およそpH4.0〜10.5)内に確実に保持するのに役立つ化合物又は化合物の混合物を意味する。適切なこのようなpH調節剤には、トリシン、リン酸若しくはTRIS[すなわちトリス(ヒドロキシメチル)アミノメタン]などの医薬として許容できる緩衝剤、及び炭酸ナトリウム、重炭酸ナトリウム又はこれらの混合物などの医薬として許容できる塩基が挙げられる。pHは、6.0〜8.5、適切には6.0〜8.0の範囲内に、又最も好ましくは5.8〜7.2の範囲内に保持することが好ましく、7.0〜7.2の範囲内のpHが特に好ましい。本発明の放射性医薬組成物のために好ましい緩衝剤は、好ましくは0.005〜0.1M、最も好ましくは0.01M〜0.1M、特に好ましくは0.01〜0.05M、又最も特に好ましくは0.01〜0.02Mのリン酸緩衝液である。
【0035】
「抗菌防腐剤」という用語とは、細菌、酵母又はカビなどの有害な可能性のある微生物の成長を抑制する薬剤を意味する。抗菌防腐剤は、用量に応じていくらかの殺菌性状をも呈することができる。本発明の1種以上の抗菌防腐剤の主な役割は、放射性医薬組成物中のこのような任意の微生物の成長を抑制することである。適切な1種以上の抗菌防腐剤には、パラベン、すなわちメチル、エチル、プロピル若しくはブチルパラベン又はこれらの混合物、ベンジルアルコール、フェノール、クレゾール、セトリミド及びチオメルサルが挙げられる。好ましい1種以上の抗菌防腐剤はパラベンである。
【0036】
「フィラー」という用語とは、製品製造の間材料取扱いを容易にし得る、医薬として許容できる充填剤を意味する。適切なフィラーには、塩化ナトリウムなどの無機塩、及びスクロース、マルトース、マンニトール若しくはトレハロースなどの水溶性糖又は糖アルコールが挙げられる。
【0037】
放射性医薬組成物についての原則として、目標は、医薬として有効な、並びに生理学的に許容される組成物を生成させる、可能な限り最低量の賦形剤を有することである。
【0038】
本発明の放射性医薬組成物は、使用のため、完全な無菌性を維持しながら、皮下針による単回若しくは多回穿刺に適しているシール(例えば圧着された隔壁シール密閉部)を備えた容器で適切に供給される。このような容器は、単回若しくは多回の患者投与量を収容できる。典型的な投与量容器は、単回若しくは多回の患者投与量を収めた小口ビン(体積5〜50cm3、例えば10〜30cm3が適している)を備え、それにより、臨床状況に適合した実行可能な製剤の有効期間内に種々の時間間隔で、患者投与量(複数可)を、こうして臨床等級注射器中に吸引することができる。薬液充填済み注射器は、単回患者投与量を収めるように設計され、したがって臨床使用に適した使い捨て若しくは他の注射器とするのが好ましい。薬液充填済み注射器は、操作者を放射線照射量から保護するため放射性医薬品用シリンジシールドを備えることができる。適切なこのような放射性医薬品用シリンジシールドは、当技術分野で知られ、鉛又はタングステンのいずれかを含むことが好ましい。典型的には、本発明の放射性医薬組成物は、50〜100MBq/ml、適切には70〜85MBq/ml、より適切には80MBq/mlの放射能濃度を有する。単回患者投与量は、典型的には、投与の時点で50〜400MBq、より典型的には80〜370MBqを含み、1〜10ml、好ましくは約5mlの体積を有するであろう。
【0039】
「ポリソルベート」はポリオキシエチレンソルビタンエステルである。ポリソルベートの総合的記述は、“Nonionic Surfactants”,M.J.Schick,Ed.(Dekker,New York,1967)pp247〜299中に見出すことができる。ポリソルベートの例には、ポリソルベート20、ポリソルベート40、ポリソルベート60及びポリソルベート80が挙げられ、Sigma−Aldrich社から商標名Tween(登録商標)のもとに、それぞれTween20、Tween40、Tween60及びTween80として市販されている。「ポリソルベート」に続く番号は、分子のポリオキシエチレンソルビタン部分に結合した脂肪酸のタイプに関連している。モノラウリン酸エステルは20により示され、モノパルミチン酸エステルは40により示され、モノステアリン酸エステルは60により、又モノオレイン酸エステルは80により示される。ポリソルベートの濃度は、フィルタータイプの範囲への式Iの化合物の付着を実質的に無くすのに十分な適切なものとする。調剤の間フィルターへの式Iの化合物の損失は、0〜10%、最も好ましくは0〜5.0%、特に好ましくは0〜1.0%の範囲にあり、又最も特に好ましくは0%であることが好ましい。好ましい実施形態において、放射性医薬品製剤のポリソルベートは、ポリソルベート20又はポリソルベート80から選択され、ポリソルベート80が特に好ましい。この放射性医薬品製剤中に存在するポリソルベートの濃度は、0.25〜2.5重量/体積%の範囲に、最も好ましくは0.5〜1.0重量/体積%の間にあり、又特に好ましくは0.5重量/体積%であることが好ましい。
【0040】
式Iの化合物は、市販の出発材料から又は国際公開第2002/16333号、同第2004/083195号及び同第2007/020400号に記載されている出発材料を使用して、或いは有機化学の標準的方法によって調製できる。
【0041】
放射性炭素又は放射性ハロゲンなどの放射性標識を含む式Iの化合物は、放射性炭素又は放射性ハロゲンの適切な供給源との、前駆体化合物の反応によって便利に調製できる。
【0042】
「前駆体化合物」は、好都合な化学形態の放射性標識との化学反応が特定の部位で起こり、最小の段階数(理想的には単一段階)で行うことができ、又著しい精製の必要がなくて(理想的にはさらなる精製なしで)、所望の式Iの放射性標識化合物をもたらすように設計された、式Iの放射性標識化合物の誘導体を含む。このような前駆体化合物は合成のものであり、良好な化学的純度で便利に得ることができる。この前駆体化合物は、この前駆体化合物のいくつかの官能基のための保護基を適宜含むことができる。
【0043】
「保護基」とは、望ましくない化学反応を阻害若しくは抑制するが、十分に反応性であって、分子の残部が改変されない十分に穏やかな条件下で、問題の官能基から切断できるように設計されている基を意味する。脱保護した後、所望の式Iの放射性標識化合物が得られる。保護基は、当業者に周知であり、アミン基については、Boc(この場合Bocはtert−ブチルオキシカルボニルである。)、Fmoc(この場合Fmocはフルオレニルメトキシカルボニルである。)、トリフルオロアセチル、アリルオキシカルボニル、Dde[すなわち1−(4,4−ジメチル−2,6−ジオキソシクロヘキシリデン)エチル]又はNpys[すなわち3−ニトロ−2−ピリジンスルフェニル]から、又カルボキシル基については、メチルエステル、tert−ブチルエステル又はベンジルエステルから適切に選択される。ヒドロキシル基について、適切な保護基は、メチル、エチル若しくはtert−ブチル、アルコキシメチル若しくはアルコキシエチル、ベンジル、アセチル、ベンゾイル、トリチル(Trt)又は、テトラブチルジメチルシリルなどのトリアルキルシリルである。チオール基について、適切な保護基は、トリチル及び4−メトキシベンジルである。さらなる保護基の使用は、‘Protective Groups in Organic Synthesis’,Theorodora W.Greene and Peter G.M.Wuts,(Third Edition,John Wiley & Sons,1999)中に記述されている。
【0044】
放射性ハロゲン又は放射性炭素で標識した式Iの化合物が、本発明の放射性医薬組成物において好ましい。適切な前駆体化合物により、式Iの、放射性ヨウ素化、放射性フッ素化及び放射性カルボニル化化合物を得る方法を、ここに記述している。
【0045】
放射性ヨウ素化
放射性ヨウ素で式Iの化合物に標識する場合、適切な前駆体化合物は、求電子ヨウ素化若しくは求核ヨウ素化のいずれかを受ける又は標識アルデヒド若しくはケトンとの縮合を受ける誘導体を含むものである。第一の範疇の例は、
(a)トリアルキルスタンナン(例えばトリメチルスタンニル又はトリブチルスタンニル)又はトリアルキルシラン(例えばトリメチルシリル)又は有機ホウ素化合物(例えばホウ素酸エステル又は有機トリフルオロホウ酸塩)などの有機金属誘導体、
(b)ハロゲン交換のための非放射性臭化アルキル又は求核ヨウ素化のためのアルキルトシレート、メシレート若しくはトリフレート、
(c)求電子ヨウ素化に向かって活性化された芳香環(例えばフェノール、フェニルアミン)及び求核ヨウ素化に向かって活性化された芳香環(例えばアリールヨードニウム塩アリールジアゾニウム、アリールトリアルキルアンモニウム塩又はニトロアリール誘導体)
である。
【0046】
放射性ヨウ素化のための前駆体化合物は、ヨウ素化アリール若しくは臭化アリールなどの非放射性ハロゲン原子(放射性ヨウ素交換を可能にするため)、活性化芳香環(例えばフェノール若しくはフェニルアミン)、有機金属置換基(例えば、トリアルキルスズ、トリアルキルシリル又は有機ホウ素化合物)又はトリアゼンなどの有機置換基若しくはヨードニウム塩などの求核置換のための良好な脱離基を含むことが好ましい。放射性ヨウ素化のため、前駆体化合物は、活性化アリール環又は有機金属置換基を含むことが好ましく、有機金属置換基はトリアルキルスズであることが最も好ましい。
【0047】
有機分子中に放射性ヨウ素を導入する前駆体化合物及び方法は、Bolton[J.Lab.Comp.Radiopharm.,45,485〜528(2002)]に記載されている。適切なホウ酸エステル有機ホウ素化合物及びそれらの調製は、Kabalakaら[Nucl.Med.Biol.,29,841〜843(2002)及び30,369〜373(2003)]に記載されている。適切な有機トリフルオロホウ酸塩及びそれらの調製は、Kabalakaら[Nucl.Med.Biol.,31,935〜938(2004)]に記載されている。
【0048】
放射性ヨウ素が結合することができるアリール基の例を以下に挙げる。
【0049】
【化5】

(この場合アルキルは、メチル又はブチルが好ましい。)。これらの基は、芳香環での容易な放射性ヨウ素置換を可能にするいくつかの置換基を含有する。放射性ヨウ素を含有する代替的な置換基は、放射性ハロゲン交換による直接ヨウ素化によって合成することができ、例えば以下の通りである。
【0050】
【化6】

飽和脂肪族系に結合したヨウ素原子は、インビボで代謝し易くしたがって放射性ヨウ素が失われ易いことが知られているので、放射性ヨウ素原子は、ベンゼン環などの芳香環又はビニル基に直接共有結合により結合することが好ましい。
【0051】
放射性ヨウ素の供給源は、ヨウ化物イオン又はヨードニウムイオン(I+)から選択される。化学形態が、放射性合成中に酸化剤により求電子化学種に典型的に変換されるヨウ化物イオンであることが最も好ましい。
【0052】
式Iの化合物の放射性ヨウ素化についてのいくつかの方法に関するさらなる詳細は、国際公開第2002/16333号及び同第2004/083195号に記載されている。
【0053】
放射性フッ素化
フッ素の放射性同位体で式Iの化合物を標識する場合、フッ化アルキルがインビボ代謝に抵抗性があるため、放射性フッ素原子は、フルオロアルキル若しくはフルオロアルコキシ基の一部を形成させることができる。フルオロアルキル化は、フルオロアルキル基との、フェノール、チオール及びアミドなどの反応性基を含有する前駆体化合物の反応によって行うことができる。
【0054】
別法として、放射性フッ素原子は、ベンゼン環などの芳香環への直接共有結合により結合できる。このようなアリール系について、アリールジアゾニウム塩、アリールニトロ化合物又はアリール第四級アンモニウム塩からの、18F−フッ化物求核性置換が、アリール−18F誘導体への適切な経路である。
【0055】
放射性フッ素化は、臭化アルキル、アルキルメシレート又はアルキルトシレートなどの良好な脱離基を有する前駆体化合物中の適切な化学基との、18F−フッ化物の反応を使用した直接標識化により行うことができる。
【0056】
18Fの半減期が僅か109.8分なので、中間体18F部分が、高い比放射能を有し、したがって可能な限り急速な反応過程を用いて生成されることが重要である。
【0057】
式Iの化合物の放射性フッ素化についてのいくつかの方法に関するさらなる詳細は、国際公開第2002/16333号、同第2004/083195号及び同第2007/020400号に記載されている。
【0058】
18F−標識誘導体への合成経路のさらなる詳細は、Bolton,J.Lab.Comp.Radiopharm.,45,485〜528(2002)に記載されている。
【0059】
放射性カルボニル化
式Iの化合物を、11Cにより標識する場合、標識化への1つの取組みは、式Iのメチル化化合物の脱メチル化バージョンである前駆体化合物を、[11C]ヨウ化メチルと反応させることである。所望の式Iの標識化合物の特定の炭化水素鎖のグリニャール試薬を、[11C]CO2と反応させることにより、11Cを組み込むことも可能である。11Cは、芳香環のメチル基として導入することもでき、その場合には、前駆体化合物はトリアルキルスズ基又はB(OH)2基を含むであろう。
【0060】
11Cの半減期が僅か20.4分なので、中間体11C部分が、高い比放射能を有し、したがって可能な限り急速な反応過程を用いて生成されることが重要である。
【0061】
式Iの化合物の放射性カルボニル化についてのいくつかの方法に関するさらなる詳細は、国際公開第2002/16333号及び同第2004/083195号に記載されている。
【0062】
このような11C−標識化技術の完全な総説は、Handbook of Radiopharmaceuticals,Ed.M.J.Welch and C.S.Redvanly(2003,John Wiley and Sons)における、Antoniらの“Aspects on the Synthesis of 11C−Labelled Compounds”中に見出すことができる。
【0063】
式Iの化合物に放射性標識する場合、例えば放射性薬学で使用するキットの一部として前駆体化合物を提供できることが便利である。このようなキットには、適切に適応させた自動合成装置に差し込むことができるカートリッジを収めることができる。このカートリッジには、前駆体のほかに、任意の望ましくない放射性イオンを除去するカラムと、反応混合物を蒸発させ、要求通りに生成物を製剤するように接続された適正な容器とを収めることができる。合成に必要とされる試薬及び溶媒並びに他の消耗品も、放射線濃度、体積、送達時間などについての顧客の要求条件に一致するような形で合成装置を操作させるソフトウエアを納めたコンパクトディスクと一緒に収めることができる。キットの全ての構成部分を使い捨てとして、使用間に汚染される可能性を最小にすること、及び無菌とし且つ品質保証できることが便利である。
【0064】
合成に続いて、式Iの化合物は精製を要する可能性があり、それは標準的方法を使用して、例えば高速液体クロマトグラフィー(HPLC)、イオン交換クロマトグラフィーを使用して、且つ/又は溶媒交換カートリッジを通過させて、行うことができる。
【0065】
高速液体クロマトグラフィー(HPLC)は、放射性医薬品の調製に通常使用され、式Iの化合物の合成に続く粗反応混合物中に存在する任意の化学的不純物を除去するため使用することができる。任意の特定の化合物について、HPLC方法を最適化する必要がある。中性、酸性若しくは塩基性pHにおいて様々な有機溶媒、例えばメタノール、アセトニトリル、エタノール、2−プロパノールの1つと一緒に順相若しくは逆相カラムを使用することができる。中性pH条件で逆相カラムを使用して、式Iの化合物の最も有利な分離を達成することが好ましい。
【0066】
溶媒交換カートリッジを使用した精製は、カラムへの式Iの化合物の充填に続く、式Iの化合物に適した溶媒によるカラムについての溶離を伴い、エタノール及びエタノール水溶液が好ましい溶媒である。適切な溶媒交換カートリッジには、C8、C18又はC30などのSEP−Pak(商標)カートリッジ(Waters社)が挙げられる。
【0067】
さらなる態様において、本発明は、本発明の放射性医薬組成物の調製方法であって、
(i)式Iの化合物、生体適合性担体媒質、及び0.05〜5.0重量/体積%のポリソルベートを混和する段階、及び
(ii)必要に応じて、得られた混合物のpHを4.0〜10.5に調節する段階
を含む方法に関する。
【0068】
段階(ii)に従って、本組成物を滅菌することができる。滅菌は、当技術分野の標準的方法、例えばガンマ線照射、オートクレーブ処理、乾燥加熱、メンブラン濾過(無菌濾過と呼ばれることがある)又は化学処理(例えばエチレンオキシドによる)によって実施できる。無菌濾過は、その中を通って放射性医薬組成物を通過させる調剤キットによって達成することができる。このような調剤キットは無菌でなければならないものであり、典型的には0.2μm気孔フィルターを備え、それと共にシリコーンチューブを備え、それにより放射性医薬組成物がフィルターを通過し、且つバイアル又は注射器などの適切な無菌受け器に入ることを可能にする。
【0069】
したがって、上述の、本発明の放射性医薬組成物の調製方法であって、
(iii)段階(ii)から得られる組成物を、好ましくは無菌濾過によって滅菌する段階
をさらに含む方法をさらに提供する。
【0070】
段階(i)は、上述の溶媒交換カートリッジに、式Iの化合物を充填し、次いで、生体適合性担体媒質中に含まれる溶媒若しくは溶媒の混合物(例えば水及びエタノール)で溶離することによって、便利に行うことができる。溶離液は、ポリソルベート並びに、フィラー(例えば塩化ナトリウム)及びpH調節剤(例えば、リン酸緩衝液などの医薬として許容できる緩衝剤)などの任意の他の賦形剤を充填済みのバイアルなどの収集容器内に集めることができる。好ましい一実施形態において、この収集容器は上述のように充填済みとし、次いで−30℃〜−10℃、適切には−25℃〜−15℃、より適切には−20℃の低温で貯蔵し、次いで使用直前に室温とする。ポリソルベートをこの方法で貯蔵することにより、その有効期間を延ばし、且つより高い放射線濃度(RAC)を有する放射性医薬組成物の製造が可能になることが、見出されている。 段階(i)において、式Iの化合物、生体適合性担体媒質、及びポリソルベート、並びにそのための好ましい実施形態は、それぞれ上記で定義した通りである。上述のように、好ましい生体適合性担体媒質は、エタノール水溶液である。
【0071】
本調製方法の段階(ii)は、段階(i)の間若しくはその後に行うことができる。例えば、上述のように、pH調節剤は、段階(i)の間に充填済み収集容器内に入れることができ、或いは段階(i)を実行する間若しくは実行した後に、収集容器に添加できる。
【0072】
本調製方法の好ましい実施形態において、上述のように、1つ以上の段階が自動化される。
【0073】
実施例1〜4は、無菌濾過の間、調剤キットの構成部分の範囲に化合物Iが付着することを低減する、本発明の組成物及び方法の利点を実証する。
【0074】
なおさらなる態様において、本発明は、被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定に使用するための本発明の放射性医薬組成物に関する。このアミロイド沈着物はアミロイドβの沈着物であり、又この被検体の器官又は体領域は脳であることが好ましい。本発明の放射性医薬組成物は、アミロイド状態を有することが疑われた被検体における1か所以上のアミロイド沈着物をインビボイメージングするためのものである。「アミロイド状態」とは、アルツハイマー病(AD)、家族性AD、ダウン症候群、アミロイド症、真性II型糖尿病、及びアポリポタンパクE4対立遺伝子のためのホモ接合体などのアミロイド沈着によって特徴付けられる障害若しくは状態である。本発明の方法は、ADをインビボイメージングするためのものであることが好ましい。「インビボイメージング」は、被検体への本発明の放射性医薬組成物の投与に続いて、式Iの化合物の検出を可能にする任意の方法をいう。好ましいインビボイメージングの方法は、陽電子放射断層撮影(PET)及び単光子放射断層撮影(SPECT)であり、PETが特に好ましい。「被検体」は哺乳動物、好ましくはヒトである。代替的実施形態において、本発明の方法は、典型的にはアミロイド状態特異性治療に応答する、アミロイド状態の進行又は寛解を監視する手段として、2つ以上のはっきり識別される時点で行うことができる。
【0075】
したがって、被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定方法であって、
(i)本発明の放射性医薬組成物の検出可能な量を被検体に投与し、
(ii)式Iの化合物を被検体内の任意のアミロイド沈着物に結合させ、
(iii)インビボイメージングにより、被検体内の1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定する
段階を含む方法を提供する。
【0076】
上記の段階(ii)及び(iii)は、放射性医薬組成物を予め投与した被検体における1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定するための、本発明の放射性医薬組成物の独立(スタンドアローン)な使用であると理解することもできる。
【0077】
「検出可能な量」は、投与された放射性医薬組成物の量が、被検体内のアミロイドに式Iの化合物が結合したことの検出を可能にするのに十分であることを意味する。注入される放射能は、典型的には50〜400MBq、より典型的には80〜370MBqであり、又1〜10ml、好ましくは約5mlの体積を有するであろう。
【0078】
本発明のこの態様は又、被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定するのに使用するための、本発明の放射性医薬組成物の製造における式Iの化合物の使用をも包含する。
【0079】
実施例の簡単な説明
実施例1は、PEG400、プロピレングリコール又はポリソルベート20を有する[19F]化合物1の製剤を比較するために行った実験を記述する。
【0080】
実施例2は、ポリソルベート20又はポリソルベート80を有する[19F]化合物1の製剤を比較するために行った実験を記述する。
【0081】
実施例3は、2種の異なったフィルタータイプへの、ポリソルベート80を有する[19F]化合物1の製剤の付着を比較するために行った実験を記述する。
【0082】
実施例4は、3種の異なったシリコーンチューブタイプへの、ポリソルベート80を有する[19F]化合物1の製剤の付着を比較するために行った実験を記述する。
【0083】
実施例5は、[18F]化合物1の自動合成、及び本発明の組成物としたその製剤について記述する。
【実施例】
【0084】
実施例1
PEG400、及びプロピレングリコールを有する化合物1製剤の除菌調剤
pH7.4の0.01Mナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び(i)12体積/体積%のプロピレングリコール(PG)又は(ii)10体積/体積%のポリエチレングリコール400(PEG400)のいずれかを含有する溶液を調製した。下記の実験において、高速液体クロマトグラフィー(HPLC)により、調剤キットの種々の構成部分への化合物1の損失百分率を評価した。
【0085】
【表1】

両賦形剤について、注射器及び硬質管内で失われた量は少なかった。主な損失は、フィルター内で見られ、又プロピレングリコールについてはシリコーン管内でも見られた。これらの結果は、12%のPG又は10%のPEG400の存在する状態でも、調剤キット表面への、最も顕著にはフィルターへの化合物1の著しい損失が観察されたことを示している。
【0086】
実施例2
ポリソルベート20及びポリソルベート80を有する化合物1組成物の無菌濾過の比較
pH7.4の0.01Mナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び選択された体積/体積%量のポリソルベート20及びポリソルベート80を含有する溶液を調製した。下記のように、4種の濾過実験を行った。
【0087】
【表2】

各溶液を、その体積がおよそ9.5mlであることが判明している10ml注射器中に吸引した。注射器内における体積を、9mlに減らし整えた。その残りを、濾過前の分析用試料として使用した(未処理標準)。
【0088】
直径25mm、“Supor(登録商標)親水性ポリエーテルスルホン及び疎水性バンドRepelメンブラン”(気孔0.20μm及び2.80cm”)を有するPall社S−200 DLL25 Repel(商標)Stripeフィルター(Pallフィルター)を通して濾過を行った。1回分当り1mlの溶液を、フィルターに圧搾通過させた。最初の1ml部分について、およそ0.4mlしか通過して出なかった(デッド体積およそ0.6ml)。残りの部分は、およそ1.9mlである最後の部分を除いて、1mlであったが、空気も圧搾通過させて溶液の全体積を集めた。部分の体積は、自動ピペットを使用して測定した。
【0089】
Tween溶液は幾分発泡し、そのため溶液は注意深くフィルターを圧搾通過させなければならなかった(9mlを濾過する平均時間はおよそ1分及び20秒であった。)。
【0090】
濾過後の回収率は、次の通りであった。
【0091】
【表3】

濾過後の全体回収率は、0.1%のポリソルベート20及び80について92%であり、5.0%のポリソルベート20及び80について100%であった。これらの結果は、低濃度であっても、化合物Iの製剤中にポリソルベート20又はポリソルベート80のいずれかが存在すると、その結果フィルターへの化合物Iの損失が著しく低減されたことを実証している。
【0092】
実施例3
種々のフィルタータイプでの化合物1組成物の無菌濾過の比較
pH7.4の10mMナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び選択された体積/体積%量のポリソルベート80を含有する溶液を調製した。下記のように、Pallフィルター並びに、Durapore(登録商標)メンブランを有するMillipore社Millex(登録商標)GV33mmフィルターユニット0.22μm(Millexフィルター)を使用し、又種々の体積/体積%量のポリソルベート80を使用して、10種の濾過実験を行った。
【0093】
【表4】

各溶液を、その体積がおよそ9.5mlであることが判明している10ml注射器中に吸引した。注射器内における体積を、9mlに減らし整えた。その残りを、濾過前の分析用試料として使用した(未処理標準)。
【0094】
各溶液は、上記に示したフィルターを、一気に圧搾通過させ、およそ16秒を要した。化合物1の領域に基づいて計算した濾過後の回収率%は、下記の通りであった。
【0095】
【表5】

これらの結果は、0.3体積/体積%以上の濃度のポリソルベート80が存在すると、以前に顕著な損失が観察されたフィルターについてさえも、化合物1の損失を低減させるのに十分であることを明確に実証している。
【0096】
実施例4
種々のシリコーンチューブへの化合物1吸着の比較
pH7.4の10mMナトリウムリン酸緩衝液中の7体積/体積%のエタノール、75μgの化合物1、及び選択された体積/体積%量のポリソルベート80を含有する溶液を調製した。下記のように、種々のシリコーンチューブタイプを試験した。
【0097】
【表6】

各実験において、チューブ上への化合物1の損失百分率を計算した。チューブを通る通過前及び通過後にフッ素を試験し、結果は、下記の通りであった。
【0098】
【表7】

これらの結果は、製剤中に1.0体積/体積%以上のポリソルベートを包含すると、各チューブタイプへの化合物1の著しい損失が低減され又は無くなりさえすることを実証している。
【0099】
実施例5
2−[3−[18F]フルオロ−4−(メチルアミノ)フェニル]−6−ヒドロキシ−ベンゾチアゾール(化合物1)の自動合成
FASTlab(商標)(GE Healthcare社)自動合成装置ユニットのための単回使用流体経路に、下記の試薬を充填し、このFASTlabプラットフォーム上に取り付けた。
【0100】
I.80:20アセトニトリル:水中の150mM重炭酸テトラブチルアンモニウム(0.8ml)、
II.最終中間体溶液:ジメチルスルホキシド中の75mM2−[3−ニトロ−4(メチルホルミルアミノ)フェニル]−6−エトキシメトキシ−ベンゾチアゾール(1.37ml)、
III.4M塩酸(4ml)、
IV.エタノール(2×4ml)、
V.水(100ml)。
【0101】
さらに、下記の賦形剤を入れた生成物収集バイアルを、FASTlabプラットフォームに隣接した位置に置いた。
0.67(重量/体積)%のポリソルベート80、1.21(重量/体積)%の塩化ナトリウム、18.82mMリン酸緩衝液(pH7)(合計体積37.2ml)。
【0102】
[18O]−濃縮水中の[18F]フッ化物の溶液を合成装置の出発位置中に充填すると、操作者は、下記の事象のシーケンスを行わせるプログラムを開始した。
【0103】
フッ化物溶液が、QMA(第四級メチルアンモニウム)カートリッジを通過して、フッ化物を捕捉し、又濃縮水を廃液に送った。次いで、フッ化物を回収するためにQMAカートリッジで、350μlの150mM重炭酸テトラブチルアンモニウムにより溶離し、得られた溶液を反応器容器に送った。
【0104】
反応器容器を120℃に加熱し、窒素流を溶液上に通しながら真空下に5分間保持した。次いで同じ加熱及び真空条件下で窒素流を、残った溶液に4分間直接通して、反応器の内容物を乾燥させた。最終中間体溶液(1ml)を、反応器容器に添加し、15分間温度を130℃に上昇させた。この段階により、最終中間体内への[18F]フッ化物の組込みが可能となる。この溶液を95℃まで冷却し、0.25mlの塩酸溶液を添加した。この混合物を5分間125℃に加熱して、ベンゾチアゾール誘導体の脱保護を達成し、2−[3−[18F]フルオロ−4−(メチルアミノ)フェニル]−6−ヒドロキシ−ベンゾチアゾールの粗製溶液を生成した。反応器容器を1mlのエタノール:水(体積で1:1)で希釈し、FASTlabに隣接した位置に置いたC30 HPLCカラム(250×10mm、5μm)上に注入した。カラムでは、5ml/分の0.8%のトリエチルアミン:アセトニトリル(体積で53:47)で溶離した。所望の生成物を、放射線検出により特定し、分流してFASTlab上に戻した。得られた精製2−[3−[18F]フルオロ−4−(メチルアミノ)フェニル]−6−ヒドロキシ−ベンゾチアゾール溶液は、2つのC30固相抽出カートリッジ(エタノール1m及び水15mlで前調質されている)を直接通過させ、それにより生成物をカートリッジ上に保持した。カートリッジを水ですすいで洗浄し、残ったHPLC溶離溶媒を廃液に送った。次いで生成物をエタノール3.5ml続いて水9.3mlによりC30カートリッジから溶出させ、薬液充填済みの生成物収集バイアルに入れて、最終生成物体積50mlをもたらした(0.5(重量/体積)%のポリソルベート80、7(体積/体積)%のエタノール、0.9(重量/体積)%の塩化ナトリウム、14mMリン酸緩衝液(pH7))。
【特許請求の範囲】
【請求項1】
放射性医薬組成物であって、pH4.0〜10.5において
(i)以下の式Iの化合物と、
(ii)生体適合性担体媒質と、
(iii)0.05〜5.0重量/体積%のポリソルベートと
を含む組成物。
【化1】

式中、
ZはS、NR’、O又はC(R’)2であり、各R’は独立にH又はC1〜6アルキルであって、ZがC(R’)2のときは互変異性体の形態の複素環は次式のインドールであり、
【化2】

Yは水素、C1〜6アルキル、ハロ、OR’若しくはSR’(R’はH又はC1〜6アルキルである。)であるか、或いはYは−NR1R2であり、
R1〜10は各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、C4〜6シクロアルキル、ヒドロキシル、C1〜6ヒドロキシアルキル、C2〜6ヒドロキシアルケニル、C2〜6ヒドロキシアルキニル、チオール、C1〜6チオアルキル、C2〜6チオアルケニル、C2〜6チオアルキニル、C1〜6チオアルコキシ、ハロ、C1〜6ハロアルキル、C2〜6ハロアルケニル、C2〜6ハロアルキニル、C1〜6ハロアルコキシ、アミノ、C1〜6アミノアルキル、C2〜6アミノアルケニル、C2〜6アミノアルキニル、C1〜6アミノアルコキシ、シアノ、C1〜6シアノアルキル、C2〜6シアノアルケニル、C2〜6シアノアルキニル及びC1〜6シアノアルコキシ、ニトロ、C1〜6ニトロアルキル、C2〜6ニトロアルケニル、C2〜6ニトロアルキニル及びC1〜6ニトロアルコキシからなる群から選択され、
式Iの化合物の1以上の原子はインビボイメージングに適した放射性同位体である。
【請求項2】
式Iの化合物において、
ZがS、NR’又はOであり、
R1〜10が各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ヒドロキシル、C1〜6ヒドロキシアルキル、ハロ、C1〜6ハロアルキル、及びC1〜6ハロアルコキシからなる群から選択される、請求項1記載の放射性医薬組成物。
【請求項3】
式Iの化合物において、
ZがSであり、
Yが−NR1R2であり、
R1〜10が各々独立に水素、C1〜3アルキル、C2〜4アルケニル、C2〜4アルキニル、C1〜3アルコキシ、ヒドロキシル、C1〜3ヒドロキシアルキル、ハロ、C1〜3ハロアルキル、及びC1〜3ハロアルコキシからなる群から選択される、請求項1又は請求項2記載の放射性医薬組成物。
【請求項4】
式Iの化合物が次の式Iaの化合物である、請求項1乃至請求項3のいずれか1項記載の放射性医薬組成物。
【化3】

式中、
R11及びR12は独立に水素、C1〜6アルキル、C1〜6アルコキシ、ニトロ、アミノ、C1〜6アミノアルキル、ハロ及びC1〜6ハロアルキルから選択され、
R13は水素、ヒドロキシ、ニトロ、シアノ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ハロ、C1〜6ハロアルキル、C1〜6ハロアルケニル、−COOR、−OCH2OR(Rは水素又はC1〜6アルキルである。)であり、
Yaは水素、ヒドロキシル、C1〜6アルキル、C1〜6アルコキシ、ハロ又は−NR1R2である(式中、R1及びR2は請求項2で定義した通りである。)。
【請求項5】
式Iaの化合物において、
R11及びR12が独立に水素、C1〜6アルキル又はハロから選択され、
R13がヒドロキシ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ又はハロであり、
Yaがハロ又は−NR1R2(R1及びR2は、請求項2で定義した通りである。)である、請求項4記載の放射性医薬組成物。
【請求項6】
R11及びR12が独立に水素又はハロから選択され、
R13がヒドロキシ又はC1〜6アルコキシであり、
Yaが−NR1R2である(式中、R1は水素であり、又R2は水素、C1〜6アルキル又はC1〜6ハロアルキルである。)、請求項5記載の放射性医薬組成物。
【請求項7】
式I又はIaの化合物中のインビボイメージングに適した放射性同位体が11C、123I、124I、125I、131I、75Br、76Br、77Br及び18Fから選択される、請求項1乃至請求項6のいずれか1項記載の放射性医薬組成物。
【請求項8】
式I又はIaの化合物中のインビボイメージングに適した放射性同位体が18Fである、請求項7記載の放射性医薬組成物。
【請求項9】
式I又はIaの化合物が以下のものから選択される、請求項1乃至請求項7のいずれか1項記載の放射性医薬組成物。
【化4】

【請求項10】
式I又はIaの化合物が次式のものである、請求項1乃至請求項9のいずれか1項記載の放射性医薬組成物。
【化5】

【請求項11】
0.25〜2.5重量/体積%のポリソルベートを含む、請求項1乃至請求項10のいずれか1項記載の放射性医薬組成物。
【請求項12】
0.5〜1.0重量/体積%のポリソルベートを含む、請求項11記載の放射性医薬組成物。
【請求項13】
ポリソルベートがポリソルベート80である、請求項1乃至請求項12のいずれか1項記載の放射性医薬組成物。
【請求項14】
生体適合性担体媒質が、エタノール水溶液、好ましくは5〜10(体積/体積)%のエタノール、さらに好ましくは6〜8(体積/体積)%のエタノール、最も好ましくは6.5〜7.5(体積/体積)%のエタノール、特に7(体積/体積)%のエタノールである、請求項1乃至請求項13のいずれか1項記載の放射性医薬組成物。
【請求項15】
請求項1乃至請求項14のいずれか1項記載の放射性医薬組成物の調製方法であって、
(i)式Iの化合物、生体適合性担体媒質、及び0.05〜5.0重量/体積%のポリソルベートを混和する段階(式Iの化合物、生体適合性担体媒質及びポリソルベートは請求項1乃至請求項14のいずれか1項で定義したものである。)、及び
(ii)必要に応じて、得られた混合物のpHを4.0〜10.5に調節する段階
を含む方法。
【請求項16】
(iii)段階(ii)から得られる組成物を、好ましくは無菌濾過によって滅菌する段階をさらに含む、請求項15記載の方法。
【請求項17】
被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定に使用するための、請求項1乃至請求項14のいずれか1項記載の放射性医薬組成物。
【請求項18】
被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定方法であって、
(i)請求項1乃至請求項14のいずれか1項記載の放射性医薬組成物の検出可能な量を被検体に投与する段階、
(ii)式Iの化合物を被検体内の任意のアミロイド沈着物に結合させる段階、及び
(iii)インビボイメージングにより、被検体内の1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定する段階
を含む方法。
【請求項19】
アミロイド沈着物がアミロイド−βの沈着物であり、又被検体の器官又は体領域が脳である、請求項18記載の方法。
【請求項20】
インビボイメージングがPET又はSPECTで実施される、請求項18乃至請求項19記載の方法。
【請求項21】
アミロイド状態特異性治療に応答する、アミロイド状態の進行又は寛解を監視する手段として、2つ以上のはっきり識別される時点で行われる、請求項18乃至請求項20のいずれか記載の方法。
【請求項1】
放射性医薬組成物であって、pH4.0〜10.5において
(i)以下の式Iの化合物と、
(ii)生体適合性担体媒質と、
(iii)0.05〜5.0重量/体積%のポリソルベートと
を含む組成物。
【化1】

式中、
ZはS、NR’、O又はC(R’)2であり、各R’は独立にH又はC1〜6アルキルであって、ZがC(R’)2のときは互変異性体の形態の複素環は次式のインドールであり、
【化2】

Yは水素、C1〜6アルキル、ハロ、OR’若しくはSR’(R’はH又はC1〜6アルキルである。)であるか、或いはYは−NR1R2であり、
R1〜10は各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、C4〜6シクロアルキル、ヒドロキシル、C1〜6ヒドロキシアルキル、C2〜6ヒドロキシアルケニル、C2〜6ヒドロキシアルキニル、チオール、C1〜6チオアルキル、C2〜6チオアルケニル、C2〜6チオアルキニル、C1〜6チオアルコキシ、ハロ、C1〜6ハロアルキル、C2〜6ハロアルケニル、C2〜6ハロアルキニル、C1〜6ハロアルコキシ、アミノ、C1〜6アミノアルキル、C2〜6アミノアルケニル、C2〜6アミノアルキニル、C1〜6アミノアルコキシ、シアノ、C1〜6シアノアルキル、C2〜6シアノアルケニル、C2〜6シアノアルキニル及びC1〜6シアノアルコキシ、ニトロ、C1〜6ニトロアルキル、C2〜6ニトロアルケニル、C2〜6ニトロアルキニル及びC1〜6ニトロアルコキシからなる群から選択され、
式Iの化合物の1以上の原子はインビボイメージングに適した放射性同位体である。
【請求項2】
式Iの化合物において、
ZがS、NR’又はOであり、
R1〜10が各々独立に水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ヒドロキシル、C1〜6ヒドロキシアルキル、ハロ、C1〜6ハロアルキル、及びC1〜6ハロアルコキシからなる群から選択される、請求項1記載の放射性医薬組成物。
【請求項3】
式Iの化合物において、
ZがSであり、
Yが−NR1R2であり、
R1〜10が各々独立に水素、C1〜3アルキル、C2〜4アルケニル、C2〜4アルキニル、C1〜3アルコキシ、ヒドロキシル、C1〜3ヒドロキシアルキル、ハロ、C1〜3ハロアルキル、及びC1〜3ハロアルコキシからなる群から選択される、請求項1又は請求項2記載の放射性医薬組成物。
【請求項4】
式Iの化合物が次の式Iaの化合物である、請求項1乃至請求項3のいずれか1項記載の放射性医薬組成物。
【化3】

式中、
R11及びR12は独立に水素、C1〜6アルキル、C1〜6アルコキシ、ニトロ、アミノ、C1〜6アミノアルキル、ハロ及びC1〜6ハロアルキルから選択され、
R13は水素、ヒドロキシ、ニトロ、シアノ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ、ハロ、C1〜6ハロアルキル、C1〜6ハロアルケニル、−COOR、−OCH2OR(Rは水素又はC1〜6アルキルである。)であり、
Yaは水素、ヒドロキシル、C1〜6アルキル、C1〜6アルコキシ、ハロ又は−NR1R2である(式中、R1及びR2は請求項2で定義した通りである。)。
【請求項5】
式Iaの化合物において、
R11及びR12が独立に水素、C1〜6アルキル又はハロから選択され、
R13がヒドロキシ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C1〜6アルコキシ又はハロであり、
Yaがハロ又は−NR1R2(R1及びR2は、請求項2で定義した通りである。)である、請求項4記載の放射性医薬組成物。
【請求項6】
R11及びR12が独立に水素又はハロから選択され、
R13がヒドロキシ又はC1〜6アルコキシであり、
Yaが−NR1R2である(式中、R1は水素であり、又R2は水素、C1〜6アルキル又はC1〜6ハロアルキルである。)、請求項5記載の放射性医薬組成物。
【請求項7】
式I又はIaの化合物中のインビボイメージングに適した放射性同位体が11C、123I、124I、125I、131I、75Br、76Br、77Br及び18Fから選択される、請求項1乃至請求項6のいずれか1項記載の放射性医薬組成物。
【請求項8】
式I又はIaの化合物中のインビボイメージングに適した放射性同位体が18Fである、請求項7記載の放射性医薬組成物。
【請求項9】
式I又はIaの化合物が以下のものから選択される、請求項1乃至請求項7のいずれか1項記載の放射性医薬組成物。
【化4】

【請求項10】
式I又はIaの化合物が次式のものである、請求項1乃至請求項9のいずれか1項記載の放射性医薬組成物。
【化5】

【請求項11】
0.25〜2.5重量/体積%のポリソルベートを含む、請求項1乃至請求項10のいずれか1項記載の放射性医薬組成物。
【請求項12】
0.5〜1.0重量/体積%のポリソルベートを含む、請求項11記載の放射性医薬組成物。
【請求項13】
ポリソルベートがポリソルベート80である、請求項1乃至請求項12のいずれか1項記載の放射性医薬組成物。
【請求項14】
生体適合性担体媒質が、エタノール水溶液、好ましくは5〜10(体積/体積)%のエタノール、さらに好ましくは6〜8(体積/体積)%のエタノール、最も好ましくは6.5〜7.5(体積/体積)%のエタノール、特に7(体積/体積)%のエタノールである、請求項1乃至請求項13のいずれか1項記載の放射性医薬組成物。
【請求項15】
請求項1乃至請求項14のいずれか1項記載の放射性医薬組成物の調製方法であって、
(i)式Iの化合物、生体適合性担体媒質、及び0.05〜5.0重量/体積%のポリソルベートを混和する段階(式Iの化合物、生体適合性担体媒質及びポリソルベートは請求項1乃至請求項14のいずれか1項で定義したものである。)、及び
(ii)必要に応じて、得られた混合物のpHを4.0〜10.5に調節する段階
を含む方法。
【請求項16】
(iii)段階(ii)から得られる組成物を、好ましくは無菌濾過によって滅菌する段階をさらに含む、請求項15記載の方法。
【請求項17】
被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定に使用するための、請求項1乃至請求項14のいずれか1項記載の放射性医薬組成物。
【請求項18】
被検体の器官又は体領域における1か所以上のアミロイド沈着物の存在、部位及び/又は量の測定方法であって、
(i)請求項1乃至請求項14のいずれか1項記載の放射性医薬組成物の検出可能な量を被検体に投与する段階、
(ii)式Iの化合物を被検体内の任意のアミロイド沈着物に結合させる段階、及び
(iii)インビボイメージングにより、被検体内の1か所以上のアミロイド沈着物の存在、部位及び/又は量を測定する段階
を含む方法。
【請求項19】
アミロイド沈着物がアミロイド−βの沈着物であり、又被検体の器官又は体領域が脳である、請求項18記載の方法。
【請求項20】
インビボイメージングがPET又はSPECTで実施される、請求項18乃至請求項19記載の方法。
【請求項21】
アミロイド状態特異性治療に応答する、アミロイド状態の進行又は寛解を監視する手段として、2つ以上のはっきり識別される時点で行われる、請求項18乃至請求項20のいずれか記載の方法。
【公表番号】特表2010−536931(P2010−536931A)
【公表日】平成22年12月2日(2010.12.2)
【国際特許分類】
【出願番号】特願2010−522366(P2010−522366)
【出願日】平成20年8月28日(2008.8.28)
【国際出願番号】PCT/EP2008/061275
【国際公開番号】WO2009/027452
【国際公開日】平成21年3月5日(2009.3.5)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
【公表日】平成22年12月2日(2010.12.2)
【国際特許分類】
【出願日】平成20年8月28日(2008.8.28)
【国際出願番号】PCT/EP2008/061275
【国際公開番号】WO2009/027452
【国際公開日】平成21年3月5日(2009.3.5)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
[ Back to top ]

