大腸菌群の検出方法
【課題】試料中の大腸菌群が陰性であるか否かを迅速に判定することができる大腸菌群の検出方法を提供することを課題とする。
【解決手段】大腸菌群の検出対象となる試料を、大腸菌群を培養することができる培地(BGLB培地など)に接種する(ステップS1)。試料が接種された培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する(ステップS2)。培養された培地に界面活性剤を添加するとともに、界面活性剤が添加された培地を40℃〜50℃程度に加温する。加温された培地を、フィルタにより濾過する(ステップS3)。フィルタ上に残留した残留物を液体中に分散させることにより残留物の浮遊液を調製し、浮遊液に含まれる菌体数をフローサイトメータにより計測する(ステップS4)。計測した菌体数に基づいて、試料中の大腸菌群が陰性であるか否かを判定する(ステップS5)。
【解決手段】大腸菌群の検出対象となる試料を、大腸菌群を培養することができる培地(BGLB培地など)に接種する(ステップS1)。試料が接種された培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する(ステップS2)。培養された培地に界面活性剤を添加するとともに、界面活性剤が添加された培地を40℃〜50℃程度に加温する。加温された培地を、フィルタにより濾過する(ステップS3)。フィルタ上に残留した残留物を液体中に分散させることにより残留物の浮遊液を調製し、浮遊液に含まれる菌体数をフローサイトメータにより計測する(ステップS4)。計測した菌体数に基づいて、試料中の大腸菌群が陰性であるか否かを判定する(ステップS5)。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、大腸菌群の検出方法に関し、さらに詳しくは、BGLB(Brilliant
Green Lactose Bile)培地などを用いた大腸菌群の検出方法に関する。
【背景技術】
【0002】
乳および乳製品の成分規格に関する省令(乳等省令)では、牛乳および乳製品の成分規格が定められている。乳等省令では、牛乳および乳製品中の大腸菌群は、陰性であることが定められている。
【0003】
大腸菌群とは、グラム陰性の芽胞を形成しない桿菌であり、48時間以内に乳糖を分解して酸およびガスを産出する好気性細菌または通性嫌気性細菌の一群を指す。Klebsiella、Citrobacter、Enterobacter、Escherichiaなどの属が、大腸菌群に属する。
【0004】
乳等省令では、牛乳の大腸菌群の検出方法として、BGLB法の使用が定められている。BGLB法は、牛乳あるいは乳製品などの検体を接種したBGLB培地を48時間で培養させる必要がある。また、乳等省令では、発酵乳などの乳製品における大腸菌群の検出方法として、デソキシコレート寒天培地(デソ培地)を用いる方法(デソ法)の使用が、定められている。デソ法は、牛乳の自主検査にも用いられる。デソ法は、検体を接種したデソ培地を20時間培養させる必要がある。
【0005】
しかし、BGLB法およびデソ法は、検体中の大腸菌群が陰性であることを確認するまでに長い時間を要するため、牛乳および乳製品の出荷鮮度を維持することが困難である。このため、検体中の大腸菌群の検出時間を短縮することが、以前から望まれている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002−186496号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記特許文献1には、培養時間を短縮することができる大腸菌群の検出方法が開示されている。具体的には、試料をグラム陽性細菌の生育を阻害する培地に接種し、培地を35℃の温度条件下にて12時間程度で培養する。培養後の培地に形成されたコロニーに、発色合成酵素基質を滴下する。大腸菌群のコロニーが発色合成酵素基質により発色するため、培養後の培地における大腸菌群の有無を肉眼により観察することができる。上記特許文献1に係る検出方法は、デソ法により大腸菌群が陽性であると推定された試料の確認試験などに用いられる。
【0008】
上記特許文献1に開示された大腸菌群の検出方法を用いることにより、12時間程度で検体中の大腸菌群が陰性であるか否かを判定することができる。しかし、検体中の大腸菌群を検出するまでの時間をさらに短くすることにより、牛乳および乳製品の安全性や品質をさらに向上させることが可能となる。
【0009】
そこで、本発明は、試料中の大腸菌群が陰性であるか否かを迅速に判定することができる大腸菌群の検出方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記課題を解決するため、請求項1記載の発明は、大腸菌群の検出方法であって、試料を、大腸菌群を培養することができる培地に接種する工程と、前記試料が接種された前記培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する培養工程と、培養された前記培地を、フィルタにより濾過する濾過工程と、前記フィルタに残留した残留物の浮遊液を調製し、前記浮遊液に含まれる菌体数を、フローサイトメータにより計測する計測工程と、計測した前記菌体数に基づいて前記試料中の大腸菌群の有無を判定する判定工程と、を備える。
【0011】
請求項2記載の発明は、請求項1に記載の大腸菌群の検出方法において、前記培地は、BGLB(Brilliant Green Lactose Bile)培地、EC(Escherichia coli)培地、及びラウリル硫酸トリプトースブイヨンのいずれかである。
【0012】
請求項3記載の発明は、請求項1または請求項2に記載の大腸菌群の検出方法において、前記培養工程は、前記試料が接種された前記培地を34.5℃以上35.5℃以下にて培養する。
【0013】
請求項4記載の発明は、請求項1ないし請求項3のいずれかに記載の大腸菌群の検出方法において、前記培養工程は、前記試料が接種された前記培地を4時間以上5時間以下で培養する。
【0014】
請求項5記載の発明は、請求項1ないし請求項4のいずれかに記載の大腸菌群の検出方法において、前記濾過工程は、前記培養された前記培地に界面活性剤を添加し、前記界面活性剤が添加された前記培地を濾過する。
【0015】
請求項6記載の発明は、請求項5に記載の大腸菌群の検出方法において、前記濾過工程は、前記界面活性剤が添加された前記培地を濾過する前に、前記界面活性剤が添加された前記培地を40℃以上47℃以下の温度にて加温する。
【発明の効果】
【0016】
本発明に係る大腸菌群の検出方法は、試料をBGLB培地などの大腸菌群を検出できる培地に接種し、試料が接種された培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する。培養された培地を濾過し、濾過後の残留物の浮遊液を調製する。フローサイトメータにより、浮遊液中の菌体数を計測する。培地の培養時間が5時間以下であるため、本発明に係る大腸菌群の検出方法は、フローサイトメータによる計測に要する時間を含めて、6時間程度で試料中の大腸菌群が陰性であるか否かを判定できる。
【図面の簡単な説明】
【0017】
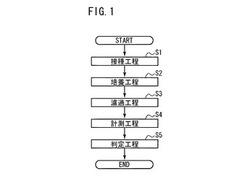
【図1】本発明の実施の形態に係る大腸菌群の検出方法の手順を示す図である。
【図2】浮遊液の調製に用いる蛍光染色液の組成を示す表である。
【図3】試料中の大腸菌群の計測結果を示す表である。
【図4】実施の形態に係る大腸菌群の検出方法を用いた大腸菌群の計測数と、従来の培養法を用いた大腸菌群のコロニー数との対応を示すグラフである。
【図5】試料中の大腸菌群に属さない菌の計測結果を示す表である。
【図6】BGLB法と、実施の形態に係る大腸菌群の検出方法との一致率を示す表である。
【図7】BGLB法とデソ法との一致率を示す表である。
【発明を実施するための形態】
【0018】
以下、図面を参照し、本発明の実施の形態を詳しく説明する。本実施の形態における大腸菌群の検出方法は、試料を、大腸菌群を培養できる培地に接種した後に、試料が接種された培地を30℃〜40℃にて、3.5時間以上5時間以下で培養する。たとえば、大腸菌群を培養できる培地として、BGLB培地、EC(Escherichia coli)培地、あるいはラウリル硫酸トリプトースブイヨンなどを用いることができる。培養後の培地をフィルタにより濾過し、フィルタ上の残留物を回収する。回収した残留物を分散させた浮遊液を調製し、浮遊液中の菌体数をフローサイトメータにより計測する。これにより、試料中の大腸菌群が陰性であるか否かを6時間以内で判定することが可能となる。
【0019】
本実施の形態に係る大腸菌群の検出方法の対象となる試料は、牛乳および乳飲料(乳を含む液体状の食品)である。水に溶解する固体状または半固体状の食品(粉末ミルク、ヨーグルトなどの乳製品)に対しても、本実施の形態の大腸菌群の検出方法を適用することができる。
【0020】
図1は、本実施の形態に係る大腸菌群の検出方法の手順を示すフローチャートである。以下、大腸菌群を培養できる培地として、BGLB培地を用いる例を説明する。まず、試料とBGLB培地とが所定の比率になるように、BGLB培地に試料を接種する(ステップS1)。BGLB培地を用いることにより、大腸菌群に属する菌(以下、単に「大腸菌群」と呼ぶ。)を選択的に培養することができる。
【0021】
試料が接種されたBGLB培地を、30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する(ステップS2)。試料が接種されたBGLB培地を3.5時間以上で培養することにより、フローサイトメータにより大腸菌群を検出することができる。
【0022】
BGLB培地の培養時間は、4時間以上5時間以下であることが望ましい。試料が、大腸菌群のうち生育の遅い菌株のみを含んでいる場合であっても、フローサイトメータにより、生育の遅い菌株を検出することができる。また、BGLB培地を4時間以上で培養することにより、BGLB培地中の菌体数が増加するため、試料中の大腸菌群が陰性であるか否かの判定精度を向上させることができる。
【0023】
BGLB培地の培養時の温度(30℃以上40℃以下)は、大腸菌群の培養に適した温度として以前から知られている温度である。本実施の形態において、BGLB培地の温度は34.5℃以上35.5℃以下であることが望ましい。培養温度を34.5℃以上35.5℃以下に設定することにより、大腸菌群の活動が活発になるため、培養時間を短縮することができる。
【0024】
次に、培養されたBGLB培地(培養液)を、フィルタにより濾過する(ステップS3)。フィルタ上に大腸菌群を残留させるために、フィルタの孔径は、0.6μm程度であることが望ましい。
【0025】
試料が牛乳あるいは乳製品である場合、培養液を濾過する前に、培養液に界面活性剤を添加することが望ましい。界面活性剤を培養液に添加しない場合、牛乳などに含まれる脂肪球がフィルタの孔を塞ぐ目詰まりが発生し、培養液を濾過できないおそれがある。培養液に界面活性剤を添加して脂肪球の界面張力を低下させることにより、脂肪球の柔軟性が向上する。この結果、脂肪球がフィルタの孔を通過しやすくなる。また、脂肪球がフィルタ上に残留することが防止されるため、菌体数の計測精度を向上させることができる。
【0026】
培養液を濾過するときに、培養液の温度が40℃以上47℃以下であることが望ましい。培養液の温度が40℃未満である場合、界面活性剤を培養液に添加したとしても、脂肪球の柔軟性が低下するおそれがある。培養液の温度が47℃よりも高い場合、試料中のタンパク質成分が凝固するおそれがある。凝固したタンパク質成分は、フィルタの目詰まりの原因となる。培養液の温度が47℃よりも高い場合、培養液中の大腸菌群の一部が死滅するおそれがある。このように、培養液を40℃以上47℃以下に加温することにより、培養液中の大腸菌群を減少させることなく、かつ、脂肪球の柔軟性を維持したまま、培養液を濾過することができる。また、フィルタ上に大腸菌群以外の成分が残留することを防ぐことができる。
【0027】
次に、フィルタ上の残留物を分散させた液体(浮遊液)を調製し、浮遊液中の菌体数をフローサイトメータにより計測する(ステップS4)。フローサイトメータは、細胞などの微粒子を分散させた液体を高速度で流し、流れる液体中の微粒子を光学的に分析する装置である。
【0028】
単位体積あたりの浮遊液中の菌体数に基づいて、試料中の大腸菌群が陰性であるか否かを判定する(ステップS5)。具体的には、牛乳の公定法であるBGLB法などにより、大腸菌群が陰性と判定された試料を比較試料(ブランク)とする。本実施の形態に係る大腸菌群の検出方法を用いてブランクの菌体数を予め計測しておく。試料の菌体数とブランクの菌体数とを比較することにより、試料中の大腸菌群が陰性であるか否かを判定する。
【0029】
BGLB培地の培養時間は、最大で5時間である。ステップS3の濾過工程に要する時間は、約20分である。ステップS4の計測工程およびステップS5の判定工程に要する時間は、合計で約40分である。したがって、本実施の形態に係る大腸菌群の検出方法は、試料中の大腸菌群が陰性であるか否かを、6時間以内に判定することができる。
【0030】
[実施例1]
以下、上記実施の形態に係る大腸菌群の検出方法の実施例を説明する。
【0031】
{実験に用いた菌株}
本実施例では、大腸菌群として、(1)〜(4)に示す4種の菌株を用いた。カッコ内の記載は、整理番号を示す。
(1)Enterobacter aerogenes(NBRC 13534T)
(2)Klebsiella oxytoca(JCM 1665)
(3)Citrobacter freundii(JCM 1657)
(4)Escherichia coli(NBRC 3972)
【0032】
大腸菌群に属さないグラム陽性菌として、(5)〜(8)に示す4種の菌株を用いた。また、大腸菌群に属さないグラム陰性菌として、(9)および(10)に示す2種の菌株を用いた。
(5)Bacillus cereus(JCM 2152)
(6)Staphylococcus aureus subsp. aureus(JCM 2151)
(7)Lactococcus lactis subsp. lactis(NBRC 12007)
(8)Microbacterium lauticum(NBRC14135)
(9)Acinetobacter calcoaceticus(NBRC12552)
(10)Pseudomonas fluorescens(NBRC 3507)
【0033】
上記(1)〜(10)の菌株のうち、整理番号が“JCM”で始まる菌株は、下記の寄託機関に寄託されている。
寄託機関名:独立行政法人理化学研究所バイオリソースセンター 微生物材料開発室
連絡先:郵便番号351−0198 埼玉県和光市広沢2−1、電話番号048−467−9560
【0034】
上記(1)〜(10)の菌株のうち、整理番号が“NBRC”で始まる菌株は、下記の寄託機関に寄託されている。
寄託機関名:独立行政法人製品評価技術基盤機構 バイオテクノロジー本部 生物遺伝資源部門
連絡先:郵便番号292−0818、千葉県木更津市かずさ鎌足2−5−8、電話番号0438−20−5763
【0035】
{実験手順}
実験手順について説明する。まず、上記(1)〜(10)の菌株がそれぞれ接種された試料を調製した。具体的には、上記(1)〜(9)の菌株を、TSB(Trypcase Soy Broth)培地を用いて35℃にて一晩培養した。(10)の菌株のみ、TSB培地を用いて30℃にて一晩培養した。
【0036】
(1)〜(4)の大腸菌群を培養したTSB培地を牛乳で段階的に希釈した。これにより、(1)〜(4)の大腸菌がそれぞれ希釈された1(CFU/ml)レベルの希釈液と、(1)〜(4)の大腸菌がそれぞれ希釈された10(CFU/ml)レベルの希釈液とを調製した。(1)〜(4)の大腸菌ごとに調製した2種類の汚染濃度の希釈液を、試料として用いた。ここで、1(CFU/ml)レベルとは、液体に接種された菌数(接種菌数)が、1mlあたり0.9〜9であることを指す。10(CFU/ml)レベルとは、液体に対する接種菌数が、1mlあたり10〜99であることを指す。
【0037】
(5)〜(10)の菌株をそれぞれ培養したTSB培地を牛乳で段階的に希釈した。これにより、(5)〜(10)の菌株がそれぞれ希釈された1(CFU/ml)レベルの希釈液と、(5)〜(10)の菌株がそれぞれ希釈された10(CFU/ml)レベルの希釈液とを調製した。(5)〜(10)の菌株ごとに調製した2種類の汚染濃度の希釈液を、試料として用いた。また、(1)〜(10)の菌のいずれも接種していない牛乳を比較試料(ブランク)として用いた。
【0038】
以下、(1)の大腸菌の試料のうち、1(CFU/ml)の試料を例にして、本実施例の手順を説明する。10mlのBGLB培地が入った試験管に、1mlの試料を接種した(ステップS1)。試料が接種されたBGLB培地を35℃に保ちながら、4時間培養した(ステップS2)。
【0039】
BGLB培地の培養後、BGLB培地をメンブレンフィルタにより濾過した(ステップS3)。具体的には、界面活性剤(Tween80)の濃度が0.1%である生理食塩水を調製した。10mlの生理食塩水が入った試験管に、培養後のBGLB培地(培養液)を3ml添加した。培養液が添加された生理食塩水を、試験管に入れたまま、42℃の湯浴中に10分間保持した。生理食塩水を試験管からシリンジに移し、シリンジ中の生理食塩水を、孔径0.6μmのメンブレンフィルタ(Whatman社製、カタログ番号7060−2506)で濾過した。
【0040】
次に、メンブレンフィルタ上の残留物を分散させた浮遊液を調製し、浮遊液中の菌体数を計測した(ステップS4)。浮遊液の調製手順について説明する。濾過後のメンブレンフィルタを容量50mlのファルコンチューブに移した。ファルコンチューブに1mlの蛍光染色液を入れ、蛍光染色液を十分に攪拌した。これにより、メンブレンフィルタ上に残留した菌体を、蛍光染色液中に浮遊させた。図2に、蛍光染色液の組成を示す。図2に示す「CHEMSOL B26/1」、「CSV」、及び「CHEMCHROME V13」は、AES Chemunex社(日本国内代理店:(株)池田理化)の製品である。菌体を蛍光染色液により着色することで、フローサイトメータにより菌体を検出することが可能となる。菌体を浮遊させた蛍光染色液をファルコンチューブに入れた状態で、30℃にて20分間で保持した後に、4℃に冷却した。
【0041】
冷却された蛍光染色液(1ml)のうち600μlを、フローサイトメータ専用の計測用チューブ(容量3ml)に移した。さらに、CSR溶液80μlを計測用チューブに加え、計測用チューブ中の蛍光染色液を攪拌した。CSR溶液は、菌体を染色することなく浮遊液中に遊離している蛍光物質を還元するために用いられる。これにより、フローサイトメータにより浮遊液中の菌体数を計測するときに、浮遊液中に遊離している蛍光物質を原因としたノイズを抑制することができる。
【0042】
フローサイトメータとして、BactiFlow(AES Chemunex社製)を用いて、浮遊液1mlあたりの菌体数を測定した。菌体数の測定には、BactiFlowの専用アプリケーションである「TVC in Milk」を用いた。(2)〜(10)の試料と、ブランクとについても、上記の手順に基づいて、浮遊液1mlあたりの菌体数を計測した。
【0043】
また、フローサイトメータの測定結果と、従来の培養法との測定結果との対応関係を調べるために、SMA培地(標準寒天培地)を用いて、培養液中の生菌数を測定した。具体的には、各試料を35℃にて4時間で培養した(ステップS2)後に、スパイラル法を用いて培養液をSMA平板上に接種した。(1)〜(9)の菌株の培養液が接種されたSMA平板を35℃にて48時間で培養した。(10)の菌株の培養液が接種されたSMA平板を30℃にて48時間で培養した。培養後の(1)〜(10)のそれぞれの菌株が培養されたSMA平板上のコロニー数を計測した。以下、SMA平板を用いた培養法を、「SMA培養法」と呼ぶ。
【0044】
{大腸菌群の計測結果}
図3に、(1)〜(4)の試料における、浮遊液1mlあたりの菌体数と、SMA培養法で計測したコロニー数との計測結果を示す。図3において、「菌体カウント法」の欄に示す数値は、浮遊液1mlあたりの菌体数を示す。以下、フローサイトメータを用いた本実施例の手順に基づく計測を、「菌体カウント法」と呼ぶ。
【0045】
図3を参照して、(1)〜(4)の大腸菌群がいずれもフローサイトメータにより検出されていることが分かる。菌体カウント法に基づく菌体数と、SMA培養法に基づくコロニー数とが、同程度の値となっている。
【0046】
図3に示していないが、ブランクから得られた浮遊液1mlあたりの菌体数の平均値AVEは、6.58(Cell/ml)であり、標準偏差σは、5.97であった。ブランクとして使用した牛乳のサンプル数は、4である。試料中の大腸菌群が陰性であるか否かを示す基準値Sを、平均値AVEおよび標準偏差σに基づいて決定した。計算式は、以下の通りである。
S=AVE+5σ≒37
【0047】
基準値Sよりも小さい菌体数が得られた試料を陰性と判定した。この結果、(1)〜(4)の全ての試料において、菌体カウント法により計測した菌体数は、基準値Sを上回っている。このため、(1)〜(4)の全ての試料は、大腸菌群が陽性であると判定された。図3に示す結果から、牛乳1mlあたりの大腸菌群の汚染が1〜2(CFU/ml)程度であれば、上記手順に基づいて、牛乳中の大腸菌群が陰性であるか否かを判断できることが明らかとなった。
【0048】
図3に示すように、(2)、(4)の大腸菌群の試料に接種された菌体数は、(1)、(3)の大腸菌群の試料に接種された菌体数よりも少ない。しかし、菌体カウント法に基づく菌体数は、(1)〜(4)の大腸菌群で同程度である。(2)、(4)の大腸菌群は、生育が速いことが知られている。したがって、菌体カウント法は、培養時間を3.5時間とした場合であっても、生育が速い(2)、(4)の大腸菌群を検出することができると考えられる。
【0049】
図4は、(1)〜(4)の試料における、菌体カウント法により得られた浮遊液1mlあたりの菌体数と、SMA培養法で計測したコロニー数との相関関係を示すグラフである。図4に示すグラフでは、図3に示す菌体数およびコロニー数の対数値をプロットしている。フローサイトメータに基づく菌体数と、SMA培養法に基づくコロニー数とは、相関関係にあることがわかる。菌体のカウント数の対数値と、コロニー数の対数値との相関係数Rの値は、0.9553であった。つまり、菌体カウント法を用いて、浮遊液中の菌体数を計測することにより、従来の培養法(SMA培養法)と同様の結果が得られることが明らかとなった。
【0050】
{大腸菌群に属さない菌株の計測結果}
図5に、(5)〜(10)の試料における、菌体カウント法により得られた浮遊液1mlあたりの菌体数と、SMA培養法によるコロニー数との計測結果を示す。図5に示すように、(5)〜(8)の試料において、培養後の菌体数が、培養前の菌体数よりも減少している。(9)および(10)の試料では、培養後の菌体数が、試料に接種された菌体数よりも減少する試料と、培養後の菌体数が試料に接種された菌体数よりも増加する試料が存在する。しかし、(9)および(10)の試料における菌体の増加率は、(1)〜(4)の試料における菌体の増加率に比べて著しく低い。つまり、大腸菌群に属さない菌株は、BGLB培地を用いて35℃にて4時間で培養しても、大腸菌群に属する菌株に比べて大量に増殖しないことが明らかとなった。この結果から、大腸菌群に属さない菌株は、培養時間が3.5時間であっても、大量に増殖しないと考えられる。
【0051】
したがって、大腸菌群に属しないグラム陽性菌およびグラム陰性菌による牛乳の汚染が10(CFU/ml)以下であれば、これらの菌が、菌体カウント法を用いた大腸菌群の陰性の判定に大きな影響を与えることはないと考えられる。また、菌体カウント法は、培養時間を3.5時間に設定したとしても、大腸菌群に属さない菌株による影響を受けることなく、試料中の大腸菌群が陰性であるか否かを判定することができると考えられる。
【0052】
[実施例2]
本実施例では、BGLB法を基準とした、本実施の形態に係る大腸菌群の検出方法の精度を検討した。大腸菌群の汚染濃度が、0.1(CFU/ml)レベル、1(CFU/ml)レベル、および10(CFU/ml)レベルの試料を準備した。つまり、未殺菌の生乳を牛乳で希釈して、試料を調製した。試料の総数は、65である。各試料中の大腸菌群が陰性であるか否かを、下記の3種類の検出方法を用いて判定した。
【0053】
上記実施例1に記載した菌体カウント法を用いて、各試料の大腸菌群が陰性であるか否かを判定した。
【0054】
牛乳の公定法であるBGLB法に基づいて、各試料の大腸菌群が陰性であるか否かを判定した。具体的には、10mlのBGLB培地に1mlの試料を接種し、接種後のBGLB培地を35℃にて48時間で培養した。培養後のBGLB培地中の気泡の有無、およびBGLB培地が黄色に変色しているか否かによって、各試料の大腸菌群が陰性であるか否かを判定した。
【0055】
牛乳の自主検査として広く用いられているデソ法を用いて、各試料の大腸菌群が陰性であるか否か判定した。10〜15mlのデソ培地と1mlの試料とを混釈し、デソ培地を35℃にて20時間で培養した。培養後のデソ培地における赤色コロニーの有無を観察することにより、各試料の大腸菌群が陰性であるか否かを判定した。
【0056】
図6は、BGLB法の判定結果と、菌体カウント法の判定結果とが一致した試料数を示す表である。図6において、「+」は、陽性を示す。「−」は、陰性を示す。
【0057】
BGLB法および菌体カウント法の両者が陽性と判定した試料の数は、44である。BGLB法および菌体カウント法の両者が陰性と判定した試料の数は、10である。すなわち、BGLB法および菌体カウント法により、判定結果が一致した試料の数は、54である。試料の総数が65であり、判定結果が一致した試料の数が54であることから、BGLB法および菌体カウント法とで、判定結果が一致する確率(一致率P1)は、83.1(%)である。
【0058】
図7は、BGLB法およびデソ法の判定結果が一致した試料数を示す表である。BGLB法およびデソ法の両者が陽性と判定した試料の数は、45である。BGLB法およびデソ法の両者が陰性と判定した試料の数は、11である。すなわち、BGLB法およびデソ法により、判定結果が一致した試料の数は、56である。試料の総数が65であり、判定結果が一致した試料の数が56であることから、BGLB法およびデソ法とで、判定結果が一致する確率(一致率P2)の値は、86.2(%)である。
【0059】
一致率P1,P2が、同程度の値であることから、上記実施の形態に係る菌体カウント法は、牛乳の検査で広く用いられているデソ法と同程度の精度を有しているといえる。したがって、菌体カウント法を、デソ法と同様に自主検査として用いることができると考えられる。
【技術分野】
【0001】
本発明は、大腸菌群の検出方法に関し、さらに詳しくは、BGLB(Brilliant
Green Lactose Bile)培地などを用いた大腸菌群の検出方法に関する。
【背景技術】
【0002】
乳および乳製品の成分規格に関する省令(乳等省令)では、牛乳および乳製品の成分規格が定められている。乳等省令では、牛乳および乳製品中の大腸菌群は、陰性であることが定められている。
【0003】
大腸菌群とは、グラム陰性の芽胞を形成しない桿菌であり、48時間以内に乳糖を分解して酸およびガスを産出する好気性細菌または通性嫌気性細菌の一群を指す。Klebsiella、Citrobacter、Enterobacter、Escherichiaなどの属が、大腸菌群に属する。
【0004】
乳等省令では、牛乳の大腸菌群の検出方法として、BGLB法の使用が定められている。BGLB法は、牛乳あるいは乳製品などの検体を接種したBGLB培地を48時間で培養させる必要がある。また、乳等省令では、発酵乳などの乳製品における大腸菌群の検出方法として、デソキシコレート寒天培地(デソ培地)を用いる方法(デソ法)の使用が、定められている。デソ法は、牛乳の自主検査にも用いられる。デソ法は、検体を接種したデソ培地を20時間培養させる必要がある。
【0005】
しかし、BGLB法およびデソ法は、検体中の大腸菌群が陰性であることを確認するまでに長い時間を要するため、牛乳および乳製品の出荷鮮度を維持することが困難である。このため、検体中の大腸菌群の検出時間を短縮することが、以前から望まれている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002−186496号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記特許文献1には、培養時間を短縮することができる大腸菌群の検出方法が開示されている。具体的には、試料をグラム陽性細菌の生育を阻害する培地に接種し、培地を35℃の温度条件下にて12時間程度で培養する。培養後の培地に形成されたコロニーに、発色合成酵素基質を滴下する。大腸菌群のコロニーが発色合成酵素基質により発色するため、培養後の培地における大腸菌群の有無を肉眼により観察することができる。上記特許文献1に係る検出方法は、デソ法により大腸菌群が陽性であると推定された試料の確認試験などに用いられる。
【0008】
上記特許文献1に開示された大腸菌群の検出方法を用いることにより、12時間程度で検体中の大腸菌群が陰性であるか否かを判定することができる。しかし、検体中の大腸菌群を検出するまでの時間をさらに短くすることにより、牛乳および乳製品の安全性や品質をさらに向上させることが可能となる。
【0009】
そこで、本発明は、試料中の大腸菌群が陰性であるか否かを迅速に判定することができる大腸菌群の検出方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
上記課題を解決するため、請求項1記載の発明は、大腸菌群の検出方法であって、試料を、大腸菌群を培養することができる培地に接種する工程と、前記試料が接種された前記培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する培養工程と、培養された前記培地を、フィルタにより濾過する濾過工程と、前記フィルタに残留した残留物の浮遊液を調製し、前記浮遊液に含まれる菌体数を、フローサイトメータにより計測する計測工程と、計測した前記菌体数に基づいて前記試料中の大腸菌群の有無を判定する判定工程と、を備える。
【0011】
請求項2記載の発明は、請求項1に記載の大腸菌群の検出方法において、前記培地は、BGLB(Brilliant Green Lactose Bile)培地、EC(Escherichia coli)培地、及びラウリル硫酸トリプトースブイヨンのいずれかである。
【0012】
請求項3記載の発明は、請求項1または請求項2に記載の大腸菌群の検出方法において、前記培養工程は、前記試料が接種された前記培地を34.5℃以上35.5℃以下にて培養する。
【0013】
請求項4記載の発明は、請求項1ないし請求項3のいずれかに記載の大腸菌群の検出方法において、前記培養工程は、前記試料が接種された前記培地を4時間以上5時間以下で培養する。
【0014】
請求項5記載の発明は、請求項1ないし請求項4のいずれかに記載の大腸菌群の検出方法において、前記濾過工程は、前記培養された前記培地に界面活性剤を添加し、前記界面活性剤が添加された前記培地を濾過する。
【0015】
請求項6記載の発明は、請求項5に記載の大腸菌群の検出方法において、前記濾過工程は、前記界面活性剤が添加された前記培地を濾過する前に、前記界面活性剤が添加された前記培地を40℃以上47℃以下の温度にて加温する。
【発明の効果】
【0016】
本発明に係る大腸菌群の検出方法は、試料をBGLB培地などの大腸菌群を検出できる培地に接種し、試料が接種された培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する。培養された培地を濾過し、濾過後の残留物の浮遊液を調製する。フローサイトメータにより、浮遊液中の菌体数を計測する。培地の培養時間が5時間以下であるため、本発明に係る大腸菌群の検出方法は、フローサイトメータによる計測に要する時間を含めて、6時間程度で試料中の大腸菌群が陰性であるか否かを判定できる。
【図面の簡単な説明】
【0017】
【図1】本発明の実施の形態に係る大腸菌群の検出方法の手順を示す図である。
【図2】浮遊液の調製に用いる蛍光染色液の組成を示す表である。
【図3】試料中の大腸菌群の計測結果を示す表である。
【図4】実施の形態に係る大腸菌群の検出方法を用いた大腸菌群の計測数と、従来の培養法を用いた大腸菌群のコロニー数との対応を示すグラフである。
【図5】試料中の大腸菌群に属さない菌の計測結果を示す表である。
【図6】BGLB法と、実施の形態に係る大腸菌群の検出方法との一致率を示す表である。
【図7】BGLB法とデソ法との一致率を示す表である。
【発明を実施するための形態】
【0018】
以下、図面を参照し、本発明の実施の形態を詳しく説明する。本実施の形態における大腸菌群の検出方法は、試料を、大腸菌群を培養できる培地に接種した後に、試料が接種された培地を30℃〜40℃にて、3.5時間以上5時間以下で培養する。たとえば、大腸菌群を培養できる培地として、BGLB培地、EC(Escherichia coli)培地、あるいはラウリル硫酸トリプトースブイヨンなどを用いることができる。培養後の培地をフィルタにより濾過し、フィルタ上の残留物を回収する。回収した残留物を分散させた浮遊液を調製し、浮遊液中の菌体数をフローサイトメータにより計測する。これにより、試料中の大腸菌群が陰性であるか否かを6時間以内で判定することが可能となる。
【0019】
本実施の形態に係る大腸菌群の検出方法の対象となる試料は、牛乳および乳飲料(乳を含む液体状の食品)である。水に溶解する固体状または半固体状の食品(粉末ミルク、ヨーグルトなどの乳製品)に対しても、本実施の形態の大腸菌群の検出方法を適用することができる。
【0020】
図1は、本実施の形態に係る大腸菌群の検出方法の手順を示すフローチャートである。以下、大腸菌群を培養できる培地として、BGLB培地を用いる例を説明する。まず、試料とBGLB培地とが所定の比率になるように、BGLB培地に試料を接種する(ステップS1)。BGLB培地を用いることにより、大腸菌群に属する菌(以下、単に「大腸菌群」と呼ぶ。)を選択的に培養することができる。
【0021】
試料が接種されたBGLB培地を、30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する(ステップS2)。試料が接種されたBGLB培地を3.5時間以上で培養することにより、フローサイトメータにより大腸菌群を検出することができる。
【0022】
BGLB培地の培養時間は、4時間以上5時間以下であることが望ましい。試料が、大腸菌群のうち生育の遅い菌株のみを含んでいる場合であっても、フローサイトメータにより、生育の遅い菌株を検出することができる。また、BGLB培地を4時間以上で培養することにより、BGLB培地中の菌体数が増加するため、試料中の大腸菌群が陰性であるか否かの判定精度を向上させることができる。
【0023】
BGLB培地の培養時の温度(30℃以上40℃以下)は、大腸菌群の培養に適した温度として以前から知られている温度である。本実施の形態において、BGLB培地の温度は34.5℃以上35.5℃以下であることが望ましい。培養温度を34.5℃以上35.5℃以下に設定することにより、大腸菌群の活動が活発になるため、培養時間を短縮することができる。
【0024】
次に、培養されたBGLB培地(培養液)を、フィルタにより濾過する(ステップS3)。フィルタ上に大腸菌群を残留させるために、フィルタの孔径は、0.6μm程度であることが望ましい。
【0025】
試料が牛乳あるいは乳製品である場合、培養液を濾過する前に、培養液に界面活性剤を添加することが望ましい。界面活性剤を培養液に添加しない場合、牛乳などに含まれる脂肪球がフィルタの孔を塞ぐ目詰まりが発生し、培養液を濾過できないおそれがある。培養液に界面活性剤を添加して脂肪球の界面張力を低下させることにより、脂肪球の柔軟性が向上する。この結果、脂肪球がフィルタの孔を通過しやすくなる。また、脂肪球がフィルタ上に残留することが防止されるため、菌体数の計測精度を向上させることができる。
【0026】
培養液を濾過するときに、培養液の温度が40℃以上47℃以下であることが望ましい。培養液の温度が40℃未満である場合、界面活性剤を培養液に添加したとしても、脂肪球の柔軟性が低下するおそれがある。培養液の温度が47℃よりも高い場合、試料中のタンパク質成分が凝固するおそれがある。凝固したタンパク質成分は、フィルタの目詰まりの原因となる。培養液の温度が47℃よりも高い場合、培養液中の大腸菌群の一部が死滅するおそれがある。このように、培養液を40℃以上47℃以下に加温することにより、培養液中の大腸菌群を減少させることなく、かつ、脂肪球の柔軟性を維持したまま、培養液を濾過することができる。また、フィルタ上に大腸菌群以外の成分が残留することを防ぐことができる。
【0027】
次に、フィルタ上の残留物を分散させた液体(浮遊液)を調製し、浮遊液中の菌体数をフローサイトメータにより計測する(ステップS4)。フローサイトメータは、細胞などの微粒子を分散させた液体を高速度で流し、流れる液体中の微粒子を光学的に分析する装置である。
【0028】
単位体積あたりの浮遊液中の菌体数に基づいて、試料中の大腸菌群が陰性であるか否かを判定する(ステップS5)。具体的には、牛乳の公定法であるBGLB法などにより、大腸菌群が陰性と判定された試料を比較試料(ブランク)とする。本実施の形態に係る大腸菌群の検出方法を用いてブランクの菌体数を予め計測しておく。試料の菌体数とブランクの菌体数とを比較することにより、試料中の大腸菌群が陰性であるか否かを判定する。
【0029】
BGLB培地の培養時間は、最大で5時間である。ステップS3の濾過工程に要する時間は、約20分である。ステップS4の計測工程およびステップS5の判定工程に要する時間は、合計で約40分である。したがって、本実施の形態に係る大腸菌群の検出方法は、試料中の大腸菌群が陰性であるか否かを、6時間以内に判定することができる。
【0030】
[実施例1]
以下、上記実施の形態に係る大腸菌群の検出方法の実施例を説明する。
【0031】
{実験に用いた菌株}
本実施例では、大腸菌群として、(1)〜(4)に示す4種の菌株を用いた。カッコ内の記載は、整理番号を示す。
(1)Enterobacter aerogenes(NBRC 13534T)
(2)Klebsiella oxytoca(JCM 1665)
(3)Citrobacter freundii(JCM 1657)
(4)Escherichia coli(NBRC 3972)
【0032】
大腸菌群に属さないグラム陽性菌として、(5)〜(8)に示す4種の菌株を用いた。また、大腸菌群に属さないグラム陰性菌として、(9)および(10)に示す2種の菌株を用いた。
(5)Bacillus cereus(JCM 2152)
(6)Staphylococcus aureus subsp. aureus(JCM 2151)
(7)Lactococcus lactis subsp. lactis(NBRC 12007)
(8)Microbacterium lauticum(NBRC14135)
(9)Acinetobacter calcoaceticus(NBRC12552)
(10)Pseudomonas fluorescens(NBRC 3507)
【0033】
上記(1)〜(10)の菌株のうち、整理番号が“JCM”で始まる菌株は、下記の寄託機関に寄託されている。
寄託機関名:独立行政法人理化学研究所バイオリソースセンター 微生物材料開発室
連絡先:郵便番号351−0198 埼玉県和光市広沢2−1、電話番号048−467−9560
【0034】
上記(1)〜(10)の菌株のうち、整理番号が“NBRC”で始まる菌株は、下記の寄託機関に寄託されている。
寄託機関名:独立行政法人製品評価技術基盤機構 バイオテクノロジー本部 生物遺伝資源部門
連絡先:郵便番号292−0818、千葉県木更津市かずさ鎌足2−5−8、電話番号0438−20−5763
【0035】
{実験手順}
実験手順について説明する。まず、上記(1)〜(10)の菌株がそれぞれ接種された試料を調製した。具体的には、上記(1)〜(9)の菌株を、TSB(Trypcase Soy Broth)培地を用いて35℃にて一晩培養した。(10)の菌株のみ、TSB培地を用いて30℃にて一晩培養した。
【0036】
(1)〜(4)の大腸菌群を培養したTSB培地を牛乳で段階的に希釈した。これにより、(1)〜(4)の大腸菌がそれぞれ希釈された1(CFU/ml)レベルの希釈液と、(1)〜(4)の大腸菌がそれぞれ希釈された10(CFU/ml)レベルの希釈液とを調製した。(1)〜(4)の大腸菌ごとに調製した2種類の汚染濃度の希釈液を、試料として用いた。ここで、1(CFU/ml)レベルとは、液体に接種された菌数(接種菌数)が、1mlあたり0.9〜9であることを指す。10(CFU/ml)レベルとは、液体に対する接種菌数が、1mlあたり10〜99であることを指す。
【0037】
(5)〜(10)の菌株をそれぞれ培養したTSB培地を牛乳で段階的に希釈した。これにより、(5)〜(10)の菌株がそれぞれ希釈された1(CFU/ml)レベルの希釈液と、(5)〜(10)の菌株がそれぞれ希釈された10(CFU/ml)レベルの希釈液とを調製した。(5)〜(10)の菌株ごとに調製した2種類の汚染濃度の希釈液を、試料として用いた。また、(1)〜(10)の菌のいずれも接種していない牛乳を比較試料(ブランク)として用いた。
【0038】
以下、(1)の大腸菌の試料のうち、1(CFU/ml)の試料を例にして、本実施例の手順を説明する。10mlのBGLB培地が入った試験管に、1mlの試料を接種した(ステップS1)。試料が接種されたBGLB培地を35℃に保ちながら、4時間培養した(ステップS2)。
【0039】
BGLB培地の培養後、BGLB培地をメンブレンフィルタにより濾過した(ステップS3)。具体的には、界面活性剤(Tween80)の濃度が0.1%である生理食塩水を調製した。10mlの生理食塩水が入った試験管に、培養後のBGLB培地(培養液)を3ml添加した。培養液が添加された生理食塩水を、試験管に入れたまま、42℃の湯浴中に10分間保持した。生理食塩水を試験管からシリンジに移し、シリンジ中の生理食塩水を、孔径0.6μmのメンブレンフィルタ(Whatman社製、カタログ番号7060−2506)で濾過した。
【0040】
次に、メンブレンフィルタ上の残留物を分散させた浮遊液を調製し、浮遊液中の菌体数を計測した(ステップS4)。浮遊液の調製手順について説明する。濾過後のメンブレンフィルタを容量50mlのファルコンチューブに移した。ファルコンチューブに1mlの蛍光染色液を入れ、蛍光染色液を十分に攪拌した。これにより、メンブレンフィルタ上に残留した菌体を、蛍光染色液中に浮遊させた。図2に、蛍光染色液の組成を示す。図2に示す「CHEMSOL B26/1」、「CSV」、及び「CHEMCHROME V13」は、AES Chemunex社(日本国内代理店:(株)池田理化)の製品である。菌体を蛍光染色液により着色することで、フローサイトメータにより菌体を検出することが可能となる。菌体を浮遊させた蛍光染色液をファルコンチューブに入れた状態で、30℃にて20分間で保持した後に、4℃に冷却した。
【0041】
冷却された蛍光染色液(1ml)のうち600μlを、フローサイトメータ専用の計測用チューブ(容量3ml)に移した。さらに、CSR溶液80μlを計測用チューブに加え、計測用チューブ中の蛍光染色液を攪拌した。CSR溶液は、菌体を染色することなく浮遊液中に遊離している蛍光物質を還元するために用いられる。これにより、フローサイトメータにより浮遊液中の菌体数を計測するときに、浮遊液中に遊離している蛍光物質を原因としたノイズを抑制することができる。
【0042】
フローサイトメータとして、BactiFlow(AES Chemunex社製)を用いて、浮遊液1mlあたりの菌体数を測定した。菌体数の測定には、BactiFlowの専用アプリケーションである「TVC in Milk」を用いた。(2)〜(10)の試料と、ブランクとについても、上記の手順に基づいて、浮遊液1mlあたりの菌体数を計測した。
【0043】
また、フローサイトメータの測定結果と、従来の培養法との測定結果との対応関係を調べるために、SMA培地(標準寒天培地)を用いて、培養液中の生菌数を測定した。具体的には、各試料を35℃にて4時間で培養した(ステップS2)後に、スパイラル法を用いて培養液をSMA平板上に接種した。(1)〜(9)の菌株の培養液が接種されたSMA平板を35℃にて48時間で培養した。(10)の菌株の培養液が接種されたSMA平板を30℃にて48時間で培養した。培養後の(1)〜(10)のそれぞれの菌株が培養されたSMA平板上のコロニー数を計測した。以下、SMA平板を用いた培養法を、「SMA培養法」と呼ぶ。
【0044】
{大腸菌群の計測結果}
図3に、(1)〜(4)の試料における、浮遊液1mlあたりの菌体数と、SMA培養法で計測したコロニー数との計測結果を示す。図3において、「菌体カウント法」の欄に示す数値は、浮遊液1mlあたりの菌体数を示す。以下、フローサイトメータを用いた本実施例の手順に基づく計測を、「菌体カウント法」と呼ぶ。
【0045】
図3を参照して、(1)〜(4)の大腸菌群がいずれもフローサイトメータにより検出されていることが分かる。菌体カウント法に基づく菌体数と、SMA培養法に基づくコロニー数とが、同程度の値となっている。
【0046】
図3に示していないが、ブランクから得られた浮遊液1mlあたりの菌体数の平均値AVEは、6.58(Cell/ml)であり、標準偏差σは、5.97であった。ブランクとして使用した牛乳のサンプル数は、4である。試料中の大腸菌群が陰性であるか否かを示す基準値Sを、平均値AVEおよび標準偏差σに基づいて決定した。計算式は、以下の通りである。
S=AVE+5σ≒37
【0047】
基準値Sよりも小さい菌体数が得られた試料を陰性と判定した。この結果、(1)〜(4)の全ての試料において、菌体カウント法により計測した菌体数は、基準値Sを上回っている。このため、(1)〜(4)の全ての試料は、大腸菌群が陽性であると判定された。図3に示す結果から、牛乳1mlあたりの大腸菌群の汚染が1〜2(CFU/ml)程度であれば、上記手順に基づいて、牛乳中の大腸菌群が陰性であるか否かを判断できることが明らかとなった。
【0048】
図3に示すように、(2)、(4)の大腸菌群の試料に接種された菌体数は、(1)、(3)の大腸菌群の試料に接種された菌体数よりも少ない。しかし、菌体カウント法に基づく菌体数は、(1)〜(4)の大腸菌群で同程度である。(2)、(4)の大腸菌群は、生育が速いことが知られている。したがって、菌体カウント法は、培養時間を3.5時間とした場合であっても、生育が速い(2)、(4)の大腸菌群を検出することができると考えられる。
【0049】
図4は、(1)〜(4)の試料における、菌体カウント法により得られた浮遊液1mlあたりの菌体数と、SMA培養法で計測したコロニー数との相関関係を示すグラフである。図4に示すグラフでは、図3に示す菌体数およびコロニー数の対数値をプロットしている。フローサイトメータに基づく菌体数と、SMA培養法に基づくコロニー数とは、相関関係にあることがわかる。菌体のカウント数の対数値と、コロニー数の対数値との相関係数Rの値は、0.9553であった。つまり、菌体カウント法を用いて、浮遊液中の菌体数を計測することにより、従来の培養法(SMA培養法)と同様の結果が得られることが明らかとなった。
【0050】
{大腸菌群に属さない菌株の計測結果}
図5に、(5)〜(10)の試料における、菌体カウント法により得られた浮遊液1mlあたりの菌体数と、SMA培養法によるコロニー数との計測結果を示す。図5に示すように、(5)〜(8)の試料において、培養後の菌体数が、培養前の菌体数よりも減少している。(9)および(10)の試料では、培養後の菌体数が、試料に接種された菌体数よりも減少する試料と、培養後の菌体数が試料に接種された菌体数よりも増加する試料が存在する。しかし、(9)および(10)の試料における菌体の増加率は、(1)〜(4)の試料における菌体の増加率に比べて著しく低い。つまり、大腸菌群に属さない菌株は、BGLB培地を用いて35℃にて4時間で培養しても、大腸菌群に属する菌株に比べて大量に増殖しないことが明らかとなった。この結果から、大腸菌群に属さない菌株は、培養時間が3.5時間であっても、大量に増殖しないと考えられる。
【0051】
したがって、大腸菌群に属しないグラム陽性菌およびグラム陰性菌による牛乳の汚染が10(CFU/ml)以下であれば、これらの菌が、菌体カウント法を用いた大腸菌群の陰性の判定に大きな影響を与えることはないと考えられる。また、菌体カウント法は、培養時間を3.5時間に設定したとしても、大腸菌群に属さない菌株による影響を受けることなく、試料中の大腸菌群が陰性であるか否かを判定することができると考えられる。
【0052】
[実施例2]
本実施例では、BGLB法を基準とした、本実施の形態に係る大腸菌群の検出方法の精度を検討した。大腸菌群の汚染濃度が、0.1(CFU/ml)レベル、1(CFU/ml)レベル、および10(CFU/ml)レベルの試料を準備した。つまり、未殺菌の生乳を牛乳で希釈して、試料を調製した。試料の総数は、65である。各試料中の大腸菌群が陰性であるか否かを、下記の3種類の検出方法を用いて判定した。
【0053】
上記実施例1に記載した菌体カウント法を用いて、各試料の大腸菌群が陰性であるか否かを判定した。
【0054】
牛乳の公定法であるBGLB法に基づいて、各試料の大腸菌群が陰性であるか否かを判定した。具体的には、10mlのBGLB培地に1mlの試料を接種し、接種後のBGLB培地を35℃にて48時間で培養した。培養後のBGLB培地中の気泡の有無、およびBGLB培地が黄色に変色しているか否かによって、各試料の大腸菌群が陰性であるか否かを判定した。
【0055】
牛乳の自主検査として広く用いられているデソ法を用いて、各試料の大腸菌群が陰性であるか否か判定した。10〜15mlのデソ培地と1mlの試料とを混釈し、デソ培地を35℃にて20時間で培養した。培養後のデソ培地における赤色コロニーの有無を観察することにより、各試料の大腸菌群が陰性であるか否かを判定した。
【0056】
図6は、BGLB法の判定結果と、菌体カウント法の判定結果とが一致した試料数を示す表である。図6において、「+」は、陽性を示す。「−」は、陰性を示す。
【0057】
BGLB法および菌体カウント法の両者が陽性と判定した試料の数は、44である。BGLB法および菌体カウント法の両者が陰性と判定した試料の数は、10である。すなわち、BGLB法および菌体カウント法により、判定結果が一致した試料の数は、54である。試料の総数が65であり、判定結果が一致した試料の数が54であることから、BGLB法および菌体カウント法とで、判定結果が一致する確率(一致率P1)は、83.1(%)である。
【0058】
図7は、BGLB法およびデソ法の判定結果が一致した試料数を示す表である。BGLB法およびデソ法の両者が陽性と判定した試料の数は、45である。BGLB法およびデソ法の両者が陰性と判定した試料の数は、11である。すなわち、BGLB法およびデソ法により、判定結果が一致した試料の数は、56である。試料の総数が65であり、判定結果が一致した試料の数が56であることから、BGLB法およびデソ法とで、判定結果が一致する確率(一致率P2)の値は、86.2(%)である。
【0059】
一致率P1,P2が、同程度の値であることから、上記実施の形態に係る菌体カウント法は、牛乳の検査で広く用いられているデソ法と同程度の精度を有しているといえる。したがって、菌体カウント法を、デソ法と同様に自主検査として用いることができると考えられる。
【特許請求の範囲】
【請求項1】
大腸菌群の検出方法であって、
試料を、大腸菌群を培養することができる培地に接種する工程と、
前記試料が接種された前記培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する培養工程と、
培養された前記培地を、フィルタにより濾過する濾過工程と、
前記フィルタに残留した残留物の浮遊液を調製し、前記浮遊液に含まれる菌体数を、フローサイトメータにより計測する計測工程と、
計測した前記菌体数に基づいて前記試料中の大腸菌群の有無を判定する判定工程と、
を備える大腸菌群の検出方法。
【請求項2】
請求項1に記載の大腸菌群の検出方法において、
前記培地は、BGLB(Brilliant Green Lactose Bile)培地、EC(Escherichia coli)培地、及びラウリル硫酸トリプトースブイヨンのいずれかである大腸菌群の検出方法。
【請求項3】
請求項1または請求項2に記載の大腸菌群の検出方法において、
前記培養工程は、前記試料が接種された前記培地を34.5℃以上35.5℃以下にて培養する大腸菌群の検出方法。
【請求項4】
請求項1ないし請求項3のいずれかに記載の大腸菌群の検出方法において、
前記培養工程は、前記試料が接種された前記培地を4時間以上5時間以下で培養する大腸菌群の検出方法。
【請求項5】
請求項1ないし請求項4のいずれかに記載の大腸菌群の検出方法において、
前記濾過工程は、前記培養された前記培地に界面活性剤を添加し、前記界面活性剤が添加された前記培地を濾過する大腸菌群の検出方法。
【請求項6】
請求項5に記載の大腸菌群の検出方法において、
前記濾過工程は、前記界面活性剤が添加された前記培地を濾過する前に、前記界面活性剤が添加された前記培地を40℃以上47℃以下の温度にて加温する大腸菌群の検出方法。
【請求項1】
大腸菌群の検出方法であって、
試料を、大腸菌群を培養することができる培地に接種する工程と、
前記試料が接種された前記培地を30℃以上40℃以下の温度にて、3.5時間以上5時間以下で培養する培養工程と、
培養された前記培地を、フィルタにより濾過する濾過工程と、
前記フィルタに残留した残留物の浮遊液を調製し、前記浮遊液に含まれる菌体数を、フローサイトメータにより計測する計測工程と、
計測した前記菌体数に基づいて前記試料中の大腸菌群の有無を判定する判定工程と、
を備える大腸菌群の検出方法。
【請求項2】
請求項1に記載の大腸菌群の検出方法において、
前記培地は、BGLB(Brilliant Green Lactose Bile)培地、EC(Escherichia coli)培地、及びラウリル硫酸トリプトースブイヨンのいずれかである大腸菌群の検出方法。
【請求項3】
請求項1または請求項2に記載の大腸菌群の検出方法において、
前記培養工程は、前記試料が接種された前記培地を34.5℃以上35.5℃以下にて培養する大腸菌群の検出方法。
【請求項4】
請求項1ないし請求項3のいずれかに記載の大腸菌群の検出方法において、
前記培養工程は、前記試料が接種された前記培地を4時間以上5時間以下で培養する大腸菌群の検出方法。
【請求項5】
請求項1ないし請求項4のいずれかに記載の大腸菌群の検出方法において、
前記濾過工程は、前記培養された前記培地に界面活性剤を添加し、前記界面活性剤が添加された前記培地を濾過する大腸菌群の検出方法。
【請求項6】
請求項5に記載の大腸菌群の検出方法において、
前記濾過工程は、前記界面活性剤が添加された前記培地を濾過する前に、前記界面活性剤が添加された前記培地を40℃以上47℃以下の温度にて加温する大腸菌群の検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−29687(P2012−29687A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2011−147061(P2011−147061)
【出願日】平成23年7月1日(2011.7.1)
【出願人】(000006138)株式会社明治 (265)
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成23年7月1日(2011.7.1)
【出願人】(000006138)株式会社明治 (265)
【Fターム(参考)】
[ Back to top ]

