生体試料からのタンパク質の分離もしくは精製方法、およびその利用
【課題】本発明は、生体内に存在する可溶性タンパク質及び難溶性タンパク質をクロマトグラフ法により精製する方法及び難溶性タンパク質をペプチド化して分離する方法を提供する。
【解決手段】生体試料を破砕し、直接、分離用のクロマトグラフカラムに導入、吸着後、溶媒で可溶性タンパク質を分離、溶出させる。クロマトグラフカラム内に残存している難溶性タンパク質を化学修飾及び酵素消化することによりペプチド断片化し、可溶化させ、分離、溶出させる。これにより、生体試料を分離用のクロマトグラフカラム内に導入することで生体試料に含有されるタンパク質の全てが分離対象となる。生体試料から抽出された成分を有機溶媒などの作用により沈殿させたタンパク質混合物を分離用のクロマトグラフカラム内に導入することで可溶性タンパク質及び難溶性タンパク質の両方が分離対象となる。
【解決手段】生体試料を破砕し、直接、分離用のクロマトグラフカラムに導入、吸着後、溶媒で可溶性タンパク質を分離、溶出させる。クロマトグラフカラム内に残存している難溶性タンパク質を化学修飾及び酵素消化することによりペプチド断片化し、可溶化させ、分離、溶出させる。これにより、生体試料を分離用のクロマトグラフカラム内に導入することで生体試料に含有されるタンパク質の全てが分離対象となる。生体試料から抽出された成分を有機溶媒などの作用により沈殿させたタンパク質混合物を分離用のクロマトグラフカラム内に導入することで可溶性タンパク質及び難溶性タンパク質の両方が分離対象となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体試料から可溶性タンパク質または難溶性タンパク質を分離同定する方法に関する。
【背景技術】
【0002】
微生物、組織細胞等の生体試料中には多種類のタンパク質が混合物として存在しており、生体にとって重要な成分である。生体内でタンパク質は、多くの機能を発揮しており、細胞の状態によって変化するため、発現しているタンパク質を網羅的に解析できればその細胞の状態を知ることができる。よって、生体内のタンパク質を分離して同定することがたいへん重要になってきている。生体内のタンパク質は、酵素のように生体内液に溶解して存在し、水に可溶化できるものもあれば、受容体などの膜タンパク質のように非常に難溶性のものが存在することが知られている。しかし、難溶性タンパク質は、生体内のシグナル伝達など重要な働きがあり、特に重要な解析対象であるにもかかわらず、難溶性であることから大変困難な解析対象である。
【0003】
生体内で発現タンパク質を網羅的に解析できる方法としてプロテオーム解析技術がある。主にプロテオーム解析は、二次元電気泳動法で分離した各タンパク質を抽出し、酵素消化によりペプチド断片化、質量分析によりその分子量を測定して、得られたデータをデータベース検索してタンパク質を同定する技術である(非特許文献1)。しかし、二次元電気泳動法は、タンパク質の分離能力に優れているが、解析対象として重要な難溶性タンパク質が1次元目のゲルに浸透しないために、解析対象とならない問題点が知られている(非特許文献2)。
【0004】
問題解決のため、難溶性タンパク質を分析対象する方法が様々考案されてきている。1つの方向性は、強力な界面活性剤により難溶性タンパク質を可溶化させて分離する一次元電気泳動法(SDS-PAGE)を利用し、プロテオーム解析をする方法である(非特許文献3)。しかし、混合タンパク質の分離の困難さ、分離できる質量範囲が狭い、試料処理量が少ない等の問題点も存在している。
【0005】
クロマトグラフ法を用いてタンパク質を分離し、分析する方法が多く考案されているが現状は可溶性タンパク質を対象としている。難溶性タンパク質を分析、同定するため生体内から可溶性タンパク質、難溶性タンパク質を全く分離せずに酵素で消化し、生成するペプチド断片を分析する方法が考案された(非特許文献4)。しかし、大量に生成したペプチド断片を測定する困難な問題点が残されている。
【0006】
生体試料を直接クロマトグラフカラムに導入する方法が一部で開発されている。血液や血しょうを直接クロマトグラフカラムに導入し目的とする成分のみを溶出させる方法がある(特許文献1)。しかし、可溶性タンパク質が対象であり、主にタンパク質を除去するためのカラムである。
【0007】
通常、高分離能のクロマトグラフカラムは、微粒子の充填剤を充填し、両端のフィルターを付けた構造となっており、破砕された生体試料を直接導入するとフィルターが目づまりをおこし、導入することはできない。カラムクロマトグラフ法(オープンカラム法)では生体試料を直接導入し、タンパク質を精製することが行われているが、溶媒を重力落下させて溶出させることから、充填できる粒子直径を大きくする必要があり、結果として分離能が低くなる。
【0008】
生体から抽出したタンパク質をクロマトグラフカラムに導入し、目的とするタンパク質のみを吸着させて分離する方法が開発されている(非特許文献5)。吸着させたタンパク質を溶出させるために消化酵素を導入して溶出させる。この方法は、クロマトグラフカラムの充填剤とタンパク質の特異的な吸着反応により、目的とするタンパク質のみを精製するのが目的であり、網羅性はない。
【0009】
プロテオーム解析により難溶性タンパク質を分離同定する方法が発明されている(特許文献2)。 この発明では、生体試料からあらかじめ、難溶性タンパク質を沈殿させ、強力な溶解剤により可溶化させ、クロマトグラフカラムに導入し、分離している。よって、はじめに可溶性タンパク質と難溶性タンパク質を分離しており、網羅性はない。
【0010】
【特許文献1】国際公開番号: WO01/059444
【特許文献2】特許公開番号: 2003-149204
【非特許文献1】P. H. O'Farrell (1975) J.Biol.Chem. 250: 4007-4021
【非特許文献2】Rabilloud T. et al. (1997) Electrophoresis 18: 307-316
【非特許文献3】Ahmad Q. R., et al. (2005) Proteome Sci. 8;3(1): 6
【非特許文献4】Wolters D. A., et al. (2001) Anal. Chem. 73(23) : 5683-5690
【非特許文献5】Walker P. A., et al. (1994) Biotechnology (NY).12(6): 601-605
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明の課題は、可溶性タンパク質及び難溶性タンパク質が分離同定できるプロテオーム技術を提供すること及びペプチドを生産することにある。より具体的には、難溶性タンパク質の分離もしくは精製方法、試料中の難溶性タンパク質を可溶化する方法、並びに、タンパク質精製用液体クロマトグラフシステムの提供を課題とする。
【課題を解決するための手段】
【0012】
本発明は、基本的には、生体内に混在して存在する可溶性タンパク質及び難溶性タンパク質をクロマトグラフ法を利用して分離した後、残存している難溶性タンパク質を化学修飾及び酵素消化することによりペプチド断片化し、効率的に可溶化させるものである。すなわち、生体を直接、又はタンパク質のみを沈殿させたものをクロマトグラフカラム内に導入し、溶媒を送液することで、酵素などの可溶性タンパク質を溶出させた後、クロマトグラフカラム内に残存する膜タンパク質などの難溶性タンパク質に対して、還元剤、アルキル化剤を導入し、化学修飾し、さらに、消化酵素を加えて、ペプチド断片化して、可溶化する。これにより、これまで検出が困難であった膜タンパク質などの難溶性タンパク質の分析が可能となり、生体内における難溶性タンパク質の発現状況、機能解析することが可能となるものである。
【0013】
本発明者は、本発明の難溶性タンパク質の分離・精製方法を利用して、微生物から多種類の難溶性タンパク質を実際に検出することに成功した。本願発明の方法により、これまで検出が困難であった難溶性タンパク質の分析が可能となり、生体内における難溶性タンパク質の発現・機能解析が可能となった。
【0014】
即ち本発明は、難溶性タンパク質の分離もしくは精製方法、試料中の難溶性タンパク質を可溶化する方法、並びに、タンパク質精製用液体クロマトグラフシステムに関し、より具体的には、
〔1〕 タンパク質の分離もしくは精製方法であって、生体試料又はタンパク質を沈殿させた試料をクロマトグラフカラムに導入し充填剤に吸着後、溶媒を送液することで、可溶性タンパク質を溶出して難溶性タンパク質をクロマトグラフカラム内に残存させることを特徴とする、タンパク質の分離もしくは精製方法、
〔2〕 前記試料のクロマトグラフカラムへの導入方法が、導入方向にフィルターを設置せず、直接充填剤に吸着させることを特徴とする、〔1〕に記載の方法、
〔3〕 前記クロマトグラフカラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させることを特徴とする、〔1〕に記載の方法、
〔4〕 以下の工程を含む、試料中の難溶性タンパク質を可溶化する方法、
(a)試料をクロマトグラフカラムへ導入する工程
(b)該カラムへ溶媒を送液し、可溶性タンパク質を溶出させる工程
(c)カラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させる工程
〔5〕 〔4〕に記載の方法により試料中の難溶性タンパク質を可溶化する工程を含む、難溶性タンパク質の断片化ペプチドを製造する方法、
〔6〕 〔3〕〜〔5〕のいずれかに記載の方法を実現させるためのシステムであって、試料成分を分離するクロマトグラフカラムと、該クロマトグラフカラムへ溶媒を送液する溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部とを備えた、タンパク質精製用液体クロマトグラフシステム、
〔7〕 前記クロマトグラフカラムが導入方向にフィルターが設置されていないことを特徴とする、〔6〕に記載のシステム、
〔8〕 さらに、前記クロマトグラフカラム内に反応試薬を循環させるための流路を備えた、〔6〕または〔7〕に記載のシステム、
〔9〕 さらに、前記クロマトグラフカラム内で生成したペプチドを取り出すためのバルブを備えた、〔6〕または〔7〕に記載のシステム、
〔10〕 さらに、前記クロマトグラフカラムから溶出される試料成分を検出する検出器を備えた、〔6〕または〔7〕に記載のシステム、
を提供するものである。
【発明の効果】
【0015】
本発明により、生体試料を直接クロマトグラフカラム内に導入し、プロテオーム解析及びペプチドを生産対象とすることができ、対象となるタンパク質が網羅的となる。従来の方法では困難であった難溶性タンパク質の分離同定が一度の操作で可溶性タンパク質と分別して行えるようになる。
【発明を実施するための最良の形態】
【0016】
本発明は、試料中に存在するタンパク質を分離もしくは精製する方法を提供する。本発明の方法の好ましい態様としては、生体試料又はタンパク質を沈殿させた試料をクロマトグラフカラムに導入し充填剤に吸着後、溶媒を送液することで、可溶性タンパク質を溶出して難溶性タンパク質をクロマトグラフカラム内に残存させることを特徴とする、タンパク質の分離もしくは精製方法である。
【0017】
通常、試料中の難溶性タンパク質を分離することは困難であったが、本発明の方法により、例えば、試料に含まれる難溶性タンパク質を効率的に分離・精製することが可能となった。また、本発明の方法により、難溶性タンパク質と可溶性タンパク質の混合物から、その一方のタンパク質のみを効率的に取得することが可能である。
【0018】
本発明の方法に供される試料は、分離したいタンパク質を含有する試料であれば特に制限されず、例えば、生体試料、生体からの抽出物からなる試料、またはタンパク質を沈殿させた試料等が挙げられる。生体としては、特に制限されないが、好ましくは細菌、酵母等の微生物を挙げることができる。本発明の生体試料は、破砕した生体試料であることが好ましい。また、上記「タンパク質を沈殿させた試料」は、例えば、タンパク質のみを沈殿させたものであることが好ましい。
【0019】
生体(個体)そのものを試料として本発明の方法に供することにより、例えば、生体内における難溶性タンパク質の発現状況もしくは機能解析を効率的に実施することができる。
【0020】
本発明の好ましい態様としては、生体試料から抽出された成分を有機溶媒などの作用により沈殿させたタンパク質混合物又は生体試料の破砕物を試料導入側にフィルターが存在しない特殊な高分離クロマトグラフカラムに直接試料を導入することで、解析対象を生体内に存在するタンパク質全体とし、網羅性を確保する。
【0021】
本発明の方法の好ましい態様としては、前記試料のクロマトグラフカラムへの導入方法が、導入方向にフィルターを設置せず、直接充填剤に吸着させることを特徴とする方法である。
【0022】
好ましい態様においては、生体試料内のタンパク質を充填剤に吸着後、溶媒を送液し、可溶性タンパク質を溶出させることで、難溶性タンパク質と可溶性タンパク質を分離、精製し、クロマトグラフカラムに難溶性タンパク質を残存させる。溶出可溶性タンパク質は、プロテオーム解析対象として、さらに分離、精製するか、又は、化学修飾、酵素消化を行い質量分析計、プロテインシーケンサー等により同定する。
【0023】
本発明の好ましい態様としては、クロマトグラフカラム内に残存する膜タンパク質などの難溶性タンパク質に対して、還元剤、アルキル化剤を導入し、化学修飾し、さらに、消化酵素を加えて、ペプチド断片化して、可溶化させる。これにより、これまで検出が困難であった難溶性タンパク質の分析が可能となり、生体内における難溶性タンパク質の発現状況、機能解析することが可能となる。
【0024】
即ち、本発明の方法の好ましい態様としては、前記クロマトグラフカラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させることを特徴とする方法である。
【0025】
本発明の方法において使用する反応試薬には、少なくとも消化酵素が含まれる。本発明における反応試薬には、好ましくは、消化酵素以外にも、例えば、還元剤、メチル化剤、界面活性剤等が含まれる。
【0026】
クロマトグラフカラム内に残存する膜タンパク質などの難溶性タンパク質に対して、還元剤、アルキル化剤を導入し、化学修飾し、さらに、消化酵素を加えて、ペプチド断片化するため、クロマトグラフカラム内に反応試薬を導入する。
【0027】
本発明の反応試薬は、例えば、注射器を用いてクロマトグラフカラム内へ導入することができる。さらに、効率を良くし、化学反応、酵素消化を行うために、クロマトグラフカラムへ通じる流路へ導入することもできる。また、本発明の反応試薬は、溶媒と混合させることにより、カラムへ送液させることができる。送液の際には、適宜、送液ポンプによって効率的にカラムへ導入することが可能である。
【0028】
また、本発明においてクロマトグラフカラム内へ導入された反応試薬は、カラム内を通過後に、さらにカラムへ再導入させるために循環させることができる。反応試薬を循環させカラムへ再び導入することにより、難溶性タンパク質に対する消化酵素の反応のための機会を上昇させ、その結果、難溶性タンパク質のペプチド断片化反応を促進させることができる。
【0029】
本発明に用いるクロマトグラフカラムの大きさは処理する試料量により変更すればよい。よって、内径数ミリから数十センチのものまで使用可能である。なお、使用したクロマトグラフカラムは、充填剤を再充填することで繰り返し使用できる。
クロマトグラフカラムの充填剤は、特に限定されないが、イオン交換体が望ましい。
【0030】
充填剤から難溶性タンパク質と可溶性タンパク質を分離して溶出させるため、たとえば、充填剤にイオン交換体を用いた場合は、塩化ナトリウム濃度勾配クロマトグラフ法で可溶性タンパク質を溶出させる。残存する難溶性タンパク質を遊離させるため、タンパク質を変性させる物質、例えば、界面活性剤、尿素、チオ尿素、塩酸グアニジン、イソチオシアン酸カリウム、グアニジンイソチオシアネート、ヨウ化カリウム等をクロマトグラフカラム内に導入する。遊離したタンパク質に対して還元するため、ジチオスレイトール(DTT)等の還元剤をクロマトグラフカラム内に導入する。さらに、還元部分の再結合を防止するため、ヨードアセトアミド(IAA)等のアルキル化剤をクロマトグラフカラム内に導入する。還元アルキル化したタンパク質をペプチド断片化するため、トリプシン等の消化酵素をクロマトグラフカラム内に導入する。
【0031】
クロマトグラフカラム内で難溶性タンパク質をペプチド断片化するため、酵素消化時間は、通常、数時間から数十時間が必要である。クロマトグラフカラムは、そのまま放置するか、クロマトグラフカラム内の難溶性タンパク質を効率的に酵素消化するため、溶媒をポンプにより循環させることが好ましい。使用した消化酵素に適正な温度で保持する。
【0032】
クロマトグラフカラム内で生成したペプチドは、例えば、オクタデシルシラン化シリカゲル(ODS)等を充填したカラム等に吸着、濃縮させ、脱塩処理し、適当な有機溶媒で溶出させる。
上記方法によって溶出させたペプチドを含む試料は、各種検査・解析等に供することができる。
【0033】
また本発明は、試料中の難溶性タンパク質をペプチド断片化することにより可溶化する方法を提供する。該方法の好ましい態様としては、例えば、以下の工程(a)〜(c)を含む方法である。
(a)試料をクロマトグラフカラムへ導入する工程
(b)該カラムへ溶媒を送液し、可溶性タンパク質を溶出させる工程
(c)カラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させる工程
【0034】
本発明に用いる消化酵素を目的に応じて任意に選択することにより、目的のペプチド結合を切断することで、生理活性ペプチドなどのペプチドの生産ができる。本発明は、上記の難溶性タンパク質を可溶化する方法によって、該難溶性タンパク質の断片化ペプチドを製造する方法を提供する。該方法の好ましい態様としては、上記の(a)〜(c)により試料中の難溶性タンパク質を可溶化する工程を含む、難溶性タンパク質の断片化ペプチドを製造する方法が挙げられる。
【0035】
また本発明は、本発明の各種方法を実現させるためのシステム(装置)を提供する。本発明のシステムの好ましい態様としては、試料成分を分離するクロマトグラフカラムと、該クロマトグラフカラムへ溶媒を送液する溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部とを備えた、タンパク質精製用液体クロマトグラフシステムを例示することができる。
【0036】
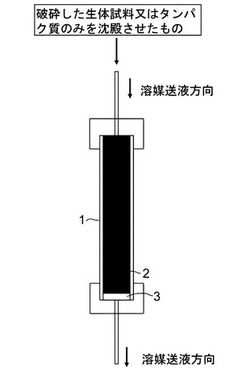
本発明のクロマトグラフカラムの構造の一例を、図1に模式的に示す。耐圧円筒の中は充填剤によって満たされ、溶媒送液方向にフィルターを有するが、好ましくは、導入方向にはフィルターが設置されない。該クロマトグラフカラムへは、溶媒もしくは反応試薬を送液するための溶媒流路によって、溶媒供給部と連結されていることが好ましい。該溶媒供給部には、溶媒脱気装置によって脱気された溶媒が送られ、溶媒混合器によって混合される。該溶媒混合器と溶媒脱気装置との間には、必要に応じてグラジエントコントローラが設置される。本発明のシステムにおいては、好ましくは、該溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部を有する。該試薬注入部は、例えば、溶媒混合器の一部として設置されていてもよい。この場合は、溶媒混合器の中に本発明の反応試薬が導入される。
【0037】
また、クロマトグラフカラムの導入方向には、試料を本システムへ導入するためのサンプルインジェクターが設置され、通常、該サンプルインジェクターから溶媒流路へ注入された試料は、クロマトグラフカラムへ導入される。該サンプルインジェクターとしては、例えば、生体試料導入用注射器を利用することができる。
【0038】
さらに、該溶媒供給部と該クロマトグラフカラムとの間の溶媒流路には、好ましくは、送液ポンプが設置される。
【0039】
前記クロマトグラフカラムは、好ましくは、導入方向にフィルターが設置されていないことを特徴とするカラムである。
【0040】
さらに本発明のシステムは、前記クロマトグラフカラム内に反応試薬を循環させるための流路(循環流路)を備えたものであることが好ましい。即ち、クロマトグラフカラムを通過した反応試薬は、循環流路を通り、再度クロマトグラフカラムへ導入される。
【0041】
また本発明のシステムは、より好ましくは、前記クロマトグラフカラム内で生成したペプチドを取り出すためのバルブを備えたシステムである。該バルブは、通常、2方3方バルブを好適に用いることができる。該バルブによって取り出されたペプチドは、例えば、検出器へ送られる。即ち、本発明のシステムは、前記クロマトグラフカラムから溶出される試料成分を検出する検出器を備えたものであってもよい。
前記バルブと検出器との間には、必要に応じて濃縮カラム(ODS)を設置することができる。また、該検出器には、必要に応じてコントロール及び検出器用コンピュータが接続される。
【0042】
上記システムの構成の一例を、模式的に示したのが図2である。また、「可溶性タンパク質の分離・精製時」、「循環・還元・アルキル化・酵素消化時」、「生成ペプチド濃縮時」、「脱塩・溶出時」における本発明のシステムの構成の一例をそれぞれ図3〜6に示す。これらの構成は、本発明のシステムの具体例であって、本発明はこれらの構成に限定されない。図2〜6に示された各種装置・機器等は、本発明の方法の目的を達成させ得る範囲において、適宜改変(装置の付加、削除、配置変更等)することができる。
【実施例】
【0043】
以下に、具体的な例をもって本発明を示すが、本発明はこれら実施例に限られるものではない。
[実施例1] 超好熱古細菌Aeropyrum pernix K1のプロテオーム解析及び難溶性タンパク質である膜タンパク質の同定
1) 菌体の準備
Aeropyrum pernix K1(A. pernix K1)を佐古ら(Sako Y., et al.(1996), Int. J. Syst. Bacteriol. 46:1070-1077)の方法により培養した。採取した菌体400 mgをマイクロテストチューブ(1.5 ml)に入れ、蒸留水1 mlを加え30秒間、回転式ホモジナイザーを用いて破砕した。破砕試料を2 mlのポリプロピレン製注射器に全量入れた。
【0044】
2) クロマトグラフカラムへの菌体破砕物の導入
可溶性タンパク質の分離、精製には陰イオン交換クロマトグラフ法(SAX)を用いた。クロマトグラフカラムは、共伸工業製の耐圧ガラスカラム(8.0 mm ID × 100 mm)にVarian(Palo Alto, CA, USA)製トリメチルアミノプロピル結合型陰イオン交換充填剤(BONDESIL-SAX, 40μm)を湿式充填した。耐圧ガラスカラム上部に取り付けるフィルターユニットのフィルターのみを取り除き、SAXカラムを組み立てた。タンパク質分離、精製用の高速液体クロマトグラフ装置は、2ポンプ高圧混合グラジエントシステムを使用した。SAXカラムを高速液体クロマトグラフ装置に取付け、A. pernix K1の破砕試料を三方バルブからSAXカラムに全量、導入した。
【0045】
3) SAXによる可溶性タンパク質の分離、精製
塩濃度勾配グラジエントで水溶性タンパク質を溶出させた。移動相の流速は、2.0 ml/minとした。移動相A(100%、トリス−塩酸緩衝液、pH 7.0)を5分間溶出後、30分間で移動相B(100%、トリス−塩酸緩衝液+1 M塩化ナトリウム、pH 7.0)とした。移動相B(100%)を20分間維持した。なお、溶離液は、4分毎に分取し、可溶性タンパク質のプロテオーム解析用の試料とした。
【0046】
4) SAXカラム内に残存する膜タンパク質などの難溶性タンパク質のペプチド断片化
難溶性タンパク質が残留しているSAXカラムをHPLCからはずし、0.1 % 界面活性剤(Sodium 3-[(2-methyl-2-undecyl-1,3-dioxolan-4-yl)methoxy]-1-propanesulfonate:RapiGest SF(Waters製))水溶液5 mlを注射器から注入し、難溶性タンパク質を遊離、可溶化させた。10分後、5 mM-DTTを10 ml注入し、60℃、30分間、保温して遊離、可溶化させた難溶性タンパク質を還元した。室温に冷却後、15 mM-ヨードアセトアミドを10 ml注入し、30分間、放置して難溶性タンパク質をアルキル化した。このSAXカラムに0.5 pM-トリプシン溶液9 mlを注射器から注入し、37℃で15時間、保温し、酵素消化を行い、難溶性タンパク質をペプチド断片化した。
【0047】
5) SAXカラムから難溶性タンパク質から生成したペプチド断片の溶出
トリプシン消化後のSAXカラムに溶離液(0.1 % TFAを含有するメタノール/蒸留水, 5/95, v/v)を高速液体クロマトグラフ装置から20 ml送液し、ペプチドを溶出させ、プロテオーム解析用の試料とした。
【0048】
6) 質量分析法によるタンパク質の同定(プロテオーム解析)
SAXカラムから溶出した可溶性タンパク質溶液は、さらに、サイズ排除クロマトグラフィー(SEC)により分離、精製し、還元、アルキル化、トリプシン消化を行い、プロテオーム解析用の試料とした。プロテオーム解析用試料は、高速液体クロマトグラフタンデム質量分析計(HPLC-MS/MS)を用いて測定した。測定されたペプチドのアミノ酸配列データをデータベース照合し、タンパク質を同定した。
【0049】
7) 同定タンパク質の特長
可溶性タンパク質をSAXカラムから溶出させたプロテオーム解析用試料をHPLC-MS/MSで分析したところ、285種のタンパク質を同定した。難溶性タンパク質をSAXカラム内でトリプシン消化したプロテオーム解析用試料をHPLC-MS/MSで分析したところ、150種のタンパク質を同定した。重複を除いて合計349種のタンパク質を同定した。特にSAXカラム内でトリプシン消化したプロテオーム解析用からは、可溶性タンパク質用のプロテオーム解析では検出できなかった種類のタンパク質が検出され、内、10種類は難溶性タンパク質の膜タンパク質と推定された。検出された膜タンパク質を表1に示す。
【0050】
【表1】

【0051】
同定された10種類の膜タンパク質は、平均分子量51676、平均pI 8.16、タンパク質の疎水・親水性を示すGRAVYスコア(score)(Kyte J., Doolittle R. F. (1982), J. Mol. Biol, 157: 105-132)は、平均で0.732であった。他法で検出されたタンパク質20)との比較をするため、GRAVY scoreと分子量の関係について図7に、GRAVY scoreとpIの関係について図8に示した。特にpIが4.71〜11.05の広い範囲に分布していること及びGRAVY scoreが0.4〜1.0程度の疎水性の高い膜タンパク質を検出しており、他のプロテオーム解析法では検出できなかった領域の膜タンパク質を検出できたことから、本発明の有効性が示された。
【0052】
[実施例2] 大腸菌Escherichia coil K-12 W3110のプロテオーム解析
1) 菌体の準備
Escherichia coil K-12 W3110 (E. coli K12)をグルコースを唯一の栄養源とする最小培地により培養した(永井和夫,"微生物実験法(新生化学実験講座17)", 日本生化学会編110-114, 東京化学同人(1992))。採取した菌体300 mgをマイクロテストチューブ(1.5 ml)に入れ、蒸留水1 mlを加え15分間、超音波式ホモジナイザーを用いて破砕した。破砕試料を2 mlのポリプロピレン製注射器に全量入れた。
【0053】
2) クロマトグラフカラムへの菌体破砕物の導入
可溶性タンパク質の分離、精製には陰イオン交換クロマトグラフ法(SAX)を用いた。クロマトグラフカラムは、実施例1と同一とした。SAXカラムを高速液体クロマトグラフ装置に取付け、E. coli K12の破砕試料を図3の符号16部分からSAXカラムに全量、導入した。
【0054】
3) SAXによる可溶性タンパク質の分離、精製
塩濃度勾配グラジエントで水溶性タンパク質を溶出させた。移動相の流速は、2.0 ml/minとした。移動相A(100%、トリス−塩酸緩衝液、pH 7.6)を5分間溶出後、30分間で移動相B(100%、トリス−塩酸緩衝液+1 M塩化ナトリウム、pH 7.6)とした。移動相B(100%)を20分間維持した。なお、溶離液は、6分毎に分取し、可溶性タンパク質のプロテオーム解析用の試料とした。
【0055】
4) SAXカラム内に残存する難溶性タンパク質のペプチド断片化
難溶性タンパク質を可溶化、断片化させるため、バルブ類を図4の状態として、移動相を循環させた。図4の符号14部分に10mgの界面活性剤(Sodium 3-[(2-methyl -2-undecyl-1,3-dioxolan-4-yl)methoxy]-1-propanesulfonate:RapiGest SF(Waters製))を導入し、60分間循環させて難溶性タンパク質を可溶化した。図4の符号14部分に0.5 M-DTTを200μl注入し、60℃、30分間、可溶化させた難溶性タンパク質を還元した。室温に冷却後、図4の符号14部分に0.5M-ヨードアセトアミドを500μl注入し、30分間、難溶性タンパク質をアルキル化した。図4の符号14部分に5μgのトリプシンを導入し、37℃、15時間、酵素消化を行い、難溶性タンパク質をペプチド断片化した。
【0056】
5) 難溶性タンパク質から生成したペプチド断片の溶出
トリプシン消化により、難溶性タンパク質から生成したペプチド断片を溶出させるため、バルブ類を図5の状態として、移動相を送液した。溶出したペプチド断片は、図5の符号20部分に濃縮した。濃縮したペプチド断片を溶出させるため、バルブ類を図6の状態として、移動相を送液し、プロテオーム解析用試料とした。
【0057】
6) 質量分析法によるタンパク質の同定(プロテオーム解析)
SAXカラムから溶出した可溶性タンパク質溶液は、さらに、サイズ排除クロマトグラフィー(SEC)により分離、精製し、還元、アルキル化、トリプシン消化を行い、プロテオーム解析用の試料とした。プロテオーム解析用試料は、高速液体クロマトグラフタンデム質量分析計(HPLC-MS/MS)を用いて測定した。測定されたペプチドのアミノ酸配列データをデータベース照合し、タンパク質を同定した。
【0058】
7) 同定タンパク質の特長
可溶性タンパク質をSAXカラムから溶出させたプロテオーム解析用試料をHPLC-MS/MSで分析したところ、197種のタンパク質を同定した。SAXカラム内でトリプシン消化したプロテオーム解析用試料をHPLC-MS/MSで分析したところ、103種のタンパク質を同定した。重複を除いて合計231種のタンパク質を同定した。特にSAXカラム内でトリプシン消化したプロテオーム解析用からは、可溶性タンパク質用のプロテオーム解析では検出できなかった34種類のタンパク質が検出された。検出された難溶性タンパク質を表2に示す。
【0059】
【表2】

【0060】
E. coli K12のSAXカラム内でトリプシン消化したプロテオーム解析用からは、可溶性タンパク質用のプロテオーム解析では検出できなかったタンパク質が検出されている。SAXカラム内でトリプシン消化したプロテオーム解析用からは、特異的に膜タンパク質と推定されたタンパク質は、少なかったが、分子量が10万を越すような高分子量の難溶性タンパク質が検出された。
【産業上の利用可能性】
【0061】
本発明は、これまで検出が困難であった膜タンパク質などの難溶性タンパク質の分析を可能とすることにより、生体内における難溶性タンパク質の発現状況、機能解析し、生命機能を活用した物質生産などの方法開発などに関する。
【図面の簡単な説明】
【0062】
【図1】クロマトグラフカラムの構造を示す図である。
【図2】タンパク質分離、精製用液体クロマトグラフ装置を示す図である。
【図3】タンパク質分離、精製用液体クロマトグラフ装置流路図(可溶性タンパク質分離、精製時)を示す図である。
【図4】タンパク質分離、精製用液体クロマトグラフ装置流路図(循環、還元・アルキル化・酵素消化時)を示す図である。
【図5】タンパク質分離、精製用液体クロマトグラフ装置流路図(生成ペプチド濃縮時)を示す図である。
【図6】タンパク質分離、精製用液体クロマトグラフ装置流路図(脱塩、溶出時)を示す図である。
【図7】A. pernix K1検出タンパク質のGRAVY scoreと分子量の関係を示すグラフである。黒三角(▲)は、特異的に同定された難溶性タンパク質である。
【図8】A. pernix K1検出タンパク質のGRAVY scoreとpIの関係を示すグラフである。黒三角(▲)は、特異的に同定された難溶性タンパク質である。
【図9】E. coli K12検出タンパク質のGRAVY scoreと分子量の関係を示すグラフである。
【図10】E. coli K12検出タンパク質のGRAVY scoreとpIの関係を示すグラフである。
【符号の説明】
【0063】
1:耐圧円筒、2:充填剤、3:フィルター、4:ポンプ、5:ミキサー、6:バルブ、7:生体試料導入用注射器、8:クロマトグラフカラム、9:検出器、10:コントロール及び検出器用コンピュータ、11:溶媒切換バルブ、12:溶媒脱気装置、13:グラジエントコントローラ、14:溶媒混合器、15:送液ポンプ、16:サンプル、17:サンプルインジェクター、18:カラム恒温槽、19:分離カラム(SAX、SCX)、20:濃縮カラム(ODS)、21:2方3方バルブ、22:6方バルブ、23:検出器
【技術分野】
【0001】
本発明は、生体試料から可溶性タンパク質または難溶性タンパク質を分離同定する方法に関する。
【背景技術】
【0002】
微生物、組織細胞等の生体試料中には多種類のタンパク質が混合物として存在しており、生体にとって重要な成分である。生体内でタンパク質は、多くの機能を発揮しており、細胞の状態によって変化するため、発現しているタンパク質を網羅的に解析できればその細胞の状態を知ることができる。よって、生体内のタンパク質を分離して同定することがたいへん重要になってきている。生体内のタンパク質は、酵素のように生体内液に溶解して存在し、水に可溶化できるものもあれば、受容体などの膜タンパク質のように非常に難溶性のものが存在することが知られている。しかし、難溶性タンパク質は、生体内のシグナル伝達など重要な働きがあり、特に重要な解析対象であるにもかかわらず、難溶性であることから大変困難な解析対象である。
【0003】
生体内で発現タンパク質を網羅的に解析できる方法としてプロテオーム解析技術がある。主にプロテオーム解析は、二次元電気泳動法で分離した各タンパク質を抽出し、酵素消化によりペプチド断片化、質量分析によりその分子量を測定して、得られたデータをデータベース検索してタンパク質を同定する技術である(非特許文献1)。しかし、二次元電気泳動法は、タンパク質の分離能力に優れているが、解析対象として重要な難溶性タンパク質が1次元目のゲルに浸透しないために、解析対象とならない問題点が知られている(非特許文献2)。
【0004】
問題解決のため、難溶性タンパク質を分析対象する方法が様々考案されてきている。1つの方向性は、強力な界面活性剤により難溶性タンパク質を可溶化させて分離する一次元電気泳動法(SDS-PAGE)を利用し、プロテオーム解析をする方法である(非特許文献3)。しかし、混合タンパク質の分離の困難さ、分離できる質量範囲が狭い、試料処理量が少ない等の問題点も存在している。
【0005】
クロマトグラフ法を用いてタンパク質を分離し、分析する方法が多く考案されているが現状は可溶性タンパク質を対象としている。難溶性タンパク質を分析、同定するため生体内から可溶性タンパク質、難溶性タンパク質を全く分離せずに酵素で消化し、生成するペプチド断片を分析する方法が考案された(非特許文献4)。しかし、大量に生成したペプチド断片を測定する困難な問題点が残されている。
【0006】
生体試料を直接クロマトグラフカラムに導入する方法が一部で開発されている。血液や血しょうを直接クロマトグラフカラムに導入し目的とする成分のみを溶出させる方法がある(特許文献1)。しかし、可溶性タンパク質が対象であり、主にタンパク質を除去するためのカラムである。
【0007】
通常、高分離能のクロマトグラフカラムは、微粒子の充填剤を充填し、両端のフィルターを付けた構造となっており、破砕された生体試料を直接導入するとフィルターが目づまりをおこし、導入することはできない。カラムクロマトグラフ法(オープンカラム法)では生体試料を直接導入し、タンパク質を精製することが行われているが、溶媒を重力落下させて溶出させることから、充填できる粒子直径を大きくする必要があり、結果として分離能が低くなる。
【0008】
生体から抽出したタンパク質をクロマトグラフカラムに導入し、目的とするタンパク質のみを吸着させて分離する方法が開発されている(非特許文献5)。吸着させたタンパク質を溶出させるために消化酵素を導入して溶出させる。この方法は、クロマトグラフカラムの充填剤とタンパク質の特異的な吸着反応により、目的とするタンパク質のみを精製するのが目的であり、網羅性はない。
【0009】
プロテオーム解析により難溶性タンパク質を分離同定する方法が発明されている(特許文献2)。 この発明では、生体試料からあらかじめ、難溶性タンパク質を沈殿させ、強力な溶解剤により可溶化させ、クロマトグラフカラムに導入し、分離している。よって、はじめに可溶性タンパク質と難溶性タンパク質を分離しており、網羅性はない。
【0010】
【特許文献1】国際公開番号: WO01/059444
【特許文献2】特許公開番号: 2003-149204
【非特許文献1】P. H. O'Farrell (1975) J.Biol.Chem. 250: 4007-4021
【非特許文献2】Rabilloud T. et al. (1997) Electrophoresis 18: 307-316
【非特許文献3】Ahmad Q. R., et al. (2005) Proteome Sci. 8;3(1): 6
【非特許文献4】Wolters D. A., et al. (2001) Anal. Chem. 73(23) : 5683-5690
【非特許文献5】Walker P. A., et al. (1994) Biotechnology (NY).12(6): 601-605
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明の課題は、可溶性タンパク質及び難溶性タンパク質が分離同定できるプロテオーム技術を提供すること及びペプチドを生産することにある。より具体的には、難溶性タンパク質の分離もしくは精製方法、試料中の難溶性タンパク質を可溶化する方法、並びに、タンパク質精製用液体クロマトグラフシステムの提供を課題とする。
【課題を解決するための手段】
【0012】
本発明は、基本的には、生体内に混在して存在する可溶性タンパク質及び難溶性タンパク質をクロマトグラフ法を利用して分離した後、残存している難溶性タンパク質を化学修飾及び酵素消化することによりペプチド断片化し、効率的に可溶化させるものである。すなわち、生体を直接、又はタンパク質のみを沈殿させたものをクロマトグラフカラム内に導入し、溶媒を送液することで、酵素などの可溶性タンパク質を溶出させた後、クロマトグラフカラム内に残存する膜タンパク質などの難溶性タンパク質に対して、還元剤、アルキル化剤を導入し、化学修飾し、さらに、消化酵素を加えて、ペプチド断片化して、可溶化する。これにより、これまで検出が困難であった膜タンパク質などの難溶性タンパク質の分析が可能となり、生体内における難溶性タンパク質の発現状況、機能解析することが可能となるものである。
【0013】
本発明者は、本発明の難溶性タンパク質の分離・精製方法を利用して、微生物から多種類の難溶性タンパク質を実際に検出することに成功した。本願発明の方法により、これまで検出が困難であった難溶性タンパク質の分析が可能となり、生体内における難溶性タンパク質の発現・機能解析が可能となった。
【0014】
即ち本発明は、難溶性タンパク質の分離もしくは精製方法、試料中の難溶性タンパク質を可溶化する方法、並びに、タンパク質精製用液体クロマトグラフシステムに関し、より具体的には、
〔1〕 タンパク質の分離もしくは精製方法であって、生体試料又はタンパク質を沈殿させた試料をクロマトグラフカラムに導入し充填剤に吸着後、溶媒を送液することで、可溶性タンパク質を溶出して難溶性タンパク質をクロマトグラフカラム内に残存させることを特徴とする、タンパク質の分離もしくは精製方法、
〔2〕 前記試料のクロマトグラフカラムへの導入方法が、導入方向にフィルターを設置せず、直接充填剤に吸着させることを特徴とする、〔1〕に記載の方法、
〔3〕 前記クロマトグラフカラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させることを特徴とする、〔1〕に記載の方法、
〔4〕 以下の工程を含む、試料中の難溶性タンパク質を可溶化する方法、
(a)試料をクロマトグラフカラムへ導入する工程
(b)該カラムへ溶媒を送液し、可溶性タンパク質を溶出させる工程
(c)カラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させる工程
〔5〕 〔4〕に記載の方法により試料中の難溶性タンパク質を可溶化する工程を含む、難溶性タンパク質の断片化ペプチドを製造する方法、
〔6〕 〔3〕〜〔5〕のいずれかに記載の方法を実現させるためのシステムであって、試料成分を分離するクロマトグラフカラムと、該クロマトグラフカラムへ溶媒を送液する溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部とを備えた、タンパク質精製用液体クロマトグラフシステム、
〔7〕 前記クロマトグラフカラムが導入方向にフィルターが設置されていないことを特徴とする、〔6〕に記載のシステム、
〔8〕 さらに、前記クロマトグラフカラム内に反応試薬を循環させるための流路を備えた、〔6〕または〔7〕に記載のシステム、
〔9〕 さらに、前記クロマトグラフカラム内で生成したペプチドを取り出すためのバルブを備えた、〔6〕または〔7〕に記載のシステム、
〔10〕 さらに、前記クロマトグラフカラムから溶出される試料成分を検出する検出器を備えた、〔6〕または〔7〕に記載のシステム、
を提供するものである。
【発明の効果】
【0015】
本発明により、生体試料を直接クロマトグラフカラム内に導入し、プロテオーム解析及びペプチドを生産対象とすることができ、対象となるタンパク質が網羅的となる。従来の方法では困難であった難溶性タンパク質の分離同定が一度の操作で可溶性タンパク質と分別して行えるようになる。
【発明を実施するための最良の形態】
【0016】
本発明は、試料中に存在するタンパク質を分離もしくは精製する方法を提供する。本発明の方法の好ましい態様としては、生体試料又はタンパク質を沈殿させた試料をクロマトグラフカラムに導入し充填剤に吸着後、溶媒を送液することで、可溶性タンパク質を溶出して難溶性タンパク質をクロマトグラフカラム内に残存させることを特徴とする、タンパク質の分離もしくは精製方法である。
【0017】
通常、試料中の難溶性タンパク質を分離することは困難であったが、本発明の方法により、例えば、試料に含まれる難溶性タンパク質を効率的に分離・精製することが可能となった。また、本発明の方法により、難溶性タンパク質と可溶性タンパク質の混合物から、その一方のタンパク質のみを効率的に取得することが可能である。
【0018】
本発明の方法に供される試料は、分離したいタンパク質を含有する試料であれば特に制限されず、例えば、生体試料、生体からの抽出物からなる試料、またはタンパク質を沈殿させた試料等が挙げられる。生体としては、特に制限されないが、好ましくは細菌、酵母等の微生物を挙げることができる。本発明の生体試料は、破砕した生体試料であることが好ましい。また、上記「タンパク質を沈殿させた試料」は、例えば、タンパク質のみを沈殿させたものであることが好ましい。
【0019】
生体(個体)そのものを試料として本発明の方法に供することにより、例えば、生体内における難溶性タンパク質の発現状況もしくは機能解析を効率的に実施することができる。
【0020】
本発明の好ましい態様としては、生体試料から抽出された成分を有機溶媒などの作用により沈殿させたタンパク質混合物又は生体試料の破砕物を試料導入側にフィルターが存在しない特殊な高分離クロマトグラフカラムに直接試料を導入することで、解析対象を生体内に存在するタンパク質全体とし、網羅性を確保する。
【0021】
本発明の方法の好ましい態様としては、前記試料のクロマトグラフカラムへの導入方法が、導入方向にフィルターを設置せず、直接充填剤に吸着させることを特徴とする方法である。
【0022】
好ましい態様においては、生体試料内のタンパク質を充填剤に吸着後、溶媒を送液し、可溶性タンパク質を溶出させることで、難溶性タンパク質と可溶性タンパク質を分離、精製し、クロマトグラフカラムに難溶性タンパク質を残存させる。溶出可溶性タンパク質は、プロテオーム解析対象として、さらに分離、精製するか、又は、化学修飾、酵素消化を行い質量分析計、プロテインシーケンサー等により同定する。
【0023】
本発明の好ましい態様としては、クロマトグラフカラム内に残存する膜タンパク質などの難溶性タンパク質に対して、還元剤、アルキル化剤を導入し、化学修飾し、さらに、消化酵素を加えて、ペプチド断片化して、可溶化させる。これにより、これまで検出が困難であった難溶性タンパク質の分析が可能となり、生体内における難溶性タンパク質の発現状況、機能解析することが可能となる。
【0024】
即ち、本発明の方法の好ましい態様としては、前記クロマトグラフカラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させることを特徴とする方法である。
【0025】
本発明の方法において使用する反応試薬には、少なくとも消化酵素が含まれる。本発明における反応試薬には、好ましくは、消化酵素以外にも、例えば、還元剤、メチル化剤、界面活性剤等が含まれる。
【0026】
クロマトグラフカラム内に残存する膜タンパク質などの難溶性タンパク質に対して、還元剤、アルキル化剤を導入し、化学修飾し、さらに、消化酵素を加えて、ペプチド断片化するため、クロマトグラフカラム内に反応試薬を導入する。
【0027】
本発明の反応試薬は、例えば、注射器を用いてクロマトグラフカラム内へ導入することができる。さらに、効率を良くし、化学反応、酵素消化を行うために、クロマトグラフカラムへ通じる流路へ導入することもできる。また、本発明の反応試薬は、溶媒と混合させることにより、カラムへ送液させることができる。送液の際には、適宜、送液ポンプによって効率的にカラムへ導入することが可能である。
【0028】
また、本発明においてクロマトグラフカラム内へ導入された反応試薬は、カラム内を通過後に、さらにカラムへ再導入させるために循環させることができる。反応試薬を循環させカラムへ再び導入することにより、難溶性タンパク質に対する消化酵素の反応のための機会を上昇させ、その結果、難溶性タンパク質のペプチド断片化反応を促進させることができる。
【0029】
本発明に用いるクロマトグラフカラムの大きさは処理する試料量により変更すればよい。よって、内径数ミリから数十センチのものまで使用可能である。なお、使用したクロマトグラフカラムは、充填剤を再充填することで繰り返し使用できる。
クロマトグラフカラムの充填剤は、特に限定されないが、イオン交換体が望ましい。
【0030】
充填剤から難溶性タンパク質と可溶性タンパク質を分離して溶出させるため、たとえば、充填剤にイオン交換体を用いた場合は、塩化ナトリウム濃度勾配クロマトグラフ法で可溶性タンパク質を溶出させる。残存する難溶性タンパク質を遊離させるため、タンパク質を変性させる物質、例えば、界面活性剤、尿素、チオ尿素、塩酸グアニジン、イソチオシアン酸カリウム、グアニジンイソチオシアネート、ヨウ化カリウム等をクロマトグラフカラム内に導入する。遊離したタンパク質に対して還元するため、ジチオスレイトール(DTT)等の還元剤をクロマトグラフカラム内に導入する。さらに、還元部分の再結合を防止するため、ヨードアセトアミド(IAA)等のアルキル化剤をクロマトグラフカラム内に導入する。還元アルキル化したタンパク質をペプチド断片化するため、トリプシン等の消化酵素をクロマトグラフカラム内に導入する。
【0031】
クロマトグラフカラム内で難溶性タンパク質をペプチド断片化するため、酵素消化時間は、通常、数時間から数十時間が必要である。クロマトグラフカラムは、そのまま放置するか、クロマトグラフカラム内の難溶性タンパク質を効率的に酵素消化するため、溶媒をポンプにより循環させることが好ましい。使用した消化酵素に適正な温度で保持する。
【0032】
クロマトグラフカラム内で生成したペプチドは、例えば、オクタデシルシラン化シリカゲル(ODS)等を充填したカラム等に吸着、濃縮させ、脱塩処理し、適当な有機溶媒で溶出させる。
上記方法によって溶出させたペプチドを含む試料は、各種検査・解析等に供することができる。
【0033】
また本発明は、試料中の難溶性タンパク質をペプチド断片化することにより可溶化する方法を提供する。該方法の好ましい態様としては、例えば、以下の工程(a)〜(c)を含む方法である。
(a)試料をクロマトグラフカラムへ導入する工程
(b)該カラムへ溶媒を送液し、可溶性タンパク質を溶出させる工程
(c)カラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させる工程
【0034】
本発明に用いる消化酵素を目的に応じて任意に選択することにより、目的のペプチド結合を切断することで、生理活性ペプチドなどのペプチドの生産ができる。本発明は、上記の難溶性タンパク質を可溶化する方法によって、該難溶性タンパク質の断片化ペプチドを製造する方法を提供する。該方法の好ましい態様としては、上記の(a)〜(c)により試料中の難溶性タンパク質を可溶化する工程を含む、難溶性タンパク質の断片化ペプチドを製造する方法が挙げられる。
【0035】
また本発明は、本発明の各種方法を実現させるためのシステム(装置)を提供する。本発明のシステムの好ましい態様としては、試料成分を分離するクロマトグラフカラムと、該クロマトグラフカラムへ溶媒を送液する溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部とを備えた、タンパク質精製用液体クロマトグラフシステムを例示することができる。
【0036】
本発明のクロマトグラフカラムの構造の一例を、図1に模式的に示す。耐圧円筒の中は充填剤によって満たされ、溶媒送液方向にフィルターを有するが、好ましくは、導入方向にはフィルターが設置されない。該クロマトグラフカラムへは、溶媒もしくは反応試薬を送液するための溶媒流路によって、溶媒供給部と連結されていることが好ましい。該溶媒供給部には、溶媒脱気装置によって脱気された溶媒が送られ、溶媒混合器によって混合される。該溶媒混合器と溶媒脱気装置との間には、必要に応じてグラジエントコントローラが設置される。本発明のシステムにおいては、好ましくは、該溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部を有する。該試薬注入部は、例えば、溶媒混合器の一部として設置されていてもよい。この場合は、溶媒混合器の中に本発明の反応試薬が導入される。
【0037】
また、クロマトグラフカラムの導入方向には、試料を本システムへ導入するためのサンプルインジェクターが設置され、通常、該サンプルインジェクターから溶媒流路へ注入された試料は、クロマトグラフカラムへ導入される。該サンプルインジェクターとしては、例えば、生体試料導入用注射器を利用することができる。
【0038】
さらに、該溶媒供給部と該クロマトグラフカラムとの間の溶媒流路には、好ましくは、送液ポンプが設置される。
【0039】
前記クロマトグラフカラムは、好ましくは、導入方向にフィルターが設置されていないことを特徴とするカラムである。
【0040】
さらに本発明のシステムは、前記クロマトグラフカラム内に反応試薬を循環させるための流路(循環流路)を備えたものであることが好ましい。即ち、クロマトグラフカラムを通過した反応試薬は、循環流路を通り、再度クロマトグラフカラムへ導入される。
【0041】
また本発明のシステムは、より好ましくは、前記クロマトグラフカラム内で生成したペプチドを取り出すためのバルブを備えたシステムである。該バルブは、通常、2方3方バルブを好適に用いることができる。該バルブによって取り出されたペプチドは、例えば、検出器へ送られる。即ち、本発明のシステムは、前記クロマトグラフカラムから溶出される試料成分を検出する検出器を備えたものであってもよい。
前記バルブと検出器との間には、必要に応じて濃縮カラム(ODS)を設置することができる。また、該検出器には、必要に応じてコントロール及び検出器用コンピュータが接続される。
【0042】
上記システムの構成の一例を、模式的に示したのが図2である。また、「可溶性タンパク質の分離・精製時」、「循環・還元・アルキル化・酵素消化時」、「生成ペプチド濃縮時」、「脱塩・溶出時」における本発明のシステムの構成の一例をそれぞれ図3〜6に示す。これらの構成は、本発明のシステムの具体例であって、本発明はこれらの構成に限定されない。図2〜6に示された各種装置・機器等は、本発明の方法の目的を達成させ得る範囲において、適宜改変(装置の付加、削除、配置変更等)することができる。
【実施例】
【0043】
以下に、具体的な例をもって本発明を示すが、本発明はこれら実施例に限られるものではない。
[実施例1] 超好熱古細菌Aeropyrum pernix K1のプロテオーム解析及び難溶性タンパク質である膜タンパク質の同定
1) 菌体の準備
Aeropyrum pernix K1(A. pernix K1)を佐古ら(Sako Y., et al.(1996), Int. J. Syst. Bacteriol. 46:1070-1077)の方法により培養した。採取した菌体400 mgをマイクロテストチューブ(1.5 ml)に入れ、蒸留水1 mlを加え30秒間、回転式ホモジナイザーを用いて破砕した。破砕試料を2 mlのポリプロピレン製注射器に全量入れた。
【0044】
2) クロマトグラフカラムへの菌体破砕物の導入
可溶性タンパク質の分離、精製には陰イオン交換クロマトグラフ法(SAX)を用いた。クロマトグラフカラムは、共伸工業製の耐圧ガラスカラム(8.0 mm ID × 100 mm)にVarian(Palo Alto, CA, USA)製トリメチルアミノプロピル結合型陰イオン交換充填剤(BONDESIL-SAX, 40μm)を湿式充填した。耐圧ガラスカラム上部に取り付けるフィルターユニットのフィルターのみを取り除き、SAXカラムを組み立てた。タンパク質分離、精製用の高速液体クロマトグラフ装置は、2ポンプ高圧混合グラジエントシステムを使用した。SAXカラムを高速液体クロマトグラフ装置に取付け、A. pernix K1の破砕試料を三方バルブからSAXカラムに全量、導入した。
【0045】
3) SAXによる可溶性タンパク質の分離、精製
塩濃度勾配グラジエントで水溶性タンパク質を溶出させた。移動相の流速は、2.0 ml/minとした。移動相A(100%、トリス−塩酸緩衝液、pH 7.0)を5分間溶出後、30分間で移動相B(100%、トリス−塩酸緩衝液+1 M塩化ナトリウム、pH 7.0)とした。移動相B(100%)を20分間維持した。なお、溶離液は、4分毎に分取し、可溶性タンパク質のプロテオーム解析用の試料とした。
【0046】
4) SAXカラム内に残存する膜タンパク質などの難溶性タンパク質のペプチド断片化
難溶性タンパク質が残留しているSAXカラムをHPLCからはずし、0.1 % 界面活性剤(Sodium 3-[(2-methyl-2-undecyl-1,3-dioxolan-4-yl)methoxy]-1-propanesulfonate:RapiGest SF(Waters製))水溶液5 mlを注射器から注入し、難溶性タンパク質を遊離、可溶化させた。10分後、5 mM-DTTを10 ml注入し、60℃、30分間、保温して遊離、可溶化させた難溶性タンパク質を還元した。室温に冷却後、15 mM-ヨードアセトアミドを10 ml注入し、30分間、放置して難溶性タンパク質をアルキル化した。このSAXカラムに0.5 pM-トリプシン溶液9 mlを注射器から注入し、37℃で15時間、保温し、酵素消化を行い、難溶性タンパク質をペプチド断片化した。
【0047】
5) SAXカラムから難溶性タンパク質から生成したペプチド断片の溶出
トリプシン消化後のSAXカラムに溶離液(0.1 % TFAを含有するメタノール/蒸留水, 5/95, v/v)を高速液体クロマトグラフ装置から20 ml送液し、ペプチドを溶出させ、プロテオーム解析用の試料とした。
【0048】
6) 質量分析法によるタンパク質の同定(プロテオーム解析)
SAXカラムから溶出した可溶性タンパク質溶液は、さらに、サイズ排除クロマトグラフィー(SEC)により分離、精製し、還元、アルキル化、トリプシン消化を行い、プロテオーム解析用の試料とした。プロテオーム解析用試料は、高速液体クロマトグラフタンデム質量分析計(HPLC-MS/MS)を用いて測定した。測定されたペプチドのアミノ酸配列データをデータベース照合し、タンパク質を同定した。
【0049】
7) 同定タンパク質の特長
可溶性タンパク質をSAXカラムから溶出させたプロテオーム解析用試料をHPLC-MS/MSで分析したところ、285種のタンパク質を同定した。難溶性タンパク質をSAXカラム内でトリプシン消化したプロテオーム解析用試料をHPLC-MS/MSで分析したところ、150種のタンパク質を同定した。重複を除いて合計349種のタンパク質を同定した。特にSAXカラム内でトリプシン消化したプロテオーム解析用からは、可溶性タンパク質用のプロテオーム解析では検出できなかった種類のタンパク質が検出され、内、10種類は難溶性タンパク質の膜タンパク質と推定された。検出された膜タンパク質を表1に示す。
【0050】
【表1】

【0051】
同定された10種類の膜タンパク質は、平均分子量51676、平均pI 8.16、タンパク質の疎水・親水性を示すGRAVYスコア(score)(Kyte J., Doolittle R. F. (1982), J. Mol. Biol, 157: 105-132)は、平均で0.732であった。他法で検出されたタンパク質20)との比較をするため、GRAVY scoreと分子量の関係について図7に、GRAVY scoreとpIの関係について図8に示した。特にpIが4.71〜11.05の広い範囲に分布していること及びGRAVY scoreが0.4〜1.0程度の疎水性の高い膜タンパク質を検出しており、他のプロテオーム解析法では検出できなかった領域の膜タンパク質を検出できたことから、本発明の有効性が示された。
【0052】
[実施例2] 大腸菌Escherichia coil K-12 W3110のプロテオーム解析
1) 菌体の準備
Escherichia coil K-12 W3110 (E. coli K12)をグルコースを唯一の栄養源とする最小培地により培養した(永井和夫,"微生物実験法(新生化学実験講座17)", 日本生化学会編110-114, 東京化学同人(1992))。採取した菌体300 mgをマイクロテストチューブ(1.5 ml)に入れ、蒸留水1 mlを加え15分間、超音波式ホモジナイザーを用いて破砕した。破砕試料を2 mlのポリプロピレン製注射器に全量入れた。
【0053】
2) クロマトグラフカラムへの菌体破砕物の導入
可溶性タンパク質の分離、精製には陰イオン交換クロマトグラフ法(SAX)を用いた。クロマトグラフカラムは、実施例1と同一とした。SAXカラムを高速液体クロマトグラフ装置に取付け、E. coli K12の破砕試料を図3の符号16部分からSAXカラムに全量、導入した。
【0054】
3) SAXによる可溶性タンパク質の分離、精製
塩濃度勾配グラジエントで水溶性タンパク質を溶出させた。移動相の流速は、2.0 ml/minとした。移動相A(100%、トリス−塩酸緩衝液、pH 7.6)を5分間溶出後、30分間で移動相B(100%、トリス−塩酸緩衝液+1 M塩化ナトリウム、pH 7.6)とした。移動相B(100%)を20分間維持した。なお、溶離液は、6分毎に分取し、可溶性タンパク質のプロテオーム解析用の試料とした。
【0055】
4) SAXカラム内に残存する難溶性タンパク質のペプチド断片化
難溶性タンパク質を可溶化、断片化させるため、バルブ類を図4の状態として、移動相を循環させた。図4の符号14部分に10mgの界面活性剤(Sodium 3-[(2-methyl -2-undecyl-1,3-dioxolan-4-yl)methoxy]-1-propanesulfonate:RapiGest SF(Waters製))を導入し、60分間循環させて難溶性タンパク質を可溶化した。図4の符号14部分に0.5 M-DTTを200μl注入し、60℃、30分間、可溶化させた難溶性タンパク質を還元した。室温に冷却後、図4の符号14部分に0.5M-ヨードアセトアミドを500μl注入し、30分間、難溶性タンパク質をアルキル化した。図4の符号14部分に5μgのトリプシンを導入し、37℃、15時間、酵素消化を行い、難溶性タンパク質をペプチド断片化した。
【0056】
5) 難溶性タンパク質から生成したペプチド断片の溶出
トリプシン消化により、難溶性タンパク質から生成したペプチド断片を溶出させるため、バルブ類を図5の状態として、移動相を送液した。溶出したペプチド断片は、図5の符号20部分に濃縮した。濃縮したペプチド断片を溶出させるため、バルブ類を図6の状態として、移動相を送液し、プロテオーム解析用試料とした。
【0057】
6) 質量分析法によるタンパク質の同定(プロテオーム解析)
SAXカラムから溶出した可溶性タンパク質溶液は、さらに、サイズ排除クロマトグラフィー(SEC)により分離、精製し、還元、アルキル化、トリプシン消化を行い、プロテオーム解析用の試料とした。プロテオーム解析用試料は、高速液体クロマトグラフタンデム質量分析計(HPLC-MS/MS)を用いて測定した。測定されたペプチドのアミノ酸配列データをデータベース照合し、タンパク質を同定した。
【0058】
7) 同定タンパク質の特長
可溶性タンパク質をSAXカラムから溶出させたプロテオーム解析用試料をHPLC-MS/MSで分析したところ、197種のタンパク質を同定した。SAXカラム内でトリプシン消化したプロテオーム解析用試料をHPLC-MS/MSで分析したところ、103種のタンパク質を同定した。重複を除いて合計231種のタンパク質を同定した。特にSAXカラム内でトリプシン消化したプロテオーム解析用からは、可溶性タンパク質用のプロテオーム解析では検出できなかった34種類のタンパク質が検出された。検出された難溶性タンパク質を表2に示す。
【0059】
【表2】

【0060】
E. coli K12のSAXカラム内でトリプシン消化したプロテオーム解析用からは、可溶性タンパク質用のプロテオーム解析では検出できなかったタンパク質が検出されている。SAXカラム内でトリプシン消化したプロテオーム解析用からは、特異的に膜タンパク質と推定されたタンパク質は、少なかったが、分子量が10万を越すような高分子量の難溶性タンパク質が検出された。
【産業上の利用可能性】
【0061】
本発明は、これまで検出が困難であった膜タンパク質などの難溶性タンパク質の分析を可能とすることにより、生体内における難溶性タンパク質の発現状況、機能解析し、生命機能を活用した物質生産などの方法開発などに関する。
【図面の簡単な説明】
【0062】
【図1】クロマトグラフカラムの構造を示す図である。
【図2】タンパク質分離、精製用液体クロマトグラフ装置を示す図である。
【図3】タンパク質分離、精製用液体クロマトグラフ装置流路図(可溶性タンパク質分離、精製時)を示す図である。
【図4】タンパク質分離、精製用液体クロマトグラフ装置流路図(循環、還元・アルキル化・酵素消化時)を示す図である。
【図5】タンパク質分離、精製用液体クロマトグラフ装置流路図(生成ペプチド濃縮時)を示す図である。
【図6】タンパク質分離、精製用液体クロマトグラフ装置流路図(脱塩、溶出時)を示す図である。
【図7】A. pernix K1検出タンパク質のGRAVY scoreと分子量の関係を示すグラフである。黒三角(▲)は、特異的に同定された難溶性タンパク質である。
【図8】A. pernix K1検出タンパク質のGRAVY scoreとpIの関係を示すグラフである。黒三角(▲)は、特異的に同定された難溶性タンパク質である。
【図9】E. coli K12検出タンパク質のGRAVY scoreと分子量の関係を示すグラフである。
【図10】E. coli K12検出タンパク質のGRAVY scoreとpIの関係を示すグラフである。
【符号の説明】
【0063】
1:耐圧円筒、2:充填剤、3:フィルター、4:ポンプ、5:ミキサー、6:バルブ、7:生体試料導入用注射器、8:クロマトグラフカラム、9:検出器、10:コントロール及び検出器用コンピュータ、11:溶媒切換バルブ、12:溶媒脱気装置、13:グラジエントコントローラ、14:溶媒混合器、15:送液ポンプ、16:サンプル、17:サンプルインジェクター、18:カラム恒温槽、19:分離カラム(SAX、SCX)、20:濃縮カラム(ODS)、21:2方3方バルブ、22:6方バルブ、23:検出器
【特許請求の範囲】
【請求項1】
タンパク質の分離もしくは精製方法であって、生体試料又はタンパク質を沈殿させた試料をクロマトグラフカラムに導入し充填剤に吸着後、溶媒を送液することで、可溶性タンパク質を溶出して難溶性タンパク質をクロマトグラフカラム内に残存させることを特徴とする、タンパク質の分離もしくは精製方法。
【請求項2】
前記試料のクロマトグラフカラムへの導入方法が、導入方向にフィルターを設置せず、直接充填剤に吸着させることを特徴とする、請求項1に記載の方法。
【請求項3】
前記クロマトグラフカラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させることを特徴とする、請求項1に記載の方法。
【請求項4】
以下の工程を含む、試料中の難溶性タンパク質を可溶化する方法。
(a)試料をクロマトグラフカラムへ導入する工程
(b)該カラムへ溶媒を送液し、可溶性タンパク質を溶出させる工程
(c)カラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させる工程
【請求項5】
請求項4に記載の方法により試料中の難溶性タンパク質を可溶化する工程を含む、難溶性タンパク質の断片化ペプチドを製造する方法。
【請求項6】
請求項3〜5のいずれかに記載の方法を実現させるためのシステムであって、試料成分を分離するクロマトグラフカラムと、該クロマトグラフカラムへ溶媒を送液する溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部とを備えた、タンパク質精製用液体クロマトグラフシステム。
【請求項7】
前記クロマトグラフカラムが導入方向にフィルターが設置されていないことを特徴とする、請求項6に記載のシステム。
【請求項8】
さらに、前記クロマトグラフカラム内に反応試薬を循環させるための流路を備えた、請求項6または7に記載のシステム。
【請求項9】
さらに、前記クロマトグラフカラム内で生成したペプチドを取り出すためのバルブを備えた、請求項6または7に記載のシステム。
【請求項10】
さらに、前記クロマトグラフカラムから溶出される試料成分を検出する検出器を備えた、請求項6または7に記載のシステム。
【請求項1】
タンパク質の分離もしくは精製方法であって、生体試料又はタンパク質を沈殿させた試料をクロマトグラフカラムに導入し充填剤に吸着後、溶媒を送液することで、可溶性タンパク質を溶出して難溶性タンパク質をクロマトグラフカラム内に残存させることを特徴とする、タンパク質の分離もしくは精製方法。
【請求項2】
前記試料のクロマトグラフカラムへの導入方法が、導入方向にフィルターを設置せず、直接充填剤に吸着させることを特徴とする、請求項1に記載の方法。
【請求項3】
前記クロマトグラフカラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させることを特徴とする、請求項1に記載の方法。
【請求項4】
以下の工程を含む、試料中の難溶性タンパク質を可溶化する方法。
(a)試料をクロマトグラフカラムへ導入する工程
(b)該カラムへ溶媒を送液し、可溶性タンパク質を溶出させる工程
(c)カラム内へ消化酵素を含む反応試薬を添加し、残存する難溶性タンパク質をペプチド断片化することにより可溶化させる工程
【請求項5】
請求項4に記載の方法により試料中の難溶性タンパク質を可溶化する工程を含む、難溶性タンパク質の断片化ペプチドを製造する方法。
【請求項6】
請求項3〜5のいずれかに記載の方法を実現させるためのシステムであって、試料成分を分離するクロマトグラフカラムと、該クロマトグラフカラムへ溶媒を送液する溶媒供給部と、該溶媒供給部からクロマトグラフカラムに至る溶媒流路に反応試薬を注入する試薬注入部とを備えた、タンパク質精製用液体クロマトグラフシステム。
【請求項7】
前記クロマトグラフカラムが導入方向にフィルターが設置されていないことを特徴とする、請求項6に記載のシステム。
【請求項8】
さらに、前記クロマトグラフカラム内に反応試薬を循環させるための流路を備えた、請求項6または7に記載のシステム。
【請求項9】
さらに、前記クロマトグラフカラム内で生成したペプチドを取り出すためのバルブを備えた、請求項6または7に記載のシステム。
【請求項10】
さらに、前記クロマトグラフカラムから溶出される試料成分を検出する検出器を備えた、請求項6または7に記載のシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2009−5692(P2009−5692A)
【公開日】平成21年1月15日(2009.1.15)
【国際特許分類】
【出願番号】特願2008−142129(P2008−142129)
【出願日】平成20年5月30日(2008.5.30)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年12月5日 社団法人 日本分析化学会発行の「分析化学 第55巻 第12号(通巻635)」に発表
【出願人】(301037213)独立行政法人製品評価技術基盤機構 (25)
【Fターム(参考)】
【公開日】平成21年1月15日(2009.1.15)
【国際特許分類】
【出願日】平成20年5月30日(2008.5.30)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成18年12月5日 社団法人 日本分析化学会発行の「分析化学 第55巻 第12号(通巻635)」に発表
【出願人】(301037213)独立行政法人製品評価技術基盤機構 (25)
【Fターム(参考)】
[ Back to top ]

