発がん性(高リスク型)ヒトパピロ−マウイルス(HPV)遺伝子型を同定するためのプライマーセット
【課題】子宮頸がんや高度異形成に関与する13種類のHPV検出のためのマルチプレックスPCR用プライマーセットを提供する。そのうちの7セットは、我が国の子宮頸がんに関連する16型,18型,31型,33型,35型,52型,58型の遺伝子型を同定し、その他の6セットは、39型、45型,51型,56型,59型,68型を一括して感染の有無を判定する方法である。すべてを1チューブでマルチプレックスPCRを行う事により、特異的且つ高感度でしかも安価な検出法を提供する。
【解決手段】我が国の子宮頸がんに関連するHPV遺伝子型7種及びその他の高リスク群A(45,51,68型)とその他の高リスク群B(39,56,59型)のアンプリコンの長さが異なるように、プライマーを設計する。すべてのプライマーを混合してマルチプレックスPCRを行い、電気泳動で分離測定することによって試料におけるHPV型を検出する。
【解決手段】我が国の子宮頸がんに関連するHPV遺伝子型7種及びその他の高リスク群A(45,51,68型)とその他の高リスク群B(39,56,59型)のアンプリコンの長さが異なるように、プライマーを設計する。すべてのプライマーを混合してマルチプレックスPCRを行い、電気泳動で分離測定することによって試料におけるHPV型を検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は我が国の子宮頸癌の主たる原因であるHPV遺伝子型(16,18,
31,33,35,52,58型)を同定するための特異的プライマーセット及び我が国では頻度は少ないが高リスクHPVに分類されているHPV(39,45,51,56,59,68型)の感染の有無を判定するプライマーセットを提示する。これを用いたマルチプレックスPCR法によるHPV遺伝子型の同定法は、高感度で且つ特異的であり、簡便で安価な方法である。
【背景技術】
【0002】
HPVは、8000bp弱の環状2本鎖ゲノムDNAを持ち、今日まで100以上のHPV遺伝子型が同定されている。
【0003】
子宮頚癌は、女性では2番目に多い悪性腫瘍であるが、HPVはこの子宮頚癌の原因ウイルスであることが知られている。
【0004】
HPV遺伝子型を検出することは、前癌病変や子宮頚癌の予後に必要不可欠である。HPV遺伝子型は、その感染によって導かれた子宮頸部の高度異形成や癌への成り易さから、高リスク型、中間型および低リスク型に分けられている。
【0005】
これまで世界的には、13種類が高リスク型に分類されている(非特許文献1)。即ち、HPV16,18、31,33,35,39,45,51,52,
56,58,59,68型である。
【0006】
13種類の高リスク型HPVの感染は必ずしも癌への進展リスクが同一ではないので、すべての高リスクHPV型を同一視することは行き過ぎた管理になる可能性がある。
【0007】
我が国の子宮頚癌から検出されるHPV遺伝子型は約95%が16,18,
52,58,33,31,35型であり(非特許文献2、非特許文献3)、その遺伝子型の型別診断法を開発することによって、我が国に合ったリスク別の管理が可能になる。
【0008】
HPV遺伝子検査の方法には、HPVのDNAを直接検査するハイブリッドキャプチャー法(HC2)とポリメラーゼ連鎖反応(PCR)でHPVのDNAを増幅した後に検出する幾つかの方法がある。
【0009】
HC2試験(市販、Digene Corporation社)は、DNA/RNAハイブリダイゼーションアッセイで、DNAの増幅を伴わない。ターゲットDNAと13種類の高リスク型HPVのRNAプローブとをハイブリダイゼーションし、そのハイブリッド量を化学発光により検出する方法である。
【0010】
HC2は簡便な方法であり、米国FDAにより認可された唯一の方法である。使用目的は高リスク・低リスクHPVの存在を判定するものであり、各遺伝子型を同定することは出来ない。
【0011】
PCRを利用する方法には、高リスク型HPVの13種類を一括検出する方法と各遺伝子型を型別同定する方法がある。
【0012】
Amplicor HPV試験(市販、Roche Molecular Systems社)は、PCRで標的DNAを増幅し、13種類の型特異的プローブとハイブリダイズし、比色酵素免疫測定法で検出する方法である。Amplicor HPV試験はHC2試験に比し、感度が高いがHC2と同様13種類のHPVの検出を一括して行い、各遺伝子型を同定することは出来ない。また、ビオチン化プライマ−やBSA 結合DNA プローブが必要であり、高価である。
【0013】
PCRを利用する方法で、遺伝子型を同定する方法には、(a) PCRで増幅後アンプリコンを制限酵素で切断し電気泳動で同定する方法(市販、タカラバイオ(株))、(b) 型特異的プローブを固定したDNAアレイを用いて、ラベルしたアンプリコンとハイブリダイズさせシグナルを検出する方法(特許文献1)、及びマイクロタイタープレートでのハイブリダイゼーション法(特許文献2)、 (c) 型特異的プライマー及び検出プローブを用いたリアルタイムマルチプレックスPCRによるHPV検出法(特許文献3)、(d) HPV遺伝子型毎にアンプリコンの長さが異なるように設計された型特異的プライマーを用いてマルチプレックスPCRを行い、電気泳動で遺伝子型を同定する法(特許文献4)がある。
【0014】
前項の(a)の制限酵素法は検出感度がそれほど高くなく、複数の制限酵素を用い、電気泳動を行うので、作業は煩雑である。感染した遺伝子型を完全に同定することは出来ない。
【0015】
(b)のハイブリダイゼーション法は検出感度や同定の特異性が高いが、工程に時間が掛かり、しかも、チップの作成のコストやプライマー又はプローブを標識しなければならないので高価である。
【0016】
(c)のリアルタイムマルチプレックスPCR法は、シングルチューブアッセイで少なくとも13種の高リスクHPVを検出出来るが、HPV遺伝子型の同定に各々の型特異的ビーコンプローブが必要であり、高価である。
【0017】
(d)のマルチプレックスPCR法は、型特異的プライマーの設計さえよければ、極めて簡便で、安価な方法である。特許文献4の方法は、17種類のHPVを同時に特異的に検出すると報告されている。この方法は電気泳動でアンプリコンのサイズによって遺伝子型の同定を行うため、型毎のサイズの違いが十分なければならない。臨床検体中のHPVの遺伝子型を同定するに際して、17種類のHPV及び内部標準、外部標準のアンプリコンをサイズの違いのみで判別することは、各アンプリコンの長さがお互いに近接しているものがあり、判断に苦しむものが含まれる。例えば、33型と58型の区別、39型と56型の区別、18型と45型の区別、51型と45型の区別、18型と59型の区別、39型と31型の複合感染と16型感染の区別が困難になり、正確な型別判定が出来ない危険がある。
【0018】
Seegene Inc.(韓国)から販売されているHPV4A ACE Screeningは16型、18型、HRC (その他の高リスク型16種類)、LRC (低リスク型2種類)をDPOマルチプレックスPCR法で検出する方法である。簡便で安価な方法であるが、
16型、18型以外の遺伝子型の型別検査が出来ない。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】特表2008−524983
【0020】
【特許文献2】特開2005−519611
【0021】
【特許文献3】特表2009−533030
【0022】
【特許文献4】特開2006−345800
【非特許文献】
【0023】
【非特許文献1】Bosch FX. et al, J Natl Cancer Inst 87, 796-802, 1995
【0024】
【非特許文献2】Miura S. et al, Int.J.Cancer 119, 2713-2715, 2006
【0025】
【非特許文献3】Onuki M, et al, Cancer Sci 100, 1312-1316, 2009
【0026】
【非特許文献4】Wang X. et al, BMC Cancer 10:19, 2010
【発明の概要】
【発明が解決しようとする課題】
【0027】
本発明は、我が国の子宮頸癌の主たる原因である7種類のHPV遺伝子型(16,18,31,33,35,52,58型)の型別検査を行い、その他の頻度の低い6種類のHPVは、A群とB群に分け、45,51,68型をA群とし、39型、56型、59型をB群として、一括して感染の有無を判定する。本発明は頻度の高い7種類の型別判定と頻度の低いA群及びB群を1チューブでマルチプレックスPCR法を行うことにより、高感度で且つ特異的に検出し、しかも、簡便で安価な方法を提供することを目的とする。課題は、第一に目的を解決するためのPCRプライマーセットの提供であり、第二にこれらのプライマーセットを混合して、1チューブでPCRを行うマルチプレックスPCRを行い、生成されたアンプリコンを電気泳動で分離同定する工程を提供することである。
【課題を解決するための手段】
【0028】
本発明は、子宮頸癌の主たる原因である13種類のPCRプライマーセットを提供する。型別検査を行うための7種類のプラマーセット及びA群、B群のプライマーセットは、アンプリコン(増幅されたPCR産物)の長さがお互いに十分違うように設計される。これらのすべてのプライマーを混合してマルチプレックスPCRを行い、アンプリコンを電気泳動で検出する。各プライマーの塩基配列は下記の表1に示される。配列番号13及び14は非特許文献4で公表されたものである。
【0029】
【表1】

【0030】
本発明のプライマーセットは配列番号1及び配列番号2で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット1、配列番号3及び配列番号4で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット2、配列番号5及び配列番号6で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット3、配列番号7及び配列番号8で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット4、配列番号9及び配列番号10で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット5、配列番号11及び配列番号12で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット6, 配列番号15及び配列番号16で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット8、配列番号17及び配列番号18で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット9、配列番号19及び配列番号20で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット10、配列番号21及び配列番号22で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット11、配列番号23及び配列番号24で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット12、配列番号25及び配列番号
26で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット13からなる。
【0031】
各プライマーの設計は、複数のプライマーセットを混合して用いることから、お互いにプライマーダイマーを生じ難いように、又相同性の高いHPVの複数の遺伝型を特異的に同定でき、しかも、非特異的増幅が起きないように設計する必要がある。
【0032】
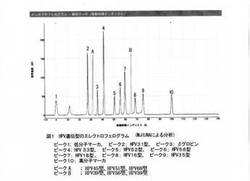
マルチプレックスPCR法による遺伝子検査では、アンプリコン(PCR産物)のサイズによって遺伝子型を同定するため、各プライマーセットによって出来るアンプリコンのサイズを変えて設計しなければならない。本発明によるアンプリコンのサイズは、プライマーセット1で536bp、プライマーセット2で427bp、プライマーセット3で132bp、プライマーセット4で249bp、プライマーセット5で633bp、プライマーセット6で332bpである。また、プライマーセット7は385bpである。プライマーセット8,9,10は166〜181bpであり(A群)、プライマーセット11,12,13は481〜490bpである(B群)。
(参照 図1)
【0033】
本発明に従えば、13種類のプライマーセットを混合して用いて、7種類のHPV遺伝子型を特異的に検出し、6種類のHPV型を一括検出することが出来る。
【発明の効果】
【0034】
高リスクHPVには遺伝子型によって癌病変への進行が早いものと遅いものが含まれる。従って、癌への成り易さを知るにはHPV型別検査が必要である。
本発明では、臨床検体(組織試料、生検、スメア等)を用いて、我が国の子宮頚癌に関連する7種類のHPVを特異的且つ高感度で、しかも迅速かつ簡便に検出することが出来る。加えて、我が国の子宮頚癌の約5%に検出されるに過ぎない“その他の高リスク群”(39,45,51,56,59,68)に対しても、一括して検出するプライマーセットを加えることにより、陽性か否かの判定が出来る。即ち、1本のチューブで7種の型別同定と6種類の“その他高リスク型群”の検出が可能である。これを子宮頚癌の健診に使用すれば、一人ひとりに見合った検診スケジュールをたてることが出来る。これによって、被験者への過度の精神的苦痛を減らし、経済的負担を軽減することが出来るなど適切な子宮頚癌の発症予防に資することが出来る。
【図面の簡単な説明】
【0035】
【図1】混合プライマーセット、混合テンプレート、QIAGEN Multiplex PCR Kitを使用した時のアンプリコンのエレクトロフェログラム(MultiNAにより分析)。
【図2】臨床検体のアンプリコンのエレクトロフェログラム。HPV16型の感染を示す。
【図3】臨床検体のアンプリコンのエレクトロフェログラム。HPV18型の感染を示す。
【図4】臨床検体のアンプリコンのエレクトロフェログラム。HPV31型の感染を示す。
【図5】臨床検体のアンプリコンのエレクトロフェログラム。HPV33型とHPV58型の複合感染を示す。
【図6】臨床検体のアンプリコンのエレクトロフェログラム。HPV35型の感染を示す。
【図7】臨床検体のアンプリコンのエレクトロフェログラム。HPV52型の感染を示す。
【図8】臨床検体のアンプリコンのエレクトロフェログラム。HPV A群の感染を示す。
【図9】臨床検体のアンプリコンのエレクトロフェログラム。HPV16型とHPV B群の複合感染を示す。
【図10】臨床検体のアンプリコンのエレクトロフェログラム。HPV31型、HPV58型及びHPV16型の複合感染を示す。
【発明を実施するための形態】
【0036】
本発明のプライマーセットのオリゴヌクレオチドは汎用のDNA合成装置を用いて化学的に合成することができる。
【0037】
検体におけるHPV遺伝子の存在を検出するためには、検体からDNAを抽出し、これをテンプレートとして、本発明のプライマーセットを用いてマルチプレックスPCRを行い、HPV遺伝子を増幅させる。増幅したHPV遺伝子断片を電気泳動で分離し、同定する。検体としては被験者から得られた組織試料、生検、スメア等を用いることができる。
【0038】
検体からのDNA抽出は市販の抽出試薬を用いてもよい。
【0039】
臨床検体から調整したDNA量は検体毎のバラツキがあるため内部標準としてβグロビンのゲノム領域を用いる(PCR産物のサイズ 196bp)。
【0040】
検体から調整したDNAをテンプレートとし、HPV16型、18型、31型、33型、35型、52型、58型、45型、51型、68型、39型、56型、59型の13種類のプライマーセットとβグロビンのプライマーセットをミックスし(“混合プライマーセット”と云う)、これをプライマーとしてマルチプレックスPCRを行う。各々のプライマー濃度はHPV型によって適宜に調節することができる。
【0041】
マルチプレックスPCRはQIAGEN Multiplex PCR Kit(Qiagen社)を用いて行うことができる。PCRの反応条件は95℃で15分間、次に95℃で30秒間、60℃で1.5分間、72℃で1分間を30サイクル、最後に72℃で2分間である。
【0042】
アンプリコンを電気泳動で分離し、バンドの長さを判定することによ
り、試料中に存在するHPV型を知ることができる。
【0043】
電気泳動に、マイクロチップ電気泳動(MCE-202MultiNA、島津製作所製)を使用することが出来る。
【実施例】
【0044】
プライマーの設計に必要なHPVの遺伝子配列はGenBankから入手した。
各HPV遺伝子の配列に基づいて、以下の基準を満たすプライマーを設計した。融解温度が60〜63℃の範囲にある、PCR産物のサイズが132〜589 bpの範囲内にある、他の種類のHPVと有意なホモロジーを有しない、
self - complementarityがない、プライマー同士がハイブリダイズしない。
【0045】
HPV16型、18型、31型、33型、35型、39型、45型、51型、52型、56型、58型、59型、68型、βグロビンのゲノムを含むサンプル(“混合テンプレート”と云う)をテンプレートとして、混合プライマーセットを用いてマルチプレックスPCRを行うと、HPV16型、18型、31型、33型、35型、52型、58型のピークとA群、B群のピーク、βグロビンのピークの10種のピークが同定可能である(図1)。アンプリコンはシークエンス解析で目的の型のHPV遺伝子の配列であることを確認した。
【0046】
市販のHPV4A ACE Screening法(Seegen Inc. 韓国)は、HPV testのゴールド スタンダードと云われているHC2試験(Digene Corporation)と同等の精度および感度を持っていると報告されている(Hong J.H.,et al, J Korean Med Sci 2009,24:579-84)。表2は臨床検体を用いて、本発明のマルチプレックスPCR法とHPV4A ACE Screening法での結果を比較したものである。本発明の方法は、各型ともHPV4A ACE Screeningと同等の感度を示している。
【0047】
【表2】

【技術分野】
【0001】
本発明は我が国の子宮頸癌の主たる原因であるHPV遺伝子型(16,18,
31,33,35,52,58型)を同定するための特異的プライマーセット及び我が国では頻度は少ないが高リスクHPVに分類されているHPV(39,45,51,56,59,68型)の感染の有無を判定するプライマーセットを提示する。これを用いたマルチプレックスPCR法によるHPV遺伝子型の同定法は、高感度で且つ特異的であり、簡便で安価な方法である。
【背景技術】
【0002】
HPVは、8000bp弱の環状2本鎖ゲノムDNAを持ち、今日まで100以上のHPV遺伝子型が同定されている。
【0003】
子宮頚癌は、女性では2番目に多い悪性腫瘍であるが、HPVはこの子宮頚癌の原因ウイルスであることが知られている。
【0004】
HPV遺伝子型を検出することは、前癌病変や子宮頚癌の予後に必要不可欠である。HPV遺伝子型は、その感染によって導かれた子宮頸部の高度異形成や癌への成り易さから、高リスク型、中間型および低リスク型に分けられている。
【0005】
これまで世界的には、13種類が高リスク型に分類されている(非特許文献1)。即ち、HPV16,18、31,33,35,39,45,51,52,
56,58,59,68型である。
【0006】
13種類の高リスク型HPVの感染は必ずしも癌への進展リスクが同一ではないので、すべての高リスクHPV型を同一視することは行き過ぎた管理になる可能性がある。
【0007】
我が国の子宮頚癌から検出されるHPV遺伝子型は約95%が16,18,
52,58,33,31,35型であり(非特許文献2、非特許文献3)、その遺伝子型の型別診断法を開発することによって、我が国に合ったリスク別の管理が可能になる。
【0008】
HPV遺伝子検査の方法には、HPVのDNAを直接検査するハイブリッドキャプチャー法(HC2)とポリメラーゼ連鎖反応(PCR)でHPVのDNAを増幅した後に検出する幾つかの方法がある。
【0009】
HC2試験(市販、Digene Corporation社)は、DNA/RNAハイブリダイゼーションアッセイで、DNAの増幅を伴わない。ターゲットDNAと13種類の高リスク型HPVのRNAプローブとをハイブリダイゼーションし、そのハイブリッド量を化学発光により検出する方法である。
【0010】
HC2は簡便な方法であり、米国FDAにより認可された唯一の方法である。使用目的は高リスク・低リスクHPVの存在を判定するものであり、各遺伝子型を同定することは出来ない。
【0011】
PCRを利用する方法には、高リスク型HPVの13種類を一括検出する方法と各遺伝子型を型別同定する方法がある。
【0012】
Amplicor HPV試験(市販、Roche Molecular Systems社)は、PCRで標的DNAを増幅し、13種類の型特異的プローブとハイブリダイズし、比色酵素免疫測定法で検出する方法である。Amplicor HPV試験はHC2試験に比し、感度が高いがHC2と同様13種類のHPVの検出を一括して行い、各遺伝子型を同定することは出来ない。また、ビオチン化プライマ−やBSA 結合DNA プローブが必要であり、高価である。
【0013】
PCRを利用する方法で、遺伝子型を同定する方法には、(a) PCRで増幅後アンプリコンを制限酵素で切断し電気泳動で同定する方法(市販、タカラバイオ(株))、(b) 型特異的プローブを固定したDNAアレイを用いて、ラベルしたアンプリコンとハイブリダイズさせシグナルを検出する方法(特許文献1)、及びマイクロタイタープレートでのハイブリダイゼーション法(特許文献2)、 (c) 型特異的プライマー及び検出プローブを用いたリアルタイムマルチプレックスPCRによるHPV検出法(特許文献3)、(d) HPV遺伝子型毎にアンプリコンの長さが異なるように設計された型特異的プライマーを用いてマルチプレックスPCRを行い、電気泳動で遺伝子型を同定する法(特許文献4)がある。
【0014】
前項の(a)の制限酵素法は検出感度がそれほど高くなく、複数の制限酵素を用い、電気泳動を行うので、作業は煩雑である。感染した遺伝子型を完全に同定することは出来ない。
【0015】
(b)のハイブリダイゼーション法は検出感度や同定の特異性が高いが、工程に時間が掛かり、しかも、チップの作成のコストやプライマー又はプローブを標識しなければならないので高価である。
【0016】
(c)のリアルタイムマルチプレックスPCR法は、シングルチューブアッセイで少なくとも13種の高リスクHPVを検出出来るが、HPV遺伝子型の同定に各々の型特異的ビーコンプローブが必要であり、高価である。
【0017】
(d)のマルチプレックスPCR法は、型特異的プライマーの設計さえよければ、極めて簡便で、安価な方法である。特許文献4の方法は、17種類のHPVを同時に特異的に検出すると報告されている。この方法は電気泳動でアンプリコンのサイズによって遺伝子型の同定を行うため、型毎のサイズの違いが十分なければならない。臨床検体中のHPVの遺伝子型を同定するに際して、17種類のHPV及び内部標準、外部標準のアンプリコンをサイズの違いのみで判別することは、各アンプリコンの長さがお互いに近接しているものがあり、判断に苦しむものが含まれる。例えば、33型と58型の区別、39型と56型の区別、18型と45型の区別、51型と45型の区別、18型と59型の区別、39型と31型の複合感染と16型感染の区別が困難になり、正確な型別判定が出来ない危険がある。
【0018】
Seegene Inc.(韓国)から販売されているHPV4A ACE Screeningは16型、18型、HRC (その他の高リスク型16種類)、LRC (低リスク型2種類)をDPOマルチプレックスPCR法で検出する方法である。簡便で安価な方法であるが、
16型、18型以外の遺伝子型の型別検査が出来ない。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】特表2008−524983
【0020】
【特許文献2】特開2005−519611
【0021】
【特許文献3】特表2009−533030
【0022】
【特許文献4】特開2006−345800
【非特許文献】
【0023】
【非特許文献1】Bosch FX. et al, J Natl Cancer Inst 87, 796-802, 1995
【0024】
【非特許文献2】Miura S. et al, Int.J.Cancer 119, 2713-2715, 2006
【0025】
【非特許文献3】Onuki M, et al, Cancer Sci 100, 1312-1316, 2009
【0026】
【非特許文献4】Wang X. et al, BMC Cancer 10:19, 2010
【発明の概要】
【発明が解決しようとする課題】
【0027】
本発明は、我が国の子宮頸癌の主たる原因である7種類のHPV遺伝子型(16,18,31,33,35,52,58型)の型別検査を行い、その他の頻度の低い6種類のHPVは、A群とB群に分け、45,51,68型をA群とし、39型、56型、59型をB群として、一括して感染の有無を判定する。本発明は頻度の高い7種類の型別判定と頻度の低いA群及びB群を1チューブでマルチプレックスPCR法を行うことにより、高感度で且つ特異的に検出し、しかも、簡便で安価な方法を提供することを目的とする。課題は、第一に目的を解決するためのPCRプライマーセットの提供であり、第二にこれらのプライマーセットを混合して、1チューブでPCRを行うマルチプレックスPCRを行い、生成されたアンプリコンを電気泳動で分離同定する工程を提供することである。
【課題を解決するための手段】
【0028】
本発明は、子宮頸癌の主たる原因である13種類のPCRプライマーセットを提供する。型別検査を行うための7種類のプラマーセット及びA群、B群のプライマーセットは、アンプリコン(増幅されたPCR産物)の長さがお互いに十分違うように設計される。これらのすべてのプライマーを混合してマルチプレックスPCRを行い、アンプリコンを電気泳動で検出する。各プライマーの塩基配列は下記の表1に示される。配列番号13及び14は非特許文献4で公表されたものである。
【0029】
【表1】

【0030】
本発明のプライマーセットは配列番号1及び配列番号2で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット1、配列番号3及び配列番号4で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット2、配列番号5及び配列番号6で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット3、配列番号7及び配列番号8で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット4、配列番号9及び配列番号10で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット5、配列番号11及び配列番号12で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット6, 配列番号15及び配列番号16で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット8、配列番号17及び配列番号18で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット9、配列番号19及び配列番号20で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット10、配列番号21及び配列番号22で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット11、配列番号23及び配列番号24で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット12、配列番号25及び配列番号
26で表される塩基配列を有するオリゴヌクレオチドを含むプライマーセット13からなる。
【0031】
各プライマーの設計は、複数のプライマーセットを混合して用いることから、お互いにプライマーダイマーを生じ難いように、又相同性の高いHPVの複数の遺伝型を特異的に同定でき、しかも、非特異的増幅が起きないように設計する必要がある。
【0032】
マルチプレックスPCR法による遺伝子検査では、アンプリコン(PCR産物)のサイズによって遺伝子型を同定するため、各プライマーセットによって出来るアンプリコンのサイズを変えて設計しなければならない。本発明によるアンプリコンのサイズは、プライマーセット1で536bp、プライマーセット2で427bp、プライマーセット3で132bp、プライマーセット4で249bp、プライマーセット5で633bp、プライマーセット6で332bpである。また、プライマーセット7は385bpである。プライマーセット8,9,10は166〜181bpであり(A群)、プライマーセット11,12,13は481〜490bpである(B群)。
(参照 図1)
【0033】
本発明に従えば、13種類のプライマーセットを混合して用いて、7種類のHPV遺伝子型を特異的に検出し、6種類のHPV型を一括検出することが出来る。
【発明の効果】
【0034】
高リスクHPVには遺伝子型によって癌病変への進行が早いものと遅いものが含まれる。従って、癌への成り易さを知るにはHPV型別検査が必要である。
本発明では、臨床検体(組織試料、生検、スメア等)を用いて、我が国の子宮頚癌に関連する7種類のHPVを特異的且つ高感度で、しかも迅速かつ簡便に検出することが出来る。加えて、我が国の子宮頚癌の約5%に検出されるに過ぎない“その他の高リスク群”(39,45,51,56,59,68)に対しても、一括して検出するプライマーセットを加えることにより、陽性か否かの判定が出来る。即ち、1本のチューブで7種の型別同定と6種類の“その他高リスク型群”の検出が可能である。これを子宮頚癌の健診に使用すれば、一人ひとりに見合った検診スケジュールをたてることが出来る。これによって、被験者への過度の精神的苦痛を減らし、経済的負担を軽減することが出来るなど適切な子宮頚癌の発症予防に資することが出来る。
【図面の簡単な説明】
【0035】
【図1】混合プライマーセット、混合テンプレート、QIAGEN Multiplex PCR Kitを使用した時のアンプリコンのエレクトロフェログラム(MultiNAにより分析)。
【図2】臨床検体のアンプリコンのエレクトロフェログラム。HPV16型の感染を示す。
【図3】臨床検体のアンプリコンのエレクトロフェログラム。HPV18型の感染を示す。
【図4】臨床検体のアンプリコンのエレクトロフェログラム。HPV31型の感染を示す。
【図5】臨床検体のアンプリコンのエレクトロフェログラム。HPV33型とHPV58型の複合感染を示す。
【図6】臨床検体のアンプリコンのエレクトロフェログラム。HPV35型の感染を示す。
【図7】臨床検体のアンプリコンのエレクトロフェログラム。HPV52型の感染を示す。
【図8】臨床検体のアンプリコンのエレクトロフェログラム。HPV A群の感染を示す。
【図9】臨床検体のアンプリコンのエレクトロフェログラム。HPV16型とHPV B群の複合感染を示す。
【図10】臨床検体のアンプリコンのエレクトロフェログラム。HPV31型、HPV58型及びHPV16型の複合感染を示す。
【発明を実施するための形態】
【0036】
本発明のプライマーセットのオリゴヌクレオチドは汎用のDNA合成装置を用いて化学的に合成することができる。
【0037】
検体におけるHPV遺伝子の存在を検出するためには、検体からDNAを抽出し、これをテンプレートとして、本発明のプライマーセットを用いてマルチプレックスPCRを行い、HPV遺伝子を増幅させる。増幅したHPV遺伝子断片を電気泳動で分離し、同定する。検体としては被験者から得られた組織試料、生検、スメア等を用いることができる。
【0038】
検体からのDNA抽出は市販の抽出試薬を用いてもよい。
【0039】
臨床検体から調整したDNA量は検体毎のバラツキがあるため内部標準としてβグロビンのゲノム領域を用いる(PCR産物のサイズ 196bp)。
【0040】
検体から調整したDNAをテンプレートとし、HPV16型、18型、31型、33型、35型、52型、58型、45型、51型、68型、39型、56型、59型の13種類のプライマーセットとβグロビンのプライマーセットをミックスし(“混合プライマーセット”と云う)、これをプライマーとしてマルチプレックスPCRを行う。各々のプライマー濃度はHPV型によって適宜に調節することができる。
【0041】
マルチプレックスPCRはQIAGEN Multiplex PCR Kit(Qiagen社)を用いて行うことができる。PCRの反応条件は95℃で15分間、次に95℃で30秒間、60℃で1.5分間、72℃で1分間を30サイクル、最後に72℃で2分間である。
【0042】
アンプリコンを電気泳動で分離し、バンドの長さを判定することによ
り、試料中に存在するHPV型を知ることができる。
【0043】
電気泳動に、マイクロチップ電気泳動(MCE-202MultiNA、島津製作所製)を使用することが出来る。
【実施例】
【0044】
プライマーの設計に必要なHPVの遺伝子配列はGenBankから入手した。
各HPV遺伝子の配列に基づいて、以下の基準を満たすプライマーを設計した。融解温度が60〜63℃の範囲にある、PCR産物のサイズが132〜589 bpの範囲内にある、他の種類のHPVと有意なホモロジーを有しない、
self - complementarityがない、プライマー同士がハイブリダイズしない。
【0045】
HPV16型、18型、31型、33型、35型、39型、45型、51型、52型、56型、58型、59型、68型、βグロビンのゲノムを含むサンプル(“混合テンプレート”と云う)をテンプレートとして、混合プライマーセットを用いてマルチプレックスPCRを行うと、HPV16型、18型、31型、33型、35型、52型、58型のピークとA群、B群のピーク、βグロビンのピークの10種のピークが同定可能である(図1)。アンプリコンはシークエンス解析で目的の型のHPV遺伝子の配列であることを確認した。
【0046】
市販のHPV4A ACE Screening法(Seegen Inc. 韓国)は、HPV testのゴールド スタンダードと云われているHC2試験(Digene Corporation)と同等の精度および感度を持っていると報告されている(Hong J.H.,et al, J Korean Med Sci 2009,24:579-84)。表2は臨床検体を用いて、本発明のマルチプレックスPCR法とHPV4A ACE Screening法での結果を比較したものである。本発明の方法は、各型ともHPV4A ACE Screeningと同等の感度を示している。
【0047】
【表2】

【特許請求の範囲】
【請求項1】
(1)配列番号1の塩基配列を有するオリゴヌクレオチド又は配列番号1の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号2の塩基配列を有するオリゴヌクレオチド又は配列番号2の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット1
(2)配列番号3の塩基配列を有するオリゴヌクレオチド又は配列番号3の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号4の塩基配列を有するオリゴヌクレオチド又は配列番号4の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット2
(3)配列番号5の塩基配列を有するオリゴヌクレオチド又は配列番号5の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号6の塩基配列を有するオリゴヌクレオチド又は配列番号6の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット3
(4)配列番号7の塩基配列を有するオリゴヌクレオチド又は配列番号7の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号8の塩基配列を有するオリゴヌクレオチド又は配列番号8の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット4
(5)配列番号9の塩基配列を有するオリゴヌクレオチド又は配列番号9の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号10の塩基配列を有するオリゴヌクレオチド又は配列番号
10の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット5
(6)配列番号11の塩基配列を有するオリゴヌクレオチド又は配列番号11の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号12の塩基配列を有するオリゴヌクレオチド又は配列番号12の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット6
(7)配列番号15の塩基配列を有するオリゴヌクレオチド又は配列番号15の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号16の塩基配列を有するオリゴヌクレオチド又は配列番号16の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット8
(8)配列番号17の塩基配列を有するオリゴヌクレオチド又は配列番号17の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号18の塩基配列を有するオリゴヌクレオチド又は配列番号18の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット9
(9)配列番号19の塩基配列を有するオリゴヌクレオチド又は配列番号19の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号20の塩基配列を有するオリゴヌクレオチド又は配列番号20の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット10
(10)配列番号21の塩基配列を有するオリゴヌクレオチド又は配列番号
21の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号22の塩基配列を有するオリゴヌクレオチド又は配列番号22の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット11
(11)配列番号23の塩基配列を有するオリゴヌクレオチド又は配列番号
23の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号24の塩基配列を有するオリゴヌクレオチド又は配列番号24の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット12
(12)配列番号25の塩基配列を有するオリゴヌクレオチド又は配列番号
25の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号26の塩基配列を有するオリゴヌクレオチド又は配列番号26の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット13
【請求項2】
プライマーセット1、2,3,4,5,6,7、8,9,10,11,12,13を混合し、1チューブでマルチプレックスPCRを行い、電気泳動で分離同定する工程。
【請求項1】
(1)配列番号1の塩基配列を有するオリゴヌクレオチド又は配列番号1の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号2の塩基配列を有するオリゴヌクレオチド又は配列番号2の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット1
(2)配列番号3の塩基配列を有するオリゴヌクレオチド又は配列番号3の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号4の塩基配列を有するオリゴヌクレオチド又は配列番号4の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット2
(3)配列番号5の塩基配列を有するオリゴヌクレオチド又は配列番号5の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号6の塩基配列を有するオリゴヌクレオチド又は配列番号6の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット3
(4)配列番号7の塩基配列を有するオリゴヌクレオチド又は配列番号7の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号8の塩基配列を有するオリゴヌクレオチド又は配列番号8の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット4
(5)配列番号9の塩基配列を有するオリゴヌクレオチド又は配列番号9の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号10の塩基配列を有するオリゴヌクレオチド又は配列番号
10の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット5
(6)配列番号11の塩基配列を有するオリゴヌクレオチド又は配列番号11の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号12の塩基配列を有するオリゴヌクレオチド又は配列番号12の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット6
(7)配列番号15の塩基配列を有するオリゴヌクレオチド又は配列番号15の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号16の塩基配列を有するオリゴヌクレオチド又は配列番号16の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット8
(8)配列番号17の塩基配列を有するオリゴヌクレオチド又は配列番号17の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号18の塩基配列を有するオリゴヌクレオチド又は配列番号18の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット9
(9)配列番号19の塩基配列を有するオリゴヌクレオチド又は配列番号19の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号20の塩基配列を有するオリゴヌクレオチド又は配列番号20の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット10
(10)配列番号21の塩基配列を有するオリゴヌクレオチド又は配列番号
21の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号22の塩基配列を有するオリゴヌクレオチド又は配列番号22の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット11
(11)配列番号23の塩基配列を有するオリゴヌクレオチド又は配列番号
23の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号24の塩基配列を有するオリゴヌクレオチド又は配列番号24の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット12
(12)配列番号25の塩基配列を有するオリゴヌクレオチド又は配列番号
25の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをフォワードプライマーとし、配列番号26の塩基配列を有するオリゴヌクレオチド又は配列番号26の塩基配列と相補的な塩基配列を有するオリゴヌクレオチドをリバースプライマーとするプライマーセット13
【請求項2】
プライマーセット1、2,3,4,5,6,7、8,9,10,11,12,13を混合し、1チューブでマルチプレックスPCRを行い、電気泳動で分離同定する工程。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−75437(P2012−75437A)
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願番号】特願2011−17808(P2011−17808)
【出願日】平成23年1月31日(2011.1.31)
【出願人】(710007412)
【Fターム(参考)】
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願日】平成23年1月31日(2011.1.31)
【出願人】(710007412)

【Fターム(参考)】
[ Back to top ]

