肺癌または子宮頸癌の診断マーカー
【課題】従来とは異なる原理を備える癌の診断手段、新しい癌診断マーカー、または検出精度の優れた癌の診断手段を明らかにする。
【解決手段】ヒト由来の特定の塩基配列、該塩基配列に対して、80%以上の相同性を有する塩基配列、上記塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、該塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列からなる群から選ばれる1種以上の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドを癌の診断に用いる。
【解決手段】ヒト由来の特定の塩基配列、該塩基配列に対して、80%以上の相同性を有する塩基配列、上記塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、該塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列からなる群から選ばれる1種以上の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドを癌の診断に用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、癌診断マーカーまたはその検出物に関する。
【背景技術】
【0002】
癌は、全世界において主要な死亡原因の1つである。WHO(世界保健機構)によると2007年には全世界の死因の約13%(790万人)が、癌が原因で死亡したと報告されている。また、癌による死者は今後も増加していくと予測されている。そのような中、世界中の研究者や専門家によって、癌の早期診断や予後診断または改善のために種々の癌診断マーカーが研究、開発されてきた。例えば、αフェトプロテイン、CEA、CA19-9、PSA、SCCなどが従来使用されている。
【0003】
癌診断マーカーの性質を分類すると、低分子化合物、DNA(Deoxyribonucleic acid)、mRNA(messenger ribonucleic acid)、蛋白質、糖鎖などが挙げられる。例えば、特許文献1には特定の塩基配列を有するmRNAが、肺癌の診断マーカーとして使用できることが記載されている。特許文献2には特定のCAPN10をコードするmRNAが、2型糖尿病の診断マーカーとして使用できることが記載されている。特許文献3にはGPC3蛋白質が、肝臓癌の診断マーカーとして使用できることが記載されている。特許文献4には特定のアミノ酸配列を有する蛋白質が、肝臓癌の診断マーカーとして使用できることが記載されている。
【0004】
癌診断マーカーの検出方法としては、免疫測定法、リアルタイムPCR、RT-PCR、サザンブロット、ノーザンブロットなどが挙げられる。例えば、特許文献1にはRT-PCRによる検査方法が記載されている。特許文献2および特許文献3にはリアルタイムPCRによる検査方法が記載されている。特許文献4には免疫測定法による検査方法が記載されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許4392163号明細書
【特許文献2】特許4214235号明細書
【特許文献3】特許4283227号明細書
【特許文献4】特許4280814号明細書
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
従来の癌診断マーカーは種々あるが、それらを使用しても癌を検出できない場合があった。例えば、癌の発症メカニズムは複雑であるため、癌が発症または進行していても従来の癌マーカーが通常通りに増加しないことがあった。そのため、従来とは異なる原理を備える、癌の診断手段が必要であった。
【0007】
また、従来の癌診断マーカーは癌の可能性を計るための指標のひとつに過ぎず、診断結果が陰性であってもそれだけで癌を完全に否定できるわけではなかった。そのため、医療現場では複数種の癌診断マーカーを組み合わせて癌を評価することがある。従って、より診断精度を高めるために、新しい癌診断マーカーが必要であった。
【0008】
さらに、癌の治療や、癌の進行を止めるには早期発見が重要である。しかし、早期の癌の場合には、被検試料中に存在する癌診断マーカーの量が微量である場合が多く、検出することは容易ではない。そのため、微量の癌診断マーカーを検出可能な、検出精度の優れた癌の診断手段が必要であった。
【0009】
加えて、従来の癌診断マーカーは正常細胞において偽陽性を示す事があった。そのため、正常細胞で検出され難い、癌に特異的な癌診断マーカーが必要であった。
【0010】
本発明は上記事情に鑑みてなされたものであり、新規の癌診断マーカーを提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドが提供される。
【0012】
このポリヌクレオチドは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているmRNAと結合できることが実証されている。そのため、このポリヌクレオチドは、肺癌または子宮頸癌の癌診断に利用することができる。
【0013】
また、本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドを含む癌診断薬が提供される。
【0014】
この癌診断薬は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているmRNAと結合できることが実証されているポリヌクレオチドを含む。そのため、この診断薬を用いて、さらに当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる
【0015】
また、本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドを有する癌診断薬を含む癌診断用キットが提供される。
【0016】
この癌診断用キットは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているmRNAと結合できることが実証されているポリヌクレオチドを有する癌診断薬を含む。そのため、この癌診断用キットを用いれば、癌の診断が可能になる。
【0017】
また、本発明によれば、配列番号1の塩基配列を有するRNA鎖を含む、癌診断マーカーが提供される。
【0018】
この癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この癌診断マーカーおよび当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる。
【0019】
また、本発明によれば、配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーが提供される。
【0020】
この癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この癌診断マーカーおよび当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる。
【0021】
また、本発明によれば、被験者由来の被検試料中において、配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出する工程を含む、被験者の癌を検査する方法が提供される。
【0022】
この癌を検査する方法は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出する工程を含む。そのため、この方法を用いれば癌の診断が可能になる。
【0023】
また、本発明によれば、被験者由来の被検試料中において、配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出する工程を含む、被験者の癌の予後を検査する方法が提供される。
【0024】
この癌の予後を検査する方法は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出する工程を含む。そのため、この方法を用いれば癌の予後の診断が可能になる。
【0025】
また、本発明によれば、被験者由来の被検試料中の配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出する検出部と、上記癌診断マーカーの検出強度に基づいて上記癌診断マーカーの量を定量化する定量部と、上記癌診断マーカーの量が所定の閾値を越えているかどうかを判定する判定部と、上記判定の結果を出力する出力部とを備えた、癌診断用装置が提供される。
【0026】
この癌診断用装置は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出する工程を含む。そのため、この装置を利用すれば癌の診断が可能になる。
【0027】
また、本発明によれば、コンピュータに、被験者由来の被検試料中の配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出するステップと、前記癌診断マーカーの検出強度に基づいて前記癌診断マーカーの量を定量化するステップと、前記癌診断マーカーの量が所定の閾値を越えているかどうかを判定するステップと、前記判定の結果を出力するステップとを実行させるための、癌診断用プログラムが提供される。
【0028】
この癌診断用プログラムは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出するステップを含む。そのため、この癌診断用プログラムを利用すれば癌の診断が可能になる。
【0029】
また、本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と結合する抗体が提供される。
【0030】
この抗体と結合する核酸もしくはその一部、またはそれらの相補鎖は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この抗体は肺癌または子宮頸癌の癌診断に利用することができる。
【0031】
なお、上記ポリヌクレオチド、上記癌診断薬、上記癌診断用キット、上記癌診断マーカー、上記癌を検査する方法、上記癌の予後を検査する方法、上記癌診断用装置、上記癌診断用プログラム、および上記抗体は、上記配列番号1が、配列番号1の塩基配列に対して80%以上の相同性を有する塩基配列、配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列であっても、当業者であれば当然同様の作用効果が得られることが容易に想定できる。
【0032】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質をコードする核酸もしくはその核酸の相補鎖、またはそれらの一部と、ハイブリダイズするポリヌクレオチドが提供される。
【0033】
このポリヌクレオチドは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているマウスNKX1−2オルソログ蛋白質をコードする核酸と結合できることが実証されている。そのため、このポリヌクレオチドは、肺癌または子宮頸癌の癌診断に利用することができる。
【0034】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカーが提供される。
【0035】
この癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この癌診断マーカーおよび当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる。
【0036】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカーに結合するマウスNKX1−2オルソログ蛋白質結合性抗体が提供される。
【0037】
このマウスNKX1−2オルソログ蛋白質結合性抗体が結合できる癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、このマウスNKX1−2オルソログ蛋白質結合性抗体は肺癌または子宮頸癌の癌診断に利用することができる。
【0038】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカーに結合するポリヌクレオチドが提供される。
【0039】
このポリヌクレオチドが結合できる癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、このポリヌクレオチドは肺癌または子宮頸癌の癌診断に利用することができる。
【発明の効果】
【0040】
本発明によれば、新規の癌診断マーカーが提供されるため、従来とは異なる方法で癌診断が可能になる。または、その癌診断マーカーに結合する新規の物質が提供されるため、新規の癌診断薬が得られる。
【図面の簡単な説明】
【0041】
【図1】図1は癌診断用装置1000の全体構成を示した機能ブロック図である。
【図2】図2は癌診断用装置1000の動作について説明するためのフローチャートである。
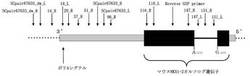
【図3】図3はゲノムDNAにおけるマウスNKX1-2オルソログ遺伝子と、SCpair67633_Lプライマー等との位置関係を示した図である。
【図4】図4はmRNAにおけるマウスNKX1-2オルソログ遺伝子に相当する位置、ポリAシグナル、イントロンに相当する位置、および各種プライマー等との位置関係を示した図である。
【発明を実施するための最良の形態】
【0042】
以下、本発明の実施の形態について、詳細に説明する。なお、同様な内容については、
繰り返しの煩雑を避けるために、適宜説明を省略する。
【0043】
<実施形態1:癌診断マーカー>
本実施形態に係る癌診断マーカーは、配列番号1の塩基配列、または配列番号1の1070番目のGから3379番目のAの塩基配列を含む、RNA鎖を含む癌診断マーカーである。ここで、後述する実施例で上記RNA鎖が肺癌または子宮頸癌で過剰発現していることが強く示唆されている。また、後述する実施例で上記RNA鎖は隣接正常細胞では発現が検出されず、肺癌または子宮頸癌における発現の特異性が高いことが強く示唆されている。そのため、上記癌診断マーカーは肺癌または子宮頸癌の癌診断マーカーとして好適に使用できる。また、上記癌診断マーカーは、同様に配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖を、過剰発現している癌の癌診断マーカーとしても使用できる。なお、配列番号1の1070番目のGとは、後述する実施例において、116_Lプライマーおよび20_Rプライマーを用いたRT-PCRでDNAの増幅が見られた塩基配列の116_Lプライマー側の5’末端の塩基に相当する。また配列番号1の3379番目のAとは、配列番号1の3’末端に位置する塩基である。
【0044】
また、上記癌診断マーカーは、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列に対して、80%以上の相同性を有する塩基配列を含むRNA鎖を有している癌診断マーカーを含む。ここで、上記80%以上は、好ましくは配列番号1に対して85%以上の相同性を有しており、より好ましくは90%以上の相同性を有しており、より好ましくは95%以上の相同性を有しており、さらに好ましくは98%以上である。なぜならば、上記80%以上の相同性を有する塩基配列を含むRNA鎖は、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に対して相同性が高いほど、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に近い性質を有していることになるからである。
【0045】
また、上記癌診断マーカーは、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列において、1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含むRNA鎖を有している癌診断マーカーを含む。ここで、上記1若しくは数個とは、好ましくは30個であり、より好ましくは20個であり、より好ましくは15個であり、より好ましくは10個であり、より好ましくは5個であり、好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、上記1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含むRNA鎖は、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に対して塩基の欠失、置換若しくは付加が少ないほど、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に近い性質を有していることになるからである。
【0046】
また、上記癌診断マーカーは、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列に、相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列を含むRNA鎖を有している癌診断マーカーを含む。
【0047】
本明細書において「過剰発現」とは、コントロール試料(例えば、肺癌および子宮頸癌を発症していない細胞、正常細胞、またはそれらに由来する試料等)の発現量に比べて有意に多くの発現をしている状態を表す。ここで、有意であることは、例えばコントロール試料と被検試料との間の統計学的有意差をスチューデント(Student)のt検定を使用して評価し、p<0.05であるときに統計学的に有意であると見なす事ができる。
【0048】
本明細書において「相同性」とは、2つもしくは複数間のアミノ酸配列の同一のアミノ酸数の割合を、当該技術分野で公知の方法に従って算定したものである。割合を算定する前には、比較するアミノ酸配列群のアミノ酸配列を整列させ、同一の割合を最大にするために必要である場合はアミノ酸配列の一部に間隙を導入する。また、いかなる保存的置換も同一と考えない。また、最適に整列した状態において、オーバーラップするアミノ酸を含めた全アミノ酸残基に対する、同一のアミノ酸数の割合を意味する。整列のための方法、割合の算定方法、およびそれらに関連するコンピュータプログラムは、当該技術分野で従来からよく知られており、一般的な配列分析プログラム(例えば、GENETYX、GeneChip Sequence Analysisなど)を使用して測定することができる。また「相同性」は、2つもしくは複数間のDNA鎖、または2つもしくは複数間のRNA鎖において、同一の塩基の割合を、上記と同様に当該技術分野で公知の方法に従って算定したものである。
【0049】
本明細書において「ストリンジェントな条件」とは、例えば(1)洗浄のための低イオン強度と高温度、例えば、50℃において0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウムを用いる、(2)ハイブリダイゼーション中にホルムアミド等の変性剤、例えば、42℃において50%(vol/vol)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウムバッファー(pH6.5)、および750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いる、または(3)42℃において50%ホルムアミド、5×SSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5×デンハート液、超音波処理サケ精子DNA(50μg/ml)、0.1%SDS、および10%のデキストラン硫酸と、42℃において0.2xSSC(塩化ナトリウム/クエン酸ナトリウム)中での洗浄および55℃のホルムアミド、次いで55℃におけるEDTAを含む0.1×SSCにてストリンジェントな洗浄を含む条件であっても良い。なお、ハイブリダイゼーション反応のストリンジェンシーは、当業者によって容易に決定でき、一般的にプローブ長、洗浄温度、および塩濃度に依存する。一般に、長いプローブは適当なアニーリングのために高温を必要とし、短いプローブは低温を必要とする。また一般に、ストリンジェンシーは塩濃度に逆比例する。
【0050】
本明細書においてポリヌクレオチドに適用される場合の「ハイブリダイズ」とは、ヌクレオチドの塩基間の水素結合等によってヌクレオチド間の対ができる性質のことを表す。塩基対はワトソン・クリック型塩基対、フーグスティーン型塩基対、または任意の他の配列特異的な形で生じうる。塩基対は二本鎖構造を形成する二本鎖、複数本鎖複合体を形成する3本以上の鎖、単一の自己ハイブリダイズ鎖、またはこれらの任意の組み合わせを含む。ハイブリダイゼーション反応は、PCR反応の開始またはリボザイムによるポリヌクレオチドの酵素的切断のような場合にも起こりうる。ハイブリダイゼーションが2つの1本鎖ポリヌクレオチド間において逆平行配置で生じる場合、それらのポリヌクレオチドは「相補的である」または「相補鎖」と言われる。
【0051】
本明細書において「癌」とは、正常な細胞が突然変異を起こして増殖を続けることで起こる疾患である。悪性の癌細胞は全身のあらゆる臓器や組織から生じ、癌細胞が増殖すると、癌組織のかたまりとなって周囲の正常な組織に侵入し破壊する。癌は、肺癌、食道癌、胃癌、肝臓癌、膵臓癌、腎臓癌、副腎癌、胆道癌、乳癌、大腸癌、小腸癌、子宮頸癌、子宮体癌、卵巣癌、膀胱癌、前立腺癌、尿管癌、腎盂癌、尿管癌、陰茎癌、精巣癌、脳腫瘍、中枢神経系の癌、末梢神経系の癌、頭頸部癌(口腔癌、咽頭癌、喉頭癌、鼻腔・副鼻腔癌、唾液腺癌、甲状腺癌等)、皮膚癌、メラノーマ、甲状腺癌、唾液腺癌、血液の癌、悪性リンパ腫、癌腫または肉腫などを含む。
【0052】
また、肺癌とは気管、気管支、肺胞の上皮細胞等に発生する悪性腫瘍を含み、病理学的には、腺癌、扁平上皮癌、大細胞癌、小細胞癌に分類できる。進展形式や治療反応性などが小細胞癌とその他の癌とでは異なるため、腺癌、扁平上皮癌および大細胞癌はまとめて非小細胞癌とも呼ばれる。カルチノイドや円柱種など、小細胞癌および非小細胞癌に含まれない少数の腫瘍もある。従来の肺癌の診断マーカーとしては、腺癌ではCEA、小細胞癌ではProGRP、扁平上皮癌ではSCCまたはシフラ21-1が使用可能である(看護のための最新医学講座(第2版)、中山書店、84-92(2008/8/29))。しかしながら、それらは癌の可能性を計るための指標のひとつに過ぎず、診断結果が陰性であってもそれだけで癌を完全に否定できるわけではない。また、CEA等、偽陽性を示しやすい診断マーカーも存在する。そのため、他の種々の癌診断マーカーと組み合わせて評価することが多い。
【0053】
また、子宮頸癌とは子宮頸部(子宮の下部にあって膣とのつながっている部分)の癌であり、病理学的には、腺癌、扁平上皮癌、その他に分類できる。従来の子宮頸癌の診断マーカーとしては、腺癌では有用なものがないがCA125やCEAが利用されている。また、扁平上皮癌ではSCC尿中hCGβ-CFが使用可能である(看護のための最新医学講座(第2版)、中山書店、106-120(2008/8/29))。但し、これら癌診断マーカー単独による診断結果が陰性であってもそれだけで癌を完全に否定できるわけではない。
【0054】
また、被験者由来の被検試料中において、上記癌診断マーカーを検出する工程を含む被験者の癌を検査する方法を行えば、癌の診断ができる。特に、肺癌または子宮頸癌の診断ができる。また、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖を、過剰発現している癌の診断ができる。
【0055】
なお本明細書において「癌の診断」は、非特定の癌であることの診断、または肺癌や子宮頸癌など特定の癌であることの診断を含む。また、本明細書において「検出」とは、定量的または非定量的な検出を含み、非定量的な検出としては、単に癌で特異的に過剰発現している癌診断マーカーが存在するか否かの測定、癌で特異的に過剰発現している癌診断マーカーが一定の量以上存在するか否かの測定、癌で特異的に過剰発現している癌診断マーカーの量を他の試料(例えば、コントロール試料など)と比較する測定などを挙げることができる。定量的な検出としては、癌で特異的に過剰発現している癌診断マーカーの濃度または量の測定などを挙げることができる。また、検出には上記癌診断マーカーまたは上記癌診断マーカー由来の派生物質に結合可能な物質を使用することができる。
【0056】
また、上記「検出」の工程は特に限定しないが、リアルタイムPCR、RT-PCR、リアルタイムRT-PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、および次世代シークエンサーからなる群から選ばれる1種以上の方法を用いた解析工程を含んでいても良い。この場合、診断分野において汎用されている手順で上記癌診断マーカーを検出することができる。なお、他の方法に比べて検出精度が高いため、リアルタイムPCRで検出することが好ましい。例えば、マイクロアレイは精度が悪いため、一般にはマイクロアレイで検出されただけでは発現していることが完全に実証されたことにはならず、リアルタイムPCRなどの実証実験が必要になる。さらに、マイクロアレイでは発現強度がいくつ以上の数値なら発現していると考えるかについて明確な基準がない。また、仮にマイクロアレイで高い数値が得られたとしても、クロスハイブリの可能性が否定できないため結局はリアルタイムPCRなどの実証実験が必要となる。また、リアルタイムPCRであれば微量の癌診断マーカーも検出可能である。
【0057】
リアルタイムPCRは、PCRによって増幅する核酸をリアルタイムでモニタリングする方法である。例えば、LightCycler480 SYBR Green I Master(Roche)等の市販のキットや、[原理からよくわかるリアルタイムPCR実験ガイド、羊土社、2007/12]に記載の手順によって行うことができる。なお、トータルRNAは任意の細胞からグアニジンチオシアネート法、市販の試薬またはキットを使用して抽出できる。また、トータルRNAはApplied Biosystems社やBioChain社等から購入することもできる。細胞は、三光純薬株式会社やタカラバイオ株式会社等から購入できる。上記モニタリングの方法としては、インターカレーション法、ハイブリダイゼーション法、LUX(Light Upon eXtensyon)法などが挙げられる。インターカレーション法の典型的な方法は、SYBRR Green Iなどの蛍光物質が二本鎖の核酸に入り込み、励起光の照射によって発光を発する特性を利用して核酸量を測定する方法である。蛍光の強さは核酸の量に比例して強くなるため、蛍光強度を測定することによって核酸の増幅量を知る事ができる。また、リアルタイムPCRを使用した定量方法では、大きく分けて絶対定量法と相対定量法の2つの定量方法がありそれらを適宜使用できる。
【0058】
RT-PCR(Reverse Transcription Polymerase Chain Reaction)は、RNA鎖を鋳型に逆転写を行い、生成されたcDNAに対してPCRを行う方法である。分子間相互作用解析とは、例えばBiacoreシステムを利用した方法が挙げられる。シークエンサーとは、DNA配列、RNA配列、またはアミノ酸配列の配列構造を計測できる装置のことであり、次世代シークエンサーを含む。
【0059】
また、本明細書において「被検者」とは、ヒトもしくはその他哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)または鳥類を含む。また、被検試料とは身体や排泄物由来の試料を含み、例えば、細胞、血液、間質液、血漿、血管外液、脳脊髄液、滑液、胸膜液、腹水、血清、リンパ液、体液、唾液、尿、便、痰、膿、病理切片またはそれらから得られる試料(例えば、細胞の培養液や抽出されたtotal RNAなど)を含む。被検試料としては、より診断精度が上がるため、疾患部位から直接的に抽出された組織もしくは細胞、またはそれらから得られる試料を使用することが好ましい。
【0060】
上記検出の態様のひとつとして、上記癌診断マーカーまたは上記癌診断マーカー由来の派生物質に結合可能な物質を標識物質で標識し、リアルタイムPCRやノーザンブロッティング等に使用することができる。この標識は通常知られている方法により行うことが可能である。標識物質としては、蛍光色素、酵素、補酵素、化学発光物質、放射性物質などの当業者に公知の標識物質を用いることが可能であり、具体的な例としては、ラジオアイソトープ(32P、14C、125I、3H、131Iなど)、フルオレセイン、ローダミン、ダンシルクロリド、ウンベリフェロン、ルシフェラーゼ、ペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ、β-グルコシダーゼ、ホースラディッシュパーオキシダーゼ、グルコアミラーゼ、リゾチーム、サッカリドオキシダーゼ、マイクロペルオキシダーゼ、ビオチンなどを挙げることができる。標識物質としてビオチンを用いる場合には、ビオチン標識抗体を添加後に、アルカリホスファターゼなどの酵素を結合させたアビジンをさらに添加することが好ましい。
【0061】
また、本明細書において診断の方法としては、2種以上の診断マーカーを組み合わせて診断しても良い。そのように組み合わせて使用した場合、例えば、上記癌診断マーカーで癌であることが診断された被検試料に対して、さらに公知の診断マーカーで癌の種類を診断することが可能である。それとは逆に、公知の診断マーカーで癌であることが診断された被検試料に対して、さらに上記癌診断マーカーで肺癌または子宮頸癌であるかどうかを診断することも可能である。また、公知の診断マーカーを検査したときの結果と、上記癌診断マーカーを検査したときの結果を総合的に評価して癌を診断することができる。
【0062】
また、上記診断は癌の発症もしくは経過状況を検査するための診断、または癌の予後を検査するための診断であっても良い。通常、癌の発症前において何らかの癌診断を行わない場合、癌の種々の症状(例えば、出血、炎症、腫れ、しこり、患部の違和感等)が現れるまで気付かず、気付いた頃にはすでに手遅れになっているケースがある。従って、癌の発症もしくは経過状況を検査するための診断は、癌を早期発見でき効果的な癌治療を始めるための重要な診断である。また、癌に発症していることがわかった後も、種々の抗癌剤の効果を検証することや、癌の治療効果を検証するために、癌の経過状況を検査する診断が重要になってくる。また癌の予後とは、一般に、何らかの治療を行った後、病状がどのような経過をたどるかの予測や見通しのことである。癌の予後を検査するための診断の結果は、癌の治療計画の策定に有効な指標となる。
【0063】
また、上記癌診断マーカーを検出する工程を含む、癌抑制薬剤のスクリーニング方法を行えば、癌抑制薬剤をスクリーニングすることができる。特に、肺癌または子宮頸癌の癌抑制薬剤をスクリーニングすることができる。また、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖を、過剰発現している癌抑制薬剤をスクリーニングすることができる。このスクリーニングの具体的な操作手順は特に限定しないが、例えば、被験者に癌抑制薬剤の候補物質を投与前後の、上記癌診断マーカーの量の増減を測定することでスクリーニングが可能である。この場合、被験者に癌抑制薬剤の候補物質を投与後に上記癌診断マーカーの量が減少していれば、上記候補物質が癌抑制薬剤としての機能を有している可能性が高いといえる。
【0064】
図1は、癌診断用装置1000の全体構成を示した機能ブロック図である。癌診断用装置1000は、被検試料における上記癌診断マーカーの検出データを解析する癌診断マーカー解析装置100を備える。癌診断用装置1000は、癌診断マーカー解析装置100を操作するための操作部102を備える。癌診断用装置1000は、被験者由来の被検試料中の上記癌診断マーカーを検出する検出部104を備えている。
【0065】
また、癌診断用装置1000は、癌診断マーカー解析装置100から出力されるデータを画像表示する画像表示装置106を備える。癌診断用装置1000は、癌診断マーカー解析装置100から出力されるデータを印刷するプリンタ108を備える。癌診断用装置1000は、癌診断マーカー解析装置100から出力されるデータを受信するPC(パーソナルコンピュータ)110を備える。
【0066】
一方、癌診断マーカー解析装置100は、検出部104から入力される被検試料の癌診断マーカーの検出データを取得する取得部202を備える。癌診断マーカー解析装置100は、癌診断マーカーの検出強度に基づいてその癌診断マーカーの量を定量化する定量部204を備えている。
【0067】
また、癌診断マーカー解析装置100は、比較試料の定量データを格納する検出強度データベース206を備える。癌診断マーカー解析装置100は、被検試料の癌診断マーカーの定量データと、比較試料の定量データとを比較する、比較対照部208を備える。
【0068】
さらに、癌診断マーカー解析装置100は、癌診断マーカーの量が所定の閾値を越えているかどうかを判定する判定部210を備えている。癌診断マーカー解析装置100は、判定の結果を出力する出力部212を備えている。
【0069】
図2は癌診断用装置1000の動作を説明するためのフローチャートである。検出部102は、サーマルサイクラーと分光蛍光光度法を用いて、癌診断マーカーを検出し、検出データを生成する。この検出データは、被験者由来のtotal RNAに対して配列番号1の塩基配列を有する核酸に結合可能なDNAプライマーセットを用い、リアルタイムPCRを行うことで得られる。上記検出データは、リアルタイムPCRで所定の蛍光強度を示したときのサイクル数である。
【0070】
また、定量部204が、上記検出データを、癌診断マーカーの量を定量的に表すことのできる定量データに変換する。定量データとは、例えば癌診断マーカーの濃度である。この濃度は、サイクル数および癌診断マーカーを検出する際の初期条件から計算できる。
【0071】
また、比較対照部208が、被検試料の癌診断マーカーの定量データと、比較試料の定量データとを比較する。ここで比較試料の定量データは、検出強度データベース206から取得した非癌検体由来の癌診断マーカーの定量データを使用できる。この比較結果は、癌診断マーカーの定量データを100%に設定し、対する比較試料の定量データの百分率で表す。
【0072】
また、判定部210は、比較対照部208から上記比較結果を取得し、被検試料の癌診断マーカーの定量データが、所定の閾値を越えている場合、癌陽性と判定する。所定の閾値は、複数の非癌検体由来の癌診断マーカーの定量データの最高値とすることができる。
【0073】
また、出力部212は、判定部210から癌陽性または癌陰性の判定結果を装置の外部の画像表示装置106等に出力し、一連のフローが終了する。
【0074】
そして、この癌診断用装置1000は、肺癌、子宮頸癌、または上記癌診断マーカーが過剰発現している癌の診断に好適に使用できる。
【0075】
また、変形例として、検出部102は、RT-PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、または次世代シークエンサーを用いた方法で癌診断マーカーを検出し、検出データを生成しても良い。その場合、検出データはサイクル数ではなく、癌診断マーカーの濃度に比例した種々の数値で表される。加えて、定量部で検出データから変換される定量データも同様に癌診断マーカーの濃度に比例した種々の数値で表される。
【0076】
別の変形例として、定量部204で検出データから変換される定量データは、濃度のように単位を有するものでなくても良く、相対値であっても良い。
【0077】
別の変形例として、検出強度データベース206には過去に測定した別の被検試料の癌診断マーカーの定量データが格納されていても良い。この場合、比較対照部208が比較に使用するための比較試料の定量データは、過去に測定した別の被検試料の癌診断マーカーの定量データを使用することができる。そして、過去に癌陽性であると判定されたもので、さらに臨床医による精密検査でも癌陽性であると判定されたものについて、その定量データを格納しておけば、ポジティブコントロールとして利用できる。
【0078】
別の変形例として、比較対照部208で得られる比較結果は、癌診断マーカーの定量データと比較試料の定量データとの関係を表すものであれば、相対値で表すこともできる。
【0079】
別の変形例として、出力部212は、上記検出データ、被検試料の癌診断マーカーの定量データ、比較試料の定量データ、もしくはそれらの比較結果を表した表、またはサイクル数と蛍光強度の関係を示すプロット図を、画像表示装置106等に出力しても良い。
【0080】
別の変形例として、検出精度を上げるために、あらかじめ癌診断マーカーが存在しないことがわかっている試料を用いて、ネガティブコントロール実験を平行して行っていても良い。この場合、仮に被検試料の癌診断マーカーが所定の濃度を示したとしても、ネガティブコントロールが被検試料の癌診断マーカーに類似の濃度、または所定の濃度を示した場合、それらはノイズとする。
【0081】
また、検出部の動作を除いた以上の動作を実行可能なプログラムがインストールされたコンピュータは、被検試料を検出可能なリアルタイムPCRを実行できる装置と接続することで、肺癌、子宮頸癌、または上記癌診断マーカーが過剰発現している癌の診断に用いることができる。なお、上記コンピュータに接続する装置は、被検試料を検出可能であれば、RT-PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、または次世代シークエンサーを備えた装置であっても良い。
【0082】
<実施形態2:癌診断マーカーの検出物質>
本発明の他の実施形態は、配列番号1の塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質である。この核酸検出物質は、核酸に結合できる性質のものであればその種類は特に限定せず、ポリヌクレオチド、蛋白質、抗体、または低分子化合物などを含むが、特にポリヌクレオチドであることが好ましい。なぜならば、ポリヌクレオチドは核酸との結合特異性に優れ、安価または容易に製造でき、またリアルタイムPCRのような検出精度の高い診断手法に好適に使用できるためである。またポリヌクレオチドの中でも、DNA鎖であることが好ましい。なぜならば、安定性に優れ、より安価に製造できるためである。
【0083】
なお、本明細書において「核酸」とは、DNA塩基、RNA塩基またはそれらの等価物から構成されているものを含む。この等価物とは、例えばDNA塩基またはRNA塩基がメチル化等の化学修飾を受けているもの、または核酸アナログを含む。また、「DNA鎖」または「RNA鎖」とは、DNA塩基またはRNA塩基が2個以上連結した形態のことを表す。「塩基配列」とは核酸を構成する塩基の配列である。また、一般的に塩基配列は、A(アデニン)、G(グアニン)、C(シトシン)、T(チミン)によって表すことができる。例えば、代表的なデータベースであるNCBI Reference Sequenceにおいて、DNA鎖およびRNA鎖の塩基配列を表すときにA、G、C、Tが用いられている。なお、本明細書においてRNA鎖の塩基配列を表現する場合には、上記TをU(ウラシル)に読み換えるものとする。また、ヌクレオチドとは、一般的にA、G、C、T、またはUを含む。
【0084】
ここで、後述する実施例で配列番号1の塩基配列を含むmRNAが、肺癌または子宮頸癌で過剰発現していることが強く示唆されている。また、後述する実施例で配列番号1の塩基配列を含むmRNAは隣接正常細胞では発現が検出されず、肺癌または子宮頸癌における発現の特異性が高いことが強く示唆されている。そして、上記核酸検出物質はこのmRNAに結合できるため、肺癌または子宮頸癌の診断薬として好適に使用できる。また、後述する実施例で、上記mRNAから調整したcDNA(complementary DNA)に対して結合するプライマーを用いて、上記mRNAを検出または定量できることが強く示唆されている。従って、上記核酸検出物質はこのcDNAと結合することによっても、肺癌または子宮頸癌の診断薬として好適に使用できる。また、上記核酸検出物質は、同様に上記mRNAを過剰発現している癌の診断薬としても好適に使用できる。
【0085】
また、上記核酸検出物質は、配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質を含む。ここで、上記80%以上は、好ましくは配列番号1に対して85%以上の相同性を有しており、より好ましくは90%以上の相同性を有しており、より好ましくは95%以上の相同性を有しており、さらに好ましくは98%以上である。なぜならば、上記80%以上の相同性を有する塩基配列を含む核酸は、配列番号1の塩基配列を含む核酸に対して相同性が高いほど、配列番号1の塩基配列を含む核酸に近い性質を有していることになるからである。
【0086】
また、上記核酸検出物質は、配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質を含む。ここで、上記1若しくは数個とは、好ましくは30個であり、より好ましくは20個であり、より好ましくは15個であり、より好ましくは10個であり、より好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、上記1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含む核酸は、配列番号1の塩基配列を含む核酸に対して塩基の欠失、置換若しくは付加が少ないほど、配列番号1の塩基配列を含む核酸に近い性質を有していることになるからである。
【0087】
また、上記核酸検出物質は、配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質を含む。
【0088】
また、上記核酸検出物質は、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、または配列番号27の塩基配列を含む核酸であっても良い。これらの核酸は、後述する実施例で配列番号1のmRNAまたはそのcDNAにハイブリダイズし、PCR反応に使用できることが実証されている。そのため、これらの核酸は上記核酸検出物質として使用できる。また、上記ポリヌクレオチドとして好ましくは、配列番号2または配列番号3である。なぜならば、後述する実施例でリアルタイムPCRに使用できることが実証されており、さらには肺癌または子宮頸癌の癌診断に使用できることが実証されているためである。
【0089】
また、上記核酸検出物質は、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、または配列番号27の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含む核酸であっても良い。ここで、この1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、この核酸検出物質の塩基配列が、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、または配列番号27の塩基配列に対してより相同性の高い塩基配列であれば、後述する実施例で配列番号1のmRNAまたはそのcDNAにハイブリダイズできることが実証されているDNAプライマーに、より近い性質を有していることになるからである。
【0090】
また、上記「その核酸の一部」は、配列番号1の塩基配列の26番目のCから3379番目のAの塩基配列、配列番号1の塩基配列の130番目のAから3379番目のAの塩基配列、配列番号1の塩基配列の134番目のTから3379番目のAの塩基配列、配列番号1の塩基配列の136番目のAから3379番目のAの塩基配列、または配列番号1の塩基配列の157番目のTから3379番目のAの塩基配列(以下「配列番号1の塩基配列の26番目から3379番目等の塩基配列」と称することもある)、その配列番号1の塩基配列の26番目から3379番目等の塩基配列に対して80%以上の相同性を有する塩基配列、その配列番号1の塩基配列の26番目から3379番目等の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その配列番号1の塩基配列の26番目から3379番目等の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記配列番号1の塩基配列の26番目から3379番目等の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、この配列番号1の塩基配列の26番目から3379番目等の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記配列番号1の塩基配列の26番目から3379番目等の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0091】
また「その核酸の一部」は、配列番号1の1070番目のGから3379番目のAの塩基配列(以下「1070番目から3379番目の塩基配列」と称することもある)、その1070番目から3379番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から3379番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から3379番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から3379番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から3379番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から3379番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0092】
また「その核酸の一部」は、配列番号1の1070番目のGから3325番目のTの塩基配列(以下「1070番目から3325番目の塩基配列」と称することもある)、その1070番目から3325番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から3325番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から3325番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から3325番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から3325番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から3325番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0093】
また「その核酸の一部」は、配列番号1の1070番目のGから2997番目のCの塩基配列(以下「1070番目から2997番目の塩基配列」と称することもある)、その1070番目から2997番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から2997番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から2997番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から2997番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から2997番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から2997番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0094】
また「その核酸の一部」は、配列番号1の1070番目のCから2685番目のTの塩基配列(以下「1070番目から2685番目の塩基配列」と称することもある)、その1070番目から2685番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から2685番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から2685番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から2685番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から2685番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から2685番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0095】
さらに「その核酸の一部」は、配列番号1の2451番目のCから2541番目のTの塩基配列(以下「2451番目から2541番目の塩基配列」と称することもある)、その2451番目から2541番目の塩基配列に対して80%以上の相同性を有する塩基配列、その2451番目から2541番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その2451番目から2541番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記2451番目から2541番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、2451番目から2541番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記2451番目から2541番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0096】
加えて「その核酸の一部」の長さは特に限定しないが、PCRプライマーやプローブがハイブリダイズできる長さを有していることが好ましい。PCRプライマーやプローブがハイブリダイズできれば、リアルタイムPCRやノーザンブロット等の方法で上記「その核酸の一部」を検出できるためである。PCRプライマーやプローブは、一般的には、短すぎると特異性が失われることが知られており(PCR法最前線、関谷剛男ら、共立出版株式会社、31-39(1997))、遺伝子工学分野の研究では15個以上の塩基を含むPCRプライマーやプローブが使用されることが多い。そのため、上記「その核酸の一部」の長さは、好ましくは連続した15個以上のRNA塩基を含み、より好ましくは連続した20個以上のRNA塩基を含み、より好ましくは連続した25個以上のRNA塩基を含み、さらに好ましくは連続した30個以上のRNA塩基を含む。
【0097】
本明細書において「ポリヌクレオチド」は、複数のDNA塩基からなるDNA鎖、または複数のRNA塩基からなるRNA鎖を含む。また、PCRプライマーやプローブとして使用した場合に使用可能な長さであることが好ましい。PCRプライマーやプローブは、一般的には短すぎると特異性が失われる傾向があり、PCRプライマーやプローブとして適さないことが知られている(PCR法最前線、関谷剛男ら、共立出版株式会社、31-39(1997))。そのため、遺伝子工学分野の研究では15個以上の塩基を含むPCRプライマーやプローブが使用されることが多い。そのため、上記「ポリヌクレオチド」は少なくとも連続した15個以上のヌクレオチドを含むことが好ましい。また、より特異性を向上させるためには連続した18個以上であることが好ましく、連続した20個以上であることがより好ましく、連続した25個以上であることがさらに好ましい。なお、ポリヌクレオチドは、DNA/RNA合成装置を用いて合成可能である。その他、任意の塩基配列を設計後、DNAまたはRNA合成の受託会社(例えば、インビトロジェン株式会社やタカラバイオ株式会社等)から購入することもできる。
【0098】
本明細書において「結合する」とは、物質間の連結を意味する。連結は共有結合または非共有結合のいずれであってもよく、たとえば、イオン結合、水素結合、疎水性相互作用、または親水性相互作用が挙げられる。また、DNA鎖またはRNA鎖の間におけるハイブリダイズを含む。
【0099】
本明細書において「抗体」は、抗原上の特定のエピトープに特異的に結合することができる分子を指し、ポリクローナル抗体、モノクローナル抗体を含む。また、抗体は様々な形態で存在することができ、例えば、Fv、Fab、F(ab’)2、Fab’、diabody、一本鎖抗体(例えば、scFv、dsFv)、CDRを含むペプチド、多価特異的抗体(例えば、二価特異的抗体)、キメラ抗体、ヒト化抗体、またはヒト抗体などが挙げられる。また、既存の化学合成医薬品原体または医薬品製剤に結合した低分子抗体、もしくは糖鎖改変抗体の形態であってもよい。
【0100】
ポリクローナル抗体は、例えば、抗原に特異的なポリクローナル抗体を含む血清の産生を誘導するために、哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)や鳥類等に、目的の抗原を含む免疫原を投与することによって抗体を生成することが可能である。免疫プロトコルは、当該技術分野で公知であり、選択する動物宿主に伴い、免疫応答を誘発する任意の方法によって実施される場合がある[タンパク質実験ハンドブック, 羊土社(2003):86-91.]。
【0101】
また、モノクローナル抗体は、実質的に均一な抗体の集団から得られる抗体を指す。すなわち、集団を構成する個々の抗体が、少量存在しうる自然に生じることが可能な突然変異を除いて、同一であるものを含む。一般的にモノクローナル抗体は高度に特異的であり、異なるエピトープに対応する異なる抗体を典型的に含む通常のポリクローナル抗体とは異なり、各モノクローナル抗体は抗原の単一のエピトープに対応する。また、モノクローナル抗体は、[Kohler G, Milstein C., Nature. 1975 Aug 7;256(5517):495-497.]に掲載されているようなハイブリドーマ法と同様の方法によって作ることができる。あるいは、米国特許第4816567号に記載されているような組換え法と同様の方法によって作ることができる。または、 [Clackson et al., Nature. 1991 Aug 15;352(6336):624-628.]もしくは[Marks et al., J Mol Biol. 1991 Dec 5;222(3):581-597.]に記載されているような技術と同様の方法を用いてファージ抗体ライブラリから単離してもよい。
【0102】
<実施形態3:癌診断マーカー蛋白質およびその検出物質>
本発明の他の実施形態は、マウスNKX1-2オルソログ蛋白質を含む、癌診断マーカーである。マウスNKX1-2オルソログ蛋白質をコードするRNA鎖は、後述する実施例において、肺癌または子宮頸癌で過剰発現することが強く示唆されている。従って、肺癌または子宮頸癌の細胞では、マウスNKX1-2オルソログ蛋白質をコードするRNA鎖が過剰に存在するために、マウスNKX1-2オルソログ蛋白質の翻訳が促進され、通常の細胞よりも多くのマウスNKX1-2オルソログ蛋白質が存在するものと考えられる。また、後述する実施例でマウスNKX1-2オルソログ蛋白質をコードするRNA鎖は、隣接正常細胞では発現が検出されず、肺癌または子宮頸癌における発現の特異性が高いことが強く示唆されている。そのため、マウスNKX1-2オルソログ蛋白質を含む癌診断マーカーは、肺癌または子宮頸癌の癌診断のためのマーカーとして好適に使用できる。また、上記癌診断マーカーは、同様に上記RNA鎖を過剰発現している癌の診断薬としても使用できる。
【0103】
また、上記マウスNKX1-2オルソログ蛋白質は、配列番号28のアミノ酸配列、配列番号28のアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列、配列番号28のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、配列番号28のアミノ酸配列をコードする塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列にコードされるアミノ酸配列、からなる群から選ばれる1種以上のアミノ酸配列を含んでいても良い。この場合、マウスNKX1-2オルソログ蛋白質は、後述する実施例において肺癌または子宮頸癌で特異的に過剰発現することが強く示唆されているmRNAにコードされているアミノ酸配列を含む。そのため、この癌診断マーカーは、肺癌、子宮頸癌または上記mRNAを過剰発現している癌の診断のためのマーカーとして好適に使用できる。なお、上記マウスNKX1-2オルソログ蛋白質は配列番号28のアミノ酸配列に対してより相同性の高いアミノ酸配列であることが好ましい。なぜならば、上記マウスNKX1-2オルソログ蛋白質は、配列番号28のアミノ酸配列を含む蛋白質に対して相同性が高いほど、配列番号28のアミノ酸配列を含む蛋白質に近い性質を有していることになるからである。
【0104】
なお、上記マウスNKX1-2オルソログ蛋白質のアミノ酸配列が、配列番号28のアミノ酸配列に対して1若しくは数個の置換がある場合には、アミノ酸側鎖の性質が保存されている別のアミノ酸に置換していることが好ましい。例えばアミノ酸側鎖の性質としては、疎水性アミノ酸(A、I、L、M、F、P、W、Y、V)、親水性アミノ酸(R、D、N、C、E、Q、G、H、K、S、T)、脂肪族側鎖を有するアミノ酸(G、A、V、L、I、P)、水酸基含有側鎖を有するアミノ酸(S、T、Y)、硫黄原子含有側鎖を有するアミノ酸(C、M)、カルボン酸及びアミド含有側鎖を有するアミノ酸(D、N、E、Q)、塩基含有側鎖を有するアミノ離(R、K、H)、および、芳香族含有側鎖を有するアミノ酸(H、F、Y、W)を挙げることができる(括弧内はいずれもアミノ酸の一文字標記を表す)。これらの各グループ内のアミノ酸同士の置換は保存的置換と総称される。あるアミノ酸配列に対する1または複数個のアミノ酸残基の欠失、付加、または他のアミノ酸による置換により修飾されたアミノ酸配列を有するポリペプチドがその生物学的活性を維持することはすでに知られている(Mark et al., Proc Natl Acad Sci U S A. 1984 Sep;81(18):5662-5666.、Zoller et al., Nucleic Acids Res. 1982 Oct 25;10(20):6487-6500.、Wang et al., Science. 1984 Jun 29;224(4656):1431-1433.)。
【0105】
本発明の他の実施形態は、上記マウスNKX1-2オルソログ蛋白質を含む癌診断マーカーに結合する蛋白質検出物質である。この蛋白質検出物質は、上記のマウスNKX1-2オルソログ蛋白質を検出できるため、肺癌、子宮頸癌または上記マウスNKX1-2オルソログ蛋白質をコードするRNA鎖を過剰発現している癌の診断薬として使用できる。なお、この蛋白質検出物質は、蛋白質に結合できる性質のものであればその種類は特に限定せず、ポリヌクレオチド、蛋白質、抗体、または低分子化合物などを含むが、特に抗体であることが好ましい。なぜならば、抗体は蛋白質との結合特異性に優れ、また免疫測定法のような一般的な蛋白質の検出手法に好適に使用できるためである。
【0106】
本発明の他の実施形態は、マウスNKX1-2オルソログ蛋白質をコードする核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質である。この核酸検出物質は、核酸に結合できる性質のものであればその種類は特に限定せず、ポリヌクレオチド、蛋白質、抗体、または低分子化合物などを含む。ここで、マウスNKX1-2オルソログ蛋白質をコードするRNA鎖は、後述する実施例において、肺癌または子宮頸癌で特異的に過剰発現することが強く示唆されている。そのため、上記核酸検出物質は肺癌または子宮頸癌の診断薬として使用できる。また、上記核酸検出物質は、同様に上記RNA鎖を過剰発現している癌の診断薬としても使用できる。
【0107】
本明細書においてマウスNKX1-2オルソログ蛋白質とは、ホメオドメインを持ち、マウスのNKX1-2蛋白質にアミノ酸配列で50%以上の相同性を有する蛋白質を表す。マウスのNKX1-2蛋白質のアミノ酸配列は、National Center for Biotechnology Information(NCBI)のデータベースであるGenBank等で参照できる。マウスのNKX1-2遺伝子は、例えば[Hong et al., Gene. 1997 Oct 1;198(1-2):373-8.]や[Rovescalli et al., Proc Natl Acad Sci U S A. 2000 Feb 29;97(5):1982-7.]にその様態が記載されている。また、ホメオドメインとは、DNAに結合しうる蛋白質部位をコードする領域のことであり、酵母からヒトに至るまで事実上すべての真核生物で存在することが知られている(細胞の分子生物学(第3版)、教育社、409-410(1995/06))。
【0108】
<実施形態4:癌診断薬>
本発明の他の実施形態は、上記核酸検出物質または蛋白質検出物質を含む癌診断薬である。この癌診断薬は上記核酸検出物質または蛋白質検出物質を有しているため、肺癌または子宮頸癌を診断するために好適に使用できる。また、配列番号1の塩基配列、配列番号1の塩基配列に対して80%以上の相同性を有する塩基配列、配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を含むmRNA、またはその一部が過剰発現している癌の診断薬としても好適に使用できる。
【0109】
本明細書において「診断薬」とは、被検者の疾患もしくは疾患可能性の診断、または被験者由来の被検試料における疾患関連物質の検査に関して使用可能な物質を表す。また、本明細書において癌診断薬の使用方法は特に限定しないが、例えば、被検者由来の被検試料において、上記核酸検出物質または蛋白質検出物質を用いて癌で特異的に過剰発現しているmRNAを検出することで癌の診断ができる。
【0110】
また、上記癌診断薬は上記癌診断薬を含む癌診断用キットとして使用できる。この癌診断用キットは、上記癌診断薬によって診断できる癌を診断するために好適に使用できる。なおこの癌診断用キットは、上記癌診断薬を癌診断に用いる際の使用方法もしくは使用例を記載した指示書、その指示書の所在を記載した文面、または種々のバッファーを含んでいても良い。
【0111】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【実施例】
【0112】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0113】
<実施例1:リアルタイムPCRによるmRNAの検出>
Applied Biosystems社から購入した肺、子宮頸、肝臓、子宮、大腸、前立腺、肝臓、またはリンパの腫瘍組織由来のtotal RNA(以下「被検試料」と称することもある)と、隣接正常組織由来のtotal RNA(以下「正常試料」と称することもある)を購入し、リアルタイムPCRによるmRNAの組織特異的な過剰発現の検出に用いた。
【0114】
(1−1)RNAの逆転写
QuantiTect Rev. Transcription Kit(QUIAGEN)を用いて、被検試料および正常試料に対して逆転写反応を行い、被検試料由来のcDNAと正常試料由来のcDNAを合成した。この逆転写反応にはランダムプライマーを用いて行った。反応時間等はキットのプロトコール通りに行った。
【0115】
(1−2)リアルタイムPCR
LightCycler480 SYBR Green I Master(Roche)を用いて、被検試料由来のcDNAと正常試料由来のcDNAに対してリアルタイムPCRを行った。プライマーはSCpair67633_Lプライマー:CCTTGCCACTTTTGCTTGGA(配列番号2)およびSCpair67633_Rプライマー:ACTGGGGACCTCTGGGTTTCT(配列番号3)を使用した。また、cDNAの確認と定量に使用するために内在性の遺伝子GAPDHに対するリアルタイムPCRも同時に行った。反応時間等はキットのプロトコール通りに行った。
【0116】
リアルタイムPCRの結果を表1に示す。肺の腫瘍組織において、リアルタイムPCRの29サイクル目に増幅されたcDNAが確認された。そのcDNAの量を100%としたとき、子宮頸の腫瘍組織は112%、肝臓の腫瘍組織は0.50%、子宮の腫瘍組織は0.80%であった。その他の腫瘍組織、隣接正常組織では検出されなかった(表1中ではnonと記す)。
【0117】
【表1】

【0118】
(1−3)結果の考察
上記の結果より、肺と子宮頸の腫瘍組織において、過剰発現しているmRNAの存在が明らかになった。従って、この過剰発現しているmRNAは、肺癌と子宮頸癌を検出するための診断マーカーとなると考えられる。
【0119】
またこのmRNAは、隣接正常組織において検出されていない。このことは、隣接正常組織においてmRNAの発現量が極めて少ないか、またはmRNAが存在していないことを意味する。従って、このmRNAは特異性の高い高精度の診断マーカーであるといえる。高精度の診断マーカーであることは、例えば、癌の陰性または陽性を診断する際に、隣接正常細胞由来の偽陽性を発生しにくくする効果がある。加えて、SCpair67633_LプライマーおよびSCpair67633_Rプライマーは、その診断マーカーを検出するための優れた検出試薬となり得る。
【0120】
<実施例2:mRNAの配列解析>
実施例1の過剰発現しているmRNAのRNA配列を調査した。なお、ヒトのゲノムDNAにおいては、上記のSCpair67633_LプライマーとSCpair67633_Rプライマーに対応するDNA配列の上流には、マウスNKX1-2オルソログ蛋白質をコードする遺伝子(以下マウスNKX1-2オルソログ遺伝子と称することもある)が存在する(図3)。また、SCpair67633_LプライマーとSCpair67633_Rプライマーに対応するDNA配列の下流には、ポリAシグナル(AATAAA)が存在する。ヒトのゲノムDNA配列は、National Center for Biotechnology Information(NCBI)のデータベースであるGenBank等で参照できる。
【0121】
(2−1)mRNAの転写開始点の解析
実施例1の過剰発現しているmRNAについて、5’RACE法を用いて転写開始点を調べた。まず、ヒト胎児腎臓由来細胞株のHEK293から、TRIzol試薬(invitrogen)を用いてtotal RNAを抽出した。抽出操作はTRIzol試薬のプロトコール通りに行った。具体的には、グアニジンイソチオシアネート/フェノール/クロロホルムによってRNAだけを分離し、イソプロパノールにより沈殿回収を行った。
【0122】
次に、GeneRacer Kit(インビトロジェン株式会社)を使用しキットのプロトコール通りに5‘RACE法を行った。具体的には、以下のように行った。GeneRacer Kitマニュアル記載の条件で、上記のTotal RNAに対してCIP処理し、次にTAP処理し、GeneRacer RNA Oligoを付加させた。そして、SuperScript III RTで逆転写反応を行った。このとき、プロトコールに記載のGeneRacer Oligo dT primerに変えてキット付属のGeneRacer Random primerを使用した。
【0123】
さらに、GeneRacer 3' primerとForward GSPを用いてのPCR、GeneRacer 3' Nested primerとForward Nested GSPを用いてのNested PCRを実施した。このとき、Reverse GSP primerにはAAGGCCACCAGCTGCTCGTAGGTGAA(配列番号4)のDNAプライマーを、Reverse GSP nested primerにはAGGGTCCCTGGAGCTGGCATCTTTCC(配列番号5)のDNAプライマーを使用した。また、変異導入を避けるために正確性の高い耐熱性酵素を使用した。PCR産物をアガロースゲル電気泳動に供し、サイズ、収量およびシングルバンドであるか否かを確認した。サイズの異なるRACE productが確認された場合には、Alternative splicingの可能性もあるので3つのフラグメントまでをクローニングした。
【0124】
次に、PCR4Blunt-TOPOへクローニングした。そして、得られたクローンのインサートサイズを確認し、目的のインサートをもつと思われるRecombinantクローンについてインサート全DNA配列の解析を実施した。その結果、CCCGAGCCCAGGCAAGCGGCCGCGGCACAGCGCCTGATAGTCCCGAGGCTGGCCCGGGCTGCGCCGGTGCCAATCGGCGCGCAGCCCCCCGCGGCGCTCTCCCCGCCCCGCCTCCCCGCCCCCCTCCCCAGCTTCACTTGGCAGCGCGGACCCGGCTCCTGGCTGGAAAGCTACCGCCAAGCCACAGCCGAAGGCAAGCCCGAGCGGCGCCATCCCCAACCCCGCGCCGCCGACCGCCGGCCCGTGGGCGACGGGCATGCTGGCATGGCAGGACGGCGGGGCCAAGGCGGCTCCCTCCCACCACAAGATTTCTTTCTCTGTCCTGGACATCCTGGACCCACAGAAATTCACCCGCGCAGCGCTCCCTGCCGTGCGCCCGGCTCCCCGGGAAGCCAGGAAAAGTTTGGCGGAGGTCGAAGCGGGGAAAGATGCCAGCTCCAGGGACCCTGTCCGACAGCTGGAGACCCCTGATGCTGCGGGCCCAGGCGCCGGCCAGGCGTCCCCCCTGGAGGGTTCCGAGGCGGAAGAGGAGGAGGATGCGGAGGATCCGAGGAGGCCGCGGCTGCGGGAGCGGGCTGCGCGCTTGCTGCCGGGCCTAGCGCGCTCACCTGACGCCCCGGCCGGGGCATTGGCGTCTGGGGAGCCCTGCGAGGACGGCGGGGGCGGCCCTGTGAGGTCCCCCCCGGGATCCCCCGGCTCCCCGCGTCCCAGGCGCCGGCGCCTGGAGCCCAACTGCGCCAAGCCGCGGCGCGCGCGCACCGCC(配列番号29)からなる763bpのcDNAの配列が明らかになった。この763bpのcDNAのうち、5’末端から257番目、258番目、259番目のA、T、GがマウスNKX1-2オルソログ遺伝子の開始コドンである(上記789bpのcDNAの配列中、開始コドンの塩基を下線で示す)。
【0125】
またこのDNA配列解析の結果、上記789bpのcDNAとは別に、この789bpのcDNAと比較して5’末端側の塩基の25bp、129bp、133bp、135bp、または156bpが欠失しているクローンが5種類存在していた(上記789bpのcDNAの配列中、欠失しているクローンの5’末端の塩基を下線で示す)。これは、マウスNKX1-2オルソログ蛋白質をコードするmRNAは、転写開始点に少なくとも6つのバリエーションが存在するためと考えられる。
【0126】
一方で、この789bpのcDNAを、ヒトのゲノムDNAのマウスNKX1-2オルソログ蛋白質をコードする領域と比較した。すると、ヒトのゲノムDNAのマウスNKX1-2オルソログ蛋白質をコードする領域には、1582bpからなるイントロンが存在することがわかった。イントロンの該当箇所は、上記の789bpのcDNAの5’末端から470番目のGと471番目のAの間であった。
【0127】
また、このイントロンに相当するDNA配列内に対応するプライマーである、151_Lプライマー:TCAAACCCCCTTTCCCTGTCT(配列番号30)および151_Rプライマー:AGAGTTTCAGATTTGTGCGGGG(配列番号31)を用いて、リアルタイムPCRを行った。加えて、上記イントロンに相当するDNA配列内に対応するプライマーである、147_Lプライマー:TGTTCACCGACCCCTTCTCC(配列番号32)、および上記イントロンよりも下流のDNA配列に対応するプライマーである、147_Rプライマー:CTCCGCATCCTCCTCCTCTTC(配列番号33)を用いて、リアルタイムPCRを行った。その結果、いずれのリアルタイムPCRにおいても、DNAの増幅は見られなかった。即ち、このリアルタイムPCRの結果からも、上記の789bpのcDNAの5’末端から470番目のGと471番目のAの間に、イントロンが存在することが支持される。
【0128】
なお、mRNA上における、マウスNKX1-2オルソログ遺伝子に相当する位置、ポリAシグナル、イントロンに相当する位置、および本実施例で用いた主なプライマー等の位置関係を図4に示す。
【0129】
(2−2)mRNAの転写終結点の解析
(2−2−1)ポリAシグナルより上流
上述のTotal RNAを鋳型として、116_Lプライマー:GCCAATGTCCTCTTCCCGTC(配列番号6)と20_Rプライマー:AGGATTTGGTTGGAAAGCCACT(配列番号9)を用いたRT-PCR(Reverse Transcription PCR)を行った(図4)。116_LプライマーはマウスNKX1-2オルソログ遺伝子内にあって、終始コドン(TGA)近傍のDNA配列に相補的なプライマーである。20_RプライマーはポリAシグナルから28塩基隔てた上流のDNA配列に相補的なプライマーである。
【0130】
その結果、約2310bpのDNAの増幅が確認できた。これは、ヒトのゲノムDNAに存在する、116_Lプライマーに相補的なDNA配列から、20_Rプライマーに相補的なDNA配列の間の長さに等しい。即ち、ヒトのゲノムDNAにおいて、この間に転写終結点はなく、DNAはすべて転写されていると考えられる。そして、ヒトのゲノムDNAの塩基配列から推定される16_Lプライマーと20_Rプライマーの間のmRNAの塩基配列は、GCCAATGTCCTCTTCCCGTCCGCCGCCTCCTTCCCGCTGACGGCTGCCGCCCCCGGGAGCCCTTTCGCGCCGTTCCTTGGGCCTTCCTACCTGACCCCCTTCTACGCCCCGCGTCTATGAATCCGGAGCCCCCTGGCCCCTCTTTCGCGGGATTCACGAGGGATTGGCATCGTCGTGTGCCCTCGGCTCCTCCACCGGGGGTGCAGGTGCGCGGGTGTCAGCGCACCCCTGCCCGCCGCGCGCACCCGCGATCCTCGCGGGCCACCAAGGGGTCAGGGATCTGCCGTCCTTCAAAGTGTCCGGGGACGGAGGCTGACCTCAAGCCTTGCCGTTTCTGGACCTTGCTGTTCACTTTGGGTCAGGTTTAATTCAGTTCAGGGGCTAGTTTTTGAGGGTCTGGGTGTTCGGCGCGGGGCTAACCAAGATGCCAGGAGGGAAATACAGGGAGCAGAGACGCCCTGGCTGCCAGCTGCTGGCGGCTAGGATGGAACCTTTAAAGGTGCTGGCTCATCAGAGGGTGAGAAACAGTCTCTGTTCACAACTGACAGCTTCCCCTCCTCGTGCTCGATGGTTCAGCCCAAACCCAGAGAGTTCTTCCAAATCCTGAACGAGGCTGGGGAGAGCTTGGTCCTGGAGCACAGACGGCCGCTCTGAAACGGACTATTTTTAAAATGCATAAAACTCCACATTTCTAGATCTTTACTTAAGATTCGGACTGGAACACAATACTTGTTCCAAATAACCTCCCCAGGCTATTCCTGAGAGAGGGGGTACCTTGGTTTTTGGAGTAGGCCAGAAGTTTGTGGTAGGAAAGGTGACTGATTTGCAGCTAGACTCACCTGCTAAAGTAGACACGGGTCTGTTGCACTGCAGGTTTTGAGAACAGCCTGGACCAAACCACACAGTGACCCCAAAGGCATAAAAATGATAATGAAGGCAGCGATGGCTCAACTAATATCATGAAGTCTATGCATGAGGCTGCCTACTTTGATTTGCAGTAGTTGATACTTTAAAACTTCAGTCCTGGCTTATCTGCCTGTCCCAGGGATTCCTGGGCTCCCAATAGTGAGCCAGGATGGGGAAGAGCTAGCTCCATCAGCACACACTACATGTGGACAGTTGGACTGGACTGTTTTTTAAAAGCACAAACTCAACATTTTTAGATCTTCGTCTAGGATTCTGACTTGAAAACAATTCTTGTTACAAACAGACTCTTTATGGTGGTGAACAAGCAGAGATTGTAAGGGCCCATGAAAGCAATACTTGGGTGTGAAGAGCCGTCATATTCCTAATGGATTCACCTCCAGGAATCTGATACATGGACATGCATTTTAACTGCTGCTTTTATTACCTCCCTTAAAAAATTAGTTCTGTGAAATTCCCTTGCCACTTTTGCTTGGAATACATTTCCTTTAGTTTTCTACCTAATATAATCTTGTAGCCCACGTCTCAGAAACCCAGAGGTCCCCAGTTGTGTCATGTATGTTTCATTCTCACTTTTGATTACTTGAGGCCAGCCGAGATCTGTGTGGATACCATATTCCTTGCTATTTTTTGGTAGCCTGTGCTACTAACAATCAAATTTAATGGTCAATGGCTTCAAAGTAAAGCACCCTGTTTGGTATTATGGATTACATTCCATGACTATGATCTTGAAATATCTAGTTCTGTTATCAGGAATGATAGAAAATATTCCCCATTTCTCCTAAATTAAGTGAAGACTTCATGGTTCATGTGACTCTCATAATATTTGATAGTATGTATTATTTAATTACTTAATATCCACTAATTAGACTCTTTTCCTTCTAAAGAAGAATGTCCCCCAAACAACACATTGTAACTTTCTAAAAGACAGTTGGTGCCAGATGAGATTAAAAATGCAGTTACTCTACTAGATAATATTCACCTTACACTTCGGTAAACACTCCTTTAATAACTATTTGTTGGTTTCTCAAAAGCAATATCCCATATTAAACAGACAATTCAAATGTGACAATTCCTCTGTAACAAAGAAGCTGAATTCTGTAATAAATGGGAAACATTTCATTCCAGTCTTCTCAGGTACCAGAATCATGGACTTCAGTAGAAGAGAGGGAATAGGGAGAGAGGTGGGAGGCTGATCTGTTCGTGGCCCAGCACGGTGCTGTAATTCCTGACCCTTCTGGTTTCCACAGATCATTGCAGAGTAATGCTTGAAGCGTGTGACTTTGGACTTCTGCTGCTTTAAAAGGCCCAGTGGCTTTCCAACCAAATCCT(配列番号29)の2256bpである。
【0131】
また、上記の20_Rプライマーに変えて、37_Rプライマー:GGAGTGTTTACCGAAGTGTAAGGTGA(配列番号11)、51_Rプライマー:AGGGTGCTTTACTTTGAAGCCATT(配列番号13)、96_Rプライマー:GCCTGGGGAGGTTATTTGGAAC(配列番号19)、または116_Rプライマー:GGTCAGGTAGGAAGGCCCAAG(配列番号7)を使用した場合においても、ヒトのゲノムDNAにおいて対応する長さに等しいDNAの増幅が確認できた(上記2256bpのcDNAの配列中、上記プライマーの配列を下線で示す)。
【0132】
また、表2に記載のプライマーをID毎にセットで使用した場合もDNAの増幅が確認できた。表2に記載のプライマーは、転写開始点より下流であり、イントロンに相当する領域を含まず、且つポリAシグナルより上流に位置するように設計したプライマーである。表2中、IDの末尾にLがあるものがフォワードプライマー、IDの末尾にRがあるものがリバースプライマーである。
【0133】
【表2】

【0134】
(2−2−2)ポリAシグナルより下流
ヒトのゲノムDNAにおいて、SCpair67633_LプライマーとSCpair67633_Rプライマーに対応するDNA配列のさらに下流には、ポリAシグナル(AATAAA)が存在する。一般的に、このポリAシグナルが存在すると、20塩基程度下流で転写が終結することが知られている。
【0135】
また、ヒトのゲノムDNAには、マウスNKX1-2オルソログ遺伝子の偽遺伝子と思われる領域が2種類確認できる。2種類の偽遺伝子はX染色体q23と、11番染色体p12に存在する。偽遺伝子とは、一般的にはかつては遺伝子産物をコードしていたが、現在はその機能を失っていると考えられているものである。形成方法にはいくつかあるが、ひとつの方法としては、機能している遺伝子から転写されたmRNAの3’末端から、レトロポゾンの逆転写酵素によって作られたcDNAがゲノム内に挿入されてできたとされている。このゲノム内に挿入されてできた偽遺伝子は、mRNAを経てできているため、この偽遺伝子の配列からmRNAの転写終結点が予測できる。
【0136】
ここで、上記のポリAシグナルおよびその下流のDNA配列と、2種類の偽遺伝子の配列を比較すると、DNA配列5’AATAAATTCTTTTTGTAGTAAATTTA3’(以下「類似していたDNA配列」と称することもある)が類似していた。そして、この類似していたDNA配列の3’末端より下流は類似していなかった。さらに、この類似していたDNA配列の3’末端はポリAシグナルの20塩基下流に位置している。従って、この類似していたDNA配列の3’末端が転写終結点であると考えられる。
【0137】
さらに、上記の類似していたDNA配列の3’末端の、さらに下流に設計したSCpair67633_dw_Lプライマー:CCCCAAAACAGCCTGGTAGGT(配列番号34)、およびSCpair67633_dw_Rプライマー:GCTCCTCGGCTATGTGGTTTC(配列番号35)を用いてリアルタイムPCRを行った。その結果、DNAの増幅がみられなかった。さらに、上記の類似していたDNA配列の3’末端をまたぐように設計した14_Lプライマー:TCCTTAGACTCAATCTATTGGTGTGTTTG(配列番号36)、および14_Rプライマー:TGAAAGCATTGCTAATAGAGAACAAGG(配列番号37)でリアルタイムPCRを行った場合も、DNAの増幅がみられなかった。従って、これらのリアルタイムPCRの結果からも、上記の類似していたDNA配列の3’末端が転写終結点であることが支持される。
【0138】
(2−3)mRNAの配列解析のまとめ
以上の結果より転写開始点、イントロン、転写終結点の位置を設定し、公開されているゲノムDNAの塩基配列を参照すると、実施例1の過剰発現しているmRNAの塩基配列はCCCGAGCCCAGGCAAGCGGCCGCGGCACAGCGCCTGATAGTCCCGAGGCTGGCCCGGGCTGCGCCGGTGCCAATCGGCGCGCAGCCCCCCGCGGCGCTCTCCCCGCCCCGCCTCCCCGCCCCCCTCCCCAGCTTCACTTGGCAGCGCGGACCCGGCTCCTGGCTGGAAAGCTACCGCCAAGCCACAGCCGAAGGCAAGCCCGAGCGGCGCCATCCCCAACCCCGCGCCGCCGACCGCCGGCCCGTGGGCGACGGGCATGCTGGCATGGCAGGACGGCGGGGCCAAGGCGGCTCCCTCCCACCACAAGATTTCTTTCTCTGTCCTGGACATCCTGGACCCACAGAAATTCACCCGCGCAGCGCTCCCTGCCGTGCGCCCGGCTCCCCGGGAAGCCAGGAAAAGTTTGGCGGAGGTCGAAGCGGGGAAAGATGCCAGCTCCAGGGACCCTGTCCGACAGCTGGAGACCCCTGATGCTGCGGGCCCAGGCGCCGGCCAGGCGTCCCCCCTGGAGGGTTCCGAGGCGGAAGAGGAGGAGGATGCGGAGGATCCGAGGAGGCCGCGGCTGCGGGAGCGGGCTGCGCGCTTGCTGCCGGGCCTAGCGCGCTCACCTGACGCCCCGGCCGGGGCATTGGCGTCTGGGGAGCCCTGCGAGGACGGCGGGGGCGGCCCTGTGAGGTCCCCCCCGGGATCCCCCGGCTCCCCGCGTCCCAGGCGCCGGCGCCTGGAGCCCAACTGCGCCAAGCCGCGGCGCGCGCGCACCGCCTTCACCTACGAGCAGCTGGTGGCCTTGGAGAACAAGTTCCGGGCCACGCGCTACCTGTCAGTGTGCGAGCGCCTGAACCTCGCGCTGTCTCTCAGCCTCACCGAGACGCAGGTCAAAATCTGGTTCCAGAATCGCAGGACCAAGTGGAAGAAGCAGAACCCGGGTGCCGACGGCGCGGCGCAGGTGGGGGGTGGCGCGCCCCAGCCAGGGGCGGCGGGGGGCGGCGGCGGCGGCGGCTCGGGGGGCAGTCCTGGCCCTCCCGGCACCGGCGCTCTGCACTTCCAGACTTTCCCCTCCTACTCCGCGGCCAATGTCCTCTTCCCGTCCGCCGCCTCCTTCCCGCTGACGGCTGCCGCCCCCGGGAGCCCTTTCGCGCCGTTCCTTGGGCCTTCCTACCTGACCCCCTTCTACGCCCCGCGTCTATGAATCCGGAGCCCCCTGGCCCCTCTTTCGCGGGATTCACGAGGGATTGGCATCGTCGTGTGCCCTCGGCTCCTCCACCGGGGGTGCAGGTGCGCGGGTGTCAGCGCACCCCTGCCCGCCGCGCGCACCCGCGATCCTCGCGGGCCACCAAGGGGTCAGGGATCTGCCGTCCTTCAAAGTGTCCGGGGACGGAGGCTGACCTCAAGCCTTGCCGTTTCTGGACCTTGCTGTTCACTTTGGGTCAGGTTTAATTCAGTTCAGGGGCTAGTTTTTGAGGGTCTGGGTGTTCGGCGCGGGGCTAACCAAGATGCCAGGAGGGAAATACAGGGAGCAGAGACGCCCTGGCTGCCAGCTGCTGGCGGCTAGGATGGAACCTTTAAAGGTGCTGGCTCATCAGAGGGTGAGAAACAGTCTCTGTTCACAACTGACAGCTTCCCCTCCTCGTGCTCGATGGTTCAGCCCAAACCCAGAGAGTTCTTCCAAATCCTGAACGAGGCTGGGGAGAGCTTGGTCCTGGAGCACAGACGGCCGCTCTGAAACGGACTATTTTTAAAATGCATAAAACTCCACATTTCTAGATCTTTACTTAAGATTCGGACTGGAACACAATACTTGTTCCAAATAACCTCCCCAGGCTATTCCTGAGAGAGGGGGTACCTTGGTTTTTGGAGTAGGCCAGAAGTTTGTGGTAGGAAAGGTGACTGATTTGCAGCTAGACTCACCTGCTAAAGTAGACACGGGTCTGTTGCACTGCAGGTTTTGAGAACAGCCTGGACCAAACCACACAGTGACCCCAAAGGCATAAAAATGATAATGAAGGCAGCGATGGCTCAACTAATATCATGAAGTCTATGCATGAGGCTGCCTACTTTGATTTGCAGTAGTTGATACTTTAAAACTTCAGTCCTGGCTTATCTGCCTGTCCCAGGGATTCCTGGGCTCCCAATAGTGAGCCAGGATGGGGAAGAGCTAGCTCCATCAGCACACACTACATGTGGACAGTTGGACTGGACTGTTTTTTAAAAGCACAAACTCAACATTTTTAGATCTTCGTCTAGGATTCTGACTTGAAAACAATTCTTGTTACAAACAGACTCTTTATGGTGGTGAACAAGCAGAGATTGTAAGGGCCCATGAAAGCAATACTTGGGTGTGAAGAGCCGTCATATTCCTAATGGATTCACCTCCAGGAATCTGATACATGGACATGCATTTTAACTGCTGCTTTTATTACCTCCCTTAAAAAATTAGTTCTGTGAAATTCCCTTGCCACTTTTGCTTGGAATACATTTCCTTTAGTTTTCTACCTAATATAATCTTGTAGCCCACGTCTCAGAAACCCAGAGGTCCCCAGTTGTGTCATGTATGTTTCATTCTCACTTTTGATTACTTGAGGCCAGCCGAGATCTGTGTGGATACCATATTCCTTGCTATTTTTTGGTAGCCTGTGCTACTAACAATCAAATTTAATGGTCAATGGCTTCAAAGTAAAGCACCCTGTTTGGTATTATGGATTACATTCCATGACTATGATCTTGAAATATCTAGTTCTGTTATCAGGAATGATAGAAAATATTCCCCATTTCTCCTAAATTAAGTGAAGACTTCATGGTTCATGTGACTCTCATAATATTTGATAGTATGTATTATTTAATTACTTAATATCCACTAATTAGACTCTTTTCCTTCTAAAGAAGAATGTCCCCCAAACAACACATTGTAACTTTCTAAAAGACAGTTGGTGCCAGATGAGATTAAAAATGCAGTTACTCTACTAGATAATATTCACCTTACACTTCGGTAAACACTCCTTTAATAACTATTTGTTGGTTTCTCAAAAGCAATATCCCATATTAAACAGACAATTCAAATGTGACAATTCCTCTGTAACAAAGAAGCTGAATTCTGTAATAAATGGGAAACATTTCATTCCAGTCTTCTCAGGTACCAGAATCATGGACTTCAGTAGAAGAGAGGGAATAGGGAGAGAGGTGGGAGGCTGATCTGTTCGTGGCCCAGCACGGTGCTGTAATTCCTGACCCTTCTGGTTTCCACAGATCATTGCAGAGTAATGCTTGAAGCGTGTGACTTTGGACTTCTGCTGCTTTAAAAGGCCCAGTGGCTTTCCAACCAAATCCTTAGACTCAATCTATTGGTGTGTTTGTCTAATAAATTCTTTTTGTAGTAAATTTA(配列番号1)の3379bpと推定される。または、実施例1の過剰発現しているmRNAの塩基配列は、この3379bpの塩基配列と比較して5’末端側の塩基の25bp、129bp、133bp、135bp、または156bpが欠失している塩基配列(配列番号1の塩基配列の26番目のCから3379番目のAの塩基配列、配列番号1の塩基配列の130番目のAから3379番目のAの塩基配列、配列番号1の塩基配列の134番目のTから3379番目のAの塩基配列、配列番号1の塩基配列の136番目のAから3379番目のAの塩基配列、または配列番号1の塩基配列の157番目のTから3379番目のAの塩基配列)であると推定される。
【0139】
また、過剰発現しているmRNAにコードされているマウスNKX1-2オルソログ蛋白質のアミノ酸配列はMLAWQDGGAKAAPSHHKISFSVLDILDPQKFTRAALPAVRPAPREARKSLAEVEAGKDASSRDPVRQLETPDAAGPGAGQASPLEGSEAEEEEDAEDPRRPRLRERAARLLPGLARSPDAPAGALASGEPCEDGGGGPVRSPPGSPGSPRPRRRRLEPNCAKPRRARTAFTYEQLVALENKFRATRYLSVCERLNLALSLSLTETQVKIWFQNRRTKWKKQNPGADGAAQVGGGAPQPGAAGGGGGGGSGGSPGPPGTGALHFQTFPSYSAANVLFPSAASFPLTAAAPGSPFAPFLGPSYLTPFYAPRL(配列番号28)と推定される。
【0140】
(2−4)結果の考察
以上の結果より、肺癌または子宮頸癌において、配列番号1の塩基配列のmRNAが特異的に過剰発現していることが強く示唆された。従って、配列番号1の塩基配列のmRNAは肺癌または子宮頸癌の癌診断マーカーとして癌の診断に利用できると考えられる。そして、このmRNAを検出できる核酸プライマーまたは核酸プローブ等は、肺癌または子宮頸癌の診断や予後の診断に使用可能な癌診断薬になると考えられる。例えば、実施例でPCR反応に使用可能であったプライマーを使用できる。
【0141】
また、マウスNKX1-2オルソログ蛋白質も肺癌または子宮頸癌の癌診断マーカーとして癌の診断に利用できると考えられる。そして、このマウスNKX1-2オルソログ蛋白質に結合する抗体等は、肺癌または子宮頸癌の診断や予後の診断に使用可能な癌診断薬になると考えられる。
【0142】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【技術分野】
【0001】
本発明は、癌診断マーカーまたはその検出物に関する。
【背景技術】
【0002】
癌は、全世界において主要な死亡原因の1つである。WHO(世界保健機構)によると2007年には全世界の死因の約13%(790万人)が、癌が原因で死亡したと報告されている。また、癌による死者は今後も増加していくと予測されている。そのような中、世界中の研究者や専門家によって、癌の早期診断や予後診断または改善のために種々の癌診断マーカーが研究、開発されてきた。例えば、αフェトプロテイン、CEA、CA19-9、PSA、SCCなどが従来使用されている。
【0003】
癌診断マーカーの性質を分類すると、低分子化合物、DNA(Deoxyribonucleic acid)、mRNA(messenger ribonucleic acid)、蛋白質、糖鎖などが挙げられる。例えば、特許文献1には特定の塩基配列を有するmRNAが、肺癌の診断マーカーとして使用できることが記載されている。特許文献2には特定のCAPN10をコードするmRNAが、2型糖尿病の診断マーカーとして使用できることが記載されている。特許文献3にはGPC3蛋白質が、肝臓癌の診断マーカーとして使用できることが記載されている。特許文献4には特定のアミノ酸配列を有する蛋白質が、肝臓癌の診断マーカーとして使用できることが記載されている。
【0004】
癌診断マーカーの検出方法としては、免疫測定法、リアルタイムPCR、RT-PCR、サザンブロット、ノーザンブロットなどが挙げられる。例えば、特許文献1にはRT-PCRによる検査方法が記載されている。特許文献2および特許文献3にはリアルタイムPCRによる検査方法が記載されている。特許文献4には免疫測定法による検査方法が記載されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許4392163号明細書
【特許文献2】特許4214235号明細書
【特許文献3】特許4283227号明細書
【特許文献4】特許4280814号明細書
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上記文献記載の従来技術は、以下の点で改善の余地を有していた。
従来の癌診断マーカーは種々あるが、それらを使用しても癌を検出できない場合があった。例えば、癌の発症メカニズムは複雑であるため、癌が発症または進行していても従来の癌マーカーが通常通りに増加しないことがあった。そのため、従来とは異なる原理を備える、癌の診断手段が必要であった。
【0007】
また、従来の癌診断マーカーは癌の可能性を計るための指標のひとつに過ぎず、診断結果が陰性であってもそれだけで癌を完全に否定できるわけではなかった。そのため、医療現場では複数種の癌診断マーカーを組み合わせて癌を評価することがある。従って、より診断精度を高めるために、新しい癌診断マーカーが必要であった。
【0008】
さらに、癌の治療や、癌の進行を止めるには早期発見が重要である。しかし、早期の癌の場合には、被検試料中に存在する癌診断マーカーの量が微量である場合が多く、検出することは容易ではない。そのため、微量の癌診断マーカーを検出可能な、検出精度の優れた癌の診断手段が必要であった。
【0009】
加えて、従来の癌診断マーカーは正常細胞において偽陽性を示す事があった。そのため、正常細胞で検出され難い、癌に特異的な癌診断マーカーが必要であった。
【0010】
本発明は上記事情に鑑みてなされたものであり、新規の癌診断マーカーを提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドが提供される。
【0012】
このポリヌクレオチドは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているmRNAと結合できることが実証されている。そのため、このポリヌクレオチドは、肺癌または子宮頸癌の癌診断に利用することができる。
【0013】
また、本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドを含む癌診断薬が提供される。
【0014】
この癌診断薬は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているmRNAと結合できることが実証されているポリヌクレオチドを含む。そのため、この診断薬を用いて、さらに当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる
【0015】
また、本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチドを有する癌診断薬を含む癌診断用キットが提供される。
【0016】
この癌診断用キットは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているmRNAと結合できることが実証されているポリヌクレオチドを有する癌診断薬を含む。そのため、この癌診断用キットを用いれば、癌の診断が可能になる。
【0017】
また、本発明によれば、配列番号1の塩基配列を有するRNA鎖を含む、癌診断マーカーが提供される。
【0018】
この癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この癌診断マーカーおよび当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる。
【0019】
また、本発明によれば、配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーが提供される。
【0020】
この癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この癌診断マーカーおよび当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる。
【0021】
また、本発明によれば、被験者由来の被検試料中において、配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出する工程を含む、被験者の癌を検査する方法が提供される。
【0022】
この癌を検査する方法は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出する工程を含む。そのため、この方法を用いれば癌の診断が可能になる。
【0023】
また、本発明によれば、被験者由来の被検試料中において、配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出する工程を含む、被験者の癌の予後を検査する方法が提供される。
【0024】
この癌の予後を検査する方法は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出する工程を含む。そのため、この方法を用いれば癌の予後の診断が可能になる。
【0025】
また、本発明によれば、被験者由来の被検試料中の配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出する検出部と、上記癌診断マーカーの検出強度に基づいて上記癌診断マーカーの量を定量化する定量部と、上記癌診断マーカーの量が所定の閾値を越えているかどうかを判定する判定部と、上記判定の結果を出力する出力部とを備えた、癌診断用装置が提供される。
【0026】
この癌診断用装置は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出する工程を含む。そのため、この装置を利用すれば癌の診断が可能になる。
【0027】
また、本発明によれば、コンピュータに、被験者由来の被検試料中の配列番号1の塩基配列または配列番号1の1071番目のGから3379番目のAの塩基配列を有するRNA鎖を含む、癌診断マーカーを検出するステップと、前記癌診断マーカーの検出強度に基づいて前記癌診断マーカーの量を定量化するステップと、前記癌診断マーカーの量が所定の閾値を越えているかどうかを判定するステップと、前記判定の結果を出力するステップとを実行させるための、癌診断用プログラムが提供される。
【0028】
この癌診断用プログラムは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている癌診断マーカーを検出するステップを含む。そのため、この癌診断用プログラムを利用すれば癌の診断が可能になる。
【0029】
また、本発明によれば、配列番号1の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と結合する抗体が提供される。
【0030】
この抗体と結合する核酸もしくはその一部、またはそれらの相補鎖は、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この抗体は肺癌または子宮頸癌の癌診断に利用することができる。
【0031】
なお、上記ポリヌクレオチド、上記癌診断薬、上記癌診断用キット、上記癌診断マーカー、上記癌を検査する方法、上記癌の予後を検査する方法、上記癌診断用装置、上記癌診断用プログラム、および上記抗体は、上記配列番号1が、配列番号1の塩基配列に対して80%以上の相同性を有する塩基配列、配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列であっても、当業者であれば当然同様の作用効果が得られることが容易に想定できる。
【0032】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質をコードする核酸もしくはその核酸の相補鎖、またはそれらの一部と、ハイブリダイズするポリヌクレオチドが提供される。
【0033】
このポリヌクレオチドは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されているマウスNKX1−2オルソログ蛋白質をコードする核酸と結合できることが実証されている。そのため、このポリヌクレオチドは、肺癌または子宮頸癌の癌診断に利用することができる。
【0034】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカーが提供される。
【0035】
この癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、この癌診断マーカーおよび当該技術分野で公知の診断手法を利用すれば、癌の診断が可能になる。
【0036】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカーに結合するマウスNKX1−2オルソログ蛋白質結合性抗体が提供される。
【0037】
このマウスNKX1−2オルソログ蛋白質結合性抗体が結合できる癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、このマウスNKX1−2オルソログ蛋白質結合性抗体は肺癌または子宮頸癌の癌診断に利用することができる。
【0038】
また、本発明によれば、マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカーに結合するポリヌクレオチドが提供される。
【0039】
このポリヌクレオチドが結合できる癌診断マーカーは、後述する実施例で肺癌または子宮頸癌で過剰発現していることが強く示唆されている。そのため、このポリヌクレオチドは肺癌または子宮頸癌の癌診断に利用することができる。
【発明の効果】
【0040】
本発明によれば、新規の癌診断マーカーが提供されるため、従来とは異なる方法で癌診断が可能になる。または、その癌診断マーカーに結合する新規の物質が提供されるため、新規の癌診断薬が得られる。
【図面の簡単な説明】
【0041】
【図1】図1は癌診断用装置1000の全体構成を示した機能ブロック図である。
【図2】図2は癌診断用装置1000の動作について説明するためのフローチャートである。
【図3】図3はゲノムDNAにおけるマウスNKX1-2オルソログ遺伝子と、SCpair67633_Lプライマー等との位置関係を示した図である。
【図4】図4はmRNAにおけるマウスNKX1-2オルソログ遺伝子に相当する位置、ポリAシグナル、イントロンに相当する位置、および各種プライマー等との位置関係を示した図である。
【発明を実施するための最良の形態】
【0042】
以下、本発明の実施の形態について、詳細に説明する。なお、同様な内容については、
繰り返しの煩雑を避けるために、適宜説明を省略する。
【0043】
<実施形態1:癌診断マーカー>
本実施形態に係る癌診断マーカーは、配列番号1の塩基配列、または配列番号1の1070番目のGから3379番目のAの塩基配列を含む、RNA鎖を含む癌診断マーカーである。ここで、後述する実施例で上記RNA鎖が肺癌または子宮頸癌で過剰発現していることが強く示唆されている。また、後述する実施例で上記RNA鎖は隣接正常細胞では発現が検出されず、肺癌または子宮頸癌における発現の特異性が高いことが強く示唆されている。そのため、上記癌診断マーカーは肺癌または子宮頸癌の癌診断マーカーとして好適に使用できる。また、上記癌診断マーカーは、同様に配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖を、過剰発現している癌の癌診断マーカーとしても使用できる。なお、配列番号1の1070番目のGとは、後述する実施例において、116_Lプライマーおよび20_Rプライマーを用いたRT-PCRでDNAの増幅が見られた塩基配列の116_Lプライマー側の5’末端の塩基に相当する。また配列番号1の3379番目のAとは、配列番号1の3’末端に位置する塩基である。
【0044】
また、上記癌診断マーカーは、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列に対して、80%以上の相同性を有する塩基配列を含むRNA鎖を有している癌診断マーカーを含む。ここで、上記80%以上は、好ましくは配列番号1に対して85%以上の相同性を有しており、より好ましくは90%以上の相同性を有しており、より好ましくは95%以上の相同性を有しており、さらに好ましくは98%以上である。なぜならば、上記80%以上の相同性を有する塩基配列を含むRNA鎖は、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に対して相同性が高いほど、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に近い性質を有していることになるからである。
【0045】
また、上記癌診断マーカーは、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列において、1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含むRNA鎖を有している癌診断マーカーを含む。ここで、上記1若しくは数個とは、好ましくは30個であり、より好ましくは20個であり、より好ましくは15個であり、より好ましくは10個であり、より好ましくは5個であり、好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、上記1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含むRNA鎖は、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に対して塩基の欠失、置換若しくは付加が少ないほど、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖に近い性質を有していることになるからである。
【0046】
また、上記癌診断マーカーは、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列に、相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列を含むRNA鎖を有している癌診断マーカーを含む。
【0047】
本明細書において「過剰発現」とは、コントロール試料(例えば、肺癌および子宮頸癌を発症していない細胞、正常細胞、またはそれらに由来する試料等)の発現量に比べて有意に多くの発現をしている状態を表す。ここで、有意であることは、例えばコントロール試料と被検試料との間の統計学的有意差をスチューデント(Student)のt検定を使用して評価し、p<0.05であるときに統計学的に有意であると見なす事ができる。
【0048】
本明細書において「相同性」とは、2つもしくは複数間のアミノ酸配列の同一のアミノ酸数の割合を、当該技術分野で公知の方法に従って算定したものである。割合を算定する前には、比較するアミノ酸配列群のアミノ酸配列を整列させ、同一の割合を最大にするために必要である場合はアミノ酸配列の一部に間隙を導入する。また、いかなる保存的置換も同一と考えない。また、最適に整列した状態において、オーバーラップするアミノ酸を含めた全アミノ酸残基に対する、同一のアミノ酸数の割合を意味する。整列のための方法、割合の算定方法、およびそれらに関連するコンピュータプログラムは、当該技術分野で従来からよく知られており、一般的な配列分析プログラム(例えば、GENETYX、GeneChip Sequence Analysisなど)を使用して測定することができる。また「相同性」は、2つもしくは複数間のDNA鎖、または2つもしくは複数間のRNA鎖において、同一の塩基の割合を、上記と同様に当該技術分野で公知の方法に従って算定したものである。
【0049】
本明細書において「ストリンジェントな条件」とは、例えば(1)洗浄のための低イオン強度と高温度、例えば、50℃において0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウムを用いる、(2)ハイブリダイゼーション中にホルムアミド等の変性剤、例えば、42℃において50%(vol/vol)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウムバッファー(pH6.5)、および750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いる、または(3)42℃において50%ホルムアミド、5×SSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5×デンハート液、超音波処理サケ精子DNA(50μg/ml)、0.1%SDS、および10%のデキストラン硫酸と、42℃において0.2xSSC(塩化ナトリウム/クエン酸ナトリウム)中での洗浄および55℃のホルムアミド、次いで55℃におけるEDTAを含む0.1×SSCにてストリンジェントな洗浄を含む条件であっても良い。なお、ハイブリダイゼーション反応のストリンジェンシーは、当業者によって容易に決定でき、一般的にプローブ長、洗浄温度、および塩濃度に依存する。一般に、長いプローブは適当なアニーリングのために高温を必要とし、短いプローブは低温を必要とする。また一般に、ストリンジェンシーは塩濃度に逆比例する。
【0050】
本明細書においてポリヌクレオチドに適用される場合の「ハイブリダイズ」とは、ヌクレオチドの塩基間の水素結合等によってヌクレオチド間の対ができる性質のことを表す。塩基対はワトソン・クリック型塩基対、フーグスティーン型塩基対、または任意の他の配列特異的な形で生じうる。塩基対は二本鎖構造を形成する二本鎖、複数本鎖複合体を形成する3本以上の鎖、単一の自己ハイブリダイズ鎖、またはこれらの任意の組み合わせを含む。ハイブリダイゼーション反応は、PCR反応の開始またはリボザイムによるポリヌクレオチドの酵素的切断のような場合にも起こりうる。ハイブリダイゼーションが2つの1本鎖ポリヌクレオチド間において逆平行配置で生じる場合、それらのポリヌクレオチドは「相補的である」または「相補鎖」と言われる。
【0051】
本明細書において「癌」とは、正常な細胞が突然変異を起こして増殖を続けることで起こる疾患である。悪性の癌細胞は全身のあらゆる臓器や組織から生じ、癌細胞が増殖すると、癌組織のかたまりとなって周囲の正常な組織に侵入し破壊する。癌は、肺癌、食道癌、胃癌、肝臓癌、膵臓癌、腎臓癌、副腎癌、胆道癌、乳癌、大腸癌、小腸癌、子宮頸癌、子宮体癌、卵巣癌、膀胱癌、前立腺癌、尿管癌、腎盂癌、尿管癌、陰茎癌、精巣癌、脳腫瘍、中枢神経系の癌、末梢神経系の癌、頭頸部癌(口腔癌、咽頭癌、喉頭癌、鼻腔・副鼻腔癌、唾液腺癌、甲状腺癌等)、皮膚癌、メラノーマ、甲状腺癌、唾液腺癌、血液の癌、悪性リンパ腫、癌腫または肉腫などを含む。
【0052】
また、肺癌とは気管、気管支、肺胞の上皮細胞等に発生する悪性腫瘍を含み、病理学的には、腺癌、扁平上皮癌、大細胞癌、小細胞癌に分類できる。進展形式や治療反応性などが小細胞癌とその他の癌とでは異なるため、腺癌、扁平上皮癌および大細胞癌はまとめて非小細胞癌とも呼ばれる。カルチノイドや円柱種など、小細胞癌および非小細胞癌に含まれない少数の腫瘍もある。従来の肺癌の診断マーカーとしては、腺癌ではCEA、小細胞癌ではProGRP、扁平上皮癌ではSCCまたはシフラ21-1が使用可能である(看護のための最新医学講座(第2版)、中山書店、84-92(2008/8/29))。しかしながら、それらは癌の可能性を計るための指標のひとつに過ぎず、診断結果が陰性であってもそれだけで癌を完全に否定できるわけではない。また、CEA等、偽陽性を示しやすい診断マーカーも存在する。そのため、他の種々の癌診断マーカーと組み合わせて評価することが多い。
【0053】
また、子宮頸癌とは子宮頸部(子宮の下部にあって膣とのつながっている部分)の癌であり、病理学的には、腺癌、扁平上皮癌、その他に分類できる。従来の子宮頸癌の診断マーカーとしては、腺癌では有用なものがないがCA125やCEAが利用されている。また、扁平上皮癌ではSCC尿中hCGβ-CFが使用可能である(看護のための最新医学講座(第2版)、中山書店、106-120(2008/8/29))。但し、これら癌診断マーカー単独による診断結果が陰性であってもそれだけで癌を完全に否定できるわけではない。
【0054】
また、被験者由来の被検試料中において、上記癌診断マーカーを検出する工程を含む被験者の癌を検査する方法を行えば、癌の診断ができる。特に、肺癌または子宮頸癌の診断ができる。また、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖を、過剰発現している癌の診断ができる。
【0055】
なお本明細書において「癌の診断」は、非特定の癌であることの診断、または肺癌や子宮頸癌など特定の癌であることの診断を含む。また、本明細書において「検出」とは、定量的または非定量的な検出を含み、非定量的な検出としては、単に癌で特異的に過剰発現している癌診断マーカーが存在するか否かの測定、癌で特異的に過剰発現している癌診断マーカーが一定の量以上存在するか否かの測定、癌で特異的に過剰発現している癌診断マーカーの量を他の試料(例えば、コントロール試料など)と比較する測定などを挙げることができる。定量的な検出としては、癌で特異的に過剰発現している癌診断マーカーの濃度または量の測定などを挙げることができる。また、検出には上記癌診断マーカーまたは上記癌診断マーカー由来の派生物質に結合可能な物質を使用することができる。
【0056】
また、上記「検出」の工程は特に限定しないが、リアルタイムPCR、RT-PCR、リアルタイムRT-PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、および次世代シークエンサーからなる群から選ばれる1種以上の方法を用いた解析工程を含んでいても良い。この場合、診断分野において汎用されている手順で上記癌診断マーカーを検出することができる。なお、他の方法に比べて検出精度が高いため、リアルタイムPCRで検出することが好ましい。例えば、マイクロアレイは精度が悪いため、一般にはマイクロアレイで検出されただけでは発現していることが完全に実証されたことにはならず、リアルタイムPCRなどの実証実験が必要になる。さらに、マイクロアレイでは発現強度がいくつ以上の数値なら発現していると考えるかについて明確な基準がない。また、仮にマイクロアレイで高い数値が得られたとしても、クロスハイブリの可能性が否定できないため結局はリアルタイムPCRなどの実証実験が必要となる。また、リアルタイムPCRであれば微量の癌診断マーカーも検出可能である。
【0057】
リアルタイムPCRは、PCRによって増幅する核酸をリアルタイムでモニタリングする方法である。例えば、LightCycler480 SYBR Green I Master(Roche)等の市販のキットや、[原理からよくわかるリアルタイムPCR実験ガイド、羊土社、2007/12]に記載の手順によって行うことができる。なお、トータルRNAは任意の細胞からグアニジンチオシアネート法、市販の試薬またはキットを使用して抽出できる。また、トータルRNAはApplied Biosystems社やBioChain社等から購入することもできる。細胞は、三光純薬株式会社やタカラバイオ株式会社等から購入できる。上記モニタリングの方法としては、インターカレーション法、ハイブリダイゼーション法、LUX(Light Upon eXtensyon)法などが挙げられる。インターカレーション法の典型的な方法は、SYBRR Green Iなどの蛍光物質が二本鎖の核酸に入り込み、励起光の照射によって発光を発する特性を利用して核酸量を測定する方法である。蛍光の強さは核酸の量に比例して強くなるため、蛍光強度を測定することによって核酸の増幅量を知る事ができる。また、リアルタイムPCRを使用した定量方法では、大きく分けて絶対定量法と相対定量法の2つの定量方法がありそれらを適宜使用できる。
【0058】
RT-PCR(Reverse Transcription Polymerase Chain Reaction)は、RNA鎖を鋳型に逆転写を行い、生成されたcDNAに対してPCRを行う方法である。分子間相互作用解析とは、例えばBiacoreシステムを利用した方法が挙げられる。シークエンサーとは、DNA配列、RNA配列、またはアミノ酸配列の配列構造を計測できる装置のことであり、次世代シークエンサーを含む。
【0059】
また、本明細書において「被検者」とは、ヒトもしくはその他哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)または鳥類を含む。また、被検試料とは身体や排泄物由来の試料を含み、例えば、細胞、血液、間質液、血漿、血管外液、脳脊髄液、滑液、胸膜液、腹水、血清、リンパ液、体液、唾液、尿、便、痰、膿、病理切片またはそれらから得られる試料(例えば、細胞の培養液や抽出されたtotal RNAなど)を含む。被検試料としては、より診断精度が上がるため、疾患部位から直接的に抽出された組織もしくは細胞、またはそれらから得られる試料を使用することが好ましい。
【0060】
上記検出の態様のひとつとして、上記癌診断マーカーまたは上記癌診断マーカー由来の派生物質に結合可能な物質を標識物質で標識し、リアルタイムPCRやノーザンブロッティング等に使用することができる。この標識は通常知られている方法により行うことが可能である。標識物質としては、蛍光色素、酵素、補酵素、化学発光物質、放射性物質などの当業者に公知の標識物質を用いることが可能であり、具体的な例としては、ラジオアイソトープ(32P、14C、125I、3H、131Iなど)、フルオレセイン、ローダミン、ダンシルクロリド、ウンベリフェロン、ルシフェラーゼ、ペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ、β-グルコシダーゼ、ホースラディッシュパーオキシダーゼ、グルコアミラーゼ、リゾチーム、サッカリドオキシダーゼ、マイクロペルオキシダーゼ、ビオチンなどを挙げることができる。標識物質としてビオチンを用いる場合には、ビオチン標識抗体を添加後に、アルカリホスファターゼなどの酵素を結合させたアビジンをさらに添加することが好ましい。
【0061】
また、本明細書において診断の方法としては、2種以上の診断マーカーを組み合わせて診断しても良い。そのように組み合わせて使用した場合、例えば、上記癌診断マーカーで癌であることが診断された被検試料に対して、さらに公知の診断マーカーで癌の種類を診断することが可能である。それとは逆に、公知の診断マーカーで癌であることが診断された被検試料に対して、さらに上記癌診断マーカーで肺癌または子宮頸癌であるかどうかを診断することも可能である。また、公知の診断マーカーを検査したときの結果と、上記癌診断マーカーを検査したときの結果を総合的に評価して癌を診断することができる。
【0062】
また、上記診断は癌の発症もしくは経過状況を検査するための診断、または癌の予後を検査するための診断であっても良い。通常、癌の発症前において何らかの癌診断を行わない場合、癌の種々の症状(例えば、出血、炎症、腫れ、しこり、患部の違和感等)が現れるまで気付かず、気付いた頃にはすでに手遅れになっているケースがある。従って、癌の発症もしくは経過状況を検査するための診断は、癌を早期発見でき効果的な癌治療を始めるための重要な診断である。また、癌に発症していることがわかった後も、種々の抗癌剤の効果を検証することや、癌の治療効果を検証するために、癌の経過状況を検査する診断が重要になってくる。また癌の予後とは、一般に、何らかの治療を行った後、病状がどのような経過をたどるかの予測や見通しのことである。癌の予後を検査するための診断の結果は、癌の治療計画の策定に有効な指標となる。
【0063】
また、上記癌診断マーカーを検出する工程を含む、癌抑制薬剤のスクリーニング方法を行えば、癌抑制薬剤をスクリーニングすることができる。特に、肺癌または子宮頸癌の癌抑制薬剤をスクリーニングすることができる。また、配列番号1の塩基配列または配列番号1の1070番目のGから3379番目のAの塩基配列を含むRNA鎖を、過剰発現している癌抑制薬剤をスクリーニングすることができる。このスクリーニングの具体的な操作手順は特に限定しないが、例えば、被験者に癌抑制薬剤の候補物質を投与前後の、上記癌診断マーカーの量の増減を測定することでスクリーニングが可能である。この場合、被験者に癌抑制薬剤の候補物質を投与後に上記癌診断マーカーの量が減少していれば、上記候補物質が癌抑制薬剤としての機能を有している可能性が高いといえる。
【0064】
図1は、癌診断用装置1000の全体構成を示した機能ブロック図である。癌診断用装置1000は、被検試料における上記癌診断マーカーの検出データを解析する癌診断マーカー解析装置100を備える。癌診断用装置1000は、癌診断マーカー解析装置100を操作するための操作部102を備える。癌診断用装置1000は、被験者由来の被検試料中の上記癌診断マーカーを検出する検出部104を備えている。
【0065】
また、癌診断用装置1000は、癌診断マーカー解析装置100から出力されるデータを画像表示する画像表示装置106を備える。癌診断用装置1000は、癌診断マーカー解析装置100から出力されるデータを印刷するプリンタ108を備える。癌診断用装置1000は、癌診断マーカー解析装置100から出力されるデータを受信するPC(パーソナルコンピュータ)110を備える。
【0066】
一方、癌診断マーカー解析装置100は、検出部104から入力される被検試料の癌診断マーカーの検出データを取得する取得部202を備える。癌診断マーカー解析装置100は、癌診断マーカーの検出強度に基づいてその癌診断マーカーの量を定量化する定量部204を備えている。
【0067】
また、癌診断マーカー解析装置100は、比較試料の定量データを格納する検出強度データベース206を備える。癌診断マーカー解析装置100は、被検試料の癌診断マーカーの定量データと、比較試料の定量データとを比較する、比較対照部208を備える。
【0068】
さらに、癌診断マーカー解析装置100は、癌診断マーカーの量が所定の閾値を越えているかどうかを判定する判定部210を備えている。癌診断マーカー解析装置100は、判定の結果を出力する出力部212を備えている。
【0069】
図2は癌診断用装置1000の動作を説明するためのフローチャートである。検出部102は、サーマルサイクラーと分光蛍光光度法を用いて、癌診断マーカーを検出し、検出データを生成する。この検出データは、被験者由来のtotal RNAに対して配列番号1の塩基配列を有する核酸に結合可能なDNAプライマーセットを用い、リアルタイムPCRを行うことで得られる。上記検出データは、リアルタイムPCRで所定の蛍光強度を示したときのサイクル数である。
【0070】
また、定量部204が、上記検出データを、癌診断マーカーの量を定量的に表すことのできる定量データに変換する。定量データとは、例えば癌診断マーカーの濃度である。この濃度は、サイクル数および癌診断マーカーを検出する際の初期条件から計算できる。
【0071】
また、比較対照部208が、被検試料の癌診断マーカーの定量データと、比較試料の定量データとを比較する。ここで比較試料の定量データは、検出強度データベース206から取得した非癌検体由来の癌診断マーカーの定量データを使用できる。この比較結果は、癌診断マーカーの定量データを100%に設定し、対する比較試料の定量データの百分率で表す。
【0072】
また、判定部210は、比較対照部208から上記比較結果を取得し、被検試料の癌診断マーカーの定量データが、所定の閾値を越えている場合、癌陽性と判定する。所定の閾値は、複数の非癌検体由来の癌診断マーカーの定量データの最高値とすることができる。
【0073】
また、出力部212は、判定部210から癌陽性または癌陰性の判定結果を装置の外部の画像表示装置106等に出力し、一連のフローが終了する。
【0074】
そして、この癌診断用装置1000は、肺癌、子宮頸癌、または上記癌診断マーカーが過剰発現している癌の診断に好適に使用できる。
【0075】
また、変形例として、検出部102は、RT-PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、または次世代シークエンサーを用いた方法で癌診断マーカーを検出し、検出データを生成しても良い。その場合、検出データはサイクル数ではなく、癌診断マーカーの濃度に比例した種々の数値で表される。加えて、定量部で検出データから変換される定量データも同様に癌診断マーカーの濃度に比例した種々の数値で表される。
【0076】
別の変形例として、定量部204で検出データから変換される定量データは、濃度のように単位を有するものでなくても良く、相対値であっても良い。
【0077】
別の変形例として、検出強度データベース206には過去に測定した別の被検試料の癌診断マーカーの定量データが格納されていても良い。この場合、比較対照部208が比較に使用するための比較試料の定量データは、過去に測定した別の被検試料の癌診断マーカーの定量データを使用することができる。そして、過去に癌陽性であると判定されたもので、さらに臨床医による精密検査でも癌陽性であると判定されたものについて、その定量データを格納しておけば、ポジティブコントロールとして利用できる。
【0078】
別の変形例として、比較対照部208で得られる比較結果は、癌診断マーカーの定量データと比較試料の定量データとの関係を表すものであれば、相対値で表すこともできる。
【0079】
別の変形例として、出力部212は、上記検出データ、被検試料の癌診断マーカーの定量データ、比較試料の定量データ、もしくはそれらの比較結果を表した表、またはサイクル数と蛍光強度の関係を示すプロット図を、画像表示装置106等に出力しても良い。
【0080】
別の変形例として、検出精度を上げるために、あらかじめ癌診断マーカーが存在しないことがわかっている試料を用いて、ネガティブコントロール実験を平行して行っていても良い。この場合、仮に被検試料の癌診断マーカーが所定の濃度を示したとしても、ネガティブコントロールが被検試料の癌診断マーカーに類似の濃度、または所定の濃度を示した場合、それらはノイズとする。
【0081】
また、検出部の動作を除いた以上の動作を実行可能なプログラムがインストールされたコンピュータは、被検試料を検出可能なリアルタイムPCRを実行できる装置と接続することで、肺癌、子宮頸癌、または上記癌診断マーカーが過剰発現している癌の診断に用いることができる。なお、上記コンピュータに接続する装置は、被検試料を検出可能であれば、RT-PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、または次世代シークエンサーを備えた装置であっても良い。
【0082】
<実施形態2:癌診断マーカーの検出物質>
本発明の他の実施形態は、配列番号1の塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質である。この核酸検出物質は、核酸に結合できる性質のものであればその種類は特に限定せず、ポリヌクレオチド、蛋白質、抗体、または低分子化合物などを含むが、特にポリヌクレオチドであることが好ましい。なぜならば、ポリヌクレオチドは核酸との結合特異性に優れ、安価または容易に製造でき、またリアルタイムPCRのような検出精度の高い診断手法に好適に使用できるためである。またポリヌクレオチドの中でも、DNA鎖であることが好ましい。なぜならば、安定性に優れ、より安価に製造できるためである。
【0083】
なお、本明細書において「核酸」とは、DNA塩基、RNA塩基またはそれらの等価物から構成されているものを含む。この等価物とは、例えばDNA塩基またはRNA塩基がメチル化等の化学修飾を受けているもの、または核酸アナログを含む。また、「DNA鎖」または「RNA鎖」とは、DNA塩基またはRNA塩基が2個以上連結した形態のことを表す。「塩基配列」とは核酸を構成する塩基の配列である。また、一般的に塩基配列は、A(アデニン)、G(グアニン)、C(シトシン)、T(チミン)によって表すことができる。例えば、代表的なデータベースであるNCBI Reference Sequenceにおいて、DNA鎖およびRNA鎖の塩基配列を表すときにA、G、C、Tが用いられている。なお、本明細書においてRNA鎖の塩基配列を表現する場合には、上記TをU(ウラシル)に読み換えるものとする。また、ヌクレオチドとは、一般的にA、G、C、T、またはUを含む。
【0084】
ここで、後述する実施例で配列番号1の塩基配列を含むmRNAが、肺癌または子宮頸癌で過剰発現していることが強く示唆されている。また、後述する実施例で配列番号1の塩基配列を含むmRNAは隣接正常細胞では発現が検出されず、肺癌または子宮頸癌における発現の特異性が高いことが強く示唆されている。そして、上記核酸検出物質はこのmRNAに結合できるため、肺癌または子宮頸癌の診断薬として好適に使用できる。また、後述する実施例で、上記mRNAから調整したcDNA(complementary DNA)に対して結合するプライマーを用いて、上記mRNAを検出または定量できることが強く示唆されている。従って、上記核酸検出物質はこのcDNAと結合することによっても、肺癌または子宮頸癌の診断薬として好適に使用できる。また、上記核酸検出物質は、同様に上記mRNAを過剰発現している癌の診断薬としても好適に使用できる。
【0085】
また、上記核酸検出物質は、配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質を含む。ここで、上記80%以上は、好ましくは配列番号1に対して85%以上の相同性を有しており、より好ましくは90%以上の相同性を有しており、より好ましくは95%以上の相同性を有しており、さらに好ましくは98%以上である。なぜならば、上記80%以上の相同性を有する塩基配列を含む核酸は、配列番号1の塩基配列を含む核酸に対して相同性が高いほど、配列番号1の塩基配列を含む核酸に近い性質を有していることになるからである。
【0086】
また、上記核酸検出物質は、配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質を含む。ここで、上記1若しくは数個とは、好ましくは30個であり、より好ましくは20個であり、より好ましくは15個であり、より好ましくは10個であり、より好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、上記1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含む核酸は、配列番号1の塩基配列を含む核酸に対して塩基の欠失、置換若しくは付加が少ないほど、配列番号1の塩基配列を含む核酸に近い性質を有していることになるからである。
【0087】
また、上記核酸検出物質は、配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列を含む核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質を含む。
【0088】
また、上記核酸検出物質は、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、または配列番号27の塩基配列を含む核酸であっても良い。これらの核酸は、後述する実施例で配列番号1のmRNAまたはそのcDNAにハイブリダイズし、PCR反応に使用できることが実証されている。そのため、これらの核酸は上記核酸検出物質として使用できる。また、上記ポリヌクレオチドとして好ましくは、配列番号2または配列番号3である。なぜならば、後述する実施例でリアルタイムPCRに使用できることが実証されており、さらには肺癌または子宮頸癌の癌診断に使用できることが実証されているためである。
【0089】
また、上記核酸検出物質は、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、または配列番号27の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列を含む核酸であっても良い。ここで、この1若しくは数個とは、好ましくは5個であり、より好ましくは4個であり、より好ましくは3個であり、より好ましくは2個であり、さらに好ましくは1個である。なぜならば、この核酸検出物質の塩基配列が、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、または配列番号27の塩基配列に対してより相同性の高い塩基配列であれば、後述する実施例で配列番号1のmRNAまたはそのcDNAにハイブリダイズできることが実証されているDNAプライマーに、より近い性質を有していることになるからである。
【0090】
また、上記「その核酸の一部」は、配列番号1の塩基配列の26番目のCから3379番目のAの塩基配列、配列番号1の塩基配列の130番目のAから3379番目のAの塩基配列、配列番号1の塩基配列の134番目のTから3379番目のAの塩基配列、配列番号1の塩基配列の136番目のAから3379番目のAの塩基配列、または配列番号1の塩基配列の157番目のTから3379番目のAの塩基配列(以下「配列番号1の塩基配列の26番目から3379番目等の塩基配列」と称することもある)、その配列番号1の塩基配列の26番目から3379番目等の塩基配列に対して80%以上の相同性を有する塩基配列、その配列番号1の塩基配列の26番目から3379番目等の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その配列番号1の塩基配列の26番目から3379番目等の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記配列番号1の塩基配列の26番目から3379番目等の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、この配列番号1の塩基配列の26番目から3379番目等の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記配列番号1の塩基配列の26番目から3379番目等の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0091】
また「その核酸の一部」は、配列番号1の1070番目のGから3379番目のAの塩基配列(以下「1070番目から3379番目の塩基配列」と称することもある)、その1070番目から3379番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から3379番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から3379番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から3379番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から3379番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から3379番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0092】
また「その核酸の一部」は、配列番号1の1070番目のGから3325番目のTの塩基配列(以下「1070番目から3325番目の塩基配列」と称することもある)、その1070番目から3325番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から3325番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から3325番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から3325番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から3325番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から3325番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0093】
また「その核酸の一部」は、配列番号1の1070番目のGから2997番目のCの塩基配列(以下「1070番目から2997番目の塩基配列」と称することもある)、その1070番目から2997番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から2997番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から2997番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から2997番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から2997番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から2997番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0094】
また「その核酸の一部」は、配列番号1の1070番目のCから2685番目のTの塩基配列(以下「1070番目から2685番目の塩基配列」と称することもある)、その1070番目から2685番目の塩基配列に対して80%以上の相同性を有する塩基配列、その1070番目から2685番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その1070番目から2685番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記1070番目から2685番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、1070番目から2685番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記1070番目から2685番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0095】
さらに「その核酸の一部」は、配列番号1の2451番目のCから2541番目のTの塩基配列(以下「2451番目から2541番目の塩基配列」と称することもある)、その2451番目から2541番目の塩基配列に対して80%以上の相同性を有する塩基配列、その2451番目から2541番目の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、その2451番目から2541番目の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を有する核酸を含む。上記2451番目から2541番目の塩基配列を有するmRNAは、後述する実施例で肺癌または子宮頸癌で特異的に過剰発現していることが強く示唆されている。従って、上記核酸検出物質は、2451番目から2541番目の塩基配列からなる核酸またはその相補鎖と結合することによっても、肺癌または子宮頸癌の診断薬として使用できる。また、同様に上記2451番目から2541番目の塩基配列を有するmRNAを過剰発現している癌の診断薬としても使用できる。
【0096】
加えて「その核酸の一部」の長さは特に限定しないが、PCRプライマーやプローブがハイブリダイズできる長さを有していることが好ましい。PCRプライマーやプローブがハイブリダイズできれば、リアルタイムPCRやノーザンブロット等の方法で上記「その核酸の一部」を検出できるためである。PCRプライマーやプローブは、一般的には、短すぎると特異性が失われることが知られており(PCR法最前線、関谷剛男ら、共立出版株式会社、31-39(1997))、遺伝子工学分野の研究では15個以上の塩基を含むPCRプライマーやプローブが使用されることが多い。そのため、上記「その核酸の一部」の長さは、好ましくは連続した15個以上のRNA塩基を含み、より好ましくは連続した20個以上のRNA塩基を含み、より好ましくは連続した25個以上のRNA塩基を含み、さらに好ましくは連続した30個以上のRNA塩基を含む。
【0097】
本明細書において「ポリヌクレオチド」は、複数のDNA塩基からなるDNA鎖、または複数のRNA塩基からなるRNA鎖を含む。また、PCRプライマーやプローブとして使用した場合に使用可能な長さであることが好ましい。PCRプライマーやプローブは、一般的には短すぎると特異性が失われる傾向があり、PCRプライマーやプローブとして適さないことが知られている(PCR法最前線、関谷剛男ら、共立出版株式会社、31-39(1997))。そのため、遺伝子工学分野の研究では15個以上の塩基を含むPCRプライマーやプローブが使用されることが多い。そのため、上記「ポリヌクレオチド」は少なくとも連続した15個以上のヌクレオチドを含むことが好ましい。また、より特異性を向上させるためには連続した18個以上であることが好ましく、連続した20個以上であることがより好ましく、連続した25個以上であることがさらに好ましい。なお、ポリヌクレオチドは、DNA/RNA合成装置を用いて合成可能である。その他、任意の塩基配列を設計後、DNAまたはRNA合成の受託会社(例えば、インビトロジェン株式会社やタカラバイオ株式会社等)から購入することもできる。
【0098】
本明細書において「結合する」とは、物質間の連結を意味する。連結は共有結合または非共有結合のいずれであってもよく、たとえば、イオン結合、水素結合、疎水性相互作用、または親水性相互作用が挙げられる。また、DNA鎖またはRNA鎖の間におけるハイブリダイズを含む。
【0099】
本明細書において「抗体」は、抗原上の特定のエピトープに特異的に結合することができる分子を指し、ポリクローナル抗体、モノクローナル抗体を含む。また、抗体は様々な形態で存在することができ、例えば、Fv、Fab、F(ab’)2、Fab’、diabody、一本鎖抗体(例えば、scFv、dsFv)、CDRを含むペプチド、多価特異的抗体(例えば、二価特異的抗体)、キメラ抗体、ヒト化抗体、またはヒト抗体などが挙げられる。また、既存の化学合成医薬品原体または医薬品製剤に結合した低分子抗体、もしくは糖鎖改変抗体の形態であってもよい。
【0100】
ポリクローナル抗体は、例えば、抗原に特異的なポリクローナル抗体を含む血清の産生を誘導するために、哺乳動物(例えば、ラット、マウス、ウサギ、ウシ、サル、ブタ、ウマ、ヒツジ、ヤギ、イヌ、ネコ、モルモット、ハムスターなど)や鳥類等に、目的の抗原を含む免疫原を投与することによって抗体を生成することが可能である。免疫プロトコルは、当該技術分野で公知であり、選択する動物宿主に伴い、免疫応答を誘発する任意の方法によって実施される場合がある[タンパク質実験ハンドブック, 羊土社(2003):86-91.]。
【0101】
また、モノクローナル抗体は、実質的に均一な抗体の集団から得られる抗体を指す。すなわち、集団を構成する個々の抗体が、少量存在しうる自然に生じることが可能な突然変異を除いて、同一であるものを含む。一般的にモノクローナル抗体は高度に特異的であり、異なるエピトープに対応する異なる抗体を典型的に含む通常のポリクローナル抗体とは異なり、各モノクローナル抗体は抗原の単一のエピトープに対応する。また、モノクローナル抗体は、[Kohler G, Milstein C., Nature. 1975 Aug 7;256(5517):495-497.]に掲載されているようなハイブリドーマ法と同様の方法によって作ることができる。あるいは、米国特許第4816567号に記載されているような組換え法と同様の方法によって作ることができる。または、 [Clackson et al., Nature. 1991 Aug 15;352(6336):624-628.]もしくは[Marks et al., J Mol Biol. 1991 Dec 5;222(3):581-597.]に記載されているような技術と同様の方法を用いてファージ抗体ライブラリから単離してもよい。
【0102】
<実施形態3:癌診断マーカー蛋白質およびその検出物質>
本発明の他の実施形態は、マウスNKX1-2オルソログ蛋白質を含む、癌診断マーカーである。マウスNKX1-2オルソログ蛋白質をコードするRNA鎖は、後述する実施例において、肺癌または子宮頸癌で過剰発現することが強く示唆されている。従って、肺癌または子宮頸癌の細胞では、マウスNKX1-2オルソログ蛋白質をコードするRNA鎖が過剰に存在するために、マウスNKX1-2オルソログ蛋白質の翻訳が促進され、通常の細胞よりも多くのマウスNKX1-2オルソログ蛋白質が存在するものと考えられる。また、後述する実施例でマウスNKX1-2オルソログ蛋白質をコードするRNA鎖は、隣接正常細胞では発現が検出されず、肺癌または子宮頸癌における発現の特異性が高いことが強く示唆されている。そのため、マウスNKX1-2オルソログ蛋白質を含む癌診断マーカーは、肺癌または子宮頸癌の癌診断のためのマーカーとして好適に使用できる。また、上記癌診断マーカーは、同様に上記RNA鎖を過剰発現している癌の診断薬としても使用できる。
【0103】
また、上記マウスNKX1-2オルソログ蛋白質は、配列番号28のアミノ酸配列、配列番号28のアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列、配列番号28のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、配列番号28のアミノ酸配列をコードする塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列にコードされるアミノ酸配列、からなる群から選ばれる1種以上のアミノ酸配列を含んでいても良い。この場合、マウスNKX1-2オルソログ蛋白質は、後述する実施例において肺癌または子宮頸癌で特異的に過剰発現することが強く示唆されているmRNAにコードされているアミノ酸配列を含む。そのため、この癌診断マーカーは、肺癌、子宮頸癌または上記mRNAを過剰発現している癌の診断のためのマーカーとして好適に使用できる。なお、上記マウスNKX1-2オルソログ蛋白質は配列番号28のアミノ酸配列に対してより相同性の高いアミノ酸配列であることが好ましい。なぜならば、上記マウスNKX1-2オルソログ蛋白質は、配列番号28のアミノ酸配列を含む蛋白質に対して相同性が高いほど、配列番号28のアミノ酸配列を含む蛋白質に近い性質を有していることになるからである。
【0104】
なお、上記マウスNKX1-2オルソログ蛋白質のアミノ酸配列が、配列番号28のアミノ酸配列に対して1若しくは数個の置換がある場合には、アミノ酸側鎖の性質が保存されている別のアミノ酸に置換していることが好ましい。例えばアミノ酸側鎖の性質としては、疎水性アミノ酸(A、I、L、M、F、P、W、Y、V)、親水性アミノ酸(R、D、N、C、E、Q、G、H、K、S、T)、脂肪族側鎖を有するアミノ酸(G、A、V、L、I、P)、水酸基含有側鎖を有するアミノ酸(S、T、Y)、硫黄原子含有側鎖を有するアミノ酸(C、M)、カルボン酸及びアミド含有側鎖を有するアミノ酸(D、N、E、Q)、塩基含有側鎖を有するアミノ離(R、K、H)、および、芳香族含有側鎖を有するアミノ酸(H、F、Y、W)を挙げることができる(括弧内はいずれもアミノ酸の一文字標記を表す)。これらの各グループ内のアミノ酸同士の置換は保存的置換と総称される。あるアミノ酸配列に対する1または複数個のアミノ酸残基の欠失、付加、または他のアミノ酸による置換により修飾されたアミノ酸配列を有するポリペプチドがその生物学的活性を維持することはすでに知られている(Mark et al., Proc Natl Acad Sci U S A. 1984 Sep;81(18):5662-5666.、Zoller et al., Nucleic Acids Res. 1982 Oct 25;10(20):6487-6500.、Wang et al., Science. 1984 Jun 29;224(4656):1431-1433.)。
【0105】
本発明の他の実施形態は、上記マウスNKX1-2オルソログ蛋白質を含む癌診断マーカーに結合する蛋白質検出物質である。この蛋白質検出物質は、上記のマウスNKX1-2オルソログ蛋白質を検出できるため、肺癌、子宮頸癌または上記マウスNKX1-2オルソログ蛋白質をコードするRNA鎖を過剰発現している癌の診断薬として使用できる。なお、この蛋白質検出物質は、蛋白質に結合できる性質のものであればその種類は特に限定せず、ポリヌクレオチド、蛋白質、抗体、または低分子化合物などを含むが、特に抗体であることが好ましい。なぜならば、抗体は蛋白質との結合特異性に優れ、また免疫測定法のような一般的な蛋白質の検出手法に好適に使用できるためである。
【0106】
本発明の他の実施形態は、マウスNKX1-2オルソログ蛋白質をコードする核酸もしくはその核酸の一部、またはそれらの相補鎖と結合する核酸検出物質である。この核酸検出物質は、核酸に結合できる性質のものであればその種類は特に限定せず、ポリヌクレオチド、蛋白質、抗体、または低分子化合物などを含む。ここで、マウスNKX1-2オルソログ蛋白質をコードするRNA鎖は、後述する実施例において、肺癌または子宮頸癌で特異的に過剰発現することが強く示唆されている。そのため、上記核酸検出物質は肺癌または子宮頸癌の診断薬として使用できる。また、上記核酸検出物質は、同様に上記RNA鎖を過剰発現している癌の診断薬としても使用できる。
【0107】
本明細書においてマウスNKX1-2オルソログ蛋白質とは、ホメオドメインを持ち、マウスのNKX1-2蛋白質にアミノ酸配列で50%以上の相同性を有する蛋白質を表す。マウスのNKX1-2蛋白質のアミノ酸配列は、National Center for Biotechnology Information(NCBI)のデータベースであるGenBank等で参照できる。マウスのNKX1-2遺伝子は、例えば[Hong et al., Gene. 1997 Oct 1;198(1-2):373-8.]や[Rovescalli et al., Proc Natl Acad Sci U S A. 2000 Feb 29;97(5):1982-7.]にその様態が記載されている。また、ホメオドメインとは、DNAに結合しうる蛋白質部位をコードする領域のことであり、酵母からヒトに至るまで事実上すべての真核生物で存在することが知られている(細胞の分子生物学(第3版)、教育社、409-410(1995/06))。
【0108】
<実施形態4:癌診断薬>
本発明の他の実施形態は、上記核酸検出物質または蛋白質検出物質を含む癌診断薬である。この癌診断薬は上記核酸検出物質または蛋白質検出物質を有しているため、肺癌または子宮頸癌を診断するために好適に使用できる。また、配列番号1の塩基配列、配列番号1の塩基配列に対して80%以上の相同性を有する塩基配列、配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、からなる群から選ばれる1種以上の塩基配列を含むmRNA、またはその一部が過剰発現している癌の診断薬としても好適に使用できる。
【0109】
本明細書において「診断薬」とは、被検者の疾患もしくは疾患可能性の診断、または被験者由来の被検試料における疾患関連物質の検査に関して使用可能な物質を表す。また、本明細書において癌診断薬の使用方法は特に限定しないが、例えば、被検者由来の被検試料において、上記核酸検出物質または蛋白質検出物質を用いて癌で特異的に過剰発現しているmRNAを検出することで癌の診断ができる。
【0110】
また、上記癌診断薬は上記癌診断薬を含む癌診断用キットとして使用できる。この癌診断用キットは、上記癌診断薬によって診断できる癌を診断するために好適に使用できる。なおこの癌診断用キットは、上記癌診断薬を癌診断に用いる際の使用方法もしくは使用例を記載した指示書、その指示書の所在を記載した文面、または種々のバッファーを含んでいても良い。
【0111】
以上、本発明の実施形態について述べたが、これらは本発明の例示であり、上記以外の様々な構成を採用することもできる。
【実施例】
【0112】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【0113】
<実施例1:リアルタイムPCRによるmRNAの検出>
Applied Biosystems社から購入した肺、子宮頸、肝臓、子宮、大腸、前立腺、肝臓、またはリンパの腫瘍組織由来のtotal RNA(以下「被検試料」と称することもある)と、隣接正常組織由来のtotal RNA(以下「正常試料」と称することもある)を購入し、リアルタイムPCRによるmRNAの組織特異的な過剰発現の検出に用いた。
【0114】
(1−1)RNAの逆転写
QuantiTect Rev. Transcription Kit(QUIAGEN)を用いて、被検試料および正常試料に対して逆転写反応を行い、被検試料由来のcDNAと正常試料由来のcDNAを合成した。この逆転写反応にはランダムプライマーを用いて行った。反応時間等はキットのプロトコール通りに行った。
【0115】
(1−2)リアルタイムPCR
LightCycler480 SYBR Green I Master(Roche)を用いて、被検試料由来のcDNAと正常試料由来のcDNAに対してリアルタイムPCRを行った。プライマーはSCpair67633_Lプライマー:CCTTGCCACTTTTGCTTGGA(配列番号2)およびSCpair67633_Rプライマー:ACTGGGGACCTCTGGGTTTCT(配列番号3)を使用した。また、cDNAの確認と定量に使用するために内在性の遺伝子GAPDHに対するリアルタイムPCRも同時に行った。反応時間等はキットのプロトコール通りに行った。
【0116】
リアルタイムPCRの結果を表1に示す。肺の腫瘍組織において、リアルタイムPCRの29サイクル目に増幅されたcDNAが確認された。そのcDNAの量を100%としたとき、子宮頸の腫瘍組織は112%、肝臓の腫瘍組織は0.50%、子宮の腫瘍組織は0.80%であった。その他の腫瘍組織、隣接正常組織では検出されなかった(表1中ではnonと記す)。
【0117】
【表1】

【0118】
(1−3)結果の考察
上記の結果より、肺と子宮頸の腫瘍組織において、過剰発現しているmRNAの存在が明らかになった。従って、この過剰発現しているmRNAは、肺癌と子宮頸癌を検出するための診断マーカーとなると考えられる。
【0119】
またこのmRNAは、隣接正常組織において検出されていない。このことは、隣接正常組織においてmRNAの発現量が極めて少ないか、またはmRNAが存在していないことを意味する。従って、このmRNAは特異性の高い高精度の診断マーカーであるといえる。高精度の診断マーカーであることは、例えば、癌の陰性または陽性を診断する際に、隣接正常細胞由来の偽陽性を発生しにくくする効果がある。加えて、SCpair67633_LプライマーおよびSCpair67633_Rプライマーは、その診断マーカーを検出するための優れた検出試薬となり得る。
【0120】
<実施例2:mRNAの配列解析>
実施例1の過剰発現しているmRNAのRNA配列を調査した。なお、ヒトのゲノムDNAにおいては、上記のSCpair67633_LプライマーとSCpair67633_Rプライマーに対応するDNA配列の上流には、マウスNKX1-2オルソログ蛋白質をコードする遺伝子(以下マウスNKX1-2オルソログ遺伝子と称することもある)が存在する(図3)。また、SCpair67633_LプライマーとSCpair67633_Rプライマーに対応するDNA配列の下流には、ポリAシグナル(AATAAA)が存在する。ヒトのゲノムDNA配列は、National Center for Biotechnology Information(NCBI)のデータベースであるGenBank等で参照できる。
【0121】
(2−1)mRNAの転写開始点の解析
実施例1の過剰発現しているmRNAについて、5’RACE法を用いて転写開始点を調べた。まず、ヒト胎児腎臓由来細胞株のHEK293から、TRIzol試薬(invitrogen)を用いてtotal RNAを抽出した。抽出操作はTRIzol試薬のプロトコール通りに行った。具体的には、グアニジンイソチオシアネート/フェノール/クロロホルムによってRNAだけを分離し、イソプロパノールにより沈殿回収を行った。
【0122】
次に、GeneRacer Kit(インビトロジェン株式会社)を使用しキットのプロトコール通りに5‘RACE法を行った。具体的には、以下のように行った。GeneRacer Kitマニュアル記載の条件で、上記のTotal RNAに対してCIP処理し、次にTAP処理し、GeneRacer RNA Oligoを付加させた。そして、SuperScript III RTで逆転写反応を行った。このとき、プロトコールに記載のGeneRacer Oligo dT primerに変えてキット付属のGeneRacer Random primerを使用した。
【0123】
さらに、GeneRacer 3' primerとForward GSPを用いてのPCR、GeneRacer 3' Nested primerとForward Nested GSPを用いてのNested PCRを実施した。このとき、Reverse GSP primerにはAAGGCCACCAGCTGCTCGTAGGTGAA(配列番号4)のDNAプライマーを、Reverse GSP nested primerにはAGGGTCCCTGGAGCTGGCATCTTTCC(配列番号5)のDNAプライマーを使用した。また、変異導入を避けるために正確性の高い耐熱性酵素を使用した。PCR産物をアガロースゲル電気泳動に供し、サイズ、収量およびシングルバンドであるか否かを確認した。サイズの異なるRACE productが確認された場合には、Alternative splicingの可能性もあるので3つのフラグメントまでをクローニングした。
【0124】
次に、PCR4Blunt-TOPOへクローニングした。そして、得られたクローンのインサートサイズを確認し、目的のインサートをもつと思われるRecombinantクローンについてインサート全DNA配列の解析を実施した。その結果、CCCGAGCCCAGGCAAGCGGCCGCGGCACAGCGCCTGATAGTCCCGAGGCTGGCCCGGGCTGCGCCGGTGCCAATCGGCGCGCAGCCCCCCGCGGCGCTCTCCCCGCCCCGCCTCCCCGCCCCCCTCCCCAGCTTCACTTGGCAGCGCGGACCCGGCTCCTGGCTGGAAAGCTACCGCCAAGCCACAGCCGAAGGCAAGCCCGAGCGGCGCCATCCCCAACCCCGCGCCGCCGACCGCCGGCCCGTGGGCGACGGGCATGCTGGCATGGCAGGACGGCGGGGCCAAGGCGGCTCCCTCCCACCACAAGATTTCTTTCTCTGTCCTGGACATCCTGGACCCACAGAAATTCACCCGCGCAGCGCTCCCTGCCGTGCGCCCGGCTCCCCGGGAAGCCAGGAAAAGTTTGGCGGAGGTCGAAGCGGGGAAAGATGCCAGCTCCAGGGACCCTGTCCGACAGCTGGAGACCCCTGATGCTGCGGGCCCAGGCGCCGGCCAGGCGTCCCCCCTGGAGGGTTCCGAGGCGGAAGAGGAGGAGGATGCGGAGGATCCGAGGAGGCCGCGGCTGCGGGAGCGGGCTGCGCGCTTGCTGCCGGGCCTAGCGCGCTCACCTGACGCCCCGGCCGGGGCATTGGCGTCTGGGGAGCCCTGCGAGGACGGCGGGGGCGGCCCTGTGAGGTCCCCCCCGGGATCCCCCGGCTCCCCGCGTCCCAGGCGCCGGCGCCTGGAGCCCAACTGCGCCAAGCCGCGGCGCGCGCGCACCGCC(配列番号29)からなる763bpのcDNAの配列が明らかになった。この763bpのcDNAのうち、5’末端から257番目、258番目、259番目のA、T、GがマウスNKX1-2オルソログ遺伝子の開始コドンである(上記789bpのcDNAの配列中、開始コドンの塩基を下線で示す)。
【0125】
またこのDNA配列解析の結果、上記789bpのcDNAとは別に、この789bpのcDNAと比較して5’末端側の塩基の25bp、129bp、133bp、135bp、または156bpが欠失しているクローンが5種類存在していた(上記789bpのcDNAの配列中、欠失しているクローンの5’末端の塩基を下線で示す)。これは、マウスNKX1-2オルソログ蛋白質をコードするmRNAは、転写開始点に少なくとも6つのバリエーションが存在するためと考えられる。
【0126】
一方で、この789bpのcDNAを、ヒトのゲノムDNAのマウスNKX1-2オルソログ蛋白質をコードする領域と比較した。すると、ヒトのゲノムDNAのマウスNKX1-2オルソログ蛋白質をコードする領域には、1582bpからなるイントロンが存在することがわかった。イントロンの該当箇所は、上記の789bpのcDNAの5’末端から470番目のGと471番目のAの間であった。
【0127】
また、このイントロンに相当するDNA配列内に対応するプライマーである、151_Lプライマー:TCAAACCCCCTTTCCCTGTCT(配列番号30)および151_Rプライマー:AGAGTTTCAGATTTGTGCGGGG(配列番号31)を用いて、リアルタイムPCRを行った。加えて、上記イントロンに相当するDNA配列内に対応するプライマーである、147_Lプライマー:TGTTCACCGACCCCTTCTCC(配列番号32)、および上記イントロンよりも下流のDNA配列に対応するプライマーである、147_Rプライマー:CTCCGCATCCTCCTCCTCTTC(配列番号33)を用いて、リアルタイムPCRを行った。その結果、いずれのリアルタイムPCRにおいても、DNAの増幅は見られなかった。即ち、このリアルタイムPCRの結果からも、上記の789bpのcDNAの5’末端から470番目のGと471番目のAの間に、イントロンが存在することが支持される。
【0128】
なお、mRNA上における、マウスNKX1-2オルソログ遺伝子に相当する位置、ポリAシグナル、イントロンに相当する位置、および本実施例で用いた主なプライマー等の位置関係を図4に示す。
【0129】
(2−2)mRNAの転写終結点の解析
(2−2−1)ポリAシグナルより上流
上述のTotal RNAを鋳型として、116_Lプライマー:GCCAATGTCCTCTTCCCGTC(配列番号6)と20_Rプライマー:AGGATTTGGTTGGAAAGCCACT(配列番号9)を用いたRT-PCR(Reverse Transcription PCR)を行った(図4)。116_LプライマーはマウスNKX1-2オルソログ遺伝子内にあって、終始コドン(TGA)近傍のDNA配列に相補的なプライマーである。20_RプライマーはポリAシグナルから28塩基隔てた上流のDNA配列に相補的なプライマーである。
【0130】
その結果、約2310bpのDNAの増幅が確認できた。これは、ヒトのゲノムDNAに存在する、116_Lプライマーに相補的なDNA配列から、20_Rプライマーに相補的なDNA配列の間の長さに等しい。即ち、ヒトのゲノムDNAにおいて、この間に転写終結点はなく、DNAはすべて転写されていると考えられる。そして、ヒトのゲノムDNAの塩基配列から推定される16_Lプライマーと20_Rプライマーの間のmRNAの塩基配列は、GCCAATGTCCTCTTCCCGTCCGCCGCCTCCTTCCCGCTGACGGCTGCCGCCCCCGGGAGCCCTTTCGCGCCGTTCCTTGGGCCTTCCTACCTGACCCCCTTCTACGCCCCGCGTCTATGAATCCGGAGCCCCCTGGCCCCTCTTTCGCGGGATTCACGAGGGATTGGCATCGTCGTGTGCCCTCGGCTCCTCCACCGGGGGTGCAGGTGCGCGGGTGTCAGCGCACCCCTGCCCGCCGCGCGCACCCGCGATCCTCGCGGGCCACCAAGGGGTCAGGGATCTGCCGTCCTTCAAAGTGTCCGGGGACGGAGGCTGACCTCAAGCCTTGCCGTTTCTGGACCTTGCTGTTCACTTTGGGTCAGGTTTAATTCAGTTCAGGGGCTAGTTTTTGAGGGTCTGGGTGTTCGGCGCGGGGCTAACCAAGATGCCAGGAGGGAAATACAGGGAGCAGAGACGCCCTGGCTGCCAGCTGCTGGCGGCTAGGATGGAACCTTTAAAGGTGCTGGCTCATCAGAGGGTGAGAAACAGTCTCTGTTCACAACTGACAGCTTCCCCTCCTCGTGCTCGATGGTTCAGCCCAAACCCAGAGAGTTCTTCCAAATCCTGAACGAGGCTGGGGAGAGCTTGGTCCTGGAGCACAGACGGCCGCTCTGAAACGGACTATTTTTAAAATGCATAAAACTCCACATTTCTAGATCTTTACTTAAGATTCGGACTGGAACACAATACTTGTTCCAAATAACCTCCCCAGGCTATTCCTGAGAGAGGGGGTACCTTGGTTTTTGGAGTAGGCCAGAAGTTTGTGGTAGGAAAGGTGACTGATTTGCAGCTAGACTCACCTGCTAAAGTAGACACGGGTCTGTTGCACTGCAGGTTTTGAGAACAGCCTGGACCAAACCACACAGTGACCCCAAAGGCATAAAAATGATAATGAAGGCAGCGATGGCTCAACTAATATCATGAAGTCTATGCATGAGGCTGCCTACTTTGATTTGCAGTAGTTGATACTTTAAAACTTCAGTCCTGGCTTATCTGCCTGTCCCAGGGATTCCTGGGCTCCCAATAGTGAGCCAGGATGGGGAAGAGCTAGCTCCATCAGCACACACTACATGTGGACAGTTGGACTGGACTGTTTTTTAAAAGCACAAACTCAACATTTTTAGATCTTCGTCTAGGATTCTGACTTGAAAACAATTCTTGTTACAAACAGACTCTTTATGGTGGTGAACAAGCAGAGATTGTAAGGGCCCATGAAAGCAATACTTGGGTGTGAAGAGCCGTCATATTCCTAATGGATTCACCTCCAGGAATCTGATACATGGACATGCATTTTAACTGCTGCTTTTATTACCTCCCTTAAAAAATTAGTTCTGTGAAATTCCCTTGCCACTTTTGCTTGGAATACATTTCCTTTAGTTTTCTACCTAATATAATCTTGTAGCCCACGTCTCAGAAACCCAGAGGTCCCCAGTTGTGTCATGTATGTTTCATTCTCACTTTTGATTACTTGAGGCCAGCCGAGATCTGTGTGGATACCATATTCCTTGCTATTTTTTGGTAGCCTGTGCTACTAACAATCAAATTTAATGGTCAATGGCTTCAAAGTAAAGCACCCTGTTTGGTATTATGGATTACATTCCATGACTATGATCTTGAAATATCTAGTTCTGTTATCAGGAATGATAGAAAATATTCCCCATTTCTCCTAAATTAAGTGAAGACTTCATGGTTCATGTGACTCTCATAATATTTGATAGTATGTATTATTTAATTACTTAATATCCACTAATTAGACTCTTTTCCTTCTAAAGAAGAATGTCCCCCAAACAACACATTGTAACTTTCTAAAAGACAGTTGGTGCCAGATGAGATTAAAAATGCAGTTACTCTACTAGATAATATTCACCTTACACTTCGGTAAACACTCCTTTAATAACTATTTGTTGGTTTCTCAAAAGCAATATCCCATATTAAACAGACAATTCAAATGTGACAATTCCTCTGTAACAAAGAAGCTGAATTCTGTAATAAATGGGAAACATTTCATTCCAGTCTTCTCAGGTACCAGAATCATGGACTTCAGTAGAAGAGAGGGAATAGGGAGAGAGGTGGGAGGCTGATCTGTTCGTGGCCCAGCACGGTGCTGTAATTCCTGACCCTTCTGGTTTCCACAGATCATTGCAGAGTAATGCTTGAAGCGTGTGACTTTGGACTTCTGCTGCTTTAAAAGGCCCAGTGGCTTTCCAACCAAATCCT(配列番号29)の2256bpである。
【0131】
また、上記の20_Rプライマーに変えて、37_Rプライマー:GGAGTGTTTACCGAAGTGTAAGGTGA(配列番号11)、51_Rプライマー:AGGGTGCTTTACTTTGAAGCCATT(配列番号13)、96_Rプライマー:GCCTGGGGAGGTTATTTGGAAC(配列番号19)、または116_Rプライマー:GGTCAGGTAGGAAGGCCCAAG(配列番号7)を使用した場合においても、ヒトのゲノムDNAにおいて対応する長さに等しいDNAの増幅が確認できた(上記2256bpのcDNAの配列中、上記プライマーの配列を下線で示す)。
【0132】
また、表2に記載のプライマーをID毎にセットで使用した場合もDNAの増幅が確認できた。表2に記載のプライマーは、転写開始点より下流であり、イントロンに相当する領域を含まず、且つポリAシグナルより上流に位置するように設計したプライマーである。表2中、IDの末尾にLがあるものがフォワードプライマー、IDの末尾にRがあるものがリバースプライマーである。
【0133】
【表2】

【0134】
(2−2−2)ポリAシグナルより下流
ヒトのゲノムDNAにおいて、SCpair67633_LプライマーとSCpair67633_Rプライマーに対応するDNA配列のさらに下流には、ポリAシグナル(AATAAA)が存在する。一般的に、このポリAシグナルが存在すると、20塩基程度下流で転写が終結することが知られている。
【0135】
また、ヒトのゲノムDNAには、マウスNKX1-2オルソログ遺伝子の偽遺伝子と思われる領域が2種類確認できる。2種類の偽遺伝子はX染色体q23と、11番染色体p12に存在する。偽遺伝子とは、一般的にはかつては遺伝子産物をコードしていたが、現在はその機能を失っていると考えられているものである。形成方法にはいくつかあるが、ひとつの方法としては、機能している遺伝子から転写されたmRNAの3’末端から、レトロポゾンの逆転写酵素によって作られたcDNAがゲノム内に挿入されてできたとされている。このゲノム内に挿入されてできた偽遺伝子は、mRNAを経てできているため、この偽遺伝子の配列からmRNAの転写終結点が予測できる。
【0136】
ここで、上記のポリAシグナルおよびその下流のDNA配列と、2種類の偽遺伝子の配列を比較すると、DNA配列5’AATAAATTCTTTTTGTAGTAAATTTA3’(以下「類似していたDNA配列」と称することもある)が類似していた。そして、この類似していたDNA配列の3’末端より下流は類似していなかった。さらに、この類似していたDNA配列の3’末端はポリAシグナルの20塩基下流に位置している。従って、この類似していたDNA配列の3’末端が転写終結点であると考えられる。
【0137】
さらに、上記の類似していたDNA配列の3’末端の、さらに下流に設計したSCpair67633_dw_Lプライマー:CCCCAAAACAGCCTGGTAGGT(配列番号34)、およびSCpair67633_dw_Rプライマー:GCTCCTCGGCTATGTGGTTTC(配列番号35)を用いてリアルタイムPCRを行った。その結果、DNAの増幅がみられなかった。さらに、上記の類似していたDNA配列の3’末端をまたぐように設計した14_Lプライマー:TCCTTAGACTCAATCTATTGGTGTGTTTG(配列番号36)、および14_Rプライマー:TGAAAGCATTGCTAATAGAGAACAAGG(配列番号37)でリアルタイムPCRを行った場合も、DNAの増幅がみられなかった。従って、これらのリアルタイムPCRの結果からも、上記の類似していたDNA配列の3’末端が転写終結点であることが支持される。
【0138】
(2−3)mRNAの配列解析のまとめ
以上の結果より転写開始点、イントロン、転写終結点の位置を設定し、公開されているゲノムDNAの塩基配列を参照すると、実施例1の過剰発現しているmRNAの塩基配列はCCCGAGCCCAGGCAAGCGGCCGCGGCACAGCGCCTGATAGTCCCGAGGCTGGCCCGGGCTGCGCCGGTGCCAATCGGCGCGCAGCCCCCCGCGGCGCTCTCCCCGCCCCGCCTCCCCGCCCCCCTCCCCAGCTTCACTTGGCAGCGCGGACCCGGCTCCTGGCTGGAAAGCTACCGCCAAGCCACAGCCGAAGGCAAGCCCGAGCGGCGCCATCCCCAACCCCGCGCCGCCGACCGCCGGCCCGTGGGCGACGGGCATGCTGGCATGGCAGGACGGCGGGGCCAAGGCGGCTCCCTCCCACCACAAGATTTCTTTCTCTGTCCTGGACATCCTGGACCCACAGAAATTCACCCGCGCAGCGCTCCCTGCCGTGCGCCCGGCTCCCCGGGAAGCCAGGAAAAGTTTGGCGGAGGTCGAAGCGGGGAAAGATGCCAGCTCCAGGGACCCTGTCCGACAGCTGGAGACCCCTGATGCTGCGGGCCCAGGCGCCGGCCAGGCGTCCCCCCTGGAGGGTTCCGAGGCGGAAGAGGAGGAGGATGCGGAGGATCCGAGGAGGCCGCGGCTGCGGGAGCGGGCTGCGCGCTTGCTGCCGGGCCTAGCGCGCTCACCTGACGCCCCGGCCGGGGCATTGGCGTCTGGGGAGCCCTGCGAGGACGGCGGGGGCGGCCCTGTGAGGTCCCCCCCGGGATCCCCCGGCTCCCCGCGTCCCAGGCGCCGGCGCCTGGAGCCCAACTGCGCCAAGCCGCGGCGCGCGCGCACCGCCTTCACCTACGAGCAGCTGGTGGCCTTGGAGAACAAGTTCCGGGCCACGCGCTACCTGTCAGTGTGCGAGCGCCTGAACCTCGCGCTGTCTCTCAGCCTCACCGAGACGCAGGTCAAAATCTGGTTCCAGAATCGCAGGACCAAGTGGAAGAAGCAGAACCCGGGTGCCGACGGCGCGGCGCAGGTGGGGGGTGGCGCGCCCCAGCCAGGGGCGGCGGGGGGCGGCGGCGGCGGCGGCTCGGGGGGCAGTCCTGGCCCTCCCGGCACCGGCGCTCTGCACTTCCAGACTTTCCCCTCCTACTCCGCGGCCAATGTCCTCTTCCCGTCCGCCGCCTCCTTCCCGCTGACGGCTGCCGCCCCCGGGAGCCCTTTCGCGCCGTTCCTTGGGCCTTCCTACCTGACCCCCTTCTACGCCCCGCGTCTATGAATCCGGAGCCCCCTGGCCCCTCTTTCGCGGGATTCACGAGGGATTGGCATCGTCGTGTGCCCTCGGCTCCTCCACCGGGGGTGCAGGTGCGCGGGTGTCAGCGCACCCCTGCCCGCCGCGCGCACCCGCGATCCTCGCGGGCCACCAAGGGGTCAGGGATCTGCCGTCCTTCAAAGTGTCCGGGGACGGAGGCTGACCTCAAGCCTTGCCGTTTCTGGACCTTGCTGTTCACTTTGGGTCAGGTTTAATTCAGTTCAGGGGCTAGTTTTTGAGGGTCTGGGTGTTCGGCGCGGGGCTAACCAAGATGCCAGGAGGGAAATACAGGGAGCAGAGACGCCCTGGCTGCCAGCTGCTGGCGGCTAGGATGGAACCTTTAAAGGTGCTGGCTCATCAGAGGGTGAGAAACAGTCTCTGTTCACAACTGACAGCTTCCCCTCCTCGTGCTCGATGGTTCAGCCCAAACCCAGAGAGTTCTTCCAAATCCTGAACGAGGCTGGGGAGAGCTTGGTCCTGGAGCACAGACGGCCGCTCTGAAACGGACTATTTTTAAAATGCATAAAACTCCACATTTCTAGATCTTTACTTAAGATTCGGACTGGAACACAATACTTGTTCCAAATAACCTCCCCAGGCTATTCCTGAGAGAGGGGGTACCTTGGTTTTTGGAGTAGGCCAGAAGTTTGTGGTAGGAAAGGTGACTGATTTGCAGCTAGACTCACCTGCTAAAGTAGACACGGGTCTGTTGCACTGCAGGTTTTGAGAACAGCCTGGACCAAACCACACAGTGACCCCAAAGGCATAAAAATGATAATGAAGGCAGCGATGGCTCAACTAATATCATGAAGTCTATGCATGAGGCTGCCTACTTTGATTTGCAGTAGTTGATACTTTAAAACTTCAGTCCTGGCTTATCTGCCTGTCCCAGGGATTCCTGGGCTCCCAATAGTGAGCCAGGATGGGGAAGAGCTAGCTCCATCAGCACACACTACATGTGGACAGTTGGACTGGACTGTTTTTTAAAAGCACAAACTCAACATTTTTAGATCTTCGTCTAGGATTCTGACTTGAAAACAATTCTTGTTACAAACAGACTCTTTATGGTGGTGAACAAGCAGAGATTGTAAGGGCCCATGAAAGCAATACTTGGGTGTGAAGAGCCGTCATATTCCTAATGGATTCACCTCCAGGAATCTGATACATGGACATGCATTTTAACTGCTGCTTTTATTACCTCCCTTAAAAAATTAGTTCTGTGAAATTCCCTTGCCACTTTTGCTTGGAATACATTTCCTTTAGTTTTCTACCTAATATAATCTTGTAGCCCACGTCTCAGAAACCCAGAGGTCCCCAGTTGTGTCATGTATGTTTCATTCTCACTTTTGATTACTTGAGGCCAGCCGAGATCTGTGTGGATACCATATTCCTTGCTATTTTTTGGTAGCCTGTGCTACTAACAATCAAATTTAATGGTCAATGGCTTCAAAGTAAAGCACCCTGTTTGGTATTATGGATTACATTCCATGACTATGATCTTGAAATATCTAGTTCTGTTATCAGGAATGATAGAAAATATTCCCCATTTCTCCTAAATTAAGTGAAGACTTCATGGTTCATGTGACTCTCATAATATTTGATAGTATGTATTATTTAATTACTTAATATCCACTAATTAGACTCTTTTCCTTCTAAAGAAGAATGTCCCCCAAACAACACATTGTAACTTTCTAAAAGACAGTTGGTGCCAGATGAGATTAAAAATGCAGTTACTCTACTAGATAATATTCACCTTACACTTCGGTAAACACTCCTTTAATAACTATTTGTTGGTTTCTCAAAAGCAATATCCCATATTAAACAGACAATTCAAATGTGACAATTCCTCTGTAACAAAGAAGCTGAATTCTGTAATAAATGGGAAACATTTCATTCCAGTCTTCTCAGGTACCAGAATCATGGACTTCAGTAGAAGAGAGGGAATAGGGAGAGAGGTGGGAGGCTGATCTGTTCGTGGCCCAGCACGGTGCTGTAATTCCTGACCCTTCTGGTTTCCACAGATCATTGCAGAGTAATGCTTGAAGCGTGTGACTTTGGACTTCTGCTGCTTTAAAAGGCCCAGTGGCTTTCCAACCAAATCCTTAGACTCAATCTATTGGTGTGTTTGTCTAATAAATTCTTTTTGTAGTAAATTTA(配列番号1)の3379bpと推定される。または、実施例1の過剰発現しているmRNAの塩基配列は、この3379bpの塩基配列と比較して5’末端側の塩基の25bp、129bp、133bp、135bp、または156bpが欠失している塩基配列(配列番号1の塩基配列の26番目のCから3379番目のAの塩基配列、配列番号1の塩基配列の130番目のAから3379番目のAの塩基配列、配列番号1の塩基配列の134番目のTから3379番目のAの塩基配列、配列番号1の塩基配列の136番目のAから3379番目のAの塩基配列、または配列番号1の塩基配列の157番目のTから3379番目のAの塩基配列)であると推定される。
【0139】
また、過剰発現しているmRNAにコードされているマウスNKX1-2オルソログ蛋白質のアミノ酸配列はMLAWQDGGAKAAPSHHKISFSVLDILDPQKFTRAALPAVRPAPREARKSLAEVEAGKDASSRDPVRQLETPDAAGPGAGQASPLEGSEAEEEEDAEDPRRPRLRERAARLLPGLARSPDAPAGALASGEPCEDGGGGPVRSPPGSPGSPRPRRRRLEPNCAKPRRARTAFTYEQLVALENKFRATRYLSVCERLNLALSLSLTETQVKIWFQNRRTKWKKQNPGADGAAQVGGGAPQPGAAGGGGGGGSGGSPGPPGTGALHFQTFPSYSAANVLFPSAASFPLTAAAPGSPFAPFLGPSYLTPFYAPRL(配列番号28)と推定される。
【0140】
(2−4)結果の考察
以上の結果より、肺癌または子宮頸癌において、配列番号1の塩基配列のmRNAが特異的に過剰発現していることが強く示唆された。従って、配列番号1の塩基配列のmRNAは肺癌または子宮頸癌の癌診断マーカーとして癌の診断に利用できると考えられる。そして、このmRNAを検出できる核酸プライマーまたは核酸プローブ等は、肺癌または子宮頸癌の診断や予後の診断に使用可能な癌診断薬になると考えられる。例えば、実施例でPCR反応に使用可能であったプライマーを使用できる。
【0141】
また、マウスNKX1-2オルソログ蛋白質も肺癌または子宮頸癌の癌診断マーカーとして癌の診断に利用できると考えられる。そして、このマウスNKX1-2オルソログ蛋白質に結合する抗体等は、肺癌または子宮頸癌の診断や予後の診断に使用可能な癌診断薬になると考えられる。
【0142】
以上、本発明を実施例に基づいて説明した。この実施例はあくまで例示であり、種々の変形例が可能なこと、またそうした変形例も本発明の範囲にあることは当業者に理解されるところである。
【特許請求の範囲】
【請求項1】
a)配列番号1の塩基配列、
b)配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列、
c)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
d)配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチド。
【請求項2】
請求項1に記載のポリヌクレオチドを含む癌診断薬。
【請求項3】
請求項2に記載の癌診断薬であって、
前記一部が、連続した15個以上の塩基を含む癌診断薬。
【請求項4】
請求項2または3記載の癌診断薬であって、
前記癌が肺癌または子宮頸癌を含む癌診断薬。
【請求項5】
請求項2乃至4いずれかに記載の癌診断薬を含む癌診断用キット。
【請求項6】
e)配列番号1の塩基配列、
f)配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列、
g)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
h)配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を有するRNA鎖を含む、癌診断マーカー。
【請求項7】
i)配列番号1の1070番目のGから3379番目のAの塩基配列、
j)前記i)の塩基配列に対して、80%以上の相同性を有する塩基配列、
k)前記i)の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
l)前記i)の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を有するRNA鎖を含む、癌診断マーカー。
【請求項8】
請求項6または7記載の癌診断マーカーであって、
前記RNA鎖が、肺癌または子宮頸癌の細胞で過剰発現しているRNA鎖である、
癌診断マーカー。
【請求項9】
被験者由来の被検試料中において、請求項6乃至8いずれかに記載の癌診断マーカーを検出する工程を含む、被験者の癌を検査する方法。
【請求項10】
請求項9に記載の方法であって、
リアルタイムPCR、RT−PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、およびシークエンサーからなる群から選ばれる1種以上の方法を用いた解析工程、
をさらに含む、被験者の癌を検査する方法。
【請求項11】
被験者由来の被検試料中において、請求項6乃至8いずれかに記載の癌診断マーカーを検出する工程を含む、被験者の癌の予後を検査する方法。
【請求項12】
m)被験者由来の被検試料中の請求項6乃至8いずれかに記載の癌診断マーカーを検出する検出部と、
n)前記癌診断マーカーの検出強度に基づいて前記癌診断マーカーの量を定量化する定量部と、
o)前記癌診断マーカーの量が所定の閾値を越えているかどうかを判定する判定部と、
p)前記判定の結果を出力する出力部と、
を備えた、癌診断用装置。
【請求項13】
コンピュータに、
q)被験者由来の被検試料中の請求項6乃至8いずれかに記載の癌診断マーカーを検出するステップと、
r)前記癌診断マーカーの検出強度に基づいて前記癌診断マーカーの量を定量化するステップと、
s)前記癌診断マーカーの量が所定の閾値を越えているかどうかを判定するステップと、
t)前記判定の結果を出力するステップと、
を実行させるための、癌診断用プログラム。
【請求項14】
u)配列番号1の塩基配列、
v)配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列、
w)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
x)配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、結合する抗体。
【請求項15】
マウスNKX1−2オルソログ蛋白質をコードする核酸もしくはその核酸の相補鎖、またはそれらの一部と、ハイブリダイズするポリヌクレオチド。
【請求項16】
マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカー。
【請求項17】
請求項16に記載の癌診断マーカーであって、前記マウスNKX1−2オルソログ蛋白質が、
y)配列番号28のアミノ酸配列、
z)配列番号28のアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列、
a’)配列番号28のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
b’)配列番号28のアミノ酸配列をコードする塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列にコードされるアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、癌診断マーカー。
【請求項18】
請求項16または17記載の癌診断マーカーに結合するマウスNKX1−2オルソログ蛋白質結合性抗体。
【請求項19】
請求項16または17記載の癌診断マーカーに結合するポリヌクレオチド。
【請求項1】
a)配列番号1の塩基配列、
b)配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列、
c)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
d)配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、ハイブリダイズするポリヌクレオチド。
【請求項2】
請求項1に記載のポリヌクレオチドを含む癌診断薬。
【請求項3】
請求項2に記載の癌診断薬であって、
前記一部が、連続した15個以上の塩基を含む癌診断薬。
【請求項4】
請求項2または3記載の癌診断薬であって、
前記癌が肺癌または子宮頸癌を含む癌診断薬。
【請求項5】
請求項2乃至4いずれかに記載の癌診断薬を含む癌診断用キット。
【請求項6】
e)配列番号1の塩基配列、
f)配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列、
g)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
h)配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を有するRNA鎖を含む、癌診断マーカー。
【請求項7】
i)配列番号1の1070番目のGから3379番目のAの塩基配列、
j)前記i)の塩基配列に対して、80%以上の相同性を有する塩基配列、
k)前記i)の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
l)前記i)の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を有するRNA鎖を含む、癌診断マーカー。
【請求項8】
請求項6または7記載の癌診断マーカーであって、
前記RNA鎖が、肺癌または子宮頸癌の細胞で過剰発現しているRNA鎖である、
癌診断マーカー。
【請求項9】
被験者由来の被検試料中において、請求項6乃至8いずれかに記載の癌診断マーカーを検出する工程を含む、被験者の癌を検査する方法。
【請求項10】
請求項9に記載の方法であって、
リアルタイムPCR、RT−PCR、ノーザンブロッティング、マイクロアレイ、免疫測定法、SAGE法、CAGE法、質量分析法、分子間相互作用解析、およびシークエンサーからなる群から選ばれる1種以上の方法を用いた解析工程、
をさらに含む、被験者の癌を検査する方法。
【請求項11】
被験者由来の被検試料中において、請求項6乃至8いずれかに記載の癌診断マーカーを検出する工程を含む、被験者の癌の予後を検査する方法。
【請求項12】
m)被験者由来の被検試料中の請求項6乃至8いずれかに記載の癌診断マーカーを検出する検出部と、
n)前記癌診断マーカーの検出強度に基づいて前記癌診断マーカーの量を定量化する定量部と、
o)前記癌診断マーカーの量が所定の閾値を越えているかどうかを判定する判定部と、
p)前記判定の結果を出力する出力部と、
を備えた、癌診断用装置。
【請求項13】
コンピュータに、
q)被験者由来の被検試料中の請求項6乃至8いずれかに記載の癌診断マーカーを検出するステップと、
r)前記癌診断マーカーの検出強度に基づいて前記癌診断マーカーの量を定量化するステップと、
s)前記癌診断マーカーの量が所定の閾値を越えているかどうかを判定するステップと、
t)前記判定の結果を出力するステップと、
を実行させるための、癌診断用プログラム。
【請求項14】
u)配列番号1の塩基配列、
v)配列番号1の塩基配列に対して、80%以上の相同性を有する塩基配列、
w)配列番号1の塩基配列において1若しくは数個の塩基が欠失、置換若しくは付加された塩基配列、
x)配列番号1の塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列、
からなる群から選ばれる1種以上の塩基配列を含む核酸もしくはその一部、またはそれらの相補鎖と、結合する抗体。
【請求項15】
マウスNKX1−2オルソログ蛋白質をコードする核酸もしくはその核酸の相補鎖、またはそれらの一部と、ハイブリダイズするポリヌクレオチド。
【請求項16】
マウスNKX1−2オルソログ蛋白質を含む、癌診断マーカー。
【請求項17】
請求項16に記載の癌診断マーカーであって、前記マウスNKX1−2オルソログ蛋白質が、
y)配列番号28のアミノ酸配列、
z)配列番号28のアミノ酸配列に対して80%以上の相同性を有するアミノ酸配列、
a’)配列番号28のアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列、
b’)配列番号28のアミノ酸配列をコードする塩基配列に相補的な塩基配列からなる核酸に対して、ストリンジェントな条件でハイブリダイズする核酸の塩基配列にコードされるアミノ酸配列、
からなる群から選ばれる1種以上のアミノ酸配列を含む、癌診断マーカー。
【請求項18】
請求項16または17記載の癌診断マーカーに結合するマウスNKX1−2オルソログ蛋白質結合性抗体。
【請求項19】
請求項16または17記載の癌診断マーカーに結合するポリヌクレオチド。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−99253(P2013−99253A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2010−54924(P2010−54924)
【出願日】平成22年3月11日(2010.3.11)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成21年度独立行政法人新エネルギー・産業技術総合開発機構「機能性RNAプロジェクト」委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(500309920)株式会社インテックシステム研究所 (22)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(500535301)一般社団法人バイオ産業情報化コンソーシアム (22)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成22年3月11日(2010.3.11)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成21年度独立行政法人新エネルギー・産業技術総合開発機構「機能性RNAプロジェクト」委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(500309920)株式会社インテックシステム研究所 (22)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(500535301)一般社団法人バイオ産業情報化コンソーシアム (22)
【Fターム(参考)】
[ Back to top ]

