胚様体形成用培養容器と、その製造方法、及び胚様体形成方法。
【課題】ES細胞から、効率よく、容易に質の高いEB体を形成することのできる胚様体形成用培養容器と、その製造方法、及び胚様体の形成方法を提供する。
【解決手段】水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、を含むことを特徴とする胚様体形成用培養容器の製造方法、および製造された杯様体形成用培養容器。さらに、この培養容器に、未分化胚性幹細胞を播種、培養することにより胚様体を形成させることを特徴とする胚様体形成方法。
【解決手段】水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、を含むことを特徴とする胚様体形成用培養容器の製造方法、および製造された杯様体形成用培養容器。さらに、この培養容器に、未分化胚性幹細胞を播種、培養することにより胚様体を形成させることを特徴とする胚様体形成方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、胚様体形成用培養容器と、その製造方法、及び胚様体形成方法に関する。
【背景技術】
【0002】
胚性幹細胞(embryonic stem cell:ES細胞)は、胚盤胞の内部細胞塊をフィーダー細胞の上に播種し、白血病阻害因子(leukemia inhibitory factor:LIF)を添加して培養することにより得られる。
未分化状態を維持したまま無限増殖するES細胞は、様々な組織細胞に分化する多分化能を有することから、分化により得られた組織を用いた移植治療、いわゆる再生医療の分野で様々な研究の対象となっている。
【0003】
ES細胞を様々な組織に分化誘導するためには、胚様体(embryoid body:EB体)と呼ばれる擬似的な胚を形成させる方法が最も広く用いられており、EB体の形成はin vitroでのES細胞の分化誘導におけるファーストステップとなる。また、EB体の形成はES細胞を培養容器に接着させない浮遊状態で培養することが必要であり、通常の培養容器を使用した接着培養ではEB体は形成されず、接着・伸展し、非特異的な分化を開始する。
【0004】
ES細胞を浮遊状態で培養するために最も広く用いられているのが懸垂培養(ハンギングドロップ培養)と呼ばれる方法である(例えば、非特許文献1参照)。ハンギングドロップ培養はその名のとおり、水滴状に垂れ下げた培養液の中で細胞を培養する方法である。すなわち、マルチウェルプレートの穴(ウェル)に、ミネラルオイルと緩衝液を添加し、マルチウェルプレートの蓋の各ウェル上に重なる位置にES細胞を含む培養懸濁液を液滴となるようにスポッティングし、マルチウェルプレートにかぶせて培養する。しかし、ハンギングドロップ法においては、EB体形成の成功率が低い、顕微鏡観察ができない、一度に形成できるEB体の量が少ない、操作が煩雑である、等の問題がある。
【0005】
その問題点を解消するために、例えば特許文献1では、容器をポリプロピレン製のチューブとしてES細胞の接着を防ぎ、かつ容器の形状を円錐状にして底部にES細胞が集まりやすくすることで、EB体を簡便かつ効率的に形成させることが開示されている。しかしながら、ポリプロピレンは透明性が無く顕微鏡観察によるEB体形成性の確認ができない点と、容器一つで一つのEB体しか形成されないので、一度に形成できるEB体の量はハンギングドロップ法と同等である。
更に、ES細胞が物理的に滑り落ちる為の傾斜が必要であるため容器の形状は前述の円錐状に限定される為、一般的に使用されるディッシュや底が平らなマルチウェルプレート形状の容器としては使用できない。
【0006】
また、例えば、特許文献2では、特定のホスホリルコリン類似基を有する化合物を用いて形成した被覆層を備える胚様体形成用容器が開示されている。当該特許文献には、ホスホリルコリン基が有する生体適合性を利用してES細胞を浮遊状態で培養することで、EB体が良好に形成されると記載されている。しかしながら、当該特許文献を実施する上で必須となるホスホリルコリン類似基を有する化合物が非常に特殊な化合物であり、例えば特許文献3に開示されている方法を用いないと合成することは困難という点が実施にあたっての限定となる。
【0007】
また、培養容器表面を親水性化合物で被覆することにより細胞接着が抑制され、浮遊状態で培養できることは公知であり、その様な培養容器をEB体形成容器として使用する試みは他にも実施されている例はある。しかしながら、それらの方法によってEB体が形成されるものはあるが、得られたEB体の質及び形成率は様々で、必ずしも分化誘導のステップにおいて満足な結果が得られるものではなかった。親水性化合物で被覆した従来の培養容器においてEB体の質及び形成率が悪くなる原因は種々考えられるが、例えばグラフト重合を利用して親水性化合物を被覆した場合、親水性化合物の密度が不充分である為に、ES細胞の接着を充分に防止することができていない可能性が考えられる。また、コーティングを利用して親水性化合物を被覆した場合、培地中に親水性化合物由来の溶出物が遊離し、EB体形成を阻害している可能性が考えられる。
【0008】
【非特許文献1】Keller,J.Physiol.(Lond)168:131−139,1998
【特許文献1】特開2004−254622号広報
【特許文献2】WO2005/001019号広報
【特許文献3】特開昭54−36025号広報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、上記こと情に鑑みてなされたものであり、ES細胞から、効率よく、容易に質の高い胚様体を形成することのできる胚様体形成用培養容器と、その製造方法、及び胚様体の形成方法を提供することにある。
【課題を解決するための手段】
【0010】
このような目的は、下記(1)から(9)に記載の本発明により達成される。
(1)胚様体形成用培養容器の製造方法であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
を含むことを特徴とする胚様体形成用培養容器の製造方法。
(2)前記水溶性樹脂は、側鎖に放射線反応性、感光性、熱反応性の中から選ばれる官能基を有するものである(1)に記載の胚様体形成用培養容器の製造方法。
(3)前記官能基は、アジド基を有するものを含む(1)又は(2)に記載の胚様体形成用培養容器の製造方法。
(4)前記水溶性被覆層を硬化させる方法は、光照射による硬化方法を含む(1)に記載の胚様体形成用培養容器の製造方法。
(5)胚様体形成用培養容器であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
によって内面に非水溶性硬化皮膜を有することを特徴とする胚様体形成用培養容器。
(6)前記水溶性樹脂は、側鎖に感光性の官能基を有するものを含む(5)に記載の胚葉体形成用培養容器。
(7)前記官能基は、アジド基を有するものを含む(5)又は(6)に記載の胚様体形成用培養容器。
(8)光照射によって前記水溶性被覆層を硬化させる(5)に記載の胚様体形成用培養容器。
(9)(5)ないし(8)のいずれかに記載の胚様体形成用培養容器に、未分化胚性幹細胞を播種し、更に前記未分化胚性幹細胞を培養することにより胚様体を形成させることを特徴とする胚様体形成方法。
【発明の効果】
【0011】
本発明によれば、ES細胞から、効率よく、容易に質の高い胚様体を形成することのできる胚様体形成用培養容器、その製造方法、及び胚様体形成方法を得ることができる。
【発明を実施するための最良の形態】
【0012】
本発明は、水溶性樹脂を培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、を含むことを特徴とする胚様体形成用培養容器の製造方法であり、上記製造方法によって製造された胚様体形成用培養容器であり、また、この培養容器に未分化胚性幹細胞を播種し、更にこの未分化胚性幹細胞を培養することにより胚様体を形成させることを特徴とする胚様体形成方法である。
【0013】
まず、本発明の本発明による胚様体形成用培養容器の製造方法(以下、単に「製造方法」ということがある)について説明する。
本発明の製造方法においては、水溶性樹脂を培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程を有することを特徴とする。
【0014】
本発明の製造方法に用いられる水溶性樹脂とは、水分子とのイオンもしくは水素結合により水和し、その結果として水に溶解するものであり、言い換えれば、水溶性樹脂とは水に溶解するために分子内の主鎖に対して必要充分な量のイオン性もしくは極性の側鎖を持つ樹脂である。なお、ここで水溶性樹脂とは、25℃の水100gに対して1.0g以上溶解可能なものをいう。
【0015】
上記水溶性樹脂の平均重合度は、特に限定されないが、100以上、10,000以下が好ましく、特に200以上、5,000以下が好ましい。平均重合度が100以上であると、均一な皮膜を成形することができ、また、平均重合度が10,000以下であれば作業性に適した水溶性の粘度とすることができる。
【0016】
上記水溶性樹脂としては、例えば、ポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコール、ポリアクリルアミド、ポリメタアクリルアミド、ポリヒドロキシエチルメタアクリレート、ポリペンタエリスリトールトリアクリレート、ポリペンタエリスリトールテトラアクリレート、ポリジエチレングリコールジアクリレート、およびそれらを構成するモノマー同士の共重合体、また2−メタクリロイルオキシエチルホスホリルコリンと他のモノマー(例えばブチルメタクリレート等)との共重合体等が挙げられる。これらの中でもポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコールの中から選ばれる1種以上と上記反応基からなる構造が好ましい。これにより、ES細胞に対する刺激を抑制し、EB体の形成速度、形成率、および形成したEB体の質を向上することができる。
【0017】
ここで、ポリ酢酸ビニルのケン化物とは、例えば、ポリビニルアルコールまたはビニルアルコールと他の化合物との共重合体をいう。さらには、例えば、ビニルアルコールと、親水基変性、疎水基変性、アニオン変性、カチオン変性、アミド基変性またはアセトアセチル基のような反応基変性させた変性酢酸ビニルのケン化物等も含まれる。
【0018】
また、上記ポリ酢酸ビニルのケン化物を用いる場合、上記ポリ酢酸ビニルのケン化物のケン化度は特に限定されないが、該ポリ酢酸ビニル全体の20mol%以上、100mol%以下が好ましく、特に50mol%以上、95mol%以下が好ましい。上記ポリ酢酸ビニルのケン化度が上記範囲内であると、EB体の形成速度、形成率、および形成したEB体の質を特に向上することができる。
【0019】
上記水溶性樹脂は、20℃における粘度が1mPa・s以上、10mPa・s以下に、好ましくは2mPa・s以上、7mPa・s以下となるよう溶媒を用いて調製されたものを使用することが好ましい。その際に使用する溶媒は水もしくは溶解度を高めるために、水と有機溶媒との混合物を使用することができる。水溶性樹脂の粘度が上記範囲内であると、細胞の接着量が少なく、細胞凝集塊形成効果が特に優れる。充分な細胞の接着低減効果により、良好な細胞凝集塊形成性が得られる。被覆層の厚みとしては、100nm以上5,000nm以下が好ましく、150以上1,000nm以下がより好ましい。
被覆層の厚みを上記下限値以上にすることにより細胞が基材から受ける物理的な刺激をより抑えることができ、厚みを上記上限値以下とすることにより被覆層に取り込まれるたんぱく質の量を少なくし、たんぱく質を介した細胞の接着を抑えることが出来るため、細胞凝集塊形成率を更に向上させることができる。
【0020】
上記水溶性樹脂を培養容器内面に被覆させる方法としては、例えば、スピンコート、ディッピング、または上記水溶性樹脂溶液を培養容器内面に分注した後、容器を傾けて溶液を排出する方法を用いることができる。この様な方法で培養容器内面に水溶性樹脂を接触させた後、培養容器内面に残留した水溶性樹脂溶液を乾燥させることで水溶性樹脂被覆層を形成することができる。
【0021】
本発明の製造方法においては、上記工程後に、上記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程を有することを特徴とする。
上記水溶性被覆層を非水溶性硬化皮膜層とすることで、密度の高いイオン性もしくは極性の側鎖を持つ表面を構築することができる。この表面に構築されたイオン性もしくは極性の側鎖は、培養液と接触した際に、静電相互作用もしくは水素結合により水分子と水和し、培養容器表面は実質的に水分子の密な水和層となり、この水和層はES細胞に対する基材表面からの刺激を抑制し、質的に良好なEB体が迅速に形成されることとなる。こうすることで、培養液を接触させた際に、水溶性樹脂の被覆層が溶解、遊離することを防ぎ、培養容器として必要な耐水性を獲得することができる。
【0022】
上記水溶性皮膜層を硬化させる方法としては特に限定するものではなく、側鎖に硬化させるための官能基、例えば放射線反応性、感光性、熱反応性の官能基を有する水溶性樹脂を用いることができる。例えば、感光性の官能基であれば、ジアゾ基、アジド基、シンモナイル基等が挙げられ、また、熱反応性および放射線反応性の官能基であれば、ビニル基、エポキシ基等を挙げることができる。これらの中でも硬化処理を迅速におこなうことができ、簡易な設備で硬化させることができる感光性の官能基を有する水溶性樹脂が特に好ましい。
【0023】
光照射により硬化させる場合の光源は、特に限定するものではなく、照度が5.0mW/cm2程度の超高圧水銀灯または0.1mW/cm2程度のUVランプを使用することができる。光照射による硬化は照度と照射時間で制御することができるため、照度の低い光源を用いる場合は照射時間を長くすればよく、反応性の高い感光基を選択した場合は蛍光灯下で硬化させることも可能である。例えば、5.0mW/cm2の超高圧水銀灯を使用した場合は1ないし10秒の照射で、0.1mW/cm2のUVランプを使用した場合は3ないし10分の照射で充分に硬化させることができる。
【0024】
上記感光性の官能基としては、アジド基を含む官能基が特に好ましい。これにより、実用的な230〜500nmの波長で反応させることができ、更に優れた解像性により皮膜の形成性を向上することができる。このように、表面に予め水溶性樹脂被覆層を形成し、該被覆層を硬化させて非水溶性硬化皮膜層に変性する工程によって上記の厚みの被覆層を得ることができる。
【0025】
水溶性樹脂を使用するもう一つの利点としては、硬化後に表面を水で洗浄することで、未反応の樹脂を容易に洗い流すことができるという点である。もし、硬化反応性が悪い等の原因で溶出物が確認された場合は、硬化後に洗浄工程を入れることにより、溶出物を低減し、更に良好なEB体形成率を得ることができる。
【0026】
次に、本発明の胚様体形成用培養容器(以下、単に「培養容器」ということがある)について説明する。本発明の培養容器は、上記本発明の製造方法によって製造されることを特徴とする。
【0027】
本発明の培養容器は、樹脂製の材料で成形することができる。この樹脂材料は、上記培養容器をディスポーザルタイプにすることができるのに加え、種々の形状を容易に成形することができる。上記樹脂材料としては、例えば、ポリプロピレン樹脂、ポリエチレン樹脂、エチレン-プロピレン共重合体等のポリオレフィン系樹脂または環状ポリオレフィン系樹脂、ポリスチレン、アクリロニトリル−ブタジエン−スチレン系樹脂等のポリスチレン系樹脂、ポリカーボネート樹脂、ポリエチレンテレフタレート樹脂、ポリメチルメタクリレート樹脂等のメタクリル系樹脂、塩化ビニル樹脂、ポリブチレンテレフタレート樹脂、ポリアリレート樹脂、ポリサルホン樹脂、ポリエーテルサルホン樹脂、ポリエーテルエーテルケトン樹脂、ポリエーテルイミド樹脂、ポリテトラフルオロエチレン等のフッ素系樹脂、ポリメチルペンテン樹脂、ポリアクリロニトリル等のアクリル系樹脂、プロピオネート樹脂等の繊維素系樹脂等が挙げられる。これらの中でも培養容器に求められる成形性、透明性、放射線耐性の点においてポリスチレン樹脂が特に好ましい。
【0028】
上記樹脂材料の重量平均分子量は、特に限定されないが、10,000以上500,000以下が好ましく、特に20,000以上100,000以下が好ましい。重量平均分子量が前記範囲内であると、培養容器の成形性に優れる。
上記重量平均分子量は、例えばサイズ排除クロマトグラフィー法(Gel Permeation Chromatography システム、Shodex KF−800 カラム、何れも昭和電工社製、溶出溶媒:テトラヒドロフラン)を用いて測定することができる。
上記樹脂材料には成形性向上、耐候性向上を目的として、本発明の目的を損なわない範囲で、例えば、炭化水素系、脂肪酸アミド系の滑剤やフェノール系、アミン系の酸化防止剤等の添加剤を添加することができる。
【0029】
上記樹脂材料から本発明の培養容器を製造する場合、例えば射出成形、ブロー成形、インジェクションブロー成形により、製造することができる。
【0030】
本発明の細胞培養容器の形態としては、例えば、マルチウェルプレートおよびシャーレ(ディッシュ)、フラスコ等の容器類が挙げられ、更にシート状の成形品であっても、容器底面等の細胞が培養できる環境下に設置して使用することができる。これらの中でも、バイオリアクターの生成または薬効や毒物の評価、人工臓器の開発研究等で用いられる6〜384穴のマルチウェルプレートやシャーレが好ましい。これにより、細胞凝集塊を用いた評価、研究の精度を向上させることができる。また、ラウンドボトムやVボトムと呼ばれる底面が半球若しくは円錐状のマルチウェルプレートを使用すると1ウェルに1個のEB体が均一な大きさで形成される為、評価・研究に好適に用いることができる。
【0031】
培養容器の必須条件である滅菌に関しては、例えば、エチレンオキサイドガス滅菌、感熱滅菌、蒸気滅菌、放射線滅菌等が挙げられるが、γ線あるいは電子線を用いた放射線滅菌が好ましく、大量生産を行う場合は放射線透過性の点でγ線滅菌が特に好ましい。
放射線の吸収線量については特に限定するものではないが、吸収線量が低すぎると滅菌性は確保されず、高すぎると細胞培養容器および被覆層が劣化してしまう場合がある。
【0032】
本発明における放射線の吸収線量としては、1kGy以上、50kGy以下が好ましく、5kGy以上、30kGy以下が特に好ましい。これによって本発明の培養容器の特性を充分に保持したまま滅菌性を付与することができる。
【0033】
次に、本発明の培養容器を用いた本発明の胚様体の形成方法について説明する。
線維芽細胞等のフィーダー上で培養した未分化のES細胞を、必要に応じて血清や成長因子等の添加物を加えた既知の培養液に任意の濃度で分散させた細胞懸濁液を本発明の培養容器に播種し、炭酸ガスインキュベーター等の環境下で培養することで、通常2日〜7日間で胚様体の形成を確認することができる。
【実施例】
【0034】
以下、本発明を実施例および比較例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
(実施例1)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)を用いて、射出成形によりディッシュ(シャーレ)を成形した。得られたディッシュにプラズマ処理装置(BRANSON/IPC社製 SERIES7000)を用いてプラズマ処理(酸素プラズマ5分)を行い、前処理としてディッシュ表面に濡れ性を付与した。
得られたディッシュの形状は、高さ13mm、内径35mmであった。
次に、水溶性樹脂として側鎖にアジド基を有するポリビニルアルコール(東洋合成工業社製 AWP、水溶性樹脂の平均重合度1600、感光基の導入率0.65mol%)をアルミ箔で遮光をしたガラス容器中で、20容量%エタノール水溶液に溶解し、1.0重量%の溶液を調整した。
上述のディッシュを前記アルミ箔で遮光したガラス容器に1分間、浸漬した後、取り出し、ディッシュを裏返して溶液を充分廃棄し、40℃で60分一次乾燥した後、UVランプで250nmのUV光を0.1mW/cm2×3分間照射して水溶性樹脂を硬化した後、純水で3回繰り返し洗浄し、乾燥後、γ線を吸収線量10kGyで照射(ラジエ工業株式会社において実施)して、本発明の培養容器(ディッシュ)を得た。
得られたディッシュの表面には、上記水溶性樹脂で形成される層が厚さ600nmで形成されていた。なお、層の厚さは液体窒素中で破断したディッシュの破断面を電子顕微鏡(FEI社製 Quanta400F)を用いて測定した。
【0035】
(実施例2)
樹脂材料として環状オレフィン共重合系樹脂(ポリプラスチックス社製、TOPAS(R) 6013)を用いた以外は実施例1と同様にして培養容器(ディッシュ)を得た。
得られたディッシュの表面には、上記側鎖に第1の官能基を有する水溶性樹脂で形成される層が厚さ600nmで形成されていた。
【0036】
(比較例1)
実施例1の工程から、水溶性樹脂への浸漬、及びUVランプによる硬化、洗浄、乾燥までの工程を除いた以外は実施例1と同様にして培養容器(ディッシュ)を得た。
【0037】
(比較例2)
水溶性樹脂への浸漬、及びUVランプによる硬化、洗浄、乾燥までの工程を除き、ディッシュをポリヒドロキシエチルメタクリレート共重合体(シグマアルドリッチ社製 poly−2hydroxyethlmethacrylate)の3重量%エタノール溶液に浸漬し、一晩乾燥させた以外は実施例1と同様にして培養容器(ディッシュ)を得た。
【0038】
得られた培養容器(ディッシュ)について、以下の評価を行った。評価項目と得られた結果を表1に示す。
1.マウスES細胞を用いたEB体形成評価
定法に従いフィーダー(マウス線維芽細胞)上で培養したマウスES細胞を2×104cells/mLとなるように下記の培地に懸濁し、実施例1、2および比較例1、2に2mLづつ播種し、5%の炭酸ガス雰囲気下で培養し、5日後の形態を観察した。
【0039】
2.接着細胞の有無
接着細胞の存在の有無及び形態を播種5日後に倒立型顕微鏡(オリンパス株式会社製 BX51)下40倍の倍率で観察した。
【0040】
【表1】

【0041】
表1から明らかなように、本発明の製造方法によって得られた培養容器を用いた実施例1、2においては複数個のEB体が形成されており、更に接着・伸展した細胞は確認されなかった。
一方、本発明の製造方法によらない培養容器を用いた比較例1、2では共にEB体は形成されず、接着・伸展した細胞が観察された。
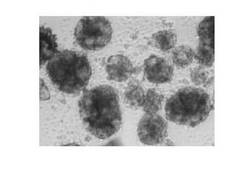
実施例1および比較例1の細胞の状態をそれぞれ図1および図2に示す。
実施例で得られたEB体をゼラチンコートディッシュ(住友ベークライト社製 スミロンセルタイトGシャーレ35φ)に移し、所定の分化誘導条件にて培養することで心筋に分化し、更に拍動が観察され、形成されたEB体が良質であることが確認された。
比較例で接着伸展した細胞は上記と同様の分化誘導条件に移して培養しても、心筋への分化は認められず、非特異的に分化してしまったものと推測される。
【図面の簡単な説明】
【0042】
【図1】実施例1の5日後の顕微鏡写真、複数のEB体形成が認められる。
【図2】比較例1の5日後の顕微鏡写真、EB体は形成されず接着細胞が確認される。
【図3】実施例1で得られたEB体から分化した心筋細胞を示す。
【技術分野】
【0001】
本発明は、胚様体形成用培養容器と、その製造方法、及び胚様体形成方法に関する。
【背景技術】
【0002】
胚性幹細胞(embryonic stem cell:ES細胞)は、胚盤胞の内部細胞塊をフィーダー細胞の上に播種し、白血病阻害因子(leukemia inhibitory factor:LIF)を添加して培養することにより得られる。
未分化状態を維持したまま無限増殖するES細胞は、様々な組織細胞に分化する多分化能を有することから、分化により得られた組織を用いた移植治療、いわゆる再生医療の分野で様々な研究の対象となっている。
【0003】
ES細胞を様々な組織に分化誘導するためには、胚様体(embryoid body:EB体)と呼ばれる擬似的な胚を形成させる方法が最も広く用いられており、EB体の形成はin vitroでのES細胞の分化誘導におけるファーストステップとなる。また、EB体の形成はES細胞を培養容器に接着させない浮遊状態で培養することが必要であり、通常の培養容器を使用した接着培養ではEB体は形成されず、接着・伸展し、非特異的な分化を開始する。
【0004】
ES細胞を浮遊状態で培養するために最も広く用いられているのが懸垂培養(ハンギングドロップ培養)と呼ばれる方法である(例えば、非特許文献1参照)。ハンギングドロップ培養はその名のとおり、水滴状に垂れ下げた培養液の中で細胞を培養する方法である。すなわち、マルチウェルプレートの穴(ウェル)に、ミネラルオイルと緩衝液を添加し、マルチウェルプレートの蓋の各ウェル上に重なる位置にES細胞を含む培養懸濁液を液滴となるようにスポッティングし、マルチウェルプレートにかぶせて培養する。しかし、ハンギングドロップ法においては、EB体形成の成功率が低い、顕微鏡観察ができない、一度に形成できるEB体の量が少ない、操作が煩雑である、等の問題がある。
【0005】
その問題点を解消するために、例えば特許文献1では、容器をポリプロピレン製のチューブとしてES細胞の接着を防ぎ、かつ容器の形状を円錐状にして底部にES細胞が集まりやすくすることで、EB体を簡便かつ効率的に形成させることが開示されている。しかしながら、ポリプロピレンは透明性が無く顕微鏡観察によるEB体形成性の確認ができない点と、容器一つで一つのEB体しか形成されないので、一度に形成できるEB体の量はハンギングドロップ法と同等である。
更に、ES細胞が物理的に滑り落ちる為の傾斜が必要であるため容器の形状は前述の円錐状に限定される為、一般的に使用されるディッシュや底が平らなマルチウェルプレート形状の容器としては使用できない。
【0006】
また、例えば、特許文献2では、特定のホスホリルコリン類似基を有する化合物を用いて形成した被覆層を備える胚様体形成用容器が開示されている。当該特許文献には、ホスホリルコリン基が有する生体適合性を利用してES細胞を浮遊状態で培養することで、EB体が良好に形成されると記載されている。しかしながら、当該特許文献を実施する上で必須となるホスホリルコリン類似基を有する化合物が非常に特殊な化合物であり、例えば特許文献3に開示されている方法を用いないと合成することは困難という点が実施にあたっての限定となる。
【0007】
また、培養容器表面を親水性化合物で被覆することにより細胞接着が抑制され、浮遊状態で培養できることは公知であり、その様な培養容器をEB体形成容器として使用する試みは他にも実施されている例はある。しかしながら、それらの方法によってEB体が形成されるものはあるが、得られたEB体の質及び形成率は様々で、必ずしも分化誘導のステップにおいて満足な結果が得られるものではなかった。親水性化合物で被覆した従来の培養容器においてEB体の質及び形成率が悪くなる原因は種々考えられるが、例えばグラフト重合を利用して親水性化合物を被覆した場合、親水性化合物の密度が不充分である為に、ES細胞の接着を充分に防止することができていない可能性が考えられる。また、コーティングを利用して親水性化合物を被覆した場合、培地中に親水性化合物由来の溶出物が遊離し、EB体形成を阻害している可能性が考えられる。
【0008】
【非特許文献1】Keller,J.Physiol.(Lond)168:131−139,1998
【特許文献1】特開2004−254622号広報
【特許文献2】WO2005/001019号広報
【特許文献3】特開昭54−36025号広報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、上記こと情に鑑みてなされたものであり、ES細胞から、効率よく、容易に質の高い胚様体を形成することのできる胚様体形成用培養容器と、その製造方法、及び胚様体の形成方法を提供することにある。
【課題を解決するための手段】
【0010】
このような目的は、下記(1)から(9)に記載の本発明により達成される。
(1)胚様体形成用培養容器の製造方法であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
を含むことを特徴とする胚様体形成用培養容器の製造方法。
(2)前記水溶性樹脂は、側鎖に放射線反応性、感光性、熱反応性の中から選ばれる官能基を有するものである(1)に記載の胚様体形成用培養容器の製造方法。
(3)前記官能基は、アジド基を有するものを含む(1)又は(2)に記載の胚様体形成用培養容器の製造方法。
(4)前記水溶性被覆層を硬化させる方法は、光照射による硬化方法を含む(1)に記載の胚様体形成用培養容器の製造方法。
(5)胚様体形成用培養容器であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
によって内面に非水溶性硬化皮膜を有することを特徴とする胚様体形成用培養容器。
(6)前記水溶性樹脂は、側鎖に感光性の官能基を有するものを含む(5)に記載の胚葉体形成用培養容器。
(7)前記官能基は、アジド基を有するものを含む(5)又は(6)に記載の胚様体形成用培養容器。
(8)光照射によって前記水溶性被覆層を硬化させる(5)に記載の胚様体形成用培養容器。
(9)(5)ないし(8)のいずれかに記載の胚様体形成用培養容器に、未分化胚性幹細胞を播種し、更に前記未分化胚性幹細胞を培養することにより胚様体を形成させることを特徴とする胚様体形成方法。
【発明の効果】
【0011】
本発明によれば、ES細胞から、効率よく、容易に質の高い胚様体を形成することのできる胚様体形成用培養容器、その製造方法、及び胚様体形成方法を得ることができる。
【発明を実施するための最良の形態】
【0012】
本発明は、水溶性樹脂を培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、を含むことを特徴とする胚様体形成用培養容器の製造方法であり、上記製造方法によって製造された胚様体形成用培養容器であり、また、この培養容器に未分化胚性幹細胞を播種し、更にこの未分化胚性幹細胞を培養することにより胚様体を形成させることを特徴とする胚様体形成方法である。
【0013】
まず、本発明の本発明による胚様体形成用培養容器の製造方法(以下、単に「製造方法」ということがある)について説明する。
本発明の製造方法においては、水溶性樹脂を培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程を有することを特徴とする。
【0014】
本発明の製造方法に用いられる水溶性樹脂とは、水分子とのイオンもしくは水素結合により水和し、その結果として水に溶解するものであり、言い換えれば、水溶性樹脂とは水に溶解するために分子内の主鎖に対して必要充分な量のイオン性もしくは極性の側鎖を持つ樹脂である。なお、ここで水溶性樹脂とは、25℃の水100gに対して1.0g以上溶解可能なものをいう。
【0015】
上記水溶性樹脂の平均重合度は、特に限定されないが、100以上、10,000以下が好ましく、特に200以上、5,000以下が好ましい。平均重合度が100以上であると、均一な皮膜を成形することができ、また、平均重合度が10,000以下であれば作業性に適した水溶性の粘度とすることができる。
【0016】
上記水溶性樹脂としては、例えば、ポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコール、ポリアクリルアミド、ポリメタアクリルアミド、ポリヒドロキシエチルメタアクリレート、ポリペンタエリスリトールトリアクリレート、ポリペンタエリスリトールテトラアクリレート、ポリジエチレングリコールジアクリレート、およびそれらを構成するモノマー同士の共重合体、また2−メタクリロイルオキシエチルホスホリルコリンと他のモノマー(例えばブチルメタクリレート等)との共重合体等が挙げられる。これらの中でもポリ酢酸ビニルのケン化物、ポリビニルピロリドン、ポリエチレングリコールの中から選ばれる1種以上と上記反応基からなる構造が好ましい。これにより、ES細胞に対する刺激を抑制し、EB体の形成速度、形成率、および形成したEB体の質を向上することができる。
【0017】
ここで、ポリ酢酸ビニルのケン化物とは、例えば、ポリビニルアルコールまたはビニルアルコールと他の化合物との共重合体をいう。さらには、例えば、ビニルアルコールと、親水基変性、疎水基変性、アニオン変性、カチオン変性、アミド基変性またはアセトアセチル基のような反応基変性させた変性酢酸ビニルのケン化物等も含まれる。
【0018】
また、上記ポリ酢酸ビニルのケン化物を用いる場合、上記ポリ酢酸ビニルのケン化物のケン化度は特に限定されないが、該ポリ酢酸ビニル全体の20mol%以上、100mol%以下が好ましく、特に50mol%以上、95mol%以下が好ましい。上記ポリ酢酸ビニルのケン化度が上記範囲内であると、EB体の形成速度、形成率、および形成したEB体の質を特に向上することができる。
【0019】
上記水溶性樹脂は、20℃における粘度が1mPa・s以上、10mPa・s以下に、好ましくは2mPa・s以上、7mPa・s以下となるよう溶媒を用いて調製されたものを使用することが好ましい。その際に使用する溶媒は水もしくは溶解度を高めるために、水と有機溶媒との混合物を使用することができる。水溶性樹脂の粘度が上記範囲内であると、細胞の接着量が少なく、細胞凝集塊形成効果が特に優れる。充分な細胞の接着低減効果により、良好な細胞凝集塊形成性が得られる。被覆層の厚みとしては、100nm以上5,000nm以下が好ましく、150以上1,000nm以下がより好ましい。
被覆層の厚みを上記下限値以上にすることにより細胞が基材から受ける物理的な刺激をより抑えることができ、厚みを上記上限値以下とすることにより被覆層に取り込まれるたんぱく質の量を少なくし、たんぱく質を介した細胞の接着を抑えることが出来るため、細胞凝集塊形成率を更に向上させることができる。
【0020】
上記水溶性樹脂を培養容器内面に被覆させる方法としては、例えば、スピンコート、ディッピング、または上記水溶性樹脂溶液を培養容器内面に分注した後、容器を傾けて溶液を排出する方法を用いることができる。この様な方法で培養容器内面に水溶性樹脂を接触させた後、培養容器内面に残留した水溶性樹脂溶液を乾燥させることで水溶性樹脂被覆層を形成することができる。
【0021】
本発明の製造方法においては、上記工程後に、上記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程を有することを特徴とする。
上記水溶性被覆層を非水溶性硬化皮膜層とすることで、密度の高いイオン性もしくは極性の側鎖を持つ表面を構築することができる。この表面に構築されたイオン性もしくは極性の側鎖は、培養液と接触した際に、静電相互作用もしくは水素結合により水分子と水和し、培養容器表面は実質的に水分子の密な水和層となり、この水和層はES細胞に対する基材表面からの刺激を抑制し、質的に良好なEB体が迅速に形成されることとなる。こうすることで、培養液を接触させた際に、水溶性樹脂の被覆層が溶解、遊離することを防ぎ、培養容器として必要な耐水性を獲得することができる。
【0022】
上記水溶性皮膜層を硬化させる方法としては特に限定するものではなく、側鎖に硬化させるための官能基、例えば放射線反応性、感光性、熱反応性の官能基を有する水溶性樹脂を用いることができる。例えば、感光性の官能基であれば、ジアゾ基、アジド基、シンモナイル基等が挙げられ、また、熱反応性および放射線反応性の官能基であれば、ビニル基、エポキシ基等を挙げることができる。これらの中でも硬化処理を迅速におこなうことができ、簡易な設備で硬化させることができる感光性の官能基を有する水溶性樹脂が特に好ましい。
【0023】
光照射により硬化させる場合の光源は、特に限定するものではなく、照度が5.0mW/cm2程度の超高圧水銀灯または0.1mW/cm2程度のUVランプを使用することができる。光照射による硬化は照度と照射時間で制御することができるため、照度の低い光源を用いる場合は照射時間を長くすればよく、反応性の高い感光基を選択した場合は蛍光灯下で硬化させることも可能である。例えば、5.0mW/cm2の超高圧水銀灯を使用した場合は1ないし10秒の照射で、0.1mW/cm2のUVランプを使用した場合は3ないし10分の照射で充分に硬化させることができる。
【0024】
上記感光性の官能基としては、アジド基を含む官能基が特に好ましい。これにより、実用的な230〜500nmの波長で反応させることができ、更に優れた解像性により皮膜の形成性を向上することができる。このように、表面に予め水溶性樹脂被覆層を形成し、該被覆層を硬化させて非水溶性硬化皮膜層に変性する工程によって上記の厚みの被覆層を得ることができる。
【0025】
水溶性樹脂を使用するもう一つの利点としては、硬化後に表面を水で洗浄することで、未反応の樹脂を容易に洗い流すことができるという点である。もし、硬化反応性が悪い等の原因で溶出物が確認された場合は、硬化後に洗浄工程を入れることにより、溶出物を低減し、更に良好なEB体形成率を得ることができる。
【0026】
次に、本発明の胚様体形成用培養容器(以下、単に「培養容器」ということがある)について説明する。本発明の培養容器は、上記本発明の製造方法によって製造されることを特徴とする。
【0027】
本発明の培養容器は、樹脂製の材料で成形することができる。この樹脂材料は、上記培養容器をディスポーザルタイプにすることができるのに加え、種々の形状を容易に成形することができる。上記樹脂材料としては、例えば、ポリプロピレン樹脂、ポリエチレン樹脂、エチレン-プロピレン共重合体等のポリオレフィン系樹脂または環状ポリオレフィン系樹脂、ポリスチレン、アクリロニトリル−ブタジエン−スチレン系樹脂等のポリスチレン系樹脂、ポリカーボネート樹脂、ポリエチレンテレフタレート樹脂、ポリメチルメタクリレート樹脂等のメタクリル系樹脂、塩化ビニル樹脂、ポリブチレンテレフタレート樹脂、ポリアリレート樹脂、ポリサルホン樹脂、ポリエーテルサルホン樹脂、ポリエーテルエーテルケトン樹脂、ポリエーテルイミド樹脂、ポリテトラフルオロエチレン等のフッ素系樹脂、ポリメチルペンテン樹脂、ポリアクリロニトリル等のアクリル系樹脂、プロピオネート樹脂等の繊維素系樹脂等が挙げられる。これらの中でも培養容器に求められる成形性、透明性、放射線耐性の点においてポリスチレン樹脂が特に好ましい。
【0028】
上記樹脂材料の重量平均分子量は、特に限定されないが、10,000以上500,000以下が好ましく、特に20,000以上100,000以下が好ましい。重量平均分子量が前記範囲内であると、培養容器の成形性に優れる。
上記重量平均分子量は、例えばサイズ排除クロマトグラフィー法(Gel Permeation Chromatography システム、Shodex KF−800 カラム、何れも昭和電工社製、溶出溶媒:テトラヒドロフラン)を用いて測定することができる。
上記樹脂材料には成形性向上、耐候性向上を目的として、本発明の目的を損なわない範囲で、例えば、炭化水素系、脂肪酸アミド系の滑剤やフェノール系、アミン系の酸化防止剤等の添加剤を添加することができる。
【0029】
上記樹脂材料から本発明の培養容器を製造する場合、例えば射出成形、ブロー成形、インジェクションブロー成形により、製造することができる。
【0030】
本発明の細胞培養容器の形態としては、例えば、マルチウェルプレートおよびシャーレ(ディッシュ)、フラスコ等の容器類が挙げられ、更にシート状の成形品であっても、容器底面等の細胞が培養できる環境下に設置して使用することができる。これらの中でも、バイオリアクターの生成または薬効や毒物の評価、人工臓器の開発研究等で用いられる6〜384穴のマルチウェルプレートやシャーレが好ましい。これにより、細胞凝集塊を用いた評価、研究の精度を向上させることができる。また、ラウンドボトムやVボトムと呼ばれる底面が半球若しくは円錐状のマルチウェルプレートを使用すると1ウェルに1個のEB体が均一な大きさで形成される為、評価・研究に好適に用いることができる。
【0031】
培養容器の必須条件である滅菌に関しては、例えば、エチレンオキサイドガス滅菌、感熱滅菌、蒸気滅菌、放射線滅菌等が挙げられるが、γ線あるいは電子線を用いた放射線滅菌が好ましく、大量生産を行う場合は放射線透過性の点でγ線滅菌が特に好ましい。
放射線の吸収線量については特に限定するものではないが、吸収線量が低すぎると滅菌性は確保されず、高すぎると細胞培養容器および被覆層が劣化してしまう場合がある。
【0032】
本発明における放射線の吸収線量としては、1kGy以上、50kGy以下が好ましく、5kGy以上、30kGy以下が特に好ましい。これによって本発明の培養容器の特性を充分に保持したまま滅菌性を付与することができる。
【0033】
次に、本発明の培養容器を用いた本発明の胚様体の形成方法について説明する。
線維芽細胞等のフィーダー上で培養した未分化のES細胞を、必要に応じて血清や成長因子等の添加物を加えた既知の培養液に任意の濃度で分散させた細胞懸濁液を本発明の培養容器に播種し、炭酸ガスインキュベーター等の環境下で培養することで、通常2日〜7日間で胚様体の形成を確認することができる。
【実施例】
【0034】
以下、本発明を実施例および比較例に基づいて詳細に説明するが、本発明はこれに限定されるものではない。
(実施例1)
樹脂材料としてポリスチレン樹脂(PSジャパン社製、HF77)を用いて、射出成形によりディッシュ(シャーレ)を成形した。得られたディッシュにプラズマ処理装置(BRANSON/IPC社製 SERIES7000)を用いてプラズマ処理(酸素プラズマ5分)を行い、前処理としてディッシュ表面に濡れ性を付与した。
得られたディッシュの形状は、高さ13mm、内径35mmであった。
次に、水溶性樹脂として側鎖にアジド基を有するポリビニルアルコール(東洋合成工業社製 AWP、水溶性樹脂の平均重合度1600、感光基の導入率0.65mol%)をアルミ箔で遮光をしたガラス容器中で、20容量%エタノール水溶液に溶解し、1.0重量%の溶液を調整した。
上述のディッシュを前記アルミ箔で遮光したガラス容器に1分間、浸漬した後、取り出し、ディッシュを裏返して溶液を充分廃棄し、40℃で60分一次乾燥した後、UVランプで250nmのUV光を0.1mW/cm2×3分間照射して水溶性樹脂を硬化した後、純水で3回繰り返し洗浄し、乾燥後、γ線を吸収線量10kGyで照射(ラジエ工業株式会社において実施)して、本発明の培養容器(ディッシュ)を得た。
得られたディッシュの表面には、上記水溶性樹脂で形成される層が厚さ600nmで形成されていた。なお、層の厚さは液体窒素中で破断したディッシュの破断面を電子顕微鏡(FEI社製 Quanta400F)を用いて測定した。
【0035】
(実施例2)
樹脂材料として環状オレフィン共重合系樹脂(ポリプラスチックス社製、TOPAS(R) 6013)を用いた以外は実施例1と同様にして培養容器(ディッシュ)を得た。
得られたディッシュの表面には、上記側鎖に第1の官能基を有する水溶性樹脂で形成される層が厚さ600nmで形成されていた。
【0036】
(比較例1)
実施例1の工程から、水溶性樹脂への浸漬、及びUVランプによる硬化、洗浄、乾燥までの工程を除いた以外は実施例1と同様にして培養容器(ディッシュ)を得た。
【0037】
(比較例2)
水溶性樹脂への浸漬、及びUVランプによる硬化、洗浄、乾燥までの工程を除き、ディッシュをポリヒドロキシエチルメタクリレート共重合体(シグマアルドリッチ社製 poly−2hydroxyethlmethacrylate)の3重量%エタノール溶液に浸漬し、一晩乾燥させた以外は実施例1と同様にして培養容器(ディッシュ)を得た。
【0038】
得られた培養容器(ディッシュ)について、以下の評価を行った。評価項目と得られた結果を表1に示す。
1.マウスES細胞を用いたEB体形成評価
定法に従いフィーダー(マウス線維芽細胞)上で培養したマウスES細胞を2×104cells/mLとなるように下記の培地に懸濁し、実施例1、2および比較例1、2に2mLづつ播種し、5%の炭酸ガス雰囲気下で培養し、5日後の形態を観察した。
【0039】
2.接着細胞の有無
接着細胞の存在の有無及び形態を播種5日後に倒立型顕微鏡(オリンパス株式会社製 BX51)下40倍の倍率で観察した。
【0040】
【表1】

【0041】
表1から明らかなように、本発明の製造方法によって得られた培養容器を用いた実施例1、2においては複数個のEB体が形成されており、更に接着・伸展した細胞は確認されなかった。
一方、本発明の製造方法によらない培養容器を用いた比較例1、2では共にEB体は形成されず、接着・伸展した細胞が観察された。
実施例1および比較例1の細胞の状態をそれぞれ図1および図2に示す。
実施例で得られたEB体をゼラチンコートディッシュ(住友ベークライト社製 スミロンセルタイトGシャーレ35φ)に移し、所定の分化誘導条件にて培養することで心筋に分化し、更に拍動が観察され、形成されたEB体が良質であることが確認された。
比較例で接着伸展した細胞は上記と同様の分化誘導条件に移して培養しても、心筋への分化は認められず、非特異的に分化してしまったものと推測される。
【図面の簡単な説明】
【0042】
【図1】実施例1の5日後の顕微鏡写真、複数のEB体形成が認められる。
【図2】比較例1の5日後の顕微鏡写真、EB体は形成されず接着細胞が確認される。
【図3】実施例1で得られたEB体から分化した心筋細胞を示す。
【特許請求の範囲】
【請求項1】
胚様体形成用培養容器の製造方法であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
を含むことを特徴とする胚様体形成用培養容器の製造方法。
【請求項2】
前記水溶性樹脂は、側鎖に放射線反応性、感光性、熱反応性の中から選ばれる官能基を有するものである請求項1に記載の胚様体形成用培養容器の製造方法。
【請求項3】
前記官能基は、アジド基を有するものを含む請求項1又は2に記載の胚様体形成用培養容器の製造方法。
【請求項4】
前記水溶性被覆層を硬化させる方法は、光照射による硬化方法を含む請求項1に記載の胚様体形成用培養容器の製造方法。
【請求項5】
胚様体形成用培養容器であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
によって内面に非水溶性硬化皮膜を有することを特徴とする胚様体形成用培養容器。
【請求項6】
前記水溶性樹脂は、側鎖に感光性の官能基を有するものを含む請求項5に記載の胚葉体形成用培養容器。
【請求項7】
前記官能基は、アジド基を有するものを含む請求項6に記載の胚様体形成用培養容器。
【請求項8】
前記水溶性被覆層を硬化させる方法は、光照射による硬化方法を含む請求項5に記載の胚様体形成用培養容器。
【請求項9】
請求項5ないし8のいずれかに記載の胚様体形成用培養容器に、未分化胚性幹細胞を播種し、更に前記未分化胚性幹細胞を培養することにより胚様体を形成させることを特徴とする胚様体形成方法。
【請求項1】
胚様体形成用培養容器の製造方法であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
を含むことを特徴とする胚様体形成用培養容器の製造方法。
【請求項2】
前記水溶性樹脂は、側鎖に放射線反応性、感光性、熱反応性の中から選ばれる官能基を有するものである請求項1に記載の胚様体形成用培養容器の製造方法。
【請求項3】
前記官能基は、アジド基を有するものを含む請求項1又は2に記載の胚様体形成用培養容器の製造方法。
【請求項4】
前記水溶性被覆層を硬化させる方法は、光照射による硬化方法を含む請求項1に記載の胚様体形成用培養容器の製造方法。
【請求項5】
胚様体形成用培養容器であって、
水溶性樹脂を前記培養容器内面に被覆させて水溶性被覆層を形成する水溶性樹脂被覆層形成工程と、
前記工程後に、前記水溶性被覆層を硬化させて非水溶性硬化皮膜層に変性する非水溶性硬化皮膜変性工程と、
によって内面に非水溶性硬化皮膜を有することを特徴とする胚様体形成用培養容器。
【請求項6】
前記水溶性樹脂は、側鎖に感光性の官能基を有するものを含む請求項5に記載の胚葉体形成用培養容器。
【請求項7】
前記官能基は、アジド基を有するものを含む請求項6に記載の胚様体形成用培養容器。
【請求項8】
前記水溶性被覆層を硬化させる方法は、光照射による硬化方法を含む請求項5に記載の胚様体形成用培養容器。
【請求項9】
請求項5ないし8のいずれかに記載の胚様体形成用培養容器に、未分化胚性幹細胞を播種し、更に前記未分化胚性幹細胞を培養することにより胚様体を形成させることを特徴とする胚様体形成方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2008−178367(P2008−178367A)
【公開日】平成20年8月7日(2008.8.7)
【国際特許分類】
【出願番号】特願2007−15793(P2007−15793)
【出願日】平成19年1月26日(2007.1.26)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成20年8月7日(2008.8.7)
【国際特許分類】
【出願日】平成19年1月26日(2007.1.26)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

