造血細胞のCXCR4アゴニスト処理
【課題】インビトロおよびインビボにおける造血細胞の処理に使用するためのCXCケモカイン受容体4(CXCR4)のペプチドアゴニストを含む、ケモカイン受容体アゴニストの治療的用途を提供する。
【解決手段】以下の(a)〜(c)を含む、CXCR4アゴニストペプチド:a)SDF-1 N末端配列と相同なN末端配列;b)SDF-1 C末端配列またはMIP-1α配列と相同なC末端配列;c)N末端配列をC末端配列に連結するペプチドスペーサー配列であって、該N末端配列をC末端へ連結するペプチドスペーサー配列が、天然のアミノ酸、非天然のアミノ酸、または天然のアミノ酸および非天然のアミノ酸の両方を含む配列、を造血細胞へ投与する段階を含む、造血細胞増殖の速度を低下させる方法。
【解決手段】以下の(a)〜(c)を含む、CXCR4アゴニストペプチド:a)SDF-1 N末端配列と相同なN末端配列;b)SDF-1 C末端配列またはMIP-1α配列と相同なC末端配列;c)N末端配列をC末端配列に連結するペプチドスペーサー配列であって、該N末端配列をC末端へ連結するペプチドスペーサー配列が、天然のアミノ酸、非天然のアミノ酸、または天然のアミノ酸および非天然のアミノ酸の両方を含む配列、を造血細胞へ投与する段階を含む、造血細胞増殖の速度を低下させる方法。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
ひとつの局面において、本発明は、インビトロおよびインビボにおける造血細胞の処理に使用するためのCXCケモカイン受容体4(CXCR4)のペプチドアゴニストを含む、ケモカイン受容体アゴニストの治療的用途に関する。
【背景技術】
【0002】
発明の背景
造血は、造血幹細胞が細胞系譜が方向づけられた(lineage-committed)細胞を生成し、自己複製過程を反復するような発生経路を含む。造血幹細胞は典型的には自己複製能および多分化能の二元的な能力を有する細胞である。
【0003】
サイトカインは、免疫応答を調節する単球またはリンパ球を含む様々な細胞から分泌される可溶性タンパク質である。ケモカインは、ジスルフィド結合形成に関与するシステイン残基の性質により特徴付けられる4群に分類された、走化性誘起作用タンパク質のスーパーファミリーである。ケモカインは、様々な生物学的反応を調節し、これらは白血球およびリンパ球の複数の系統の生体臓器組織への補充を促進する。ケモカインは、タンパク質中の最初の2個のシステイン残基の相対的位置に従い2つのファミリーに分類することができる。βケモカインを含むCCケモカインにおいて、最初の2個のシステインは、互いに隣接している。αケモカインを含むCXCケモカインにおいて、最初の2個のシステインは、1個のアミノ酸残基により隔てられている。2個の小型のサブグループは、2個のシステインの1個のみを有する(C)か、もしくはシステイン間に3個のアミノ酸を有する(CX3C)。ヒトにおいて、CXCケモカイン遺伝子は第4染色体上に(SDF-1遺伝子を除く、これは第10染色体に位置する)およびCCケモカインは第17染色体上にクラスター化している。
【0004】
ケモカインの分子標的は細胞表面受容体である。そのような受容体の一つは、CXCケモカイン受容体4(CXCR4)であり、これは7回膜貫通タンパク質にカップリングしたGタンパク質であり、これまでLESTR(ローチャー、ガイサー、オレイリー、ツァーレン、バジオンリニ、モサー(Loetsher, M., Geiser, T. O'Reilly, T., Zwahlen, R., Baggionlini, M., & Moser, B.)(1994)J. Biol. Chem. 269, 232-237)、HUMSTR(フェダースピール、ダンカン、デラニー、シャパート、クラーク・ルイス、ジリク(Federsppiel, B., Duncan, A. M. V., Delaney, A., Shappert, K., Clark-Lewis, I., & Jirik, F. R.)(1993)Genomics 16, 707-712)、およびフュージン(フェン、ブローダー、ケネディ、バーガー(Feng, Y., Broeder, C.C., Kennedy, P. E., & Berger, E. A.)(1996)、Science 272、872-877)と呼ばれていた。CXC4は、造血起源の細胞上に広く発現しており、ヒト免疫不全ウイルス1(HIV-1)に関してCD4+の主な共受容体である(フェン、ブローダー、ケネディ、バーガー(Feng, Y., Broeder, C.C., Kennedy, P. E., & Berger, E. A.)(1996)、「HIV-1流入共因子:7回膜貫通Gタンパク質カップリング受容体の機能的cDNAクローニング(HIV-1 entry cofactor:Functional cDNA cloning of a seven-transmembrane G protein-coupled receptor)」、Science 272、872-877)。
【0005】
ケモカインは、7回膜貫通Gタンパク質と共役型受容体との結合によりそれらの作用を媒介し、かつ白血球サブセットを炎症部位へ引きつけると考えられている(Baglioniniら、Nature、392:565-568(1998))。多くのケモカインが、リンパ系組織において構成的に発現されることが示されており、このことはこれらがリンパ系器官間および器官内のリンパ球遊送(lympnocyte trafficking)の調節における血流途絶性(hemostatic)機能を有し得ることを示唆している(KimおよびBroxmeyer、J. Leuk. Biol.、56:6-15(1999))。
【0006】
ストローマ細胞由来因子-1(SDF-1)は、骨髄ストローマから構成的に選択されることが知られているケモカインCXCファミリーの一員である(Tashiro、Science、261:600-602(1993))。ヒトとマウスのSDF-1推定タンパク質配列は、およそ92%の同一性がある。ストローマ細胞由来因子-1α(SDF-1α)およびストローマ細胞由来因子-1β(SDF-1β)は密接に関連している(本明細書においては共にSDF-1と称する)。SDF-1αおよびSDF-1βの天然のアミノ酸配列は公知であり、これらのタンパク質をコードしているゲノム配列も知られている(1996年10月8日に発行された米国特許第5,563,048号、および1998年5月26日に発行された米国特許第5,756,084号を参照のこと)。ゲノムクローンの同定は、αおよびβアイソフォームが、単独の遺伝子の選択的スプライシングの結果であることを示している。α型はエクソン1〜3に由来し、一方β型はエクソン4由来の追加の配列を含む。全ヒト遺伝子はおよそ10Kbである。SDF-1は最初に、プレB細胞刺激因子として、ならびにT細胞および単球についての高度に効果的な走化性因子として特徴付けられた(Bieulら、J. Exp. Med.、184:1101-1110(1996))。
【0007】
SDF-1の生物学的作用は、造血幹細胞を含む単核白血球上に発現される、ケモカイン受容体CXCR4(同じくフューシンまたはLESTRとしても公知)を介しうる。SDF-1は、CXCR4の天然のリガンドと考えられ、CXCR4はSDF-1の天然の受容体と考えられている(Nagasawzaら、Proc. Natl. Acad. Sci. USA、93:726-732(1997))。SDF-1の遺伝的排除は、周産期の致死率に関連し、これは心発生、B細胞リンパ球新生、および骨髄発生の異常を含む(Nagasawaら、Nature、382:635-637(1996))。
【0008】
SDF-1は骨髄前駆細胞の通行、輸送、およびホーミングに基本的な役割を有すると報告されているという点において他のケモカインとは機能的に異なっている(Aiuti, A., Webb, I. J., Bleul, C., Springer, T., & Guierrez-Ramos, J. C.(1996)、J. Exp. Med. 185、111-120、およびNagasawa, T., Hirota, S., Tachibana, K., Takakura N., Nishikawa, S. I., Kitamura, Y., Yoshida, N., Kikutani, H., およびKishimoto, T.(1996)Nature 382、635-638)。SDF-1はまた、他のCXCケモカインとのアミノ酸配列同一性が約22%に過ぎないという点においても構造的に異なっている(Bleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., およびSpringer, T. A.(1996)、J. Exp. Med. 184、1101-1109)。SDF-1は、幾つかの細胞タイプによって構成的に産生されているように考えられ、特に骨髄間質細胞に高レベルに認められる(Shirozu, M., Nakano, T., Inazawa, J., Tashiro, K., Tada, H., Shinohara, T., およびHonjo, T.(1995)Genomics 28、495-500、ならびにBleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., およびSpringer, T. A.(1996)、J. Exp. Med. 184、1101-1109)。SDF-1の基本的な生理的役割は、種間のSDF-1配列の保存が高レベルであることから暗示される。インビトロにおいて、SDF-1はまた、単球および骨髄由来前駆細胞を含む広範囲の細胞の化学走性を刺激する(Aiuti, A., Webb, I. J., Bleul, C., Springer, T., およびGuierrez-Ramos, J. C.(1996)、J. Exp. Med. 185、111-120、ならびにBleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., & Springer, T. A.)(1996)、J. Exp. Med. 184、1101-1109)。SDF-1が高い割合の休止期Tリンパ球および活性化Tリンパ球を刺激することである(Bleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., およびSpringer, T. A.(1996)、J. Exp. Med. 184、1101-1109、ならびにCampbell, J. J., Hendrick, J., Zlotnik, A., Siani, M. A., Thompson, D. A., およびButcher, E. C.(1998)Science、279、381-383)。
【0009】
様々な疾患は、分裂細胞に対し優先的に細胞傷害性であるような物質による治療を必要としている。例えば、癌細胞は、細胞傷害性用量の放射線および化学療法剤により標的化することができる。癌療法のためのこれらの手法の顕著な副作用は、活発に分裂している正常細胞に対するこのような治療の病理学的な影響である。これらの正常細胞は、例えば毛嚢細胞、粘膜細胞、および造血細胞、例えば未成熟骨髄前駆細胞および幹細胞などを含む。造血幹細胞、始原細胞または前駆細胞の無差別破壊は、白血球、リンパ球、および赤血球などの正常な成熟血液細胞数の減少につながり得る。成熟細胞数に対する大きな影響は、天然に比較的短い半減期を有する細胞、特に好中球(好中球減少症(neutropaenia))および血小板(血小板減少症)により認められる。白血球数の減少は、免疫系の機能喪失を伴い、これにより患者の日和見感染のリスクを増大することがある。化学療法に起因した好中球減少症は、例えば細胞傷害性処置の2日または3日以内に生じ、かつ患者は造血システムが好中球数を再生するのに十分に回復されるまで、最大2週間易感染性となる。癌療法の結果としての減少した白血球数(白血球減少症)は、この療法が白血球数が復元するように中断されなければならないほど十分に重篤となることがある。癌療法の中断は、その後の癌細胞の生存、癌細胞における薬剤耐性発生の増加、および最終的には癌再発につながることがある。従って、細胞傷害性物質による治療を受けた患者における造血前駆細胞または幹細胞の維持を促進するような治療物質および処置の必要性が存在している。
【0010】
骨髄移植は、様々な血液疾患、自己免疫疾患、および悪性疾患の治療において使用されている。骨髄移植と組合わせて、造血前駆細胞または幹細胞の集団を増殖するために、エキソビボ造血(骨髄)細胞培養が使用される。造血前駆細胞または幹細胞の生存力を保ちながら、細胞傷害性治療を受けた癌細胞でエキソビボ造血細胞培養物をパージすることが望ましい。従って、細胞傷害性物質へ曝露されたエキソビボ細胞培養中の造血前駆細胞または幹細胞を維持することを促進する物質および方法が必要である。
【0011】
多くのタンパク質が、造血細胞増殖のインヒビターとして治療的に有用な可能性を有する、造血前駆細胞発生のインヒビターとして同定されている:マクロファージ炎症タンパク質1-α(MIP-1-α)およびLD78(米国特許第5,856,301号参照);ヘモグロビンαグロブリン鎖およびヘモグロビンβグロブリン鎖(米国特許第6,022,848号参照);ならびに、インターフェロンγ(米国特許第5,807,744号参照)。
【0012】
細胞傷害性の薬物および放射線療法後の永続的な骨髄の回復は、長期再構成(LTR)能を有する造血幹細胞の生存によって左右される。化学療法および/または放射線療法の結果として主要な用量を制限する続発症は、好中球減少症および血小板減少症である。用量強化(dose intensification)(すなわち、各々の腫瘍療法の対数殺傷(log-kill)の増加)またはスケジュールの圧縮に関連しているプロトコールは、標準の化学療法および/または放射線療法に関連した脊髄抑制の程度および期間を増悪すると考えられる。例えば、アジュバントの設定において、ドキソルビシンベースの治療の反復サイクルが、骨髄前駆細胞集団に蓄積性および長期永続性の損傷を生じることが示されている(Lorhrmanら、Br. J. Haematol.、40:369(1978))。化学療法により生じる短期の造血細胞損傷の作用は、好中球再生を加速するために使用される、現在使用されているG-CSF(ノイポゲン(Neupogen)(登録商標))によりある程度克服されている(Le Chevalier、Eur. J. Cancer、30A:410(1994))。この手法も同じく、治療の連続サイクルにわたって動員された前駆細胞の品質の低下を反映している進行性血小板減少症および蓄積性骨髄損傷を併発するために制限されている。現在の関心は腫瘍反応速度およびおそらくは患者生存率の改善の手段としての化学療法の用量強化にあるので、化学療法および/または放射線療法の脊髄解離性の作用をレスキューするために現在の治療を改善または交代するための代替療法の必然性が増しつつあり、これは現在腫瘍療法用量漸増のための主要な速度制限因子のひとつである。
【0013】
移植された末梢血幹細胞(PBSC、または自家PBSC)は、血液学的悪性疾患および固形腫瘍を有する患者への高用量の化学療法または放射線療法を投与後に、即時および持続性の造血回復を提供することができる。PBSC移植は、生着まで比較的短時間でおよび骨髄収集に必要な外科的手法が不要であるために、自家移植用の幹細胞の好ましい給源となりつつある(Demirerら、Stem Cells、14:106-116(1996);Pettengelら、Blood、82:2239-2248(1992))。幹細胞の骨髄から末梢血への放出の機序はよくわかっていないが、CD34+細胞の動員を増強する物質は、自家PBSC移植の増強において有効であることは証明することができる。G-CSFおよびGM-CSFは、PBSC動員のために現在最も一般的に使用される造血促進因子(hematopoietic growth gfactor)である。従って、この臨床適応にはその他の物質が必要とされる。
【0014】
自己免疫疾患のための幹細胞移植は、自家または同種移植片を用いて開始されなければならず、前者が合併症のリスクが低いために一般に好ましいとされている(BurtおよびTaylor、Stem Cells、17:366-372(1999))。リンパ球枯渇も推奨されており、この場合リンパ球枯渇は、移植片からの自己反応性細胞をパージする形態である。実際には、自家移植片の攻撃的リンパ球枯渇は、免疫抑制的予防策を伴わずとも、同種反応性(すなわち、移植片対宿主疾患(GVHD))を防止することができる。従ってリンパ球枯渇した自家移植片は、自己反応性の再発を防止することができる。結論として、CFU-GEMM骨髄性幹細胞、またはBFU-EおよびCFU-GM骨髄単球性幹細胞の生存を増強することができる併用療法のいずれかは、造血幹細胞に欠陥が生じる自己免疫疾患の療法において恩典を有する。
【0015】
マウスの造血幹細胞へのレトロウイルスを介する遺伝子導入および同系マウスの再構築は、長期にわたる導入遺伝子の持続性および機能性を明らかにしている(Kumeら、69:227-233(1999))。最終的に分化した細胞は、記憶BおよびTリンパ球以外は、比較的短期間生存し、非常に多数の血液細胞が毎日入れ替わっている。従って遺伝子導入による血液細胞の長期間機能する補正が必要な場合、標的細胞は造血幹細胞であり得る(Kumeら、69:227-233(1999))。従って前駆幹細胞の生存を維持することができる化合物は、より大きい造血幹細胞の集団を得ることができる点で遺伝子導入効率を増大することができる。
【0016】
多くのタンパク質が、同定され、造血前駆細胞発生および造血細胞繁殖(増殖)のインヒビターとして現在臨床利用されている。これらは、組換えメチオニルヒトG-CSF(ノイポゲン(登録商標)、フィルグラスチム;Amgen社)、GM-CSF(リューカイン(Leukine)(登録商標)、サルグラモスチム;Immunex社)、エリスロポエチン(rhEPO、エポジェン(Epogen)(登録商標);Amgen社)、トロンボポエチン(rhTPO;Genentech社)、インターロイキン-11(rhIL-11、ニューメガ(Neumega)(登録商標);American Home Products社)、Flt3リガンド(Mobista;Immunex社)、多系統造血因子(MARstem(商標);Maret Pharm社)、ミエロポエチン(Leridistem;Searle社)、IL-3、骨髄前駆体阻害因子-1(Mirostipen;Human Genome Sciences社)、幹細胞因子(rhSCF、ステムジェン(Stemgen)(登録商標);Amgen社)を含む。
【発明の概要】
【0017】
本発明の様々な局面に従い、CXCR4アゴニストは、細胞傷害性物質に対する細胞の感受性を低下させるための骨髄前駆細胞または幹細胞を処置するために使用することができる。CXCR4アゴニストは、細胞増殖速度を低下させるための骨髄前駆細胞または幹細胞を処置するために使用することができる。CXCR4アゴニストは、例えば、骨髄前駆細胞または幹細胞を処置するための骨髄または末梢血幹細胞移植手法においてインビボまたはエキソビボで使用することができる。CXCR4アゴニストは、哺乳類において癌を治療するために1種またはそれ以上の細胞傷害性物質と組合わせて使用することができる。細胞傷害性物質は例えば、化学療法剤または放射線を含む。CXCR4アゴニストは、インビボ、エキソビボ、およびヒトにおける疾患、例えば癌などにおける骨髄前駆細胞または幹細胞の増殖を調節するために治療的に使用することができる。
【0018】
発明の詳細な説明
本発明のいくつかの局面に従い、造血幹細胞は、細胞増殖抑制の機序を介して、CXCR4アゴニストにより影響をうけることがある。増殖している癌性細胞を殺傷するために利用される細胞傷害性療法、例えば化学療法および/または放射線療法は、増殖している細胞を標的化するので、本発明の様々な局面に従うCXCR4アゴニストを、未成熟骨髄および末梢血前駆細胞および幹細胞などの造血細胞の細胞毒が媒介した破壊を低下させるために利用し、これにより細胞毒処置後の白血球、リンパ球および赤血球のような成熟血液細胞数の回復を増強することができる。本発明の様々な局面において、CXCR4アゴニストは、前駆細胞の増殖を抑制し、その結果それらを、例えば癌治療のために患者が受けている治療様式による破壊からレスキューするために、脊髄解離性化学療法および/または放射線療法のような細胞毒処置の前に、処置中、または処置の前および途中の両方に、患者に投与することができる。従って本発明の様々な局面に従うCXCR4アゴニストで治療され易い癌は、乳房、結腸、直腸、肺、中咽頭、下咽頭、食道、胃、膵臓、肝臓、胆嚢および胆管、小腸、尿管(腎、膀胱および尿路上皮を含む)、女性生殖道(子宮頸部、子宮、および卵巣に加え、絨毛上皮腫および妊娠絨毛性疾患)、男性生殖道(前立腺、精嚢、精巣および生殖細胞腫瘍を含む)、内分泌腺(甲状腺、副腎、および下垂体を含む)、ならびに皮膚の癌腫、更には血管腫、黒色腫、肉腫(骨および軟組織に生じるものに加え、カポジ肉腫を含む)ならびに脳、神経、目、および髄膜の腫瘍(星状細胞腫、神経膠腫、膠芽腫、網膜芽腫、神経腫、神経芽細胞腫、シュワン細胞腫、および髄膜腫)を含む、原発性および転移性の両方の腫瘍、ならびに固形腫瘍である。本発明のいくつかの局面において、CXCR4アゴニストは、白血病のような、造血系悪性疾患から生じる固形腫瘍のような腫瘍(すなわち、緑色腫、形質細胞腫ならびに菌状息肉腫および皮膚T細胞リンパ腫/白血病のプラークおよび腫瘍)の治療に加え、リンパ腫(ホジキンおよび非ホジキンリンパ腫の両方)の治療にも有用である。加えて、CXCR4アゴニストは、単独で使用した場合、または放射線療法もしくは化学療法剤などの細胞傷害性物質との併用した場合のいずれかにおいて、前述の腫瘍からの転移の防止に有用でありうる。
【0019】
本発明の別の局面において、CXCR4アゴニストは、CD34+前駆細胞の集団を濃縮するために使用することができる。このような細胞は、例えば、骨髄(BM)および末梢血(PB)幹細胞移植手法において、CXCR4アゴニストにより濃縮することができる。このような手法は、様々な疾患を治療するために利用することができる(例えば、Ball, E.D.、Lister, J.、およびLaw, P.の「造血幹細胞療法(Hematopoietic Stem Cell Therapy)」、Chruchill Livingston(Harcourt社)、ニューヨーク、(2000)参照)。従ってCXCR4アゴニストは、下記のCXCR4アゴニストで治療され得るような疾患などの、疾患治療を目的として、このような造血幹細胞移植(HSCT)プロトコールにおいて使用することができる:
再生不良性貧血;
急性リンパ芽球性貧血;
急性骨髄性白血病;
骨髄形成異常症;
多発性骨髄腫;
慢性リンパ球性白血病;
先天性免疫不全症(例えば、自己免疫リンパ増殖症候群、ウィスコット-アルドリッチ症候群、X-連鎖リンパ増殖症、慢性肉芽腫症、コストマン型好中球減少症、白血球粘着異常症);
代謝性疾患(例えば、フルラー症候群(MPS I/II)、スライ症候群(MPS VII)、幼児期に発症する脳のX-副腎白質ジストロフィー、グロボイド細胞白質異栄養症などの、HSCTで指摘されたもの)。
【0020】
別の態様において、CXCR4アゴニストは、様々な造血細胞の処置に使用することができ、このような細胞は、単離されるか、またはインビボもしくはインビトロにおいて処理された細胞集団の一部のみを形成することができる。CXCR4アゴニストで処理し易い細胞は、例えば、骨髄幹細胞または前駆細胞、リンパ系幹細胞または前駆細胞、骨髄系幹細胞、CFU-GEMM細胞(顆粒球、赤芽球、マクロファージ、巨核球コロニー形成単位)、B系幹細胞、T系幹細胞、DC系幹細胞、プレB細胞、前胸腺細胞、BFU-E細胞(赤芽球バースト形成単位)、BFU-MK細胞(巨核球バースト形成単位)、CFU-GM細胞(顆粒球-マクロファージコロニー形成単位)、CFU-bas細胞(好塩基球コロニー形成単位)、CFU-Mast細胞(マスト細胞コロニー形成単位)、CFU-G細胞(顆粒球コロニー形成単位)、CFU-M/DC細胞(単球/樹状細胞コロニー形成単位)、CFU-Eo細胞(好酸球コロニー形成単位)、CFU-E細胞(赤芽球コロニー形成単位)、CFU-MK細胞(巨核球コロニー形成単位)、骨髄芽細胞、単芽球、B-リンパ芽球、T-リンパ芽球、前赤血球、好中球性骨髄球、前単球、またはマクロファージ、骨髄細胞関連した樹状細胞、マスト細胞、形質細胞、赤血球、血小板、好中球、単球、好酸球、好塩基球、B細胞、T細胞もしくはリンパ関連樹状細胞などの成熟細胞を生じるように分化する他の造血細胞などのような、多能性幹細胞で始まる造血系統の細胞を含む。
【0021】
いくつかの態様において、本発明は、配列番号:1、2または3に示したアミノ酸配列を有するポリペプチドに関する(図13)。いくつかの態様において、PEG結合(pegylation)部分は、この配列上の任意の位置に供することができる。本発明のポリペプチドは、アミノ酸配列の一部が省略されたポリペプチド、または付加もしくは置換されたアミノ酸を含む配列を含むポリペプチド、または配列のスプライシングされた形を含むことができ、更にはCXCR4の活性化を誘導する。いくつかの態様において、本発明のポリペプチドは、配列番号:1、2または3のポリペプチドと、最適に並べた場合に、少なくとも10個、15個、20個、30個、40個、50個、60個または80個以上の連続するアミノ酸の領域にわたって、少なくとも70%、80%、90%または95%の同一性を有する。別の態様において、本発明のSDF-1ポリペプチドは、配列番号:1、2または3の一部と70%未満が同一のアミノ酸配列を含み、このポリペプチドは、配列番号:1、2または3のSDF-1ポリペプチドで得られるものと同等(例えば0.01倍、0.1倍、1.0倍、10倍、または100倍)の活性であるような、CXCR4アゴニスト活性を示す。
【0022】
本発明のある局面において、配列番号:1、2または3といくらかの類似性のある推定SDF-1ポリペプチドは、CXCR4アゴニスト活性について評価することができる。本発明の推定SDF-1ポリペプチドは、例えば放射標識したリガンド受容体競合アッセイ法のような、受容体結合アッセイ法により決定されるようなCXCR4受容体結合についてアッセイすることができる。SDF-1ポリペプチドによるCXCR4の活性化は、細胞内カルシウム動員、細胞走化性、ケミルミネセンス、脱顆粒アッセイ法、活性酸素種のNADPH-依存型の発生の測定、Gプロテイン、ホスホリパーゼC(PLC)、プロテインキナーゼC(PKC)、またはSrcおよびSrcファミリーキナーゼ(すなわち、Fyn)のような第二メッセンジャー酵素の活性化などを含む、標準の生化学的技術による受容体の活性のアッセイを通じて、決定することができる。いくつかの態様において、CXCR4アゴニスト活性、本発明の推定CXCR4アゴニストのCXCR4受容体結合またはCXCR4受容体活性化は、配列番号:1、2または3のポリペプチドの対応するパラメータの少なくとも0.01倍、0.1倍、1.0倍、10倍、または100倍である。
【0023】
別の態様において、様々な小型のSDF-1ペプチド類似体を、CXCR4アゴニストとして使用することができる。このようなペプチドのひとつは、アミノ酸1〜9の二量体であり、そのアミノ酸鎖は、各配列における9位の各システインの間のジスルフィド結合により連結されている(SDF-1(1-9)2またはKPVSLSYRCCRYSLSVPKと称される)。別のペプチドは、アミノ酸1〜8、KPVSLSYR-X-RYSLSVPKの二量体であり、ここでこれらのアミノ酸鎖は、各配列の8位の各アルギニンの間の連結部分Xにより連結されている(SDF-1(1-8)2と称する)。CXCR4アゴニストペプチドは、例えば下記の配列を有するペプチドからなる群より選択することができる:

前記ペプチドにおいて、Xは、リシンのα(アルファ)およびε(イプシロン)両アミノ基が共有(アミド)結合形成により会合され、かつリシルカルボキシル基が保護されているリシンであることができる。前記一覧の中で最後の2種の化合物は、例えば下記のように表され、これは標準のアミノからカルボキシル方向のペプチド配列を示している:

様々な代わりの態様において、このようなSDF-1ペプチド類似体は、SDF-1ポリペプチドと共に、本発明のCXCR4アゴニスト中に含まれる。
【0024】
いくつかの態様において、本発明において使用するためのCXCR4アゴニストは、実質的に精製されたペプチド断片、修飾されたペプチド断片、SDF-1αまたはSDF-1βのいずれかの類似体または薬学的に許容される塩でありうる。CXCR4のSDF-1由来のペプチドアゴニストは、公知の生物学的アッセイ法およびCrumpら、The EMBO Journal、16(23)6996-7007(1997);および、Hevekerら、Current Biology、8(7):369-376(1998)(これらは各々、本明細書に参照として組入れられる)のような様々な技術により同定することができる。このようなSDF-1由来のペプチドは、ペプチドがCXCR4アゴニスト活性を有するという条件で、天然のアイソフォームまたは遺伝的変種のような天然のSDF-1の同族体、または天然のSDF-1の少なくとも一部と40%、50%、60%、70%、80%、90%、95%または99%の配列同一性を有するようなSDF-1に類似した実質的配列を有するポリペプチド、10個、15個、20個、30個、40個、50個以上のアミノ酸の連続した配列である天然のSDF-1の一部を含むことができる。いくつかの態様において、化学的に類似したアミノ酸は、(保存的アミノ酸置換を提供するために)天然のSDF-1配列においてアミノ酸が置換され得る。いくつかの態様において、N末端の10または7個のアミノ酸の内部にN末端LSY配列部分、および/またはN末端の20個のアミノ酸内部のN末端RFFESH(配列番号:5)配列部分を有するペプチドを、これらがCXCR4アゴニスト活性を有するならば使用することができる。このようなペプチドアゴニスト候補のひとつのファミリーは、アミノ酸5〜7にLSYモチーフを有する。別のペプチドは更に、アミノ酸12〜17にRFFESH(配列番号:5)部分を含む。別の態様において、LSY部分は、ペプチドの3〜5位に位置している。本発明は更に、2種のアミノ酸配列を有するペプチド二量体を提供しており、これらは各々、N末端の20個、または好ましくは10個以内のアミノ酸にジスルフィド架橋により結合され、システイン残基またはα-アミノ酪酸残基に連結した、前記配列エレメントを有することができる。
【0025】
本発明は、CXCR4アゴニストを含む薬学的組成物を提供する。一つの態様において、そのような組成物は、骨髄および/もしくは末梢前駆体もしくは幹細胞の増殖、変異、および/または移動を変化させるために十分な治療的または予防的有効量のCXCR4アゴニスト化合物と、薬学的に許容される担体とを含む。もう一つの態様において、組成物は、例えば、癌に対する化学療法または放射線療法に使用されるような細胞傷害性物質による細胞傷害性作用を阻害するために十分な治療的または予防的有効量のCXCR4アゴニスト化合物と、薬学的に許容される担体とを含む。
【0026】
本発明の化合物の「有効量」とは、治療的有効量または予防的有効量を含む。「治療的有効量」とは、骨髄前駆細胞もしくは幹細胞の増殖の低下、または細胞傷害性物質の細胞傷害性作用の低下もしくは阻害のような、望ましい治療的結果を達成するのに必要な用量または期間で有効な量を意味する。CXCR4アゴニストの治療的有効量は、個体の疾患の状態、年齢、性別および体重、ならびに個体におけるCXCR4アゴニストの所望の反応の誘発能のような要因に応じて変化してもよい。投与レジメは最適な治療反応が得られるように調節してもよい。治療的有効量はまた、CXCR4アゴニストの毒性または有害な作用を治療的に恩典を有する作用が上回る量である。
【0027】
「予防的有効量」とは、細胞傷害性物質の細胞傷害性作用を予防もしくは阻害するような望ましい予防的結果を得るために必要な用量および期間で有効な量を指す。典型的に、予防的用量は疾患の発病前、または初期段階に被験者に用いられるため、予防的有効量は治療的有効量より少ない可能性がある。
【0028】
特定の態様において、CXCR4アゴニストの治療的有効量または予防的有効量の好ましい範囲は、0.1 nM〜0.1 M、0.1 nM〜0.05 M、0.05 nM〜15 μM、または0.01 nM〜10 Mであってもよい。用量の値は、緩和すべき疾患の重症度に応じて変化してもよいことに注目すべきである。特定の被験者に関して、個々の需要、および組成物を投与する人または投与を管轄する人の専門的な判断に応じて、経時的に特定の用量レジメを調節することができる。本明細書において述べた用量範囲は説明のためであって、医師によって選択されうる用量範囲を制限するものではない。
【0029】
組成物中の活性化合物の量は、個体の疾患の状態、年齢、性別および体重のような要因に応じて変化してもよい。投与レジメは最適な治療反応が得られるように調節してもよい。例えば、ボーラス投与を1回行ってもよく、数回の分割用量を経時的に投与してもよく、または治療状況の緊急性によって示されるように用量はそれに応じて減少または増加させてもよい。投与を容易にするために、且つ投与を均一に行うために、非経口投与組成物を単位投与剤形に製剤化することは好都合でありうる。本明細書において用いる「単位投与剤形」は、治療すべき被験者の単位用量として適している物理的に個別の単位を指す;それぞれの単位は必要な薬学的担体に関連して所望の治療的作用を生じるように計算される活性化合物の既定量を含む。本発明の単位投与剤形の詳細は、(a)活性化合物の独自の特徴および得られる特定の治療効果、および(b)個体における感受性を治療するための活性化合物のような化合物を合成する技術分野における固有の制限によって指図され、直接依存する。
【0030】
本明細書において用いるように、「薬学的に許容される担体」または「賦形剤」とは、生理学的に適合性である任意の全ての溶媒、分散媒体、コーティング、抗菌剤、抗真菌剤、等張剤、および吸収遅延剤等を含む。一つの態様において、担体は非経口投与に適している。または、担体は、静脈内、腹腔内、筋肉内、舌下、または経口投与に適合することができる。薬学的に許容される担体には、滅菌水溶液または分散液、および滅菌注射用溶液または分散液の即時混合型調製用の滅菌粉末が含まれる。そのような媒体および物質を薬学的に活性な物質に用いることは当技術分野で周知である。従来の媒体または物質が活性化合物と不適合性である場合を除いて、これを本発明の薬学的組成物において用いることが考慮される。補助的な活性化合物もまた組成物に組み入れることができる。
【0031】
いくつかの態様において、CXCR4アゴニストは、追加の活性成分と共に薬学的組成物中に処方するか、または1種もしくはそれ以上の追加の投薬による治療と組み合わせた治療法で投与することができ、このような医薬品は、下記から選択される:組換えメチオニルヒトG-CSF(ノイポゲン(登録商標)、フィルグラスチム;Amgen社)、GM-CSF(リューカイン(登録商標)、サルグラモスチム;Immunex社)、エリスロポエチン(rhEPO、エポジェン(登録商標);Amgen社)、トロンボポエチン(rhTPO;Genentech社)、インターロイキン-11(rhIL-11、ニューメガ(登録商標);American Home Products社)、Flt3リガンド(Mobista;Immunex社)、多系統造血因子(MARstem(商標);Maret Pharm.社)、ミエロポエチン(Leridistem;Searle社)、IL-3、骨髄前駆体阻害因子-1(Mirostipen;Human Genome Sciences社)、および幹細胞因子(rhSCF、ステムジェン(登録商標);Amgen社)。
【0032】
治療的組成物は典型的に、製造および保存条件下で滅菌かつ安定でなければならない。組成物は、溶液、微小乳液、リポソーム、または高い薬物濃度に適したその他の指示された構造に製剤化することができる。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、および液体ポリエチレングリコール等)、および適したその混合液となりうる。適当な流動性は、例えば、レシチンのようなコーティングを用いることによって、分散剤の場合には必要な粒子径を維持することによって、並びに界面活性剤を用いることによって維持することができる。多くの場合、組成物に等張剤、例えば、糖、マンニトール、ソルビトール、または塩化ナトリウムのような多価アルコールを含むことが好ましいと思われる。注射可能な組成物の持続的な吸収は例えば吸収を遅らせる物質を、例えばモノステアリン酸塩およびゼラチン組成物に含めることによって、得ることができる。その上、CXCR4アゴニストは、持効性製剤、例えば徐放性ポリマーを含む組成物において投与することができる。活性化合物は、インプラントおよび微量封入輸送系を含む徐放製剤のような、化合物が急速に放出されないようにする担体と共に調製することができる。エチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、ポリ乳酸およびポリ乳酸ポリグリコール酸コポリマー(PLG)のような生分解性ポリマーを用いることができる。そのような製剤を調製するための多くの方法は特許権が与えられているか、または一般的に当技術分野で既知である。
【0033】
滅菌注射可能溶液は、活性化合物を、必要に応じて上記列挙した成分の1つまたは組合せと共に適当な溶媒中で必要な量を組み入れて、その後濾過滅菌することによって調製することができる。一般的に、分散液は、基礎分散媒体と上記に列挙した成分から必要な他の成分とを含む滅菌媒体に活性化合物を組み入れることによって調製される。滅菌注射液を調製するための滅菌粉末の場合、好ましい調製法は、真空乾燥および凍結乾燥によって生じた活性成分に、あらかじめ濾過滅菌した溶液由来のさらなる所望の成分を添加する。本発明のもう一つの局面に従って、CXCR4アゴニストはCXCR4アゴニストの溶解度を増加させる1つまたはそれ以上のさらなる化合物と共に製剤化してもよい。
【0034】
本発明のCXCR4アンタゴニスト化合物には、C末端ヒドロキシメチル誘導体、O-修飾誘導体(例えば、C末端ヒドロキシメチルベンジルエーテル)、アルキルアミドのような置換されたアミドおよびヒドラジドおよびC末端のフェニルアラニンをフェネチルアミド類似体で置換した化合物(例えば、トリペプチドSer-Ile-Pheの類似体としてのSer-Ile-フェネチルアミド)を含むN末端修飾誘導体のようなSDF-1誘導体が含まれる。
【0035】
本発明のCXCR4アゴニストにおいて、ペプチド構造(SDF-1由来ペプチドのように)は、少なくとも1つの修飾基に直接または間接的にカップリングしてもよい。「修飾基」という用語は、ペプチド構造に間接的に結合する構造(例えば、SDF-1コアペプチド構造に隣接してもよい、さらなるアミノ酸残基、またはその模倣体、類似体もしくは誘導体との安定な非共有結合的会合、または共有結合によって)、並びにペプチド構造(例えば、共有結合または共有カップリングによる)に直接結合する構造を含むと解釈される。例えば、修飾基はSDF-1ペプチド構造のアミノ末端もしくはカルボキシル末端、またはコアドメインに隣接するペプチドまたはペプチド模倣領域にカップリングすることができる。または、修飾基はSDF-1ペプチド構造の少なくとも1つのアミノ酸残基の側鎖、またはコアドメインに隣接するペプチドもしくはペプチド模倣領域にカップリングすることができる(例えば、リジン残基のεアミノ基を通じて、アスパラギン酸残基もしくはグルタミン酸残基のカルボキシル基を通じて、チロシン残基、セリン残基もしくはトレオニン残基のヒドロキシ基を通じて、またはアミノ酸側鎖上のその他の適した反応基を通じて)。ペプチド構造に共有結合的にカップリングした修飾基は、例えば、アミド、アルキルアミノ、スルフィド、カルバメート、または尿素結合を含む化学構造の結合に関して、当技術分野で周知の手段および方法によって結合することができる。
【0036】
いくつかの態様において、修飾基は、環状、複素環状、または多環状基を含みうる。本明細書において用いられる「環状基」という用語は、炭素原子3〜10個、4〜8個、または5〜7個を有する環状の飽和または不飽和(すなわち芳香族)基を含む。例としての環状基には、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、およびシクロオクチルが含まれる。環状基は、非置換であってもよく、または1つもしくはそれ以上の環の位置で置換されていてもよい。環状基は例えば、ハロゲン、アルキル、シクロアルキル、アルケニル、アルキニル、アリール、ヘテロサイクル、ヒドロキシル、アミノ、ニトロ、チオール、アミン、イミン、アミド、ホスホネート、ホスフィン、カルボニル、カルボキシル、シリル、エーテル、チオエーテル、スルホニル、スルホネート、セレノエーテル、ケトン、アルデヒド、エステル、-CF3、-CNによって置換してもよい。
【0037】
「複素環状基」という用語は、環構造が1個または複数のヘテロ原子を含む、炭素原子3〜10個、4〜8個、または5〜7個を有する環状の飽和、不飽和、または芳香族基を含む。複素環状基には、ピロリジン、オキソラン、チオラン、イミダゾール、オキサゾール、ピペリジン、ピペラジン、モルフォリンが含まれる。複素環は、例えば、ハロゲン、アルキル、シクロアルキル、アルケニル、アルキニル、アリール、他のヘテロサイクル、ヒドロキシル、アミノ、ニトロ、チオール、アミン、イミン、アミド、ホスホネート、ホスフィン、カルボニル、カルボキシル、シリル、エーテル、チオエーテル、スルホニル、スルホネート、セレノエーテル、ケトン、アルデヒド、エステル、-CF3、-CNのような置換基によって1つまたはそれ以上の基で置換することができる。複素環はまた、下記のように、他の環状基に架橋または融合してもよい。
【0038】
本明細書において用いられる「多環状基」という用語は、2つまたはそれ以上の炭素が2つの隣接する基に共通であり、従って環が「縮合環」である、2つまたはそれ以上の飽和、不飽和、または芳香族の環状環を意味すると解釈される。隣接しない原子を通じて結合される環は「架橋」環と呼ばれる。多環状基の環のそれぞれは、上記のような、例えば、ハロゲン、アルキル、シクロアルキル、アルケニル、アルキニル、ヒドロキシル、アミノ、ニトロ、チオール、アミン、イミン、アミド、ホスホネート、ホスフィン、カルボニル、カルボキシル、シリル、エーテル、チオエーテル、スルホニル、スルホネート、セレノエーテル、ケトン、アルデヒド、エステル、-CF3、または-CNの置換基で置換することができる。
【0039】
「アルキル」という用語は、直鎖アルキル基、分岐鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基、およびシクロアルキル置換アルキル基を含む、飽和脂肪族基のラジカルを意味する。いくつかの態様において、直鎖または分岐鎖アルキルはその骨格の炭素原子が20個もしくはそれより少なく(直鎖ではC1〜C20、分岐鎖ではC3〜C20)、または炭素原子が10個もしくはそれより少ない。いくつかの態様において、シクロアルキルは環構造の炭素原子が4〜10個であり、例えば炭素原子が5、6または7個である。炭素数を特に明記していなければ、本明細書において用いられる「低級アルキル」とは、上記の通りであり、その骨格構造に炭素原子10個を有するアルキル基を意味する。同様に、「低級アルケニル」および「低級アルキニル」は、10個またはそれより短い炭素鎖長を有する。
【0040】
本明細書および特許請求の範囲を通じて用いられる「アルキル」(または「低級アルキル」)という用語は、「非置換アルキル」および「置換アルキル」の双方を含むと解釈され、後者は、炭化水素骨格の1つまたはそれ以上の炭素上の水素を置換する置換基を有するアルキル部分を意味する。そのような置換基は、例えば、ハロゲン、ヒドロキシル、カルボニル(カルボキシル、ケトン(アルキルカルボニルおよびアリールカルボニル基を含む)ならびにエステル(アルキルオキシカルボニルおよびアリールオキシカルボニル基を含む)のような、チオカルボニル、アシルオキシ、アルコキシル、ホスホリル、ホスホネート、ホスフィネート、アミノ、アシルアミノ、アミド、アミジン、イミノ、シアノ、ニトロ、アジド、スルフヒドリル、アルキルチオ、スルフェート、スルホネート、スルファモイル、スルホンアミド、ヘテロシクリル、アラルキル、または芳香族もしくはヘテロ芳香族部分を含むことができる。炭化水素鎖上で置換された部分は、それ自身適当であれば置換される。例えば、置換アルキルの置換基は、アミノ、アジド、イミノ、アミド、ホスホリル(ホスホネートおよびホスフィネートを含む)、スルホニル(スルフェート、スルホンアミド、スルファモイル、およびスルホネートを含む)、ならびにシリル基のみならず、エーテル、アルキルチオ、カルボニル、(ケトン、アルデヒド、カルボキシレート、およびエステルを含む)、-CF3、-CN等の置換または非置換型を含んでもよい。一例としての置換アルキルを下記に示す。シクロアルキルはさらに、アルキル、アルケニル、アルコキシ、アルキルチオ、アミノアルキル、カルボニル置換アルキル、-CF3、-CN等によって置換することができる。
【0041】
「アルケニル」および「アルキニル」という用語は、長さが類似で、上記のアルキルとの置換が起こりうるが、それぞれ少なくとも1つの二重結合または三重結合を含む、不飽和脂肪族基を意味する。
【0042】
本明細書において用いられる「アラルキル」という用語は、少なくとも1つのアリール基で置換されたアルキル基またはアルキレニル基を意味する。一例としてのアラルキルには、ベンジル(すなわち、フェニルメチル)、2-ナフチルエチル、2-(2-ピリジル)プロピル、5-ジベンゾスベリル等が含まれる。
【0043】
本明細書において用いられる「アルキルカルボニル」という用語は、-C(O)-アルキルを意味する。同様に、「アリールカルボニル」という用語は-C(O)-アリールを意味する。本明細書において用いられる「アルキルオキシカルボニル」という用語は-C(O)-O-アルキルを意味し、「アリールオキシカルボニル」という用語は-C(O)-O-アリールを意味する。「アシルオキシ」という用語は、R7がアルキル、アルケニル、アルキニル、アリール、アラルキル、またはヘテロシクリルである、-O-C(O)-R7を意味する。
【0044】
本明細書において用いられる「アミノ」という用語は、RαおよびRβがそれぞれ独立して、ハロゲン、アルキル、アルケニル、アルキニル、アラルキル、アリールであるか、またはRαおよびRβがそれらが結合する窒素原子と共に原子4〜8個を有する環を形成する、-N(Rα)-(Rβ)を意味する。従って、本明細書において用いられる「アミノ」という用語は、非置換、モノ置換(例えば、モノアルキルアミノまたはモノアリールアミノ)、および二置換(例えば、ジアルキルアミノまたはアルキルアリールアミノ)アミノ基を含む。「アミド」という用語は、R8およびR9が上記の定義の通りである、-C(O)-N(R8)-(R9)を意味する。「アシルアミノ」という用語は、R7が上記の通りであり、R'8がアルキルである、-N(R'8)C(O)-R7を意味する。
【0045】
本明細書に用いられているように、「ニトロ」という用語は-NO2を意味し;「ハロゲン」とは、-F、-Cl、-Brまたは-Iを意味し;「スルフヒドリル」という用語は-SHを意味し;および「ヒドロキシル」という用語は-OHを意味する。
【0046】
本明細書に用いられる「アリール」という用語には、環にゼロから4個のヘテロ原子を含んでもよい、例えばフェニル、ピロリル、フリル、チオフェニル、イミダゾール、オキサゾール、チアゾリル、トリアゾリル、ピラゾリル、ピリジル、ピラジニル、ピリダジニル、およびピリミジニル等のような、5、6および7員環芳香族基が含まれる。環構造にヘテロ原子を有するそれらのアリール基もまた、「アリール複素環」または「ヘテロ芳香族」と呼んでもよい。芳香環は、1つまたはそれ以上の環の位置で、上記のような、例えば、ハロゲン、アジド、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、ヒドロキシル、アミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホネート、ホスフィネート、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、スルホンアミド、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族またはヘテロ芳香族部分、-CF3、-CN等の置換基に置換することができる。アリール基はまた、多環状基の一部となりうる。例えば、アリール基にはナフチル、アントラセニル、キノリル、インドリル等のような縮合芳香族部分が含まれる。
【0047】
修飾基は、ビオチニル構造、フルオレセイン含有基、ジエチレントリアミンペンタアセチル基、(0)-メトキシアセチル基、N-アセチルノイラミニル基、コリル構造またはイミノビオチニル基を含む基であることができる。CXCR4アゴニスト化合物は、当技術分野において公知の方法に従い、そのカルボキシル末端でコリル基により修飾することができる(例えば、Wess, G.ら、Tetrahedron Letters、34:817-822(1993);Wess, G.ら、Tetrahedron Letters、33:195-198(1992);および、Kramer, W.ら、J. Biol. Chem.、267:18598-18604(1992))。コリル誘導体および類似体は、修飾基としても利用することができる。例えば、好ましいコリル誘導体は、Aic(3-(O-アミノエチル-イソ)-コリル)であり、これは更にCXCR4アゴニスト化合物の修飾に使用することができるような遊離のアミノ基を有する。修飾基は「ビオチニル構造」であることができ、これはビオチニル基ならびにそれらの類似体および誘導体を含む(例えば2-イミノビオチニル基)。別の態様において、修飾基は、「フルオレセイン含有基」、例えばSDF-1由来のペプチド構造と5-(および6-)-カルボキシフルオレセイン、スクシンイミジルエステルまたはフルオレセインイソチオシアナートとの反応に由来した基などを含むことができる。様々な別の態様において、修飾基は、N-アセチルノイラミニル基、トランス-4-コチニンカルボキシル基、2-イミノ-1-イミダゾリジンアセチル基、(S)-(-)-インドリン-2-カルボキシル基、(-)-メントキシアセチル基、2-ノルボルナンアセチル基、γ-オキソ-5-アセナフテンブチリル、(-)-2-オキソ-4-チアゾリジンカルボキシル基、テトラヒドロ-3-フロイル基、2-イミノビオチニル基、ジエチレントリアミンペンタアセチル基、4-モルホリノカルボニル基、2-チオフェンアセチル基、または2-チオフェンスルホニル基を含むことができる。
【0048】
本発明のCXCR4アゴニスト化合物は、化合物の望ましい機能性を保持しながら、化合物の特定の特性を変化させるようにさらに修飾することができる。例えば、一つの態様において、インビボ安定性、生物利用可能性、または半減期のような化合物の薬物動態特性を変化させるように、化合物を修飾することができる。検出可能な物質によって化合物を標識するように、化合物を修飾することができる。化合物がさらなる治療的部位にカップリングするように、化合物を修飾することができる。化合物を、その薬物動態特性を変化させるためなどの、さらに化学的に修飾するために反応基を誘導体化することができる。例えば、修飾基をSDF-1コアドメインのアミノ末端に結合させると、化合物のカルボキシル末端をさらに修飾することができる。潜在的なC末端修飾には、化合物のカルボキシペプチダーゼの基質としての作用能を減少させる修飾が含まれる。好ましいC末端修飾物質の例には、アミド基、エチルアミド基、並びにD-アミノ酸およびβ-アラニンのような様々な非天然アミノ酸が含まれる。または、修飾基を凝集コアドメインのカルボキシル末端に結合させると、化合物のアミノ末端はさらに、例えば化合物のアミノペプチダーゼの基質としての作用能を減少させるようにさらに修飾することができる。
【0049】
CXCR4アゴニスト化合物は、検出可能な物質と化合物とを反応させることによって化合物を標識するようにさらに修飾することができる。適した検出可能な物質には、様々な酵素、補欠分子団、蛍光物質、発光物質、および放射性物質が含まれる。適した酵素の例には、西洋ワサビペルオキシダーゼ、アルカリフォスファターゼ、-ガラクトシダーゼ、またはアセチルコリンエステラーゼが含まれ;適した補欠分子団の例には、ストレプトアビジン/ビオチン、およびアビジン/ビオチンが含まれ;適した蛍光物質の例には、ウンベリフェロン、フルオレセイン、フルオレセインイソチオシアネート、ローダミン、ジクロロトリアジニルアミンフルオレセイン、塩化ダンシル、またはフィコエリスリンが含まれ;発光物質の例には、ルミノールが含まれ;および適した放射性物質の例には14C、123I、124I、125I、131I、99mTc、35Sまたは3Hが含まれる。CXCR4アゴニスト化合物は、14Cを修飾基またはCXCR4アゴニスト化合物の1つまたはそれ以上のアミノ酸構造の中に組み入れることによって、14Cによって放射性標識されうる。標識したCXCR4アゴニスト化合物は、化合物のインビボ薬物動態を評価するためのみならず、被験者の疾患の進行または例えば診断目的のために被験者が疾患を発症する可能性を検出するために用いてもよい。CXCR4受容体の組織分布は、被験者に由来するインビボまたはインビトロ試料のいずれかにおいて標識したCXCR4アゴニスト化合物を用いて検出することができる。インビボ診断剤として用いるために、本発明のCXCR4アンタゴニスト化合物は、放射性テクネチウムまたはヨウ素によって標識してもよい。遊離のアミノ基を有するコール酸のAic誘導体のような、標識のキレート剤を導入することができる部位を提供する修飾基を選択することができる。例えば、SDF-1配列内のフェニルアラニン残基(例えばアミノ酸残基13位)は、放射性ヨウ化チロシルに置換することができる。放射性ヨウ素の様々な同位元素の如何なるものも、診断薬を作製するために組み入れることができる。123I(半減期=13.2時間)を全身シンチグラフィーに用い、124I(半減期=4日)を陽電子射出断層撮影(PET)に用い、125I(半減期=60日)は代謝回転試験に用いてもよく、131I(半減期=8日)は、全身計数および遅延型低解像度画像試験に用いてもよい。
【0050】
もう一つの化学修飾において、本発明のCXCR4アゴニスト化合物は、化合物そのものはCXCR4アゴニストとして作用することはないが、インビボで代謝されると本明細書に記述のCXCR4アゴニスト化合物に変化することができる、「プロドラッグ」の形で調製してもよい。例えば、このタイプの化合物では、調節基は、代謝されると活性なCXCR4アゴニストの形に変換することができるプロドラッグの形で存在しうる。修飾基のそのようなプロドラッグ型は、本明細書において「二次修飾基」と呼ばれる。ペプチド骨格の薬物の活性型の輸送を最適にするために代謝を制限する、ペプチドプロドラッグを調製するための多様な戦略が当技術分野で既知である(例えば、モス(Moss, J.)(1995)「ペプチド骨格の薬物の設計:輸送と代謝の調節(Peptide-Based Drug Design:Controlling Transport and Metabolism)」、タイラー&アミドン(Taylor, M. D. & Amidon, G. L.)編、第18章を参照のこと)。
【0051】
本発明のCXCR4アゴニスト化合物は、当技術分野で既知の標準的な技術によって調製することができる。CXCR4アゴニストのペプチドまたはポリペプチドの成分は少なくとも一部では、標準的な技術(Bodansky, M.、「ペプチド合成の原理(Principles of Peptide Synthesis)」、Springer Verlag、ベルリン(1993);Grant, G. A.編、「合成ペプチド;ユーザーズガイド(Synthetic Peptides:A User's Guide)」、W. H. Freeman & Company、ニューヨーク(1992);またはClark-Lewis, I., Dewald, B., Loetscher, M., Moser, B.,およびBaggiolini, M.、(1994)、J. Biol. Chem., 269, 16075-16081などに記載される技術)を用いて合成されるペプチドで構成されうる。自動ペプチドシンセサイザーは市販されている(例えば、アドバンスド・ケムテックモデル396;ミリジェン/バイオサーチ9600)。ペプチドおよびポリペプチドは、標準的な方法に従いCXCR4アゴニスト活性に関してアッセイされうる。ペプチドおよびポリペプチドは、HPLCにより精製され、質量分析により分析されうる。ペプチドおよびポリペプチドは、10%DMSOを含む水を用いて、システインの穏和な酸化により形成されるジスルフィド架橋を介して二量体化されうる。HPLC精製後、二量体形成が質量分析により確認されうる。標準的な方法、例えばアミノ基(例えば、ペプチドのアミノ末端のαアミノ基)、カルボキシル基(例えばペプチドのカルボキシル末端)、ヒドロキシル基(例えば、チロシン、セリンもしくはトレオニン残基上)、またはアミノ酸側鎖上のその他の適した反応基による反応方法を用いて、1つまたは複数の調節基をSDF-1由来ペプチド成分に結合してもよい(例えば、Greene, T. W.およびWuts, P. G. M.「有機合成における保護基(Protective Groups in Organic Synthesis)」、John Wiley & Sons, Inc.、ニューヨーク(1991))。
【0052】
本発明のもう一つの局面において、CXCR4アゴニストペプチドは、ペプチドをコードする核酸分子を用いて、標準的な組換えDNA技術に従って調製してもよい。ペプチドまたはポリペプチドをコードするヌクレオチド配列は遺伝子コードを用いて決定してもよく、このヌクレオチド配列を有するオリゴヌクレオチド分子は標準的なDNA合成法によって合成してもよい(例えば、自動DNAシンセサイザーの使用)。またはペプチド化合物をコードするDNA分子を、標準的な分子生物学技術に従って、天然の前駆体タンパク質遺伝子またはcDNA(例えば、ポリメラーゼ連鎖反応(PCR)および/または制限酵素消化の使用)から誘導することができる。
【0053】
本発明はまた、本発明のペプチドをコードするヌクレオチド配列を含む単離核酸分離を提供する。いくつかの態様において、ペプチドは、天然SDF-1と比較して少なくとも一つのアミノ酸欠失を有するアミノ酸配列を含みうる。「核酸分子」という用語は、DNA分子及びRNA分子を含むものとし、一本鎖であっても又は二本鎖であってもよい。別の態様において、単離核酸は、SDF-1のN末端、C末端、及び/又は内部から一つ又は複数のアミノ酸が欠失したペプチドをコードする。
【0054】
標準的な組換えDNA技術により宿主細胞におけるペプチド化合物の発現を促進するため、ペプチドをコードする単離核酸は、組換え発現ベクターに組み入れられても良い。従って、本発明は、本発明の核酸分子を含む組換え発現ベクターも提供する。本明細書において用いられるように、「ベクター」という用語は、それに機能的に結合されている他の核酸を輸送することができる核酸分子をさす。ベクターには、環状二本鎖DNAプラスミドおよび/またはウイルスベクターが含まれる。ある種のベクターは、それらが導入された宿主細胞において自律的に複製することができる(例えば、細菌性複製開始点を有する細菌ベクター及びエピソーム性哺乳動物ベクター)。その他のベクター(例えば、非エピソーム性哺乳動物ベクター)は、宿主細胞へ導入されたとき宿主細胞のゲノムに取り込まれ、それにより宿主ゲノムと共に複製されうる。ある種のベクターは、それらと機能的に結合した遺伝子の発現を誘導することができる。そのようなベクターは、本明細書において、「組換え発現ベクター」又は単に「発現ベクター」と呼ばれる。
【0055】
本発明の組換え発現ベクターにおいて、ペプチドをコードするヌクレオチド配列は、発現のため用いられる宿主細胞に基づき選択された一つ又は複数の調節配列と機能的に結合していてもよい。「機能的に結合した」又は「機能可能に」結合したという用語は、ペプチド化合物の発現を可能にする様式で(一つ又は複数の)調節配列と結合した、ペプチドをコードする配列を意味する。「調節配列」という用語は、プロモーター、エンハンサー、ポリアデニル化シグナル、及びその他の発現調節要素を含む。そのような調節配列は、例えば、Goeddel;Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif.(1990)(本明細書に参照として組み込まれる)に記載されている。調節配列には、多くの型の宿主細胞におけるヌクレオチド配列の構成性発現を導くもの、ある種の宿主細胞のみにおけるヌクレオチド配列の構成性発現を導くもの(例えば、組織特異的調節配列)、及び調節可能な様式で(例えば、誘導剤の存在下でのみ)発現を導くものが含まれる。発現ベクターの設計は、形質転換される宿主細胞の選択、および所望のペプチド化合物の発現レベルのような要因によると考えられる。
【0056】
本発明の組換え発現ベクターは、原核細胞又は真核細胞におけるペプチド化合物の発現のため設計されうる。例えば、ペプチド化合物は、大腸菌のような細菌細胞、昆虫細胞(バキュロウイルス発現ベクターを用いる)、酵母細胞、又は哺乳動物細胞において発現されうる。適当な宿主細胞は、Goeddel;Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif.(1990)にさらに論じられている。又は、組換え発現ベクターは、例えばT7プロモーター調節配列及びT7ポリメラーゼを用いて、インビトロで転写及び翻訳されうる。酵母S.セレビシエ(S.cerevisae)における発現のためのベクターの例には、pYepSec1(Baldariら,(1987)EMBO J.6:229-234)、pMFa(KurjanおよびHerskowitz,(1982)Cell 30:933-943)、pJRY88(Schultzら,(1987)Gene 54:113-123)、及びpYES2(Invitrogen Corporation, San Diego, Calif.)が含まれる。培養昆虫細胞(例えば、Sf9細胞)におけるタンパク質又はペプチドの発現のために利用可能なバキュロウイルスベクターには、pAc系(Smithら,(1983)Mol.Cell.Biol.3:2156-2165)及びpVL系(Lucklow,V.A.,およびSummers,M.D.,(1989)Virology 170:31-39)が含まれる。哺乳動物発現ベクターの例には、pCDM8(Seed,B.,(1987)Nature 329:840)及びpMT2PC(Kaufmanら(1987),EMBO J.6:187-195)が含まれる。哺乳動物細胞において用いられる場合、発現ベクターの調節機能は、ウイルス性調節要素により提供される場合が多い。例えば、一般的に用いられるプロモーターは、ポリオーマ、アデノウイルス2型、サイトメガロウイルス、及びSV40由来のものである。
【0057】
制御調節配列に加え、組換え発現ベクターは、例えばベクターを取り込んだ宿主細胞を同定するための選択マーカー遺伝子のような、付加的なヌクレオチド配列を含有しうる。選択マーカー遺伝子は、当技術分野において周知である。宿主細胞、特に哺乳動物宿主細胞からのペプチド化合物の分泌を促進するため、組換え発現ベクターは、好ましくは、ペプチド化合物が発現時にそのアミノ酸と融合したシグナル配列と共に合成されるように、ペプチド化合物のアミノ末端をコードする配列と機能的に結合したシグナル配列をコードする。このシグナル配列は、ペプチド化合物を細胞の分泌経路へと導き、その後、切断され、宿主細胞からの成熟ペプチド化合物(即ち、シグナル配列を含まないペプチド化合物)の放出を可能にする。哺乳動物宿主細胞からのタンパク質又はペプチドの分泌を促進するためのシグナル配列の使用は、当分技術野において周知である。
【0058】
ペプチド化合物をコードする核酸を含む組換え発現ベクターは、宿主細胞へ導入され、宿主細胞においてペプチド化合物を産生することができる。従って、本発明は、本発明の組換え発現ベクターを含有する宿主細胞も提供する。「宿主細胞」及び「組換え宿主細胞」という用語は、本明細書において互換的に用いられる。そのような用語は、特定の対象細胞のみならず、そのような細胞の継代細胞、又は継代細胞である可能性のある細胞をもさす。変異又は環境的影響のいずれかのため後代においてはある種の修飾が起こりうるため、そのような継代細胞は、実際は、親細胞と同一でないかもしれないが、それでも、本明細書において用いられるようにその用語の範囲内に含まれる。宿主細胞は、任意の原核細胞又は真核細胞でありうる。例えば、ペプチド化合物は、大腸菌のような細菌細胞、昆虫細胞、酵母、又は哺乳動物細胞において発現されうる。ペプチド化合物は、遺伝子治療により被験者に対して被験者のインビボで発現される(以下に更に論じる)。
【0059】
ベクターDNAは、通常の、形質転換、トランスフェクション、または感染の技術を介して原核細胞又は真核細胞へ導入される。「形質転換」、「トランスフェクション」、および「感染」という用語は、リン酸カルシウム又は塩化カルシウム共沈殿、DEAEデキストラン媒介トランスフェクション、リポフェクション、エレクトロポレーション、マイクロインジェクション、及びウイルスを介した感染を含む、外来核酸を宿主細胞へ導入するための技術をさす。宿主細胞を形質転換、トランスフェクション、または感染させるための適当な方法は、例えばSambrookら(「分子クローニング:実験マニュアル(Molecular Cloning:A Laboratory Manual)」、第2版、Cold Spring Harbor Laboratory Press(1989))及びその他の実験書に見出すことができる。インビボの哺乳動物細胞へDNAを導入するための方法も既知であり、遺伝子治療の目的のため被験者に本発明のベクターDNAを輸送するために用いられうる。
【0060】
哺乳動物細胞の安定的なトランスフェクションのため、用いられる発現ベクター及びトランスフェクション技術により異なるが、細胞のほんの一部のみが、外因性DNAをゲノム中に組み込まれることが知られている。これらの組込み体を同定及び選択するため、選択マーカー(例えば、抗生物質に対する耐性)をコードする遺伝子を、対象となる遺伝子と共に宿主細胞に導入してもよい。好ましい選択マーカーには、G418、ハイグロマイシン、及びメトトレキセートのような薬物に対する耐性を与えるものが含まれる。選択マーカーをコードする核酸は、ペプチド化合物をコードする核酸と同一のベクターで宿主細胞へ導入されてもよいし、別々のベクターで導入されてもよい。導入された核酸で安定的にトランスフェクションされた細胞は、薬物選択により同定されうる(選択マーカー遺伝子を取り込んだ細胞は生存するが、他の細胞は死滅する)。
【0061】
本発明の核酸は、DNAの直接注入、受容体を介したDNAの取り込み、又はウイルスを介した感染のような方法を用いて、インビボの細胞へ輸送されうる。直接注入は、裸のDNAをインビボの細胞へ導入するために用いられている(例えば、Acsadiら(1991)Nature 332:815-818;Wolffら(1990)Science 247:1465-1468を参照のこと)。インビボの細胞にDNAを注入するための輸送装置(例えば、「遺伝子銃」)が用いられうる。そのような装置は市販されている(例えば、BioRad)。細胞表面受容体に対するリガンドとカップリングしたポリリジンのような陽イオンと、DNAを複合体化することによって、裸のDNAを細胞に導入することもできる(例えば、Wu,G.およびWu,C.H.(1988)J.Biol.Chem.263:14621;Wilsonら(1992)J.Biol.Chem.267:963-967;及び米国特許第5,166,320号を参照のこと)。DNA-リガンド複合体と受容体との結合により、受容体媒介エンドサイトーシスによるDNAの取り込みが促進されうる。エンドソームを破壊し、それにより物質を細胞質へと放出するアデノウイルス・カプシドと結合したDNA-リガンド複合体を、細胞内リソソームによる複合体の分解を回避するために用いてもよい(例えば、Curielら(1991)Proc.Natl.Acad.Sci.USA 88:8850;Cristianoら(1993)Proc.Natl.Acad.Sci.USA 90:2122-2126を参照のこと)。
【0062】
欠陥レトロウイルスが、遺伝子治療目的の遺伝子移入における使用のため、よく特徴決定されている(概説については、Miller, A. D.(1990)Blood 76:271、Kumeら(1999)International. J. Hematol. 69:227-233を参照のこと)。組換えレトロウイルスを作製し、そのようなウイルスをインビトロ又はインビボの細胞に感染させるためのプロトコルは、「分子生物学の最新プロトコール(Current Protocols in Molecular Biology)」、Ausubel, F. M.ら、(編)、Greene Publishing Associates,(1989),Sections 9.10-9.14及びその他の標準的な実験マニュアルに見出されうる。適当なレトロウイルスの例には、当業者に周知のpLJ、pZIP、pWE、及びpEMが含まれる。適当なパッケージング・ウイルス系の例には、.pψi.Crip、.pψi.Cre、.pψi.2、及び.pψi.Amが含まれる。レトロウイルスは、インビトロ及び/又はインビボの上皮細胞、内皮細胞、リンパ球、筋芽細胞、肝細胞、骨髄細胞を含む多くの異なる細胞型へ、多様な遺伝子を導入するために用いられている(例えば、Eglitis,ら、(1985)Science 230:1395-1398;DanosおよびMulligan(1988)Proc. Natl. Acad. Sci. USA 85:6460-6464;Wilsonら(1988)Proc. Natl. Acad. Sci. USA 85:3014-3018;Armentanoら(1990)Proc. Natl. Acad. Sci. USA 87:6141-6145;Huberら(1991)Proc. Natl. Acad. Sci. USA 88:8039-8043;Ferryら(1991)Proc. Natl. Acad. Sci. USA 88:8377-8381;Chowdhuryら(1991)Science 254:1802-1805;van Beusechemら(1992)Proc. Natl. Acad. Sci. USA 89:7640-7644;Kayら(1992)Human Gene Therapy 3:641-647;Daiら(1992)Proc. Natl. Acad. Sci. USA 89:10892-10895;Hwuら(1993)J. Immunol. 150:4104-4115;米国特許第4,868,116号;米国特許第4,980,286号;国際公開公報第89/07136号;国際公開公報第89/02468号;国際公開公報第89/05345号;及び国際公開公報第92/07573号を参照のこと)。様々な態様において、本発明のポリペプチド化合物をコードおよび発現するレトロウイルスゲノムは、造血前駆幹細胞のような細胞の増殖および/または生存のため、輸血または生着、化学療法、放射線療法または脊髄解離性療法に関連した宿主の馴化または適応の臨床目的のための細胞の維持および/または増殖のために利用することができる。
【0063】
遺伝子治療用のベクターとして使用するために、アデノウイルスのゲノムを、正常な溶解性ウイルス生活環において複製する能力に関して不活化されることなく、本発明のペプチド化合物をコードし発現するように操作してもよい。例えば、Berknerら(1988)BioTechniques 6:616;Rosenfeldら(1991)Science 252:431-433;及びRosenfeldら(1992)Cell 68:143-155を参照のこと。アデノウイルス株Ad5型d1324又はその他のアデノウイルス株(例えば、Ad2、Ad3、Ad7など)に由来する適当なアデノウイルスベクターは、当業者に周知である。組換えアデノウイルスは、効率的な遺伝子輸送媒体となるために分裂細胞を必要とせず、気道上皮(Rosenfeldら(1992)、前記)、内皮細胞(Lemarchandら(1992)Proc. Natl. Acad. Sci. USA 89:6482-6486)、肝細胞(HerzおよびGerard(1993)Proc. Natl. Acad. Sci. USA 90:2812-2816)、及び筋細胞(Quantinら(1992)Proc. Natl. Acad. Sci. USA 89:2581-2584)を含む極めて多様な細胞型を感染させるために用いられうるために有利である。様々な態様において、本発明のポリペプチド化合物をコードおよび発現するアデノウイルスゲノムは、造血前駆幹細胞、間質細胞、または間葉細胞のような細胞の増殖および/または生存のため、輸血または生着、化学療法、放射線療法または脊髄解離性療法に関連した宿主の馴化または適応の臨床目的のための細胞の維持および/または増殖のために利用することができる。
【0064】
いくつかの態様において、アデノ随伴ウイルス(AAV)も、遺伝子治療目的のためのDNAの輸送において、遺伝子治療用ベクターとして用いることができる。AAVは、効率的な複製及び生産的な生活環のために、ヘルパーウイルスとして、アデノウイルス又はヘルペスウイルスのような他のウイルスを必要とする、天然に存在する欠陥ウイルスである(MuzyczkaらCurr. Topics in Micro. and Immunol.(1992)158:97-129)。AAVは、非分裂細胞中にDNAを導入するために使用することができる(例えば、Flotteら(1992) Am. J. Respir. Cell. Mol. Biol. 7:349-356;Samulskiら(1989)J. Virol. 63:3822-3828;及びMcLaughlinら(1989)J. Virol. 62:1963-1973を参照のこと)。Tratschinら(1985)Mol. Cell. Biol. 5:3251-3260に記載されているもののようなAAVベクターが、DNAを細胞へ導入するために用いられうる(例えば、Hermonatら(1984)Proc. Natl. Acad. Sci. USA 81:6466-6470;Tratschinら(1985)Mol. Cell. Biol. 4:2072-2081;Wondisfordら(1988)Mol. Endocrinol. 2:32-39;Tratschinら(1984)J. Virol. 51:611-619;及びFlotteら(1993)J. Biol. Chem. 268:3781-3790)。いくつかの態様において、本発明のポリペプチド化合物をコードおよび発現するAAVゲノムは、造血前駆幹細胞、間質細胞、または間葉細胞のような細胞の増殖および/または生存のため、輸血または生着、化学療法、放射線療法または脊髄解離性療法に関連した宿主の馴化または適応の臨床目的のための細胞の維持および/または増殖のために利用することができる。
【0065】
遺伝子治療のための一般的な方法は、当技術分野において既知である。例えば、アンダーソン(Anderson)らによる米国特許第5,399,346号を参照のこと。遺伝物質を輸送するための生体適合性カプセルが、ベテージ(Baetage)らによる国際公開公報第95/05452号に記載されている。中枢神経系障害を治療するため遺伝学的に修飾された細胞を移植するための方法は、米国特許第5,082,670号及び国際公開公報第90/06757号及び同第93/10234号に記載されている。これらは全てゲージ(Gage)らによる。造血細胞への遺伝子導入法は、先に報告されている(Clapp, D. W.ら、Blood、78:1132-1139(1991);Anderson、Science、288:627-9(2000);および、Cavazzana-Calvoら、Science、288:669-72(2000)参照、これらは全て本明細書に参照として組入れられる)。
【0066】
本発明の様々な局面のCXCR4アゴニスト治療に感受性のある癌は、乳房、結腸、直腸、中咽頭、下咽頭、食道、胃、膵臓、肝臓、胆嚢および胆管、小腸、尿管(腎、膀胱および尿路上皮を含む)、女性生殖道(子宮頸部、子宮、および卵巣に加え、絨毛上皮腫および妊娠絨毛性疾患)、男性生殖道(前立腺、精嚢、精巣および生殖細胞腫瘍を含む)、内分泌腺(甲状腺、副腎、および下垂体を含む)、ならびに皮膚の癌腫、更には血管腫、黒色腫、肉腫(骨および軟組織に生じるものに加え、カポジ肉腫を含む)ならびに脳、神経、目、および髄膜の腫瘍(星状細胞腫、神経膠腫、網膜芽腫、神経腫、神経芽細胞腫、シュワン細胞腫、および髄膜腫)を含む、固形腫瘍のような原発性および転移性の両方の腫瘍である。本発明の一部の局面において、CXCR4アゴニストは、白血病のような、造血系悪性疾患から生じる固形腫瘍のような腫瘍(すなわち、緑色腫、形質細胞腫ならびに菌状息肉腫および皮膚T細胞リンパ腫/白血病のプラーク及び腫瘍)の治療に加え、リンパ腫(ホジキンおよび非ホジキンリンパ腫の両方)の治療にも有用である。加えて、CDCX4アゴニストは、単独で使用した場合、または放射線療法もしくは化学療法剤などの細胞傷害性物質との併用した場合のいずれかにおいて、前述の腫瘍からの転移の防止に有用でありうる。
【0067】
本発明の別の局面において、SDF-1ポリペプチドのようなCXCR4アゴニストは、末梢血にCD34+細胞の放出を媒介するために、CD34+細胞を標的とすることができる。本発明のこれらの局面において、SDF-1などのCXCR4アゴニストは、循環CD34+細胞の増殖ならびに造血幹細胞または前駆細胞の生存またはレベルを増強することができ、これは例えば幹細胞移植において有用であることができる。
【0068】
本発明の様々な局面において、CXCR4アゴニストは、造血細胞増殖速度を低下させる際に使用することができる。本発明の方法は、造血幹細胞および造血前駆細胞、ストローマ細胞、または間充織細胞からなる群より選択された細胞へ有効量のCXCR4アゴニストを投与する段階を含むことができる。別の態様において、治療的有効量のCXCR4アゴニストを、このような治療が必要な患者へ投与することができる。このような治療が必要な患者は、例えば以下を含む:癌患者、自己免疫疾患患者、造血幹細胞、ストローマ細胞または間充織細胞への機能的遺伝子導入が必要な患者(例えば幹細胞が分化するような組織または器官の機能不全)、リンパ球枯渇が必要な患者、自家もしくは同種移植片を用いる自己反応性細胞または癌性細胞のパージの形での血液癌の枯渇が必要な患者、または自家末梢血幹細胞移植が必要な患者。本発明の治療が必要な患者は、化学療法または放射線療法のような細胞傷害性治療を受け取ることもできる。いくつかの態様において、CXCR4アゴニストは、造血前駆細胞または幹細胞の生存力を保存しながら、細胞傷害性治療による癌細胞のエキソビボにおける造血幹細胞培養をパージするために、治療において使用することができる。
【0069】
別の態様において、CXCR4アゴニストは、例えば以下のような治療が必要な患者において、造血細胞を治療するために、本発明に従い使用することができる:
i)放射線照射後の造血回復および骨髄再生において;
ii)用量強化化学療法に関連した骨髄抑制を改善するため;
iii)収集および末梢血幹細胞移植のための高品質の動員された前駆細胞を維持ことにおいて;
iv)自家幹細胞移植後の造血能回復を増強するため;
v)癌および感染症の免疫療法において;
vi)固形器官再生において(SilbersteinおよびToy、JAMA、285:577-580(2001));
vii)造血前駆細胞(Hacein-Bey、Hum. Gene Ther.、12:291-301(2001);KajiおよびLeiden、JAMA、285:545-550(2001))、ストローマ細胞または間充織細胞への幹細胞遺伝子療法およびレトロウイルス遺伝子導入において;
viii)骨発生、骨修復、および骨格再建療法において。
【0070】
本発明の様々な態様が本明細書において明らかにされているが、多くの適応および変更を、当業者に共通の一般的知識に従い本発明の範囲内で行うことができる。このような変更は、実質的に同じ方法で同じ結果を達成するための、本発明のいずれかの局面に関する公知の同等物との置換を含む。数値範囲は、その範囲で定義された数字を含む。特許請求の範囲において、「を含む(comprising)」という用語は、オープン-エンド(open ended)用語として使用され、「を含むが、これらに限定されるものではない」という句と実質的に同一である。
【0071】
実施例
下記実施例は、本発明を例証するものであって、制限するものではない。
【0072】
実施例1
本発明のペプチドは、例えば下記のプロトコールを用いて実行することができるような、連続フローペプチド合成装置におけるFmoc/tBu法を用い、化学的に合成することができる。
【0073】
A)試薬(溶媒、支持体、化学物質)
主要溶媒:N,N-ジメチルホルムアミド(DMF):Fisher(D131-4)で分光分析されたACS認証、分子量=73.10。このDMFは、少なくとも2週間、活性化した分子篩4A型(BDH:B54005)により処理され、その後FDNB(2,4-ジニトロフルオロベンゼン、Eastman社)により処理されている。
【0074】
手順:等容量のFDNB溶液(95%EtOH中1mg/ml)およびDMFを混合;30分間静置;FDNBブランク(0.5ml FDNB+0.5ml 95%EtOH)について、吸光度を381nmで測定。吸光度が〜0.2であるならば、DMFは本合成での使用に適している。
【0075】
脱保護剤:0.5%トリトンX100v/v(Sigma社、カタログ番号T9284)を含有するDMFを溶媒とする、20%ピペリジン(Aldrich Chemical社、カタログ番号:10,409-4)。
【0076】
活性化剤:2-(H-ベンゾトリアゾール-リル)1,1,3,3-テトラメチルウロニウムテトラフルオロホウ酸(TBTU:分子量=321.09、Quantum Richilieu社、カタログ番号:R0139)/ヒドロキシベンゾトリアゾール(HOBt、分子量=135.1、Quantum Richilieu社、カタログ番号:R0166-100)を各々、DMFおよび4-メチルモルホリン(NMM、分子量=101.15、d=0.926、Aldrich社、カタログ番号:M5,655-7)中に0.52M:DMF中、またはCysのようなラセミ化に敏感なアミノ酸中の場合は0.9M、本発明者らは2,4,6-コリジン、99%(分子量=121.18、d=0.917、Aldrich社、カタログ番号:14,238-7)を使用:DMF/DCM、1/1v/v中に0.78M。
【0077】
支持体:TentaGel R RAM (90μm)、RinK-型Fmoc(Peptides International社、カタログ番号:RTS-9995-PI):0.21mmol/g、0.1mmolのペプチドについて0.5g。
【0078】
側鎖が以下で保護されたFmoc-L-アミノ誘導体:Boc;tBu;Trt基:4倍過剰(Peptides International社、Bachem社、Novabiochem社、ChemImpex社)。Glu24およびLys24は、アリル保護されている(Millipore/Perseptive Biosystems社)。
【0079】
B)最初のアミノ負荷およびペプチド合成手順
最初のアミノ酸Asn31および残りの残基は、各結合において4倍過剰で450℃で自動的に二重結合した。この合成は、残基Leu19の後で中断される。ペプチド結合した支持体を、合成装置カラムから取り出し、緩徐な攪拌のための小型の磁気攪拌子を有する反応バイアルに入れた。
【0080】
C)アリル基の除去
5%酢酸中に溶解したテトラキス(トリフェニルホスフィン)パラジウム(0) Pd(PPh3)4(Sigma-Aldrich社、カタログ番号:21,666-6);分子量=1155.58 x 0.1mmolペプチド x 3倍=347mgの溶液;CHCl3を溶媒とする2.5%NMMで、0.14M、アルゴン雰囲気下。この溶液を、支持体に結合したペプチドに添加し、その後、緩徐に攪拌を行うために、小型の磁気攪拌子を有する反応バイアル中のカラムから取除く。この混合液を、アルゴンでフラッシュし、密封し、室温で6時間攪拌する。支持体に結合したペプチドを、濾過漏斗に移し、DMF中0.5%ジエチルジチオカーボネートナトリウム溶液30ml;DCM;DCM/DMF(1:1)およびDMFで洗浄する。陽性カイザー(Kaiser)試験は、Lys20のアミノ側鎖の脱保護を示している。
【0081】
D)ラクタム形成:
活性化剤:7-アザベンズトリアゾール-1-イルオキシトリス(ピロリジノ)ホスホニウム-ヘキサフルオロリン酸(PyAOP:分子量=521.7、PerSeptive Biosystems社、カタログ番号:GEN076531)、1.4倍:0.105mmol x 1.4 x 521.7=76.6mgおよびNMM、1.5倍:0.105 x 1.4 x 1.5=0.23mmol、v=0.23/0.9M、NMM溶液=263μl)。
【0082】
環化は、アミノ酸バイアル中で、室温でゆるやかに攪拌しながら一晩(〜16時間)かけて行うことができる。環化の完了は、陰性カイザー(kaiser)試験により示すことができる。支持体に結合したペプチドを、カラムに注ぎ、DMFで洗浄し、合成が完了するまで続け、これにより環状アミド架橋をペプチドに導入することができる。
【0083】
E)最終生成物の支持体からの除去
支持体に結合したペプチドを、合成装置から中型濾過漏斗へと取除き、DCMで洗浄し、不揮発性DMFと交換し、高真空下で少なくとも2時間、または好ましくは一晩かけて完全に乾燥する。
切断混合物(試薬K):
TFA/フェノール/水/チオ-アニソール/EDT(82/5/5/5/2.5);7.5ml
支持体:0.5g樹脂-ペプチド。

【0084】
切断は、振盪器上で緩やかに攪拌しながら、室温で4時間かけて行うことができる。
【0085】
F)ペプチドの沈殿
切断したペプチド溶液を、50mlの丸底フラスコ中に濾過漏斗を通して濾過する。支持体を、TFA 4mlで2回すすぐ。TFA溶液を、回転蒸発装置(rotavap)で濃縮し、活性化した中性酸化アルミニウムで予め処理した冷ジエチルエーテルへ滴下し、これを過酸化物から遊離する。約10倍過剰のエーテルを使用する。ビーズは、収量を決定しペプチドを特徴決定するまで貯蔵する。沈殿を、ねじ込みキャップ付き50mlポリプロピレン製バイアル中に、トップベンチ(top bench)遠心(試行時間4分間)を用い、2000rpmでの遠心により、室温で収集する。ペレットを、3x冷エーテルで洗浄し、遠心し、アルゴン流により乾燥する。沈殿を、0.1% TFAを溶媒とする20%アセトニトリル中に溶解し、凍結乾燥する。
【0086】
G)粗生成物の特徴決定
生成物を、分析的HPLCにより特徴決定する。
実験条件:カラム:Vydac 218TP54:C18逆相5μm、直径4.6mmx長さ150mm。
溶離液:0.1% TFA/H2O(溶媒A);0.1%TFA/アセトニトリル(溶媒B)
溶離条件:20〜50%B(40分間);60〜90%B(5分間);90〜20%B(5分間);20%B(10分間)。1.0ml/分およびA214nm=0.5吸光度単位フルスケール
【0087】
H)試料の調製
生成物のアリコートを秤量し、濃度2mg/mlで20%アセトニトリル0.1%TFA中に溶解する。この溶液を微量遠心し、20μlをカラムに負荷する。主要ピークまたは大きなピークを収集し、SpeedVac乾燥し、質量分析により分子量を決定する。
【0088】
本発明の様々な局面に従い、広範なペプチド配列を調製し、それに関して下記の命名法を使用する。ケモカイン配列に相当するペプチド部分、例えばSDF-1配列は、ケモカインの対応する部分を特定することにより確定することができ、ここで例えばSDF-1配列の表示は、配列番号:1の配列の一部と実質的に同一性を有する配列を意味する。例えば、命名SDF-1(1-14)は、配列番号:1のSDF-1のN末端配列の最初の14個のアミノ酸を意味する。いくつかの態様において、SDF-1配列のN末端およびC末端部分は、様々なアミノ酸により、または式(L)n(式中Lは、例えばアミノ酸である連結基を意味し、かつnは0または整数である)で示される他の連結部分により、連結することができる。このペプチドのカルボキシル末端は、カルボン酸よりはむしろアミドに修飾することができる。いくつかの態様において、本発明のポリペプチドは、下記式であることができる:
SDF-1(1-X)-(L)n-SDF-1(Y-Z)
式中、
Xは、5〜20の整数であり;
Lは、少なくとも1個の炭素原子を有する連結部分、例えば置換もしくは非置換のアルキル部分またはアミノ酸であり;
nは、1〜50の整数であり;
Yは、50〜60の整数であり;
Zは、60〜67の整数である。
【0089】
いくつかの態様において、例えば(CH2)nは、N末端およびC末端の間のリンカー(L)として使用することができ、式中、nは整数であり、例えば20、30、40、50または100未満であってもよい。
【0090】
直鎖状ポリペプチド配列の例示的態様を以下に示す:

【0091】
別の態様において、本発明のペプチドは環化され、例えばグルタミン酸(E)およびリシン(K)残基は、連結した残基を二重下線で示した下記の配列において示されたような、ラクタム形成法を用いる側鎖環化により結合することができる。ラクタムは、例えばこのポリペプチドにおいて、アミノ酸残基24位のグルタミン酸(E)および20位または28位のいずれかのリシン(K)の間に形成される(これは、天然の配列中の残基の番号に必ずしも対応していない)。更に別のものにおいて、リシン(K)は、ロイシン(L)、オルニチン(O)または他の疎水性残基、例えばイソロイシン(I)、ノルロイシン(Nle)、メチオニン(M)、バリン(V)、アラニン(A)、トリプトファン(W)、またはフェニルアラニン(F)により置換することができる。同様に、グルタミン酸(E)は、例えばアスパラギン酸(D)で置換することができ、これはペプチドの24位においてアスパラギン酸にグルタミン酸が置換されていることを示している記述(E24->D)により示される。
【0092】

【0093】
本発明のペプチドの別の態様において、下線のスペーサーモノマー(例えば例示されたグリシンG)を、様々な数、例えば2、3または4個のグリシンなどで使用することができる。
【0094】
別の態様において、本発明のペプチドの内部環化は、別の位置、または置換されたアミノ酸の間であってもよい。同じく環状連結の性質は変動することができる。例えば、連結は、関連のあるグルタミン酸(E)をアスパラギン酸(D)残基で置換することにより、および/またはリシン(K)をオルニチン(O)残基で置換することにより短縮することができる。環化は、例示したポリペプチドの一部に説明したように、例えば、アスパラギン酸24(D24)およびリシン20または28(K20またはK28)の間で可能である。
【0095】

【0096】
ジスルフィドまたはスルフィド架橋は、本発明のポリペプチドの別の態様を生成するために使用することができ、ここでシステイン残基は、例えば下記配列において二重下線を付けた残基で示されるような、架橋形成に関連することができる。
【0097】

【0098】
ある局面において、本発明のポリペプチド化合物は、下記を有するペプチドを含むCXCR4アゴニストを提供することができる:(a)ケモカインと相同なN末端配列、例えばSDF-1 N末端配列;(b)ケモカインと相同なC末端配列、例えばSDF-1 C末端配列;(c)N末端配列をC末端配列に結合する連結部分、例えばポリペプチドリンカー;および、(d)ポリペプチド部分の間に形成された内部環状架橋、例えば第一のアミノ酸残基のカルボン酸側鎖と第二のアミノ酸残基のアミン側鎖を連結するアミド。いくつかの態様において、C末端配列は、内部環状架橋を含むことができる。
【0099】
前述のように、3個または4個のグリシンリンカーによりC末端SDF-1残基(55-67)に連結されたN末端SDF-1残基(1-14)または(1-17)を有する本発明のポリペプチドの例示的態様が合成されている。いくつかの態様において、ペプチドは、グルタミン酸(24位)およびリシン(20または28位)の間で環化されている。ラクタム化は、パラジウム法を用い、リシンおよびグルタミン酸の両方の側鎖からアリル型基を取除き、次に対応するリシンおよびグルタミン酸の間に内部アミド結合形成を実行することによって作用され得る。このポリペプチドファミリーの選択されたメンバーは、CXCR4受容体結合アッセイ法(CEM細胞)および[Ca2+]動員の活性化(THP-1細胞)において高い親和性を示した。ポリペプチドの更なる態様を以下に列記する:

オルニチン(O)とグルタミン酸(E)の間にも環化が生じ得る。

オルニチン(O)とアスパラギン酸(D)の間にも環化が生じ得る。

【0100】
いくつかの態様において、6位のプロリン(P)は、セリン(S)と交換され得る。いくつかの態様において、リシン(K)およびグルタミン酸(E)は、各々、オルニチン(O)およびアスパラギン酸(D)で置換することができる。同様に、置換は、LSYR領域において生じ、ロイシン(L)、セリン(S)、チロシン(Y)またはアルギニン(R)を、プロリン(P)または他の類似した形状の部分で置換することができる。あるいは、プロリンは、P*と置換することができる:
ここでP*は下記式である:
【化1】

(X=Ar、Ar-OH、アルキル、およびそれ以外)
【0101】
多種多様なアミノ酸置換、例えばKからE、KからD、OからE、OからDなどを、ポリペプチド配列において行うことができる。天然のアミノ酸以外の部分、例えば下記のBtdなども、置換することができる:
ここでBtd*は下記式である:
【化2】

または
【化3】

または
【化4】

(X=アルキル、Ar、Ar-OH、およびそれ以外)
【0102】
同様に、ポリペプチドは、SDF-1以外のケモカイン由来の配列を用いて調製することができる。例えばMIP-1αの残基36〜50、10〜50、または55〜70など:

【0103】
様々な図面において、化合物は下記の略号により確定される:
CTCE99O1の構造:
SDF-1(1-9)2-C9/C9-システイン二量体

CTCE99O2の構造:
SDF-1(1-17)

CTCE99O4の構造:
SDF-1(1-8)2-リシン架橋二量体

CTCEOO13の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)酸

CTCE0017の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)アミド

CTCE0022の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミド

CTCE0021の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド

【0104】
実施例2
表1および表2は、CXCR4アゴニストの骨髄前駆細胞への作用、特に未成熟赤芽球細胞および未成熟顆粒球への作用を成熟顆粒球と比較して示している。表1および表2のデータを得るために、各化合物または生理食塩水単独(対照としての「薬物なし」)と共に予備インキュベーションした。その後、細胞を、細胞傷害性物質である高用量3H-チミジンに曝露した。活発に分裂している細胞は、細胞傷害性放射性チミジンを均等に増すように蓄積し、結果的に優先的に殺傷された。対照と比較したチミジン処理により殺傷された細胞の相対割合は、それらの化合物の細胞増殖を低減する、すなわち細胞周期の進行速度を低下させる相対効果の指標である。対照と比較して殺傷された細胞のより高い(または変化のない)割合は、化合物が所定の細胞型において細胞増殖を減少しないことを示している。
【0105】
(表1) CXCR4アゴニストの3H-チミジンに曝露した骨髄前駆細胞への作用

【0106】
表1において、SDF-1ポリペプチド

は、ヒト骨髄細胞培養物において100ng/mlで使用される。
SDF-1(1-9)2

は、ヒト骨髄細胞培養物において50μg/mlで使用される。
【0107】
表2は、本実施例において先に説明したアッセイ法によっては、SDF-1(1-14)-(G)4-SDF-1(55-67)-アミドおよびSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドは共に、ヒト陽性赤芽球細胞および未成熟顆粒球形成細胞では細胞周期を阻害することができるが、成熟顆粒球形成細胞では阻害できないことを明らかにしている。
【0108】
(表2)

表中、
化合物Aは、SDF-1(1-14)-(G)4-SDF-1(55-67)-アミドであり、
化合物Bは、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドである。
【0109】
実施例3
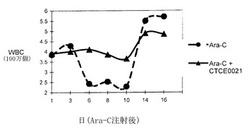
本発明は、動物モデルにおけるCXCR4アゴニストの治療的作用を明らかにしており、これは、CXCR4アゴニストによる細胞傷害性治療からの造血細胞の保護を示している。これらの動物実験において、正常マウスを、DNA合成の高い割合(迅速な細胞周期を反映)で細胞に有害に作用することがことが公知である、細胞傷害性化学療法剤アラビノース-シトシン(Ara-C)で処置した。
【0110】
図1に示したように、0日目にアラビノース-シトシン(Ara-C)が単回用量350mg/kgで静脈内投与されたマウスは、白血球数(WBC)が減少した(Ara-Cの細胞傷害性作用に起因)。対照的に、Ara-Cと併用してペプチドSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(図の凡例ではCTCと表記)を投与したマウスは、白血球数の減少の程度が、有意に緩和された。この図において、丸のデータ点は、Ara-Cを受け取ったが該ペプチドは受け取っていない動物における白血球数に相当し、三角データ点は、Ara-CおよびSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドを受け取った動物における値に相当する。このデータは明確に、Ara-Cの細胞傷害性作用に対する本発明のペプチドの保護作用を明らかにしている。
【0111】
実施例4
CXCR4アゴニストとしてのSDF-1およびSDF-1ペプチド類似体の効能を、CXCR4受容体結合アッセイ法により明らかにした。天然のSDF-1およびCXCR4アゴニストによる125I-SDF-1に対するSDF-1受容体への結合の競合的用量反応を、図2Aおよび図2Bにそれぞれ示した。125I-SDF-1の濃度-依存型阻害を、図2Aに示し、これはSDF-1のこの受容体への親和性を示唆している。スキャッチャードプロットを図示し、KDを26nMで決定した。SDF-1および示された類似体(競合リガンド)は、記された濃度で4nM 125I-SDF-1の存在下で添加した。CEM細胞を、2時間インキュベーションした後の125I-SDF-1結合について評価した。これらの結果は、競合リガンドなしに決定された最大特異結合の割合(%)として表し、個別の3回の実験の平均である。SDF-1およびSDF-1類似体による125I-SDF-1の阻害は、CXCR4受容体結合の指標である。この図に示された化合物は以下である:SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCE0021)、SDF-1(1-14)-(G)4-SDF1(55-67)-E24/K28-環状アミド(CTCE0022)、SDF-1(1-9)2-C9/C9-システイン二量体(CTCE99O1)、SDF-1(1-17)(CTCE9902)、SDF-1(1-8)2-リシン架橋二量体(CTCE99O4)およびSDF-1(1-14)-(G)4-SDF-1(55-67)アミド(CTCE0017)。
【0112】
実施例5
本実施例は、細胞内カルシウム動員([Ca2+]i)を介するSDF-1およびSDF-1ペプチド類似体の効能を説明している。SDF-1およびSDF-1ペプチド類似体の結合が、CXCR4受容体のアゴニスト性の誘導を生じることを説明するために、[Ca2+]i動員アッセイ法を行い、その結果を図3に示した。図3に示したデータを得るために、fura-2、AM負荷したTHP-1細胞(1x106細胞/ml)を、指示された濃度のSDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)K20/E24-環状アミドまたはSDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミドで刺激した(値は、3回の実験(n=3)の平均±1S.D.で示した)。図3のデータに示したように、THP-1細胞のSDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)K20/E24-環状アミドまたはSDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミドとのインキュベーションは、受容体を介した[Ca2+]i動員の誘導を生じた。SDF-1(1-14)-(G)4-SDF-1(55-67)酸、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドまたはSDF-1(1-14)(G)4-SDF-1(55-67)-E24/K28-環状アミドおよび天然のSDF-1についてのEC50値(完全[Ca2+]i動員能の50%を効果的に誘導するのに必要なリガンド濃度)を表3に示す。
【0113】
(表3)

【0114】
天然のSDF-1が最大[Ca2+]i動員を生じるリガンド濃度(1μM、図3参照)での、SDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24環状アミド(CTCE0021)、SDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミド(CTCE0022)、SDF-1(1-9)2-C9/C9-システイン二量体(CTCE99O1)、SDF-1(1-17)(CTCE99O2)、SDF-1(1-8)2-リシン架橋二量体(CTCE9904)およびSDF-1(1-14)-(G)4-SDF-1(55-67)アミド(CTCEOO17)の[Ca2+]i動員を誘導する能力の比較を、図4に示す。Fura-2、AM負荷したTHP-1細胞(1x106細胞/ml)を、天然のSDF-1およびSDF-1ペプチドアゴニスト類似体により、天然のSDF-1が最大[Ca2+]i刺激を生じる濃度(1μM)で刺激した(値は、3回の実験(n=3)の平均±1S.D.で示した)。
【0115】
実施例6
培養物中の接着層内の未成熟高増殖能コロニー形成細胞(HHP-CFC)は、通常静止期にある。この長期培養物(LTC)は、LTC開始後7〜10日で確立される。これらの細胞は、新鮮な培地に添加することにより、増殖を刺激することができる。LTCのBFU-E(赤芽球バースト形成単位前駆体)細胞およびCFU-GM(顆粒球-単球コロニー形成単位-共通前駆体)細胞の両方を、接着層内の間充織的に(mesenchymally)由来したストローマ細胞により静止期に維持することができるが、新鮮な培地の添加により周期へと可逆的に刺激することもできる。SDF-1およびSDF-1ポリペプチドのようなCXCR4アゴニストがこの活性化に打ち勝つ能力は、培地交換時のLTCへのそれの添加により決定することができる。活発に分裂している細胞は、放射性チミジンのような細胞毒を均等に増えるように蓄積し、その結果、優先的に殺傷される。
【0116】
表4に示した結果は、インビトロLTC-IC(長期培養-開始細胞)アッセイ法における、SDF-1、およびSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCEOO21)およびSDF-1(1-14)-(G)4-SDF-1(55-67)酸(CTCEOO13)の、赤芽球および顆粒球形成前駆体(これは、赤血球、血小板、単球/マクロファージおよび好中球へと分化する)の増殖を抑制する能力を例示している。
【0117】
(表4) ヒトLTCの接着層内の未成熟前駆体の周期に対するSDF-1およびSDF-1アゴニストの作用

【0118】
表4に示した結果を得るために、クローン原性赤芽球(BFU-E)および顆粒球形成(CFU-GM)前駆体を、メチルセルロース培養においてアッセイした。接着細胞を、新鮮な培地単独(対照として)または指示したCXCR4アゴニスト(10μg/ml SDF-1、CTCE0021またはCTCEOO13)で処理した。3日後に皿を収集し、3H-チミジン自殺アッセイ法を、接着層中の前駆細胞について行い、細胞傷害性3H-チミジンを蓄積した結果殺傷された細胞の割合を決定した。対照の細胞と残りの細胞の数の間の差異は、殺傷された細胞を示している。
【0119】
図5は、培地の変更と組合わせたフィーダー培養物SDF-1は、分裂細胞に優先的に毒性であるような物質を細胞に投与した場合に、造血細胞の有意な細胞致死率の低下を生じることを説明しており、ここで丸はBFU-E細胞(赤芽球バースト形成単位前駆体)を表し、四角はCFU-GM細胞(顆粒球-単球コロニー形成単位共通前駆体)を表している。図6は、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/D24-環状アミド(化合物番号1)およびSDF-1(1-9)2(化合物番号3)により、同様の濃度依存性作用が得られることを示している。図5および6を合わせると、SDF-1ポリペプチドおよびSDF-1ペプチド類似体は、LTCの接着層においてBFU-EおよびCFU-GM前駆体幹細胞の周期活性化を抑制することを示している。
【0120】
実施例7
図7および図9は、SDF-1およびSDF-1類似体のようなCXCR4アゴニストの、インビボ生着モデルにおけるヒト前駆細胞の増殖の抑制における効能を示している。
【0121】
図7において、骨髄移植したNOD/SCIDマウスから単離したCD34+細胞の懸濁液中の成熟および未成熟コロニー形成細胞(CFU-GM;顆粒球-単球コロニー形成単位-前駆体、BFU-E;赤血球バースト形成単位-前駆体;LTC-IC、長期培養開始細胞)の周期の状態を、高特異活性3H-チミジン20μg/mlへの細胞の短期間(20分間)または一晩(16時間)の曝露により不活性化(殺傷)されたこれらの前駆体の割合の評価により決定した(値は、各点毎に最大4匹のマウスでの最大4回の実験のデータの平均±S.D.で示した)。図4に示した結果の有意性は、類似体SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCEOO21)およびSDF-1(1-14)-(G)4-SDF-1(55-67)酸(CTCEO13)が、高特異活性3H-チミジンへの曝露により殺傷された細胞の減少により測定される、「未成熟」ヒト前駆細胞の増殖の阻害について天然のSDF-1と同程度有効であることの知見である。
【0122】
実施例8
SDF-1は、ヒト胎児肝細胞を移植したNOD/SCIDマウスにおいて再生されたコロニー再生単位(CRU)の検出能を増強する(図8)。1群につき3〜4匹のNOD/SCIDマウスを、致死量以下で放射線照射し、ヒト細胞、この場合107個の低濃度の胎児肝細胞を注射し、その後マウスを2.5〜3週間の間維持した。次に示されたように、各群に、SDF-1 10μg、または等容積の対照培地のいずれかを毎日2回注射し、その後全てのマウスを、2回目の注射の翌日に屠殺した。次に各群からの骨髄細胞をプールし、存在するヒトCFCおよびLTC-IC(長期培養開始培養物)の周期活性を測定するためのFACS分析および一晩の3H-チミジン自殺アッセイ法のために、アリコートを採取した。細胞の残りは、3〜6匹の二次レシピエントに注射した。これらの動物はその後6〜8週間後に屠殺し、それらの骨髄を取り出し、ヒト細胞の存在について分析した。
【0123】
この実施例は、二次生着を説明している。二次レシピエントの骨髄を評価した場合に、一次マウスの様々な群由来の細胞のレシピエントに存在するヒト細胞のレベルにおいてかなりの差異が認められた。図8に示したように、SDF-1-注射したマウスにとって、培地を注射した対照一次マウス由来の細胞のレシピエントとの比較により、はるかに多い数の評価した全ての種類のヒト細胞が、いずれかのSDF-1で処理した一次マウスから骨髄を受け取った二次レシピエントの骨髄中に認められた。
【0124】
実施例9
本実施例は、ヒト胎児肝移植したNOD/SCIDマウスにおける、SDF-1およびSDF-1ポリペプチド類似体のようなCXCR4アゴニストの、ヒト細胞の生着に対する作用を説明している(図9)。この図に示されるように、NOD/SCIDマウスにおける存在する様々なヒト細胞の頻度に対するCXCR4アゴニストの短期作用はない。これらの実験において、被験化合物(SDF-1、SDF1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCEOO21)またはSDF-1(1-14)-(G)4-SDF-1(55-67)酸(CTCE013))を、移植後6〜8週間のマウスに、1日あけて2回注射し、1日後に屠殺した。マウスの長骨(頸骨および大腿骨)において検出された表現型で定義されたヒト造血細胞の頻度を決定した。SDF-1 0.5mg/kgの投与は、CD45/71、CD19/20、またはCD34細胞の数に加え、CFCまたはLTC-ICに対しても、有意な作用を有さなかった。加えて、このCXCR4アゴニスト投与のスケジュールで、検出できるように影響されたヒト細胞型はない。このデータを、図7および図8と組合せて、SDF-1、SDF-1類似体および他のCXCR4アゴニストは、ヒト前駆細胞の二次生着を効果的に増強し得ることを示している。
【0125】
実施例10
この実施例は、SDF-1ポリペプチド類似体CTCE0021(10mg/kg、図12においては化合物番号1として示す)のAra-C(300mg/kg)による脊髄解離性化学療法後の白血球回復に対する作用を説明している。この実施例において説明した実験では、C3Hhenマウス(雌)を、Ara-C 500mg/kgで0日目および10日目に2サイクル処理した。Ara-C投与の2回目のサイクルにおいて、Ara-C処理したマウスは、毎日CTCE0021 10mg/kgを注射した。対照は、Ara-C単独で処置した動物で行った。実験開始時、ならびに2回目のAra-C投与1日前および投与後毎日に、尾静脈から血液をヘパリン含有チューブに採取した。総白血球数を決定した。図10に示したように、CXCR4アゴニストCTCE0021は、Ara-Cの細胞傷害性作用を阻害し、白血球をより高いレベルに維持するように作用し、これはインビボにおける化学療法様式の骨髄抑制作用の逆転を説明している。
【0126】
実施例11
本実施例は、Ara-C (500mg/kg)による脊髄解離性化学療法後の白血球の回復に対するSDF-1ポリペプチド類似体SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCE0021, 1mg/kg)の作用と、G-CSF(ノイポゲン(登録商標))の比較を示す(図11)。C3Hhenマウス(雌)を、Ara-C 500mg/kgで0日目および10日目に2サイクル処置した。Ara-C投与の2回目のサイクルの間に、CTCE0021 10mg/kg、ノイポゲン(登録商標) 10mg/kgを、単独または併用し注射し(-1日目、0日目、および1〜3日目)、対照は薬物を受け取らなかった。実験開始時、ならびに2回目のAra-C投与の1日前ならびに1、7および12日目に、尾静脈から血液をヘパリン含有チューブに採取した。総白血球数を得た。本実施例の結果は、CTCE0021の投与処置のみが、Ara-Cによる脊髄解離性化学療法後の白血球を回復を増大するのではなく、SDF-1ポリペプチド類似体およびG-CSF(ノイポゲン(登録商標))の併用処置も、G-CSF単独で処置した動物と比べ、早期治療相において、より大きい回復を生じたことを示している。更に、SDF-1ポリペプチド類似体による処置後の回復は、G-CSF処置した動物と比べ維持されていた。
【0127】
図12は、同じ条件下で行った実験の結果を示しているが、Ara-C単独で処置した動物において計測された細胞数に対する増殖(白血球数の増加)を説明している。Ara-C投与後12日目まで、CTCE0021で処置したマウスにおいて、Ara-C単独で処置した動物に対し白血球のおよそ7.5倍の増加が認められ、ノイポゲン(登録商標)により処置した動物においては180%が得られた。
【図面の簡単な説明】
【0128】
【図1】本発明のペプチド(CTCE0021と称され、実施例1および3に記載)の存在(三角のデータ点、実線、凡例表記Ara-C+CTCE0021)および非存在(丸のデータ点、破線、凡例表記Ara-C)下における、マウスの白血球数(WBC)に対するAra-C(350mg/kg)の作用を示す。
【図2A】SDF-1による、CXCR4への125I-SDF-1結合の濃度依存性阻害を示し、これは図2Aで示されたデータについて説明されたような、CXCR4受容体のSDF-1の親和性を示す。
【図2B】SDF-1およびSDF-1ペプチドアゴニスト類似体のCXCR4受容体結合を示している。SDF-1および指示された類似体(競合リガンド、実施例に記載)は、4nM 125I-SDF-1の存在下で、指定された濃度で添加した。CEM細胞は、2時間インキュベーションした後に125I-SDF-1結合について評価した。結果は、競合リガンドの非存在下で決定された最大特異結合の割合で表され、3回の個別の実験の平均である。
【図3】SDF-1およびSDF-1受容体類似体による[Ca2+]i動員の誘導を示している(実施例に記載)。Fura-2、AM負荷したTHP-1細胞(1x106/ml)を、SDF-1、CTCE0021またはCTCE0022により指定された濃度で刺激した。値は、3回の実験(n=3)の平均±1S.D.で表す。
【図4】SDF-1およびSDF-1類似体による[Ca2+]i動員の誘導を示している Fura-2、AM負荷したTHP-1細胞(1x106/ml)を、天然のSDF-1およびSDF-1ペプチド類似体により、最大[Ca2+]i刺激を生じる天然のSDF-1の濃度(1μM)で刺激した。値は、3回の実験(n=3)の平均±1S.D.で表す。指定した化合物は以下のものである:SDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCE0021)、SDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミド(CTCE0022)、SDF-1(1-9)2-C9/C9-システイン二量体(CTCE99O1)、SDF-1(1-17)(CTCE9902)、SDF-1(1-8)2-リシン架橋二量体(CTCE99O4)およびSDF-1(1-14)-(G)4-SDF-1(55-67)アミド(CTCE0017)。
【図5】標準の長期培養(LTC)における接着層中の未成熟正常コロニー形成細胞(CFC)の周期性の増殖性活性を示し、ここで丸はBFU-E細胞(赤芽球バースト形成単位前駆体)を表し、および四角はCFU-GM細胞(顆粒球-単球コロニー形成単位共通前駆体)を表し、これは増殖している細胞に対し優先的に細胞毒に対する細胞の感受性の測定による、SDF-1の細胞増殖に対する阻害作用を図示している。
【図6】SDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/D24-環状アミド(化合物番号1)、SDF-1(1-9)2(化合物番号3)で処理した場合の、分裂している細胞に対し優先的に細胞毒に対する細胞の感受性として測定する、標準LTCにおける接着層中の未成熟正常CFCの周期性の増殖性活性を示す。
【図7】胎仔肝移植したNOD/SCIDマウス由来のヒト前駆体の周期に対するSDF-1およびSDF-1類似体(実施例において定義)の作用を示す。移植したNOD/SCIDマウスの骨髄から単離したCD34+細胞の懸濁液中の成熟および未成熟コロニー形成細胞(CFU-GM;顆粒球-単球コロニー形成単位共通前駆体、BFU-E細胞;赤芽球バースト形成単位前駆体)の周期の状態は、高特異活性3H-チミジン20μg/mlへの細胞の短期間(20分間)または一晩(LTC-IC;長期培養開始細胞)曝露により失活(殺傷)したこれらの前駆体の割合の評価により決定した。値は、各点につき最大4匹のマウスの実験の平均±S.D.で表す。
【図8】SDF-1が、ヒト胎児肝を移植されたNOD/SCIDマウスにおいて再生されたCRU(コロニー再生単位)の検出能を増強することを示唆するデータを示す。
【図9】SDF-1およびSDF-1アゴニスト(実施例において定義した)のヒト胎児肝移植したNOD/SCIDマウスにおけるヒト細胞の生着に対する作用を示す。107個の低密度ヒト胎児肝血液細胞を移植して4週間後およびその後のSDF-1、CTCE0021またはCTCE0013(0.5mg/kg)の1週間に3回で2週間投与後屠殺したマウスの長骨(頸骨および大腿骨)において検出された表現型で定義した造血細胞数の比較。値は、3回の実験における3〜7匹の個別のマウスから得た結果の平均±1S.D.で表す。
【図10】Ara-C(300mg/kg)で処置した脊髄解離性化学療法後の白血球回収に対するCTCE0021(1mg/kg、実施例において定義した)の作用を示す。マウスは、Ara-C単独で(Ara-C)またはCTCE0021と併用して処置した。結果は、6匹動物/群の平均±1S.D.で表す。
【図11】Ara-C処理したマウスにおける白血球増殖に対するCTCE0021(実施例において定義した)およびノイポゲン(Neupogen)(登録商標)(G-CSF)の作用を示す。C3Hhenマウス(雌)を、500mg/kg Ara-Cで0日目および10日目に2サイクル処理した。Ara-C投与の第二サイクルの間に、Ara-C処置したマウスに、CTCE0021 10mg/kg、ノイポゲン(登録商標)10mg/kgを単独または併用して投与した(-1、0日目および1〜3日目)。対照は、Ara-C単独で処置した動物を示す。実験開始時、ならびに二回目のAra-C投与の1日前および1日目、7日目、および12日目に、血液を尾静脈からヘパリン含有チューブへと採取した。総白血球数を得た。結果は、6匹動物/群の平均±1S.D.で表す。
【図12】Ara-C処理マウスにおける白血球の相対増殖に対する、CTCE0021およびノイポゲン(登録商標)の作用を示している。C3Hhenマウス(雌)を、500mg/kg Ara-Cで0日目および10日目に2サイクル処理した。Ara-C投与の第二サイクルの間に、Ara-C処置したマウスに、CTCE0021 10mg/kg(実施例において定義した)、ノイポゲン(登録商標)10mg/kgを単独または併用して投与した(-1日目、0日目、および1〜3日目)。対照は、Ara-C単独で処置した動物を示す。実験開始時、ならびに二回目のAra-C投与の1日前および7および12日目に、血液を尾静脈からヘパリン含有チューブへと採取した。総白血球数を得た。白血球(WBC)の増加は、第二サイクルのAra-C用量が投与される前日に測定した細胞数に対して決定した。結果は、6匹動物/群の平均±1S.D.で表す。
【図13】ヒトSDF-1α、SDF-1前駆体(PBSF)、およびSDF-1βの配列を示す。
【技術分野】
【0001】
発明の分野
ひとつの局面において、本発明は、インビトロおよびインビボにおける造血細胞の処理に使用するためのCXCケモカイン受容体4(CXCR4)のペプチドアゴニストを含む、ケモカイン受容体アゴニストの治療的用途に関する。
【背景技術】
【0002】
発明の背景
造血は、造血幹細胞が細胞系譜が方向づけられた(lineage-committed)細胞を生成し、自己複製過程を反復するような発生経路を含む。造血幹細胞は典型的には自己複製能および多分化能の二元的な能力を有する細胞である。
【0003】
サイトカインは、免疫応答を調節する単球またはリンパ球を含む様々な細胞から分泌される可溶性タンパク質である。ケモカインは、ジスルフィド結合形成に関与するシステイン残基の性質により特徴付けられる4群に分類された、走化性誘起作用タンパク質のスーパーファミリーである。ケモカインは、様々な生物学的反応を調節し、これらは白血球およびリンパ球の複数の系統の生体臓器組織への補充を促進する。ケモカインは、タンパク質中の最初の2個のシステイン残基の相対的位置に従い2つのファミリーに分類することができる。βケモカインを含むCCケモカインにおいて、最初の2個のシステインは、互いに隣接している。αケモカインを含むCXCケモカインにおいて、最初の2個のシステインは、1個のアミノ酸残基により隔てられている。2個の小型のサブグループは、2個のシステインの1個のみを有する(C)か、もしくはシステイン間に3個のアミノ酸を有する(CX3C)。ヒトにおいて、CXCケモカイン遺伝子は第4染色体上に(SDF-1遺伝子を除く、これは第10染色体に位置する)およびCCケモカインは第17染色体上にクラスター化している。
【0004】
ケモカインの分子標的は細胞表面受容体である。そのような受容体の一つは、CXCケモカイン受容体4(CXCR4)であり、これは7回膜貫通タンパク質にカップリングしたGタンパク質であり、これまでLESTR(ローチャー、ガイサー、オレイリー、ツァーレン、バジオンリニ、モサー(Loetsher, M., Geiser, T. O'Reilly, T., Zwahlen, R., Baggionlini, M., & Moser, B.)(1994)J. Biol. Chem. 269, 232-237)、HUMSTR(フェダースピール、ダンカン、デラニー、シャパート、クラーク・ルイス、ジリク(Federsppiel, B., Duncan, A. M. V., Delaney, A., Shappert, K., Clark-Lewis, I., & Jirik, F. R.)(1993)Genomics 16, 707-712)、およびフュージン(フェン、ブローダー、ケネディ、バーガー(Feng, Y., Broeder, C.C., Kennedy, P. E., & Berger, E. A.)(1996)、Science 272、872-877)と呼ばれていた。CXC4は、造血起源の細胞上に広く発現しており、ヒト免疫不全ウイルス1(HIV-1)に関してCD4+の主な共受容体である(フェン、ブローダー、ケネディ、バーガー(Feng, Y., Broeder, C.C., Kennedy, P. E., & Berger, E. A.)(1996)、「HIV-1流入共因子:7回膜貫通Gタンパク質カップリング受容体の機能的cDNAクローニング(HIV-1 entry cofactor:Functional cDNA cloning of a seven-transmembrane G protein-coupled receptor)」、Science 272、872-877)。
【0005】
ケモカインは、7回膜貫通Gタンパク質と共役型受容体との結合によりそれらの作用を媒介し、かつ白血球サブセットを炎症部位へ引きつけると考えられている(Baglioniniら、Nature、392:565-568(1998))。多くのケモカインが、リンパ系組織において構成的に発現されることが示されており、このことはこれらがリンパ系器官間および器官内のリンパ球遊送(lympnocyte trafficking)の調節における血流途絶性(hemostatic)機能を有し得ることを示唆している(KimおよびBroxmeyer、J. Leuk. Biol.、56:6-15(1999))。
【0006】
ストローマ細胞由来因子-1(SDF-1)は、骨髄ストローマから構成的に選択されることが知られているケモカインCXCファミリーの一員である(Tashiro、Science、261:600-602(1993))。ヒトとマウスのSDF-1推定タンパク質配列は、およそ92%の同一性がある。ストローマ細胞由来因子-1α(SDF-1α)およびストローマ細胞由来因子-1β(SDF-1β)は密接に関連している(本明細書においては共にSDF-1と称する)。SDF-1αおよびSDF-1βの天然のアミノ酸配列は公知であり、これらのタンパク質をコードしているゲノム配列も知られている(1996年10月8日に発行された米国特許第5,563,048号、および1998年5月26日に発行された米国特許第5,756,084号を参照のこと)。ゲノムクローンの同定は、αおよびβアイソフォームが、単独の遺伝子の選択的スプライシングの結果であることを示している。α型はエクソン1〜3に由来し、一方β型はエクソン4由来の追加の配列を含む。全ヒト遺伝子はおよそ10Kbである。SDF-1は最初に、プレB細胞刺激因子として、ならびにT細胞および単球についての高度に効果的な走化性因子として特徴付けられた(Bieulら、J. Exp. Med.、184:1101-1110(1996))。
【0007】
SDF-1の生物学的作用は、造血幹細胞を含む単核白血球上に発現される、ケモカイン受容体CXCR4(同じくフューシンまたはLESTRとしても公知)を介しうる。SDF-1は、CXCR4の天然のリガンドと考えられ、CXCR4はSDF-1の天然の受容体と考えられている(Nagasawzaら、Proc. Natl. Acad. Sci. USA、93:726-732(1997))。SDF-1の遺伝的排除は、周産期の致死率に関連し、これは心発生、B細胞リンパ球新生、および骨髄発生の異常を含む(Nagasawaら、Nature、382:635-637(1996))。
【0008】
SDF-1は骨髄前駆細胞の通行、輸送、およびホーミングに基本的な役割を有すると報告されているという点において他のケモカインとは機能的に異なっている(Aiuti, A., Webb, I. J., Bleul, C., Springer, T., & Guierrez-Ramos, J. C.(1996)、J. Exp. Med. 185、111-120、およびNagasawa, T., Hirota, S., Tachibana, K., Takakura N., Nishikawa, S. I., Kitamura, Y., Yoshida, N., Kikutani, H., およびKishimoto, T.(1996)Nature 382、635-638)。SDF-1はまた、他のCXCケモカインとのアミノ酸配列同一性が約22%に過ぎないという点においても構造的に異なっている(Bleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., およびSpringer, T. A.(1996)、J. Exp. Med. 184、1101-1109)。SDF-1は、幾つかの細胞タイプによって構成的に産生されているように考えられ、特に骨髄間質細胞に高レベルに認められる(Shirozu, M., Nakano, T., Inazawa, J., Tashiro, K., Tada, H., Shinohara, T., およびHonjo, T.(1995)Genomics 28、495-500、ならびにBleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., およびSpringer, T. A.(1996)、J. Exp. Med. 184、1101-1109)。SDF-1の基本的な生理的役割は、種間のSDF-1配列の保存が高レベルであることから暗示される。インビトロにおいて、SDF-1はまた、単球および骨髄由来前駆細胞を含む広範囲の細胞の化学走性を刺激する(Aiuti, A., Webb, I. J., Bleul, C., Springer, T., およびGuierrez-Ramos, J. C.(1996)、J. Exp. Med. 185、111-120、ならびにBleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., & Springer, T. A.)(1996)、J. Exp. Med. 184、1101-1109)。SDF-1が高い割合の休止期Tリンパ球および活性化Tリンパ球を刺激することである(Bleul, C. C., Fuhlbridgge, R. C., Casasnovas, J. M., Aiuti, A., およびSpringer, T. A.(1996)、J. Exp. Med. 184、1101-1109、ならびにCampbell, J. J., Hendrick, J., Zlotnik, A., Siani, M. A., Thompson, D. A., およびButcher, E. C.(1998)Science、279、381-383)。
【0009】
様々な疾患は、分裂細胞に対し優先的に細胞傷害性であるような物質による治療を必要としている。例えば、癌細胞は、細胞傷害性用量の放射線および化学療法剤により標的化することができる。癌療法のためのこれらの手法の顕著な副作用は、活発に分裂している正常細胞に対するこのような治療の病理学的な影響である。これらの正常細胞は、例えば毛嚢細胞、粘膜細胞、および造血細胞、例えば未成熟骨髄前駆細胞および幹細胞などを含む。造血幹細胞、始原細胞または前駆細胞の無差別破壊は、白血球、リンパ球、および赤血球などの正常な成熟血液細胞数の減少につながり得る。成熟細胞数に対する大きな影響は、天然に比較的短い半減期を有する細胞、特に好中球(好中球減少症(neutropaenia))および血小板(血小板減少症)により認められる。白血球数の減少は、免疫系の機能喪失を伴い、これにより患者の日和見感染のリスクを増大することがある。化学療法に起因した好中球減少症は、例えば細胞傷害性処置の2日または3日以内に生じ、かつ患者は造血システムが好中球数を再生するのに十分に回復されるまで、最大2週間易感染性となる。癌療法の結果としての減少した白血球数(白血球減少症)は、この療法が白血球数が復元するように中断されなければならないほど十分に重篤となることがある。癌療法の中断は、その後の癌細胞の生存、癌細胞における薬剤耐性発生の増加、および最終的には癌再発につながることがある。従って、細胞傷害性物質による治療を受けた患者における造血前駆細胞または幹細胞の維持を促進するような治療物質および処置の必要性が存在している。
【0010】
骨髄移植は、様々な血液疾患、自己免疫疾患、および悪性疾患の治療において使用されている。骨髄移植と組合わせて、造血前駆細胞または幹細胞の集団を増殖するために、エキソビボ造血(骨髄)細胞培養が使用される。造血前駆細胞または幹細胞の生存力を保ちながら、細胞傷害性治療を受けた癌細胞でエキソビボ造血細胞培養物をパージすることが望ましい。従って、細胞傷害性物質へ曝露されたエキソビボ細胞培養中の造血前駆細胞または幹細胞を維持することを促進する物質および方法が必要である。
【0011】
多くのタンパク質が、造血細胞増殖のインヒビターとして治療的に有用な可能性を有する、造血前駆細胞発生のインヒビターとして同定されている:マクロファージ炎症タンパク質1-α(MIP-1-α)およびLD78(米国特許第5,856,301号参照);ヘモグロビンαグロブリン鎖およびヘモグロビンβグロブリン鎖(米国特許第6,022,848号参照);ならびに、インターフェロンγ(米国特許第5,807,744号参照)。
【0012】
細胞傷害性の薬物および放射線療法後の永続的な骨髄の回復は、長期再構成(LTR)能を有する造血幹細胞の生存によって左右される。化学療法および/または放射線療法の結果として主要な用量を制限する続発症は、好中球減少症および血小板減少症である。用量強化(dose intensification)(すなわち、各々の腫瘍療法の対数殺傷(log-kill)の増加)またはスケジュールの圧縮に関連しているプロトコールは、標準の化学療法および/または放射線療法に関連した脊髄抑制の程度および期間を増悪すると考えられる。例えば、アジュバントの設定において、ドキソルビシンベースの治療の反復サイクルが、骨髄前駆細胞集団に蓄積性および長期永続性の損傷を生じることが示されている(Lorhrmanら、Br. J. Haematol.、40:369(1978))。化学療法により生じる短期の造血細胞損傷の作用は、好中球再生を加速するために使用される、現在使用されているG-CSF(ノイポゲン(Neupogen)(登録商標))によりある程度克服されている(Le Chevalier、Eur. J. Cancer、30A:410(1994))。この手法も同じく、治療の連続サイクルにわたって動員された前駆細胞の品質の低下を反映している進行性血小板減少症および蓄積性骨髄損傷を併発するために制限されている。現在の関心は腫瘍反応速度およびおそらくは患者生存率の改善の手段としての化学療法の用量強化にあるので、化学療法および/または放射線療法の脊髄解離性の作用をレスキューするために現在の治療を改善または交代するための代替療法の必然性が増しつつあり、これは現在腫瘍療法用量漸増のための主要な速度制限因子のひとつである。
【0013】
移植された末梢血幹細胞(PBSC、または自家PBSC)は、血液学的悪性疾患および固形腫瘍を有する患者への高用量の化学療法または放射線療法を投与後に、即時および持続性の造血回復を提供することができる。PBSC移植は、生着まで比較的短時間でおよび骨髄収集に必要な外科的手法が不要であるために、自家移植用の幹細胞の好ましい給源となりつつある(Demirerら、Stem Cells、14:106-116(1996);Pettengelら、Blood、82:2239-2248(1992))。幹細胞の骨髄から末梢血への放出の機序はよくわかっていないが、CD34+細胞の動員を増強する物質は、自家PBSC移植の増強において有効であることは証明することができる。G-CSFおよびGM-CSFは、PBSC動員のために現在最も一般的に使用される造血促進因子(hematopoietic growth gfactor)である。従って、この臨床適応にはその他の物質が必要とされる。
【0014】
自己免疫疾患のための幹細胞移植は、自家または同種移植片を用いて開始されなければならず、前者が合併症のリスクが低いために一般に好ましいとされている(BurtおよびTaylor、Stem Cells、17:366-372(1999))。リンパ球枯渇も推奨されており、この場合リンパ球枯渇は、移植片からの自己反応性細胞をパージする形態である。実際には、自家移植片の攻撃的リンパ球枯渇は、免疫抑制的予防策を伴わずとも、同種反応性(すなわち、移植片対宿主疾患(GVHD))を防止することができる。従ってリンパ球枯渇した自家移植片は、自己反応性の再発を防止することができる。結論として、CFU-GEMM骨髄性幹細胞、またはBFU-EおよびCFU-GM骨髄単球性幹細胞の生存を増強することができる併用療法のいずれかは、造血幹細胞に欠陥が生じる自己免疫疾患の療法において恩典を有する。
【0015】
マウスの造血幹細胞へのレトロウイルスを介する遺伝子導入および同系マウスの再構築は、長期にわたる導入遺伝子の持続性および機能性を明らかにしている(Kumeら、69:227-233(1999))。最終的に分化した細胞は、記憶BおよびTリンパ球以外は、比較的短期間生存し、非常に多数の血液細胞が毎日入れ替わっている。従って遺伝子導入による血液細胞の長期間機能する補正が必要な場合、標的細胞は造血幹細胞であり得る(Kumeら、69:227-233(1999))。従って前駆幹細胞の生存を維持することができる化合物は、より大きい造血幹細胞の集団を得ることができる点で遺伝子導入効率を増大することができる。
【0016】
多くのタンパク質が、同定され、造血前駆細胞発生および造血細胞繁殖(増殖)のインヒビターとして現在臨床利用されている。これらは、組換えメチオニルヒトG-CSF(ノイポゲン(登録商標)、フィルグラスチム;Amgen社)、GM-CSF(リューカイン(Leukine)(登録商標)、サルグラモスチム;Immunex社)、エリスロポエチン(rhEPO、エポジェン(Epogen)(登録商標);Amgen社)、トロンボポエチン(rhTPO;Genentech社)、インターロイキン-11(rhIL-11、ニューメガ(Neumega)(登録商標);American Home Products社)、Flt3リガンド(Mobista;Immunex社)、多系統造血因子(MARstem(商標);Maret Pharm社)、ミエロポエチン(Leridistem;Searle社)、IL-3、骨髄前駆体阻害因子-1(Mirostipen;Human Genome Sciences社)、幹細胞因子(rhSCF、ステムジェン(Stemgen)(登録商標);Amgen社)を含む。
【発明の概要】
【0017】
本発明の様々な局面に従い、CXCR4アゴニストは、細胞傷害性物質に対する細胞の感受性を低下させるための骨髄前駆細胞または幹細胞を処置するために使用することができる。CXCR4アゴニストは、細胞増殖速度を低下させるための骨髄前駆細胞または幹細胞を処置するために使用することができる。CXCR4アゴニストは、例えば、骨髄前駆細胞または幹細胞を処置するための骨髄または末梢血幹細胞移植手法においてインビボまたはエキソビボで使用することができる。CXCR4アゴニストは、哺乳類において癌を治療するために1種またはそれ以上の細胞傷害性物質と組合わせて使用することができる。細胞傷害性物質は例えば、化学療法剤または放射線を含む。CXCR4アゴニストは、インビボ、エキソビボ、およびヒトにおける疾患、例えば癌などにおける骨髄前駆細胞または幹細胞の増殖を調節するために治療的に使用することができる。
【0018】
発明の詳細な説明
本発明のいくつかの局面に従い、造血幹細胞は、細胞増殖抑制の機序を介して、CXCR4アゴニストにより影響をうけることがある。増殖している癌性細胞を殺傷するために利用される細胞傷害性療法、例えば化学療法および/または放射線療法は、増殖している細胞を標的化するので、本発明の様々な局面に従うCXCR4アゴニストを、未成熟骨髄および末梢血前駆細胞および幹細胞などの造血細胞の細胞毒が媒介した破壊を低下させるために利用し、これにより細胞毒処置後の白血球、リンパ球および赤血球のような成熟血液細胞数の回復を増強することができる。本発明の様々な局面において、CXCR4アゴニストは、前駆細胞の増殖を抑制し、その結果それらを、例えば癌治療のために患者が受けている治療様式による破壊からレスキューするために、脊髄解離性化学療法および/または放射線療法のような細胞毒処置の前に、処置中、または処置の前および途中の両方に、患者に投与することができる。従って本発明の様々な局面に従うCXCR4アゴニストで治療され易い癌は、乳房、結腸、直腸、肺、中咽頭、下咽頭、食道、胃、膵臓、肝臓、胆嚢および胆管、小腸、尿管(腎、膀胱および尿路上皮を含む)、女性生殖道(子宮頸部、子宮、および卵巣に加え、絨毛上皮腫および妊娠絨毛性疾患)、男性生殖道(前立腺、精嚢、精巣および生殖細胞腫瘍を含む)、内分泌腺(甲状腺、副腎、および下垂体を含む)、ならびに皮膚の癌腫、更には血管腫、黒色腫、肉腫(骨および軟組織に生じるものに加え、カポジ肉腫を含む)ならびに脳、神経、目、および髄膜の腫瘍(星状細胞腫、神経膠腫、膠芽腫、網膜芽腫、神経腫、神経芽細胞腫、シュワン細胞腫、および髄膜腫)を含む、原発性および転移性の両方の腫瘍、ならびに固形腫瘍である。本発明のいくつかの局面において、CXCR4アゴニストは、白血病のような、造血系悪性疾患から生じる固形腫瘍のような腫瘍(すなわち、緑色腫、形質細胞腫ならびに菌状息肉腫および皮膚T細胞リンパ腫/白血病のプラークおよび腫瘍)の治療に加え、リンパ腫(ホジキンおよび非ホジキンリンパ腫の両方)の治療にも有用である。加えて、CXCR4アゴニストは、単独で使用した場合、または放射線療法もしくは化学療法剤などの細胞傷害性物質との併用した場合のいずれかにおいて、前述の腫瘍からの転移の防止に有用でありうる。
【0019】
本発明の別の局面において、CXCR4アゴニストは、CD34+前駆細胞の集団を濃縮するために使用することができる。このような細胞は、例えば、骨髄(BM)および末梢血(PB)幹細胞移植手法において、CXCR4アゴニストにより濃縮することができる。このような手法は、様々な疾患を治療するために利用することができる(例えば、Ball, E.D.、Lister, J.、およびLaw, P.の「造血幹細胞療法(Hematopoietic Stem Cell Therapy)」、Chruchill Livingston(Harcourt社)、ニューヨーク、(2000)参照)。従ってCXCR4アゴニストは、下記のCXCR4アゴニストで治療され得るような疾患などの、疾患治療を目的として、このような造血幹細胞移植(HSCT)プロトコールにおいて使用することができる:
再生不良性貧血;
急性リンパ芽球性貧血;
急性骨髄性白血病;
骨髄形成異常症;
多発性骨髄腫;
慢性リンパ球性白血病;
先天性免疫不全症(例えば、自己免疫リンパ増殖症候群、ウィスコット-アルドリッチ症候群、X-連鎖リンパ増殖症、慢性肉芽腫症、コストマン型好中球減少症、白血球粘着異常症);
代謝性疾患(例えば、フルラー症候群(MPS I/II)、スライ症候群(MPS VII)、幼児期に発症する脳のX-副腎白質ジストロフィー、グロボイド細胞白質異栄養症などの、HSCTで指摘されたもの)。
【0020】
別の態様において、CXCR4アゴニストは、様々な造血細胞の処置に使用することができ、このような細胞は、単離されるか、またはインビボもしくはインビトロにおいて処理された細胞集団の一部のみを形成することができる。CXCR4アゴニストで処理し易い細胞は、例えば、骨髄幹細胞または前駆細胞、リンパ系幹細胞または前駆細胞、骨髄系幹細胞、CFU-GEMM細胞(顆粒球、赤芽球、マクロファージ、巨核球コロニー形成単位)、B系幹細胞、T系幹細胞、DC系幹細胞、プレB細胞、前胸腺細胞、BFU-E細胞(赤芽球バースト形成単位)、BFU-MK細胞(巨核球バースト形成単位)、CFU-GM細胞(顆粒球-マクロファージコロニー形成単位)、CFU-bas細胞(好塩基球コロニー形成単位)、CFU-Mast細胞(マスト細胞コロニー形成単位)、CFU-G細胞(顆粒球コロニー形成単位)、CFU-M/DC細胞(単球/樹状細胞コロニー形成単位)、CFU-Eo細胞(好酸球コロニー形成単位)、CFU-E細胞(赤芽球コロニー形成単位)、CFU-MK細胞(巨核球コロニー形成単位)、骨髄芽細胞、単芽球、B-リンパ芽球、T-リンパ芽球、前赤血球、好中球性骨髄球、前単球、またはマクロファージ、骨髄細胞関連した樹状細胞、マスト細胞、形質細胞、赤血球、血小板、好中球、単球、好酸球、好塩基球、B細胞、T細胞もしくはリンパ関連樹状細胞などの成熟細胞を生じるように分化する他の造血細胞などのような、多能性幹細胞で始まる造血系統の細胞を含む。
【0021】
いくつかの態様において、本発明は、配列番号:1、2または3に示したアミノ酸配列を有するポリペプチドに関する(図13)。いくつかの態様において、PEG結合(pegylation)部分は、この配列上の任意の位置に供することができる。本発明のポリペプチドは、アミノ酸配列の一部が省略されたポリペプチド、または付加もしくは置換されたアミノ酸を含む配列を含むポリペプチド、または配列のスプライシングされた形を含むことができ、更にはCXCR4の活性化を誘導する。いくつかの態様において、本発明のポリペプチドは、配列番号:1、2または3のポリペプチドと、最適に並べた場合に、少なくとも10個、15個、20個、30個、40個、50個、60個または80個以上の連続するアミノ酸の領域にわたって、少なくとも70%、80%、90%または95%の同一性を有する。別の態様において、本発明のSDF-1ポリペプチドは、配列番号:1、2または3の一部と70%未満が同一のアミノ酸配列を含み、このポリペプチドは、配列番号:1、2または3のSDF-1ポリペプチドで得られるものと同等(例えば0.01倍、0.1倍、1.0倍、10倍、または100倍)の活性であるような、CXCR4アゴニスト活性を示す。
【0022】
本発明のある局面において、配列番号:1、2または3といくらかの類似性のある推定SDF-1ポリペプチドは、CXCR4アゴニスト活性について評価することができる。本発明の推定SDF-1ポリペプチドは、例えば放射標識したリガンド受容体競合アッセイ法のような、受容体結合アッセイ法により決定されるようなCXCR4受容体結合についてアッセイすることができる。SDF-1ポリペプチドによるCXCR4の活性化は、細胞内カルシウム動員、細胞走化性、ケミルミネセンス、脱顆粒アッセイ法、活性酸素種のNADPH-依存型の発生の測定、Gプロテイン、ホスホリパーゼC(PLC)、プロテインキナーゼC(PKC)、またはSrcおよびSrcファミリーキナーゼ(すなわち、Fyn)のような第二メッセンジャー酵素の活性化などを含む、標準の生化学的技術による受容体の活性のアッセイを通じて、決定することができる。いくつかの態様において、CXCR4アゴニスト活性、本発明の推定CXCR4アゴニストのCXCR4受容体結合またはCXCR4受容体活性化は、配列番号:1、2または3のポリペプチドの対応するパラメータの少なくとも0.01倍、0.1倍、1.0倍、10倍、または100倍である。
【0023】
別の態様において、様々な小型のSDF-1ペプチド類似体を、CXCR4アゴニストとして使用することができる。このようなペプチドのひとつは、アミノ酸1〜9の二量体であり、そのアミノ酸鎖は、各配列における9位の各システインの間のジスルフィド結合により連結されている(SDF-1(1-9)2またはKPVSLSYRCCRYSLSVPKと称される)。別のペプチドは、アミノ酸1〜8、KPVSLSYR-X-RYSLSVPKの二量体であり、ここでこれらのアミノ酸鎖は、各配列の8位の各アルギニンの間の連結部分Xにより連結されている(SDF-1(1-8)2と称する)。CXCR4アゴニストペプチドは、例えば下記の配列を有するペプチドからなる群より選択することができる:

前記ペプチドにおいて、Xは、リシンのα(アルファ)およびε(イプシロン)両アミノ基が共有(アミド)結合形成により会合され、かつリシルカルボキシル基が保護されているリシンであることができる。前記一覧の中で最後の2種の化合物は、例えば下記のように表され、これは標準のアミノからカルボキシル方向のペプチド配列を示している:

様々な代わりの態様において、このようなSDF-1ペプチド類似体は、SDF-1ポリペプチドと共に、本発明のCXCR4アゴニスト中に含まれる。
【0024】
いくつかの態様において、本発明において使用するためのCXCR4アゴニストは、実質的に精製されたペプチド断片、修飾されたペプチド断片、SDF-1αまたはSDF-1βのいずれかの類似体または薬学的に許容される塩でありうる。CXCR4のSDF-1由来のペプチドアゴニストは、公知の生物学的アッセイ法およびCrumpら、The EMBO Journal、16(23)6996-7007(1997);および、Hevekerら、Current Biology、8(7):369-376(1998)(これらは各々、本明細書に参照として組入れられる)のような様々な技術により同定することができる。このようなSDF-1由来のペプチドは、ペプチドがCXCR4アゴニスト活性を有するという条件で、天然のアイソフォームまたは遺伝的変種のような天然のSDF-1の同族体、または天然のSDF-1の少なくとも一部と40%、50%、60%、70%、80%、90%、95%または99%の配列同一性を有するようなSDF-1に類似した実質的配列を有するポリペプチド、10個、15個、20個、30個、40個、50個以上のアミノ酸の連続した配列である天然のSDF-1の一部を含むことができる。いくつかの態様において、化学的に類似したアミノ酸は、(保存的アミノ酸置換を提供するために)天然のSDF-1配列においてアミノ酸が置換され得る。いくつかの態様において、N末端の10または7個のアミノ酸の内部にN末端LSY配列部分、および/またはN末端の20個のアミノ酸内部のN末端RFFESH(配列番号:5)配列部分を有するペプチドを、これらがCXCR4アゴニスト活性を有するならば使用することができる。このようなペプチドアゴニスト候補のひとつのファミリーは、アミノ酸5〜7にLSYモチーフを有する。別のペプチドは更に、アミノ酸12〜17にRFFESH(配列番号:5)部分を含む。別の態様において、LSY部分は、ペプチドの3〜5位に位置している。本発明は更に、2種のアミノ酸配列を有するペプチド二量体を提供しており、これらは各々、N末端の20個、または好ましくは10個以内のアミノ酸にジスルフィド架橋により結合され、システイン残基またはα-アミノ酪酸残基に連結した、前記配列エレメントを有することができる。
【0025】
本発明は、CXCR4アゴニストを含む薬学的組成物を提供する。一つの態様において、そのような組成物は、骨髄および/もしくは末梢前駆体もしくは幹細胞の増殖、変異、および/または移動を変化させるために十分な治療的または予防的有効量のCXCR4アゴニスト化合物と、薬学的に許容される担体とを含む。もう一つの態様において、組成物は、例えば、癌に対する化学療法または放射線療法に使用されるような細胞傷害性物質による細胞傷害性作用を阻害するために十分な治療的または予防的有効量のCXCR4アゴニスト化合物と、薬学的に許容される担体とを含む。
【0026】
本発明の化合物の「有効量」とは、治療的有効量または予防的有効量を含む。「治療的有効量」とは、骨髄前駆細胞もしくは幹細胞の増殖の低下、または細胞傷害性物質の細胞傷害性作用の低下もしくは阻害のような、望ましい治療的結果を達成するのに必要な用量または期間で有効な量を意味する。CXCR4アゴニストの治療的有効量は、個体の疾患の状態、年齢、性別および体重、ならびに個体におけるCXCR4アゴニストの所望の反応の誘発能のような要因に応じて変化してもよい。投与レジメは最適な治療反応が得られるように調節してもよい。治療的有効量はまた、CXCR4アゴニストの毒性または有害な作用を治療的に恩典を有する作用が上回る量である。
【0027】
「予防的有効量」とは、細胞傷害性物質の細胞傷害性作用を予防もしくは阻害するような望ましい予防的結果を得るために必要な用量および期間で有効な量を指す。典型的に、予防的用量は疾患の発病前、または初期段階に被験者に用いられるため、予防的有効量は治療的有効量より少ない可能性がある。
【0028】
特定の態様において、CXCR4アゴニストの治療的有効量または予防的有効量の好ましい範囲は、0.1 nM〜0.1 M、0.1 nM〜0.05 M、0.05 nM〜15 μM、または0.01 nM〜10 Mであってもよい。用量の値は、緩和すべき疾患の重症度に応じて変化してもよいことに注目すべきである。特定の被験者に関して、個々の需要、および組成物を投与する人または投与を管轄する人の専門的な判断に応じて、経時的に特定の用量レジメを調節することができる。本明細書において述べた用量範囲は説明のためであって、医師によって選択されうる用量範囲を制限するものではない。
【0029】
組成物中の活性化合物の量は、個体の疾患の状態、年齢、性別および体重のような要因に応じて変化してもよい。投与レジメは最適な治療反応が得られるように調節してもよい。例えば、ボーラス投与を1回行ってもよく、数回の分割用量を経時的に投与してもよく、または治療状況の緊急性によって示されるように用量はそれに応じて減少または増加させてもよい。投与を容易にするために、且つ投与を均一に行うために、非経口投与組成物を単位投与剤形に製剤化することは好都合でありうる。本明細書において用いる「単位投与剤形」は、治療すべき被験者の単位用量として適している物理的に個別の単位を指す;それぞれの単位は必要な薬学的担体に関連して所望の治療的作用を生じるように計算される活性化合物の既定量を含む。本発明の単位投与剤形の詳細は、(a)活性化合物の独自の特徴および得られる特定の治療効果、および(b)個体における感受性を治療するための活性化合物のような化合物を合成する技術分野における固有の制限によって指図され、直接依存する。
【0030】
本明細書において用いるように、「薬学的に許容される担体」または「賦形剤」とは、生理学的に適合性である任意の全ての溶媒、分散媒体、コーティング、抗菌剤、抗真菌剤、等張剤、および吸収遅延剤等を含む。一つの態様において、担体は非経口投与に適している。または、担体は、静脈内、腹腔内、筋肉内、舌下、または経口投与に適合することができる。薬学的に許容される担体には、滅菌水溶液または分散液、および滅菌注射用溶液または分散液の即時混合型調製用の滅菌粉末が含まれる。そのような媒体および物質を薬学的に活性な物質に用いることは当技術分野で周知である。従来の媒体または物質が活性化合物と不適合性である場合を除いて、これを本発明の薬学的組成物において用いることが考慮される。補助的な活性化合物もまた組成物に組み入れることができる。
【0031】
いくつかの態様において、CXCR4アゴニストは、追加の活性成分と共に薬学的組成物中に処方するか、または1種もしくはそれ以上の追加の投薬による治療と組み合わせた治療法で投与することができ、このような医薬品は、下記から選択される:組換えメチオニルヒトG-CSF(ノイポゲン(登録商標)、フィルグラスチム;Amgen社)、GM-CSF(リューカイン(登録商標)、サルグラモスチム;Immunex社)、エリスロポエチン(rhEPO、エポジェン(登録商標);Amgen社)、トロンボポエチン(rhTPO;Genentech社)、インターロイキン-11(rhIL-11、ニューメガ(登録商標);American Home Products社)、Flt3リガンド(Mobista;Immunex社)、多系統造血因子(MARstem(商標);Maret Pharm.社)、ミエロポエチン(Leridistem;Searle社)、IL-3、骨髄前駆体阻害因子-1(Mirostipen;Human Genome Sciences社)、および幹細胞因子(rhSCF、ステムジェン(登録商標);Amgen社)。
【0032】
治療的組成物は典型的に、製造および保存条件下で滅菌かつ安定でなければならない。組成物は、溶液、微小乳液、リポソーム、または高い薬物濃度に適したその他の指示された構造に製剤化することができる。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、および液体ポリエチレングリコール等)、および適したその混合液となりうる。適当な流動性は、例えば、レシチンのようなコーティングを用いることによって、分散剤の場合には必要な粒子径を維持することによって、並びに界面活性剤を用いることによって維持することができる。多くの場合、組成物に等張剤、例えば、糖、マンニトール、ソルビトール、または塩化ナトリウムのような多価アルコールを含むことが好ましいと思われる。注射可能な組成物の持続的な吸収は例えば吸収を遅らせる物質を、例えばモノステアリン酸塩およびゼラチン組成物に含めることによって、得ることができる。その上、CXCR4アゴニストは、持効性製剤、例えば徐放性ポリマーを含む組成物において投与することができる。活性化合物は、インプラントおよび微量封入輸送系を含む徐放製剤のような、化合物が急速に放出されないようにする担体と共に調製することができる。エチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、ポリ乳酸およびポリ乳酸ポリグリコール酸コポリマー(PLG)のような生分解性ポリマーを用いることができる。そのような製剤を調製するための多くの方法は特許権が与えられているか、または一般的に当技術分野で既知である。
【0033】
滅菌注射可能溶液は、活性化合物を、必要に応じて上記列挙した成分の1つまたは組合せと共に適当な溶媒中で必要な量を組み入れて、その後濾過滅菌することによって調製することができる。一般的に、分散液は、基礎分散媒体と上記に列挙した成分から必要な他の成分とを含む滅菌媒体に活性化合物を組み入れることによって調製される。滅菌注射液を調製するための滅菌粉末の場合、好ましい調製法は、真空乾燥および凍結乾燥によって生じた活性成分に、あらかじめ濾過滅菌した溶液由来のさらなる所望の成分を添加する。本発明のもう一つの局面に従って、CXCR4アゴニストはCXCR4アゴニストの溶解度を増加させる1つまたはそれ以上のさらなる化合物と共に製剤化してもよい。
【0034】
本発明のCXCR4アンタゴニスト化合物には、C末端ヒドロキシメチル誘導体、O-修飾誘導体(例えば、C末端ヒドロキシメチルベンジルエーテル)、アルキルアミドのような置換されたアミドおよびヒドラジドおよびC末端のフェニルアラニンをフェネチルアミド類似体で置換した化合物(例えば、トリペプチドSer-Ile-Pheの類似体としてのSer-Ile-フェネチルアミド)を含むN末端修飾誘導体のようなSDF-1誘導体が含まれる。
【0035】
本発明のCXCR4アゴニストにおいて、ペプチド構造(SDF-1由来ペプチドのように)は、少なくとも1つの修飾基に直接または間接的にカップリングしてもよい。「修飾基」という用語は、ペプチド構造に間接的に結合する構造(例えば、SDF-1コアペプチド構造に隣接してもよい、さらなるアミノ酸残基、またはその模倣体、類似体もしくは誘導体との安定な非共有結合的会合、または共有結合によって)、並びにペプチド構造(例えば、共有結合または共有カップリングによる)に直接結合する構造を含むと解釈される。例えば、修飾基はSDF-1ペプチド構造のアミノ末端もしくはカルボキシル末端、またはコアドメインに隣接するペプチドまたはペプチド模倣領域にカップリングすることができる。または、修飾基はSDF-1ペプチド構造の少なくとも1つのアミノ酸残基の側鎖、またはコアドメインに隣接するペプチドもしくはペプチド模倣領域にカップリングすることができる(例えば、リジン残基のεアミノ基を通じて、アスパラギン酸残基もしくはグルタミン酸残基のカルボキシル基を通じて、チロシン残基、セリン残基もしくはトレオニン残基のヒドロキシ基を通じて、またはアミノ酸側鎖上のその他の適した反応基を通じて)。ペプチド構造に共有結合的にカップリングした修飾基は、例えば、アミド、アルキルアミノ、スルフィド、カルバメート、または尿素結合を含む化学構造の結合に関して、当技術分野で周知の手段および方法によって結合することができる。
【0036】
いくつかの態様において、修飾基は、環状、複素環状、または多環状基を含みうる。本明細書において用いられる「環状基」という用語は、炭素原子3〜10個、4〜8個、または5〜7個を有する環状の飽和または不飽和(すなわち芳香族)基を含む。例としての環状基には、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、およびシクロオクチルが含まれる。環状基は、非置換であってもよく、または1つもしくはそれ以上の環の位置で置換されていてもよい。環状基は例えば、ハロゲン、アルキル、シクロアルキル、アルケニル、アルキニル、アリール、ヘテロサイクル、ヒドロキシル、アミノ、ニトロ、チオール、アミン、イミン、アミド、ホスホネート、ホスフィン、カルボニル、カルボキシル、シリル、エーテル、チオエーテル、スルホニル、スルホネート、セレノエーテル、ケトン、アルデヒド、エステル、-CF3、-CNによって置換してもよい。
【0037】
「複素環状基」という用語は、環構造が1個または複数のヘテロ原子を含む、炭素原子3〜10個、4〜8個、または5〜7個を有する環状の飽和、不飽和、または芳香族基を含む。複素環状基には、ピロリジン、オキソラン、チオラン、イミダゾール、オキサゾール、ピペリジン、ピペラジン、モルフォリンが含まれる。複素環は、例えば、ハロゲン、アルキル、シクロアルキル、アルケニル、アルキニル、アリール、他のヘテロサイクル、ヒドロキシル、アミノ、ニトロ、チオール、アミン、イミン、アミド、ホスホネート、ホスフィン、カルボニル、カルボキシル、シリル、エーテル、チオエーテル、スルホニル、スルホネート、セレノエーテル、ケトン、アルデヒド、エステル、-CF3、-CNのような置換基によって1つまたはそれ以上の基で置換することができる。複素環はまた、下記のように、他の環状基に架橋または融合してもよい。
【0038】
本明細書において用いられる「多環状基」という用語は、2つまたはそれ以上の炭素が2つの隣接する基に共通であり、従って環が「縮合環」である、2つまたはそれ以上の飽和、不飽和、または芳香族の環状環を意味すると解釈される。隣接しない原子を通じて結合される環は「架橋」環と呼ばれる。多環状基の環のそれぞれは、上記のような、例えば、ハロゲン、アルキル、シクロアルキル、アルケニル、アルキニル、ヒドロキシル、アミノ、ニトロ、チオール、アミン、イミン、アミド、ホスホネート、ホスフィン、カルボニル、カルボキシル、シリル、エーテル、チオエーテル、スルホニル、スルホネート、セレノエーテル、ケトン、アルデヒド、エステル、-CF3、または-CNの置換基で置換することができる。
【0039】
「アルキル」という用語は、直鎖アルキル基、分岐鎖アルキル基、シクロアルキル(脂環式)基、アルキル置換シクロアルキル基、およびシクロアルキル置換アルキル基を含む、飽和脂肪族基のラジカルを意味する。いくつかの態様において、直鎖または分岐鎖アルキルはその骨格の炭素原子が20個もしくはそれより少なく(直鎖ではC1〜C20、分岐鎖ではC3〜C20)、または炭素原子が10個もしくはそれより少ない。いくつかの態様において、シクロアルキルは環構造の炭素原子が4〜10個であり、例えば炭素原子が5、6または7個である。炭素数を特に明記していなければ、本明細書において用いられる「低級アルキル」とは、上記の通りであり、その骨格構造に炭素原子10個を有するアルキル基を意味する。同様に、「低級アルケニル」および「低級アルキニル」は、10個またはそれより短い炭素鎖長を有する。
【0040】
本明細書および特許請求の範囲を通じて用いられる「アルキル」(または「低級アルキル」)という用語は、「非置換アルキル」および「置換アルキル」の双方を含むと解釈され、後者は、炭化水素骨格の1つまたはそれ以上の炭素上の水素を置換する置換基を有するアルキル部分を意味する。そのような置換基は、例えば、ハロゲン、ヒドロキシル、カルボニル(カルボキシル、ケトン(アルキルカルボニルおよびアリールカルボニル基を含む)ならびにエステル(アルキルオキシカルボニルおよびアリールオキシカルボニル基を含む)のような、チオカルボニル、アシルオキシ、アルコキシル、ホスホリル、ホスホネート、ホスフィネート、アミノ、アシルアミノ、アミド、アミジン、イミノ、シアノ、ニトロ、アジド、スルフヒドリル、アルキルチオ、スルフェート、スルホネート、スルファモイル、スルホンアミド、ヘテロシクリル、アラルキル、または芳香族もしくはヘテロ芳香族部分を含むことができる。炭化水素鎖上で置換された部分は、それ自身適当であれば置換される。例えば、置換アルキルの置換基は、アミノ、アジド、イミノ、アミド、ホスホリル(ホスホネートおよびホスフィネートを含む)、スルホニル(スルフェート、スルホンアミド、スルファモイル、およびスルホネートを含む)、ならびにシリル基のみならず、エーテル、アルキルチオ、カルボニル、(ケトン、アルデヒド、カルボキシレート、およびエステルを含む)、-CF3、-CN等の置換または非置換型を含んでもよい。一例としての置換アルキルを下記に示す。シクロアルキルはさらに、アルキル、アルケニル、アルコキシ、アルキルチオ、アミノアルキル、カルボニル置換アルキル、-CF3、-CN等によって置換することができる。
【0041】
「アルケニル」および「アルキニル」という用語は、長さが類似で、上記のアルキルとの置換が起こりうるが、それぞれ少なくとも1つの二重結合または三重結合を含む、不飽和脂肪族基を意味する。
【0042】
本明細書において用いられる「アラルキル」という用語は、少なくとも1つのアリール基で置換されたアルキル基またはアルキレニル基を意味する。一例としてのアラルキルには、ベンジル(すなわち、フェニルメチル)、2-ナフチルエチル、2-(2-ピリジル)プロピル、5-ジベンゾスベリル等が含まれる。
【0043】
本明細書において用いられる「アルキルカルボニル」という用語は、-C(O)-アルキルを意味する。同様に、「アリールカルボニル」という用語は-C(O)-アリールを意味する。本明細書において用いられる「アルキルオキシカルボニル」という用語は-C(O)-O-アルキルを意味し、「アリールオキシカルボニル」という用語は-C(O)-O-アリールを意味する。「アシルオキシ」という用語は、R7がアルキル、アルケニル、アルキニル、アリール、アラルキル、またはヘテロシクリルである、-O-C(O)-R7を意味する。
【0044】
本明細書において用いられる「アミノ」という用語は、RαおよびRβがそれぞれ独立して、ハロゲン、アルキル、アルケニル、アルキニル、アラルキル、アリールであるか、またはRαおよびRβがそれらが結合する窒素原子と共に原子4〜8個を有する環を形成する、-N(Rα)-(Rβ)を意味する。従って、本明細書において用いられる「アミノ」という用語は、非置換、モノ置換(例えば、モノアルキルアミノまたはモノアリールアミノ)、および二置換(例えば、ジアルキルアミノまたはアルキルアリールアミノ)アミノ基を含む。「アミド」という用語は、R8およびR9が上記の定義の通りである、-C(O)-N(R8)-(R9)を意味する。「アシルアミノ」という用語は、R7が上記の通りであり、R'8がアルキルである、-N(R'8)C(O)-R7を意味する。
【0045】
本明細書に用いられているように、「ニトロ」という用語は-NO2を意味し;「ハロゲン」とは、-F、-Cl、-Brまたは-Iを意味し;「スルフヒドリル」という用語は-SHを意味し;および「ヒドロキシル」という用語は-OHを意味する。
【0046】
本明細書に用いられる「アリール」という用語には、環にゼロから4個のヘテロ原子を含んでもよい、例えばフェニル、ピロリル、フリル、チオフェニル、イミダゾール、オキサゾール、チアゾリル、トリアゾリル、ピラゾリル、ピリジル、ピラジニル、ピリダジニル、およびピリミジニル等のような、5、6および7員環芳香族基が含まれる。環構造にヘテロ原子を有するそれらのアリール基もまた、「アリール複素環」または「ヘテロ芳香族」と呼んでもよい。芳香環は、1つまたはそれ以上の環の位置で、上記のような、例えば、ハロゲン、アジド、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、ヒドロキシル、アミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホネート、ホスフィネート、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、スルホンアミド、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族またはヘテロ芳香族部分、-CF3、-CN等の置換基に置換することができる。アリール基はまた、多環状基の一部となりうる。例えば、アリール基にはナフチル、アントラセニル、キノリル、インドリル等のような縮合芳香族部分が含まれる。
【0047】
修飾基は、ビオチニル構造、フルオレセイン含有基、ジエチレントリアミンペンタアセチル基、(0)-メトキシアセチル基、N-アセチルノイラミニル基、コリル構造またはイミノビオチニル基を含む基であることができる。CXCR4アゴニスト化合物は、当技術分野において公知の方法に従い、そのカルボキシル末端でコリル基により修飾することができる(例えば、Wess, G.ら、Tetrahedron Letters、34:817-822(1993);Wess, G.ら、Tetrahedron Letters、33:195-198(1992);および、Kramer, W.ら、J. Biol. Chem.、267:18598-18604(1992))。コリル誘導体および類似体は、修飾基としても利用することができる。例えば、好ましいコリル誘導体は、Aic(3-(O-アミノエチル-イソ)-コリル)であり、これは更にCXCR4アゴニスト化合物の修飾に使用することができるような遊離のアミノ基を有する。修飾基は「ビオチニル構造」であることができ、これはビオチニル基ならびにそれらの類似体および誘導体を含む(例えば2-イミノビオチニル基)。別の態様において、修飾基は、「フルオレセイン含有基」、例えばSDF-1由来のペプチド構造と5-(および6-)-カルボキシフルオレセイン、スクシンイミジルエステルまたはフルオレセインイソチオシアナートとの反応に由来した基などを含むことができる。様々な別の態様において、修飾基は、N-アセチルノイラミニル基、トランス-4-コチニンカルボキシル基、2-イミノ-1-イミダゾリジンアセチル基、(S)-(-)-インドリン-2-カルボキシル基、(-)-メントキシアセチル基、2-ノルボルナンアセチル基、γ-オキソ-5-アセナフテンブチリル、(-)-2-オキソ-4-チアゾリジンカルボキシル基、テトラヒドロ-3-フロイル基、2-イミノビオチニル基、ジエチレントリアミンペンタアセチル基、4-モルホリノカルボニル基、2-チオフェンアセチル基、または2-チオフェンスルホニル基を含むことができる。
【0048】
本発明のCXCR4アゴニスト化合物は、化合物の望ましい機能性を保持しながら、化合物の特定の特性を変化させるようにさらに修飾することができる。例えば、一つの態様において、インビボ安定性、生物利用可能性、または半減期のような化合物の薬物動態特性を変化させるように、化合物を修飾することができる。検出可能な物質によって化合物を標識するように、化合物を修飾することができる。化合物がさらなる治療的部位にカップリングするように、化合物を修飾することができる。化合物を、その薬物動態特性を変化させるためなどの、さらに化学的に修飾するために反応基を誘導体化することができる。例えば、修飾基をSDF-1コアドメインのアミノ末端に結合させると、化合物のカルボキシル末端をさらに修飾することができる。潜在的なC末端修飾には、化合物のカルボキシペプチダーゼの基質としての作用能を減少させる修飾が含まれる。好ましいC末端修飾物質の例には、アミド基、エチルアミド基、並びにD-アミノ酸およびβ-アラニンのような様々な非天然アミノ酸が含まれる。または、修飾基を凝集コアドメインのカルボキシル末端に結合させると、化合物のアミノ末端はさらに、例えば化合物のアミノペプチダーゼの基質としての作用能を減少させるようにさらに修飾することができる。
【0049】
CXCR4アゴニスト化合物は、検出可能な物質と化合物とを反応させることによって化合物を標識するようにさらに修飾することができる。適した検出可能な物質には、様々な酵素、補欠分子団、蛍光物質、発光物質、および放射性物質が含まれる。適した酵素の例には、西洋ワサビペルオキシダーゼ、アルカリフォスファターゼ、-ガラクトシダーゼ、またはアセチルコリンエステラーゼが含まれ;適した補欠分子団の例には、ストレプトアビジン/ビオチン、およびアビジン/ビオチンが含まれ;適した蛍光物質の例には、ウンベリフェロン、フルオレセイン、フルオレセインイソチオシアネート、ローダミン、ジクロロトリアジニルアミンフルオレセイン、塩化ダンシル、またはフィコエリスリンが含まれ;発光物質の例には、ルミノールが含まれ;および適した放射性物質の例には14C、123I、124I、125I、131I、99mTc、35Sまたは3Hが含まれる。CXCR4アゴニスト化合物は、14Cを修飾基またはCXCR4アゴニスト化合物の1つまたはそれ以上のアミノ酸構造の中に組み入れることによって、14Cによって放射性標識されうる。標識したCXCR4アゴニスト化合物は、化合物のインビボ薬物動態を評価するためのみならず、被験者の疾患の進行または例えば診断目的のために被験者が疾患を発症する可能性を検出するために用いてもよい。CXCR4受容体の組織分布は、被験者に由来するインビボまたはインビトロ試料のいずれかにおいて標識したCXCR4アゴニスト化合物を用いて検出することができる。インビボ診断剤として用いるために、本発明のCXCR4アンタゴニスト化合物は、放射性テクネチウムまたはヨウ素によって標識してもよい。遊離のアミノ基を有するコール酸のAic誘導体のような、標識のキレート剤を導入することができる部位を提供する修飾基を選択することができる。例えば、SDF-1配列内のフェニルアラニン残基(例えばアミノ酸残基13位)は、放射性ヨウ化チロシルに置換することができる。放射性ヨウ素の様々な同位元素の如何なるものも、診断薬を作製するために組み入れることができる。123I(半減期=13.2時間)を全身シンチグラフィーに用い、124I(半減期=4日)を陽電子射出断層撮影(PET)に用い、125I(半減期=60日)は代謝回転試験に用いてもよく、131I(半減期=8日)は、全身計数および遅延型低解像度画像試験に用いてもよい。
【0050】
もう一つの化学修飾において、本発明のCXCR4アゴニスト化合物は、化合物そのものはCXCR4アゴニストとして作用することはないが、インビボで代謝されると本明細書に記述のCXCR4アゴニスト化合物に変化することができる、「プロドラッグ」の形で調製してもよい。例えば、このタイプの化合物では、調節基は、代謝されると活性なCXCR4アゴニストの形に変換することができるプロドラッグの形で存在しうる。修飾基のそのようなプロドラッグ型は、本明細書において「二次修飾基」と呼ばれる。ペプチド骨格の薬物の活性型の輸送を最適にするために代謝を制限する、ペプチドプロドラッグを調製するための多様な戦略が当技術分野で既知である(例えば、モス(Moss, J.)(1995)「ペプチド骨格の薬物の設計:輸送と代謝の調節(Peptide-Based Drug Design:Controlling Transport and Metabolism)」、タイラー&アミドン(Taylor, M. D. & Amidon, G. L.)編、第18章を参照のこと)。
【0051】
本発明のCXCR4アゴニスト化合物は、当技術分野で既知の標準的な技術によって調製することができる。CXCR4アゴニストのペプチドまたはポリペプチドの成分は少なくとも一部では、標準的な技術(Bodansky, M.、「ペプチド合成の原理(Principles of Peptide Synthesis)」、Springer Verlag、ベルリン(1993);Grant, G. A.編、「合成ペプチド;ユーザーズガイド(Synthetic Peptides:A User's Guide)」、W. H. Freeman & Company、ニューヨーク(1992);またはClark-Lewis, I., Dewald, B., Loetscher, M., Moser, B.,およびBaggiolini, M.、(1994)、J. Biol. Chem., 269, 16075-16081などに記載される技術)を用いて合成されるペプチドで構成されうる。自動ペプチドシンセサイザーは市販されている(例えば、アドバンスド・ケムテックモデル396;ミリジェン/バイオサーチ9600)。ペプチドおよびポリペプチドは、標準的な方法に従いCXCR4アゴニスト活性に関してアッセイされうる。ペプチドおよびポリペプチドは、HPLCにより精製され、質量分析により分析されうる。ペプチドおよびポリペプチドは、10%DMSOを含む水を用いて、システインの穏和な酸化により形成されるジスルフィド架橋を介して二量体化されうる。HPLC精製後、二量体形成が質量分析により確認されうる。標準的な方法、例えばアミノ基(例えば、ペプチドのアミノ末端のαアミノ基)、カルボキシル基(例えばペプチドのカルボキシル末端)、ヒドロキシル基(例えば、チロシン、セリンもしくはトレオニン残基上)、またはアミノ酸側鎖上のその他の適した反応基による反応方法を用いて、1つまたは複数の調節基をSDF-1由来ペプチド成分に結合してもよい(例えば、Greene, T. W.およびWuts, P. G. M.「有機合成における保護基(Protective Groups in Organic Synthesis)」、John Wiley & Sons, Inc.、ニューヨーク(1991))。
【0052】
本発明のもう一つの局面において、CXCR4アゴニストペプチドは、ペプチドをコードする核酸分子を用いて、標準的な組換えDNA技術に従って調製してもよい。ペプチドまたはポリペプチドをコードするヌクレオチド配列は遺伝子コードを用いて決定してもよく、このヌクレオチド配列を有するオリゴヌクレオチド分子は標準的なDNA合成法によって合成してもよい(例えば、自動DNAシンセサイザーの使用)。またはペプチド化合物をコードするDNA分子を、標準的な分子生物学技術に従って、天然の前駆体タンパク質遺伝子またはcDNA(例えば、ポリメラーゼ連鎖反応(PCR)および/または制限酵素消化の使用)から誘導することができる。
【0053】
本発明はまた、本発明のペプチドをコードするヌクレオチド配列を含む単離核酸分離を提供する。いくつかの態様において、ペプチドは、天然SDF-1と比較して少なくとも一つのアミノ酸欠失を有するアミノ酸配列を含みうる。「核酸分子」という用語は、DNA分子及びRNA分子を含むものとし、一本鎖であっても又は二本鎖であってもよい。別の態様において、単離核酸は、SDF-1のN末端、C末端、及び/又は内部から一つ又は複数のアミノ酸が欠失したペプチドをコードする。
【0054】
標準的な組換えDNA技術により宿主細胞におけるペプチド化合物の発現を促進するため、ペプチドをコードする単離核酸は、組換え発現ベクターに組み入れられても良い。従って、本発明は、本発明の核酸分子を含む組換え発現ベクターも提供する。本明細書において用いられるように、「ベクター」という用語は、それに機能的に結合されている他の核酸を輸送することができる核酸分子をさす。ベクターには、環状二本鎖DNAプラスミドおよび/またはウイルスベクターが含まれる。ある種のベクターは、それらが導入された宿主細胞において自律的に複製することができる(例えば、細菌性複製開始点を有する細菌ベクター及びエピソーム性哺乳動物ベクター)。その他のベクター(例えば、非エピソーム性哺乳動物ベクター)は、宿主細胞へ導入されたとき宿主細胞のゲノムに取り込まれ、それにより宿主ゲノムと共に複製されうる。ある種のベクターは、それらと機能的に結合した遺伝子の発現を誘導することができる。そのようなベクターは、本明細書において、「組換え発現ベクター」又は単に「発現ベクター」と呼ばれる。
【0055】
本発明の組換え発現ベクターにおいて、ペプチドをコードするヌクレオチド配列は、発現のため用いられる宿主細胞に基づき選択された一つ又は複数の調節配列と機能的に結合していてもよい。「機能的に結合した」又は「機能可能に」結合したという用語は、ペプチド化合物の発現を可能にする様式で(一つ又は複数の)調節配列と結合した、ペプチドをコードする配列を意味する。「調節配列」という用語は、プロモーター、エンハンサー、ポリアデニル化シグナル、及びその他の発現調節要素を含む。そのような調節配列は、例えば、Goeddel;Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif.(1990)(本明細書に参照として組み込まれる)に記載されている。調節配列には、多くの型の宿主細胞におけるヌクレオチド配列の構成性発現を導くもの、ある種の宿主細胞のみにおけるヌクレオチド配列の構成性発現を導くもの(例えば、組織特異的調節配列)、及び調節可能な様式で(例えば、誘導剤の存在下でのみ)発現を導くものが含まれる。発現ベクターの設計は、形質転換される宿主細胞の選択、および所望のペプチド化合物の発現レベルのような要因によると考えられる。
【0056】
本発明の組換え発現ベクターは、原核細胞又は真核細胞におけるペプチド化合物の発現のため設計されうる。例えば、ペプチド化合物は、大腸菌のような細菌細胞、昆虫細胞(バキュロウイルス発現ベクターを用いる)、酵母細胞、又は哺乳動物細胞において発現されうる。適当な宿主細胞は、Goeddel;Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif.(1990)にさらに論じられている。又は、組換え発現ベクターは、例えばT7プロモーター調節配列及びT7ポリメラーゼを用いて、インビトロで転写及び翻訳されうる。酵母S.セレビシエ(S.cerevisae)における発現のためのベクターの例には、pYepSec1(Baldariら,(1987)EMBO J.6:229-234)、pMFa(KurjanおよびHerskowitz,(1982)Cell 30:933-943)、pJRY88(Schultzら,(1987)Gene 54:113-123)、及びpYES2(Invitrogen Corporation, San Diego, Calif.)が含まれる。培養昆虫細胞(例えば、Sf9細胞)におけるタンパク質又はペプチドの発現のために利用可能なバキュロウイルスベクターには、pAc系(Smithら,(1983)Mol.Cell.Biol.3:2156-2165)及びpVL系(Lucklow,V.A.,およびSummers,M.D.,(1989)Virology 170:31-39)が含まれる。哺乳動物発現ベクターの例には、pCDM8(Seed,B.,(1987)Nature 329:840)及びpMT2PC(Kaufmanら(1987),EMBO J.6:187-195)が含まれる。哺乳動物細胞において用いられる場合、発現ベクターの調節機能は、ウイルス性調節要素により提供される場合が多い。例えば、一般的に用いられるプロモーターは、ポリオーマ、アデノウイルス2型、サイトメガロウイルス、及びSV40由来のものである。
【0057】
制御調節配列に加え、組換え発現ベクターは、例えばベクターを取り込んだ宿主細胞を同定するための選択マーカー遺伝子のような、付加的なヌクレオチド配列を含有しうる。選択マーカー遺伝子は、当技術分野において周知である。宿主細胞、特に哺乳動物宿主細胞からのペプチド化合物の分泌を促進するため、組換え発現ベクターは、好ましくは、ペプチド化合物が発現時にそのアミノ酸と融合したシグナル配列と共に合成されるように、ペプチド化合物のアミノ末端をコードする配列と機能的に結合したシグナル配列をコードする。このシグナル配列は、ペプチド化合物を細胞の分泌経路へと導き、その後、切断され、宿主細胞からの成熟ペプチド化合物(即ち、シグナル配列を含まないペプチド化合物)の放出を可能にする。哺乳動物宿主細胞からのタンパク質又はペプチドの分泌を促進するためのシグナル配列の使用は、当分技術野において周知である。
【0058】
ペプチド化合物をコードする核酸を含む組換え発現ベクターは、宿主細胞へ導入され、宿主細胞においてペプチド化合物を産生することができる。従って、本発明は、本発明の組換え発現ベクターを含有する宿主細胞も提供する。「宿主細胞」及び「組換え宿主細胞」という用語は、本明細書において互換的に用いられる。そのような用語は、特定の対象細胞のみならず、そのような細胞の継代細胞、又は継代細胞である可能性のある細胞をもさす。変異又は環境的影響のいずれかのため後代においてはある種の修飾が起こりうるため、そのような継代細胞は、実際は、親細胞と同一でないかもしれないが、それでも、本明細書において用いられるようにその用語の範囲内に含まれる。宿主細胞は、任意の原核細胞又は真核細胞でありうる。例えば、ペプチド化合物は、大腸菌のような細菌細胞、昆虫細胞、酵母、又は哺乳動物細胞において発現されうる。ペプチド化合物は、遺伝子治療により被験者に対して被験者のインビボで発現される(以下に更に論じる)。
【0059】
ベクターDNAは、通常の、形質転換、トランスフェクション、または感染の技術を介して原核細胞又は真核細胞へ導入される。「形質転換」、「トランスフェクション」、および「感染」という用語は、リン酸カルシウム又は塩化カルシウム共沈殿、DEAEデキストラン媒介トランスフェクション、リポフェクション、エレクトロポレーション、マイクロインジェクション、及びウイルスを介した感染を含む、外来核酸を宿主細胞へ導入するための技術をさす。宿主細胞を形質転換、トランスフェクション、または感染させるための適当な方法は、例えばSambrookら(「分子クローニング:実験マニュアル(Molecular Cloning:A Laboratory Manual)」、第2版、Cold Spring Harbor Laboratory Press(1989))及びその他の実験書に見出すことができる。インビボの哺乳動物細胞へDNAを導入するための方法も既知であり、遺伝子治療の目的のため被験者に本発明のベクターDNAを輸送するために用いられうる。
【0060】
哺乳動物細胞の安定的なトランスフェクションのため、用いられる発現ベクター及びトランスフェクション技術により異なるが、細胞のほんの一部のみが、外因性DNAをゲノム中に組み込まれることが知られている。これらの組込み体を同定及び選択するため、選択マーカー(例えば、抗生物質に対する耐性)をコードする遺伝子を、対象となる遺伝子と共に宿主細胞に導入してもよい。好ましい選択マーカーには、G418、ハイグロマイシン、及びメトトレキセートのような薬物に対する耐性を与えるものが含まれる。選択マーカーをコードする核酸は、ペプチド化合物をコードする核酸と同一のベクターで宿主細胞へ導入されてもよいし、別々のベクターで導入されてもよい。導入された核酸で安定的にトランスフェクションされた細胞は、薬物選択により同定されうる(選択マーカー遺伝子を取り込んだ細胞は生存するが、他の細胞は死滅する)。
【0061】
本発明の核酸は、DNAの直接注入、受容体を介したDNAの取り込み、又はウイルスを介した感染のような方法を用いて、インビボの細胞へ輸送されうる。直接注入は、裸のDNAをインビボの細胞へ導入するために用いられている(例えば、Acsadiら(1991)Nature 332:815-818;Wolffら(1990)Science 247:1465-1468を参照のこと)。インビボの細胞にDNAを注入するための輸送装置(例えば、「遺伝子銃」)が用いられうる。そのような装置は市販されている(例えば、BioRad)。細胞表面受容体に対するリガンドとカップリングしたポリリジンのような陽イオンと、DNAを複合体化することによって、裸のDNAを細胞に導入することもできる(例えば、Wu,G.およびWu,C.H.(1988)J.Biol.Chem.263:14621;Wilsonら(1992)J.Biol.Chem.267:963-967;及び米国特許第5,166,320号を参照のこと)。DNA-リガンド複合体と受容体との結合により、受容体媒介エンドサイトーシスによるDNAの取り込みが促進されうる。エンドソームを破壊し、それにより物質を細胞質へと放出するアデノウイルス・カプシドと結合したDNA-リガンド複合体を、細胞内リソソームによる複合体の分解を回避するために用いてもよい(例えば、Curielら(1991)Proc.Natl.Acad.Sci.USA 88:8850;Cristianoら(1993)Proc.Natl.Acad.Sci.USA 90:2122-2126を参照のこと)。
【0062】
欠陥レトロウイルスが、遺伝子治療目的の遺伝子移入における使用のため、よく特徴決定されている(概説については、Miller, A. D.(1990)Blood 76:271、Kumeら(1999)International. J. Hematol. 69:227-233を参照のこと)。組換えレトロウイルスを作製し、そのようなウイルスをインビトロ又はインビボの細胞に感染させるためのプロトコルは、「分子生物学の最新プロトコール(Current Protocols in Molecular Biology)」、Ausubel, F. M.ら、(編)、Greene Publishing Associates,(1989),Sections 9.10-9.14及びその他の標準的な実験マニュアルに見出されうる。適当なレトロウイルスの例には、当業者に周知のpLJ、pZIP、pWE、及びpEMが含まれる。適当なパッケージング・ウイルス系の例には、.pψi.Crip、.pψi.Cre、.pψi.2、及び.pψi.Amが含まれる。レトロウイルスは、インビトロ及び/又はインビボの上皮細胞、内皮細胞、リンパ球、筋芽細胞、肝細胞、骨髄細胞を含む多くの異なる細胞型へ、多様な遺伝子を導入するために用いられている(例えば、Eglitis,ら、(1985)Science 230:1395-1398;DanosおよびMulligan(1988)Proc. Natl. Acad. Sci. USA 85:6460-6464;Wilsonら(1988)Proc. Natl. Acad. Sci. USA 85:3014-3018;Armentanoら(1990)Proc. Natl. Acad. Sci. USA 87:6141-6145;Huberら(1991)Proc. Natl. Acad. Sci. USA 88:8039-8043;Ferryら(1991)Proc. Natl. Acad. Sci. USA 88:8377-8381;Chowdhuryら(1991)Science 254:1802-1805;van Beusechemら(1992)Proc. Natl. Acad. Sci. USA 89:7640-7644;Kayら(1992)Human Gene Therapy 3:641-647;Daiら(1992)Proc. Natl. Acad. Sci. USA 89:10892-10895;Hwuら(1993)J. Immunol. 150:4104-4115;米国特許第4,868,116号;米国特許第4,980,286号;国際公開公報第89/07136号;国際公開公報第89/02468号;国際公開公報第89/05345号;及び国際公開公報第92/07573号を参照のこと)。様々な態様において、本発明のポリペプチド化合物をコードおよび発現するレトロウイルスゲノムは、造血前駆幹細胞のような細胞の増殖および/または生存のため、輸血または生着、化学療法、放射線療法または脊髄解離性療法に関連した宿主の馴化または適応の臨床目的のための細胞の維持および/または増殖のために利用することができる。
【0063】
遺伝子治療用のベクターとして使用するために、アデノウイルスのゲノムを、正常な溶解性ウイルス生活環において複製する能力に関して不活化されることなく、本発明のペプチド化合物をコードし発現するように操作してもよい。例えば、Berknerら(1988)BioTechniques 6:616;Rosenfeldら(1991)Science 252:431-433;及びRosenfeldら(1992)Cell 68:143-155を参照のこと。アデノウイルス株Ad5型d1324又はその他のアデノウイルス株(例えば、Ad2、Ad3、Ad7など)に由来する適当なアデノウイルスベクターは、当業者に周知である。組換えアデノウイルスは、効率的な遺伝子輸送媒体となるために分裂細胞を必要とせず、気道上皮(Rosenfeldら(1992)、前記)、内皮細胞(Lemarchandら(1992)Proc. Natl. Acad. Sci. USA 89:6482-6486)、肝細胞(HerzおよびGerard(1993)Proc. Natl. Acad. Sci. USA 90:2812-2816)、及び筋細胞(Quantinら(1992)Proc. Natl. Acad. Sci. USA 89:2581-2584)を含む極めて多様な細胞型を感染させるために用いられうるために有利である。様々な態様において、本発明のポリペプチド化合物をコードおよび発現するアデノウイルスゲノムは、造血前駆幹細胞、間質細胞、または間葉細胞のような細胞の増殖および/または生存のため、輸血または生着、化学療法、放射線療法または脊髄解離性療法に関連した宿主の馴化または適応の臨床目的のための細胞の維持および/または増殖のために利用することができる。
【0064】
いくつかの態様において、アデノ随伴ウイルス(AAV)も、遺伝子治療目的のためのDNAの輸送において、遺伝子治療用ベクターとして用いることができる。AAVは、効率的な複製及び生産的な生活環のために、ヘルパーウイルスとして、アデノウイルス又はヘルペスウイルスのような他のウイルスを必要とする、天然に存在する欠陥ウイルスである(MuzyczkaらCurr. Topics in Micro. and Immunol.(1992)158:97-129)。AAVは、非分裂細胞中にDNAを導入するために使用することができる(例えば、Flotteら(1992) Am. J. Respir. Cell. Mol. Biol. 7:349-356;Samulskiら(1989)J. Virol. 63:3822-3828;及びMcLaughlinら(1989)J. Virol. 62:1963-1973を参照のこと)。Tratschinら(1985)Mol. Cell. Biol. 5:3251-3260に記載されているもののようなAAVベクターが、DNAを細胞へ導入するために用いられうる(例えば、Hermonatら(1984)Proc. Natl. Acad. Sci. USA 81:6466-6470;Tratschinら(1985)Mol. Cell. Biol. 4:2072-2081;Wondisfordら(1988)Mol. Endocrinol. 2:32-39;Tratschinら(1984)J. Virol. 51:611-619;及びFlotteら(1993)J. Biol. Chem. 268:3781-3790)。いくつかの態様において、本発明のポリペプチド化合物をコードおよび発現するAAVゲノムは、造血前駆幹細胞、間質細胞、または間葉細胞のような細胞の増殖および/または生存のため、輸血または生着、化学療法、放射線療法または脊髄解離性療法に関連した宿主の馴化または適応の臨床目的のための細胞の維持および/または増殖のために利用することができる。
【0065】
遺伝子治療のための一般的な方法は、当技術分野において既知である。例えば、アンダーソン(Anderson)らによる米国特許第5,399,346号を参照のこと。遺伝物質を輸送するための生体適合性カプセルが、ベテージ(Baetage)らによる国際公開公報第95/05452号に記載されている。中枢神経系障害を治療するため遺伝学的に修飾された細胞を移植するための方法は、米国特許第5,082,670号及び国際公開公報第90/06757号及び同第93/10234号に記載されている。これらは全てゲージ(Gage)らによる。造血細胞への遺伝子導入法は、先に報告されている(Clapp, D. W.ら、Blood、78:1132-1139(1991);Anderson、Science、288:627-9(2000);および、Cavazzana-Calvoら、Science、288:669-72(2000)参照、これらは全て本明細書に参照として組入れられる)。
【0066】
本発明の様々な局面のCXCR4アゴニスト治療に感受性のある癌は、乳房、結腸、直腸、中咽頭、下咽頭、食道、胃、膵臓、肝臓、胆嚢および胆管、小腸、尿管(腎、膀胱および尿路上皮を含む)、女性生殖道(子宮頸部、子宮、および卵巣に加え、絨毛上皮腫および妊娠絨毛性疾患)、男性生殖道(前立腺、精嚢、精巣および生殖細胞腫瘍を含む)、内分泌腺(甲状腺、副腎、および下垂体を含む)、ならびに皮膚の癌腫、更には血管腫、黒色腫、肉腫(骨および軟組織に生じるものに加え、カポジ肉腫を含む)ならびに脳、神経、目、および髄膜の腫瘍(星状細胞腫、神経膠腫、網膜芽腫、神経腫、神経芽細胞腫、シュワン細胞腫、および髄膜腫)を含む、固形腫瘍のような原発性および転移性の両方の腫瘍である。本発明の一部の局面において、CXCR4アゴニストは、白血病のような、造血系悪性疾患から生じる固形腫瘍のような腫瘍(すなわち、緑色腫、形質細胞腫ならびに菌状息肉腫および皮膚T細胞リンパ腫/白血病のプラーク及び腫瘍)の治療に加え、リンパ腫(ホジキンおよび非ホジキンリンパ腫の両方)の治療にも有用である。加えて、CDCX4アゴニストは、単独で使用した場合、または放射線療法もしくは化学療法剤などの細胞傷害性物質との併用した場合のいずれかにおいて、前述の腫瘍からの転移の防止に有用でありうる。
【0067】
本発明の別の局面において、SDF-1ポリペプチドのようなCXCR4アゴニストは、末梢血にCD34+細胞の放出を媒介するために、CD34+細胞を標的とすることができる。本発明のこれらの局面において、SDF-1などのCXCR4アゴニストは、循環CD34+細胞の増殖ならびに造血幹細胞または前駆細胞の生存またはレベルを増強することができ、これは例えば幹細胞移植において有用であることができる。
【0068】
本発明の様々な局面において、CXCR4アゴニストは、造血細胞増殖速度を低下させる際に使用することができる。本発明の方法は、造血幹細胞および造血前駆細胞、ストローマ細胞、または間充織細胞からなる群より選択された細胞へ有効量のCXCR4アゴニストを投与する段階を含むことができる。別の態様において、治療的有効量のCXCR4アゴニストを、このような治療が必要な患者へ投与することができる。このような治療が必要な患者は、例えば以下を含む:癌患者、自己免疫疾患患者、造血幹細胞、ストローマ細胞または間充織細胞への機能的遺伝子導入が必要な患者(例えば幹細胞が分化するような組織または器官の機能不全)、リンパ球枯渇が必要な患者、自家もしくは同種移植片を用いる自己反応性細胞または癌性細胞のパージの形での血液癌の枯渇が必要な患者、または自家末梢血幹細胞移植が必要な患者。本発明の治療が必要な患者は、化学療法または放射線療法のような細胞傷害性治療を受け取ることもできる。いくつかの態様において、CXCR4アゴニストは、造血前駆細胞または幹細胞の生存力を保存しながら、細胞傷害性治療による癌細胞のエキソビボにおける造血幹細胞培養をパージするために、治療において使用することができる。
【0069】
別の態様において、CXCR4アゴニストは、例えば以下のような治療が必要な患者において、造血細胞を治療するために、本発明に従い使用することができる:
i)放射線照射後の造血回復および骨髄再生において;
ii)用量強化化学療法に関連した骨髄抑制を改善するため;
iii)収集および末梢血幹細胞移植のための高品質の動員された前駆細胞を維持ことにおいて;
iv)自家幹細胞移植後の造血能回復を増強するため;
v)癌および感染症の免疫療法において;
vi)固形器官再生において(SilbersteinおよびToy、JAMA、285:577-580(2001));
vii)造血前駆細胞(Hacein-Bey、Hum. Gene Ther.、12:291-301(2001);KajiおよびLeiden、JAMA、285:545-550(2001))、ストローマ細胞または間充織細胞への幹細胞遺伝子療法およびレトロウイルス遺伝子導入において;
viii)骨発生、骨修復、および骨格再建療法において。
【0070】
本発明の様々な態様が本明細書において明らかにされているが、多くの適応および変更を、当業者に共通の一般的知識に従い本発明の範囲内で行うことができる。このような変更は、実質的に同じ方法で同じ結果を達成するための、本発明のいずれかの局面に関する公知の同等物との置換を含む。数値範囲は、その範囲で定義された数字を含む。特許請求の範囲において、「を含む(comprising)」という用語は、オープン-エンド(open ended)用語として使用され、「を含むが、これらに限定されるものではない」という句と実質的に同一である。
【0071】
実施例
下記実施例は、本発明を例証するものであって、制限するものではない。
【0072】
実施例1
本発明のペプチドは、例えば下記のプロトコールを用いて実行することができるような、連続フローペプチド合成装置におけるFmoc/tBu法を用い、化学的に合成することができる。
【0073】
A)試薬(溶媒、支持体、化学物質)
主要溶媒:N,N-ジメチルホルムアミド(DMF):Fisher(D131-4)で分光分析されたACS認証、分子量=73.10。このDMFは、少なくとも2週間、活性化した分子篩4A型(BDH:B54005)により処理され、その後FDNB(2,4-ジニトロフルオロベンゼン、Eastman社)により処理されている。
【0074】
手順:等容量のFDNB溶液(95%EtOH中1mg/ml)およびDMFを混合;30分間静置;FDNBブランク(0.5ml FDNB+0.5ml 95%EtOH)について、吸光度を381nmで測定。吸光度が〜0.2であるならば、DMFは本合成での使用に適している。
【0075】
脱保護剤:0.5%トリトンX100v/v(Sigma社、カタログ番号T9284)を含有するDMFを溶媒とする、20%ピペリジン(Aldrich Chemical社、カタログ番号:10,409-4)。
【0076】
活性化剤:2-(H-ベンゾトリアゾール-リル)1,1,3,3-テトラメチルウロニウムテトラフルオロホウ酸(TBTU:分子量=321.09、Quantum Richilieu社、カタログ番号:R0139)/ヒドロキシベンゾトリアゾール(HOBt、分子量=135.1、Quantum Richilieu社、カタログ番号:R0166-100)を各々、DMFおよび4-メチルモルホリン(NMM、分子量=101.15、d=0.926、Aldrich社、カタログ番号:M5,655-7)中に0.52M:DMF中、またはCysのようなラセミ化に敏感なアミノ酸中の場合は0.9M、本発明者らは2,4,6-コリジン、99%(分子量=121.18、d=0.917、Aldrich社、カタログ番号:14,238-7)を使用:DMF/DCM、1/1v/v中に0.78M。
【0077】
支持体:TentaGel R RAM (90μm)、RinK-型Fmoc(Peptides International社、カタログ番号:RTS-9995-PI):0.21mmol/g、0.1mmolのペプチドについて0.5g。
【0078】
側鎖が以下で保護されたFmoc-L-アミノ誘導体:Boc;tBu;Trt基:4倍過剰(Peptides International社、Bachem社、Novabiochem社、ChemImpex社)。Glu24およびLys24は、アリル保護されている(Millipore/Perseptive Biosystems社)。
【0079】
B)最初のアミノ負荷およびペプチド合成手順
最初のアミノ酸Asn31および残りの残基は、各結合において4倍過剰で450℃で自動的に二重結合した。この合成は、残基Leu19の後で中断される。ペプチド結合した支持体を、合成装置カラムから取り出し、緩徐な攪拌のための小型の磁気攪拌子を有する反応バイアルに入れた。
【0080】
C)アリル基の除去
5%酢酸中に溶解したテトラキス(トリフェニルホスフィン)パラジウム(0) Pd(PPh3)4(Sigma-Aldrich社、カタログ番号:21,666-6);分子量=1155.58 x 0.1mmolペプチド x 3倍=347mgの溶液;CHCl3を溶媒とする2.5%NMMで、0.14M、アルゴン雰囲気下。この溶液を、支持体に結合したペプチドに添加し、その後、緩徐に攪拌を行うために、小型の磁気攪拌子を有する反応バイアル中のカラムから取除く。この混合液を、アルゴンでフラッシュし、密封し、室温で6時間攪拌する。支持体に結合したペプチドを、濾過漏斗に移し、DMF中0.5%ジエチルジチオカーボネートナトリウム溶液30ml;DCM;DCM/DMF(1:1)およびDMFで洗浄する。陽性カイザー(Kaiser)試験は、Lys20のアミノ側鎖の脱保護を示している。
【0081】
D)ラクタム形成:
活性化剤:7-アザベンズトリアゾール-1-イルオキシトリス(ピロリジノ)ホスホニウム-ヘキサフルオロリン酸(PyAOP:分子量=521.7、PerSeptive Biosystems社、カタログ番号:GEN076531)、1.4倍:0.105mmol x 1.4 x 521.7=76.6mgおよびNMM、1.5倍:0.105 x 1.4 x 1.5=0.23mmol、v=0.23/0.9M、NMM溶液=263μl)。
【0082】
環化は、アミノ酸バイアル中で、室温でゆるやかに攪拌しながら一晩(〜16時間)かけて行うことができる。環化の完了は、陰性カイザー(kaiser)試験により示すことができる。支持体に結合したペプチドを、カラムに注ぎ、DMFで洗浄し、合成が完了するまで続け、これにより環状アミド架橋をペプチドに導入することができる。
【0083】
E)最終生成物の支持体からの除去
支持体に結合したペプチドを、合成装置から中型濾過漏斗へと取除き、DCMで洗浄し、不揮発性DMFと交換し、高真空下で少なくとも2時間、または好ましくは一晩かけて完全に乾燥する。
切断混合物(試薬K):
TFA/フェノール/水/チオ-アニソール/EDT(82/5/5/5/2.5);7.5ml
支持体:0.5g樹脂-ペプチド。

【0084】
切断は、振盪器上で緩やかに攪拌しながら、室温で4時間かけて行うことができる。
【0085】
F)ペプチドの沈殿
切断したペプチド溶液を、50mlの丸底フラスコ中に濾過漏斗を通して濾過する。支持体を、TFA 4mlで2回すすぐ。TFA溶液を、回転蒸発装置(rotavap)で濃縮し、活性化した中性酸化アルミニウムで予め処理した冷ジエチルエーテルへ滴下し、これを過酸化物から遊離する。約10倍過剰のエーテルを使用する。ビーズは、収量を決定しペプチドを特徴決定するまで貯蔵する。沈殿を、ねじ込みキャップ付き50mlポリプロピレン製バイアル中に、トップベンチ(top bench)遠心(試行時間4分間)を用い、2000rpmでの遠心により、室温で収集する。ペレットを、3x冷エーテルで洗浄し、遠心し、アルゴン流により乾燥する。沈殿を、0.1% TFAを溶媒とする20%アセトニトリル中に溶解し、凍結乾燥する。
【0086】
G)粗生成物の特徴決定
生成物を、分析的HPLCにより特徴決定する。
実験条件:カラム:Vydac 218TP54:C18逆相5μm、直径4.6mmx長さ150mm。
溶離液:0.1% TFA/H2O(溶媒A);0.1%TFA/アセトニトリル(溶媒B)
溶離条件:20〜50%B(40分間);60〜90%B(5分間);90〜20%B(5分間);20%B(10分間)。1.0ml/分およびA214nm=0.5吸光度単位フルスケール
【0087】
H)試料の調製
生成物のアリコートを秤量し、濃度2mg/mlで20%アセトニトリル0.1%TFA中に溶解する。この溶液を微量遠心し、20μlをカラムに負荷する。主要ピークまたは大きなピークを収集し、SpeedVac乾燥し、質量分析により分子量を決定する。
【0088】
本発明の様々な局面に従い、広範なペプチド配列を調製し、それに関して下記の命名法を使用する。ケモカイン配列に相当するペプチド部分、例えばSDF-1配列は、ケモカインの対応する部分を特定することにより確定することができ、ここで例えばSDF-1配列の表示は、配列番号:1の配列の一部と実質的に同一性を有する配列を意味する。例えば、命名SDF-1(1-14)は、配列番号:1のSDF-1のN末端配列の最初の14個のアミノ酸を意味する。いくつかの態様において、SDF-1配列のN末端およびC末端部分は、様々なアミノ酸により、または式(L)n(式中Lは、例えばアミノ酸である連結基を意味し、かつnは0または整数である)で示される他の連結部分により、連結することができる。このペプチドのカルボキシル末端は、カルボン酸よりはむしろアミドに修飾することができる。いくつかの態様において、本発明のポリペプチドは、下記式であることができる:
SDF-1(1-X)-(L)n-SDF-1(Y-Z)
式中、
Xは、5〜20の整数であり;
Lは、少なくとも1個の炭素原子を有する連結部分、例えば置換もしくは非置換のアルキル部分またはアミノ酸であり;
nは、1〜50の整数であり;
Yは、50〜60の整数であり;
Zは、60〜67の整数である。
【0089】
いくつかの態様において、例えば(CH2)nは、N末端およびC末端の間のリンカー(L)として使用することができ、式中、nは整数であり、例えば20、30、40、50または100未満であってもよい。
【0090】
直鎖状ポリペプチド配列の例示的態様を以下に示す:

【0091】
別の態様において、本発明のペプチドは環化され、例えばグルタミン酸(E)およびリシン(K)残基は、連結した残基を二重下線で示した下記の配列において示されたような、ラクタム形成法を用いる側鎖環化により結合することができる。ラクタムは、例えばこのポリペプチドにおいて、アミノ酸残基24位のグルタミン酸(E)および20位または28位のいずれかのリシン(K)の間に形成される(これは、天然の配列中の残基の番号に必ずしも対応していない)。更に別のものにおいて、リシン(K)は、ロイシン(L)、オルニチン(O)または他の疎水性残基、例えばイソロイシン(I)、ノルロイシン(Nle)、メチオニン(M)、バリン(V)、アラニン(A)、トリプトファン(W)、またはフェニルアラニン(F)により置換することができる。同様に、グルタミン酸(E)は、例えばアスパラギン酸(D)で置換することができ、これはペプチドの24位においてアスパラギン酸にグルタミン酸が置換されていることを示している記述(E24->D)により示される。
【0092】

【0093】
本発明のペプチドの別の態様において、下線のスペーサーモノマー(例えば例示されたグリシンG)を、様々な数、例えば2、3または4個のグリシンなどで使用することができる。
【0094】
別の態様において、本発明のペプチドの内部環化は、別の位置、または置換されたアミノ酸の間であってもよい。同じく環状連結の性質は変動することができる。例えば、連結は、関連のあるグルタミン酸(E)をアスパラギン酸(D)残基で置換することにより、および/またはリシン(K)をオルニチン(O)残基で置換することにより短縮することができる。環化は、例示したポリペプチドの一部に説明したように、例えば、アスパラギン酸24(D24)およびリシン20または28(K20またはK28)の間で可能である。
【0095】

【0096】
ジスルフィドまたはスルフィド架橋は、本発明のポリペプチドの別の態様を生成するために使用することができ、ここでシステイン残基は、例えば下記配列において二重下線を付けた残基で示されるような、架橋形成に関連することができる。
【0097】

【0098】
ある局面において、本発明のポリペプチド化合物は、下記を有するペプチドを含むCXCR4アゴニストを提供することができる:(a)ケモカインと相同なN末端配列、例えばSDF-1 N末端配列;(b)ケモカインと相同なC末端配列、例えばSDF-1 C末端配列;(c)N末端配列をC末端配列に結合する連結部分、例えばポリペプチドリンカー;および、(d)ポリペプチド部分の間に形成された内部環状架橋、例えば第一のアミノ酸残基のカルボン酸側鎖と第二のアミノ酸残基のアミン側鎖を連結するアミド。いくつかの態様において、C末端配列は、内部環状架橋を含むことができる。
【0099】
前述のように、3個または4個のグリシンリンカーによりC末端SDF-1残基(55-67)に連結されたN末端SDF-1残基(1-14)または(1-17)を有する本発明のポリペプチドの例示的態様が合成されている。いくつかの態様において、ペプチドは、グルタミン酸(24位)およびリシン(20または28位)の間で環化されている。ラクタム化は、パラジウム法を用い、リシンおよびグルタミン酸の両方の側鎖からアリル型基を取除き、次に対応するリシンおよびグルタミン酸の間に内部アミド結合形成を実行することによって作用され得る。このポリペプチドファミリーの選択されたメンバーは、CXCR4受容体結合アッセイ法(CEM細胞)および[Ca2+]動員の活性化(THP-1細胞)において高い親和性を示した。ポリペプチドの更なる態様を以下に列記する:

オルニチン(O)とグルタミン酸(E)の間にも環化が生じ得る。

オルニチン(O)とアスパラギン酸(D)の間にも環化が生じ得る。

【0100】
いくつかの態様において、6位のプロリン(P)は、セリン(S)と交換され得る。いくつかの態様において、リシン(K)およびグルタミン酸(E)は、各々、オルニチン(O)およびアスパラギン酸(D)で置換することができる。同様に、置換は、LSYR領域において生じ、ロイシン(L)、セリン(S)、チロシン(Y)またはアルギニン(R)を、プロリン(P)または他の類似した形状の部分で置換することができる。あるいは、プロリンは、P*と置換することができる:
ここでP*は下記式である:
【化1】

(X=Ar、Ar-OH、アルキル、およびそれ以外)
【0101】
多種多様なアミノ酸置換、例えばKからE、KからD、OからE、OからDなどを、ポリペプチド配列において行うことができる。天然のアミノ酸以外の部分、例えば下記のBtdなども、置換することができる:
ここでBtd*は下記式である:
【化2】

または
【化3】

または
【化4】

(X=アルキル、Ar、Ar-OH、およびそれ以外)
【0102】
同様に、ポリペプチドは、SDF-1以外のケモカイン由来の配列を用いて調製することができる。例えばMIP-1αの残基36〜50、10〜50、または55〜70など:

【0103】
様々な図面において、化合物は下記の略号により確定される:
CTCE99O1の構造:
SDF-1(1-9)2-C9/C9-システイン二量体

CTCE99O2の構造:
SDF-1(1-17)

CTCE99O4の構造:
SDF-1(1-8)2-リシン架橋二量体

CTCEOO13の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)酸

CTCE0017の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)アミド

CTCE0022の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミド

CTCE0021の構造:
SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド

【0104】
実施例2
表1および表2は、CXCR4アゴニストの骨髄前駆細胞への作用、特に未成熟赤芽球細胞および未成熟顆粒球への作用を成熟顆粒球と比較して示している。表1および表2のデータを得るために、各化合物または生理食塩水単独(対照としての「薬物なし」)と共に予備インキュベーションした。その後、細胞を、細胞傷害性物質である高用量3H-チミジンに曝露した。活発に分裂している細胞は、細胞傷害性放射性チミジンを均等に増すように蓄積し、結果的に優先的に殺傷された。対照と比較したチミジン処理により殺傷された細胞の相対割合は、それらの化合物の細胞増殖を低減する、すなわち細胞周期の進行速度を低下させる相対効果の指標である。対照と比較して殺傷された細胞のより高い(または変化のない)割合は、化合物が所定の細胞型において細胞増殖を減少しないことを示している。
【0105】
(表1) CXCR4アゴニストの3H-チミジンに曝露した骨髄前駆細胞への作用

【0106】
表1において、SDF-1ポリペプチド

は、ヒト骨髄細胞培養物において100ng/mlで使用される。
SDF-1(1-9)2

は、ヒト骨髄細胞培養物において50μg/mlで使用される。
【0107】
表2は、本実施例において先に説明したアッセイ法によっては、SDF-1(1-14)-(G)4-SDF-1(55-67)-アミドおよびSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドは共に、ヒト陽性赤芽球細胞および未成熟顆粒球形成細胞では細胞周期を阻害することができるが、成熟顆粒球形成細胞では阻害できないことを明らかにしている。
【0108】
(表2)

表中、
化合物Aは、SDF-1(1-14)-(G)4-SDF-1(55-67)-アミドであり、
化合物Bは、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドである。
【0109】
実施例3
本発明は、動物モデルにおけるCXCR4アゴニストの治療的作用を明らかにしており、これは、CXCR4アゴニストによる細胞傷害性治療からの造血細胞の保護を示している。これらの動物実験において、正常マウスを、DNA合成の高い割合(迅速な細胞周期を反映)で細胞に有害に作用することがことが公知である、細胞傷害性化学療法剤アラビノース-シトシン(Ara-C)で処置した。
【0110】
図1に示したように、0日目にアラビノース-シトシン(Ara-C)が単回用量350mg/kgで静脈内投与されたマウスは、白血球数(WBC)が減少した(Ara-Cの細胞傷害性作用に起因)。対照的に、Ara-Cと併用してペプチドSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(図の凡例ではCTCと表記)を投与したマウスは、白血球数の減少の程度が、有意に緩和された。この図において、丸のデータ点は、Ara-Cを受け取ったが該ペプチドは受け取っていない動物における白血球数に相当し、三角データ点は、Ara-CおよびSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドを受け取った動物における値に相当する。このデータは明確に、Ara-Cの細胞傷害性作用に対する本発明のペプチドの保護作用を明らかにしている。
【0111】
実施例4
CXCR4アゴニストとしてのSDF-1およびSDF-1ペプチド類似体の効能を、CXCR4受容体結合アッセイ法により明らかにした。天然のSDF-1およびCXCR4アゴニストによる125I-SDF-1に対するSDF-1受容体への結合の競合的用量反応を、図2Aおよび図2Bにそれぞれ示した。125I-SDF-1の濃度-依存型阻害を、図2Aに示し、これはSDF-1のこの受容体への親和性を示唆している。スキャッチャードプロットを図示し、KDを26nMで決定した。SDF-1および示された類似体(競合リガンド)は、記された濃度で4nM 125I-SDF-1の存在下で添加した。CEM細胞を、2時間インキュベーションした後の125I-SDF-1結合について評価した。これらの結果は、競合リガンドなしに決定された最大特異結合の割合(%)として表し、個別の3回の実験の平均である。SDF-1およびSDF-1類似体による125I-SDF-1の阻害は、CXCR4受容体結合の指標である。この図に示された化合物は以下である:SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCE0021)、SDF-1(1-14)-(G)4-SDF1(55-67)-E24/K28-環状アミド(CTCE0022)、SDF-1(1-9)2-C9/C9-システイン二量体(CTCE99O1)、SDF-1(1-17)(CTCE9902)、SDF-1(1-8)2-リシン架橋二量体(CTCE99O4)およびSDF-1(1-14)-(G)4-SDF-1(55-67)アミド(CTCE0017)。
【0112】
実施例5
本実施例は、細胞内カルシウム動員([Ca2+]i)を介するSDF-1およびSDF-1ペプチド類似体の効能を説明している。SDF-1およびSDF-1ペプチド類似体の結合が、CXCR4受容体のアゴニスト性の誘導を生じることを説明するために、[Ca2+]i動員アッセイ法を行い、その結果を図3に示した。図3に示したデータを得るために、fura-2、AM負荷したTHP-1細胞(1x106細胞/ml)を、指示された濃度のSDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)K20/E24-環状アミドまたはSDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミドで刺激した(値は、3回の実験(n=3)の平均±1S.D.で示した)。図3のデータに示したように、THP-1細胞のSDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)K20/E24-環状アミドまたはSDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミドとのインキュベーションは、受容体を介した[Ca2+]i動員の誘導を生じた。SDF-1(1-14)-(G)4-SDF-1(55-67)酸、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミドまたはSDF-1(1-14)(G)4-SDF-1(55-67)-E24/K28-環状アミドおよび天然のSDF-1についてのEC50値(完全[Ca2+]i動員能の50%を効果的に誘導するのに必要なリガンド濃度)を表3に示す。
【0113】
(表3)

【0114】
天然のSDF-1が最大[Ca2+]i動員を生じるリガンド濃度(1μM、図3参照)での、SDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24環状アミド(CTCE0021)、SDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミド(CTCE0022)、SDF-1(1-9)2-C9/C9-システイン二量体(CTCE99O1)、SDF-1(1-17)(CTCE99O2)、SDF-1(1-8)2-リシン架橋二量体(CTCE9904)およびSDF-1(1-14)-(G)4-SDF-1(55-67)アミド(CTCEOO17)の[Ca2+]i動員を誘導する能力の比較を、図4に示す。Fura-2、AM負荷したTHP-1細胞(1x106細胞/ml)を、天然のSDF-1およびSDF-1ペプチドアゴニスト類似体により、天然のSDF-1が最大[Ca2+]i刺激を生じる濃度(1μM)で刺激した(値は、3回の実験(n=3)の平均±1S.D.で示した)。
【0115】
実施例6
培養物中の接着層内の未成熟高増殖能コロニー形成細胞(HHP-CFC)は、通常静止期にある。この長期培養物(LTC)は、LTC開始後7〜10日で確立される。これらの細胞は、新鮮な培地に添加することにより、増殖を刺激することができる。LTCのBFU-E(赤芽球バースト形成単位前駆体)細胞およびCFU-GM(顆粒球-単球コロニー形成単位-共通前駆体)細胞の両方を、接着層内の間充織的に(mesenchymally)由来したストローマ細胞により静止期に維持することができるが、新鮮な培地の添加により周期へと可逆的に刺激することもできる。SDF-1およびSDF-1ポリペプチドのようなCXCR4アゴニストがこの活性化に打ち勝つ能力は、培地交換時のLTCへのそれの添加により決定することができる。活発に分裂している細胞は、放射性チミジンのような細胞毒を均等に増えるように蓄積し、その結果、優先的に殺傷される。
【0116】
表4に示した結果は、インビトロLTC-IC(長期培養-開始細胞)アッセイ法における、SDF-1、およびSDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCEOO21)およびSDF-1(1-14)-(G)4-SDF-1(55-67)酸(CTCEOO13)の、赤芽球および顆粒球形成前駆体(これは、赤血球、血小板、単球/マクロファージおよび好中球へと分化する)の増殖を抑制する能力を例示している。
【0117】
(表4) ヒトLTCの接着層内の未成熟前駆体の周期に対するSDF-1およびSDF-1アゴニストの作用

【0118】
表4に示した結果を得るために、クローン原性赤芽球(BFU-E)および顆粒球形成(CFU-GM)前駆体を、メチルセルロース培養においてアッセイした。接着細胞を、新鮮な培地単独(対照として)または指示したCXCR4アゴニスト(10μg/ml SDF-1、CTCE0021またはCTCEOO13)で処理した。3日後に皿を収集し、3H-チミジン自殺アッセイ法を、接着層中の前駆細胞について行い、細胞傷害性3H-チミジンを蓄積した結果殺傷された細胞の割合を決定した。対照の細胞と残りの細胞の数の間の差異は、殺傷された細胞を示している。
【0119】
図5は、培地の変更と組合わせたフィーダー培養物SDF-1は、分裂細胞に優先的に毒性であるような物質を細胞に投与した場合に、造血細胞の有意な細胞致死率の低下を生じることを説明しており、ここで丸はBFU-E細胞(赤芽球バースト形成単位前駆体)を表し、四角はCFU-GM細胞(顆粒球-単球コロニー形成単位共通前駆体)を表している。図6は、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/D24-環状アミド(化合物番号1)およびSDF-1(1-9)2(化合物番号3)により、同様の濃度依存性作用が得られることを示している。図5および6を合わせると、SDF-1ポリペプチドおよびSDF-1ペプチド類似体は、LTCの接着層においてBFU-EおよびCFU-GM前駆体幹細胞の周期活性化を抑制することを示している。
【0120】
実施例7
図7および図9は、SDF-1およびSDF-1類似体のようなCXCR4アゴニストの、インビボ生着モデルにおけるヒト前駆細胞の増殖の抑制における効能を示している。
【0121】
図7において、骨髄移植したNOD/SCIDマウスから単離したCD34+細胞の懸濁液中の成熟および未成熟コロニー形成細胞(CFU-GM;顆粒球-単球コロニー形成単位-前駆体、BFU-E;赤血球バースト形成単位-前駆体;LTC-IC、長期培養開始細胞)の周期の状態を、高特異活性3H-チミジン20μg/mlへの細胞の短期間(20分間)または一晩(16時間)の曝露により不活性化(殺傷)されたこれらの前駆体の割合の評価により決定した(値は、各点毎に最大4匹のマウスでの最大4回の実験のデータの平均±S.D.で示した)。図4に示した結果の有意性は、類似体SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCEOO21)およびSDF-1(1-14)-(G)4-SDF-1(55-67)酸(CTCEO13)が、高特異活性3H-チミジンへの曝露により殺傷された細胞の減少により測定される、「未成熟」ヒト前駆細胞の増殖の阻害について天然のSDF-1と同程度有効であることの知見である。
【0122】
実施例8
SDF-1は、ヒト胎児肝細胞を移植したNOD/SCIDマウスにおいて再生されたコロニー再生単位(CRU)の検出能を増強する(図8)。1群につき3〜4匹のNOD/SCIDマウスを、致死量以下で放射線照射し、ヒト細胞、この場合107個の低濃度の胎児肝細胞を注射し、その後マウスを2.5〜3週間の間維持した。次に示されたように、各群に、SDF-1 10μg、または等容積の対照培地のいずれかを毎日2回注射し、その後全てのマウスを、2回目の注射の翌日に屠殺した。次に各群からの骨髄細胞をプールし、存在するヒトCFCおよびLTC-IC(長期培養開始培養物)の周期活性を測定するためのFACS分析および一晩の3H-チミジン自殺アッセイ法のために、アリコートを採取した。細胞の残りは、3〜6匹の二次レシピエントに注射した。これらの動物はその後6〜8週間後に屠殺し、それらの骨髄を取り出し、ヒト細胞の存在について分析した。
【0123】
この実施例は、二次生着を説明している。二次レシピエントの骨髄を評価した場合に、一次マウスの様々な群由来の細胞のレシピエントに存在するヒト細胞のレベルにおいてかなりの差異が認められた。図8に示したように、SDF-1-注射したマウスにとって、培地を注射した対照一次マウス由来の細胞のレシピエントとの比較により、はるかに多い数の評価した全ての種類のヒト細胞が、いずれかのSDF-1で処理した一次マウスから骨髄を受け取った二次レシピエントの骨髄中に認められた。
【0124】
実施例9
本実施例は、ヒト胎児肝移植したNOD/SCIDマウスにおける、SDF-1およびSDF-1ポリペプチド類似体のようなCXCR4アゴニストの、ヒト細胞の生着に対する作用を説明している(図9)。この図に示されるように、NOD/SCIDマウスにおける存在する様々なヒト細胞の頻度に対するCXCR4アゴニストの短期作用はない。これらの実験において、被験化合物(SDF-1、SDF1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCEOO21)またはSDF-1(1-14)-(G)4-SDF-1(55-67)酸(CTCE013))を、移植後6〜8週間のマウスに、1日あけて2回注射し、1日後に屠殺した。マウスの長骨(頸骨および大腿骨)において検出された表現型で定義されたヒト造血細胞の頻度を決定した。SDF-1 0.5mg/kgの投与は、CD45/71、CD19/20、またはCD34細胞の数に加え、CFCまたはLTC-ICに対しても、有意な作用を有さなかった。加えて、このCXCR4アゴニスト投与のスケジュールで、検出できるように影響されたヒト細胞型はない。このデータを、図7および図8と組合せて、SDF-1、SDF-1類似体および他のCXCR4アゴニストは、ヒト前駆細胞の二次生着を効果的に増強し得ることを示している。
【0125】
実施例10
この実施例は、SDF-1ポリペプチド類似体CTCE0021(10mg/kg、図12においては化合物番号1として示す)のAra-C(300mg/kg)による脊髄解離性化学療法後の白血球回復に対する作用を説明している。この実施例において説明した実験では、C3Hhenマウス(雌)を、Ara-C 500mg/kgで0日目および10日目に2サイクル処理した。Ara-C投与の2回目のサイクルにおいて、Ara-C処理したマウスは、毎日CTCE0021 10mg/kgを注射した。対照は、Ara-C単独で処置した動物で行った。実験開始時、ならびに2回目のAra-C投与1日前および投与後毎日に、尾静脈から血液をヘパリン含有チューブに採取した。総白血球数を決定した。図10に示したように、CXCR4アゴニストCTCE0021は、Ara-Cの細胞傷害性作用を阻害し、白血球をより高いレベルに維持するように作用し、これはインビボにおける化学療法様式の骨髄抑制作用の逆転を説明している。
【0126】
実施例11
本実施例は、Ara-C (500mg/kg)による脊髄解離性化学療法後の白血球の回復に対するSDF-1ポリペプチド類似体SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCE0021, 1mg/kg)の作用と、G-CSF(ノイポゲン(登録商標))の比較を示す(図11)。C3Hhenマウス(雌)を、Ara-C 500mg/kgで0日目および10日目に2サイクル処置した。Ara-C投与の2回目のサイクルの間に、CTCE0021 10mg/kg、ノイポゲン(登録商標) 10mg/kgを、単独または併用し注射し(-1日目、0日目、および1〜3日目)、対照は薬物を受け取らなかった。実験開始時、ならびに2回目のAra-C投与の1日前ならびに1、7および12日目に、尾静脈から血液をヘパリン含有チューブに採取した。総白血球数を得た。本実施例の結果は、CTCE0021の投与処置のみが、Ara-Cによる脊髄解離性化学療法後の白血球を回復を増大するのではなく、SDF-1ポリペプチド類似体およびG-CSF(ノイポゲン(登録商標))の併用処置も、G-CSF単独で処置した動物と比べ、早期治療相において、より大きい回復を生じたことを示している。更に、SDF-1ポリペプチド類似体による処置後の回復は、G-CSF処置した動物と比べ維持されていた。
【0127】
図12は、同じ条件下で行った実験の結果を示しているが、Ara-C単独で処置した動物において計測された細胞数に対する増殖(白血球数の増加)を説明している。Ara-C投与後12日目まで、CTCE0021で処置したマウスにおいて、Ara-C単独で処置した動物に対し白血球のおよそ7.5倍の増加が認められ、ノイポゲン(登録商標)により処置した動物においては180%が得られた。
【図面の簡単な説明】
【0128】
【図1】本発明のペプチド(CTCE0021と称され、実施例1および3に記載)の存在(三角のデータ点、実線、凡例表記Ara-C+CTCE0021)および非存在(丸のデータ点、破線、凡例表記Ara-C)下における、マウスの白血球数(WBC)に対するAra-C(350mg/kg)の作用を示す。
【図2A】SDF-1による、CXCR4への125I-SDF-1結合の濃度依存性阻害を示し、これは図2Aで示されたデータについて説明されたような、CXCR4受容体のSDF-1の親和性を示す。
【図2B】SDF-1およびSDF-1ペプチドアゴニスト類似体のCXCR4受容体結合を示している。SDF-1および指示された類似体(競合リガンド、実施例に記載)は、4nM 125I-SDF-1の存在下で、指定された濃度で添加した。CEM細胞は、2時間インキュベーションした後に125I-SDF-1結合について評価した。結果は、競合リガンドの非存在下で決定された最大特異結合の割合で表され、3回の個別の実験の平均である。
【図3】SDF-1およびSDF-1受容体類似体による[Ca2+]i動員の誘導を示している(実施例に記載)。Fura-2、AM負荷したTHP-1細胞(1x106/ml)を、SDF-1、CTCE0021またはCTCE0022により指定された濃度で刺激した。値は、3回の実験(n=3)の平均±1S.D.で表す。
【図4】SDF-1およびSDF-1類似体による[Ca2+]i動員の誘導を示している Fura-2、AM負荷したTHP-1細胞(1x106/ml)を、天然のSDF-1およびSDF-1ペプチド類似体により、最大[Ca2+]i刺激を生じる天然のSDF-1の濃度(1μM)で刺激した。値は、3回の実験(n=3)の平均±1S.D.で表す。指定した化合物は以下のものである:SDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/E24-環状アミド(CTCE0021)、SDF-1(1-14)-(G)4-SDF-1(55-67)-E24/K28-環状アミド(CTCE0022)、SDF-1(1-9)2-C9/C9-システイン二量体(CTCE99O1)、SDF-1(1-17)(CTCE9902)、SDF-1(1-8)2-リシン架橋二量体(CTCE99O4)およびSDF-1(1-14)-(G)4-SDF-1(55-67)アミド(CTCE0017)。
【図5】標準の長期培養(LTC)における接着層中の未成熟正常コロニー形成細胞(CFC)の周期性の増殖性活性を示し、ここで丸はBFU-E細胞(赤芽球バースト形成単位前駆体)を表し、および四角はCFU-GM細胞(顆粒球-単球コロニー形成単位共通前駆体)を表し、これは増殖している細胞に対し優先的に細胞毒に対する細胞の感受性の測定による、SDF-1の細胞増殖に対する阻害作用を図示している。
【図6】SDF-1、SDF-1(1-14)-(G)4-SDF-1(55-67)-K20/D24-環状アミド(化合物番号1)、SDF-1(1-9)2(化合物番号3)で処理した場合の、分裂している細胞に対し優先的に細胞毒に対する細胞の感受性として測定する、標準LTCにおける接着層中の未成熟正常CFCの周期性の増殖性活性を示す。
【図7】胎仔肝移植したNOD/SCIDマウス由来のヒト前駆体の周期に対するSDF-1およびSDF-1類似体(実施例において定義)の作用を示す。移植したNOD/SCIDマウスの骨髄から単離したCD34+細胞の懸濁液中の成熟および未成熟コロニー形成細胞(CFU-GM;顆粒球-単球コロニー形成単位共通前駆体、BFU-E細胞;赤芽球バースト形成単位前駆体)の周期の状態は、高特異活性3H-チミジン20μg/mlへの細胞の短期間(20分間)または一晩(LTC-IC;長期培養開始細胞)曝露により失活(殺傷)したこれらの前駆体の割合の評価により決定した。値は、各点につき最大4匹のマウスの実験の平均±S.D.で表す。
【図8】SDF-1が、ヒト胎児肝を移植されたNOD/SCIDマウスにおいて再生されたCRU(コロニー再生単位)の検出能を増強することを示唆するデータを示す。
【図9】SDF-1およびSDF-1アゴニスト(実施例において定義した)のヒト胎児肝移植したNOD/SCIDマウスにおけるヒト細胞の生着に対する作用を示す。107個の低密度ヒト胎児肝血液細胞を移植して4週間後およびその後のSDF-1、CTCE0021またはCTCE0013(0.5mg/kg)の1週間に3回で2週間投与後屠殺したマウスの長骨(頸骨および大腿骨)において検出された表現型で定義した造血細胞数の比較。値は、3回の実験における3〜7匹の個別のマウスから得た結果の平均±1S.D.で表す。
【図10】Ara-C(300mg/kg)で処置した脊髄解離性化学療法後の白血球回収に対するCTCE0021(1mg/kg、実施例において定義した)の作用を示す。マウスは、Ara-C単独で(Ara-C)またはCTCE0021と併用して処置した。結果は、6匹動物/群の平均±1S.D.で表す。
【図11】Ara-C処理したマウスにおける白血球増殖に対するCTCE0021(実施例において定義した)およびノイポゲン(Neupogen)(登録商標)(G-CSF)の作用を示す。C3Hhenマウス(雌)を、500mg/kg Ara-Cで0日目および10日目に2サイクル処理した。Ara-C投与の第二サイクルの間に、Ara-C処置したマウスに、CTCE0021 10mg/kg、ノイポゲン(登録商標)10mg/kgを単独または併用して投与した(-1、0日目および1〜3日目)。対照は、Ara-C単独で処置した動物を示す。実験開始時、ならびに二回目のAra-C投与の1日前および1日目、7日目、および12日目に、血液を尾静脈からヘパリン含有チューブへと採取した。総白血球数を得た。結果は、6匹動物/群の平均±1S.D.で表す。
【図12】Ara-C処理マウスにおける白血球の相対増殖に対する、CTCE0021およびノイポゲン(登録商標)の作用を示している。C3Hhenマウス(雌)を、500mg/kg Ara-Cで0日目および10日目に2サイクル処理した。Ara-C投与の第二サイクルの間に、Ara-C処置したマウスに、CTCE0021 10mg/kg(実施例において定義した)、ノイポゲン(登録商標)10mg/kgを単独または併用して投与した(-1日目、0日目、および1〜3日目)。対照は、Ara-C単独で処置した動物を示す。実験開始時、ならびに二回目のAra-C投与の1日前および7および12日目に、血液を尾静脈からヘパリン含有チューブへと採取した。総白血球数を得た。白血球(WBC)の増加は、第二サイクルのAra-C用量が投与される前日に測定した細胞数に対して決定した。結果は、6匹動物/群の平均±1S.D.で表す。
【図13】ヒトSDF-1α、SDF-1前駆体(PBSF)、およびSDF-1βの配列を示す。
【特許請求の範囲】
【請求項1】
有効量のCXCR4アゴニストを造血細胞へ投与する段階を含む、造血細胞増殖の速度を低下させる方法。
【請求項2】
造血細胞が、造血幹細胞および造血前駆細胞からなる群より選択される、請求項1記載の方法。
【請求項3】
細胞が患者のインビボにあり、治療的有効量のCXCR4アゴニストが、そのような治療を必要とする患者に投与される、請求項1記載の方法。
【請求項4】
患者が癌を有する、請求項3記載の方法。
【請求項5】
患者が、自家または同種骨髄または末梢血幹細胞移植を必要とする、請求項3記載の方法。
【請求項6】
患者を細胞傷害性物質により治療する段階をさらに含み、有効量のCXCR4アゴニストが、細胞傷害性物質に対する細胞の感受性を低下させるのに十分である、請求項3記載の方法。
【請求項7】
CXCR4アゴニストがペプチドを含む、請求項1記載の方法。
【請求項8】
ペプチドが、下記の配列を有するペプチドからなる群より選択される、請求項7記載の方法:

【請求項9】
CXCR4アゴニストが、以下の(a)〜(c)を含むペプチドである、請求項1記載の方法:
a)SDF-1 N末端配列と相同なN末端配列;
b)SDF-1 C末端配列またはMIP-1α配列と相同なC末端配列;
c)N末端配列をC末端配列に連結するペプチドスペーサー配列であって、該N末端配列をC末端へ連結するペプチドスペーサー配列が、天然のアミノ酸、非天然のアミノ酸、または天然のアミノ酸および非天然のアミノ酸の両方を含む配列。
【請求項10】
CXCR4アゴニストが、
a)第一のアミノ酸残基上のカルボン酸側鎖と第二のアミノ酸残基上のアミン側鎖の間に形成された内部環状アミド架橋
を含む、請求項9記載の方法。
【請求項11】
CXCR4アゴニストが:
a)2個のアミノ酸の間の内部環状ジスルフィド結合またはラクタム結合
を含む、請求項9記載の方法。
【請求項12】
内部環状アミド架橋がC末端配列であるCXCR4アゴニストである、請求項10記載の方法。
【請求項13】
ペプチドが、下記の配列を有するポリペプチドからなる群より選択される、請求項7記載の方法:

【請求項14】
ペプチドが、SDF-1α、SDF-1β、またはSDF-1前駆体をコードしている核酸の一部に、ストリンジェントな条件下でハイブリダイズする核酸によりコードされる、請求項7記載の方法。
【請求項15】
CXCR4アゴニストがSDF-1である、請求項1記載の方法。
【請求項16】
CXCR4アゴニストが、核酸によりコードされたペプチドであって、該核酸を造血細胞の形質転換に使用することによって、該細胞が該ペプチドを発現可能となる、請求項1記載の方法。
【請求項17】
造血細胞を細胞傷害性物質へ曝露する前または曝露中に、有効量のCXCR4アゴニストを造血細胞へ投与する段階を含む、細胞傷害性物質に対する造血細胞の感受性を低下させる方法。
【請求項18】
造血細胞が、造血幹細胞および造血前駆細胞からなる群より選択される、請求項17記載の方法。
【請求項19】
細胞が患者のインビボにあり、治療的有効量のCXCR4アゴニストが、そのような治療を必要とする患者に投与される、請求項17記載の方法。
【請求項20】
患者が癌を有する、請求項19記載の方法。
【請求項21】
患者が、自家または同種骨髄または末梢血幹細胞移植を必要とする、請求項19記載の方法。
【請求項22】
患者が自己免疫疾患である、請求項19記載の方法。
【請求項23】
造血細胞増殖速度を低下させるための、CXCR4アゴニストの使用。
【請求項24】
造血細胞増殖速度を低下させる医薬品を製剤化するための、CXCR4アゴニストの使用。
【請求項25】
細胞傷害性物質に対する造血細胞の感受性を低下させるための、CXCR4アゴニストの使用。
【請求項26】
細胞傷害性物質に対する造血細胞の感受性を低下させる医薬品を製剤化するための、CXCR4アゴニストの使用。
【請求項27】
造血細胞移植療法において使用する医薬品を製剤化するための、CXCR4アゴニストの使用。
【請求項28】
以下の(a)〜(c)を含む、CXCR4アゴニストペプチド:
a)SDF-1 N末端配列と相同なN末端配列;
b)SDF-1 C末端配列またはMIP-1α配列と相同なC末端配列;
c)N末端配列をC末端配列に連結するペプチドスペーサー配列であって、該N末端配列をC末端へ連結するペプチドスペーサー配列が、天然のアミノ酸、非天然のアミノ酸、または天然のアミノ酸および非天然のアミノ酸の両方を含む配列。
【請求項29】
a)第一のアミノ酸残基上のカルボン酸側鎖と第二のアミノ酸残基上のアミン側鎖の間に形成された内部環状アミド架橋をさらに含む、請求項28記載のCXCR4アゴニスト。
【請求項30】
a)2個のアミノ酸の間の内部環状ジスルフィド結合またはラクタム結合をさらに含む、請求項28記載のCXCR4アゴニスト。
【請求項31】
内部環状アミド架橋がC末端配列内にある、請求項29記載のCXCR4アゴニスト。
【請求項1】
有効量のCXCR4アゴニストを造血細胞へ投与する段階を含む、造血細胞増殖の速度を低下させる方法。
【請求項2】
造血細胞が、造血幹細胞および造血前駆細胞からなる群より選択される、請求項1記載の方法。
【請求項3】
細胞が患者のインビボにあり、治療的有効量のCXCR4アゴニストが、そのような治療を必要とする患者に投与される、請求項1記載の方法。
【請求項4】
患者が癌を有する、請求項3記載の方法。
【請求項5】
患者が、自家または同種骨髄または末梢血幹細胞移植を必要とする、請求項3記載の方法。
【請求項6】
患者を細胞傷害性物質により治療する段階をさらに含み、有効量のCXCR4アゴニストが、細胞傷害性物質に対する細胞の感受性を低下させるのに十分である、請求項3記載の方法。
【請求項7】
CXCR4アゴニストがペプチドを含む、請求項1記載の方法。
【請求項8】
ペプチドが、下記の配列を有するペプチドからなる群より選択される、請求項7記載の方法:

【請求項9】
CXCR4アゴニストが、以下の(a)〜(c)を含むペプチドである、請求項1記載の方法:
a)SDF-1 N末端配列と相同なN末端配列;
b)SDF-1 C末端配列またはMIP-1α配列と相同なC末端配列;
c)N末端配列をC末端配列に連結するペプチドスペーサー配列であって、該N末端配列をC末端へ連結するペプチドスペーサー配列が、天然のアミノ酸、非天然のアミノ酸、または天然のアミノ酸および非天然のアミノ酸の両方を含む配列。
【請求項10】
CXCR4アゴニストが、
a)第一のアミノ酸残基上のカルボン酸側鎖と第二のアミノ酸残基上のアミン側鎖の間に形成された内部環状アミド架橋
を含む、請求項9記載の方法。
【請求項11】
CXCR4アゴニストが:
a)2個のアミノ酸の間の内部環状ジスルフィド結合またはラクタム結合
を含む、請求項9記載の方法。
【請求項12】
内部環状アミド架橋がC末端配列であるCXCR4アゴニストである、請求項10記載の方法。
【請求項13】
ペプチドが、下記の配列を有するポリペプチドからなる群より選択される、請求項7記載の方法:

【請求項14】
ペプチドが、SDF-1α、SDF-1β、またはSDF-1前駆体をコードしている核酸の一部に、ストリンジェントな条件下でハイブリダイズする核酸によりコードされる、請求項7記載の方法。
【請求項15】
CXCR4アゴニストがSDF-1である、請求項1記載の方法。
【請求項16】
CXCR4アゴニストが、核酸によりコードされたペプチドであって、該核酸を造血細胞の形質転換に使用することによって、該細胞が該ペプチドを発現可能となる、請求項1記載の方法。
【請求項17】
造血細胞を細胞傷害性物質へ曝露する前または曝露中に、有効量のCXCR4アゴニストを造血細胞へ投与する段階を含む、細胞傷害性物質に対する造血細胞の感受性を低下させる方法。
【請求項18】
造血細胞が、造血幹細胞および造血前駆細胞からなる群より選択される、請求項17記載の方法。
【請求項19】
細胞が患者のインビボにあり、治療的有効量のCXCR4アゴニストが、そのような治療を必要とする患者に投与される、請求項17記載の方法。
【請求項20】
患者が癌を有する、請求項19記載の方法。
【請求項21】
患者が、自家または同種骨髄または末梢血幹細胞移植を必要とする、請求項19記載の方法。
【請求項22】
患者が自己免疫疾患である、請求項19記載の方法。
【請求項23】
造血細胞増殖速度を低下させるための、CXCR4アゴニストの使用。
【請求項24】
造血細胞増殖速度を低下させる医薬品を製剤化するための、CXCR4アゴニストの使用。
【請求項25】
細胞傷害性物質に対する造血細胞の感受性を低下させるための、CXCR4アゴニストの使用。
【請求項26】
細胞傷害性物質に対する造血細胞の感受性を低下させる医薬品を製剤化するための、CXCR4アゴニストの使用。
【請求項27】
造血細胞移植療法において使用する医薬品を製剤化するための、CXCR4アゴニストの使用。
【請求項28】
以下の(a)〜(c)を含む、CXCR4アゴニストペプチド:
a)SDF-1 N末端配列と相同なN末端配列;
b)SDF-1 C末端配列またはMIP-1α配列と相同なC末端配列;
c)N末端配列をC末端配列に連結するペプチドスペーサー配列であって、該N末端配列をC末端へ連結するペプチドスペーサー配列が、天然のアミノ酸、非天然のアミノ酸、または天然のアミノ酸および非天然のアミノ酸の両方を含む配列。
【請求項29】
a)第一のアミノ酸残基上のカルボン酸側鎖と第二のアミノ酸残基上のアミン側鎖の間に形成された内部環状アミド架橋をさらに含む、請求項28記載のCXCR4アゴニスト。
【請求項30】
a)2個のアミノ酸の間の内部環状ジスルフィド結合またはラクタム結合をさらに含む、請求項28記載のCXCR4アゴニスト。
【請求項31】
内部環状アミド架橋がC末端配列内にある、請求項29記載のCXCR4アゴニスト。
【図1】


【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2009−143942(P2009−143942A)
【公開日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願番号】特願2009−23230(P2009−23230)
【出願日】平成21年2月4日(2009.2.4)
【分割の表示】特願2001−574131(P2001−574131)の分割
【原出願日】平成13年4月12日(2001.4.12)
【出願人】(399016651)ザ ユニバーシティ オブ ブリティッシュ コロンビア (3)
【出願人】(502373271)ケモカイン セラピューティクス コーポレーション (1)
【Fターム(参考)】
【公開日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願日】平成21年2月4日(2009.2.4)
【分割の表示】特願2001−574131(P2001−574131)の分割
【原出願日】平成13年4月12日(2001.4.12)
【出願人】(399016651)ザ ユニバーシティ オブ ブリティッシュ コロンビア (3)
【出願人】(502373271)ケモカイン セラピューティクス コーポレーション (1)
【Fターム(参考)】
[ Back to top ]

