GPR43陽性・腸内分泌細胞増加促進剤
【課題】本発明はGPR43陽性・腸内分泌細胞を特異的に増加させるGPR43陽性・腸内分泌細胞増加促進剤を提供することを目的とする。
【解決手段】フラクトオリゴ糖を有効成分として含有する、GPR43陽性・腸内分泌細胞増加促進剤。
【解決手段】フラクトオリゴ糖を有効成分として含有する、GPR43陽性・腸内分泌細胞増加促進剤。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はGPR43陽性・腸内分泌細胞増加促進剤に関する。
【背景技術】
【0002】
我々の体を貫く一本の「管」である消化管は単に中空の管ではなく、食物の消化、栄養分の吸収、残渣の排出といった本来の生理機能を適切に実施するとともに、体外からの有害化学物質や病原微生物から生体を防御するために、消化管腔内を監視し処理するシステムが存在するとされる。その具体的な分子機構はまだ解明されていないが、管腔内の状態を反映する情報伝達物質と、その情報を受け取る受容体とが存在していると思われる。
【0003】
G蛋白質共役型受容体43(GPR43)は、リガンドが不明なG蛋白質共役型受容体の中から、G蛋白質共役型受容体41(GPR41)とともに短鎖脂肪酸に応答し、細胞内カルシウム上昇やcAMP減少を惹起する受容体として、2003年に同定されている(非特許文献1〜3)。最近、国際薬理学連合によりGPR43は遊離脂肪酸受容体2(FFA2)、GPR41はFFA3と命名された。
【0004】
GPR43は、単球、好中球といった免疫細胞に発現するとともに、ラット及びヒトの腸管粘膜におけるL型腸内分泌細胞にも発現していることが報告されている(非特許文献4及び5)。したがって、GPR43は消化管において何らかの制御機能を果たしていると推測される。また、ごく最近の研究によると、GPR43欠失マウスでは大腸炎や関節炎、喘息などの炎症応答が消失しなかったり、逆に炎症が悪化したりすることが認められるので、GPR43はある種の炎症応答の沈静化に必要であると考えられる(非特許文献6)。
【0005】
一方、短鎖脂肪酸は、大腸において生理的状態でも高濃度で存在している。食事により摂取された難消化性糖質の大部分は大腸において腸内細菌の発酵を受け、酢酸やプロピオン酸、酪酸といった短鎖脂肪酸に変換される。古くから短鎖脂肪酸は、反芻動物では栄養学的観点からよく研究されているが、1960年代になるまでヒトの生理機能に及ぼす短鎖脂肪酸の影響についてはあまり注目されていなかった。最近では栄養分として大腸粘膜から吸収されるのみならず、大腸に対して様々な生理作用を発揮し、さらに脂質代謝、グルコース・インスリン代謝などにも関与している可能性があり注目を集めてきている。しかしながら、その詳細な分子機構は未だ不明なところが多い。
【0006】
フラクトオリゴ糖(FOS)は、腸内細菌の発酵を受け短鎖脂肪酸に変換される難消化性糖質の一つである。フラクトオリゴ糖は、腸内のビフィズス菌増殖促進作用、整腸作用、ミネラル吸収促進作用等の優れた生理機能を有することから、機能性素材として広く使用されている。しかしながら、フラクトオリゴ糖とGPR43陽性細胞との関連性についての報告はなかった。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Brown AJら,J Biol Chem 278:11312−11319,2003.
【非特許文献2】Le Poul Eら,J Biol Chem 278:25481−25489,2003.
【非特許文献3】Nilsson NEら,Biochem Biophys Res Commun 303:1047−1052、2003.
【非特許文献4】Karaki Sら,Cell Tissue Res 324:353−360、2006.
【非特許文献5】Karaki Sら,J Mol Histol 39:135−142,2008.
【非特許文献6】Kendle M. Maslowskiら,Nature vol.461,1282−1286,2009.
【発明の概要】
【発明が解決しようとする課題】
【0008】
上述したように、GPR43は正常な腸内環境を保つための消化管腔内の監視・処理システムにおいて、何らかの監視役、すなわちセンサーとして機能していると思われる。したがって、そのセンサーの数が多くなればなるほど、生体にとっては有益な働きはより大きくなることが期待される。しかしながら、GPR43の発現量又はGPR43発現細胞(GPR43陽性細胞)を特異的に増加させる手段はこれまでなかった。そこで、本発明はGPR43陽性細胞を特異的に増加させる、GPR43陽性・腸内分泌細胞増加促進剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは上記課題を解決するため鋭意研究した結果、ラットにフラクトオリゴ糖を投与したところ、顕著なGPR43陽性・腸内分泌細胞増加促進作用が認められ、さらにGLP−1陽性・腸内分泌細胞の増加促進作用もあることを見出し、本発明の完成に至った。
【0010】
すなわち、本発明は、フラクトオリゴ糖を有効成分として含有する、GPR43陽性・腸内分泌細胞増加促進剤を提供する。また、本発明においてGPR43陽性・腸内分泌細胞がL型腸内分泌細胞であることが好ましい。
【0011】
本発明は、また、上記GPR43陽性・腸内分泌細胞増加促進剤を含む飲食品を提供する。
【発明の効果】
【0012】
本発明のGPR43陽性・腸内分泌細胞増加促進剤によれば、GPR43を発現する腸内分泌細胞の数を増加することができる。これにより、GPR43に伴う有益な働き、例えば、抗アレルギー作用や抗炎症作用などをもたらすことが可能となる。また、本発明のGPR43陽性・腸内分泌細胞増加促進剤は、その有効成分であるフラクトオリゴ糖が食品としても利用されるため、安全である。
【図面の簡単な説明】
【0013】
【図1】図1は特殊混餌粉末飼料の投与期間中におけるラットの体重変化を示す図である。
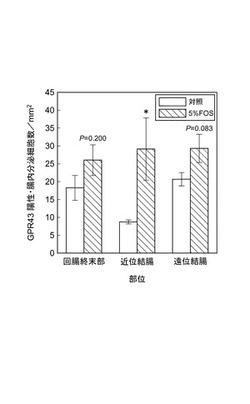
【図2】図2は対照群と5%FOS群とのGPR43陽性・腸内分泌細胞数の差異を示すグラフである。
【図3】図3は対照群と5%FOS群とのGLP−1陽性・腸内分泌細胞数の差異を示すグラフである。
【発明を実施するための形態】
【0014】
本発明のGPR43陽性・腸内分泌細胞増加剤は、フラクトオリゴ糖(FOS)を有効成分として含有する。本明細書における「GPR43陽性・腸内分泌細胞」とは、G蛋白質共役型受容体43(GPR43)を発現する腸内分泌細胞を指す。GPR43陽性細胞は、例えば免疫組織化学的手法によって検出することができ、抗GPR43抗体に対する免疫活性のある細胞をGPR43陽性細胞と判定することができる。また、in situハイブリダイゼーション法などによってGPR43のmRNAの発現量を測定することによってもGPR43陽性細胞であるかどうかを判定することができる。また、本明細書における「GLP−1陽性・腸内分泌細胞」とは、グルカゴン様ペプチド−1(GLP−1)を発現する腸内分泌細胞を指す。GLP−1陽性細胞の検出も同様に、免疫組織化学的手法やmRNAの発現量の測定によって行うことができる。なおここで、「細胞増加」とは、GPR43又はGLP−1を発現する腸内分泌細胞の増殖による増加と、GPR43又はGLP−1を発現しなかった又は発現量が検出限界以下の腸内分泌細胞が検出可能な量のGPR43又はGLP−1を発現するようになることによる増加との両方を含む。
【0015】
腸内分泌細胞のうち、特にL型腸内分泌細胞はGPR43を発現することが知られている。本発明のGPR43陽性・腸内分泌細胞増加剤によって増えた細胞のうち、殆どがL型腸内分泌細胞であると推測される。L型腸内分泌細胞は、GPR43を発現するほか、グルカゴン様ペプチド−1(GLP−1)やペプチドYY(PYY)などの消化管ホルモンを分泌する細胞としても知られている。したがって、本発明のGPR43陽性・腸内分泌細胞増加剤によって、腸管内に分泌されるGLP−1やPYYの量に影響する可能性があると推測される。実際に本発明者らは、本発明のGPR43陽性・腸内分泌細胞増加剤によって、GPR43陽性・腸内分泌細胞の増加とともに、GLP−1陽性・腸内分泌細胞も増加したことを初めて証明した。
【0016】
GLP−1は、(1)グルコース濃度依存性インスリン分泌促進、(2)グルカゴン分泌抑制、(3)膵β細胞増殖、(4)胃排泄抑制、(5)中枢性食欲抑制、(6)インスリン抵抗性改善などの作用があるとされている。PYYは、摂食の制御や上部消化管の運動抑制の制御に関与することが知られている。したがって、本発明のGPR43陽性・腸内分泌細胞増加剤は、GPR43の増加に伴う有益の作用のほか、GLP−1やPYYの増加に伴う有益な作用も奏する可能性があると推測される。
【0017】
本発明のGPR43陽性・腸内分泌細胞増加剤の有効成分であるフラクトオリゴ糖は、β−1,2結合によりショ糖のフラクトース残基に1〜3分子のフラクトースが結合したものであり、3糖類の1−ケストース、4糖類のニストース、5糖類の1−フルクトシルニストース等が含まれる。フラクトオリゴ糖は腸内のビフィズス菌増殖促進作用、整腸作用、ミネラル吸収促進作用等の優れた生理機能を有することから、機能性素材として広く使用されている。本発明に使用されるフラクトオリゴ糖は特に限定されないが、メイオリゴP(明治製菓株式会社製)などが好ましく用いられる。
【0018】
本発明のGPR43陽性・腸内分泌細胞増加剤は、好ましく1〜99重量%のフラクトオリゴ糖を含み、より好ましくは10〜99重量%のフラクトオリゴ糖を含む。本発明のGPR43陽性・腸内分泌細胞増加剤は経口投与の形態であれば特に限定されないが、錠剤、カプセル剤、散剤、懸濁剤、水剤などの剤形であってもよい。
【0019】
本発明のGPR43陽性・腸内分泌細胞増加剤は、有効成分であるフラクトオリゴ糖の他、薬学的に許容される担体又は添加物を含んでもよい。このような担体及び添加物の例として、水、薬学的に許容される有機溶剤、コラーゲン、ポリビニルアルコール、ポリビニルピロリドン、カルボキシビニルポリマー、アルギン酸ナトリウム、水溶性デキストラン、カルボキシメチルスターチナトリウム、ペクチン、キサンタンガム、アラビアゴム、カゼイン、ゼラチン、寒天、グリセリン、プロピレングリコール、ポリエチレングリコール、ワセリン、パラフィン、ステアリルアルコール、ステアリン酸、ヒト血清アルブミン、マンニトール、ソルビトール、ラクトースなどが挙げられる。使用される添加物は、剤形に応じて上記の中から適宜又は組み合わせて選択される。
【0020】
本発明はまた、GPR43陽性・腸内分泌細胞増加剤を含む飲食品を提供する。ここで、飲食品とは全ての飲食物を含む。本発明の目的にかなうものであれば、通常の飲食品に本発明のGPR43陽性・腸内分泌細胞増加剤を添加して、GPR43陽性・腸内分泌細胞増加用機能性飲食品として使用することができる。フラクトオリゴ糖の腸への送達及び腸内細菌によるフラクトオリゴ糖の資化(発酵)に影響を与えないものであれば、あらゆる飲食品に本発明のGPR43陽性・腸内分泌細胞増加剤を添加することができる。飲食品への添加量は特に限定されないが、各飲飲食品の特性、嗜好性、経済性等を考慮して、その添加量としては0.5〜99重量%程度であればよく、目的に応じて適当な製造工程の段階で適宜配合すればよい。フラクトオリゴ糖は飲食品としても利用される実績があるため、安全性に問題がないと考えられる。
【実施例】
【0021】
以下、実施例を用いて本発明をより詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0022】
実施例1 ラットにおけるFOS添加食餌によるGPR43陽性・腸内分泌細胞増加の評価試験
[材料及び方法]
【0023】
1.被験物質
本試験にはフラクトオリゴ糖としてメイオリゴP粉末(フラクトオリゴ糖含量95.4%、明治製菓株式会社製)を使用した。
2.供試動物
日本エスエルシー株式会社生産の雄性Slc:Wistarラット(SPF)9週齢を10匹購入した。動物は購入から実験開始まで馴化した。
3.飼育施設
動物は温度24±2℃、湿度50±10%、空調方式:オールフレッシュエアー、午前7時から午後7時までの12時間照明に設定されたバリア施設内の動物室で飼育した。
4.飼育方法
試験期間中はアルミ製平板ケージ(W25×D40×H18cm)で個別飼育した。動物には3日間の予備飼育期間中は固形飼料(ラボMRストック日本農産工業株式会社)を、群分け後は、試験期間を通じ特殊混餌粉末飼料(オリエンタル酵母工業株式会社にて作製)を16g/日摂取させた。飲水は、水道水を給水瓶で、試験期間を通じ自由摂取させた。
【0024】
5.試験実施方法
5−1.特殊混餌粉末飼料の調製方法
放射線滅菌した、表1に示した配合の2種類の特殊混餌粉末飼料をオリエンタル酵母工業株式会社にて作製した。
【表1】

5−2.測定及び群分け方法
9週齢のラットの体重を測定し、これを指標とし、層別連続無作為化法により対照群と5%FOS群とに群分けを行った。それぞれの群のラットに、表1に示す混餌粉末飼料を28日間にわたり、1日あたり16g給与し、食べ残した場合には残量を測定した。投与期間中、2回/週の割合で体重測定を行った。
【0025】
6.屠殺・標本採取方法
6−1.屠殺・腸管摘出
ラットをジエチルエーテルにより吸入麻酔し、断頭・放血屠殺した。回腸以下を摘出して氷冷リン酸緩衝液(PBS)+ニカルジピン(10−6M)に浸漬した。
6−2.標本組織の区分
本試験に供する腸管組織は、回腸終末部(回盲部より口側へ約2cmまで)と、近位結腸と、遠位結腸とに区分した。
【0026】
7.組織化学法
7−1.Zamboni(ザンボニ)固定液の調製
4%パラホルムアルデヒド、0.2%ピクリン酸、及び0.1Mリン酸緩衝液(pH7.4)を含むZamboni固定液を用時調製した。
【0027】
7−2.凍結切片の作製
腸管組織各部位を組織包埋カセット(プロカセット、サクラファインテックジャパン株式会社、日本)に入れ、Zamboni固定液20時間、4℃で浸漬固定した。固定した組織をPBSで10分×3回洗浄し、さらにPBSを毎日交換しながら3日間4℃で保存した。次に、10%→20%→30%ショ糖PBSに2時間ずつ浸潤させてクリオプロテクションを行った。標本をOCTコンパウンド(サクラファインテックジャパン株式会社)に包埋、液体窒素で凍結、凍結ブロックは切片作製まで−80℃で保存した。凍結した組織をクリオスタット(CM1100、Leica Microsystems、ドイツ)で10μm厚に薄切し、PLL(Poly−L−Lysine)被覆したスライドグラスに切片を貼り付け、風乾、染色に供するまで−80℃で保存した。なお、組織染色・計測を行う実験者とは別の実験者をコントローラーとして標本ラベルをコード化し、盲検的に以下の試験を行った。
7−3.蛍光免疫染色
【0028】
切片をPBSで洗浄(10分×3回)、10%ロバ正常血清、1%Triton X−100を含むPBSを滴下し、湿箱中、室温、1時間静置し、非特異反応のブロッキングを行った。次に、0.1%Triton X−100 PBSで希釈したウサギ抗GPR43抗体又はウサギ抗GLP−1抗体を1次抗体として、抗GPR43抗体は4℃で一晩、抗GLP−1抗体は室温で、湿箱中に静置し、反応させた。PBSで10分×3回洗浄した後、2次抗体(0.1%Triton X−100 PBSで希釈し、1μg/mLのDAPIを含有)に室温、1時間反応させた。二重染色には、一次反応はヤギ抗GLP−1抗体をウサギ抗GPR43抗体液と混合して反応させ、二次反応には標識の異なる2次抗体を使用した。2次抗体反応の終了した標本をPBSで10分×3回洗浄した後、蛍光標識標本用封入剤(DakoCytomation、デンマーク)で封入、マニキュアでカバーガラスの周囲をシールした。蛍光顕微鏡(IX70、オリンパス株式会社、日本)で蛍光観察し、冷却CCDカメラ(AxioVision、ドイツ)で画像を撮影した。画像解析ソフトウェアImage J(NIH)により、画像の粘膜面積当たりの免疫活性陽性腸内分泌細胞数を計測した。なお、使用した抗体は表2に示した。
【0029】
【表2】

【0030】
7−4.計測・検定
免疫染色によりGPR43陽性・腸内分泌細胞及びGLP−1陽性・腸内分泌細胞の細胞密度について、それぞれ2切片以上の標本から各切片5視野以上を計測し、動物1個体1部位、10視野以上の計測結果を平均して1標本のデータ(n=1)とした。各食餌群n=5の平均を算出し、t‐検定によって対照群と5%FOS群との間の有意差検定(有意水準5%未満)を行った。
【0031】
[結果]
1.飼育データ
1−1.一般状態観察
被験物質食餌飼育期間中、全ての動物の一般状態に異常はなく、被験物質摂取による下痢及び軟便等も観察されなかった。
1−2.体重
体重推移を図1に示した。対照群と5%FOS群間の体重増加に有意な差はみられなかった。
1−3.残餌量
特餌開始14日まではいずれの試験群も混餌飼料を残す動物はほとんどいなかった。しかし、5%FOS群では、23日以降3匹に食べ残しがみられたが、食べ残した量は少量(4g以内)であった。
【0032】
2.蛍光免疫組織化学
2−1.GPR−43陽性・腸内分泌細胞数
ウサギ抗GPR43(RY1505)を用いた蛍光免疫染色により、GPR43免疫活性を有する腸内分泌細胞が観察された。5%FOS群の単位面積(1mm2)当たりのGPR43陽性・腸内分泌細胞数は、対照群に対して、回腸終末部で1.42倍、近位結腸で3.33倍、遠位結腸で1.42倍に増加しており、近位結腸においては統計学的に有意に増加していた(P<0.05)。なお、腸内分泌細胞のほか粘膜における上皮細胞もGPR43を発現するとされるが、今回の実験では粘膜厚(上皮細胞数に相当する)に変化が認められなかったため、増加したのは腸内分泌細胞のみであったと示唆された。
【0033】
2−2.GLP−1陽性・腸内分泌細胞数
抗GLP−1抗体を用いた蛍光免疫染色により、GLP−1免疫活性を有する腸内分泌細胞が観察された。回腸終末部及び遠位結腸にはウサギ抗GLP−1抗体(Y320)、近位結腸にはヤギ抗GLP−1抗体(sc7782)をそれぞれ用いた。5%FOS群の単位面積(1mm2)当たりのGLP−1陽性・腸内分泌細胞数は、対照群に対して、回腸終末部で1.28倍、近位結腸で2.08倍、遠位結腸で1.25倍に増加しており、近位結腸においては統計学的に有意に増加していた(P<0.001)。
【0034】
3.結果総括
本実施例において、5%FOS群は、対照群に比して体重増加に差は無く、下痢等も発生しなかったことから、5%FOS食餌による不快な症状は惹起されなかったものと考えられる。また、粘膜の肥厚等の形態的変化も観察されなかったが、単位面積当たりのGPR43陽性・腸内分泌細胞及びGLP−1陽性・腸内分泌細胞数は、近位結腸においてそれぞれ約3倍及び約2倍に有意に増加し、遠位結腸、回腸終末部においても増加傾向を示した。また、二重染色試験により、GPR43及びGLP−1が殆ど同じ細胞に共存することが示されたことから、増加したGPR43陽性・腸内分泌細胞は殆どL型腸内分泌細胞であると示唆された。
【0035】
フラクトオリゴ糖によるGPR43陽性・腸内分泌細胞増加促進効果のメカニズムは不明であるが、フラクトオリゴ糖がビフィズス菌等をはじめとする有益な腸内細菌によって大腸内で短鎖脂肪酸に変換されるため、恐らく短鎖脂肪酸の作用・刺激により、GPR43陽性・腸内分泌細胞が増加するものと推定される。一方で、腸内分泌細胞以外のGPR43発現細胞(例えば、上皮細胞)の増加が認められていないため、フラクトオリゴ糖による作用はGPR43陽性・腸内分泌細胞特異的であると推測される。
【0036】
実施例2 錠剤の製造
以下に示す配合比率で定法に従い300mgの錠剤を製造した。
メイオリゴP粉末
(フラクトオリゴ糖含量95.4%、明治製菓株式会社製) 250mg
トウモロコシデンプン 15mg
結晶セルロース 25mg
カルボキシメチルセルロース 10mg
【0037】
実施例3 散剤の製造
以下に示す配合比率で定法に従い散剤を製造した。
メイオリゴP粉末
(フラクトオリゴ糖含量95.4%、明治製菓株式会社製) 200mg
乳糖 791mg
ヒドロキシプロピルセルロース 4mg
無水ケイ酸 5mg
【0038】
実施例4 錠菓の製造
以下に示す配合比率で定法に従い錠菓を製造した。
メイオリゴP粉末
(フラクトオリゴ糖含量95.4%、明治製菓株式会社製) 85mg
アビセル 4mg
クエン酸 3mg
シュガーエステル 3mg
ビフィズス菌 5mg
【技術分野】
【0001】
本発明はGPR43陽性・腸内分泌細胞増加促進剤に関する。
【背景技術】
【0002】
我々の体を貫く一本の「管」である消化管は単に中空の管ではなく、食物の消化、栄養分の吸収、残渣の排出といった本来の生理機能を適切に実施するとともに、体外からの有害化学物質や病原微生物から生体を防御するために、消化管腔内を監視し処理するシステムが存在するとされる。その具体的な分子機構はまだ解明されていないが、管腔内の状態を反映する情報伝達物質と、その情報を受け取る受容体とが存在していると思われる。
【0003】
G蛋白質共役型受容体43(GPR43)は、リガンドが不明なG蛋白質共役型受容体の中から、G蛋白質共役型受容体41(GPR41)とともに短鎖脂肪酸に応答し、細胞内カルシウム上昇やcAMP減少を惹起する受容体として、2003年に同定されている(非特許文献1〜3)。最近、国際薬理学連合によりGPR43は遊離脂肪酸受容体2(FFA2)、GPR41はFFA3と命名された。
【0004】
GPR43は、単球、好中球といった免疫細胞に発現するとともに、ラット及びヒトの腸管粘膜におけるL型腸内分泌細胞にも発現していることが報告されている(非特許文献4及び5)。したがって、GPR43は消化管において何らかの制御機能を果たしていると推測される。また、ごく最近の研究によると、GPR43欠失マウスでは大腸炎や関節炎、喘息などの炎症応答が消失しなかったり、逆に炎症が悪化したりすることが認められるので、GPR43はある種の炎症応答の沈静化に必要であると考えられる(非特許文献6)。
【0005】
一方、短鎖脂肪酸は、大腸において生理的状態でも高濃度で存在している。食事により摂取された難消化性糖質の大部分は大腸において腸内細菌の発酵を受け、酢酸やプロピオン酸、酪酸といった短鎖脂肪酸に変換される。古くから短鎖脂肪酸は、反芻動物では栄養学的観点からよく研究されているが、1960年代になるまでヒトの生理機能に及ぼす短鎖脂肪酸の影響についてはあまり注目されていなかった。最近では栄養分として大腸粘膜から吸収されるのみならず、大腸に対して様々な生理作用を発揮し、さらに脂質代謝、グルコース・インスリン代謝などにも関与している可能性があり注目を集めてきている。しかしながら、その詳細な分子機構は未だ不明なところが多い。
【0006】
フラクトオリゴ糖(FOS)は、腸内細菌の発酵を受け短鎖脂肪酸に変換される難消化性糖質の一つである。フラクトオリゴ糖は、腸内のビフィズス菌増殖促進作用、整腸作用、ミネラル吸収促進作用等の優れた生理機能を有することから、機能性素材として広く使用されている。しかしながら、フラクトオリゴ糖とGPR43陽性細胞との関連性についての報告はなかった。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Brown AJら,J Biol Chem 278:11312−11319,2003.
【非特許文献2】Le Poul Eら,J Biol Chem 278:25481−25489,2003.
【非特許文献3】Nilsson NEら,Biochem Biophys Res Commun 303:1047−1052、2003.
【非特許文献4】Karaki Sら,Cell Tissue Res 324:353−360、2006.
【非特許文献5】Karaki Sら,J Mol Histol 39:135−142,2008.
【非特許文献6】Kendle M. Maslowskiら,Nature vol.461,1282−1286,2009.
【発明の概要】
【発明が解決しようとする課題】
【0008】
上述したように、GPR43は正常な腸内環境を保つための消化管腔内の監視・処理システムにおいて、何らかの監視役、すなわちセンサーとして機能していると思われる。したがって、そのセンサーの数が多くなればなるほど、生体にとっては有益な働きはより大きくなることが期待される。しかしながら、GPR43の発現量又はGPR43発現細胞(GPR43陽性細胞)を特異的に増加させる手段はこれまでなかった。そこで、本発明はGPR43陽性細胞を特異的に増加させる、GPR43陽性・腸内分泌細胞増加促進剤を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは上記課題を解決するため鋭意研究した結果、ラットにフラクトオリゴ糖を投与したところ、顕著なGPR43陽性・腸内分泌細胞増加促進作用が認められ、さらにGLP−1陽性・腸内分泌細胞の増加促進作用もあることを見出し、本発明の完成に至った。
【0010】
すなわち、本発明は、フラクトオリゴ糖を有効成分として含有する、GPR43陽性・腸内分泌細胞増加促進剤を提供する。また、本発明においてGPR43陽性・腸内分泌細胞がL型腸内分泌細胞であることが好ましい。
【0011】
本発明は、また、上記GPR43陽性・腸内分泌細胞増加促進剤を含む飲食品を提供する。
【発明の効果】
【0012】
本発明のGPR43陽性・腸内分泌細胞増加促進剤によれば、GPR43を発現する腸内分泌細胞の数を増加することができる。これにより、GPR43に伴う有益な働き、例えば、抗アレルギー作用や抗炎症作用などをもたらすことが可能となる。また、本発明のGPR43陽性・腸内分泌細胞増加促進剤は、その有効成分であるフラクトオリゴ糖が食品としても利用されるため、安全である。
【図面の簡単な説明】
【0013】
【図1】図1は特殊混餌粉末飼料の投与期間中におけるラットの体重変化を示す図である。
【図2】図2は対照群と5%FOS群とのGPR43陽性・腸内分泌細胞数の差異を示すグラフである。
【図3】図3は対照群と5%FOS群とのGLP−1陽性・腸内分泌細胞数の差異を示すグラフである。
【発明を実施するための形態】
【0014】
本発明のGPR43陽性・腸内分泌細胞増加剤は、フラクトオリゴ糖(FOS)を有効成分として含有する。本明細書における「GPR43陽性・腸内分泌細胞」とは、G蛋白質共役型受容体43(GPR43)を発現する腸内分泌細胞を指す。GPR43陽性細胞は、例えば免疫組織化学的手法によって検出することができ、抗GPR43抗体に対する免疫活性のある細胞をGPR43陽性細胞と判定することができる。また、in situハイブリダイゼーション法などによってGPR43のmRNAの発現量を測定することによってもGPR43陽性細胞であるかどうかを判定することができる。また、本明細書における「GLP−1陽性・腸内分泌細胞」とは、グルカゴン様ペプチド−1(GLP−1)を発現する腸内分泌細胞を指す。GLP−1陽性細胞の検出も同様に、免疫組織化学的手法やmRNAの発現量の測定によって行うことができる。なおここで、「細胞増加」とは、GPR43又はGLP−1を発現する腸内分泌細胞の増殖による増加と、GPR43又はGLP−1を発現しなかった又は発現量が検出限界以下の腸内分泌細胞が検出可能な量のGPR43又はGLP−1を発現するようになることによる増加との両方を含む。
【0015】
腸内分泌細胞のうち、特にL型腸内分泌細胞はGPR43を発現することが知られている。本発明のGPR43陽性・腸内分泌細胞増加剤によって増えた細胞のうち、殆どがL型腸内分泌細胞であると推測される。L型腸内分泌細胞は、GPR43を発現するほか、グルカゴン様ペプチド−1(GLP−1)やペプチドYY(PYY)などの消化管ホルモンを分泌する細胞としても知られている。したがって、本発明のGPR43陽性・腸内分泌細胞増加剤によって、腸管内に分泌されるGLP−1やPYYの量に影響する可能性があると推測される。実際に本発明者らは、本発明のGPR43陽性・腸内分泌細胞増加剤によって、GPR43陽性・腸内分泌細胞の増加とともに、GLP−1陽性・腸内分泌細胞も増加したことを初めて証明した。
【0016】
GLP−1は、(1)グルコース濃度依存性インスリン分泌促進、(2)グルカゴン分泌抑制、(3)膵β細胞増殖、(4)胃排泄抑制、(5)中枢性食欲抑制、(6)インスリン抵抗性改善などの作用があるとされている。PYYは、摂食の制御や上部消化管の運動抑制の制御に関与することが知られている。したがって、本発明のGPR43陽性・腸内分泌細胞増加剤は、GPR43の増加に伴う有益の作用のほか、GLP−1やPYYの増加に伴う有益な作用も奏する可能性があると推測される。
【0017】
本発明のGPR43陽性・腸内分泌細胞増加剤の有効成分であるフラクトオリゴ糖は、β−1,2結合によりショ糖のフラクトース残基に1〜3分子のフラクトースが結合したものであり、3糖類の1−ケストース、4糖類のニストース、5糖類の1−フルクトシルニストース等が含まれる。フラクトオリゴ糖は腸内のビフィズス菌増殖促進作用、整腸作用、ミネラル吸収促進作用等の優れた生理機能を有することから、機能性素材として広く使用されている。本発明に使用されるフラクトオリゴ糖は特に限定されないが、メイオリゴP(明治製菓株式会社製)などが好ましく用いられる。
【0018】
本発明のGPR43陽性・腸内分泌細胞増加剤は、好ましく1〜99重量%のフラクトオリゴ糖を含み、より好ましくは10〜99重量%のフラクトオリゴ糖を含む。本発明のGPR43陽性・腸内分泌細胞増加剤は経口投与の形態であれば特に限定されないが、錠剤、カプセル剤、散剤、懸濁剤、水剤などの剤形であってもよい。
【0019】
本発明のGPR43陽性・腸内分泌細胞増加剤は、有効成分であるフラクトオリゴ糖の他、薬学的に許容される担体又は添加物を含んでもよい。このような担体及び添加物の例として、水、薬学的に許容される有機溶剤、コラーゲン、ポリビニルアルコール、ポリビニルピロリドン、カルボキシビニルポリマー、アルギン酸ナトリウム、水溶性デキストラン、カルボキシメチルスターチナトリウム、ペクチン、キサンタンガム、アラビアゴム、カゼイン、ゼラチン、寒天、グリセリン、プロピレングリコール、ポリエチレングリコール、ワセリン、パラフィン、ステアリルアルコール、ステアリン酸、ヒト血清アルブミン、マンニトール、ソルビトール、ラクトースなどが挙げられる。使用される添加物は、剤形に応じて上記の中から適宜又は組み合わせて選択される。
【0020】
本発明はまた、GPR43陽性・腸内分泌細胞増加剤を含む飲食品を提供する。ここで、飲食品とは全ての飲食物を含む。本発明の目的にかなうものであれば、通常の飲食品に本発明のGPR43陽性・腸内分泌細胞増加剤を添加して、GPR43陽性・腸内分泌細胞増加用機能性飲食品として使用することができる。フラクトオリゴ糖の腸への送達及び腸内細菌によるフラクトオリゴ糖の資化(発酵)に影響を与えないものであれば、あらゆる飲食品に本発明のGPR43陽性・腸内分泌細胞増加剤を添加することができる。飲食品への添加量は特に限定されないが、各飲飲食品の特性、嗜好性、経済性等を考慮して、その添加量としては0.5〜99重量%程度であればよく、目的に応じて適当な製造工程の段階で適宜配合すればよい。フラクトオリゴ糖は飲食品としても利用される実績があるため、安全性に問題がないと考えられる。
【実施例】
【0021】
以下、実施例を用いて本発明をより詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0022】
実施例1 ラットにおけるFOS添加食餌によるGPR43陽性・腸内分泌細胞増加の評価試験
[材料及び方法]
【0023】
1.被験物質
本試験にはフラクトオリゴ糖としてメイオリゴP粉末(フラクトオリゴ糖含量95.4%、明治製菓株式会社製)を使用した。
2.供試動物
日本エスエルシー株式会社生産の雄性Slc:Wistarラット(SPF)9週齢を10匹購入した。動物は購入から実験開始まで馴化した。
3.飼育施設
動物は温度24±2℃、湿度50±10%、空調方式:オールフレッシュエアー、午前7時から午後7時までの12時間照明に設定されたバリア施設内の動物室で飼育した。
4.飼育方法
試験期間中はアルミ製平板ケージ(W25×D40×H18cm)で個別飼育した。動物には3日間の予備飼育期間中は固形飼料(ラボMRストック日本農産工業株式会社)を、群分け後は、試験期間を通じ特殊混餌粉末飼料(オリエンタル酵母工業株式会社にて作製)を16g/日摂取させた。飲水は、水道水を給水瓶で、試験期間を通じ自由摂取させた。
【0024】
5.試験実施方法
5−1.特殊混餌粉末飼料の調製方法
放射線滅菌した、表1に示した配合の2種類の特殊混餌粉末飼料をオリエンタル酵母工業株式会社にて作製した。
【表1】

5−2.測定及び群分け方法
9週齢のラットの体重を測定し、これを指標とし、層別連続無作為化法により対照群と5%FOS群とに群分けを行った。それぞれの群のラットに、表1に示す混餌粉末飼料を28日間にわたり、1日あたり16g給与し、食べ残した場合には残量を測定した。投与期間中、2回/週の割合で体重測定を行った。
【0025】
6.屠殺・標本採取方法
6−1.屠殺・腸管摘出
ラットをジエチルエーテルにより吸入麻酔し、断頭・放血屠殺した。回腸以下を摘出して氷冷リン酸緩衝液(PBS)+ニカルジピン(10−6M)に浸漬した。
6−2.標本組織の区分
本試験に供する腸管組織は、回腸終末部(回盲部より口側へ約2cmまで)と、近位結腸と、遠位結腸とに区分した。
【0026】
7.組織化学法
7−1.Zamboni(ザンボニ)固定液の調製
4%パラホルムアルデヒド、0.2%ピクリン酸、及び0.1Mリン酸緩衝液(pH7.4)を含むZamboni固定液を用時調製した。
【0027】
7−2.凍結切片の作製
腸管組織各部位を組織包埋カセット(プロカセット、サクラファインテックジャパン株式会社、日本)に入れ、Zamboni固定液20時間、4℃で浸漬固定した。固定した組織をPBSで10分×3回洗浄し、さらにPBSを毎日交換しながら3日間4℃で保存した。次に、10%→20%→30%ショ糖PBSに2時間ずつ浸潤させてクリオプロテクションを行った。標本をOCTコンパウンド(サクラファインテックジャパン株式会社)に包埋、液体窒素で凍結、凍結ブロックは切片作製まで−80℃で保存した。凍結した組織をクリオスタット(CM1100、Leica Microsystems、ドイツ)で10μm厚に薄切し、PLL(Poly−L−Lysine)被覆したスライドグラスに切片を貼り付け、風乾、染色に供するまで−80℃で保存した。なお、組織染色・計測を行う実験者とは別の実験者をコントローラーとして標本ラベルをコード化し、盲検的に以下の試験を行った。
7−3.蛍光免疫染色
【0028】
切片をPBSで洗浄(10分×3回)、10%ロバ正常血清、1%Triton X−100を含むPBSを滴下し、湿箱中、室温、1時間静置し、非特異反応のブロッキングを行った。次に、0.1%Triton X−100 PBSで希釈したウサギ抗GPR43抗体又はウサギ抗GLP−1抗体を1次抗体として、抗GPR43抗体は4℃で一晩、抗GLP−1抗体は室温で、湿箱中に静置し、反応させた。PBSで10分×3回洗浄した後、2次抗体(0.1%Triton X−100 PBSで希釈し、1μg/mLのDAPIを含有)に室温、1時間反応させた。二重染色には、一次反応はヤギ抗GLP−1抗体をウサギ抗GPR43抗体液と混合して反応させ、二次反応には標識の異なる2次抗体を使用した。2次抗体反応の終了した標本をPBSで10分×3回洗浄した後、蛍光標識標本用封入剤(DakoCytomation、デンマーク)で封入、マニキュアでカバーガラスの周囲をシールした。蛍光顕微鏡(IX70、オリンパス株式会社、日本)で蛍光観察し、冷却CCDカメラ(AxioVision、ドイツ)で画像を撮影した。画像解析ソフトウェアImage J(NIH)により、画像の粘膜面積当たりの免疫活性陽性腸内分泌細胞数を計測した。なお、使用した抗体は表2に示した。
【0029】
【表2】

【0030】
7−4.計測・検定
免疫染色によりGPR43陽性・腸内分泌細胞及びGLP−1陽性・腸内分泌細胞の細胞密度について、それぞれ2切片以上の標本から各切片5視野以上を計測し、動物1個体1部位、10視野以上の計測結果を平均して1標本のデータ(n=1)とした。各食餌群n=5の平均を算出し、t‐検定によって対照群と5%FOS群との間の有意差検定(有意水準5%未満)を行った。
【0031】
[結果]
1.飼育データ
1−1.一般状態観察
被験物質食餌飼育期間中、全ての動物の一般状態に異常はなく、被験物質摂取による下痢及び軟便等も観察されなかった。
1−2.体重
体重推移を図1に示した。対照群と5%FOS群間の体重増加に有意な差はみられなかった。
1−3.残餌量
特餌開始14日まではいずれの試験群も混餌飼料を残す動物はほとんどいなかった。しかし、5%FOS群では、23日以降3匹に食べ残しがみられたが、食べ残した量は少量(4g以内)であった。
【0032】
2.蛍光免疫組織化学
2−1.GPR−43陽性・腸内分泌細胞数
ウサギ抗GPR43(RY1505)を用いた蛍光免疫染色により、GPR43免疫活性を有する腸内分泌細胞が観察された。5%FOS群の単位面積(1mm2)当たりのGPR43陽性・腸内分泌細胞数は、対照群に対して、回腸終末部で1.42倍、近位結腸で3.33倍、遠位結腸で1.42倍に増加しており、近位結腸においては統計学的に有意に増加していた(P<0.05)。なお、腸内分泌細胞のほか粘膜における上皮細胞もGPR43を発現するとされるが、今回の実験では粘膜厚(上皮細胞数に相当する)に変化が認められなかったため、増加したのは腸内分泌細胞のみであったと示唆された。
【0033】
2−2.GLP−1陽性・腸内分泌細胞数
抗GLP−1抗体を用いた蛍光免疫染色により、GLP−1免疫活性を有する腸内分泌細胞が観察された。回腸終末部及び遠位結腸にはウサギ抗GLP−1抗体(Y320)、近位結腸にはヤギ抗GLP−1抗体(sc7782)をそれぞれ用いた。5%FOS群の単位面積(1mm2)当たりのGLP−1陽性・腸内分泌細胞数は、対照群に対して、回腸終末部で1.28倍、近位結腸で2.08倍、遠位結腸で1.25倍に増加しており、近位結腸においては統計学的に有意に増加していた(P<0.001)。
【0034】
3.結果総括
本実施例において、5%FOS群は、対照群に比して体重増加に差は無く、下痢等も発生しなかったことから、5%FOS食餌による不快な症状は惹起されなかったものと考えられる。また、粘膜の肥厚等の形態的変化も観察されなかったが、単位面積当たりのGPR43陽性・腸内分泌細胞及びGLP−1陽性・腸内分泌細胞数は、近位結腸においてそれぞれ約3倍及び約2倍に有意に増加し、遠位結腸、回腸終末部においても増加傾向を示した。また、二重染色試験により、GPR43及びGLP−1が殆ど同じ細胞に共存することが示されたことから、増加したGPR43陽性・腸内分泌細胞は殆どL型腸内分泌細胞であると示唆された。
【0035】
フラクトオリゴ糖によるGPR43陽性・腸内分泌細胞増加促進効果のメカニズムは不明であるが、フラクトオリゴ糖がビフィズス菌等をはじめとする有益な腸内細菌によって大腸内で短鎖脂肪酸に変換されるため、恐らく短鎖脂肪酸の作用・刺激により、GPR43陽性・腸内分泌細胞が増加するものと推定される。一方で、腸内分泌細胞以外のGPR43発現細胞(例えば、上皮細胞)の増加が認められていないため、フラクトオリゴ糖による作用はGPR43陽性・腸内分泌細胞特異的であると推測される。
【0036】
実施例2 錠剤の製造
以下に示す配合比率で定法に従い300mgの錠剤を製造した。
メイオリゴP粉末
(フラクトオリゴ糖含量95.4%、明治製菓株式会社製) 250mg
トウモロコシデンプン 15mg
結晶セルロース 25mg
カルボキシメチルセルロース 10mg
【0037】
実施例3 散剤の製造
以下に示す配合比率で定法に従い散剤を製造した。
メイオリゴP粉末
(フラクトオリゴ糖含量95.4%、明治製菓株式会社製) 200mg
乳糖 791mg
ヒドロキシプロピルセルロース 4mg
無水ケイ酸 5mg
【0038】
実施例4 錠菓の製造
以下に示す配合比率で定法に従い錠菓を製造した。
メイオリゴP粉末
(フラクトオリゴ糖含量95.4%、明治製菓株式会社製) 85mg
アビセル 4mg
クエン酸 3mg
シュガーエステル 3mg
ビフィズス菌 5mg
【特許請求の範囲】
【請求項1】
フラクトオリゴ糖を有効成分として含有する、GPR43陽性・腸内分泌細胞増加促進剤。
【請求項2】
前記GPR43陽性・腸内分泌細胞がL型腸内分泌細胞である、請求項1記載のGPR43陽性・腸内分泌細胞増加促進剤。
【請求項3】
請求項1又は2に記載のGPR43陽性・腸内分泌細胞増加促進剤を含む、飲食品。
【請求項1】
フラクトオリゴ糖を有効成分として含有する、GPR43陽性・腸内分泌細胞増加促進剤。
【請求項2】
前記GPR43陽性・腸内分泌細胞がL型腸内分泌細胞である、請求項1記載のGPR43陽性・腸内分泌細胞増加促進剤。
【請求項3】
請求項1又は2に記載のGPR43陽性・腸内分泌細胞増加促進剤を含む、飲食品。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−207834(P2011−207834A)
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願番号】特願2010−78653(P2010−78653)
【出願日】平成22年3月30日(2010.3.30)
【出願人】(507219686)静岡県公立大学法人 (63)
【出願人】(000006138)株式会社明治 (265)
【Fターム(参考)】
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願日】平成22年3月30日(2010.3.30)
【出願人】(507219686)静岡県公立大学法人 (63)
【出願人】(000006138)株式会社明治 (265)
【Fターム(参考)】
[ Back to top ]

