国際特許分類[C07K16/46]の内容
化学;冶金 (1,075,549) | 有機化学 (230,229) | ペプチド (29,849) | 免疫グロブリン,例.モノクローナル抗体またはポリクローナル抗体 (8,664) | ハイブリッド免疫グロブリン (1,034)
国際特許分類[C07K16/46]に分類される特許
901 - 910 / 1,034
インターロイキン13受容体α1(IL−13Rα1)に対するモノクローナル抗体
本発明は概してインターロイキン13受容体α1鎖(IL-13Rα1)に結合し、そしてIL-13および/またはIL-4によるIL-13受容体を介したシグナル伝達に拮抗する抗体に関する。さらに特に、本発明は哺乳動物、特にIL-13Rα1に対するヒト化またはヒト抗体を提供する。これらの抗体はIL-13および/またはIL-4介在性の疾患または症状の治療または予防における用途を有する。本発明はさらに対象抗体の投与によりIL-13および/またはIL-4介在性疾患または症状を調節する方法を企図する。本発明はさらにIL-13受容体複合体を介したIL-13および/またはIL-4シグナル伝達を調節する抗体またはその他の作用物質を同定するのに有用なアッセイ系を提供する。従って、IL-13Rα1/リガンド相互作用のモジュレーターをスクリーニングする方法もまた提供される。 (もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
DKK−1に対する抗体
本発明は、Dkk−1ポリペプチド類に特異的に結合する抗体およびその免疫機能性フラグメントを提供する。対象の抗体およびフラグメントは、Dkk−1タンパク質のカルボキシ領域に位置する配座エピトープに高親和性で結合する。このような抗体またはそのフラグメント、ならびに抗体またはそのフラグメントを含有する生理的に受容可能な組成物を調製する方法もまた提供する。骨疾患、炎症性疾患、神経系疾患、眼疾患、腎疾患、肺疾患および皮膚疾患など、種々の疾患を治療するための抗体およびフラグメントの使用法もまた開示する。  (もっと読む)
(もっと読む)
細胞死誘導剤
本発明者らは、2D7抗体の抗原を同定することを目的として、2D7抗原のクローニングを行った。その結果、2D7抗原はHLA class I分子であることが示唆された。本発明者らは、この知見に基づき、2D7抗体が細胞死誘導活性を有するか否かを検討した。その結果、2D7抗体をさらに別の抗体でクロスリンクすることで核の断片化が観察され、細胞死が誘導されることが分かった。さらに、2D7抗体のDiabodyは、さらに別の抗体を添加しなくても非常に強力な細胞死誘導活性を有することが判明した。以上の結果は、HLAを認識する抗体の低分子化抗体が細胞死誘導剤として利用できることを示している。 (もっと読む)
哺乳動物のCH1欠失ミメティボディ、組成物、方法および使用
本発明は少なくとも1つのCH1欠失ミメティボディまたは特定部分またはバリアントをコードする単離された核酸を含む少なくとも1つの新規ヒトCH1欠失ミメティボディまたは特定部分またはバリアント、CH1欠失ミメティボディまたは特定部分またはバリアント、ベクター、宿主細胞、トランスジェニック動物もしくは植物、および治療用組成物、方法およびデバイスを含むそれらの作成および使用法に関する。 (もっと読む)
ヒト化抗CMET抗体
本発明は、治療的抗c-met抗体と、この抗体を含んでなる組成物及びこの抗体の使用方法を提供するものである。 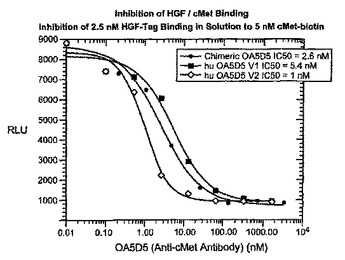 (もっと読む)
(もっと読む)
血液凝固を阻害する抗体及びその使用方法
本発明は、生の(未変性の)ヒトTFに高い親和性と特異性で結合することによって優れた抗凝固活性を提供する抗体を含んでいる。本発明の抗体は、インビトロでの血液凝固を効果的に阻害することができる。本発明の抗体は、それのみで、又はTF:VIIa複合体中に存在して、第X因子又は第IX因子がTF又は当該複合体に結合することを妨げるよう、未変性のヒトTFと結合することが可能であり、そうすることによって血液凝固を低下させるものである。本発明の好ましい抗体は、未変性のヒトTFに対して優位なエピトープの配座に特異的に結合する。当該エピトープは非常に強い抗体結合部位を有する。TFに結合するヒト型抗体及びその断片も又提供される。 (もっと読む)
抗EGFR一本鎖Fvおよび抗EGFR抗体
【課題】 免疫された哺乳動物、好ましくはマウスの細胞から構築されるファージ−抗体ライブラリーから得られる新規の抗EGFR抗体およびそれらの一本鎖Fv(scFv)の提供。
【解決手段】 ファージ−抗体ライブラリーから分離された一本鎖Fvの二つを、部分的にヒト化された全抗体分子を作出するために遺伝子操作した。これらキメラ抗EGFR抗体はヒト免疫グロブリンの定常部を含み、一本鎖Fvと同様にヒト腫瘍の診断および治療のための薬剤として使用することができる。
(もっと読む)
ヒト・インターフェロン−ガンマ中和活性を持つ、完全ヒト抗体Fab断片
本発明は、インターフェロン−ガンマ(IFNγ)の選択的結合剤を提供する。より具体的には、本発明は、IFNγに選択的に結合し、そして関節リウマチ、全身性エリテマトーデスおよび多発性硬化症などの自己免疫および炎症性疾患に関連する状態を防止するかまたは治療するのに使用可能な、抗体および抗原結合ドメインを提供する。前記の抗体および抗原結合ドメインをコードする核酸分子、並びに該核酸分子を産生するための発現ベクターおよび宿主細胞もまた、提供する。  (もっと読む)
(もっと読む)
結合分子
本発明は、親和性成熟を受ける機能性重鎖のみ抗体の多様なレパートリーの製造及びその使用に関する。また本発明は、クラス特異的重鎖のみ抗体の多様なレパートリーの製造及びその使用並びに抗体重鎖の機能、好ましくは抗体重鎖の結合機能、定常領域のエフェクター活性及び任意選択的に追加のエフェクター機能を有する多価ポリペプチド複合体の製造及び使用にも関する。また本発明は、抗原の投与に応答してトランスジェニックマウス中に十分に機能性の重鎖のみ抗体を生成させる方法にも関する。特に、本発明は、任意のクラス又は混合したクラスのヒトの抗原特異的で高アフィニティの重鎖のみ抗体の生成方法及び十分に機能性のVH抗原結合ドメインの単離と発現に関する。  (もっと読む)
(もっと読む)
901 - 910 / 1,034
[ Back to top ]

