キャップ非依存性RNA翻訳効率制御要素およびその利用
【課題】IRESを介した翻訳効率を向上させるキャップ非依存性RNA翻訳効率制御要素を提供する。
【解決手段】少なくとも1つのステム−ループ構造を形成可能なポリリボヌクレオチドであり、内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させるポリリボヌクレオチドをコードするポリヌクレオチドを、キャップ非依存性RNA翻訳効率の制御要素とする。
【解決手段】少なくとも1つのステム−ループ構造を形成可能なポリリボヌクレオチドであり、内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させるポリリボヌクレオチドをコードするポリヌクレオチドを、キャップ非依存性RNA翻訳効率の制御要素とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、キャップ非依存性RNA翻訳効率制御要素およびその利用に関し、詳しくは、キャップ非依存性RNA翻訳効率制御要素および該制御要素を利用するキャップ非依存性RNA翻訳開始要素、発現ベクター、形質転換体、遺伝子の発現方法、遺伝子産物の製造方法に関する。
【背景技術】
【0002】
植物細胞などの真核細胞においては、核酸から転写されたmRNAの翻訳はその5'末端側のキャップ構造にリボソームが結合することにより開始されるいわゆるキャップ依存性のmRNAの翻訳が主体となっている。一方、ある種のレトロウイルスにおいては、キャップ構造以外にリボソームが結合する内部リボソーム導入部位(Internal Ribosomal Entry Site,以下単にIRESともいう。)を有しており、キャップ非依存性のmRNA翻訳が行われることが知られている。
【0003】
動物ピコルナウイルスの1種であるencephalomyocarditis virus(EMCV)のゲノムはプラス鎖1本鎖RNAであり、全長834塩基からなる5’UTRを持っている。この5’UTRのうち260〜836の約574塩基にIRES配列が存在し、この配列にリボソームが直接結合して翻訳を開始することが証明されている(Jackson et al., 1990; Hellen and Sarnow, 2001)。このEMCV-IRESを使用したバイシストロニック(bicistronic)なタンパク質発現系は動物細胞においてはほぼ確立されており、市販品として入手可能である。EMCV-IRESは試験管内翻訳系においてもキャップ非依存的翻訳を促進する働きを示し、ウサギ網状赤血球の系では有効に機能することが明らかとなっている。しかし、コムギ胚芽の系ではEMCV-IRESは全く機能せず、むしろ翻訳抑制的に働いた。これらのことから、当初はEMCV-IRESは植物細胞においては機能しないと推定されていた。しかし、一過的発現系や形質転換植物を用いたin vivo実験系においてEMCV-IRESの挿入による翻訳効率上昇が観察され、植物細胞内でEMCV-IRESが機能することが判明した(非特許文献1)。
【0004】
また、植物ウイルスの1種であるアブラナ感染性トバモウイルス(crucifer-infecting tobamovirus(crTMV))は1分節のプラス鎖1本鎖RNAである。ゲノムRNAの5’側から複製酵素、移動タンパク質(movement protein(MP))、コートタンパク質(coat protein(CP))をコードするORFを持っており、各ORFはそれぞれ数塩基ずつ重なっている。そのため、最も上流に存在する複製酵素はゲノムRNAから翻訳されるが、その際MPおよびCP遺伝子は翻訳されないメカニズムとなっている。このcrTMVについては、crTMVゲノムRNAから生じたサブゲノムRNAの5’UTR部分を2種類の遺伝子のORF間に挿入したバイシストロニックベクターを用いた実験が行われ、sgRNAI2とmonocistronic sgRNAの5’UTRがin vitro翻訳実験およびタバコプロトプラストにおける一過的遺伝子発現実験において下流遺伝子を翻訳すること、すなわち各サブゲノムの5’UTRにIRES配列が存在することが証明された(非特許文献2および非特許文献3)。
【0005】
さらに、crTMV以外の植物ウイルスでは、tobacco etch virus(TEV)のゲノムRNA(非特許文献4)やhibiscus chlorotic ringspot virus(HCRSV)のサブゲノムRNAの5’UTR(非特許文献5)などにおいてもIRES配列が存在するという報告がある。また、植物ウイルス由来IRESの長さは100塩基前後であり、ピコルナウイルス由来のIRESよりも非常にサイズが小さいのが特徴的である。
【非特許文献1】Urwin, P., Yi, L., Martin, H., Atkinson, H., and Gilmartin, P.M. (2000). Functional characterization of the EMCV IRES in plants. Plnat J. 24, 583-589.
【非特許文献2】Ivanov, P.A., Karpova, O.V., Skulachev, M.V., Tomashevskaya, O.L., Rodionova, N.P., Dorokhov, Y.L., and Atabekov, J.G. (1997). A tobamovirus genome that contains an internal ribosome entry site functional in vitro. Virology 232, 32-43.
【非特許文献3】Skulachev, M.V., Ivanov, P.A., Karpova, O.V., Korpela, T., Rodionova, N.P., Dorokhov, Y.L., and Atabekov, J.G. (1999). Internal initiation of translation directed by the 5’-untranslated region of the tobamovirus subgenomic RNA I2. Virology 263, 139-154.
【非特許文献4】Niepel, M., and Gallie, D.R. (1999). Identfiation and characterization of the functional elements within the tobacco etch virus 5’leader required for cap-independent translation. J. Virol. 73, 9080-9088.
【非特許文献5】Koh, D.C.-Y., Wong, S.-M., and Liu, D.X. (2003). Synergism of the 3’-untranslated region and an internal ribosome entry site differentially enhances the translation of a plant virus coat protein. J. Biol. Chem. 278, 20565-20573.
【発明の開示】
【発明が解決しようとする課題】
【0006】
このように、IRESが植物細胞内において機能しmRNAにおける多重的な翻訳領域を翻訳することは既に明らかとなっているが、それらの性能は必ずしも満足なものではない。そこで、本発明は、IRESを介した翻訳効率を向上させるキャップ非依存性RNA翻訳効率制御要素を提供することを1つの目的とする。また、本発明は、IRESを介して翻訳効率を向上させるキャップ非依存性RNA翻訳制御要素を利用したキャップ非依存性RNA翻訳開始要素、発現ベクター、形質転換体、遺伝子の発現方法、および遺伝子産物の製造方法を提供することを他の1つの目的とする。
【課題を解決するための手段】
【0007】
本発明の一つの形態によれば、翻訳効率制御要素キャップ非依存性RNA翻訳効率の制御要素であって、少なくとも1つのステム−ループ構造を形成可能なポリリボヌクレオチドであり、該ポリリボヌクレオチドの近傍に接続される内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させるポリリボヌクレオチドをコードするポリヌクレオチドである、翻訳効率制御要素が提供される。この形態においては、前記ステム−ループ構造のステムは6塩基対以上30塩基対以下の二重鎖または部分二重鎖であることが好ましい。また、本発明の他の一つの形態によれば、キャップ非依存性RNAの翻訳効率の制御要素であって、配列番号1に記載の塩基配列の第13位〜第34位の塩基配列を有するポリヌクレオチドであることが好ましい態様であり、配列番号2に記載の塩基配列の第13位〜第65位の塩基配列を有するポリヌクレオチドであることが好ましい態様である。
【0008】
これらの形態の翻訳制御要素においては、前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有することが好ましい態様であり、また、植物ウイルスゲノムにコードされる内部リボソーム導入部位であることが好ましい態様であり、前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位であることがさらに好ましい態様である。これらのいずれかの翻訳制御要素は、植物体におけるキャップ非依存性RNAの翻訳効率制御要素であることが好ましい態様である。
【0009】
また、本発明の他の一つの形態によれば、キャップ非依存性RNA翻訳開始要素であって、上記いずれかのキャップ非依存性RNAの翻訳効率制御要素を含むポリヌクレオチド鎖と、該翻訳効率制御要素によってキャップ非依存性RNA翻訳効率を向上させる内部リボソーム導入部位をコードするポリヌクレオチド鎖と、を備える、翻訳開始要素が提供される。この形態においては、前記翻訳効率制御要素は、前記内部リボソーム導入部位によるキャップ非依存性RNA翻訳効率を20倍以上向上させるものであることが好ましい態様であり、前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有することが好ましい態様である。さらに、前記内部リボソーム導入部位は、植物ウイルスゲノムにコードされる内部リボソーム導入部位であることが好ましい態様であり、さらに好ましくは、前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位である。また、本発明のキャップ非依存性翻訳開始要素は、配列番号3、配列番号4、配列番号5および配列番号6のいずれかに記載の塩基配列を有することが好ましい。
【0010】
本発明のさらに他の一つの形態によれば、発現ベクターであって、真核細胞で動作可能なプロモーターと、該プロモーターの下流側に結合された上記いずれかのキャップ非依存性RNA翻訳開始要素とを備える、発現ベクターが提供される。この形態においては、前記プロモーターによって作動可能に結合されるとともに前記キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合され、タンパク質のコード領域を有するポリヌクレオチド鎖を備えることが好ましい態様であり、前記プロモーターによって作動可能に結合されたタンパク質のコード領域を含むポリヌクレオチド鎖を備える前記プロモーターによって作動可能に結合されキャップ依存的に翻訳されるタンパク質のコード領域を含むポリヌクレオチド鎖を備えることも好ましい態様である。また、プラスミドベクターであることも好ましい態様であり、植物細胞用であることが好ましい態様である。
【0011】
本発明の他の一つの形態によれば、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された上記いずれかのキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体が提供される。この形態においては、形質転換体は植物細胞であることが好ましく、より好ましくは植物体である。
【0012】
また、本発明の他の一つの形態によれば、遺伝子の発現方法であって、上記いずれかのキャップ非依存性RNA翻訳開始要素の下流に該翻訳開始要素によって翻訳開始可能に結合された所望の遺伝子をコードする翻訳領域を備える外来ポリヌクレオチドを保持することにより、前記翻訳領域にコードされた遺伝子を発現させる工程を備える、発現方法が提供される。この形態においては、前記形質転換体は植物体であることが好ましい態様である。
【0013】
さらに、本発明の他の一つの形態によれば、形質転換体を用いた遺伝子産物の製造方法であって、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された上記いずれかのキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体を増殖あるいは生育させて、前記コード領域にコードされた前記タンパク質を製造する工程を備える、遺伝子産物の製造方法が提供される。この形態においては、前記形質転換体は植物体であることが好ましい態様である。また、本発明の他の一つの形態によれば、内部リボソーム導入部位の上流側に少なくとも一つのステム−ループ構造を有するポリヌクレオチドを挿入することにより、前記内部リボソーム導入部位を介した翻訳開始効率を上昇させる方法も提供される。この形態においては、前記ポリリボヌクレオチドは、上記翻訳効率制御要素におけるポリリボヌクレオチドであることが好ましい。
【発明を実施するための最良の形態】
【0014】
本発明のキャップ非依存性翻訳効率制御要素は、少なくとも1つのステム−ループ構造を形成可能なポリヌクレオチドであり、内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させることができるものである。本発明者らは、これまでの研究からシロイヌナズナ以外の植物細胞においてはEMCV-IRESよりもcrTMVのIRES(MP-IRES及びCP-IRES)の活性は低い傾向が観察されていることに着目した。さらに、EMCV-IRES(574塩基)は9つのStem-loopを含むが(Witherell et al., 1995)、73塩基のMP-IRESは1つ(Skulachev et al., 1999)、148塩基のCP-IRESは2つのStem-loopを含む(Ivanov et al., 1997)こと、およびEMCV-IRESに比べてMP-IRESおよびCP-IRESは小型で単純な構造をとっていることから、この構造の差異に着目した。そこで、比較的小型なMP-IRESおよびCP-IRESの直前に安定な高次構造を形成するステム−ループ構造を挿入したところ、これらのIRESの従前の翻訳効率を、予想を超えて向上させうることを見出し、本知見に基づき本発明を完成したものである。
【0015】
こうしたキャップ非依存性翻訳制御要素は、内部リボソーム導入部位(IRES)のキャップ非依存性のRNA翻訳効率を向上させることができるため、IRESを介して本制御要素により翻訳効率が向上された所望のタンパク質のコード領域を有するポリヌクレオチドを保持する宿主細胞では、キャップ非依存性翻訳の制御下で所望のタンパク質を効率よく発現させることができるようになる。また、キャップ非依存性翻訳の制御下でポリシストロニックにタンパク質を発現させることができるようになる。こうした遺伝子発現形態は、遺伝子の高発現系の構築に有用であるとともに宿主細胞におけるキャップ依存性mRNA翻訳を補充あるいは代替できる遺伝子発現系の構築にも有用である。
【0016】
以下、本発明の最良の実施形態として、キャップ非依存性翻訳効率制御要素について説明するとともに、該制御要素を利用したキャップ非依存性RNA翻訳開始要素、発現ベクター、形質転換体、遺伝子の発現方法、および遺伝子産物の製造方法について併せて説明する。
【0017】
(キャップ非依存性RNA翻訳効率制御要素)
本制御要素の好ましい形態は、少なくとも1つのステム−ループ構造を形成可能な配列を有するポリリボヌクレオチドをコードするポリヌクレオチドである。ステム−ループ構造は、ウイルスゲノムRNAやmRNAが形成されたときなど一重鎖の状態のポリリボヌクレオチドにおいて形成される。本制御要素は、機能時においてはポリリボヌクレオチドの形態を採り、RNA分子あるいはRNA配列の部分であるが、本明細書においては、これらのRNA分子あるいはRNA配列を意味する他、これらのRNA分子あるいはRNA配列をコードするDNA分子もしくはRNA分子もしくはDNA配列もしくはRNA配列の部分を意味するものとして用いることとする。したがって、本制御要素におけるポリヌクレオチド鎖は、RNAでもDNAで構成されていてもよい。また、本制御要素は、通常、+鎖RNAウイルスなどに由来するRNAのコピーあるいはcDNAコピーとして得ることができる。
【0018】
ステム−ループ構造は、相補的塩基対からなる二重鎖のポリヌクレオチドからなるステムと、ステムを結合する端部であるループを有していればよい。なお、ループは、互いに塩基対を形成しない配列を有する一重鎖からなるループのみならず実質的にループを形成しない端部であってもよい。したがって、本発明におけるステム−ループ構造は、ヘヤピン構造を含んでいる。本制御要素におけるステム−ループ構造の形成は、本制御要素のポリヌクレオチド鎖が自己相補性を有することにより、該自己相補性を有する鎖部分が塩基対を形成することによりステムが形成される。したがって、本制御要素は、少なくともステムを形成可能な一対の自己相補性鎖部位を有していればよく、さらに、該自己相補性鎖部位に加え、該部位間に介在されるループを形成可能な自己相補性を有しない(あるいは自己相補性がほとんどない)非自己相補性鎖部位を有していてもよい。
【0019】
ステムを形成可能な自己相補性鎖部位は、自己相補的塩基間で結合するのに十分な長さを有していることが好ましいが、例えば、合わせて合計で50ヌクレオチド残基以上100ヌクレオチド残基以下の範囲とすることができる。また、自己相補性部位が自己塩基対合してステムを形成したときには、5塩基対以上35塩基対以下の二重鎖または部分二重鎖を形成可能とすることができる。形成する塩基対が少なすぎるとステムの安定性が低く、安定したステム−ループ構造を形成しにくく、塩基対が多すぎるキャップ依存性翻訳やキャップ非依存性翻訳の双方を阻害するおそれがあるからである。好ましくは、一対の自己相補性部位は6塩基対以上30塩基対以下の塩基対合が形成可能である。塩基対合は、より好ましくは、7塩基対以上25塩基対以下であり、さらに好ましくは8塩基対以上22塩基対以下である。
【0020】
また、自己相補性鎖部位を構成するヌクレオチド鎖の構成塩基は、本制御要素がDNAとしたとき、グアニン(G)およびシトシン(C)の比率がアデニン(A)およびチミン(T)より多いことが好ましく、より好ましくはGC含量が54%以上である。
【0021】
ループを形成可能な非自己相補性鎖部位は、ステムの二重鎖の安定性を阻害しないことが好ましく、2ヌクレオチド残基以上であることが好ましく、より好ましくは4ヌクレオチド残基以上である。また、上限は、好ましくは20ヌクレオチド残基程度であり、より好ましくは10ヌクレオチド残基程度である。
【0022】
少なくとも自己相補性部位を備えるステム−ループ構造部分は、全体として20以上60以下のヌクレオチド残基からなることが好ましい。また、本制御要素は、ステム−ループ構造部分以外の部分、すなわち、ステムのループに連続しない3'末端およびの5’末端の部分を有することができる。この両テール部分は、本制御要素の上流あるいは下流に結合されるIRESや翻訳領域との介在配列となり、IRESや翻訳領域との間で適切な距離や位置関係を形成するのに寄与することができる。このような介在配列としては、3’側には20残基以上23残基程度有することが好ましく、5’側には10残基以上15残基以下程度有することが好ましい。
【0023】
本制御要素としては、配列番号1に記載の塩基配列ならびにそのホモログおよび配列番号2に記載の塩基配列ならびにそのホモログを挙げることができる。ここで、ホモログとは、本来の配列とは異なるが類似の折りたたみ構造を形成でき、本来の配列の有するキャップ非依存性翻訳効率向上機能の全部を損なうことなく有効なキャップ非依存性翻訳効率向上機能を有する変異体をいうものとする。通常、ホモログは、本来の配列と少なくとも70%以上の相同性を有し、好ましくは、80%以上、より好ましくは90%以上、一層好ましくは95%以上の相同性を有している。また、ホモログは、本来の配列に対して1あるいは2以上の塩基の置換、欠失および/または挿入を有している。なお、本明細書において、DNAなどの核酸の相同性については、なお、DNAの塩基配列のホモロジーは、遺伝子解析プログラムBLAST(http://blast.genome.ad.jp),FASTA(http://fasta.genome.ad.jp/SIT/FASTA.html)などによって決定することができる。
【0024】
本制御要素においてステム−ループ構造を形成可能な部位としては、配列番号1に記載の塩基配列の第13位〜34位の塩基配列あるいはそのホモログを挙げることができる。また、他の好ましいステム−ループ構造は、配列番号2に記載に塩基配列の13位〜65位の塩基配列あるいはそのホモログを挙げることができる。
【0025】
本制御要素は、IRESを介してキャップ非依存性翻訳効率を向上させることができる。本制御要素は、IRESに対して好ましくはその上流に位置される。好ましくは、IRESの直前に本制御要素を結合することが好ましい。IRESとの本制御要素との間にヌクレオチド残基が多いと本制御要素によるキャップ非依存性翻訳効率の向上効果が低下するおそれがあるからである。
【0026】
(IRES)
本制御要素を適用してキャップ非依存性RNA翻訳効率を向上させるIRESは、キャップ非依存性RNA翻訳が知られているウイルスや細胞などのコード領域の5’UTRあるいはその一部にコードされている。なお、IRESは、RNAあるいはmRNA上において内部リボソーム導入部位として機能するものであるため、IRESとして機能する状態のポリヌクレオチドのタイプはRNAであり、IRESは、本来的にRNA分子の一部分あるいはRNA配列である。なお、本発明の本制御要素、開始要素およびベクター等において、この語を用いるときには、IRESとして機能するRNA分子の一部分あるいはRNA配列を意味する他、これらをコードするポリヌクレオチドとして表現するものとする。したがって、IRESはDNAであってもRNAであっても、
【0027】
本制御要素を適用するのに好ましいIRESとしては、例えば、1以上8以下のステム−ループ構造を有するものを挙げることができる。かかるIRESにおいては、ステム−ループ構造を追加することでキャップ非依存性翻訳効率を向上させることができる。ステム−ループ構造は好ましくは、6以下であり、より好ましくは4以下であり、さらに好ましくは2以下である
【0028】
また、本制御要素を適用するIRESは、おおよそ70ヌクレオチド残基以上300ヌクレオチド残基以下程度の長さを有していることが好ましい。本制御要素は、比較的単純あるいはサイズの小さいIRESに対して本制御要素は有効に作用する。
【0029】
本制御要素を適用するIRESは、RNAウイルスゲノムにコードされる該ウイルスゲノム由来のIRESであることが好ましい。こうしたIRESは、本制御要素によってキャップ非依存性翻訳効率を向上させやすいからである。なかでも植物RNAウイルスであり、例えば、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)やタバコエッチウイルス(tobacco etch virus(TEV))ハイビスカスクロロティックリングスポットウイルス(hibiscus chlorotic ring spot virus(HCRSV))が有するIRESが好ましいものとして挙げられる。特に、アブラナ感染性トバモウイルスの移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子のIRESを用いることができる。
【0030】
(キャップ非依存性RNA翻訳開始要素)
こうした本制御要素は、IRESと組み合わされて一つのキャップ非依存性翻訳開始要素を構成することができる。本開始要素におけるIRESとしては既に述べたIRESを好ましく用いることができ、また、本制御要素とIRESとの位置関係についても既に述べた通りである。本開始要素は、用いる本制御要素がIRESと組み合わされることにより該IRES単独の場合のキャップ非依存性翻訳効率を10倍以上の向上させることができるIRESを備えることが好ましい。10倍以上の翻訳効率向上によりキャップ非依存性翻訳による遺伝子の発現や遺伝子産物の製造に有効に寄与できるからである。好ましくは20倍以上である。より好ましくは40倍以上である。
【0031】
本開始要素としては、配列番号3に記載の塩基配列および配列番号4に記載の塩基配列を有するポリヌクレオチドを挙げることができる。なお、配列番号3における65位〜134位の塩基配列および配列番号4における96位〜165位の塩基配列は、アブラナ感染性トバモウイルスの移動タンパク質をコードする5'UTRに存在するIRESである。また、本開始要素としては、配列番号5および配列番号6に記載の塩基配列を有するポリヌクレオチドを挙げることができる。配列番号5における65位〜216位の塩基配列および配列番号6における96位〜247位の塩基配列は、同ウイルスのコートタンパク質のコード領域の5'UTRに存在するIRESである。なお、本開始要素として好ましいポリヌクレオチドの塩基配列は、これらの塩基配列のホモログも包含している。
【0032】
こうした本制御要素や本開始要素は、化学合成法、PCR法等の当業者に周知の如何なる方法によっても製造することができる。これらの方法によって得られるこれらの要素は、は塩基配列決定用ゲルを用いたゲル濾過等の当業者に周知の方法により精製されることが好ましい。なお、好ましい制御要素あるいは開始要素として挙げた配列はいずれもDNA配列であるが、これらの各DNA配列に対応するRNA配列(これらのDNA配列によってコードされるRNA配列)を有するポリヌクレオチドも本発明において好ましいポリヌクレオチドである。
【0033】
(発現ベクター)
本制御要素および本開始要素は、所望のタンパク質を宿主細胞内で発現させるための発現ベクターの構成部分としての形態で使用することができる。発現ベクターは、真核細胞において動作可能なプロモーターと、この下流側に結合された少なくとも1あるいは2以上の本開始要素を備えることができる。こうした発現ベクターに少なくとも本開始要素によって翻訳開始可能に所望のコード領域を結合し、この発現ベクターを宿主細胞に導入することで、キャップ非依存性翻訳により所望のタンパク質を産生させることができる。また、2以上の本開始要素のそれぞれの下流に前記プロモーターによって作用可能であってかつ各開始要素によって翻訳開始可能にタンパク質のコード領域を結合させることで、ポリシストロン性の発現ベクターが得られる。
【0034】
発現ベクターにおいて、前記プロモーターにより作動可能に第1のタンパク質のコード領域を含む第1のポリヌクレオチド鎖を結合し、該第1のポリヌクレオチドと同時に転写可能であって本開始要素により翻訳開始可能に第2のタンパク質のコード領域を含む第2のポリヌクレオチド鎖を結合して、この発現ベクターを宿主真核細胞に導入することで、真核細胞のキャップ依存性翻訳による第1のタンパク質の産生と、キャップ非依存性翻訳による第2のタンパク質の産生とを同時に達成できる。第2のタンパク質のコード領域の下流には、さらに、順次追加の本開始要素を結合することで第3以降のタンパク質のコード領域を同様にして結合することができる。各コード領域がコードするタンパク質は同一であってもよいし異なっていてもよい。すなわち、本発現ベクターによれば、キャップ依存性およびキャップ非依存性の翻訳機構により一つのmRNAから2以上のタンパク質が発現可能、換言すれば、ポリシストロニックな発現が可能となっている。本開始要素は、本開始要素によって翻訳可能に結合させた所望のコード領域を効率よく翻訳できるため、宿主のキャップ依存性翻訳機構によらないで所望のタンパク質を高レベルで発現させることが可能となる。したがって、例えば、第1のタンパク質と第2のタンパク質とを同じくすれば、結果として一つのプロモーターの制御下でより多くのタンパク質を発現可能となり、第1のタンパク質と第2のタンパク質とが異なるものであれば、異種のタンパク質を一つのプロモーターで発現可能となる。こうした発現ベクターは、特に、一つの好ましい表現型を構成するのに複数種類のタンパク質が必要なときにおいて好ましい。さらに、例えば、第1のタンパク質を目的のタンパク質とし、第2のタンパク質を選択マーカーとするなど、選択マーカーを同一プロモーターの作動下で好ましくはキャップ非依存的に翻訳開始することで、目的遺伝子を発現するクローンを容易に選択できるようになる。
【0035】
発現ベクターによれば、本開始要素を構成する本制御要素の種類と個数および/またはIRESの種類を適宜変更することで、従来、IRES単独ではキャップ非依存性翻訳効率が十分に得られなかった真核細胞においてもキャップ非依存性翻訳効率を向上させることができる。特に、IRESとして植物ウイルス由来のIRESやステム−ループ構造を形成しないIRESや300ヌクレオチド残基程度以下の小さいIRESをコードするポリヌクレオチドを用いる場合に、本制御要素を含む本開始要素は有効である。この結果、本発現ベクターによれば、IRESによってキャップ非依存性翻訳が可能な真核細胞、特に植物細胞の種類を拡張でき、また、これらの細胞におけるIRESによるキャップ非依存性翻訳の効率を向上させることができる。
【0036】
発現ベクターに組み込まれるコード領域がコードするタンパク質としては、医薬用途のあるペプチドあるいはタンパク質、栄養価が高められたタンパク質、殺虫性ペプチドあるいはタンパク質、植物病原体等に対する抗菌性ペプチドあるいはタンパク質、プロテアーゼ、アミラーゼ、あるいは植物細胞内における糖合成経路、タンパク質合成経路における酵素タンパク質、ある種の酵素阻害剤であるペプチドあるいはタンパク質とすることができる。
【0037】
本発現ベクターにおける真核細胞において動作可能なプロモーターは、特に限定しないで、必要に応じ宿主真核細胞において構成的、誘導的、時期特異的あるいは組織特異的なプロモーターを用いることができる。植物細胞に用いる発現ベクターとしては、例えば、CaMV35Sプロモーター、エロンゲーションファクター1α遺伝子のプロモーター(EF1αプロモーター)などの植物における構成プロモーター、光誘導プロモーターなどの誘導的プロモーターを用いることができる。また、本発現ベクターにおいては、最も3'側に位置された最後のタンパク質コード領域の3’側にはターミネーターを備えることが好ましい。ターミネーターとしては、NOSターミネーターなどを使用できる。宿主細胞で使用するプロモーターやターミネーターは、当業者であれば公知物を適宜選択して使用し、あるいは公知物を改変して使用することができる。
【0038】
本発現ベクターには、必要に応じて、エンハンサーなどのシスエレメント、人工イントロン、シグナルペプチドなどを連結することができる。また、本発現ベクターにおいて使用する選択マーカーは、特に限定しないが、緑色蛍光タンパク質(GFP)、ウミシイタケルシフェンラーゼ(Rluc)、ホタルルシフェラーゼ(Fluc)など細胞に識別可能な色を付与する選択マーカーの他、薬剤抵抗性遺伝子、栄養要求性遺伝子などを始めとする公知の各種選択マーカー遺伝子を利用できる。なお、本発現ベクターは、予め、いずれかのコード領域、好ましくは、本開始要素によって翻訳可能に備えられていることが好ましい。例えば、最も下流側に位置されるコード領域にコードされていることが好ましい。また、本発現ベクターには、前記プロモーターや各開始要素の下流に各コード領域を含むポリヌクレオチド鎖を挿入可能なマルチクローニングサイトを備えることもできる。
【0039】
本発現ベクターは、染色体外で自律複製できるものの他染色体組込み型ベクターとして構築されていてもよい。また、形態としては、線状の断片、プラスミド、コスミド、ファージ、ウイルス、トランスポゾン、酵母人工染色体(YAC)や植物人工染色体(PAC)、哺乳類人工染色体(MAC)等を採ることができる。
【0040】
(形質転換体およびその作製)
本発現ベクターを、植物細胞、動物細胞、昆虫細胞、酵母、真菌などの真核細胞に導入する。好ましい宿主細胞は、産生しようとするタンパク質の種類や使用するIRESによって適当なものが選択される。本発現ベクターについては、好ましくは植物細胞である。発現ベクターの導入方法は、トランスフェクション法、接合法、プロトプラスト融合、エレクトロポレーション法、リポフェクション法、酢酸リチウム法、パーティクルガン法、リン酸カルシウム沈殿法、アグロバクテリウム法、PEG法、直接マイクロインジェクション法等の各種の適切な手段のいずれかを採用できる。発現ベクターの導入後、その宿主細胞は、用いた選択マーカーに応じた培地で培養することができ、選択マーカーの種類に応じた選別することで、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された本開始要素と、前記プロモーターによって作動可能であって本開始要素によって翻訳開始可能に結合された所望のコード領域を有するポリヌクレオチド鎖と、を保持する形質転換体を得ることができる。
【0041】
発現ベクターが宿主細胞に導入されたか否か、あるいは染色体上に保持されているか否かの確認は、PCR法やサザンハイブリダイゼーション法により行うことができる。例えば、形質転換体からDNAを調製し、導入部位特異的プライマーによりPCRを行い、PCR産物について、電気泳動において予期されるバンドを検出することによって確認できる。あるいは蛍光色素などで標識したプライマーでPCRを行うことでも確認できる。これらの方法は、当業者において周知である。
【0042】
特に、植物の形質転換体を得るのに際して、本発現ベクターが導入される細胞としては、植物体に再生可能なあらゆる種類の形態の植物細胞を含めることができる。例えば、培養細胞、プロトプラスト、苗条原基、多芽体、毛状根、カルス等が挙げられる。また、形質転換される植物種としては、特に、限定しないで単子葉植物でも双子葉植物でもよいが、農作物あるいは園芸用作物であることが好ましい。たとえば、イネ、オオムギ、コムギ、ライムギ、トウモロコシ、サトウキビなどの穀類、じゃがいも、さつまいもなどの根茎又は塊根を形成する作物、インゲンマメ、ソラマメ、エンドウなどのマメ科植物、ピーナッツ、ごま、ナタネ、綿実、ヒマワリ、サフラワーなどの種子作物、リンゴ、メロン、ブドウなどの果実を有する作物、トマト、ナスなどの作物、各種花卉植物であることが好ましい。植物の形質転体は、所定の再生工程を実施することで細胞を植物体に変換することができる。再生の方法は、植物の種類によって異なるが、各種公知の方法を使用できる。
【0043】
こうして得られる形質転換体は、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された本開始要素と、前記プロモーターによって作動可能であって本開始要素によって翻訳開始可能に結合された所望のコード領域を有するポリヌクレオチド鎖と、からなるポリシストロンを、染色体内あるいは染色体外で保持していてもよい。また、形質の発現は、一時的であっても安定的であってもよい。
【0044】
また、形質転換体としては、特に限定しないで全ての種類、形態の細胞を包含し、各種細胞の他、動植物個体、その動植物個体を構成しうる真核細胞、およびその一部である組織や器官ならびに生殖細胞を含む。また、ウイルス粒子も包含する。さらに、また植物個体の一部であるその繁殖媒体(種子、根茎、果実、切穂等)も包含する。
【0045】
形質転換体を、適切な培養条件下で培養し、増殖させることにより、形質転換体は、細胞内、細胞表面、あるいは細胞外にポリペプチドあるいはタンパク質を製造する。適当な方法でこのタンパク質等を回収、精製することができる。
【0046】
本発明のキャップ非依存性翻訳開始要素、またこれを有する発現ベクターによれば、mRNA上のIRESの上流側に少なくとも一つのステム−ループ構造を有するポリリボヌクレオチドを挿入された構造が得られる。この結果、このmRNAにおいては、IRESを介した翻訳開始効率が上昇される。したがって、本発明のさらに別の形態として、IRESの上流側に少なくとも一つのステム−ループ構造を有するポリリボヌクレオチドを挿入することにより、IRESを介した翻訳開始効率を上昇させる方法が提供される。また、本発明のさらに他の形態として、IRESの上流側に少なくとも一つのステム−ループ構造を有するリボヌクレオチド配列を備えるRNA配列あるいは断片も提供されることになる。このようなRNA配列やRNA断片は、そのまま無細胞翻訳系等において用いられる。なお、これらのRNA配列やRNA断片は、IRESの下流にタンパク質のコード領域を備えることもできる。
【実施例1】
【0047】
以下、本発明を実施例を挙げて説明するが、これらの実施例は本発明を説明するものであって、本発明を限定するものではない。
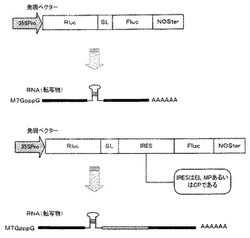
実施例1では、CaMV 35Sプロモーター・NOSターミネーターカセット内に二種のルシフェラーゼタンパク質(上流遺伝子としてウミシイタケルシフェラーゼ(Rluc)、下流遺伝子としてホタルルシフェラーゼ(Fluc))を有し、これらのコード領域間にIRESを有するバイシストロニック発現ベクターを構築するとともに、この発現ベクター中のIRESの直前に配列番号1に記載の塩基配列を有するポリヌクレオチド鎖である8塩基対のステムと6塩基のループをもつステム−ループ(以下、単にSLというものとする。)を形成可能なSL配列を挿入したSL挿入バイシストロニック発現ベクターを構築し、SLのキャップ非依存性RNA翻訳効率向上性能を確認した。図1には、本実施例で作製した各種のバイシストロニック発現ベクターおよび該発現ベクターから転写されるmRNAの構造の一例を示す。
【0048】
(1)バイシストロニック発現ベクターの作製
(a)35S::Flucは、pSP-luc+(Promega社)のFluc断片をpBI221(Clontech社)のGUSコード領域と置換したプラスミドである(Matsuo et al., 2001)。
(b)pR-Fベクターの作製
pR-Fベクターは、CaMV 35Sプロモーター・NOSターミネーターカセット内に上流遺伝子としてウミシイタケルシフェラーゼ(Rluc)、下流遺伝子としてホタルルシフェラーゼ(Fluc)のORFを連結させたプラスミドである。まず、pRL-null(Promega社)をNdeI及びXbaI処理によりRluc断片を切り出し、pSP-Luc+(Promega社)のNdeI及びNheI切断部位にサブクローニングした。次に、このプラスミドをXbaI処理し、平滑末端化した後、NheI処理することによって得られた断片を、pBI221(Clontech社)の平滑末端化したSacI及びXbaI切断部位にサブクローニングし、本ベクターとした。
【0049】
(c)pF-Rベクターの作製
pF-Rベクターは、CaMV 35Sプロモーター・NOSターミネーターカセット内に上流遺伝子としてFluc、下流遺伝子としてRlucのORFを連結させたプラスミドである。pSP-luc+をBglII及びEcoRI処理により切り出した断片をpRL-nullのBglII及びEcoRI切断部位にサブクローニングした。このプラスミドをBglII及びXbaI処理によって切り出した断片をpSP-luc+のBglII及びXbaI切断部位にサブクローニングすることによってpSP-Rlucを作製した。次に、pSP-RlucをNheI及びEcoRI処理によりRluc断片を切り出し、pSP-luc+のXbaI及びEcoRI切断部位にサブクローニングしてpSP-Fluc-Rlucを作製した。さらに、pSP-Fluc-RlucをXbaI処理し、平滑末端化した後、NheI処理することによって得られた断片を、pBI221の平滑末端化したSacI及びXbaI切断部位にサブクローニングして、本ベクターとした。
【0050】
(d)pR-spacer-Fの作製
pR-spacer-Fは、EMCV-IRESと同等の長さをもつ任意な配列を挿入したプラスミドである。pBI221のβ-グルクロニダーゼ(GUS)コード領域をpEGFP-C1(Clontech社)から得られたEGFP断片と置き換えて作製した221 EGFP-C1を利用した。221 EGFP-C1をNcoIで処理し、平滑末端化した後、BglII処理することによって得られたEGFP断片を35S::R-Fの平滑末端化したAvrII及びBglII切断部位にサブクローニングし、本ベクターとした。
【0051】
(2)植物ウイルス由来IRES挿入バイシストロニック発現ベクターの作製
(a)pR-MP-F(0)ベクターの作製
pR-MP-F(0)ベクターは、pR-FベクターのORF間に植物ウイルスであるアブラナ感染性トバモウイルス(crucifer-infecting tobamovirus(crTMV))のサブゲノムRNA I2の5’UTRに存在するIRESのうち領域IIIのみ(MP-IRES)を挿入したプラスミドである。表1に示す、5’IRESmpと3’IRESmp(0)のオリゴヌクレオチドプライマー(配列番号7、8)の組み合わせを用いてPCRによりMP-IRES断片を合成した。PCR反応はEx Taq(TaKaRa社)を用いて行った。各オリゴヌクレオチドを50pmolずつ加えた全量50μLの反応液を94℃で5分間変性した後、30℃で10分-72℃で10分の反応を1サイクル反応させた。この反応液を5%ポリアクリルアミドゲルで電気泳動した後に予測される長さのバンドを回収し、BglII及びAvrII処理し、前記pR-FベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【表1】

【0052】
(b)pF-MP-R(0)ベクターの作製
pF-MP-R(0)ベクターは、pF-RベクターのORF間にcrTMVのサブゲノムRNA I2由来のMP-IRESを挿入したプラスミドである。上記と同様にして得られたMP-IRES断片をBglII及びAvrII処理し、pF-RベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0053】
(c)pR-CP-F(0)ベクターの作製
pR-CP-F(0)ベクターは、pR-FベクターのORF間にcrTMV monocistronic subgenomic RNAの5’UTRに存在するCP-IRESを挿入したプラスミドである。表1に示すIREScp-1、IREScp-2、IREScp-3のオリゴヌクレオチドプライマー(順に配列番号9、10および11)の組み合わせを用いてPCRによりCP-IRES断片を合成した。PCR反応はEx Taq(TaKaRa社)を用いて行った。IREScp-1及びIREScp-2を50pmolずつ加えた全量50μLの反応液を94℃で5分間変性した後、30℃で10分-72℃で10分の反応を1サイクル反応させた。さらに、この反応液に、表1に示すオリゴヌクレオチドプライマーIREScp-3(配列番号11)及びIREScp-4(配列番号12)をそれぞれ300pmol添加し、94℃で5分間変性した後、30℃で10分-72℃で10分の反応を10サイクル反応させた。この反応液を5%ポリアクリルアミドゲルで電気泳動した後に予測される長さのバンドを回収し、BglII及びAvrII処理し、pR-FベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0054】
(d)pF-CP-R(0)ベクターの作製
pR-CP-F(0)ベクターは、pF-RベクターのORF間にcrTMV monocistronic subgenomic RNA由来のCP-IRESを挿入したプラスミドである。上記と同様にして得られたCP-IRES断片をBglII及びAvrII処理し、pF-RベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0055】
(3)動物ウイルス由来IRES挿入バイシストロニック発現ベクターの作製
(a)pR-EI-F(0)ベクターの作製
pR-EI-F(0)ベクターはpR-FベクターのORF間にピコルナウイルスencephalomyocarditis virus(EMCV)由来のIRESを挿入したプラスミドである。上記35S::FlucをNcoIで処理し、平滑末端化した後、XbaI処理することによって得られたFluc断片を、pIRESneo(Clontech社)のSmaI及びXbaI切断部位にサブクローニングしてEI-Flucを作製した。EI-FlucをXbaI処理し、平滑末端化した後セルフライゲーションし、それをXhoI処理し、平滑末端化した後、BamHI処理することによって得られた断片をp35S-GFP(Clontech社)の平滑末端化したSacI及びBamHI切断部位にサブクローニングした(このプラスミドを35S::EI-Fluc polyAと呼ぶ)。そして、pRL-nullをXbaI処理し、平滑末端化した後、NheI処理することによって得られたRluc断片を、35S::EI-Fluc polyAの平滑末端化したBstXI及びXbaI切断部位にサブクローニングして35S::R-EI-F(BstXI)を作製した。次に、35S::R-EI-F(BstXI)をAvrII処理し、平滑末端化した後セルフライゲーションして得られたプラスミドを鋳型とし、BglII-IRESとIRES-AvrII(0)を用いてPCR反応を行った。PCRはKOD DNA Polymerase(TOYOBO社)を用いて行った。鋳型DNAを30ng、各プライマーを50pmolずつ加えた全量50μLの反応液を94℃で3分間変性した後、94℃で30秒-60℃で7秒-74℃で50秒の反応を25サイクル行い、続けて74℃で5分間反応させた。この反応液を1%アガロースゲルで電気泳動した後に予測される長さのバンドを回収し、BglII及びAvrII処理し、pR-FのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0056】
(b)pF-EI-Rベクターの作製
pF-EI-Rベクターは、pF-RベクターのORF間にピコルナウイルスEMCV由来のIRESを挿入したプラスミドである。pR-EI-FをBglII及びAvrII処理し、得られたEMCV-IRES断片をpF-RのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0057】
(3)SL配列を挿入したバイシストロニック発現ベクターの作製
(a)pR-slCP-Fベクターの作製
pR-slCP-Fベクターは、pR-CP-FベクターのORF間にSL配列を有するベクターである。表1に示すオリゴヌクレオチドプライマー5’-40ntSL(配列番号13)及び3’-40ntSL(配列番号14)を用いてステム−ループ断片を合成した。クレノウフラグメント(TaKaRa社)の付属プロトコールにしたがって、各オリゴヌクレオチドを50pmolずつ加えた全量50μLで反応し、5%ポリアクリルアミドゲルで電気泳動した後に予測される長さのバンドを回収した。得られたステム−ループ断片をBamHI処理し、pR-F、pR-EI-F、pR-MP-F、pR-CP-Fの各ベクターのBglII切断部位にサブクローニングした。Stem-Loop部分をシークエンスによって確認した結果、ほぼ完全な配列を保持しているpR-slCP-Fを本ベクターとし、本ベクターにおけるSL配列を他のベクターへの挿入用SL配列として用いた。
【0058】
(b)pR-Kpn-Fベクターの作製
pR-Kpn-Fベクターは、pR-FベクターのORF間にKpnI部位を挿入したプラスミドである。pR-Fベクターを鋳型とし、表1に示すBgl-Avr-Flucプライマー(配列番号15)及びKpn-Rlucプライマー(配列番号16)を用いてPCRにより合成した。まず、Cloned T4 Polynucleotide Kinase(TaKaRa社)の付属プロトコールにしたがって、各プライマーの5’末端をリン酸化した。PCR反応はKOD -Plus-(TOYOBO社)用いた。鋳型DNAを5ng、リン酸化したプライマーを50pmolずつ加えた全量50μLの反応液を94℃で2分間変性した後、94℃で15秒-55℃で30秒-68℃で7分の反応を25サイクル行い、続けて68℃で5分間反応させた。この反応液を0.8%アガロースゲルで電気泳動した後に予測される長さのバンドを回収し、セルフライゲーションさせ、本ベクターとした。
【0059】
(c)pR-SL-Fベクターの作製
pR-SL-Fベクターは、pR-FベクターのORF間にSL配列を挿入したプラスミドである。pR-slCP-FベクターをPstI及びKpnI処理により切り出した断片をpR-Kpn-FベクターのPstI及びKpnI切断部位にサブクローニングした。このようにして完成したプラスミドはRlucの下流のNheIからFluc直前のBglIIまでの長さが56塩基となり、SL構造は8塩基対のステムを形成可能となっていた。
【0060】
(d)pR-SLEI-F、pR-SLMP-F、pR-SLCP-Fの各ベクターの作製
これらのベクターは、pR-EI-F、pR-MP-F、pR-CP-Fの各ベクターの上流遺伝子RlucとIRESの間にSL配列が挿入されたプラスミドである。pR-SL-FベクターをPstI及びBglII処理により切り出した断片をpR-EI-F(0)、pR-MP-F(0)およびpR-CP-F(0)の各ベクターのPstI及びBglII切断部位にサブクローニングし、各ベクターとした。
【0061】
(e)pF-SL-Rベクターの作製
pF-SL-Rベクターは、pF-RベクターのORF間にSL配列が挿入されたプラスミドである。pR-SL-FベクターをNheI処理し、平滑末端化した後、AvrIIで処理する事によって得られた断片をpF-Rの平滑末端化したBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0062】
(f)pF-SLEI-R、pF-SLMP-R、pF-SLCP-Rの各ベクターの作製
これらのベクターは、pF-EI-R、pF-MP-R、pF-CP-Rの各ベクターの上流遺伝子FlucとIRESの間にSL配列が挿入されたプラスミドである。pF-EI-R、pF-MP-RおよびpF-CP-Rの各ベクターをBglII及びAvrII処理により切り出した断片をそれぞれpF-SL-RのBglII及びAvrII切断部位にサブクローニングし、各ベクターとした。
【0063】
(4)遺伝子の導入
作製した各種ベクターを植物細胞に導入するのにあたり、遺伝子銃(model PDS-1000/He Biolistic Particle Delivery System(Bio-Rad社))を用い、付属のプロトコールにしたがって実験を行った。ヘリウムガスの圧力は1100psiで、1サンプルに対して1回ずつ打ち込んだ。金粒子(直径1.6μm)へのDNAの吸着方法は次に示す。まず、金粒子は50%グリセロールで60mg/mlに調製し、3回の遺伝子導入実験用サンプル当たり金粒子懸濁液25μLを用いた。金粒子懸濁液25μLをチューブに分注し、DNAを2μg、2.5M塩化カルシウム25μL、0.1mMスペルミジン10μLを順次加えて穏やかに撹拌した。1分間静置した後、12000rpmで3秒間遠心し上清を除去した。金粒子を70%エタノール200μL及び100%エタノール200μLで1回ずつ洗浄し、最後に30μLの100%エタノールで懸濁した。そして、この溶液7.5μLを1回の遺伝子導入実験に使用した。導入細胞は、タバコBY-2細胞を用い、培養5日目の該細胞2mlを3%アガープレートの上に1層になるように拡げ、余分な液体を除去した後、十分に乾燥させた上で用いた。遺伝子導入後は27℃で24時間静置した。なお、各ベクターについて3回ずつ遺伝子導入を行った。
【0064】
(5)細胞抽出液の調製
遺伝子導入から24時間経過後、プレート当たり2mlのPassive Lysis Buffer(Promega社)を加えて細胞を回収し、このうち1mlを1.5mlチューブに分注し、15000rpmで1分間遠心して上清を除去した。回収した細胞にPassive Lysis Bufferを250μL加え、電動ホモジェナイザーを用いて10秒間破砕した。これを15000rpmで1分間遠心し、上清を活性測定に使用した。
【0065】
(6)活性測定
活性測定は、デュアルルシフェラーゼ活性測定とし、Dual-Luciferase(商標) Reporter Assay System(Promega社)を用い、付属のプロトコールにしたがって行った。調製した細胞抽出液10μLとLARII溶液50μLを試験管内で混合し、ルミノメーター(Berthold社、Lumat LB9501)を用いて10秒間測定した。この時得られた値がホタルルシフェラーゼ活性であった。続いて、Stop&Glo(商標)溶液50μLを加えてルミノメーターを用いて10秒間測定した。この時得られた値がウミシイタケルシフェラーゼ活性であった。測定された絶対活性は、102〜103(RLU)の間にあった。結果を図2に示す。
【0066】
(7)評価
図2に示すように、タバコBY-2細胞における一過的遺伝子発現実験の結果、上流遺伝子としてRluc、下流遺伝子としてFlucをもつバイシストロニック遺伝子発現ベクターに関しては(図2のAレーン参照)、MP-IRESの直前にSLを挿入することによってFluc(下流遺伝子)翻訳効率は約30倍に、CP-IRESの直前に挿入することによって約20倍に上昇した(図2Aレーン5と6、7と8を比較)。一方、pR-EI-F(0)のEMCV-IRESの直前にSLを挿入してもFluc翻訳効率の有意な増加は得られなかった(図2Aレーン3と4を比較)。また、pR-FのORF間にSLを挿入した場合もFluc翻訳効率に大きな変化は観察されなかった(図2Aレーン1と2を比較)。
【0067】
上流遺伝子としてFluc、下流遺伝子としてRlucをもつバイシストロニック遺伝子発現ベクターに関しても、MP-IRESおよびCP-IRESの直前にSLを挿入することによってRluc翻訳効率は8倍程度高くなった(図2Bレーン5と6、7と8を比較)。しかし、EMCV-IRESの直前にSLを挿入した場合やpF-RのORF間にSLを挿入した場合ではRluc翻訳効率の増加はほとんど見られなかった。
【0068】
以上の結果より、8塩基対のステムと6塩基のループをもつSL構造を形成可能なSL配列を挿入することによってMP-IRES及びCP-IRESを介した下流遺伝子のキャップ非依存性の翻訳効率が上昇することが証明された。さらに、ステム−ループ構造による効果は下流遺伝子の配列よりもIRESの種類によって異なることがわかった。
【実施例2】
【0069】
実施例2では、実施例1で用いたSL配列よりもより長いステムを有するSL配列を挿入したSL挿入バイシストロニック発現ベクターを構築し、SLのキャップ非依存性RNA翻訳効率向上性能を確認した。図3には、本実施例で作製した各種のバイシストロニック発現ベクターおよび該発現ベクターから転写されるmRNAの構造の一例を示す。本実施例で用いたSL配列は、配列番号2に記載の塩基配列を有するポリヌクレオチドであり、22塩基対のステムと6塩基対のループを形成可能なポリヌクレオチドであった。
【0070】
(1)長いステムをもつ長SL配列を挿入したバイシストロニック発現ベクターの作製
(a)pR-longSLCP-Fベクターの作製
pR-longSLCP-Fベクターは、実施例1の(3)SL配列を挿入したバイシストロニック発現ベクターの(c)で作製したpR-SLCP-F(0)を元にして、より長い22塩基対のステムを形成可能なSL配列を挿入したプラスミドである。pR-SLCP-F(0)ベクターをNheI処理し、平滑末端化した後、EcoRIで処理する事によって得られた断片を、pR-SLCP-F(0)の平滑末端化したApaI及びEcoRI切断部位にサブクローニングし、本ベクターとした。このようにして完成したプラスミドベクターはRlucの下流のNheIからCP-IRES直前のBglIIまでの長さが87塩基であり、22塩基対のステムを形成可能となっていた。
【0071】
(b)pR-longSL-Fベクターの作製
pR-longSL-Fベクターは、pR-FベクターのORF間に長ステムの長SL配列を挿入したプラスミドである。pR-longSLCP-FベクターをBglII及びEcoRI処理により切り出した断片をpR-SL-FのBglII及びEcoRI切断部位にサブクローニングし、本ベクターとした。
【0072】
(2)遺伝子導入およびデュアルルシフェラーゼ活性測定に基づく評価
作製した各ベクターおよび実施例1で作製したpR-SLEI-F、pR-SLMP-F、pR-SLCP-FおよびpR-SL-Fの各ベクターについて、実施例1の(4)遺伝子の導入〜(6)活性測定と同様の操作を行い、評価を行った。タバコBY-2細胞における一過的遺伝子発現実験の結果を図4に示す。
【0073】
図4には、(a)Rlucの絶対活性、(b)Flucの絶対活性、および(c)Fluc/Rluc相対活性(Fluc翻訳効率)のそれぞれのグラフを示した。図4(c)に示すように、pR-MP-F(0)ベクターの場合、SLを挿入する事によってFluc翻訳効率は約40倍に上昇し(レーン8)、長SL配列を挿入する事によって約100倍に上昇した(レーン9)。すなわち、長SL配列をMP-IRESの直前に挿入する事によってMP-IRESを介した翻訳開始効率が飛躍的に上昇することが示された。また、pR-CP-F(0)の場合、CP-IRESの直前にSL配列を挿入する事によってFluc/Rluc相対活性が約20倍に上昇し(レーン11)、長SL配列を挿入する事によって約30倍に上昇した(レーン12)。これらのことから、安定性の高いステム−ループ構造を形成可能な長SL配列をIRESの直上流に配することによって、より効果的にキャップ非依存性のRNA翻訳効率を向上させることができることがわかった。なお、全ての発現ベクターは35Sプロモーターで制御されているにも関わらず上流ORFであるRluc活性がベクター間に変動が見られたが、その要因は遺伝子銃を用いて遺伝子導入する際に遺伝子サンプル毎の導入効率に差異が生じるためであると考えられた。
【実施例3】
【0074】
実施例3では、SL配列がMP-IRESおよびCP-IRESを介してこれらのIRESのキャップ非依存性翻訳効率を向上させることについてステム−ループ構造の塩基長による効果なのか、あるいは高次構造による効果なのかを確認した。なお、対照としてpR-FのORF間にlink56およびlink87をそれぞれ挿入した発現ベクターも作製した。
【0075】
(1)SL配列に替えて任意な配列を挿入したバイシストロニック発現ベクターの作製
SL配列(56塩基長)および長ステムSL配列(87塩基長)と同じ塩基長の任意な2種の塩基配列link56およびlink87(pRL-nullのリンカー配列由来)を挿入した。
(a)pR-link56-F、pR-link56CP-Fの各ベクターの作製
pR-link56-FおよびpR-link56CP-Fの各ベクターは、pR-FおよびpR-CP-F(0)の各ベクターのFlucあるいはCP-IRESの直前にそれぞれlink56をそれぞれ挿入した発現ベクターである。pRL-nullをNheI及びMluIで処理し、平滑末端化した後セルフライゲーションすることによってpRL-null(Nhef/Mluf)を作製し、これをSacI処理し、平滑末端化した後セルフライゲーションした。続いて、このプラスミドをBglII及びNheI処理することによって得られたlink56断片をpR-FおよびpR-SLCP-Fの各ベクターのBglII及びNheI切断部位にサブクローニングし、pR-link56-F、pR-link56CP-Fの各ベクターとした。
【0076】
(b)pR-link87-F、pR-link87CP-Fの各ベクターの作製
pR-link87-F、pR-link87CP-Fの各ベクターは、pR-FおよびpR-CP-F(0)の各ベクターのFlucあるいはCP-IRESの直前にそれぞれlink87をそれぞれ挿入した発現ベクターである。pRL-null(Nhef/Mluf)をSacI処理し、平滑末端化した後、HindIII処理したものをセルフライゲーションした。さらに、EcoRI処理し、平滑末端化した後セルフライゲーションした。続いて、このプラスミドをBglII及びNheI処理することによって得られたlink87断片をpR-FoおよびpR-SLCP-FのBglII及びNheI切断部位にサブクローニングし、pR-link87-F、pR-link87CP-Fの各ベクターを作製した。
【0077】
(2)遺伝子導入およびデュアルルシフェラーゼ活性測定に基づく評価
作製した各ベクターおよび実施例1で作製したpR-F pR-SL-F、pR-CP-F(0)、pR-SLCP-Fおよび実施例2で作製したpR-longSL-F、pR-longSLCP-Fベクターの各ベクターについて、実施例1の(4)遺伝子の導入〜(6)活性測定と同様の操作を行い、評価を行った。タバコBY-2細胞における一過的遺伝子発現実験の結果を図5に示す。
【0078】
図5には、(a)Rlucの絶対活性、(b)Flucの絶対活性、および(c)Fluc/Rluc相対活性(Fluc翻訳効率)のそれぞれのグラフを示した。図5(a)〜(c)に示すように、pR-FのORF間にSLあるいはlongSL、link56、link87をそれぞれ挿入してもFluc翻訳効率の大きな差異は観察されなかった(図5レーン1とレーン2〜5を比較)。この結果はSL配列あるいは長SL配列、link56、link87がIRES様の機能を保持しないことを意味している。
【0079】
一方、CP-IRESの直前にSL配列、長SL配列を挿入したことによってFluc翻訳効率はそれぞれ約20倍、約30倍上昇したのに対して(図5レーン6と7〜8を比較)、link56及びlink87を挿入したときには有意な増加は観察されなかった(図5レーン6と9〜10を比較)。これらの結果より、SL配列あるいは長SL配列をCP-IRESの直前に挿入した際に見られたFluc翻訳効率の増加はSL配列あるいは長SL配列の塩基配列あるいは二次構造に由来するものであり、CP-IRESと上流遺伝子までの距離によってIRES活性が上昇したのではないという事がわかった。
【0080】
以上の結果より、高等植物ポリシストロニック遺伝子発現ベクターの2番目以降のシストロンをキャップ非依存的に効率よく翻訳させる介在配列として、SL配列+MP-IRESの組み合わせならびにSL配列+CP-IRESの組み合わせ、および長SL配列+MP-IRESの組み合わせならびに長SL配列+CP-IRESの組み合わせが有効であることが示された。
【配列表フリーテキスト】
【0081】
配列番号1〜6:合成DNA
配列番号7〜16:プライマー
【図面の簡単な説明】
【0082】
【図1】SL配列を挿入したバイシストロニック発現ベクターおよびその転写物の一例を示す図。
【図2】SL配列挿入によるIRESを介したキャップ非依存性翻訳効率への影響を示す図。
【図3】長SL配列を挿入したバイシストロニック発現ベクターおよびその転写物の一例を示す図。
【図4】長SL配列挿入によるIRESを介したキャップ非依存性翻訳効率への影響を示す図。
【図5】SL配列および長SL配列挿入によるIRESを介したキャップ非依存性翻訳効率への影響を示す図。
【技術分野】
【0001】
本発明は、キャップ非依存性RNA翻訳効率制御要素およびその利用に関し、詳しくは、キャップ非依存性RNA翻訳効率制御要素および該制御要素を利用するキャップ非依存性RNA翻訳開始要素、発現ベクター、形質転換体、遺伝子の発現方法、遺伝子産物の製造方法に関する。
【背景技術】
【0002】
植物細胞などの真核細胞においては、核酸から転写されたmRNAの翻訳はその5'末端側のキャップ構造にリボソームが結合することにより開始されるいわゆるキャップ依存性のmRNAの翻訳が主体となっている。一方、ある種のレトロウイルスにおいては、キャップ構造以外にリボソームが結合する内部リボソーム導入部位(Internal Ribosomal Entry Site,以下単にIRESともいう。)を有しており、キャップ非依存性のmRNA翻訳が行われることが知られている。
【0003】
動物ピコルナウイルスの1種であるencephalomyocarditis virus(EMCV)のゲノムはプラス鎖1本鎖RNAであり、全長834塩基からなる5’UTRを持っている。この5’UTRのうち260〜836の約574塩基にIRES配列が存在し、この配列にリボソームが直接結合して翻訳を開始することが証明されている(Jackson et al., 1990; Hellen and Sarnow, 2001)。このEMCV-IRESを使用したバイシストロニック(bicistronic)なタンパク質発現系は動物細胞においてはほぼ確立されており、市販品として入手可能である。EMCV-IRESは試験管内翻訳系においてもキャップ非依存的翻訳を促進する働きを示し、ウサギ網状赤血球の系では有効に機能することが明らかとなっている。しかし、コムギ胚芽の系ではEMCV-IRESは全く機能せず、むしろ翻訳抑制的に働いた。これらのことから、当初はEMCV-IRESは植物細胞においては機能しないと推定されていた。しかし、一過的発現系や形質転換植物を用いたin vivo実験系においてEMCV-IRESの挿入による翻訳効率上昇が観察され、植物細胞内でEMCV-IRESが機能することが判明した(非特許文献1)。
【0004】
また、植物ウイルスの1種であるアブラナ感染性トバモウイルス(crucifer-infecting tobamovirus(crTMV))は1分節のプラス鎖1本鎖RNAである。ゲノムRNAの5’側から複製酵素、移動タンパク質(movement protein(MP))、コートタンパク質(coat protein(CP))をコードするORFを持っており、各ORFはそれぞれ数塩基ずつ重なっている。そのため、最も上流に存在する複製酵素はゲノムRNAから翻訳されるが、その際MPおよびCP遺伝子は翻訳されないメカニズムとなっている。このcrTMVについては、crTMVゲノムRNAから生じたサブゲノムRNAの5’UTR部分を2種類の遺伝子のORF間に挿入したバイシストロニックベクターを用いた実験が行われ、sgRNAI2とmonocistronic sgRNAの5’UTRがin vitro翻訳実験およびタバコプロトプラストにおける一過的遺伝子発現実験において下流遺伝子を翻訳すること、すなわち各サブゲノムの5’UTRにIRES配列が存在することが証明された(非特許文献2および非特許文献3)。
【0005】
さらに、crTMV以外の植物ウイルスでは、tobacco etch virus(TEV)のゲノムRNA(非特許文献4)やhibiscus chlorotic ringspot virus(HCRSV)のサブゲノムRNAの5’UTR(非特許文献5)などにおいてもIRES配列が存在するという報告がある。また、植物ウイルス由来IRESの長さは100塩基前後であり、ピコルナウイルス由来のIRESよりも非常にサイズが小さいのが特徴的である。
【非特許文献1】Urwin, P., Yi, L., Martin, H., Atkinson, H., and Gilmartin, P.M. (2000). Functional characterization of the EMCV IRES in plants. Plnat J. 24, 583-589.
【非特許文献2】Ivanov, P.A., Karpova, O.V., Skulachev, M.V., Tomashevskaya, O.L., Rodionova, N.P., Dorokhov, Y.L., and Atabekov, J.G. (1997). A tobamovirus genome that contains an internal ribosome entry site functional in vitro. Virology 232, 32-43.
【非特許文献3】Skulachev, M.V., Ivanov, P.A., Karpova, O.V., Korpela, T., Rodionova, N.P., Dorokhov, Y.L., and Atabekov, J.G. (1999). Internal initiation of translation directed by the 5’-untranslated region of the tobamovirus subgenomic RNA I2. Virology 263, 139-154.
【非特許文献4】Niepel, M., and Gallie, D.R. (1999). Identfiation and characterization of the functional elements within the tobacco etch virus 5’leader required for cap-independent translation. J. Virol. 73, 9080-9088.
【非特許文献5】Koh, D.C.-Y., Wong, S.-M., and Liu, D.X. (2003). Synergism of the 3’-untranslated region and an internal ribosome entry site differentially enhances the translation of a plant virus coat protein. J. Biol. Chem. 278, 20565-20573.
【発明の開示】
【発明が解決しようとする課題】
【0006】
このように、IRESが植物細胞内において機能しmRNAにおける多重的な翻訳領域を翻訳することは既に明らかとなっているが、それらの性能は必ずしも満足なものではない。そこで、本発明は、IRESを介した翻訳効率を向上させるキャップ非依存性RNA翻訳効率制御要素を提供することを1つの目的とする。また、本発明は、IRESを介して翻訳効率を向上させるキャップ非依存性RNA翻訳制御要素を利用したキャップ非依存性RNA翻訳開始要素、発現ベクター、形質転換体、遺伝子の発現方法、および遺伝子産物の製造方法を提供することを他の1つの目的とする。
【課題を解決するための手段】
【0007】
本発明の一つの形態によれば、翻訳効率制御要素キャップ非依存性RNA翻訳効率の制御要素であって、少なくとも1つのステム−ループ構造を形成可能なポリリボヌクレオチドであり、該ポリリボヌクレオチドの近傍に接続される内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させるポリリボヌクレオチドをコードするポリヌクレオチドである、翻訳効率制御要素が提供される。この形態においては、前記ステム−ループ構造のステムは6塩基対以上30塩基対以下の二重鎖または部分二重鎖であることが好ましい。また、本発明の他の一つの形態によれば、キャップ非依存性RNAの翻訳効率の制御要素であって、配列番号1に記載の塩基配列の第13位〜第34位の塩基配列を有するポリヌクレオチドであることが好ましい態様であり、配列番号2に記載の塩基配列の第13位〜第65位の塩基配列を有するポリヌクレオチドであることが好ましい態様である。
【0008】
これらの形態の翻訳制御要素においては、前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有することが好ましい態様であり、また、植物ウイルスゲノムにコードされる内部リボソーム導入部位であることが好ましい態様であり、前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位であることがさらに好ましい態様である。これらのいずれかの翻訳制御要素は、植物体におけるキャップ非依存性RNAの翻訳効率制御要素であることが好ましい態様である。
【0009】
また、本発明の他の一つの形態によれば、キャップ非依存性RNA翻訳開始要素であって、上記いずれかのキャップ非依存性RNAの翻訳効率制御要素を含むポリヌクレオチド鎖と、該翻訳効率制御要素によってキャップ非依存性RNA翻訳効率を向上させる内部リボソーム導入部位をコードするポリヌクレオチド鎖と、を備える、翻訳開始要素が提供される。この形態においては、前記翻訳効率制御要素は、前記内部リボソーム導入部位によるキャップ非依存性RNA翻訳効率を20倍以上向上させるものであることが好ましい態様であり、前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有することが好ましい態様である。さらに、前記内部リボソーム導入部位は、植物ウイルスゲノムにコードされる内部リボソーム導入部位であることが好ましい態様であり、さらに好ましくは、前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位である。また、本発明のキャップ非依存性翻訳開始要素は、配列番号3、配列番号4、配列番号5および配列番号6のいずれかに記載の塩基配列を有することが好ましい。
【0010】
本発明のさらに他の一つの形態によれば、発現ベクターであって、真核細胞で動作可能なプロモーターと、該プロモーターの下流側に結合された上記いずれかのキャップ非依存性RNA翻訳開始要素とを備える、発現ベクターが提供される。この形態においては、前記プロモーターによって作動可能に結合されるとともに前記キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合され、タンパク質のコード領域を有するポリヌクレオチド鎖を備えることが好ましい態様であり、前記プロモーターによって作動可能に結合されたタンパク質のコード領域を含むポリヌクレオチド鎖を備える前記プロモーターによって作動可能に結合されキャップ依存的に翻訳されるタンパク質のコード領域を含むポリヌクレオチド鎖を備えることも好ましい態様である。また、プラスミドベクターであることも好ましい態様であり、植物細胞用であることが好ましい態様である。
【0011】
本発明の他の一つの形態によれば、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された上記いずれかのキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体が提供される。この形態においては、形質転換体は植物細胞であることが好ましく、より好ましくは植物体である。
【0012】
また、本発明の他の一つの形態によれば、遺伝子の発現方法であって、上記いずれかのキャップ非依存性RNA翻訳開始要素の下流に該翻訳開始要素によって翻訳開始可能に結合された所望の遺伝子をコードする翻訳領域を備える外来ポリヌクレオチドを保持することにより、前記翻訳領域にコードされた遺伝子を発現させる工程を備える、発現方法が提供される。この形態においては、前記形質転換体は植物体であることが好ましい態様である。
【0013】
さらに、本発明の他の一つの形態によれば、形質転換体を用いた遺伝子産物の製造方法であって、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された上記いずれかのキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体を増殖あるいは生育させて、前記コード領域にコードされた前記タンパク質を製造する工程を備える、遺伝子産物の製造方法が提供される。この形態においては、前記形質転換体は植物体であることが好ましい態様である。また、本発明の他の一つの形態によれば、内部リボソーム導入部位の上流側に少なくとも一つのステム−ループ構造を有するポリヌクレオチドを挿入することにより、前記内部リボソーム導入部位を介した翻訳開始効率を上昇させる方法も提供される。この形態においては、前記ポリリボヌクレオチドは、上記翻訳効率制御要素におけるポリリボヌクレオチドであることが好ましい。
【発明を実施するための最良の形態】
【0014】
本発明のキャップ非依存性翻訳効率制御要素は、少なくとも1つのステム−ループ構造を形成可能なポリヌクレオチドであり、内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させることができるものである。本発明者らは、これまでの研究からシロイヌナズナ以外の植物細胞においてはEMCV-IRESよりもcrTMVのIRES(MP-IRES及びCP-IRES)の活性は低い傾向が観察されていることに着目した。さらに、EMCV-IRES(574塩基)は9つのStem-loopを含むが(Witherell et al., 1995)、73塩基のMP-IRESは1つ(Skulachev et al., 1999)、148塩基のCP-IRESは2つのStem-loopを含む(Ivanov et al., 1997)こと、およびEMCV-IRESに比べてMP-IRESおよびCP-IRESは小型で単純な構造をとっていることから、この構造の差異に着目した。そこで、比較的小型なMP-IRESおよびCP-IRESの直前に安定な高次構造を形成するステム−ループ構造を挿入したところ、これらのIRESの従前の翻訳効率を、予想を超えて向上させうることを見出し、本知見に基づき本発明を完成したものである。
【0015】
こうしたキャップ非依存性翻訳制御要素は、内部リボソーム導入部位(IRES)のキャップ非依存性のRNA翻訳効率を向上させることができるため、IRESを介して本制御要素により翻訳効率が向上された所望のタンパク質のコード領域を有するポリヌクレオチドを保持する宿主細胞では、キャップ非依存性翻訳の制御下で所望のタンパク質を効率よく発現させることができるようになる。また、キャップ非依存性翻訳の制御下でポリシストロニックにタンパク質を発現させることができるようになる。こうした遺伝子発現形態は、遺伝子の高発現系の構築に有用であるとともに宿主細胞におけるキャップ依存性mRNA翻訳を補充あるいは代替できる遺伝子発現系の構築にも有用である。
【0016】
以下、本発明の最良の実施形態として、キャップ非依存性翻訳効率制御要素について説明するとともに、該制御要素を利用したキャップ非依存性RNA翻訳開始要素、発現ベクター、形質転換体、遺伝子の発現方法、および遺伝子産物の製造方法について併せて説明する。
【0017】
(キャップ非依存性RNA翻訳効率制御要素)
本制御要素の好ましい形態は、少なくとも1つのステム−ループ構造を形成可能な配列を有するポリリボヌクレオチドをコードするポリヌクレオチドである。ステム−ループ構造は、ウイルスゲノムRNAやmRNAが形成されたときなど一重鎖の状態のポリリボヌクレオチドにおいて形成される。本制御要素は、機能時においてはポリリボヌクレオチドの形態を採り、RNA分子あるいはRNA配列の部分であるが、本明細書においては、これらのRNA分子あるいはRNA配列を意味する他、これらのRNA分子あるいはRNA配列をコードするDNA分子もしくはRNA分子もしくはDNA配列もしくはRNA配列の部分を意味するものとして用いることとする。したがって、本制御要素におけるポリヌクレオチド鎖は、RNAでもDNAで構成されていてもよい。また、本制御要素は、通常、+鎖RNAウイルスなどに由来するRNAのコピーあるいはcDNAコピーとして得ることができる。
【0018】
ステム−ループ構造は、相補的塩基対からなる二重鎖のポリヌクレオチドからなるステムと、ステムを結合する端部であるループを有していればよい。なお、ループは、互いに塩基対を形成しない配列を有する一重鎖からなるループのみならず実質的にループを形成しない端部であってもよい。したがって、本発明におけるステム−ループ構造は、ヘヤピン構造を含んでいる。本制御要素におけるステム−ループ構造の形成は、本制御要素のポリヌクレオチド鎖が自己相補性を有することにより、該自己相補性を有する鎖部分が塩基対を形成することによりステムが形成される。したがって、本制御要素は、少なくともステムを形成可能な一対の自己相補性鎖部位を有していればよく、さらに、該自己相補性鎖部位に加え、該部位間に介在されるループを形成可能な自己相補性を有しない(あるいは自己相補性がほとんどない)非自己相補性鎖部位を有していてもよい。
【0019】
ステムを形成可能な自己相補性鎖部位は、自己相補的塩基間で結合するのに十分な長さを有していることが好ましいが、例えば、合わせて合計で50ヌクレオチド残基以上100ヌクレオチド残基以下の範囲とすることができる。また、自己相補性部位が自己塩基対合してステムを形成したときには、5塩基対以上35塩基対以下の二重鎖または部分二重鎖を形成可能とすることができる。形成する塩基対が少なすぎるとステムの安定性が低く、安定したステム−ループ構造を形成しにくく、塩基対が多すぎるキャップ依存性翻訳やキャップ非依存性翻訳の双方を阻害するおそれがあるからである。好ましくは、一対の自己相補性部位は6塩基対以上30塩基対以下の塩基対合が形成可能である。塩基対合は、より好ましくは、7塩基対以上25塩基対以下であり、さらに好ましくは8塩基対以上22塩基対以下である。
【0020】
また、自己相補性鎖部位を構成するヌクレオチド鎖の構成塩基は、本制御要素がDNAとしたとき、グアニン(G)およびシトシン(C)の比率がアデニン(A)およびチミン(T)より多いことが好ましく、より好ましくはGC含量が54%以上である。
【0021】
ループを形成可能な非自己相補性鎖部位は、ステムの二重鎖の安定性を阻害しないことが好ましく、2ヌクレオチド残基以上であることが好ましく、より好ましくは4ヌクレオチド残基以上である。また、上限は、好ましくは20ヌクレオチド残基程度であり、より好ましくは10ヌクレオチド残基程度である。
【0022】
少なくとも自己相補性部位を備えるステム−ループ構造部分は、全体として20以上60以下のヌクレオチド残基からなることが好ましい。また、本制御要素は、ステム−ループ構造部分以外の部分、すなわち、ステムのループに連続しない3'末端およびの5’末端の部分を有することができる。この両テール部分は、本制御要素の上流あるいは下流に結合されるIRESや翻訳領域との介在配列となり、IRESや翻訳領域との間で適切な距離や位置関係を形成するのに寄与することができる。このような介在配列としては、3’側には20残基以上23残基程度有することが好ましく、5’側には10残基以上15残基以下程度有することが好ましい。
【0023】
本制御要素としては、配列番号1に記載の塩基配列ならびにそのホモログおよび配列番号2に記載の塩基配列ならびにそのホモログを挙げることができる。ここで、ホモログとは、本来の配列とは異なるが類似の折りたたみ構造を形成でき、本来の配列の有するキャップ非依存性翻訳効率向上機能の全部を損なうことなく有効なキャップ非依存性翻訳効率向上機能を有する変異体をいうものとする。通常、ホモログは、本来の配列と少なくとも70%以上の相同性を有し、好ましくは、80%以上、より好ましくは90%以上、一層好ましくは95%以上の相同性を有している。また、ホモログは、本来の配列に対して1あるいは2以上の塩基の置換、欠失および/または挿入を有している。なお、本明細書において、DNAなどの核酸の相同性については、なお、DNAの塩基配列のホモロジーは、遺伝子解析プログラムBLAST(http://blast.genome.ad.jp),FASTA(http://fasta.genome.ad.jp/SIT/FASTA.html)などによって決定することができる。
【0024】
本制御要素においてステム−ループ構造を形成可能な部位としては、配列番号1に記載の塩基配列の第13位〜34位の塩基配列あるいはそのホモログを挙げることができる。また、他の好ましいステム−ループ構造は、配列番号2に記載に塩基配列の13位〜65位の塩基配列あるいはそのホモログを挙げることができる。
【0025】
本制御要素は、IRESを介してキャップ非依存性翻訳効率を向上させることができる。本制御要素は、IRESに対して好ましくはその上流に位置される。好ましくは、IRESの直前に本制御要素を結合することが好ましい。IRESとの本制御要素との間にヌクレオチド残基が多いと本制御要素によるキャップ非依存性翻訳効率の向上効果が低下するおそれがあるからである。
【0026】
(IRES)
本制御要素を適用してキャップ非依存性RNA翻訳効率を向上させるIRESは、キャップ非依存性RNA翻訳が知られているウイルスや細胞などのコード領域の5’UTRあるいはその一部にコードされている。なお、IRESは、RNAあるいはmRNA上において内部リボソーム導入部位として機能するものであるため、IRESとして機能する状態のポリヌクレオチドのタイプはRNAであり、IRESは、本来的にRNA分子の一部分あるいはRNA配列である。なお、本発明の本制御要素、開始要素およびベクター等において、この語を用いるときには、IRESとして機能するRNA分子の一部分あるいはRNA配列を意味する他、これらをコードするポリヌクレオチドとして表現するものとする。したがって、IRESはDNAであってもRNAであっても、
【0027】
本制御要素を適用するのに好ましいIRESとしては、例えば、1以上8以下のステム−ループ構造を有するものを挙げることができる。かかるIRESにおいては、ステム−ループ構造を追加することでキャップ非依存性翻訳効率を向上させることができる。ステム−ループ構造は好ましくは、6以下であり、より好ましくは4以下であり、さらに好ましくは2以下である
【0028】
また、本制御要素を適用するIRESは、おおよそ70ヌクレオチド残基以上300ヌクレオチド残基以下程度の長さを有していることが好ましい。本制御要素は、比較的単純あるいはサイズの小さいIRESに対して本制御要素は有効に作用する。
【0029】
本制御要素を適用するIRESは、RNAウイルスゲノムにコードされる該ウイルスゲノム由来のIRESであることが好ましい。こうしたIRESは、本制御要素によってキャップ非依存性翻訳効率を向上させやすいからである。なかでも植物RNAウイルスであり、例えば、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)やタバコエッチウイルス(tobacco etch virus(TEV))ハイビスカスクロロティックリングスポットウイルス(hibiscus chlorotic ring spot virus(HCRSV))が有するIRESが好ましいものとして挙げられる。特に、アブラナ感染性トバモウイルスの移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子のIRESを用いることができる。
【0030】
(キャップ非依存性RNA翻訳開始要素)
こうした本制御要素は、IRESと組み合わされて一つのキャップ非依存性翻訳開始要素を構成することができる。本開始要素におけるIRESとしては既に述べたIRESを好ましく用いることができ、また、本制御要素とIRESとの位置関係についても既に述べた通りである。本開始要素は、用いる本制御要素がIRESと組み合わされることにより該IRES単独の場合のキャップ非依存性翻訳効率を10倍以上の向上させることができるIRESを備えることが好ましい。10倍以上の翻訳効率向上によりキャップ非依存性翻訳による遺伝子の発現や遺伝子産物の製造に有効に寄与できるからである。好ましくは20倍以上である。より好ましくは40倍以上である。
【0031】
本開始要素としては、配列番号3に記載の塩基配列および配列番号4に記載の塩基配列を有するポリヌクレオチドを挙げることができる。なお、配列番号3における65位〜134位の塩基配列および配列番号4における96位〜165位の塩基配列は、アブラナ感染性トバモウイルスの移動タンパク質をコードする5'UTRに存在するIRESである。また、本開始要素としては、配列番号5および配列番号6に記載の塩基配列を有するポリヌクレオチドを挙げることができる。配列番号5における65位〜216位の塩基配列および配列番号6における96位〜247位の塩基配列は、同ウイルスのコートタンパク質のコード領域の5'UTRに存在するIRESである。なお、本開始要素として好ましいポリヌクレオチドの塩基配列は、これらの塩基配列のホモログも包含している。
【0032】
こうした本制御要素や本開始要素は、化学合成法、PCR法等の当業者に周知の如何なる方法によっても製造することができる。これらの方法によって得られるこれらの要素は、は塩基配列決定用ゲルを用いたゲル濾過等の当業者に周知の方法により精製されることが好ましい。なお、好ましい制御要素あるいは開始要素として挙げた配列はいずれもDNA配列であるが、これらの各DNA配列に対応するRNA配列(これらのDNA配列によってコードされるRNA配列)を有するポリヌクレオチドも本発明において好ましいポリヌクレオチドである。
【0033】
(発現ベクター)
本制御要素および本開始要素は、所望のタンパク質を宿主細胞内で発現させるための発現ベクターの構成部分としての形態で使用することができる。発現ベクターは、真核細胞において動作可能なプロモーターと、この下流側に結合された少なくとも1あるいは2以上の本開始要素を備えることができる。こうした発現ベクターに少なくとも本開始要素によって翻訳開始可能に所望のコード領域を結合し、この発現ベクターを宿主細胞に導入することで、キャップ非依存性翻訳により所望のタンパク質を産生させることができる。また、2以上の本開始要素のそれぞれの下流に前記プロモーターによって作用可能であってかつ各開始要素によって翻訳開始可能にタンパク質のコード領域を結合させることで、ポリシストロン性の発現ベクターが得られる。
【0034】
発現ベクターにおいて、前記プロモーターにより作動可能に第1のタンパク質のコード領域を含む第1のポリヌクレオチド鎖を結合し、該第1のポリヌクレオチドと同時に転写可能であって本開始要素により翻訳開始可能に第2のタンパク質のコード領域を含む第2のポリヌクレオチド鎖を結合して、この発現ベクターを宿主真核細胞に導入することで、真核細胞のキャップ依存性翻訳による第1のタンパク質の産生と、キャップ非依存性翻訳による第2のタンパク質の産生とを同時に達成できる。第2のタンパク質のコード領域の下流には、さらに、順次追加の本開始要素を結合することで第3以降のタンパク質のコード領域を同様にして結合することができる。各コード領域がコードするタンパク質は同一であってもよいし異なっていてもよい。すなわち、本発現ベクターによれば、キャップ依存性およびキャップ非依存性の翻訳機構により一つのmRNAから2以上のタンパク質が発現可能、換言すれば、ポリシストロニックな発現が可能となっている。本開始要素は、本開始要素によって翻訳可能に結合させた所望のコード領域を効率よく翻訳できるため、宿主のキャップ依存性翻訳機構によらないで所望のタンパク質を高レベルで発現させることが可能となる。したがって、例えば、第1のタンパク質と第2のタンパク質とを同じくすれば、結果として一つのプロモーターの制御下でより多くのタンパク質を発現可能となり、第1のタンパク質と第2のタンパク質とが異なるものであれば、異種のタンパク質を一つのプロモーターで発現可能となる。こうした発現ベクターは、特に、一つの好ましい表現型を構成するのに複数種類のタンパク質が必要なときにおいて好ましい。さらに、例えば、第1のタンパク質を目的のタンパク質とし、第2のタンパク質を選択マーカーとするなど、選択マーカーを同一プロモーターの作動下で好ましくはキャップ非依存的に翻訳開始することで、目的遺伝子を発現するクローンを容易に選択できるようになる。
【0035】
発現ベクターによれば、本開始要素を構成する本制御要素の種類と個数および/またはIRESの種類を適宜変更することで、従来、IRES単独ではキャップ非依存性翻訳効率が十分に得られなかった真核細胞においてもキャップ非依存性翻訳効率を向上させることができる。特に、IRESとして植物ウイルス由来のIRESやステム−ループ構造を形成しないIRESや300ヌクレオチド残基程度以下の小さいIRESをコードするポリヌクレオチドを用いる場合に、本制御要素を含む本開始要素は有効である。この結果、本発現ベクターによれば、IRESによってキャップ非依存性翻訳が可能な真核細胞、特に植物細胞の種類を拡張でき、また、これらの細胞におけるIRESによるキャップ非依存性翻訳の効率を向上させることができる。
【0036】
発現ベクターに組み込まれるコード領域がコードするタンパク質としては、医薬用途のあるペプチドあるいはタンパク質、栄養価が高められたタンパク質、殺虫性ペプチドあるいはタンパク質、植物病原体等に対する抗菌性ペプチドあるいはタンパク質、プロテアーゼ、アミラーゼ、あるいは植物細胞内における糖合成経路、タンパク質合成経路における酵素タンパク質、ある種の酵素阻害剤であるペプチドあるいはタンパク質とすることができる。
【0037】
本発現ベクターにおける真核細胞において動作可能なプロモーターは、特に限定しないで、必要に応じ宿主真核細胞において構成的、誘導的、時期特異的あるいは組織特異的なプロモーターを用いることができる。植物細胞に用いる発現ベクターとしては、例えば、CaMV35Sプロモーター、エロンゲーションファクター1α遺伝子のプロモーター(EF1αプロモーター)などの植物における構成プロモーター、光誘導プロモーターなどの誘導的プロモーターを用いることができる。また、本発現ベクターにおいては、最も3'側に位置された最後のタンパク質コード領域の3’側にはターミネーターを備えることが好ましい。ターミネーターとしては、NOSターミネーターなどを使用できる。宿主細胞で使用するプロモーターやターミネーターは、当業者であれば公知物を適宜選択して使用し、あるいは公知物を改変して使用することができる。
【0038】
本発現ベクターには、必要に応じて、エンハンサーなどのシスエレメント、人工イントロン、シグナルペプチドなどを連結することができる。また、本発現ベクターにおいて使用する選択マーカーは、特に限定しないが、緑色蛍光タンパク質(GFP)、ウミシイタケルシフェンラーゼ(Rluc)、ホタルルシフェラーゼ(Fluc)など細胞に識別可能な色を付与する選択マーカーの他、薬剤抵抗性遺伝子、栄養要求性遺伝子などを始めとする公知の各種選択マーカー遺伝子を利用できる。なお、本発現ベクターは、予め、いずれかのコード領域、好ましくは、本開始要素によって翻訳可能に備えられていることが好ましい。例えば、最も下流側に位置されるコード領域にコードされていることが好ましい。また、本発現ベクターには、前記プロモーターや各開始要素の下流に各コード領域を含むポリヌクレオチド鎖を挿入可能なマルチクローニングサイトを備えることもできる。
【0039】
本発現ベクターは、染色体外で自律複製できるものの他染色体組込み型ベクターとして構築されていてもよい。また、形態としては、線状の断片、プラスミド、コスミド、ファージ、ウイルス、トランスポゾン、酵母人工染色体(YAC)や植物人工染色体(PAC)、哺乳類人工染色体(MAC)等を採ることができる。
【0040】
(形質転換体およびその作製)
本発現ベクターを、植物細胞、動物細胞、昆虫細胞、酵母、真菌などの真核細胞に導入する。好ましい宿主細胞は、産生しようとするタンパク質の種類や使用するIRESによって適当なものが選択される。本発現ベクターについては、好ましくは植物細胞である。発現ベクターの導入方法は、トランスフェクション法、接合法、プロトプラスト融合、エレクトロポレーション法、リポフェクション法、酢酸リチウム法、パーティクルガン法、リン酸カルシウム沈殿法、アグロバクテリウム法、PEG法、直接マイクロインジェクション法等の各種の適切な手段のいずれかを採用できる。発現ベクターの導入後、その宿主細胞は、用いた選択マーカーに応じた培地で培養することができ、選択マーカーの種類に応じた選別することで、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された本開始要素と、前記プロモーターによって作動可能であって本開始要素によって翻訳開始可能に結合された所望のコード領域を有するポリヌクレオチド鎖と、を保持する形質転換体を得ることができる。
【0041】
発現ベクターが宿主細胞に導入されたか否か、あるいは染色体上に保持されているか否かの確認は、PCR法やサザンハイブリダイゼーション法により行うことができる。例えば、形質転換体からDNAを調製し、導入部位特異的プライマーによりPCRを行い、PCR産物について、電気泳動において予期されるバンドを検出することによって確認できる。あるいは蛍光色素などで標識したプライマーでPCRを行うことでも確認できる。これらの方法は、当業者において周知である。
【0042】
特に、植物の形質転換体を得るのに際して、本発現ベクターが導入される細胞としては、植物体に再生可能なあらゆる種類の形態の植物細胞を含めることができる。例えば、培養細胞、プロトプラスト、苗条原基、多芽体、毛状根、カルス等が挙げられる。また、形質転換される植物種としては、特に、限定しないで単子葉植物でも双子葉植物でもよいが、農作物あるいは園芸用作物であることが好ましい。たとえば、イネ、オオムギ、コムギ、ライムギ、トウモロコシ、サトウキビなどの穀類、じゃがいも、さつまいもなどの根茎又は塊根を形成する作物、インゲンマメ、ソラマメ、エンドウなどのマメ科植物、ピーナッツ、ごま、ナタネ、綿実、ヒマワリ、サフラワーなどの種子作物、リンゴ、メロン、ブドウなどの果実を有する作物、トマト、ナスなどの作物、各種花卉植物であることが好ましい。植物の形質転体は、所定の再生工程を実施することで細胞を植物体に変換することができる。再生の方法は、植物の種類によって異なるが、各種公知の方法を使用できる。
【0043】
こうして得られる形質転換体は、真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された本開始要素と、前記プロモーターによって作動可能であって本開始要素によって翻訳開始可能に結合された所望のコード領域を有するポリヌクレオチド鎖と、からなるポリシストロンを、染色体内あるいは染色体外で保持していてもよい。また、形質の発現は、一時的であっても安定的であってもよい。
【0044】
また、形質転換体としては、特に限定しないで全ての種類、形態の細胞を包含し、各種細胞の他、動植物個体、その動植物個体を構成しうる真核細胞、およびその一部である組織や器官ならびに生殖細胞を含む。また、ウイルス粒子も包含する。さらに、また植物個体の一部であるその繁殖媒体(種子、根茎、果実、切穂等)も包含する。
【0045】
形質転換体を、適切な培養条件下で培養し、増殖させることにより、形質転換体は、細胞内、細胞表面、あるいは細胞外にポリペプチドあるいはタンパク質を製造する。適当な方法でこのタンパク質等を回収、精製することができる。
【0046】
本発明のキャップ非依存性翻訳開始要素、またこれを有する発現ベクターによれば、mRNA上のIRESの上流側に少なくとも一つのステム−ループ構造を有するポリリボヌクレオチドを挿入された構造が得られる。この結果、このmRNAにおいては、IRESを介した翻訳開始効率が上昇される。したがって、本発明のさらに別の形態として、IRESの上流側に少なくとも一つのステム−ループ構造を有するポリリボヌクレオチドを挿入することにより、IRESを介した翻訳開始効率を上昇させる方法が提供される。また、本発明のさらに他の形態として、IRESの上流側に少なくとも一つのステム−ループ構造を有するリボヌクレオチド配列を備えるRNA配列あるいは断片も提供されることになる。このようなRNA配列やRNA断片は、そのまま無細胞翻訳系等において用いられる。なお、これらのRNA配列やRNA断片は、IRESの下流にタンパク質のコード領域を備えることもできる。
【実施例1】
【0047】
以下、本発明を実施例を挙げて説明するが、これらの実施例は本発明を説明するものであって、本発明を限定するものではない。
実施例1では、CaMV 35Sプロモーター・NOSターミネーターカセット内に二種のルシフェラーゼタンパク質(上流遺伝子としてウミシイタケルシフェラーゼ(Rluc)、下流遺伝子としてホタルルシフェラーゼ(Fluc))を有し、これらのコード領域間にIRESを有するバイシストロニック発現ベクターを構築するとともに、この発現ベクター中のIRESの直前に配列番号1に記載の塩基配列を有するポリヌクレオチド鎖である8塩基対のステムと6塩基のループをもつステム−ループ(以下、単にSLというものとする。)を形成可能なSL配列を挿入したSL挿入バイシストロニック発現ベクターを構築し、SLのキャップ非依存性RNA翻訳効率向上性能を確認した。図1には、本実施例で作製した各種のバイシストロニック発現ベクターおよび該発現ベクターから転写されるmRNAの構造の一例を示す。
【0048】
(1)バイシストロニック発現ベクターの作製
(a)35S::Flucは、pSP-luc+(Promega社)のFluc断片をpBI221(Clontech社)のGUSコード領域と置換したプラスミドである(Matsuo et al., 2001)。
(b)pR-Fベクターの作製
pR-Fベクターは、CaMV 35Sプロモーター・NOSターミネーターカセット内に上流遺伝子としてウミシイタケルシフェラーゼ(Rluc)、下流遺伝子としてホタルルシフェラーゼ(Fluc)のORFを連結させたプラスミドである。まず、pRL-null(Promega社)をNdeI及びXbaI処理によりRluc断片を切り出し、pSP-Luc+(Promega社)のNdeI及びNheI切断部位にサブクローニングした。次に、このプラスミドをXbaI処理し、平滑末端化した後、NheI処理することによって得られた断片を、pBI221(Clontech社)の平滑末端化したSacI及びXbaI切断部位にサブクローニングし、本ベクターとした。
【0049】
(c)pF-Rベクターの作製
pF-Rベクターは、CaMV 35Sプロモーター・NOSターミネーターカセット内に上流遺伝子としてFluc、下流遺伝子としてRlucのORFを連結させたプラスミドである。pSP-luc+をBglII及びEcoRI処理により切り出した断片をpRL-nullのBglII及びEcoRI切断部位にサブクローニングした。このプラスミドをBglII及びXbaI処理によって切り出した断片をpSP-luc+のBglII及びXbaI切断部位にサブクローニングすることによってpSP-Rlucを作製した。次に、pSP-RlucをNheI及びEcoRI処理によりRluc断片を切り出し、pSP-luc+のXbaI及びEcoRI切断部位にサブクローニングしてpSP-Fluc-Rlucを作製した。さらに、pSP-Fluc-RlucをXbaI処理し、平滑末端化した後、NheI処理することによって得られた断片を、pBI221の平滑末端化したSacI及びXbaI切断部位にサブクローニングして、本ベクターとした。
【0050】
(d)pR-spacer-Fの作製
pR-spacer-Fは、EMCV-IRESと同等の長さをもつ任意な配列を挿入したプラスミドである。pBI221のβ-グルクロニダーゼ(GUS)コード領域をpEGFP-C1(Clontech社)から得られたEGFP断片と置き換えて作製した221 EGFP-C1を利用した。221 EGFP-C1をNcoIで処理し、平滑末端化した後、BglII処理することによって得られたEGFP断片を35S::R-Fの平滑末端化したAvrII及びBglII切断部位にサブクローニングし、本ベクターとした。
【0051】
(2)植物ウイルス由来IRES挿入バイシストロニック発現ベクターの作製
(a)pR-MP-F(0)ベクターの作製
pR-MP-F(0)ベクターは、pR-FベクターのORF間に植物ウイルスであるアブラナ感染性トバモウイルス(crucifer-infecting tobamovirus(crTMV))のサブゲノムRNA I2の5’UTRに存在するIRESのうち領域IIIのみ(MP-IRES)を挿入したプラスミドである。表1に示す、5’IRESmpと3’IRESmp(0)のオリゴヌクレオチドプライマー(配列番号7、8)の組み合わせを用いてPCRによりMP-IRES断片を合成した。PCR反応はEx Taq(TaKaRa社)を用いて行った。各オリゴヌクレオチドを50pmolずつ加えた全量50μLの反応液を94℃で5分間変性した後、30℃で10分-72℃で10分の反応を1サイクル反応させた。この反応液を5%ポリアクリルアミドゲルで電気泳動した後に予測される長さのバンドを回収し、BglII及びAvrII処理し、前記pR-FベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【表1】

【0052】
(b)pF-MP-R(0)ベクターの作製
pF-MP-R(0)ベクターは、pF-RベクターのORF間にcrTMVのサブゲノムRNA I2由来のMP-IRESを挿入したプラスミドである。上記と同様にして得られたMP-IRES断片をBglII及びAvrII処理し、pF-RベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0053】
(c)pR-CP-F(0)ベクターの作製
pR-CP-F(0)ベクターは、pR-FベクターのORF間にcrTMV monocistronic subgenomic RNAの5’UTRに存在するCP-IRESを挿入したプラスミドである。表1に示すIREScp-1、IREScp-2、IREScp-3のオリゴヌクレオチドプライマー(順に配列番号9、10および11)の組み合わせを用いてPCRによりCP-IRES断片を合成した。PCR反応はEx Taq(TaKaRa社)を用いて行った。IREScp-1及びIREScp-2を50pmolずつ加えた全量50μLの反応液を94℃で5分間変性した後、30℃で10分-72℃で10分の反応を1サイクル反応させた。さらに、この反応液に、表1に示すオリゴヌクレオチドプライマーIREScp-3(配列番号11)及びIREScp-4(配列番号12)をそれぞれ300pmol添加し、94℃で5分間変性した後、30℃で10分-72℃で10分の反応を10サイクル反応させた。この反応液を5%ポリアクリルアミドゲルで電気泳動した後に予測される長さのバンドを回収し、BglII及びAvrII処理し、pR-FベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0054】
(d)pF-CP-R(0)ベクターの作製
pR-CP-F(0)ベクターは、pF-RベクターのORF間にcrTMV monocistronic subgenomic RNA由来のCP-IRESを挿入したプラスミドである。上記と同様にして得られたCP-IRES断片をBglII及びAvrII処理し、pF-RベクターのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0055】
(3)動物ウイルス由来IRES挿入バイシストロニック発現ベクターの作製
(a)pR-EI-F(0)ベクターの作製
pR-EI-F(0)ベクターはpR-FベクターのORF間にピコルナウイルスencephalomyocarditis virus(EMCV)由来のIRESを挿入したプラスミドである。上記35S::FlucをNcoIで処理し、平滑末端化した後、XbaI処理することによって得られたFluc断片を、pIRESneo(Clontech社)のSmaI及びXbaI切断部位にサブクローニングしてEI-Flucを作製した。EI-FlucをXbaI処理し、平滑末端化した後セルフライゲーションし、それをXhoI処理し、平滑末端化した後、BamHI処理することによって得られた断片をp35S-GFP(Clontech社)の平滑末端化したSacI及びBamHI切断部位にサブクローニングした(このプラスミドを35S::EI-Fluc polyAと呼ぶ)。そして、pRL-nullをXbaI処理し、平滑末端化した後、NheI処理することによって得られたRluc断片を、35S::EI-Fluc polyAの平滑末端化したBstXI及びXbaI切断部位にサブクローニングして35S::R-EI-F(BstXI)を作製した。次に、35S::R-EI-F(BstXI)をAvrII処理し、平滑末端化した後セルフライゲーションして得られたプラスミドを鋳型とし、BglII-IRESとIRES-AvrII(0)を用いてPCR反応を行った。PCRはKOD DNA Polymerase(TOYOBO社)を用いて行った。鋳型DNAを30ng、各プライマーを50pmolずつ加えた全量50μLの反応液を94℃で3分間変性した後、94℃で30秒-60℃で7秒-74℃で50秒の反応を25サイクル行い、続けて74℃で5分間反応させた。この反応液を1%アガロースゲルで電気泳動した後に予測される長さのバンドを回収し、BglII及びAvrII処理し、pR-FのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0056】
(b)pF-EI-Rベクターの作製
pF-EI-Rベクターは、pF-RベクターのORF間にピコルナウイルスEMCV由来のIRESを挿入したプラスミドである。pR-EI-FをBglII及びAvrII処理し、得られたEMCV-IRES断片をpF-RのBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0057】
(3)SL配列を挿入したバイシストロニック発現ベクターの作製
(a)pR-slCP-Fベクターの作製
pR-slCP-Fベクターは、pR-CP-FベクターのORF間にSL配列を有するベクターである。表1に示すオリゴヌクレオチドプライマー5’-40ntSL(配列番号13)及び3’-40ntSL(配列番号14)を用いてステム−ループ断片を合成した。クレノウフラグメント(TaKaRa社)の付属プロトコールにしたがって、各オリゴヌクレオチドを50pmolずつ加えた全量50μLで反応し、5%ポリアクリルアミドゲルで電気泳動した後に予測される長さのバンドを回収した。得られたステム−ループ断片をBamHI処理し、pR-F、pR-EI-F、pR-MP-F、pR-CP-Fの各ベクターのBglII切断部位にサブクローニングした。Stem-Loop部分をシークエンスによって確認した結果、ほぼ完全な配列を保持しているpR-slCP-Fを本ベクターとし、本ベクターにおけるSL配列を他のベクターへの挿入用SL配列として用いた。
【0058】
(b)pR-Kpn-Fベクターの作製
pR-Kpn-Fベクターは、pR-FベクターのORF間にKpnI部位を挿入したプラスミドである。pR-Fベクターを鋳型とし、表1に示すBgl-Avr-Flucプライマー(配列番号15)及びKpn-Rlucプライマー(配列番号16)を用いてPCRにより合成した。まず、Cloned T4 Polynucleotide Kinase(TaKaRa社)の付属プロトコールにしたがって、各プライマーの5’末端をリン酸化した。PCR反応はKOD -Plus-(TOYOBO社)用いた。鋳型DNAを5ng、リン酸化したプライマーを50pmolずつ加えた全量50μLの反応液を94℃で2分間変性した後、94℃で15秒-55℃で30秒-68℃で7分の反応を25サイクル行い、続けて68℃で5分間反応させた。この反応液を0.8%アガロースゲルで電気泳動した後に予測される長さのバンドを回収し、セルフライゲーションさせ、本ベクターとした。
【0059】
(c)pR-SL-Fベクターの作製
pR-SL-Fベクターは、pR-FベクターのORF間にSL配列を挿入したプラスミドである。pR-slCP-FベクターをPstI及びKpnI処理により切り出した断片をpR-Kpn-FベクターのPstI及びKpnI切断部位にサブクローニングした。このようにして完成したプラスミドはRlucの下流のNheIからFluc直前のBglIIまでの長さが56塩基となり、SL構造は8塩基対のステムを形成可能となっていた。
【0060】
(d)pR-SLEI-F、pR-SLMP-F、pR-SLCP-Fの各ベクターの作製
これらのベクターは、pR-EI-F、pR-MP-F、pR-CP-Fの各ベクターの上流遺伝子RlucとIRESの間にSL配列が挿入されたプラスミドである。pR-SL-FベクターをPstI及びBglII処理により切り出した断片をpR-EI-F(0)、pR-MP-F(0)およびpR-CP-F(0)の各ベクターのPstI及びBglII切断部位にサブクローニングし、各ベクターとした。
【0061】
(e)pF-SL-Rベクターの作製
pF-SL-Rベクターは、pF-RベクターのORF間にSL配列が挿入されたプラスミドである。pR-SL-FベクターをNheI処理し、平滑末端化した後、AvrIIで処理する事によって得られた断片をpF-Rの平滑末端化したBglII及びAvrII切断部位にサブクローニングし、本ベクターとした。
【0062】
(f)pF-SLEI-R、pF-SLMP-R、pF-SLCP-Rの各ベクターの作製
これらのベクターは、pF-EI-R、pF-MP-R、pF-CP-Rの各ベクターの上流遺伝子FlucとIRESの間にSL配列が挿入されたプラスミドである。pF-EI-R、pF-MP-RおよびpF-CP-Rの各ベクターをBglII及びAvrII処理により切り出した断片をそれぞれpF-SL-RのBglII及びAvrII切断部位にサブクローニングし、各ベクターとした。
【0063】
(4)遺伝子の導入
作製した各種ベクターを植物細胞に導入するのにあたり、遺伝子銃(model PDS-1000/He Biolistic Particle Delivery System(Bio-Rad社))を用い、付属のプロトコールにしたがって実験を行った。ヘリウムガスの圧力は1100psiで、1サンプルに対して1回ずつ打ち込んだ。金粒子(直径1.6μm)へのDNAの吸着方法は次に示す。まず、金粒子は50%グリセロールで60mg/mlに調製し、3回の遺伝子導入実験用サンプル当たり金粒子懸濁液25μLを用いた。金粒子懸濁液25μLをチューブに分注し、DNAを2μg、2.5M塩化カルシウム25μL、0.1mMスペルミジン10μLを順次加えて穏やかに撹拌した。1分間静置した後、12000rpmで3秒間遠心し上清を除去した。金粒子を70%エタノール200μL及び100%エタノール200μLで1回ずつ洗浄し、最後に30μLの100%エタノールで懸濁した。そして、この溶液7.5μLを1回の遺伝子導入実験に使用した。導入細胞は、タバコBY-2細胞を用い、培養5日目の該細胞2mlを3%アガープレートの上に1層になるように拡げ、余分な液体を除去した後、十分に乾燥させた上で用いた。遺伝子導入後は27℃で24時間静置した。なお、各ベクターについて3回ずつ遺伝子導入を行った。
【0064】
(5)細胞抽出液の調製
遺伝子導入から24時間経過後、プレート当たり2mlのPassive Lysis Buffer(Promega社)を加えて細胞を回収し、このうち1mlを1.5mlチューブに分注し、15000rpmで1分間遠心して上清を除去した。回収した細胞にPassive Lysis Bufferを250μL加え、電動ホモジェナイザーを用いて10秒間破砕した。これを15000rpmで1分間遠心し、上清を活性測定に使用した。
【0065】
(6)活性測定
活性測定は、デュアルルシフェラーゼ活性測定とし、Dual-Luciferase(商標) Reporter Assay System(Promega社)を用い、付属のプロトコールにしたがって行った。調製した細胞抽出液10μLとLARII溶液50μLを試験管内で混合し、ルミノメーター(Berthold社、Lumat LB9501)を用いて10秒間測定した。この時得られた値がホタルルシフェラーゼ活性であった。続いて、Stop&Glo(商標)溶液50μLを加えてルミノメーターを用いて10秒間測定した。この時得られた値がウミシイタケルシフェラーゼ活性であった。測定された絶対活性は、102〜103(RLU)の間にあった。結果を図2に示す。
【0066】
(7)評価
図2に示すように、タバコBY-2細胞における一過的遺伝子発現実験の結果、上流遺伝子としてRluc、下流遺伝子としてFlucをもつバイシストロニック遺伝子発現ベクターに関しては(図2のAレーン参照)、MP-IRESの直前にSLを挿入することによってFluc(下流遺伝子)翻訳効率は約30倍に、CP-IRESの直前に挿入することによって約20倍に上昇した(図2Aレーン5と6、7と8を比較)。一方、pR-EI-F(0)のEMCV-IRESの直前にSLを挿入してもFluc翻訳効率の有意な増加は得られなかった(図2Aレーン3と4を比較)。また、pR-FのORF間にSLを挿入した場合もFluc翻訳効率に大きな変化は観察されなかった(図2Aレーン1と2を比較)。
【0067】
上流遺伝子としてFluc、下流遺伝子としてRlucをもつバイシストロニック遺伝子発現ベクターに関しても、MP-IRESおよびCP-IRESの直前にSLを挿入することによってRluc翻訳効率は8倍程度高くなった(図2Bレーン5と6、7と8を比較)。しかし、EMCV-IRESの直前にSLを挿入した場合やpF-RのORF間にSLを挿入した場合ではRluc翻訳効率の増加はほとんど見られなかった。
【0068】
以上の結果より、8塩基対のステムと6塩基のループをもつSL構造を形成可能なSL配列を挿入することによってMP-IRES及びCP-IRESを介した下流遺伝子のキャップ非依存性の翻訳効率が上昇することが証明された。さらに、ステム−ループ構造による効果は下流遺伝子の配列よりもIRESの種類によって異なることがわかった。
【実施例2】
【0069】
実施例2では、実施例1で用いたSL配列よりもより長いステムを有するSL配列を挿入したSL挿入バイシストロニック発現ベクターを構築し、SLのキャップ非依存性RNA翻訳効率向上性能を確認した。図3には、本実施例で作製した各種のバイシストロニック発現ベクターおよび該発現ベクターから転写されるmRNAの構造の一例を示す。本実施例で用いたSL配列は、配列番号2に記載の塩基配列を有するポリヌクレオチドであり、22塩基対のステムと6塩基対のループを形成可能なポリヌクレオチドであった。
【0070】
(1)長いステムをもつ長SL配列を挿入したバイシストロニック発現ベクターの作製
(a)pR-longSLCP-Fベクターの作製
pR-longSLCP-Fベクターは、実施例1の(3)SL配列を挿入したバイシストロニック発現ベクターの(c)で作製したpR-SLCP-F(0)を元にして、より長い22塩基対のステムを形成可能なSL配列を挿入したプラスミドである。pR-SLCP-F(0)ベクターをNheI処理し、平滑末端化した後、EcoRIで処理する事によって得られた断片を、pR-SLCP-F(0)の平滑末端化したApaI及びEcoRI切断部位にサブクローニングし、本ベクターとした。このようにして完成したプラスミドベクターはRlucの下流のNheIからCP-IRES直前のBglIIまでの長さが87塩基であり、22塩基対のステムを形成可能となっていた。
【0071】
(b)pR-longSL-Fベクターの作製
pR-longSL-Fベクターは、pR-FベクターのORF間に長ステムの長SL配列を挿入したプラスミドである。pR-longSLCP-FベクターをBglII及びEcoRI処理により切り出した断片をpR-SL-FのBglII及びEcoRI切断部位にサブクローニングし、本ベクターとした。
【0072】
(2)遺伝子導入およびデュアルルシフェラーゼ活性測定に基づく評価
作製した各ベクターおよび実施例1で作製したpR-SLEI-F、pR-SLMP-F、pR-SLCP-FおよびpR-SL-Fの各ベクターについて、実施例1の(4)遺伝子の導入〜(6)活性測定と同様の操作を行い、評価を行った。タバコBY-2細胞における一過的遺伝子発現実験の結果を図4に示す。
【0073】
図4には、(a)Rlucの絶対活性、(b)Flucの絶対活性、および(c)Fluc/Rluc相対活性(Fluc翻訳効率)のそれぞれのグラフを示した。図4(c)に示すように、pR-MP-F(0)ベクターの場合、SLを挿入する事によってFluc翻訳効率は約40倍に上昇し(レーン8)、長SL配列を挿入する事によって約100倍に上昇した(レーン9)。すなわち、長SL配列をMP-IRESの直前に挿入する事によってMP-IRESを介した翻訳開始効率が飛躍的に上昇することが示された。また、pR-CP-F(0)の場合、CP-IRESの直前にSL配列を挿入する事によってFluc/Rluc相対活性が約20倍に上昇し(レーン11)、長SL配列を挿入する事によって約30倍に上昇した(レーン12)。これらのことから、安定性の高いステム−ループ構造を形成可能な長SL配列をIRESの直上流に配することによって、より効果的にキャップ非依存性のRNA翻訳効率を向上させることができることがわかった。なお、全ての発現ベクターは35Sプロモーターで制御されているにも関わらず上流ORFであるRluc活性がベクター間に変動が見られたが、その要因は遺伝子銃を用いて遺伝子導入する際に遺伝子サンプル毎の導入効率に差異が生じるためであると考えられた。
【実施例3】
【0074】
実施例3では、SL配列がMP-IRESおよびCP-IRESを介してこれらのIRESのキャップ非依存性翻訳効率を向上させることについてステム−ループ構造の塩基長による効果なのか、あるいは高次構造による効果なのかを確認した。なお、対照としてpR-FのORF間にlink56およびlink87をそれぞれ挿入した発現ベクターも作製した。
【0075】
(1)SL配列に替えて任意な配列を挿入したバイシストロニック発現ベクターの作製
SL配列(56塩基長)および長ステムSL配列(87塩基長)と同じ塩基長の任意な2種の塩基配列link56およびlink87(pRL-nullのリンカー配列由来)を挿入した。
(a)pR-link56-F、pR-link56CP-Fの各ベクターの作製
pR-link56-FおよびpR-link56CP-Fの各ベクターは、pR-FおよびpR-CP-F(0)の各ベクターのFlucあるいはCP-IRESの直前にそれぞれlink56をそれぞれ挿入した発現ベクターである。pRL-nullをNheI及びMluIで処理し、平滑末端化した後セルフライゲーションすることによってpRL-null(Nhef/Mluf)を作製し、これをSacI処理し、平滑末端化した後セルフライゲーションした。続いて、このプラスミドをBglII及びNheI処理することによって得られたlink56断片をpR-FおよびpR-SLCP-Fの各ベクターのBglII及びNheI切断部位にサブクローニングし、pR-link56-F、pR-link56CP-Fの各ベクターとした。
【0076】
(b)pR-link87-F、pR-link87CP-Fの各ベクターの作製
pR-link87-F、pR-link87CP-Fの各ベクターは、pR-FおよびpR-CP-F(0)の各ベクターのFlucあるいはCP-IRESの直前にそれぞれlink87をそれぞれ挿入した発現ベクターである。pRL-null(Nhef/Mluf)をSacI処理し、平滑末端化した後、HindIII処理したものをセルフライゲーションした。さらに、EcoRI処理し、平滑末端化した後セルフライゲーションした。続いて、このプラスミドをBglII及びNheI処理することによって得られたlink87断片をpR-FoおよびpR-SLCP-FのBglII及びNheI切断部位にサブクローニングし、pR-link87-F、pR-link87CP-Fの各ベクターを作製した。
【0077】
(2)遺伝子導入およびデュアルルシフェラーゼ活性測定に基づく評価
作製した各ベクターおよび実施例1で作製したpR-F pR-SL-F、pR-CP-F(0)、pR-SLCP-Fおよび実施例2で作製したpR-longSL-F、pR-longSLCP-Fベクターの各ベクターについて、実施例1の(4)遺伝子の導入〜(6)活性測定と同様の操作を行い、評価を行った。タバコBY-2細胞における一過的遺伝子発現実験の結果を図5に示す。
【0078】
図5には、(a)Rlucの絶対活性、(b)Flucの絶対活性、および(c)Fluc/Rluc相対活性(Fluc翻訳効率)のそれぞれのグラフを示した。図5(a)〜(c)に示すように、pR-FのORF間にSLあるいはlongSL、link56、link87をそれぞれ挿入してもFluc翻訳効率の大きな差異は観察されなかった(図5レーン1とレーン2〜5を比較)。この結果はSL配列あるいは長SL配列、link56、link87がIRES様の機能を保持しないことを意味している。
【0079】
一方、CP-IRESの直前にSL配列、長SL配列を挿入したことによってFluc翻訳効率はそれぞれ約20倍、約30倍上昇したのに対して(図5レーン6と7〜8を比較)、link56及びlink87を挿入したときには有意な増加は観察されなかった(図5レーン6と9〜10を比較)。これらの結果より、SL配列あるいは長SL配列をCP-IRESの直前に挿入した際に見られたFluc翻訳効率の増加はSL配列あるいは長SL配列の塩基配列あるいは二次構造に由来するものであり、CP-IRESと上流遺伝子までの距離によってIRES活性が上昇したのではないという事がわかった。
【0080】
以上の結果より、高等植物ポリシストロニック遺伝子発現ベクターの2番目以降のシストロンをキャップ非依存的に効率よく翻訳させる介在配列として、SL配列+MP-IRESの組み合わせならびにSL配列+CP-IRESの組み合わせ、および長SL配列+MP-IRESの組み合わせならびに長SL配列+CP-IRESの組み合わせが有効であることが示された。
【配列表フリーテキスト】
【0081】
配列番号1〜6:合成DNA
配列番号7〜16:プライマー
【図面の簡単な説明】
【0082】
【図1】SL配列を挿入したバイシストロニック発現ベクターおよびその転写物の一例を示す図。
【図2】SL配列挿入によるIRESを介したキャップ非依存性翻訳効率への影響を示す図。
【図3】長SL配列を挿入したバイシストロニック発現ベクターおよびその転写物の一例を示す図。
【図4】長SL配列挿入によるIRESを介したキャップ非依存性翻訳効率への影響を示す図。
【図5】SL配列および長SL配列挿入によるIRESを介したキャップ非依存性翻訳効率への影響を示す図。
【特許請求の範囲】
【請求項1】
キャップ非依存性RNA翻訳効率の制御要素であって、
少なくとも1つのステム−ループ構造を形成可能なポリリボヌクレオチドであり、該ポリリボヌクレオチドの近傍に接続される内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させるポリリボヌクレオチドをコードするポリヌクレオチドである、翻訳効率制御要素。
【請求項2】
前記ステム−ループ構造のステムは6塩基対以上30塩基対以下の二重鎖または部分二重鎖を形成する、請求項1に記載の翻訳効率制御要素。
【請求項3】
配列番号1に記載の塩基配列の第13位〜第34位の塩基配列を有するポリヌクレオチドであるキャップ非依存性RNA翻訳効率の制御要素。
【請求項4】
配列番号2に記載の塩基配列の第13位〜第65位の塩基配列を有するポリヌクレオチドであるキャップ非依存性RNA翻訳効率の制御要素。
【請求項5】
前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有する、請求項1〜4のいずれかに記載の翻訳効率制御要素。
【請求項6】
前記内部リボソーム導入部位は、植物ウイルスゲノムにコードされる内部リボソーム導入部位である、請求項1〜5のいずれかに記載の翻訳効率制御要素。
【請求項7】
前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位である、請求項1〜6のいずれかに記載の翻訳効率制御要素。
【請求項8】
植物細胞におけるキャップ非依存性RNAの翻訳効率制御要素である、請求項1〜7のいずれかに記載の翻訳効率制御要素。
【請求項9】
キャップ非依存性RNA翻訳開始要素であって、
請求項1〜4のいずれかに記載のキャップ非依存性RNAの翻訳効率制御要素を有するポリヌクレオチド鎖と、
該翻訳効率制御要素によってキャップ非依存性RNA翻訳効率を向上可能に結合された内部リボソーム導入部位をコードするポリヌクレオチド鎖と、
を備える、翻訳開始要素。
【請求項10】
前記翻訳効率制御要素は、前記内部リボソーム導入部位によるキャップ非依存性RNA翻訳効率を10倍以上向上させる、請求項9に記載の翻訳開始要素。
【請求項11】
前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有する、請求項9または10に記載の翻訳開始要素。
【請求項12】
前記内部リボソーム導入部位は、植物ウイルスゲノムにコードされる内部リボソーム導入部位である、請求項9〜11のいずれかに記載の翻訳開始要素。
【請求項13】
前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位である、請求項9〜12のいずれかに記載の翻訳開始要素。
【請求項14】
配列番号3に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項15】
配列番号4に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項16】
配列番号5に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項17】
配列番号6に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項18】
発現ベクターであって、真核細胞で動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性RNA翻訳開始要素と、を備える、発現ベクター。
【請求項19】
前記プロモーターによって作動可能に結合されるとともに前記キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合される、タンパク質のコード領域を有する領域を含むポリヌクレオチド鎖、を備える、請求項18に記載の発現ベクター。
【請求項20】
前記プロモーターによって作動可能に結合されキャップ依存的に翻訳されるタンパク質のコードするポリヌクレオチド鎖を備える、請求項19に記載の発現ベクター。
【請求項21】
プラスミドベクターである、請求項18〜20のいずれかに記載の発現ベクター。
【請求項22】
植物細胞用である、請求項18〜21のいずれかに記載の発現ベクター。
【請求項23】
真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体。
【請求項24】
前記形質転換体は植物細胞である、請求項23に記載の形質転換体。
【請求項25】
前記形質転換体は植物体である、請求項24に記載の形質転換体。
【請求項26】
遺伝子の発現方法であって、
真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体において、前記コード領域にコードされたタンパク質を発現させる工程を備える、発現方法。
【請求項27】
前記形質転換体は植物体である、請求項26に記載の発現方法。
【請求項28】
形質転換体を用いた遺伝子産物の製造方法であって、
真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体を増殖あるいは生育させて、前記コード領域にコードされた前記タンパク質を製造する工程を備える、遺伝子産物の製造方法。
【請求項29】
前記形質転換体は植物体である、請求項28に記載の遺伝子産物の製造方法。
【請求項30】
内部リボソーム導入部位の上流側に少なくとも一つのステム−ループ構造を有するポリリボヌクレオチドを挿入することにより、前記内部リボソーム導入部位を介した翻訳開始効率を上昇させる方法。
【請求項31】
前記ポリリボヌクレオチドは、請求項1〜4に記載のポリヌクレオチドによってコードされるポリリボヌクレオチドである、請求項30に記載の方法。
【請求項1】
キャップ非依存性RNA翻訳効率の制御要素であって、
少なくとも1つのステム−ループ構造を形成可能なポリリボヌクレオチドであり、該ポリリボヌクレオチドの近傍に接続される内部リボソーム導入部位を介してキャップ非依存性RNAの翻訳効率を向上させるポリリボヌクレオチドをコードするポリヌクレオチドである、翻訳効率制御要素。
【請求項2】
前記ステム−ループ構造のステムは6塩基対以上30塩基対以下の二重鎖または部分二重鎖を形成する、請求項1に記載の翻訳効率制御要素。
【請求項3】
配列番号1に記載の塩基配列の第13位〜第34位の塩基配列を有するポリヌクレオチドであるキャップ非依存性RNA翻訳効率の制御要素。
【請求項4】
配列番号2に記載の塩基配列の第13位〜第65位の塩基配列を有するポリヌクレオチドであるキャップ非依存性RNA翻訳効率の制御要素。
【請求項5】
前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有する、請求項1〜4のいずれかに記載の翻訳効率制御要素。
【請求項6】
前記内部リボソーム導入部位は、植物ウイルスゲノムにコードされる内部リボソーム導入部位である、請求項1〜5のいずれかに記載の翻訳効率制御要素。
【請求項7】
前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位である、請求項1〜6のいずれかに記載の翻訳効率制御要素。
【請求項8】
植物細胞におけるキャップ非依存性RNAの翻訳効率制御要素である、請求項1〜7のいずれかに記載の翻訳効率制御要素。
【請求項9】
キャップ非依存性RNA翻訳開始要素であって、
請求項1〜4のいずれかに記載のキャップ非依存性RNAの翻訳効率制御要素を有するポリヌクレオチド鎖と、
該翻訳効率制御要素によってキャップ非依存性RNA翻訳効率を向上可能に結合された内部リボソーム導入部位をコードするポリヌクレオチド鎖と、
を備える、翻訳開始要素。
【請求項10】
前記翻訳効率制御要素は、前記内部リボソーム導入部位によるキャップ非依存性RNA翻訳効率を10倍以上向上させる、請求項9に記載の翻訳開始要素。
【請求項11】
前記内部リボソーム導入部位は、1以上8以下のステム−ループ構造を有する、請求項9または10に記載の翻訳開始要素。
【請求項12】
前記内部リボソーム導入部位は、植物ウイルスゲノムにコードされる内部リボソーム導入部位である、請求項9〜11のいずれかに記載の翻訳開始要素。
【請求項13】
前記内部リボソーム導入部位は、アブラナ感染性トバモウイルス(crucifer-infecting tobamovirus)の移動タンパク質をコードする遺伝子またはコートタンパク質をコードする遺伝子の内部リボソーム導入部位である、請求項9〜12のいずれかに記載の翻訳開始要素。
【請求項14】
配列番号3に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項15】
配列番号4に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項16】
配列番号5に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項17】
配列番号6に記載の配列を有する、請求項9〜13のいずれかに記載の翻訳開始要素。
【請求項18】
発現ベクターであって、真核細胞で動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性RNA翻訳開始要素と、を備える、発現ベクター。
【請求項19】
前記プロモーターによって作動可能に結合されるとともに前記キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合される、タンパク質のコード領域を有する領域を含むポリヌクレオチド鎖、を備える、請求項18に記載の発現ベクター。
【請求項20】
前記プロモーターによって作動可能に結合されキャップ依存的に翻訳されるタンパク質のコードするポリヌクレオチド鎖を備える、請求項19に記載の発現ベクター。
【請求項21】
プラスミドベクターである、請求項18〜20のいずれかに記載の発現ベクター。
【請求項22】
植物細胞用である、請求項18〜21のいずれかに記載の発現ベクター。
【請求項23】
真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性RNA翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体。
【請求項24】
前記形質転換体は植物細胞である、請求項23に記載の形質転換体。
【請求項25】
前記形質転換体は植物体である、請求項24に記載の形質転換体。
【請求項26】
遺伝子の発現方法であって、
真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体において、前記コード領域にコードされたタンパク質を発現させる工程を備える、発現方法。
【請求項27】
前記形質転換体は植物体である、請求項26に記載の発現方法。
【請求項28】
形質転換体を用いた遺伝子産物の製造方法であって、
真核細胞において動作可能なプロモーターと、該プロモーターの下流側に結合された請求項9〜17のいずれかに記載のキャップ非依存性RNA翻訳開始要素と、前記プロモーターによって作動可能であって該キャップ非依存性翻訳開始要素によって翻訳開始可能に結合されたタンパク質のコード領域を有するポリヌクレオチド鎖と、を保持する、形質転換体を増殖あるいは生育させて、前記コード領域にコードされた前記タンパク質を製造する工程を備える、遺伝子産物の製造方法。
【請求項29】
前記形質転換体は植物体である、請求項28に記載の遺伝子産物の製造方法。
【請求項30】
内部リボソーム導入部位の上流側に少なくとも一つのステム−ループ構造を有するポリリボヌクレオチドを挿入することにより、前記内部リボソーム導入部位を介した翻訳開始効率を上昇させる方法。
【請求項31】
前記ポリリボヌクレオチドは、請求項1〜4に記載のポリヌクレオチドによってコードされるポリリボヌクレオチドである、請求項30に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2006−55091(P2006−55091A)
【公開日】平成18年3月2日(2006.3.2)
【国際特許分類】
【出願番号】特願2004−241216(P2004−241216)
【出願日】平成16年8月20日(2004.8.20)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【出願人】(504182255)国立大学法人横浜国立大学 (429)
【出願人】(504143441)国立大学法人 奈良先端科学技術大学院大学 (226)
【出願人】(000183646)出光興産株式会社 (2,069)
【出願人】(000122298)王子製紙株式会社 (2,055)
【出願人】(000001904)サントリー株式会社 (319)
【出願人】(000206211)大成建設株式会社 (1,602)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【Fターム(参考)】
【公開日】平成18年3月2日(2006.3.2)
【国際特許分類】
【出願日】平成16年8月20日(2004.8.20)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【出願人】(504182255)国立大学法人横浜国立大学 (429)
【出願人】(504143441)国立大学法人 奈良先端科学技術大学院大学 (226)
【出願人】(000183646)出光興産株式会社 (2,069)
【出願人】(000122298)王子製紙株式会社 (2,055)
【出願人】(000001904)サントリー株式会社 (319)
【出願人】(000206211)大成建設株式会社 (1,602)
【出願人】(000003160)東洋紡績株式会社 (3,622)
【Fターム(参考)】
[ Back to top ]

