新規なカリックスクラウン誘導体、その製造方法、それを利用して製造された自己組立単分子層、及びその自己組立単分子層を利用する蛋白質単分子層の固定化方法
【課題】従来の蛋白質固定化方法が有していた、濃度、活性及び配向性等の問題を解決する。
【解決手段】本発明は、蛋白質単分子層を固定化させるために使用される、自己組立単分子層の製造に必須的な、化学式(1)乃至(3)の、カリックスクラウン誘導体、及びその合成方法を提供する。本発明は、また、化学式(1)乃至(3)の化合物を含有する有機溶液に、真空蒸着された金基質又は関連金属基質を浸して製造される自己組立単分子層、及びこの自己組立単分子層上に分子量が20,000D(20KD)以上の蛋白質を固定化させる蛋白質単分子層の固定化方法を提供する。
【解決手段】本発明は、蛋白質単分子層を固定化させるために使用される、自己組立単分子層の製造に必須的な、化学式(1)乃至(3)の、カリックスクラウン誘導体、及びその合成方法を提供する。本発明は、また、化学式(1)乃至(3)の化合物を含有する有機溶液に、真空蒸着された金基質又は関連金属基質を浸して製造される自己組立単分子層、及びこの自己組立単分子層上に分子量が20,000D(20KD)以上の蛋白質を固定化させる蛋白質単分子層の固定化方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規なカリックスクラウン(キャリックスクラウン)誘導体、その製造方法、それを利用して製造された自己組立単分子層、及び自己組立単分子層を利用する蛋白質単分子層の固定化方法に関する。より具体的には、本発明は、多重イオン認識により、蛋白質を固定することができる、自己組立単分子層の製造に必須的な、チオール基が付着された、新規なカリックスクラウン誘導体、及びその製造方法、上記カリックスクラウン誘導体を金基質又は関連金属基質上に適用して製造される自己組立単分子層、及びその自己組立単分子層を利用する蛋白質単分子層の固定化方法に関する。
【背景技術】
【0002】
酵素、抗原、抗体等を、固体基質に固定化する方法は、免疫化学と酵素化学等、生命科学や蛋白質を使用する分野において、全ての分析の最も基礎的な基盤技術となる。例えば、生命工学分野において多く使用される、ELISA(Enzyme Linked Immunoassay)法等は、特定の蛋白質又は病原を起こす特異蛋白質を分析するために、実験室や臨床医学の分野において多く使用されている方法であって、この方法を使用するために必要な分析用キットが、既に市場において販売されている。さらに最近では、固体マトリックス上に蛋白質を固定化させるための改良された方法を必要とする蛋白質チップの開発が、ゲノム研究以後の段階で蛋白質工学研究をさらに進展させるべく、生物工学分野において大きな関心になっている。
【0003】
抗体、抗原及び酵素等の蛋白質の表面を固定化させる方法としては、従来から、物理吸着方式により、主に高分子基質やニトロセルロース基質に、蛋白質の表面を固定化させる方式が利用されてきたが、最近は、蛋白質と基質表面の間に炭素結合を形成する化学反応による表面固定化方式が登場した。
【0004】
また、固体基質上に、ビオチン(biotin)を付着させた後、そのビオチン層上に、アビジン(avidin)や、ストレプトアビジン(streptoavidin)を、化学結合方式により付着させ、ビオチンが付着された蛋白質を利用する、三重分子層による蛋白質固定化方式が、文献(Science,1993年 Vol 262,pp. 1706-1708)に発表された。
【0005】
しかし、従来から使用されていた物理吸着方式、最近使用され始めた炭素結合方式、ビオチン−アビジン引力を利用した方式等の、蛋白質固定化方法において現れている問題点は、次のとおりである。
【0006】
1.濃度:従来から知られている蛋白質の固定化反応において最も問題となることは、表面に固定化された蛋白質の量がかなり少ないことである。表面に固定化された蛋白質の濃度が低いと、他の蛋白質が、非特異性固定化反応により固体基質表面の空間に固定化され得るので、蛋白質が固定化されていない部分が反応性を有しないように、化学的な処理等をしなければならない。しかし、上記の化学的な処理過程において、固定化された蛋白質分子の活性に問題が生じる可能性があり、分析しようとする特定の蛋白質を付着させる時も、その蛋白質のかなり少ない量のみが認識されるため、分析しようとする蛋白質の量が微量となるので、多様な分析実験方式を通じて確認を行わなければならない。特に、基質の単位面積当たり、その表面に固定化される蛋白質の量が多いほど、分析が容易になるので、固定化された蛋白質の量を最大化した蛋白質単分子層の開発に対し、多くの研究が行われたが、未だ満足できる結果は得られていない。
【0007】
2.活性:化学結合による方式や、表面における物理吸着による方式等の、既存の固定化方法においては、蛋白質が溶液状で自由に漂う時より、基質の表面に固定化される時の方が、より容易に活性を失う場合が多い。その理由は、蛋白質が固体基質に固定化される時、かなり強く表面に引かれるために、活性位置が変化するからであると考えられている。
【0008】
3.配向性:従来の蛋白質の固定化方法においては、蛋白質分子が表面に固定化されると、必然的に活性位置含有部分が固体基質に向かうようになり、実際に活性がないものと同じになる場合が生じる。これを配向性問題といい、固定化蛋白質分子の約半分程度においてこのような現象が発生する。
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の目的は、前述した従来の蛋白質固定化方法が有していた、濃度、活性及び配向性等の問題を解決するために、蛋白質の固定化方法において使用する、自己組立単分子層に必須的な、蛋白質のアンモニウム基を認識することができる認識基を有するカリックスクラウン誘導体、及びその製造方法を提供することである。
【0010】
本発明の他の目的は、上記の化合物を金基質又は関連金属基質に付着させることにより、全ての種類の蛋白質について、何等の加工過程を必要とすることなく、蛋白質が表面に密に満たされた蛋白質単分子層を生成することができる、カリックスクラウン誘導体の自己組立単分子層を提供することである。
【0011】
本発明のさらに他の目的は、上記の自己組立単分子層上に、分子量が20,000D(20KD)以上の、抗原、抗体、及び酵素等の蛋白質分子を固定させる、蛋白質の固定化方法を提供することである。
【0012】
本発明のさらに他の目的は、蛋白質チップ、診断キット、蛋白質分離パック等を製造するための、金、銀、ガラス、珪素、ポリスチレン、ポリカーボネート等の無機又は有機固体基質の上に、下記式(1)乃至(3)の化合物を適用することによる上記蛋白質分子の固定化方法を提供することである。
【課題を解決するための手段】
【0013】
蛋白質固定化方法において使用される、自己組立単分子層に必須的な、新規なカリックスクラウン誘導体は、下記化学式(1)乃至(3)の構造を有する化合物である。
【化1】

上記式(1)中において、R1、R2、R3及びR4は、互いに独立的に−CH2SH基を示すか、又はR1乃至R4のうち二つが、互いに結合してそれぞれ−CH2−S−S−CH2−基を形成することができ;又はR1、R2、R3及びR4は、独立的に−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOHであり得る。
【0014】
【化2】

上記式(2)中において、nは1であり;R1、R2、R3及びR4は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれHを示すことができ;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。
【0015】
【化3】

上記式(3)中において、nは2であり;R1、R2、R3及びR4は、互いに独立的に−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれ−H基を示し;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。
【発明を実施するための最良の形態】
【0016】
上記化学式(1)乃至(3)の化合物を、一般的に命名する時、カリックスクラウン誘導体といい、具体的には、化学式(1)の化合物は、カリックス[4]アレン−ビスクラウン−4と、化学式(2)の化合物は、カリックス[4]アレン−クラウン−5と、化学式(3)の化合物は、カリックス[4]アレン−クラウン−6と命名する。
【0017】
化学式(1)乃至(3)の化合物を合成するための出発物質は、R1、R2、R3及びR4がHであり、R5及びR6が−CH3のカリックス[4]アレン−クラウン−5と、−6、及びR1、R2、R3及びR4がHのカリックス[4]アレン−ビスクラウン−4であって、これらの出発物質は、文献(米国化学会誌、J.Am.Chem.Soc.,1995年,Vol 117,pp 2767-2777;Tetrahedron,1997年,Vol 53,pp 3767-3776)に発表された方法に従って合成する。
【0018】
本発明の化学式(1)乃至(3)の化合物は、上記の公知の方法により合成された出発物質をクロロメチル化反応に付して、R1乃至R4のうち、二つ又は四つの作用基を−CH2Cl基に変換させた後、場合により通常の方法で、それぞれのCl基を、チオール(−SH)、シアノ(−CN)、アルデヒド(−CHO)、アミド(−NH2)又はカルボン酸(−COOH)基に変換させるか、又は二つのCl基をジスルフィド(−S−S−)基に変換させて製造する。
【0019】
従来のクロロメチル基付着反応においては、クラウン基にクロロメチル基を付着する時に使用するルイス酸(SnCl4等)のためにクラウン基が容易に破壊されたが、本発明の製造方法においては、クラウン基に全く影響を与えず、クロロメチル基のみを付着させることができ、高収率でカリックスクラウン誘導体を合成することができる。本発明においては、クロロメチル基への変換試薬として、CH3−O−CH2Clを使用し、ルイス酸としては、SnCl4を使用する。R1、R2、R3及びR4が、チオール基を有するか、又はこれらがジスルフィド基を形成する化学式(1)乃至(3)の化合物を製造するために、クロロメチル基をチオールやジスルフィド基に変換させる場合は、NaSHを使用して直接的にチオールに変える方法と、チオウレアと反応させた後、NaOH等の塩基性水溶液において還流を行ってチオールに変換させる方法があり、これらの方法は、いずれも優れた収率で、上記化学式(1)乃至(3)の化合物を合成することができる。
【0020】
また、本発明は、上記の化学式(1)乃至(3)の化合物を、金基質又は関連金属基質に付着させることにより、全ての種類の蛋白質について、何等の加工過程を必要とすることなく、蛋白質が表面に密に満たされた蛋白質単分子層を生成することができる、カリックスクラウン誘導体の、自己組立単分子層を提供するものである。関連金属基質とは、Ag、Pt等の貴金属類を含むものと理解される。
【0021】
さらに、化学式(1)乃至(3)の化合物は、金属、ガラス、珪素、ポリスチレン、ポリカーボネート等の無機又は有機固体基質の上にコーティングされ得る。
【0022】
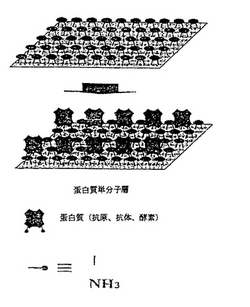
図1は、本発明によるカリックスクラウン誘導体の自己組立単分子層の製造過程を概略的に示す。
【0023】
カリックスクラウン誘導体の自己組立単分子層を製造するための具体的な方法は、次のとおりである:
CHCl3等の有機溶媒に、化学式(1)乃至(3)の化合物を、1−3mM濃度に溶かした溶液を製造する。金基質を、上記製造された溶液中に入れて1乃至24時間浸した後取り出し、これをアセトン溶液及び水でそれぞれ洗滌した後乾燥させると、図1のような、カリックスクラウン誘導体の、自己組立単分子層が完成する。ここで使用される金基質は、いろいろな形態で使用されるが、一般的に、ガラス、溶融石英、シリコンウエハー、プラスチック等に、クロム(Cr)やチタン(Ti)等を5−10nmに蒸着させた後、金を200nm程度蒸着して得られる基質である。このように製造された金基質は、使用直前に、ピランハ(piranha)溶液(過酸化水素水:濃硫酸を、1:2〜3程度の割合で混ぜた混合溶液)に、1分程度浸した後、水で洗滌して使用することが一般的であるが、塩基性溶液において沸かして使用するか、又はオゾン中に通過させてもよい。クリーニング後は、なるべく早く、上記の金基質を使用しなければならず、単分子層の生成は、表面反射赤外線分光分析法を利用して確認する。
【0024】
また、本発明は、カリックスクラウン誘導体のクラウン環を利用して、蛋白質の活性位置の反対側に多量に分布するアンモニウム基等の陽イオンを認識する多重イオン認識による、蛋白質固定化方法を提供するものである。
【0025】
本発明の固定化方式は、蛋白質を利用した全ての種類の分析方法の基盤となるものであり、未だ世界的に類似する研究結果も発表されたことがない。
【0026】
本発明の固定化方法によれば、従来の、蛋白質固定化反応において使用されてきた蛋白質分子の化学的な処理や遺伝子工学的な変換なくして、分子認識作用のうちの一つである多重イオン認識作用を利用して、蛋白質を固体基質の表面に簡単に固定化して、固体基質上に他の蛋白質分子が固定化されない程度に、所望の蛋白質分子が密に満たされた蛋白質の単分子層を提供することができる。
【0027】
上記のような蛋白質の単分子層が製造されるなら、次の測定に影響を及ぼさない程度に、空間がほとんど存在しないので、従来の固定化方法において発生していた濃度問題と、非特異性固定化反応に対する問題等が、同時に解決される。
【0028】
また、本発明は、従来の固定化反応とは確然と区別される、化学結合力に比して相対的に弱い力による多重イオン認識により固定化が行われるので、表面に引かれる力による活性減少効果が、従来の方法に比して相対的に小さく現れる。これは、蛋白質の二重分子層の製造により確認することができる。
【0029】
また、本発明の方法により製造された蛋白質単分子層において、ほとんどの抗原、抗体、及び酵素を含む蛋白質は、アンモニウム基等の陽イオンが最も多く分布する場所が、ほとんどの場合、蛋白質の活性位置の反対側にあるため、配向性問題を適切な水準で解決することができる。
【0030】
実際に、図3において認められるように、抗原−抗体反応を、抗原又は抗体単分子層において実施して、実時間帯に微細重さ変化を直接的に測定すると、全ての固定化された抗原分子に抗体分子が、又は固定化された全ての抗体分子に抗原分子が付着されるという結果を得ることができるので、本発明により製造された蛋白質単分子層に固定化された蛋白質の活性が、既存の方式に比して、画期的に改善されることを確認することができる。
【0031】
図2は、化学式(1)乃至(3)の化合物により製造された自己組立単分子層に、カリックスクラウン分子の分子認識機能により、蛋白質の−NH3+基が自発的に固定化される、多重イオン認識による、抗原、抗体、酵素等の蛋白質の固定化反応を、概略的に示す図面である。蛋白質が溶けている溶液に、化学式(1)乃至(3)の化合物の自己組立単分子層を浸すと、自発的な認識作用による固定化反応により、約3分から1時間の間に、表面が完全に蛋白質で覆われた、蛋白質の単分子層が形成される。原子間力顕微鏡を使用した表面分析と、クワルツ振動微視秤(Quartz Crystal Microbalance:QCM)を利用して、溶液状において、蛋白質分子が、化学式(1)乃至(3)の化合物の自己組立単分子層上に固定化されて、完全な蛋白質単分子層を形成することを確認することができる。また、サイクリックボルタンメトリーを利用して、静電容量(capacitance)を測定する。いずれの場合も共通して、完全な蛋白質単分子層が、1時間程度で完成されることを確認することができる。
【0032】
図3は、図2において製造された蛋白質単分子層の活性を研究するためのものであり、抗原又は抗体の単分子層と、溶液状の蛋白質との認識過程を示している。クワルツ結晶微視秤を利用して、蛋白質単分子層が形成される時と蛋白質二重分子層が形成される時の微細な重さ変化を測定した結果、抗原単分子層を利用した場合、これに最適の認識を示す抗体の抗原−抗体引力による認識の程度が、その抗体を利用して蛋白質単分子層を製造した場合と、ほとんど一致する変化が現れる。また、反対に、抗体の自己組立単分子層と、溶液状の抗原との反応においても、抗原の自己組立単分子層を製造した場合と、ほとんど同一の結果が得られる。これは、多重イオン認識により、化学式(1)乃至(3)の化合物の自己組立単分子層上に固定化された蛋白質の活性が、極めて優れていることを意味するものである。
【0033】
本発明の、蛋白質単分子層の製造方法を、具体的に説明すると、次のとおりである:
分子量が20,000D(20KD)以上である蛋白質を、数nM乃至数μMの濃度で含有している緩衝溶液に、上記において製造した、カリックスクラウン誘導体の自己組立単分子層を入れた後、1時間乃至2時間が過ぎた後に取り出すと、蛋白質単分子層の製造が完了する。この時、蛋白質が溶けている、緩衝溶液の陽イオン濃度が低いほど、より早く単分子層が生成され、その生成過程は、クワルツ結晶微視秤を利用した、重さ変化の測定により確認することができる。蛋白質単分子層の製造時の、最適の陽イオン濃度は、0.083mM−1.4mMであって、0.083mM未満の低い濃度において、又は10mM以上の高い濃度においては、蛋白質単分子層の生成に要する時間が3時間以上と長くなる。
【0034】
蛋白質単分子層が製造された後、表面において、蛋白質分子等が、ある程度完全に固体基質上を満たしているかは、原子間力顕微鏡を使用して、nmのレベルまで直接的に確認することができる。
【0035】
図5及び図6は、カリックスクラウン誘導体の自己組立単分子層上に生成された、二種類の抗原、抗体の単分子層と、使用した金基質の表面との差を、nm水準において確認したAFMイメージである。金基質の表面と比較すると、上記自己組立単分子層の表面には、他の蛋白質分子が入る程度の大きさの空間がない程に蛋白質分子等が位置しており、完全な単分子層を形成していることを確認することができる。
【0036】
また、高さの変化を見ると、蛋白質単分子層上に他の蛋白質が乗っている(積層している)なら、蛋白質の直径から見て、数nm以上の高さの差を示す筈であるが、ここではその程度の高さの差を示さない。このことから見ても、蛋白質単分子層上に、同一の種類の蛋白質が物理吸着により二重層を形成してしまうような現象はほとんど現れず、蛋白質が大部分単分子層を形成することが分かる。これは、分子認識機能を有するクラウン環の特性により、カリックスクラウン誘導体の自己組立単分子層において、蛋白質のアンモニウム基が認識される時にのみ、蛋白質分子の固定化が進行し、適切な大きさの空間がもはや残っていない場合は、蛋白質が金基質の表面に接近することができないので、蛋白質の表面固定化がそれ以上進行せず、また固定された単分子層上に蛋白質がさらに積層されることもないからである。
【0037】
上記の結果は、QCMを利用した、重さ変化を測定する時にも確認されたが、単分子層が製造された後は、同一の蛋白質の濃度を増加させても、これ以上の重さ変化は現れない。即ち、同一の蛋白質分子間の物理吸着は、蛋白質単分子層が、一旦形成された後は、ほとんど進行されないことが分かる。
【0038】
図4a、4b及び4cは、表面において起こるナノグラムからマイクログラム水準の重さ変化を直接的に測定することができるクワルツ結晶微視秤を使用して、蛋白質単分子層の生成を測定したものである。表面に固定化された物質の重さが増加すると、クワルツ板の振動数が相対的に減少するようになり、この振動数の減少値を、下記サウベリ式(Saubery Equation)に代入して、重さの変化値を得る。
△f=−Cf△m
【0039】
上記式において、△fは振動数の変化を、△mは重さの変化を表し、また、Cfの値は2.26×102cm2MHz/gであって、1Hzの変化は、4.42ng/cm2の重さ変化を示す。上記式によると、図4cのβ−Gal(β−ガラクトシダーゼ)抗体投入において見られるように、分子量が160KDの抗体を使用した場合は、表面に固定化された分子等の重さが約4.2μg/cm2の水準であり、これは約26ピコモルの分子が表面に固定化されることを意味する。図4aと図4bにおいて図示されているように、重さが相対的に軽いβ−Gal抗原やGST(グルタチオン−S−トランスフェラーゼ)抗原の場合は、相対的に、固定化された蛋白質の重さが小さく示されることが分かる(図4a及び4b参照)。
【0040】
固定された蛋白質が極めて高い活性を示すことは、図4a及び4cにおいて示されるように、固定化されたβ−Gal(β−ガラクトシダーゼ)抗原や、抗体に対応する抗体や抗原を、それぞれ投入するか、又はGST(グルタチオン−S−トランスフェラーゼ)抗原単分子層に、抗体(GST抗体)が10−20%の濃度で存在する蛋白質混合溶液を投与して、抗原−抗体引力を通じて、表面に固定化される抗体の量を、直接重さ変化により測定して分かる。図4bは、GST抗原の単分子層に、分子量が150KDのGST抗体が付着される時の重さ変化を示すが、その重さ変化は、図4aにおいて見られるように抗原単分子層にGST抗体と分子量が類似するβ−Gal抗体(分子量160KD)を投入する時と、ほとんど類似することが分かる。図4cは、β−Gal抗体単分子層を製造した場合の重さ変化を示すが、図4aにおいて見られるように、β−Gal抗原の単分子層にβ−Gal抗体が二重分子層として付着する時の重さ変化と、ほとんど同じである。
【0041】
この結果は、大きさが大きい抗体分子が、大きさが相対的に小さい抗原分子の単分子層に付着する時、1対1結合をすると、該抗体の分子層が、抗体のみから形成された単分子層の場合とほとんど同一の程度に密に形成されることを意味する。図4cは、抗体単分子層上に、相対的に大きさが小さい抗原分子が付着される時、ほとんど1対1水準の結合がなされても、抗原の単分子層を製造した場合より、実際に積層される抗原の分子数が少ないので、重さ変化が抗原単分子層を製造した場合より少ないことを示す。単分子層の製造に必要な濃度の抗原が含まれている緩衝溶液を投与して、単分子層の製造を行った後、更に、抗原をより高い濃度により投与した時は、これ以上の意味のある重さ変化が現われないので、単分子層の製造以後は、これ以上同一の蛋白質が、物理吸着により付着はされないことが分かる。
【0042】
各実験時に使用した抗原又は抗体の溶液を、次の蛋白質の投入前に除去し、緩衝溶液を満たした後、次の蛋白質を投入する。上記の実験結果は、表面に固定化された抗原と抗体が、対応する蛋白質と反応(抗原−抗体反応)をするのに十分な程度の、活性を維持していることを示している。
以下において、上述した本発明を例証するために、下記実施例を提供するが、この実施例が、本発明の範囲を限定し、又は制限するものではない。
【実施例】
【0043】
実施例1
【化4】

乾燥した容器にCHCl3 20mLを入れた後、その容器を氷槽に入れて冷やしながら、窒素気流下に攪拌した。その容器内に、CH3OCH2Cl 0.468ml(6.16mmol)を入れ、2分ほど過ぎた後、SnCl4 0.577ml(4.93mmol)を、3〜4分に亙って徐々に入れた。15分後に、CHCl3の適当量(30乃至50ml)に溶かしたカリックス[4]アレン−ビスクラウン−4(CABCR−4)100mg(0.154mmol)を徐々に加えた。5分後に、氷槽を除去し、常温に温度を上げながら、1時間反応させる。反応溶液に、CH2Cl2の適当量(30乃至50ml)を加えて希釈した後、氷を入れて、冷たい状態において攪拌しながら、余分のSnCl4を除去した。有機層を分離した後、冷たい脱イオン水で2回洗滌した。乾燥剤を入れて乾燥した後、乾燥剤を除去し、溶媒を減圧蒸留して除去した後、目的物のTCCABCR−4(102mg、80%収率)を得た。
【数1】

【0044】
実施例2
【化5】

TCCABCR−4 115mg(0.136mmol)と、チオウレア 41.3mg(0.544mmol)を、エタノール 30mLに溶かした。Arガスを1分程度混合物に通過させた後、Ar気体雰囲気下において反応を行った。反応物を、45℃〜55℃において60分間ソニック処理(sonication)した。この混合物に、NaOH 32.64mg(0.816mmol)を入れた後、30分間ソニック処理した。反応後、1N HClにより反応溶液のpHを4に合わせた。反応物を、CH2Cl2の適当量(30乃至50ml)に溶かした後、水でリンスし、有機溶媒を乾燥させた後、有機溶媒を減圧下において除去し、得られた物質を、シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン−エチルアセテート)により精製して、TMCABCR−4 54mgを得た。NaSHを使用して−Clを−SHに変える過程は、TCCABCR−4の8倍モル濃度のNaSHを使用して、エタノール溶媒30mLにおいて1時間ソニック処理し、同じ精製過程を経て行われ、上記の反応と同じ収率の結果物が得られた。
【数2】

【0045】
実施例3
【化6】

TCCABCR−4 115mg(0.136mmol)と、チオウレア 41.3mg(0.544mmol)を、エタノール 30mLに溶かした。溶媒内の酸素を除去せず、反応を行った。反応物を、45℃〜55℃において60分間ソニック処理した。この混合物に、NaOH 32.64mg(0.816mmol)を入れた後、30分間ソニック処理した。反応後、1N HClを使用して反応溶液のpHを4に合わせた。反応物を、CH2Cl2 30乃至50mlに溶かした後、水でリンスし、有機溶媒を乾燥させた後、有機溶媒を減圧下に除去し、得られる物質を、シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン−エチルアセテート)により精製して、DDSCABCR−4 60mgを得た。
【数3】

【0046】
実施例4
【化7】

乾燥した容器にCHCl3 20mLを入れ、その容器を氷槽に入れて冷やしながら、窒素気流下に攪拌した。その容器に、CH3OCH2Cl 0.515mL(6.56mmol)を入れ、2分程度過ぎた後、SnCl4 0.612mL(5.23mmol)を3〜4分に亙って徐々に入れた。
15分後に、1,3−ジメトキシカリックス[4]アレン−クラウン−5(DMCACR−5) 100mg(0.164mmol)を、CHCl3適当量(30乃至50ml)に溶かした後、上記容器に徐々に加えた。DMCACR−5を全て加えた後、5分間、氷槽において攪拌した後、10分に亙って常温に温度を上げた後、1時間反応させた。反応溶液に、CH2Cl2適当量(30乃至50ml)を加えて希釈した後、氷を入れて冷たい状態において攪拌して、余分のSnCl4を除去した。有機層を分離した後、冷たい脱イオン水により2回洗滌した。その後、乾燥剤を入れて乾燥した後これを除去し、溶媒を減圧蒸留して除去した後、結果物TCDMCACR−5(99mg、75%収率)を得た。
【数4】

【0047】
実施例5
【化8】

TCDMCACR−5 100mg(0.124mmol)と、チオウレア 38mg(0.50mmol)を、エタノール 25mLに溶かした。Arガスを1分程度混合物に通過させた後、Ar気体雰囲気下において反応を行った。反応物を、45℃〜55℃において60分間ソニック処理した。この混合物にNaOH 30mg(0.75mmol)を入れた後、30分間ソニック処理した。反応後、1N HClにより、反応溶液のpHを4に合わせた。反応物を、CH2Cl2適当量(30乃至50ml)に溶かした後、水で3回リンスし、これを乾燥した後、有機溶媒を減圧下において除去し、得られる物質を、シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン−エチルアセテート)により精製して、TMDMCACR−5 55mgを得た。
【数5】

【0048】
実施例6
図1のような、カリックスクラウン誘導体の自己組立単分子層を、TMDMCACR−5化合物を利用して製造した。真空蒸着された金基質をクリーニングした後、窒素雰囲気下において乾燥させた。この基質を、TMDMCACR−5が2mM濃度に溶けているCHCl3適当量(30乃至50ml)の溶液に3時間程度浸した。金基質を、アセトンで洗い、乾燥させて、TMDMCACR−5自己組立単分子層の製造を完了した。この基質に、外部反射赤外線分光分析(FT−IR ERS)を行うと、1040cm-1において、クラウン環の特徴的な、C−Oストレッチングモードと、1480cm-1において、カリックスアレンの特徴的な芳香族ストレッチングモードの、強い吸収バンドが現れるので、カリックスクラウン化合物が、基質の表面に、単分子層を形成していることを確認することができた。
【0049】
実施例7
図2のような蛋白質単分子層は、次のように製造することができた。実施例6において製造した、金基質上のカリックスクラウン誘導体の単分子層を、β−ガラクトシダーゼ抗原が0.1μm濃度で存在する0.83mM PBS(リン酸塩緩衝溶液、Na+及びK+含有)緩衝溶液に浸し、1時間後に、緩衝溶液により洗滌すると、β−ガラクトシダーゼ抗原単分子層が製造された。この実験の結果は、クワルツ結晶微視秤を利用して測定した図4aに示されている。実時間帯に、この蛋白質単分子層の製造を行うと、2.4μg/cm2、即ち、2.4μg程度の抗原が、1cm2に固定化された。また、QCM実験時に、固定化がなされるまでは、3分程度の時間が必要であった。固定化された抗原単分子層に対し、原子間力顕微鏡を利用して、実際使用した基質と表面における変化を観察した実験結果が、図5と6に提示されている。図5と6を見ると、表面が蛋白質単分子層製造の前後で完全に相違しており、蛋白質が表面に固定化されていることを確認することができる。たとえ、3分程度で、蛋白質単分子層の製造が完了しても、原子間力顕微鏡測定時のチップ(AFM tip)による摩擦力に耐えるためには、1時間の固定化時間が必要である。図4a、4b及び4cにおいて、最初に投入した蛋白質の濃度は、全て0.1μMである。図4a、4b及び4cは、それぞれの蛋白質単分子層に対応する蛋白質を、0.1μM濃度により投入した時に現れる重さ変化を図示する。図4aは、抗原単分子層に160KDの分子量を有する抗体単分子層を投入すると、抗原の二倍に近い重さ変化が生じることを示しており、図4bは、軽いGST抗原単分子層に分子量が150KDの抗体を投入すると、160KD分子量の抗体をβ−ガラクトシダーゼ抗原単分子層に投入した時と、ほとんど同じ重さ変化が表面において起こることを示す。このような重さ変化は、蛋白質が表面に密に満たされた時の重さ変化と一致するものであり、これは、表面に固定化された蛋白質等が活性をほとんど完全に維持していることを示す。
【0050】
本発明は、従来の蛋白質固定化方法として使用された化学結合方式や物理吸着方式等において現れた問題点を解決することができる、分子認識を利用した、新規な蛋白質固定化方法である。この方法は、単純に、カリックスクラウン化合物が自己組立単分子層をなしている固体基質を、固定化させる蛋白質の水溶液に浸しておくだけで、1時間以内に、分子量20,000D(20KD)以上の全ての種類の蛋白質を、活性を失わない状態で、他の蛋白質が固定化される空間を残さない程度に密に付着させることができる。これにより、非特異性蛋白質の固定化を誘発していた、従来の固定化反応における大きな問題点が解決されると同時に、非特異性蛋白質の固定化を抑制するために、必須的に使用しなければならなかった化学物質の使用を不要にして、時間を節約するとともに、固定化された蛋白質の活性維持を画期的に改善し、また、特定蛋白質の認識に必要な蛋白質単分子層を直接製造して使用するので、時間と経費の節減の効果が極めて大きい。従って、本発明は、蛋白質チップ、診断キット及びバイオセンサーの未来の開発に対し幅広く適用することができる。また、カリックスクラウン誘導体を、既存の方式により製造する時は、クラウン環の安定性が問題となっていたが、本発明においては、このような問題点は解決され、高い収率で所望のカリックスクラウン分子の合成をすることができるようになった。
【図面の簡単な説明】
【0051】
【図1】本発明のカリックスクラウン誘導体の自己組立単分子層の製造過程の概略図である。
【図2】本発明の蛋白質単分子層の固定化方法についての概略図である。
【図3】図2において製造された蛋白質単分子層の活性を研究するために、抗原又は抗体の単分子層と、溶液状の蛋白質との認識過程を示す概略図である。
【図4】蛋白質単分子層の製造と、その蛋白質単分子層に対応する蛋白質を投与して、実時間帯において、抗原−抗体引力を測定した結果を示す図である。
【図5】カリックスクラウン単分子層上に製造されたβ−ガラクトシダーゼ抗原蛋白質単分子層を、原子間力顕微鏡(Atomic Force Microscope:AFM)で撮った写真である。
【図6】カリックスクラウン単分子層上に製造されたβ−ガラクトシダーゼ抗体蛋白質単分子層を、原子間力顕微鏡で撮った写真である。
【技術分野】
【0001】
本発明は、新規なカリックスクラウン(キャリックスクラウン)誘導体、その製造方法、それを利用して製造された自己組立単分子層、及び自己組立単分子層を利用する蛋白質単分子層の固定化方法に関する。より具体的には、本発明は、多重イオン認識により、蛋白質を固定することができる、自己組立単分子層の製造に必須的な、チオール基が付着された、新規なカリックスクラウン誘導体、及びその製造方法、上記カリックスクラウン誘導体を金基質又は関連金属基質上に適用して製造される自己組立単分子層、及びその自己組立単分子層を利用する蛋白質単分子層の固定化方法に関する。
【背景技術】
【0002】
酵素、抗原、抗体等を、固体基質に固定化する方法は、免疫化学と酵素化学等、生命科学や蛋白質を使用する分野において、全ての分析の最も基礎的な基盤技術となる。例えば、生命工学分野において多く使用される、ELISA(Enzyme Linked Immunoassay)法等は、特定の蛋白質又は病原を起こす特異蛋白質を分析するために、実験室や臨床医学の分野において多く使用されている方法であって、この方法を使用するために必要な分析用キットが、既に市場において販売されている。さらに最近では、固体マトリックス上に蛋白質を固定化させるための改良された方法を必要とする蛋白質チップの開発が、ゲノム研究以後の段階で蛋白質工学研究をさらに進展させるべく、生物工学分野において大きな関心になっている。
【0003】
抗体、抗原及び酵素等の蛋白質の表面を固定化させる方法としては、従来から、物理吸着方式により、主に高分子基質やニトロセルロース基質に、蛋白質の表面を固定化させる方式が利用されてきたが、最近は、蛋白質と基質表面の間に炭素結合を形成する化学反応による表面固定化方式が登場した。
【0004】
また、固体基質上に、ビオチン(biotin)を付着させた後、そのビオチン層上に、アビジン(avidin)や、ストレプトアビジン(streptoavidin)を、化学結合方式により付着させ、ビオチンが付着された蛋白質を利用する、三重分子層による蛋白質固定化方式が、文献(Science,1993年 Vol 262,pp. 1706-1708)に発表された。
【0005】
しかし、従来から使用されていた物理吸着方式、最近使用され始めた炭素結合方式、ビオチン−アビジン引力を利用した方式等の、蛋白質固定化方法において現れている問題点は、次のとおりである。
【0006】
1.濃度:従来から知られている蛋白質の固定化反応において最も問題となることは、表面に固定化された蛋白質の量がかなり少ないことである。表面に固定化された蛋白質の濃度が低いと、他の蛋白質が、非特異性固定化反応により固体基質表面の空間に固定化され得るので、蛋白質が固定化されていない部分が反応性を有しないように、化学的な処理等をしなければならない。しかし、上記の化学的な処理過程において、固定化された蛋白質分子の活性に問題が生じる可能性があり、分析しようとする特定の蛋白質を付着させる時も、その蛋白質のかなり少ない量のみが認識されるため、分析しようとする蛋白質の量が微量となるので、多様な分析実験方式を通じて確認を行わなければならない。特に、基質の単位面積当たり、その表面に固定化される蛋白質の量が多いほど、分析が容易になるので、固定化された蛋白質の量を最大化した蛋白質単分子層の開発に対し、多くの研究が行われたが、未だ満足できる結果は得られていない。
【0007】
2.活性:化学結合による方式や、表面における物理吸着による方式等の、既存の固定化方法においては、蛋白質が溶液状で自由に漂う時より、基質の表面に固定化される時の方が、より容易に活性を失う場合が多い。その理由は、蛋白質が固体基質に固定化される時、かなり強く表面に引かれるために、活性位置が変化するからであると考えられている。
【0008】
3.配向性:従来の蛋白質の固定化方法においては、蛋白質分子が表面に固定化されると、必然的に活性位置含有部分が固体基質に向かうようになり、実際に活性がないものと同じになる場合が生じる。これを配向性問題といい、固定化蛋白質分子の約半分程度においてこのような現象が発生する。
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の目的は、前述した従来の蛋白質固定化方法が有していた、濃度、活性及び配向性等の問題を解決するために、蛋白質の固定化方法において使用する、自己組立単分子層に必須的な、蛋白質のアンモニウム基を認識することができる認識基を有するカリックスクラウン誘導体、及びその製造方法を提供することである。
【0010】
本発明の他の目的は、上記の化合物を金基質又は関連金属基質に付着させることにより、全ての種類の蛋白質について、何等の加工過程を必要とすることなく、蛋白質が表面に密に満たされた蛋白質単分子層を生成することができる、カリックスクラウン誘導体の自己組立単分子層を提供することである。
【0011】
本発明のさらに他の目的は、上記の自己組立単分子層上に、分子量が20,000D(20KD)以上の、抗原、抗体、及び酵素等の蛋白質分子を固定させる、蛋白質の固定化方法を提供することである。
【0012】
本発明のさらに他の目的は、蛋白質チップ、診断キット、蛋白質分離パック等を製造するための、金、銀、ガラス、珪素、ポリスチレン、ポリカーボネート等の無機又は有機固体基質の上に、下記式(1)乃至(3)の化合物を適用することによる上記蛋白質分子の固定化方法を提供することである。
【課題を解決するための手段】
【0013】
蛋白質固定化方法において使用される、自己組立単分子層に必須的な、新規なカリックスクラウン誘導体は、下記化学式(1)乃至(3)の構造を有する化合物である。
【化1】

上記式(1)中において、R1、R2、R3及びR4は、互いに独立的に−CH2SH基を示すか、又はR1乃至R4のうち二つが、互いに結合してそれぞれ−CH2−S−S−CH2−基を形成することができ;又はR1、R2、R3及びR4は、独立的に−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOHであり得る。
【0014】
【化2】

上記式(2)中において、nは1であり;R1、R2、R3及びR4は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれHを示すことができ;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。
【0015】
【化3】

上記式(3)中において、nは2であり;R1、R2、R3及びR4は、互いに独立的に−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれ−H基を示し;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。
【発明を実施するための最良の形態】
【0016】
上記化学式(1)乃至(3)の化合物を、一般的に命名する時、カリックスクラウン誘導体といい、具体的には、化学式(1)の化合物は、カリックス[4]アレン−ビスクラウン−4と、化学式(2)の化合物は、カリックス[4]アレン−クラウン−5と、化学式(3)の化合物は、カリックス[4]アレン−クラウン−6と命名する。
【0017】
化学式(1)乃至(3)の化合物を合成するための出発物質は、R1、R2、R3及びR4がHであり、R5及びR6が−CH3のカリックス[4]アレン−クラウン−5と、−6、及びR1、R2、R3及びR4がHのカリックス[4]アレン−ビスクラウン−4であって、これらの出発物質は、文献(米国化学会誌、J.Am.Chem.Soc.,1995年,Vol 117,pp 2767-2777;Tetrahedron,1997年,Vol 53,pp 3767-3776)に発表された方法に従って合成する。
【0018】
本発明の化学式(1)乃至(3)の化合物は、上記の公知の方法により合成された出発物質をクロロメチル化反応に付して、R1乃至R4のうち、二つ又は四つの作用基を−CH2Cl基に変換させた後、場合により通常の方法で、それぞれのCl基を、チオール(−SH)、シアノ(−CN)、アルデヒド(−CHO)、アミド(−NH2)又はカルボン酸(−COOH)基に変換させるか、又は二つのCl基をジスルフィド(−S−S−)基に変換させて製造する。
【0019】
従来のクロロメチル基付着反応においては、クラウン基にクロロメチル基を付着する時に使用するルイス酸(SnCl4等)のためにクラウン基が容易に破壊されたが、本発明の製造方法においては、クラウン基に全く影響を与えず、クロロメチル基のみを付着させることができ、高収率でカリックスクラウン誘導体を合成することができる。本発明においては、クロロメチル基への変換試薬として、CH3−O−CH2Clを使用し、ルイス酸としては、SnCl4を使用する。R1、R2、R3及びR4が、チオール基を有するか、又はこれらがジスルフィド基を形成する化学式(1)乃至(3)の化合物を製造するために、クロロメチル基をチオールやジスルフィド基に変換させる場合は、NaSHを使用して直接的にチオールに変える方法と、チオウレアと反応させた後、NaOH等の塩基性水溶液において還流を行ってチオールに変換させる方法があり、これらの方法は、いずれも優れた収率で、上記化学式(1)乃至(3)の化合物を合成することができる。
【0020】
また、本発明は、上記の化学式(1)乃至(3)の化合物を、金基質又は関連金属基質に付着させることにより、全ての種類の蛋白質について、何等の加工過程を必要とすることなく、蛋白質が表面に密に満たされた蛋白質単分子層を生成することができる、カリックスクラウン誘導体の、自己組立単分子層を提供するものである。関連金属基質とは、Ag、Pt等の貴金属類を含むものと理解される。
【0021】
さらに、化学式(1)乃至(3)の化合物は、金属、ガラス、珪素、ポリスチレン、ポリカーボネート等の無機又は有機固体基質の上にコーティングされ得る。
【0022】
図1は、本発明によるカリックスクラウン誘導体の自己組立単分子層の製造過程を概略的に示す。
【0023】
カリックスクラウン誘導体の自己組立単分子層を製造するための具体的な方法は、次のとおりである:
CHCl3等の有機溶媒に、化学式(1)乃至(3)の化合物を、1−3mM濃度に溶かした溶液を製造する。金基質を、上記製造された溶液中に入れて1乃至24時間浸した後取り出し、これをアセトン溶液及び水でそれぞれ洗滌した後乾燥させると、図1のような、カリックスクラウン誘導体の、自己組立単分子層が完成する。ここで使用される金基質は、いろいろな形態で使用されるが、一般的に、ガラス、溶融石英、シリコンウエハー、プラスチック等に、クロム(Cr)やチタン(Ti)等を5−10nmに蒸着させた後、金を200nm程度蒸着して得られる基質である。このように製造された金基質は、使用直前に、ピランハ(piranha)溶液(過酸化水素水:濃硫酸を、1:2〜3程度の割合で混ぜた混合溶液)に、1分程度浸した後、水で洗滌して使用することが一般的であるが、塩基性溶液において沸かして使用するか、又はオゾン中に通過させてもよい。クリーニング後は、なるべく早く、上記の金基質を使用しなければならず、単分子層の生成は、表面反射赤外線分光分析法を利用して確認する。
【0024】
また、本発明は、カリックスクラウン誘導体のクラウン環を利用して、蛋白質の活性位置の反対側に多量に分布するアンモニウム基等の陽イオンを認識する多重イオン認識による、蛋白質固定化方法を提供するものである。
【0025】
本発明の固定化方式は、蛋白質を利用した全ての種類の分析方法の基盤となるものであり、未だ世界的に類似する研究結果も発表されたことがない。
【0026】
本発明の固定化方法によれば、従来の、蛋白質固定化反応において使用されてきた蛋白質分子の化学的な処理や遺伝子工学的な変換なくして、分子認識作用のうちの一つである多重イオン認識作用を利用して、蛋白質を固体基質の表面に簡単に固定化して、固体基質上に他の蛋白質分子が固定化されない程度に、所望の蛋白質分子が密に満たされた蛋白質の単分子層を提供することができる。
【0027】
上記のような蛋白質の単分子層が製造されるなら、次の測定に影響を及ぼさない程度に、空間がほとんど存在しないので、従来の固定化方法において発生していた濃度問題と、非特異性固定化反応に対する問題等が、同時に解決される。
【0028】
また、本発明は、従来の固定化反応とは確然と区別される、化学結合力に比して相対的に弱い力による多重イオン認識により固定化が行われるので、表面に引かれる力による活性減少効果が、従来の方法に比して相対的に小さく現れる。これは、蛋白質の二重分子層の製造により確認することができる。
【0029】
また、本発明の方法により製造された蛋白質単分子層において、ほとんどの抗原、抗体、及び酵素を含む蛋白質は、アンモニウム基等の陽イオンが最も多く分布する場所が、ほとんどの場合、蛋白質の活性位置の反対側にあるため、配向性問題を適切な水準で解決することができる。
【0030】
実際に、図3において認められるように、抗原−抗体反応を、抗原又は抗体単分子層において実施して、実時間帯に微細重さ変化を直接的に測定すると、全ての固定化された抗原分子に抗体分子が、又は固定化された全ての抗体分子に抗原分子が付着されるという結果を得ることができるので、本発明により製造された蛋白質単分子層に固定化された蛋白質の活性が、既存の方式に比して、画期的に改善されることを確認することができる。
【0031】
図2は、化学式(1)乃至(3)の化合物により製造された自己組立単分子層に、カリックスクラウン分子の分子認識機能により、蛋白質の−NH3+基が自発的に固定化される、多重イオン認識による、抗原、抗体、酵素等の蛋白質の固定化反応を、概略的に示す図面である。蛋白質が溶けている溶液に、化学式(1)乃至(3)の化合物の自己組立単分子層を浸すと、自発的な認識作用による固定化反応により、約3分から1時間の間に、表面が完全に蛋白質で覆われた、蛋白質の単分子層が形成される。原子間力顕微鏡を使用した表面分析と、クワルツ振動微視秤(Quartz Crystal Microbalance:QCM)を利用して、溶液状において、蛋白質分子が、化学式(1)乃至(3)の化合物の自己組立単分子層上に固定化されて、完全な蛋白質単分子層を形成することを確認することができる。また、サイクリックボルタンメトリーを利用して、静電容量(capacitance)を測定する。いずれの場合も共通して、完全な蛋白質単分子層が、1時間程度で完成されることを確認することができる。
【0032】
図3は、図2において製造された蛋白質単分子層の活性を研究するためのものであり、抗原又は抗体の単分子層と、溶液状の蛋白質との認識過程を示している。クワルツ結晶微視秤を利用して、蛋白質単分子層が形成される時と蛋白質二重分子層が形成される時の微細な重さ変化を測定した結果、抗原単分子層を利用した場合、これに最適の認識を示す抗体の抗原−抗体引力による認識の程度が、その抗体を利用して蛋白質単分子層を製造した場合と、ほとんど一致する変化が現れる。また、反対に、抗体の自己組立単分子層と、溶液状の抗原との反応においても、抗原の自己組立単分子層を製造した場合と、ほとんど同一の結果が得られる。これは、多重イオン認識により、化学式(1)乃至(3)の化合物の自己組立単分子層上に固定化された蛋白質の活性が、極めて優れていることを意味するものである。
【0033】
本発明の、蛋白質単分子層の製造方法を、具体的に説明すると、次のとおりである:
分子量が20,000D(20KD)以上である蛋白質を、数nM乃至数μMの濃度で含有している緩衝溶液に、上記において製造した、カリックスクラウン誘導体の自己組立単分子層を入れた後、1時間乃至2時間が過ぎた後に取り出すと、蛋白質単分子層の製造が完了する。この時、蛋白質が溶けている、緩衝溶液の陽イオン濃度が低いほど、より早く単分子層が生成され、その生成過程は、クワルツ結晶微視秤を利用した、重さ変化の測定により確認することができる。蛋白質単分子層の製造時の、最適の陽イオン濃度は、0.083mM−1.4mMであって、0.083mM未満の低い濃度において、又は10mM以上の高い濃度においては、蛋白質単分子層の生成に要する時間が3時間以上と長くなる。
【0034】
蛋白質単分子層が製造された後、表面において、蛋白質分子等が、ある程度完全に固体基質上を満たしているかは、原子間力顕微鏡を使用して、nmのレベルまで直接的に確認することができる。
【0035】
図5及び図6は、カリックスクラウン誘導体の自己組立単分子層上に生成された、二種類の抗原、抗体の単分子層と、使用した金基質の表面との差を、nm水準において確認したAFMイメージである。金基質の表面と比較すると、上記自己組立単分子層の表面には、他の蛋白質分子が入る程度の大きさの空間がない程に蛋白質分子等が位置しており、完全な単分子層を形成していることを確認することができる。
【0036】
また、高さの変化を見ると、蛋白質単分子層上に他の蛋白質が乗っている(積層している)なら、蛋白質の直径から見て、数nm以上の高さの差を示す筈であるが、ここではその程度の高さの差を示さない。このことから見ても、蛋白質単分子層上に、同一の種類の蛋白質が物理吸着により二重層を形成してしまうような現象はほとんど現れず、蛋白質が大部分単分子層を形成することが分かる。これは、分子認識機能を有するクラウン環の特性により、カリックスクラウン誘導体の自己組立単分子層において、蛋白質のアンモニウム基が認識される時にのみ、蛋白質分子の固定化が進行し、適切な大きさの空間がもはや残っていない場合は、蛋白質が金基質の表面に接近することができないので、蛋白質の表面固定化がそれ以上進行せず、また固定された単分子層上に蛋白質がさらに積層されることもないからである。
【0037】
上記の結果は、QCMを利用した、重さ変化を測定する時にも確認されたが、単分子層が製造された後は、同一の蛋白質の濃度を増加させても、これ以上の重さ変化は現れない。即ち、同一の蛋白質分子間の物理吸着は、蛋白質単分子層が、一旦形成された後は、ほとんど進行されないことが分かる。
【0038】
図4a、4b及び4cは、表面において起こるナノグラムからマイクログラム水準の重さ変化を直接的に測定することができるクワルツ結晶微視秤を使用して、蛋白質単分子層の生成を測定したものである。表面に固定化された物質の重さが増加すると、クワルツ板の振動数が相対的に減少するようになり、この振動数の減少値を、下記サウベリ式(Saubery Equation)に代入して、重さの変化値を得る。
△f=−Cf△m
【0039】
上記式において、△fは振動数の変化を、△mは重さの変化を表し、また、Cfの値は2.26×102cm2MHz/gであって、1Hzの変化は、4.42ng/cm2の重さ変化を示す。上記式によると、図4cのβ−Gal(β−ガラクトシダーゼ)抗体投入において見られるように、分子量が160KDの抗体を使用した場合は、表面に固定化された分子等の重さが約4.2μg/cm2の水準であり、これは約26ピコモルの分子が表面に固定化されることを意味する。図4aと図4bにおいて図示されているように、重さが相対的に軽いβ−Gal抗原やGST(グルタチオン−S−トランスフェラーゼ)抗原の場合は、相対的に、固定化された蛋白質の重さが小さく示されることが分かる(図4a及び4b参照)。
【0040】
固定された蛋白質が極めて高い活性を示すことは、図4a及び4cにおいて示されるように、固定化されたβ−Gal(β−ガラクトシダーゼ)抗原や、抗体に対応する抗体や抗原を、それぞれ投入するか、又はGST(グルタチオン−S−トランスフェラーゼ)抗原単分子層に、抗体(GST抗体)が10−20%の濃度で存在する蛋白質混合溶液を投与して、抗原−抗体引力を通じて、表面に固定化される抗体の量を、直接重さ変化により測定して分かる。図4bは、GST抗原の単分子層に、分子量が150KDのGST抗体が付着される時の重さ変化を示すが、その重さ変化は、図4aにおいて見られるように抗原単分子層にGST抗体と分子量が類似するβ−Gal抗体(分子量160KD)を投入する時と、ほとんど類似することが分かる。図4cは、β−Gal抗体単分子層を製造した場合の重さ変化を示すが、図4aにおいて見られるように、β−Gal抗原の単分子層にβ−Gal抗体が二重分子層として付着する時の重さ変化と、ほとんど同じである。
【0041】
この結果は、大きさが大きい抗体分子が、大きさが相対的に小さい抗原分子の単分子層に付着する時、1対1結合をすると、該抗体の分子層が、抗体のみから形成された単分子層の場合とほとんど同一の程度に密に形成されることを意味する。図4cは、抗体単分子層上に、相対的に大きさが小さい抗原分子が付着される時、ほとんど1対1水準の結合がなされても、抗原の単分子層を製造した場合より、実際に積層される抗原の分子数が少ないので、重さ変化が抗原単分子層を製造した場合より少ないことを示す。単分子層の製造に必要な濃度の抗原が含まれている緩衝溶液を投与して、単分子層の製造を行った後、更に、抗原をより高い濃度により投与した時は、これ以上の意味のある重さ変化が現われないので、単分子層の製造以後は、これ以上同一の蛋白質が、物理吸着により付着はされないことが分かる。
【0042】
各実験時に使用した抗原又は抗体の溶液を、次の蛋白質の投入前に除去し、緩衝溶液を満たした後、次の蛋白質を投入する。上記の実験結果は、表面に固定化された抗原と抗体が、対応する蛋白質と反応(抗原−抗体反応)をするのに十分な程度の、活性を維持していることを示している。
以下において、上述した本発明を例証するために、下記実施例を提供するが、この実施例が、本発明の範囲を限定し、又は制限するものではない。
【実施例】
【0043】
実施例1
【化4】

乾燥した容器にCHCl3 20mLを入れた後、その容器を氷槽に入れて冷やしながら、窒素気流下に攪拌した。その容器内に、CH3OCH2Cl 0.468ml(6.16mmol)を入れ、2分ほど過ぎた後、SnCl4 0.577ml(4.93mmol)を、3〜4分に亙って徐々に入れた。15分後に、CHCl3の適当量(30乃至50ml)に溶かしたカリックス[4]アレン−ビスクラウン−4(CABCR−4)100mg(0.154mmol)を徐々に加えた。5分後に、氷槽を除去し、常温に温度を上げながら、1時間反応させる。反応溶液に、CH2Cl2の適当量(30乃至50ml)を加えて希釈した後、氷を入れて、冷たい状態において攪拌しながら、余分のSnCl4を除去した。有機層を分離した後、冷たい脱イオン水で2回洗滌した。乾燥剤を入れて乾燥した後、乾燥剤を除去し、溶媒を減圧蒸留して除去した後、目的物のTCCABCR−4(102mg、80%収率)を得た。
【数1】

【0044】
実施例2
【化5】

TCCABCR−4 115mg(0.136mmol)と、チオウレア 41.3mg(0.544mmol)を、エタノール 30mLに溶かした。Arガスを1分程度混合物に通過させた後、Ar気体雰囲気下において反応を行った。反応物を、45℃〜55℃において60分間ソニック処理(sonication)した。この混合物に、NaOH 32.64mg(0.816mmol)を入れた後、30分間ソニック処理した。反応後、1N HClにより反応溶液のpHを4に合わせた。反応物を、CH2Cl2の適当量(30乃至50ml)に溶かした後、水でリンスし、有機溶媒を乾燥させた後、有機溶媒を減圧下において除去し、得られた物質を、シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン−エチルアセテート)により精製して、TMCABCR−4 54mgを得た。NaSHを使用して−Clを−SHに変える過程は、TCCABCR−4の8倍モル濃度のNaSHを使用して、エタノール溶媒30mLにおいて1時間ソニック処理し、同じ精製過程を経て行われ、上記の反応と同じ収率の結果物が得られた。
【数2】

【0045】
実施例3
【化6】

TCCABCR−4 115mg(0.136mmol)と、チオウレア 41.3mg(0.544mmol)を、エタノール 30mLに溶かした。溶媒内の酸素を除去せず、反応を行った。反応物を、45℃〜55℃において60分間ソニック処理した。この混合物に、NaOH 32.64mg(0.816mmol)を入れた後、30分間ソニック処理した。反応後、1N HClを使用して反応溶液のpHを4に合わせた。反応物を、CH2Cl2 30乃至50mlに溶かした後、水でリンスし、有機溶媒を乾燥させた後、有機溶媒を減圧下に除去し、得られる物質を、シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン−エチルアセテート)により精製して、DDSCABCR−4 60mgを得た。
【数3】

【0046】
実施例4
【化7】

乾燥した容器にCHCl3 20mLを入れ、その容器を氷槽に入れて冷やしながら、窒素気流下に攪拌した。その容器に、CH3OCH2Cl 0.515mL(6.56mmol)を入れ、2分程度過ぎた後、SnCl4 0.612mL(5.23mmol)を3〜4分に亙って徐々に入れた。
15分後に、1,3−ジメトキシカリックス[4]アレン−クラウン−5(DMCACR−5) 100mg(0.164mmol)を、CHCl3適当量(30乃至50ml)に溶かした後、上記容器に徐々に加えた。DMCACR−5を全て加えた後、5分間、氷槽において攪拌した後、10分に亙って常温に温度を上げた後、1時間反応させた。反応溶液に、CH2Cl2適当量(30乃至50ml)を加えて希釈した後、氷を入れて冷たい状態において攪拌して、余分のSnCl4を除去した。有機層を分離した後、冷たい脱イオン水により2回洗滌した。その後、乾燥剤を入れて乾燥した後これを除去し、溶媒を減圧蒸留して除去した後、結果物TCDMCACR−5(99mg、75%収率)を得た。
【数4】

【0047】
実施例5
【化8】

TCDMCACR−5 100mg(0.124mmol)と、チオウレア 38mg(0.50mmol)を、エタノール 25mLに溶かした。Arガスを1分程度混合物に通過させた後、Ar気体雰囲気下において反応を行った。反応物を、45℃〜55℃において60分間ソニック処理した。この混合物にNaOH 30mg(0.75mmol)を入れた後、30分間ソニック処理した。反応後、1N HClにより、反応溶液のpHを4に合わせた。反応物を、CH2Cl2適当量(30乃至50ml)に溶かした後、水で3回リンスし、これを乾燥した後、有機溶媒を減圧下において除去し、得られる物質を、シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン−エチルアセテート)により精製して、TMDMCACR−5 55mgを得た。
【数5】

【0048】
実施例6
図1のような、カリックスクラウン誘導体の自己組立単分子層を、TMDMCACR−5化合物を利用して製造した。真空蒸着された金基質をクリーニングした後、窒素雰囲気下において乾燥させた。この基質を、TMDMCACR−5が2mM濃度に溶けているCHCl3適当量(30乃至50ml)の溶液に3時間程度浸した。金基質を、アセトンで洗い、乾燥させて、TMDMCACR−5自己組立単分子層の製造を完了した。この基質に、外部反射赤外線分光分析(FT−IR ERS)を行うと、1040cm-1において、クラウン環の特徴的な、C−Oストレッチングモードと、1480cm-1において、カリックスアレンの特徴的な芳香族ストレッチングモードの、強い吸収バンドが現れるので、カリックスクラウン化合物が、基質の表面に、単分子層を形成していることを確認することができた。
【0049】
実施例7
図2のような蛋白質単分子層は、次のように製造することができた。実施例6において製造した、金基質上のカリックスクラウン誘導体の単分子層を、β−ガラクトシダーゼ抗原が0.1μm濃度で存在する0.83mM PBS(リン酸塩緩衝溶液、Na+及びK+含有)緩衝溶液に浸し、1時間後に、緩衝溶液により洗滌すると、β−ガラクトシダーゼ抗原単分子層が製造された。この実験の結果は、クワルツ結晶微視秤を利用して測定した図4aに示されている。実時間帯に、この蛋白質単分子層の製造を行うと、2.4μg/cm2、即ち、2.4μg程度の抗原が、1cm2に固定化された。また、QCM実験時に、固定化がなされるまでは、3分程度の時間が必要であった。固定化された抗原単分子層に対し、原子間力顕微鏡を利用して、実際使用した基質と表面における変化を観察した実験結果が、図5と6に提示されている。図5と6を見ると、表面が蛋白質単分子層製造の前後で完全に相違しており、蛋白質が表面に固定化されていることを確認することができる。たとえ、3分程度で、蛋白質単分子層の製造が完了しても、原子間力顕微鏡測定時のチップ(AFM tip)による摩擦力に耐えるためには、1時間の固定化時間が必要である。図4a、4b及び4cにおいて、最初に投入した蛋白質の濃度は、全て0.1μMである。図4a、4b及び4cは、それぞれの蛋白質単分子層に対応する蛋白質を、0.1μM濃度により投入した時に現れる重さ変化を図示する。図4aは、抗原単分子層に160KDの分子量を有する抗体単分子層を投入すると、抗原の二倍に近い重さ変化が生じることを示しており、図4bは、軽いGST抗原単分子層に分子量が150KDの抗体を投入すると、160KD分子量の抗体をβ−ガラクトシダーゼ抗原単分子層に投入した時と、ほとんど同じ重さ変化が表面において起こることを示す。このような重さ変化は、蛋白質が表面に密に満たされた時の重さ変化と一致するものであり、これは、表面に固定化された蛋白質等が活性をほとんど完全に維持していることを示す。
【0050】
本発明は、従来の蛋白質固定化方法として使用された化学結合方式や物理吸着方式等において現れた問題点を解決することができる、分子認識を利用した、新規な蛋白質固定化方法である。この方法は、単純に、カリックスクラウン化合物が自己組立単分子層をなしている固体基質を、固定化させる蛋白質の水溶液に浸しておくだけで、1時間以内に、分子量20,000D(20KD)以上の全ての種類の蛋白質を、活性を失わない状態で、他の蛋白質が固定化される空間を残さない程度に密に付着させることができる。これにより、非特異性蛋白質の固定化を誘発していた、従来の固定化反応における大きな問題点が解決されると同時に、非特異性蛋白質の固定化を抑制するために、必須的に使用しなければならなかった化学物質の使用を不要にして、時間を節約するとともに、固定化された蛋白質の活性維持を画期的に改善し、また、特定蛋白質の認識に必要な蛋白質単分子層を直接製造して使用するので、時間と経費の節減の効果が極めて大きい。従って、本発明は、蛋白質チップ、診断キット及びバイオセンサーの未来の開発に対し幅広く適用することができる。また、カリックスクラウン誘導体を、既存の方式により製造する時は、クラウン環の安定性が問題となっていたが、本発明においては、このような問題点は解決され、高い収率で所望のカリックスクラウン分子の合成をすることができるようになった。
【図面の簡単な説明】
【0051】
【図1】本発明のカリックスクラウン誘導体の自己組立単分子層の製造過程の概略図である。
【図2】本発明の蛋白質単分子層の固定化方法についての概略図である。
【図3】図2において製造された蛋白質単分子層の活性を研究するために、抗原又は抗体の単分子層と、溶液状の蛋白質との認識過程を示す概略図である。
【図4】蛋白質単分子層の製造と、その蛋白質単分子層に対応する蛋白質を投与して、実時間帯において、抗原−抗体引力を測定した結果を示す図である。
【図5】カリックスクラウン単分子層上に製造されたβ−ガラクトシダーゼ抗原蛋白質単分子層を、原子間力顕微鏡(Atomic Force Microscope:AFM)で撮った写真である。
【図6】カリックスクラウン単分子層上に製造されたβ−ガラクトシダーゼ抗体蛋白質単分子層を、原子間力顕微鏡で撮った写真である。
【特許請求の範囲】
【請求項1】
下記化学式(1)のカリックス[4]アレン−ビスクラウン−4の誘導体:
【化1】

(上記式(1)中において、R1、R2、R3及びR4は、互いに独立的に−CH2SH基を示すか、又はR1乃至R4のうち二つが、互いに結合してそれぞれ−CH2−S−S−CH2−基を形成することができ;又はR1、R2、R3及びR4は、独立的に−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOHであり得る。)
【請求項2】
下記化学式(2)のカリックス[4]アレン−クラウン−5の誘導体:
【化2】

(上記式(2)中において、nは1であり;R1、R2、R3及びR4は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれHを示すことができ;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。)
【請求項3】
下記化学式(3)のカリックス[4]アレン−クラウン−6の誘導体:
【化3】

(上記式(3)中において、nは2であり;R1、R2、R3及びR4は、互いに独立的に−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれ−H基を示し;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。)
【請求項4】
請求項2又は請求項3に記載の化学式において、R1、R2、R3及びR4がHであり、R5及びR6が−CH3の化合物、又は請求項1に記載の化学式において、R1、R2、R3及びR4がHの化合物を、クロロメチル化反応させて、R1乃至R4のうち二つ又は四つの作用基を−CH2Cl基に変換させた後、場合によってそれぞれのCl基を、−SH、−CN、−CHO、−NH2又は−COOH基に変換させるか、又は二つのCl基を、ジスルフィド(−S−S−)基に変換させて製造することを特徴とする、請求項1乃至請求項3のいずれか一項記載のカリックスクラウン誘導体の製造方法。
【請求項5】
蛋白質チップ、診断キット又は蛋白質分離パックを製造するための、請求項1乃至請求項3による化学式(1)乃至(3)の少なくとも一つの化合物を、金、銀、ガラス、珪素、ポリスチレン及びポリカーボネートからなる群から選ばれる無機又は有機固体基質の上に適用することを特徴とする蛋白質の固定化方法。
【請求項6】
請求項1乃至請求項3の少なくとも一つの化合物が、1乃至3mMの濃度で溶けている有機溶液に、真空蒸着された金基質又は関連金属基質を、1乃至24時間浸して製造されることを特徴とする、請求項1乃至請求項3のいずれか一項記載のカリックスクラウン誘導体の自己組立単分子層。
【請求項7】
請求項6のカリックスクラウン誘導体の自己組立単分子層を、分子量が20,000D(20KD)以上の蛋白質が数nM乃至数μMの濃度で溶けている緩衝溶液に、1乃至2時間浸して、上記蛋白質を上記自己組立単分子層上に固定化させることを特徴とする、蛋白質単分子層の固定化方法。
【請求項1】
下記化学式(1)のカリックス[4]アレン−ビスクラウン−4の誘導体:
【化1】

(上記式(1)中において、R1、R2、R3及びR4は、互いに独立的に−CH2SH基を示すか、又はR1乃至R4のうち二つが、互いに結合してそれぞれ−CH2−S−S−CH2−基を形成することができ;又はR1、R2、R3及びR4は、独立的に−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOHであり得る。)
【請求項2】
下記化学式(2)のカリックス[4]アレン−クラウン−5の誘導体:
【化2】

(上記式(2)中において、nは1であり;R1、R2、R3及びR4は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれHを示すことができ;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。)
【請求項3】
下記化学式(3)のカリックス[4]アレン−クラウン−6の誘導体:
【化3】

(上記式(3)中において、nは2であり;R1、R2、R3及びR4は、互いに独立的に−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示すか;又はR1及びR3は、それぞれ−CH2SH、−CH2Cl、−CH2CN、−CH2CHO、−CH2NH2又は−CH2COOH基を示し、R2及びR4は、それぞれ−H基を示し;R5及びR6は、互いに独立的に、−H、メチル、エチル、プロピル、イソプロピル又はイソブチルを示す。)
【請求項4】
請求項2又は請求項3に記載の化学式において、R1、R2、R3及びR4がHであり、R5及びR6が−CH3の化合物、又は請求項1に記載の化学式において、R1、R2、R3及びR4がHの化合物を、クロロメチル化反応させて、R1乃至R4のうち二つ又は四つの作用基を−CH2Cl基に変換させた後、場合によってそれぞれのCl基を、−SH、−CN、−CHO、−NH2又は−COOH基に変換させるか、又は二つのCl基を、ジスルフィド(−S−S−)基に変換させて製造することを特徴とする、請求項1乃至請求項3のいずれか一項記載のカリックスクラウン誘導体の製造方法。
【請求項5】
蛋白質チップ、診断キット又は蛋白質分離パックを製造するための、請求項1乃至請求項3による化学式(1)乃至(3)の少なくとも一つの化合物を、金、銀、ガラス、珪素、ポリスチレン及びポリカーボネートからなる群から選ばれる無機又は有機固体基質の上に適用することを特徴とする蛋白質の固定化方法。
【請求項6】
請求項1乃至請求項3の少なくとも一つの化合物が、1乃至3mMの濃度で溶けている有機溶液に、真空蒸着された金基質又は関連金属基質を、1乃至24時間浸して製造されることを特徴とする、請求項1乃至請求項3のいずれか一項記載のカリックスクラウン誘導体の自己組立単分子層。
【請求項7】
請求項6のカリックスクラウン誘導体の自己組立単分子層を、分子量が20,000D(20KD)以上の蛋白質が数nM乃至数μMの濃度で溶けている緩衝溶液に、1乃至2時間浸して、上記蛋白質を上記自己組立単分子層上に固定化させることを特徴とする、蛋白質単分子層の固定化方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2006−219499(P2006−219499A)
【公開日】平成18年8月24日(2006.8.24)
【国際特許分類】
【出願番号】特願2006−130163(P2006−130163)
【出願日】平成18年5月9日(2006.5.9)
【分割の表示】特願2000−242413(P2000−242413)の分割
【原出願日】平成12年8月10日(2000.8.10)
【出願人】(500373909)
【出願人】(500373910)プロテオゼン株式会社 (1)
【Fターム(参考)】
【公開日】平成18年8月24日(2006.8.24)
【国際特許分類】
【出願日】平成18年5月9日(2006.5.9)
【分割の表示】特願2000−242413(P2000−242413)の分割
【原出願日】平成12年8月10日(2000.8.10)
【出願人】(500373909)

【出願人】(500373910)プロテオゼン株式会社 (1)
【Fターム(参考)】
[ Back to top ]

