植物系バイオマスの糖化用担体、糖化方法および糖化装置
【課題】環境への負荷が小さい生物学的糖化法において、糖化工程での運転の管理および制御が容易で、かつ、植物系バイオマス由来のセルロース系多糖類の糖化に対して適用可能であり、生成物である単糖の単離・精製が容易な、微生物を固定化した糖化用担体、糖化方法および糖化装置を提供する。
【解決手段】微生物として好アルカリ性好熱微生物を使用し、当該好アルカリ性好熱微生物を、10μm〜2mmの細孔を有し、その空隙率が70〜98%であり、水への浸漬所要時間が20秒以下となるように細孔が連通している多孔質構造体に固定化した、糖化用担体を使用する。
【解決手段】微生物として好アルカリ性好熱微生物を使用し、当該好アルカリ性好熱微生物を、10μm〜2mmの細孔を有し、その空隙率が70〜98%であり、水への浸漬所要時間が20秒以下となるように細孔が連通している多孔質構造体に固定化した、糖化用担体を使用する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、植物系バイオマス中に含まれるセルロースまたはヘミセルロースを、微生物を用いてバイオエタノール原料となる単糖に分解するための、植物系バイオマスの糖化用担体、糖化方法および糖化装置に関する。
【背景技術】
【0002】
化石燃料の枯渇をはじめとするエネルギー危機、あるいは地球温暖化防止などの環境保全の観点から、バイオエタノール(バイオマスエタノール)の活用が脚光を浴びている。バイオエタノールとは、サトウキビやトウモロコシなどのいわゆるバイオマスを発酵させて得られるエチルアルコール(エタノール)のことで、内燃機関用燃料の新型燃料として注目を浴びている。また、バイオマスとは、木材、草本、海草、藻、生ごみ、紙、動物の死骸や糞尿、およびプランクトンなど、再生可能な生物由来の有機性エネルギーおよび資源であって、化石燃料を除いたものを指すと言われている。
【0003】
バイオマスから得られるバイオエタノール等のバイオマス由来エネルギーは、その使用時に二酸化炭素を排出するものの、バイオマス自身が太陽エネルギーと水と二酸化炭素から合成されるため、バイオエタノール等の使用によって二酸化炭素を新たに増加させることはない。この意味で、バイオマスは「カーボンニュートラル」なエネルギーであり、世界中でその活用に拍車がかかっている。その中でも、原料の豊富さ、化石燃料との代替のし易さの点で、バイオエタノールが注目されている。
【0004】
これまでのバイオエタノールを得るための一般的な方法は、糖質やデンプン質を多く含む植物資源を原料とし、必要に応じてデンプン質の糖化工程を経ての、酵母等によるアルコール発酵によるものである。これら糖質やデンプン質を多く含む植物資源原料の代表的なものが、サトウキビおよびトウモロコシである。
【0005】
しかし、このサトウキビやトウモロコシを原料としたバイオエタノールの製造が急増し、食料や家畜用飼料の価格を押し上げ、大きな国際的社会問題となっている。また、このようなバイオエタノールの生産は、貧困国の食糧事情を悪化させるとの批判もある。そのため、食料と競合しないセルロース系バイオマス資源からのバイオエタノールの製造が喫緊の課題となっている。
【0006】
しかしながら、セルロース等(ヘミセルロースも含めて)の多糖類から発酵によって直接エタノールを製造することはできないため、まず、この多糖類をアルコール発酵可能な単糖類に分解(糖化)する必要がある。セルロースを単糖に分解する糖化技術としては、硫酸による加水分解(特許文献1)またはセルロース分解酵素(セルラーゼ)を使用した生物学的糖化法(特許文献2)が検討されている。なお、本願においてセルロース系多糖類と称した場合、以後特に断らない限り、ヘミセルロースも含めて言及しているものとする。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−189291号公報
【特許文献2】特開2006−088136号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、上記硫酸等による加水分解、いわゆる化学的糖化法では、酸を使用するため環境への負荷および後処理コスト等の問題が存在する。一方、酵素による生物学的糖化法は、高価な加水分解酵素を大量に必要とする上、酵素活性維持のために温度およびpHの管理や制御が非常に煩雑で運転コストも高くなる。したがって、必然的にバイオエタノールの生産コストが高くなるという問題点を有している。また、微生物による生物学的糖化法も検討されているが、セルロース系多糖類は水に不溶なため、セルロース分解微生物を、多孔質等の担体に固定化した「微生物固定化担体」を使用しての糖化は不向きであると考えられていた。すなわち、セルロース系多糖類が水に不溶であるので、担体に固定化された微生物との接触が不十分となり、糖化速度が非常に遅くなるためである。そのため、微生物による生物学的糖化法は、糖化反応終了後の単糖と微生物の分離が非常に煩雑であるという問題点を有していた。
【0009】
そこで、本発明の目的は、環境への負荷が小さい生物学的糖化法において、糖化工程での運転の管理および制御が容易で、かつ、セルロース系多糖類の糖化に対しても適用可能であり、生成物である単糖の単離・精製が容易な、微生物を固定化した糖化用担体、糖化方法および糖化装置を提供することにある。
【課題を解決するための手段】
【0010】
前記課題を解決するために、本発明者らは鋭意研究を重ねた結果、微生物として好アルカリ性好熱微生物を使用し、当該好アルカリ性好熱微生物を、以下に詳述する特徴をもつ多孔質構造体に固定化した糖化用担体を開発することにより、本発明を完成させた。
【0011】
すなわち、本発明によれば、多孔質構造体に、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が固定化され、多孔質構造体が有する細孔の少なくとも一部が連通している、植物系バイオマスの糖化用担体が提供される。ここにおいて、多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、細孔が連通していることが好ましい。
【0012】
また、本発明の別の観点によれば、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物を液体培地で培養して、該好アルカリ性好熱微生物が該液体培地中に懸濁した培養液を調製する工程と、該培養液中に多孔質構造体を浸漬して、該多孔質構造体の多孔質構造を形成している構造体物質表面に、前記好アルカリ性好熱微生物を固定化して糖化用担体を調製する工程と、該糖化用担体、植物系バイオマス由来のセルロース系多糖類、および糖化反応用液体培地を混合して、該糖化反応用液体培地中に前記糖化用担体および前記セルロース系多糖類が分散した分散液を調製する工程と、該分散液を、前記好アルカリ性好熱微生物の生育条件で処理する工程とを有し、前記多孔質構造体として、形成されている細孔の少なくとも一部が連通している多孔質構造体を使用する、植物系バイオマスの糖化方法が提供される。ここにおいて、好アルカリ性好熱微生物を固定化する工程の後に、前記構造体物質表面に固定化された前記好アルカリ性好熱微生物をさらに培養して、前記構造体物質表面で増殖させる工程を有することが好ましい。さらに、多孔質構造体として、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記細孔が連通している多孔質構造体を使用する糖化方法であることがより好ましい。
【0013】
本発明のさらに別の観点によれば、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が、多孔質構造体に固定化された植物系バイオマスの糖化用担体と、撹拌手段とを有する、植物系バイオマスの糖化装置が提供される。ここにおいて、多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記多孔質構造体が有する細孔が連通していることが好ましい。
【発明の効果】
【0014】
本発明の植物系バイオマスの糖化用担体、糖化方法および糖化装置によれば、環境への負荷が小さい生物学的糖化法において、糖化工程での運転の管理および制御が容易であり、かつ、セルロース系多糖類の糖化に対して優れた糖化能を発揮することができる。
【図面の簡単な説明】
【0015】
【図1】本発明に係る糖化用担体の原料となる多孔質構造体(多孔質担体)の一例を写真で示したものである。
【図2】(A)はリブ構造の多孔質構造体(多孔質担体)を示す模式図である。(B)はウォール構造の多孔質構造体(多孔質担体)を示す模式図である。
【図3】多孔質構造体(多孔質担体)に好アルカリ性好熱微生物が担持により固定化された様子を示す顕微鏡写真である。
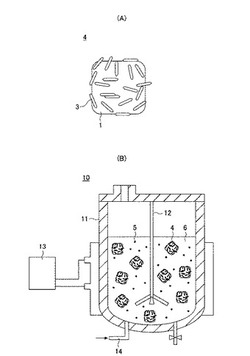
【図4】(A)は本発明に係る糖化用担体を概略的に示す模式図である。(B)は本発明に係る糖化装置を概略的に示す模式図である。
【図5】本発明に係る糖化方法による糖化反応結果を示すグラフ図である。
【発明を実施するための形態】
【0016】
以下、本発明の実施の形態について、適宜、図を参照しながら、課題解決のために重要な点および従来技術と異なる特徴等について説明する。
【0017】
本発明の植物系バイオマスの糖化用担体(以後単に糖化用担体と称する場合もある)は、多孔質構造を有する多孔質構造体にセルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物を固定化したものである。なお、以後、多孔質構造体を多孔質担体と称する場合もある。本発明に使用される該多孔質担体の材質としては、多孔質構造を形成し得るものであれば特に限定されず、セラミック、ゼオライト等の無機化合物、または樹脂等の有機化合物を使用することができる。微生物による糖化反応を行う際の、攪拌のし易さ、攪拌時の摩擦力やせん断力による担体の破壊が起こりにくい点で、樹脂製多孔質担体であることが好ましい。
【0018】
本発明に使用できる樹脂製多孔質担体としては、例えば、ポリウレタン系、ポリエーテル系、ポリエステル系、ポリビニル系、ポリ(メタ)アクリレート系などを挙げることができ、付加重合体、縮合重合体または付加縮合体のいずれであってもよい。また、架橋剤により架橋された、これら高分子(樹脂)の三次元網目構造体であってもよい。後で詳述する本発明に好適な多孔質を形成しやすい点で、ポリウレタン系樹脂が好ましく、水膨潤性のポリウレタン樹脂がより好ましい。
【0019】
また、本発明の糖化用担体として好適な多孔質構造は、例えば図1に示すような構造である。図1は、本発明の好アルカリ性好熱微生物を担持して固定化するのに適した多孔質担体1の一例を写真で示すものである。該多孔質担体1は、ポリウレタン製であり、その構造体全体にわたって多数の細孔2が形成されている。この細孔2を形成する構造体の形状として、樹脂等の構造体部分が繊維状または骨状であって「リブ構造」と呼ばれるタイプと、当該構造体部分が膜状であって、その膜に細孔2が開いている「ウォール構造」と呼ばれるタイプがある。リブ構造およびウォール構造の模式図を図2(A)および(B)に示す。
【0020】
本発明の多孔質担体1としては、リブ構造、ウォール構造いずれのタイプであってもよいが、好アルカリ性好熱微生物が担持されやすく、安定的に固定化される点でウォール構造であることが好ましい。また、多孔質担体1に形成される細孔2の細孔径は、糖化されるセルロース系多糖類の微粒化物が容易に出入りあるいは通過できる大きさであり、セルロース系多糖類の微粒化度によって、必要とされる細孔径の範囲が決められる。糖化効率の点で、セルロース系多糖類は、0.1〜200μmの粒子径範囲が好ましいので、当該細孔径として径10μm〜2mmの細孔2が、細孔の80%以上、好ましくは90%以上、より好ましくは95%以上を占める多孔質構造であることが好ましい。なお、本発明の多孔質担体1に多数存在する細孔2は、その細孔径が10μm未満のものや2mmより大きいものも当然存在する。
【0021】
好適には、100μm〜2mmの細孔2が、細孔の60%以上、好ましくは70%以上、より好ましくは80%以上を占める多孔質構造であることが好ましい。より好適には、300μ〜2mmの細孔が、細孔の40%以上、好ましくは50%以上、より好ましくは60%以上を占める多孔質構造であることが好ましい。
【0022】
なお、ここで細孔径とは、顕微鏡で観察される細孔を平面に投影したとした場合に描かれる円の直径、それが楕円であれば長径(長半径の2倍)部分を指すものとし、顕微鏡写真で当該径の長さを直接測定するものとする。ただし、容易に理解できるように、当該細孔の平面投影図は、数学的な円や楕円では無いことは明らかであるので、円状、楕円状と考えて、直径に相当、長径に相当するという意味である。また、微粒化されたセルロース系多糖類の粒子径とは、例えばレーザー回折式測定法またはレーザー散乱式測定法等によって測定される半径を指すものとする。ただし、セルロース系多糖類の粒子径は、本発明の本質ではなく、概略前記範囲であれば好ましいのであって、当該粒子径および測定法を規定するものではない。
【0023】
また、細孔は当然のことながら容積を有するものであるため、上記投影図での細孔径のみで規定することは難しい点もある。したがって、当該多孔質担体の多孔質の程度について、多孔質担体の空隙率で表すことも好ましい。この空隙率の観点において、本発明の多孔質担体は、糖化効率と好アルカリ性好熱微生物の担持されやすさのバランスの点で、70〜98%の空隙率を有することが好ましい。微粒状セルロース系多糖類と、固定化された好アルカリ性好熱微生物との接触頻度の高さの点で、空隙率は80%以上が好ましく、85%以上がより好ましい。また、多孔質担体1の構造強度、すなわち撹拌等によるせん断力、機械力が付与される糖化反応時の多孔質担体1の破壊を防止する点で、97%以下が好ましく、95%以下がより好ましい。ここで、空隙率とは、多孔質担体1の一定嵩体積中の空隙の割合を百分率で表したものである。
【0024】
このように大きな空隙率を持つため、好アルカリ性好熱微生物を多く担持できる点でも、多孔質担体1の構造体物質の表面積が大きくなる前記ウォール構造が好ましい。ここで、空隙率は、理論的には、真密度と嵩密度の差から求められる。すなわち、例えば、真密度が1g/cm3、嵩密度が0.1g/cm3であれば、空隙率は、(1−0.1)/1×100=90(%)と計算される。
【0025】
具体的には、該多孔質担体1の所定の体積(例えば1cm四方のいわゆる嵩体積)の重量を測定する。また、該多孔質担体1を構成する樹脂(高分子)の、空隙が存在しない場合の当該体積に相当する重量を当該樹脂の真密度から計算する。そして、この二つの値から嵩密度を算出し、空隙率を計算する。ここで、嵩体積とは、空隙部を含む体積を意味する。例えば、図1の多孔質担体が略立方体形状であるとした場合、各辺に相当する部分に直線を引いて形成される立方体図形の体積を言うものとする。
【0026】
しかし、樹脂(高分子)の場合、その重合条件によって真密度が異なるので、上記のような計算方法では、正確さを欠く場合がある。したがって、市販の真密度測定器等によって真密度を測定して、空隙率を計算する方法もある。ただし、多孔質担体中に、表面(外部)に連通していない(すなわち多孔質構造体物質の内部に独立した)細孔が存在する場合は、いわゆる見かけ密度が測定されることもあるが、この見かけ密度を基に空隙率を算出してもよい。
【0027】
さらに、微粒状セルロース系多糖類が、当該細孔2を容易に出入りでき、あるいは、当該多孔質体1の細孔2を貫通して通過でき、多孔質担体1に固定化された好アルカリ性好熱微生物と高頻度に接触するためには、細孔2の少なくとも一部が連通している必要がある。好ましくは、多孔質担体1の内部の細孔2の大部分が、表面部分のいずれかの細孔2と連通していることが望ましい。この好ましい連通度を規定する方法として、次に示す方法を採用することができる。
【0028】
すなわち、所定の体積(嵩体積)を有する本発明の多孔質担体1を、水面に静かに載置(静置)し、載置したときから、当該多孔質担体1全体が水面下に没するまでの時間で規定する。本発明においては、この時間を「浸漬所要時間」と称することとする。ここで、所定の体積(嵩体積)としては、概略1cm3とし、略1cm3であればその形状は特に規定されるものではなく、立方体、直方体、球体もしくは紡錘形状体、またはこれらの類似形状でもよく、他の形状であってもよい。本発明の植物系バイオマスの糖化用担体としての実際の使用時の形態が好ましい。
【0029】
本発明の植物系バイオマスの糖化用担体としての多孔質担体1は、例えば、嵩体積として概略1cm3の略立方体、略直方体または略球体で使用するのが好ましいので、当該形状での浸漬所要時間で規定する。なお、前記概略1cm3の略立方体、略直方体または略球体であれば、細孔径や連通度合いが同程度、すなわち多孔質担体1の製造条件が同じ場合は、その浸漬所要間はほぼ同じである。また、紡錘形状体であってもほぼ同じである。
【0030】
本発明に係る多孔質担体1の連通度としては、概略1cm3の上記形状体での浸漬所要時間は20秒以下であり、セルロース系多糖類の糖化速度が速い点で、10秒以下が好ましく、5秒以下がより好ましい。さらに、浸漬所要時間は、多孔質担体1の密度にも影響されるので、それが非常に短く、1秒以下、例えば、0.1秒またはそれ未満で0秒に近い場合であってもよい。多孔質担体原料の真密度または見かけ密度が水の密度より小さい場合は、水中に没することは無いが、このような密度の担体は、微粒状セルロース系多糖類の出入りや通過の点であまり好ましくない。すなわち、本発明の多孔質担体としては、その真密度または見かけ密度が水の密度以上であることが好ましい。
【0031】
次に、本発明の糖化用原料である植物系バイオマスについて説明する。植物系バイオマスとしては、水中の藻や水草などの水性系バイオマス、雑草や農作物などの草本系バイオマス、および木由来の木質系バイオマスを挙げることができる。木質系バイオマスとしては、幹や枝などのいわゆる木材、間伐材、および製材所で発生するおが屑などが含まれる。なお、植物系バイオマスの中で、セルロース系多糖類を多く含むものは、その成分に着目してセルロース系バイオマスとも呼ばれる。上記草本系バイオマスには、上述したサトウキビやトウモロコシが含まれるが、これらは糖質(炭水化物)を多く含み、特に糖化を必要とせず、エタノール発酵工程のみでバイオエタノールが得られる場合が多い。
【0032】
したがって、草本系バイオマスのうち、サトウキビなどのように糖質を多く含有するバイオマスは、本発明の糖化技術を活用する必然性が小さい。この点から、本発明の糖化技術に適した植物系バイオマスは、セルロースやヘミセルロースといったセルロース系多糖類を多く含むバイオマスであり、成分での呼称で表現するとセルロース系バイオマスが対象として好適である。セルロース系多糖類を多く含む点、原料が豊富な点、間伐材やおが屑を原料とした「有効利用」の観点で資源保護に多大な利点をもたらす点において、木質系バイオマスを原料とすることが好ましい。
【0033】
以後、本発明は特にセルロース系多糖類を多く含有する植物系バイオマスを、その原料として対象としている点を考慮して、本発明の原料であるバイオマスをセルロース系バイオマスと称することとする。なお、上述したのと同様、セルロース系バイオマスと称した場合、ヘミセルロースも含むこととする。
【0034】
本発明において、原料であるこのセルロース系バイオマスは、糖化反応を効率よく進行させるため、粉砕処理され、微粒状セルロース系多糖類として使用される。粉砕方法の例としては次の方法が挙げられる。例えば、木質系バイオマスを原料とする場合は、まず木材を木材チップとし、粗粉砕した後、蒸解によって脱リグニンしてセルロースを得る。得られたセルロース、ヘミセルロースまたはその両者を、乾式または湿式粉砕によって微粉砕する。このときの粒度としては、平均粒子径(半径)で0.2〜100μmの範囲とすることが好ましい。糖化効率および糖化速度を向上させる点で、50μm以下が好ましく、5μm以下がより好ましい。粉砕効率の点では、0.2μm未満は現実的では無いので、その平均粒子径(半径)は、0.2μm以上、好ましくは0.5μm以上である。なお、粉砕には、ボールミル、ビーズミルあるいはハンマーミル等、任意の粉砕機を使用することができる。
【0035】
つづいて、本発明の上記多孔質担体1に担持して固定化する微生物について説明する。当該微生物は、好アルカリ性好熱微生物であり、本発明の目的上、ヘミセルロースを含む、セルロース系多糖類を糖化する微生物である。当該微生物の例として、サーモバチルス・コンポスティ(Thermobacillus composti)、バチルス・ハロデュランス(Bacillus halodurans)を挙げることができる。アルカリ性高温下は、セルロース系多糖類の糖化に有利に働くので、このような条件が活動に至適である好アルカリ性好熱微生物が、本発明の糖化技術に適用する微生物に適している。
【0036】
次に、この好アルカリ性好熱微生物を多孔質担体1に固定化する方法について説明する。多くの好熱微生物は、生育に適さない環境下では芽胞という耐久性の高い休眠状態の細胞構造をとるため、まずこの休眠状態を解除するために、好アルカリ性好熱微生物を、pH7〜10、25℃〜70℃の条件下において培養用液体培地で培養し、好アルカリ性好熱微生物の前培養液を調製する。なお、上記条件は、採用する好アルカリ性好熱微生物の至適生育条件によって、この範囲内で適した条件を選択する。例えば、サーモバチルス・コンポスティ(Thermobacillus composti)であれば、pH約9、温度約50℃で培養することが好ましい。
【0037】
つづいて、この微生物前培養液を、嵩体積略1cm3の多孔質担体1を浸漬した微生物増殖用培地へ加え、その微生物の至適生育条件で培養し、好アルカリ性好熱微生物を当該多孔質担体1へ固定化し、増殖させる。当該多孔質担体1の形状は、上述した通り、特に限定は無いが、略立方体、略直方体または略球体の形状のものを使用する。なお、多孔質担体1の嵩体積は略1cm3に限定されることなく、実生産の規模によって変更することができ、より大きい、数cm3〜数千cm3、例えば5cm3〜1000cm3、あるいは10cm3〜500cm3であってもよい。一方、実験室での少量の合成では、1cm3以下、例えば1cm3〜0.01cm3程度の嵩体積であってもよい。
【0038】
上記培養用液体培地および微生物増殖用培地は、使用する好アルカリ性好熱微生物に適するように調製され、例えば、Modified Brock's basal salts培地(MBS培地)をベースとして調製される。
【0039】
図3に、好アルカリ性好熱微生物3が多孔質担体1に担持され、固定化される様子を示す。固定化の様式としては、物理吸着であると考えられるが、好アルカリ性好熱微生物3と多孔質担体1との化学吸着であってもよい。
【0040】
このようにして好アルカリ性好熱微生物3を多孔質担体1に固定化した後、当該微生物が固定化された多孔質担体(すなわち、本発明の糖化用担体4)を微生物増殖用培養液から分離して取り出す。次に、セルロース系バイオマスから得た微粒状セルロース系多糖類5、糖化用担体4に固定化された微生物の生育用培地である糖化反応用液体培地6、および糖化用担体4を、本発明の糖化装置10を構成する糖化用容器11に投入する(図4)。この後、以下に示す条件により、糖化用担体4の好アルカリ性好熱微生物3の活性を維持しつつ、当該微生物による糖化反応、すなわち微粒状セルロース系多糖類5の単糖への分解反応を行う。ここにおいて、糖化反応用液体培地6も、例えばMBS培地をベースとして調製することができる。
【0041】
本糖化装置10は、糖化用容器11、撹拌機12、恒温装置(温度制御装置)13、および必要に応じて通気管14を装備する。ここで、糖化用容器11の容量は、微粒状セルロース系多糖類の所望の処理量に適合させて適宜決定することができる。すなわち、実験室での試験生産レベルであれば、数mL〜数Lの容積が考えられ、実生産レベルであれば、数m3(数t)以上の反応容器となる。また、撹拌機12としては、特に制限はなく、プロペラ羽根、パドル羽根、タービン羽根あるいはアンカー羽根等を有する撹拌機12であればどのようなものであってもよく、また糖化用容器11は邪魔板を有していてもよい。
【0042】
恒温装置13は糖化用容器11の中に熱源を設置するものでも容器自体または容器の外側に熱源があってもよい。図4(B)では、外部熱源によるジャケット式の温度制御を例示したが、上記したように、温度制御は本方式に限られない。また温度制御はオンオフ制御程度の簡易なもので良い。通気管14は微生物が好気性でかつ糖化用容器11のサイズが数L以上となり、微生物による糖化反応の進行に伴い溶液内が嫌気条件になってしまう場合のみでよい。
【0043】
上記のように、微粒状セルロース系多糖類5、糖化反応用液体培地6、および糖化用担体4を糖化用容器11に投入した後、当該微生物の至適生育温度で、数日から数週間、撹拌機12で撹拌しながら糖化反応を行う。所定の間隔で糖化の進行状況、すなわち当該糖化反応によって生産される単糖の生成状況を追跡し、生成物である単糖の糖化反応用液体培地6中での濃度が一定となった時点で(あるいは原料の微粒状セルロース系多糖類5が消費された時点で)、糖化が終了したと判断する。本糖化工程が終了した後、単糖を含む糖化反応用液体培地6から糖化用担体4を回収し、つづいて、糖化反応用液体培地6からの抽出、精製によって、目的物である単糖を得る。
【0044】
以上、糖化反応工程について、撹拌機12で撹拌する形式の糖化装置10を例として説明したが、糖化反応用液体培地6、糖化用担体4および微粒状セルロース系多糖類5の混合、ならびに糖化用担体4中の好アルカリ性好熱微生物と微粒状セルロース系多糖類5との接触が十分行われるのであれば、他の撹拌型式であってもよい。例えば、糖化反応用液体培地6中に糖化用担体4および微粒状セルロース系多糖類5が分散した分散液が、ポンプ等により糖化用容器11内または糖化用容器11と外部循環装置間で循環しながら糖化反応を行う方式であってもよい。または、糖化用容器11が糖化用担体4をカラム方式で充填固定化できる形態であり、このように糖化用担体4が充填固定化された糖化用容器11内を、糖化反応用液体培地6に微粒状セルロース系多糖類5のみが分散したセルロース分散液が流動して循環するタイプであってもよい。
【0045】
以上説明した本発明に係る好アルカリ性好熱微生物による糖化は、従来の酵素による微生物学的糖化法と比較して、反応制御が複雑でなく、精緻な制御も不要であるという利点を有している。この両者の方法は具体的に次のような差異を有している。
【0046】
すなわち、酵素の場合、温度やpHのわずかな変動によって、酵素を構成するタンパク質の三次元構造が崩壊し、同時に機能も失ってしまう(失活)。この失活は不可逆であり、一度失活した酵素は機能を回復することはない。したがって、酵素処理の場合、精度の高い温度管理とpH制御を行わないと、生産性が減少するだけでなく、酵素が失活し、極端な場合、糖化反応が停止してしまう。それゆえ、温度とpHにおいて高精度な制御が要求され、失活した酵素の補充も必要となるため、糖化反応コストが高いという問題点が存在する。一方、好アルカリ性好熱微生物の場合は、環境適応能力を有しており、多少温度およびpHが変化しても好アルカリ性好熱微生物が死滅することはなく、さらに、好アルカリ性好熱微生物が自己増殖するので、補充が不要で自律的な運転が可能となる。したがって、酵素による生物学的糖化法と比較して、低コストで糖化反応を行うことができる。
【実施例】
【0047】
以下、実施例を示してさらに本発明を詳細に説明する。しかし、本実施例は本発明の理解を助けるための具体的な実施手段および方法を例示するものであって、本発明の範囲は本実施例に限定されるものではない。また、本発明の効果を証明するために、好アルカリ性好熱微生物を多孔質担体に固定化せずに糖化反応させたもの、すなわち従来の微生物による生物学的糖化方法に準拠した方法も比較例として示す。
【0048】
実施例
1.試料
(1)セルロース系バイオマスおよび微粒状セルロース系多糖類
本発明に係るセルロース系バイオマスの一例として、ブナから得られるヘミセルロースの1種であるキシラン粉末(シグマアルドリッチジャパン株式会社製、Xylan from beechwood: X4252、平均粒子径2μm)を入手して使用した。
(2)好アルカリ性好熱微生物
本発明に係る好アルカリ性好熱微生物の一例として、渡邉らによって家庭用生ごみ処理装置より単離されたサーモバチルス・コンポスティ(Thermobacillus composti)(DSM No. 18247)を使用した。
(3)サーモバチルス・コンポスティの培養用液体培地(兼微生物増殖用培地)
サーモバチルス・コンポスティの培養のための液体培地として、Modified Brock's basal salts培地(MBS培地:1リットル当たりの組成を以下に示す;(NH4)2SO4 (1.3g)、KH2PO4 (0.28g)、MgSO4・7H2O (0.25g)、CaC12・2H2O (70mg)、FeCl3・6H2O (2mg)、MnC12・4H2O (1.8mg)、Na2B4O7・10H2O (4.5mg)、ZnSO4・7H2O (0.22mg)、CuCl2・2H2O (0.05mg)、NaMoO4・2H2O (0.03mg)、VOSO4・2H2O (0.03mg)、CoSO4 (0.01mg))をpH9.0に調整し、これにグルコースと酵母抽出物を各々の最終濃度が5g/Lと0.5%になるように添加した培養用液体培地を使用した。
(4)糖化反応用液体培地
糖化反応用液体培地としてMBS培地をpH9.0に調整したものを使用した。
(5)多孔質担体
本発明に係る、好アルカリ性好熱微生物(サーモバチルス・コンポスティ)固定化用の多孔質担体1として、APG(登録商標)(日清紡ケミカル株式会社製、ポリウレタン樹脂)を使用した。当該APG(登録商標)の空隙率は約92%であった(図1)。また、顕微鏡観察において、径10μm〜2mmの細孔が細孔の80%以上を占めており、浸漬所要時間は1秒程度のものであった。
【0049】
2.糖化装置
糖化用容器11として硬質ガラス製50mL三角フラスコ、撹拌機12兼恒温装置として振盪機付恒温槽(タイテック株式会社、Bioshaker BR-30)を、実験室スケール用の糖化装置10として使用した。振盪により反応容器内の培養液のガス交換は充分であるため、通気管14は設けなかった。
【0050】
3.サーモバチルス・コンポスティの前培養
サーモバチルス・コンポスティを培養用液体培地によって、以下の条件で培養し、休眠状態を解除して増殖させ、サーモバチルス・コンポスティの前培養液(波長600nmでの吸光度(OD600)が0.2〜0.4まで増殖し、懸濁している培養液)を調製した。上記の培養用液体培地を試験管に5mL入れ、これに保存用サーモバチルス・コンポスティ液(休眠状態)を50μL添加し、振盪機付恒温槽により、50℃、150rpmで一晩振盪培養し、サーモバチルス・コンポスティの前培養液を調製した。
【0051】
4.糖化用担体の調製
約1cm3の略立方体状に成形したAPG(登録商標)20個を培養用液体培地40mLが入った100mL三角フラスコへ投入し、つづいて上記3.の前培養液を50μL加えた。次に、振盪機付恒温槽により、50℃で一晩振盪培養し、サーモバチルス・コンポスティをAPG(登録商標)に固定化させると同時に増殖させた。その後、MBS培地で2回すすぎ、固定化されていない微生物と担体内部に残った培養用液体培地を洗い流し、糖化用担体4を調製した。
【0052】
5.糖化反応
上記2.の糖化装置10の糖化用容器11内に、糖化反応用液体培地6を20mL、微粉状キシラン(微粒状セルロース系多糖類5)0.1g(濃度として;5g/L)、および4.の立方体状糖化用担体4を20個投入し、50℃、150rpmで撹拌しながら糖化反応を開始した(図4)。この糖化反応工程により、キシランが糖化用担体4のサーモバチルス・コンポスティによって分解(糖化)され、キシランに対応する単糖であるキシロースが生産される。糖化反応開始から1日毎に生成したキシロース量を次の6.に示す方法で測定した。
【0053】
6.キシロース測定方法
キシロースの定量測定には、D−キシロース測定キット(Megazyme International Ireland LTD.製)を使用した。上記5.より糖化反応培養液を1mL採取し、15000rpm、4℃で20分間遠心分離し、菌体と糖化されなかったキシランとを沈殿させた。上清に含まれるキシロースをキシロース測定キットによって比色定量分析した。この分析法では、以下の式(1)および式(2)のような反応により、D−キシロースと同量のNADHが生成される。
【0054】
【化1】

【0055】
【化2】

【0056】
上記式で示したNADH変化量を波長340nmの吸光度変化として測定し、検量線からキシロース濃度を算出した。
【0057】
7.糖化反応結果
糖化反応によるキシロース生産の結果を、後述する比較例の結果と共に表1および図5に示す。糖化反応用液体培地6中のキシロース濃度はほぼ7日間で最大値に達した。ここで、表1の、T1/2は、キシロースの糖化反応用液体培地6中の濃度が、最大濃度の50%に到達する時間(日)を表している。
後述する比較例と比較して、生産されるキシロースの最大到達濃度はほぼ同じであった。したがって、本発明に係る糖化用担体4を使用すれば、キシランとサーモバチルス・コンポスティとの接触が十分に行われ、多孔質担体にサーモバチルス・コンポスティを固定化しない場合と同じ量のキシロース生産が行われていることが証明された。
加えて、T1/2が、実施例は比較例の1/2以下であり、本発明に係る糖化用担体はキシロース生産の立ち上がり速度が速いという顕著な効果を有している。その理由は、実施例では多孔質担体にサーモバチルス・コンポスティが多数固定化されているため、糖化反応工程開始直後から、有意な量のキシロースが生産されているためと考えられる。すなわち、糖化用担体4を使用すれば、キシランとサーモバチルス・コンポスティとの接触が十分に行われるだけでなく、固定化によるサーモバチルス・コンポスティのキシラン糖化能が下がることなく、反応容器内の微生物を常に高濃度に維持することができ、糖化処理に要する時間を短縮していることが証明された。
【0058】
比較例
サーモバチルス・コンポスティを用い、従来の固定化しない微生物による処理法を用いた。糖化装置10の糖化用容器11内に、糖化反応用液体培地6を20mL、微粉状キシラン(微粒状セルロース系多糖類5)0.1g(濃度として;5g/L)、およびサーモバチルス・コンポスティの前培養液200μLを投入し、50℃、150rpmで実施例と同条件下で糖化反応を行った。なお、糖化反応スケールおよび糖化反応条件は実施例と比較例で同じであり、糖化反応期間中のサーモバチルス・コンポスティの菌濃度は、同等レベルであると判断できる。実施例との比較を表1および図5に示す。
【0059】
【表1】

【符号の説明】
【0060】
1 多孔質構造体(多孔質担体)、 2 細孔、 3 好アルカリ性好熱微生物、4 糖化用担体、 5 微粒状セルロース系多糖類、 6 糖化反応用液体培地、 10 糖化装置、 11 糖化用容器、 12 撹拌機、 13 恒温装置(温度制御装置)、 14 通気管
【技術分野】
【0001】
本発明は、植物系バイオマス中に含まれるセルロースまたはヘミセルロースを、微生物を用いてバイオエタノール原料となる単糖に分解するための、植物系バイオマスの糖化用担体、糖化方法および糖化装置に関する。
【背景技術】
【0002】
化石燃料の枯渇をはじめとするエネルギー危機、あるいは地球温暖化防止などの環境保全の観点から、バイオエタノール(バイオマスエタノール)の活用が脚光を浴びている。バイオエタノールとは、サトウキビやトウモロコシなどのいわゆるバイオマスを発酵させて得られるエチルアルコール(エタノール)のことで、内燃機関用燃料の新型燃料として注目を浴びている。また、バイオマスとは、木材、草本、海草、藻、生ごみ、紙、動物の死骸や糞尿、およびプランクトンなど、再生可能な生物由来の有機性エネルギーおよび資源であって、化石燃料を除いたものを指すと言われている。
【0003】
バイオマスから得られるバイオエタノール等のバイオマス由来エネルギーは、その使用時に二酸化炭素を排出するものの、バイオマス自身が太陽エネルギーと水と二酸化炭素から合成されるため、バイオエタノール等の使用によって二酸化炭素を新たに増加させることはない。この意味で、バイオマスは「カーボンニュートラル」なエネルギーであり、世界中でその活用に拍車がかかっている。その中でも、原料の豊富さ、化石燃料との代替のし易さの点で、バイオエタノールが注目されている。
【0004】
これまでのバイオエタノールを得るための一般的な方法は、糖質やデンプン質を多く含む植物資源を原料とし、必要に応じてデンプン質の糖化工程を経ての、酵母等によるアルコール発酵によるものである。これら糖質やデンプン質を多く含む植物資源原料の代表的なものが、サトウキビおよびトウモロコシである。
【0005】
しかし、このサトウキビやトウモロコシを原料としたバイオエタノールの製造が急増し、食料や家畜用飼料の価格を押し上げ、大きな国際的社会問題となっている。また、このようなバイオエタノールの生産は、貧困国の食糧事情を悪化させるとの批判もある。そのため、食料と競合しないセルロース系バイオマス資源からのバイオエタノールの製造が喫緊の課題となっている。
【0006】
しかしながら、セルロース等(ヘミセルロースも含めて)の多糖類から発酵によって直接エタノールを製造することはできないため、まず、この多糖類をアルコール発酵可能な単糖類に分解(糖化)する必要がある。セルロースを単糖に分解する糖化技術としては、硫酸による加水分解(特許文献1)またはセルロース分解酵素(セルラーゼ)を使用した生物学的糖化法(特許文献2)が検討されている。なお、本願においてセルロース系多糖類と称した場合、以後特に断らない限り、ヘミセルロースも含めて言及しているものとする。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2009−189291号公報
【特許文献2】特開2006−088136号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、上記硫酸等による加水分解、いわゆる化学的糖化法では、酸を使用するため環境への負荷および後処理コスト等の問題が存在する。一方、酵素による生物学的糖化法は、高価な加水分解酵素を大量に必要とする上、酵素活性維持のために温度およびpHの管理や制御が非常に煩雑で運転コストも高くなる。したがって、必然的にバイオエタノールの生産コストが高くなるという問題点を有している。また、微生物による生物学的糖化法も検討されているが、セルロース系多糖類は水に不溶なため、セルロース分解微生物を、多孔質等の担体に固定化した「微生物固定化担体」を使用しての糖化は不向きであると考えられていた。すなわち、セルロース系多糖類が水に不溶であるので、担体に固定化された微生物との接触が不十分となり、糖化速度が非常に遅くなるためである。そのため、微生物による生物学的糖化法は、糖化反応終了後の単糖と微生物の分離が非常に煩雑であるという問題点を有していた。
【0009】
そこで、本発明の目的は、環境への負荷が小さい生物学的糖化法において、糖化工程での運転の管理および制御が容易で、かつ、セルロース系多糖類の糖化に対しても適用可能であり、生成物である単糖の単離・精製が容易な、微生物を固定化した糖化用担体、糖化方法および糖化装置を提供することにある。
【課題を解決するための手段】
【0010】
前記課題を解決するために、本発明者らは鋭意研究を重ねた結果、微生物として好アルカリ性好熱微生物を使用し、当該好アルカリ性好熱微生物を、以下に詳述する特徴をもつ多孔質構造体に固定化した糖化用担体を開発することにより、本発明を完成させた。
【0011】
すなわち、本発明によれば、多孔質構造体に、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が固定化され、多孔質構造体が有する細孔の少なくとも一部が連通している、植物系バイオマスの糖化用担体が提供される。ここにおいて、多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、細孔が連通していることが好ましい。
【0012】
また、本発明の別の観点によれば、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物を液体培地で培養して、該好アルカリ性好熱微生物が該液体培地中に懸濁した培養液を調製する工程と、該培養液中に多孔質構造体を浸漬して、該多孔質構造体の多孔質構造を形成している構造体物質表面に、前記好アルカリ性好熱微生物を固定化して糖化用担体を調製する工程と、該糖化用担体、植物系バイオマス由来のセルロース系多糖類、および糖化反応用液体培地を混合して、該糖化反応用液体培地中に前記糖化用担体および前記セルロース系多糖類が分散した分散液を調製する工程と、該分散液を、前記好アルカリ性好熱微生物の生育条件で処理する工程とを有し、前記多孔質構造体として、形成されている細孔の少なくとも一部が連通している多孔質構造体を使用する、植物系バイオマスの糖化方法が提供される。ここにおいて、好アルカリ性好熱微生物を固定化する工程の後に、前記構造体物質表面に固定化された前記好アルカリ性好熱微生物をさらに培養して、前記構造体物質表面で増殖させる工程を有することが好ましい。さらに、多孔質構造体として、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記細孔が連通している多孔質構造体を使用する糖化方法であることがより好ましい。
【0013】
本発明のさらに別の観点によれば、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が、多孔質構造体に固定化された植物系バイオマスの糖化用担体と、撹拌手段とを有する、植物系バイオマスの糖化装置が提供される。ここにおいて、多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記多孔質構造体が有する細孔が連通していることが好ましい。
【発明の効果】
【0014】
本発明の植物系バイオマスの糖化用担体、糖化方法および糖化装置によれば、環境への負荷が小さい生物学的糖化法において、糖化工程での運転の管理および制御が容易であり、かつ、セルロース系多糖類の糖化に対して優れた糖化能を発揮することができる。
【図面の簡単な説明】
【0015】
【図1】本発明に係る糖化用担体の原料となる多孔質構造体(多孔質担体)の一例を写真で示したものである。
【図2】(A)はリブ構造の多孔質構造体(多孔質担体)を示す模式図である。(B)はウォール構造の多孔質構造体(多孔質担体)を示す模式図である。
【図3】多孔質構造体(多孔質担体)に好アルカリ性好熱微生物が担持により固定化された様子を示す顕微鏡写真である。
【図4】(A)は本発明に係る糖化用担体を概略的に示す模式図である。(B)は本発明に係る糖化装置を概略的に示す模式図である。
【図5】本発明に係る糖化方法による糖化反応結果を示すグラフ図である。
【発明を実施するための形態】
【0016】
以下、本発明の実施の形態について、適宜、図を参照しながら、課題解決のために重要な点および従来技術と異なる特徴等について説明する。
【0017】
本発明の植物系バイオマスの糖化用担体(以後単に糖化用担体と称する場合もある)は、多孔質構造を有する多孔質構造体にセルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物を固定化したものである。なお、以後、多孔質構造体を多孔質担体と称する場合もある。本発明に使用される該多孔質担体の材質としては、多孔質構造を形成し得るものであれば特に限定されず、セラミック、ゼオライト等の無機化合物、または樹脂等の有機化合物を使用することができる。微生物による糖化反応を行う際の、攪拌のし易さ、攪拌時の摩擦力やせん断力による担体の破壊が起こりにくい点で、樹脂製多孔質担体であることが好ましい。
【0018】
本発明に使用できる樹脂製多孔質担体としては、例えば、ポリウレタン系、ポリエーテル系、ポリエステル系、ポリビニル系、ポリ(メタ)アクリレート系などを挙げることができ、付加重合体、縮合重合体または付加縮合体のいずれであってもよい。また、架橋剤により架橋された、これら高分子(樹脂)の三次元網目構造体であってもよい。後で詳述する本発明に好適な多孔質を形成しやすい点で、ポリウレタン系樹脂が好ましく、水膨潤性のポリウレタン樹脂がより好ましい。
【0019】
また、本発明の糖化用担体として好適な多孔質構造は、例えば図1に示すような構造である。図1は、本発明の好アルカリ性好熱微生物を担持して固定化するのに適した多孔質担体1の一例を写真で示すものである。該多孔質担体1は、ポリウレタン製であり、その構造体全体にわたって多数の細孔2が形成されている。この細孔2を形成する構造体の形状として、樹脂等の構造体部分が繊維状または骨状であって「リブ構造」と呼ばれるタイプと、当該構造体部分が膜状であって、その膜に細孔2が開いている「ウォール構造」と呼ばれるタイプがある。リブ構造およびウォール構造の模式図を図2(A)および(B)に示す。
【0020】
本発明の多孔質担体1としては、リブ構造、ウォール構造いずれのタイプであってもよいが、好アルカリ性好熱微生物が担持されやすく、安定的に固定化される点でウォール構造であることが好ましい。また、多孔質担体1に形成される細孔2の細孔径は、糖化されるセルロース系多糖類の微粒化物が容易に出入りあるいは通過できる大きさであり、セルロース系多糖類の微粒化度によって、必要とされる細孔径の範囲が決められる。糖化効率の点で、セルロース系多糖類は、0.1〜200μmの粒子径範囲が好ましいので、当該細孔径として径10μm〜2mmの細孔2が、細孔の80%以上、好ましくは90%以上、より好ましくは95%以上を占める多孔質構造であることが好ましい。なお、本発明の多孔質担体1に多数存在する細孔2は、その細孔径が10μm未満のものや2mmより大きいものも当然存在する。
【0021】
好適には、100μm〜2mmの細孔2が、細孔の60%以上、好ましくは70%以上、より好ましくは80%以上を占める多孔質構造であることが好ましい。より好適には、300μ〜2mmの細孔が、細孔の40%以上、好ましくは50%以上、より好ましくは60%以上を占める多孔質構造であることが好ましい。
【0022】
なお、ここで細孔径とは、顕微鏡で観察される細孔を平面に投影したとした場合に描かれる円の直径、それが楕円であれば長径(長半径の2倍)部分を指すものとし、顕微鏡写真で当該径の長さを直接測定するものとする。ただし、容易に理解できるように、当該細孔の平面投影図は、数学的な円や楕円では無いことは明らかであるので、円状、楕円状と考えて、直径に相当、長径に相当するという意味である。また、微粒化されたセルロース系多糖類の粒子径とは、例えばレーザー回折式測定法またはレーザー散乱式測定法等によって測定される半径を指すものとする。ただし、セルロース系多糖類の粒子径は、本発明の本質ではなく、概略前記範囲であれば好ましいのであって、当該粒子径および測定法を規定するものではない。
【0023】
また、細孔は当然のことながら容積を有するものであるため、上記投影図での細孔径のみで規定することは難しい点もある。したがって、当該多孔質担体の多孔質の程度について、多孔質担体の空隙率で表すことも好ましい。この空隙率の観点において、本発明の多孔質担体は、糖化効率と好アルカリ性好熱微生物の担持されやすさのバランスの点で、70〜98%の空隙率を有することが好ましい。微粒状セルロース系多糖類と、固定化された好アルカリ性好熱微生物との接触頻度の高さの点で、空隙率は80%以上が好ましく、85%以上がより好ましい。また、多孔質担体1の構造強度、すなわち撹拌等によるせん断力、機械力が付与される糖化反応時の多孔質担体1の破壊を防止する点で、97%以下が好ましく、95%以下がより好ましい。ここで、空隙率とは、多孔質担体1の一定嵩体積中の空隙の割合を百分率で表したものである。
【0024】
このように大きな空隙率を持つため、好アルカリ性好熱微生物を多く担持できる点でも、多孔質担体1の構造体物質の表面積が大きくなる前記ウォール構造が好ましい。ここで、空隙率は、理論的には、真密度と嵩密度の差から求められる。すなわち、例えば、真密度が1g/cm3、嵩密度が0.1g/cm3であれば、空隙率は、(1−0.1)/1×100=90(%)と計算される。
【0025】
具体的には、該多孔質担体1の所定の体積(例えば1cm四方のいわゆる嵩体積)の重量を測定する。また、該多孔質担体1を構成する樹脂(高分子)の、空隙が存在しない場合の当該体積に相当する重量を当該樹脂の真密度から計算する。そして、この二つの値から嵩密度を算出し、空隙率を計算する。ここで、嵩体積とは、空隙部を含む体積を意味する。例えば、図1の多孔質担体が略立方体形状であるとした場合、各辺に相当する部分に直線を引いて形成される立方体図形の体積を言うものとする。
【0026】
しかし、樹脂(高分子)の場合、その重合条件によって真密度が異なるので、上記のような計算方法では、正確さを欠く場合がある。したがって、市販の真密度測定器等によって真密度を測定して、空隙率を計算する方法もある。ただし、多孔質担体中に、表面(外部)に連通していない(すなわち多孔質構造体物質の内部に独立した)細孔が存在する場合は、いわゆる見かけ密度が測定されることもあるが、この見かけ密度を基に空隙率を算出してもよい。
【0027】
さらに、微粒状セルロース系多糖類が、当該細孔2を容易に出入りでき、あるいは、当該多孔質体1の細孔2を貫通して通過でき、多孔質担体1に固定化された好アルカリ性好熱微生物と高頻度に接触するためには、細孔2の少なくとも一部が連通している必要がある。好ましくは、多孔質担体1の内部の細孔2の大部分が、表面部分のいずれかの細孔2と連通していることが望ましい。この好ましい連通度を規定する方法として、次に示す方法を採用することができる。
【0028】
すなわち、所定の体積(嵩体積)を有する本発明の多孔質担体1を、水面に静かに載置(静置)し、載置したときから、当該多孔質担体1全体が水面下に没するまでの時間で規定する。本発明においては、この時間を「浸漬所要時間」と称することとする。ここで、所定の体積(嵩体積)としては、概略1cm3とし、略1cm3であればその形状は特に規定されるものではなく、立方体、直方体、球体もしくは紡錘形状体、またはこれらの類似形状でもよく、他の形状であってもよい。本発明の植物系バイオマスの糖化用担体としての実際の使用時の形態が好ましい。
【0029】
本発明の植物系バイオマスの糖化用担体としての多孔質担体1は、例えば、嵩体積として概略1cm3の略立方体、略直方体または略球体で使用するのが好ましいので、当該形状での浸漬所要時間で規定する。なお、前記概略1cm3の略立方体、略直方体または略球体であれば、細孔径や連通度合いが同程度、すなわち多孔質担体1の製造条件が同じ場合は、その浸漬所要間はほぼ同じである。また、紡錘形状体であってもほぼ同じである。
【0030】
本発明に係る多孔質担体1の連通度としては、概略1cm3の上記形状体での浸漬所要時間は20秒以下であり、セルロース系多糖類の糖化速度が速い点で、10秒以下が好ましく、5秒以下がより好ましい。さらに、浸漬所要時間は、多孔質担体1の密度にも影響されるので、それが非常に短く、1秒以下、例えば、0.1秒またはそれ未満で0秒に近い場合であってもよい。多孔質担体原料の真密度または見かけ密度が水の密度より小さい場合は、水中に没することは無いが、このような密度の担体は、微粒状セルロース系多糖類の出入りや通過の点であまり好ましくない。すなわち、本発明の多孔質担体としては、その真密度または見かけ密度が水の密度以上であることが好ましい。
【0031】
次に、本発明の糖化用原料である植物系バイオマスについて説明する。植物系バイオマスとしては、水中の藻や水草などの水性系バイオマス、雑草や農作物などの草本系バイオマス、および木由来の木質系バイオマスを挙げることができる。木質系バイオマスとしては、幹や枝などのいわゆる木材、間伐材、および製材所で発生するおが屑などが含まれる。なお、植物系バイオマスの中で、セルロース系多糖類を多く含むものは、その成分に着目してセルロース系バイオマスとも呼ばれる。上記草本系バイオマスには、上述したサトウキビやトウモロコシが含まれるが、これらは糖質(炭水化物)を多く含み、特に糖化を必要とせず、エタノール発酵工程のみでバイオエタノールが得られる場合が多い。
【0032】
したがって、草本系バイオマスのうち、サトウキビなどのように糖質を多く含有するバイオマスは、本発明の糖化技術を活用する必然性が小さい。この点から、本発明の糖化技術に適した植物系バイオマスは、セルロースやヘミセルロースといったセルロース系多糖類を多く含むバイオマスであり、成分での呼称で表現するとセルロース系バイオマスが対象として好適である。セルロース系多糖類を多く含む点、原料が豊富な点、間伐材やおが屑を原料とした「有効利用」の観点で資源保護に多大な利点をもたらす点において、木質系バイオマスを原料とすることが好ましい。
【0033】
以後、本発明は特にセルロース系多糖類を多く含有する植物系バイオマスを、その原料として対象としている点を考慮して、本発明の原料であるバイオマスをセルロース系バイオマスと称することとする。なお、上述したのと同様、セルロース系バイオマスと称した場合、ヘミセルロースも含むこととする。
【0034】
本発明において、原料であるこのセルロース系バイオマスは、糖化反応を効率よく進行させるため、粉砕処理され、微粒状セルロース系多糖類として使用される。粉砕方法の例としては次の方法が挙げられる。例えば、木質系バイオマスを原料とする場合は、まず木材を木材チップとし、粗粉砕した後、蒸解によって脱リグニンしてセルロースを得る。得られたセルロース、ヘミセルロースまたはその両者を、乾式または湿式粉砕によって微粉砕する。このときの粒度としては、平均粒子径(半径)で0.2〜100μmの範囲とすることが好ましい。糖化効率および糖化速度を向上させる点で、50μm以下が好ましく、5μm以下がより好ましい。粉砕効率の点では、0.2μm未満は現実的では無いので、その平均粒子径(半径)は、0.2μm以上、好ましくは0.5μm以上である。なお、粉砕には、ボールミル、ビーズミルあるいはハンマーミル等、任意の粉砕機を使用することができる。
【0035】
つづいて、本発明の上記多孔質担体1に担持して固定化する微生物について説明する。当該微生物は、好アルカリ性好熱微生物であり、本発明の目的上、ヘミセルロースを含む、セルロース系多糖類を糖化する微生物である。当該微生物の例として、サーモバチルス・コンポスティ(Thermobacillus composti)、バチルス・ハロデュランス(Bacillus halodurans)を挙げることができる。アルカリ性高温下は、セルロース系多糖類の糖化に有利に働くので、このような条件が活動に至適である好アルカリ性好熱微生物が、本発明の糖化技術に適用する微生物に適している。
【0036】
次に、この好アルカリ性好熱微生物を多孔質担体1に固定化する方法について説明する。多くの好熱微生物は、生育に適さない環境下では芽胞という耐久性の高い休眠状態の細胞構造をとるため、まずこの休眠状態を解除するために、好アルカリ性好熱微生物を、pH7〜10、25℃〜70℃の条件下において培養用液体培地で培養し、好アルカリ性好熱微生物の前培養液を調製する。なお、上記条件は、採用する好アルカリ性好熱微生物の至適生育条件によって、この範囲内で適した条件を選択する。例えば、サーモバチルス・コンポスティ(Thermobacillus composti)であれば、pH約9、温度約50℃で培養することが好ましい。
【0037】
つづいて、この微生物前培養液を、嵩体積略1cm3の多孔質担体1を浸漬した微生物増殖用培地へ加え、その微生物の至適生育条件で培養し、好アルカリ性好熱微生物を当該多孔質担体1へ固定化し、増殖させる。当該多孔質担体1の形状は、上述した通り、特に限定は無いが、略立方体、略直方体または略球体の形状のものを使用する。なお、多孔質担体1の嵩体積は略1cm3に限定されることなく、実生産の規模によって変更することができ、より大きい、数cm3〜数千cm3、例えば5cm3〜1000cm3、あるいは10cm3〜500cm3であってもよい。一方、実験室での少量の合成では、1cm3以下、例えば1cm3〜0.01cm3程度の嵩体積であってもよい。
【0038】
上記培養用液体培地および微生物増殖用培地は、使用する好アルカリ性好熱微生物に適するように調製され、例えば、Modified Brock's basal salts培地(MBS培地)をベースとして調製される。
【0039】
図3に、好アルカリ性好熱微生物3が多孔質担体1に担持され、固定化される様子を示す。固定化の様式としては、物理吸着であると考えられるが、好アルカリ性好熱微生物3と多孔質担体1との化学吸着であってもよい。
【0040】
このようにして好アルカリ性好熱微生物3を多孔質担体1に固定化した後、当該微生物が固定化された多孔質担体(すなわち、本発明の糖化用担体4)を微生物増殖用培養液から分離して取り出す。次に、セルロース系バイオマスから得た微粒状セルロース系多糖類5、糖化用担体4に固定化された微生物の生育用培地である糖化反応用液体培地6、および糖化用担体4を、本発明の糖化装置10を構成する糖化用容器11に投入する(図4)。この後、以下に示す条件により、糖化用担体4の好アルカリ性好熱微生物3の活性を維持しつつ、当該微生物による糖化反応、すなわち微粒状セルロース系多糖類5の単糖への分解反応を行う。ここにおいて、糖化反応用液体培地6も、例えばMBS培地をベースとして調製することができる。
【0041】
本糖化装置10は、糖化用容器11、撹拌機12、恒温装置(温度制御装置)13、および必要に応じて通気管14を装備する。ここで、糖化用容器11の容量は、微粒状セルロース系多糖類の所望の処理量に適合させて適宜決定することができる。すなわち、実験室での試験生産レベルであれば、数mL〜数Lの容積が考えられ、実生産レベルであれば、数m3(数t)以上の反応容器となる。また、撹拌機12としては、特に制限はなく、プロペラ羽根、パドル羽根、タービン羽根あるいはアンカー羽根等を有する撹拌機12であればどのようなものであってもよく、また糖化用容器11は邪魔板を有していてもよい。
【0042】
恒温装置13は糖化用容器11の中に熱源を設置するものでも容器自体または容器の外側に熱源があってもよい。図4(B)では、外部熱源によるジャケット式の温度制御を例示したが、上記したように、温度制御は本方式に限られない。また温度制御はオンオフ制御程度の簡易なもので良い。通気管14は微生物が好気性でかつ糖化用容器11のサイズが数L以上となり、微生物による糖化反応の進行に伴い溶液内が嫌気条件になってしまう場合のみでよい。
【0043】
上記のように、微粒状セルロース系多糖類5、糖化反応用液体培地6、および糖化用担体4を糖化用容器11に投入した後、当該微生物の至適生育温度で、数日から数週間、撹拌機12で撹拌しながら糖化反応を行う。所定の間隔で糖化の進行状況、すなわち当該糖化反応によって生産される単糖の生成状況を追跡し、生成物である単糖の糖化反応用液体培地6中での濃度が一定となった時点で(あるいは原料の微粒状セルロース系多糖類5が消費された時点で)、糖化が終了したと判断する。本糖化工程が終了した後、単糖を含む糖化反応用液体培地6から糖化用担体4を回収し、つづいて、糖化反応用液体培地6からの抽出、精製によって、目的物である単糖を得る。
【0044】
以上、糖化反応工程について、撹拌機12で撹拌する形式の糖化装置10を例として説明したが、糖化反応用液体培地6、糖化用担体4および微粒状セルロース系多糖類5の混合、ならびに糖化用担体4中の好アルカリ性好熱微生物と微粒状セルロース系多糖類5との接触が十分行われるのであれば、他の撹拌型式であってもよい。例えば、糖化反応用液体培地6中に糖化用担体4および微粒状セルロース系多糖類5が分散した分散液が、ポンプ等により糖化用容器11内または糖化用容器11と外部循環装置間で循環しながら糖化反応を行う方式であってもよい。または、糖化用容器11が糖化用担体4をカラム方式で充填固定化できる形態であり、このように糖化用担体4が充填固定化された糖化用容器11内を、糖化反応用液体培地6に微粒状セルロース系多糖類5のみが分散したセルロース分散液が流動して循環するタイプであってもよい。
【0045】
以上説明した本発明に係る好アルカリ性好熱微生物による糖化は、従来の酵素による微生物学的糖化法と比較して、反応制御が複雑でなく、精緻な制御も不要であるという利点を有している。この両者の方法は具体的に次のような差異を有している。
【0046】
すなわち、酵素の場合、温度やpHのわずかな変動によって、酵素を構成するタンパク質の三次元構造が崩壊し、同時に機能も失ってしまう(失活)。この失活は不可逆であり、一度失活した酵素は機能を回復することはない。したがって、酵素処理の場合、精度の高い温度管理とpH制御を行わないと、生産性が減少するだけでなく、酵素が失活し、極端な場合、糖化反応が停止してしまう。それゆえ、温度とpHにおいて高精度な制御が要求され、失活した酵素の補充も必要となるため、糖化反応コストが高いという問題点が存在する。一方、好アルカリ性好熱微生物の場合は、環境適応能力を有しており、多少温度およびpHが変化しても好アルカリ性好熱微生物が死滅することはなく、さらに、好アルカリ性好熱微生物が自己増殖するので、補充が不要で自律的な運転が可能となる。したがって、酵素による生物学的糖化法と比較して、低コストで糖化反応を行うことができる。
【実施例】
【0047】
以下、実施例を示してさらに本発明を詳細に説明する。しかし、本実施例は本発明の理解を助けるための具体的な実施手段および方法を例示するものであって、本発明の範囲は本実施例に限定されるものではない。また、本発明の効果を証明するために、好アルカリ性好熱微生物を多孔質担体に固定化せずに糖化反応させたもの、すなわち従来の微生物による生物学的糖化方法に準拠した方法も比較例として示す。
【0048】
実施例
1.試料
(1)セルロース系バイオマスおよび微粒状セルロース系多糖類
本発明に係るセルロース系バイオマスの一例として、ブナから得られるヘミセルロースの1種であるキシラン粉末(シグマアルドリッチジャパン株式会社製、Xylan from beechwood: X4252、平均粒子径2μm)を入手して使用した。
(2)好アルカリ性好熱微生物
本発明に係る好アルカリ性好熱微生物の一例として、渡邉らによって家庭用生ごみ処理装置より単離されたサーモバチルス・コンポスティ(Thermobacillus composti)(DSM No. 18247)を使用した。
(3)サーモバチルス・コンポスティの培養用液体培地(兼微生物増殖用培地)
サーモバチルス・コンポスティの培養のための液体培地として、Modified Brock's basal salts培地(MBS培地:1リットル当たりの組成を以下に示す;(NH4)2SO4 (1.3g)、KH2PO4 (0.28g)、MgSO4・7H2O (0.25g)、CaC12・2H2O (70mg)、FeCl3・6H2O (2mg)、MnC12・4H2O (1.8mg)、Na2B4O7・10H2O (4.5mg)、ZnSO4・7H2O (0.22mg)、CuCl2・2H2O (0.05mg)、NaMoO4・2H2O (0.03mg)、VOSO4・2H2O (0.03mg)、CoSO4 (0.01mg))をpH9.0に調整し、これにグルコースと酵母抽出物を各々の最終濃度が5g/Lと0.5%になるように添加した培養用液体培地を使用した。
(4)糖化反応用液体培地
糖化反応用液体培地としてMBS培地をpH9.0に調整したものを使用した。
(5)多孔質担体
本発明に係る、好アルカリ性好熱微生物(サーモバチルス・コンポスティ)固定化用の多孔質担体1として、APG(登録商標)(日清紡ケミカル株式会社製、ポリウレタン樹脂)を使用した。当該APG(登録商標)の空隙率は約92%であった(図1)。また、顕微鏡観察において、径10μm〜2mmの細孔が細孔の80%以上を占めており、浸漬所要時間は1秒程度のものであった。
【0049】
2.糖化装置
糖化用容器11として硬質ガラス製50mL三角フラスコ、撹拌機12兼恒温装置として振盪機付恒温槽(タイテック株式会社、Bioshaker BR-30)を、実験室スケール用の糖化装置10として使用した。振盪により反応容器内の培養液のガス交換は充分であるため、通気管14は設けなかった。
【0050】
3.サーモバチルス・コンポスティの前培養
サーモバチルス・コンポスティを培養用液体培地によって、以下の条件で培養し、休眠状態を解除して増殖させ、サーモバチルス・コンポスティの前培養液(波長600nmでの吸光度(OD600)が0.2〜0.4まで増殖し、懸濁している培養液)を調製した。上記の培養用液体培地を試験管に5mL入れ、これに保存用サーモバチルス・コンポスティ液(休眠状態)を50μL添加し、振盪機付恒温槽により、50℃、150rpmで一晩振盪培養し、サーモバチルス・コンポスティの前培養液を調製した。
【0051】
4.糖化用担体の調製
約1cm3の略立方体状に成形したAPG(登録商標)20個を培養用液体培地40mLが入った100mL三角フラスコへ投入し、つづいて上記3.の前培養液を50μL加えた。次に、振盪機付恒温槽により、50℃で一晩振盪培養し、サーモバチルス・コンポスティをAPG(登録商標)に固定化させると同時に増殖させた。その後、MBS培地で2回すすぎ、固定化されていない微生物と担体内部に残った培養用液体培地を洗い流し、糖化用担体4を調製した。
【0052】
5.糖化反応
上記2.の糖化装置10の糖化用容器11内に、糖化反応用液体培地6を20mL、微粉状キシラン(微粒状セルロース系多糖類5)0.1g(濃度として;5g/L)、および4.の立方体状糖化用担体4を20個投入し、50℃、150rpmで撹拌しながら糖化反応を開始した(図4)。この糖化反応工程により、キシランが糖化用担体4のサーモバチルス・コンポスティによって分解(糖化)され、キシランに対応する単糖であるキシロースが生産される。糖化反応開始から1日毎に生成したキシロース量を次の6.に示す方法で測定した。
【0053】
6.キシロース測定方法
キシロースの定量測定には、D−キシロース測定キット(Megazyme International Ireland LTD.製)を使用した。上記5.より糖化反応培養液を1mL採取し、15000rpm、4℃で20分間遠心分離し、菌体と糖化されなかったキシランとを沈殿させた。上清に含まれるキシロースをキシロース測定キットによって比色定量分析した。この分析法では、以下の式(1)および式(2)のような反応により、D−キシロースと同量のNADHが生成される。
【0054】
【化1】

【0055】
【化2】

【0056】
上記式で示したNADH変化量を波長340nmの吸光度変化として測定し、検量線からキシロース濃度を算出した。
【0057】
7.糖化反応結果
糖化反応によるキシロース生産の結果を、後述する比較例の結果と共に表1および図5に示す。糖化反応用液体培地6中のキシロース濃度はほぼ7日間で最大値に達した。ここで、表1の、T1/2は、キシロースの糖化反応用液体培地6中の濃度が、最大濃度の50%に到達する時間(日)を表している。
後述する比較例と比較して、生産されるキシロースの最大到達濃度はほぼ同じであった。したがって、本発明に係る糖化用担体4を使用すれば、キシランとサーモバチルス・コンポスティとの接触が十分に行われ、多孔質担体にサーモバチルス・コンポスティを固定化しない場合と同じ量のキシロース生産が行われていることが証明された。
加えて、T1/2が、実施例は比較例の1/2以下であり、本発明に係る糖化用担体はキシロース生産の立ち上がり速度が速いという顕著な効果を有している。その理由は、実施例では多孔質担体にサーモバチルス・コンポスティが多数固定化されているため、糖化反応工程開始直後から、有意な量のキシロースが生産されているためと考えられる。すなわち、糖化用担体4を使用すれば、キシランとサーモバチルス・コンポスティとの接触が十分に行われるだけでなく、固定化によるサーモバチルス・コンポスティのキシラン糖化能が下がることなく、反応容器内の微生物を常に高濃度に維持することができ、糖化処理に要する時間を短縮していることが証明された。
【0058】
比較例
サーモバチルス・コンポスティを用い、従来の固定化しない微生物による処理法を用いた。糖化装置10の糖化用容器11内に、糖化反応用液体培地6を20mL、微粉状キシラン(微粒状セルロース系多糖類5)0.1g(濃度として;5g/L)、およびサーモバチルス・コンポスティの前培養液200μLを投入し、50℃、150rpmで実施例と同条件下で糖化反応を行った。なお、糖化反応スケールおよび糖化反応条件は実施例と比較例で同じであり、糖化反応期間中のサーモバチルス・コンポスティの菌濃度は、同等レベルであると判断できる。実施例との比較を表1および図5に示す。
【0059】
【表1】

【符号の説明】
【0060】
1 多孔質構造体(多孔質担体)、 2 細孔、 3 好アルカリ性好熱微生物、4 糖化用担体、 5 微粒状セルロース系多糖類、 6 糖化反応用液体培地、 10 糖化装置、 11 糖化用容器、 12 撹拌機、 13 恒温装置(温度制御装置)、 14 通気管
【特許請求の範囲】
【請求項1】
多孔質構造体に、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が固定化され、
前記多孔質構造体が有する細孔の少なくとも一部が連通している、
植物系バイオマスの糖化用担体。
【請求項2】
前記多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記細孔が連通している、
請求項1に記載の植物系バイオマスの糖化用担体。
【請求項3】
セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物を液体培地で培養して、該好アルカリ性好熱微生物が該液体培地中に懸濁した培養液を調製する工程と、
該培養液中に多孔質構造体を浸漬して、該多孔質構造体の多孔質構造を形成している構造体物質表面に、前記好アルカリ性好熱微生物を固定化して糖化用担体を調製する工程と、
該糖化用担体、植物系バイオマス由来のセルロース系多糖類、および糖化反応用液体培地を混合して、該糖化反応用液体培地中に前記糖化用担体および前記セルロース系多糖類が分散した分散液を調製する工程と、
該分散液を、前記好アルカリ性好熱微生物の生育条件で処理する工程とを有し、
前記多孔質構造体として、形成されている細孔の少なくとも一部が連通している多孔質構造体を使用する、
植物系バイオマスの糖化方法。
【請求項4】
前記好アルカリ性好熱微生物を固定化する工程の後に、前記構造体物質表面に固定化された前記好アルカリ性好熱微生物をさらに培養して、前記構造体物質表面で増殖させる工程を有する、
請求項3に記載の植物系バイオマスの糖化方法。
【請求項5】
前記多孔質構造体として、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記細孔が連通している多孔質構造体を使用する、
請求項4に記載の植物系バイオマスの糖化方法。
【請求項6】
セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が、多孔質構造体に固定化された植物系バイオマスの糖化用担体と、
撹拌手段とを有する、
植物系バイオマスの糖化装置。
【請求項7】
前記多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記多孔質構造体が有する細孔が連通している、
請求項6に記載の植物系バイオマスの糖化装置。
【請求項1】
多孔質構造体に、セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が固定化され、
前記多孔質構造体が有する細孔の少なくとも一部が連通している、
植物系バイオマスの糖化用担体。
【請求項2】
前記多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記細孔が連通している、
請求項1に記載の植物系バイオマスの糖化用担体。
【請求項3】
セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物を液体培地で培養して、該好アルカリ性好熱微生物が該液体培地中に懸濁した培養液を調製する工程と、
該培養液中に多孔質構造体を浸漬して、該多孔質構造体の多孔質構造を形成している構造体物質表面に、前記好アルカリ性好熱微生物を固定化して糖化用担体を調製する工程と、
該糖化用担体、植物系バイオマス由来のセルロース系多糖類、および糖化反応用液体培地を混合して、該糖化反応用液体培地中に前記糖化用担体および前記セルロース系多糖類が分散した分散液を調製する工程と、
該分散液を、前記好アルカリ性好熱微生物の生育条件で処理する工程とを有し、
前記多孔質構造体として、形成されている細孔の少なくとも一部が連通している多孔質構造体を使用する、
植物系バイオマスの糖化方法。
【請求項4】
前記好アルカリ性好熱微生物を固定化する工程の後に、前記構造体物質表面に固定化された前記好アルカリ性好熱微生物をさらに培養して、前記構造体物質表面で増殖させる工程を有する、
請求項3に記載の植物系バイオマスの糖化方法。
【請求項5】
前記多孔質構造体として、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記細孔が連通している多孔質構造体を使用する、
請求項4に記載の植物系バイオマスの糖化方法。
【請求項6】
セルロース、ヘミセルロースまたはその両者の分解能を有する好アルカリ性好熱微生物が、多孔質構造体に固定化された植物系バイオマスの糖化用担体と、
撹拌手段とを有する、
植物系バイオマスの糖化装置。
【請求項7】
前記多孔質構造体は、該多孔質構造体を略1cm3の立方体または略同体積の直方体、球状体もしくは紡錘体として、水面上に静置したとき、前記多孔質構造体の全体が20秒以内に水中に没するように、前記多孔質構造体が有する細孔が連通している、
請求項6に記載の植物系バイオマスの糖化装置。
【図2】


【図4】


【図5】


【図1】


【図3】




【図4】


【図5】


【図1】


【図3】


【公開番号】特開2012−44875(P2012−44875A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−187201(P2010−187201)
【出願日】平成22年8月24日(2010.8.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成22年3月5日 日本木材学会第60回日本木材学会大会実行委員会発行の「平成22年第60回日本木材学会大会研究発表要旨論集」に発表 〔刊行物等〕 平成22年3月18日開催 日本木材学会主催の「平成22年第60回日本木材学会大会」で発表
【出願人】(598123138)学校法人 創価大学 (49)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月24日(2010.8.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成22年3月5日 日本木材学会第60回日本木材学会大会実行委員会発行の「平成22年第60回日本木材学会大会研究発表要旨論集」に発表 〔刊行物等〕 平成22年3月18日開催 日本木材学会主催の「平成22年第60回日本木材学会大会」で発表
【出願人】(598123138)学校法人 創価大学 (49)
【Fターム(参考)】
[ Back to top ]

