神経変性の治療としてのニトロキシドラジカル
テンポールなどの安定なニトロキシドラジカルの有効量を哺乳動物に投与することを含む、哺乳動物において神経変性を治療又は予防する方法、ならびに関連する方法。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本願は、援用により組み込まれた2007年3月9日に出願された米国仮特許出願60/894,134号の利益を主張する。
【背景技術】
【0002】
(発明の背景)
神経変性疾患は、世界中で何百万人もの人に影響を与えている。脳内の生物学的に利用可能な鉄量の欠乏が、神経変性をもたらすと考えられている。詳細には、鉄調節タンパク質、特にIRP1及びIRP2は神経変性疾患に罹患した患者に見られる損なわれた鉄ホメオスタシスに含まれると考えられている。IRP1及びIRP2は、転写産物内の鉄応答性エレメントに結合することによってフェリチン、トランスフェリン(transferring)受容体(TfR1)、及び他の遺伝子の発現を制御する。IRP2が不足する動物は、TfR1発現が減少することによって貧血及び成人発症進行性神経変性が進行し、発生中の赤血球系細胞及び中枢神経系(CNS)で機能的鉄の欠乏が生じる。IRP1が不足する動物は、IRP2がIRP1の減少を補償するので、鉄代謝のわずかな揺らぎがあるだけである。しかしながら、IRP2が不足する動物では、ほとんどの組織でフェライトレベルが増加し、TfRレベルが減少することにより、使用可能な鉄量の欠乏が生じる。
【発明の概要】
【発明が解決しようとする課題】
【0003】
したがって、神経変性の進行を遅らせ、治療し、又は予防するため、あるいは鉄代謝、IRP機能、又はTfR1発現における異常を治療又は予防するために使用できる化合物が希求されている。
【課題を解決するための手段】
【0004】
(本発明の簡単な要旨)
本発明は、神経変性を治療又は予防するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、神経変性疾患に罹患した哺乳動物における神経変性を治療又は予防する方法を提供する。
【0005】
本発明はまた、哺乳動物の中枢神経系において生物学的に利用可能な鉄の量を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、中枢神経系(CNS)の鉄が欠乏している哺乳動物のCNSにおいて生物学的に利用可能な鉄の量を増加させる方法を提供する。
【0006】
本発明は更に、哺乳動物において鉄調節タンパク質1(IRP1)を活性化するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてIRP1を活性化する方法を提供する。
【0007】
加えて本発明は、トランスフェリン受容体1(TfR1)発現を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物におけるTfR1発現を増加させる方法を提供する。
【図面の簡単な説明】
【0008】
(図面の簡単な説明)
以下の図面は、少なくともいくつかの本発明の実施態様を示す:
【0009】
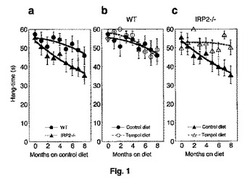
【図1】図1a、1b、及び1cは、コントロール飼料又はテンポール添加飼料を与えた野生型(WT)及びIRP2−/−マウスのぶら下がり試験結果のグラフである。
【図2】図2a及び2bは、マウス胎児線維芽細胞におけるIRP1の鉄応答性エレメント(IRE)結合活性ならびにTfR1、L−フェリチン(L−Ft)、IRP1、及びチューブリンのタンパク質レベルを示すゲルである。
【図2c】図2cは、ゲルのバンドの相対的な強度による結果のいくつかを表す。
【図3a】図3aは、コントロール(Ctrl)又はテンポール(Tem)飼料を与えたIRP2−/−動物の小脳、前脳及び脳幹領域におけるIRP1のIRE結合活性及びTfR1、IRP1およびアクチンタンパク質レベルを示すゲルである。
【図3b】図3bは、ゲルのバンドの相対的な強度による結果のいくつかを表す。
【図4】図4aは、コントロール又はテンポール飼料を与えた野生型及びIRP2−/−マウス由来の小脳溶解物のフェリチン及びアクチンタンパク質レベルを示すゲルである。図4bは、ゲルのバンドの相対的な強度による結果のいくつかを表す。
【図4c】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図4d】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図4e】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図4f】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図5a】図5aは、野生型、IRP2−/−及びIRP1−/−マウス由来のマウス胎児線維芽細胞溶解物における細胞質及びミトコンドリアのアコニターゼ活性を示すゲルを表す。
【図5b】図5bは、テンポール又は鉄キレート剤(cheltor)デフェリプロン(deferiprone)(DFO)で処理後のマウス胎児線維芽細胞におけるIRP1レベル及びIRP2レベルを示すゲルを表す。
【図5c】図5cは、テンポール又はDFO処理後のマウス胎児線維芽細胞の細胞質及びミトコンドリアアコニターゼ活性、ならびにIRP1及びIRP2タンパク質レベルを示すゲルを表す。
【図6】図6a及び6bは、βメルカプトエタノールとともにインキュベートした処理サンプルを用いたIREゲルシフトアッセイにより精製ホロIRP1のIRE結合活性を示すゲルを表す。図6c及び6dは、結合溶液(coupled solution)アッセイにより時間の経過とともに測定したアコニターゼ活性のグラフである。
【図7】図7a及び7bは、赤芽球細胞及び前脳溶解物におけるIRP1、IRP2及びアクチンタンパク質レベルを示すゲルを表す。
【図7c】図7cは、コントロール又はテンポール添加飼料を与えた野生型、IRP2−/−及びIRP1+/− IRP2−/−マウスに対するぶら下がり試験の結果のグラフである。
【図7d】図7dは、テンポールがIRE結合活性を回復させるIRP1の鉄−硫黄クラスターを直接不安定化できるという機序案を示す。
【発明を実施するための形態】
【0010】
(本発明の詳細な説明)
安定なニトロキシドラジカルは、一般式R2NOを有する化合物を含有する。本発明を使用する哺乳動物にとって生理学的に許容可能なものであれば、いずれの安定なニトロキシドラジカルも本発明に使用可能である。全身的に投与される場合、選択されたニトロキシドラジカルは選ばれた哺乳動物の血液脳関門を通り抜けられることが望ましい。本発明の方法で使用される好ましい安定なニトロキシドラジカルは、テンポール又はそのヒドロキシルアミン類似体(テンポール−Hなど)を含む。テンポールはフリーラジカル捕捉剤であり、再利用できる抗酸化物質であり、動物飼料に添加することができ、血液脳関門を通り抜けて吸収される。安定なニトロキシドラジカルはフリーラジカルにとって良い捕捉剤であり、安定なニトロキシド電子は反応性ラジカル電子と安定な電子対を形成している。
【0011】
本発明で使用されるのに適した他の安定なニトロキシドラジカルは、当該分野で既知である。一般的に、本発明で有用な安定なニトロキシドラジカルは、一般式R2NOを有し、2つのR基が同一であっても異なっていても良い。概して、各R基は、H、ヒドロキシル、ハロゲン、CN、NO2、スルホンアミド、C1−C8アルキル、C3−C6シクロアルキル、C1−C6アルコキシ、C1−C6ハロアルコキシ、C1−C4ハロアルキル、C2−C8アルケニル、C2−C8アルキニル、アミノ、C1−C4ジアルキルアミノ、C1−C4アルキルアミノ、C1−C6シクロアルキルアミノ、モルホリン、ヘテロアリール(チエニル、ピリジル及びピリミジニルに限定しないことを含む)、アリールアミノ、アリールアルキルアミノ、フェニル、C(O)R’、NR’(COR’’)、NR’SO2R’’及びNR’(CONR’’R’’’)からなる群より独立に選択される。ここで、R’、R’’及びR’’’は独立してH、C1−C6アルキル、フェニル又は置換されたフェニルであり、また、C1−C8アルキルはC1−C4アルコキシ、C1−C4ハロアルキル、C1−C6ジアルキルアミノ、C1−C6アルキルアミノ、シクロアルキルアミノ、及びモルホリンからなる群から選択された1つ以上で任意に置換されており、フェニルはハロゲン、NO2、CN、C1−C4アルキル、C1−C4ハロアルキル、及びC1−C4アルコキシからなる群から選択された1つ以上で任意に置換されており、またはR3及びR4は、それらが結合する炭素と一緒になって環を形成する。
【0012】
本明細書では特に断りのない限り、用語「アルキル」は表示された数の炭素原子(例えば、C1−C20、C1−C10、C1−C4など)を有する飽和直鎖又は分岐非環状炭化水素を意味する。代表的な飽和直鎖アルキルは、−メチル、−エチル、−n−プロピル、−n−ブチル、−n−ペンチル、−n−ヘキシル、−n−ヘプチル、−n−オクチル、−n−ノニル及び−n−デシルを含有し、代表的な飽和分岐アルキルは−イソプロピル、−sec−ブチル、−イソブチル、−tert−ブチル、−イソペンチル、2−メチルブチル、3−メチルブチル、2−メチルペンチル、3−メチルペンチル、4−メチルペンチル、2−メチルヘキシル、3−メチルヘキシル、4−メチルヘキシル、5−メチルヘキシル、2,3−ジメチルブチル、2,3−ジメチルペンチル、2,4−ジメチルペンチル、2,3−ジメチルヘキシル、2,4−ジメチルヘキシル、2,5−ジメチルヘキシル、2,2−ジメチルペンチル、2,2−ジメチルヘキシル、3,3−ジメチルペンチル(dimtheylpentyl)、3,3−ジメチルヘキシル、4,4−ジメチルヘキシル、2−エチルペンチル、3−エチルペンチル、2−エチルヘキシル、3−エチルヘキシル、4−エチルヘキシル、2−メチル−2−エチルペンチル、2−メチル−3−エチルペンチル、2−メチル−4−エチルペンチル、2−メチル−2−エチルヘキシル、2−メチル−3−エチルヘキシル、2−メチル−4−エチルヘキシル、2,2−ジエチルペンチル、3,3−ジエチルヘキシル、2,2−ジエチルヘキシル、3,3−ジエチルヘキシルなどを含有する。アルキル基は非置換であっても置換されていても良い。
【0013】
本明細書では特に断りのない限り、用語「シクロアルキル」は炭素及び水素原子を含み、かつ、炭素−炭素多重結合を持たない単環又は多環飽和環を意味する。シクロアルキル基は、例えばシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチル、並びに飽和環状及び飽和二環式テルペンが挙げられるが、これらに限定されない。シクロアルキル基は非置換であっても置換されていても良い。好ましくは、シクロアルキル基は単環式環又は二環式環である。
【0014】
本明細書では特に断りのない限り、用語「アルケニル基」は表示された数の炭素原子(例えば、C2−C20、C2−C10、C2−C4など)を有する直鎖又は分岐非環状炭化水素を意味する。代表的な直鎖及び分岐アルケニルは、−ビニル、−アリル、−1−ブテニル、−2−ブテニル、−イソブチレニル、−1−ペンテニル、−2−ペンテニル、−3−メチル−1−ブテニル、−2−メチル−2−ブテニル、−2,3−ジメチル−2−ブテニル、−1−ヘキセニル、−2−ヘキセニル、−3−ヘキセニル、−1−ヘプテニル、−2−ヘプテニル、−3−ヘプテニル、−1−オクテニル、−2−オクテニル、−3−オクテニル、−1−ノネニル、−2−ノネニル、−3−ノネニル、−1−デセニル、−2−デセニル、−3−デセニルなどが挙げられる。アルケニル基の二重結合は他の不飽和基と非共役であっても共役であっても良い。アルケニル基は非置換であっても置換されていても良い。
【0015】
本明細書では特に断りのない限り、用語「アルキニル基」は表示された数の炭素原子(例えば、C2−C20、C2−C10、C2−C6など)を有し、少なくとも1つの炭素−炭素三重結合を含有する直鎖または分岐非環状炭化水素を意味する。代表的な直鎖及び分岐アルキニルは−アセチレニル、−プロピニル、−1−ブチニル、−2−ブチニル、−1−ペンチニル、−2−ペンチニル、−3−メチル−1−ブチニル、−4−ペンチニル、−1−ヘキシニル、−2−ヘキシニル、−5−ヘキシニル、−1−へプチニル、−2−へプチニル、−6−へプチニル、−1−オクチニル、−2−オクチニル、−7−オクチニル、−1−ノニニル、−2−ノニニル、−8−ノニニル、−1−デシニル、−2−デシニル、−9−デシニルなどが挙げられる。アルキニル基の三重結合は他の不飽和基と非共役であっても共役であっても良い。アルキニル基は非置換であっても置換されていても良い。
【0016】
本明細書では特に断りのない限り、用語「ハロゲン」又は「ハロ」はフッ素、塩素、臭素、又はヨウ素を意味する。更に、特に断りのない限り、用語「ハロアルキル」は1つ以上のハロゲンで置換されたアルキルを意味し、アルキル及びハロゲンは前記で定義した通りである。
【0017】
本明細書では特に断りのない限り、用語「アルコキシ」は−O−(アルキル)を意味し、ここで、アルキルは前記で定義した通りである。更に、本明細書では用語「ハロアルコキシ」は1つ以上のハロゲンで置換されたアルコキシを意味し、アルコキシ及びハロゲンは前記で定義した通りである。
【0018】
本明細書では特に断りのない限り、用語「ヘテロアリール」は窒素、酸素又は硫黄から独立に選択された少なくとも1つのヘテロ原子、好ましくは1〜3つのヘテロ原子を含む5〜14の環原子を含む炭素環芳香族環を意味する。ヘテロアリール環構造は、単環、二環又は三環化合物などの1つ以上の環構造ならびに縮合ヘテロ環部分を有する化合物を含む。代表的なヘテロアリールは、トリアゾリル、テトラゾリル、オキサジアゾリル、ピリジル、フラニル、ベンゾフラニル、チオフェニル、チアゾリル、ベンゾチオフェニル、ベンゾイソオキサゾリル、ベンゾイソチアゾリル、キノリニル、ピロリル、インドリル、オキサゾリル、ベンゾオキサゾリル、イミダゾリル、ベンズイミダゾリル、チアゾリル、ベンゾチアゾリル、イソオキサゾリル、ピラゾリル、イソチアゾリル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、シンノリニル、フタラジニル、キナゾリニル、ベンゾキナゾリニル、アクリジニル、ピリミジル、オキサゾリル、ベンゾ[1,3]ジオキソール、及び2,3−ジヒドロ−ベンゾ[1,4]ジオキシンが挙げられる。ヘテロアリール基は非置換であっても置換されていても良い。
【0019】
本明細書では特に断りのない限り、用語「アルキルアミノ」は−NH(アルキル)又は−N(アルキル)(アルキル)を意味し、ここで、アルキルは前記で定義した通りである。本明細書では特に断りのない限り、用語「アミノアルキル」は−(アルキル)−NH2を意味し、ここで、アルキルは前記で定義した通りである。
【0020】
本明細書では特に断りのない限り、用語「置換された」とは、1〜4以上の置換基(アルキル、アルケニル、アルキニル、シクロアルキル、アロイル、ハロ、ハロアルキル(例えば、トリフルオロメチル)、ハロアルコキシ(例えば、トリフルオロメトキシ)、ヒドロキシ、アルコキシ、アルキルチオエーテル、シクロアルキルオキシ、ヘテロシクロオキシ(heterocylooxy)、オキソ、アルカノイル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、ヘテロシクロ、アリールオキシ、アルカノイルオキシ、アミノ、アルキルアミノ、アリールアミノ、アリールアルキルアミノ、シクロアルキルアミノ、ヘテロシクロアミノ、1又は2置換されたアミノ(アミノ基の2個の置換基はアルキル、アリール又はアリールアルキルから選択される)、アルカノイルアミノ、アロイルアミノ、アラルカノイルアミノ、置換されたアルカノイルアミノ、置換されたアリールアミノ、置換されたアラルカノイルアミノ、チオール、アルキルチオ、アリールチオ、アリールアルキルチオ、シクロアルキルチオ、ヘテロシクロチオ、アルキルチオノ、アリールチオノ、アリールアルキルチオノ、アルキルスルホニル、アリールスルホニル、アリールアルキルスルホニル、スルホンアミド(例えば、SO2NH2)、置換されたスルホンアミド、ニトロ、シアノ、カルボキシ、カルバミル(例えば、CONH2)、置換されたカルバミル(例えば、CONH−アルキル、CONH−アリール、CONH−アリールアルキルあるいはアルキル又はアリールアルキルから選択された2個の置換基が窒素上に存在する場合)、アルコキシカルボニル、アリール、置換されたアリール、グアニジノ、置換又は非置換のヘテロシクロアルキル、置換又は非置換のヘテロアリール(インドリル、イミダゾリル、フリル、チエニル、チアゾリル、ピロリジル、ピリジル、ピリミジルなど)など)で置換された基を意味する。
【0021】
構造中の原子数の範囲が示されているときはいつでも(例えば、C1−C8、C1−C6、C1−C4、又はC1−C3アルキル、ハロアルキル、アルキルアミノ、アルケニルなど)、示された範囲内のいずれの小領域又は各数の炭素原子も使用できることが明確に意図される。したがって、例えば、本明細書で引用されるいずれの化学基(例えば、アルキル、ハロアルキル、アルキルアミノ、アルケニルなど)に関しても使用されるように、1〜8個の炭素原子(例えば、C1−C8)、1〜6個の炭素原子(例えば、C1−C6)、1〜4個の炭素原子(例えば、C1−C4)、1〜3個の炭素原子(例えば、C1−C3)、又は2〜8個の炭素原子(例えば、C2−C8)の範囲の記載は、1、2、3、4、5、6、7又は8個の炭素原子、ならびに必要に応じてその小領域を包含し、具体的に記載する(例えば、必要に応じて、1〜2個の炭素原子、1〜3個の炭素原子、1〜4個の炭素原子、1〜5個の炭素原子、1〜6個の炭素原子、1〜7個の炭素原子、1〜8個の炭素原子、2〜3個の炭素原子、2〜4個の炭素原子、2〜5個の炭素原子、2〜6個の炭素原子、2〜7個の炭素原子、2〜8個の炭素原子、3〜4個の炭素原子、3〜5個の炭素原子、3〜6個の炭素原子、3〜7個の炭素原子、3〜8個の炭素原子、4〜5個の炭素原子、4〜6個の炭素原子、4〜7個の炭素原子、4〜8個の炭素原子、5〜6個の炭素原子、5〜7個の炭素原子、5〜8個の炭素原子、6〜7個の炭素原子、又は6〜8個の炭素原子)。
【0022】
特定の理論に拘束されることなく、安定なニトロキシドラジカルを哺乳動物に投与すると、もし投与されなければmRNAに結合してTfR1及びフェリチンの発現を制御できる部位から抑制性鉄−硫黄クラスターを取り除くことによりIRP1の活性が高まると考えられる。かかる制御により、鉄吸収を増加させ、利用できないタンパク質中への鉄の封鎖を減少させることができる。したがって、安定なニトロキシドは、IRP1がIRP2欠乏を補うことを可能にすると考えられる。それゆえ、本発明の方法は鉄調節タンパク質2(IRP2)機能を欠損した哺乳動物に対して投与するのに特に有用であり、そのためIRP2欠乏に関連するいずれの疾患の治療にも特に有用であると考えられる。同様に、TfR1発現をアップレギュレートする能力のおかげで、直接的又は間接的に、本発明の方法はTfR1低発現の哺乳動物への投与に有用であり、それゆえTfR1低発現に関連するいかなる疾患の治療にも有用であると考えられる。本発明の範囲において低発現とは、特に限定しないが、減少したタンパク質レベル、その他の正常なタンパク質機能の阻害要因の存在、又はその機能に影響するタンパク質の変異を含むいずれの理由であってもタンパク質の活性が減少することを包含することを意図する。
【0023】
したがって、本発明は、哺乳動物の中枢神経系で生物学的に利用可能な鉄の量を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、CNSの鉄が欠乏している哺乳動物の中枢神経系(CNS)において生物学的に利用可能な鉄の量を増加させる方法を提供する。「生物学的に利用可能な鉄の量を増加させる」とは、安定なニトロキシドラジカルの投与前(または投与なし)の哺乳動物における生物学的に利用可能な鉄の量と比較した場合に、安定なニトロキシドラジカルの投与後の哺乳動物における生物学的に利用可能な鉄を増加させることを意味する。好ましくは、生物学的に利用可能な鉄の量は、約10%以上、15%以上、20%以上、25%以上、50%以上、又は100%以上増加する。「生物学的に利用可能な」とは、哺乳動物の細胞で有用であること又は利用できることを意味する。生物学的に利用可能な鉄の量を測定し、比較する方法は、当該分野で既知である。
【0024】
本発明はさらに、哺乳動物においてIRP1を活性化するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物において鉄調節タンパク質1(IRP1)を活性化する方法を提供する。安定なニトロキシドラジカルの投与前(又は投与なし)の哺乳動物、又は哺乳動物から得られた生物学的サンプルにおけるIRP1の活性よりも、安定なニトロキシドラジカルの投与後に哺乳動物、又は哺乳動物から単離された生物学的サンプルの活性が増加する場合、IRP1は活性化される。好ましくは、IRP1活性は少なくとも約10%以上、15%以上、20%以上、25%以上、50%以上、100%以上、又は500%以上までも増加する。IRP1の活性を測定し、比較する方法は当該分野で既知である。
【0025】
本発明はさらに、TfR1発現を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてトランスフェリン受容体1(TfR1)発現を増加させる方法を提供する。TfR1発現の増加は、安定なニトロキシドラジカルの投与前(又はニトロキシドラジカルなし)の哺乳動物又は哺乳動物由来の生物学的サンプルでのTfR1発現と比較した場合の、安定なニトロキシドラジカル投与後の哺乳動物又は哺乳動物由来の生物学的サンプルにおけるTfR1発現のいかなる増加でもあり得る。TfR1発現の増加は、例えばTfR1量の増加なしに、存在するTfR1の相対量が増加すること、またはTfR1の生物学的活性が増加することを含むことができる。好ましくは、TfR1発現が約10%以上、15%以上、20%以上、25%以上、50%以上、100%以上、又は500%以上までも増加する。TfR1の発現を測定し、比較する方法は、当該分野で既知である。
【0026】
本発明の方法は、生物学的に利用可能な鉄の異常なレベル(例えば、正常より低い)、異常なIRP1又はIRP2の活性レベル(例えば、正常より低い)、又はTfR1発現の異常なレベル(例えば、正常より低い)に関連する疾患の研究、診断、予防、治療のためにいかなる目的でも使用することができる。かかる状態は神経変性に関連し得る。したがって、前記のいずれの方法も神経変性疾患の研究、診断、予防又は治療と組み合わせて使用することができる。
【0027】
それゆえ本発明は、別の側面では、神経変性を治療又は予防するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、神経変性疾患に罹患した哺乳動物における神経変性を治療又は予防する方法を提供する。哺乳動物における神経変性の治療又は予防は、神経変性の1つ以上の症状を治療又は予防することを含む。かかる症状は当該分野で既知であり、そのうちのいくつかを実施例で示す。
【0028】
本発明のいずれの方法も、特に神経変性疾患又は異常な鉄代謝(例えば、CNSでの第二鉄の異常蓄積)、IRP機能の欠損(例えば、IRP2変異又は欠失)、又はTfR1低発現に特徴づけられた神経変性疾患又は神経変性状態に罹患した哺乳動物に組み合わせて使用することができる。IRP2が欠乏したヒトは、部分的又は完全に、軽度の小球性貧血、血清フェリチンの上昇、又は赤血球中のプロトポルフィリンIX量の上昇に関連し得る成人発症神経変性疾患を有することが予想される。例としては、かかる疾患又は状態は、パーキンソン病、アルツハイマー病、ハラーフォルデンシュパッツ症候群、無セルロプラスミン血症、難治性貧血、フリードライヒ失調症、骨髄性プロトポルフィリア、又は成人発症神経変性を含み得る。もちろん、本発明の方法は、神経変性の兆候を示していないがIRP機能の欠損又はTfR1低発現を有する哺乳動物と組み合わせて使用することもできる。本発明の方法のかかる適用は、例えば、IRP機能、TfR1発現、及び/又は鉄代謝を回復させること、ならびにおそらく神経変性の開始を予防又は遅延させるのに有用であるだろう。
【0029】
さらに、本発明の方法はいずれも、哺乳動物に鉄サプリメント又は効果的に鉄高含有食を投与する工程と組み合わせて行うことができる。テンポールなどの安定なニトロキシドラジカルの投与により得られる利益をさらに議論するために、IRP2が欠乏した哺乳動物において、機能的鉄の欠乏は、当業者には既知の適切な鉄化合物で補給することができる。かかる鉄高含有食又は他の鉄サプリメントは、安定なニトロキシドラジカル投与に関して以下で議論等されたいずれの適切な方法でも投与することができる。
【0030】
安定なニトロキシドラジカルは、いずれの適切な方法によっても投与できる。例えば、安定なニトロキシドラジカルは、経口投与、エアロゾル投与、非経口投与、皮下投与、静脈内投与、筋肉内投与、腹腔内投与、または動脈内投与により投与することができる。本発明の方法と組み合わせて使用するテンポールの適切な剤形は、当該分野で既知である。
【0031】
ニトロキシドラジカルは、化合物と担体(特に薬学的に許容可能な担体)を含む医薬組成物などの組成物として製剤することができる。医薬組成物は、2つ以上の異なるニトロキシドラジカルを含むことができる。その代わりに、又はそれに追加して、医薬組成物は、他の薬学的に活性な剤や薬と併用させて1つ以上のニトロキシラジカルを含むことができる。その薬は、それと関連した前記疾患又は症状のいずれかを治療又は予防するのに有用であることが知られているものを含む(例えば、レボドパ、カルビドパ、ドーパミン作動薬(パーロデル、ペルマックス、リキップ、ミラペックス、シンメトレル)、抗コリン薬(アーテン、コゲンチン)、エルデプリル、COMT阻害剤(タスマール、コムタン)、非ステロイド系抗炎症薬(NSAID)、GSK−3阻害剤など)。かかる他の薬もニトロキシドラジカルと同時投与又は逐次投与して使用することができる。
【0032】
組成物はさらに担体を含む。該担体は、いずれの適切な担体でもあり得る。好ましくは、該担体は薬学的に許容可能な担体である。医薬組成物に関しては、該担体は慣用されているものであればいずれでも使用できるし、生理化学的検討(溶解性や活性な化合物(単数又は複数)との反応性を欠くなど)によって及び投与経路によってのみ限定される。後述の医薬組成物に加えて、本発明の方法の化合物と阻害剤とを包接錯体(シクロデキストリン包接錯体など)又はリポソームとして製剤することができることは当業者なら認識できるだろう。
【0033】
本明細書に記載の薬学的に許容可能な担体は、例えば、ビヒクル、アジュバント、賦形剤、および希釈剤であり、当業者に周知で公衆に容易に利用可能なものである。薬学的に許容可能な担体は、活性薬剤(単数又は複数)に対して化学的に不活性のものであり、有害な副作用又は使用状態下で毒性がないものであることが好ましい。
【0034】
担体の選択は、特定のニトロキシドラジカル及び使用された他の活性薬剤又は薬によって、ならびに化合物及び/又は阻害剤を投与するのに使用した特定の方法によってある程度決定されるだろう。したがって、本発明の方法の医薬組成物の適切な製剤は様々である。経口、エアロゾル、非経口、皮下、静脈内、筋肉内、腹腔内、直腸内及び膣内投与用の下記製剤は、例示であって限定ではない。ニトロキシドラジカルのこれらの投与経路が知られていることは当業者であれば理解しているし、また、特定の化合物を投与するために1以上の経路が使用され得るが、特定の経路が、他の経路よりもより早くより効果的な応答を提供し得る。
【0035】
本発明に係る有用な製剤の中に注射製剤がある。注射組成物用の効果的な薬学的担体が必要であることは、当業者に周知である(例えば、Pharmaceutics and Pharmacy Practice,J.B.Lippincott Company,Philadelphia,PA,Banker and Chalmers,eds.,238 250頁(1982)、及びASHP Handbook on Injectable Drugs,Toissel,4th ed.,622 630頁(1986)参照)。
【0036】
局所的な製剤は、当業者に周知である。かかる剤形は本発明の範囲において皮膚への適用に特に適している。
【0037】
経口投与に適した製剤は、(a)水、生理食塩水、オレンジジュースなどの希釈剤で溶解された有効量の阻害剤などの液体溶液;(b)カプセル、小袋、錠剤、ロゼンジ及びトローチ(それぞれ固体又は顆粒として事前に決定された量の活性成分を含む);(c)粉体;(d)適当な液体中の懸濁液;及び(e)適切な乳剤からなり得る。液体製剤は、薬学的に許容可能な界面活性剤の添加又は無添加の、水やアルコール(例えば、エタノール、ベンジルアルコール、及びポリエチレンアルコール)などの希釈剤を含んでいてもよい。カプセル製剤は通常の硬い又は軟らかいシェルをもつゼラチンタイプであることができ、例えば、界面活性剤、滑沢剤及び不活性充填剤(乳糖、蔗糖、リン酸カルシウム及びコーンスターチなど)を含む。錠剤製剤は、乳糖、蔗糖、マンニトール、コーンスターチ、ジャガイモデンプン、アルギン酸、結晶セルロース、アラビアゴム、ゼラチン、グアーガム、コロイド状二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリン酸、及びその他の賦形剤、着色料、希釈剤、緩衝剤、崩壊剤、湿潤剤、保存料、着香料、ならびに薬学的に適合する賦形剤から1つ以上を含有させることができる。ロゼンジ製剤は、香味料、通常蔗糖及びアラビアゴム又はトラガカント中に活性成分を含有させることができ、またトローチは活性成分に加えて、当該分野で既知の賦形剤を含む不活性基剤(ゼラチン及びグリセリン又はスクロース及びアラビアゴムなど)、乳剤、ゲル等中に活性成分を含有させることができる。
【0038】
医薬組成物は、吸入により投与するためにエアロゾル製剤にすることができる。これらのエアロゾル製剤は、ジクロロジフルオロメタン、プロパン、窒素などの加圧された許容可能な高圧ガス中に置くことができる。エアロゾル製剤は、非加圧調合のための医薬としても、ネブライザー又はアトマイザー中などで製剤され得る。かかるスプレー製剤はまた、粘膜に噴霧するために使用され得る。
【0039】
非経口投与に適切な製剤は、抗酸化剤、緩衝液、静菌剤、及び対象のレシピエントの血液と等張の製剤にする溶質を含有することができる水性及び非水性の等張滅菌注射液、ならびに懸濁化剤、可溶化剤、増粘剤、安定化剤及び保存料を含むことができる水性及び非水性滅菌懸濁剤を含む。ニトロキシドラジカルは滅菌液又は混合液(水、生理食塩水、水性デキストロース及び関連する糖溶液、アルコール(エタノール、イソプロパノール又はヘキサデシルアルコールなど)、グリコール(プロピレングリコール又はポリエチレングリコールなど)、ジメチルスルホキシド、グリセロールケタール(2,2−ジメチル−1,3−ジオキソラン−4−メタノールなど)、エーテル(ポリ(エチレングリコール) 400、油、脂肪酸、脂肪酸エステル又はグリセリドなど)、又はアセチル化脂肪酸グリセリドを含む)などの薬学的担体における生理学的に許容可能な希釈剤中に入れて投与することができ、薬学的に許容可能な界面活性剤(石鹸又は合成界面活性剤など)、懸濁化剤(ペクチン、カルボマー、メチルセルロース、ヒドロキシプロピルメチルセルロース又はカルボキシメチルセルロースなど)、又は乳化剤及びその他の薬学的アジュバントは添加しても、しなくても良い。
【0040】
非経口製剤に使用できる油は、石油、動物油、植物油、又は合成油を含む。油の具体例としては、落花生油、大豆油、ゴマ油、綿実油、トウモロコシ油、オリーブ油、流動パラフィン、及び鉱油が挙げられる。非経口製剤に使用するのに適切な脂肪酸は、オレイン酸、ステアリン酸、及びイソステアリン酸を含む。適切な脂肪酸エステルの例としては、オレイン酸エチル及びミリスチン酸イソプロピルが挙げられる。
【0041】
非経口製剤で使用される適切な石鹸は、脂肪族アルカリ金属、アンモニウム、及びトリエタノールアミン塩を含む。そして、適切な合成界面活性剤は、(a)カチオン合成界面活性剤、例えば、ハロゲン化ジメチルジアルキルアンモニウム及びハロゲン化アルキルピリジニウムなど、(b)アニオン性合成界面活性剤、例えば、アルキル、アリール及びオレフィンスルホン酸塩、アルキル、オレフィン、エーテル及び硫酸モノグリセリド及びスルホサクシネートなど、(c)非イオン合成界面活性剤、例えば、脂肪族アミンオキシド、脂肪族アルカノイルアミド、及びポリオキシエチレンポリプロピレン共重合体、(d)両性合成界面活性剤、例えば、b−アミノプロピオン酸アルキル、及び2−アルキル−イミダゾリン第4級アンモニウム塩、ならびに(e)それらの混合物を含む。
【0042】
概して、非経口製剤は、約0.5%から約25%の重量の活性成分を溶液中に含むであろう。保存料及び緩衝液が使用され得る。注射部位の刺激を最小にする又は取り除くために、かかる組成物は約12から約17の親水性・親油性バランス(HLB)を有する1つ以上の非イオン界面活性剤を含み得る。かかる製剤における界面活性剤の量は、概して約5重量%から約15重量%の範囲であろう。適切な界面活性剤は、モノオレイン酸ソルビタンなどのポリエチレンソルビタン脂肪酸エステル及びエチレンオキシドと疎水性塩基との高分子量付加物を含み、プロピレングリコールで酸化プロピレンとを縮合することにより形成される。非経口製剤は、単位用量又は複数回用量で密封された容器(アンプルやバイアルなど)中に存在させることができ、使用直前に注射のために滅菌液体賦形剤(例えば、水)を添加することのみが要求されるフリーズドライ(凍結乾燥された)状態で保存することができる。即席の注射溶液及び懸濁液は、前記の滅菌粉末、顆粒、及び錠剤から調製することができる。
【0043】
加えて、医薬組成物は、乳化基剤又は水溶性基剤などの様々な基剤と混合して座薬にすることができる。膣投与に適切な製剤は、活性成分に加えて適当であることが当該分野で既知の担体を含むペッサリー、タンポン、クリーム、ゲル、ペースト、泡、又はスプレーの処方として提示することができる。
【0044】
当業者は、化合物の治療効果を増加させる多数の方法でニトロキシドラジカルが改良できることを容易に理解するだろう。例えば、ニトロキシドラジカルは標的部分に対するリンカーにより直接的又は間接的のどちらかで結合できるだろう。標的部分に対して化合物を結合させるプラクティスは当該分野で既知である。本明細書で使用される用語「標的部分」とは、標的部分が受容体が表面に発現している個々の細胞に化合物又は阻害剤を直接運搬できる、細胞表面の受容体を特異的に認識して結合するいずれの分子又は剤をもいう。標的部分は、抗体又はその断片、ペプチド、ホルモン、成長因子、サイトカイン、及び他のいかなる天然又は非天然に存在するリガンド(該リガンドは細胞表面に結合する)も含むが、これに限定されない。本明細書で使用される用語「リンカー」とは、標的部分に化合物を架橋させるいずれの剤も分子もいう。当業者は、いったん化合物に付着したらリンカー及び/又は標的部分はその機能を妨げないという条件で、化合物又は阻害剤の機能に必要でない化合物上の部位が、リンカー及び/又は標的部分に付着するのに理想的な部位であることを認識している。
【0045】
その代わりに、ニトロキシドラジカルが投与された体内で放出される方法が時間と体内の場所に応じてコントロールされるように、デポの剤形に変更することができる(例えば、米国特許第4,450,150号参照)。デポの剤形は、例えば、カプセル化又は多孔質材中に拡散しているニトロキシドラジカルとポリマーなどの多孔質材とを含む埋め込み可能な組成物にすることができる。その後、デポは体内の所望の部位に埋め込まれ、活性成分が多孔質材を通過して拡散することにより事前に決定された速度でインプラントから放出される。
【0046】
ニトロキシドラジカルは、くも膜下への送達を可能にするよう埋め込まれたポンプを介して有利に投与することができる場合もある。かかる送達方法は、投与された薬物が他の方法では血液脳関門を十分に通り抜けないとき、特にCNSへの薬物送達に有用である。
【0047】
本明細書で記載されたニトロキシドラジカルは、哺乳動物へのニトロキシドラジカル投与に関して前記したいずれの効果も達成するようにインビトロで細胞中に投与できる。本明細書において、用語「インビトロ」とは、細胞が生体器官内にないことを意味する。ニトロキシドラジカルはまた、インビボでも細胞に投与できる。本明細書で使用する場合、用語「インビボ」は細胞が生体器官の一部又は生体器官内にあることを意味する。さらに、ニトロキシドラジカルは、宿主にインビボ又はエキソビボで投与することができる。本明細書で使用される場合、用語「エキソビボ」は1つの細胞または細胞集団にインビトロで化合物を投与し、その後、細胞または細胞集団を宿主に投与することをいう。
【0048】
さらに、ニトロキシドラジカルは、それ単独で投与することもできるが、ニトロキシドラジカルの有効性を高める剤と一緒に投与することもできる。かかる剤には、例えば、医薬組成物に関して本明細書で記載したいかなる他の活性成分も含まれ、該剤はニトロキシドラジカルを含む組成物とは分離した組成物で投与することができる。
【0049】
ニトロキシドラジカルの量又は用量は、適切な期間中宿主に治療又は予防応答をもたらすのに十分な量であるべきである。適当な用量は、治療又は予防するべき疾患又は苦痛の性質及び深刻さ、ならびにその他の要因によるだろう。例えば、用量はまた、特定の化合物の投与に伴い得るいずれの副作用の存在、性質及び程度によっても決定することができる。最終的には、年齢、体重、全体的な健康、食べ物、性別、投与するべき阻害剤、投与経路、及び治療される状態の深刻さなどの多様な要因を考慮して、主治医が各患者を治療する用量を決定するだろう。典型的な用量は、例えば毎日0.1mg〜1gであり、例えば毎日5mg〜500mgであり得る。
【0050】
本発明の方法は、哺乳動物のいずれのタイプとも組み合わせて使用することができる。本明細書で議論された哺乳動物は、特に限定されないが、マウスなどのげっ歯目、ウサギなどのウサギ目(Logomorpha)が挙げられる。哺乳動物は、ネコ科(ネコ)及びイヌ科(イヌ)を含む食肉目由来であることが好ましい。哺乳動物は、ウシ及び豚を含む偶蹄目、またはウマを含む奇蹄目(Perssodactyla)由来であることがより好ましい。哺乳動物は、霊長目、Ceboid又はSimoid(サル)あるいは類人猿(Anthropoid)(ヒト又は類人猿(ape))であることが最も好ましい。特に好ましい哺乳動物はヒトである。さらに、子宮内で化合物を投与する場合には、哺乳動物はいずれの前の(forgoing)宿主(特に哺乳動物又はヒト)のいずれの胎児であることもできる。
【0051】
該方法は、いずれの目的(本明細書で議論された疾患又は状態のいずれか、他の疾患又は状態の研究、治療、又は予防を含むが、これに限定されない)にも使用することができる。
【0052】
以下の実施例は、さらに本発明を例証するが、当然本発明の範囲を限定する手段として考えられるべきでない。
【実施例】
【0053】
実験モデルの背景:以下の実施例において、IRP2−/−マウスが神経変性疾患モデルに使用される。IRP2−/−動物の神経変性は、例えば、成獣における、ぶら下がり試験(hang−test)、ロータロッド回転ドラム式トレッドミルテスト(rotarod rotating drum treadmill testing)、平均台(balance beams)、登棒テスト(climbing pole tests)、アレルロッド(allelerods)、足跡、減少した身づくろい行動及び歩行異常に関する動作によりマウスで測定されたように、進行性の運動能力喪失によって特徴付けられる。IRP2−/−動物の神経変性は動物の加齢とともにゆっくりと進行する。
【0054】
鉄調節タンパク質(IRP)が鉄代謝タンパク質をコードする転写産物中に見られる鉄応答性エレメント(IRE)として知られるRNAステムループと結合することによって、細胞性鉄ホメオスタシスを制御すると考えられる。例えば、フェリチンH又はLの転写産物の5’末端でIREと結合するIRPは、フェリチンの翻訳を抑制する。一方、TfR1の3’UTRにおいてIREと結合するIRP、及び金属トランスポーターDMT1の1つのアイソフォームは、mRNAを安定化する。フェリチンレベルはIRP2−/−動物のほとんどの組織で異常に高いが、TfR1レベルは異常に低い。
【0055】
IRP2を欠損するマウスは、低TfR1及び高フェリチン発現により生じる機能的細胞性鉄の減少に関連して小球性貧血及び神経変性が進行する。IRP1−/−動物は、鉄代謝を有意には誤って制御しない。1つには、IRP1が、哺乳動物組織において主に細胞質アコニターゼとして機能する鉄−硫黄タンパク質であり、IRP2活性がIRP1の構造と結合するIREの欠失を補償するために増加するためである。これまでのところ、細胞質アコニターゼの欠失に起因する表現型は同定されていない。
【0056】
特に、1つのIRP1アレル(IRP1−/+)も欠失したIRP2−/−動物は、貧血や神経変性の深刻さの増大につれてIRP標的転写産物のより大きな誤制御を示す。このことは、IRE結合活性を有するIRP1の小さな断片が細胞内の鉄代謝の制御に寄与することを示す。IRP1のIRE結合活性は鉄ホメオスタシスに重要であるという認識と一致して、IRP2に加えてIRP1の両アレルが欠損している動物(IRP1−/− IRP2−/−)が発生の胞胚期を越えて生存しない。
【0057】
IRP2−/−マウスでは、マウス脳白質の鉄の染色により観察することができる進行性神経変性疾患が進行する。高められたペルルスの(Perls’)DAB染色及びアミノ銅銀染色において、軸索の鉄は軸索の変性とともに局所的に集積しているのが観察できる。軸索炎症もまた、脊髄前根や頸髄などの部分でIRP2−/−マウスで広く見られる。神経細胞体の変性の初期兆候は、核質の暗色化、核膜の完全性の喪失、及び血漿膜のブレブ形成を含み、これはコントロールWTマウスに対して上丘試料の比較分析により観察することができる。ニューロンのサイズや形と一致する空胞が、脳の患部の至る所に見られる。多数の空胞がIRP2−/−マウスの黒質にあるのが見られる。軸索の変性は、少なくとも部分的には、機能的鉄の欠乏とミトコンドリア機能不全に導かれるTfR低発現と結びついて、フェリチンターンオーバー由来の鉄毒性に起因し、フェリチンによる鉄の封鎖に起因するように思われる。見かけの「鉄過負荷」における鉄の不均等分布は、機能的鉄の欠乏と関連付けできる。それによって、フェリチンは、他の鉄タンパク質を犠牲にして鉄を封鎖し、発生中の赤血球におけるTfR発現が欠損するのでIRP2−/−マウスは鉄欠乏性貧血になる。IRP2−/−マウスの鉄機能不全性貧血は、WTと比較してヘモクリットレベルが減少し、遊離プロトポルフィリンや亜鉛プロトポルフィリンレベルが上昇することが観察される。さらに、ペルルスの(Perls’)鉄染色で試験した場合、IRP2−/−動物の骨髄は、完全に鉄が欠損していると思われる。
【0058】
加えて、約97kDのウェスタンブロット像は、トランスフェリン(transferring)受容体レベルがIRP2−/−及び(amd)IRP1+/− IRP2−/−マウス由来の赤血球造血細胞において低下することを示すが、約36kD及び22kDの像で示されるフェリチンL及びHレベル(leves)は上昇する。約64kD及び51kDの像で示されるeALASの翻訳はWTコントロールと比較して増加する。eALASの過剰発現は、プロトポルフィリンIX合成の増加を導き、鉄欠乏はヘム形成を妨げると思われる。IRP2欠乏は赤芽球増殖性プロトポルフィリン症(erythropoietic protoporphryia)(EPP)を生じ得る。非ヘム脳内鉄含有量はIRP2−/−動物で減少しているのが観察された。例えば、WTマウスの約78.9+/−9μg/グラム 乾燥重量は、IRP2−/−マウスではP<0.01で約62.2+/−12になった。しかし、全量の非ヘム脳内鉄は同じか僅かに減るが、全第二鉄イオンはIRP2−/−脳で比較的増加し(4つの要因のうち約1つより多くで)、生物学的に利用可能な第一鉄がWTに対して比較的減少する(4つの要因のうち約1つより多くで)と思われる。
【0059】
TfRは脳内鉄摂取に重要であり、鉄−硫黄クラスターはミトコンドリア呼吸複合体に重要であると思われる。ミトコンドリアは軸索の維持を必要とする。軸索の完全性の喪失はIRP2−/−マウスで広く見られる。遺伝子型分析に基づくと、NF−κBはニューロンの活性に依存する転写の制御及び軸索の挙動における重要な遺伝子であると思われる。逆行性輸送により、NF−κBがニューロンの安定に関する標的遺伝子を転写的に活性化することができる。したがって、特定の理論に拘束されることなく、IRP2−/−マウスにおける神経変性の病因は、ミトコンドリア機能に欠陥を生じさせる鉄欠乏によるものであり、減少したATP産生は軸索の腫脹と軸索の輸送の減少を導き、ならびに、NF−κBが核に移動できないことはニューロンの維持と安定に重要な多数のタンパク質の発現を減少させると考えられる。テンポールなどの安定なニトロキシドラジカルを投与することにより、IRP2欠損患者にとって、神経変性を妨げる有用な治療が得られる。
【0060】
方法:
【0061】
マウス:IRP2−/−マウスはLaVaute et al.,Nature Genetics,27,209−214(2001)に記載の通り飼育し、遺伝子型を決定することにより生産し繁殖させた。本研究に使用したマウスは129S4/SvJae×C57Bl/6の雑種であるという背景を有する(各系統の詳細な比は不明である)。同一の遺伝子型で異なる飼料を与えたマウスにおける実験で、遺伝的背景の違いによる表現型の多様性を最小化するために同胞を使用した。異なる遺伝子型で異なる飼料を与えたマウスは、齢と性別が一致していた。すべてのプロトコルは米国国立小児保健発達研究所動物実験委員会に承認されており、米国立衛生研究所動物の人道的管理に関する指針を満たした。
【0062】
飼料:マウスは生後3〜4週で離乳した。離乳直後から、マウスはテンポール添加飼料またはコントロールの飼料で維持した。テンポール添加飼料では、粉末にしたテンポールを飼料に対して10mg/gの濃度で「コールドプレス」技術(Bio−Serv、フレンチタウン、NJ、USA)によりベーコン風味のマウス食に均一に混合した。テンポールなしのベーコン風味食をコントロール飼料として使用した。
【0063】
ぶら下がり試験:ぶら下がり試験では、マウスは金網を握らせ、その後、逆さにした。マウスが落下前(最大60秒まで)に逆さにした金網にぶら下がっていられた時間の長さを計測して記録した。
【0064】
組織及び溶解物の調製:動物は安楽死させ、組織は採取後すぐに液体窒素中で凍結し、アルゴン下−80℃で保存した。実験は、嫌気性チャンバー中、液体窒素で冷却した乳鉢で粉砕した組織で行い、周期的な凍結融解及びアルゴンを用いた空気除去により脱気した溶解バッファーで溶解した。核及び残渣を遠心分離により除去した。IRP1活性アッセイ、ウェスタンブロッティング、カルボニルアッセイ及びタンパク質分析のための溶解物の調製は、嫌気的に行われた。
【0065】
細胞:13日齢胚の胎児線維芽細胞はLaVaute et al.supraに記載の通り、野生型、IRP1−/−マウス及びIRP2−/−マウスから単離した。IRP2発現が誘導され得るMycタグされたHEK293Tet−on細胞株は、Bourdon et al.,Blood Cells Mol Dis,31,247−255(2003)に記載の通り、調製され培養された。赤芽球はCooperman et al.,Blood,106,1084−1091(2005)に記載の通り、骨髄から採取し、精製した。
【0066】
RNA移動度シフトアッセイ:ゲル遅延度アッセイをMeyron−Holtz et al.,EMBO J,23,386−395(2004)に記載の通り行った。組織溶解物は、10mM HEPES(pH7.2)、3mM MgCl2、40mM KCl、5%グリセロール、0.2% Nonidet P−40、5mM DTT、1mM AEBSF、10μg/mlロイペプチン及びcompleteTM EDTAフリープロテアーゼ阻害剤カクテル(ロシュ アプライド サイエンス社、インディアナ)を含有する酸素除去溶解バッファーで前記の嫌気性チャンバー中で調製した。全タンパク質10μgを含有する溶解物(xμl)を25mM Tris−HCl(pH7.5)及び40mM KClを含有するバンドシフトバッファー(12.5−x)μlに添加した。サンプルは、20%グリセロール、0.2U/μl Super RNAsine(アンビオン社、テキサス)、0.6μg/μl酵母t−RNA、5mM DTT及び25mM Tris−HCl(pH7.5)及び40mM KCl中20nM ヒトフェリチンH鎖遺伝子由来の32PでラベルしたIREを含有する反応カクテル12.5μlとともに室温(RT)で5分間インキュベートした。本反応混合物20μlの測定は、10%アクリルアミド/TBEゲルにロードし(200V、2.15時間で電気泳動し)、その後、ゲルを固定、乾燥し、オートラジオグラフィーに供した。
【0067】
ウェスタンブロッティング及び抗体:タンパク質分析はLaVaute et al.,supraに記載の通り行った。等量のタンパク質(20〜40μg/レーン)を13% SDS PAGEで分離し、ニトロセルロースメンブレンに転写した。メンブレンを5%無脂肪ミルク、PBS中0.1% Triton X−100で固定し、同一のブロッキングバッファー中、室温(RT)でプローブ標識した。IRP1抗体は精製したhIRP1に対して調製し、1:5000に希釈して使用した。L−フェリチン抗体はマウス肝臓から精製したL−フェリチンタンパク質からウサギで産生した。ザイメッド社のマウスモノクローナルTfR抗体は、1:2000に希釈して使用した。シグマ社のモノクローナル抗αチューブリン抗体及び抗βアクチン抗体は、1:5000に希釈して使用した。ウェスタンブロットは、GEヘルスケア社の二次ペルオキシダーゼconjugateヤギ抗ウサギIgG抗体またはヒツジ抗マウスIgG抗体をそれぞれ1:5000及び1:2000に希釈して処理した。ウェスタンブロットは、高感度化学発光法(ECLキット、ピアス社、イリノイ)を使用して現像した。
【0068】
アコニターゼアッセイ:ヒト溶解物に対するアコニターゼ活性ゲルはTong et al.,infraに記載の通り行い、マウス溶解物に対するアコニターゼ活性ゲルは以下の変更をして行った。ゲルは、6%アクリルアミド、132mMトリス塩基、66mMホウ酸塩、3.6mMクエン酸塩を含む分離ゲル及び4%アクリルアミド、66mMトリス塩基、33mMホウ酸塩、3.6mMクエン酸塩を含むスタッキングゲルから作成された。ランニングバッファーは、25mMトリスpH8.3、96mMグリシン、及び3.6mMクエン酸塩を含む。電気泳動は、170V、4℃で行った。スペクトルアコニターゼ活性は、基質としてシス−アコニターゼを使用してFillebeen et al.,infraの方法に従って測定した。
【0069】
免疫組織化学:パラフィン包埋組織切片を、脱ろう、補水後に10mMクエン酸バッファーpH6.4中で抗原回復のために15分間電子レンジ(micro oven)で煮沸した。切片は30分間ブロッキングバッファー(トリス緩衝食塩水pH7.4、5%正常ヤギ血清、0.1% Tween−20)でブロックし、その後、室温で2時間ポリクローナルウサギ抗フェリチン抗体とともにインキュベートした。タンパク質−抗体複合体はCY3−ロバ抗ウサギ抗体(ジャクソンイムノリサーチラボラトリーズ、ウェストグローブ、PA)で標識した。核は対比染色としてDAPIで標識した。スライドを観察し、写真をニコンEclipse E600蛍光顕微鏡で記録した。
【0070】
ペルルスの(Perl’s)DAB鉄染色:脱ろう及び補水後、パラフィン包埋組織切片は、予熱した染色液(5%フェロシアン化カリウム15.0ml、5%塩酸15.0ml、電子レンジ(micro oven)で15秒間)で5分間染色した。切片は滅菌水、及びトリス緩衝食塩水pH7.4で洗浄し、その後、DAB染色液(20mg DAB、50μl 30% H2O2、20mlトリス緩衝食塩水pH7.4)で室温で30分間染色した。滅菌水で洗浄後、切片はCrystal Mountマウンティング液(シグマ社)でマウントし、観察し、ニコンEclipse E600蛍光顕微鏡で写真撮影した。
【0071】
統計:対応のあるスチューデントt検定(paired Student’s t−test)でぶら下がり時間の平均値間の違いを調べた。p<0.05の結果は、統計的に有意であると考えられた。
【0072】
(実施例1)
以下の実施例は、IRP2欠損マウスにおける神経変性を治療又は予防するためにテンポールを使用することを示す。
【0073】
安定なニトロキシドラジカル、テンポールを栄養補助食品としてノックアウトマウス(IRP2−/−)に投与し、「ぶら下がり試験」を用いて神経変性を調べた。該「ぶら下がり試験」では、マウスに逆さまにした位置で金網スクリーンを握らせ、スクリーンを握っていられる時間の長さを測定した(最大60秒まで)。ぶら下がり試験はマウスにおける神経変性の進行を定量的に評価する。Crawley et al.,Brain Res.835,18−26(1999)。
【0074】
金網を逆さまにした後に握り続けるIRP2−/−マウスの能力は、動物の加齢につれて次第に減少し、WTマウス(図1a参照)に比べてIRP2−/−マウスで有意に悪化する(p値=0.015)。テンポール添加飼料を与えたノックアウトマウスは、治療されていないノックアウトマウスに比べてぶら下がり時間の実質的な増加を示した。これは、テンポール添加飼料で維持されたIRP2−/−マウスが神経筋の能力を次第に失うことから有意に(p値=0.009)守られていることを示す(図1c)。テンポールを添加されたIRP2−/−マウスは、行動障害、震えまたは歩行や毛づくろい異常などの神経変性の他の兆候が進行しなかった。
【0075】
(実施例2)
以下の実施例は、安定なニトロキシドラジカルが、鉄代謝遺伝子の活性及び/又は発現のポジティブな効果を介して治療的有用性を提供することを示す。
【0076】
テンポールなどのニトロキシドラジカルは、酸化ストレスを軽減する治療的有用性を提供するフリーラジカル捕捉剤として機能すると一般的に考えられている。しかしながら、IRP2−/−動物における脂質酸化、DNA酸化(8−ヒドロキシグアニンアッセイ)及びタンパク質酸化アッセイを含む酸化ストレスに対する複数のアッセイは、酸化ストレスが疾患の進行に重大な役割を有することは示さなかった(本明細書ではデータを示さない)。
【0077】
IRP1のIRE結合活性に対するテンポールの効果を調査するため、IRP2−/−胎児線維芽細胞に、0、0.3及び1.0mMテンポールを添加し、クエン酸第二鉄アンモニウム(FAC)を添加した培地又は無添加の培地で16時間維持した。図2a及び2bのウェスタンブロットは、IRP1のIRE結合活性ならびにTfR1、L−Ft、IRP1及びチューブリンのタンパク質レベルを示す。全てのIRE結合活性は、IRP1活性化に起因した。その結果は、テンポール処理細胞においてTfR1レベルが増加し、フェリチンレベルが減少する一方で、IRP1レベル及びチューブリンレベル(ロードしたコントロール)は変化しないことを示す。図2cは、異なった濃度のテンポール(FAC添加なし)でのIRP1、TfR1及びL−フェリチン(L−Ft)タンパク質レベルのIRE結合活性を、ここで100%と表わされるコントロールレーンと比較した強度として示す。定量化はIQMac(IRP1活性)又はNIHイメージ(タンパク質レベル)プログラムで行った。エラーバーは、2つの異なるセットの実験から計算された標準偏差を示す。
【0078】
総合すれば、これらの結果は、ニトロキシラジカル処理がIRP1の潜在的なIRE結合活性を活性化し、かくしてTfR1及びフェリチンの誤制御を覆すことにより、細胞にIRP2の喪失を補償することを可能にする。したがって、テンポール及び同様の安定なニトロキシドラジカルは有意なフリーラジカルストレス又は鉄減少を生じないメカニズムによってIRP1を活性化するので、魅力的な神経保護療法である。
【0079】
(実施例3)
以下の実施例は、インビボでのIRE結合活性に対するニトロキシドラジカルの効果を示す。
【0080】
コントロール飼料またはテンポール添加飼料で維持したIRP2−/−マウスの様々な脳領域から作製された溶解物は、ゲルシフトアッセイ及びウェスタンブロットによりIRP1のIRE結合活性、ならびにTfR1、IRP1及びアクチンタンパク質レベルについて分析された。結果は図3aに示す。図3bは、ここで100%と表されたコントロールと比較したバンドの強度としての結果を定量化したものである。定量化はIQMac(IRP1活性)又はNIHイメージ(タンパク質レベル)プログラムで行った。エラーバーは、2つの異なるセットの動物から計算された標準偏差を示す。
【0081】
小脳、脳幹及び前脳由来の溶解物において、IRE結合活性及びTfR1タンパク質レベルがコントロールマウスと比較してテンポール補給マウスで顕著に増加した。IRP1及びアクチンタンパク質レベルは、テンポール処理結果としてはこれらの脳領域で有意な変化を生じなかった。これらの結果は、テンポールがインビボでIRP1のIRE結合活性に対するポジティブな効果を与えることを裏付ける。
【0082】
(実施例4)
以下の実施例は、脳白質におけるニトロキシドラジカル処理がフェリチン発現及び第二鉄蓄積を減少させることを示す。
【0083】
コントロール飼料又はテンポール添加飼料で維持した野生型マウス及びIRP2−/−マウス由来の小脳溶解物を、フェリチン発現又はアクチン発現について分析した。図4aは、ウェスタンブロット分析結果を示す。図4bでは、100%として表されるコントロールと比較した相対的な強度の測定値としてフェリチンレベルを示す。定量化はNIHイメージプログラムで行った。エラーバーは、3つの異なるセットの動物の結果から計算された標準偏差を示す。結果が示すように、フェリチンレベルは野生型マウスと比較してコントロール飼料のIRP2−/−マウスで上昇した。テンポールを用いた処理はIRP2−/−マウスでのフェリチンレベルを減少させた。これはテンポールにより誘導されたIRE結合活性の観察された増加と一致する。
【0084】
免疫組織化学研究は、マウス脳の海馬及び大脳皮質領域におけるフェリチン発現を分析することで行った。結果は図4c及び4dに示す。結果が示すように、フェリチン発現は野生型動物と比較してIRP2−/−動物(左下パネル)の海馬及び大脳皮質で顕著に増加した。フェリチン過剰発現はテンポール処理とともに減少した。
【0085】
コントロール飼料又はテンポール添加飼料で維持した野生型マウス及びIRP2−/−マウスの小脳葉及び線条体は、ペルルスの(Perls’)DAB染色を用いた第二鉄蓄積で分析した。結果を図4e及び4fに示す。図で示すように、第二鉄染色は野生型コントロールと比較してコントロール飼料のIRP2−/−動物の試験領域において増加した。これは、IRP2−/−動物のオリゴデンドロサイト及び小脳白質路における第二鉄の封鎖を示す。染色は、テンポール飼料のIRP2−/−動物で減少し、これは鉄の封鎖が減少したことを示す。
【0086】
これらの結果は、安定なニトロキシドラジカルが脳におけるフェリチン発現及び第二鉄蓄積を減少させられることを示す。
【0087】
(実施例5)
以下の実施例は、ニトロキシドラジカルがIRP1のIRE結合構造を生じさせるために細胞質(cytolic)アコニターゼの鉄−硫黄クラスターの分解を介してIRE結合活性を回復させることを示す。
【0088】
IRP1は、2つの形態の間で変化する二官能性タンパク質である:鉄が豊富な細胞において、IRP1はキュバン鉄−硫黄クラスター及び機能をクエン酸塩とイソクエン酸塩で相互転換する細胞質アコニターゼとして含む。一方、酸化還元−感受性鉄−硫黄クラスターを喪失する際に、IRP1はIREと結合できるように重要な形態変化をする。動物組織中で、ほとんどのIRP1は、主に活性化したアコニターゼとして無傷の鉄−硫黄クラスター及び機能を含む。
【0089】
ニトロキシドラジカルが鉄−硫黄クラスターの分解によりIRP1結合を活性化することを裏付けるために、我々はin−gelアコニターゼアッセイを行ってテンポールが細胞質アコニターゼの活性を減少させたかどうかを決定した。図5aはマウス胎児線維芽細胞(MEF)溶解物における細胞質アコニターゼ活性を示す。バンドは、細胞質アコニターゼがIRP1−/−細胞由来の溶解物中にないことが直ちに確認されたことを示す。特に、テンポール処理は、WT及びIRP2−/−胎児線維芽細胞由来の溶解物中の細胞質アコニターゼの活性を減少させる。一酸化窒素、O2・−及びアスコルビン酸塩などの小さな酸化還元分子が細胞質アコニターゼの鉄−硫黄クラスターと反応できること、それにより鉄−硫黄クラスターの喪失とIRP1のIRE結合構造への転化を導くことは、当該分野での他の所見と一致している。Tong et al.,Cell Metab 3,199−210(2006);Bouton et al.,Sci STKE 2003,pe 17(2003)。
【0090】
IRP1活性に対するテンポールの効果が鉄−硫黄クラスターの酸化分解と動力学的に一致するかどうかを決定するために、アコニターゼ活性に関するテンポールの効果をIRP1での鉄−硫黄クラスターの新規合成と修復を限定することによってIRP1のIRE結合活性を活性化する鉄キレート剤、デフェリプロン(DFO)の効果と比較した。野生型及びIRP2−/−マウス由来のマウス胎児線維芽細胞は、テンポール又は鉄−キレート剤デフェリプロン(DFO)で16時間処理し、その後、新鮮な無添加培地に取り換え、続いてゲルシフトアッセイ及びアコニターゼゲルアッセイにより様々な時間ポイントでアッセイした。アコニターゼ活性の回復は、野生型及びIRP2−/−細胞で評価した。結果は図5b及び5cに示す。
【0091】
テンポール及びDFOの両方の処理により、IRP1のIRE結合活性が活性化された。しかしながら、テンポールにより誘導されたIRE結合活性の活性化及び細胞質アコニターゼ活性の喪失は、テンポール除去2時間後まで容易に逆転したが、細胞質アコニターゼ活性の回復はDFO除去8時間後に活性を評価したときでさえもほとんど認識されなかった。DFOと比較してテンポール処理後の鉄−硫黄クラスター回復の速度における差異は、テンポールとDFOが異なる機序によりIRP1を活性化することを示した。結果は、IRP1の鉄−硫黄クラスターはテンポールによって分解されるが、クラスター不安定化試薬が除去されると直ちに再構築されることを示す。一方、DFO処理後の細胞質アコニターゼ活性の回復は、細胞内鉄の減少、及び減少した鉄−硫黄会合タンパク質の発現により制限された。加えて、処理は実質的にミトコンドリアアコニターゼ活性に影響を及ぼさず、それゆえに相対的に良性であった。
【0092】
(実施例6)
以下の実施例は、ニトロキシドラジカルがIRP1の鉄−硫黄クラスターに対して直接効果を与えることを示す。
【0093】
IRP1の鉄−硫黄クラスター状態に対するテンポールの効果が直接的化学的分解過程を表すかどうかを評価するため、テンポールで精製ホロIRP1(無傷の[4Fe−4S]クラスターを含む)を一酸化窒素によるIRP1の鉄−硫黄クラスターの分解を示すために当該分野で使用されてきた条件と同様の時間及び温度条件で処理した。Soum et al.,J Biol Inorg Chem,8,226−232(2003)。精製ホロIRP1(11ng)のIRE結合活性は、IREゲルシフトアッセイによって評価した。精製タンパク質(11ng)を1mMテンポールなし(レーン1)又はあり(レーン2)で室温で2時間0.1% β−メルカプトエタノールとともにインキュベートした。レーン3のサンプルはテンポールなしで2時間インキュベートした後、2% β−メルカプトエタノールで2分間処理した。結果は図6a及び6bに示す。アコニターゼ活性は、室温及び37℃で3時間コントロール及びテンポール処理されたサンプルにおいて、時間とともにアコニターゼ活性を同程度に喪失することを示す基質としてシスアコニターゼを使用し、Fillebeen et al.,Biochem J,388,143−150(2005)の方法に従った結合溶液(coupled solution)アッセイにより測定した。結果は図6d及び6eに示す。
【0094】
テンポール処理は、[4Fe−4S]クラスターの完全な崩壊と一致してIRP1のIRE結合活性を増加させる。IRE結合活性は2時間室温でテンポール処理したIRP1及び3時間37℃でテンポール処理したIRP1では、室内空気のみに暴露したIRP1と比較してはるかに高かった。図6bは、IRE結合活性は、3時間37℃で1.0mMテンポールによるホロIRP1の処理でほとんど完全に回復したことを示す。しかしながら、テンポールを精製タンパク質に添加することは、2時間まで又は3時間37℃で室内空気に暴露されて生じるアコニターゼ活性の喪失を促進しなかった。これらの結果は、精製タンパク質を使用したアッセイにおいてテンポールがクラスターの分解を促進することを示した。一方、酸素だけに暴露するとアコニターゼ活性を欠く識別可能な中間体の形成を促進するが、IRE結合を妨げるクラスターの残存物を保持する。
【0095】
精製タンパク質に関するこれらのアッセイは、テンポールが直接的及び十分にIRP1の鉄−硫黄クラスターを分解することを示し、直接IRP1の鉄−硫黄クラスターを不安定化することによってテンポールが細胞及び動物におけるIRP1のIRE結合活性を活性化するという結論を支持する。鉄−硫黄クラスターの部分的に分解された構造は細胞及び動物内では修復されるかもしれないが、精製タンパク質サンプルでは修復されないかもしれない。このことは、テンポール処理後のインビボ及びインビトロでのアコニターゼ活性測定結果を説明している。
【0096】
(実施例7)
以下の実施例は、ニトロキシドラジカルがIRP1結合活性の回復を通して治療効果に影響することを示す。
【0097】
赤芽球は、IRP1とIRP2との相対的な活性を評価するため及び赤芽球におけるIRP1の潜在的プールからIRP1がIRE結合構造に回復できたかどうかを決定するために野生型マウスから単離された。ゲルシフト研究により、IRP1及びIRP2が赤芽球でのIRE結合活性に同等に寄与することを示した(図7a)。しかしながら、IRP1レベルは脳と比べて赤芽球で顕著に減少した(図7b)。同様に、IRP1を細胞質アコニターゼ構造からIRE結合構造に変換する高濃度のβメルカプトエタノールで赤芽球を処理することは、赤芽球でのIRP1のさらなるIRE結合活性を活性化しない。対照的に、IRE結合活性の有意な増加を、βメルカプトエタノール処理を使用した脳溶解物から得た(図7a)。このことは、発生中の赤血球が、テンポール又は他の鉄−硫黄クラスター不安定化試薬で処理することによりIRE結合構造へと変換され得る細胞質アコニターゼ構造においてIRP1の有意な量を欠失していることを示す。
【0098】
これらの結果は、IRP2−/−動物の軽度の鉄欠乏貧血が主に赤芽球における減少したTfR1の発現及び減少した骨髄鉄蓄積に寄与するが、IRP2−/−マウスのテンポール処理がなぜ神経変性を予防するのに、IRP2−/−マウスの軽度の貧血を改善に導かないのかを説明する。IRP2−/−マウスの軽度の貧血(ヘマトクリット値はWTの52±2に対して46±5であった。p=0.022)は、テンポール処理動物では改善されず、テンポール飼料を与えた8ヵ月後46±4のままであった。赤芽球では非常に少しのIRE結合活性しか改善できないので、テンポールはIRP2−/−マウスの貧血を治さなかった。
【0099】
さらに、テンポールは神経変性からIRP2−/−動物を保護するが、IRP1+/− IRP2−/−マウスにおける疾患の進行を有意には(p=0.559)妨げなかった(図7c)。WT、IRP2−/−及びIRP1+/− IRP2−/−マウスのぶら下がり試験結果は、IRP1+/− IRP2−/−動物がIRP2−/−動物よりも症状を示した。しかしながら、テンポール処理は、神経変性症状の進行から有意に(p=0.559)十分にIRP1+/− IRP2−/−動物を保護しないことは明らかであった。エラーバーは、平均値の標準誤差を表す。曲線は、KaleidaGraphプログラムの多項式曲線適合を用いて描いた。図1に示したWT及びIRP2−/−マウスのぶら下がり試験曲線は、IRP1+/− IRP2−/−動物と比較してここで再度表示する。これらの結果は、1つのIRP1アレルの喪失はIRP1+/− IRP2−/−マウスにおけるIRP1量を顕著に減少させ、これによりIREへの結合を回復できるということを示唆している。
【0100】
総合すると、これらの結果は、テンポール処理による正常な鉄ホメオスタシスの回復がIRE結合構造へのIRP1の十分な量の変換によるものであるという結論をさらに支持する。
【0101】
本明細書中で引用した刊行物、特許出願、及び特許を含む全ての参考文献は、各参考文献が、本明細書中で参考として援用されることが個別におよび具体的に示され、かつその全体が記載されているのと同じ程度に、本明細書中で参考として援用される。本発明を記載する文脈において(特に、添付の特許請求の範囲の文脈において)、用語「a」及び「an」及び「the」及び同様の指示語の使用は、本明細書中で他に特に明記がない限り、又は文脈に明らかに矛盾しない限り、単数と複数の両方を包含するように解釈されるべきである。「含有する(comprising)」、「有する(having)」、「含む(including)」及び「含む(containing)」という用語は、他に特に明記がない限り、オープンエンドの用語(即ち、「〜を含むが、限定されない」ことを意味する)として解釈されるべきである。本明細書中での値の範囲の記載は、本明細書中で他に特に明記がない限り、その範囲内にある各々の別々の値を個々に言及する略記方法として働くことが単に意図され、そして各々の別々の値は、それが本明細書中で個々に列挙されているかのように本明細書中に含まれるものである。本明細書中に記載される全ての方法は、本明細書中で他に特に明記がない限り、または文脈に明らかに矛盾しない限り、任意の適切な順序で行われ得る。本明細書中で提供される任意及び全ての例、又は例示的な言葉(例えば、「などの」)の使用は、本発明をより良く明瞭にすることが単に意図され、そして他に特に主張されない限り、本発明の範囲を制限するものではない。本明細書中の如何なる言葉も、本発明の実施に必須なものとして主張されていない要素を示すと解釈されるべきではない。
【0102】
本発明の実施に関して、本発明者らが知っている最良の形態を含む、本発明の好適な実施態様を本明細書中に記載する。もちろん、それらの好適な実施態様のバリエーションは、上記の説明を読むと、当業者に明白となるであろう。本発明者らは、当業者が適宜このようなバリエーションを用いることを予想し、そして本発明者らは、本発明が本明細書中に具体的に記載されたものとは別の状態で実施されることを意図する。従って、本発明は、適用法によって許されるように、本明細書に添付の特許請求の範囲に列挙される主題の全ての改変物及び均等物を含む。さらに、その全ての可能なバリエーションにおける上記要素の任意の組合わせは、本明細書中で他に特に明記がない限り、又は文脈に明らかに矛盾しない限り、本発明に包含される。
【技術分野】
【0001】
(関連出願の相互参照)
本願は、援用により組み込まれた2007年3月9日に出願された米国仮特許出願60/894,134号の利益を主張する。
【背景技術】
【0002】
(発明の背景)
神経変性疾患は、世界中で何百万人もの人に影響を与えている。脳内の生物学的に利用可能な鉄量の欠乏が、神経変性をもたらすと考えられている。詳細には、鉄調節タンパク質、特にIRP1及びIRP2は神経変性疾患に罹患した患者に見られる損なわれた鉄ホメオスタシスに含まれると考えられている。IRP1及びIRP2は、転写産物内の鉄応答性エレメントに結合することによってフェリチン、トランスフェリン(transferring)受容体(TfR1)、及び他の遺伝子の発現を制御する。IRP2が不足する動物は、TfR1発現が減少することによって貧血及び成人発症進行性神経変性が進行し、発生中の赤血球系細胞及び中枢神経系(CNS)で機能的鉄の欠乏が生じる。IRP1が不足する動物は、IRP2がIRP1の減少を補償するので、鉄代謝のわずかな揺らぎがあるだけである。しかしながら、IRP2が不足する動物では、ほとんどの組織でフェライトレベルが増加し、TfRレベルが減少することにより、使用可能な鉄量の欠乏が生じる。
【発明の概要】
【発明が解決しようとする課題】
【0003】
したがって、神経変性の進行を遅らせ、治療し、又は予防するため、あるいは鉄代謝、IRP機能、又はTfR1発現における異常を治療又は予防するために使用できる化合物が希求されている。
【課題を解決するための手段】
【0004】
(本発明の簡単な要旨)
本発明は、神経変性を治療又は予防するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、神経変性疾患に罹患した哺乳動物における神経変性を治療又は予防する方法を提供する。
【0005】
本発明はまた、哺乳動物の中枢神経系において生物学的に利用可能な鉄の量を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、中枢神経系(CNS)の鉄が欠乏している哺乳動物のCNSにおいて生物学的に利用可能な鉄の量を増加させる方法を提供する。
【0006】
本発明は更に、哺乳動物において鉄調節タンパク質1(IRP1)を活性化するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてIRP1を活性化する方法を提供する。
【0007】
加えて本発明は、トランスフェリン受容体1(TfR1)発現を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物におけるTfR1発現を増加させる方法を提供する。
【図面の簡単な説明】
【0008】
(図面の簡単な説明)
以下の図面は、少なくともいくつかの本発明の実施態様を示す:
【0009】
【図1】図1a、1b、及び1cは、コントロール飼料又はテンポール添加飼料を与えた野生型(WT)及びIRP2−/−マウスのぶら下がり試験結果のグラフである。
【図2】図2a及び2bは、マウス胎児線維芽細胞におけるIRP1の鉄応答性エレメント(IRE)結合活性ならびにTfR1、L−フェリチン(L−Ft)、IRP1、及びチューブリンのタンパク質レベルを示すゲルである。
【図2c】図2cは、ゲルのバンドの相対的な強度による結果のいくつかを表す。
【図3a】図3aは、コントロール(Ctrl)又はテンポール(Tem)飼料を与えたIRP2−/−動物の小脳、前脳及び脳幹領域におけるIRP1のIRE結合活性及びTfR1、IRP1およびアクチンタンパク質レベルを示すゲルである。
【図3b】図3bは、ゲルのバンドの相対的な強度による結果のいくつかを表す。
【図4】図4aは、コントロール又はテンポール飼料を与えた野生型及びIRP2−/−マウス由来の小脳溶解物のフェリチン及びアクチンタンパク質レベルを示すゲルである。図4bは、ゲルのバンドの相対的な強度による結果のいくつかを表す。
【図4c】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図4d】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図4e】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図4f】図4c〜4fは、免疫組織化学及びペルルスの(Perl’s)DAB染色による野生型及びIRP2−/−マウスの脳の多様な領域における相対的なフェリチンと第二鉄レベルを示す写真である。
【図5a】図5aは、野生型、IRP2−/−及びIRP1−/−マウス由来のマウス胎児線維芽細胞溶解物における細胞質及びミトコンドリアのアコニターゼ活性を示すゲルを表す。
【図5b】図5bは、テンポール又は鉄キレート剤(cheltor)デフェリプロン(deferiprone)(DFO)で処理後のマウス胎児線維芽細胞におけるIRP1レベル及びIRP2レベルを示すゲルを表す。
【図5c】図5cは、テンポール又はDFO処理後のマウス胎児線維芽細胞の細胞質及びミトコンドリアアコニターゼ活性、ならびにIRP1及びIRP2タンパク質レベルを示すゲルを表す。
【図6】図6a及び6bは、βメルカプトエタノールとともにインキュベートした処理サンプルを用いたIREゲルシフトアッセイにより精製ホロIRP1のIRE結合活性を示すゲルを表す。図6c及び6dは、結合溶液(coupled solution)アッセイにより時間の経過とともに測定したアコニターゼ活性のグラフである。
【図7】図7a及び7bは、赤芽球細胞及び前脳溶解物におけるIRP1、IRP2及びアクチンタンパク質レベルを示すゲルを表す。
【図7c】図7cは、コントロール又はテンポール添加飼料を与えた野生型、IRP2−/−及びIRP1+/− IRP2−/−マウスに対するぶら下がり試験の結果のグラフである。
【図7d】図7dは、テンポールがIRE結合活性を回復させるIRP1の鉄−硫黄クラスターを直接不安定化できるという機序案を示す。
【発明を実施するための形態】
【0010】
(本発明の詳細な説明)
安定なニトロキシドラジカルは、一般式R2NOを有する化合物を含有する。本発明を使用する哺乳動物にとって生理学的に許容可能なものであれば、いずれの安定なニトロキシドラジカルも本発明に使用可能である。全身的に投与される場合、選択されたニトロキシドラジカルは選ばれた哺乳動物の血液脳関門を通り抜けられることが望ましい。本発明の方法で使用される好ましい安定なニトロキシドラジカルは、テンポール又はそのヒドロキシルアミン類似体(テンポール−Hなど)を含む。テンポールはフリーラジカル捕捉剤であり、再利用できる抗酸化物質であり、動物飼料に添加することができ、血液脳関門を通り抜けて吸収される。安定なニトロキシドラジカルはフリーラジカルにとって良い捕捉剤であり、安定なニトロキシド電子は反応性ラジカル電子と安定な電子対を形成している。
【0011】
本発明で使用されるのに適した他の安定なニトロキシドラジカルは、当該分野で既知である。一般的に、本発明で有用な安定なニトロキシドラジカルは、一般式R2NOを有し、2つのR基が同一であっても異なっていても良い。概して、各R基は、H、ヒドロキシル、ハロゲン、CN、NO2、スルホンアミド、C1−C8アルキル、C3−C6シクロアルキル、C1−C6アルコキシ、C1−C6ハロアルコキシ、C1−C4ハロアルキル、C2−C8アルケニル、C2−C8アルキニル、アミノ、C1−C4ジアルキルアミノ、C1−C4アルキルアミノ、C1−C6シクロアルキルアミノ、モルホリン、ヘテロアリール(チエニル、ピリジル及びピリミジニルに限定しないことを含む)、アリールアミノ、アリールアルキルアミノ、フェニル、C(O)R’、NR’(COR’’)、NR’SO2R’’及びNR’(CONR’’R’’’)からなる群より独立に選択される。ここで、R’、R’’及びR’’’は独立してH、C1−C6アルキル、フェニル又は置換されたフェニルであり、また、C1−C8アルキルはC1−C4アルコキシ、C1−C4ハロアルキル、C1−C6ジアルキルアミノ、C1−C6アルキルアミノ、シクロアルキルアミノ、及びモルホリンからなる群から選択された1つ以上で任意に置換されており、フェニルはハロゲン、NO2、CN、C1−C4アルキル、C1−C4ハロアルキル、及びC1−C4アルコキシからなる群から選択された1つ以上で任意に置換されており、またはR3及びR4は、それらが結合する炭素と一緒になって環を形成する。
【0012】
本明細書では特に断りのない限り、用語「アルキル」は表示された数の炭素原子(例えば、C1−C20、C1−C10、C1−C4など)を有する飽和直鎖又は分岐非環状炭化水素を意味する。代表的な飽和直鎖アルキルは、−メチル、−エチル、−n−プロピル、−n−ブチル、−n−ペンチル、−n−ヘキシル、−n−ヘプチル、−n−オクチル、−n−ノニル及び−n−デシルを含有し、代表的な飽和分岐アルキルは−イソプロピル、−sec−ブチル、−イソブチル、−tert−ブチル、−イソペンチル、2−メチルブチル、3−メチルブチル、2−メチルペンチル、3−メチルペンチル、4−メチルペンチル、2−メチルヘキシル、3−メチルヘキシル、4−メチルヘキシル、5−メチルヘキシル、2,3−ジメチルブチル、2,3−ジメチルペンチル、2,4−ジメチルペンチル、2,3−ジメチルヘキシル、2,4−ジメチルヘキシル、2,5−ジメチルヘキシル、2,2−ジメチルペンチル、2,2−ジメチルヘキシル、3,3−ジメチルペンチル(dimtheylpentyl)、3,3−ジメチルヘキシル、4,4−ジメチルヘキシル、2−エチルペンチル、3−エチルペンチル、2−エチルヘキシル、3−エチルヘキシル、4−エチルヘキシル、2−メチル−2−エチルペンチル、2−メチル−3−エチルペンチル、2−メチル−4−エチルペンチル、2−メチル−2−エチルヘキシル、2−メチル−3−エチルヘキシル、2−メチル−4−エチルヘキシル、2,2−ジエチルペンチル、3,3−ジエチルヘキシル、2,2−ジエチルヘキシル、3,3−ジエチルヘキシルなどを含有する。アルキル基は非置換であっても置換されていても良い。
【0013】
本明細書では特に断りのない限り、用語「シクロアルキル」は炭素及び水素原子を含み、かつ、炭素−炭素多重結合を持たない単環又は多環飽和環を意味する。シクロアルキル基は、例えばシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチル、並びに飽和環状及び飽和二環式テルペンが挙げられるが、これらに限定されない。シクロアルキル基は非置換であっても置換されていても良い。好ましくは、シクロアルキル基は単環式環又は二環式環である。
【0014】
本明細書では特に断りのない限り、用語「アルケニル基」は表示された数の炭素原子(例えば、C2−C20、C2−C10、C2−C4など)を有する直鎖又は分岐非環状炭化水素を意味する。代表的な直鎖及び分岐アルケニルは、−ビニル、−アリル、−1−ブテニル、−2−ブテニル、−イソブチレニル、−1−ペンテニル、−2−ペンテニル、−3−メチル−1−ブテニル、−2−メチル−2−ブテニル、−2,3−ジメチル−2−ブテニル、−1−ヘキセニル、−2−ヘキセニル、−3−ヘキセニル、−1−ヘプテニル、−2−ヘプテニル、−3−ヘプテニル、−1−オクテニル、−2−オクテニル、−3−オクテニル、−1−ノネニル、−2−ノネニル、−3−ノネニル、−1−デセニル、−2−デセニル、−3−デセニルなどが挙げられる。アルケニル基の二重結合は他の不飽和基と非共役であっても共役であっても良い。アルケニル基は非置換であっても置換されていても良い。
【0015】
本明細書では特に断りのない限り、用語「アルキニル基」は表示された数の炭素原子(例えば、C2−C20、C2−C10、C2−C6など)を有し、少なくとも1つの炭素−炭素三重結合を含有する直鎖または分岐非環状炭化水素を意味する。代表的な直鎖及び分岐アルキニルは−アセチレニル、−プロピニル、−1−ブチニル、−2−ブチニル、−1−ペンチニル、−2−ペンチニル、−3−メチル−1−ブチニル、−4−ペンチニル、−1−ヘキシニル、−2−ヘキシニル、−5−ヘキシニル、−1−へプチニル、−2−へプチニル、−6−へプチニル、−1−オクチニル、−2−オクチニル、−7−オクチニル、−1−ノニニル、−2−ノニニル、−8−ノニニル、−1−デシニル、−2−デシニル、−9−デシニルなどが挙げられる。アルキニル基の三重結合は他の不飽和基と非共役であっても共役であっても良い。アルキニル基は非置換であっても置換されていても良い。
【0016】
本明細書では特に断りのない限り、用語「ハロゲン」又は「ハロ」はフッ素、塩素、臭素、又はヨウ素を意味する。更に、特に断りのない限り、用語「ハロアルキル」は1つ以上のハロゲンで置換されたアルキルを意味し、アルキル及びハロゲンは前記で定義した通りである。
【0017】
本明細書では特に断りのない限り、用語「アルコキシ」は−O−(アルキル)を意味し、ここで、アルキルは前記で定義した通りである。更に、本明細書では用語「ハロアルコキシ」は1つ以上のハロゲンで置換されたアルコキシを意味し、アルコキシ及びハロゲンは前記で定義した通りである。
【0018】
本明細書では特に断りのない限り、用語「ヘテロアリール」は窒素、酸素又は硫黄から独立に選択された少なくとも1つのヘテロ原子、好ましくは1〜3つのヘテロ原子を含む5〜14の環原子を含む炭素環芳香族環を意味する。ヘテロアリール環構造は、単環、二環又は三環化合物などの1つ以上の環構造ならびに縮合ヘテロ環部分を有する化合物を含む。代表的なヘテロアリールは、トリアゾリル、テトラゾリル、オキサジアゾリル、ピリジル、フラニル、ベンゾフラニル、チオフェニル、チアゾリル、ベンゾチオフェニル、ベンゾイソオキサゾリル、ベンゾイソチアゾリル、キノリニル、ピロリル、インドリル、オキサゾリル、ベンゾオキサゾリル、イミダゾリル、ベンズイミダゾリル、チアゾリル、ベンゾチアゾリル、イソオキサゾリル、ピラゾリル、イソチアゾリル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、シンノリニル、フタラジニル、キナゾリニル、ベンゾキナゾリニル、アクリジニル、ピリミジル、オキサゾリル、ベンゾ[1,3]ジオキソール、及び2,3−ジヒドロ−ベンゾ[1,4]ジオキシンが挙げられる。ヘテロアリール基は非置換であっても置換されていても良い。
【0019】
本明細書では特に断りのない限り、用語「アルキルアミノ」は−NH(アルキル)又は−N(アルキル)(アルキル)を意味し、ここで、アルキルは前記で定義した通りである。本明細書では特に断りのない限り、用語「アミノアルキル」は−(アルキル)−NH2を意味し、ここで、アルキルは前記で定義した通りである。
【0020】
本明細書では特に断りのない限り、用語「置換された」とは、1〜4以上の置換基(アルキル、アルケニル、アルキニル、シクロアルキル、アロイル、ハロ、ハロアルキル(例えば、トリフルオロメチル)、ハロアルコキシ(例えば、トリフルオロメトキシ)、ヒドロキシ、アルコキシ、アルキルチオエーテル、シクロアルキルオキシ、ヘテロシクロオキシ(heterocylooxy)、オキソ、アルカノイル、アリール、アリールアルキル、アルキルアリール、ヘテロアリール、ヘテロアリールアルキル、アルキルヘテロアリール、ヘテロシクロ、アリールオキシ、アルカノイルオキシ、アミノ、アルキルアミノ、アリールアミノ、アリールアルキルアミノ、シクロアルキルアミノ、ヘテロシクロアミノ、1又は2置換されたアミノ(アミノ基の2個の置換基はアルキル、アリール又はアリールアルキルから選択される)、アルカノイルアミノ、アロイルアミノ、アラルカノイルアミノ、置換されたアルカノイルアミノ、置換されたアリールアミノ、置換されたアラルカノイルアミノ、チオール、アルキルチオ、アリールチオ、アリールアルキルチオ、シクロアルキルチオ、ヘテロシクロチオ、アルキルチオノ、アリールチオノ、アリールアルキルチオノ、アルキルスルホニル、アリールスルホニル、アリールアルキルスルホニル、スルホンアミド(例えば、SO2NH2)、置換されたスルホンアミド、ニトロ、シアノ、カルボキシ、カルバミル(例えば、CONH2)、置換されたカルバミル(例えば、CONH−アルキル、CONH−アリール、CONH−アリールアルキルあるいはアルキル又はアリールアルキルから選択された2個の置換基が窒素上に存在する場合)、アルコキシカルボニル、アリール、置換されたアリール、グアニジノ、置換又は非置換のヘテロシクロアルキル、置換又は非置換のヘテロアリール(インドリル、イミダゾリル、フリル、チエニル、チアゾリル、ピロリジル、ピリジル、ピリミジルなど)など)で置換された基を意味する。
【0021】
構造中の原子数の範囲が示されているときはいつでも(例えば、C1−C8、C1−C6、C1−C4、又はC1−C3アルキル、ハロアルキル、アルキルアミノ、アルケニルなど)、示された範囲内のいずれの小領域又は各数の炭素原子も使用できることが明確に意図される。したがって、例えば、本明細書で引用されるいずれの化学基(例えば、アルキル、ハロアルキル、アルキルアミノ、アルケニルなど)に関しても使用されるように、1〜8個の炭素原子(例えば、C1−C8)、1〜6個の炭素原子(例えば、C1−C6)、1〜4個の炭素原子(例えば、C1−C4)、1〜3個の炭素原子(例えば、C1−C3)、又は2〜8個の炭素原子(例えば、C2−C8)の範囲の記載は、1、2、3、4、5、6、7又は8個の炭素原子、ならびに必要に応じてその小領域を包含し、具体的に記載する(例えば、必要に応じて、1〜2個の炭素原子、1〜3個の炭素原子、1〜4個の炭素原子、1〜5個の炭素原子、1〜6個の炭素原子、1〜7個の炭素原子、1〜8個の炭素原子、2〜3個の炭素原子、2〜4個の炭素原子、2〜5個の炭素原子、2〜6個の炭素原子、2〜7個の炭素原子、2〜8個の炭素原子、3〜4個の炭素原子、3〜5個の炭素原子、3〜6個の炭素原子、3〜7個の炭素原子、3〜8個の炭素原子、4〜5個の炭素原子、4〜6個の炭素原子、4〜7個の炭素原子、4〜8個の炭素原子、5〜6個の炭素原子、5〜7個の炭素原子、5〜8個の炭素原子、6〜7個の炭素原子、又は6〜8個の炭素原子)。
【0022】
特定の理論に拘束されることなく、安定なニトロキシドラジカルを哺乳動物に投与すると、もし投与されなければmRNAに結合してTfR1及びフェリチンの発現を制御できる部位から抑制性鉄−硫黄クラスターを取り除くことによりIRP1の活性が高まると考えられる。かかる制御により、鉄吸収を増加させ、利用できないタンパク質中への鉄の封鎖を減少させることができる。したがって、安定なニトロキシドは、IRP1がIRP2欠乏を補うことを可能にすると考えられる。それゆえ、本発明の方法は鉄調節タンパク質2(IRP2)機能を欠損した哺乳動物に対して投与するのに特に有用であり、そのためIRP2欠乏に関連するいずれの疾患の治療にも特に有用であると考えられる。同様に、TfR1発現をアップレギュレートする能力のおかげで、直接的又は間接的に、本発明の方法はTfR1低発現の哺乳動物への投与に有用であり、それゆえTfR1低発現に関連するいかなる疾患の治療にも有用であると考えられる。本発明の範囲において低発現とは、特に限定しないが、減少したタンパク質レベル、その他の正常なタンパク質機能の阻害要因の存在、又はその機能に影響するタンパク質の変異を含むいずれの理由であってもタンパク質の活性が減少することを包含することを意図する。
【0023】
したがって、本発明は、哺乳動物の中枢神経系で生物学的に利用可能な鉄の量を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、CNSの鉄が欠乏している哺乳動物の中枢神経系(CNS)において生物学的に利用可能な鉄の量を増加させる方法を提供する。「生物学的に利用可能な鉄の量を増加させる」とは、安定なニトロキシドラジカルの投与前(または投与なし)の哺乳動物における生物学的に利用可能な鉄の量と比較した場合に、安定なニトロキシドラジカルの投与後の哺乳動物における生物学的に利用可能な鉄を増加させることを意味する。好ましくは、生物学的に利用可能な鉄の量は、約10%以上、15%以上、20%以上、25%以上、50%以上、又は100%以上増加する。「生物学的に利用可能な」とは、哺乳動物の細胞で有用であること又は利用できることを意味する。生物学的に利用可能な鉄の量を測定し、比較する方法は、当該分野で既知である。
【0024】
本発明はさらに、哺乳動物においてIRP1を活性化するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物において鉄調節タンパク質1(IRP1)を活性化する方法を提供する。安定なニトロキシドラジカルの投与前(又は投与なし)の哺乳動物、又は哺乳動物から得られた生物学的サンプルにおけるIRP1の活性よりも、安定なニトロキシドラジカルの投与後に哺乳動物、又は哺乳動物から単離された生物学的サンプルの活性が増加する場合、IRP1は活性化される。好ましくは、IRP1活性は少なくとも約10%以上、15%以上、20%以上、25%以上、50%以上、100%以上、又は500%以上までも増加する。IRP1の活性を測定し、比較する方法は当該分野で既知である。
【0025】
本発明はさらに、TfR1発現を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてトランスフェリン受容体1(TfR1)発現を増加させる方法を提供する。TfR1発現の増加は、安定なニトロキシドラジカルの投与前(又はニトロキシドラジカルなし)の哺乳動物又は哺乳動物由来の生物学的サンプルでのTfR1発現と比較した場合の、安定なニトロキシドラジカル投与後の哺乳動物又は哺乳動物由来の生物学的サンプルにおけるTfR1発現のいかなる増加でもあり得る。TfR1発現の増加は、例えばTfR1量の増加なしに、存在するTfR1の相対量が増加すること、またはTfR1の生物学的活性が増加することを含むことができる。好ましくは、TfR1発現が約10%以上、15%以上、20%以上、25%以上、50%以上、100%以上、又は500%以上までも増加する。TfR1の発現を測定し、比較する方法は、当該分野で既知である。
【0026】
本発明の方法は、生物学的に利用可能な鉄の異常なレベル(例えば、正常より低い)、異常なIRP1又はIRP2の活性レベル(例えば、正常より低い)、又はTfR1発現の異常なレベル(例えば、正常より低い)に関連する疾患の研究、診断、予防、治療のためにいかなる目的でも使用することができる。かかる状態は神経変性に関連し得る。したがって、前記のいずれの方法も神経変性疾患の研究、診断、予防又は治療と組み合わせて使用することができる。
【0027】
それゆえ本発明は、別の側面では、神経変性を治療又は予防するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、神経変性疾患に罹患した哺乳動物における神経変性を治療又は予防する方法を提供する。哺乳動物における神経変性の治療又は予防は、神経変性の1つ以上の症状を治療又は予防することを含む。かかる症状は当該分野で既知であり、そのうちのいくつかを実施例で示す。
【0028】
本発明のいずれの方法も、特に神経変性疾患又は異常な鉄代謝(例えば、CNSでの第二鉄の異常蓄積)、IRP機能の欠損(例えば、IRP2変異又は欠失)、又はTfR1低発現に特徴づけられた神経変性疾患又は神経変性状態に罹患した哺乳動物に組み合わせて使用することができる。IRP2が欠乏したヒトは、部分的又は完全に、軽度の小球性貧血、血清フェリチンの上昇、又は赤血球中のプロトポルフィリンIX量の上昇に関連し得る成人発症神経変性疾患を有することが予想される。例としては、かかる疾患又は状態は、パーキンソン病、アルツハイマー病、ハラーフォルデンシュパッツ症候群、無セルロプラスミン血症、難治性貧血、フリードライヒ失調症、骨髄性プロトポルフィリア、又は成人発症神経変性を含み得る。もちろん、本発明の方法は、神経変性の兆候を示していないがIRP機能の欠損又はTfR1低発現を有する哺乳動物と組み合わせて使用することもできる。本発明の方法のかかる適用は、例えば、IRP機能、TfR1発現、及び/又は鉄代謝を回復させること、ならびにおそらく神経変性の開始を予防又は遅延させるのに有用であるだろう。
【0029】
さらに、本発明の方法はいずれも、哺乳動物に鉄サプリメント又は効果的に鉄高含有食を投与する工程と組み合わせて行うことができる。テンポールなどの安定なニトロキシドラジカルの投与により得られる利益をさらに議論するために、IRP2が欠乏した哺乳動物において、機能的鉄の欠乏は、当業者には既知の適切な鉄化合物で補給することができる。かかる鉄高含有食又は他の鉄サプリメントは、安定なニトロキシドラジカル投与に関して以下で議論等されたいずれの適切な方法でも投与することができる。
【0030】
安定なニトロキシドラジカルは、いずれの適切な方法によっても投与できる。例えば、安定なニトロキシドラジカルは、経口投与、エアロゾル投与、非経口投与、皮下投与、静脈内投与、筋肉内投与、腹腔内投与、または動脈内投与により投与することができる。本発明の方法と組み合わせて使用するテンポールの適切な剤形は、当該分野で既知である。
【0031】
ニトロキシドラジカルは、化合物と担体(特に薬学的に許容可能な担体)を含む医薬組成物などの組成物として製剤することができる。医薬組成物は、2つ以上の異なるニトロキシドラジカルを含むことができる。その代わりに、又はそれに追加して、医薬組成物は、他の薬学的に活性な剤や薬と併用させて1つ以上のニトロキシラジカルを含むことができる。その薬は、それと関連した前記疾患又は症状のいずれかを治療又は予防するのに有用であることが知られているものを含む(例えば、レボドパ、カルビドパ、ドーパミン作動薬(パーロデル、ペルマックス、リキップ、ミラペックス、シンメトレル)、抗コリン薬(アーテン、コゲンチン)、エルデプリル、COMT阻害剤(タスマール、コムタン)、非ステロイド系抗炎症薬(NSAID)、GSK−3阻害剤など)。かかる他の薬もニトロキシドラジカルと同時投与又は逐次投与して使用することができる。
【0032】
組成物はさらに担体を含む。該担体は、いずれの適切な担体でもあり得る。好ましくは、該担体は薬学的に許容可能な担体である。医薬組成物に関しては、該担体は慣用されているものであればいずれでも使用できるし、生理化学的検討(溶解性や活性な化合物(単数又は複数)との反応性を欠くなど)によって及び投与経路によってのみ限定される。後述の医薬組成物に加えて、本発明の方法の化合物と阻害剤とを包接錯体(シクロデキストリン包接錯体など)又はリポソームとして製剤することができることは当業者なら認識できるだろう。
【0033】
本明細書に記載の薬学的に許容可能な担体は、例えば、ビヒクル、アジュバント、賦形剤、および希釈剤であり、当業者に周知で公衆に容易に利用可能なものである。薬学的に許容可能な担体は、活性薬剤(単数又は複数)に対して化学的に不活性のものであり、有害な副作用又は使用状態下で毒性がないものであることが好ましい。
【0034】
担体の選択は、特定のニトロキシドラジカル及び使用された他の活性薬剤又は薬によって、ならびに化合物及び/又は阻害剤を投与するのに使用した特定の方法によってある程度決定されるだろう。したがって、本発明の方法の医薬組成物の適切な製剤は様々である。経口、エアロゾル、非経口、皮下、静脈内、筋肉内、腹腔内、直腸内及び膣内投与用の下記製剤は、例示であって限定ではない。ニトロキシドラジカルのこれらの投与経路が知られていることは当業者であれば理解しているし、また、特定の化合物を投与するために1以上の経路が使用され得るが、特定の経路が、他の経路よりもより早くより効果的な応答を提供し得る。
【0035】
本発明に係る有用な製剤の中に注射製剤がある。注射組成物用の効果的な薬学的担体が必要であることは、当業者に周知である(例えば、Pharmaceutics and Pharmacy Practice,J.B.Lippincott Company,Philadelphia,PA,Banker and Chalmers,eds.,238 250頁(1982)、及びASHP Handbook on Injectable Drugs,Toissel,4th ed.,622 630頁(1986)参照)。
【0036】
局所的な製剤は、当業者に周知である。かかる剤形は本発明の範囲において皮膚への適用に特に適している。
【0037】
経口投与に適した製剤は、(a)水、生理食塩水、オレンジジュースなどの希釈剤で溶解された有効量の阻害剤などの液体溶液;(b)カプセル、小袋、錠剤、ロゼンジ及びトローチ(それぞれ固体又は顆粒として事前に決定された量の活性成分を含む);(c)粉体;(d)適当な液体中の懸濁液;及び(e)適切な乳剤からなり得る。液体製剤は、薬学的に許容可能な界面活性剤の添加又は無添加の、水やアルコール(例えば、エタノール、ベンジルアルコール、及びポリエチレンアルコール)などの希釈剤を含んでいてもよい。カプセル製剤は通常の硬い又は軟らかいシェルをもつゼラチンタイプであることができ、例えば、界面活性剤、滑沢剤及び不活性充填剤(乳糖、蔗糖、リン酸カルシウム及びコーンスターチなど)を含む。錠剤製剤は、乳糖、蔗糖、マンニトール、コーンスターチ、ジャガイモデンプン、アルギン酸、結晶セルロース、アラビアゴム、ゼラチン、グアーガム、コロイド状二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリン酸、及びその他の賦形剤、着色料、希釈剤、緩衝剤、崩壊剤、湿潤剤、保存料、着香料、ならびに薬学的に適合する賦形剤から1つ以上を含有させることができる。ロゼンジ製剤は、香味料、通常蔗糖及びアラビアゴム又はトラガカント中に活性成分を含有させることができ、またトローチは活性成分に加えて、当該分野で既知の賦形剤を含む不活性基剤(ゼラチン及びグリセリン又はスクロース及びアラビアゴムなど)、乳剤、ゲル等中に活性成分を含有させることができる。
【0038】
医薬組成物は、吸入により投与するためにエアロゾル製剤にすることができる。これらのエアロゾル製剤は、ジクロロジフルオロメタン、プロパン、窒素などの加圧された許容可能な高圧ガス中に置くことができる。エアロゾル製剤は、非加圧調合のための医薬としても、ネブライザー又はアトマイザー中などで製剤され得る。かかるスプレー製剤はまた、粘膜に噴霧するために使用され得る。
【0039】
非経口投与に適切な製剤は、抗酸化剤、緩衝液、静菌剤、及び対象のレシピエントの血液と等張の製剤にする溶質を含有することができる水性及び非水性の等張滅菌注射液、ならびに懸濁化剤、可溶化剤、増粘剤、安定化剤及び保存料を含むことができる水性及び非水性滅菌懸濁剤を含む。ニトロキシドラジカルは滅菌液又は混合液(水、生理食塩水、水性デキストロース及び関連する糖溶液、アルコール(エタノール、イソプロパノール又はヘキサデシルアルコールなど)、グリコール(プロピレングリコール又はポリエチレングリコールなど)、ジメチルスルホキシド、グリセロールケタール(2,2−ジメチル−1,3−ジオキソラン−4−メタノールなど)、エーテル(ポリ(エチレングリコール) 400、油、脂肪酸、脂肪酸エステル又はグリセリドなど)、又はアセチル化脂肪酸グリセリドを含む)などの薬学的担体における生理学的に許容可能な希釈剤中に入れて投与することができ、薬学的に許容可能な界面活性剤(石鹸又は合成界面活性剤など)、懸濁化剤(ペクチン、カルボマー、メチルセルロース、ヒドロキシプロピルメチルセルロース又はカルボキシメチルセルロースなど)、又は乳化剤及びその他の薬学的アジュバントは添加しても、しなくても良い。
【0040】
非経口製剤に使用できる油は、石油、動物油、植物油、又は合成油を含む。油の具体例としては、落花生油、大豆油、ゴマ油、綿実油、トウモロコシ油、オリーブ油、流動パラフィン、及び鉱油が挙げられる。非経口製剤に使用するのに適切な脂肪酸は、オレイン酸、ステアリン酸、及びイソステアリン酸を含む。適切な脂肪酸エステルの例としては、オレイン酸エチル及びミリスチン酸イソプロピルが挙げられる。
【0041】
非経口製剤で使用される適切な石鹸は、脂肪族アルカリ金属、アンモニウム、及びトリエタノールアミン塩を含む。そして、適切な合成界面活性剤は、(a)カチオン合成界面活性剤、例えば、ハロゲン化ジメチルジアルキルアンモニウム及びハロゲン化アルキルピリジニウムなど、(b)アニオン性合成界面活性剤、例えば、アルキル、アリール及びオレフィンスルホン酸塩、アルキル、オレフィン、エーテル及び硫酸モノグリセリド及びスルホサクシネートなど、(c)非イオン合成界面活性剤、例えば、脂肪族アミンオキシド、脂肪族アルカノイルアミド、及びポリオキシエチレンポリプロピレン共重合体、(d)両性合成界面活性剤、例えば、b−アミノプロピオン酸アルキル、及び2−アルキル−イミダゾリン第4級アンモニウム塩、ならびに(e)それらの混合物を含む。
【0042】
概して、非経口製剤は、約0.5%から約25%の重量の活性成分を溶液中に含むであろう。保存料及び緩衝液が使用され得る。注射部位の刺激を最小にする又は取り除くために、かかる組成物は約12から約17の親水性・親油性バランス(HLB)を有する1つ以上の非イオン界面活性剤を含み得る。かかる製剤における界面活性剤の量は、概して約5重量%から約15重量%の範囲であろう。適切な界面活性剤は、モノオレイン酸ソルビタンなどのポリエチレンソルビタン脂肪酸エステル及びエチレンオキシドと疎水性塩基との高分子量付加物を含み、プロピレングリコールで酸化プロピレンとを縮合することにより形成される。非経口製剤は、単位用量又は複数回用量で密封された容器(アンプルやバイアルなど)中に存在させることができ、使用直前に注射のために滅菌液体賦形剤(例えば、水)を添加することのみが要求されるフリーズドライ(凍結乾燥された)状態で保存することができる。即席の注射溶液及び懸濁液は、前記の滅菌粉末、顆粒、及び錠剤から調製することができる。
【0043】
加えて、医薬組成物は、乳化基剤又は水溶性基剤などの様々な基剤と混合して座薬にすることができる。膣投与に適切な製剤は、活性成分に加えて適当であることが当該分野で既知の担体を含むペッサリー、タンポン、クリーム、ゲル、ペースト、泡、又はスプレーの処方として提示することができる。
【0044】
当業者は、化合物の治療効果を増加させる多数の方法でニトロキシドラジカルが改良できることを容易に理解するだろう。例えば、ニトロキシドラジカルは標的部分に対するリンカーにより直接的又は間接的のどちらかで結合できるだろう。標的部分に対して化合物を結合させるプラクティスは当該分野で既知である。本明細書で使用される用語「標的部分」とは、標的部分が受容体が表面に発現している個々の細胞に化合物又は阻害剤を直接運搬できる、細胞表面の受容体を特異的に認識して結合するいずれの分子又は剤をもいう。標的部分は、抗体又はその断片、ペプチド、ホルモン、成長因子、サイトカイン、及び他のいかなる天然又は非天然に存在するリガンド(該リガンドは細胞表面に結合する)も含むが、これに限定されない。本明細書で使用される用語「リンカー」とは、標的部分に化合物を架橋させるいずれの剤も分子もいう。当業者は、いったん化合物に付着したらリンカー及び/又は標的部分はその機能を妨げないという条件で、化合物又は阻害剤の機能に必要でない化合物上の部位が、リンカー及び/又は標的部分に付着するのに理想的な部位であることを認識している。
【0045】
その代わりに、ニトロキシドラジカルが投与された体内で放出される方法が時間と体内の場所に応じてコントロールされるように、デポの剤形に変更することができる(例えば、米国特許第4,450,150号参照)。デポの剤形は、例えば、カプセル化又は多孔質材中に拡散しているニトロキシドラジカルとポリマーなどの多孔質材とを含む埋め込み可能な組成物にすることができる。その後、デポは体内の所望の部位に埋め込まれ、活性成分が多孔質材を通過して拡散することにより事前に決定された速度でインプラントから放出される。
【0046】
ニトロキシドラジカルは、くも膜下への送達を可能にするよう埋め込まれたポンプを介して有利に投与することができる場合もある。かかる送達方法は、投与された薬物が他の方法では血液脳関門を十分に通り抜けないとき、特にCNSへの薬物送達に有用である。
【0047】
本明細書で記載されたニトロキシドラジカルは、哺乳動物へのニトロキシドラジカル投与に関して前記したいずれの効果も達成するようにインビトロで細胞中に投与できる。本明細書において、用語「インビトロ」とは、細胞が生体器官内にないことを意味する。ニトロキシドラジカルはまた、インビボでも細胞に投与できる。本明細書で使用する場合、用語「インビボ」は細胞が生体器官の一部又は生体器官内にあることを意味する。さらに、ニトロキシドラジカルは、宿主にインビボ又はエキソビボで投与することができる。本明細書で使用される場合、用語「エキソビボ」は1つの細胞または細胞集団にインビトロで化合物を投与し、その後、細胞または細胞集団を宿主に投与することをいう。
【0048】
さらに、ニトロキシドラジカルは、それ単独で投与することもできるが、ニトロキシドラジカルの有効性を高める剤と一緒に投与することもできる。かかる剤には、例えば、医薬組成物に関して本明細書で記載したいかなる他の活性成分も含まれ、該剤はニトロキシドラジカルを含む組成物とは分離した組成物で投与することができる。
【0049】
ニトロキシドラジカルの量又は用量は、適切な期間中宿主に治療又は予防応答をもたらすのに十分な量であるべきである。適当な用量は、治療又は予防するべき疾患又は苦痛の性質及び深刻さ、ならびにその他の要因によるだろう。例えば、用量はまた、特定の化合物の投与に伴い得るいずれの副作用の存在、性質及び程度によっても決定することができる。最終的には、年齢、体重、全体的な健康、食べ物、性別、投与するべき阻害剤、投与経路、及び治療される状態の深刻さなどの多様な要因を考慮して、主治医が各患者を治療する用量を決定するだろう。典型的な用量は、例えば毎日0.1mg〜1gであり、例えば毎日5mg〜500mgであり得る。
【0050】
本発明の方法は、哺乳動物のいずれのタイプとも組み合わせて使用することができる。本明細書で議論された哺乳動物は、特に限定されないが、マウスなどのげっ歯目、ウサギなどのウサギ目(Logomorpha)が挙げられる。哺乳動物は、ネコ科(ネコ)及びイヌ科(イヌ)を含む食肉目由来であることが好ましい。哺乳動物は、ウシ及び豚を含む偶蹄目、またはウマを含む奇蹄目(Perssodactyla)由来であることがより好ましい。哺乳動物は、霊長目、Ceboid又はSimoid(サル)あるいは類人猿(Anthropoid)(ヒト又は類人猿(ape))であることが最も好ましい。特に好ましい哺乳動物はヒトである。さらに、子宮内で化合物を投与する場合には、哺乳動物はいずれの前の(forgoing)宿主(特に哺乳動物又はヒト)のいずれの胎児であることもできる。
【0051】
該方法は、いずれの目的(本明細書で議論された疾患又は状態のいずれか、他の疾患又は状態の研究、治療、又は予防を含むが、これに限定されない)にも使用することができる。
【0052】
以下の実施例は、さらに本発明を例証するが、当然本発明の範囲を限定する手段として考えられるべきでない。
【実施例】
【0053】
実験モデルの背景:以下の実施例において、IRP2−/−マウスが神経変性疾患モデルに使用される。IRP2−/−動物の神経変性は、例えば、成獣における、ぶら下がり試験(hang−test)、ロータロッド回転ドラム式トレッドミルテスト(rotarod rotating drum treadmill testing)、平均台(balance beams)、登棒テスト(climbing pole tests)、アレルロッド(allelerods)、足跡、減少した身づくろい行動及び歩行異常に関する動作によりマウスで測定されたように、進行性の運動能力喪失によって特徴付けられる。IRP2−/−動物の神経変性は動物の加齢とともにゆっくりと進行する。
【0054】
鉄調節タンパク質(IRP)が鉄代謝タンパク質をコードする転写産物中に見られる鉄応答性エレメント(IRE)として知られるRNAステムループと結合することによって、細胞性鉄ホメオスタシスを制御すると考えられる。例えば、フェリチンH又はLの転写産物の5’末端でIREと結合するIRPは、フェリチンの翻訳を抑制する。一方、TfR1の3’UTRにおいてIREと結合するIRP、及び金属トランスポーターDMT1の1つのアイソフォームは、mRNAを安定化する。フェリチンレベルはIRP2−/−動物のほとんどの組織で異常に高いが、TfR1レベルは異常に低い。
【0055】
IRP2を欠損するマウスは、低TfR1及び高フェリチン発現により生じる機能的細胞性鉄の減少に関連して小球性貧血及び神経変性が進行する。IRP1−/−動物は、鉄代謝を有意には誤って制御しない。1つには、IRP1が、哺乳動物組織において主に細胞質アコニターゼとして機能する鉄−硫黄タンパク質であり、IRP2活性がIRP1の構造と結合するIREの欠失を補償するために増加するためである。これまでのところ、細胞質アコニターゼの欠失に起因する表現型は同定されていない。
【0056】
特に、1つのIRP1アレル(IRP1−/+)も欠失したIRP2−/−動物は、貧血や神経変性の深刻さの増大につれてIRP標的転写産物のより大きな誤制御を示す。このことは、IRE結合活性を有するIRP1の小さな断片が細胞内の鉄代謝の制御に寄与することを示す。IRP1のIRE結合活性は鉄ホメオスタシスに重要であるという認識と一致して、IRP2に加えてIRP1の両アレルが欠損している動物(IRP1−/− IRP2−/−)が発生の胞胚期を越えて生存しない。
【0057】
IRP2−/−マウスでは、マウス脳白質の鉄の染色により観察することができる進行性神経変性疾患が進行する。高められたペルルスの(Perls’)DAB染色及びアミノ銅銀染色において、軸索の鉄は軸索の変性とともに局所的に集積しているのが観察できる。軸索炎症もまた、脊髄前根や頸髄などの部分でIRP2−/−マウスで広く見られる。神経細胞体の変性の初期兆候は、核質の暗色化、核膜の完全性の喪失、及び血漿膜のブレブ形成を含み、これはコントロールWTマウスに対して上丘試料の比較分析により観察することができる。ニューロンのサイズや形と一致する空胞が、脳の患部の至る所に見られる。多数の空胞がIRP2−/−マウスの黒質にあるのが見られる。軸索の変性は、少なくとも部分的には、機能的鉄の欠乏とミトコンドリア機能不全に導かれるTfR低発現と結びついて、フェリチンターンオーバー由来の鉄毒性に起因し、フェリチンによる鉄の封鎖に起因するように思われる。見かけの「鉄過負荷」における鉄の不均等分布は、機能的鉄の欠乏と関連付けできる。それによって、フェリチンは、他の鉄タンパク質を犠牲にして鉄を封鎖し、発生中の赤血球におけるTfR発現が欠損するのでIRP2−/−マウスは鉄欠乏性貧血になる。IRP2−/−マウスの鉄機能不全性貧血は、WTと比較してヘモクリットレベルが減少し、遊離プロトポルフィリンや亜鉛プロトポルフィリンレベルが上昇することが観察される。さらに、ペルルスの(Perls’)鉄染色で試験した場合、IRP2−/−動物の骨髄は、完全に鉄が欠損していると思われる。
【0058】
加えて、約97kDのウェスタンブロット像は、トランスフェリン(transferring)受容体レベルがIRP2−/−及び(amd)IRP1+/− IRP2−/−マウス由来の赤血球造血細胞において低下することを示すが、約36kD及び22kDの像で示されるフェリチンL及びHレベル(leves)は上昇する。約64kD及び51kDの像で示されるeALASの翻訳はWTコントロールと比較して増加する。eALASの過剰発現は、プロトポルフィリンIX合成の増加を導き、鉄欠乏はヘム形成を妨げると思われる。IRP2欠乏は赤芽球増殖性プロトポルフィリン症(erythropoietic protoporphryia)(EPP)を生じ得る。非ヘム脳内鉄含有量はIRP2−/−動物で減少しているのが観察された。例えば、WTマウスの約78.9+/−9μg/グラム 乾燥重量は、IRP2−/−マウスではP<0.01で約62.2+/−12になった。しかし、全量の非ヘム脳内鉄は同じか僅かに減るが、全第二鉄イオンはIRP2−/−脳で比較的増加し(4つの要因のうち約1つより多くで)、生物学的に利用可能な第一鉄がWTに対して比較的減少する(4つの要因のうち約1つより多くで)と思われる。
【0059】
TfRは脳内鉄摂取に重要であり、鉄−硫黄クラスターはミトコンドリア呼吸複合体に重要であると思われる。ミトコンドリアは軸索の維持を必要とする。軸索の完全性の喪失はIRP2−/−マウスで広く見られる。遺伝子型分析に基づくと、NF−κBはニューロンの活性に依存する転写の制御及び軸索の挙動における重要な遺伝子であると思われる。逆行性輸送により、NF−κBがニューロンの安定に関する標的遺伝子を転写的に活性化することができる。したがって、特定の理論に拘束されることなく、IRP2−/−マウスにおける神経変性の病因は、ミトコンドリア機能に欠陥を生じさせる鉄欠乏によるものであり、減少したATP産生は軸索の腫脹と軸索の輸送の減少を導き、ならびに、NF−κBが核に移動できないことはニューロンの維持と安定に重要な多数のタンパク質の発現を減少させると考えられる。テンポールなどの安定なニトロキシドラジカルを投与することにより、IRP2欠損患者にとって、神経変性を妨げる有用な治療が得られる。
【0060】
方法:
【0061】
マウス:IRP2−/−マウスはLaVaute et al.,Nature Genetics,27,209−214(2001)に記載の通り飼育し、遺伝子型を決定することにより生産し繁殖させた。本研究に使用したマウスは129S4/SvJae×C57Bl/6の雑種であるという背景を有する(各系統の詳細な比は不明である)。同一の遺伝子型で異なる飼料を与えたマウスにおける実験で、遺伝的背景の違いによる表現型の多様性を最小化するために同胞を使用した。異なる遺伝子型で異なる飼料を与えたマウスは、齢と性別が一致していた。すべてのプロトコルは米国国立小児保健発達研究所動物実験委員会に承認されており、米国立衛生研究所動物の人道的管理に関する指針を満たした。
【0062】
飼料:マウスは生後3〜4週で離乳した。離乳直後から、マウスはテンポール添加飼料またはコントロールの飼料で維持した。テンポール添加飼料では、粉末にしたテンポールを飼料に対して10mg/gの濃度で「コールドプレス」技術(Bio−Serv、フレンチタウン、NJ、USA)によりベーコン風味のマウス食に均一に混合した。テンポールなしのベーコン風味食をコントロール飼料として使用した。
【0063】
ぶら下がり試験:ぶら下がり試験では、マウスは金網を握らせ、その後、逆さにした。マウスが落下前(最大60秒まで)に逆さにした金網にぶら下がっていられた時間の長さを計測して記録した。
【0064】
組織及び溶解物の調製:動物は安楽死させ、組織は採取後すぐに液体窒素中で凍結し、アルゴン下−80℃で保存した。実験は、嫌気性チャンバー中、液体窒素で冷却した乳鉢で粉砕した組織で行い、周期的な凍結融解及びアルゴンを用いた空気除去により脱気した溶解バッファーで溶解した。核及び残渣を遠心分離により除去した。IRP1活性アッセイ、ウェスタンブロッティング、カルボニルアッセイ及びタンパク質分析のための溶解物の調製は、嫌気的に行われた。
【0065】
細胞:13日齢胚の胎児線維芽細胞はLaVaute et al.supraに記載の通り、野生型、IRP1−/−マウス及びIRP2−/−マウスから単離した。IRP2発現が誘導され得るMycタグされたHEK293Tet−on細胞株は、Bourdon et al.,Blood Cells Mol Dis,31,247−255(2003)に記載の通り、調製され培養された。赤芽球はCooperman et al.,Blood,106,1084−1091(2005)に記載の通り、骨髄から採取し、精製した。
【0066】
RNA移動度シフトアッセイ:ゲル遅延度アッセイをMeyron−Holtz et al.,EMBO J,23,386−395(2004)に記載の通り行った。組織溶解物は、10mM HEPES(pH7.2)、3mM MgCl2、40mM KCl、5%グリセロール、0.2% Nonidet P−40、5mM DTT、1mM AEBSF、10μg/mlロイペプチン及びcompleteTM EDTAフリープロテアーゼ阻害剤カクテル(ロシュ アプライド サイエンス社、インディアナ)を含有する酸素除去溶解バッファーで前記の嫌気性チャンバー中で調製した。全タンパク質10μgを含有する溶解物(xμl)を25mM Tris−HCl(pH7.5)及び40mM KClを含有するバンドシフトバッファー(12.5−x)μlに添加した。サンプルは、20%グリセロール、0.2U/μl Super RNAsine(アンビオン社、テキサス)、0.6μg/μl酵母t−RNA、5mM DTT及び25mM Tris−HCl(pH7.5)及び40mM KCl中20nM ヒトフェリチンH鎖遺伝子由来の32PでラベルしたIREを含有する反応カクテル12.5μlとともに室温(RT)で5分間インキュベートした。本反応混合物20μlの測定は、10%アクリルアミド/TBEゲルにロードし(200V、2.15時間で電気泳動し)、その後、ゲルを固定、乾燥し、オートラジオグラフィーに供した。
【0067】
ウェスタンブロッティング及び抗体:タンパク質分析はLaVaute et al.,supraに記載の通り行った。等量のタンパク質(20〜40μg/レーン)を13% SDS PAGEで分離し、ニトロセルロースメンブレンに転写した。メンブレンを5%無脂肪ミルク、PBS中0.1% Triton X−100で固定し、同一のブロッキングバッファー中、室温(RT)でプローブ標識した。IRP1抗体は精製したhIRP1に対して調製し、1:5000に希釈して使用した。L−フェリチン抗体はマウス肝臓から精製したL−フェリチンタンパク質からウサギで産生した。ザイメッド社のマウスモノクローナルTfR抗体は、1:2000に希釈して使用した。シグマ社のモノクローナル抗αチューブリン抗体及び抗βアクチン抗体は、1:5000に希釈して使用した。ウェスタンブロットは、GEヘルスケア社の二次ペルオキシダーゼconjugateヤギ抗ウサギIgG抗体またはヒツジ抗マウスIgG抗体をそれぞれ1:5000及び1:2000に希釈して処理した。ウェスタンブロットは、高感度化学発光法(ECLキット、ピアス社、イリノイ)を使用して現像した。
【0068】
アコニターゼアッセイ:ヒト溶解物に対するアコニターゼ活性ゲルはTong et al.,infraに記載の通り行い、マウス溶解物に対するアコニターゼ活性ゲルは以下の変更をして行った。ゲルは、6%アクリルアミド、132mMトリス塩基、66mMホウ酸塩、3.6mMクエン酸塩を含む分離ゲル及び4%アクリルアミド、66mMトリス塩基、33mMホウ酸塩、3.6mMクエン酸塩を含むスタッキングゲルから作成された。ランニングバッファーは、25mMトリスpH8.3、96mMグリシン、及び3.6mMクエン酸塩を含む。電気泳動は、170V、4℃で行った。スペクトルアコニターゼ活性は、基質としてシス−アコニターゼを使用してFillebeen et al.,infraの方法に従って測定した。
【0069】
免疫組織化学:パラフィン包埋組織切片を、脱ろう、補水後に10mMクエン酸バッファーpH6.4中で抗原回復のために15分間電子レンジ(micro oven)で煮沸した。切片は30分間ブロッキングバッファー(トリス緩衝食塩水pH7.4、5%正常ヤギ血清、0.1% Tween−20)でブロックし、その後、室温で2時間ポリクローナルウサギ抗フェリチン抗体とともにインキュベートした。タンパク質−抗体複合体はCY3−ロバ抗ウサギ抗体(ジャクソンイムノリサーチラボラトリーズ、ウェストグローブ、PA)で標識した。核は対比染色としてDAPIで標識した。スライドを観察し、写真をニコンEclipse E600蛍光顕微鏡で記録した。
【0070】
ペルルスの(Perl’s)DAB鉄染色:脱ろう及び補水後、パラフィン包埋組織切片は、予熱した染色液(5%フェロシアン化カリウム15.0ml、5%塩酸15.0ml、電子レンジ(micro oven)で15秒間)で5分間染色した。切片は滅菌水、及びトリス緩衝食塩水pH7.4で洗浄し、その後、DAB染色液(20mg DAB、50μl 30% H2O2、20mlトリス緩衝食塩水pH7.4)で室温で30分間染色した。滅菌水で洗浄後、切片はCrystal Mountマウンティング液(シグマ社)でマウントし、観察し、ニコンEclipse E600蛍光顕微鏡で写真撮影した。
【0071】
統計:対応のあるスチューデントt検定(paired Student’s t−test)でぶら下がり時間の平均値間の違いを調べた。p<0.05の結果は、統計的に有意であると考えられた。
【0072】
(実施例1)
以下の実施例は、IRP2欠損マウスにおける神経変性を治療又は予防するためにテンポールを使用することを示す。
【0073】
安定なニトロキシドラジカル、テンポールを栄養補助食品としてノックアウトマウス(IRP2−/−)に投与し、「ぶら下がり試験」を用いて神経変性を調べた。該「ぶら下がり試験」では、マウスに逆さまにした位置で金網スクリーンを握らせ、スクリーンを握っていられる時間の長さを測定した(最大60秒まで)。ぶら下がり試験はマウスにおける神経変性の進行を定量的に評価する。Crawley et al.,Brain Res.835,18−26(1999)。
【0074】
金網を逆さまにした後に握り続けるIRP2−/−マウスの能力は、動物の加齢につれて次第に減少し、WTマウス(図1a参照)に比べてIRP2−/−マウスで有意に悪化する(p値=0.015)。テンポール添加飼料を与えたノックアウトマウスは、治療されていないノックアウトマウスに比べてぶら下がり時間の実質的な増加を示した。これは、テンポール添加飼料で維持されたIRP2−/−マウスが神経筋の能力を次第に失うことから有意に(p値=0.009)守られていることを示す(図1c)。テンポールを添加されたIRP2−/−マウスは、行動障害、震えまたは歩行や毛づくろい異常などの神経変性の他の兆候が進行しなかった。
【0075】
(実施例2)
以下の実施例は、安定なニトロキシドラジカルが、鉄代謝遺伝子の活性及び/又は発現のポジティブな効果を介して治療的有用性を提供することを示す。
【0076】
テンポールなどのニトロキシドラジカルは、酸化ストレスを軽減する治療的有用性を提供するフリーラジカル捕捉剤として機能すると一般的に考えられている。しかしながら、IRP2−/−動物における脂質酸化、DNA酸化(8−ヒドロキシグアニンアッセイ)及びタンパク質酸化アッセイを含む酸化ストレスに対する複数のアッセイは、酸化ストレスが疾患の進行に重大な役割を有することは示さなかった(本明細書ではデータを示さない)。
【0077】
IRP1のIRE結合活性に対するテンポールの効果を調査するため、IRP2−/−胎児線維芽細胞に、0、0.3及び1.0mMテンポールを添加し、クエン酸第二鉄アンモニウム(FAC)を添加した培地又は無添加の培地で16時間維持した。図2a及び2bのウェスタンブロットは、IRP1のIRE結合活性ならびにTfR1、L−Ft、IRP1及びチューブリンのタンパク質レベルを示す。全てのIRE結合活性は、IRP1活性化に起因した。その結果は、テンポール処理細胞においてTfR1レベルが増加し、フェリチンレベルが減少する一方で、IRP1レベル及びチューブリンレベル(ロードしたコントロール)は変化しないことを示す。図2cは、異なった濃度のテンポール(FAC添加なし)でのIRP1、TfR1及びL−フェリチン(L−Ft)タンパク質レベルのIRE結合活性を、ここで100%と表わされるコントロールレーンと比較した強度として示す。定量化はIQMac(IRP1活性)又はNIHイメージ(タンパク質レベル)プログラムで行った。エラーバーは、2つの異なるセットの実験から計算された標準偏差を示す。
【0078】
総合すれば、これらの結果は、ニトロキシラジカル処理がIRP1の潜在的なIRE結合活性を活性化し、かくしてTfR1及びフェリチンの誤制御を覆すことにより、細胞にIRP2の喪失を補償することを可能にする。したがって、テンポール及び同様の安定なニトロキシドラジカルは有意なフリーラジカルストレス又は鉄減少を生じないメカニズムによってIRP1を活性化するので、魅力的な神経保護療法である。
【0079】
(実施例3)
以下の実施例は、インビボでのIRE結合活性に対するニトロキシドラジカルの効果を示す。
【0080】
コントロール飼料またはテンポール添加飼料で維持したIRP2−/−マウスの様々な脳領域から作製された溶解物は、ゲルシフトアッセイ及びウェスタンブロットによりIRP1のIRE結合活性、ならびにTfR1、IRP1及びアクチンタンパク質レベルについて分析された。結果は図3aに示す。図3bは、ここで100%と表されたコントロールと比較したバンドの強度としての結果を定量化したものである。定量化はIQMac(IRP1活性)又はNIHイメージ(タンパク質レベル)プログラムで行った。エラーバーは、2つの異なるセットの動物から計算された標準偏差を示す。
【0081】
小脳、脳幹及び前脳由来の溶解物において、IRE結合活性及びTfR1タンパク質レベルがコントロールマウスと比較してテンポール補給マウスで顕著に増加した。IRP1及びアクチンタンパク質レベルは、テンポール処理結果としてはこれらの脳領域で有意な変化を生じなかった。これらの結果は、テンポールがインビボでIRP1のIRE結合活性に対するポジティブな効果を与えることを裏付ける。
【0082】
(実施例4)
以下の実施例は、脳白質におけるニトロキシドラジカル処理がフェリチン発現及び第二鉄蓄積を減少させることを示す。
【0083】
コントロール飼料又はテンポール添加飼料で維持した野生型マウス及びIRP2−/−マウス由来の小脳溶解物を、フェリチン発現又はアクチン発現について分析した。図4aは、ウェスタンブロット分析結果を示す。図4bでは、100%として表されるコントロールと比較した相対的な強度の測定値としてフェリチンレベルを示す。定量化はNIHイメージプログラムで行った。エラーバーは、3つの異なるセットの動物の結果から計算された標準偏差を示す。結果が示すように、フェリチンレベルは野生型マウスと比較してコントロール飼料のIRP2−/−マウスで上昇した。テンポールを用いた処理はIRP2−/−マウスでのフェリチンレベルを減少させた。これはテンポールにより誘導されたIRE結合活性の観察された増加と一致する。
【0084】
免疫組織化学研究は、マウス脳の海馬及び大脳皮質領域におけるフェリチン発現を分析することで行った。結果は図4c及び4dに示す。結果が示すように、フェリチン発現は野生型動物と比較してIRP2−/−動物(左下パネル)の海馬及び大脳皮質で顕著に増加した。フェリチン過剰発現はテンポール処理とともに減少した。
【0085】
コントロール飼料又はテンポール添加飼料で維持した野生型マウス及びIRP2−/−マウスの小脳葉及び線条体は、ペルルスの(Perls’)DAB染色を用いた第二鉄蓄積で分析した。結果を図4e及び4fに示す。図で示すように、第二鉄染色は野生型コントロールと比較してコントロール飼料のIRP2−/−動物の試験領域において増加した。これは、IRP2−/−動物のオリゴデンドロサイト及び小脳白質路における第二鉄の封鎖を示す。染色は、テンポール飼料のIRP2−/−動物で減少し、これは鉄の封鎖が減少したことを示す。
【0086】
これらの結果は、安定なニトロキシドラジカルが脳におけるフェリチン発現及び第二鉄蓄積を減少させられることを示す。
【0087】
(実施例5)
以下の実施例は、ニトロキシドラジカルがIRP1のIRE結合構造を生じさせるために細胞質(cytolic)アコニターゼの鉄−硫黄クラスターの分解を介してIRE結合活性を回復させることを示す。
【0088】
IRP1は、2つの形態の間で変化する二官能性タンパク質である:鉄が豊富な細胞において、IRP1はキュバン鉄−硫黄クラスター及び機能をクエン酸塩とイソクエン酸塩で相互転換する細胞質アコニターゼとして含む。一方、酸化還元−感受性鉄−硫黄クラスターを喪失する際に、IRP1はIREと結合できるように重要な形態変化をする。動物組織中で、ほとんどのIRP1は、主に活性化したアコニターゼとして無傷の鉄−硫黄クラスター及び機能を含む。
【0089】
ニトロキシドラジカルが鉄−硫黄クラスターの分解によりIRP1結合を活性化することを裏付けるために、我々はin−gelアコニターゼアッセイを行ってテンポールが細胞質アコニターゼの活性を減少させたかどうかを決定した。図5aはマウス胎児線維芽細胞(MEF)溶解物における細胞質アコニターゼ活性を示す。バンドは、細胞質アコニターゼがIRP1−/−細胞由来の溶解物中にないことが直ちに確認されたことを示す。特に、テンポール処理は、WT及びIRP2−/−胎児線維芽細胞由来の溶解物中の細胞質アコニターゼの活性を減少させる。一酸化窒素、O2・−及びアスコルビン酸塩などの小さな酸化還元分子が細胞質アコニターゼの鉄−硫黄クラスターと反応できること、それにより鉄−硫黄クラスターの喪失とIRP1のIRE結合構造への転化を導くことは、当該分野での他の所見と一致している。Tong et al.,Cell Metab 3,199−210(2006);Bouton et al.,Sci STKE 2003,pe 17(2003)。
【0090】
IRP1活性に対するテンポールの効果が鉄−硫黄クラスターの酸化分解と動力学的に一致するかどうかを決定するために、アコニターゼ活性に関するテンポールの効果をIRP1での鉄−硫黄クラスターの新規合成と修復を限定することによってIRP1のIRE結合活性を活性化する鉄キレート剤、デフェリプロン(DFO)の効果と比較した。野生型及びIRP2−/−マウス由来のマウス胎児線維芽細胞は、テンポール又は鉄−キレート剤デフェリプロン(DFO)で16時間処理し、その後、新鮮な無添加培地に取り換え、続いてゲルシフトアッセイ及びアコニターゼゲルアッセイにより様々な時間ポイントでアッセイした。アコニターゼ活性の回復は、野生型及びIRP2−/−細胞で評価した。結果は図5b及び5cに示す。
【0091】
テンポール及びDFOの両方の処理により、IRP1のIRE結合活性が活性化された。しかしながら、テンポールにより誘導されたIRE結合活性の活性化及び細胞質アコニターゼ活性の喪失は、テンポール除去2時間後まで容易に逆転したが、細胞質アコニターゼ活性の回復はDFO除去8時間後に活性を評価したときでさえもほとんど認識されなかった。DFOと比較してテンポール処理後の鉄−硫黄クラスター回復の速度における差異は、テンポールとDFOが異なる機序によりIRP1を活性化することを示した。結果は、IRP1の鉄−硫黄クラスターはテンポールによって分解されるが、クラスター不安定化試薬が除去されると直ちに再構築されることを示す。一方、DFO処理後の細胞質アコニターゼ活性の回復は、細胞内鉄の減少、及び減少した鉄−硫黄会合タンパク質の発現により制限された。加えて、処理は実質的にミトコンドリアアコニターゼ活性に影響を及ぼさず、それゆえに相対的に良性であった。
【0092】
(実施例6)
以下の実施例は、ニトロキシドラジカルがIRP1の鉄−硫黄クラスターに対して直接効果を与えることを示す。
【0093】
IRP1の鉄−硫黄クラスター状態に対するテンポールの効果が直接的化学的分解過程を表すかどうかを評価するため、テンポールで精製ホロIRP1(無傷の[4Fe−4S]クラスターを含む)を一酸化窒素によるIRP1の鉄−硫黄クラスターの分解を示すために当該分野で使用されてきた条件と同様の時間及び温度条件で処理した。Soum et al.,J Biol Inorg Chem,8,226−232(2003)。精製ホロIRP1(11ng)のIRE結合活性は、IREゲルシフトアッセイによって評価した。精製タンパク質(11ng)を1mMテンポールなし(レーン1)又はあり(レーン2)で室温で2時間0.1% β−メルカプトエタノールとともにインキュベートした。レーン3のサンプルはテンポールなしで2時間インキュベートした後、2% β−メルカプトエタノールで2分間処理した。結果は図6a及び6bに示す。アコニターゼ活性は、室温及び37℃で3時間コントロール及びテンポール処理されたサンプルにおいて、時間とともにアコニターゼ活性を同程度に喪失することを示す基質としてシスアコニターゼを使用し、Fillebeen et al.,Biochem J,388,143−150(2005)の方法に従った結合溶液(coupled solution)アッセイにより測定した。結果は図6d及び6eに示す。
【0094】
テンポール処理は、[4Fe−4S]クラスターの完全な崩壊と一致してIRP1のIRE結合活性を増加させる。IRE結合活性は2時間室温でテンポール処理したIRP1及び3時間37℃でテンポール処理したIRP1では、室内空気のみに暴露したIRP1と比較してはるかに高かった。図6bは、IRE結合活性は、3時間37℃で1.0mMテンポールによるホロIRP1の処理でほとんど完全に回復したことを示す。しかしながら、テンポールを精製タンパク質に添加することは、2時間まで又は3時間37℃で室内空気に暴露されて生じるアコニターゼ活性の喪失を促進しなかった。これらの結果は、精製タンパク質を使用したアッセイにおいてテンポールがクラスターの分解を促進することを示した。一方、酸素だけに暴露するとアコニターゼ活性を欠く識別可能な中間体の形成を促進するが、IRE結合を妨げるクラスターの残存物を保持する。
【0095】
精製タンパク質に関するこれらのアッセイは、テンポールが直接的及び十分にIRP1の鉄−硫黄クラスターを分解することを示し、直接IRP1の鉄−硫黄クラスターを不安定化することによってテンポールが細胞及び動物におけるIRP1のIRE結合活性を活性化するという結論を支持する。鉄−硫黄クラスターの部分的に分解された構造は細胞及び動物内では修復されるかもしれないが、精製タンパク質サンプルでは修復されないかもしれない。このことは、テンポール処理後のインビボ及びインビトロでのアコニターゼ活性測定結果を説明している。
【0096】
(実施例7)
以下の実施例は、ニトロキシドラジカルがIRP1結合活性の回復を通して治療効果に影響することを示す。
【0097】
赤芽球は、IRP1とIRP2との相対的な活性を評価するため及び赤芽球におけるIRP1の潜在的プールからIRP1がIRE結合構造に回復できたかどうかを決定するために野生型マウスから単離された。ゲルシフト研究により、IRP1及びIRP2が赤芽球でのIRE結合活性に同等に寄与することを示した(図7a)。しかしながら、IRP1レベルは脳と比べて赤芽球で顕著に減少した(図7b)。同様に、IRP1を細胞質アコニターゼ構造からIRE結合構造に変換する高濃度のβメルカプトエタノールで赤芽球を処理することは、赤芽球でのIRP1のさらなるIRE結合活性を活性化しない。対照的に、IRE結合活性の有意な増加を、βメルカプトエタノール処理を使用した脳溶解物から得た(図7a)。このことは、発生中の赤血球が、テンポール又は他の鉄−硫黄クラスター不安定化試薬で処理することによりIRE結合構造へと変換され得る細胞質アコニターゼ構造においてIRP1の有意な量を欠失していることを示す。
【0098】
これらの結果は、IRP2−/−動物の軽度の鉄欠乏貧血が主に赤芽球における減少したTfR1の発現及び減少した骨髄鉄蓄積に寄与するが、IRP2−/−マウスのテンポール処理がなぜ神経変性を予防するのに、IRP2−/−マウスの軽度の貧血を改善に導かないのかを説明する。IRP2−/−マウスの軽度の貧血(ヘマトクリット値はWTの52±2に対して46±5であった。p=0.022)は、テンポール処理動物では改善されず、テンポール飼料を与えた8ヵ月後46±4のままであった。赤芽球では非常に少しのIRE結合活性しか改善できないので、テンポールはIRP2−/−マウスの貧血を治さなかった。
【0099】
さらに、テンポールは神経変性からIRP2−/−動物を保護するが、IRP1+/− IRP2−/−マウスにおける疾患の進行を有意には(p=0.559)妨げなかった(図7c)。WT、IRP2−/−及びIRP1+/− IRP2−/−マウスのぶら下がり試験結果は、IRP1+/− IRP2−/−動物がIRP2−/−動物よりも症状を示した。しかしながら、テンポール処理は、神経変性症状の進行から有意に(p=0.559)十分にIRP1+/− IRP2−/−動物を保護しないことは明らかであった。エラーバーは、平均値の標準誤差を表す。曲線は、KaleidaGraphプログラムの多項式曲線適合を用いて描いた。図1に示したWT及びIRP2−/−マウスのぶら下がり試験曲線は、IRP1+/− IRP2−/−動物と比較してここで再度表示する。これらの結果は、1つのIRP1アレルの喪失はIRP1+/− IRP2−/−マウスにおけるIRP1量を顕著に減少させ、これによりIREへの結合を回復できるということを示唆している。
【0100】
総合すると、これらの結果は、テンポール処理による正常な鉄ホメオスタシスの回復がIRE結合構造へのIRP1の十分な量の変換によるものであるという結論をさらに支持する。
【0101】
本明細書中で引用した刊行物、特許出願、及び特許を含む全ての参考文献は、各参考文献が、本明細書中で参考として援用されることが個別におよび具体的に示され、かつその全体が記載されているのと同じ程度に、本明細書中で参考として援用される。本発明を記載する文脈において(特に、添付の特許請求の範囲の文脈において)、用語「a」及び「an」及び「the」及び同様の指示語の使用は、本明細書中で他に特に明記がない限り、又は文脈に明らかに矛盾しない限り、単数と複数の両方を包含するように解釈されるべきである。「含有する(comprising)」、「有する(having)」、「含む(including)」及び「含む(containing)」という用語は、他に特に明記がない限り、オープンエンドの用語(即ち、「〜を含むが、限定されない」ことを意味する)として解釈されるべきである。本明細書中での値の範囲の記載は、本明細書中で他に特に明記がない限り、その範囲内にある各々の別々の値を個々に言及する略記方法として働くことが単に意図され、そして各々の別々の値は、それが本明細書中で個々に列挙されているかのように本明細書中に含まれるものである。本明細書中に記載される全ての方法は、本明細書中で他に特に明記がない限り、または文脈に明らかに矛盾しない限り、任意の適切な順序で行われ得る。本明細書中で提供される任意及び全ての例、又は例示的な言葉(例えば、「などの」)の使用は、本発明をより良く明瞭にすることが単に意図され、そして他に特に主張されない限り、本発明の範囲を制限するものではない。本明細書中の如何なる言葉も、本発明の実施に必須なものとして主張されていない要素を示すと解釈されるべきではない。
【0102】
本発明の実施に関して、本発明者らが知っている最良の形態を含む、本発明の好適な実施態様を本明細書中に記載する。もちろん、それらの好適な実施態様のバリエーションは、上記の説明を読むと、当業者に明白となるであろう。本発明者らは、当業者が適宜このようなバリエーションを用いることを予想し、そして本発明者らは、本発明が本明細書中に具体的に記載されたものとは別の状態で実施されることを意図する。従って、本発明は、適用法によって許されるように、本明細書に添付の特許請求の範囲に列挙される主題の全ての改変物及び均等物を含む。さらに、その全ての可能なバリエーションにおける上記要素の任意の組合わせは、本明細書中で他に特に明記がない限り、又は文脈に明らかに矛盾しない限り、本発明に包含される。
【特許請求の範囲】
【請求項1】
神経変性を治療又は予防するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、神経変性疾患に罹患した哺乳動物において神経変性を治療又は予防する方法。
【請求項2】
哺乳動物の中枢神経系において生物学的に利用可能な鉄の量を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、中枢神経系(CNS)の鉄が欠乏している哺乳動物のCNSにおいて生物学的に利用可能な鉄の量を増加させる方法。
【請求項3】
哺乳動物において鉄調節タンパク質1(IRP1)を活性化するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてIRP1を活性化する方法。
【請求項4】
トランスフェリン受容体1(TfR1)発現を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてTfR1発現を増加させる方法。
【請求項5】
該安定なニトロキシドラジカルがテンポール又はそのヒドロキシルアミン類似体である、請求項1〜4のいずれかに記載の方法。
【請求項6】
該安定なニトロキシドラジカルがテンポール−Hである、請求項1〜5のいずれかに記載の方法。
【請求項7】
該哺乳動物が鉄調節タンパク質2(IRP2)機能を欠損している、請求項1〜6のいずれかに記載の方法。
【請求項8】
該哺乳動物がTfR1低発現である(under−expresses)、請求項1〜7のいずれかに記載の方法。
【請求項9】
該哺乳動物がCNSにおいて第二鉄の異常な蓄積により特徴付けられる神経変性疾患に罹患している、請求項1〜8のいずれかに記載の方法。
【請求項10】
該哺乳動物がパーキンソン病、アルツハイマー病、ハラーフォルデンシュパッツ症候群、無セルロプラスミン血症、難治性貧血、骨髄性プロトポルフィリア又は成人発症神経変性に罹患している、請求項1〜9のいずれかに記載の方法。
【請求項11】
該哺乳動物がヒトである、請求項1〜10のいずれかに記載の方法。
【請求項12】
さらに該哺乳動物に鉄サプリメント又は鉄高含有食を投与することを含む、請求項1〜11のいずれかに記載の方法。
【請求項1】
神経変性を治療又は予防するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、神経変性疾患に罹患した哺乳動物において神経変性を治療又は予防する方法。
【請求項2】
哺乳動物の中枢神経系において生物学的に利用可能な鉄の量を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、中枢神経系(CNS)の鉄が欠乏している哺乳動物のCNSにおいて生物学的に利用可能な鉄の量を増加させる方法。
【請求項3】
哺乳動物において鉄調節タンパク質1(IRP1)を活性化するのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてIRP1を活性化する方法。
【請求項4】
トランスフェリン受容体1(TfR1)発現を増加させるのに十分な量の安定なニトロキシドラジカルを哺乳動物に投与することを含む、哺乳動物においてTfR1発現を増加させる方法。
【請求項5】
該安定なニトロキシドラジカルがテンポール又はそのヒドロキシルアミン類似体である、請求項1〜4のいずれかに記載の方法。
【請求項6】
該安定なニトロキシドラジカルがテンポール−Hである、請求項1〜5のいずれかに記載の方法。
【請求項7】
該哺乳動物が鉄調節タンパク質2(IRP2)機能を欠損している、請求項1〜6のいずれかに記載の方法。
【請求項8】
該哺乳動物がTfR1低発現である(under−expresses)、請求項1〜7のいずれかに記載の方法。
【請求項9】
該哺乳動物がCNSにおいて第二鉄の異常な蓄積により特徴付けられる神経変性疾患に罹患している、請求項1〜8のいずれかに記載の方法。
【請求項10】
該哺乳動物がパーキンソン病、アルツハイマー病、ハラーフォルデンシュパッツ症候群、無セルロプラスミン血症、難治性貧血、骨髄性プロトポルフィリア又は成人発症神経変性に罹患している、請求項1〜9のいずれかに記載の方法。
【請求項11】
該哺乳動物がヒトである、請求項1〜10のいずれかに記載の方法。
【請求項12】
さらに該哺乳動物に鉄サプリメント又は鉄高含有食を投与することを含む、請求項1〜11のいずれかに記載の方法。
【図1】


【図2c】


【図2】


【図3a】


【図3b】


【図4】


【図4c】


【図4d】


【図4e】


【図4f】


【図5a】


【図5b】


【図5c】


【図6】


【図7】


【図7c】


【図7d】




【図2c】


【図2】


【図3a】


【図3b】


【図4】


【図4c】


【図4d】


【図4e】


【図4f】


【図5a】


【図5b】


【図5c】


【図6】


【図7】


【図7c】


【図7d】


【公表番号】特表2010−520888(P2010−520888A)
【公表日】平成22年6月17日(2010.6.17)
【国際特許分類】
【出願番号】特願2009−552929(P2009−552929)
【出願日】平成20年3月10日(2008.3.10)
【国際出願番号】PCT/US2008/056429
【国際公開番号】WO2008/112647
【国際公開日】平成20年9月18日(2008.9.18)
【出願人】(304048296)アメリカ合衆国 (18)
【Fターム(参考)】
【公表日】平成22年6月17日(2010.6.17)
【国際特許分類】
【出願日】平成20年3月10日(2008.3.10)
【国際出願番号】PCT/US2008/056429
【国際公開番号】WO2008/112647
【国際公開日】平成20年9月18日(2008.9.18)
【出願人】(304048296)アメリカ合衆国 (18)
【Fターム(参考)】
[ Back to top ]

