試料中のブドウ球菌のメチシリン耐性を試験する方法
【課題】 生きたメチシリン耐性ブドウ球菌のメチシリン耐性を迅速に判定するために、mecA mRNAの迅速かつ高感度な検出方法を提供する。
【解決手段】 試料中のメチシリン耐性ブドウ球菌に由来するmecA mRNAを、(1)前記ブドウ球菌をβ−ラクタム系抗生物質存在下でインキュベートして誘導する工程、(2)続いて、前記ブドウ球菌からmecA mRNAを抽出する工程、(3)抽出されたmecA mRNAを増幅し検出する工程、からなる方法により検出する。同時に、mecA mRNAを高効率に増幅するためのプライマーセットを提供する。
【解決手段】 試料中のメチシリン耐性ブドウ球菌に由来するmecA mRNAを、(1)前記ブドウ球菌をβ−ラクタム系抗生物質存在下でインキュベートして誘導する工程、(2)続いて、前記ブドウ球菌からmecA mRNAを抽出する工程、(3)抽出されたmecA mRNAを増幅し検出する工程、からなる方法により検出する。同時に、mecA mRNAを高効率に増幅するためのプライマーセットを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ブドウ球菌のメチシリン耐性を迅速かつ高感度に判定するために、メチシリン耐性ブドウ球菌のメチシリン耐性遺伝子(mecA) mRNAを簡便、迅速、かつ高感度に測定する方法を提供する。したがって、本発明は、医学分野における感染症の診療において、ブドウ球菌等の薬剤感受性の試験、予防及び感染拡大防止のための薬剤感受性菌のモニタリング、薬剤感受性菌の治療効果モニタリング、さらには抗菌薬投与の指標のために有用である。また、微生物学、分子生物学、及び生化学などの分野における、薬剤耐性試験、薬剤耐性機構の解析、抗菌薬スクリーニング及びmecAの発現解析のために有用である。
【背景技術】
【0002】
メチシリン耐性黄色ブドウ球菌(MRSA)は、メチシリン耐性に係わる遺伝子mecAを獲得した黄色ブドウ球菌であり、幅広い抗生物質に対する耐性を示す。mecAは、PBP(Penicillin−Binding Protein)−2’(PBP−2aとも呼ばれる)をコードする。通常、MRSA以外の黄色ブドウ球菌は、主として4種のPBP−1〜4を産生する。PBPは、細胞壁のペプチドグリカン合成のペプチド転移反応に係わるプロテアーゼ活性を有し、細胞壁合成に関与する。β−ラクタム系抗生物質は、PBPの活性部位に結合して前記活性を不活化するが、特に細胞増殖に必須なPBP−1〜3に対して強い親和性を有する。一方、PBP−2’は、β−ラクタム系抗生物質との親和性が低いため、PBP−2’産生菌以外のブドウ球菌に対しては致死的な量のβ−ラクタム系抗生物質が存在しても、細胞増殖に必須な前記活性を補完することが可能である(非特許文献1及び2)。
【0003】
MRSAは院内感染の主要な病原菌で、治療薬の切り札的存在とみなされているバンコマイシンに対しても耐性を示す菌株も検出されている(非特許文献3)。特に、高齢者や新生児など、抵抗力が低い易感染者に対する感染は依然として深刻な問題となっている。また、以前は、MRSAが病院等の施設から市中に出ても、健常者にはほとんど感染しないと考えられていた。しかし、1980年代に市中で感染を起こす市中感染型MRSA(Community−Associated MRSA、CA−MRSA)が報告されて以来、CA−MRSAは増加傾向にあり、さらに小児の肺炎、敗血症で死亡例が報告されるなど、公衆衛生上の大きな問題になっている(非特許文献4)。
【0004】
一般に、黄色ブドウ球菌はコアグラーゼ陰性ブドウ球菌より強病原性といわれるためブドウ球菌の中でMRSAが重要視される傾向はあるが、表皮ブドウ球菌などのコアグラーゼ陰性ブドウ球菌の中で前記mecA遺伝子を獲得したメチシリン耐性コアグラーゼ陰性ブドウ球菌(MR−CNS)についても、易感染者に対する感染が重要視されるようになってきた(非特許文献5)。メチシリン耐性ブドウ球菌の院内感染や市中感染への対策として、鼻咽頭への定着菌の除菌、菌保有者の隔離、及び抗菌薬の選定等を迅速に実施する必要がある。そのため、臨床現場においては、診断、治療及び予防を目的として、簡便・迅速なメチシリン耐性菌の検出が望まれてきた。
【0005】
メチシリン耐性を試験する方法としては、培養による薬剤感受性試験、mecAがコードするPBP−2'を抗PBP−2'抗体を用いたイムノアッセイで検出する方法、mecA又はmecAと連鎖するDNAをPCRで増幅して検出する方法などが実施されている。
【0006】
【特許文献1】特許第3735400号
【特許文献2】特開平6−165681号
【特許文献3】特表2004−534537号
【特許文献4】特許第2650159号
【特許文献5】特許第3152927号
【特許文献6】特許第3241717号
【特許文献7】特開2000−14400号
【特許文献8】特開2001−37500号
【特許文献9】特開2001−353000号
【特許文献10】特開2001−333783号
【非特許文献1】Chanbers,H.F.(1997)Clin.Microbiol.Reviews,10(4),781−791.
【非特許文献2】Stepleton,P.D. and Taylor,P.W.(2002)Sci.Prog.,85(Pt1),57−72.
【非特許文献3】Weigel,L.M.,et al.(2003)Science,302,1569−1571.
【非特許文献4】山本 達男 他(2008)モダンメディア,54(3),95−103.
【非特許文献5】辺 夏蓮 他(2008)臨床病理,56,955−960.
【非特許文献6】Murakami,K.,et al.(1991)J.Clin.Microbiol.,29(10),2240−2244.
【非特許文献7】Ito,T.,et al.(2007)Methods Mol.Biol.,391,87−102.
【非特許文献8】Huletsky,A.,et al.(2004)J.Clin.Microbiol.,42(5),1875−1884.
【非特許文献9】Grisold,A.J.,et al.(2002)J.Clin.Microbiol.,40(7),2392−2397.
【非特許文献10】Farly,J.E.,et al.(2008)J.Clin.Microbiol.,46(2),743−746.
【非特許文献11】Ishiguro,T.,et al.(2003)Anal. Biochem.,314,1247−1252.
【非特許文献12】Weller,T.M.(1999)J.Antimicrob.Chemother.,43,15−22.
【発明の開示】
【発明が解決しようとする課題】
【0007】
薬剤感受性試験については、使用する薬剤や試験方法により判定がばらつくという問題が指摘されている。また、イムノアッセイによるPBP−2'の検出は、感度が十分ではなく、他法と乖離するという問題点が指摘されている(非特許文献5)。加えて、薬剤感受性試験やイムノアッセイは、いずれも検体の採取から判定まで48時間以上を要し、院内感染や市中感染における感染者の隔離や投与薬の選定などで迅速な対応を求められる臨床現場への適用のために十分な性能とはいえなかった。一方、mecA又はmecAと連鎖する遺伝子をPCRで増幅して検出する方法(特許文献1〜3、非特許文献6〜10)の中には、数時間で検出可能な方法もあるが、PCRは、原則的に熱変性、プライマー・アニール、伸長反応からなる急激な温度サイクルを必要とし、システム化を考える場合に簡素化及び低コスト化のための大きな障壁となっていた。さらに、mecAは宿主の染色体DNA上にあるが、DNAは一般に安定で、ブドウ球菌が死滅しても試料中に長時間にわたり存在し続けることが知られている。したがって、DNAを標的とするPCRの場合、臨床的には意味のない死菌を検出してしまうという問題点がある。これに対し、RNAはDNAに比して不安定であり、とりわけmRNAは菌が死ぬと速やかに分解されるため、mRNAを標的とした場合は生菌を反映した結果が得られることが知られている。したがって、臨床的に意味のある、死滅していないブドウ球菌のメチシリン耐性を迅速・高感度に試験するためには、mecA mRNAを検出することが最も有効であるといえる。
【0008】
mRNAを検出する方法としては、RT−PCR(Reverse Transcription−Polymerase Chain Reaction)を核酸増幅法として用いる方法が汎用されている。該増幅法は、通常、mRNAを抽出後、抽出したRNAから逆転写酵素によりcDNAを合成する工程、及び、該cDNAをPCRで増幅し検出する工程、と二段階の工程(場合によってはさらに検出工程を別個に実施する必要がある)が必要であるため、操作の煩雑性や煩雑さに伴う二次汚染の危険性及び再現性の不良が問題とされる。また、前記薬剤感受性試験よりは迅速であるものの、前記二段階の工程を実施するのに通常2〜3時間以上が必要であり、複数の工程の実施による再現性不良、多数検体処理や検査コストの削減の点で問題があった。反応時間短縮のため、前記二工程を同時に行うワンステップRT−PCR法も開発されているが、各工程を別個に行うRT−PCR法に比べて検出感度の低下や非特異的増幅産物が産生されやすいことなどが指摘されている。さらに、PCR法による増幅は2本鎖DNAを増幅するため、混入する染色体DNAを増幅してしまう可能性があり、厳密にmRNAのみを検出するためにはDNase等による消化を行い染色体DNAを完全に除く必要があった。このため、操作の更なる煩雑化や再現性不良を招いていた。
【0009】
一方、一定温度でRNAのみを増幅する方法として、NASBA法(特許文献4及び5)、TMA法(特許文献6)及びTRC法(特許文献7及び8、非特許文献11)などが報告されている。これらのRNA増幅方法は、標的となるRNAに対してプロモーター配列を含むプライマー、逆転写酵素及び必要に応じてリボヌクレアーゼH(RNaseH)により、プロモーター配列を含む2本鎖DNAを合成し、この2本鎖DNAを鋳型としRNAポリメラーゼによって標的RNA由来の特定塩基配列を含むRNAを生産し、このRNAが引き続きプロモーター配列を含む2本鎖DNA合成の鋳型となる連鎖反応を行うものである。そして、RNA増幅後、電気泳動または検出可能な標識を結合させた核酸プローブを用いたハイブリダイゼーション法などにより増幅されたRNAを検出する。
【0010】
前記RNA増幅法は一定温度、一段階でRNAのみを増幅することから簡便なRNA測定に適しているが、通常、NASBA法やTMA法ではその実施に90分以上必要であり、迅速な結果を得るに至っていない。さらに、増幅工程は一定温度であるものの、通例は増幅工程前に変性のための加温(例えば、65℃)が必要であり(特許文献5実施例1及び特許文献6実施例1に記載)、反応装置の省力化や低コスト化のための課題となっていた。
【0011】
一定温度、一段階でRNAを増幅・測定する方法として、TRC法(特許文献7〜9、非特許文献11)が挙げられる。当該方法は、インターカレーター性蛍光色素で標識され、標的核酸と相補的に2本鎖を形成するとインターカレーター性蛍光色素部分が前記2本鎖部分にインターカレートすることによって、蛍光特性が変化するように設計されたオリゴヌクレオチドプローブ存在下、前記RNA増幅法を実施し、蛍光特性の変化を測定するもので、プライマーなどの結合領域を標的RNAの(二次構造を計算して推定した)高次構造フリー領域に設定することで、一定温度、一段階かつ密閉容器内でRNA増幅及び測定を、同時にかつ迅速(30分以内)、簡便に実施することが可能である(非特許文献11)。このRNA増幅測定法は、前記mRNA検出法の中で、迅速性、簡便性、信頼性の点から、特に好適な方法といえる。ただし、該RNA増幅測定法は、比較的一定の低温度(35〜60℃)で実施され、変性工程を伴わないため、標的RNAの高次構造の影響だけでなく、プライマーダイマー等の非特異的増幅の影響も受けやすいため、そのプライマーセットの設計には細心の配慮が必要で、汎用されているPCRプライマー用の設計手法では不十分なことが明らかである。
【0012】
TRC法におけるmecA mRNA増幅測定方法のために設計されたプライマーの一例が特許文献9及び10に開示されている。しかし、本発明者は、メチシリン耐性ブドウ球菌が抗生物質のプレッシャーのない条件に生育した場合、mecA mRNAをほとんど発現しない場合があることを見出した。このような場合には、このプライマーセットとmecA mRNA検出に有効なTRC法によっても、検出は困難である。
【課題を解決するための手段】
【0013】
本発明者は、上記課題を解決すべく鋭意研究を重ねた結果、試料中のブドウ球菌のメチシリン耐性を試験するための改良された方法を完成した。すなわち、本発明は、試料中のブドウ球菌のメチシリン耐性を試験する方法であって、(1)前記試料にβ−ラクタム系抗生物質を添加する工程、(2)前記試料からmRNAを含む核酸を抽出する工程、(3)抽出した核酸中のmecA mRNAを増幅し検出する工程、からなることを特徴とする、試料中のブドウ球菌のメチシリン耐性を試験する方法である。
【0014】
本発明におけるmecA mRNAを増幅し検出する工程は、好ましくは(1)mecA mRNA中の特定塩基配列の一部と相補的な配列を有する第二のプライマー(DNA)が前記mRNAにハイブリダイズし、RNA依存性DNAポリメラーゼ活性を有する酵素により、特定塩基配列に相補的なcDNAを合成し、前記mRNAとのRNA−DNA2本鎖を生成する工程、(2)リボヌクレアーゼH(RNaseH)活性を有する酵素により、前記RNA−DNA2本鎖のRNAを分解して1本鎖DNAを生成する工程、(3)該1本鎖DNAに、前記特定塩基配列の一部と相同的な配列を有する第一のプライマー(DNA)がハイブリダイズし(ここで前記第二または第一のプライマーのいずれか一方はその5’末端にRNAポリメラーゼのプロモーター配列が付加されてなる)、DNA依存性DNAポリメラーゼ活性を有する酵素により、前記特定塩基配列または前記特定塩基配列に相補的な配列のRNAを転写可能な、プロモーター配列を含む2本鎖DNAを生成する工程、(4)RNAポリメラーゼ活性を有する酵素により前記2本鎖DNAを鋳型とする前記RNAを転写する工程(ここで、該RNAは、前記(1)の反応におけるcDNA合成の鋳型となることで、連鎖的にRNA転写産物が生成される)及び、(5)前記転写されたRNAを検出する工程、からなることを特徴とする。
【0015】
本発明においては、好ましくは、前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなるオリゴヌクレオチドであることを特徴とする。なお、配列番号1で示された塩基配列は、GenBank No.Y00688の5’端982番のCから1006番のAまでの配列部分に相補的な塩基配列である。配列番号2で示された塩基配列は、GenBank No.Y00688の5’端1176番のTから1196番のTまでの配列部分に相同的な塩基配列である。配列番号3で示された塩基配列は、GenBank No.Y00688の5’端1178番のTから1198番のAまでの配列部分に相同的な塩基配列である。配列番号4で示された塩基配列は、GenBank No.Y00688の5’端1172番のAから1192番のCまでの配列部分に相同的な塩基配列である。
【0016】
本発明における前記転写されたRNAを検出する工程は、好ましくは、検出されるべきRNA(標的RNA)と相補的な2本鎖を形成すると蛍光特性が変化するように設計された蛍光色素標識オリゴヌクレオチドプローブ共存下で当該蛍光特性の変化を測定することによってなされる。この蛍光色素標識オリゴヌクレオチドプローブは、好ましくは、配列番号5に示された配列又はその相補的配列にストリンジェントな条件でハイブリダイズ可能である配列からなることを特徴とする。なお、配列番号5で示された塩基配列は、GenBank No.Y00688の5’端1068番のAから1049番のCまでの配列部分に相補的な塩基配列である。
【0017】
より好ましくは、本発明における配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号7〜9で示された配列のいずれか一以上であることを特徴とする。
【0018】
また本発明は、mecA mRNAを増幅するための第一のプライマー及び第二のプライマーからなるプライマーセットであって、前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであることを特徴とする。
【0019】
より好ましくは、本発明のプライマーセットにおける配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号7〜9で示された配列のいずれか一以上であることを特徴とする。
【0020】
以下、本発明を詳細に説明する。
【0021】
本発明中の試料とは、鼻腔及び咽頭等のぬぐい液、血液、その他の分泌液、体液、組織洗浄液、液体培地及び寒天培地で培養した菌株である。本発明が試験の対象とするブドウ球菌とは、スタフィロコッカス属に属する菌種である。もっとも主要で臨床的にも重要な菌種としては、コアグラーゼ陽性の黄色ブドウ球菌とコアグラーゼ陰性の表皮ブドウ球菌が挙げられるが、特に限定されるものでない。本明細書では、これらを単にブドウ球菌と記載し、特に必要がある場合を除いて区別しない。
【0022】
本発明は、試料にβ−ラクタム系抗生物質を添加し、試料中のブドウ球菌にβ−ラクタム系抗生物質を接触させることでmecA mRNAの発現を誘導するという構成に特徴を有する。この構成により、ブドウ球菌が増殖する条件やタンパク質を過剰に生産する条件で試料中のブドウ球菌をインキュベートする必要はなくなり、インキュベートに要する時間やブドウ球菌の増殖を待つ時間を省くことを可能としている。実施例に記載した形態では、本発明は30分程度で実施可能である。PBP−2’の誘導には48時間以上のインキュベートが必要である(非特許文献2及び5)ことと比較すると、わずか30分でメチシリン耐性を試験可能とする本発明は、メチシリン耐性ブドウ球菌のメチシリン耐性を迅速かつ高感度に試験するという、臨床の現場の要請に応えるものである。
【0023】
β−ラクタム系抗生物質は、メチシリン類似の抗生物質であれば制限はない。例えば、β−ラクタム構造を有する抗生物質で、ペニシリン系及びセフェム系に属する抗生物質が例示できるが、比較的低濃度でもmecA mRNAの誘導が可能な、メチシリン、オキサシリン、クロキサシリン又はジクロキサシリンなどのメチシリン類似のペニシリン系抗生物質から選ばれた少なくとも1つの抗生物質が好ましい。β−ラクタム系抗生物質を添加した後には、試料を適当に加温してmecA mRNAの発現を誘導することが好ましい。なお、試料それ自体がブドウ球菌のmecA mRNAの発現に不適当である場合には、ブドウ球菌が生育可能な液体培地に試料を添加するようにしても良い。なお、本発明では、この工程にてmecA mRNAの発現を誘導できれば良いので、ブドウ球菌が増殖する条件やタンパク質を過剰に生産する培地、条件を採用する必要はない。β−ラクタム系抗生物質と接触させる時間は特に限定されないが、本発明ではブドウ球菌を増殖する必要がないため、30分程度で実施可能である。
【0024】
核酸を抽出する工程は、mRNAを含む核酸を抽出できる、既知の方法が採用可能であり、特に限定されるものではない。RNAのみを分離・精製する方法である必要はないが、好ましくは、引き続き実施するmecA mRNAの増幅と検出を阻害しない程度に純度の高いmRNAが得られれば良い。この核酸を抽出する工程においては、実際の抽出操作に先立って、試料中のブドウ球菌を溶菌酵素と接触させておくことが好ましい。溶菌酵素は、細胞壁構成成分を分解する作用を有する酵素ならば特に限定されないが、汎用されている、リゾチーム、アクロモペプチダーゼ、ラビアーゼ、リソスタフィン、ムタノリシンなどから選ばれた少なくとも1つの酵素であることが好ましい。
【0025】
mecA mRNAを増幅し検出する工程では、RT−PCR、RT−LAMP、NASBA、TMA、TRCなどのRNAの増幅法が使用可能であり、特に限定されないが、混入する染色体DNAの影響を受けず、迅速な試験のために一定温度で実施可能なRNA増幅法であるNASBA、TMA、TRCが特に好ましい。また当該工程では、既知の核酸検出方法が使用可能であるが、ハイブリダイズすることによって蛍光特性が変化するように設計された蛍光物質標識プローブを使用することが好ましい。該蛍光物質標識プローブとしては、FRET(蛍光共鳴エネルギー移動)を利用した蛍光標識プローブやインターカレーター標識プローブなどが挙げられる。前記mecA mRNAを増幅し検出する工程における最も好適な方法は、前記したTRCにおける一定温度、一段階でのRNAの増幅工程において、mecA mRNAの増幅と同時に増幅されたmecA RNA(特定塩基配列)をモニタリングできるインターカレーター標識プローブ(特許文献9及び非特許文献11)の使用である。
【0026】
本発明の好ましいmecA mRNAを増幅し検出する工程では、mecA mRNA中の特定塩基配列を増幅し検出するが、この特定塩基配列とは、mecA mRNAを他のRNAから識別し得る程度に特徴的な配列であって、mecA mRNAの塩基配列の中で、第一のプライマーとの相同領域の5’末端から第二のプライマーとの相補領域の3’末端までの塩基配列に相当するRNAまたはDNAの塩基配列を示す。言い換えれば、第一及び第二のプライマーは、前記したような特徴的な配列の前後に存在する、これもまたmecA mRNAを他のRNAから識別し得る程度に特徴的な配列に対してデザインされる。
【0027】
本発明中のストリンジェントな条件とは特に限定されるものではなく、通常の状態と比較してDNA同士又はDNAとRNAが二重鎖を形成し難い条件をいうが、例えば、42℃で50%(v/v)ホルムアミド、0.1%ウシ血清アルブミン、0.1%フィコール、0.1%のポリビニルピロリドン、50mMリン酸ナトリウムバッファー(pH6.5)、150mMの塩化ナトリウム及び75mMクエン酸ナトリウムが共存する条件等が挙げられる。本明細書中で単にハイブリダイズすると記載した場合、ストリンジェントな条件でハイブリダイズすることを意味するものである。なお、該条件におけるハイブリダイゼーションの十分な特異性や効率が得られる範囲内で、塩基の置換、欠失、付加、修飾等が可能であり、長さも任意に設定できることはいうまでもない。
【0028】
本発明では、第一のプライマーは配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなるオリゴヌクレオチドであることが好ましい。より具体的には、配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号6で示された配列、又は、配列番号6の少なくとも連続する15塩基からなる配列を例示することができる。配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号7〜9で示された配列、又は、配列番号7〜9の少なくとも連続する15塩基からなる配列のいずれか一以上であることを例示できる。
【0029】
mecA mRNA中の特定塩基配列の一部と相補的な配列を有する第二のプライマー(DNA)がmecA mRNAにハイブリダイズすると、RNA依存性DNAポリメラーゼ活性を有する酵素により、特定塩基配列に相補的なcDNAが合成され、mecA mRNAとのRNA−DNA2本鎖が生成する。この2本鎖はヘテロなものであることから、リボヌクレアーゼH(RNaseH)活性を有する酵素により、RNAは分解され、結果的に1本鎖DNAが生成することになる。この1本鎖DNAに、前記特定塩基配列の一部と相同的な配列を有する第一のプライマー(DNA)がハイブリダイズすると、DNA依存性DNAポリメラーゼ活性を有する酵素により、前記特定塩基配列または前記特定塩基配列に相補的な配列のRNAを転写可能な、プロモーター配列を含む2本鎖DNAが生成される。第二のプライマーがその5’端にRNAポリメラーゼのプロモーター配列を有する場合、当該2本鎖DNAは前記特定塩基配列に相補的な配列のRNAを転写可能なものとなり、第一のプライマーがその5’端にRNAポリメラーゼのプロモーター配列を有する場合、当該2本鎖DNAは前記特定塩基配列に相同的な配列のRNAを転写可能なものとなる。プロモーター配列は既知のものなら特に限定されないが、分子生物学の分野で汎用されるバクテリアファージ由来の、T7 RNAポリメラーゼ、T3 RNAポリメラーゼ、SP6 RNAポリメラーゼなどを使用することができる。
【0030】
RNAポリメラーゼ活性を有する酵素は、上記のようにして生成した2本鎖DNAを鋳型としてRNAを転写するが、該RNAは、最初の工程におけるcDNA合成の鋳型となるため、連鎖的にRNA転写産物が生成されることになる。
【0031】
RNA依存性DNAポリメラーゼ活性を有する酵素、リボヌクレアーゼH(RNaseH)活性を有する酵素、及びDNA依存性DNAポリメラーゼ活性を有する酵素は、それぞれ別個又は種々の組合せで添加することもできるが、前記活性を併せ持つレトロウイルス由来の逆転写酵素を使用することもできる。該逆転写酵素は特に限定されないが、分子生物学の分野で汎用される、AMV(Avian Myeloblastosis Virus)逆転写酵素、MMLV(Molony Murine Leukemia Virus)逆転写酵素、RAV(Rous Associated Virus)逆転写酵素、HIV(Human Immunodeficiency Virus)逆転写酵素などが使用可能である。
【0032】
以上のようにして転写されたRNAを検出することにより、試料中のブドウ球菌のメチシリン耐性を試験することができるが、この検出には、例えば検出されるべきRNA(標的RNA)と相補的な2本鎖を形成すると蛍光特性が変化するように設計された蛍光色素標識オリゴヌクレオチドプローブを使用することが提示できる。中でも、その共存下で前記増幅、検出の工程を実施可能なプローブを使用することが特に好ましい。その共存下で増幅、検出の工程を実施することが可能であれば、増幅を行いつつ、試料からの蛍光特性の変化を測定することによる検出を同時に実施して、リアルタイムモニタリングを実現できるからである。このような蛍光物質標識プローブとして、特に、インターカレーター性蛍光色素を適当なリンカーを介してオリゴヌクレオチドプローブと結合したインターカレーター性蛍光色素標識オリゴヌクレオチドプローブを使用することが好ましい。インターカレーター性蛍光色素は2本鎖核酸にインターカレートし、蛍光増感を示すものであれば特に限定されないが、分子生物学分野で汎用されるオキサゾールイエロー、チアゾールオレンジ、エチジウムブロミド、及びこれらの誘導体が例示できる。これらは、適当な官能基を導入してリンカーと結合して使用すれば良い。オリゴヌクレオチドプローブは、好ましくは配列番号5に示された配列、又はその相補配列にハイブリダイズ可能な配列からなることが好ましい。更にオリゴヌクレオチドプローブは、前記増幅工程に共存させた場合にDNAポリメラーゼの作用によってその3’末端からの伸長が起きないようにするため、そのOH基を修飾しておくことが好ましい。修飾の手段としては、汎用されている既知の末端修飾であるグリコール酸付加、ビオチン化、アミノ化などが挙げられる。
【0033】
本発明のmecA mRNAを増幅し検出する工程において、第一のプライマーの5’末端にプロモーター配列を付加した場合は、mecA mRNA中の特定塩基配列の5’末端領域で当該mRNAをトリミングすることが好ましい。該トリミングの手段としては、既知の特異的核酸切断法が利用可能であり、特に限定されるものではないが、前記mRNA中の特定塩基配列5’末端領域及びその5’末端のさらに5’末端側に隣接する領域に対してハイブリダイズするオリゴヌクレオチド(DNA)(切断オリゴと呼ぶ)と、RNaseH活性を有する酵素を使用することが例示できる。前記特定塩基配列5’末端領域及びその5’末端に隣接する領域の長さは特に限定されないが、特定塩基配列の5’末端領域は5〜20塩基、その5’末端に隣接する領域は5〜50塩基が好ましい。例えば、第一のプライマーが配列番号1で示された塩基配列にハイブリダイズ可能な配列からなる場合、切断オリゴとして配列番号10に示された配列中の少なくとも連続する15塩基よりなる配列を使用することが例示できる。切断オリゴは、mecA mRNAにハイブリダイズしてRNA−DNA2本鎖を形成するため、RNaseH活性を有する酵素によってRNA部分が消化され、結果としてmecA mRNAの特定塩基配列5’末端付近で切断される。引き続き、RNA依存性DNAポリメラーゼ活性によるcDNA合成が行われると、該cDNAの3’末端が規定され、当該cDNAの3’末端領域に第一のプライマーがハイブリダイズした際に、DNA依存性DNAポリメラーゼ活性によるプロモーター(2本鎖DNA)構造の構築が可能となる。
【0034】
本発明は、前記したmecA mRNAの増幅工程で使用することのできる、mecA mRNAを高効率に増幅するための第一及び第二のプライマーのセットであって、第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであり、第二のプライマーが配列番号2〜4から選ばれた塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドである。より具体的には、配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号6で示された配列、又は、配列番号6の少なくとも連続する15塩基からなる配列を例示することができる。配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号7〜9で示された配列、又は、配列番号7〜9の少なくとも連続する15塩基からなる配列のいずれか一以上であることを例示できる。
【発明の効果】
【0035】
本発明では、試料にβ−ラクタム系抗生物質を添加し、試料中のブドウ球菌にβ−ラクタム系抗生物質を接触させてmecA mRNAの発現を誘導するという構成を採用したことで、メチシリン耐性であるにもかかわらず抗生物質のプレッシャーのない条件に生育したためにmecA mRNAをほとんど発現しないという菌であっても、確実に検出することが可能である。
【0036】
本発明は、mecA mRNAの増幅工程を低温度(35〜60℃)かつ一定で行うことができ、また好ましくインターカレーター性蛍光色素標識オリゴヌクレオチドプローブ等を使用することによって検出の工程を前記増幅工程と同時に実施することができるため、昇温、下温を繰り返すために要する時間や変性処理に要する時間、更には増幅後に別途検出を行う時間等を省き、実施例に記載したように、30分という極めて短時間の内に、迅速に実施をすることが可能である。しかも、mRNAの検出によりメチシリン耐性を試験するため、死滅していないブドウ球菌のメチシリン耐性を試験することができる。
【発明を実施するための最良の形態】
【0037】
以下、本発明を実施例により具体的に説明するが、これらは一例であり、本発明はこれら実施例により限定されるものではない。
【実施例1】
【0038】
プライマーセットの決定
以下の実施例で使用した標準RNAはGenBank Accession No.Y00688として登録された配列の1番目〜2013番目を含む精製RNAであり、260nmにおける吸光度から分子数(コピー数)を計算したものである。
以下の実施例で使用したインターカレーター標識プローブは、配列番号5からなり、5’末端から6番目のGと7番目のAの間のリン酸ジエステルにリンカーを介してオキサゾールイエローを結合させた図1に示した構造を有する。
(1)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI社製)に分注し、これに、0コピー、30コピー、及び10^6コピーの前記RNAを含有する試料5μLを添加した。
【0039】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12、特開2009−017824において配列番号13として開示された配列の5’端1番のAから28番のAまでの配列部分に相同的な配列)が付加されている。なお、配列番号6で示された塩基配列は、GenBank No.Y00688の5’端982番のCから1006番のAまでの配列部分に相同的な塩基配列であり、配列番号1の配列と相補的である)
1.5μM 第二のプライマー(配列番号7、8、9、11より選ばれたプライマー、なお配列番号7で示された塩基配列は、GenBank No.Y00688の5’端1176番のTから1196番のTまでの配列部分に相補的な塩基配列であり、配列番号2の配列と相補的である、配列番号8で示された塩基配列は、GenBank No.Y00688の5’端1178番のTから1198番のAまでの配列部分に相補的な塩基配列であり、配列番号3の配列と相補的である、配列番号9で示された塩基配列は、GenBank No.Y00688の5’端1172番のAから1192番のCまでの配列部分に相補的な塩基配列であり、配列番号4の配列と相補的である、配列番号11で示された塩基配列は、GenBank No.Y00688の5’端1156番のAから1173番のAまでの配列部分に相補的な塩基配列である)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。なお、配列番号10で示された塩基配列は、GenBank No.Y00688の5’端938番のAから986番のAまでの配列部分に相補的な塩基配列である)
30nM インターカレーター標識プローブ(配列番号5)
6ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0040】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、増加を示さなかった場合を陰性判定とした。当該検出時間は、増幅効率や標的RNAコピー数と相関するため、以降の図において、検出時間が小さいほど、増幅効率が高い、又はRNAコピー数が高いことを示す。各種プライマーセットを用い、前記試料を測定した場合の検出時間を図2に示した。ここで、第一のプライマー(配列番号6)及び第二のプライマー(配列番号11)からなるプライマーセット(図中の6−11)は特許文献9に開示されたものである。図2から、第一のプライマー(配列番号6)及び第二のプライマー(配列番号7)のプライマーセット(図中の6−7)、第一のプライマー(配列番号6)及び第二のプライマー(配列番号8)のプライマーセット(図中の6−8)、第一のプライマー(配列番号6)及び第二のプライマー(配列番号9)のプライマーセット(図中の6−9)のそれぞれを用いた場合、前記6−11より検出時間が顕著に迅速化しており、既知のプライマーセットである前記6−11に比べて、本発明のプライマーセット(6−7、6−8、6−9)を用いると増幅効率が向上することが示された。該6−7、6−8、6−9間では著しい差は認められないものの、中でも6−7は最も検出時間が短く、最も機能的であると考えられた。
【実施例2】
【0041】
抗生物質非存在下におけるmecA mRNA発現の検討
β−ラクタム系抗生物質非存在下で生育したMRSA(ATCC 700699及びATCC 33592)のmecA mRNA発現量を解析することとした。
(1)MRSA(ATCC 700699及びATCC 33592)を、血液寒天培地(β−ラクタム系抗生物質非添加)及びMRSA分離用寒天培地(セフェム系抗生物質含有)で培養した(37℃、一夜)。
(2)コロニーを釣菌し、10mM Tris(pH8)−1mM EDTA中に懸濁し、10倍希釈系列を調製した。なお、希釈系列の50μLをMRSA分離用寒天培地にまいて(37℃、一夜)colony formation unit(cfu)も計測した。
(3)前記希釈系列100μLをとり、アクロモペプチダーゼ(和光純薬社製)を添加し(終濃度0.5units/μL)、37℃、10分間インキュベートした。
(4)これに、メーカープロトコールに従って、Isogen−LS(ニッポンジーン社製)を添加し、RNA抽出を行った。
(5)得られたRNAのペレットを50μLの10mM Tris(pH8)−1mM EDTA(TE)に溶解し、RNA試料とした。
(6)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI製)に分注し、これに、前記RNA試料5μLを添加した。
【0042】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12)が付加されている。)
1.5μM 第二のプライマー(配列番号7)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。)
30nM インターカレーター標識プローブ(配列番号5)
6.0ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0043】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、増加を示さなかった場合を陰性判定とした。前記希釈系列由来のRNA試料を測定した場合の検出時間を図3(ATCC 33592の結果をAに、ATCC 700699の結果をB)に示した。また、検出感度を調べるために、図3中のブロック矢印の点に相当するRNA試料の2倍希釈系列を調製し、測定した結果を図4に示した。図3から、ATCC 33592及びATCC 70069は、いずれも、β−ラクタム系抗生物質有りに比べて無しの方が、1LOG〜2LOG程度低cfu側にシフトし、すなわち、RNA発現量が1/10〜1/100程度であった。さらに、図4から、前記株の検出感度は、β−ラクタム系抗生物質有りに比べて無しの方が20〜70倍程度不良であった。すなわち、mecA mRNA検出において、MRSAであっても抗生物質のプレッシャーのない条件で生育した菌株の中には、mecA mRNAの発現量が低く、高感度に検出できないものがあることが示唆された。
【実施例3】
【0044】
mecA mRNAの誘導の検討(1)
β−ラクタム系抗生物質非存在下で生育したMRSA(ATCC 33592)を、核酸抽出に先立ってβ−ラクタム系抗生物質存在下でインキュベートすることによって、mecA mRNA発現量を誘導できるか検討することとした。
(1)MRSA(ATCC 33592)を、血液寒天培地(β−ラクタム系抗生物質非添加)で培養した(37℃、一夜)。
(2)コロニーを釣菌し、終濃度10μg/mLオキサシリン(和光純薬社製)添加又はオキサシリン非添加トリプチケース・ソイ ブロス(ベクトン・ディッキンソン社製)中に懸濁した。各々の懸濁液から前記ブロスを用いて、それぞれ10倍希釈系列(オキサシリン添加又はオキサシリン非添加)を調製し、37℃で30分間インキュベートした。なお、インキュベート後、希釈系列の50μLをMRSA分離用寒天培地にまいて(37℃、一夜)colony formation unit(cfu)も計測した。
(3)前記希釈系列100μLをとり、アクロモペプチダーゼ(和光純薬社製)を添加し(終濃度0.5units/μL)、37℃、10分間インキュベートした。
(4)これに、メーカープロトコールに従って、Isogen−LS(ニッポンジーン社製)を添加し、RNA抽出を行った。
(5)得られたRNAのペレットを50μLの10mM Tris(pH8)−1mM EDTAに溶解し、RNA試料とした。
(6)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI製)に分注し、これに、前記RNA試料5μLを添加した。
【0045】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12)が付加されている。)
1.5μM 第二のプライマー(配列番号7)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。)
30nM インターカレーター標識プローブ (配列番号5)
6.0ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0046】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
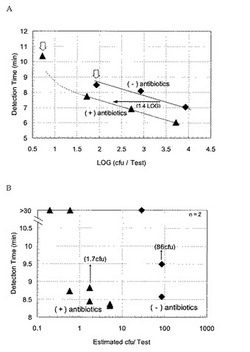
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、増加を示さなかった場合を陰性判定とした。前記希釈系列由来のRNA試料を測定した場合の検出時間を図5Aに示した。また、検出感度を調べるために、図5中のブロック矢印の点に相当するRNA試料の3倍希釈系列を調製し、測定した結果を図5Bに示した。図5Aから、オキサシリン含有ブロスでインキュベートしたものはオキサシリン非添加の場合より、1.4LOG程度高cfu側にシフトし、RNA発現量が20倍以上に誘導されたと考えられた。さらに、図5Bから、検出感度は、オキサシリン含有ブロスでインキュベートした方がオキサシリン非添加に比べて、50倍程度向上した。すなわち、抗生物質のプレッシャーのない条件で生育したMRSAであっても、β−ラクタム系抗生物質存在下で、30分間インキュベートすれば、mecA mRNAの発現を誘導することが可能であり、結果として、メチシリン耐性菌を高感度に検出可能であることが示された。
【実施例4】
【0047】
mecA mRNAの誘導の検討(2)
β−ラクタム系抗生物質非存在下で生育したMRSA(ATCC 33592)を、核酸抽出に先立って異なる種類のβ−ラクタム系抗生物質存在下でインキュベートする場合に、抗生物質の種類によって、mecA mRNA誘導に差があるか検討することとした。
(1)MRSA(ATCC 33592)を、血液寒天培地(β−ラクタム系抗生物質非添加)で培養した(37℃、一夜)。
(2)1白金耳量を釣菌し、以下の(i)〜(vi)のトリプチケース・ソイ ブロス(ベクトン・ディッキンソン社製)200μL中に懸濁した。各々の懸濁液を対応する前記ブロスにて、それぞれ10^5倍希釈し、37℃で30分間インキュベートした。
(i)5μg/mL オキサシリン(OX)(和光純薬社製)含有トリプチケース・ソイ ブロス。
(ii)10μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。
(iii)20μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。
(iv)5μg/mL セフォキシチン(CFX)(シグマ・アルドリッチ社製)含有トリプチケース・ソイ ブロス。
(v)10μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。
(vi)20μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。
(vii)抗生物質非添加トリプチケース・ソイ ブロス。
(3)前記希釈液100μLをとり、メーカープロトコールに従って、ExtragenII(東ソー社製)によるRNA抽出を行った。
(5)得られたRNAのペレットを50μLの10mM Tris(pH8)−1mM EDTAに溶解し、RNA試料とした。
(6)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI製)に分注し、これに、前記RNA試料5μLを添加した。
【0048】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12)が付加されている。)
1.5μM 第二のプライマー(配列番号7)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。)
30nM インターカレーター標識プローブ (配列番号5)
6.0ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0049】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、前記RNA試料を測定した場合の検出時間を図6に示した。図6から、オキサシリンは5μg/mLでもmecA mRNAの誘導が起こっており、セフォキシチンは5〜20μg/mLで濃度増加に応じたmecA mRNA発現量の増加が認められた。オキサシリンに比べてセフォキシチンの誘導の程度は小さいが、セフォキシチンも20μg/mL以上で用いればオキサシリンと同等の誘導が可能と推定された。すなわち、濃度は適切に設定する必要はあるが、いずれの抗生物質もわずか30分間インキュベートするだけで前記mRNAを誘導することが可能であった。β−ラクタム系抗生物質のうち、オキサシリンはメチシリン類似のペニシリン系抗生物質の典型的なもので、セフォキシチンはセフェム系抗生物質の典型的なものである。したがって、前記抗生物質と同様の作用機序や構造を有する他のβ−ラクタム系抗生物質を用いても本実施例と同様の結果が得られると考えられる。その中でも、オキサシリンに代表されるメチシリン類似のペニシリン系抗生物質は、低濃度で前記mRNAを誘導できる点においてより有効である。
【図面の簡単な説明】
【0050】
【図1】インターカレーター性蛍光色素標識オリゴヌクレオチドプローブ(インターカレーター標識プローブ)の構造を示した。リン酸ジエステルのリンにリンカーを介してオキサゾールイエローが結合している。B1〜B4は、アデニン、グアニン、シトシン、チミン、又はウラシルのいずれかを示す。
【図2】以下に示したプライマーセット(i)〜(iv)を用い、0コピー(陰性、Nega)、30コピー、10^6コピーの標準RNAを添加した5μL試料を測定した時の検出時間(分間)(Detection Time)を示した。凡例は、ひし形が陰性、正方形が30コピー、三角形が10^6コピーを示す。検出時間>30は反応時間30分における陰性判定を表す。(i)6−11:第一のプライマー(配列番号6)及び第二のプライマー(配列番号11)からなるプライマーセット(特許文献9で開示)。(ii)6−7:第一のプライマー(配列番号6)及び第二のプライマー(配列番号7)からなるプライマーセット。(iii)6−8:第一のプライマー(配列番号6)及び第二のプライマー(配列番号8)からなるプライマーセット。(iv)6−9:第一のプライマー(配列番号6)及び第二のプライマー(配列番号9)からなるプライマーセット。
【図3】β−ラクタム系抗生物質添加寒天培地((+)antibiotics)及びβ−ラクタム系抗生物質非添加寒天培地((−)antibiotics)で生育したMRSA(ATCC 700699及びATCC 33592)の10倍希釈系列よりRNAを抽出して、mecA mRNAを測定した場合の検出時間(Detection Time)を示した。横軸は、希釈系列100μL中のcfuの対数値(LOG(cfu/100μL))、縦軸は検出時間(分間)を示す。凡例は、ひし形が抗生物質非添加、三角形が抗生物質添加を示す。検出時間>30は反応時間30分における陰性判定を表す。ATCC 33592を用いた結果をAに、ATCC 700699を用いた結果をBに示した。
【図4】図3中のブロック矢印で指した点の抽出RNA試料から、TEで2倍希釈系列を調製し、測定した時の検出時間(Detection Time)を示した。横軸(対数目盛)は希釈率から計算したMRSA希釈系列100μL中のcfu(Estimated cfu/100μL)を表す。図中( )内のcfu値は検出率2/2が得られた検出限界を示す。凡例は、丸がATCC 700699の抗生物質非添加、ひし形がATCC 700699の抗生物質添加、三角がATCC 33592の抗生物質非添加、正方形がATCC33592の抗生物質添加、を示す。検出時間>30は反応時間30分における陰性判定を表す。
【図5】Aの図には、β−ラクタム系抗生物質非添加寒天培地で生育したMRSA(ATCC 33592)を用い、β−ラクタム系抗生物質添加液体培地((+)antibiotics)及びβ−ラクタム系抗生物質非添加液体培地((−)antibiotics)で10倍希釈系列を調製し、37℃、30分間インキュベートした後、RNAを抽出してmecA mRNAを測定した場合の検出時間(Detection Time)を示した。横軸は、希釈系列100μL中のcfuの対数値(LOG(cfu/100μL))、縦軸は検出時間(分間)を示す。Aの図中のブロック矢印で指した点の抽出RNA試料から、TEにより3倍希釈系列を調製し、測定した時の検出時間をBに示した。横軸(対数目盛)は希釈率から計算したMRSA希釈系列100μL中のcfu(Estimated cfu/100μL)を表す。図中( )内のcfu値は検出率2/2が得られた検出限界を示す。凡例は、ひし形が抗生物質非添加、三角形が抗生物質添加を示す。検出時間>30は反応時間30分における陰性判定を表す。
【図6】β−ラクタム系抗生物質非添加寒天培地で生育したMRSA(ATCC 33592)を、以下に示した(i)〜(vii)の液体培地に懸濁し、37℃、30分間インキュベートした後、RNAを抽出してmecA mRNAを測定した場合の検出時間(Detection Time)を示した。検出時間>30は反応時間30分における陰性判定を表す。(i)5μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。(ii)10μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。(iii)20μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。(iv)5μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。(v)10μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。(vi)20μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。(vii)抗生物質非添加トリプチケース・ソイ ブロス((−)AB)。
【技術分野】
【0001】
本発明は、ブドウ球菌のメチシリン耐性を迅速かつ高感度に判定するために、メチシリン耐性ブドウ球菌のメチシリン耐性遺伝子(mecA) mRNAを簡便、迅速、かつ高感度に測定する方法を提供する。したがって、本発明は、医学分野における感染症の診療において、ブドウ球菌等の薬剤感受性の試験、予防及び感染拡大防止のための薬剤感受性菌のモニタリング、薬剤感受性菌の治療効果モニタリング、さらには抗菌薬投与の指標のために有用である。また、微生物学、分子生物学、及び生化学などの分野における、薬剤耐性試験、薬剤耐性機構の解析、抗菌薬スクリーニング及びmecAの発現解析のために有用である。
【背景技術】
【0002】
メチシリン耐性黄色ブドウ球菌(MRSA)は、メチシリン耐性に係わる遺伝子mecAを獲得した黄色ブドウ球菌であり、幅広い抗生物質に対する耐性を示す。mecAは、PBP(Penicillin−Binding Protein)−2’(PBP−2aとも呼ばれる)をコードする。通常、MRSA以外の黄色ブドウ球菌は、主として4種のPBP−1〜4を産生する。PBPは、細胞壁のペプチドグリカン合成のペプチド転移反応に係わるプロテアーゼ活性を有し、細胞壁合成に関与する。β−ラクタム系抗生物質は、PBPの活性部位に結合して前記活性を不活化するが、特に細胞増殖に必須なPBP−1〜3に対して強い親和性を有する。一方、PBP−2’は、β−ラクタム系抗生物質との親和性が低いため、PBP−2’産生菌以外のブドウ球菌に対しては致死的な量のβ−ラクタム系抗生物質が存在しても、細胞増殖に必須な前記活性を補完することが可能である(非特許文献1及び2)。
【0003】
MRSAは院内感染の主要な病原菌で、治療薬の切り札的存在とみなされているバンコマイシンに対しても耐性を示す菌株も検出されている(非特許文献3)。特に、高齢者や新生児など、抵抗力が低い易感染者に対する感染は依然として深刻な問題となっている。また、以前は、MRSAが病院等の施設から市中に出ても、健常者にはほとんど感染しないと考えられていた。しかし、1980年代に市中で感染を起こす市中感染型MRSA(Community−Associated MRSA、CA−MRSA)が報告されて以来、CA−MRSAは増加傾向にあり、さらに小児の肺炎、敗血症で死亡例が報告されるなど、公衆衛生上の大きな問題になっている(非特許文献4)。
【0004】
一般に、黄色ブドウ球菌はコアグラーゼ陰性ブドウ球菌より強病原性といわれるためブドウ球菌の中でMRSAが重要視される傾向はあるが、表皮ブドウ球菌などのコアグラーゼ陰性ブドウ球菌の中で前記mecA遺伝子を獲得したメチシリン耐性コアグラーゼ陰性ブドウ球菌(MR−CNS)についても、易感染者に対する感染が重要視されるようになってきた(非特許文献5)。メチシリン耐性ブドウ球菌の院内感染や市中感染への対策として、鼻咽頭への定着菌の除菌、菌保有者の隔離、及び抗菌薬の選定等を迅速に実施する必要がある。そのため、臨床現場においては、診断、治療及び予防を目的として、簡便・迅速なメチシリン耐性菌の検出が望まれてきた。
【0005】
メチシリン耐性を試験する方法としては、培養による薬剤感受性試験、mecAがコードするPBP−2'を抗PBP−2'抗体を用いたイムノアッセイで検出する方法、mecA又はmecAと連鎖するDNAをPCRで増幅して検出する方法などが実施されている。
【0006】
【特許文献1】特許第3735400号
【特許文献2】特開平6−165681号
【特許文献3】特表2004−534537号
【特許文献4】特許第2650159号
【特許文献5】特許第3152927号
【特許文献6】特許第3241717号
【特許文献7】特開2000−14400号
【特許文献8】特開2001−37500号
【特許文献9】特開2001−353000号
【特許文献10】特開2001−333783号
【非特許文献1】Chanbers,H.F.(1997)Clin.Microbiol.Reviews,10(4),781−791.
【非特許文献2】Stepleton,P.D. and Taylor,P.W.(2002)Sci.Prog.,85(Pt1),57−72.
【非特許文献3】Weigel,L.M.,et al.(2003)Science,302,1569−1571.
【非特許文献4】山本 達男 他(2008)モダンメディア,54(3),95−103.
【非特許文献5】辺 夏蓮 他(2008)臨床病理,56,955−960.
【非特許文献6】Murakami,K.,et al.(1991)J.Clin.Microbiol.,29(10),2240−2244.
【非特許文献7】Ito,T.,et al.(2007)Methods Mol.Biol.,391,87−102.
【非特許文献8】Huletsky,A.,et al.(2004)J.Clin.Microbiol.,42(5),1875−1884.
【非特許文献9】Grisold,A.J.,et al.(2002)J.Clin.Microbiol.,40(7),2392−2397.
【非特許文献10】Farly,J.E.,et al.(2008)J.Clin.Microbiol.,46(2),743−746.
【非特許文献11】Ishiguro,T.,et al.(2003)Anal. Biochem.,314,1247−1252.
【非特許文献12】Weller,T.M.(1999)J.Antimicrob.Chemother.,43,15−22.
【発明の開示】
【発明が解決しようとする課題】
【0007】
薬剤感受性試験については、使用する薬剤や試験方法により判定がばらつくという問題が指摘されている。また、イムノアッセイによるPBP−2'の検出は、感度が十分ではなく、他法と乖離するという問題点が指摘されている(非特許文献5)。加えて、薬剤感受性試験やイムノアッセイは、いずれも検体の採取から判定まで48時間以上を要し、院内感染や市中感染における感染者の隔離や投与薬の選定などで迅速な対応を求められる臨床現場への適用のために十分な性能とはいえなかった。一方、mecA又はmecAと連鎖する遺伝子をPCRで増幅して検出する方法(特許文献1〜3、非特許文献6〜10)の中には、数時間で検出可能な方法もあるが、PCRは、原則的に熱変性、プライマー・アニール、伸長反応からなる急激な温度サイクルを必要とし、システム化を考える場合に簡素化及び低コスト化のための大きな障壁となっていた。さらに、mecAは宿主の染色体DNA上にあるが、DNAは一般に安定で、ブドウ球菌が死滅しても試料中に長時間にわたり存在し続けることが知られている。したがって、DNAを標的とするPCRの場合、臨床的には意味のない死菌を検出してしまうという問題点がある。これに対し、RNAはDNAに比して不安定であり、とりわけmRNAは菌が死ぬと速やかに分解されるため、mRNAを標的とした場合は生菌を反映した結果が得られることが知られている。したがって、臨床的に意味のある、死滅していないブドウ球菌のメチシリン耐性を迅速・高感度に試験するためには、mecA mRNAを検出することが最も有効であるといえる。
【0008】
mRNAを検出する方法としては、RT−PCR(Reverse Transcription−Polymerase Chain Reaction)を核酸増幅法として用いる方法が汎用されている。該増幅法は、通常、mRNAを抽出後、抽出したRNAから逆転写酵素によりcDNAを合成する工程、及び、該cDNAをPCRで増幅し検出する工程、と二段階の工程(場合によってはさらに検出工程を別個に実施する必要がある)が必要であるため、操作の煩雑性や煩雑さに伴う二次汚染の危険性及び再現性の不良が問題とされる。また、前記薬剤感受性試験よりは迅速であるものの、前記二段階の工程を実施するのに通常2〜3時間以上が必要であり、複数の工程の実施による再現性不良、多数検体処理や検査コストの削減の点で問題があった。反応時間短縮のため、前記二工程を同時に行うワンステップRT−PCR法も開発されているが、各工程を別個に行うRT−PCR法に比べて検出感度の低下や非特異的増幅産物が産生されやすいことなどが指摘されている。さらに、PCR法による増幅は2本鎖DNAを増幅するため、混入する染色体DNAを増幅してしまう可能性があり、厳密にmRNAのみを検出するためにはDNase等による消化を行い染色体DNAを完全に除く必要があった。このため、操作の更なる煩雑化や再現性不良を招いていた。
【0009】
一方、一定温度でRNAのみを増幅する方法として、NASBA法(特許文献4及び5)、TMA法(特許文献6)及びTRC法(特許文献7及び8、非特許文献11)などが報告されている。これらのRNA増幅方法は、標的となるRNAに対してプロモーター配列を含むプライマー、逆転写酵素及び必要に応じてリボヌクレアーゼH(RNaseH)により、プロモーター配列を含む2本鎖DNAを合成し、この2本鎖DNAを鋳型としRNAポリメラーゼによって標的RNA由来の特定塩基配列を含むRNAを生産し、このRNAが引き続きプロモーター配列を含む2本鎖DNA合成の鋳型となる連鎖反応を行うものである。そして、RNA増幅後、電気泳動または検出可能な標識を結合させた核酸プローブを用いたハイブリダイゼーション法などにより増幅されたRNAを検出する。
【0010】
前記RNA増幅法は一定温度、一段階でRNAのみを増幅することから簡便なRNA測定に適しているが、通常、NASBA法やTMA法ではその実施に90分以上必要であり、迅速な結果を得るに至っていない。さらに、増幅工程は一定温度であるものの、通例は増幅工程前に変性のための加温(例えば、65℃)が必要であり(特許文献5実施例1及び特許文献6実施例1に記載)、反応装置の省力化や低コスト化のための課題となっていた。
【0011】
一定温度、一段階でRNAを増幅・測定する方法として、TRC法(特許文献7〜9、非特許文献11)が挙げられる。当該方法は、インターカレーター性蛍光色素で標識され、標的核酸と相補的に2本鎖を形成するとインターカレーター性蛍光色素部分が前記2本鎖部分にインターカレートすることによって、蛍光特性が変化するように設計されたオリゴヌクレオチドプローブ存在下、前記RNA増幅法を実施し、蛍光特性の変化を測定するもので、プライマーなどの結合領域を標的RNAの(二次構造を計算して推定した)高次構造フリー領域に設定することで、一定温度、一段階かつ密閉容器内でRNA増幅及び測定を、同時にかつ迅速(30分以内)、簡便に実施することが可能である(非特許文献11)。このRNA増幅測定法は、前記mRNA検出法の中で、迅速性、簡便性、信頼性の点から、特に好適な方法といえる。ただし、該RNA増幅測定法は、比較的一定の低温度(35〜60℃)で実施され、変性工程を伴わないため、標的RNAの高次構造の影響だけでなく、プライマーダイマー等の非特異的増幅の影響も受けやすいため、そのプライマーセットの設計には細心の配慮が必要で、汎用されているPCRプライマー用の設計手法では不十分なことが明らかである。
【0012】
TRC法におけるmecA mRNA増幅測定方法のために設計されたプライマーの一例が特許文献9及び10に開示されている。しかし、本発明者は、メチシリン耐性ブドウ球菌が抗生物質のプレッシャーのない条件に生育した場合、mecA mRNAをほとんど発現しない場合があることを見出した。このような場合には、このプライマーセットとmecA mRNA検出に有効なTRC法によっても、検出は困難である。
【課題を解決するための手段】
【0013】
本発明者は、上記課題を解決すべく鋭意研究を重ねた結果、試料中のブドウ球菌のメチシリン耐性を試験するための改良された方法を完成した。すなわち、本発明は、試料中のブドウ球菌のメチシリン耐性を試験する方法であって、(1)前記試料にβ−ラクタム系抗生物質を添加する工程、(2)前記試料からmRNAを含む核酸を抽出する工程、(3)抽出した核酸中のmecA mRNAを増幅し検出する工程、からなることを特徴とする、試料中のブドウ球菌のメチシリン耐性を試験する方法である。
【0014】
本発明におけるmecA mRNAを増幅し検出する工程は、好ましくは(1)mecA mRNA中の特定塩基配列の一部と相補的な配列を有する第二のプライマー(DNA)が前記mRNAにハイブリダイズし、RNA依存性DNAポリメラーゼ活性を有する酵素により、特定塩基配列に相補的なcDNAを合成し、前記mRNAとのRNA−DNA2本鎖を生成する工程、(2)リボヌクレアーゼH(RNaseH)活性を有する酵素により、前記RNA−DNA2本鎖のRNAを分解して1本鎖DNAを生成する工程、(3)該1本鎖DNAに、前記特定塩基配列の一部と相同的な配列を有する第一のプライマー(DNA)がハイブリダイズし(ここで前記第二または第一のプライマーのいずれか一方はその5’末端にRNAポリメラーゼのプロモーター配列が付加されてなる)、DNA依存性DNAポリメラーゼ活性を有する酵素により、前記特定塩基配列または前記特定塩基配列に相補的な配列のRNAを転写可能な、プロモーター配列を含む2本鎖DNAを生成する工程、(4)RNAポリメラーゼ活性を有する酵素により前記2本鎖DNAを鋳型とする前記RNAを転写する工程(ここで、該RNAは、前記(1)の反応におけるcDNA合成の鋳型となることで、連鎖的にRNA転写産物が生成される)及び、(5)前記転写されたRNAを検出する工程、からなることを特徴とする。
【0015】
本発明においては、好ましくは、前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなるオリゴヌクレオチドであることを特徴とする。なお、配列番号1で示された塩基配列は、GenBank No.Y00688の5’端982番のCから1006番のAまでの配列部分に相補的な塩基配列である。配列番号2で示された塩基配列は、GenBank No.Y00688の5’端1176番のTから1196番のTまでの配列部分に相同的な塩基配列である。配列番号3で示された塩基配列は、GenBank No.Y00688の5’端1178番のTから1198番のAまでの配列部分に相同的な塩基配列である。配列番号4で示された塩基配列は、GenBank No.Y00688の5’端1172番のAから1192番のCまでの配列部分に相同的な塩基配列である。
【0016】
本発明における前記転写されたRNAを検出する工程は、好ましくは、検出されるべきRNA(標的RNA)と相補的な2本鎖を形成すると蛍光特性が変化するように設計された蛍光色素標識オリゴヌクレオチドプローブ共存下で当該蛍光特性の変化を測定することによってなされる。この蛍光色素標識オリゴヌクレオチドプローブは、好ましくは、配列番号5に示された配列又はその相補的配列にストリンジェントな条件でハイブリダイズ可能である配列からなることを特徴とする。なお、配列番号5で示された塩基配列は、GenBank No.Y00688の5’端1068番のAから1049番のCまでの配列部分に相補的な塩基配列である。
【0017】
より好ましくは、本発明における配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号7〜9で示された配列のいずれか一以上であることを特徴とする。
【0018】
また本発明は、mecA mRNAを増幅するための第一のプライマー及び第二のプライマーからなるプライマーセットであって、前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであることを特徴とする。
【0019】
より好ましくは、本発明のプライマーセットにおける配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列は配列番号7〜9で示された配列のいずれか一以上であることを特徴とする。
【0020】
以下、本発明を詳細に説明する。
【0021】
本発明中の試料とは、鼻腔及び咽頭等のぬぐい液、血液、その他の分泌液、体液、組織洗浄液、液体培地及び寒天培地で培養した菌株である。本発明が試験の対象とするブドウ球菌とは、スタフィロコッカス属に属する菌種である。もっとも主要で臨床的にも重要な菌種としては、コアグラーゼ陽性の黄色ブドウ球菌とコアグラーゼ陰性の表皮ブドウ球菌が挙げられるが、特に限定されるものでない。本明細書では、これらを単にブドウ球菌と記載し、特に必要がある場合を除いて区別しない。
【0022】
本発明は、試料にβ−ラクタム系抗生物質を添加し、試料中のブドウ球菌にβ−ラクタム系抗生物質を接触させることでmecA mRNAの発現を誘導するという構成に特徴を有する。この構成により、ブドウ球菌が増殖する条件やタンパク質を過剰に生産する条件で試料中のブドウ球菌をインキュベートする必要はなくなり、インキュベートに要する時間やブドウ球菌の増殖を待つ時間を省くことを可能としている。実施例に記載した形態では、本発明は30分程度で実施可能である。PBP−2’の誘導には48時間以上のインキュベートが必要である(非特許文献2及び5)ことと比較すると、わずか30分でメチシリン耐性を試験可能とする本発明は、メチシリン耐性ブドウ球菌のメチシリン耐性を迅速かつ高感度に試験するという、臨床の現場の要請に応えるものである。
【0023】
β−ラクタム系抗生物質は、メチシリン類似の抗生物質であれば制限はない。例えば、β−ラクタム構造を有する抗生物質で、ペニシリン系及びセフェム系に属する抗生物質が例示できるが、比較的低濃度でもmecA mRNAの誘導が可能な、メチシリン、オキサシリン、クロキサシリン又はジクロキサシリンなどのメチシリン類似のペニシリン系抗生物質から選ばれた少なくとも1つの抗生物質が好ましい。β−ラクタム系抗生物質を添加した後には、試料を適当に加温してmecA mRNAの発現を誘導することが好ましい。なお、試料それ自体がブドウ球菌のmecA mRNAの発現に不適当である場合には、ブドウ球菌が生育可能な液体培地に試料を添加するようにしても良い。なお、本発明では、この工程にてmecA mRNAの発現を誘導できれば良いので、ブドウ球菌が増殖する条件やタンパク質を過剰に生産する培地、条件を採用する必要はない。β−ラクタム系抗生物質と接触させる時間は特に限定されないが、本発明ではブドウ球菌を増殖する必要がないため、30分程度で実施可能である。
【0024】
核酸を抽出する工程は、mRNAを含む核酸を抽出できる、既知の方法が採用可能であり、特に限定されるものではない。RNAのみを分離・精製する方法である必要はないが、好ましくは、引き続き実施するmecA mRNAの増幅と検出を阻害しない程度に純度の高いmRNAが得られれば良い。この核酸を抽出する工程においては、実際の抽出操作に先立って、試料中のブドウ球菌を溶菌酵素と接触させておくことが好ましい。溶菌酵素は、細胞壁構成成分を分解する作用を有する酵素ならば特に限定されないが、汎用されている、リゾチーム、アクロモペプチダーゼ、ラビアーゼ、リソスタフィン、ムタノリシンなどから選ばれた少なくとも1つの酵素であることが好ましい。
【0025】
mecA mRNAを増幅し検出する工程では、RT−PCR、RT−LAMP、NASBA、TMA、TRCなどのRNAの増幅法が使用可能であり、特に限定されないが、混入する染色体DNAの影響を受けず、迅速な試験のために一定温度で実施可能なRNA増幅法であるNASBA、TMA、TRCが特に好ましい。また当該工程では、既知の核酸検出方法が使用可能であるが、ハイブリダイズすることによって蛍光特性が変化するように設計された蛍光物質標識プローブを使用することが好ましい。該蛍光物質標識プローブとしては、FRET(蛍光共鳴エネルギー移動)を利用した蛍光標識プローブやインターカレーター標識プローブなどが挙げられる。前記mecA mRNAを増幅し検出する工程における最も好適な方法は、前記したTRCにおける一定温度、一段階でのRNAの増幅工程において、mecA mRNAの増幅と同時に増幅されたmecA RNA(特定塩基配列)をモニタリングできるインターカレーター標識プローブ(特許文献9及び非特許文献11)の使用である。
【0026】
本発明の好ましいmecA mRNAを増幅し検出する工程では、mecA mRNA中の特定塩基配列を増幅し検出するが、この特定塩基配列とは、mecA mRNAを他のRNAから識別し得る程度に特徴的な配列であって、mecA mRNAの塩基配列の中で、第一のプライマーとの相同領域の5’末端から第二のプライマーとの相補領域の3’末端までの塩基配列に相当するRNAまたはDNAの塩基配列を示す。言い換えれば、第一及び第二のプライマーは、前記したような特徴的な配列の前後に存在する、これもまたmecA mRNAを他のRNAから識別し得る程度に特徴的な配列に対してデザインされる。
【0027】
本発明中のストリンジェントな条件とは特に限定されるものではなく、通常の状態と比較してDNA同士又はDNAとRNAが二重鎖を形成し難い条件をいうが、例えば、42℃で50%(v/v)ホルムアミド、0.1%ウシ血清アルブミン、0.1%フィコール、0.1%のポリビニルピロリドン、50mMリン酸ナトリウムバッファー(pH6.5)、150mMの塩化ナトリウム及び75mMクエン酸ナトリウムが共存する条件等が挙げられる。本明細書中で単にハイブリダイズすると記載した場合、ストリンジェントな条件でハイブリダイズすることを意味するものである。なお、該条件におけるハイブリダイゼーションの十分な特異性や効率が得られる範囲内で、塩基の置換、欠失、付加、修飾等が可能であり、長さも任意に設定できることはいうまでもない。
【0028】
本発明では、第一のプライマーは配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなるオリゴヌクレオチドであることが好ましい。より具体的には、配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号6で示された配列、又は、配列番号6の少なくとも連続する15塩基からなる配列を例示することができる。配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号7〜9で示された配列、又は、配列番号7〜9の少なくとも連続する15塩基からなる配列のいずれか一以上であることを例示できる。
【0029】
mecA mRNA中の特定塩基配列の一部と相補的な配列を有する第二のプライマー(DNA)がmecA mRNAにハイブリダイズすると、RNA依存性DNAポリメラーゼ活性を有する酵素により、特定塩基配列に相補的なcDNAが合成され、mecA mRNAとのRNA−DNA2本鎖が生成する。この2本鎖はヘテロなものであることから、リボヌクレアーゼH(RNaseH)活性を有する酵素により、RNAは分解され、結果的に1本鎖DNAが生成することになる。この1本鎖DNAに、前記特定塩基配列の一部と相同的な配列を有する第一のプライマー(DNA)がハイブリダイズすると、DNA依存性DNAポリメラーゼ活性を有する酵素により、前記特定塩基配列または前記特定塩基配列に相補的な配列のRNAを転写可能な、プロモーター配列を含む2本鎖DNAが生成される。第二のプライマーがその5’端にRNAポリメラーゼのプロモーター配列を有する場合、当該2本鎖DNAは前記特定塩基配列に相補的な配列のRNAを転写可能なものとなり、第一のプライマーがその5’端にRNAポリメラーゼのプロモーター配列を有する場合、当該2本鎖DNAは前記特定塩基配列に相同的な配列のRNAを転写可能なものとなる。プロモーター配列は既知のものなら特に限定されないが、分子生物学の分野で汎用されるバクテリアファージ由来の、T7 RNAポリメラーゼ、T3 RNAポリメラーゼ、SP6 RNAポリメラーゼなどを使用することができる。
【0030】
RNAポリメラーゼ活性を有する酵素は、上記のようにして生成した2本鎖DNAを鋳型としてRNAを転写するが、該RNAは、最初の工程におけるcDNA合成の鋳型となるため、連鎖的にRNA転写産物が生成されることになる。
【0031】
RNA依存性DNAポリメラーゼ活性を有する酵素、リボヌクレアーゼH(RNaseH)活性を有する酵素、及びDNA依存性DNAポリメラーゼ活性を有する酵素は、それぞれ別個又は種々の組合せで添加することもできるが、前記活性を併せ持つレトロウイルス由来の逆転写酵素を使用することもできる。該逆転写酵素は特に限定されないが、分子生物学の分野で汎用される、AMV(Avian Myeloblastosis Virus)逆転写酵素、MMLV(Molony Murine Leukemia Virus)逆転写酵素、RAV(Rous Associated Virus)逆転写酵素、HIV(Human Immunodeficiency Virus)逆転写酵素などが使用可能である。
【0032】
以上のようにして転写されたRNAを検出することにより、試料中のブドウ球菌のメチシリン耐性を試験することができるが、この検出には、例えば検出されるべきRNA(標的RNA)と相補的な2本鎖を形成すると蛍光特性が変化するように設計された蛍光色素標識オリゴヌクレオチドプローブを使用することが提示できる。中でも、その共存下で前記増幅、検出の工程を実施可能なプローブを使用することが特に好ましい。その共存下で増幅、検出の工程を実施することが可能であれば、増幅を行いつつ、試料からの蛍光特性の変化を測定することによる検出を同時に実施して、リアルタイムモニタリングを実現できるからである。このような蛍光物質標識プローブとして、特に、インターカレーター性蛍光色素を適当なリンカーを介してオリゴヌクレオチドプローブと結合したインターカレーター性蛍光色素標識オリゴヌクレオチドプローブを使用することが好ましい。インターカレーター性蛍光色素は2本鎖核酸にインターカレートし、蛍光増感を示すものであれば特に限定されないが、分子生物学分野で汎用されるオキサゾールイエロー、チアゾールオレンジ、エチジウムブロミド、及びこれらの誘導体が例示できる。これらは、適当な官能基を導入してリンカーと結合して使用すれば良い。オリゴヌクレオチドプローブは、好ましくは配列番号5に示された配列、又はその相補配列にハイブリダイズ可能な配列からなることが好ましい。更にオリゴヌクレオチドプローブは、前記増幅工程に共存させた場合にDNAポリメラーゼの作用によってその3’末端からの伸長が起きないようにするため、そのOH基を修飾しておくことが好ましい。修飾の手段としては、汎用されている既知の末端修飾であるグリコール酸付加、ビオチン化、アミノ化などが挙げられる。
【0033】
本発明のmecA mRNAを増幅し検出する工程において、第一のプライマーの5’末端にプロモーター配列を付加した場合は、mecA mRNA中の特定塩基配列の5’末端領域で当該mRNAをトリミングすることが好ましい。該トリミングの手段としては、既知の特異的核酸切断法が利用可能であり、特に限定されるものではないが、前記mRNA中の特定塩基配列5’末端領域及びその5’末端のさらに5’末端側に隣接する領域に対してハイブリダイズするオリゴヌクレオチド(DNA)(切断オリゴと呼ぶ)と、RNaseH活性を有する酵素を使用することが例示できる。前記特定塩基配列5’末端領域及びその5’末端に隣接する領域の長さは特に限定されないが、特定塩基配列の5’末端領域は5〜20塩基、その5’末端に隣接する領域は5〜50塩基が好ましい。例えば、第一のプライマーが配列番号1で示された塩基配列にハイブリダイズ可能な配列からなる場合、切断オリゴとして配列番号10に示された配列中の少なくとも連続する15塩基よりなる配列を使用することが例示できる。切断オリゴは、mecA mRNAにハイブリダイズしてRNA−DNA2本鎖を形成するため、RNaseH活性を有する酵素によってRNA部分が消化され、結果としてmecA mRNAの特定塩基配列5’末端付近で切断される。引き続き、RNA依存性DNAポリメラーゼ活性によるcDNA合成が行われると、該cDNAの3’末端が規定され、当該cDNAの3’末端領域に第一のプライマーがハイブリダイズした際に、DNA依存性DNAポリメラーゼ活性によるプロモーター(2本鎖DNA)構造の構築が可能となる。
【0034】
本発明は、前記したmecA mRNAの増幅工程で使用することのできる、mecA mRNAを高効率に増幅するための第一及び第二のプライマーのセットであって、第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであり、第二のプライマーが配列番号2〜4から選ばれた塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドである。より具体的には、配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号6で示された配列、又は、配列番号6の少なくとも連続する15塩基からなる配列を例示することができる。配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列としては配列番号7〜9で示された配列、又は、配列番号7〜9の少なくとも連続する15塩基からなる配列のいずれか一以上であることを例示できる。
【発明の効果】
【0035】
本発明では、試料にβ−ラクタム系抗生物質を添加し、試料中のブドウ球菌にβ−ラクタム系抗生物質を接触させてmecA mRNAの発現を誘導するという構成を採用したことで、メチシリン耐性であるにもかかわらず抗生物質のプレッシャーのない条件に生育したためにmecA mRNAをほとんど発現しないという菌であっても、確実に検出することが可能である。
【0036】
本発明は、mecA mRNAの増幅工程を低温度(35〜60℃)かつ一定で行うことができ、また好ましくインターカレーター性蛍光色素標識オリゴヌクレオチドプローブ等を使用することによって検出の工程を前記増幅工程と同時に実施することができるため、昇温、下温を繰り返すために要する時間や変性処理に要する時間、更には増幅後に別途検出を行う時間等を省き、実施例に記載したように、30分という極めて短時間の内に、迅速に実施をすることが可能である。しかも、mRNAの検出によりメチシリン耐性を試験するため、死滅していないブドウ球菌のメチシリン耐性を試験することができる。
【発明を実施するための最良の形態】
【0037】
以下、本発明を実施例により具体的に説明するが、これらは一例であり、本発明はこれら実施例により限定されるものではない。
【実施例1】
【0038】
プライマーセットの決定
以下の実施例で使用した標準RNAはGenBank Accession No.Y00688として登録された配列の1番目〜2013番目を含む精製RNAであり、260nmにおける吸光度から分子数(コピー数)を計算したものである。
以下の実施例で使用したインターカレーター標識プローブは、配列番号5からなり、5’末端から6番目のGと7番目のAの間のリン酸ジエステルにリンカーを介してオキサゾールイエローを結合させた図1に示した構造を有する。
(1)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI社製)に分注し、これに、0コピー、30コピー、及び10^6コピーの前記RNAを含有する試料5μLを添加した。
【0039】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12、特開2009−017824において配列番号13として開示された配列の5’端1番のAから28番のAまでの配列部分に相同的な配列)が付加されている。なお、配列番号6で示された塩基配列は、GenBank No.Y00688の5’端982番のCから1006番のAまでの配列部分に相同的な塩基配列であり、配列番号1の配列と相補的である)
1.5μM 第二のプライマー(配列番号7、8、9、11より選ばれたプライマー、なお配列番号7で示された塩基配列は、GenBank No.Y00688の5’端1176番のTから1196番のTまでの配列部分に相補的な塩基配列であり、配列番号2の配列と相補的である、配列番号8で示された塩基配列は、GenBank No.Y00688の5’端1178番のTから1198番のAまでの配列部分に相補的な塩基配列であり、配列番号3の配列と相補的である、配列番号9で示された塩基配列は、GenBank No.Y00688の5’端1172番のAから1192番のCまでの配列部分に相補的な塩基配列であり、配列番号4の配列と相補的である、配列番号11で示された塩基配列は、GenBank No.Y00688の5’端1156番のAから1173番のAまでの配列部分に相補的な塩基配列である)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。なお、配列番号10で示された塩基配列は、GenBank No.Y00688の5’端938番のAから986番のAまでの配列部分に相補的な塩基配列である)
30nM インターカレーター標識プローブ(配列番号5)
6ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0040】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、増加を示さなかった場合を陰性判定とした。当該検出時間は、増幅効率や標的RNAコピー数と相関するため、以降の図において、検出時間が小さいほど、増幅効率が高い、又はRNAコピー数が高いことを示す。各種プライマーセットを用い、前記試料を測定した場合の検出時間を図2に示した。ここで、第一のプライマー(配列番号6)及び第二のプライマー(配列番号11)からなるプライマーセット(図中の6−11)は特許文献9に開示されたものである。図2から、第一のプライマー(配列番号6)及び第二のプライマー(配列番号7)のプライマーセット(図中の6−7)、第一のプライマー(配列番号6)及び第二のプライマー(配列番号8)のプライマーセット(図中の6−8)、第一のプライマー(配列番号6)及び第二のプライマー(配列番号9)のプライマーセット(図中の6−9)のそれぞれを用いた場合、前記6−11より検出時間が顕著に迅速化しており、既知のプライマーセットである前記6−11に比べて、本発明のプライマーセット(6−7、6−8、6−9)を用いると増幅効率が向上することが示された。該6−7、6−8、6−9間では著しい差は認められないものの、中でも6−7は最も検出時間が短く、最も機能的であると考えられた。
【実施例2】
【0041】
抗生物質非存在下におけるmecA mRNA発現の検討
β−ラクタム系抗生物質非存在下で生育したMRSA(ATCC 700699及びATCC 33592)のmecA mRNA発現量を解析することとした。
(1)MRSA(ATCC 700699及びATCC 33592)を、血液寒天培地(β−ラクタム系抗生物質非添加)及びMRSA分離用寒天培地(セフェム系抗生物質含有)で培養した(37℃、一夜)。
(2)コロニーを釣菌し、10mM Tris(pH8)−1mM EDTA中に懸濁し、10倍希釈系列を調製した。なお、希釈系列の50μLをMRSA分離用寒天培地にまいて(37℃、一夜)colony formation unit(cfu)も計測した。
(3)前記希釈系列100μLをとり、アクロモペプチダーゼ(和光純薬社製)を添加し(終濃度0.5units/μL)、37℃、10分間インキュベートした。
(4)これに、メーカープロトコールに従って、Isogen−LS(ニッポンジーン社製)を添加し、RNA抽出を行った。
(5)得られたRNAのペレットを50μLの10mM Tris(pH8)−1mM EDTA(TE)に溶解し、RNA試料とした。
(6)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI製)に分注し、これに、前記RNA試料5μLを添加した。
【0042】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12)が付加されている。)
1.5μM 第二のプライマー(配列番号7)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。)
30nM インターカレーター標識プローブ(配列番号5)
6.0ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0043】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、増加を示さなかった場合を陰性判定とした。前記希釈系列由来のRNA試料を測定した場合の検出時間を図3(ATCC 33592の結果をAに、ATCC 700699の結果をB)に示した。また、検出感度を調べるために、図3中のブロック矢印の点に相当するRNA試料の2倍希釈系列を調製し、測定した結果を図4に示した。図3から、ATCC 33592及びATCC 70069は、いずれも、β−ラクタム系抗生物質有りに比べて無しの方が、1LOG〜2LOG程度低cfu側にシフトし、すなわち、RNA発現量が1/10〜1/100程度であった。さらに、図4から、前記株の検出感度は、β−ラクタム系抗生物質有りに比べて無しの方が20〜70倍程度不良であった。すなわち、mecA mRNA検出において、MRSAであっても抗生物質のプレッシャーのない条件で生育した菌株の中には、mecA mRNAの発現量が低く、高感度に検出できないものがあることが示唆された。
【実施例3】
【0044】
mecA mRNAの誘導の検討(1)
β−ラクタム系抗生物質非存在下で生育したMRSA(ATCC 33592)を、核酸抽出に先立ってβ−ラクタム系抗生物質存在下でインキュベートすることによって、mecA mRNA発現量を誘導できるか検討することとした。
(1)MRSA(ATCC 33592)を、血液寒天培地(β−ラクタム系抗生物質非添加)で培養した(37℃、一夜)。
(2)コロニーを釣菌し、終濃度10μg/mLオキサシリン(和光純薬社製)添加又はオキサシリン非添加トリプチケース・ソイ ブロス(ベクトン・ディッキンソン社製)中に懸濁した。各々の懸濁液から前記ブロスを用いて、それぞれ10倍希釈系列(オキサシリン添加又はオキサシリン非添加)を調製し、37℃で30分間インキュベートした。なお、インキュベート後、希釈系列の50μLをMRSA分離用寒天培地にまいて(37℃、一夜)colony formation unit(cfu)も計測した。
(3)前記希釈系列100μLをとり、アクロモペプチダーゼ(和光純薬社製)を添加し(終濃度0.5units/μL)、37℃、10分間インキュベートした。
(4)これに、メーカープロトコールに従って、Isogen−LS(ニッポンジーン社製)を添加し、RNA抽出を行った。
(5)得られたRNAのペレットを50μLの10mM Tris(pH8)−1mM EDTAに溶解し、RNA試料とした。
(6)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI製)に分注し、これに、前記RNA試料5μLを添加した。
【0045】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12)が付加されている。)
1.5μM 第二のプライマー(配列番号7)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。)
30nM インターカレーター標識プローブ (配列番号5)
6.0ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0046】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、増加を示さなかった場合を陰性判定とした。前記希釈系列由来のRNA試料を測定した場合の検出時間を図5Aに示した。また、検出感度を調べるために、図5中のブロック矢印の点に相当するRNA試料の3倍希釈系列を調製し、測定した結果を図5Bに示した。図5Aから、オキサシリン含有ブロスでインキュベートしたものはオキサシリン非添加の場合より、1.4LOG程度高cfu側にシフトし、RNA発現量が20倍以上に誘導されたと考えられた。さらに、図5Bから、検出感度は、オキサシリン含有ブロスでインキュベートした方がオキサシリン非添加に比べて、50倍程度向上した。すなわち、抗生物質のプレッシャーのない条件で生育したMRSAであっても、β−ラクタム系抗生物質存在下で、30分間インキュベートすれば、mecA mRNAの発現を誘導することが可能であり、結果として、メチシリン耐性菌を高感度に検出可能であることが示された。
【実施例4】
【0047】
mecA mRNAの誘導の検討(2)
β−ラクタム系抗生物質非存在下で生育したMRSA(ATCC 33592)を、核酸抽出に先立って異なる種類のβ−ラクタム系抗生物質存在下でインキュベートする場合に、抗生物質の種類によって、mecA mRNA誘導に差があるか検討することとした。
(1)MRSA(ATCC 33592)を、血液寒天培地(β−ラクタム系抗生物質非添加)で培養した(37℃、一夜)。
(2)1白金耳量を釣菌し、以下の(i)〜(vi)のトリプチケース・ソイ ブロス(ベクトン・ディッキンソン社製)200μL中に懸濁した。各々の懸濁液を対応する前記ブロスにて、それぞれ10^5倍希釈し、37℃で30分間インキュベートした。
(i)5μg/mL オキサシリン(OX)(和光純薬社製)含有トリプチケース・ソイ ブロス。
(ii)10μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。
(iii)20μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。
(iv)5μg/mL セフォキシチン(CFX)(シグマ・アルドリッチ社製)含有トリプチケース・ソイ ブロス。
(v)10μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。
(vi)20μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。
(vii)抗生物質非添加トリプチケース・ソイ ブロス。
(3)前記希釈液100μLをとり、メーカープロトコールに従って、ExtragenII(東ソー社製)によるRNA抽出を行った。
(5)得られたRNAのペレットを50μLの10mM Tris(pH8)−1mM EDTAに溶解し、RNA試料とした。
(6)以下の組成の反応液20μLを0.5mL容量PCR用チューブ(individual PCR tube with dome cap、SSI製)に分注し、これに、前記RNA試料5μLを添加した。
【0048】
反応液(20μL)の組成
90mM Tris−塩酸緩衝液(pH8.6)
27mM 塩化マグネシウム
150mM 塩化カリウム
1.5mM DTT
各0.375mM dATP、dCTP、dGTP、dTTP
各4.5mM ATP、CTP、UTP、GTP
5.4mM ITP
1.5μM 第一のプライマー(配列番号6、その5’末端にはT7プロモーター配列(配列番号12)が付加されている。)
1.5μM 第二のプライマー(配列番号7)
0.24μM 切断オリゴ(配列番号10、該切断オリゴの3'末端はアミノ化されている。)
30nM インターカレーター標識プローブ (配列番号5)
6.0ユニット リボヌクレアーゼ インヒビター(タカラバイオ社製)
19.5% DMSO
(3)上記の反応液を、43℃で5分間保温後、以下の組成で、予め43℃で2分間保温した酵素液5μLを添加した。
【0049】
酵素液(5μL)の組成
12% ソルビトール
6.4ユニット AMV逆転写酵素 (ライフサイエンス社製)
142ユニット T7 RNAポリメラーゼ (インビトロジェン社製)
0.72mg/mL 牛血清アルブミン(タカラバイオ社製)
(4)引き続きPCRチューブを直接測定可能な温調機能付き蛍光分光光度計(東ソー社製)を用い、43℃で反応させると同時に反応溶液の蛍光強度(励起波長470nm、蛍光波長510nm)を経時的に30分間測定した。酵素添加(反応開始)時を0分として、反応液の蛍光強度比(所定時刻の蛍光強度値÷バックグランドの蛍光強度値)が有意な増加を示した(強度比1.2を超えた)時間を検出時間とし、前記RNA試料を測定した場合の検出時間を図6に示した。図6から、オキサシリンは5μg/mLでもmecA mRNAの誘導が起こっており、セフォキシチンは5〜20μg/mLで濃度増加に応じたmecA mRNA発現量の増加が認められた。オキサシリンに比べてセフォキシチンの誘導の程度は小さいが、セフォキシチンも20μg/mL以上で用いればオキサシリンと同等の誘導が可能と推定された。すなわち、濃度は適切に設定する必要はあるが、いずれの抗生物質もわずか30分間インキュベートするだけで前記mRNAを誘導することが可能であった。β−ラクタム系抗生物質のうち、オキサシリンはメチシリン類似のペニシリン系抗生物質の典型的なもので、セフォキシチンはセフェム系抗生物質の典型的なものである。したがって、前記抗生物質と同様の作用機序や構造を有する他のβ−ラクタム系抗生物質を用いても本実施例と同様の結果が得られると考えられる。その中でも、オキサシリンに代表されるメチシリン類似のペニシリン系抗生物質は、低濃度で前記mRNAを誘導できる点においてより有効である。
【図面の簡単な説明】
【0050】
【図1】インターカレーター性蛍光色素標識オリゴヌクレオチドプローブ(インターカレーター標識プローブ)の構造を示した。リン酸ジエステルのリンにリンカーを介してオキサゾールイエローが結合している。B1〜B4は、アデニン、グアニン、シトシン、チミン、又はウラシルのいずれかを示す。
【図2】以下に示したプライマーセット(i)〜(iv)を用い、0コピー(陰性、Nega)、30コピー、10^6コピーの標準RNAを添加した5μL試料を測定した時の検出時間(分間)(Detection Time)を示した。凡例は、ひし形が陰性、正方形が30コピー、三角形が10^6コピーを示す。検出時間>30は反応時間30分における陰性判定を表す。(i)6−11:第一のプライマー(配列番号6)及び第二のプライマー(配列番号11)からなるプライマーセット(特許文献9で開示)。(ii)6−7:第一のプライマー(配列番号6)及び第二のプライマー(配列番号7)からなるプライマーセット。(iii)6−8:第一のプライマー(配列番号6)及び第二のプライマー(配列番号8)からなるプライマーセット。(iv)6−9:第一のプライマー(配列番号6)及び第二のプライマー(配列番号9)からなるプライマーセット。
【図3】β−ラクタム系抗生物質添加寒天培地((+)antibiotics)及びβ−ラクタム系抗生物質非添加寒天培地((−)antibiotics)で生育したMRSA(ATCC 700699及びATCC 33592)の10倍希釈系列よりRNAを抽出して、mecA mRNAを測定した場合の検出時間(Detection Time)を示した。横軸は、希釈系列100μL中のcfuの対数値(LOG(cfu/100μL))、縦軸は検出時間(分間)を示す。凡例は、ひし形が抗生物質非添加、三角形が抗生物質添加を示す。検出時間>30は反応時間30分における陰性判定を表す。ATCC 33592を用いた結果をAに、ATCC 700699を用いた結果をBに示した。
【図4】図3中のブロック矢印で指した点の抽出RNA試料から、TEで2倍希釈系列を調製し、測定した時の検出時間(Detection Time)を示した。横軸(対数目盛)は希釈率から計算したMRSA希釈系列100μL中のcfu(Estimated cfu/100μL)を表す。図中( )内のcfu値は検出率2/2が得られた検出限界を示す。凡例は、丸がATCC 700699の抗生物質非添加、ひし形がATCC 700699の抗生物質添加、三角がATCC 33592の抗生物質非添加、正方形がATCC33592の抗生物質添加、を示す。検出時間>30は反応時間30分における陰性判定を表す。
【図5】Aの図には、β−ラクタム系抗生物質非添加寒天培地で生育したMRSA(ATCC 33592)を用い、β−ラクタム系抗生物質添加液体培地((+)antibiotics)及びβ−ラクタム系抗生物質非添加液体培地((−)antibiotics)で10倍希釈系列を調製し、37℃、30分間インキュベートした後、RNAを抽出してmecA mRNAを測定した場合の検出時間(Detection Time)を示した。横軸は、希釈系列100μL中のcfuの対数値(LOG(cfu/100μL))、縦軸は検出時間(分間)を示す。Aの図中のブロック矢印で指した点の抽出RNA試料から、TEにより3倍希釈系列を調製し、測定した時の検出時間をBに示した。横軸(対数目盛)は希釈率から計算したMRSA希釈系列100μL中のcfu(Estimated cfu/100μL)を表す。図中( )内のcfu値は検出率2/2が得られた検出限界を示す。凡例は、ひし形が抗生物質非添加、三角形が抗生物質添加を示す。検出時間>30は反応時間30分における陰性判定を表す。
【図6】β−ラクタム系抗生物質非添加寒天培地で生育したMRSA(ATCC 33592)を、以下に示した(i)〜(vii)の液体培地に懸濁し、37℃、30分間インキュベートした後、RNAを抽出してmecA mRNAを測定した場合の検出時間(Detection Time)を示した。検出時間>30は反応時間30分における陰性判定を表す。(i)5μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。(ii)10μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。(iii)20μg/mL オキサシリン(OX)含有トリプチケース・ソイ ブロス。(iv)5μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。(v)10μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。(vi)20μg/mL セフォキシチン(CFX)含有トリプチケース・ソイ ブロス。(vii)抗生物質非添加トリプチケース・ソイ ブロス((−)AB)。
【特許請求の範囲】
【請求項1】
試料中のブドウ球菌のメチシリン耐性を試験する方法であって、
(1)前記試料にβ−ラクタム系抗生物質を添加する工程、
(2)前記試料からmRNAを含む核酸を抽出する工程、
(3)抽出した核酸中のメチシリン耐性遺伝子(以下、mecAと記す)mRNAを増幅し検出する工程、
からなることを特徴とする、試料中のブドウ球菌のメチシリン耐性を試験する方法。
【請求項2】
前記mecA mRNAを増幅し検出する工程が、
(1)mecA mRNA中の特定塩基配列の一部と相補的な配列を有する第二のプライマー(DNA)が前記mRNAにハイブリダイズし、RNA依存性DNAポリメラーゼ活性を有する酵素により、特定塩基配列に相補的なcDNAを合成し、前記mRNAとのRNA−DNA2本鎖を生成する工程、
(2)リボヌクレアーゼH(RNaseH)活性を有する酵素により、前記RNA−DNA2本鎖のRNAを分解して1本鎖DNAを生成する工程、
(3)該1本鎖DNAに、前記特定塩基配列の一部と相同的な配列を有する第一のプライマー(DNA)がハイブリダイズし(ここで前記第二または第一のプライマーのいずれか一方はその5’末端にRNAポリメラーゼのプロモーター配列が付加されてなる)、DNA依存性DNAポリメラーゼ活性を有する酵素により、前記特定塩基配列または前記特定塩基配列に相補的な配列のRNAを転写可能な、プロモーター配列を含む2本鎖DNAを生成する工程、
(4)RNAポリメラーゼ活性を有する酵素により前記2本鎖DNAを鋳型とする前記RNAを転写する工程(ここで、該RNAは、前記(1)の反応におけるcDNA合成の鋳型となることで、連鎖的にRNA転写産物が生成される)及び、
(5)前記転写されたRNAを検出する工程、
からなることを特徴とする請求項1に記載の試験方法。
【請求項3】
前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなるオリゴヌクレオチドであることを特徴とする請求項2に記載の検出方法。
【請求項4】
前記転写されたRNAを検出する工程が、検出されるべきRNA(標的RNA)と相補的な2本鎖を形成すると蛍光特性が変化するように設計された蛍光色素標識オリゴヌクレオチドプローブ共存下で当該蛍光特性の変化を測定することによってなされることを特徴とする請求項2に記載の試験方法。
【請求項5】
前記蛍光色素標識オリゴヌクレオチドプローブが、配列番号5に示された配列又はその相補的配列にストリンジェントな条件でハイブリダイズ可能である配列からなることを特徴とする請求項4に記載の検出方法。
【請求項6】
前記配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号7〜9で示された配列のいずれか一以上であることを特徴とする請求項3に記載の検出方法。
【請求項7】
mecA mRNAを増幅するための第一のプライマー及び第二のプライマーからなるプライマーセットであって、前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであることを特徴とするプライマーセット。
【請求項8】
前記配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号7〜9で示された配列のいずれか一以上であることを特徴とする請求項7に記載のプライマーセット。
【請求項1】
試料中のブドウ球菌のメチシリン耐性を試験する方法であって、
(1)前記試料にβ−ラクタム系抗生物質を添加する工程、
(2)前記試料からmRNAを含む核酸を抽出する工程、
(3)抽出した核酸中のメチシリン耐性遺伝子(以下、mecAと記す)mRNAを増幅し検出する工程、
からなることを特徴とする、試料中のブドウ球菌のメチシリン耐性を試験する方法。
【請求項2】
前記mecA mRNAを増幅し検出する工程が、
(1)mecA mRNA中の特定塩基配列の一部と相補的な配列を有する第二のプライマー(DNA)が前記mRNAにハイブリダイズし、RNA依存性DNAポリメラーゼ活性を有する酵素により、特定塩基配列に相補的なcDNAを合成し、前記mRNAとのRNA−DNA2本鎖を生成する工程、
(2)リボヌクレアーゼH(RNaseH)活性を有する酵素により、前記RNA−DNA2本鎖のRNAを分解して1本鎖DNAを生成する工程、
(3)該1本鎖DNAに、前記特定塩基配列の一部と相同的な配列を有する第一のプライマー(DNA)がハイブリダイズし(ここで前記第二または第一のプライマーのいずれか一方はその5’末端にRNAポリメラーゼのプロモーター配列が付加されてなる)、DNA依存性DNAポリメラーゼ活性を有する酵素により、前記特定塩基配列または前記特定塩基配列に相補的な配列のRNAを転写可能な、プロモーター配列を含む2本鎖DNAを生成する工程、
(4)RNAポリメラーゼ活性を有する酵素により前記2本鎖DNAを鋳型とする前記RNAを転写する工程(ここで、該RNAは、前記(1)の反応におけるcDNA合成の鋳型となることで、連鎖的にRNA転写産物が生成される)及び、
(5)前記転写されたRNAを検出する工程、
からなることを特徴とする請求項1に記載の試験方法。
【請求項3】
前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列からなるオリゴヌクレオチドであることを特徴とする請求項2に記載の検出方法。
【請求項4】
前記転写されたRNAを検出する工程が、検出されるべきRNA(標的RNA)と相補的な2本鎖を形成すると蛍光特性が変化するように設計された蛍光色素標識オリゴヌクレオチドプローブ共存下で当該蛍光特性の変化を測定することによってなされることを特徴とする請求項2に記載の試験方法。
【請求項5】
前記蛍光色素標識オリゴヌクレオチドプローブが、配列番号5に示された配列又はその相補的配列にストリンジェントな条件でハイブリダイズ可能である配列からなることを特徴とする請求項4に記載の検出方法。
【請求項6】
前記配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号7〜9で示された配列のいずれか一以上であることを特徴とする請求項3に記載の検出方法。
【請求項7】
mecA mRNAを増幅するための第一のプライマー及び第二のプライマーからなるプライマーセットであって、前記第一のプライマーが配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであり、前記第二のプライマーが配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能なオリゴヌクレオチドであることを特徴とするプライマーセット。
【請求項8】
前記配列番号1で示された塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号6で示された配列であり、前記配列番号2〜4から選ばれた一の塩基配列にストリンジェントな条件でハイブリダイズ可能な配列が配列番号7〜9で示された配列のいずれか一以上であることを特徴とする請求項7に記載のプライマーセット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−45315(P2011−45315A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2009−197801(P2009−197801)
【出願日】平成21年8月28日(2009.8.28)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成21年8月28日(2009.8.28)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

